JP2012167091A - イバブラジン及び薬学的に許容しうる酸とのその付加塩の新規合成方法 - Google Patents
イバブラジン及び薬学的に許容しうる酸とのその付加塩の新規合成方法 Download PDFInfo
- Publication number
- JP2012167091A JP2012167091A JP2012028129A JP2012028129A JP2012167091A JP 2012167091 A JP2012167091 A JP 2012167091A JP 2012028129 A JP2012028129 A JP 2012028129A JP 2012028129 A JP2012028129 A JP 2012028129A JP 2012167091 A JP2012167091 A JP 2012167091A
- Authority
- JP
- Japan
- Prior art keywords
- formula
- acid
- compound
- synthesis method
- reaction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- ACRHBAYQBXXRTO-OAQYLSRUSA-N ivabradine Chemical compound C1CC2=CC(OC)=C(OC)C=C2CC(=O)N1CCCN(C)C[C@H]1CC2=C1C=C(OC)C(OC)=C2 ACRHBAYQBXXRTO-OAQYLSRUSA-N 0.000 title claims abstract description 17
- 229960003825 ivabradine Drugs 0.000 title claims abstract description 15
- 239000002253 acid Substances 0.000 title claims description 11
- 238000000034 method Methods 0.000 title claims description 7
- 150000003839 salts Chemical class 0.000 title claims description 7
- 230000002194 synthesizing effect Effects 0.000 title claims description 3
- 150000001875 compounds Chemical class 0.000 claims abstract description 70
- 238000001308 synthesis method Methods 0.000 claims abstract description 17
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 33
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims description 24
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 23
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 22
- 238000006268 reductive amination reaction Methods 0.000 claims description 15
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 claims description 12
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 claims description 12
- 239000003960 organic solvent Substances 0.000 claims description 12
- 239000000203 mixture Substances 0.000 claims description 11
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 claims description 10
- 238000006243 chemical reaction Methods 0.000 claims description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 9
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical group [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 8
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 claims description 8
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 claims description 8
- 238000007363 ring formation reaction Methods 0.000 claims description 8
- 239000003638 chemical reducing agent Substances 0.000 claims description 7
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 claims description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 6
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 claims description 6
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 claims description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 claims description 6
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 claims description 4
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 claims description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 claims description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 4
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 claims description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 claims description 4
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 claims description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 claims description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims description 4
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 claims description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 claims description 4
- 230000015572 biosynthetic process Effects 0.000 claims description 4
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 claims description 4
- QEWYKACRFQMRMB-UHFFFAOYSA-N fluoroacetic acid Chemical compound OC(=O)CF QEWYKACRFQMRMB-UHFFFAOYSA-N 0.000 claims description 4
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 claims description 4
- 229940098779 methanesulfonic acid Drugs 0.000 claims description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 claims description 4
- 239000002904 solvent Substances 0.000 claims description 4
- 238000003786 synthesis reaction Methods 0.000 claims description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 claims description 4
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 claims description 3
- VDFVNEFVBPFDSB-UHFFFAOYSA-N 1,3-dioxane Chemical group C1COCOC1 VDFVNEFVBPFDSB-UHFFFAOYSA-N 0.000 claims description 3
- CZLMRJZAHXYRIX-UHFFFAOYSA-N 1,3-dioxepane Chemical group C1CCOCOC1 CZLMRJZAHXYRIX-UHFFFAOYSA-N 0.000 claims description 3
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical group C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 claims description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 3
- 230000002378 acidificating effect Effects 0.000 claims description 3
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- 239000003054 catalyst Substances 0.000 claims description 3
- 229910052763 palladium Inorganic materials 0.000 claims description 3
- -1 sodium triacetoxyborohydride Chemical compound 0.000 claims description 3
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 claims description 2
- RTBFRGCFXZNCOE-UHFFFAOYSA-N 1-methylsulfonylpiperidin-4-one Chemical compound CS(=O)(=O)N1CCC(=O)CC1 RTBFRGCFXZNCOE-UHFFFAOYSA-N 0.000 claims description 2
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 claims description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 claims description 2
- LSPHULWDVZXLIL-UHFFFAOYSA-N Camphoric acid Natural products CC1(C)C(C(O)=O)CCC1(C)C(O)=O LSPHULWDVZXLIL-UHFFFAOYSA-N 0.000 claims description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 claims description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 claims description 2
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 claims description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 claims description 2
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 claims description 2
- 150000001298 alcohols Chemical class 0.000 claims description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 claims description 2
- JFCQEDHGNNZCLN-UHFFFAOYSA-N anhydrous glutaric acid Natural products OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 claims description 2
- 239000011668 ascorbic acid Substances 0.000 claims description 2
- 235000010323 ascorbic acid Nutrition 0.000 claims description 2
- 229960005070 ascorbic acid Drugs 0.000 claims description 2
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 claims description 2
- 229940092714 benzenesulfonic acid Drugs 0.000 claims description 2
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 claims description 2
- LSPHULWDVZXLIL-QUBYGPBYSA-N camphoric acid Chemical compound CC1(C)[C@H](C(O)=O)CC[C@]1(C)C(O)=O LSPHULWDVZXLIL-QUBYGPBYSA-N 0.000 claims description 2
- 235000015165 citric acid Nutrition 0.000 claims description 2
- 238000006482 condensation reaction Methods 0.000 claims description 2
- 239000001530 fumaric acid Substances 0.000 claims description 2
- 238000005984 hydrogenation reaction Methods 0.000 claims description 2
- 239000004310 lactic acid Substances 0.000 claims description 2
- 235000014655 lactic acid Nutrition 0.000 claims description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 claims description 2
- 239000011976 maleic acid Substances 0.000 claims description 2
- 229910052759 nickel Inorganic materials 0.000 claims description 2
- 235000006408 oxalic acid Nutrition 0.000 claims description 2
- 229910052697 platinum Inorganic materials 0.000 claims description 2
- 229920000137 polyphosphoric acid Polymers 0.000 claims description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims description 2
- 229940107700 pyruvic acid Drugs 0.000 claims description 2
- 229910052703 rhodium Inorganic materials 0.000 claims description 2
- 239000010948 rhodium Substances 0.000 claims description 2
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 claims description 2
- 229910052707 ruthenium Inorganic materials 0.000 claims description 2
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 claims description 2
- 239000012321 sodium triacetoxyborohydride Substances 0.000 claims description 2
- 239000011975 tartaric acid Substances 0.000 claims description 2
- 235000002906 tartaric acid Nutrition 0.000 claims description 2
- 150000003512 tertiary amines Chemical class 0.000 claims description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 2
- 239000008096 xylene Substances 0.000 claims description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 4
- 208000035475 disorder Diseases 0.000 abstract description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 abstract description 4
- 230000033764 rhythmic process Effects 0.000 abstract description 4
- 206010002383 Angina Pectoris Diseases 0.000 abstract description 2
- 206010019280 Heart failures Diseases 0.000 abstract description 2
- 208000031225 myocardial ischemia Diseases 0.000 abstract description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 abstract description 2
- GYIYVTGAOWHWRI-UHFFFAOYSA-N 1,2,3,5-tetrahydro-3-benzazepin-4-one Chemical compound C1CNC(=O)CC2=CC=CC=C21 GYIYVTGAOWHWRI-UHFFFAOYSA-N 0.000 abstract 1
- 125000003545 alkoxy group Chemical group 0.000 abstract 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 abstract 1
- 238000010189 synthetic method Methods 0.000 abstract 1
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 150000007513 acids Chemical class 0.000 description 5
- 0 *CCCN(C=Cc1cc(*)c(C=O)cc1C1)C1=O Chemical compound *CCCN(C=Cc1cc(*)c(C=O)cc1C1)C1=O 0.000 description 4
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 4
- 239000012074 organic phase Substances 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- IMNIMPAHZVJRPE-UHFFFAOYSA-N triethylenediamine Chemical compound C1CN2CCN1CC2 IMNIMPAHZVJRPE-UHFFFAOYSA-N 0.000 description 3
- PAMIQIKDUOTOBW-UHFFFAOYSA-N 1-methylpiperidine Chemical compound CN1CCCCC1 PAMIQIKDUOTOBW-UHFFFAOYSA-N 0.000 description 2
- YOYAIZYFCNQIRF-UHFFFAOYSA-N 2,6-dichlorobenzonitrile Chemical compound ClC1=CC=CC(Cl)=C1C#N YOYAIZYFCNQIRF-UHFFFAOYSA-N 0.000 description 2
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 2
- 150000001241 acetals Chemical class 0.000 description 2
- 239000012973 diazabicyclooctane Substances 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- 150000004677 hydrates Chemical class 0.000 description 2
- MAPQQNKEQGLJFV-GFCCVEGCSA-N n'-[[(7s)-3,4-dimethoxy-7-bicyclo[4.2.0]octa-1,3,5-trienyl]methyl]-n'-methylpropane-1,3-diamine Chemical compound C1=C(OC)C(OC)=CC2=C1[C@@H](CN(C)CCCN)C2 MAPQQNKEQGLJFV-GFCCVEGCSA-N 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 1
- SGUVLZREKBPKCE-UHFFFAOYSA-N 1,5-diazabicyclo[4.3.0]-non-5-ene Chemical compound C1CCN=C2CCCN21 SGUVLZREKBPKCE-UHFFFAOYSA-N 0.000 description 1
- OGFKTAMJLKHRAZ-UHFFFAOYSA-N 2,2-dimethoxyacetaldehyde Chemical compound COC(OC)C=O OGFKTAMJLKHRAZ-UHFFFAOYSA-N 0.000 description 1
- VKJCJJYNVIYVQR-UHFFFAOYSA-N 2-(3-bromopropyl)isoindole-1,3-dione Chemical compound C1=CC=C2C(=O)N(CCCBr)C(=O)C2=C1 VKJCJJYNVIYVQR-UHFFFAOYSA-N 0.000 description 1
- VSSPQHJUBJPAQA-MRXNPFEDSA-N 2-[3-[[(7s)-3,4-dimethoxy-7-bicyclo[4.2.0]octa-1,3,5-trienyl]methyl-methylamino]propyl]isoindole-1,3-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1CCCN(C)C[C@H]1CC2=C1C=C(OC)C(OC)=C2 VSSPQHJUBJPAQA-MRXNPFEDSA-N 0.000 description 1
- AQSRHFYHXNSUAO-OAQYLSRUSA-N 3-[3-[[(7s)-3,4-dimethoxy-7-bicyclo[4.2.0]octa-1,3,5-trienyl]methyl-methylamino]propyl]-7,8-dimethoxy-1h-3-benzazepin-2-one Chemical compound C1=CC2=CC(OC)=C(OC)C=C2CC(=O)N1CCCN(C)C[C@H]1CC2=C1C=C(OC)C(OC)=C2 AQSRHFYHXNSUAO-OAQYLSRUSA-N 0.000 description 1
- VZGITQAWSRBJPP-UHFFFAOYSA-N 4-(2-chloroethyl)-1,2-dimethoxybenzene Chemical compound COC1=CC=C(CCCl)C=C1OC VZGITQAWSRBJPP-UHFFFAOYSA-N 0.000 description 1
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 230000000059 bradycardiac effect Effects 0.000 description 1
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- HLUKNZUABFFNQS-ZMBIFBSDSA-N ivabradine hydrochloride Chemical compound Cl.C1CC2=CC(OC)=C(OC)C=C2CC(=O)N1CCCN(C)C[C@H]1CC2=C1C=C(OC)C(OC)=C2 HLUKNZUABFFNQS-ZMBIFBSDSA-N 0.000 description 1
- 229960000504 ivabradine hydrochloride Drugs 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- AGRVSYDMSVXZAD-OAHLLOKOSA-N n'-[[(7s)-3,4-dimethoxy-7-bicyclo[4.2.0]octa-1,3,5-trienyl]methyl]-n-(2,2-dimethoxyethyl)-n'-methylpropane-1,3-diamine Chemical compound COC1=C(OC)C=C2[C@@H](CN(C)CCCNCC(OC)OC)CC2=C1 AGRVSYDMSVXZAD-OAHLLOKOSA-N 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/04—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D233/06—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring carbon atoms
- C07D233/08—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring carbon atoms with alkyl radicals, containing more than four carbon atoms, directly attached to ring carbon atoms
- C07D233/12—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring carbon atoms with alkyl radicals, containing more than four carbon atoms, directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D233/16—Radicals substituted by nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D223/00—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom
- C07D223/14—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D223/16—Benzazepines; Hydrogenated benzazepines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Cardiology (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Heart & Thoracic Surgery (AREA)
- General Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Urology & Nephrology (AREA)
- Hospice & Palliative Care (AREA)
- Vascular Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
- Other In-Based Heterocyclic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Description
で示されるイバブラジン、又は3−{3−[{[(7S)−3,4−ジメトキシビシクロ[4.2.0]オクタ−1,3,5−トリエン−7−イル]メチル}(メチル)アミノ]プロピル}−7,8−ジメトキシ−1,3,4,5−テトラヒドロ−2H−3−ベンゾアゼピン−2−オン、薬学的に許容しうる酸とのその付加塩、及びその水和物の合成方法に関する。
で示される化合物から出発して、これを分割して、式(III):
で示される化合物を得て、これを、式(IV):
で示される化合物と反応させて、式(V):
で示される化合物を得て、これの接触水素化によってイバブラジンを得て、次いで、これをその塩酸塩へと変換する、イバブラジン塩酸塩の合成を記載している。
で示されるイバブラジンの合成方法であって、式(VI):
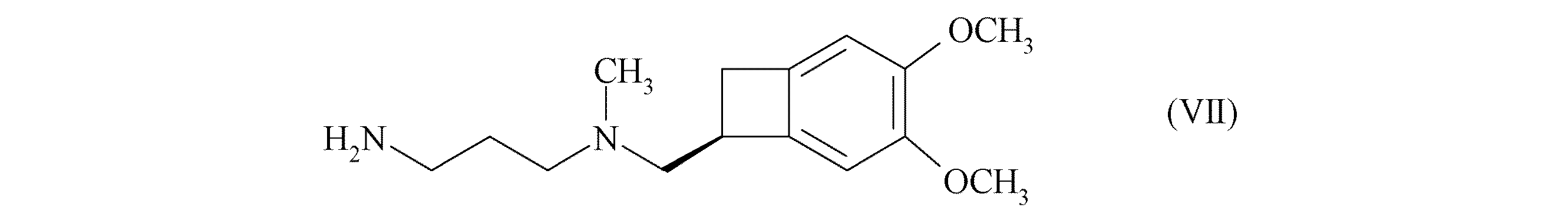
[式中、R1及びR2(これらは、同じであるか又は異なっている)は、直鎖状もしくは分岐鎖状(C1−C6)アルコキシ基を表わすか、又はそれらを担持する炭素原子と一緒になって、1,3−ジオキサン、1,3−ジオキソランもしくは1,3−ジオキセパン環を形成する]で示される化合物を、式(VII):
で示される化合物と、還元剤の存在下、有機溶媒、有機溶媒の混合物、又は有機溶媒と水の混合物中で、還元的アミノ化反応に付して、式(VIII):
[式中、R1及びR2は、本明細書で先に定義されたとおりである]で示される化合物を得て、これを、式(IX):
で示される化合物と、塩基の存在下、有機溶媒中で縮合反応に付して、式(X):
[式中、R1及びR2は、本明細書で先に定義されたとおりである]で示される化合物を得て、これを、酸性媒体中で環化反応に付して、式(V):
で示される化合物を得て、これを水素化反応に付して、式(I)で示されるイバブラジンを得て、これを場合により、塩酸、臭化水素酸、硫酸、リン酸、酢酸、トリフルオロ酢酸、乳酸、ピルビン酸、マロン酸、コハク酸、グルタル酸、フマル酸、酒石酸、マレイン酸、クエン酸、アスコルビン酸、シュウ酸、メタンスルホン酸、ベンゼンスルホン酸及びショウノウ酸より選択される薬学的に許容しうる酸とのその付加塩に、及びその水和物に変換できることを特徴とする方法に関する。
DABCO: 1,4−ジアザビシクロ[2.2.2]オクタン
DBN: 1,5−ジアザビシクロ[4.3.0]ノナ−5−エン
DBU: 1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン
DIEA: N,N−ジイソプロピルエチルアミン
DMAP: 4−ジメチルアミノピリジン
IR: 赤外線
1−[(7S)−3,4−ジメトキシビシクロ[4.2.0]オクタ−1,3,5−トリエン−7−イル]−N−メチルメタンアミン5.3g(25.5mmoles)及び2−(3−ブロモプロピル)−1H−イソインドール−1,3(2H)−ジオン6.8g(25.5mmoles)を、アセトン230mLに溶解した。炭酸カリウム13g(95mmoles、3.7当量)を、得られた溶液に加えた。次に混合物を24時間加熱還流した。周囲温度に戻った後、炭酸カリウムを濾別し、濾液を蒸発乾固した。残留物を水に取り、ジクロロメタンで抽出した。有機相を、MgSO4で乾燥させ、濾過し、蒸発乾固した。目的生成物9.7gを、淡黄色の油状物の形態で得た。
収率=97%
IR:ν=2782、1770、1704、1206、836、718cm−1。
前記工程からのフタルイミド化合物9.7g(24.58mmoles)を、エタノール100mLに溶解した。ヒドラジン水和物2.7mL(36.87mmoles、1.5当量)を加え、加熱還流を4時間行った。周囲温度に戻った後、塩酸水溶液(4N )100mLを加え;混合物を周囲温度で1時間撹拌し、フリットで濾過した。次に濾液を蒸発(エタノールの除去)させた。次に水相をエーテルで2回洗浄し、冷温状態で濃水酸化ナトリウム溶液を加えることによりpH9にした。ジクロロメタンでの抽出を3回実施し、次に合わせた有機相を水で洗浄し、MgSO4で乾燥させ、濾過し、蒸発乾固した。目的生成物4.9gを、淡黄色の油状物の形態で得た。
収率=75%
IR:ν=3366、3302、1591cm−1。
N−{[(7S)−3,4−ジメトキシビシクロ[4.2.0]オクタ−1,3,5−トリエン−7−イル]メチル}−N−メチルプロパン−1,3−ジアミン1g(3.7mmoles)を、エタノール20mLに溶解した。水中のグリオキサール 1,1−ジメチルアセタールの60%溶液520mg(0.45mL)を加え、次に10%Pd/C 100mgを加えた。反応混合物を大気圧で周囲温度にて12時間水素化した。触媒を濾別し、濾液を蒸発乾固した。目的生成物1.2gを、油状物の形態で得た。
収率=90%
IR:ν=1207、1508、834cm−1。
CH2Cl280mL中の前記工程からのアセタール6.3g(17.9mmoles)の溶液を調製した。トリエチルアミン5mL(35.8mmoles、2当量)を、得られた溶液に加え、次にこれを0℃に冷却した。次にそこに、ジクロロメタン40mL中の塩化ホモベラトリル3.8g(17.9mmoles)の溶液を滴下した。次に撹拌を周囲温度で3時間実施した。混合物を水で希釈し、ジクロロメタンで抽出した。有機相をMgSO4で乾燥させ、濾過し、蒸発乾固した。ここで、油状物10gを得て、これをシリカゲル500g(溶離剤=CH2Cl2/EtOH:90/10)で精製した。目的生成物8.5gを、褐色の油状物の形態で得た。
収率=90%
IR:ν=1627、1207、1124、1071、1049、1027cm−1。
酢酸10mLと濃塩酸10mLの混合物に、前記工程からのアセタール1g(1.9mmoles)を周囲温度で加えた。撹拌を25℃で1時間実施した。氷及び水酸化ナトリウム水溶液(20%)を加えることにより、溶液をpH9にした。次に混合物をジクロロメタンで抽出した。有機相を水で洗浄し、MgSO4で乾燥させ、濾過し、蒸発乾固した。ここで、油状物1gを得て、これをシリカ40gのフラッシュクロマトグラフィー(Merck(商標)カラム、溶離剤=CH2Cl2/EtOH:95/5)により精製した。ここで、目的生成物270mgを、99%を超える光学純度を有する油状物の形態で得た。
収率=31%
IR:ν=1656、836、760cm−1。
標記化合物を、本明細書に先に記載の実施例5の化合物から出発し、欧州特許第0 534 859号の明細書の実施例1工程Dを再現生成することにより得た。
Claims (17)
- 式(I):
で示されるイバブラジンの合成方法であって、式(VI):
[式中、R1及びR2(これらは、同じであるか又は異なっている)は、直鎖状もしくは分岐鎖状(C1−C6)アルコキシ基を表わすか、又はそれらを担持する炭素原子と一緒になって、1,3−ジオキサン、1,3−ジオキソランもしくは1,3−ジオキセパン環を形成する]で示される化合物を、式(VII):
で示される化合物と、還元剤の存在下、有機溶媒、有機溶媒の混合物、又は有機溶媒と水の混合物中で、還元的アミノ化反応に付して、式(VIII):
[式中、R1及びR2は、先に定義されたとおりである]で示される化合物を得て、これを、式(IX):
で示される化合物と、塩基の存在下、有機溶媒中で縮合反応に付して、式(X):
[式中、R1及びR2は、先に定義されたとおりである]で示される化合物を得て、これを、酸性媒体中で環化反応に付して、式(V):
で示される化合物を得て、これを水素化反応に付して、式(I)で示されるイバブラジンを得て、これを場合により、塩酸、臭化水素酸、硫酸、リン酸、酢酸、トリフルオロ酢酸、乳酸、ピルビン酸、マロン酸、コハク酸、グルタル酸、フマル酸、酒石酸、マレイン酸、クエン酸、アスコルビン酸、シュウ酸、メタンスルホン酸、ベンゼンスルホン酸及びショウノウ酸より選択される薬学的に許容しうる酸とのその付加塩に、及びその水和物に変換できることを特徴とする、方法。 - 式(VI)の化合物と式(VII)の化合物との還元的アミノ化反応を実施するために使用する還元剤が、トリアセトキシ水素化ホウ素ナトリウム、シアノ水素化ホウ素ナトリウム、及びパラジウム、白金、ニッケル、ルテニウム、ロジウム、及びそれらの化合物のような、特に支持体上の又は酸化物の形態の触媒の存在下の二水素より選択されることを特徴とする、請求項1記載の合成方法。
- 式(VI)の化合物と式(VII)の化合物との還元的アミノ化反応を実施するために使用する還元剤が、パラジウム担持炭の存在下の二水素であることを特徴とする、請求項2記載の合成方法。
- 式(VI)の化合物と式(VII)の化合物との間の還元的アミノ化反応が、0.5〜1.5barの二水素圧で実施されることを特徴とする、請求項3記載の合成方法。
- 式(VI)の化合物と式(VII)の化合物との還元的アミノ化反応を実施するために使用する溶媒が、テトラヒドロフラン、ジクロロメタン、1,2−ジクロロエタン、アセテート、及びアルコール類(好ましくはエタノール、メタノール又はイソプロパノール)、トルエン及びキシレンより選択されることを特徴とする、請求項1〜4のいずれか一項記載の合成方法。
- 式(VI)の化合物と式(VII)の化合物との還元的アミノ化反応を実施するために使用する溶媒が、エタノールと水の混合物を含むことを特徴とする、請求項5記載の合成方法。
- 式(VI)の化合物と式(VII)の化合物との間の還元的アミノ化反応が、0℃〜40℃の温度で実施されることを特徴とする、請求項1〜6のいずれか一項記載の合成方法。
- 式(VIII)と式(IX)の化合物の間の反応で使用する有機溶媒が、トルエン、ジクロロメタン、2−メチルテトラヒドロフラン、クロロベンゼン、1,2−ジクロロエタン、クロロホルム及びジオキサンより選択されることを特徴とする、請求項1〜7のいずれか一項記載の合成方法。
- 式(VIII)と式(IX)の化合物の間の反応で使用する有機溶媒が、ジクロロメタンであることを特徴とする、請求項8記載の合成方法。
- 式(VIII)と式(IX)の化合物の間の反応が、0〜40℃の温度で実施されることを特徴とする、請求項1〜9のいずれか一項記載の合成方法。
- 式(VIII)と式(IX)の化合物の間の反応で使用する塩基が、ピリジン、4−ジメチルアミノピリジン(DMAP)及び第三級アミンより選択されることを特徴とする、請求項1〜10のいずれか一項記載の合成方法。
- 式(VIII)と式(IX)の化合物の間の反応で使用する塩基が、トリエチルアミンであることを特徴とする、請求項11記載の合成方法。
- 式(V)の化合物を生成するための式(X)の化合物の環化を実施するために使用する酸が、濃硫酸、ポリリン酸、濃塩酸水溶液、酢酸中の濃塩酸溶液、酢酸中の濃臭化水素酸溶液、及びメタンスルホン酸より選択されることを特徴とする、請求項1〜12のいずれか一項記載の合成方法。
- 式(V)の化合物を生成するための式(X)の化合物の環化を実施するために使用する酸が、酢酸中の濃塩酸溶液であることを特徴とする、請求項13記載の合成方法。
- 式(V)の化合物を生成するための式(X)の化合物の環化が、0〜40℃の温度で実施されることを特徴とする、請求項1〜14のいずれか一項記載の合成方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR11/00446 | 2011-02-14 | ||
| FR1100446A FR2971507B1 (fr) | 2011-02-14 | 2011-02-14 | Nouveau procede de synthese de l'ivabradine et de ses sels d'addition a un acide pharmaceutiquement acceptable |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012167091A true JP2012167091A (ja) | 2012-09-06 |
| JP5475813B2 JP5475813B2 (ja) | 2014-04-16 |
Family
ID=43901397
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012028129A Active JP5475813B2 (ja) | 2011-02-14 | 2012-02-13 | イバブラジン及び薬学的に許容しうる酸とのその付加塩の新規合成方法 |
Country Status (35)
| Country | Link |
|---|---|
| US (1) | US8476426B2 (ja) |
| EP (1) | EP2487158B1 (ja) |
| JP (1) | JP5475813B2 (ja) |
| KR (1) | KR101372389B1 (ja) |
| CN (1) | CN102633720B (ja) |
| AR (1) | AR085344A1 (ja) |
| AU (1) | AU2012200439B2 (ja) |
| BR (1) | BR102012003254A2 (ja) |
| CA (1) | CA2767893C (ja) |
| CL (1) | CL2012000270A1 (ja) |
| CY (1) | CY1113983T1 (ja) |
| DK (1) | DK2487158T3 (ja) |
| EA (1) | EA020735B1 (ja) |
| ES (1) | ES2408213T3 (ja) |
| FR (1) | FR2971507B1 (ja) |
| GE (1) | GEP20135970B (ja) |
| HR (1) | HRP20130368T1 (ja) |
| IN (1) | IN2012DE00289A (ja) |
| JO (1) | JO2930B1 (ja) |
| MA (1) | MA34990B1 (ja) |
| ME (1) | ME01479B (ja) |
| MX (1) | MX337997B (ja) |
| MY (1) | MY171954A (ja) |
| NZ (1) | NZ598138A (ja) |
| PE (1) | PE20121741A1 (ja) |
| PL (1) | PL2487158T3 (ja) |
| PT (1) | PT2487158E (ja) |
| RS (1) | RS52699B (ja) |
| SA (1) | SA112330272B1 (ja) |
| SG (1) | SG183607A1 (ja) |
| SI (1) | SI2487158T1 (ja) |
| TW (1) | TWI430993B (ja) |
| UA (1) | UA110326C2 (ja) |
| UY (1) | UY33893A (ja) |
| WO (1) | WO2012110716A1 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102827019B (zh) * | 2012-09-12 | 2014-12-10 | 江苏宇田生物医药科技有限公司 | 一组新的苯并环丁烷化合物及其在化学合成中的应用 |
| CN103848789B (zh) * | 2012-11-29 | 2016-05-18 | 江苏恒瑞医药股份有限公司 | 一种伊伐布雷定的制备方法 |
| CN104447553B (zh) * | 2013-09-22 | 2017-02-01 | 广东众生药业股份有限公司 | 伊伐布雷定及其中间体的制备方法 |
| CN104829470B (zh) * | 2015-04-20 | 2017-08-25 | 江苏宇田医药有限公司 | 一组合成伊伐布雷定的中间体化合物及其应用 |
| KR200488336Y1 (ko) | 2017-01-04 | 2019-01-15 | 한전케이피에스 주식회사 | 저압터빈의 구동기 커플링용 분해 조립 작업대 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005298480A (ja) * | 2004-04-13 | 2005-10-27 | Lab Servier | イバブラジン及び薬学的に許容し得る酸とのその付加塩の新規合成方法 |
| WO2010072409A1 (en) * | 2008-12-22 | 2010-07-01 | Krka, D. D., Novo Mesto | Process for preparation of ivabradine |
| JP2010150259A (ja) * | 2008-12-24 | 2010-07-08 | Lab Servier | イバブラジン及び薬学的に許容されうる酸とのその付加塩の合成のための新たな方法 |
| JP2010241808A (ja) * | 2009-03-31 | 2010-10-28 | Lab Servier | イバブラジンおよび薬学的に許容され得る酸とのその付加塩の新たな合成方法 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US179316A (en) * | 1876-06-27 | Improvement in processes of preparing and producing colored photographs on glass | ||
| FR2681862B1 (fr) | 1991-09-27 | 1993-11-12 | Adir Cie | Nouvelles (benzocycloalkyl)alkylamines, leur procede de preparation, et les compositions pharmaceutiques qui les contiennent. |
| FR2868775B1 (fr) * | 2004-04-13 | 2008-04-11 | Servier Lab | Nouveau procede de synthese de derives de la 1,3,4,5- tetrahydro-2h-3-benzazepin-2-one, et application a la synthese de l'ivabradine et de ses sels d'addition a un acide pharmaceutiquement acceptable |
| EP2097383B1 (en) * | 2006-11-30 | 2012-02-08 | Cadila Healthcare Limited | Process for preparation of ivabradine hydrochloride |
| PT2471780E (pt) * | 2007-05-30 | 2015-02-24 | Ind Swift Lab Ltd | Sais oxalato de ivabradina cristalinos e seus polimorfos |
| FR2933975B1 (fr) * | 2008-07-17 | 2011-02-18 | Servier Lab | Nouveau procede de preparation de benzocyclobutenes fonctionnalises,et application a la synthese de l'ivabradine et de ses sels d'addition a un acide pharmaceutiquement acceptable. |
| CN101723897B (zh) * | 2008-10-31 | 2011-11-16 | 齐鲁制药有限公司 | 伊伐布雷定的合成方法 |
| FR2941695B1 (fr) * | 2009-02-04 | 2011-02-18 | Servier Lab | Nouveau procede de synthese de l'ivabradine et de ses sels d'addition a un acide pharmaceutiquement acceptable |
-
2011
- 2011-02-14 FR FR1100446A patent/FR2971507B1/fr not_active Expired - Fee Related
-
2012
- 2012-01-24 PE PE2012000091A patent/PE20121741A1/es active IP Right Grant
- 2012-01-25 AU AU2012200439A patent/AU2012200439B2/en not_active Ceased
- 2012-01-27 SG SG2012005856A patent/SG183607A1/en unknown
- 2012-01-29 JO JO201221A patent/JO2930B1/en active
- 2012-01-31 MY MYPI2012700016A patent/MY171954A/en unknown
- 2012-02-01 CL CL2012000270A patent/CL2012000270A1/es unknown
- 2012-02-02 IN IN289DE2012 patent/IN2012DE00289A/en unknown
- 2012-02-03 UY UY0001033893A patent/UY33893A/es unknown
- 2012-02-06 CA CA2767893A patent/CA2767893C/fr not_active Expired - Fee Related
- 2012-02-09 MX MX2012001722A patent/MX337997B/es active IP Right Grant
- 2012-02-09 AR ARP120100424A patent/AR085344A1/es unknown
- 2012-02-09 US US13/369,690 patent/US8476426B2/en not_active Expired - Fee Related
- 2012-02-09 NZ NZ598138A patent/NZ598138A/xx not_active IP Right Cessation
- 2012-02-10 GE GEAP201212569A patent/GEP20135970B/en unknown
- 2012-02-10 EA EA201200123A patent/EA020735B1/ru not_active IP Right Cessation
- 2012-02-13 JP JP2012028129A patent/JP5475813B2/ja active Active
- 2012-02-13 ME MEP-2013-41A patent/ME01479B/me unknown
- 2012-02-13 CN CN201210031500.2A patent/CN102633720B/zh not_active Expired - Fee Related
- 2012-02-13 DK DK12290050.9T patent/DK2487158T3/da active
- 2012-02-13 TW TW101104569A patent/TWI430993B/zh not_active IP Right Cessation
- 2012-02-13 BR BRBR102012003254-6A patent/BR102012003254A2/pt not_active Application Discontinuation
- 2012-02-13 UA UAA201201495A patent/UA110326C2/uk unknown
- 2012-02-13 SI SI201230001T patent/SI2487158T1/sl unknown
- 2012-02-13 WO PCT/FR2012/000055 patent/WO2012110716A1/fr not_active Ceased
- 2012-02-13 PL PL12290050T patent/PL2487158T3/pl unknown
- 2012-02-13 ES ES12290050T patent/ES2408213T3/es active Active
- 2012-02-13 PT PT122900509T patent/PT2487158E/pt unknown
- 2012-02-13 RS RS20130095A patent/RS52699B/sr unknown
- 2012-02-13 EP EP12290050A patent/EP2487158B1/fr active Active
- 2012-02-13 SA SA112330272A patent/SA112330272B1/ar unknown
- 2012-02-14 MA MA34630A patent/MA34990B1/fr unknown
- 2012-02-14 KR KR1020120015001A patent/KR101372389B1/ko not_active Expired - Fee Related
-
2013
- 2013-04-26 HR HRP20130368AT patent/HRP20130368T1/hr unknown
- 2013-05-08 CY CY20131100371T patent/CY1113983T1/el unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005298480A (ja) * | 2004-04-13 | 2005-10-27 | Lab Servier | イバブラジン及び薬学的に許容し得る酸とのその付加塩の新規合成方法 |
| WO2010072409A1 (en) * | 2008-12-22 | 2010-07-01 | Krka, D. D., Novo Mesto | Process for preparation of ivabradine |
| JP2010150259A (ja) * | 2008-12-24 | 2010-07-08 | Lab Servier | イバブラジン及び薬学的に許容されうる酸とのその付加塩の合成のための新たな方法 |
| JP2010241808A (ja) * | 2009-03-31 | 2010-10-28 | Lab Servier | イバブラジンおよび薬学的に許容され得る酸とのその付加塩の新たな合成方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5563600B2 (ja) | イバブラジン及びその薬学的に許容しうる酸付加塩の新規の合成方法 | |
| JP2010150259A (ja) | イバブラジン及び薬学的に許容されうる酸とのその付加塩の合成のための新たな方法 | |
| JP5475813B2 (ja) | イバブラジン及び薬学的に許容しうる酸とのその付加塩の新規合成方法 | |
| JP2010047577A (ja) | 1,3,4,5−テトラヒドロ−2h−3−ベンゾアゼピン−2−オン化合物の新規な合成方法、並びにイバブラジン及び薬学的に許容され得る酸とのその付加塩の合成への適用 | |
| JP2010006807A (ja) | 7,8−ジメトキシ−1,3−ジヒドロ−2h−3−ベンゾアゼピン−2−オンの新規合成方法、ならびにイバブラジンおよび薬学的に許容され得る酸とのその付加塩の合成における適用 | |
| JP2013505225A (ja) | イバブラジン及び薬学的に許容しうる酸とのその付加塩の新規な合成方法 | |
| TWI395738B (zh) | 伊伐佈雷定(ivabradine)及其與醫藥上可接受性酸之加成鹽之新合成方法 | |
| RS51962B (sr) | Novi postupak sinteze ivabradina i njegovih adicionih soli sa farmaceutski prihvatljivom kiselinom | |
| TWI519507B (zh) | 合成3-(2-溴-4,5-二甲氧基苯基)丙烷腈之新穎方法及於合成依伐布雷定(ivabradine)及與醫藥可接受酸合成其加成鹽之應用 | |
| JP5793171B2 (ja) | 3−(2−ブロモ−4,5−ジメトキシフェニル)プロパンニトリルの新規合成方法、及びイバブラジン及び薬学的に許容される酸とのその付加塩の合成における適用 | |
| JP5531084B2 (ja) | イバブラジン及びその薬学的に許容され得る酸との付加塩の新規な合成方法 | |
| HK1174616B (en) | Process for the synthesis of ivabradine and addition salts thereof with a pharmaceutically acceptable acid | |
| HK1174616A (en) | Process for the synthesis of ivabradine and addition salts thereof with a pharmaceutically acceptable acid | |
| HK1148748B (en) | Process for the synthesis of ivabradine and addition salts thereof with a pharmaceutically acceptable acid |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20130926 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131001 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131226 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20140128 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140206 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5475813 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |