JP2011509071A - 炎症性腸疾患のための遺伝子発現マーカー - Google Patents
炎症性腸疾患のための遺伝子発現マーカー Download PDFInfo
- Publication number
- JP2011509071A JP2011509071A JP2010536200A JP2010536200A JP2011509071A JP 2011509071 A JP2011509071 A JP 2011509071A JP 2010536200 A JP2010536200 A JP 2010536200A JP 2010536200 A JP2010536200 A JP 2010536200A JP 2011509071 A JP2011509071 A JP 2011509071A
- Authority
- JP
- Japan
- Prior art keywords
- ibd
- expression
- seq
- acid sequence
- polypeptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6809—Methods for determination or identification of nucleic acids involving differential detection
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/156—Polymorphic or mutational markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/172—Haplotypes
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Analytical Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Genetics & Genomics (AREA)
- Medicinal Chemistry (AREA)
- General Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Immunology (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Pathology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Physical Education & Sports Medicine (AREA)
- Dermatology (AREA)
- Gastroenterology & Hepatology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
(関連出願とのクロスリファレンス)
この出願は、全開示を出典明示によりここに援用する2007年11月29日出願の米国仮出願第60/991203号、2008年9月17日出願の米国仮出願第61/192268号、及び2008年5月22日出願の国際特許出願第PCT/US08/64562号の利益と米国特許法第119条第(e)項の優先権を主張する。
本発明は、炎症性腸疾患の検出及び診断における使用を含む、炎症性腸疾患病理発生における遺伝子発現プロファイルに関する。
免疫関連及び炎症疾患は、正常な生理機能では、発作又は傷害に反応して、発作又は傷害からの修復を開始し、外来生物体に対する生得的及び後天的防御を開始するのに重要な、かなり複雑で、多くの場合は多重に相互関連した生物学的経路の現れ又は結果である。疾患又は病理は、これらの正常な生理学的経路が、反応の強さに直接関連してか、異常な調節又は過度な刺激の結果として、自己に対する反応として、又はこれらの組合せとして、更なる発作又は傷害を引き起こすときに生じる。
これらの疾患の発生は、多くの場合、多段階経路及びしばしば多数の異なった生物学的システム/経路に関与しているが、一又は複数のこれら経路の重要な点における介在により改善又は治療効果を有し得る。治療的介在は有害なプロセス/経路の拮抗作用又は有益なプロセス/経路の刺激のいずれかにより生じる。
多くの免疫関連疾患が知られており、広範囲にわたって研究されている。このような疾患には、免疫媒介炎症疾患、非免疫媒介炎症疾患、感染疾患、免疫欠損症、異常増殖等が含まれる。
しばしば所定の患者がどちらの病気に罹っているのか言うのが難しいほど、UCとCDの診断基準には十分なオーバーラップがある;しかしながら、局在性のように、典型的に見られる病変のタイプは異なっている。UCは殆どは直腸に近位の結腸中に見られ、特徴的な病変は粘膜の表在性潰瘍であり;CDは腸の何処にでも見られ、胃、食道及び十二指腸にも時折関与し、病変は通常は広汎な直線状の裂溝として記述される。
炎症性腸疾患(IBD)において観察される慢性的小腸炎を生じる複雑な遺伝子−遺伝子及び遺伝子−環境関係の同定と理解に向けての補完的アプローチは、マイクロアレイ遺伝子発現解析である。マイクロアレイは、組織及び細胞レベルでの遺伝子発現の包括的な像を明らかにし、根底にある病態生理学的過程の理解を助ける(Stoughton等 Annu Rev Biochem. 2005;74:53-82)。マイクロアレイ解析は最初は1997年にIBDの患者に応用され、CDの患者の手術切除中の96遺伝子の発現を、関節リウマチの患者の滑液組織と比較した(Heller 等 Proc Natl Acad Sci U S A. 1997;94:2150-2155)。IBD患者からの手術標本を調べるためにマイクロアレイプラットホームを使用する更なる研究により、疾患試料をコントロールと比較した場合に差次的に調節された多くの新規遺伝子が同定された(Dieckgraefe等 Physiol Genomics. 2000;4:1-11;Lawrance等 Hum Mol Genet. 2001;10:445-456)。
ここに開示した発明は、哺乳動物組織又は細胞試料中の一又は複数の遺伝子発現マーカーの発現を検査する方法及びアッセイを提供し、ここで、一又は複数のかかるバイオマーカーの発現が、組織又は細胞試料が採取された哺乳動物被検者がIBDに罹っている可能性が高いかどうかを予測する。本発明の様々な実施態様では、該方法及びアッセイは、表1、2、及び3に列挙されたもののような遺伝子発現マーカーの発現を検査し、発現がコントロール試料よりも高いか又は低いかを決定する。
本発明のこれらの及び更なる実施態様は当業者には明らかであろう。
一実施態様では、哺乳動物被検者におけるIBDを診断又は検出する方法は、被検者から得られた試験試料において、(i)表1A、2、又は3Aから選択された一又は複数のポリペプチドをコードする一又は複数の核酸;又は(ii)表1A、2、又は3Aから選択された一又は複数の遺伝子のRNA転写物又はその発現産物の発現レベルが、コントロールにおける発現レベルに対して高いことを決定することを含み、発現の高いレベルが、試験試料が得られた被検者におけるIBDの存在を示している方法に関する。
他の実施態様では、哺乳動物被検者におけるIBDを診断又は検出する方法は、被検者から得られた試験試料において、(i)表1B又は3Bから選択された一又は複数のポリペプチドをコードする一又は複数の核酸;又は(ii)表1B又は3Aから選択された一又は複数の遺伝子のRNA転写物又はその発現産物の発現レベルが、コントロールにおける発現レベルに対して低いことを決定することを含み、発現の低いレベルが、試験試料が得られた被検者におけるIBDの存在を示している方法に関する。
本発明の方法の全ての態様に対して、ここに記載の一又は複数の遺伝子(あるいはかかる遺伝子の一又は複数によって発現されるポリペプチドをコードする一又は複数の核酸)の発現レベルの決定は、例えば遺伝し発現プロファイリングによって得ることができる。遺伝子発現プロファイリングの方法は、例えば、PCRベースの方法でありうる。
本発明の全態様に対して、遺伝子の発現レベルは、一又は複数の参照遺伝子、又はその発現産物の発現レベルに対して正規化されうる。
本発明の全態様に対して、該方法は、上記遺伝子の少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、又は20、又はその発現産物の発現レベルのエビデンスを決定することを更に含みうる。
本発明の全態様に対して、該方法は上記予想をまとめるレポートを作成する工程を更に含みうる。
本発明の全態様に対して、哺乳動物被検者から得られる試験試料は、結腸組織生検由来でありうる。好ましい実施態様では、生検は、回腸末端、上行結腸、下行結腸、及びS状結腸からなる群から選択される組織である。他の好ましい実施態様では、生検は炎症結腸領域又は非炎症結腸領域由来である。炎症結腸領域は急性的に炎症状態となっているか又は慢性的な炎症状態でありうる。
全態様に対して、発現レベルの決定は一回を越えて生じうる。本発明の全態様に対して、発現レベルの決定は、患者が手術前及び/又は手術後に何らかの治療を患者が受ける前になされうる。ある実施態様では、決定工程は、手術後の哺乳動物被検者におけるIBDの再発を示し、又は上記哺乳動物被検者における上記IBDの突然の再発を示している。好ましい実施態様では、IBDはクローン病である。
他の態様では、本発明は、IBDの存在がここに記載された方法によって検出されている哺乳動物被検者を治療する方法に関する。例えば、哺乳動物被検者から得られた試験試料がここに記載されたIBDマーカーのRNA転写物又は対応する遺伝子産物の一又は複数のコントロールに対する発現差異を示していることが決定された後、哺乳動物被検者にIBD治療剤が投与されうる。
異なった態様では、本発明は、(1)抽出バッファー/試薬及びプロトコル;(2)逆転写バッファー/試薬及びプロトコル;及び(3)qPCRバッファー/試薬及びプロトコルで本発明の方法を実施するのに適したものの一又は複数を含むキットに関する。該キットは、データ検索及び解析ソフトウェアを含みうる。
一実施態様では、発現差異がIBDを示す遺伝子はGLI1である。他の実施態様では、GLI1遺伝子はGLI1変異体である。好ましい実施態様では、GLI1変異体は実施例4に記載したようなrs2228226C→G(Q1100E)である。
特に定義しない限り、本明細書で使用する技術用語および科学用語は全て、本発明が属する分野の当業者によって一般的に理解されているのと同じ意味を有する。Singleton 等, Dictionary of Microbiology and Molecular Biology 2版, J. Wiley & Sons (New York, N.Y. 1994)、及びMarch, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4版, John Wiley & Sons (New York, N.Y. 1992)により当業者は本出願に使用した多くの用語の一般的な理解が得られる。
当業者は、本発明の実施に使用することができるであろう、ここに記載のものと同様もしくは等価な多くの方法及び材料が分かるであろう。実際、本発明は記載された方法及び材料に決して限定されるものではない。本発明の目的のために、次の用語を以下に定義する。
「クローン病」又は「CD」なる用語は、ここでは胃腸管の慢性的な炎症を含む症状を意味するために使用される。クローン関連炎症は通常は腸管を冒すが口から肛門までの至る所で発生しうる。CDは、腸管壁の全層にわたって広がり、腸間膜並びにリンパ節を含む点でUCとは異なる。該疾病はしばしば非連続的であり、つまり、腸の重篤に罹患しているセグメントが明らかに疾患がない領域から分離している。CDでは、腸壁がまた厚くなり、これが閉塞を生じ得、瘻孔及び裂溝の発生が珍しくはない。ここで使用される場合、CDは、限定するものではないが、(回腸及び大腸を冒す)回結腸炎;(回腸を冒す)回腸炎;胃十二指腸CD(胃及び十二指腸の炎症);空回腸炎(空腸における炎症の斑状パッチ);及びクローン(肉芽腫性)大腸炎(大腸のみを冒す)を含むCDの幾つかのタイプの一又は複数でありうる。
「非活動的」IBDなる用語は、ここでは、個体において過去に診断されたが現在は寛解しているIBDを意味するために使用される。これは、個体が診断されたが治療を受けていない活動的IBDと対照的なものである。加えて、活動的IBDは、 寛解(つまり、不活動的IBDになる)になった過去に診断され治療されたIBDの再発でありうる。かかる再発はここではIBDの「突然の再発」とも称されうる。IBDのような活動的な自己免疫疾患を有する哺乳動物被検者は、高まった疾患活動の期間又は対応する徴候の戻りである突然の再発を被りうる。突然の再発は、深刻な感染、アレルギー反応、肉体的ストレス、情動性トラウマ、手術、又は環境因子に応答して生じうる。
「阻害する」、「ダウンレギュレートする」、「過小発現する」及び「減少する」なる用語は、交換可能に使用され、遺伝子の発現、又は一又は複数のタンパク質又はタンパク質サブユニットをコードするRNA分子又は等価なRNA分子のレベル、又は一又は複数のタンパク質又はタンパク質サブユニットの活性が、一又は複数のコントロール、例えば一又は複数のポジティブ及び/又はネガティブコントロールに対して減少することを意味する。
「アップレギュレートする」又は「過剰発現する」なる用語は、遺伝子の発現、又は一又は複数のタンパク質又はタンパク質サブユニットをコードするRNA分子又は等価なRNA分子のレベル、又は一又は複数のタンパク質又はタンパク質サブユニットの活性が、一又は複数のコントロール、例えば一又は複数のポジティブ及び/又はネガティブコントロールに対して上昇されることを意味する。
「予後」なる用語は、ここでは、自己免疫の突然の再発及び手術後の再発を含むIBDの発生又は進行の可能性の予測を意味する。予後因子は、IBDをひとたび発症したら患者の再発率及び結果に影響を及ぼすIBDの自然経過に関連した変量である。悪い予後に関連しうる臨床的パラメータは、例えば、腹部腫瘤又は圧痛、皮疹、関節腫脹、 口腔内潰瘍、及び腹鳴(腸にわたる腹鳴又は振とう音)を含む。予後因子は、異なったベースライン再発リスクを持つサブグループに患者を分類するために使用することができる。
これらの疾患の病因論は知られておらず、初期の病変ははっきりとは定まっていない;しかし、表面上皮の斑状壊死、腺性陰窩に隣接する白血球の局所性蓄積、及び増加した数の上皮内リンパ球及びある種のマクロファージサブセットが、特にクローン病における推定される初期の変化として記述されている。
「試験試料」なる用語は、IBDになっていることが疑われ、IBDであることが知られ、又はIBDからの寛解にあることが知られている哺乳動物被検者からの試料を意味する。試験試料は、限定しないが、血液、精液、血清、尿、骨髄、粘膜、組織等を含む哺乳動物被検者における様々な供給源から由来しうる。
「マイクロアレイ」は、基質上の、ハイブリダイズ可能なアレイ要素、好ましくはポリヌクレオチドプローブの秩序だった配置を意味する。
「遺伝子増幅」なる語句は、遺伝子又は遺伝子断片の複数コピーが特定の細胞又は細胞株中で形成されるプロセスを意味する。複製領域(増幅DNAの伸展)はしばしば「増幅産物」と称される。通常、生産されたメッセンジャーRNA(mRNA)の量、つまり遺伝子発現のレベルは、発現した特定の遺伝子から作製されたコピー数の割合でまた増加する。
一般に、「マーカー」又は「バイオマーカー」なる用語は、その遺伝がモニターできる制限酵素認識部位又は遺伝子のような染色体上の同定可能な物理的位置を意味する。該マーカーは「遺伝子発現マーカー」と称される遺伝子の発現領域、又は既知のコード化機能のないDNAのあるセグメントでありうる。ここで使用される「IBDマーカー」は表1、2、及び3に列挙された遺伝子を意味する。
本発明の文脈において、任意の特定の遺伝子セットに列挙された遺伝子の「少なくとも一つ」、「少なくとも二つ」、「少なくとも5つ」等の標記は、列挙された遺伝子の何れか一つ又は任意のかつ全ての組合せを意味する。
理論的には、「エキソン」なる用語は、成熟RNA産物に提示される介在遺伝子の任意のセグメントを意味する(B. Lewin. Genes IV Cell Press, Cambridge Mass. 1990)。理論的には、「イントロン」なる用語は、転写されているがその何れかの側のエキソンを共にスプライシングすることによって転写物内から除去されるDNAの任意のセグメントを意味する。作用的には、エキソン配列は参照配列番号によって定義される遺伝子のmRNA配列で生じる。作用的には、イントロン配列は、エキソン配列によって一括されその5’及び3’境界にGT及びAGスプライスコンセンサス配列を有する遺伝子のゲノムDNA内の介在配列である。
「天然配列」ポリペプチドは、天然に生じる又は対立遺伝子変異体を含む天然由来のポリペプチドと同じアミノ酸配列を有するものである。かかる天然配列ポリペプチドは天然から単離することができ、又は組換え又は合成手段によって生産されうる。よって、天然配列ポリペプチドは、天然に生じるヒトポリペプチド、マウスポリペプチド、又は任意の他の哺乳動物種由来のポリペプチドのアミノ酸配列を有しうる。
ここで使用される「モノクローナル抗体」なる用語は、実質的に均一な抗体の集団から得られる抗体を指す、すなわち、その集団を構成する個々の抗体が、モノクローナル抗体の生産中に生じ得、一般には少量で存在しうる可能な変異体を除いて、同一であり、及び/又は同じエピトープに結合する。かかるモノクローナル抗体には典型的には標的に結合するポリペプチド配列を含む抗体が含まれ、ここで、標的結合ポリペプチド配列は複数のポリペプチド配列から単一の標的結合ポリペプチド配列を選択することを含む方法によって得られた。
非ヒト(例えば齧歯類)抗体の「ヒト化」型とは、非ヒト免疫グロブリンから誘導された最小配列を含むキメラ抗体である。大部分では、ヒト化抗体はレシピエントの高頻度可変領域由来の残基が、マウス、ラット、ウサギ又は非ヒト霊長類のような所望の特異性、親和性及び能力を有する非ヒト種(ドナー抗体)の高頻度可変領域由来の残基によって置換されたヒト免疫グロブリン(レシピエント抗体)である。
「抗体断片」は、好ましくはその抗原結合領域を含む、インタクトな抗体の一部を含む。抗体断片の例には、Fab、Fab'、F(ab')2及びFv断片;ダイアボディ;直鎖状抗体;単鎖抗体分子;及び抗体断片から形成される多重特異性抗体が含まれる。
ループ カバット AbM Chothia 接触
−−−−−− −−− −−−− −−−−
L1 L24-L34 L24-L34 L24-L34 L30-L36
L2 L50-L56 L50-L56 L50-L56 L46-L55
L3 L89-L97 L89-L97 L89-L97 L89-L96
H1 H31-H35B H26-H35B H26-H32,33又は34 H30-H35B (Kabat番号付け)
H1 H31-H35 H26-H35 H26-H32 H30-H35 (Chothia番号付け)
H2 H50-H65 H50-H58 H52-H56 H47-H58
H3 H95-H102 H95-H102 H95-H102 H93-H101
抗体のパパイン消化は、「Fab」断片と呼ばれる2つの同一の抗体結合断片を生成し、各々が単一の抗原結合部位と、名前が容易に結晶化するその能力を反映する残留「Fc」断片を有する。ペプシン処理は、2つの抗原結合部位を持ち、抗原になお架橋できるF(ab')2断片を生じる。
Fab断片は軽鎖の定常ドメインと重鎖の第一定常ドメイン(CH1)をまた含んでいる。Fab’断片は、抗体ヒンジ領域からの一又は複数のシステインを含む重鎖CH1ドメインのカルボキシ末端に2,3の残基が付加される点でFab断片とは異なる。Fab’−SHは、ここでは、定常ドメインのシステイン残基が少なくとも一つの遊離チオール基を担持しているFab’についての標記である。F(ab’)2抗体断片は、その間にヒンジシステインを有するFab’断片対として元々は生産された。抗体断片の他の化学的カップリングもまた知られている。
ここでの「Fc領域」なる用語は、天然配列Fc領域及び変異体Fc領域を含む、免疫グロブリン重鎖のC末端領域を定義するために使用される。免疫グロブリン重鎖のFc領域の境界は変化するかも知れないが、通常、ヒトIgG重鎖Fc領域はCys226の位置又はPro230からそのカルボキシル末端までの位置のアミノ酸残基から伸長すると定義される。Fc領域のC末端リジン(EU番号付けシステムによれば残基447)は、例えば抗体の産生又は精製中に、又は抗体の重鎖をコードする核酸を組換え的に操作することによって、取り除かれてもよい。従って、インタクトな抗体の組成物は、全てのK447残基が除去された抗体群、K447残基が除去されていない抗体群、及びK447残基を有する抗体と有さない抗体の混合を含む抗体群を含みうる。
「天然配列Fc領域」は、天然に見出されるFc領域のアミノ酸配列と同一のアミノ酸配列を含む。天然配列のヒトFc領域には、天然配列のヒトIgG1Fc領域(非A-及びA-アロタイプ);天然配列のヒトIgG2 Fc領域;天然配列のヒトIgG3 Fc領域;及び天然配列のヒトIgG4 Fc領域;並びにその自然に生じる変異体が含まれる。
それらの重鎖の定常ドメインのアミノ酸配列に依存して、インタクトな抗体は異なる「クラス」に分類できる。インタクトな抗体の五つの主要なクラス:IgA、IgD、IgE、IgG及びIgMがあり、それらの幾つかは更に「サブクラス」(アイソタイプ)、例えばIgG1、IgG2、IgG3,IgG4、IgA及びIgA2に分類される。抗体の異なるクラスに対応する重鎖定常ドメインはそれぞれα、δ、ε、γ及びμと呼ばれる。免疫グロブリンの異なるクラスのサブユニット構造及び3次元構造はよく知られている。
「ダイアボディ」なる用語は、二つの抗原結合部位を持ち、その断片が同一のポリペプチド鎖(VH−VL)内で軽鎖可変ドメイン(VL)に結合した重鎖可変ドメイン(VH)を含む抗体断片を指す。非常に短いために同一鎖上で二つのドメイン間での対形成を可能にするリンカーを使用して、ドメインを他の鎖の相補ドメインと強制的に対形成させ、二つの抗原結合部位を創製する。ダイアボディは、例えば欧州特許出願公開第404097号;国際公開第93/11161号;及びHudson等, Nat. Med. 9:129-134 (2003);及びHollinger等, Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993)に更に十分に記載されている。
「単離された」抗体は、その自然環境の成分から同定され分離され及び/又は回収されたものである。その自然環境の汚染成分とは、その抗体の研究、診断又は治療への使用を妨害する物質であり、酵素、ホルモン、及び他のタンパク質様又は非タンパク質様溶質が含まれうる。好ましい実施態様では、抗体は、(1)ローリー法で測定して95重量%抗体を越えるまで、最も好ましくは99重量%を越えるまで、(2)スピニングカップシークエネーターを使用することにより、少なくとも15残基のN末端又は内部アミノ酸配列を得るのに充分なほど、あるいは、(3)クーマシーブルー又は好ましくは銀染色を用いた還元又は非還元条件下でのSDS−PAGEにより均一になるまで、精製される。単離された抗体には、抗体の自然環境の少なくとも一つの成分が存在しないため、組換え細胞内のインサイツの抗体が含まれる。しかしながら、通常は、単離された抗体は少なくとも一つの精製工程により調製される。
抗体がFc領域を有する場合、オリゴ糖構造は、例えば残基299(残基のEu番号付けでは298)で、抗体の一又は二の重鎖に結合していてもよい。パーツズマブでは、G0が主要なオリゴ糖構造で、例えばG0−F、G−1、Man5、Man6、G1−1、G1(1−6)、G1(1−3)及びG2のような他のオリゴ糖構造はパーツズマブ組成物中により少量で見出される。
特に明記しない限り、ここでの「G1オリゴ糖構造」にはG−1、G1−1、G1(1−6)及びG1(1−3)構造が含まれる。
「脱アミド化」抗体は、その一又は複数のアスパラギン残基が、例えばアスパラギン酸、スクシンイミド又はイソ-アスパラギン酸に誘導体化されているものである。
本発明の実施には、別段の記載がない限り、当業者の技量の範囲内にある分子生物学(組換え技術を含む)、微生物学、細胞生物学、生化学、及び免疫学の一般的な技術を使用する。かかる技術は、例えば“Molecular Cloning: A Laboratory Manual”, 2版 (Sambrook等, 1989);“Oligonucleotide Synthesis” (M. J. Gait編, 1984);“Animal Cell Culture” (R. I. Freshney編, 1987);“Methods in Enzymology” (Academic Press, Inc.);“Handbook of Experimental Immunology”, 4版(D.M. Weir及びC.C. Blackwell編, Blackwell Science Inc., 1987);“Gene Transfer Vectors for Mammalian Cells”(J.M. Miller及びM.P. Calos編, 1987);“Current Protocols in Molecular Biology”(F. M. Ausubel等編, 1987);及び“PCR: The Polymerase Chain Reaction”, (Mullis等編, 1994)のような文献に十分に説明されている。
本発明は表1A、1B、2、3A、及び3Bに列挙されたIBDに対する数多くの遺伝子発現マーカー又はバイオマーカーを提供する。本発明の一実施態様では、バイオマーカーは(ここに記載の)マーカーパネルでの使用に適している。かかるパネルは、表1Aからの一又は複数のマーカー;表1Bからの一又は複数のマーカーl表2からのマーカー;表3Aからの一又は複数のマーカー;及び表3Bからの一又は複数のマーカーを含みうる。加えて、本発明はまた表1A、1B、2、3A、及び3Bの二以上から選択されたマーカーのパネルを考慮する。例えば、パネルは、表1Aからの一又は複数のマーカーと表1Bからの一又は複数のマーカー; 又は表1Aからの一又は複数のマーカーと表2からのマーカー;又は表1Bからの一又は複数のマーカーと表2からのマーカー;又は表1Aからの一又は複数のマーカーと表3Aからの一又は複数のマーカー等々を含むかもしれない。当業者であれば、ここに記載のパネルで使用するのに適した表1−3からのバイオマーカーの様々な組合せが分かるであろう。
正常細胞及びIBDの哺乳動物被検者からの細胞におけるRNA転写物の発現差異のエビデンスに基づいて、本発明はIBDのための遺伝子マーカーを提供する。本発明によってもたらされるIBDマーカーと関連した情報によって、医師はより賢明な処置の決定をなし、個々の患者の必要性に対してIBDの治療をあつらえ、それによって治療の恩恵を最大にし、有意な恩恵を提供せず毒性の副作用による深刻な危険性をしばしばもたらす不要な治療に患者を暴露することを最小にする。
IBDの発症又は進行の予測における遺伝子マーカーの有用性はそのマーカーに独特なものでなくともよい。特定の試験マーカーと非常に類似した発現パターンを有する代替マーカーを試験マーカーに置換するか又は試験マーカーに加えて使用することができ、試験の全体的な予測上の有用性に影響は殆どない。二つの遺伝子の非常に類似した発現パターンは、特定のプロセスにあり、及び/又は共通の調節コントロール下にある双方の遺伝子の関連から生じうる。本発明は、本発明の方法でのそのような代替遺伝子又は遺伝子セットの使用を含み、また考える。
IBDの発症及び/又は進行を予測する本発明によって提供されるマーカー及び関連情報はまたIBDの患者の治療のための薬剤化合物の効能を試験する臨床治験に含める患者をスクリーニングする際に有用性を有している。
他の実施態様では、IBDマーカー及び関連する情報は、遺伝子の転写物又はその発現産物のレベル又は活性を調節する試薬を設計し又は製造するために使用される。上記試薬には、限定しないが、アンチセンスRNA、低分子阻害性RNA(siRNA)、リボザイム、モノクローナル又はポリクローナル抗体が含まれうる。更なる実施態様では、上記遺伝子又はその転写物、又はより特定的には上記転写物の発現産物は薬剤化合物を同定する(スクリーニング)アッセイにおいて使用され、ここで、上記薬剤化合物はIBDを治療するための薬剤の開発において使用される。
本発明の様々な実施態様では、以下に記載される様々な技術的アプローチ法が、開示された遺伝子の発現レベルの決定に利用できる。特定の実施態様では、各遺伝子の発現レベルは、エキソン、イントロン、タンパク質エピトープ及びタンパク質活性を含む遺伝子の発現産物の様々な特徴に関して決定されうる。他の実施態様では、遺伝子の発現レベルは、遺伝子の構造の解析から、例えば遺伝子のプロモーターのメチル化パターンの解析から推量されうる。
本発明はIBDマーカーの発現差異に基づき哺乳動物被検者におけるIBDを検出又は診断する方法を提供する。一実施態様では、該方法は上で検討されたIBDマーカーのパネルの使用を含む。パネルは表1−3から選択される一又は複数のIBDマーカーを含みうる。
ある実施態様では、IBDマーカーのパネルは、少なくとも1のIBDマーカー、少なくとも2のIBDマーカー、少なくとも3のIBDマーカー、少なくとも4のIBDマーカー、少なくとも5のIBDマーカー、少なくとも6のIBDマーカー、少なくとも7のIBDマーカー、少なくとも8のIBDマーカー、少なくとも9のIBDマーカー、少なくとも10のIBDマーカー、少なくとも11のIBDマーカー、少なくとも12のIBDマーカー、少なくとも13のIBDマーカー、少なくとも14のIBDマーカー、少なくとも15のIBDマーカー、少なくとも16のIBDマーカー、少なくとも17のIBDマーカー、少なくとも18のIBDマーカー、少なくとも19のIBDマーカー、又は少なくとも20のIBDマーカーを含むであろう。一実施態様では、パネルは5の増分でマーカーを含む。他の実施態様では、パネルは10の増分でマーカーを含む。該パネルは、コントロールに対してIBDにおいて過剰発現されるIBDマーカー、コントロールに対してIBDにおいて過小発現されるIBDマーカー、又はコントロールに対してIBDにおいて過剰発現及び過小発現の双方が生じるIBDマーカーを含みうる。好ましい実施態様では、該パネルは、CDにおいてアップレギュレートされた一又は複数のマーカーと、CDにおいてダウンレギュレートされた一又は複数のマーカーを含む。他の好ましい実施態様では、該パネルは、UCにおいてアップレギュレートされた一又は複数のマーカーと、UCにおいてダウンレギュレートされた一又は複数のマーカーを含む。
好ましい実施態様では、哺乳動物被検者においてIBDの存在を診断又は検出する方法は、被検者から得られた試験試料中のIBDマーカーのパネルからのRNA転写物又はその発現産物の、コントロールにおける発現レベルに対する発現レベル差を決定することを含み、ここで、発現レベルの差が、試験試料が得られた被検者におけるIBDの存在を示している。試験試料中の発現差異は、ここで検討されたようにコントロールに対して高い及び/又は低いものでありうる。
IBD患者を同定するための方法がここに提供される。この患者集団のうち、IBDの患者は、患者から得られた細胞を含む生物学的試料中における遺伝子、対応するRNA分子又はコード化タンパク質の一又は複数の発現レベルを決定することによって同定することができる。生物学的試料は、例えばここに記載された組織生検でありうる。
本発明の他の態様は、ここに記載された分子を発現する細胞を同定するための方法に関する。ここに記載の分子の発現プロファイルは、それをIBDに対する診断マーカーにする。従って、分子の発現の状態は、疾患の進行段階の罹患率、進行速度、及び/又は活動的IBD又は非活動的IBDにおける徴候の突然で深刻な発症、つまり突然の再発を含む様々な因子を予測するのに有用な情報を提供する。
他の実施態様では、本発明の方法によって検出されるIBDは、哺乳動物被検者におけるIBDの再発又は突然の再発である。
ある実施態様では、決定工程は、(i)試験試料及びコントロールにおけるIBDマーカーの発現レベル差を測定し; 及び/又は(ii) 試験試料及びコントロールにおけるIBDマーカーの発現レベル差の測定から得られるデータを分析する目的で、適切なプロセッサーによって実行されるソフトウェアプログラムの使用を含む。適切なソフトウェア及びプロセッサーはよく知られており、商業的に入手できる。該プログラムは、有形媒体、例えばCD−ROM、フロッピーディスク、ハードドライブ、DVD、又はプロセッサーに伴うメモリーに保存したソフトウェアで具体化できるが、当業者ならば、プログラム全体又はその一部をプロセッサー以外の装置で実行し、及び/又はよく知られた形でファームウェア及び/又は専用のハードウェアで具現化できることを直ぐに理解するであろう。
好ましい実施態様では、ここでのIBDマーカーの一又は複数を有する被検者において測定されたここに開示された一又は複数のIBDマーカーの発現レベルに基づく診断、予測及び/又は推奨治療は、アッセイが完了し、診断及び/又は予測が作成された後に出来るだけ早く被検者に伝えられうる。結果及び/又は関連情報は、被検者を治療する医師によって被検者に伝えられうる。あるいは、結果は、書面、伝達の電子形態、例えば電子メール、又は電話を含む任意の伝達手段によって被検者に直接伝えることができる。伝達は、電子メール通信の場合におけるように、コンピュータの使用により容易にすることができる。ある実施態様では、診断試験の結果及び/又は導かれた結論及び/又は試験に基づく治療の推奨を含む伝達が作成され、テレコミュニケーションの熟練した技術者にはよく知られているコンピュータハードウェア及びソフトウェアの組合せを使用して被検者に自動的に配信されうる。ヘルスケア向けのコミュニケーションシステムの一例は米国特許第6283761号に記載されている;しかしながら、本発明はこの特定のコミュニケーションシステムを利用する方法に限られるものではない。本発明の方法のある実施態様では、試料のアッセイ、疾患の診断、及びアッセイ結果又は診断の伝達を含む方法工程の全て又は一部が異なった(例えば外国の)管轄区域で実施されうる。
本発明の様々な実施態様では、限定しないが、RT−PCR、マイクロアレイ、遺伝子発現の連続解析(SAGE)及びMassively Parallel Signature Sequencing(MPSS)による遺伝子発現解析(以下に詳細に検討する)を含む様々な技術的アプローチ法が、開示された遺伝子の発現レベルの決定に利用できる。特定の実施態様では、各遺伝子の発現レベルは、エキソン、イントロン、タンパク質エピトープ及びタンパク質活性を含む遺伝子の発現産物の様々な特徴に関連して決定れうる。他の実施態様では、遺伝子の発現レベルは、遺伝子の構造解析から、例えば遺伝子プロモータのメチル化パターンの解析から推定されうる。
本発明は、ここに記載の診断方法によって哺乳動物被検者におけるIBDの存在を検出し、ついで該哺乳動物被検者にIBD治療剤を投与することを含む治療を必要とする被検者においてIBDを治療する方法を提供する。当業者であれば、本発明での使用に適しているであろう様々なIBD治療剤を把握できる(その全体を出典明示によりここに援用するSt Clair Jones, Hospital Pharmacist, May 2006, Vol. 13; pages 161-166を参照)。本発明は治療を必要とする被検者に一又は複数のIBD治療剤が投与されるIBDの治療方法を考慮する。一実施態様では、IBD治療剤は、アミノサリチル酸、副腎皮質ステロイド、及び免疫抑制剤の一又は複数である。好ましい実施態様では、アミノサリチル酸は、スルファサラジン、オルサラジン、メサラミン、バルサラジド、及びアサコールの一つである。他の好ましい実施態様では、例えばスルファサラジンとオルサラジンの組合せのような複数のアミノサリチル酸類が同時投与される。他の好ましい実施態様では、副腎皮質ステロイドは、ブデソニド、プレドニゾン、プレドニゾロン、メチルプレドニゾロン、6−メルカプトプリン(6−MP)、アザチオプリン、メトトレキセート、及びシクロスポリンでありうる。他の好ましい実施態様では、IBD治療剤は抗生物質、例えばシプロフロキサシン及び/又はメトロニダゾール;又は抗体ベースの薬剤、例えばインフリキシマブ (レミケード(登録商標))でありうる。
薬学的医薬及び手術に加えて、栄養療法のようなIBDに対する非常套的な治療法もまた試みられている。例えば、Flexical(登録商標)という半成分的処方物が、ステロイドのプレドニゾロンと同じ効果を有することが示されている。Sanderson等、Arch. Dis. Child. 51:123-7 (1987)。しかしながら、半成分的処方物は比較的高価であり、通常は好まれず、その使用は制限されている。タンパク質全体を導入する栄養療法はまたIBDの症状を軽減するために試みられてきた。Giafer等、Lancet 335:816-9 (1990)。米国特許第5461033号には、牛乳から単離された酸性カゼイン及びTGF−2の使用が開示されている。Beattie等, Aliment. Pharmacol. Ther. 8:1-6 (1994)には、IBDの子供の幼児期の処方にカゼインを使用する方法が開示されている。米国特許第5952295号には、IBDの治療用の腸溶性製剤にカゼインを使用する方法が開示されている。しかしながら、栄養療法は、非毒性ではあるが対症療法に過ぎず、疾病の根源にある原因を治療することはできない。
一態様では、本発明は、IBDを治療又は予防するための方法を提供し、該方法は、被検者におけるIBDの存在を検出し、被検者に有効量のIBD治療剤を投与することを含む。ここで検討されるようにアミノサリチル酸類、副腎皮質ステロイド類、及び免疫抑制剤を含む任意の適切なIBD治療剤を治療方法において使用することができる。
第一医薬と第二医薬を使用するかかる治療は、併用投与(二以上の薬剤が同じ又は別個の製剤に含まれる)、及び第一医薬の投与が第二医薬の投与の前、及び/又は次に生じうる別個の投与を含む。一般に、かかる第二医薬は、第一医薬が投与された後、48時間以内に、又は24時間以内に、又は12時間以内に、又は第一医薬後3−12時間以内に投与され得、あるいは、好ましくは約1から2日、約2から3日、約3から4日、約4から5日、約5から6日、又は6から7日である予め選択された時間にわたって投与されうる。
一又は複数のIBD治療剤の組合せ、又は一又は複数の治療剤とここに記載の外科手技の組合せでの治療は、好ましくはIBDの徴候又は症状の改善を生じる。例えば、かかる治療法は、IBDの病理の重篤性の減少によって裏付けられるように、IBD治療剤治療計画と外科手技を受ける被検者に改善を生じうる。
本発明の方法に従って投与されるIBD治療剤は、良好な医療実務に一致した態様で製剤され、用量決定され、投与される。この点において考慮される因子には、治療されている特定の疾患、個々の患者の臨床状態、疾患の原因、薬剤の送達部位、投与方法、投与スケジュール、及び医療実務者に知られている他の因子が含まれる。第一医薬はその必要はないが、場合によってはここに記載された一又は複数の更なる医薬(例えば第二、第三、第四等の医薬)と共に製剤化される。かかる更なる医薬の有効量は、製剤中に存在する第一医薬の量、疾患又は治療のタイプ、及び上で検討した他の因子に依存する。これらは一般にこれまで使用したものと同じ投薬量及び投薬経路で使用され、又はこれまで用いられた投薬量のおよそ1から99%で用いられる。
一般に、遺伝子発現プロファイリングの方法は、二つの大きなグループに分けることができる:ポリヌクレオチドのハイブリダイゼーション解析に基づく方法と、生化学的検出又はポリヌクレオチドの配列決定に基づく他の方法である。試料中のmRNA発現を定量化するために当該分野で最も広く用いられている方法には、ノーザンブロット及びインサイツハイブリダイゼーション(Parker及びBarnes, Methods in Molecular Biology 106: 247-283(1999);RNAse保護アッセイ(Hod, Biotechniques 13: 852-854(1992);及び逆転写ポリメラーゼ連鎖反応(RT−PCR)(Weis等, Trends in Genetics 8: 263-264(1992))が含まれる。あるいは、DNA二重鎖、RNA二重鎖、及びDNA-RNAハイブリッド二重鎖又はDNA-タンパク質二重鎖を含む特定の二重鎖を認識できる抗体を用いてもよい。mRNA又はタンパク質の発現を決定するための様々な方法には、限定されないが、遺伝子発現プロファイリング、定量的リアルタイムPCR(qRT−PCR)を含むポリメラーゼ連鎖反応(PCR)、例えばアフィメトリックス・ジーンチップ技術を用いるなど、製造者のプロトコルに従って市販の装置によって実施することができるマイクロアレイ解析、連続遺伝子発現解析(SAGE)(Velculescu等, Science 270:484-487 (1995);及びVelculescu等, Cell 88:243-51 (1997))、MassARRAY,Massively Parallel Signature Sequencing (MPSS)による遺伝子発現解析(Brenner等, Nature Biotechnology 18:630-634 (2000))、プロテオミクス、免疫組織化学的検査(IHC)等が含まれる。好ましくは、mRNAが定量される。かかるmRNA解析は、好ましくはポリメラーゼ連鎖反応(PCR)の技術を使用して、又はマイクロアレイ解析によって実施される。PCRが用いられる場合、PCRの好ましい形態は定量的リアルタイムPCR(qRT−PCR)である。
上に列挙した技術のうち、最も感度が良く最も柔軟性がある定量法はRT−PCRであり、これは、正常及び試験試料中の異なった試料集団におけるmRNAレベルを比較し、遺伝子発現のパターンを特徴付けし、密接に関連したmRNA間を識別し、RNA構造を解析するために使用することができる。
第一工程は標的試料からのmRNAの単離である。出発材料は典型的には結腸組織生検から単離された全RNAである。よって、RNAは、限定されないが、回腸末端、上行結腸、下行結腸、及びS状結腸を含む様々な組織から単離することができる。また、生検が得られる結腸組織は、炎症及び/又は非炎症結腸領域由来でありうる。
mRNA抽出に関する一般的方法は当該分野で良く知られており、Ausubel等, Current Protocols of Molecular Biology, John Wiley and Sons (1997)を含む分子生物学の標準的教科書に開示されている。特に、RNAの単離は、Qiagen等の商業的製造者の精製キット、バッファーセット及びプロテアーゼを、製造者の指示書に従って使用することで実施することができる。組織試料からの全RNAは、RNA Stat−60(Tel−Test)を使用して単離できる。生検から調製したRNAは、例えば、塩化セシウム密度勾配遠心分離によって単離できる。
PCR工程では、様々な熱安定性DNA依存性DNAポリメラーゼを使用することができるが、典型的には、5’−3’ヌクレアーゼ活性を有するが3’−5’プルーフリーディングエンドヌクレアーゼ活性を欠くTaq DNAポリメラーゼを用いる。よって、TaqMan(登録商標)PCRでは、典型的には、Taq又はTthポリメラーゼの5’−ヌクレアーゼ活性を用いて、その標的アンプリコンに結合したハイブリダイゼーションプローブを加水分解するが、5’ヌクレアーゼ活性と同等の任意の酵素を用いることができる。PCR反応にとって典型的なアンプリコンを生成するために2つのオリゴヌクレオチドプライマーを使用する。三番目のオリゴヌクレオチド、又はプローブを、2つのPCRプライマーの間に位置するヌクレオチド配列を検出するために設計する。該プローブは、Taq DNAポリメラーゼ酵素によって伸長せず、レポーター蛍光色素及び消光蛍光色素で標識される。このレポーター色素のどんなレーザー誘導放射も、プローブ上でこの2つの色素が近接して位置している場合には、消光色素によって消光する。増幅反応の間、Taq DNAポリメラーゼ酵素は、テンプレートに依存する形でプローブを切断する。生じたプローブ断片は溶液中で解離し、放出されたレポーター色素からのシグナルは、二番目のフルオロフォアの消光効果とは無関係である。新しい分子が合成される度にレポーター色素の1分子が遊離させられ、消光しないレポーター色素の検出がデータの定量的な解釈の基礎を提供する。
エラー及び試料と試料間の変化による効果を最小限にするために、通常は内部標準を使用してRT-PCRを実施する。理想的な内部標準は、異なる組織間では一定のレベルで発現し、実験上の処理によって影響を受けない。遺伝子発現のパターンを正規化するために最も頻繁に使用されているRNAは、ハウスキーピング遺伝子であるグリセルアルデヒド-3-リン酸-デヒドロゲナーゼ(GAPDH)及びβ-アクチンのmRNAである。
非特異的シグナルを避けるために、プライマーとプローブを設計する場合、イントロン内において反復配列をマスクすることが重要である。これは、反復エレメントのライブラリーに対してDNA配列をスクリーニングし、反復エレメントがマスクされる問い合わせ配列を返すベイラー医科大学からオンラインで入手可能なRepeat Maskerプログラムを使用して容易に達成することができる。ついで、マスクされたイントロン配列を使用し、例えばPrimer Express(Applied Biosystems);MGBアッセイ−バイ−デザイン(Applied Biosystems);プライマー3(Steve Rozen及びHelen J. Skaletsky (2000) Primer3 on the WWW for general users and for biologist programmers. In: Krawetz S, Misener S編 Bioinformatics Methods and Protocols: Methods in Molecular Biology. Humana Press, Totowa, NJ, pp 365-386)のような任意の商業的に又は他の好適に入手できるプライマー/プローブ設計パッケージを使用して、プライマー及びプローブ配列を設計することができる。
PCRプライマー及びプローブ設計のための更なる指針については、その開示全体が出典明示によりここに明示的に援用される例えばDieffenbach, C.W.等, “General Concepts for PCR Primer Design” in: PCR Primer, A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, 1995, pp. 133-155;Innis 及びGelfand, “Optimization of PCRs” in: PCR Protocols, A Guide to Methods and Applications, CRC Press, London, 1994, pp. 5-11;及びPlasterer, T.N. Primerselect: Primer and probe design. Methods Mol. Biol. 70:520-527 (1997)を参照のこと。
ディファレンシャル遺伝子発現も、マイクロアレイ技術を用いて同定し、又は確かめることができる。よって、IBD関連遺伝子の発現プロファイルを、マイクロアレイ技術を使用して新鮮組織又はパラフィン包埋組織の何れかで測定することができる。この方法では、興味あるポリヌクレオチド配列(cDNA及びオリゴヌクレオチドを含む)をマイクロチップ基板上にプレートし、整列させる。ついで、この整列させた配列を、興味ある細胞又は組織からの特異的DNAプローブでハイブリダイズする。丁度RT-PCR法のように、mRNAのソースは、典型的にはIBDの患者から得られた細胞由来の生検組織又は細胞株、及び対応する正常な組織又は細胞株からの全RNAである。よって、様々な結腸組織又は結腸組織由来細胞株からRNAを単離することができる。
遺伝子発現連続解析(SAGE)は、各転写物に対して個々のハイブリダイゼーションプローブを提供することを要せず、多数の遺伝子転写物の同時の定量解析を可能にせしめる方法である。先ず、タグが各転写物内の独特の位置から得られるとの前提で、転写物をユニークに同定するのに十分な情報を含む短い配列タグ(約10−14bp)が生成される。ついで、多くの転写物を互いに結合させて長い連続の分子を形成し、これを配列決定して、複数タグの同一性を同時に明らかにすることができる。転写物の任意の集団の発現パターンは、個々のタグの存在量を決定し、各タグに対応する遺伝子を同定することによって定量的に評価することができる。更なる詳細については、例えばVelculescu等, Science 270:484-487 (1995);及びVelculescu等, Cell 88:243-51 (1997)を参照のこと。
RNAの単離及び逆転写の後に、Sequenom社(San Diego, CA)によって開発されたMassARRAYベースの遺伝子発現プロファイリング法では、得られたcDNAに、単一の塩基を除く全ての位置で標的cDNA領域に一致し内部標準となる合成DNA分子(競合体)が添加される。cDNA/競合体混合物をPCR増幅し、これにPCR後エビアルカリホスファターゼ(SAP)酵素処理を施し、残りのヌクレオチドの脱リン酸化を生じせしめる。アルカリホスファターゼの不活化後、競合体及びcDNAからのPCR産物にプライマー伸長を施し、これが競合体及びcDNA駆動PCR産物の区別される質量シグナルを生成する。精製後、これらの産物をチップアレイ上に分配し、これを、マトリックス支援レーザー脱離イオン化飛行時間型質量分析(MALDI−TOF MS)での解析に必要なコンポーネントと共に前負荷する。ついで、反応物中に存在するcDNAを、生成された質量スペクトルにおけるピーク面積の比を解析することによって定量する。更なる詳細については、例えばDing及びCantor, Proc. Natl. Acad. Sci. USA 100:3059-3064 (2003)を参照のこと。
Brenner 等, Nature Biotechnology 18:630-634 (2000)によって記載されたこの方法は、非ゲルベースのサイン配列決定を、別個の5mm径のマイクロビーズでの何百万のテンプレートのインビトロクローニングと組み合わせる配列決定アプローチである。先ず、DNAテンプレートのマイクロビーズライブラリーがインビトロクローニングによって構築される。これに、高密度(典型的には3×106マイクロビーズ/cm2より多い)でのフローセル中のテンプレート含有マイクロビーズの平面状アレイのアセンブリが続く。各マイクロビーズ上のクローン化テンプレートの遊離端を、DNA断片分離を必要としない蛍光ベースのサイン配列決定法を使用して、同時に分析する。この方法は、酵母cDNAライブラリーから何十万ものサイン配列を単一の操作で同時にかつ精確に提供することが示されている。
免疫組織化学法はまた本発明のIBDマーカーの発現レベルを検出するのに適している。よって、抗体又は抗血清、好ましくはポリクローナル抗血清、最も好ましくは各マーカーに特異的なモノクローナル抗体が発現の検出に使用される。抗体は、例えば、放射標識、蛍光標識、ハプテン標識、例えばビオチンを用いて抗体自体の直接的標識によって、又は西洋ワサビペルオキシダーゼ又はアルカリホスファターゼのような酵素によって、検出することができる。あるいは、未標識一次抗体が、抗血清、ポリクローナル抗血清又は一次抗体に特異的なモノクローナル抗体を含む、標識二次抗体との関連で使用される。免疫組織化学プロトコル及びキットは当該分野でよく知られており、商業的に入手可能である。
発現レベルはまた例えば様々なタイプのイムノアッセイ又はプロテオミクス技術を使用して、タンパク質レベルで決定することができる。
放射性同位体、例えば、35S、14C、125I、3H及び131I。抗体は、例えばCurrent Protocols in Immunology, 1及び2巻, Coligen等編, (1991) Wiley-Interscience, New York, Pubs.に記載された技術を用いて放射性同位体で標識され、放射能はシンチレーションカウンターを使用して測定できる。
蛍光標識、例えば希土類キレート(ユーロピウムキレート)又はフルオレセインとその誘導体、ローダミンとその誘導体、ダンシル、リサミン(Lissamine)、フィコエリトリン及びテキサスレッドが利用できる。蛍光標識は、例えば上掲のCurrent Protocols in Immunologyに開示された技術を用いて抗体にコンジュゲートさせることができる。蛍光は蛍光光度計によって定量できる。
数多くの他の酵素−基質の組み合わせが当業者には利用可能である。これらの一般的な概説は、米国特許第4275149号及び第4318980号を参照のこと。
イムノアッセイ技術の他の型では、抗体は標識される必要はなく、その存在が、抗体に結合する標識抗体を用いて検出されうる。
よって、ここでの診断イムノアッセイは、例えば競合結合アッセイ、直接及び間接サンドウィッチアッセイ、及び免疫沈降アッセイを含む任意のアッセイ形式でありうる。Zola, Monoclonal Antibodies: A Manual of Techniques, pp. 147-158 (CRC Press, Inc. 1987)。
サンドウィッチアッセイは、それぞれが検出されるタンパク質の異なった免疫原性部分又はエピトープに結合可能である二つの抗体の使用を含む。サンドウィッチアッセイでは、試験試料分析物に、固形担体に固定された第一抗体が結合し、その後、第二抗体が分析物に結合し、よって不溶性の3部分複合体を形成する。例えば米国特許第4376110号を参照のこと。第二抗体自体は検出可能な部分で標識され(直接的サンドウィッチアッセイ)、又は検出可能な部分で標識される抗免疫グロブリン抗体を使用して測定されうる(間接的サンドウィッチアッセイ)。例えば、サンドウィッチアッセイの一つのタイプは、検出可能な部分が酵素であるELISAアッセイである。
「プロテオーム」なる用語は、ある時点での試料(例えば組織、生物、又は細胞培養物)中に存在するタンパク質の全体として定義される。 プロテオミクスは、とりわけ、試料中のタンパク質発現の網羅的変化の研究を含む(「発現プロテオミクス」とも称される)。プロテオミクスは典型的には次の工程を含む: (1) 2-D ゲル電気泳動(2-D PAGE)による試料中の個々のタンパク質の分離; (2) 例えば質量スペクトル又はN末端配列決定によるゲルから回収された個々のタンパク質の同定、及び(3)バイオインフォマティクスを使用するデータ解析。プロテオミクス法は、遺伝子発現プロファイリングの他の方法に対する貴重な補充手段であり、単独で又は他の方法と組み合わせて、本発明のマーカーの産物を検出するために使用することができる。
RT−PCRは第一工程として試験RNA集団の逆転写を必要とする。逆転写のために最も一般的に使用されるプライマーはオリゴ−dTであり、これはRNAがインタクトな場合に良好に機能する。しかしながら、このプライマーは、RNAが高度に断片化されている場合は効果的ではないであろう。
本発明は、58℃と60℃の間に最適なTmを有し大ざっぱに20塩基長である遺伝子特異的プライマーの使用を含む。これらのプライマーはまたPCR DNA増幅を駆動する逆方向プライマーとなる。
代替アプローチ法は、cDNA合成のためのプライマーとしてランダムヘキサマーを使用することに基づいている。しかしながら、我々は、多重の遺伝子特異的プライマーの使用方法がランダムヘキサマーを使用する既知のアプローチ法よりも優れていることを実験的に証明した。
RNA転写物(遺伝子発現解析)又はそのタンパク質翻訳産物の多くの定量方法をここで検討する。遺伝子の発現レベルは、例えば遺伝子プロモーター及び他の調節エレメントのメチル化状態及びヒストンのアセチル化状態のようなクロマチン構造に関する情報から推測することもできる。
特に、プロモーターのメチル化状態はそのプロモーターによって調節される遺伝子の発現レベルに影響を及ぼす。特定の遺伝子プロモーターの異常なメチル化は、例えば腫瘍抑制因子遺伝子のサイレンシングのような発現調節に関係していた。よって、遺伝子のプロモーターのメチル化状態の検査はRNAレベルの直接の定量の代替として利用することができる。
メチル化特異的PCR(Herman J.G.等(1996) Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc. Natl Acad. Sci. USA. 93, 9821-9826.)及び亜硫酸水素DNA配列決定(Frommer M.等(1992) A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands. Proc. Natl Acad. Sci. USA. 89, 1827-1831.)を含む特定のDNAエレメントのメチル化状態を測定するための幾つかのアプローチ法が案出されている。更に最近では、マイクロアレイベースの技術がプロモーターメチル化状態を特徴付けるために使用されている(Chen C.M. (2003) Methylation target array for rapid analysis of CpG island hypermethylation in multiple tissue genomes. Am. J. Pathol. 163, 37-45.)。
本発明の更なる態様は遺伝子発現クラスターの同定である。遺伝子発現クラスターは、ピアソン相関係数に基づく相関の対解析(Pearson K.及びLee A. (1902) Biometrika 2, 357)を含む当該分野で知られている統計解析法を使用する発現データの解析によって同定することができる。
一実施態様では、ここで同定された発現クラスターは、左結腸でアップレギュレートされた遺伝子を含む(図1)。
他の実施態様では、ここで同定された発現クラスターは、右結腸でアップレギュレートされた遺伝子を含む(図1)。
他の一実施態様では、ここで同定された発現クラスターは、回腸末端でアップレギュレートされた遺伝子を含む(図1)。
他の実施態様では、ここで同定された発現クラスターは、IBD2遺伝子座(表7)又はIBD5遺伝子座(表8)に遺伝子を含む。
ある実施態様では、ここで同定された発現クラスターは、免疫応答下で分類された遺伝子を含む。
他の実施態様では、ここで同定された発現クラスターは、創傷への応答下で分類される遺伝子を含む。
本発明の一態様によれば、増幅される遺伝子中に存在するイントロン配列に基づいてPCRプライマー及びプローブが設計される。従って、プライマー/プローブ設計の第一工程は遺伝子内のイントロン配列の 描写である。これは、公に入手可能なソフトウェア、例えばKent, W.J., Genome Res. 12(4):656-64 (2002)によって開発されたDNA BLATソフトウェア、あるいはその変形形を含むBLASTソフトウェアによって行うことができる。PCRプライマー及びプローブ設計の十分に確立された方法が次の工程として続く。
非特異的シグナルを避けるために、プライマーとプローブを設計する場合、イントロン内において反復配列をマスクすることが重要である。これは、反復エレメントのライブラリーに対してDNA配列をスクリーニングし、反復エレメントがマスクされる問い合わせ配列を返すベイラー医科大学からオンラインで入手可能なRepeat Maskerプログラムを使用して容易に達成することができる。ついで、マスクされたイントロン配列を使用し、例えばPrimer Express(Applied Biosystems);MGBアッセイ−バイ−デザイン(Applied Biosystems);プライマー3(Steve Rozen及びHelen J. Skaletsky (2000) Primer3 on the WWW for general users and for biologist programmers. In: Krawetz S, Misener S編 Bioinformatics Methods and Protocols: Methods in Molecular Biology. Humana Press, Totowa, NJ, pp 365-386)のような任意の商業的に又は他の好適に入手できるプライマー/プローブ設計パッケージを使用して、プライマー及びプローブ配列を設計することができる。
PCRプライマー及びプローブ設計のための更なる指針については、その開示全体が出典明示によりここに明示的に援用される例えばDieffenbach, C.W.等, “General Concepts for PCR Primer Design” in: PCR Primer, A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, 1995, pp. 133-155;Innis 及びGelfand, “Optimization of PCRs” in: PCR Protocols, A Guide to Methods and Applications, CRC Press, London, 1994, pp. 5-11;及びPlasterer, T.N. Primerselect: Primer and probe design. Methods Mol. Biol. 70:520-527 (1997)を参照のこと。
本発明の重要な態様は、結腸組織によるある種の遺伝子の測定した発現を使用して、診断情報を提供することである。この目的のために、アッセイされたRNAの量の差と使用されたRNAの質の変動の双方について修正する(標準化する)ことが必要である。従って、該アッセイは、よく知られたハウスキーピング遺伝子、例えばGAPFDH及びCyp1を含むある種の基準化遺伝子の発現を典型的には測定し取り込む。あるいは、基準化はアッセイされた遺伝子の全て又はその大きなサブセットの平均又は中央値シグナル(Ct)に基づくことができる(包括的正規化アプローチ)。遺伝子毎のベースで、患者の結腸組織mRNAの測定された基準化量が、適切な組織参照セットに見出される量と比較される。この参照セット中の組織の数(N)は、異なった参照セットが(全体として)本質的に同じように挙動するようにするためには十分に多くしなければならない。この条件が満たされる場合、特定のセットに存在する個々の結腸組織の同一性はアッセイされる遺伝子の相対量に有意な影響は持たないであろう。通常、組織参照セットは少なくとも約30,好ましくは少なくとも約40の異なったIBD組織検体からなる。別の記載がなされない限り、各mRNA/試験組織/患者の正規化発現レベルは、参照セットにおいて測定された発現レベルの割合として表される。より詳細には、IBD試料の十分に多い数(例えば40)の参照セットが、各mRNA種の正規化レベルの分布を生じる。分析される特定の試料において測定されるレベルはこの範囲内のあるパーセンタイルになり、これは当該分野でよく知られた方法によって決定することができる。以下、別段の記載がない場合は、遺伝子の発現レベルに対する参照は、これは常に明示的に述べるとは限らないが、参照セットに対して正規化された発現を想定する。
本発明は抗IBDマーカー抗体を更に提供する。例示的な抗体には、ポリクローナル、モノクローナル、ヒト化、二重特異性、及びヘテロコンジュゲート抗体が含まれる。ここで検討したように、抗体はIBDの診断方法において、ある場合にはIBDの治療方法において使用されうる。
ポリクローナル抗体は、好ましくは、関連する抗原とアジュバントを複数回皮下(sc)又は腹腔内(ip)注射することにより動物に産生されうる。免疫化される種において免疫原性であるタンパク質、例えばキーホールリンペットヘモシアニン、血清アルブミン、ウシサイログロブリン、又は大豆トリプシンインヒビターに関連抗原を、二官能性又は誘導体形成剤、例えばマレイミドベンゾイルスルホスクシンイミドエステル(システイン残基によるコンジュゲーション)、N−ヒドロキシスクシンイミド(リジン残基による)、グルタルアルデヒド、無水コハク酸、SOCl2、又はRとR1が異なったアルキル基であるR1N=C=NRによりコンジュゲートさせることが有用でありうる。
動物を、例えばタンパク質又はコンジュゲート100μg又は5μg(それぞれウサギ又はマウスの場合)を完全フロイントアジュバント3容量と併せ、この溶液を複数部位に皮内注射することによって、抗原、免疫原性コンジュゲート、又は誘導体に対して免疫化する。1か月後、該動物を、完全フロイントアジュバントに入れた初回量の1/5ないし1/10のペプチド又はコンジュゲートを用いて複数部位に皮下注射することにより、追加免疫する。7ないし14日後に動物を採血し、抗体価について血清を検定する。動物は、力価がプラトーに達するまで追加免疫する。好ましくは、動物は、同じ抗原のコンジュゲートであるが、異なったタンパク質にコンジュゲートさせた、及び/又は異なった架橋剤によってコンジュゲートさせたコンジュゲートで追加免疫する。コンジュゲートはまたタンパク融合として組換え細胞培養中で調製することもできる。また、ミョウバンのような凝集化剤が、免疫反応の増強のために好適に使用される。
ここでのモノクローナル抗体を作製するための様々な方法が当該分野で利用できる。例えば、モノクローナル抗体は、Kohler等, Nature, 256:495 (1975)により最初に記載されたハイブリドーマ法を用いて作製でき、又は組換えDNA法(米国特許第4816567号)によって作製することができる。
ハイブリドーマ法においては、マウス又はその他の適当な宿主動物、例えばハムスターを上記したようにして免疫し、免疫化に用いられるタンパク質と特異的に結合する抗体を生産するか又は生産することのできるリンパ球を導き出す。別法として、リンパ球をインビトロで免疫することもできる。次に、リンパ球を、ポリエチレングリコールのような適当な融剤を用いてミエローマ細胞と融合させ、ハイブリドーマ細胞を形成する(Goding, Monoclonal Antibodies: Principles and Practice,59-103頁(Academic Press, 1986))。
好ましい骨髄腫細胞は、効率的に融合し、選択された抗体産生細胞による抗体の安定な高レベルの生産を支援し、HAT培地のような培地に対して感受性である細胞である。これらの中でも、好ましい骨髄腫株化細胞には、マウス骨髄腫系、例えば、ソーク・インスティテュート・セル・ディストリビューション・センター、San Diego, California USAから入手し得るMOPC-21及びMPC-11マウス腫瘍、及びアメリカン・タイプ・カルチュア・コレクション、Rockville, Maryland USAから入手し得るSP-2又はX63-Ag8-653細胞から誘導されたものが含まれる。ヒト骨髄腫及びマウス−ヒトヘテロ骨髄腫株化細胞もまたヒトモノクローナル抗体の産生のために記載されている(Kozbor, J.Immunol., 133:3001 (1984);及びBrodeur等, Monoclonal Antibody Production Techniques and Applications,51-63頁(Marcel Dekker, Inc., New York, 1987))。
モノクローナル抗体の結合親和性は、例えばMunson等, Anal. Biochem., 107:220 (1980)のスキャッチャード分析法によって測定することができる。
所望の特異性、親和性、及び/又は活性の抗体を産生するハイブリドーマ細胞が確定された後、該クローンを限界希釈法によりサブクローニングし、標準的な方法により増殖させることができる(Goding, Monoclonal Antibodies: Principles and Practice, 59-103頁(Academic Press, 1986))。この目的に対して好適な培地には、例えば、D-MEM又はRPMI-1640培地が包含される。加えて、該ハイブリドーマ細胞は、動物において腹水腫瘍としてインビボで増殖させることができる。
モノクローナル抗体をコードしているDNAは、常法を用いて(例えば、マウスの重鎖及び軽鎖をコードしている遺伝子に特異的に結合できるオリゴヌクレオチドプローブを用いることにより)即座に単離され配列決定される。ハイブリドーマ細胞は、このようなDNAの好ましい供給源となる。ひとたび単離されたならば、DNAを発現ベクター中に入れ、ついでこれを、そうしないと抗体タンパク質を産生しない大腸菌細胞、サルCOS細胞、チャイニーズハムスター卵巣(CHO)細胞、又はミエローマ細胞のような宿主細胞中にトランスフェクトし、組換え宿主細胞中でモノクローナル抗体の合成を達成することができる。抗体をコードするDNAの細菌中での組換え発現に関する概説論文には、Skerra等, Curr. Opinion in Immunol., 5:256-262(1993)及びPlueckthum, Immunol. Revs., 130:151-188(1992)がある。
DNAはまた、例えばヒト重鎖及び軽鎖定常ドメインのコード化配列を、相同的マウス配列に代えて置換することにより(米国特許第4816567号;Morrison等, Proc.Nat.Acad.Sci.,USA,81:6851(1984))、又は免疫グロブリンコード配列に非免疫グロブリンポリペプチドのコード配列の全部又は一部を共有結合させることで修飾できる。
典型的には、このような非免疫グロブリンポリペプチドは、抗体の定常ドメインに置換され、又は抗体の一つの抗原結合部位の可変ドメインに置換されて、抗原に対する特異性を有する1つの抗原結合部位と異なる抗原に対する特異性を有するもう一つの抗原結合部位とを含むキメラ二価抗体を作り出す。
非ヒト抗体をヒト化する方法の例は当該分野で記載されている。好ましくは、ヒト化抗体は非ヒト由来のものに導入した一又は複数のアミノ酸残基を有する。これら非ヒトアミノ酸残基は、しばしば、典型的には「移入」可変ドメインから得られる「移入」残基と呼ばれる(Jones等, Nature, 321:522-525 (1986)、Riechmann等, Nature, 332:323-327 (1988)、Verhoeyen等, Science, 239:1534-1536(1988))。ヒト化は、本質的には、ウィンター及び共同研究者(Jones等, Nature, 321:522-525 (1986)、Riechmann等, Nature, 332:323-327 (1988)、Verhoeyen等, Science, 239:1534-1536 (1988))の方法に従って、高頻度可変領域配列をヒト抗体の対応する配列に置換することにより実施されうる。従って、このような「ヒト化」抗体は、無傷のヒト可変ドメインより実質的に少ない分が非ヒト種由来の対応する配列で置換されたキメラ抗体である(米国特許第4816567号)。実際には、ヒト化抗体は典型的には幾つかの高頻度可変領域残基及び場合によっては幾つかのFR残基が齧歯類抗体の類似部位からの残基によって置換されたヒト抗体である。IBDを治療するために使用されるヒト化抗体の例は、操作されたマウス−ヒトキメラモノクローナル抗体であるインフリキシマブ(レミケード(登録商標))である。抗体はサイトカインTNF−αに結合し、そのレセプターへの結合を防止して炎症反応を惹起し維持する。インフリキシマブはCDとUCの双方を治療するために使用される。
ヒト化抗体の様々な形態が考えられる。例えば、ヒト化抗体は、抗体断片、例えばFab、場合によっては免疫コンジュゲートを作成するために一又は複数の細胞傷害剤とコンジュゲートされたものであってもよい。あるいは、ヒト化抗体又は、親和性成熟抗体は、インタクトな抗体、例えばインタクトなIgG1抗体であってもよい。
ヒト化の代わりにヒト抗体を産生することができる。例えば、内在性の免疫グロブリン産生がない状態で、ヒト抗体の全レパートリーを免疫化することで産生することのできるトランスジェニック動物(例えば、マウス)を作ることが現在では可能である。例えば、キメラ及び生殖系列突然変異体マウスにおける抗体重鎖結合領域(JH)遺伝子の同型接合欠損が内因性抗体産生を完全に阻害することが記載されている。このような生殖系列突然変異体マウスにおけるヒト生殖系列イムノグロブリン遺伝子列の移入は、抗原投与時にヒト抗体の産生をもたらす。例としてJakobovits等, Proc.Natl.Acad.Sci.USA, 90:2551 (1993);Jakobovits等, Nature 362:255-258 (1993);Bruggermann等, Year in Immuno., 7:33 (1993);米国特許第5591669号、第5589369号及び第5545807号を参照。あるいは、ファージディスプレイ技術(McCafferty等, Nature 348:552-553(1990))を、非免疫化ドナーからの免疫グロブリン可変(V)ドメイン遺伝子レパートリーから、インビトロでヒト抗体及び抗体断片を産出させるために使用することができる。この技術によれば、抗体Vドメイン遺伝子は、繊維状バクテリオファージ、例えばM13またはfdの大きい又は小さいコートタンパク質遺伝子の何れかにインフレームでクローニングし、ファージ粒子の表面上に機能的抗体断片としてディスプレイさせる。繊維状粒子がファージゲノムの一本鎖DNAコピーを含むので、抗体の機能特性に基づいた選択により、これらの特性を示す抗体をコードする遺伝子の選択がなされる。よって、ファージはB細胞の特性の幾つかを模倣している。ファージディスプレイは多様な形式で行うことができる;例えばJohnson, Kevin S. 及びChiswell, David J., Current Opinion in Structural Biology 3:564-571(1993)を参照のこと。V-遺伝子セグメントの幾つかの供給源がファージディスプレイのために使用可能である。Clackson等, Nature, 352:624-628(1991)は、免疫化されたマウス脾臓から得られたV遺伝子の小ランダムコンビナトリアルライブラリーからの抗オキサゾロン抗体の異なった配列を単離した。非免疫化ヒトドナーからのV遺伝子のレパートリーを構成可能で、抗原(自己抗原を含む)とは異なる配列の抗体を、Marks等, J. Mol. Biol. 222:581-597(1991)、又はGriffith等, EMBO J. 12:725-734(1993)に記載の技術に従って単離することができる。また、米国特許第5565332号及び同5573905号を参照のこと。
上で検討したように、ヒト抗体はまたインビトロ活性化B細胞により産生されうる(米国特許第5567610号及び同第5229275号を参照)。
一又は複数の抗原結合領域を含む抗体断片を生産するために様々な技術が開発されている。伝統的には、これらの断片は、インタクトな抗体のタンパク分解性消化を介して誘導されていた(例えば、Morimoto等, Journal of Biochemical and Biophysical Methods 24:107-117 (1992)及びBrennan等, Science, 229:81(1985)を参照されたい)。しかし、これらの断片は現在は組換え宿主細胞により直接生産することができる。例えば、抗体断片は上記した抗体ファージライブラリーから単離することができる。あるいは、Fab'-SH断片は大腸菌から直接回収することができ、化学的に結合してF(ab')2断片を形成することができる(Carterら, Bio/Technology 10:163-167(1992))。他のアプローチ法では、F(ab')2断片を組換え宿主細胞培養から直接分離することができる。抗体断片の産生のための他の技術は熟練した実務者に明らかであろう。他の実施態様では、選択抗体は一本鎖Fv断片(scFV)である。国際公開第93/16185号;米国特許第5571894号;及び米国特許第5587458号を参照のこと。また、抗体断片は、例えば米国特許第5641870号に記載されているような直鎖状抗体であってもよい。このような直鎖状抗体断片は単一特異性又は二重特異性であってもよい。
二重特異性抗体は、少なくとも2つの異なるエピトープに対する結合特異性を有する抗体である。例示的二重特異性抗体はIBDマーカータンパク質の2つの異なるエピトープに結合しうる。二重特異性抗体はIBDマーカータンパク質を発現する細胞に薬剤を局在化させるために使用することもできる。
これらの抗体はIBDマーカー結合アームと薬剤(例えば、アミノサリチル酸)に結合するアームを有している。二重特異性抗体は、完全長抗体又は抗体断片(例えばF(ab')2 二重特異性抗体)として調製することができる。
二重特異性抗体を作製する方法は当該分野において知られている。完全長二重特異性抗体の伝統的な産生は二つの免疫グロブリン重鎖-軽鎖対の同時発現に基づき、ここで二つの鎖は異なる特異性を持っている(Millstein等, Nature, 305:537-539(1983))。免疫グロブリン重鎖及び軽鎖が無作為に取り揃えられているため、これらのハイブリドーマ(四部雑種)は10個の異なる抗体分子の可能性ある混合物を産生し、そのうちただ一つが正しい二重特異性構造を有する。通常、アフィニティークロマトグラフィー工程により行われる正しい分子の精製は、かなり煩わしく、生成物収率は低い。同様の方法が国際公開第93/08829号及びTraunecker等, EMBO J. 10:3655-3659(1991)に開示されている。
このアプローチ法の一実施態様では、二重特異性抗体は、第一の結合特異性を有する一方のアームのハイブリッド免疫グロブリン重鎖と他方のアームのハイブリッド免疫グロブリン重鎖-軽鎖対(第二の結合特異性を提供する)とからなる。二重特異性分子の半分にしか免疫グロブリン軽鎖がないと容易な分離法が提供されるため、この非対称的構造は、所望の二重特異性化合物を不要な免疫グロブリン鎖の組み合わせから分離することを容易にすることが分かった。このアプローチ法は、国際公開第94/04690号に開示されている。二重特異性抗体を産生する更なる詳細については、例えばSuresh等, Methods in Enzymology, 121:210 (1986)を参照されたい。
抗体断片から二重特異性抗体を産生する技術もまた文献に記載されている。例えば、化学結合を使用して二重特異性抗体を調製することができる。Brennan等, Science, 229:81 (1985) はインタクトな抗体をタンパク分解性に切断してF(ab')<SUB>2</SUB>断片を産生する手順を記述している。これらの断片は、ジチオール錯体形成剤亜砒酸ナトリウムの存在下で還元して近接ジチオールを安定化させ、分子間ジスルヒド形成を防止する。産生されたFab'断片はついでチオニトロベンゾアート(TNB)誘導体に転換される。Fab'-TNB誘導体の一つをついでメルカプトエチルアミンでの還元によりFab'-チオールに再転換し、他のFab'-TNB誘導体の等モル量と混合して二重特異性抗体を形成する。生産された二重特異性抗体は酵素の選択的固定化のための薬剤として使用することができる。
二価より多い抗体も考えられる。例えば、三重特異性抗体を調製することができる。Tutt等 J.Immunol. 147:60(1991)。
ここに記載された抗体のアミノ酸配列の修飾を考える。例えば、抗体の結合親和性及び/又は生物学的特性を向上することができれば望ましい。抗体のアミノ酸配列変異体は、抗体の核酸に適切なヌクレオチド変化を導入して、又はペプチド合成により調製されうる。そのような修飾は、抗体のアミノ酸配列内の残基の、例えば、欠失型、及び/又は挿入及び/又は置換を含む。最終構成物が所望する特徴を有していれば、欠失、挿入及び置換をどのように組合せてもよい。アミノ酸変化は、またグリコシル化部位の数又は位置を変化させるなど、抗体の翻訳後プロセスを変更してもよい。
突然変異誘発に好ましい位置である抗体のある種の残基又は領域の同定に有益な方法は、Cunningham及びWells Science, 244:1081-1085 (1989)に記載されているように「アラニンスキャニング突然変異誘発」と呼ばれる。ここで、標的残基又は残基の組が同定され(例えば、arg、asp、his、lys、及びgluなどの荷電した残基)、中性の又は負に荷電したアミノ酸(最も好ましくはアラニン又はポリアラニン)で置換され、アミノ酸の抗原との相互作用に影響を与える。ついで、置換に対する機能的感受性を示しているそれらアミノ酸位置を、置換の部位において、又は置換の部位のために、更なる又は他の変異体を導入することにより精製する。このように、アミノ酸配列変異体を導入する部位は予め決定されるが、突然変異自体の性質は予め決定される必要はない。例えば、与えられた部位における突然変異のパーフォーマンスを分析するために、標的コドン又は領域においてalaスキャンニング又はランダム突然変異誘発を実施し、発現した免疫グロブリンを所望の活性についてスクリーニングする。
非保存的置換は、これらの分類の一つのメンバーを他の分類に交換することを必要とするであろう。
ある好ましい型の置換変異体は、親抗体(例えばヒト化又はヒト抗体)の一又は複数の高頻度可変領域残基の置換を含む。一般的に、更なる発展のために選択され、得られた変異体は、それらが作製された親抗体と比較して向上した生物学的特性を有している。そのような置換変異体を作製する簡便な方法は、ファージディスプレイを使用する親和性突然変異である。簡潔に言えば、幾つかの高頻度可変領域部位(例えば6−7部位)を突然変異させて各部位における全ての可能なアミノ酸置換を生成させる。このように生成された多価抗体は、繊維状ファージ粒子から、各粒子内に充填されたM13の遺伝子III産物への融合物としてディスプレイされる。ファージディスプレイ変異体は、ついで、ここに開示されるようなそれらの生物学的活性(例えば、結合親和性)についてスクリーニングされる。修飾のための候補となる高頻度可変領域部位を同定するために、アラニンスキャンニング突然変異誘発を実施し、抗原結合に有意に寄与する高頻度可変領域残基を同定することができる。別法として、又はそれに加えて、抗原-抗体複合体の結晶構造を分析して抗体と抗原の接点を特定するのが有利である場合もある。このような接触残基及び隣接残基は、ここに述べた技術に従う置換の候補である。そのような変異体が生成されると、変異体のパネルにここに記載するようなスクリーニングを施し、一又は複数の関連アッセイにおいて優れた特性を持つ抗体を更なる開発のために選択することができる。
抗体のアミノ酸配列変異体をコードする核酸分子は当該分野で知られている様々な方法により調製される。これらの方法は、天然源からの単離(天然に生じるアミノ酸配列変異体の場合)又はオリゴヌクレオチド媒介性(又は部位特異的)突然変異による調製、PCR突然変異誘発、及び前もって調製された変異体又は抗体の非変異型のカセット変異導入法を含むが、これらに限定されない。
本発明の方法で使用するための材料は、良く知られた手順に従って生産されるキットの調製に適している。よって、本発明は、IBDに対する開示された遺伝子の発現を定量するための遺伝子特異的又は遺伝子選択的プローブ及び/又はプライマーを含みうる薬剤を含むキットを提供する。このようなキットは、場合によっては、試料、特にパラフィン包埋組織試料からRNAを抽出するための試薬、及び/又はRNA増幅のための試薬を含みうる。加えて、キットは、本発明の方法での使用に関する記載又はラベル又は指示書と共に試薬を含んでいてもよい。該キットは、例えば、それぞれ、前もって製造されたマイクロアレイ、バッファー、適切なヌクレオチド三リン酸(例えばdATP、dCTP、dGTP及びdTTP;又はrATP、rCTP、rGTP及びUTP)、逆転写酵素、DNAポリメラーゼ、RNAポリメラーゼ、及び本発明の一又は複数のプローブ及びプライマー(例えばRMAポリメラーゼと反応性のプロモーターに結合した適切な長さのポリ(T)又はランダムプライマー)を含む該方法で利用される(典型的には濃縮形態の)様々な試薬の一又は複数と共に、(方法の自動化された実施に使用するのに適したマイクロタイタープレートを含む)容器を含みうる。
この発明の方法は、商業的な診断目的に対して実施される場合、選択された遺伝子の一又は複数の正規化された発現レベルのレポート又はまとめを一般に作成する。この発明の方法及びレポートは、データベース中にレポートを保存することを更に含みうる。あるいは、該方法は、被検者のためにデータベース中に記録を更に作成し、記録にデータを追加することができる。 一実施態様では、レポートは紙のレポートであり、他の実施態様では、レポートは聴覚性レポートであり、他の実施態様では、レポートは電子的レポートである。レポートは医師及び/又は患者に提供されることが考えられる。レポートの受領は、データ及びレポートを含むサーバーコンピュータにネットワーク接続を樹立し、サーバーコンピュータからデータ及びレポートを要求することを更に含みうる。
本発明によって提供される方法はまた全体を又は部分的に自動化することもできる。
臨床的に、IBDは、しばしば慢性的な予測できない経過を生じる多様な徴候によって特徴付けられる。血性下痢及び腹痛はしばしば熱及び体重減少を伴う。貧血は重度の疲労のように一般的である。関節痛から急性関節炎にわたる関節の症状並びに肝機能の異常が通常IBDに伴う。IBDの患者はまた一般の集団と比較して結腸癌のリスクが高い。IBDの急性の「攻撃」の間、仕事や他の正常な活動は通常不可能であり、患者はしばしば入院させられる。
表1Bに列挙された配列番号は、CD及び/又はUCにおいて有意にダウンレギュレートされ/過小発現したポリヌクレオチド及びそれらのコードされたポリペプチドを表す。
表3Aに列挙された配列番号は、UCにおいて有意にアップレギュレートされ/過剰発現したポリヌクレオチド及びそのコードされたポリペプチドを表す。
表3Bに列挙された配列番号は、UCにおいて有意にダウンレギュレートされ/過小発現したポリヌクレオチド及びそれらのコードされたポリペプチドを表す。
マイクロアレイ解析により、細胞レベルでの遺伝子発現の包括的画像が可能になった。この研究の目的は、潰瘍性大腸炎(UC)を患っている患者及びコントロールの差次的腸遺伝子発現を研究することである。
SAA1、順方向−agcgatgccagagagaata、逆方向−ggaagtgattggggtctttg、Taq−ctttggccatggtgcggagg、[配列番号:235]
IL-8、順方向−actcccagtcttgtcattgc、逆方向−caagtttcaaccagcaagaa、Taq−tgtgttggtagtgctgtgttgaattacgg、[配列番号:236]
DEFA5、順方向−gctacccgtgagtccctct、逆方向−tcttgcactgctttggtttc、Taq−tgtgtgaaatcagtggccgcct、[配列番号:237]
DEFA6、順方向−agagctttgggctcaacaag、逆方向−atgacagtgcaggtcccata、Taq−cacttgccattgcagaaggtcctg, [配列番号:238]
MMP3、順方向−aagggaacttgagcgtgaat、逆方向−gagtgcttccccttctcttg、Taq−ggcattcaaatgggctgctgc、[配列番号:239]
MMP7、順方向−cacttcgatgaggatgaacg、逆方向−gtcccatacccaaagaatgg、Taq−ctggacggatggtagcagtctaggga、[配列番号:240]
S100A8、順方向−ttgaccgagctggagaaag、逆方向−tcaggtcatccctgtagacg、Taq−tccctgataaaggggaatttccatgc [配列番号:241]及び
TLR4、順方向−agagccgctggtgtatcttt、逆方向−ccttctgcaggacaatgaag、Taq−tggcagtttctgagcagtcgtgc [配列番号:242]。
nt55-372のNM_021010(上方-5’catcccttgctgccattct [配列番号:243]及び下位-5’gaccttgaactgaatcttgc [配列番号:244])からスパンニングするDEFA5の318bpフラグメントを増幅するために、PCRプライマーを設計した。プライマーには、増幅生成物から、それぞれセンス又はアンチセンスプローブのインビトロ転写を可能にする27-ヌクレオチドT7又はT3 RNAポリメラーゼ開始部位が含まれる。内視鏡生検を10%の中性緩衝ホルマリンにおいて固定し、パラフィン包埋した。5μm厚の切片を脱パラフィンし、10μg/mlのプロテイナーゼKにおいて、37℃で45分脱タンパクし、先に記載したようにして、インサイツハイブリダイゼーション用に更にプロセシングした。(Jubb 等 Methods Mol Biol. 2006;326:255-264)。33P-UTP標識化されたセンス及びアンチセンスプローブを、55℃で一晩、切片に対してハイブリダイズさせた。ハイブリダイズされていないプローブを、37℃で30分、20μg/mlのRNアーゼAにおいてインキュベートし、続いて0.1×SSCにおいて55℃で2時間、高緊縮洗浄し、グレイデッドエタノールを通して脱水することにより除去した。スライドをNTB核トラックエマルション(Eastman Kodak)に浸漬し、4℃で4週間、乾燥剤を収容した密封のプラスチックスライドボックスにおいて暴露し、ヘマトキシリン及びエオシンで発色及び対比染色した。
ホルマリン固定され、パラフィン包埋された組織切片を、内在性ペルオキシダーゼ活性をクエンチし(KPL, Gathersburg, MD)、アビジン及びビオチンでブロックする(Vector, Burlingame, CA)前に再水和させた。3%のBSAとPBSに10%の正常なヤギ血清が入ったもので、切片を30分ブロックした。ついで組織切片を、室温で60分一次抗体と、30分ビオチン化された二次抗体と共にインキュベートし、ABC試薬(Vector, Burlingame, CA)において30分、続いて金属強化(metal enhanced)DAB(Pierce, Rockford, IL)において5分、インキュベートした。ついで、切片をメイヤーのヘマトキシリンで対比染色した。使用した一次抗体は、5.0μg/mlのウサギ抗ヒトリゾチーム(Dako, Carpinteria, CA)、及び5.0μg/mlのウサギ抗ヒトDEFA6(Alpha Diagnostics, SanAntonio, TX)であった。使用した二次抗体は、7.5μg/mlのビオチン化したヤギ抗ウサギIgG(Vector, Burlingame, CA)であった。DEFA6α染色には、99℃で20分の、標的回収高pH(Target Retrieval High pH)(Dako, Carpenteria,CA)を用いた前処置が必要であり、リゾチーム染色には前処理の必要がなかった。全ての他の工程を室温で実施した。
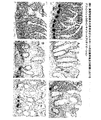
健常な大腸及び回腸末端における遺伝子発現での解剖学的部位の影響。コントロール患者からの56の組織学的に正常な生検を、教師なしの階層的クラスタリングにより分析した。デンドログラムの片側では、25/25の生検が左結腸(下行結腸又はS状結腸)からのものであり、デンドログラムの反対側では、20/31の生検が上行結腸(χ2=25.1、p<0.0001) (図1)からのものであるという、解剖学的部位による明確な分離が観察された。6/6の回腸末端生検を、一緒にクラスター化した。個々の患者からの生検は、一緒にクラスター化しなかった。観察されたクラスター化の原因である、右及び左の結腸との間の差次的発現を促進させる遺伝子は、GI管の発生学的発達に優位に関与しており−HOXA13(FC+4.93、p=2.3×10−16)、HOXB13(FC+16.96、p<1×10−45)、GLI1(FC+2.2、p=4.0×10−24)、及びGLI3(FC+2.3、p=2.1×10−28)は、全て左結腸でアップレギュレートしていた。
教師なしの階層的クラスタリングを使用しても、UC患者及びコントロール患者からの生検の間に差異を見出すことはできなかった。更に、生体の炎症状態に基づくクラスタリングは観察されなかった。観察された唯一のクラスタリングは、回腸末端からの生検であり、ここでUC及びコントロール生検は共にクラスター化していた。全てのUC生検(129)及びコントロール生検(73)を比較し、UC生検において、143の配列では1.5以上の倍率変化があり(0.01>p>10−45)、54の配列では1.5未満の倍率変化があった(0.01>p>10−20)(データを示さず)。
一以上の実験にわたる多くの候補遺伝子の差次的遺伝子発現を表6に示す。表6には、倍率変化及びp値が、4つの異なる実験において、多くの異なる遺伝子で示されていることが表されている。各実験で分析された生検の数を括弧内に示す。一以上の実験をまたがって、発現における有意の一貫した変化が、この表の関心ある遺伝子で観察された。
関心ある多くの遺伝子の発現を、解剖学的部位及びUC試料における炎症度合いを考慮して、更に分析した。DEFA5及びDEFA6を分析すると、正常なコントロール及び非炎症UC生検における発現は、異なる解剖学的部位をまたがって類似しており、回腸末端に高度な発現が存在し、生検位置が結腸の更に遠位となるにつれて発現が低下した(図2)。
急性及び慢性の炎症UC生検においては、上行、下行及びS状結腸にわたって、DEFA5及びDEFA6発現に際だったアップレギュレートがあった(表6)。
非炎症のUS生検と比較した場合、急性及び慢性的に炎症したUC生検においてはMMP3及びMMP7の発現増加が観察された−S状結腸の炎症対非炎症UC試料MMP3(FC+8.15、p=2.3×10−35)及びMMP7(FC+5.53、p=1.0×10−23)(図3)。
図3において、各アレイ試料の発現をAgilentユニバーサル参照に対してプロットする。各内視鏡生検を、患者の状態、生検炎症状態、及び解剖学的部位によって分ける。各解剖学的部位についての平均発現レベルを青で結びつける。非炎症のUC生検と比較した場合、急性及び慢性的に炎症したUC生検においてはMMP3(パネルA)及びMMP7(B)の発現増加が観察された−S状結腸の炎症対非炎症UC試料MMP3(FC+8.15、p=2.3×10−35)及びMMP7(FC+5.53、p=1.0×10−23)。炎症及び非炎症のコントロール試料を分析した場合と比較して、炎症コントロール生検におけるMMP3及びMMP7の発現レベルの低下が観察された(それぞれ、FC−1.62、p=0.012及びFC−2.0、p=0.0002)。
UCを患っている患者の結腸における、過剰のDEFA5&6発現の細胞局在化を更に研究するために、インサイツハイブリダイゼーション及び免疫組織化学的検査を、UCを患っている患者及びコントロール生検のコホートで試みた(図6及び7)。
図6は、パネート細胞位置と一致する基底陰窩における強ハイブリダイゼーションを示すDEFA5に対する、回腸末端生検のインサイツハイブリダイゼーションを示す。上部パネル回腸末端(TI)において、アンチセンスプローブは、パネート細胞位置と一致する基底陰窩における強ハイブリダイゼーションを示す。下部パネル回腸末端(TI)においては、センスコントロールプローブでは、何も有意なハイブリダイゼーションは観察されなかった。パネルAは、非炎症コントロール患者のS状結腸生検を示す。パネルB、C及びDは、パネート細胞異形成と一致して、UCS状結腸生検の基底陰窩領域における、強い多巣性ハイブリダイゼーションを示す。S状結腸からのUC生検においては、これらの生検の基底陰窩領域に多巣性ハイブリダイゼーションが観察され、これはパネート細胞異形成と一致した。このことは、非炎症コントロール生検には観察されなかった。
表3A(上掲)には、正常な患者と比較した場合、IBD患者においてアップレギュレートしたことが見出された、染色体12上のIBD2遺伝子座からの遺伝子を列挙する。
表3B(上掲)には、正常な患者と比較した場合、IBD患者においてダウンレギュレートしたことが見出された、染色体12上のIBD2遺伝子座からの遺伝子を列挙する。
IRF1及びPDLIM4の発現を炎症及び非炎症のUCS状結腸生検、(それぞれ、FC+1.12、p=2.9×10−6及びFC+1.14、p=0.00039)で比較した場合、有意ではないが、発現において一致した折り畳み増加が観察された。
新たに診断された患者において、最もアップレギュレートした3つの遺伝子はSelectin E(FC+10.95、p=1.8×10−6)、CCL19(FC+7.42、p=4.7×10−15)及びIL-8(FC+7.32、p=2.9×10−7)であり、ダウンレギュレートした遺伝子はS100P(FC−6.4、p=2.0×10−9)を含む。
本研究は、正常なコントロールと、UCを患っている患者、並びに他の原因の大腸炎症を患っている患者における、腸の遺伝子発現を比較して報告した最も正確なマイクロアレイ解析を表す。右及び左結腸で興味深い差異を有する健常な結腸における遺伝子発現の解剖学的パターンの重要な情報が、本データにより提供される。更に、UCにおける調節不全の遺伝子発現の特徴についての強力な証拠が提供され、これら全てのデータが、正常な生理学的ホメオスタシスにおける遺伝子発現、及びUCの病理過程に、価値ある見識を提供する。
更に、本研究は、非特異的な急性炎症のサインの強度の潜在的に重要な交絡的影響に対処している。コントロールとUCを患っている患者からの静止状態の生検を比較し、これらの分析から、UCの病原において価値ある病識を得ることができた。また更に、本研究により、新たに診断された疾患を患っている患者の割合へのアクセスが提供され、遺伝子発現における処置に関連した変化が克服された。我々の研究の更なる長所は、リアルタイムPCR分析が、関心ある候補遺伝子の一つではなく全ての発現における有意な変化を常に確認でき、データの解釈に関連して、信頼性がかなり増加しているという事実にある。
これは、健常な成人の結腸に沿った多くの遺伝子の発現における勾配を示す最初のマイクロアレイ研究である。これらの結果は、盲腸、横行結腸、下行結腸及びS状結腸からの生検を比較した場合に、発現パターンに何の有意な差異は観察されなかったコステロ及び共同研究者からのデータ(Costello CM,等PLoS Med 2005;2:e199)とは対照的である。これらのデータセットにおいて観察された差異は、コステロがコントロール及び疾患患者で研究したのに対し、非炎症コントロール試料でのみ見られる我々の分析により説明され得る。
IBD生検中におけるDefA6の発現
デフェンシンα6は、通常、小腸陰窩上皮においてパネート細胞により発現し、結腸上皮細胞では発現しない。我々は、Agilentマイクロアレイを使用し、潰瘍性大腸炎及びクローン病患者において、また生検溶菌液でのtaqmanで、RNAレベルでDefA6の発現が増加することを観察した。この実験は、DefA6タンパク質発現の増加がホルマリン固定された結腸生検において見られるかどうかを評価するものである。
予期したように、我々の実験は、炎症の組織的証拠のない非IBDコントロール患者からの結腸生検において、DefA6の染色がなかったことを示す。また我々は、顕微鏡的大腸炎と診断された非IBDコントロール患者も評価した。その患者において、DefA6はS状結腸陰窩上皮細胞に存在していた。
18人の潰瘍性大腸炎患者では、結腸上皮にDefA6染色の証拠がなかった。これらの患者の多く(10)に、生検組織に炎症の組織学的証拠はなかった。残った患者の6人には、主として好中球炎症(急性炎症)があり、2人には慢性/慢性-活動的炎症があった。
表9は組織学的所見を示す。DefA6の発現は「−」、「+」又は「++」で示し、対応する炎症スコアを幾つかの場合に提供する。
潰瘍性大腸炎(UC)及びクローン病(CD)は、かなりの罹患率を有する高有病率の多遺伝子性慢性炎症性腸疾患(IBD)である。ヘッジホッグ(HH)シグナル伝達経路は、胃腸管発育、ホメオスタシス、及び悪性腫瘍において、生命維持の役割を担っている。我々は、IBDを患っている患者における、GLI1(IBD2結合領域、12q13)での生殖系列変異を同定した。このIBD-関連変異体は、還元型機能を有するGLI1タンパク質をコードするため、還元Gli1活性を有するマウスが化学的に誘発された大腸炎に対して感受性である。遺伝子ワイドのハプロタイプ-タギングアプローチを使用し、生殖系列GLI1変異を、全体で5000人以上の、IBD患者、及び北ヨーロッパ(スコットランド、イングランド及びスウェーデン)の健常なコントロールの3つの独立した集団で試験した。対数尤度分析において、スコットランド及びイングランドでは、GLI1はIBD、主としてUCと関連していた(p<0.0001)。GLI1のエクソン12(Q1100E)における非同義SNP(rs2228226C→G)は、1.194(C.I=1.09−1.31、p=0.0002)のプールされたオッズ比を有し、強く関与していた。GLI1変異体を、ルシフェラーゼアッセイにおける転写活性について、インビトロで試験した。Q1100Eは、GLI1のC末端近傍の保存モチーフ内に入り;変異GLIタンパク質は、インビトロで還元トランス活性化機能を示した。相補的な発現研究において、我々は、GLI1、PTCH及びHHIPを含む、結腸HH反応が、UCを患っている患者においてダウンレギュレートしていることを言及する。最後に、GLI1+/−マウスを、DSS-誘発性大腸炎に対する感受性について試験した。臨床反応、組織検査及び炎症サイトカインの発現を記録した。GLI1+/−マウスでは、野生型と比較して、かなりの罹患率及び死亡率を有する重度の小腸炎を急速に発症した。局所骨髄細胞はHHシグナルの直接標的であることが示され、サイトカイン発現研究により、このモデルにおけるIL-12、IL-17及びIL-23の強いアップレギュレートが明らかとなった。GLI1を介したHHシグナル伝達は、急性炎症誘発に対する腸反応の適切な調製にとって必要である。還元GLI1機能はIBD病変形成の素因になりやすく、新規の治療手段が提案される。
GLI1における遺伝子全体の変異は、IBDと関連しており、スコットランド人の集団では、非同義SNP(rs2228226)に起因していた。
4つのマルチマーカータギングシングルヌクレオチド多形性(tSNPs;r2≧0.8)を同定し(rs3817474、rs2228225、rs2228224、及びrs2228226)、頻度>1%のハプロタイプで検出されるGLI1のハプロタイプ変異を記述した。我々は、474のUC及び335のCD症例、及び1364の十分に適合させた健常なコントロールからなるスコットランド人のIBD集団における、これら4つのtSNPの遺伝子型同定を実施した(表10)。ついで、我々は、GLI1及びIBD感受性の関連性を試験するために、モデル-フリー分析を使用した。スコットランド人の集団において、我々は、IBD(p<0.0001)とUC(p<0.0001)との間の極めて有意な関連性、及び境界有意性(p=0.03)のCDとの関連性を示した。ハプロビューにおける個々の推定ハプロタイプ頻度の分析において、3つの共通したハプロタイプが記述された(データを示さず)。我々は、この影響を、166のCD及び170のUC患者において、フェーズIIハップマップ(HapMap)データから選択される付加的な7つのハプロタイプタギングSNPの遺伝子型を同定することにより、GLI1遺伝子が制限され、隣接ブロックにタグ化されることを確認した。このことは、隣接遺伝子に伸長しないGLI1スパンニングハプロタイプブロックの存在により確認された(INHBE及びARHGAP9)(データを示さず)。
ハプロタイプ検定及び対数尤度分析における関連性は、GLI1のエキソン12における非同義SNP(rs2228226C→G;tSNP4)に大きく起因している。rs2228226は、IBD (対立遺伝子頻度OR=1.23、C.I.1.07−1.40、p=0.0026; ホモ接合体OR=1.56、C.I.1.15−2.11、p=0.0047)、CD(対立遺伝子頻度OR=1.30、C.I.1.08−1.55、p=0.0053、ホモ接合体OR=1.79、C.I.1.21−2.65、p=0.0048)及びUC(対立遺伝子頻度OR=1.19、C.I.1.01−1.39、p=0.04)と関連している(表11及びデータを示さず)。これらのデータでは、ヘテロ接合体患者よりも、ホモ接合体の方が、より大きなオッズ比を有する、対立遺伝子特異性用量反応であることが示唆される。直接配列化することによるGLI1コード領域の変異スクリーニングでは、新規のSNPの同定に失敗した。dbSNP及びIBDからの7つの付加的なGLI1変異の間に関連性はなかった(データを示さず)。
GLI1+/−動物では、IL-23p19及び炎症誘発性サイトカインの発現が増加している。
ここに提示されるデータは、無傷のHHシグナル伝達が、炎症性攻撃に応じて、哺乳動物の腸において重要であり、GLI1の機能低下が、IBD病変形成に関与しているという、第1の証拠を提供する。我々は、HHシグナル伝達経路が、ヒトの大腸炎症でダウンレギュレートしていることを確認した。また我々は、UC/IBDに高度に関連した、特異的GLI1変異体を同定し、変異体タンパク質は、インビトロにおいて、転写アクチベーターとして機能的に不十分であることが示されている。最後に、我々は、マウスGli1における50%低減により、IL-23経路の有意なアップレギュレートと、DSSに対する腸の炎症反応が高まることを示した。これらの発見のみが治療介入に対して可能性のあるIBD病変形成の理解に、明確に関与しているものではなく、それらは、腸炎症のけるGLI1とHHシグナル伝達についての機能的役割の第1の明確な記載である。我々が検出したGLI1遺伝子における遺伝的変異は、オッズ比1.19を有し、5000人以上の個人のメタアナリシスにより確認されたrs2228226についての発見と共に、スコットランド及びイングランドの双方において、IBD及びUCと関連している。CDにおける影響についての証拠が近年の研究で示されているが、優位な影響は、明らかにUCに関連している。この関連性における指針は、CD、結腸直腸癌Tenesa等(2008) Nat Genet 40: 631-637]、及びセリアック病[Hunt等(2008) Nat Genet 40: 395-402]を含む、複雑な病気の遺伝学の近年の多くの研究に記述されたエフェクトサイズと完全に一致している。獲得した有意性レベルは、遺伝子-中心体研究についての、p<10−4-10−6という提案された基準を満たしている[Burton等(2007) Nat Genet 39: 1329-1337; Thomas等(2004) J Natl Cancer Inst 96: 421-423]。研究された3つの北ヨーロッパ人の集団では、以前から、他のIBD感受性 遺伝子 / NOD2及びIBD5を含む遺伝子座[Gaya等(2006) Lancet 367: 1271-1284]の類似した寄与が示されている。このSNPに対する少ない対立遺伝子頻度は、スコットランド及びスウェーデンでは非常に類似している(30.3%と30.6%)が、スコットランドとケンブリッジ(30.3%と26.4%)との間では3.9%異なっている。この差異は維持されており、近年のWTCCC研究[Wellcome Trust Case Control Consortium (2007) Nature 447: 661-678]における、集団階層化ついて分析された多くのSNPについて言及されている。我々の再配列化の取り組みにより、IBDに関連した唯一のコード化変異体として、rs2228226が同定されたが、ハプロタイプ分析及び対数尤度分析では、他の生殖系列変異体がIBDの危険性に寄与しているかもしれないという可能性が上昇した。これらは、形式的に−特にイントロン変異体、長期にわたるプロモーター効果及び/又はコピー数の変動の役割を研究するのに必要である。ここで、NOD2[Hugot等(2001). Nature 411: 599-603; Ogura Y等(2001). Nature 411: 603-606]を含む幾つかの複雑な疾患の遺伝子は、病気の危険性を付与する多数の独立した変異を有し、幾つかの疾患はコード化配列内に原因となる変異を有さず(例えば、 IRGM in CD [Parkes等 Am J Hum Genet. 2000;67:1605-16105])、同義SNPは機能的影響に関連している[Kimchi-Sarfaty等(2007) Science 315: 525-528]。rs2228226C→Gは、グルタミンからグルタミン酸(Q1100E)への変化をコードする。我々のインビトロデータには、適切に合成及び局在化しても、GLI1 1100EがWT GLI1と比較して副次的転写アクチベーターであることが示されている。Q1100E変異により、GLI1の公知のトランス活性化領域に直接隣接する保存領域において、かなりの荷電変化が引き起こされ;この変化がトランス活性化活性を直接修飾し、トランス活性化ドメインの構造を破壊し、又はタンパク質の安定化に影響を及ぼし[Huntzicker等(2006) 遺伝子s Dev 20: 276-281]、活性を低下させる可能性がある。また、我々のデータから、GLI1の活性又は量が低減すると、強力な表現型が生成されることが示唆される。Gli1のWTレベルの50%のみを有しているGLI1+/−動物は、中程度の刺激に反応して、素早く重度の炎症を発症する。Gli1の機能低下についての表現型の記述[Park等(2000) Development 127: 1593-1605]である、我々の知識に対するこれらのデータは、Hh反応の全補体が、炎症疾患からの保護において、鍵となる役割を担っていることを示している。更に我々のインビトロデータには、GLI1 E1100が幾つかのGli反応を活性化可能であることが示されており、ホメオスタシス条件下で、GLI1 E1100が適切に機能可能であることが示唆される。しかしながら、GLI1+/−動物における状況と類似して、炎症性ストレスの条件下では、GLI1 E1100は、WT GLI1の50%しか機能できない。これらの系における炎症に対する傾向により、炎症細胞内のHHシグナル伝達が直接低下するか、又はストローマ標的細胞におけるHHシグナルの低下による影響を表すかどうかにかかわらず、上皮層の完全性に影響を与えるシグナルが放出されることは、未だ明らかではない。この問題への取り組みは、未来の研究の鍵となる手段となるであろう。我々は、HH経路が骨髄標的細胞へのシグナル伝達を介して、自然免疫反応を直接修飾し得ることを示した。この発見は、脾臓における骨髄細胞変異におけるHhシグナル伝達にとっての重要な役割を示す近年のデータと一致している[Varas等, (2008) J Leukoc Biol Jun;83(6):1476-83. Epub 2008 Mar 1123]。興味あることに、骨髄細胞集団は、IL-23/IL-17経路におけるかなりの衝撃を介して、腸の炎症環境を差次的に修飾することができる[Denning等(2007) Nat Immunol 8: 1086-1094]。共に、GLI1+/−動物におけるDSS処理後のIL-23の増加及び自然免疫集団による、HHの直接的反応を示す我々の発見は、粘膜骨髄細胞における免疫寛容誘発性表現型を、通常は促進させることが示唆され;HHシグナル伝達の低下が、これらの細胞における、炎症反応を代わりに誘発させ得る。
ヒト内視鏡結腸生検からのゲノムワイド発現プロファイルを開始し、IBDにおける細胞レベルでの病原性炎症経路の精査を補助した(Noble CL等. Gut, 2008 Jun 3. [Epub ahead of print])。全血のゲノムワイド発現プロファイルは、従来からの内視鏡技術を補完するもので、IBD-クローン病(CD)及び潰瘍性大腸炎(UC)の診断を補助する。この研究の目的は、IBD-CD、UC及びコントロール(HC)を患っている患者を識別するために、全血の遺伝子発現プロファイルを研究することである。
Claims (45)
- 哺乳動物被検者における炎症性腸疾患(IBD)の存在を診断する方法であって、上記被検者から得られた試験試料における配列番号:2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、110、112、114、116、118、120、122、124、126、128、130、132、134、136、138、140、142、144、146、148、150、152、154、156、158、160、162、164、166、168、170、172、194、197、199、201、203、205、207、及び230の何れか一に示されたポリペプチドをコードする核酸の発現レベルがコントロールの発現レベルに対して高いことを決定し、上記高い発現レベルが、試験試料が得られた被検者におけるIBDの存在を示す方法。
- 哺乳動物被検者における炎症性腸疾患(IBD)の存在を診断する方法であって、上記被検者から得られた試験試料における配列番号:108、174、176、178、180、182、184、186、188、190、192、211、213、215、217、219、221、223、225、及び228のの何れか一に示されたポリペプチドをコードする核酸の発現レベルがコントロールの発現レベルに対して低いことを決定し、上記低い発現レベルが、試験試料が得られた被検者におけるIBDの存在を示す方法。
- 上記哺乳動物被検者がヒト患者である請求項1又は2に記載の方法。
- 上記発現レベルのエビデンスが遺伝子発現プロファイリング法によって得られる請求項3に記載の方法。
- 上記方法がPCRベースの方法である請求項3に記載の方法。
- 上記発現レベルが一又は複数の参照遺伝子又はその発現産物の発現レベルに対して正規化される請求項4に記載の方法。
- 上記遺伝子又はその発現産物の少なくとも二の発現レベルのエビデンスを決定することを含む請求項1又は2に記載の方法。
- 上記遺伝子又はその発現産物の少なくとも三の発現レベルのエビデンスを決定することを含む請求項1又は2に記載の方法。
- 上記遺伝子又はその発現産物の少なくとも四の発現レベルのエビデンスを決定することを含む請求項1又は2に記載の方法。
- 上記遺伝子又はその発現産物の少なくとも五の発現レベルのエビデンスを決定することを含む請求項1又は2に記載の方法。
- 上記IBD検出をまとめるレポートを作成する工程を更に含む請求項1又は2に記載の方法。
- 上記IBDが潰瘍性大腸炎である請求項1又は2に記載の方法。
- 上記IBDがクローン病である請求項1又は2に記載の方法。
- 上記IBDが潰瘍性大腸炎及びクローン病である請求項1又は2に記載の方法。
- 上記試験試料が結腸組織生検由来である請求項1又は2に記載の方法。
- 上記生検が、 回腸末端、上行結腸、下行結腸、及びS状結腸からなる群から選択される組織由来である請求項15に記載の方法。
- 上記生検が炎症結腸領域由来である請求項15に記載の方法。
- 上記生検が非炎症結腸領域由来である請求項15に記載の方法。
- 上記決定工程が、上記哺乳動物被検者におけるIBDの再発を示し、上記哺乳動物被検者が過去にIBDと診断され、該過去に診断されたIBDに対して治療されている請求項1又は2に記載の方法。
- 上記治療が手術からなる請求項19に記載の方法。
- 上記決定工程が、上記哺乳動物被検者における上記IBDの突然の再発を示す請求項1又は2に記載の方法。
- 治療を必要とする哺乳動物被検者における炎症性腸疾患(IBD)を治療する方法であって、
(a)上記被検者から得られた試験試料における配列番号:2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、110、112、114、116、118、120、122、124、126、128、130、132、134、136、138、140、142、144、146、148、150、152、154、156、158、160、162、164、166、168、170、172、194、197、199、201、203、205、207、及び230の何れか一に示されたポリペプチドをコードする核酸の発現レベルがコントロールの発現レベルに対して高いことを決定する工程であって、上記高い発現レベルが、試験試料が得られた被検者におけるIBDの存在を示す工程と;
(b)有効量のIBD治療剤を上記被検者に投与する工程
を含む方法。 - 治療を必要とする哺乳動物被検者における炎症性腸疾患(IBD)を治療する方法であって、
(a)上記被検者から得られた試験試料における配列番号:108、174、176、178、180、182、184、186、188、190、192、211、213、215、217、219、221、223、225、及び228のの何れか一に示されたポリペプチドをコードする核酸の発現レベルがコントロールの発現レベルに対して低いことを決定する工程であって、上記低い発現レベルが、試験試料が得られた被検者におけるIBDの存在を示す工程と;
(b)有効量のIBD治療剤を上記被検者に投与する工程
を含む方法。 - 上記哺乳動物被検者がヒト患者である請求項22又は23に記載の方法。
- 上記発現レベルのエビデンスが遺伝子発現プロファイリング法によって得られる請求項24に記載の方法。
- 上記方法がPCRベースの方法である請求項24に記載の方法。
- 上記発現レベルが一又は複数の参照遺伝子又はその発現産物の発現レベルに対して正規化される請求項25に記載の方法。
- 上記遺伝子又はその発現産物の少なくとも二の発現レベルのエビデンスを決定することを含む請求項22又は23に記載の方法。
- 上記遺伝子又はその発現産物の少なくとも三の発現レベルのエビデンスを決定することを含む請求項22又は23に記載の方法。
- 上記遺伝子又はその発現産物の少なくとも四の発現レベルのエビデンスを決定することを含む請求項22又は23に記載の方法。
- 上記遺伝子又はその発現産物の少なくとも五の発現レベルのエビデンスを決定することを含む請求項22又は23に記載の方法。
- 上記IBD検出をまとめるレポートを作成する工程を更に含む請求項22又は23に記載の方法。
- 上記IBDが潰瘍性大腸炎である請求項22又は23に記載の方法。
- 上記IBDがクローン病である請求項22又は23に記載の方法。
- 上記IBDが潰瘍性大腸炎及びクローン病である請求項22又は23に記載の方法。
- 上記試験試料が結腸組織生検由来である請求項22又は23に記載の方法。
- 上記生検が、 回腸末端、上行結腸、下行結腸、及びS状結腸からなる群から選択される組織由来である請求項36に記載の方法。
- 上記生検が炎症結腸領域由来である請求項36に記載の方法。
- 上記生検が非炎症結腸領域由来である請求項36に記載の方法。
- 上記決定工程が、上記哺乳動物被検者におけるIBDの再発を示し、上記哺乳動物被検者が過去にIBDと診断され、該過去に診断されたIBDに対して治療されている請求項22又は23に記載の方法。
- 上記治療が手術からなる請求項40に記載の方法。
- 上記決定工程が、上記哺乳動物被検者における上記IBDの突然の再発を示す請求項22又は23に記載の方法。
- 上記IBD治療剤がアミノサリチル酸である請求項22又は23に記載の方法。
- 上記IBD治療剤がコルチコステロイドである請求項22又は23に記載の方法。
- 上記IBD 治療剤が免疫抑制剤である請求項22又は23に記載の方法。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US99120307P | 2007-11-29 | 2007-11-29 | |
| PCT/US2008/064562 WO2008147900A2 (en) | 2007-05-22 | 2008-05-22 | Gene expression markers for inflammatory bowel disease |
| US19226808P | 2008-09-17 | 2008-09-17 | |
| PCT/US2008/085045 WO2009073565A2 (en) | 2007-11-29 | 2008-11-26 | Gene expression markers for inflammatory bowel disease |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2011509071A true JP2011509071A (ja) | 2011-03-24 |
| JP2011509071A5 JP2011509071A5 (ja) | 2013-01-17 |
Family
ID=40459795
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010536200A Pending JP2011509071A (ja) | 2007-11-29 | 2008-11-26 | 炎症性腸疾患のための遺伝子発現マーカー |
Country Status (9)
| Country | Link |
|---|---|
| EP (1) | EP2261367A3 (ja) |
| JP (1) | JP2011509071A (ja) |
| KR (1) | KR20110015409A (ja) |
| CN (1) | CN101970689A (ja) |
| AU (1) | AU2008334095A1 (ja) |
| CA (1) | CA2706729A1 (ja) |
| IL (2) | IL206014A (ja) |
| MX (1) | MX2010005893A (ja) |
| WO (1) | WO2009073565A2 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016217956A (ja) * | 2015-05-25 | 2016-12-22 | ヤマサ醤油株式会社 | 炎症性腸疾患のバイオマーカーとしてのs100a9の使用 |
| JP2019527039A (ja) * | 2016-07-05 | 2019-09-26 | ケンブリッジ エンタープライズ リミテッド | 炎症性腸疾患用のバイオマーカー |
| JP7382489B2 (ja) | 2019-08-23 | 2023-11-16 | インシリコ メディシン アイピー リミテッド | 特定の生物学的標的に対して生物学的活性を有する化合物を生成するためのワークフロー |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2456890A1 (en) * | 2009-07-20 | 2012-05-30 | Genentech, Inc. | Gene expression markers for crohn's disease |
| WO2011042030A1 (en) * | 2009-10-06 | 2011-04-14 | Tallinn University Of Technology | Inhibition or activation of serine/threonine ulk3 kinase activity |
| WO2011127351A1 (en) * | 2010-04-09 | 2011-10-13 | Exagen Diagnostics, Inc. | Biomarkers for ulcerative colitis and crohn's disease |
| CA2801575A1 (en) * | 2010-06-04 | 2011-12-08 | Prometheus Laboratories Inc. | Methods for improving inflammatory bowel disease diagnosis |
| KR101394197B1 (ko) * | 2012-08-17 | 2014-05-30 | 관동대학교산학협력단 | 염증성 장 질환과 연관된 단일염기다형성 정보를 제공하는 방법 |
| US20160039877A1 (en) | 2013-03-15 | 2016-02-11 | Shenzhen Hightide Biopharmaceutical, Ltd. | Compositions and methods of using islet neogenesis peptides and analogs thereof |
| CN103336914B (zh) * | 2013-05-31 | 2016-05-25 | 中国人民解放军国防科学技术大学 | 一种提取荟萃生物标志物的方法及装置 |
| EP3736340A1 (en) * | 2014-08-28 | 2020-11-11 | The Provost, Fellows, Foundation Scholars, and The Other Members of Board, of The College of The Holy and Undivided Trinity of Queen Elizabeth | Methods and kit for identification of cancer |
| KR20180127416A (ko) * | 2016-03-17 | 2018-11-28 | 세다르스-신나이 메디칼 센터 | Rnaset2를 통한 염증성 장 질환의 진단 방법 |
| EP3602041A4 (en) * | 2017-03-23 | 2021-01-13 | Meharry Medical College | METHODS FOR DIAGNOSING AND TREATING INFLAMMATORY INTESTINE DISEASE |
| WO2018237064A1 (en) * | 2017-06-20 | 2018-12-27 | Meharry Medical College | TARGETED ANTI-DEFA5 ANTIBODIES AND ASSAYING METHODS FOR DIAGNOSING AND TREATING INFLAMMATORY BOWEL DISEASE |
| AU2019240773B2 (en) * | 2018-03-29 | 2024-05-16 | Lateral IP Pty Ltd | Cyclic peptides and uses thereof |
| CN110577953B (zh) * | 2018-06-11 | 2024-02-20 | 深圳华大生命科学研究院 | 基因突变体及其应用 |
| CN108893488A (zh) * | 2018-06-19 | 2018-11-27 | 刘志强 | 一种重组质粒、dna疫苗及其制备方法和应用 |
| WO2020000436A1 (zh) * | 2018-06-29 | 2020-01-02 | 深圳市博奥康生物科技有限公司 | 一种特异靶向人INDO基因的gRNA导向序列及其应用 |
| US20210262032A1 (en) * | 2018-07-15 | 2021-08-26 | Rambam Med-Tech Ltd. | Determining responders to inflammation treatment |
| CN110241116B (zh) * | 2019-05-21 | 2023-02-07 | 中国医学科学院放射医学研究所 | 一种环状rna及在促进dna损伤修复中的应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH10327878A (ja) * | 1997-03-14 | 1998-12-15 | Smithkline Beecham Corp | 腫瘍壊死因子関連のレセプター、tr6 |
| JP2003512020A (ja) * | 1999-03-04 | 2003-04-02 | ヒューマン ジノーム サイエンシーズ, インコーポレイテッド | 腫瘍壊死因子レセプター6αおよび腫瘍壊死因子レセプター6β |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2413974A1 (fr) | 1978-01-06 | 1979-08-03 | David Bernard | Sechoir pour feuilles imprimees par serigraphie |
| US4275149A (en) | 1978-11-24 | 1981-06-23 | Syva Company | Macromolecular environment control in specific receptor assays |
| US4318980A (en) | 1978-04-10 | 1982-03-09 | Miles Laboratories, Inc. | Heterogenous specific binding assay employing a cycling reactant as label |
| US4376110A (en) | 1980-08-04 | 1983-03-08 | Hybritech, Incorporated | Immunometric assays using monoclonal antibodies |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4737456A (en) | 1985-05-09 | 1988-04-12 | Syntex (U.S.A.) Inc. | Reducing interference in ligand-receptor binding assays |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| US5567610A (en) | 1986-09-04 | 1996-10-22 | Bioinvent International Ab | Method of producing human monoclonal antibodies and kit therefor |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5175384A (en) | 1988-12-05 | 1992-12-29 | Genpharm International | Transgenic mice depleted in mature t-cells and methods for making transgenic mice |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| CA2062795A1 (en) | 1989-06-29 | 1990-12-30 | Michael W. Fanger | Bispecific reagents for aids therapy |
| US5229275A (en) | 1990-04-26 | 1993-07-20 | Akzo N.V. | In-vitro method for producing antigen-specific human monoclonal antibodies |
| US5571894A (en) | 1991-02-05 | 1996-11-05 | Ciba-Geigy Corporation | Recombinant antibodies specific for a growth factor receptor |
| JPH06507398A (ja) | 1991-05-14 | 1994-08-25 | リプリジェン コーポレーション | Hiv感染治療のための異種複合抗体 |
| DK0527283T3 (da) | 1991-08-12 | 1998-08-10 | Nestle Sa | Levnedsmiddelsammensætning |
| US5565332A (en) | 1991-09-23 | 1996-10-15 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| US5587458A (en) | 1991-10-07 | 1996-12-24 | Aronex Pharmaceuticals, Inc. | Anti-erbB-2 antibodies, combinations thereof, and therapeutic and diagnostic uses thereof |
| WO1993008829A1 (en) | 1991-11-04 | 1993-05-13 | The Regents Of The University Of California | Compositions that mediate killing of hiv-infected cells |
| WO1993011161A1 (en) | 1991-11-25 | 1993-06-10 | Enzon, Inc. | Multivalent antigen-binding proteins |
| EP0625200B1 (en) | 1992-02-06 | 2005-05-11 | Chiron Corporation | Biosynthetic binding protein for cancer marker |
| JP3571337B2 (ja) | 1992-02-11 | 2004-09-29 | セル ジェネシス,インコーポレーテッド | 遺伝子標的現象による同型遺伝子接合 |
| US5573905A (en) | 1992-03-30 | 1996-11-12 | The Scripps Research Institute | Encoded combinatorial chemical libraries |
| EP0656064B1 (en) | 1992-08-17 | 1997-03-05 | Genentech, Inc. | Bispecific immunoadhesins |
| US6283761B1 (en) | 1992-09-08 | 2001-09-04 | Raymond Anthony Joao | Apparatus and method for processing and/or for providing healthcare information and/or healthcare-related information |
| US20030198640A1 (en) * | 1994-11-07 | 2003-10-23 | Human Genome Sciences, Inc. | Methods and compositions for treating inflammatory bowel diseases relating to human tumor necrosis factor-gamma-beta |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US5641870A (en) | 1995-04-20 | 1997-06-24 | Genentech, Inc. | Low pH hydrophobic interaction chromatography for antibody purification |
| CA2223198A1 (en) | 1997-01-14 | 1998-07-14 | Societe Des Produits Nestle S.A. | Composition and method for treatment of inflammatory conditions of the gastro-intestinal tract |
| EP1287162A2 (en) * | 1999-10-21 | 2003-03-05 | Case Western Reserve University | Gene expression profiling of inflammatory bowel disease |
| SI2857516T1 (sl) | 2000-04-11 | 2017-09-29 | Genentech, Inc. | Multivalentna protitelesa in njihove uporabe |
| GB0130955D0 (en) | 2001-12-24 | 2002-02-13 | Cancer Res Ventures | Expression system |
| WO2003064621A2 (en) | 2002-02-01 | 2003-08-07 | Ambion, Inc. | HIGH POTENCY siRNAS FOR REDUCING THE EXPRESSION OF TARGET GENES |
| US7526387B2 (en) | 2003-07-10 | 2009-04-28 | Genomic Health, Inc. | Expression profile algorithm and test for cancer prognosis |
| EP1844158A4 (en) * | 2004-12-06 | 2010-09-08 | Univ Johns Hopkins | BIOMARKERS FOR INFLAMMATORY INTESTINAL DISEASE |
| WO2007081486A2 (en) * | 2005-12-15 | 2007-07-19 | Ventria Bioscience | Oral administration of defensins to treat intestinal diseases |
| WO2009105590A2 (en) * | 2008-02-19 | 2009-08-27 | The Children's Hospital Of Philadelphia | Identification of pediatric onset inflammatory bowel disease loci and methods of use thereof for the diagnosis and treatment of the same |
-
2008
- 2008-11-26 AU AU2008334095A patent/AU2008334095A1/en not_active Abandoned
- 2008-11-26 CN CN2008801258460A patent/CN101970689A/zh active Pending
- 2008-11-26 JP JP2010536200A patent/JP2011509071A/ja active Pending
- 2008-11-26 EP EP10008262A patent/EP2261367A3/en not_active Withdrawn
- 2008-11-26 MX MX2010005893A patent/MX2010005893A/es not_active Application Discontinuation
- 2008-11-26 CA CA2706729A patent/CA2706729A1/en not_active Abandoned
- 2008-11-26 KR KR1020107014096A patent/KR20110015409A/ko not_active Application Discontinuation
- 2008-11-26 WO PCT/US2008/085045 patent/WO2009073565A2/en active Application Filing
-
2010
- 2010-05-27 IL IL206014A patent/IL206014A/en not_active IP Right Cessation
-
2014
- 2014-06-29 IL IL233432A patent/IL233432A0/en unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH10327878A (ja) * | 1997-03-14 | 1998-12-15 | Smithkline Beecham Corp | 腫瘍壊死因子関連のレセプター、tr6 |
| JP2003512020A (ja) * | 1999-03-04 | 2003-04-02 | ヒューマン ジノーム サイエンシーズ, インコーポレイテッド | 腫瘍壊死因子レセプター6αおよび腫瘍壊死因子レセプター6β |
Non-Patent Citations (2)
| Title |
|---|
| JPN5011008938; ROBERT BERKOW: 'MERCK MANUAL OF DIAGNOSIS AND THERAPY,CHRONIC INFLAMMATORY DISEASES OF THE BOWEL' MERCK MANUAL OF DIAGNOSIS AND THERAPY , 19920101, P830-834, MERCK RESEARCH LABORATORIES * |
| JPN6013037727; Fayad R. et al: 'Apoptosis resistance in ulcerative colitis: High expression of decoy receptors by lamina propria T c' European Journal of Immunology vol.36, no.8, 200608, pages 2215-2222 * |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016217956A (ja) * | 2015-05-25 | 2016-12-22 | ヤマサ醤油株式会社 | 炎症性腸疾患のバイオマーカーとしてのs100a9の使用 |
| JP2019527039A (ja) * | 2016-07-05 | 2019-09-26 | ケンブリッジ エンタープライズ リミテッド | 炎症性腸疾患用のバイオマーカー |
| JP2020198884A (ja) * | 2016-07-05 | 2020-12-17 | ケンブリッジ エンタープライズ リミテッド | 炎症性腸疾患用のバイオマーカー |
| JP7111630B2 (ja) | 2016-07-05 | 2022-08-02 | ケンブリッジ エンタープライズ リミテッド | 炎症性腸疾患用のバイオマーカー |
| JP7382489B2 (ja) | 2019-08-23 | 2023-11-16 | インシリコ メディシン アイピー リミテッド | 特定の生物学的標的に対して生物学的活性を有する化合物を生成するためのワークフロー |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2706729A1 (en) | 2009-06-11 |
| EP2261367A2 (en) | 2010-12-15 |
| IL233432A0 (en) | 2014-08-31 |
| CN101970689A (zh) | 2011-02-09 |
| WO2009073565A2 (en) | 2009-06-11 |
| AU2008334095A2 (en) | 2010-07-15 |
| KR20110015409A (ko) | 2011-02-15 |
| IL206014A (en) | 2014-07-31 |
| EP2261367A3 (en) | 2011-03-23 |
| WO2009073565A3 (en) | 2009-09-24 |
| IL206014A0 (en) | 2010-11-30 |
| MX2010005893A (es) | 2011-03-04 |
| AU2008334095A1 (en) | 2009-06-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2011509071A (ja) | 炎症性腸疾患のための遺伝子発現マーカー | |
| US20110033486A1 (en) | Gene expression markers for crohn's disease | |
| US20090186034A1 (en) | Gene expression markers for inflammatory bowel disease | |
| US20140179620A1 (en) | Gene expression markers for inflammatory bowel disease | |
| CA2726691C (en) | Use of oncogene nrf2 for cancer prognosis | |
| WO2014074942A1 (en) | Risk variants of alzheimer's disease | |
| US20140037618A1 (en) | Method of treating autoimmune inflammatory disorders using il-23r loss-of-function mutants | |
| JP2008539728A (ja) | 膀胱癌バイオマーカーおよびその使用 | |
| BR112016020987B1 (pt) | Método de identificação de receptores de aloenxerto renal e método de seleção de receptor do aloenxerto renal | |
| JP2015519311A (ja) | Il−17アンタゴニストを用いて強直性脊椎炎を治療する方法 | |
| US20230058214A1 (en) | Identification of Unique Blood-Based Gene Expression Profiles in Children with Regressive Autism Spectrum Disorder (ASD) and Ileocolitis | |
| US20090155788A1 (en) | Gene expression markers for inflammatory bowel disease | |
| US20220290246A1 (en) | Single nucleotide polymorphisms and uses thereof | |
| US20100167285A1 (en) | Methods and agents for evaluating inflammatory bowel disease, and targets for treatment | |
| WO2008079406A2 (en) | Gene expression markers for inflammatory bowel disease | |
| US20210278417A1 (en) | Targeted hd5 antibody and assay methods for diagnosing and treating inflammatory bowel disease | |
| US20180073075A1 (en) | Risk Factors of Cigarette Smoke-Induced Spriometric Phenotypes | |
| KR20180125911A (ko) | 차세대서열분석 스크리닝을 통해 발굴한 단일염기다형성에 의한 염증성 장질환의 예측 또는 진단에 관한 정보 제공 방법 | |
| Veenin et al. | Association of mitochondrial DNA polymorphisms with pediatric-onset cyclic vomiting syndrome | |
| CN116761896A (zh) | 在诊断时确定难以治疗的骨肉瘤患者并通过提供新疗法改善其结果的方法 | |
| KR20180125778A (ko) | 차세대서열분석 스크리닝을 통해 발굴한 단일염기다형성에 의한 염증성 장질환의 예측 또는 진단에 관한 정보 제공 방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111121 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111121 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121114 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130806 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140610 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150303 |