JP2010532656A - 癌退縮抗原ny−eso−1およびlage−1を含む融合タンパク質 - Google Patents
癌退縮抗原ny−eso−1およびlage−1を含む融合タンパク質 Download PDFInfo
- Publication number
- JP2010532656A JP2010532656A JP2009545705A JP2009545705A JP2010532656A JP 2010532656 A JP2010532656 A JP 2010532656A JP 2009545705 A JP2009545705 A JP 2009545705A JP 2009545705 A JP2009545705 A JP 2009545705A JP 2010532656 A JP2010532656 A JP 2010532656A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- lage
- fusion protein
- eso
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 101000889345 Homo sapiens Cancer/testis antigen 2 Proteins 0.000 title claims abstract description 141
- 102100039510 Cancer/testis antigen 2 Human genes 0.000 title claims abstract description 140
- 108020001507 fusion proteins Proteins 0.000 title claims abstract description 129
- 102000037865 fusion proteins Human genes 0.000 title claims abstract description 129
- 102100025570 Cancer/testis antigen 1 Human genes 0.000 title claims abstract description 122
- 101000856237 Homo sapiens Cancer/testis antigen 1 Proteins 0.000 title claims abstract description 122
- 239000000427 antigen Substances 0.000 title claims abstract description 63
- 102000036639 antigens Human genes 0.000 title claims abstract description 63
- 108091007433 antigens Proteins 0.000 title claims abstract description 63
- 206010028980 Neoplasm Diseases 0.000 title claims abstract description 46
- 201000011510 cancer Diseases 0.000 title claims abstract description 21
- 230000004927 fusion Effects 0.000 claims abstract description 22
- 229960005486 vaccine Drugs 0.000 claims abstract description 19
- 150000001413 amino acids Chemical class 0.000 claims description 94
- 102100037840 Dehydrogenase/reductase SDR family member 2, mitochondrial Human genes 0.000 claims description 46
- 101710188053 Protein D Proteins 0.000 claims description 46
- 101710132893 Resolvase Proteins 0.000 claims description 46
- 239000012634 fragment Substances 0.000 claims description 38
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 29
- 239000000203 mixture Substances 0.000 claims description 27
- 239000002671 adjuvant Substances 0.000 claims description 22
- 230000002163 immunogen Effects 0.000 claims description 15
- 239000013598 vector Substances 0.000 claims description 12
- 108020004707 nucleic acids Proteins 0.000 claims description 10
- 102000039446 nucleic acids Human genes 0.000 claims description 10
- 150000007523 nucleic acids Chemical class 0.000 claims description 10
- 238000004519 manufacturing process Methods 0.000 claims description 9
- 238000011282 treatment Methods 0.000 claims description 8
- 108091034117 Oligonucleotide Proteins 0.000 claims description 6
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 6
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 6
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 claims description 5
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 claims description 5
- 206010005003 Bladder cancer Diseases 0.000 claims description 4
- 206010006187 Breast cancer Diseases 0.000 claims description 4
- 208000026310 Breast neoplasm Diseases 0.000 claims description 4
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 claims description 4
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 claims description 4
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 4
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 4
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 3
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 3
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 3
- 206010060862 Prostate cancer Diseases 0.000 claims description 3
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 3
- 201000004101 esophageal cancer Diseases 0.000 claims description 3
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 claims description 3
- 201000005202 lung cancer Diseases 0.000 claims description 3
- 208000020816 lung neoplasm Diseases 0.000 claims description 3
- 239000007764 o/w emulsion Substances 0.000 claims description 3
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 2
- 102000004127 Cytokines Human genes 0.000 claims description 2
- 108090000695 Cytokines Proteins 0.000 claims description 2
- 101150029707 ERBB2 gene Proteins 0.000 claims description 2
- 201000010536 head and neck cancer Diseases 0.000 claims description 2
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 2
- 208000032839 leukemia Diseases 0.000 claims description 2
- 201000007270 liver cancer Diseases 0.000 claims description 2
- 208000014018 liver neoplasm Diseases 0.000 claims description 2
- 206010041823 squamous cell carcinoma Diseases 0.000 claims description 2
- 238000002626 targeted therapy Methods 0.000 claims description 2
- 206010044412 transitional cell carcinoma Diseases 0.000 claims description 2
- 239000003814 drug Substances 0.000 claims 2
- 102000019034 Chemokines Human genes 0.000 claims 1
- 108010012236 Chemokines Proteins 0.000 claims 1
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 claims 1
- 206010039491 Sarcoma Diseases 0.000 claims 1
- 230000003308 immunostimulating effect Effects 0.000 claims 1
- 201000010893 malignant breast melanoma Diseases 0.000 claims 1
- 239000007762 w/o emulsion Substances 0.000 claims 1
- 108090000623 proteins and genes Proteins 0.000 abstract description 59
- 102000004169 proteins and genes Human genes 0.000 abstract description 50
- 230000028993 immune response Effects 0.000 abstract description 11
- 238000000034 method Methods 0.000 abstract description 11
- 235000001014 amino acid Nutrition 0.000 description 106
- 229940024606 amino acid Drugs 0.000 description 95
- 235000018102 proteins Nutrition 0.000 description 48
- 241000699670 Mus sp. Species 0.000 description 39
- 108090000765 processed proteins & peptides Proteins 0.000 description 37
- 102000004196 processed proteins & peptides Human genes 0.000 description 35
- 210000004027 cell Anatomy 0.000 description 30
- 229920001184 polypeptide Polymers 0.000 description 30
- 102000008186 Collagen Human genes 0.000 description 25
- 108010035532 Collagen Proteins 0.000 description 25
- 229920001436 collagen Polymers 0.000 description 25
- 239000002773 nucleotide Substances 0.000 description 16
- 125000003729 nucleotide group Chemical group 0.000 description 16
- 108020004414 DNA Proteins 0.000 description 15
- 239000000872 buffer Substances 0.000 description 13
- 102000000440 Melanoma-associated antigen Human genes 0.000 description 11
- 108050008953 Melanoma-associated antigen Proteins 0.000 description 11
- 230000003053 immunization Effects 0.000 description 11
- 238000002649 immunization Methods 0.000 description 11
- 238000012737 microarray-based gene expression Methods 0.000 description 11
- 238000012243 multiplex automated genomic engineering Methods 0.000 description 11
- 210000004881 tumor cell Anatomy 0.000 description 10
- 238000002965 ELISA Methods 0.000 description 9
- 241000699666 Mus <mouse, genus> Species 0.000 description 9
- 238000006467 substitution reaction Methods 0.000 description 9
- 238000013461 design Methods 0.000 description 8
- 238000009472 formulation Methods 0.000 description 8
- 238000012986 modification Methods 0.000 description 8
- 230000004048 modification Effects 0.000 description 8
- SSOORFWOBGFTHL-OTEJMHTDSA-N (4S)-5-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[2-[(2S)-2-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S,3S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-5-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-5-amino-1-[[(2S)-5-carbamimidamido-1-[[(2S)-5-carbamimidamido-1-[[(1S)-4-carbamimidamido-1-carboxybutyl]amino]-1-oxopentan-2-yl]amino]-1-oxopentan-2-yl]amino]-1,5-dioxopentan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-1-oxohexan-2-yl]amino]-1-oxohexan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1,5-dioxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-1-oxopropan-2-yl]amino]-1-oxohexan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-methyl-1-oxopentan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-1-oxohexan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxopropan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]carbamoyl]pyrrolidin-1-yl]-2-oxoethyl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-1-oxohexan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-(1H-imidazol-4-yl)-1-oxopropan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-4-[[(2S)-2-[[(2S)-2-[[(2S)-2,6-diaminohexanoyl]amino]-3-methylbutanoyl]amino]propanoyl]amino]-5-oxopentanoic acid Chemical compound CC[C@H](C)[C@H](NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H]1CCCN1C(=O)CNC(=O)[C@H](Cc1c[nH]c2ccccc12)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](Cc1ccccc1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](Cc1ccccc1)NC(=O)[C@H](Cc1c[nH]cn1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@@H](N)CCCCN)C(C)C)C(C)C)C(C)C)C(C)C)C(C)C)C(C)C)C(=O)N[C@@H](Cc1ccccc1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O SSOORFWOBGFTHL-OTEJMHTDSA-N 0.000 description 7
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 7
- 239000013604 expression vector Substances 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 238000012216 screening Methods 0.000 description 7
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 7
- 102000053602 DNA Human genes 0.000 description 6
- 241000588724 Escherichia coli Species 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 238000010586 diagram Methods 0.000 description 6
- 238000013401 experimental design Methods 0.000 description 6
- 238000007918 intramuscular administration Methods 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- BKAYIFDRRZZKNF-VIFPVBQESA-N N-acetylcarnosine Chemical compound CC(=O)NCCC(=O)N[C@H](C(O)=O)CC1=CN=CN1 BKAYIFDRRZZKNF-VIFPVBQESA-N 0.000 description 5
- 125000000539 amino acid group Chemical group 0.000 description 5
- 238000010367 cloning Methods 0.000 description 5
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 5
- 201000001441 melanoma Diseases 0.000 description 5
- 230000028327 secretion Effects 0.000 description 5
- 230000009466 transformation Effects 0.000 description 5
- 241000894006 Bacteria Species 0.000 description 4
- 238000011748 CB6F1 mouse Methods 0.000 description 4
- 241000251204 Chimaeridae Species 0.000 description 4
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 4
- 210000004899 c-terminal region Anatomy 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- FGDZQCVHDSGLHJ-UHFFFAOYSA-M rubidium chloride Chemical compound [Cl-].[Rb+] FGDZQCVHDSGLHJ-UHFFFAOYSA-M 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 230000004083 survival effect Effects 0.000 description 4
- 210000001550 testis Anatomy 0.000 description 4
- -1 DNA Chemical class 0.000 description 3
- 241000606768 Haemophilus influenzae Species 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 230000005875 antibody response Effects 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 239000002502 liposome Substances 0.000 description 3
- 229940035032 monophosphoryl lipid a Drugs 0.000 description 3
- 210000004897 n-terminal region Anatomy 0.000 description 3
- 230000000717 retained effect Effects 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Chemical compound OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 108091026890 Coding region Proteins 0.000 description 2
- 102000012422 Collagen Type I Human genes 0.000 description 2
- 108010022452 Collagen Type I Proteins 0.000 description 2
- 150000008574 D-amino acids Chemical class 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 101001005719 Homo sapiens Melanoma-associated antigen 3 Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- 102000043129 MHC class I family Human genes 0.000 description 2
- 108091054437 MHC class I family Proteins 0.000 description 2
- 102100025082 Melanoma-associated antigen 3 Human genes 0.000 description 2
- 125000001429 N-terminal alpha-amino-acid group Chemical group 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- 230000005867 T cell response Effects 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 239000013613 expression plasmid Substances 0.000 description 2
- 229940045808 haemophilus influenzae type b Drugs 0.000 description 2
- 238000001597 immobilized metal affinity chromatography Methods 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 230000016784 immunoglobulin production Effects 0.000 description 2
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 2
- 229930027917 kanamycin Natural products 0.000 description 2
- 229960000318 kanamycin Drugs 0.000 description 2
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 2
- 229930182823 kanamycin A Natural products 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 235000015097 nutrients Nutrition 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 230000001131 transforming effect Effects 0.000 description 2
- 238000002255 vaccination Methods 0.000 description 2
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- DVLFYONBTKHTER-UHFFFAOYSA-N 3-(N-morpholino)propanesulfonic acid Chemical compound OS(=O)(=O)CCCN1CCOCC1 DVLFYONBTKHTER-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 108700023418 Amidases Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 108091029430 CpG site Proteins 0.000 description 1
- 230000007023 DNA restriction-modification system Effects 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 102000025850 HLA-A2 Antigen Human genes 0.000 description 1
- 108010074032 HLA-A2 Antigen Proteins 0.000 description 1
- 101710154606 Hemagglutinin Proteins 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 239000006137 Luria-Bertani broth Substances 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- QTZXSYBVOSXBEJ-WDSKDSINSA-N Met-Asp Chemical compound CSCC[C@H](N)C(=O)N[C@H](C(O)=O)CC(O)=O QTZXSYBVOSXBEJ-WDSKDSINSA-N 0.000 description 1
- KTHDTJVBEPMMGL-VKHMYHEASA-N N-acetyl-L-alanine Chemical compound OC(=O)[C@H](C)NC(C)=O KTHDTJVBEPMMGL-VKHMYHEASA-N 0.000 description 1
- KTHDTJVBEPMMGL-UHFFFAOYSA-N N-acetyl-L-alanine Natural products OC(=O)C(C)NC(C)=O KTHDTJVBEPMMGL-UHFFFAOYSA-N 0.000 description 1
- 101800000512 Non-structural protein 1 Proteins 0.000 description 1
- 206010061534 Oesophageal squamous cell carcinoma Diseases 0.000 description 1
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 1
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 101710176177 Protein A56 Proteins 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 208000036765 Squamous cell carcinoma of the esophagus Diseases 0.000 description 1
- 241000193998 Streptococcus pneumoniae Species 0.000 description 1
- 108700005078 Synthetic Genes Proteins 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- FHICGHSMIPIAPL-HDYAAECPSA-N [2-[3-[6-[3-[(5R,6aS,6bR,12aR)-10-[6-[2-[2-[4,5-dihydroxy-3-(3,4,5-trihydroxyoxan-2-yl)oxyoxan-2-yl]ethoxy]ethyl]-3,4,5-trihydroxyoxan-2-yl]oxy-5-hydroxy-2,2,6a,6b,9,9,12a-heptamethyl-1,3,4,5,6,6a,7,8,8a,10,11,12,13,14b-tetradecahydropicene-4a-carbonyl]peroxypropyl]-5-[[5-[8-[3,5-dihydroxy-4-(3,4,5-trihydroxyoxan-2-yl)oxyoxan-2-yl]octoxy]-3,4-dihydroxy-6-methyloxan-2-yl]methoxy]-3,4-dihydroxyoxan-2-yl]propoxymethyl]-5-hydroxy-3-[(6S)-6-hydroxy-2,6-dimethylocta-2,7-dienoyl]oxy-6-methyloxan-4-yl] (2E,6S)-6-hydroxy-2-(hydroxymethyl)-6-methylocta-2,7-dienoate Chemical compound C=C[C@@](C)(O)CCC=C(C)C(=O)OC1C(OC(=O)C(\CO)=C\CC[C@](C)(O)C=C)C(O)C(C)OC1COCCCC1C(O)C(O)C(OCC2C(C(O)C(OCCCCCCCCC3C(C(OC4C(C(O)C(O)CO4)O)C(O)CO3)O)C(C)O2)O)C(CCCOOC(=O)C23C(CC(C)(C)CC2)C=2[C@@]([C@]4(C)CCC5C(C)(C)C(OC6C(C(O)C(O)C(CCOCCC7C(C(O)C(O)CO7)OC7C(C(O)C(O)CO7)O)O6)O)CC[C@]5(C)C4CC=2)(C)C[C@H]3O)O1 FHICGHSMIPIAPL-HDYAAECPSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000005377 adsorption chromatography Methods 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 229960003767 alanine Drugs 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 229940037003 alum Drugs 0.000 description 1
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 1
- 229940024546 aluminum hydroxide gel Drugs 0.000 description 1
- SMYKVLBUSSNXMV-UHFFFAOYSA-K aluminum;trihydroxide;hydrate Chemical compound O.[OH-].[OH-].[OH-].[Al+3] SMYKVLBUSSNXMV-UHFFFAOYSA-K 0.000 description 1
- 102000005922 amidase Human genes 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 210000004900 c-terminal fragment Anatomy 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 229960003669 carbenicillin Drugs 0.000 description 1
- FPPNZSSZRUTDAP-UWFZAAFLSA-N carbenicillin Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)C(C(O)=O)C1=CC=CC=C1 FPPNZSSZRUTDAP-UWFZAAFLSA-N 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000012411 cloning technique Methods 0.000 description 1
- 238000000975 co-precipitation Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000000287 crude extract Substances 0.000 description 1
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 208000007276 esophageal squamous cell carcinoma Diseases 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 238000001400 expression cloning Methods 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- YMAWOPBAYDPSLA-UHFFFAOYSA-N glycylglycine Chemical compound [NH3+]CC(=O)NCC([O-])=O YMAWOPBAYDPSLA-UHFFFAOYSA-N 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 229960000789 guanidine hydrochloride Drugs 0.000 description 1
- PJJJBBJSCAKJQF-UHFFFAOYSA-N guanidinium chloride Chemical compound [Cl-].NC(N)=[NH2+] PJJJBBJSCAKJQF-UHFFFAOYSA-N 0.000 description 1
- 229940047650 haemophilus influenzae Drugs 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 230000028996 humoral immune response Effects 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 230000002998 immunogenetic effect Effects 0.000 description 1
- 230000009851 immunogenic response Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 210000004898 n-terminal fragment Anatomy 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 210000001322 periplasm Anatomy 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 229920002627 poly(phosphazenes) Polymers 0.000 description 1
- 229920002704 polyhistidine Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000000751 protein extraction Methods 0.000 description 1
- 238000000164 protein isolation Methods 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 238000003521 protein stability assay Methods 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 230000000601 reactogenic effect Effects 0.000 description 1
- 101150079601 recA gene Proteins 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 230000000405 serological effect Effects 0.000 description 1
- 238000005063 solubilization Methods 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000004988 splenocyte Anatomy 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 229960001295 tocopherol Drugs 0.000 description 1
- 229930003799 tocopherol Natural products 0.000 description 1
- 235000010384 tocopherol Nutrition 0.000 description 1
- 239000011732 tocopherol Substances 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 210000002993 trophoblast Anatomy 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 125000001493 tyrosinyl group Chemical class [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4748—Tumour specific antigens; Tumour rejection antigen precursors [TRAP], e.g. MAGE
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001184—Cancer testis antigens, e.g. SSX, BAGE, GAGE or SAGE
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001184—Cancer testis antigens, e.g. SSX, BAGE, GAGE or SAGE
- A61K39/001188—NY-ESO
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55555—Liposomes; Vesicles, e.g. nanoparticles; Spheres, e.g. nanospheres; Polymers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55561—CpG containing adjuvants; Oligonucleotide containing adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55577—Saponins; Quil A; QS21; ISCOMS
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
Abstract
Description
本発明は、概して、癌退縮抗原NY-ESO-1およびLAGE-1の一方または両者由来の抗原を含むポリペプチドおよび構築物に関する。
癌精巣(CT)抗原は、その発現が通常は精巣、卵巣または栄養膜細胞中の生殖細胞に限定される腫瘍関連抗原の1クラスである。これらの抗原は、通常、成体の体細胞組織では発現されない。Simpson, et al., Nat. Rev. Cancer, 5(8):615-625 (2005); Scanlan, et al., Immunol. Reviews, 188:22-32 (2002); Scanlan, et al., Canc. Immun., 4:1-15 (2004)を参照のこと。
N末端領域 約またはおよそアミノ酸1〜70位
中央領域 約またはおよそアミノ酸71〜134位、および
C末端領域 約またはおよそアミノ酸135〜180位。
本発明は、以下のもの:
(i) 以下の(ii)に連結された、NY-ESO-1またはその断片
(ii) LAGE-1またはその断片
を含み、NY-ESO-1および/またはLAGE-1の少なくとも一方がトランケートもしくは部分的にトランケートされているか、またはNY-ESO-1もしくはLAGE-1の1個以上のエピトープを含む断片である、免疫原性融合タンパク質を提供する。また本発明は、以下のもの:
(i) 以下の(ii)に連結された、LAGE-1またはその断片
(ii) NY-ESO-1またはその断片,
を含み、NY-ESO-1および/またはLAGE-1の少なくとも一方がトランケートもしくは部分的にトランケートされているか、またはNY-ESO-1もしくはLAGE-1の1個以上のエピトープを含む断片である、免疫原性融合タンパク質を提供する。ゆえに、NY-ESO-1の1個以上のエピトープを含む、トランケートもしくは部分的にトランケートされたNY-ESO-1、またはその断片を含む、ポリペプチドおよび融合タンパク質も提供される。また、LAGE-1の1個以上のエピトープを含む、トランケートもしくは部分的にトランケートされたLAGE-1、またはその断片を含む、ポリペプチドおよび融合タンパク質が提供される。そのような融合タンパク質およびポリペプチドを含む組成物および方法がさらに提供される。
融合タンパク質。本発明の融合タンパク質は癌の治療に有用であり、より具体的には以下の癌: 黒色腫; 乳癌; 前立腺癌; 移行上皮癌を含む膀胱癌; 非小細胞肺癌(NSCLC)を含む肺癌; 食道癌を含む頭頸部癌; 扁平上皮癌; 消化管の癌腫; 肝癌; 脳腫瘍; 白血病; および種々の肉腫の治療に有用である。
1種以上のコラーゲン様ドメインの除去によって、天然内因性コラーゲン構造とのホモロジーによって生じる化合物の潜在的免疫寛容が低減されるか、または
異種融合パートナーの任意の付加によってCD4 T細胞応答をさらに刺激することができるからである。ゆえに、該融合タンパク質は癌抗原、例えばNY-ESO-1もしくはLAGE-1、または両者に対する免疫原性応答の誘発に有用である。
i) アスパラギン酸/アスパラギン/グルタミン酸/グルタミン、
ii) セリン/スレオニン、
iii) リシン/アルギニン、
iv) フェニルアラニン/チロシン/トリプトファン、
v) ロイシン/イソロイシン/バリン/メチオニン、
vi) グリシン/アラニン。
・インフルエンザウイルス由来の非構造タンパク質NS1 (赤血球凝集素)。典型的に、N末端の81アミノ酸を使用するが、Tヘルパーエピトープを含む限り異なる断片を使用してもよい;
・LytA遺伝子によってコードされるN-アセチル-L-アラニンアミダーゼLytAを合成する肺炎連鎖球菌(Streptococcus pneumoniae)由来のLytA(Gene, 43 (1986) 265-272ページ)。例えば残基178から始まるC末端に見出される、残基188〜305等のLytA分子の反復部分等である。一実施形態では、異種融合パートナーはCLytAである。別の実施形態では、異種融合パートナーは、WO03/104272に記載のCLytA-P2-CLytAを含む融合タンパク質であるCPCである。アミノ末端にC-LytA断片を含有するハイブリッドタンパク質の精製はBiotechnology: 10, (1992) 795-798ページに記載されている。
i) 宿主細胞中で、融合タンパク質またはその免疫原性誘導体をコードするヌクレオチド配列を含むDNAポリマーを発現可能な、複製可能または組み込み発現ベクターを調製するステップ;
ii) 宿主細胞を該ベクターで形質転換するステップ;
iii) 該DNAポリマーの発現により該タンパク質の生産が可能になる条件下で該形質転換宿主細胞を培養するステップ; および
iv) 該タンパク質を回収するステップ。
・AR58: gal E::Tn 10,Δ-8(chlD-pgl),Δ-H1(cro-chlA),N+, およびcI857であるN99由来の潜在性λ溶原菌(参考文献: Proc.Natl.Acad.Sci.USA vol82,pp.88-92,January 1985 Biochemistry)
・BLR (DE3) Novagen, WI, USA (カタログ番号: 69053-4): 使用されうるBLRはBL21のrecA-誘導体である。概して、例えばカナマイシン耐性またはアンピシリン耐性の選択マーカーを組み入れて、発現系への組換え遺伝子/構築物の組み込み成功の識別を容易にする。
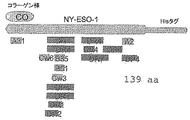
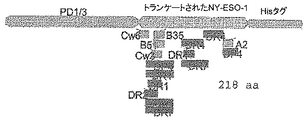
アミノ酸1-18位 1-Metおよび、プロテインDの天然アミノ酸残基2-Lysおよび3-Thrに代わる置換残基2-Aspおよび3-Proを含むプロテインDのシグナル配列
アミノ酸19-127位 プロテインDのアミノ酸20〜127位を含む
アミノ酸128-129位 クローニング部位を創出するためのアミノ酸(aa)128-129の位置の無関係のアミノ酸Met-Asp
アミノ酸130-441位 MAGE3の断片(MAGE3のアミノ酸3-314位)
アミノ酸442-443位 無関係のアミノ酸Gly-Gly
アミノ酸444-451位 7his尾部。
CO コラーゲン様領域
W/Ocoll コラーゲン様領域(コラーゲン様ドメイン)を含まない
PD1/3 プロテインDの最初の3分の1
融合タンパク質およびそれをコードするヌクレオチド配列の典型的な実施形態を表1-3に挙げる。
図17にまとめるように、いくつかのNY-ESO-1/LAGE-1融合タンパク質を設計した。該融合タンパク質には、コラーゲン様ドメインを含むものおよび含まないもの、ならびにプロテインDの末端を含むものおよび含まないものがある。Escherichia coliでの発現のために、設計された構築物のコドンを最適化した。オリゴヌクレオチドおよび/またはPCR産物から合成遺伝子を組み立てた。KpnIおよびSacI制限部位を使用してpGA4主鎖(AmpR)中に該断片をクローニングし、最適化された遺伝子の5'末端および3'末端にNdeIおよびXhoI部位をそれぞれ加えた。
培養
2.5L振とうフラスコ中で800 mlのLuria-Bertani (LB)ブロス(BD) + 1% (w/v)グルコース(Laboratoire MAT, カタログ番号: GR-0101) + 抗生物質(pET19に関してはカルベニシリン100μg/ml, pET26に関してはカナマイシン40μg/ml)で細菌を培養した。BLR (DE3)細胞に関しては、O.D.600nmが0.8付近になるまで培養物を37℃でインキュベートした。
0.8付近のO.D.600nmで、培養BLR (DE3)を1 mMイソプロピルβ-D-1-チオガラクトピラノシド(IPTG; EMD Chemicals Inc., カタログ番号: 5815)で誘導し、16-18時間16℃でインキュベートした。構築物LVL106、151、155および157を用いて特定タンパク質5〜15 mg/800mlを得た。各構築物に関するタンパク質生産を図17にまとめる。
タンパク質の抽出および精製
遠心分離によって細胞を回収し、次いで物理的または化学的手段によってそれを破壊し、目的のポリペプチドを単離するために、得られた粗製抽出物を保持した。
発現された組換えタンパク質を塩酸グアニジン溶液で可溶化し、固定化金属アフィニティークロマトグラフィー(IMAC)樹脂に載せた。次いでタンパク質をカラム上で8Mおよび4M尿素溶液で洗浄した後、イミダゾール濃度を増加させることによって溶出させた。次いで、後の使用のために、最終4M尿素バッファー、pH 7.0中でタンパク質を脱塩した。SDS PAGEおよびウエスタンブロットによって精製物を評価し、タンパク質の純度および同一性を確認した。
安定性アッセイを37℃で実施し、タンパク質をSDS-PAGEによって評価した。予備安定性アッセイでは大きな問題は示されなかった。
下記のように一連の筋肉内免疫化スクリーニング実験を含むマウスモデルにおいて融合タンパク質を前臨床的に評価した。選択されたマウスモデルはC57BL6マウスとBalb/cマウスの交雑から得られた第一世代であるCB6F1であった。そのマウスはCharles River Laboratories, Inc., 251 Ballardvale Street, Wilmington, MA 01887-1000から市販されている。選択された腫瘍セルラインは癌治療の研究のために市販されている移植可能なマウス黒色腫であるB16 (マウス黒色腫セルライン)であった。
実験設計。76日間の試験では、融合タンパク質プラスアジュバントでの筋肉内免疫化が、移植された腫瘍細胞(B16/NYESO1)での皮下チャレンジに対抗する防御をもたらすかどうかを決定するために、CB6F1マウスを使用して、LVL076、LVL079、LVL078、LVL068、LVL020、LVL026、LVL024、LVL030のそれぞれを評価した。具体的には、タンパク質15μgおよびアジュバントを含有する50μL注射でマウスを筋肉内で免疫化した。選択されたアジュバントはAS15であった。AS15は、QS21、3D-MPLおよびCpGを含むリポソームアジュバント製剤である。
試験1A
LVL079
LVL026
LVL068
LVL030
試験1B
LVL076
LVL020
LVL078
LVL024
コントロール
抗原バッファー/AS15バッファー
全長NY-ESO-1
コラーゲン様ドメイン(CLD)を有さないLAGE-1a
MAGE A3。
実験設計。105日間の試験では、融合タンパク質プラスアジュバントでの筋肉内免疫化がB16/NYESO1移植腫瘍細胞(2回の免疫化後)またはB16/LAGE-1a腫瘍細胞(4回の免疫化後)での皮下チャレンジに対抗する防御をもたらすかどうかを決定するために、CB6F1マウスを使用して、LVL076、LVL078、LVL068、およびLVL024のそれぞれを評価した。具体的には、タンパク質15μgおよびAS15アジュバント25μLを含有する50μL注射でマウスを筋肉内で免疫化した。
試験
LVL076
LVL068
LVL078
LVL024
コントロール
抗原バッファー/AS15バッファー
全長NY-ESO-1
コラーゲン様ドメイン(CLD)を有さないLAGE-1a
MAGE A3。
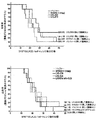
B16-NYESO1腫瘍チャレンジ
LVL078を投与されたマウスのうち、B16-NY-ESO-1チャレンジ後の50日にわたって2匹が腫瘍を有さなかった。全長NY-ESO-1またはLVL024を投与されたマウスのうち、50日にわたって各群由来の2匹が腫瘍を有さず、3匹が生存した。LVL068を投与されたマウスのうち、3匹が腫瘍を有さず、4匹が生存した。LVL076を投与されたマウスのうち、3匹が腫瘍を有さず、5匹が生存してた。図24を参照のこと。
LVL076または、コラーゲン様領域を有さないLAGE-1aを投与されたすべてのマウスがチャレンジ後40日目より早期に死滅した。バッファーのみを投与されたマウスのうち、1匹が研究の終了時点まで生存し腫瘍を有さなかった。LVL024を投与されたマウスのうち、研究の終了時点で1匹が腫瘍を有さなかった。全長NY-ESO-1を投与されたマウスのうち、腫瘍を有さないマウスはいなかったが、研究の終了時点で1匹が依然として生存していた。LVL078を投与されたマウスのうち、1匹が腫瘍を有さなかった。LVL068を投与されたマウスのうち、3匹が腫瘍を有さなかった。LVL076を投与されたマウスのうち、研究の終了時点で3匹が腫瘍を有さなかった。図25を参照のこと。これらの結果を以下のチャートにまとめる。
NY-ESO-1のコラーゲン様ドメインがヒトコラーゲン特異的免疫応答を刺激するかどうかを調べるために、以下の抗原: (1)バッファー(コントロール); (2)全長NY-ESO-1; (3)コラーゲン様ドメインを有さないLAGE-1a; (4) LVL068; (5) LVL078; (6) LVL024; (7) LVL076、のうちの1つで免疫したマウスから接種14日後に血清を回収し、プールした。これらの7種の血清プールのそれぞれ、ならびに抗ヒトコラーゲンI mAbを含有する陽性コントロールに関してELISAを行った。該コラーゲン様ドメインはマウス抗ヒトコラーゲンI抗体生産を刺激しなった。図26を参照のこと。コラーゲンIIIおよびコラーゲンVIに関して同様の試験(結果は示していない)を行った。マウス抗ヒトコラーゲンIIIおよびマウス抗ヒトコラーゲンVI抗体生産のいずれも検出されなかった。
表4に列挙されるいくつかの構築物に対して、通常のクローニング技術を使用して改変を行った。具体的には、LVL068、LVL030、LVL076、LVL078、LVL024を改変して、LVL155、LVL106、LVL156、LVL157、LVL151を得た。2種類の改変が存在した。第一の改変はプロテインDとキメラ(chimers)の先頭部位の間の5アミノ酸残基の除去であった。例えば、LVL024 (配列番号74; 配列番号75)を用いてこの改変を実行し、LVL151 (配列番号90; 配列番号91)を得た。ゆえに、LVL024はLVL 151と対応する。第二のタイプの改変はhisタグとキメラ(chimer)の先頭部位の間のアミノ酸の除去であった。LVL068 (配列番号80; 配列番号81)を用いてこの改変を実行し、LVL155 (配列番号92; 配列番号93)を得た。ゆえに、LVL068はLVL 151と対応する。改変された各融合タンパク質構築物およびそれに対応する融合タンパク質構築物を本説明の表5に記載する。
実験設計。105日間の試験では、B16/NYESO1移植腫瘍細胞(2回の免疫化後)またはB16/LAGE-1a腫瘍細胞(4回の免疫化後)での皮下チャレンジに対抗する、融合タンパク質プラスアジュバントでの筋肉内免疫化を調べるために、CB6F1マウスを使用して、LVL068、LVL030、LVL076、LVL078、LVL024、および改変LVL155、LVL106、LVL156、LVL157、LVL151のそれぞれを評価する。具体的には、タンパク質15μgおよびAS15アジュバント25μLを含有する50μL注射でマウスを筋肉内で免疫化する。
試験
LVL068
LVL030
LVL076
LVL078
LVL024
LVL155
LVL106
LVL156
LVL157
LVL151
コントロール
抗原バッファー/AS15バッファー
全長NY-ESO-1
コラーゲンドメインを有さないLAGE-1a
MAGE A3。
Claims (29)
- (a) 以下の(b)に連結された、NY-ESO-1またはその断片
(b) LAGE-1またはその断片、
を含み、そのNY-ESO-1および/またはLAGE-1の少なくとも一方が、トランケートもしくは部分的にトランケートされているか、またはNY-ESO-1もしくはLAGE-1の1個以上のエピトープを含む断片である、融合タンパク質。 - NY-ESO-1が、全長NY-ESO-1、部分的にトランケートされたNY-ESO-1もしくはトランケートされたNY-ESO-1、またはNY-ESO-1の1個以上のエピトープを含むその任意の断片から選択される、請求項1に記載の融合タンパク質。
- LAGE-1が、全長LAGE-1、部分的にトランケートされたLAGE-1もしくはトランケートされたLAGE-1、またはLAGE-1の1個以上のエピトープを含むその任意の断片から選択される、請求項1又は2に記載の融合タンパク質。
- NY-ESO-1またはLAGE-1が、天然NY-ESO-1またはLAGE-1と少なくとも95、96、97、98、99%または100%同一である、請求項1〜3のいずれかに記載の融合タンパク質。
- LAGE-1がLAGE-1aである、請求項1〜4のいずれかに記載の融合タンパク質。
- NY-ESO-1のN末端がLAGE-1のC末端に融合されている、請求項1〜5のいずれかに記載の融合タンパク質。
- NY-ESO-1のC末端がLAGE-1のN末端に融合されている、請求項1〜5のいずれかに記載の融合タンパク質。
- 融合タンパク質が異種融合パートナーをさらに含む、請求項1〜7のいずれかに記載の融合タンパク質。
- 異種融合パートナーがプロテインDまたはその誘導体もしくは断片である、請求項8に記載の融合タンパク質。
- プロテインD誘導体がプロテインDの最初のおよそ1/3、例えばプロテインDのアミノ酸20〜127を含む、請求項9に記載の融合タンパク質。
- プロテインD誘導体が脂質化されていない、請求項9または10に記載の融合タンパク質。
- アミノ酸Met、AspおよびProをさらに含む、請求項1〜11のいずれかに記載の融合タンパク質。
- アミノ酸Met、AspおよびProが、請求項9〜11のいずれかに記載のプロテインD異種融合パートナーのN末端に融合されている、請求項12に記載の融合タンパク質。
- 組換え融合タンパク質である、請求項1〜13のいずれかに記載の融合タンパク質。
- 親和性タグをさらに含む、請求項1〜14のいずれかに記載の融合タンパク質。
- 親和性タグが1〜10個の範囲のヒスチジン残基を含むヒスチジン尾部である、請求項15に記載の融合タンパク質。
- 以下の配列: 配列番号3、配列番号4、配列番号7、配列番号8、配列番号11、配列番号12、配列番号15、配列番号16、配列番号19、配列番号20、配列番号23、配列番号24、配列番号26、配列番号28、配列番号30、配列番号32、配列番号34、配列番号36、配列番号38、配列番号40、配列番号42、配列番号44、配列番号46、配列番号48、配列番号51、配列番号53、配列番号55、配列番号57、配列番号60、配列番号62、配列番号64、配列番号66、配列番号68、配列番号70配列番号73、配列番号75、配列番号77、配列番号79、配列番号81、配列番号83、配列番号85、配列番号87、配列番号89、配列番号91、配列番号93、配列番号95、および配列番号97からなる群から選択されるアミノ酸配列を含む、請求項1〜5のいずれかに記載の融合タンパク質。
- 以下の配列: 配列番号81、配列番号85、配列番号93、および配列番号97からなる群から選択されるアミノ酸配列を含む、請求項1〜5のいずれかに記載の融合タンパク質。
- 請求項1〜18のいずれかに記載の融合タンパク質をコードする核酸分子。
- 請求項19に記載の核酸分子を含むベクター。
- 請求項20に記載のベクターで形質転換された宿主細胞。
- 請求項1〜18のいずれかに記載の融合タンパク質、請求項19に記載の核酸分子または請求項20に記載のベクターを含む免疫原性組成物またはワクチン。
- アジュバント、および/または免疫賦活性サイトカインまたはケモカインをさらに含む、請求項22に記載の免疫原性組成物。
- 融合タンパク質が水中油型または油中水型エマルジョンビヒクル中で提供される、請求項22または23に記載の免疫原性組成物またはワクチン。
- 以下のアジュバント: 3D-MPL、QS21またはCpGオリゴヌクレオチドの1種以上を含む、請求項23または24に記載の免疫原性組成物またはワクチン。
- 1種以上の他の抗原をさらに含む、請求項22〜26のいずれかに記載の免疫原性組成物またはワクチン。
- 医療において使用するための、請求項22〜26のいずれかに記載の免疫原性組成物またはワクチン。
- 癌、例えば、乳房黒色腫; 乳癌; 前立腺癌; 移行上皮癌を含む膀胱癌; 非小細胞肺癌(NSCLC)を含む肺癌; 食道癌を含む頭頸部癌; 扁平上皮癌; 消化管癌; 肝癌; 脳腫瘍; 白血病; および種々の肉腫、を治療するための医薬の製造における、請求項1〜18のいずれかに記載の融合タンパク質または請求項19に記載の核酸分子または請求項20に記載のベクターまたは請求項22〜26のいずれかに記載の組成物もしくはワクチンの使用。
- Her2/neu標的療法が適応にならない患者の治療のための、請求項28に記載の使用。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0700759A GB0700759D0 (en) | 2007-01-15 | 2007-01-15 | Novel fusion protein |
| US91492507P | 2007-04-30 | 2007-04-30 | |
| US91484807P | 2007-04-30 | 2007-04-30 | |
| GB0709707A GB0709707D0 (en) | 2007-05-21 | 2007-05-21 | Novel fusion protein |
| PCT/US2008/050879 WO2008089074A2 (en) | 2007-01-15 | 2008-01-11 | Fusion proteins comprising the tumor rejection antigens ny-eso-1 and lage-1 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010532656A true JP2010532656A (ja) | 2010-10-14 |
| JP2010532656A5 JP2010532656A5 (ja) | 2011-02-24 |
Family
ID=41111108
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009545705A Pending JP2010532656A (ja) | 2007-01-15 | 2008-01-11 | 癌退縮抗原ny−eso−1およびlage−1を含む融合タンパク質 |
Country Status (15)
| Country | Link |
|---|---|
| EP (1) | EP2118128B1 (ja) |
| JP (1) | JP2010532656A (ja) |
| KR (1) | KR20090122426A (ja) |
| BR (1) | BRPI0806501A2 (ja) |
| CA (1) | CA2674458A1 (ja) |
| DK (1) | DK2118128T3 (ja) |
| EA (1) | EA016818B1 (ja) |
| ES (1) | ES2398492T3 (ja) |
| HR (1) | HRP20130022T1 (ja) |
| MX (1) | MX2009007572A (ja) |
| PE (1) | PE20081687A1 (ja) |
| PL (1) | PL2118128T3 (ja) |
| SI (1) | SI2118128T1 (ja) |
| TW (1) | TW200902049A (ja) |
| WO (1) | WO2008089074A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008308474A (ja) * | 2007-06-18 | 2008-12-25 | Nitto Denko Corp | 抗原ペプチド製剤の調製方法 |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI1009873A2 (pt) | 2009-03-17 | 2016-03-08 | Glaxosmithkline Biolog Sa | detecção aperfeiçoada de expressão gênica |
| GB0910046D0 (en) | 2009-06-10 | 2009-07-22 | Glaxosmithkline Biolog Sa | Novel compositions |
| AU2012302778B2 (en) * | 2011-08-31 | 2016-11-24 | Mie University | Vaccine preparation for cancer treatment |
| GB201116248D0 (en) | 2011-09-20 | 2011-11-02 | Glaxosmithkline Biolog Sa | Liposome production using isopropanol |
| JP6659535B2 (ja) | 2013-06-28 | 2020-03-04 | オークランド ユニサービシーズ リミティド | アミノ酸及びペプチド接合体及び接合方法 |
| WO2015050158A1 (ja) | 2013-10-01 | 2015-04-09 | 国立大学法人三重大学 | 抗原提示を促進するエピトープ間配列を含むt細胞誘導ワクチン |
| CA2971677A1 (en) | 2014-12-23 | 2016-06-30 | Margaret Anne Brimble | Amino acid and peptide conjugates and uses thereof |
| BR112018017174A2 (pt) | 2016-02-26 | 2019-01-02 | Auckland Uniservices Ltd | conjugados de aminoácido e peptídeo e processo de conjugação |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH06205672A (ja) * | 1992-03-19 | 1994-07-26 | Nippon Zeon Co Ltd | 日本脳炎ウイルス及びb型肝炎ウイルスの表面抗原タンパク質の抗原部位を持つキメラタンパク質の製造法、およびそれに用いる組み換えバキュロウイルス |
| JP2003529608A (ja) * | 2000-03-30 | 2003-10-07 | デンドレオン コーポレイション | 樹状細胞に基づく免疫治療のための組成物および方法 |
| US6686147B1 (en) * | 1998-07-15 | 2004-02-03 | Ludwig Institute For Cancer Research | Cancer associated antigens and uses therefor |
| JP2004532629A (ja) * | 2001-03-30 | 2004-10-28 | ルードヴィッヒ インスティテュート フォー キャンサー リサーチ | 癌・精巣抗原 |
| WO2005071088A2 (en) * | 2003-12-24 | 2005-08-04 | Cerus Corporation | Recombinant nucleic acid molecules encoding fusion proteins comprising antigens and bacterial secretory signal polypeptides, expression cassettes, and bacteria, and methods of use thereof |
| WO2005105139A2 (en) * | 2004-05-04 | 2005-11-10 | Glaxosmithkline Biologicals S.A. | Mage-3 and ny-eso-1 based polyvalent vaccine for cancer immunotherapy |
| WO2006053871A2 (en) * | 2004-11-16 | 2006-05-26 | Crucell Holland B.V. | Multivalent vaccines comprising recombinant viral vectors |
| JP2009538286A (ja) * | 2006-05-26 | 2009-11-05 | グラクソスミスクライン バイオロジカルズ ソシエテ アノニム | 癌に対するワクチン接種 |
| JP2010515444A (ja) * | 2007-01-15 | 2010-05-13 | グラクソスミスクライン バイオロジカルズ ソシエテ アノニム | ワクチン |
-
2008
- 2008-01-11 PL PL08727588T patent/PL2118128T3/pl unknown
- 2008-01-11 PE PE2008000128A patent/PE20081687A1/es not_active Application Discontinuation
- 2008-01-11 KR KR1020097016892A patent/KR20090122426A/ko not_active Application Discontinuation
- 2008-01-11 SI SI200830870T patent/SI2118128T1/sl unknown
- 2008-01-11 EP EP08727588A patent/EP2118128B1/en not_active Not-in-force
- 2008-01-11 EA EA200900738A patent/EA016818B1/ru not_active IP Right Cessation
- 2008-01-11 ES ES08727588T patent/ES2398492T3/es active Active
- 2008-01-11 JP JP2009545705A patent/JP2010532656A/ja active Pending
- 2008-01-11 DK DK08727588.9T patent/DK2118128T3/da active
- 2008-01-11 CA CA002674458A patent/CA2674458A1/en not_active Abandoned
- 2008-01-11 TW TW097101220A patent/TW200902049A/zh unknown
- 2008-01-11 MX MX2009007572A patent/MX2009007572A/es active IP Right Grant
- 2008-01-11 WO PCT/US2008/050879 patent/WO2008089074A2/en active Application Filing
- 2008-01-11 BR BRPI0806501-2A2A patent/BRPI0806501A2/pt not_active IP Right Cessation
-
2013
- 2013-01-14 HR HRP20130022AT patent/HRP20130022T1/hr unknown
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH06205672A (ja) * | 1992-03-19 | 1994-07-26 | Nippon Zeon Co Ltd | 日本脳炎ウイルス及びb型肝炎ウイルスの表面抗原タンパク質の抗原部位を持つキメラタンパク質の製造法、およびそれに用いる組み換えバキュロウイルス |
| US6686147B1 (en) * | 1998-07-15 | 2004-02-03 | Ludwig Institute For Cancer Research | Cancer associated antigens and uses therefor |
| JP2003529608A (ja) * | 2000-03-30 | 2003-10-07 | デンドレオン コーポレイション | 樹状細胞に基づく免疫治療のための組成物および方法 |
| JP2004532629A (ja) * | 2001-03-30 | 2004-10-28 | ルードヴィッヒ インスティテュート フォー キャンサー リサーチ | 癌・精巣抗原 |
| WO2005071088A2 (en) * | 2003-12-24 | 2005-08-04 | Cerus Corporation | Recombinant nucleic acid molecules encoding fusion proteins comprising antigens and bacterial secretory signal polypeptides, expression cassettes, and bacteria, and methods of use thereof |
| WO2005105139A2 (en) * | 2004-05-04 | 2005-11-10 | Glaxosmithkline Biologicals S.A. | Mage-3 and ny-eso-1 based polyvalent vaccine for cancer immunotherapy |
| WO2006053871A2 (en) * | 2004-11-16 | 2006-05-26 | Crucell Holland B.V. | Multivalent vaccines comprising recombinant viral vectors |
| JP2009538286A (ja) * | 2006-05-26 | 2009-11-05 | グラクソスミスクライン バイオロジカルズ ソシエテ アノニム | 癌に対するワクチン接種 |
| JP2010515444A (ja) * | 2007-01-15 | 2010-05-13 | グラクソスミスクライン バイオロジカルズ ソシエテ アノニム | ワクチン |
Non-Patent Citations (12)
| Title |
|---|
| JPN6012068240; RIMOLDI, D. et al.: J. Immunol. Vol.165, 2000, pp.7253-7261 * |
| JPN6012068243; ODUNSI, K. et al.: Cancer Res. Vol.63, 2003, pp.6076-6083 * |
| JPN6012068246; LETHE, B. et al.: Int. J. Cancer Vol.76, 1998, pp.903-908 * |
| JPN6014013663; VAUGHAN, H.A. et al.: Clin. Cancer Res. Vol.10, 2004, pp.8396-8404 * |
| JPN6014013667; GNJATIC, S. et al.: Adv. Cancer Res. , 2006 * |
| JPN6014013671; WANG, H.Y. et al.: Immunity Vol.20, 2004, pp.107-118 * |
| JPN6014013673; CHEN, Q. et al.: Proc. Natl. Acad. Sci. USA Vol.101, No.25, 2004, pp.9363-9368 * |
| JPN6014013675; DAVIS, I.D. et al.: Proc. Natl. Acad. Sci. USA Vol.101, No.29, 2004, pp.10697-10702 * |
| JPN6015008459; SUN, Z. et al.: Cancer Immunol. Immunother. Vol.55, 2006, pp.644-652 * |
| JPN6015008462; CHEN, Y.-T. et al.: Proc. Natl. Acad. Sci. USA Vol.95, 1998, pp.6919-6923 * |
| JPN6015008463; TAJIMA, K. et al.: Lung Cancer Vol.42, 2003, pp.23-33 * |
| JPN6015008465; MARASKOVSKY, E. et al.: Clin. Cancer Res. Vol.10, 2004, pp.2879-2890 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008308474A (ja) * | 2007-06-18 | 2008-12-25 | Nitto Denko Corp | 抗原ペプチド製剤の調製方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2009007572A (es) | 2009-10-13 |
| KR20090122426A (ko) | 2009-11-30 |
| HRP20130022T1 (hr) | 2013-02-28 |
| PL2118128T3 (pl) | 2013-03-29 |
| EP2118128A2 (en) | 2009-11-18 |
| DK2118128T3 (da) | 2013-02-18 |
| EA200900738A1 (ru) | 2010-02-26 |
| BRPI0806501A2 (pt) | 2014-04-22 |
| EA016818B1 (ru) | 2012-07-30 |
| SI2118128T1 (sl) | 2013-02-28 |
| EP2118128B1 (en) | 2012-11-07 |
| ES2398492T3 (es) | 2013-03-19 |
| WO2008089074A9 (en) | 2012-07-12 |
| WO2008089074A3 (en) | 2008-12-31 |
| WO2008089074A2 (en) | 2008-07-24 |
| TW200902049A (en) | 2009-01-16 |
| PE20081687A1 (es) | 2008-12-25 |
| CA2674458A1 (en) | 2008-07-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4768121B2 (ja) | Mageファミリーからの腫瘍関連抗原及びそれらをコードする核酸配列、融合タンパク質の及びワクチン接種のための組成物の調製のための使用 | |
| AU2008207025B2 (en) | Vaccine | |
| EP2118128B1 (en) | Fusion proteins comprising the tumor rejection antigens ny-eso-1 and lage-1 | |
| US8309096B2 (en) | Fusion protein | |
| US8916514B2 (en) | CASB7439 constructs | |
| AU2008206463B2 (en) | Fusion proteins comprising the tumor rejection antigens NY-ESO-1 and LAGE-1 | |
| ES2367998T3 (es) | Derivados antígenos asociados a tumores de la familia mage, y secuencias de ácidos nucleicos que los codifican, usados para la preparación de proteínas de fusión y de composiciones para vacunación. | |
| CN101583623A (zh) | 包含肿瘤排斥抗原ny-eso-1和lage-1的融合蛋白 | |
| MXPA00007677A (en) | Tumor-associated antigen derivatives from the mage family, and nucleic acid sequences encoding them, used for the preparation of fusion proteins and of compositions for vaccination |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101227 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20101227 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130108 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130402 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130409 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130708 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140401 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140625 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140702 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150303 |