JP2010524486A - β−カテニンを調節するためのRNAアンタゴニスト化合物 - Google Patents
β−カテニンを調節するためのRNAアンタゴニスト化合物 Download PDFInfo
- Publication number
- JP2010524486A JP2010524486A JP2010504745A JP2010504745A JP2010524486A JP 2010524486 A JP2010524486 A JP 2010524486A JP 2010504745 A JP2010504745 A JP 2010504745A JP 2010504745 A JP2010504745 A JP 2010504745A JP 2010524486 A JP2010524486 A JP 2010524486A
- Authority
- JP
- Japan
- Prior art keywords
- oligomer
- catenin
- seq
- nucleotide
- sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- BYPMTZHMLAXLGO-UHFFFAOYSA-N COP(O)(OCCCCCCN)=O Chemical compound COP(O)(OCCCCCCN)=O BYPMTZHMLAXLGO-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
- C12N2310/315—Phosphorothioates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/323—Chemical structure of the sugar modified ring structure
- C12N2310/3231—Chemical structure of the sugar modified ring structure having an additional ring, e.g. LNA, ENA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/33—Chemical structure of the base
- C12N2310/334—Modified C
- C12N2310/3341—5-Methylcytosine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Plant Pathology (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Epidemiology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
Description
本発明は、配列番号173に示されているβ−カテニン核酸などの哺乳動物β−カテニンをコードする核酸分子、および哺乳動物β−カテニンをコードする、これら核酸分子の天然の対立遺伝子変異体の機能の調節に使用するため、オリゴマー化合物(本明細書ではオリゴマーと称する)を利用する。
本明細書中で使用する「標的核酸」という用語は、配列番号173などのヒトβ−カテニンのような乳動物β−カテニンポリペプチドをコードするDNA、核酸をコードするβ−カテニン、またはその天然変異体、およびそれから誘導されたRNA核酸のことをいい、好ましくはmRNA、例えばmRNA前駆体であり、成熟mRNAであることが好ましい。さまざまな実施形態において、例えば、研究または診断に使用される場合、「標的核酸」は、上述のDNAまたはRNA核酸標的から誘導された合成オリゴヌクレオチドまたはcDNAであってよい。本発明に係るオリゴマー化合物は、好ましくは、標的核酸にハイブリッド形成することができる。
本発明のオリゴマーは、ヒトβ−カテニンmRNAを標的として差し支えなく、かくして、配列番号173内に存在するヌクレオチド配列または配列番号1〜132からなる群より選択される配列に対応する隣接した核酸塩基配列を含むか、またはこれで構成され、ここで前記オリゴマー(またはその隣接核酸塩基部分)は随意的に、前記選択される配列に対する1個、2個または3個のミスマッチを含んでいてよい。さまざまな実施形態において、オリゴヌクレオチド配列は、10〜16個の(隣接)核酸塩基の配列からなるかまたはこれらを含んでいる。16個の核酸塩基を含むオリゴヌクレオチド配列の例が、配列番号1、16、17、18、33、34、49、50、51、52、53、54、55、56、57、58、73、88、103および118中に示されている。より短い配列をこれから誘導することができる。より長い配列は、それぞれの配列番号からのすべてのまたは少なくとも10個の核酸塩基を含み得る。
オリゴマーは、合計10〜50個の核酸塩基、例えば10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29または30個の隣接核酸塩基の長さの隣接した核酸塩基配列を含むか、またはこれからなる。
本明細書で使用する「ヌクレオチド」という用語は、糖部分、塩基部分および共有結合により連結されたリン酸基を含むグリコシドを意味し、DNAまたはRNAなどの両方の天然ヌクレオチドを網羅するが、好ましくはDNAである。修飾された糖および/または塩基部分を含む非天然ヌクレオチドは、本明細書において「ヌクレオチド類似体」と称される。「核酸塩基」という用語は、天然(DNAまたはRNAタイプ)のヌクレオチドならびにヌクレオチド類似体の両方を包含するように使用されている。
したがってオリゴマーは、天然ヌクレオチド、好ましくは2’−デオキシヌクレオチド(ここでは一般に「DNA」と呼ばれる)の単純配列のみならず場合によってはリボヌクレオチド(ここでは一般に「RNA」と呼ばれる)、またはかかる天然ヌクレオチドおよび1つ以上の非天然ヌクレオチドの組合せ、すなわちヌクレオチド類似体を含むか、またはそれからなる。かかるヌクレオチド類似体は、適切には、標的配列に対するオリゴマーの親和力を増強し得る。
「LNA」という用語は、「ロックされた核酸」として公知の二環式ヌクレオチド類似体を意味する。それは、LNAモノマーを意味してもよく、そうでなければ、「LNAオリゴヌクレオチド」またはLNA「オリゴマー」に関連して使用される場合、1個以上のかかる二環式ヌクレオチド類似体を含有するオリゴマーを意味する。
式中、Xは、−O−、−S−、−N(RN*)−、−C(R6R6*)−から選択され;
Bは、水素、随意的に置換されたC1−4−アルコキシ、随意的に置換されたC1−4−アルキル、随意的に置換されたC1−4−アシルオキシ、核酸塩基、DNAインターカレーター、光化学的活性基、熱化学的活性基、キレート化基、リポーター基、およびリガンドから選択され;
Pは、後続するモノマーに対するヌクレオチド間連結または5’末端基のためのラジカル位置を表わし、かかるヌクレオチド間連結または5’末端基は随意的に置換基R5を含むか、または置換基R5*も同様に適用可能であり;
P*は、先行するモノマーに対するヌクレオチド間連結または3’末端基を表わし;
R4*およびR2*は一緒になって、−C(RaRb)−、−C(Ra)=C(Rb)−、−C(Ra)=N−、−O−、−Si(Ra)2−、−S−、−SO2−、−N(Ra)−および>C=Zから選択される1〜4基/原子からなるビラジカルを表わし、
ここでZは、−O−、−S−、および−N(Ra)−から選択され、RaおよびRbは各々独立して、水素、随意的に置換されたC1−12−アルキル、随意的に置換されたC2−12−アルケニル、随意的に置換されたC2−12−アルキニル、ヒドロキシ、C1−12−アルコキシ、C2−12−アルコキシアルキル、C2−12−アルケニルオキシ、カルボキシ、C1−12−アルコキシカルボニル、C1−12−アルキルカルボニル、ホルミル、アリール、アリールオキシ−カルボニル、アリールオキシ、アリールカルボニル、ヘテロアリール、ヘテロアリールオキシ−カルボニル、ヘテロアリールオキシ、ヘテロアリールカルボニル、アミノ、モノ−およびジ(C1−6−アルキル)アミノ、カルバモイル、モノ−およびジ(C1−6−アルキル)−アミノ−カルボニル、アミノ−C1−6−アルキル−アミノカルボニル、モノ−およびジ(C1−6−アルキル)アミノ−C1−6−アルキル−アミノカルボニル、C1−6−アルキル−カルボニルアミノ、カルバミド、C1−6−アルカノイルオキシ、スルホノ、C1−6−アルキルスルホニルオキシ、ニトロ、アジド、スルファニル、C1−6−アルキルチオ、ハロゲン、DNAインターカレーター、光化学的活性基、熱化学的活性基、キレート化基、リポーター基およびリガンドから選択され、ここでアリールおよびヘテロアリールは随意的に置換されていてよく、2つのジェミナル置換基RaおよびRbは一緒になって、随意的に置換されたメチレン(=CH2)を表わしてよく、
存在する置換基R1*、R2、R3、R5、R5*、R6およびR6*の各々は、独立して、水素、随意的に置換されたC1−12−アルキル、随意的に置換されたC2−12−アルケニル、随意的に置換されたC2−12−アルキニル、ヒドロキシ、C1−12−アルコキシ、C2−12−アルコキシアルキル、C2−12−アルケニルオキシ、カルボキシ、C1−12−アルコキシカルボニル、C1−12−アルキルカルボニル、ホルミル、アリール、アリールオキシ−カルボニル、アリールオキシ、アリールカルボニル、ヘテロアリール、ヘテロアリールオキシ−カルボニル、ヘテロアリールオキシ、ヘテロアリールカルボニル、アミノ、モノ−およびジ(C1−6−アルキル)アミノ、カルバモイル、モノ−およびジ(C1−6−アルキル)−アミノ−カルボニル、アミノ−C1−6−アルキル−アミノカルボニル、モノ−およびジ(C1−6−アルキル)アミノ−C1−6−アルキル−アミノカルボニル、C1−6−アルキル−カルボニルアミノ、カルバミド、C1−6−アルカノイルオキシ、スルホノ、C1−6−アルキルスルホニルオキシ、ニトロ、アジド、スルファニル、C1−6−アルキルチオ、ハロゲン、DNAインターカレーター、光化学的活性基、熱化学的活性基、キレート化基、リポーター基およびリガンドから選択され、ここでアリールおよびヘテロアリールは随意的に置換されていてよく、2つのジェミナル置換基は一緒になって、オキソ、チオキソ、イミノまたは随意的に置換されたメチレンを表わしてよく、そうでなければ一緒になって、−O−、−S−および−(NRN)−から選択される1つ以上のヘテロ原子/基により随意的に中断および/または終結されている1〜5個の炭素原子アルキレン鎖からなるスピロ・ビラジカルを形成してよく、式中RNは水素およびC1−4−アルキルから選択され、2つの隣接する(非ジェミナル)置換基は2重結合をもたらすさらなる結合を表わしていてよく、RN*が存在しかつビラジカルに関与していない場合、それは水素およびC1−4−アルキル、そしてその塩基性塩および酸付加塩から選択される。
「チオ−LNA」という用語は、上記の一般構造式におけるYが、Sまたは−CH2−S−から選択されているロックされた核酸塩基(LNA)を含む。チオ−LNAは、β−Dおよびα−L−立体配置の両方であり得る。
オリゴマー化合物は、翻訳の立体障害またはその他の方法などによる標的mRNAの非RNase媒介型の分解を介して機能し得ると認識されているが、本発明の好ましいオリゴマーには、RNaseHなどのエンドリボヌクレアーゼ(RNase)を採用することができる。
好ましくは、本発明のオリゴマーは、ギャップマーである。ギャップマーオリゴマーは、RNAse、例えばRNAseH、例えば本明細書において領域Bと呼ばれる少なくとも6個または7個のDNAヌクレオチドの領域を採用できるヌクレオチドまたは核酸塩基の隣接ストレッチを含むオリゴマーであり、ここで領域Bは、5’および3’の両方で、ヌクレオチド類似体の領域、例えば親和力増強ヌクレオチド類似体、例えばRNAseを採用することのできるヌクレオチドの隣接ストレッチに対する5’および3’の1〜6個のヌクレオチド類似体によってフランキングされており、これらの領域はそれぞれ領域AおよびCと呼ばれる。
「連結基」または「ヌクレオチド間連結」という用語は、2つのヌクレオチドまたは核酸塩基、2つのヌクレオチド類似体、およびヌクレオチドおよびヌクレオチド類似体などを合わせて共有結合によりカップリングさせることのできる基を意味するように意図されている。具体的なおよび好ましい例としては、リン酸基およびホスホロチオエート基が含まれる。
本明細書中で提供される、適切な硫黄(S)含有連結基が好ましいであろう。特にギャップマーのギャップ領域(B)については、ホスホロチオエート連結基も同様に好ましい。ホスホロチオエート連結は、フランキング領域(適宜、AおよびC、そしてAまたはCをDに連結するため、および領域D内)に使用してもよい。
本発明のオリゴマーは、表2に示されているように、配列番号133〜152からなる群より選択されてよい。
本明細書に関連して、「複合体」という用語は、1つ以上の非ヌクレオチド/非ヌクレオチド類似体(すなわち非核酸塩基)または非ポリヌクレオチド部分に対する本明細書中に記載されているオリゴマーの共有結合による連結(「複合」)によって形成された非相同分子を表わすことが意図されている。非ヌクレオチドまたは非ポリヌクレオチド部分の例としては、タンパク質、脂肪酸鎖、糖残基、糖タンパク質、ポリマーまたはそれらの組合せなどの高分子作用物質が含まれる。典型的には、タンパク質は標的タンパク質のための抗体であってよい。典型的ポリマーは、ポリエチレングリコールであってよい。
本明細書中で使用される「活性化オリゴマー」という用語は、本明細書中に記述されている複合体を形成するため、1つ以上の複合化部分すなわちそれ自体核酸またはモノマーでない部分に対するオリゴマーの共有結合による連結を可能にする少なくとも1つの官能部分に対し共有結合により連結されている(すなわち官能化されている)本発明のオリゴマーを意味する。典型的には、官能部分は、例えばアデニン塩基の環外NH2基または3’−ヒドロキシル基を介してオリゴマーに共有結合できる化学基、好ましくは親水性であるスペーサ、そして複合化部分に対して結合できる末端基(例えばアミノ、スルフヒドリルまたはヒドロキシル基)を含む。一部の実施形態においては、この末端基は保護されておらず、例えばNH2基である。その他の実施形態においては、末端基は例えば、Theodora W GreeneおよびPeter G M Wutsによる「Protective Groups in Organic Synthesis」,3rd edition (John Wiley & Sons,1999)に記載されているものなど、任意の適切な保護基によって保護される。適切なヒドロキシル保護基の例としては、エステル、例えば酢酸エステル、アラルキル基、例えばベンジル、ジフェニルメチル、またはトリフェニルメチルおよびテトラヒドロピラニルが含まれる。適切なアミノ保護基の例としては、ベンジル、α−メチルベンジル、ジフェニルメチル、トリフェニルメチル、ベンジルオキシカルボニル、tert−ブトキシカルボニル、およびアシル基、例えばトリクロロアセチルまたはトリフルオロアセチルが含まれる。一部の実施形態においては、官能部分は自己開裂性である。その他の実施形態においては、官能部分は生物分解性である。例えば、その全体が参照することにより本明細書に援用される米国特許第7,087,229号明細書を参照のこと。
本発明のオリゴマーは、医薬調合物および組成物中に使用してもよい。適切には、かかる組成物は、薬学的に許容される希釈剤、担体、塩またはアジュバントを含む。国際公開第2007/031091号パンフレットは、適切でかつ好ましい薬学的に許容できる希釈剤、担体およびアジュバントを提供しており、これらは参照することにより本明細書に援用される。適切な投薬量、調合物、投与経路、組成物、剤形、その他の治療薬との組合せ、プロドラッグ調合物も同様に、国際公開第2007/031091号パンフレットに提供されており、これらも同じく参照することにより本明細書に援用される。
本発明のオリゴマーは、例えば診断、治療および予防のための研究用試薬として利用されてよい。
本明細書中で言及されている疾患はさまざまな実施形態において、過剰増殖性疾患、例えば癌、例えば結腸直腸癌、肝細胞癌、子宮内膜癌、悪性黒色腫、卵巣癌、膵臓癌、下垂体癌、食道癌、肺癌、乳癌、腎臓癌、造血系癌、子宮頸癌、CNS(中枢神経系)癌、骨癌、胆道癌および副腎癌からなる群より選択される癌からなる群より選択される。
以下の実施形態も同様に、本発明の詳細な説明および概要に関連しており、特許請求の範囲で言及されている実施形態を含めて、詳細な説明および概要において言及される本発明の実施形態と以下の実施形態を組合せてよい:
1. 配列番号173のβ−カテニン遺伝子またはその対立遺伝子の標的配列に結合し、β−カテニンの発現をダウンレギュレートすることができ、標的配列に対応する10〜50個の核酸塩基の配列を含む、アンチセンスオリゴヌクレオチド(例えばオリゴマー)。
LNAモノマー構築ブロックおよび誘導体を、以下の公開された方法およびその中で引用されている参考文献にしたがって調製した。国際公開第07/031081号パンフレットおよびその中に引用されている参考文献を参照のこと。
オリゴヌクレオチドを、国際公開第07/031081号パンフレットに記載される方法にしたがって合成した。表1は、本発明のアンチセンスオリゴヌクレオチドモチーフの例を示す。
本発明に従い、一連のオリゴヌクレオチドを、本明細書中に配列番号173として提示されている公開された配列Gen Bank登録番号NM_001904を用いてヒトβ−カテニンの異なる領域を標的とするように設計した。
標的核酸発現に対するアンチセンスオリゴヌクレオチドの効果は、標的核酸が測定可能なレベルで存在することを条件として、さまざまな細胞型のいずれにおいてもテストすることができる。標的は内生的に、または、この核酸をコードする核酸の過渡的または安定したトランスフェクションによって発現され得る。標的核酸の発現レベルは、例えばノーザンブロット分析、実時間PCR、リボヌクレアーゼ保護アッセイを用いて、定型的に判定され得る。例示を目的として以下の細胞型が提供されるが、選択される細胞型の中で標的が発現されることを条件として、その他の細胞型を定型として使用することができる。
トランスフェクションビヒクルとしてカチオンリポソーム調合物Lipofect AMINE 2000(Gibco)を用いて、オリゴヌクレオチドで細胞を処理した。6ウェルの細胞培養平板(NUNC)に細胞を塗沫し、集密性が75〜90%になった時点で処理した。使用したオリゴヌクレオチド濃度は、1nM〜25nMの範囲の最終濃度であった。無血清OptiMEM(Gibco)およびLipofectAMINE 2000の10μg/mLという最終脂質濃度を用いて本質的にメーカーが記述する通りにオリゴヌクレオチド−脂質複合体の調合を実施した。細胞を4時間37℃でインキュベートし、オリゴヌクレオチド含有培地を除去することで処理を停止させた。細胞を洗浄し、血清含有培地を添加した。オリゴヌクレオチド処理の後、細胞を20時間回復させてからRNA分析のために収穫した。
細胞系からRNAを単離するために、RNeasyミニキット(Qiagenカタログ番号74104)を、メーカーにより提供されたプロトコルにしたがって使用した。
β−カテニン発現のアンチセンス調節を、当該技術分野において公知のさまざまな方式でアッセイすることができる。例えば、β−カテニンmRNAレベルを例えばノーザンブロット分析、競合ポリメラーゼ連鎖反応(PCR)、または実時間PCRによって定量化することができる。現在では、実時間定量PCRが好まれている。RNA分析は、全細胞RNAまたはmRNAについて実施できる。RNA単離およびRNA分析の方法、例えばノーザンブロット分析が、当該技術分野において定型であり例えばCurrent Protocols in Molecular Biology,John Wiley and Sonsの中で教示されている。
ヒトβ−カテニンmRNAの試料含有量を、ヒトβ−カテニンABI Prism Pre−Developed TaqMan Assay Reagent(Applied Biosystems cat.no.Hs00170025_m1)を用いて、メーカーの使用説明書にしたがって定量化した。
実施例8で記述されている通りに実施された最初の鎖の合成から得られたcDNAを2〜20倍に希釈し、Applied Biosystems社製のTaqman 7500EASTを用いて実時間定量PCRによって分析した。プライマおよびプローブを2倍のTaqman Fast Universal PCR master mix(2x)(Applied Biosystems社、カタログ番号4364103)と混合し、10μlの最終体積になるまで4μlのcDNAに添加した。各試料を、トリプリケートで分析した。関心対象のRNAを発現する細胞系から精製した材料上で調製されたcDNAの2倍希釈物をアッセイすることによって、アッセイについての標準曲線が生成された。無鋳型対照については、cDNAに代って無菌H2Oを使用した。PCRプログラム:30分間95℃とそれに続けて95℃3秒、60℃30秒の40サイクル。標的mRNA配列の相対数量を、Applied Biosystems Fast System SDS Software Version 1.3.1.21.を用いて計算上の閾値サイクルから決定した。
表2からのオリゴヌクレオチドを、SW480細胞において1、5および25nMの濃度でβ−カテニンmRNAをノックダウンするそれらの潜在性について評価した(図2を参照のこと)。データは、表4中に、5nMでモックトランスフェクトされた細胞との関係におけるβ−カテニンmRNAのダウンレギュレーション百分率として提示されている。小文字はDNA単位を表わし、ボールド体の大文字はβ−D−オキシ−LNA単位を表わす。すべてのLNACは5’メチルCである。下付き文字「s」はホスホロチエート連結を表わす。
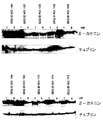
トランスフェクションを受けた細胞のβ−カテニンタンパク質レベルに対するオリゴマー化合物のインビトロ効果を、ウェスタンブロット法により判定した。実施例5で記載されている通りにオリゴヌクレオチドでのトランスフェクションを受けた200,000個のSW480細胞を回収し、プロテアーゼ阻害物質カクテル(Roche)で補充されたRIPA溶解緩衝液(50mMのトリス−HCl pH7.4、150mMのNacl、1mMのEDTA、1%のトリトンX−100、0.1%のSDS、1%のデオキシコール酸ナトリウム)中にこれを溶解させた。全タンパク質濃度を、BCAタンパク質アッセイキット(Pierce社製)を用いて測定した。3〜8%のトリスアセテートゲル上に50μgの全タンパク質を走らせ、製造元(Invitrogen社)の使用説明書にしたがってPVDF膜上でブロットした。遮断緩衝液(5%の低脂肪粉乳を補充したPBS−T)中で一晩インキュベートした後、抗β−カテニン抗体(BD Transduction laboratories社製)と共に膜を一晩インキュベートした。負荷対照として、Neo markerから得られたモノクローナル抗体を用いてチュブリンを検出した。その後、膜を二次抗体と共にインキュベートし、β−カテニンまたはチュブリンタンパク質を、化学発光ECL+検出キット(Amersham社製)を用いて視覚化した。図3を参照のこと。
HCT116結腸直腸癌細胞を、トランスフェクションの前日に、6ウェル平板内でMcCoyの5a修正培地(Sigma社製M8403)+2mMのGlutamax I(Gibco社製35050−038)+10%のFBS(Brochrom社製#193575010)+25μg/μlのGentamicin(Sigma社製G1397 50mg/ml)中で、1ウェルあたり200,000細胞の密度まで塗沫した。翌日、培地を除去しその後、7.5μg/mlのLipofectamine 2000(Invitrogen社製)を含有する1.2mlのOptiMEMを添加した。7分間細胞をインキュベートしてから、OptiMEM中に希釈した0.3mlのオリゴヌクレオチドを添加した。最終オリゴヌクレオチド濃度は25nMであった。4時間の処理後、培地を除去し、細胞をトリプシン処理し、100μlのMcCoyの5a修正培地(Sigma社製M8403)+2mMのGlutamax I(Gibco社製35050−038)+10%のFBS(Brochrom社製#193575010)+25μg/μlのGentamicin(Sigma社製G1397 50mg/ml)中において、透明な96ウェル平板(Scientific Orange社製no.1472030100)内で1ウェルあたり5000細胞の密度に塗沫した。10μlのテトラゾリウム化合物[3−(4,5−ジメチル−2−イル)−5−(3−カルボキシメトシキフェニル)−2−(4−スルホフェニル)−2H−テトラゾリウム、内部塩;MTS]および電子結合試薬(フェナジンエトスルフェート;PES)(CellTiter 96(登録商標)AQueous One Solution Cell Proliferation Assay,Promega社製)を添加することにより、指示された時点で生存細胞を測定した。Powerwave(Biotek Instruments社製)において490nmで生存細胞を測定した。OD490nmを時間数(時間単位)に対しプロットした(図4参照)。
連続三日間、25mg/kgのオリゴヌクレオチド(配列番号156、158、168、169、171)をNMRIマウスに静脈内投薬した(群の大きさはマウス5匹)。0.9%の生理食塩水(NaCl)中にアンチセンスオリゴヌクレオチドを溶解させた。最終投薬から24時間後に動物を屠殺し、肝臓組織の試料を採取し、その後のRNA抽出およびQPCR分析までRNA中に保管した。全RNAを抽出し、肝臓試料内のβ−カテニンmRNA発現を、マウスβ−カテニンQPCRアッセイ(カタログ番号Mm00483033_m1、Applied Biosystems社製)を用いて実施例7で記載されている通りにQPCRにより測定した。結果をマウスGAPDH(カタログ番号4352339E、Applied Biosystems社製)に対し正規化し、生理食塩水で処理した対照との関係においてプロットした。図5を参照のこと。
遮断基、例えばFmocで遮断されたヘキサン−1−アミンなどのアミノアルキル基を、定型ホスホラミダイト化学反応を用いてオリゴマーの5’リン酸基に連結させ、得られた化合物を酸化させ、それを脱保護し、精製して以下の構造式(I)をもつ官能化オリゴマーを達成することにより、5’末端で官能化させる:
Claims (18)
- 合計10〜24個の核酸塩基の隣接した核酸塩基配列を含む、長さが10〜25個の核酸塩基のオリゴマーであって、
i)前記隣接した核酸塩基配列が、配列番号192および配列番号89からなる群より選択される配列の対応領域に対して100%の相同性を有するか、または
ii)前記隣接した核酸塩基配列が、配列番号192および配列番号189からなる群より選択される配列の対応領域に対して単一のミスマッチしか含まない、
オリゴマー。 - 合計10〜50個の核酸塩基の隣接した核酸塩基配列を含む、長さが10〜50個の核酸塩基のオリゴマーであって、
前記隣接した核酸塩基配列が、哺乳動物β−カテニン遺伝子またはmRNAに対応する領域に対して少なくとも80%の相同性を有する、
オリゴマー。 - 前記隣接した核酸塩基配列が、配列番号1〜132および配列番号174〜193からなる群より選択される配列に対応する領域に対して少なくとも80%の相同性を有することを特徴とする請求項1または2記載のオリゴマー。
- 前記隣接した核酸塩基配列が、配列番号173の対応領域とのミスマッチを含まないか、あるいは1個または2個しか含まないことを特徴とする請求項1〜3いずれか1項記載のオリゴマー。
- 前記オリゴマーの核酸塩基配列が、前記隣接した核酸塩基配列からなることを特徴とする請求項1〜4いずれか1項記載のオリゴマー。
- 前記隣接した核酸塩基配列が、長さが10〜18個のヌクレオチドであることを特徴とする請求項1〜5いずれか1項記載のオリゴマー。
- 前記隣接した核酸塩基配列が、ヌクレオチド類似体を含むことを特徴とする請求項1〜6いずれか1項記載のオリゴマー。
- 前記ヌクレオチド類似体が、糖修飾ヌクレオチドであることを特徴とする請求項7記載のオリゴマー。
- 前記ヌクレオチド類似体がLNAであることを特徴とする請求項7記載のオリゴマー。
- ギャップマーであることを特徴とする請求項7〜9いずれか1項記載のオリゴマー。
- β−カテニン遺伝子またはmRNAを発現している細胞において、前記β−カテニン遺伝子またはmRNAの発現を阻害することを特徴とする請求項1〜10いずれか1項記載のオリゴマー。
- 前記オリゴマーが配列番号133〜174からなる群より選択されることを特徴とする請求項1〜11いずれか1項記載のオリゴマー。
- 請求項1〜12いずれか1項記載のオリゴマーと、
前記オリゴマーに共有結合した少なくとも1つの非ヌクレオチドまたは非ポリヌクレオチド部分と
を含む複合体。 - 請求項1〜12いずれか1項記載のオリゴマー、または請求項13記載の複合体と、
薬学的に許容される希釈剤、担体、塩またはアジュバントと
を含む医薬組成物。 - 薬剤として使用するための、請求項1〜12いずれか1項記載のオリゴマーまたは請求項13記載の複合体。
- 過剰増殖性疾患の治療用の薬剤を製造するための、請求項1〜12いずれか1項記載のオリゴマーまたは請求項13記載の複合体の使用方法。
- 過剰増殖性疾患の治療方法であって、
請求項1〜12いずれか1項記載のオリゴマー、または請求項13記載の複合体、または請求項14記載の医薬組成物を、過剰増殖性疾患を患っているか、患う可能性の高い患者に投与するステップを有してなる方法。 - β−カテニンを発現している細胞におけるβ−カテニンを阻害する方法であって、
前記細胞においてβ−カテニンを阻害するように、前記細胞に対して請求項1〜12いずれか1項記載のオリゴマーまたは請求項13記載の複合体を投与するステップを有してなる方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US91537107P | 2007-05-01 | 2007-05-01 | |
| US2324408P | 2008-01-24 | 2008-01-24 | |
| PCT/EP2008/055365 WO2008132234A2 (en) | 2007-05-01 | 2008-04-30 | Rna antagonist compounds for the modulation of beta-catenin |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014125205A Division JP2014209915A (ja) | 2007-05-01 | 2014-06-18 | β−カテニンを調節するためのRNAアンタゴニスト化合物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010524486A true JP2010524486A (ja) | 2010-07-22 |
| JP2010524486A5 JP2010524486A5 (ja) | 2011-07-14 |
Family
ID=39926160
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010504745A Pending JP2010524486A (ja) | 2007-05-01 | 2008-04-30 | β−カテニンを調節するためのRNAアンタゴニスト化合物 |
| JP2014125205A Abandoned JP2014209915A (ja) | 2007-05-01 | 2014-06-18 | β−カテニンを調節するためのRNAアンタゴニスト化合物 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014125205A Abandoned JP2014209915A (ja) | 2007-05-01 | 2014-06-18 | β−カテニンを調節するためのRNAアンタゴニスト化合物 |
Country Status (15)
| Country | Link |
|---|---|
| US (4) | US20090005335A1 (ja) |
| EP (1) | EP2152879B1 (ja) |
| JP (2) | JP2010524486A (ja) |
| KR (1) | KR20100024399A (ja) |
| CN (1) | CN101842483A (ja) |
| AU (1) | AU2008244211B2 (ja) |
| CA (1) | CA2685444A1 (ja) |
| DK (1) | DK2152879T3 (ja) |
| EA (1) | EA018986B1 (ja) |
| ES (1) | ES2399371T3 (ja) |
| IL (1) | IL201865A0 (ja) |
| MX (1) | MX2009011878A (ja) |
| NZ (1) | NZ581200A (ja) |
| TW (1) | TW200848077A (ja) |
| WO (1) | WO2008132234A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015503608A (ja) * | 2012-01-09 | 2015-02-02 | ノバルティス アーゲー | ベータ−カテニン関連疾患を処置するための有機組成物 |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2008244211B2 (en) * | 2007-05-01 | 2014-08-21 | Santaris Pharma A/S | RNA antagonist compounds for the modulation of beta-catenin |
| US9040493B2 (en) | 2009-07-15 | 2015-05-26 | Santaris Pharma A/S | RNA antagonists targeting GLI2 for the treatment of leukemia |
| WO2012006243A2 (en) | 2010-07-06 | 2012-01-12 | Dicerna Pharmaceuticals, Inc. | Methods and compositions for the specific inhibition of beta-catenin by double-stranded rna |
| US9920317B2 (en) | 2010-11-12 | 2018-03-20 | The General Hospital Corporation | Polycomb-associated non-coding RNAs |
| AU2011325956B2 (en) | 2010-11-12 | 2016-07-14 | The General Hospital Corporation | Polycomb-associated non-coding RNAs |
| EP2776566A4 (en) * | 2011-11-11 | 2014-09-17 | Santaris Pharma As | COMPOUNDS FOR MODULATING BETA-CATENIN EXPRESSION AND USES THEREOF |
| AU2013262663A1 (en) | 2012-05-16 | 2015-01-22 | The General Hospital Corporation D/B/A Massachusetts General Hospital | Compositions and methods for modulating gene expression |
| US10837014B2 (en) | 2012-05-16 | 2020-11-17 | Translate Bio Ma, Inc. | Compositions and methods for modulating SMN gene family expression |
| EA201492116A1 (ru) | 2012-05-16 | 2015-05-29 | Рана Терапьютикс, Инк. | Композиции и способы для модулирования экспрессии mecp2 |
| BR112015010116A2 (pt) | 2012-11-15 | 2017-08-22 | Roche Innovation Ct Copenhagen As | COMPOSTOS CONJUGADOS ANTI-SENTIDO ANTI-ApoB |
| EP2951305B1 (en) * | 2013-01-30 | 2018-08-15 | F.Hoffmann-La Roche Ag | Lna oligonucleotide carbohydrate conjugates |
| US9506030B2 (en) | 2013-05-01 | 2016-11-29 | Regulus Therapeutics Inc. | Compounds and methods for enhanced cellular uptake |
| TW201446791A (zh) | 2013-05-01 | 2014-12-16 | Regulus Therapeutics Inc | 用於調節mir-122之微小rna化合物及方法 |
| EP3036602A4 (en) | 2013-08-22 | 2017-04-12 | Hewlett-Packard Development Company, L.P. | Projective computing system |
| TWI657755B (zh) * | 2013-12-30 | 2019-05-01 | Philip Morris Products S. A. | 包含隔熱可燃熱源之煙品 |
| CN106470699A (zh) | 2014-02-03 | 2017-03-01 | 耶路撒冷希伯来大学的益生研究开发有限公司 | 使用酪蛋白激酶i抑制剂以消耗干细胞的用途 |
| EP3212824A4 (en) | 2014-10-30 | 2018-08-08 | The General Hospital Corporation | Methods for modulating atrx-dependent gene repression |
| EP3271460A4 (en) | 2015-03-17 | 2019-03-13 | The General Hospital Corporation | INTERACTOME RNA OF COMPLEX REPRESSIVE POLYCOMB 1 (PRC1) |
| WO2018093919A1 (en) * | 2016-11-15 | 2018-05-24 | City Of Hope | Methods for intracellular delivery and enhanced gene targeting |
| EP3790972A1 (en) | 2018-05-08 | 2021-03-17 | Regulus Therapeutics Inc. | Galnac conjugated modified oligonucleotide as mir-122 inhibitor having hcv antiviral activity with reduced hyperbilirubinemia side-effect |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001000872A1 (en) * | 1999-06-25 | 2001-01-04 | Isis Pharmaceuticals, Inc. | Antisense modulation of beta catenin expression |
| WO2003031937A2 (en) * | 2001-10-12 | 2003-04-17 | Morphotek, Inc. | Genetic hypermutability of plants for gene discovery and diagnosis |
| JP2006507841A (ja) * | 2002-11-14 | 2006-03-09 | ダーマコン, インコーポレイテッド | 機能的siRNAおよび超機能的siRNA |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4914210A (en) | 1987-10-02 | 1990-04-03 | Cetus Corporation | Oligonucleotide functionalizing reagents |
| US4962029A (en) | 1987-10-02 | 1990-10-09 | Cetus Corporation | Covalent oligonucleotide-horseradish peroxidase conjugate |
| US6617442B1 (en) | 1999-09-30 | 2003-09-09 | Isis Pharmaceuticals, Inc. | Human Rnase H1 and oligonucleotide compositions thereof |
| US20030064384A1 (en) * | 2001-04-02 | 2003-04-03 | Mien-Chie Hung | Beta-catenin is a strong and independent prognostic factor for cancer |
| US7087229B2 (en) | 2003-05-30 | 2006-08-08 | Enzon Pharmaceuticals, Inc. | Releasable polymeric conjugates based on aliphatic biodegradable linkers |
| US7687617B2 (en) | 2002-11-18 | 2010-03-30 | Santaris Pharma A/S | Oligonucleotides with alternating segments of locked and non-locked nucleotides |
| JP5209204B2 (ja) * | 2003-04-13 | 2013-06-12 | エンゾン ファーマスーティカルズ インコーポレイテッド | ポリマーオリゴヌクレオチドプロドラッグ |
| US20050136395A1 (en) * | 2003-05-08 | 2005-06-23 | Affymetrix, Inc | Methods for genetic analysis of SARS virus |
| US20070009899A1 (en) * | 2003-10-02 | 2007-01-11 | Mounts William M | Nucleic acid arrays for detecting gene expression in animal models of inflammatory diseases |
| US20090118213A1 (en) | 2005-09-15 | 2009-05-07 | Henrik Frydenlund Hansen | Rna antagonist compounds for the inhibition of apo-b100 expression |
| WO2007031091A2 (en) | 2005-09-15 | 2007-03-22 | Santaris Pharma A/S | Rna antagonist compounds for the modulation of p21 ras expression |
| EP2015758B1 (en) | 2006-05-05 | 2014-04-02 | Isis Pharmaceuticals, Inc. | Compounds and methods for modulating expression apob |
| JP2010503707A (ja) | 2006-09-15 | 2010-02-04 | エンゾン ファーマスーティカルズ インコーポレイテッド | オリゴヌクレオチドの送達を目的としたヒンダードエステル系生体分解性リンカー |
| MX2009002856A (es) | 2006-09-15 | 2009-03-30 | Enzon Pharmaceuticals Inc | Conjugados polimericos que contienen porciones cargadas positivamente. |
| EP2090127A2 (en) | 2006-10-30 | 2009-08-19 | Nokia Corporation | Method, apparatus and system providing operator controlled mobility for user equipment |
| AU2008244211B2 (en) * | 2007-05-01 | 2014-08-21 | Santaris Pharma A/S | RNA antagonist compounds for the modulation of beta-catenin |
-
2008
- 2008-04-30 AU AU2008244211A patent/AU2008244211B2/en not_active Ceased
- 2008-04-30 JP JP2010504745A patent/JP2010524486A/ja active Pending
- 2008-04-30 EA EA200971013A patent/EA018986B1/ru not_active IP Right Cessation
- 2008-04-30 WO PCT/EP2008/055365 patent/WO2008132234A2/en active Application Filing
- 2008-04-30 KR KR1020097025006A patent/KR20100024399A/ko not_active Application Discontinuation
- 2008-04-30 NZ NZ581200A patent/NZ581200A/en not_active IP Right Cessation
- 2008-04-30 DK DK08749943.0T patent/DK2152879T3/da active
- 2008-04-30 EP EP08749943A patent/EP2152879B1/en active Active
- 2008-04-30 MX MX2009011878A patent/MX2009011878A/es active IP Right Grant
- 2008-04-30 US US12/113,031 patent/US20090005335A1/en not_active Abandoned
- 2008-04-30 CN CN200880022871A patent/CN101842483A/zh active Pending
- 2008-04-30 TW TW097116039A patent/TW200848077A/zh unknown
- 2008-04-30 ES ES08749943T patent/ES2399371T3/es active Active
- 2008-04-30 CA CA002685444A patent/CA2685444A1/en not_active Abandoned
-
2009
- 2009-01-21 US US12/356,923 patent/US7915401B2/en not_active Expired - Fee Related
- 2009-11-01 IL IL201865A patent/IL201865A0/en unknown
-
2010
- 2010-09-02 US US12/874,668 patent/US8039446B2/en not_active Expired - Fee Related
-
2011
- 2011-09-14 US US13/232,123 patent/US20120004288A1/en not_active Abandoned
-
2014
- 2014-06-18 JP JP2014125205A patent/JP2014209915A/ja not_active Abandoned
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001000872A1 (en) * | 1999-06-25 | 2001-01-04 | Isis Pharmaceuticals, Inc. | Antisense modulation of beta catenin expression |
| WO2003031937A2 (en) * | 2001-10-12 | 2003-04-17 | Morphotek, Inc. | Genetic hypermutability of plants for gene discovery and diagnosis |
| JP2006507841A (ja) * | 2002-11-14 | 2006-03-09 | ダーマコン, インコーポレイテッド | 機能的siRNAおよび超機能的siRNA |
Non-Patent Citations (5)
| Title |
|---|
| ANN SURG ONCOL, vol. 12, no. 9, JPN6013012203, 2005, pages 733 - 742, ISSN: 0002482597 * |
| CANCER RES, vol. 61, JPN6013012197, 2001, pages 6563 - 6568, ISSN: 0002482594 * |
| EUR J CANCER, vol. 40, JPN6013012201, 2004, pages 1441 - 1452, ISSN: 0002482596 * |
| J SURG RES, vol. 101, JPN6013012199, 2001, pages 16 - 20, ISSN: 0002482595 * |
| J THORAC CARDIOVASC SURG, vol. 127, JPN6013012194, 2004, pages 92 - 98, ISSN: 0002482593 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015503608A (ja) * | 2012-01-09 | 2015-02-02 | ノバルティス アーゲー | ベータ−カテニン関連疾患を処置するための有機組成物 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2008244211A1 (en) | 2008-11-06 |
| CN101842483A (zh) | 2010-09-22 |
| TW200848077A (en) | 2008-12-16 |
| EP2152879A2 (en) | 2010-02-17 |
| US20090005335A1 (en) | 2009-01-01 |
| AU2008244211B2 (en) | 2014-08-21 |
| EP2152879B1 (en) | 2012-11-14 |
| KR20100024399A (ko) | 2010-03-05 |
| US7915401B2 (en) | 2011-03-29 |
| NZ581200A (en) | 2012-04-27 |
| ES2399371T3 (es) | 2013-03-27 |
| MX2009011878A (es) | 2010-01-25 |
| IL201865A0 (en) | 2011-08-01 |
| DK2152879T3 (da) | 2013-02-18 |
| CA2685444A1 (en) | 2008-11-06 |
| US20090203137A1 (en) | 2009-08-13 |
| WO2008132234A3 (en) | 2009-05-07 |
| JP2014209915A (ja) | 2014-11-13 |
| EA200971013A1 (ru) | 2010-04-30 |
| WO2008132234A4 (en) | 2009-07-09 |
| EA018986B1 (ru) | 2013-12-30 |
| US20120004288A1 (en) | 2012-01-05 |
| WO2008132234A2 (en) | 2008-11-06 |
| US8039446B2 (en) | 2011-10-18 |
| US20110086902A1 (en) | 2011-04-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8039446B2 (en) | Compounds for the modulation of beta-catenin expression | |
| US8450291B2 (en) | RNA antagonist compounds for the modulation of PIK3CA expression | |
| US20120295955A1 (en) | Rna antagonist compounds for the modulation of her3 | |
| US20110124709A1 (en) | Rna antagonists targeting gli2 | |
| US9506060B2 (en) | LNA antisense oligonucleotides for the modulation of Myc expression | |
| EP2440215B1 (en) | New potent anti apob antisense compounds | |
| JP2011505798A (ja) | Mcl−1を調節するためのRNAアンタゴニスト化合物 | |
| US8440809B2 (en) | RNA antagonists targeting Hsp27 | |
| US20120232132A1 (en) | Rna antagonists targeting gli2 for the treatment of leukemia | |
| US20140323557A1 (en) | Compounds for the modulation of beta-catenin expression and uses thereof | |
| AU2014265070A1 (en) | Rna antagonist compounds for the modulation of beta-catenin | |
| US20110224281A1 (en) | Rna antagonists targeting hsp70-2 | |
| WO2012066092A1 (en) | Compounds for the modulation of aurora kinase a expression |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110502 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110502 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130319 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130618 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130625 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130719 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130726 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130819 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140218 |