JP2008528510A - 紅潮および/または薬物誘発性体重増加を処置するためのサーチュイン活性化化合物の使用 - Google Patents
紅潮および/または薬物誘発性体重増加を処置するためのサーチュイン活性化化合物の使用 Download PDFInfo
- Publication number
- JP2008528510A JP2008528510A JP2007552335A JP2007552335A JP2008528510A JP 2008528510 A JP2008528510 A JP 2008528510A JP 2007552335 A JP2007552335 A JP 2007552335A JP 2007552335 A JP2007552335 A JP 2007552335A JP 2008528510 A JP2008528510 A JP 2008528510A
- Authority
- JP
- Japan
- Prior art keywords
- compound
- formula
- sirtuin activating
- further embodiment
- activating compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 0 *c1c(*)c(*)c(C(Ic(c(*)c(*)c(*)c2IC(c3c(*)c(I)c(*)c(*)c3*)=I)c2I)=I)c(*)c1* Chemical compound *c1c(*)c(*)c(C(Ic(c(*)c(*)c(*)c2IC(c3c(*)c(I)c(*)c(*)c3*)=I)c2I)=I)c(*)c1* 0.000 description 5
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/05—Phenols
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/12—Ketones
- A61K31/122—Ketones having the oxygen directly attached to a ring, e.g. quinones, vitamin K1, anthralin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
- A61K31/353—3,4-Dihydrobenzopyrans, e.g. chroman, catechin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/426—1,3-Thiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7048—Compounds having saccharide radicals and heterocyclic rings having oxygen as a ring hetero atom, e.g. leucoglucosan, hesperidin, erythromycin, nystatin, digitoxin or digoxin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/12—Drugs for genital or sexual disorders; Contraceptives for climacteric disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/18—Feminine contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Abstract
本明細書において、サーチュイン(例えばSIRT1またはSir2など)の活性またはレベルをモジュレートすることにより、紅潮および/または体重増加を、処置するか、そして/または予防するための組成物、ならびにその使用を、提供する。例示的な実施形態としては、薬物誘発性体重増加および/または薬物誘発性紅潮に対して反対作用を行なうための、サーチュイン活性化化合物を含有する組成物、およびその使用が、挙げられる。
Description
(関連出願)
本出願は、米国仮特許出願第60/645,962号(2005年1月21日出願)および同第60/645,916号(2005年1月20日出願出願)に対する優先権を主張し、これらの米国出願は、本明細書によってその全体が参考として援用される。
本出願は、米国仮特許出願第60/645,962号(2005年1月21日出願)および同第60/645,916号(2005年1月20日出願出願)に対する優先権を主張し、これらの米国出願は、本明細書によってその全体が参考として援用される。
(背景)
遺伝子のサイレント情報調節因子(Silent Information Regulator)(SIR)ファミリーは、古細菌から種々の真核生物までの範囲にわたる生物体のゲノム内に存在する高度に保存された遺伝子群を表す(非特許文献1)。コードされたSIRタンパク質は、ジーンサイレンシングの調節からDNA修復までの多様なプロセスに関与している。SIR2遺伝子ファミリーの構成員にコードされるタンパク質は、250個のアミノ酸コアドメインにおいて高度な配列保存を示す。このファミリーの充分キャラクタライズされた遺伝子はS.cerevisiae SIR2であり、これは、酵母交配型、テロメア位置効果および細胞加齢を特定する情報を含むHM遺伝子座のサイレンシングに関与している(非特許文献2;Guarente,1999;Shore,2000)。酵母Sir2タンパク質は、ヒストン脱アセチル化酵素のファミリーに属する(非特許文献3;Shore,2000に概説)。Salmonella typhimuriumのSir2ホモログであるCobBは、NAD(ニコチンアミドアデニンジヌクレオチド)依存性ADP−リボシルトランスフェラーゼとしての機能を果たす(TsangおよびEscalante−Semerena,1998)。
遺伝子のサイレント情報調節因子(Silent Information Regulator)(SIR)ファミリーは、古細菌から種々の真核生物までの範囲にわたる生物体のゲノム内に存在する高度に保存された遺伝子群を表す(非特許文献1)。コードされたSIRタンパク質は、ジーンサイレンシングの調節からDNA修復までの多様なプロセスに関与している。SIR2遺伝子ファミリーの構成員にコードされるタンパク質は、250個のアミノ酸コアドメインにおいて高度な配列保存を示す。このファミリーの充分キャラクタライズされた遺伝子はS.cerevisiae SIR2であり、これは、酵母交配型、テロメア位置効果および細胞加齢を特定する情報を含むHM遺伝子座のサイレンシングに関与している(非特許文献2;Guarente,1999;Shore,2000)。酵母Sir2タンパク質は、ヒストン脱アセチル化酵素のファミリーに属する(非特許文献3;Shore,2000に概説)。Salmonella typhimuriumのSir2ホモログであるCobBは、NAD(ニコチンアミドアデニンジヌクレオチド)依存性ADP−リボシルトランスフェラーゼとしての機能を果たす(TsangおよびEscalante−Semerena,1998)。
Sir2タンパク質は、脱アセチル化酵素であり、NADを補因子として利用する(非特許文献4;非特許文献5;Moazed,2001;Tannerら,2000;TannyおよびMoazed,2001)。他の脱アセチル化酵素と異なり、これらの多くは、ジーンサイレンシングに関与しており、Sir2は、トリコスタチンA(TSA)のようなヒストン脱アセチル化酵素阻害剤に対して非感受性である(非特許文献4;非特許文献5;Landryら,2000a)。
Sir2によるアセチル−リシンの脱アセチル化は、NADの加水分解と密接にカップリングしており、ニコチンアミドおよび新規なアセチル−ADPリボース化合物(1−O−アセチル−ADP−リボース)を生成させる(Tannerら,2000;Landryら,2000b;TannyおよびMoazed,2001)。Sir2のNAD依存性脱アセチル化酵素活性は、その生物学的役割を酵母内での細胞性代謝と関連させ得るその機能に不可欠である(非特許文献3;非特許文献4;非特許文献5;Linら,2000)。哺乳動物のSir2ホモログは、NAD依存性ヒストン脱アセチル化酵素活性を有する(非特許文献4;非特許文献5)。Sir2媒介性機能に関する情報のほとんどは、酵母での研究に由来するものである(Gartenberg,2000;Gottschling,2000)。
生化学研究により、Sir2は、ヒストンH3およびH4のアミノ末端テイルを容易に脱アセチル化し、1−O−アセチル−ADP−リボースおよびニコチンアミドの形成をもたらし得ることが示されている。さらなるSIR2コピーを有する系統は、rDNAサイレンシングの増大および30%長い寿命を示す。最近、さらなるsir−2.1(C.elegans SIR2ホモログ)コピーは、該生物体において寿命を大きく延長させることが示された。これは、加齢のSIR2依存性調節経路が、進化において早期に生成され、充分保存されることを示唆する。また、酵母の寿命も後生動物と同様、カロリー制限と似た介入によって延長される。グルコース応答性cAMP(アデノシン3’5’−一リン酸塩)依存性(PKA)経路の活性を低下させる変異により、野生型細胞において寿命が延長されるが、変異型sir2系統では延長されず、これは、SIR2が、カロリー制限経路の重要な下流成分であることを示す。
最近、SIRタンパク質の小分子活性化剤および阻害剤がいくつか報告され(例えば、特許文献1および特許文献2ならびに特許文献3および特許文献4を参照)、このような化合物の使用がいくつか特定されている。例えば、SIRタンパク質の小分子活性化剤は、酵母細胞および培養ヒト細胞において寿命を延長させること、ならびにヒト細胞においてSIRタンパク質活性を活性化することが示された(前掲)。さらに、小分子SIR活性化剤は、Caenorhabditis elegansおよびDrosophila melanogasterにおいて、カロリー制限を模倣し、寿命を延長させることが示された(前掲)。したがって、SIRタンパク質の活性化剤は、真核生物細胞におけるカロリー制限の効果の模倣、および加齢関連疾患、例えば、脳卒中、心血管疾患、関節炎、高血圧またはアルツハイマー病などの処置に有用であり得る(前掲)。さらに、SIRタンパク質の小分子活性化剤であるレスベラトロール、ブテイン、フィセチン、ピセアタンノールおよびケルセチンは、C.elegansにおいて脂肪動員を促進させること、C.elegansにおいて脂肪蓄積を抑制すること、哺乳動物細胞において脂肪動員を刺激すること、および哺乳動物細胞において脂肪生成を阻害することが示された(例えば、特許文献5および特許文献6参照)。同様に、SIRタンパク質の阻害剤であるニコチンアミドは、脂肪蓄積を促進させることが示された(前掲)。さらに、レスベラトロールは、インスリン抵抗性細胞においてインスリン感受性を少なくとも一部回復させることが示された(前掲)。したがって、SIRタンパク質の活性化剤はまた、インスリン抵抗性障害の処置または予防に有用でもあり得、減量または体重増加の抑制と関連する使用が提案されている(前掲)。特許文献1、特許文献2、特許文献3、特許文献4、特許文献5および特許文献6に示された方法および結果のある特定の詳細事項を、SIRの活性化剤および阻害剤の構造および活性のためのさらなる補足として、およびその例示のため、本開示の図面および実験セクションに示す。
米国特許出願公開第2005/0136537号明細書
米国特許出願公開第2005/0096256号明細書
国際公開第2005/002555号パンフレット
国際公開第2005/002672号パンフレット
米国特許出願公開第2005/0171027号明細書
国際公開第2005/065667号パンフレット
Frye,R.A.Biochem Biophys Res Coimmun,2000年,第273号,p.793−8
Kaeberleinら,Genes Dev,1999年,第13号,p.2570−80
Guarente,L.&Kenyon,C.Nature,2000年,第408号,p.255−62
Imaiら,Nature,2000年,第403号,p.795−800
Smithら,Proc Natl Acad Sci USA,2000年,第97号,p.6658−63
(概要)
一態様において、本発明は、紅潮および/またはのぼせを処置または予防するための方法を提供する。該方法は、治療有効量のサーチュイン活性化化合物を、その必要がある被験体に投与することを含んでよい。一実施形態において、紅潮は、閉経期と関連し得る。かかる実施形態において、被験体は、閉経期または閉経後の女性であり得る。別の実施形態において、紅潮は、薬物誘発性紅潮であり得る。一実施形態において、紅潮は、ラロキシフェンの投与と関連し得る。別の実施形態において、紅潮は、抗鬱薬または抗精神病剤の投与と関連する。かかる実施形態において、抗鬱薬または抗精神病剤は、以下:セロトニン再取り込み阻害剤、5HT2受容体拮抗剤、抗痙攣薬、ノルエピネフリン再取り込み阻害剤、α−アドレナリン作用性受容体拮抗薬、NK−3拮抗剤、NK−1受容体拮抗剤、PDE4阻害剤、神経ペプチドY5受容体拮抗剤、D4受容体拮抗剤、5HT1A受容体拮抗剤、5HT1D受容体拮抗剤、CRF拮抗剤、モノアミンオキシダーゼ阻害剤または鎮静催眠薬の1種類以上であり得る。紅潮を誘発し得る例示的なセロトニン再取り込み阻害剤としては、例えば、フルオキセチノイド(fluoxetinoid)、ネファゾドノイド(nefazodonoid)、デュロキセチン、ベンラファキシン、ミルナシプラン、シタロプラム、フルボキサミン、パロキセチンまたはセルトラリンが挙げられる。紅潮を誘発し得る例示的な鎮静催眠薬としては、例えば、ベンゾジアゼピン、ゾルピデムまたはバルビツール酸系が挙げられる。紅潮を誘発し得る例示的な5−HT1A受容体拮抗剤としては、例えば、ブスピロン、フレシノキサン、ゲピロンまたはイプサピロンが挙げられる。紅潮を誘発し得る例示的なノルエピネフリン再取り込み阻害剤としては、例えば、第3級アミン三環系(例えば、アミトリプチリン、クロミプラミン、ドキセピン、イミプラミンもしくはトリミプラミン)または第2級アミン三環系(例えば、アモキサピン、デシプラミン、マプロチリン、ノルトリプチリンもしくはプロトリプチリン)が挙げられる。紅潮を誘発し得る例示的なモノアミンオキシダーゼ阻害剤としては、例えば、イソカルボキサジド、フェネルジン、トラニルシプロミン、セレギリンまたはモクロベマイドが挙げられる。別の実施形態において、紅潮は、化学療法薬、例えば、シクロホスファミドまたはタモキシフェンなどの投与と関連し得る。別の実施形態において、紅潮は、カルシウムチャンネル遮断薬、例えば、アムロジピンなどの投与と関連し得る。別の実施形態において、紅潮は、ニコチン酸の投与と関連し得る。別の実施形態において、紅潮は、抗生物質、例えば、レボフロキサシンなどの投与と関連し得る。紅潮を処置および/または予防するために投与され得る例示的なサーチュイン活性化化合物としては、例えば、レスベラトロール、フィセチン、ブテイン、ピセアタンノールまたはケルセチンが挙げられる。紅潮を処置および/または予防するために投与され得る他の例示的なサーチュイン活性化化合物としては、例えば、式1〜25、30、32〜65または69〜76の化合物が挙げられる。例示的な実施形態において、被験体はヒトである。
一態様において、本発明は、紅潮および/またはのぼせを処置または予防するための方法を提供する。該方法は、治療有効量のサーチュイン活性化化合物を、その必要がある被験体に投与することを含んでよい。一実施形態において、紅潮は、閉経期と関連し得る。かかる実施形態において、被験体は、閉経期または閉経後の女性であり得る。別の実施形態において、紅潮は、薬物誘発性紅潮であり得る。一実施形態において、紅潮は、ラロキシフェンの投与と関連し得る。別の実施形態において、紅潮は、抗鬱薬または抗精神病剤の投与と関連する。かかる実施形態において、抗鬱薬または抗精神病剤は、以下:セロトニン再取り込み阻害剤、5HT2受容体拮抗剤、抗痙攣薬、ノルエピネフリン再取り込み阻害剤、α−アドレナリン作用性受容体拮抗薬、NK−3拮抗剤、NK−1受容体拮抗剤、PDE4阻害剤、神経ペプチドY5受容体拮抗剤、D4受容体拮抗剤、5HT1A受容体拮抗剤、5HT1D受容体拮抗剤、CRF拮抗剤、モノアミンオキシダーゼ阻害剤または鎮静催眠薬の1種類以上であり得る。紅潮を誘発し得る例示的なセロトニン再取り込み阻害剤としては、例えば、フルオキセチノイド(fluoxetinoid)、ネファゾドノイド(nefazodonoid)、デュロキセチン、ベンラファキシン、ミルナシプラン、シタロプラム、フルボキサミン、パロキセチンまたはセルトラリンが挙げられる。紅潮を誘発し得る例示的な鎮静催眠薬としては、例えば、ベンゾジアゼピン、ゾルピデムまたはバルビツール酸系が挙げられる。紅潮を誘発し得る例示的な5−HT1A受容体拮抗剤としては、例えば、ブスピロン、フレシノキサン、ゲピロンまたはイプサピロンが挙げられる。紅潮を誘発し得る例示的なノルエピネフリン再取り込み阻害剤としては、例えば、第3級アミン三環系(例えば、アミトリプチリン、クロミプラミン、ドキセピン、イミプラミンもしくはトリミプラミン)または第2級アミン三環系(例えば、アモキサピン、デシプラミン、マプロチリン、ノルトリプチリンもしくはプロトリプチリン)が挙げられる。紅潮を誘発し得る例示的なモノアミンオキシダーゼ阻害剤としては、例えば、イソカルボキサジド、フェネルジン、トラニルシプロミン、セレギリンまたはモクロベマイドが挙げられる。別の実施形態において、紅潮は、化学療法薬、例えば、シクロホスファミドまたはタモキシフェンなどの投与と関連し得る。別の実施形態において、紅潮は、カルシウムチャンネル遮断薬、例えば、アムロジピンなどの投与と関連し得る。別の実施形態において、紅潮は、ニコチン酸の投与と関連し得る。別の実施形態において、紅潮は、抗生物質、例えば、レボフロキサシンなどの投与と関連し得る。紅潮を処置および/または予防するために投与され得る例示的なサーチュイン活性化化合物としては、例えば、レスベラトロール、フィセチン、ブテイン、ピセアタンノールまたはケルセチンが挙げられる。紅潮を処置および/または予防するために投与され得る他の例示的なサーチュイン活性化化合物としては、例えば、式1〜25、30、32〜65または69〜76の化合物が挙げられる。例示的な実施形態において、被験体はヒトである。
別の態様において、本発明は、少なくとも1種類のサーチュイン活性化化合物および少なくとも1種類の紅潮を誘発する薬物を含む組成物を提供する。例示的なサーチュイン活性化化合物としては、例えば、レスベラトロール、フィセチン、ブテイン、ピセアタンノール、ケルセチンまたは式1〜25、30、32〜65もしくは69〜76の化合物が挙げられる。かかる組成物に使用され得る他のサーチュイン活性化化合物としては、例えば、レスベラトロール、フィセチン、ブテイン、ピセアタンノールまたはケルセチンが挙げられる。ある特定の実施形態において、紅潮を誘発する薬物は、以下:ニコチン酸、ラロキシフェン、抗鬱薬、抗精神病薬、化学療法薬(例えば、シクロホスファミドもしくはタモキシフェン)、カルシウムチャンネル遮断薬(例えば、アムロジピン)、または抗生物質(例えば、レボフロキサシン)の少なくとも1種類である。紅潮を誘発し得る例示的な抗鬱薬としては、例えば、セロトニン再取り込み阻害剤(例えば、フルオキセチノイド、ネファゾドノイド、ドロキセチン、ベンラファキシン、ミルナシプラン、シタロプラム、フルボキサミン、パロキセチンもしくはセルトラリン)、5HT2受容体拮抗剤、抗痙攣薬、ノルエピネフリン再取り込み阻害剤(例えば、第3級アミン三環系(例えば、アミトリプチリン、クロミプラミン、ドキセピン、イミプラミンもしくはトリミプラミンなど)または第2級アミン三環系(例えば、アモキサピン、デシプラミン、マプロチリン、ノルトリプチリンもしくはプロトリプチリンなど))、α−アドレナリン作用性受容体拮抗薬、NK−3拮抗剤、NK−1受容体拮抗剤、PDE4阻害剤、神経ペプチドY5受容体拮抗剤、D4受容体拮抗剤、5HT1A受容体拮抗剤(例えば、ブスピロン、フレシノキサン、ゲピロンもしくはイプサピロン)、5HT1D受容体拮抗剤、CRF拮抗剤、モノアミンオキシダーゼ阻害剤(例えば、イソカルボキサジド、フェネルジン、トラニルシプロミン、セレギリンもしくはモクロベマイド)、または鎮静催眠薬(例えば、ベンゾジアゼピン、ゾルピデムもしくはバルビツール酸系)が挙げられる。例示的な一実施形態において、該組成物は、治療有効量の少なくとも1種類のサーチュイン活性化化合物および治療有効量の少なくとも1種類の紅潮を誘発する薬物を含むものであり得る。
別の態様において、本発明は、薬物誘発性体重増加を処置または予防するための方法を提供する。該方法は、治療有効量のサーチュイン活性化化合物を、その必要がある被験体に投与することを含み得る。例示的な体重増加を誘発し得る薬物としては、例えば、抗糖尿病剤、抗鬱薬、ステロイド、ホルモン、β遮断薬、α遮断薬および避妊薬が挙げられる。例示的な一実施形態において、体重増加は、糖尿病処置薬、例えば、スルホニル尿素、チアゾリジンジオン、メグリチナイド、ナテグリニド、レパグリニドまたはインスリンなどの投与と関連する。別の実施形態において、体重増加は、抗鬱薬、例えば、三環系抗鬱薬、不可逆的モノアミンオキシダーゼ阻害剤(MAOI)、選択的セロトニン再取り込み阻害剤(SSRI)、ブプロピオン、パロキセチンまたはミルタザピンなどの投与と関連する。別の実施形態において、体重増加は、ステロイドまたはホルモンの投与と関連する。別の実施形態において、体重増加は、β遮断薬の投与と関連する。別の実施形態において、体重増加は、α遮断薬の投与と関連する。別の実施形態において、体重増加は、避妊薬の投与と関連する。薬物誘発性体重増加を処置および/または予防するために投与され得る例示的なサーチュイン活性化化合物としては、例えば、レスベラトロール、フィセチン、ブテイン、ピセアタンノールまたはケルセチンが挙げられる。薬物誘発性体重増加を処置および/または予防するために投与され得る他の例示的なサーチュイン活性化化合物としては、例えば、式1〜25、30、32〜65または69〜76の化合物が挙げられる。例示的な一実施形態において、被験体はヒトである。
別の態様において、本発明は、少なくとも1種類のサーチュイン活性化化合物および少なくとも1種類の体重増加を誘発する薬物を含む組成物を提供する。例示的なサーチュイン活性化化合物としては、例えば、レスベラトロール、フィセチン、ブテイン、ピセアタンノール、ケルセチンまたは式1〜25、30、32〜65もしくは69〜76の化合物が挙げられる。ある特定の実施形態において、体重増加を誘発する薬物は、以下:抗糖尿病薬(例えば、スルホニル尿素、チアゾリジンジオン、メグリチナイド、ナテグリニド、レパグリニドもしくはインスリン)、抗鬱薬(例えば、三環系抗鬱薬、不可逆的モノアミンオキシダーゼ阻害剤(MAOI)、選択的セロトニン再取り込み阻害剤(SSRI)、ブプロピオン、パロキセチンもしくはミルタザピン)、ステロイド、ホルモン、β遮断薬、α遮断薬または避妊薬の少なくとも1種類である。例示的な一実施形態において、該組成物は、治療有効量の少なくとも1種類のサーチュイン活性化化合物および治療有効量の少なくとも1種類の体重増加を誘発する薬物を含み得る。
別の態様において、本発明は、例えば、サーチュイン活性化化合物をニコチン酸との組み合わせで使用し、サーチュインタンパク質のレベルまたは活性を増大させるための方法、細胞の寿命を増大させるための方法、ならびに多種多様な疾患および障害(例えば、加齢もしくはストレス、糖尿病、肥満、神経変性疾患、心血管疾患、血液凝固障害、炎症、癌および/または紅潮などと関連する疾患もしくは障害が挙げられる)処置および/または予防するための方法を提供する。該方法は、サーチュイン活性化化合物およびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含む組成物を、その必要がある被験体に投与することを含み得る。一実施形態において、サーチュイン活性化化合物およびニコチン酸は、併用療法の一部として、種々の疾患(例えば、癌、糖尿病、神経変性疾患、心血管疾患、血液凝固、炎症、紅潮、肥満、加齢、ストレスなどが挙げられる)の処置または予防のための1種類以上の治療剤とともに投与され得る。例示的な一実施形態において、被験体はヒトである。
一実施形態において、本発明は、細胞を、サーチュイン活性化化合物およびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含む組成物と接触させることを含む、真核生物細胞の生存を促進させるための方法を提供する。ある特定の実施形態において、該組成物は、該細胞内のSIRT1タンパク質、例えば、哺乳動物SIRT1またはヒトSIRT1のレベルまたは活性の少なくとも一方を増大させる。ある特定の実施形態において、該組成物は、該細胞の寿命を増大させる。ある特定の実施形態において、該組成物は、ストレス、例えば、熱ショック、浸透ストレス、DNA損傷、不充分な塩レベル、不充分な窒素レベルまたは不充分な栄養レベルなどに抵抗する該細胞の能力を増大させる。ある特定の実施形態において、該組成物は、該細胞に対する栄養制限の効果を模倣する。ある特定の実施形態において、該組成物は、SIRT1タンパク質の脱アセチル化酵素活性を増大させる。ある特定の実施形態において、真核生物細胞は哺乳動物細胞である。
別の実施形態において、本発明は、治療有効量のサーチュイン活性化化合物およびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含む組成物を、その必要がある被験体に投与することを含む、被験体において細胞死または加齢と関連する疾患または障害を処置または予防する方法を提供する。ある特定の実施形態において、加齢関連疾患は、脳卒中、心血管疾患、関節炎、高血圧またはアルツハイマー病である。
別の実施形態において、本発明は、治療有効量のサーチュイン活性化化合物およびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含む組成物を、その必要がある被験体に投与することを含む、被験体においてインスリン抵抗性、メタボリックシンドローム、糖尿病もしくはその合併症を処置もしくは予防するための方法、またはインスリン感受性を増大させるための方法を提供する。
別の実施形態において、本発明は、治療有効量のサーチュイン活性化化合物およびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含む組成物を、その必要がある被験体に投与することを含む、被験体の体重を減少させるため、または被験体において体重増加を抑制するための方法を提供する。
別の実施形態において、本発明は、前駆脂肪細胞を、サーチュイン活性化化合物およびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含む組成物と接触させることを含む、前駆脂肪細胞の分化を抑制するための方法を提供する。
別の実施形態において、本発明は、治療有効量のサーチュイン活性化化合物およびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含む組成物を投与することを含む、被験体の寿命を延長させるための方法を提供する。
別の実施形態において、本発明は、治療有効量のサーチュイン活性化化合物およびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含む組成物を、その必要がある被験体に投与することを含む、被験体において神経変性障害を処置または予防する方法を提供する。例示的な神経変性障害としては、例えば、アルツハイマー病(AD)、パーキンソン病(PD)、ハンティングトン病(HD)、筋萎縮性側索硬化症(ALS;ルー・ゲーリグ病)、びまん性レヴィー小体病、舞踏病有棘赤血球増加症、原発性側索硬化症、多発性硬化症(MS)およびフリードライヒ失調症が挙げられる。
別の実施形態において、本発明は、治療有効量のサーチュイン活性化化合物およびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含む組成物を、その必要がある被験体に投与することを含む、被験体において血液凝固障害を処置または予防する方法を提供する。例示的な血液凝固障害としては、例えば、血栓塞栓症、深静脈血栓症、肺動脈塞栓症、脳卒中、心筋梗塞、流産、アンチトロンビンIII欠損と関連する栓友病、プロテインC欠損、プロテインS欠損、活性化されプロテインCに対する抵抗性、異常フィブリノゲン血症、線維素溶解性障害、ホモシスチン尿症、妊娠、炎症性障害、骨髄増殖性障害、動脈硬化、狭心症、播種性血管内凝固症候群、脳卒中、虚血性組織損傷、心虚血、心臓の再灌流傷害、血栓性血小板減少性紫斑病、癌転移、鎌状赤血球症、糸球体腎炎、薬物誘発性血小板減少症、および治療的血餅溶解または血管形成術もしくは外科処置などの手順の間またはその後の再閉塞が挙げられる。
別の態様において、本発明は、少なくとも1種類のサーチュイン活性化化合物およびニコチン酸を含む組成物を提供する。ある特定の実施形態において、本発明は、少なくとも1種類のサーチュイン活性化化合物、ニコチン酸および種々の疾患(例えば、癌、糖尿病、神経変性疾患、心血管疾患、血液凝固、炎症、紅潮、肥満、加齢、ストレスなどが挙げられる)の処置または予防に有用な治療剤を含む医薬組成物を提供する。例示的な一実施形態において、該組成物は、治療有効量のサーチュイン活性化化合物およびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含み得る。例示的なサーチュイン活性化化合物としては、例えば、式1〜25、30、32〜65および69〜76からなる群より選択される式を有する化合物が挙げられる。他のサーチュイン活性化化合物としては、レスベラトロール、フィセチン、ブテイン、ピセアタンノールまたはケルセチンが挙げられる。ある特定の実施形態において、ニコチン酸は、以下のニコチン酸同等物:ニコチニルアルコールの酒石酸エステル、d−ヘキサニコチン酸グルシトール、ニコチン酸アルミニウム、ニセリトロールまたはd,1−α−トコフェリルニコチン酸塩の1種類以上であり得る。ある特定の実施形態において、該組成物は徐放性製剤である。別の実施形態において、本発明は、治療有効量のレスベラトロールおよびニコチン酸またはその薬学的に許容され得る塩もしくはプロドラッグを含む組成物を提供する。
別の態様において、紅潮を処置または予防するための医薬の製造のためのサーチュイン活性化化合物の使用が提供される。
別の態様において、薬物誘発性体重増加を処置または予防するための医薬の製造のためのサーチュイン活性化化合物の使用が提供される。
(詳細な説明)
1.定義
本明細書で用いる場合、以下の用語および語句は、以下に示す意味を有するものとする。特に記載のない限り、本明細書で用いるすべての科学技術用語は、当業者に一般に理解されているものと同じ意味を有する。
1.定義
本明細書で用いる場合、以下の用語および語句は、以下に示す意味を有するものとする。特に記載のない限り、本明細書で用いるすべての科学技術用語は、当業者に一般に理解されているものと同じ意味を有する。
単数形「a」、「an」および「the」は、文脈において、そうでないと明白に記載されていない限り、複数に対する言及を含む。
用語「薬剤」は、本明細書において、化合物、化合物の混合物、生体高分子(核酸、抗体、タンパク質もしくはその部分、例えばペプチドなど)、または生物学的材料、例えば、細菌、植物、真菌もしくは動物(特に、哺乳動物)の細胞もしくは組織などから作製された抽出物を表すために用いる。かかる薬剤の活性により、被験体において局所または全身に作用する生物学的、生理学的または薬理学的に活性な物質(単一もしくは複数)である「治療剤」として適したものとなり得る。
化合物に言及する場合の用語「生物学的利用可能な」は当該技術分野で明確に理解されており、投与される化合物またはその量の一部が、投与された被験体または患者に吸収され、取り込まれ、あるいは生理学的に利用可能となることが許容される化合物の形態をいう。
「サーチュインの生物学的に活性な部分」は、サーチュインタンパク質の生物学的活性(例えば、脱アセチル化する能力など)を有する部分をいう。サーチュインの生物学的に活性な部分は、サーチュインのコアドメインを含み得る。例えば、GenBank受託番号NP_036370を有し、NAD+結合ドメインおよび基質結合ドメインを含むSIRT1の生物学的に活性な部分としては、限定されないが、GenBank受託番号NP_036370のアミノ酸62〜293(これは、GenBank受託番号NM_012238のヌクレオチド237〜932にコードされている)が挙げられ得る。したがって、この領域はコアドメインと呼ばれることがある。SIRT1の他の生物学的に活性な部分(これも、コアドメインと呼ばれることもある)としては、GenBank受託番号NP_036370のアミノ酸261〜447あたり(これは、GenBank受託番号NM_012238ヌクレオチド834〜1394にコードされている);GenBank受託番号NP_036370のアミノ酸242〜493あたり(これは、GenBank受託番号NM_012238のヌクレオチド777〜1532にコードされている);またはGenBank受託番号NP_036370のアミノ酸254〜495あたり(これは、GenBank受託番号NM_012238のヌクレオチド813〜1538にコードされている)が挙げられる。
用語「愛玩動物」は、ネコおよびイヌをいう。本明細書で用いる場合、用語「イヌ(1匹または複数)」は、イヌ科(familiaris)の種(これには、多数の異なる血統がある)の任意の構成員を表す。用語「ネコ(1匹または複数)」は、イエネコを含むネコ科動物およびネコ科の他の構成員、ネコ属をいう。
用語「含む(comprise)」および「含む(comprising)」は、包括的で開いた意義(open sense)で用い、さらなる要素が含まれ得ることを意味する。
用語「保存された残基」は、ある特定の共通の特性を有する一群のアミノ酸の構成員であるアミノ酸をいう。用語「保存的アミノ酸置換」は、かかる群の1つの同じ群の異なるアミノ酸によるアミノ酸の置換(概念的またはその他)をいう。個々のアミノ酸間の共通の特性を規定する機能的な方法は、同種生物体の対応するタンパク質間でアミノ酸変化の標準化した頻度を解析することである(Schulz,G.E.およびR.H.Schirmer.,Principles of Protein Structure,Springer−Verlag)。かかる解析によれば、ある群内のアミノ酸が互いに、選択的に交換されており、したがって、タンパク質構造全体に対するその影響が互いに非常に類似しているアミノ酸の群が規定され得る(Schulz,G.E.およびR.H.Schirmer,Principles of Protein Structure,Springer−Verlag)。この様式で規定される一組のアミノ酸群の一例としては、(i)GluおよびAsp、Lys、ArgおよびHisからなる電荷を有する群、(ii)Lys、ArgおよびHisからなる正の電荷を有する群、(iii)GluおよびAspからなる正の電荷を有する群、(iv)Phe、TyrおよびTrpからなる芳香族群、(v)HisおよびTrpからなる窒素環群、(vi)Val、LeuおよびIleからなる大きな脂肪族無極性群、(vii)MetおよびCysからなるやや極性群、(viii)Ser、Thr、Asp、Asn、Gly、Ala、Glu、GlnおよびProからなる小さな残基群、(ix)Val、Leu、Ile、MetおよびCysからなる脂肪族群、ならびに(x)SerおよびThrからなる小さなヒドロキシル群が挙げられる。
「糖尿病」は、高血糖またはケトアシドーシス、ならびに長期高血糖状態または耐糖能の低下により生じる慢性の全身性代謝異常をいう。「糖尿病」は、該疾患のI型およびII型(インスリン非依存性糖尿病またはNIDDM)形態の両方を包含する。糖尿病の危険因子としては、以下の因子:ウエストラインが男性で40インチ超または女性で35インチ、血圧が130/85mmHg以上、トリグリセリドが150mg/dlより上、空腹時の血糖値が100mg/dlより高いか、または高密度リポタンパク質が男性で40mg/dl未満もしくは女性で50mg/dl未満が挙げられる。
サーチュインの「直接的活性化剤」はサーチュインに結合することによってこれを活性化する分子である。
用語「ED50」は当該技術分野で明確に理解されている。ある特定の実施形態において、ED50は、最大の応答もしくは効果の50%をもたらす薬物の用量、あるいはまた、試験被験体もしくは調製物の50%において所定の応答をもたらす用量を意味する。用語「LD50」は当該技術分野で明確に理解されている。ある特定の実施形態において、LD50は、試験被験体の50%において致死性である薬物の用量を意味する。用語「治療指数」は、当該技術分野で明確に理解されている用語であり、LD50/ED50で規定される薬物の治療指数をいう。
用語「高インスリン血症」は、血中インスリンレベルが正常より高い個体の状態をいう。
用語「挙げられる(including)」は、「限定されないが、・・・が挙げられる」を意味するために用いる。「挙げられる」および「限定されないが、・・・が挙げられる」は互換的に使用している。
用語「インスリン抵抗性」は、正常な量のインスリンが、インスリン抵抗性を有しない被験体の生物学的応答と比べ、正常以下の生物学的応答をもたらす状態をいう。
「インスリン抵抗性障害」は、本明細書で記載する場合、インスリン抵抗性によって引き起こされるか、またはこれが一因となっている任意の疾患または状態をいう。例としては、糖尿病、肥満、メタボリックシンドローム、インスリン抵抗性症候群、X症候群、インスリン抵抗性、高血圧、高血圧症、高血中コレステロール、脂質代謝異常、高脂血症、脂質代謝異常、アテローム硬化性疾患、例えば、脳卒中、冠状動脈疾患または心筋梗塞、高血糖症、高インスリン血症および/または高プロインスリン血症、グルコース寛容減損、インスリン放出遅滞、糖尿病合併症、例えば、冠動脈心臓疾患、狭心症、うっ血性心不全、脳卒中、痴呆における認知機能、網膜障害、末梢神経障害、腎症、糸球体腎炎、糸球体硬化症、ネフローゼ症候群、高血圧性腎硬化症、ある種の癌(例えば、子宮内膜、乳房、前立腺および結腸)、妊娠合併症、女性の不充分な生殖上の健康(例えば、月経不順、不妊、不規則な排卵、多嚢胞性卵巣症候群(PCOS))、リポジストロフィ、コレステロール関連障害、例えば、胆石、胆嚢炎(cholescystitis)および胆石症、痛風、閉塞性睡眠時無呼吸および呼吸困難、変形性関節症、ならびに骨量減少、例えば骨粗鬆症の予防および処置が挙げられる。
用語「家畜動物」は、飼養化四足獣をいい、食肉および種々の副製品のために飼育されているもの、例えば、ウシ系動物(例えば、畜牛およびウシ属の他の構成員)、ブタ系動物(例えば、飼養ブタおよびブタ属の他の構成員)、ヒツジ系動物(例えば、ヒツジおよびヒツジ属の他の構成員)、飼養ヤギおよびヤギ属の他の構成員、特定の仕事、例えば、役畜としての使用のために飼育されている飼養化四足獣、例えば、ウマ系動物(例えば、飼養ウマおよびウマ科、ウマ属の他の構成員)が挙げられる。
用語「哺乳動物」は、当該技術分野において知られており、例示的な哺乳動物としては、ヒト、霊長類、家畜動物(例えば、ウシ、ブタなど)、愛玩動物(例えば、イヌ、ネコなど)および齧歯類(例えば、マウスおよびラット)が挙げられる。
化合物に言及する場合の用語「天然に存在する形態」は、自然状態で見られ得る形態(例えば、組成物)である化合物を意味する。例えば、レスベラトロールは赤ワイン中に見られ得るため、これは、天然に存在する形態で赤ワイン中に存在する。例えば、化合物が、自然界で該化合物とともに見られるその他の分子の少なくとも一部から精製および分離されている場合、該化合物は、天然に存在する形態ではない。「天然に存在する化合物」は、自然界に見られ得る化合物、すなわち、人間によって設計されたものではない化合物をいう。天然に存在する化合物は、人間によって、または自然によって作製されたものであり得る。
「天然に存在する化合物」は、自然界に見られ得る化合物、すなわち、人間によって設計されたものではない化合物をいう。天然に存在する化合物は、人間によって、または自然によって作製されたものであり得る。例えば、レスベラトロールは、天然に存在する化合物である。「天然に存在しない化合物」は、自然界に存在することが知られていないか、または自然界に存在しない化合物である。
「肥満」個体または肥満に苦しむ個体は、一般的に、少なくとも25またはそれより大きいボディマス指数(BMI)を有する個体である。肥満は、インスリン抵抗性と関連するもの、または関連しないものであり得る。
用語「非経口投与」および「非経口で投与される」は当該技術分野で明確に理解されており、経腸的および経表面的投与以外の、通常注射による投与様式をいい、限定されないが、静脈内、筋肉内、動脈内、髄腔内、包内、眼窩内、心臓内、皮内、腹腔内、気管経由、皮下、表皮下、関節内、被膜下、クモ膜下、脊椎内、および基質内への注射および輸液が挙げられる。
「患者」、「被験体」、「個体」または「宿主」は、ヒトまたは非ヒト動物のいずれかをいう。
用語「同一割合」は、2つのアミノ酸配列間または2つのヌクレオチド配列間の配列同一性をいう。同一性は、各々、比較の目的でアラインメントさせてもよい配列の各位置を比較することにより決定され得る。比較対象の配列の対応する位置が同じ塩基またはアミノ酸で占められている場合、該分子は該位置において同一であり、対応する部位が同じまたは類似のアミノ酸残基(例えば、立体構造的および/または電子的性質が類似する)で占められている場合、該分子は、該位置において相同(類似する)と呼ばれ得る。相同性、類似性または同一性のパーセントでの表示は、比較対象の配列が共有する位置における同一または類似のアミノ酸の数の関数を示す。相同性、類似性または同一性のパーセントでの表示は、比較対象の配列が共有する位置における同一または類似のアミノ酸の数の関数を示す。種々のアラインメントアルゴリズムおよび/またはプログラムが使用され得、FASTA、BLASTまたはENTREZが挙げられる。FASTAおよびBLASTは、GCG配列解析パッケージ(University of Wisconsin,Madison,Wis.)の一部として入手可能であり、例えば、デフォルト設定を伴って使用され得る。ENTREZは、National Center for Biotechnology Information,National Library of Medicine,National Institutes of Health,Bethesda,MDから入手可能である。一実施形態において、2つの配列の同一性割合は、GCGプログラムによって、ギャップウェイトを1として、例えば、各アミノ酸ギャップが2つの配列間に単一のアミノ酸またはヌクレオチドミスマッチがあるものと仮定してウェイト付け(weight)て決定され得る。
アラインメントの他の手法は、Methods in Enzymology,第266巻:Computer Methods for Macromolecular Sequence Analysis(1996),編集Doolittle,Academic Press,Inc.(Harcourt Brace & Co.,San Diego,California,USAの一部門)に記載されている。好ましくは、配列内のギャップが許容されるアラインメントプログラムを用いて配列をアラインメントする。Smith−Watermanは、配列アラインメントにおけるギャップが許容されるアルゴリズムの一類型である。Meth.Mol.Biol.70:173−187(1997)を参照のこと。また、NeedlemanおよびWunschのアラインメント法を用いるGAPプログラムを、配列のアラインメントに用いてもよい。択一的な検索ストラテジーは、MPSRCHソフトウエアを使用するものであり、MASPARコンピュータ上で実行する。MPSRCHではSmith−Watermanアルゴリズムを用い、大規模並列処理コンピュータにおいて配列をスコアリングする。このアプローチにより、間隔関連マッチング(distantly related match)の収集(pick up)能が改善され、小ギャップおよびヌクレオチド配列エラーに特に寛容性となる。核酸にコードされたアミノ酸配列を用い、タンパク質とDNAとの両方のデータベースを検索することができる。
用語「薬学的に許容され得る担体」は、当該技術分野で明確に理解されており、任意の主題の組成物またはその成分をある1つの器官または身体の一部から別の器官または身体の一部に運搬または輸送することに関与する、薬学的に許容され得る材料、組成物またはビヒクル、例えば、液状もしくは固形の充填剤、希釈剤、賦形剤、溶媒またはカプセル化材料をいう。各担体は、主題の組成物およびその成分と適合性であり、患者に対して有害でないという意味で「許容され得る」ものでなければならない。薬学的に許容され得る担体をして供され得る材料の一部の例としては、(1)糖類、例えばラクトース、グルコースおよびスクロースなど;(2)デンプン、例えばトウモロコシデンプンおよびイモデンプンなど;(3)セルロースおよびその誘導体、例えばカルボキシメチルセルロースナトリウム、エチルセルロースおよびセルロースアセテートなど;(4)粉末トラガカント;(5)麦芽;(6)ゼラチン;(7)タルク;(8)賦形剤、例えばココアバターおよび坐剤用ワックスなど;(9)油類、例えばピーナッツ油、綿実油、サフラワー油、ゴマ油、オリーブ油、コーン油および大豆油など;(10)グリコール、例えばプロピレングリコールなど;(11)ポリオール、例えばグリセリン、ソルビトール、マンニトールおよびポリエチレングリコールなど;(12)エステル、例えばオレイン酸エチルおよびラウリン酸エチル;など(13)寒天;(14)緩衝剤、例えば水酸化マグネシウムおよび水酸化アルミニウムなど;(15)アルギン酸;(16)発熱物質なしの水;(17)等張生理食塩水;(18)リンゲル溶液;(19)エチルアルコール;(20)リン酸緩衝溶液;ならびに(21)医薬製剤に用いられる他の無毒性の適合可能な物質が挙げられる。
用語「薬学的に許容され得る塩」は、当該技術分野で明確に理解されており、化合物の比較的無毒性の無機および有機酸付加塩をいい、例えば、本明細書に記載の組成物に含まれるものが挙げられる。
用語「ポリヌクレオチド」および「核酸」は互換的に使用している。これらは、任意の長さのヌクレオチドのポリマー形態であって、デオキシリボヌクレオチドもしくはリボヌクレオチドまたはその類縁体のいずれかをいう。ポリヌクレオチドは、任意の3次元構造を有し得、既知または未知の任意の機能を果たし得る。以下:遺伝子または遺伝子断片のコード領域もまたは非コード領域、連鎖解析から規定される遺伝子座(1つまたは複数)、エクソン、イントロン、メッセンジャーRNA(mRNA)、転移RNA、リボソームRNA、リボザイム、cDNA、組換えポリヌクレオチド、分枝ポリヌクレオチド、プラスミド、ベクター、任意の配列の単離されたDNA、任意の配列の単離されたRNA、核酸プローブおよびプライマーは、ポリヌクレオチドの非限定的な例である。ポリヌクレオチドは、修飾されたヌクレオチド、例えば、メチル化されたヌクレオチドおよびヌクレオチド類縁体などを含み得る。ヌクレオチド構造に対する修飾は、存在する場合は、該ポリマーの合成前または後に付与され得る。ヌクレオチドの配列は、非ヌクレオチド成分によって分断されていてもよい。ポリヌクレオチドは、例えば、標識成分とのコンジュゲーションなどによってさらに修飾されたものであってもよい。用語「組換え」ポリヌクレオチドは、自然界に存在しないか、または天然にない配置で別のポリヌクレオチドに連結されているかのいずれかであるゲノム、cDNA、反合成または合成起源のポリヌクレオチドを意味する。
用語「予防的」または「治療的」処置は、当該技術分野で明確に理解されており、宿主への薬物の投与をいう。好ましくない状態(例えば、宿主動物の疾患または他の好ましくない状況)の臨床徴候の前に投与される場合、処置は予防的である、すなわち、宿主を好ましくない状態の発現から保護し、一方、好ましくない状態の徴候後に投与される場合、処置は治療的である(すなわち、既に存在する好ましくない状態またはこれによる副作用を減退、改善または維持することが意図される)。
用語「保護基」は、当該技術分野で明確に理解されており、潜在的に反応性の官能基を望ましくない化学的変換から保護する一時的な置換基をいう。かかる保護基の例としては、カルボン酸のエステル、アルコールのシリルエーテル、ならびにそれぞれ、アルデヒドおよびケトンのアセタールおよびケタールが挙げられる。保護基化学反応の分野は、Greene and Wuts in Protective Groups in Organic Synthesis(第2版,Wiley:New York,1991)に概説されている。
「サーチュイン活性化化合物」、「活性化化合物」または「サーチュイン活性化剤」は、サーチュインタンパク質を活性化するか、またはサーチュインタンパク質の少なくとも1つの活性を刺激もしくは増大させる化合物をいう。ある特定の実施形態において、サーチュイン活性化化合物は、式1〜25、30、32〜65および69〜76の群から選択される式を有し得る。
「サーチュイン活性化」は、サーチュインタンパク質の少なくとも1つの活性を、好ましくは、少なくとも約10%、50%、100%またはそれより大きく増大させることをいう。「サーチュインタンパク質を活性化すること」とは、活性化されたサーチュインタンパク質、すなわち、その生物学的活性の少なくとも1つを、少なくとも約10%、50%、2倍またはそれより大きい活性の増加を伴って発揮することができるサーチュインタンパク質を生成させる作用をいう。サーチュインタンパク質の生物学的活性としては、脱アセチル化(例えば、ヒストンおよびp53の);寿命の延長;ゲノムの安定性の増大;転写のサイレンシング;および母細胞癌と娘細胞癌との間での酸化タンパク質の分離の制御が挙げられる。
「サーチュインタンパク質」は、サーチュイン脱アセチル化酵素タンパク質ファミリー構成員、または好ましくは、sir2ファミリーをいい、酵母Sir2(GenBank受託番号P53685)、C.elegans Sir−2.1(GenBank受託番号NP_501912)、ならびにヒトSIRT1(GenBank受託番号NM_012238およびNP_036370(またはAF083106))およびSIRT2(GenBank受託番号NM_012237、NM_030593、NP_036369、NP_085096およびAF083107)タンパク質が挙げられる。他のファミリー構成員としては、「HST遺伝子」と呼ばれる4種類のさらなる酵母Sir2様遺伝子(homologues of Sir two)(Sir2のホモログ)HST1、HST2、HST3およびHST4、ならびに5種類の他のヒトホモログhSIRT3、hSIRT4、hSIRT5、hSIRT6およびhSIRT7(Brachmannら(1995)Genes Dev.9:2888 and Fryeら(1999)BBRC 260:273)が挙げられる。好ましいサーチュインは、SIRT2よりもSIRT1、すなわちhSIRT1および/またはSir2と、より多くの類似性を共有するもの、例えば、SIRT1に存在するがSIRT2に存在しないN末端配列の少なくとも一部分を有する構成員など(例えば、SIRT3が有する)である。
「SIRT1タンパク質」は、サーチュイン脱アセチル化酵素のsir2ファミリーの構成員をいう。一実施形態において、SIRT1タンパク質としては、酵母Sir2(GenBank受託番号P53685)、C.elegans Sir−2.1(GenBank受託番号NP_501912)、ヒトSIRT1(GenBank受託番号NM_012238またはNP_036370(またはAF083106))、およびヒトSIRT2(GenBank受託番号NM_012237、NM_030593、NP_036369、NP_085096、またはAF083107)タンパク質、ならびにその同等物および断片が挙げられる。別の実施形態において、SIRT1タンパク質としては、GenBank受託番号NP_036370、NP_501912、NP_085096、NP_036369またはP53685に示すアミノ酸配列からなるか、または本質的にアミノ酸配列からなる配列を含むポリペプチドが挙げられる。SIRT1タンパク質としては、GenBank受託番号NP_036370、NP_501912、NP_085096、NP_036369またはP53685に示すアミノ酸配列;GenBank受託番号NP_036370、NP_501912、NP_085096、NP_036369またはP53685に示すアミノ酸配列であって、1〜約2、3、5、7、10、15、20、30、50、75またはそれより多くの保存的アミノ酸置換を有する配列;GenBank受託番号NP_036370、NP_501912、NP_085096、NP_036369またはP53685と少なくとも60%、70%、80%、90%、95%、96%、97%、98%または99%同一であるアミノ酸配列の全部または一部を含むポリペプチド、ならびにその機能性断片が挙げられる。また、本発明のポリペプチドには、GenBank受託番号NP_036370、NP_501912、NP_085096、NP_036369またはP53685のホモログ(例えば、オルソログおよびパラログ)、バリアントまたは断片も含まれる。
用語「実質的に相同な」は、アミノ酸配列に関して用いる場合、配列が互いに実質的に同一であるかまたは類似しており、コンホメーションの相同性、したがって、有用な程度に1つ以上の生物学的(例えば、免疫学的)活性の保持をもたらす配列をいう。該用語は、配列の共通の進化を暗に意味することは意図されない。
用語「合成の」は当該技術分野で明確に理解されており、インビトロでの化学的または酵素的合成による作製をいう。
用語「全身投与」、「全身に投与される」、「末梢投与」および「末梢に投与される」は当該技術分野で明確に理解されており、主題の組成物、治療剤または他の材料を、直接中枢神経系内に行なう以外で、患者の系に侵入させ、したがって、代謝および他の同様のプロセスに供されるように投与することをいう。
用語「治療剤」は当該技術分野で明確に理解されており、被験体において局所または全身に作用する生物学的、生理学的または薬理学的に活性な物質である任意の化学的部分をいう。該用語はまた、疾患の診断、治癒、軽減、処置もしくは予防における使用、または動物もしくはヒトにおける望ましい身体的もしくは精神的発達および/または状態の増強における使用が意図される任意の物質も意味する。
用語「治療効果」は当該技術分野で明確に理解されており、薬理学的に活性な物質によってもたらされる動物、特に哺乳動物、より特別にはヒトにおける局所性または全身性効果をいう。語句「治療有効量」は、任意の処置に適用可能な妥当な便益/リスク比で、いくらかの所望の局所または全身性効果をもたらす、かかる物質の量を意味する。かかる物質の治療有効量は、処置される被験体および疾患状態、被験体の体重および年齢、疾患状態の重篤度、投与様式などに応じて異なり、当業者によって容易に決定され得る。例えば、本明細書に記載のある特定の組成物は、かかる処置に適用可能な妥当な便益/リスク比で所望の効果をもたらすのに充分な量で投与され得る。
「転写調節配列」は、本明細書全体を通して、開始シグナル、エンハンサーおよびプロモーターなどの、これらが作動可能に連結されるタンパク質コード配列の転写を誘導または制御するDNA配列をいうために用いる総称である。好ましい実施形態において、組換え遺伝子のうちの1つの転写は、発現が意図される細胞型において組換え遺伝子の発現を制御するプロモーター配列(または他の転写調節配列)の制御下にある。また、組換え遺伝子は、本明細書において上記の天然に存在する形態の遺伝子の転写を制御する配列と同じか、または異なる、転写調節配列の制御下にあり得ることは理解されよう。
ある状態または疾患を「処置すること」とは、該状態または疾患の少なくとも1種類の症状を治癒することならびに改善することをいう。
「ベクター」は、挿入された核酸分子を宿主細胞内および/または宿主細胞間に移送する自己複製性核酸分子である。該用語には、細胞内への核酸分子の挿入に対して主に機能を果たすベクター、核酸の複製に対して主に機能を果たすベクターの複製、ならびにDNAまたはRNAの転写および/または翻訳に対して機能を果たす発現ベクターが含まれる。また、上記の1つより多くの機能を提供するベクターも含まれる。本明細書で用いる場合、「発現ベクター」は、適切な宿主細胞に導入されると、ポリペプチド(1つまたは複数)に転写および翻訳され得るポリヌクレオチドと規定する。「発現系」は、通常、所望の発現産物をもたらすための機能を果たし得る発現ベクターを含む適当な宿主細胞を内包する。
用語「シス」は当該技術分野で明確に理解されており、二重結合の周りの2つの原子または基が、該原子または基が二重結合の同じ側に存在する配置をいう。シス立体配置は、多くの場合、(Z)立体配置と表示される。
用語「トランス」は当該技術分野で明確に理解されており、二重結合の周りの2つの原子または基が、該原子または基が、二重結合の反対側に存在する配置をいう。トランス立体配置は、多くの場合、(E)立体配置と表示される。
用語「共有結合」は当該技術分野で明確に理解されており、電子が2つの原子の両方の核に静電気的に結合され、核間の電子密度増加の正味効果によって核間反発力が相殺されている2つの原子間の結合をいう。共有結合という用語は、結合が金属イオンとのものである場合の配位結合を含む。
用語「メソ化合物」は当該技術分野で明確に理解されており、少なくとも2つのキラル中心を有するが、対称面または対称点によりアキラルである化合物をいう。
用語「キラル」は当該技術分野で明確に理解されており、鏡像パートナーと重ね合わせられない性質を有する分子をいい、一方、用語「アキラル」は、その鏡像パートナーに重ね合わせることができる分子をいう。「プロキラル分子」は、特定のプロセスにおいてキラル分子に変換される可能性を有する分子である。
用語「立体異性体」は当該技術分野で明確に理解されており、同一の化学的構成を有するが、空間における原子または基の配置に関して異なる化合物をいう。特に、「エナンチオマー」は、互いに重ね合わせることができない鏡像である化合物の2つの立体異性体をいう。他方、「ジアステレオマー」は、2つ以上の非対称中心を有し、その分子は互いに鏡像でない立体異性体をいう。
さらにまた、「立体選択的プロセス」は、反応生成物の特定の立体異性体を、該生成物の他の可能な立体異性体よりも優先して生成させるものである。「エナンチオ選択的プロセス」は、反応生成物の2つの可能なエナンチオマーの一方の生成に有利なものである。
用語「レギオ異性体」は当該技術分野で明確に理解されており、同じ分子式を有するが、原子の連結が異なる化合物をいう。したがって、「レジオ選択的プロセス」は、他のレギオ異性体に対して特定のレギオ異性体の生成に有利なものであり、例えば、該反応は、ある特定のレギオ異性体の収率において統計学的に有意な増加をもたらすものである。
用語「エピマー」は当該技術分野で明確に理解されており、同一の化学的構成を有し、1つより多くの立体中心を含むが、この立体中心の1つだけにおいて立体配置が異なる分子をいう。
用語「構造活性相関」または「(SAR)」は当該技術分野で明確に理解されており、薬物または他の化合物の分子構造の改変により、その生物学的活性、例えば、受容体、酵素、核酸または他の標的などとの相互作用が改変される様式をいう。
用語「脂肪族」は当該技術分野で明確に理解されており、直鎖、分枝鎖、環状のアルカン、アルケンまたはアルキンをいう。ある特定の実施形態において、本発明の化合物内の脂肪族基は、直鎖または分枝鎖であり、1〜約20個の炭素原子を有する。
用語「アルキル」は当該技術分野で明確に理解されており、飽和脂肪族基、例えば、直鎖アルキル基、分枝鎖アルキル基、シクロアルキル(脂環式)基、アルキル置換シクロアルキル基およびシクロアルキル置換アルキル基が挙げられる。ある特定の実施形態において、直鎖または分枝鎖アルキルは、約30個以下(例えば、直鎖ではC1〜C30、分枝鎖ではC3〜C30)、あるいはまた約20個以下の炭素原子をその主鎖内に有する。同じく、シクロアルキルは、約3〜約10個の炭素原子をその環構造内に有し、あるいはまた約5、6または7個の炭素を環構造内に有する。また、用語「アルキル」は、ハロ置換されたアルキルも含めて規定する。
用語「アラルキル」は当該技術分野で明確に理解されており、アリール基(例えば、芳香族またはヘテロ芳香族基)で置換されたアルキル基をいう。
用語「アルケニル」および「アルキニル」は当該技術分野で明確に理解されており、鎖長および可能な置換が上記のアルキルと類似するが、それぞれ、少なくとも1つの二重結合または三重結合を含む不飽和脂肪族基をいう。
炭素数について特に記載のない限り、「低級アルキル」は、上記のアルキル基であるが、1〜約10個の炭素、あるいはまた、1〜約6個の炭素原子をその主鎖構造内に有するものをいう。同じく、「低級アルケニル」および「低級アルキニル」は同様の鎖長を有する。
用語「ヘテロ原子」は当該技術分野で明確に理解されており、炭素または水素以外の任意の元素の原子をいう。例示的なヘテロ原子としては、ホウ素、窒素、酸素、リン、イオウおよびセレンが挙げられる。
用語「アリール」は当該技術分野で明確に理解されており、5、6および7員の単環式芳香族基をいい、0〜4個のヘテロ原子を含有するものであってもよく、例えば、ベンゼン、ナフタレン、アントラセン、ピレン、ピロール、フラン、チオフェン、イミダゾール、オキサゾール、チアゾール、トリアゾール、ピラゾール、ピリジン、ピラジン、ピリダジンおよびピリミジンなどが挙げられる。また、環構造内にヘテロ原子を有するアリール基は、「アリール複素環」または「ヘテロ芳香族」とも称され得る。芳香族環は、環の1つ以上の位置が、上記の置換基、例えば、ハロゲン、アジド、アルキル、アラルキル、アルケニル、アルキニル、シクロアルキル、ヒドロキシル、アルコキシル、アミノ、ニトロ、スルフヒドリル、イミノ、アミド、ホスホネート、ホスフィネート、カルボニル、カルボキシル、シリル、エーテル、アルキルチオ、スルホニル、スルホンアミド、ケトン、アルデヒド、エステル、ヘテロシクリル、芳香族またはヘテロ芳香族部分、−CF3、−CNなどで置換され得る。また、用語「アリール」は、2個以上の炭素が2つの隣接する環に共有された2つ以上の環(この環は「縮合環」である)を有する多環系を含み、この場合、環の少なくとも1つが芳香族であり、その他の環は、例えば、シクロアルキル、シクロアルケニル、シクロアルキニル、アリールおよび/またはヘテロシクリルであり得る。
用語オルト、メタおよびパラは当該技術分野で明確に理解されており、それぞれ、1,2−,1,3−および1,4−二置換ベンゼンをいう。例えば、名称1,2−ジメチルベンゼンとオルト−ジメチルベンゼンとは、同義である。
用語「ヘテロシクリル」または「複素環式基」は当該技術分野で明確に理解されており、3〜約10員環構造、あるいはまた3〜約7員環であって、その環構造が1〜4個のヘテロ原子を含むものをいう。また、複素環は多環であり得る。ヘテロシクリル基としては、例えば、チオフェン、チアントレン、フラン、ピラン、イソベンゾフラン、クロメン、キサンテン、フェノキサンテン、ピロール、イミダゾール、ピラゾール、イソチアゾール、イソキサゾール、ピリジン、ピラジン、ピリミジン、ピリダジン、インドリジン、イソインドール、インドール、インダゾール、プリン、キノリジン、イソキノリン、キノリン、フタラジン、ナフチリジン、キノキサリン、キナゾリン、シンノリン、プテリジン、カルバゾール、カルボリン、フェナントリジン、アクリジン、ピリミジン、フェナントロリン、フェナジン、フェナルサジン、フェノチアジン、フラザン、フェノキサジン、ピロリジン、オキソラン、チオラン、オキサゾール、ピペリジン、ピペラジン、モルホリン、ラクトン、ラクタム、例えば、アゼチジノンおよびピロリジノン、スルタム、スルトンなどが挙げられる。複素環式環は、1つ以上の位置が、上記の置換基、例えば、ハロゲン、アルキル、アラルキル、アルケニル、アルキニル、シクロアルキル、ヒドロキシル、アミノ、ニトロ、スルフヒドリル、イミノ、アミド、ホスホネート、ホスフィネート、カルボニル、カルボキシル、シリル、エーテル、アルキルチオ、スルホニル、ケトン、アルデヒド、エステル、ヘテロシクリル、芳香族またはヘテロ芳香族部分、−CF3、−CNなどで置換されていてよい。
用語「多環系(polycyclyl)」または「多環式基」は当該技術分野で明確に理解されており、2個以上の炭素が2つの隣接する環に共通している2つ以上の環(例えば、シクロアルキル、シクロアルケニル、シクロアルキニル、アリールおよび/またはヘテロシクリル)をいい、例えば、該環は「縮合環」である。非隣接原子を介して連結された環は、「橋絡」環と呼ばれる。多環の環の各々は、上記の置換基、例えば、ハロゲン、アルキル、アラルキル、アルケニル、アルキニル、シクロアルキル、ヒドロキシル、アミノ、ニトロ、スルフヒドリル、イミノ、アミド、ホスホネート、ホスフィネート、カルボニル、カルボキシル、シリル、エーテル、アルキルチオ、スルホニル、ケトン、アルデヒド、エステル、ヘテロシクリル、芳香族またはヘテロ芳香族部分、−CF3、−CN5などで置換されていてよい。
用語「炭素環」は当該技術分野で明確に理解されており、環の各原子が炭素である芳香族または非芳香族環をいう。
用語「ニトロ」は当該技術分野で明確に理解されており、−NO2をいい、用語「ハロゲン」は当該技術分野で明確に理解されており、−F、−Cl、−Brまたは−Iをいい、用語「スルフヒドリル」は当該技術分野で明確に理解されており、−SHをいい、用語「ヒドロキシル」は−OHを意味し、用語「スルホニル」は当該技術分野で明確に理解されており、−SO2 −をいう。「ハライド」は、ハロゲンの対応するアニオンを示し、「プソイドハライド」は、CottonおよびWilkinsonによる「Advanced Inorganic Chemistry」の560に示された定義を有する。
用語「アミン」および「アミノ」は当該技術分野で明確に理解されており、非置換および置換の両方のアミン、例えば、一般式:
で表され得る部分をいう。ある特定の実施形態において、R50またはR51の一方だけが、カルボニルであり得、例えば、R50、R51および窒素が一緒にイミドを形成しない。他の実施形態において、R50およびR51(ならびに任意選択でR52)は、各々独立して、水素、アルキル、アルケニルまたは−(CH2)m−R61を表す。したがって、用語「アルキルアミン」は、上記のアミン基であって、置換もしくは非置換のアルキルが結合されたものを含む、すなわち、R50およびR51の少なくとも一方はアルキル基である。
用語「アシルアミノ」は当該技術分野で明確に理解されており、一般式:
用語「アミド」は、アミノ置換されたカルボニルとして当該技術分野で明確に理解されており、一般式:
用語「アルキルチオ」は、上記規定のアルキル基であって、イオウラジカルが結合されたものをいう。ある特定の実施形態において、「アルキルチオ」部分は、−S−アルキル、−S−アルケニル、−S−アルキニルおよび−S−(CH2)m−R61(式中、mおよびR61は上記規定のとおりである)の1つで表される。代表的なアルキルチオ基としては、メチルチオ、エチルチオなどが挙げられる。
用語「カルボニル」は当該技術分野で明確に理解されており、一般式:
用語「アルコキシル」または「アルコキシ」は当該技術分野で明確に理解されており、上記のアルキル基であって、酸素ラジカルが結合されたものをいう。代表的なアルコキシル基としては、メトキシ、エトキシ、プロピルオキシ、tert−ブトキシなどが挙げられる。「エーテル」は、酸素によって共有結合された2つの炭化水素である。したがって、アルキルをエーテルにするアルキルの置換基は、アルコキシルであるか、またはこれと似ており、例えば、−O−アルキル、−O−アルケニル、−O−アルキニル、−O−(CH2)m−R61(式中、mおよびR61は上記規定のとおりである)の1つで表されるものであり得る。
用語「スルホン酸塩」は当該技術分野で明確に理解されており、
一般式:
一般式:
用語「硫酸(またはサルフェート)」は当該技術分野で明確に理解されており、一般式:
用語「スルホンアミド」は当該技術分野で明確に理解されており、一般式:
用語「スルファモイル」は当該技術分野で明確に理解されており、
一般式:
一般式:
用語「スルホニル」は当該技術分野で明確に理解されており、
一般式:
一般式:
用語「スルホキシド」は当該技術分野で明確に理解されており、
一般式:
一般式:
用語「ホスホリル」は当該技術分野で明確に理解されており、一般に、式:
用語「ホスホロアミダイト」は当該技術分野で明確に理解されており、一般式:
用語「ホスホンアミダイト」は当該技術分野で明確に理解されており、一般式:
同様の置換が、アルケニルおよびアルキニル基に対して行なわれ、例えば、アミノアルケニル、アミノアルキニル、アミドアルケニル、アミドアルキニル、イミノアルケニル、イミノアルキニル、チオアルケニル、チオアルキニル、カルボニル−置換されたアルケニルまたはアルキニルが生成され得る。各表現、例えば、アルキル、m、nなどの定義は、任意の構造において1回より多く存在する場合、同じ構造における他の箇所でのその定義とは独立していることを意図する。
用語「セレノアルキル」は当該技術分野で明確に理解されており、置換されたセレノ基が結合されているアルキル基をいう。例示的な「セレノエーテル」は、アルキルが置換されていてもよく、−Se−アルキル、−Se−アルケニル、−Se−アルキニルおよび−Se−(CH2)m−R61(mおよびR61は上記規定のとおりである)の1つから選択される。
用語トリフリル、トシル、メシルおよびノナフリルは当該技術分野で明確に理解されており、それぞれ、トリフルオロメタンスルホニル、p−トルエンスルホニル、メタンスルホニルおよびノナフルオロブタンスルホニル基をいう。用語トリフレート、トシレート、メシレートおよびノナフレートは当該技術分野で明確に理解されており、それぞれ、トリフルオロメタンスルホン酸エステル、p−トルエンスルホン酸エステル、メタンスルホン酸エステルおよびノナフルオロブタンスルホン酸エステル官能基ならびに該基を含有する分子をいう。
略語Me、Et、Ph、Tf、Nf、TsおよびMsは、それぞれ、メチル、エチル、フェニル、トリフルオロメタンスルホニル、ノナフルオロブタンスルホニル、p−トルエンスルホニルおよびメタンスルホニルを表す。当業者である有機化学者によって用いられる略語のより包括的な一覧は、Journal of Organic Chemistryの各巻の創刊号に見られ、この一覧は、典型的には、標準的な略語の一覧(Standard List of Abbreviations)と題する表に示されている。
本明細書に記載の組成物に含まれるある特定の化合物は、特定の幾何異性体または立体異性体の形態で存在し得る。さらに、化合物はまた、光学的に活性でもあり得る。かかるすべての化合物、例えば、シスおよびトランス異性体、RおよびSエナンチオマー、ジアステレオマー、(D)−異性体、(L)−異性体、そのラセミ混合物、ならびに他のその混合物が本明細書において想定される。さらなる不斉炭素原子が、アルキル基などの置換基に存在していてもよい。かかるすべての異性体ならびにその混合物は、本明細書に包含される。
例えば、化合物の特定のエナンチオマーが所望される場合、これは、不斉合成によって、またはキラル補助剤による誘導体化によって調製され得、この場合、得られたジアステレオマー混合物を分離し、補助基を切断して純粋な所望のエナンチオマーを得る。あるいはまた、分子が塩基性官能基(アミノなど)または酸性官能基(カルボキシルなど)を含む場合、適切な光学的に活性な酸または塩基とともにジアステレオマーの塩を形成させた後、このようにして形成されたジアステレオマーを、当該技術分野においてよく知られた分別結晶またはクロマトグラフィー手段によって分離し、続いて、純粋なエナンチオマーを回収する。
「置換」または「・・・で置換された」には、かかる置換が、置換された原子および置換基の許容される原子価に従うこと、および該置換により、安定な化合物がもたらされる(例えば、転位、環化、脱離もしくは他の反応などによって自発的に変換を受けない)ことが黙示されることは、理解されよう。
用語「置換された」はまた、有機化合物の許容され得るあらゆる置換基を含むことが想定される。広い態様において、許容され得る置換基としては、有機化合物の非環式および環式、分枝鎖および非分枝鎖、炭素環式および複素環式、芳香族および非芳香族の置換基が挙げられる。例示的な置換基としては、例えば、本明細書において上記に記載のものが挙げられる。許容され得る置換基は、適切な有機化合物に対して1つ以上であってもよく、同じであっても異なっていてもよい。窒素などのヘテロ原子は、水素置換基および/または本明細書に記載の有機化合物の許容され得る任意の置換基(該ヘテロ原子の原子価を満足する)を有し得る。化合物は、該有機化合物の許容され得る置換基に、なんら限定されないものとする。
化学元素は、Handbook of Chemistry and Physics,第67版,1986−87の内表紙のCAS方式の元素周期表に従って特定される。
用語「保護基」は当該技術分野で明確に理解されており、潜在的に反応性の官能基を望ましくない化学的変換から保護する一時的な置換基をいう。かかる保護基の例としては、それぞれ、カルボン酸のエステル、アルコールのシリルエーテル、ならびにアルデヒドおよびケトンのアセタールおよびケタールが挙げられる。保護基化学反応の分野は、Greene and Wuts in Protective Groups in Organic Synthesis(第2版,Wiley:New York,1991)に概説されている。
用語「ヒドロキシル保護基」は当該技術分野で明確に理解されており、ヒドロキシル(hydrozyl)基を、合成手順の間の望ましくない反応から保護することが意図される基をいい、当該技術分野で知られた例えば、ベンジルまたは他の適当なエステルもしくはエーテル基が挙げられる。
用語「カルボキシル保護基」は当該技術分野で明確に理解されており、カルボン酸基、例えば、アミノ酸もしくはペプチドまたは酸性もしくはヒドロキシルアゼピン環置換基のC末端などを、合成手順の間の望ましくない反応から保護することが意図される基をいい、含む。カルボキシル基の保護基の例には、例えば、ベンジルエステル、シクロヘキシルエステル、4−ニトロベンジルエステル、t−ブチルエステル、4−ピリジルメチルエステルなどが含まれる。
用語「アミノ保護基」は当該技術分野で明確に理解されており、アミノ基が一部の他の官能基上で行なわれる反応に関与するのを抑制するが、所望の場合にはアミンから除去され得る基をいう。かかる基は、上記のGreene and Wutsの第7章、ならびにBartonによるProtective Groups in Organic Chemistry第2章(McOmie編集.,Plenum Press,New York,1973)に論考されている。好適な基の例としては、アシル保護基、例えば、ホルミル、ダンシル、アセチル、ベンゾイル、トリフルオロアセチル、スクシニル、メトキシスクシニル、ベンジルなど、および置換されたベンジル、例えば、3,4−ジメトキシベンジル、o−ニトロベンジルおよびトリフェニルメチル;式−COORのもの(式中、Rとしては、メチル、エチル、プロピル、イソプロピル、2,2,2−トリクロロエチル、1−メチル−1−フェニルエチル、イソブチル、t−ブチル、t−アミル、ビニル、アリル、フェニル、ベンジル、p−ニトロベンジル、o−ニトロベンジルおよび2,4−ジクロロベンジルなどの基が挙げられる);アシル基および置換されたアシル、例えば、ホルミル、アセチル、クロロアセチル、ジクロロアセチル、トリクロロアセチル、トリフルオロアセチル、ベンゾイルおよびp−メトキシベンゾイル;ならびにメタンスルホニル、p−トルエンスルホニル、p−ブロモベンゼンスルホニル、p−ニトロフェニルエチルおよびp−トルエンスルホニル−アミノカルボニルなどの他の基が挙げられる。好ましいアミノ保護基は、ベンジル(−CH2C6H5)、アシル[C(O)Rl]またはSiRl3(式中、RlはC1〜C4アルキル、ハロメチルまたは2−ハロ置換(C2〜C4アルコキシ)である)、芳香族ウレタン保護基、例えば、カルボニルベンジルオキシ(Cbz);ならびに脂肪族ウレタン保護基、例えば、t−ブチルオキシカルボニル(Boc)または9−フルオレニルメトキシカルボニル(FMOC)である。
各表現、例えば、低級アルキル、m、n、pなどの定義は、任意の構造において1回より多く存在する場合、同じ構造における他の箇所でのその定義とは独立しているものとする。
用語「電子求引基」は当該技術分野で明確に理解されており、置換基が隣接原子から価電子を引き付ける傾向をいい、すなわち、該置換基は、隣接原子に対して電気的陰性である。電子求引能力のレベルの定量化は、ハメットのシグマ定数によって示される。このよく知られた定数は、多くの参考文献、例えば、March,Advanced Organic Chemistry251−59(McGraw Hill Book Company:New York,1977)に記載されている。ハメット定数の値は、一般的に、電子供与基では負(NH2ではσ(P)=−0.66)であり、電子吸引基では正(ニトロ基ではσ(P)=0.78)であり、σ(P)はパラ置換を示す。例示的な電子求引基としては、ニトロ、アシル、ホルミル、スルホニル、トリフルオロメチル、シアノ、クロリドなどが挙げられる。例示的な電子供与基としては、アミノ、メトキシなどが挙げられる。
2.例示的なサーチュイン活性化化合物
一実施形態において、例示的なサーチュイン活性化化合物は、Howitzら(2003)Nature 425:191に記載されたものであり、例えば、レスベラトロール(3,5,4’−トリヒドロキシ−トランス−スチルベン)、ブテイン(3,4,2’,4’−テトラヒドロキシカルコン)、ピセアタンノール(3,5,3’,4’−テトラヒドロキシ−トランス−スチルベン)、イソリキリチゲニン(4,2’,4’−トリヒドロキシカルコン)、フィセチン(3,7,3’,4’−テトラヒドロキシ(hyddroxy)フラボン)、ケルセチン(3,5,7,3’,4’−ペンタヒドロキシフラボン)、デオキシラポンチン(3,5−ジヒドロキシ−4’−メトキシスチルベン3−O−β−D−グルコシド);トランス−スチルベン;ラポンチン(3,3’,5−トリヒドロキシ−4’−メトキシスチルベン3−O−β−D−グルコシド);シス−スチルベン;ブテイン(3,4,2’,4’−テトラヒドロキシカルコン);3,4,2’4’6’−ペンタヒドロキシカルコン;カルコン;7,8,3’,4’−テトラヒドロキシフラボン;3,6,2’,3’−テトラヒドロキシフラボン;4’−ヒドロキシフラボン;5,4’−ジヒドロキシフラボン;5,7−ジヒドロキシフラボン;モリン(3,5,7,2’,4’−ペンタヒドロキシフラボン);フラボン;5−ヒドロキシフラボン;(−)−エピカテキン(ヒドロキシ部位:3,5,7,3’,4’);(−)−カテキン(ヒドロキシ部位:3,5,7,3’,4’);(−)−ガロカテキン(ヒドロキシ部位:3,5,7,3’,4’,5’)(+)−カテキン(ヒドロキシ部位:3,5,7,3’,4’);5,7,3’,4’,5’−ペンタヒドロキシフラボン;ルテオリン(5,7,3’,4’−テトラヒドロキシフラボン);3,6,3’,4’−テトラヒドロキシフラボン;7,3’,4’,5’−テトラヒドロキシフラボン;ケンフェロール(3,5,7,4’−テトラヒドロキシフラボン);6−ヒドロキシアピゲニン(5,6,7,4’−テトラヒドロキシフラボン);スクテラレイン);アピゲニン(5,7,4’−トリヒドロキシフラボン);3,6,2’,4’−テトラヒドロキシフラボン;7,4’−ジヒドロキシフラボン;ダイドゼイン(7,4’−ジヒドロキシイソフラボン);ゲニステイン(5,7,4’−トリヒドロキシフラバノン);ナリンゲニン(5,7,4’−トリヒドロキシフラバノン);3,5,7,3’,4’−ペンタヒドロキシフラバノン;フラバノン;塩化ペラルゴニジン(3,5,7,4’−テトラヒドロキシフラビリウム塩化物);ヒノキチオール(b−ツジャプリシン;2−ヒドロキシ−4−イソプロピル−2,4,6−シクロヘプタトリエン−1−オン);L−(+)−エルゴチオネン((S)−a−カルボキシ−2,3−ジヒドロ−N,N,N−トリメチル−2−チオキソ−1H−イミダゾール−4−エタナミニウム内部塩);コーヒー酸フェニルエステル;MCI−186(3−メチル−1−フェニル−2−ピラゾリン−5−オン);HBED(N,N’−ジ−(2−ヒドロキシベンジル)エチレンジアミン−N,N’−アセト酢酸・Η2O);アンブロキソール(トランス−4−(2−アミノ−3,5−ジブロモベンジルアミノ)シクロヘキサン・HCl;およびU−83836E((−)−2−((4−(2,6−ジ−1−ピロリジニル−4−ピリミジニル)−1−ピペロザイニル(piperzainyl))メチル)−3,4−ジヒドロ−2,5,7,8−テトラメチル−2H−1−ベンゾピラン−6−オール−2HCl)が挙げられる。これらの類縁体および誘導体もまた使用され得る。
2.例示的なサーチュイン活性化化合物
一実施形態において、例示的なサーチュイン活性化化合物は、Howitzら(2003)Nature 425:191に記載されたものであり、例えば、レスベラトロール(3,5,4’−トリヒドロキシ−トランス−スチルベン)、ブテイン(3,4,2’,4’−テトラヒドロキシカルコン)、ピセアタンノール(3,5,3’,4’−テトラヒドロキシ−トランス−スチルベン)、イソリキリチゲニン(4,2’,4’−トリヒドロキシカルコン)、フィセチン(3,7,3’,4’−テトラヒドロキシ(hyddroxy)フラボン)、ケルセチン(3,5,7,3’,4’−ペンタヒドロキシフラボン)、デオキシラポンチン(3,5−ジヒドロキシ−4’−メトキシスチルベン3−O−β−D−グルコシド);トランス−スチルベン;ラポンチン(3,3’,5−トリヒドロキシ−4’−メトキシスチルベン3−O−β−D−グルコシド);シス−スチルベン;ブテイン(3,4,2’,4’−テトラヒドロキシカルコン);3,4,2’4’6’−ペンタヒドロキシカルコン;カルコン;7,8,3’,4’−テトラヒドロキシフラボン;3,6,2’,3’−テトラヒドロキシフラボン;4’−ヒドロキシフラボン;5,4’−ジヒドロキシフラボン;5,7−ジヒドロキシフラボン;モリン(3,5,7,2’,4’−ペンタヒドロキシフラボン);フラボン;5−ヒドロキシフラボン;(−)−エピカテキン(ヒドロキシ部位:3,5,7,3’,4’);(−)−カテキン(ヒドロキシ部位:3,5,7,3’,4’);(−)−ガロカテキン(ヒドロキシ部位:3,5,7,3’,4’,5’)(+)−カテキン(ヒドロキシ部位:3,5,7,3’,4’);5,7,3’,4’,5’−ペンタヒドロキシフラボン;ルテオリン(5,7,3’,4’−テトラヒドロキシフラボン);3,6,3’,4’−テトラヒドロキシフラボン;7,3’,4’,5’−テトラヒドロキシフラボン;ケンフェロール(3,5,7,4’−テトラヒドロキシフラボン);6−ヒドロキシアピゲニン(5,6,7,4’−テトラヒドロキシフラボン);スクテラレイン);アピゲニン(5,7,4’−トリヒドロキシフラボン);3,6,2’,4’−テトラヒドロキシフラボン;7,4’−ジヒドロキシフラボン;ダイドゼイン(7,4’−ジヒドロキシイソフラボン);ゲニステイン(5,7,4’−トリヒドロキシフラバノン);ナリンゲニン(5,7,4’−トリヒドロキシフラバノン);3,5,7,3’,4’−ペンタヒドロキシフラバノン;フラバノン;塩化ペラルゴニジン(3,5,7,4’−テトラヒドロキシフラビリウム塩化物);ヒノキチオール(b−ツジャプリシン;2−ヒドロキシ−4−イソプロピル−2,4,6−シクロヘプタトリエン−1−オン);L−(+)−エルゴチオネン((S)−a−カルボキシ−2,3−ジヒドロ−N,N,N−トリメチル−2−チオキソ−1H−イミダゾール−4−エタナミニウム内部塩);コーヒー酸フェニルエステル;MCI−186(3−メチル−1−フェニル−2−ピラゾリン−5−オン);HBED(N,N’−ジ−(2−ヒドロキシベンジル)エチレンジアミン−N,N’−アセト酢酸・Η2O);アンブロキソール(トランス−4−(2−アミノ−3,5−ジブロモベンジルアミノ)シクロヘキサン・HCl;およびU−83836E((−)−2−((4−(2,6−ジ−1−ピロリジニル−4−ピリミジニル)−1−ピペロザイニル(piperzainyl))メチル)−3,4−ジヒドロ−2,5,7,8−テトラメチル−2H−1−ベンゾピラン−6−オール−2HCl)が挙げられる。これらの類縁体および誘導体もまた使用され得る。
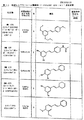
他のサーチュイン活性化化合物は、下記の式1〜25、30、32〜65および69〜76いずれかを有し得る。一実施形態において、サーチュイン活性化化合物は、式1:
R1、R2、R3、R4、R5、R’1、R’2、R3、R’4およびR’5は、H、アルキル、アリール、ヘテロアリール、アラルキル、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2またはカルボキシルを表し;
Rは、H、アルキル、アリール、ヘテロアリールまたはアラルキルを表し;
Mは、O、NRまたはSを表し;
A−Bは、二価のアルキル、アルケニル、アルキニル、アミド、スルホンアミド、ジアゾ、エーテル、アルキルアミノ、アルキルスルフィド、ヒドロキシルアミンまたはヒドラジン基を表し;ならびに
nは0または1である)
のスチルベンまたはカルコン化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが0である。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが1である。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちA−Bがエテニルである。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちA−Bが−CH2CH(Me)CH(Me)CH2−である。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちMがOである。さらなる実施形態において、該方法は、式1の化合物であって、その付随する定義のうちR1、R2、R3、R4、R5、R’1、R’2、R’3、R’4およびR’5がHであるものを含む。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちR2、R4およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちR2、R4、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちR3、R5、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちR1、R3、R5、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちR2およびR’2がOHであり;R4がO−β−D−グルコシドであり;ならびにR’3がOCH3である。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちR2がOHであり;R4がO−β−D−グルコシドであり;ならびにR’3がOCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが0であり;A−Bがエテニルであり;ならびにR1、R2、R3、R4、R5、R’1、R’2、R’3、R’4およびR’5がHである(トランススチルベン)。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが1である;A−Bがエテニルであり;MがOであり;ならびにR1、R2、R3、R4、R5、R’1、R’2、R’3、R’4およびR’5がHである(カルコン)。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが0である;A−Bがエテニルであり;R2、R4およびR’3がOHであり;ならびにR1、R3、R5、R’1、R’2、R’4およびR’5がHである(レスベラトロール)。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが0であり;A−Bがエテニルであり;R2、R4、R’2およびR’3がOHであり;ならびにR1、R3、R5、R’1、R’4およびR’5がHである(ピセアタンノール)。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが1であり;A−Bがエテニルであり;MがOであり;R3、R5、R’2およびR’3がOHであり;ならびにR1、R2、R4、R’1、R’4およびR’5がHである(ブテイン)。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが1であり;A−Bがエテニルであり;MがOであり;R1、R3、R5、R’2およびR’3がOHであり;ならびにR2、R4、R’1、R’4およびR’5がHである(3,4,2’,4’,6’−ペンタヒドロキシカルコン)。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが0であり;A−Bがエテニルであり;R2およびR’2がOHであり、R4がO−β−D−グルコシドであり、R’3がOCH3であり;ならびにR1、R3、R5、R’1、R’4およびR’5がHである(ラポンチン)。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが0であり;A−Bがエテニルであり;R2がOHであり、R4がO−β−D−グルコシドであり、R’3がOCH3であり;ならびにRh、R3、R5、R’1、R’2、R’4およびR’5がHである(デオキシラポンチン)。さらなる実施形態において、サーチュイン活性化化合物は式1の化合物であって、その付随する定義のうちnが0であり;A−Bが−CH2CH(Me)CH(Me)CH2−であり;R2、R3、R’2およびR’3がOHであり;ならびにR1、R4、R5、R’1、R’4およびR’5がHである(NDGA)。
別の実施形態において、サーチュイン活性化化合物は、式2:
R1、R2、R3、R4、R’1、R’2、R’3、R’4、R’5およびR”は、H、アルキル、アリール、ヘテロアリール、アラルキル、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2またはカルボキシルを表し;
Rは、H、アルキル、アリール、ヘテロアリールまたはアラルキルを表し;
Mは、H2、O、NRまたはSを表し;
Zは、CR、O、NRまたはSを表し;
Xは、CRまたはNを表し;ならびに
Yは、CRまたはNを表す)
のフラバノン化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちXおよびYがともにCHである。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちMがOである。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちMがH2である。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちZがOである。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちR”がHである。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちR”がOHである。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちR”がアルコキシカルボニルである。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちR1が
さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちXおよびYがCHであり;MがOであり;ZおよびO;R”がHであり;ならびにR1、R2、R3、R4、R’1、R’2、R’3、R’4、R’5およびR”がHである(フラバノン)。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちXおよびYがCHであり;MがOであり;ZおよびO;R”がHであり;R2、R4およびR’3がOHであり;ならびにR1、R3、R’1、R’2、R’4およびR’5がHである(ナリンゲニン)。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちXおよびYがCHであり;MがOであり;ZおよびO;R”がOHであり;R2、R4、R’2およびR’3がOHであり;ならびにR1、R3、R’1、R’4およびR’5がHである(3,5,7,3’,4’−ペンタヒドロキシフラバノン)。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちXおよびYがCHであり;MがH2であり;ZおよびO;R”がOHであり;R2、R4、R’2およびR’3がOHである;ならびにR1、R3、R’1、R’4およびR’5がHである(エピカテキン)。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちXおよびYがCHであり;MがH2であり;ZおよびO;R”がOHであり;R2、R4、R’2、R’3およびR’4がOHであり;ならびにR1、R3、R’1およびR’5がHである(ガロカテキン)。さらなる実施形態において、サーチュイン活性化化合物は式2の化合物であって、その付随する定義のうちXおよびYがCHであり;MがH2であり;ZおよびO;R”が
別の実施形態において、サーチュイン活性化化合物は、式3:
R1、R2、R3、R4、R’1、R’2、R’3、R’4、R’5およびR”1は、H、アルキル、アリール、ヘテロアリール、アラルキル、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2またはカルボキシルを表し;
Rは、H、アルキル、アリール、ヘテロアリールまたはアラルキルを表し;
Mは、H2、O、NRまたはSを表し;
Zは、C(R)2、O、NRまたはSを表し;
Xは、CRまたはNを表し;ならびに
Yは、CRまたはNを表す)
のイソフラバノン化合物である。
別の実施形態において、サーチュイン活性化化合物は、式4:
R1、R2、R3、R4、R’1、R’2、R’3、R’4およびR’5,は、H、アルキル、アリール、ヘテロアリール、アラルキル、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2またはカルボキシルを表し;
Rは、H、アルキル、アリール、ヘテロアリールまたはアラルキルを表し;
Mは、H2、O、NRまたはSを表し;
Zは、CR、O、NRまたはSを表し;ならびに
Xは、CR”またはNを表す(式中、
R”は、H、アルキル、アリール、ヘテロアリール、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2またはカルボキシルである)
のフラボン化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCRである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちZがOである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちMがOである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR”がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR”がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR1、R2、R3、R4、R’1、R’2、R’3、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R4、R’2、R’3およびR’4がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R4、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR3、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R4、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R’2、R’3およびR’4がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R4およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R3、R4およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R4およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR3、R’1およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR1、R2、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR3、R’1およびR’2がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR4およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2およびR4がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R4、R’1およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR4がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R4、R’2、R’3およびR’4がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR2、R’2、R’3およびR’4がOHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちR1、R2、R4、R’2およびR’3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHである;ZがOであり;MがOであり;ならびにR1、R2、R3、R4、R’1、R’2、R’3、R’4およびR’5がHである(フラボン)。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R2、R’2およびR’3がOHであり;ならびにR1、R3、R4、R’1、R’4およびR’5がHである(フィセチン)。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHであり;ZがOであり;MがOであり;R2、R4、R’2、R’3およびR’4がOHであり;ならびにR1、R3、R’1およびR’5がHである(5,7,3’,4’,5’−ペンタヒドロキシフラボン)。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHであり;ZがOであり;MがOであり;R2、R4、R’2およびR’3がOHであり;ならびにR1、R3、R’1、R’4およびR’5がHである(ルテオリン)。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R3、R’2およびR’3がOHであり;ならびにR1、R2、R4、R’1、R’4およびR’5がHである(3,6,3’,4’−テトラヒドロキシフラボン)。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R2、R4、R’2およびR’3がOHであり;ならびにR1、R3、R’1、R’4およびR’5がHである(ケルセチン)。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHであり;ZがOであり;MがOであり;R2、R’2、R’3およびR’4がOHであり;ならびにR1、R3、R4、R’1およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R2、R4およびR’3がOHであり;ならびにR1、R3、R’1、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHであり;ZがOであり;MがOであり;R2、R3、R4およびR’3がOHであり;ならびにR1、R’1、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHであり;ZがOであり;MがOであり;R2、R4およびR’3がOHであり;ならびにR1、R3、R’1、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R3、R’1およびR’3がOHであり;ならびにR1、R2、R4、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHであり;ZがOであり;MがOであり;R2およびR’3がOHであり;ならびにR1、R3、R4、R’1、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R1、R2、R’2およびR’3がOHであり;ならびにR1、R2、R4、R’3、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R3、R’1およびR’2がOHであり;ならびにR1、R2、R4;R’3、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHであり;ZがOであり;MがOであり;R’3がOHであり;ならびにR1、R2、R3、R4、R’1、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHであり;ZがOであり;MがOであり;R4およびR’3がOHであり;ならびにR1、R2、R3、R’1、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHであり;ZがOであり;MがOであり;R2およびR4がOHであり;ならびにR1、R3、R’1、R’2、R’3、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R2、R4、R’1およびR’3がOHであり;ならびにR1、R3、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCHであり;ZがOであり;MがOであり;R4がOHであり;ならびにR1、R2、R3、R’1、R’2、R’3、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R2、R4、R’2、R’3およびR’4がOHであり;ならびにR1、R3、R’1およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R2、R’2、R’3およびR’4がOHであり;ならびにR1、R3、R4、R’1およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式4の化合物であって、その付随する定義のうちXがCOHであり;ZがOであり;MがOであり;R1、R2、R4、R’2およびR’3がOHであり;ならびにR3、R’1、R’4およびR’5がHである。
別の実施形態において、サーチュイン活性化化合物は、式5:
R1、R2、R3、R4、R’1、R’2、R’3、R’4およびR’5は、H、アルキル、アリール、ヘテロアリール、アラルキル、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2またはカルボキシルを表し;
Rは、H、アルキル、アリール、ヘテロアリールまたはアラルキルを表し;
Mは、H2、O、NRまたはSを表し;
Zは、C(R)2、O、NRまたはSを表し;ならびに
Yは、CR”またはNを表す(式中、
R”は、H、アルキル、アリール、ヘテロアリール、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2またはカルボキシルを表す)
のイソフラボン化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式5の化合物であって、その付随する定義のうちYがCR”である。さらなる実施形態において、サーチュイン活性化化合物は式5の化合物であって、その付随する定義のうちYがCHである。さらなる実施形態において、サーチュイン活性化化合物は式5の化合物であって、その付随する定義のうちZがOである。さらなる実施形態において、サーチュイン活性化化合物は式5の化合物であって、その付随する定義のうちMがOである。さらなる実施形態において、サーチュイン活性化化合物は式5の化合物であって、その付随する定義のうちR2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式5の化合物であって、その付随する定義のうちR2、R4およびR’3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式5の化合物であって、その付随する定義のうちYがCHであり;ZがOであり;MがOであり;R2およびR’3がOHであり;ならびにR1、R3、R4、R’1、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式5の化合物であって、その付随する定義のうちYがCHであり;ZがOであり;MがOであり;R2、R4およびR’3がOHであり;ならびにR1、R3、R’1、R’2、R’4およびR’5がHである。
別の実施形態において、サーチュイン活性化化合物は、式6:
R3、R4、R5、R6、R7、R8、R’2、R’3、R’4、R’5およびR’6は、H、アルキル、アリール、ヘテロアリール、アラルキル、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2またはカルボキシルを表し;
Rは、H、アルキル、アリール、ヘテロアリールまたはアラルキルを表し;ならびに
A−は、以下:Cl−、Br−またはI−から選択されるアニオンを表す)
のアントシアニジン化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式6の化合物であって、その付随する定義のうちA−がCl−である。さらなる実施形態において、サーチュイン活性化化合物は式6の化合物であって、その付随する定義のうちR3、R5、R7およびR’4がOHである。さらなる実施形態において、サーチュイン活性化化合物は式6の化合物であって、その付随する定義のうちR3、R5、R7、R’3およびR’4がOHである。さらなる実施形態において、サーチュイン活性化化合物は式6の化合物であって、その付随する定義のうちR3、R5、R7、R’3、R’4およびR’5がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式6の化合物であって、その付随する定義のうちA−がCl−であり;R3、R5、R7およびR’4がOHであり;ならびにR4、R6、R8、R’2、R’3、R’5およびR’6がHである。さらなる実施形態において、サーチュイン活性化化合物は式6の化合物であって、その付随する定義のうちA−がCl−であり;R3、R5、R7、R’3およびR’4がOHであり;ならびにR4、R6、R8、R’2、R’5およびR’6がHである。さらなる実施形態において、サーチュイン活性化化合物は式6の化合物であって、その付随する定義のうちA−がCl−であり;R3、R5、R7、R’3、R’4およびR’5がOHであり;ならびにR4、R6、R8、R’2およびR’6がHである。
さらなる実施形態において、サーチュイン活性化化合物は、式7:
Mは、存在しないかまたはOであり;
R1、R2、R3、R4、R5、R’1、R’2、R’3、R’4およびR’5は、H、アルキル、アリール、ヘテロアリール、アラルキル、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2またはカルボキシルを表し;
Raは、Hを表すか、またはRaの2つの例が結合を形成し;
Rは、H、アルキル、アリール、ヘテロアリール、アラルキルを表し;ならびに
nは0または1である)
で表されるスチルベン、カルコンまたはフラボン化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちnが0である。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちnが1である。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちMが存在しない。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちMがOである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちRaがHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちMがOであり、2つのRaが結合を形成している。
さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちR5がHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちR5がOHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちR1、R3およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちR2、R4、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちR2、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちR2およびR4がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちnが0であり;Mが存在せず;RaがHであり;R5がHであり;R1、R3およびR’3がOHであり;ならびにR2、R4、R’1、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちnが1であり;Mが存在せず;RaがHであり;R5がHであり;R2、R4、R’2およびR’3がOHであり;ならびにR1、R3、R’1、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される活性化化合物であって、その付随する定義のうちnが1であり;MがOであり;2つのRaが結合を形成し;R5がOHであり;R2、R’2およびR’3がOHであり;ならびにR1、R3、R4、R’1、R’4およびR’5がHである。
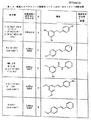
他のサーチュイン活性化化合物としては、以下に示す式8〜25および30からなる群より選択される式を有する化合物が挙げられる。
R2=H、ハロゲン、NO2、SR(R=H、アルキル、アリール)、OR(R=H、アルキル、アリール)、NRR’(R、R’=アルキル、アリール)、アルキル、アリール、カルボキシ
R3=H、ハロゲン、NO2、SR(R=H、アルキル、アリール)、OR(R=H、アルキル、アリール)、NRR’(R、R’=アルキル、アリール)、アルキル、アリール、カルボキシ
R4=H、ハロゲン、NO2、SR(R=H、アルキル、アリール)、OR(R=H、アルキル、アリール)、NRR’(R、R’=アルキル.アリール)、アルキル、アリール、カルボキシ
R5=H、ハロゲン、NO2、SR(R=H、アルキル、アリール)、OR(R=H、アルキル、アリール)、NRR’(R、R’=アルキル、アリール)、アルキル、アリール、カルボキシ
R’1=H、ハロゲン、NO2、SR(R=H、アルキル、アリール)、OR(R=H、アルキル、アリール)、NRR’(R、R’=アルキル、アリール)、アルキル、アリール、カルボキシ
R’2=H、ハロゲン、NO2、SR(R=H、アルキル、アリール)、OR(R=H、アルキル、アリール)、NRR’(R、R’=アルキル、アリール)、アルキル、アリール、カルボキシ
R’3=H、ハロゲン、NO2、SR(R=H、アルキル、アリール)、OR(R=H、アルキル、アリール)、NRR’(R、R’=アルキル、アリール)、アルキル、アリール、カルボキシ
R’4=H、ハロゲン、NO2、SR(R=H、アルキル、アリール)、OR(R=H、アルキル、アリール)、NRR’(R、R−アルキル、アリール)、アルキル、アリール、カルボキシ
R’5=H、ハロゲン、NO2、SR(R=H、アルキル、アリール)、OR(R=H、アルキル、アリール)、NRR’(R、R’=アルキル、アリール)、アルキル、アリール、カルボキシ
R”1=H、ハロゲン、NO2、SR(R=H、アルキル、アリール)、OR(R=H、アルキル、アリール)、NRR’(R、R’=アルキル、アリール)、アルキル、アリール、カルボキシ
A−B=エテン、エチン、アミド、スルホンアミド、ジアゾ、アルキルエーテル、アルキルアミン、アルキルスルフィド、ヒドロキシアミン、ヒドラジン
X=CR、N
Y=CR、N
Z=O、S、C(R)2、NR
R=H、アルキル、アリール、アラルキル
R=H、アルキル、アリール、ヘテロシクリル、ヘテロアリールまたはアラルキル;および
R’=H、ハロゲン、NO2、SR、OR、NR2、アルキル、アリールまたはカルボキシ)
R’=H、ハロゲン、NO2、SR、OR、NR2、アルキル、アリール、アラルキルまたはカルボキシ;および
R=H、アルキル、アリール、ヘテロシクリル、ヘテロアリールまたはアラルキル)
Lは、CR2、O、NRまたはSを表し;
Rは、H、アルキル、アリール、アラルキルまたはヘテロアラルキルを表し;ならびに
R’は、H、ハロゲン、NO2、SR、OR、NR2、アルキル、アリール、アラルキルまたはカルボキシを表す)
Lは、CR2、O、NRまたはSを表し;
Wは、CRまたはNを表し;
Rは、H、アルキル、アリール、アラルキルまたはヘテロアラルキルを表し;
Arは、縮合アリールまたはヘテロアリール環を表し;ならびに
R’は、H、ハロゲン、NO2、SR、OR、NR2、アルキル、アリール、アラルキルまたはカルボキシを表す)
Lは、CR2、O、NRまたはSを表し;
Rは、H、アルキル、アリール、アラルキルまたはヘテロアラルキルを表し;ならびに
R’は、H、ハロゲン、NO2、SR、OR、NR2、アルキル、アリール、アラルキルまたはカルボキシを表す)
Lは、CR2、O、NRまたはSを表す;
Rは、H、アルキル、アリール、アラルキルまたはヘテロアラルキルを表し;ならびに
R’は、H、ハロゲン、NO2、SR、OR、NR2、アルキル、アリール、アラルキルまたはカルボキシを表す)
さらなる実施形態において、サーチュイン活性化化合物は、式30:
Dは、フェニルまたはシクロヘキシル基であり;
R1、R2、R3、R4、R5、R’1、R’2、R’3、R’4およびR’5は、H、アルキル、アリール、ヘテロアリール、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2、カルボキシル、アジド、エーテルを表すか、または任意の2つの隣接するRまたはR’基が一緒になって縮合ベンゼンまたはシクロヘキシル基を形成し;
Rは、H、アルキル、アリールまたはアラルキルを表し;ならびに
A−Bは、エチレン、エテニレンまたはイミン基を表し;
ただし、A−Bがエテニレンである場合、DはフェニルでありR’3がHであり:R1、R2、R4およびR5がHである場合、R3はOHでなく;ならびにR1、R3およびR5がHである場合、R2およびR4はOMeでなく;ならびにR1、R2、R4およびR5がHである場合、R3はOMeでないものとする)
で表されるスチルベン、カルコンまたはフラボン化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちDがフェニル基である。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンまたはイミン基である。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレン基である。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちR2がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちR2がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちR4がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちR2およびR4がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちDがフェニル基であり;およびA−Bがエテニレン基である。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちDがフェニル基であり;A−Bがエテニレン基であり;ならびにR2およびR4がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がClである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がHである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がCH2CH3である。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がFである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がMeである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がアジドである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がSMeである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がNO2である。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がCH(CH3)2である。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がOMeである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;R’2がOHである;ならびにR’3がOMeである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2がOHであり;R4がカルボキシルであり;ならびにR’3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がカルボキシルである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3およびR’4が一緒になって縮合ベンゼン環を形成している。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;ならびにR4がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOCH2OCH3であり;ならびにR’3がSMeである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がカルボキシルである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがシクロヘキシル環であり;ならびにR2およびR4がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;ならびにR3およびR4がOMeである。
さらなる実施形態において、サーチュイン活性化化合物は式30で表される化合物であって、その付随する定義のうちA−Bがエテニレンであり;Dがフェニル環であり;R2およびR4がOHであり;ならびにR’3がOHである。
別の実施形態において、サーチュイン活性化化合物は、式32:
Rは、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;ならびに
R1およびR2は、置換または非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアラルキルである)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式32の化合物であって、その付随する定義のうちRがHである。
さらなる実施形態において、サーチュイン活性化化合物は式32の化合物であって、その付随する定義のうちR1が3−ヒドロキシフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式32の化合物であって、その付随する定義のうちR2がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式32の化合物であって、その付随する定義のうちRがHであり、R1が3−ヒドロキシフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式32の化合物であって、その付随する定義のうちRがHであり、R1が3−ヒドロキシフェニルであり、R2がメチルである。
別の実施形態において、サーチュイン活性化化合物は、式33:
Rは、Hまたは置換もしくは非置換のアルキル、アルケニルまたはアルキニルであり;
R1およびR2は、置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;ならびに
Lは、O、SまたはNRである)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式33の化合物であって、その付随する定義のうちRがアルキニルである。
さらなる実施形態において、サーチュイン活性化化合物は式33の化合物であって、その付随する定義のうちR1が2,6−ジクロロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式33の化合物であって、その付随する定義のうちR2がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式33の化合物であって、その付随する定義のうちLがOである。
さらなる実施形態において、サーチュイン活性化化合物は式33の化合物であって、その付随する定義のうちRがアルキニルであり、R1が2,6−ジクロロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式33の化合物であって、その付随する定義のうちRがアルキニルであり、R1が2,6−ジクロロフェニルであり、R2がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式33の化合物であって、その付随する定義のうちRがアルキニルであり、R1が2,6−ジクロロフェニルであり、R2がメチルであり、LがOである。
別の実施形態において、サーチュイン活性化化合物は、式34:
R、R1およびR2は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;ならびに
nは、0〜5(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式34の化合物であって、その付随する定義のうちRが3,5−ジクロロ−2−ヒドロキシフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式34の化合物であって、その付随する定義のうちR1がHである。
さらなる実施形態において、サーチュイン活性化化合物は式34の化合物であって、その付随する定義のうちR2がHである。
さらなる実施形態において、サーチュイン活性化化合物は式34の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式34の化合物であって、その付随する定義のうちRが3,5−ジクロロ−2−ヒドロキシフェニルであり、R1がHである。
さらなる実施形態において、サーチュイン活性化化合物は式34の化合物であって、その付随する定義のうちRが3,5−ジクロロ−2−ヒドロキシフェニルであり、R1がHであり、R2がHである。
さらなる実施形態において、サーチュイン活性化化合物は式34の化合物であって、その付随する定義のうちRが3,5−ジクロロ−2−ヒドロキシフェニルであり、R1がHであり、R2がHであり、nが1である。
別の実施形態において、サーチュイン活性化化合物は、式35:
Rは、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R1は、置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R2は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアラルキルであり;
Lは、O、NRまたはSであり;
mは、0〜3(両端を含む)の整数であり;
nは、0〜5(両端を含む)整数であり;ならびに
oは、0〜2(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちRがフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちR1がピリジンである。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちLがSである。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちmが0である。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちoが0である。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちRがフェニルであり、R1がピリジンである。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちRがフェニルであり、R1がピリジンであり、LがSである。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちRがフェニルであり、R1がピリジンであり、LがSであり、mが0である。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちRがフェニルであり、R1がピリジンであり、LがSであり、mが0であり、nが1である。
さらなる実施形態において、サーチュイン活性化化合物は式35の化合物であって、その付随する定義のうちRがフェニルであり、R1がピリジンであり、LがSであり、mが0であり、nが1であり、oが0である。
別の実施形態において、サーチュイン活性化化合物は、式36:
R、R3およびR4は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアラルキルであり;
R1およびR2は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアラルキルであり;
L1は、O、NR1、S、C(R)2またはSO2であり;ならびに
L2およびL3は、O、NR1、SまたはC(R)2である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちRがHである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちR1が4−クロロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちR2が4−クロロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちR3がHである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちR4がHである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちL1がSO2である。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちL2がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちL3がOである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちRがHであり、R1が4−クロロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちRがHであり、R1が4−クロロフェニルであり、R2が4−クロロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちRがHであり、R1が4−クロロフェニルであり、R2が4−クロロフェニルであり、R3がHである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちRがHであり、R1が4−クロロフェニルであり、R2が4−クロロフェニルであり、R3がHであり、R4がHである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちRがHであり、R1が4−クロロフェニルであり、R2が4−クロロフェニルであり、R3がHであり、R4がHであり、L1がSO2である。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちRがHであり、R1が4−クロロフェニルであり、R2が4−クロロフェニルであり、R3がHであり、R4がHであり、L1がSO2であり、L2がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式36の化合物であって、その付随する定義のうちRがHであり、R1が4−クロロフェニルであり、R2が4−クロロフェニルであり、R3がHであり、R4がHであり、L1がSO2であり、L2がNHであり、L3がOである。
別の実施形態において、サーチュイン活性化化合物は、式37:
Rは、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアラルキルであり;
R1は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアラルキルであり;
R2およびR3は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアラルキルであり;
Lは、O、NR1またはSであり;ならびに
nは、0〜4(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式37の化合物であって、その付随する定義のうちRがメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式37の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式37の化合物であって、その付随する定義のうちR1が3−フルオロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式37の化合物であって、その付随する定義のうちR2がHである。
さらなる実施形態において、サーチュイン活性化化合物は式37の化合物であって、その付随する定義のうちR3が4−クロロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式37の化合物であって、その付随する定義のうちLがOである。
さらなる実施形態において、サーチュイン活性化化合物は式37の化合物であって、その付随する定義のうちRがメチルであり、nが1である。
さらなる実施形態において、サーチュイン活性化化合物は式37の化合物であって、その付随する定義のうちRがメチルであり、nが1であり、R1が3−フルオロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式37の化合物であって、その付随する定義のうちRがメチルであり、nが1であり、R1が3−フルオロフェニルであり、R2がHである。
さらなる実施形態において、サーチュイン活性化化合物は式37の化合物であって、その付随する定義のうちRがメチルであり、nが1であり、R1が3−フルオロフェニルであり、R2がHであり、R3が4−クロロフェニルである。
別の実施形態において、サーチュイン活性化化合物は、式38:
RおよびR1は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;ならびにL1およびL2は、O、NRまたはSである)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式38の化合物であって、その付随する定義のうちRが3−メトキシフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式38の化合物であって、その付随する定義のうちR1が4−t−ブチルフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式38の化合物であって、その付随する定義のうちL1がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式38の化合物であって、その付随する定義のうちL2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式38の化合物であって、その付随する定義のうちRが3−メトキシフェニルであり、R1が4−t−ブチルフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式38の化合物であって、その付随する定義のうちRが3−メトキシフェニルであり、R1が4−t−ブチルフェニルであり、L1がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式38の化合物であって、その付随する定義のうちRが3−メトキシフェニルであり、R1が4−t−ブチルフェニルであり、L1がNHであり、L2がOである。
別の実施形態において、サーチュイン活性化化合物は、式39:
Rは、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R1は、Hまたは置換もしくは非置換のアルキル、アリール、アルカリール、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1およびL2は、O、NRまたはSであり;ならびに
nは、0〜4(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式39の化合物であって、その付随する定義のうちRがメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式39の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式39の化合物であって、その付随する定義のうちR1が3,4,5−トリメトキシフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式39の化合物であって、その付随する定義のうちL1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式39の化合物であって、その付随する定義のうちL2がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式39の化合物であって、その付随する定義のうちRがメチルであり、nが1である。
さらなる実施形態において、サーチュイン活性化化合物は式39の化合物であって、その付随する定義のうちRがメチルであり、nが1であり、R1が3,4,5−トリメトキシフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式39の化合物であって、その付随する定義のうちRがメチルであり、nが1であり、R1が3,4,5−トリメトキシフェニルであり、L1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式39の化合物であって、その付随する定義のうちRがメチルであり、nが1であり、R1が3,4,5−トリメトキシフェニルであり、L1がSであり、L2がNHである。
別の実施形態において、サーチュイン活性化化合物は、式40:
R、R1、R2、R3は、Hまたは置換もしくは非置換のアルキル、アリール、アルカリール、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R4は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1およびL2は、O、NRまたはSであり;ならびに
nは、0〜3(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちRがHである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちR1がパーフルオロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちR2がHである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちR3がHである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちL1がOである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちL2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちnが0である。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちRがHであり、R1がパーフルオロフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちRがHであり、R1がパーフルオロフェニルであり、R2がHである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちRがHであり、R1がパーフルオロフェニルであり、R2がHであり、R3がHである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちRがHであり、R1がパーフルオロフェニルであり、R2がHであり、R3がHであり、L1がOである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちRがHであり、R1がパーフルオロフェニルであり、R2がHであり、R3がHであり、L1がOであり、L2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式40の化合物であって、その付随する定義のうちRがHであり、R1がパーフルオロフェニルであり、R2がHであり、R3がHであり、L1がOであり、L2がOであり、nが0である。
別の実施形態において、サーチュイン活性化化合物は、式41:
R、R1およびR3は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R2は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1、L2およびL3は、O、NR2またはSであり;ならびに
mおよびnは、0〜8(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちnが0である。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちR1がシアノである。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちR2がエチルである。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちmが0である。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちL1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちL2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちL3がOである。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちnが0であり、R1がシアノである。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちnが0であり、R1がシアノであり、R2がエチルである。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちnが0であり、R1がシアノであり、R2がエチルであり、mが0である。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちnが0であり、R1がシアノであり、R2がエチルであり、mが0であり、L1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちnが0であり、R1がシアノであり、R2がエチルであり、mが0であり、L1がSであり、L2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式41の化合物であって、その付随する定義のうちnが0であり、R1がシアノであり、R2がエチルであり、mが0であり、L1がSであり、L2がOであり、L3がOである。
別の実施形態において、サーチュイン活性化化合物は、式42:
RおよびR2は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R1およびR3は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1、L2、L3およびL4は、O、NR1またはSであり;
mは、0〜6(両端を含む)の整数であり;ならびに
nは、0〜8(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちnが0である。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちR1がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちR2がCF3であり、mが1である。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちR3が4−メチルフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちL1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちL2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちL3がNR1である。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちL4がNR1である。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちnが0であり、R1がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちnが0であり、R1がメチルであり、R2がCF3であり、mが1である。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちnが0であり、R1がメチルであり、R2がCF3であり、mが1である;ならびにR3が4−メチルフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちnが0であり、R1がメチルであり、R2がCF3であり、mが1であり;R3が4−メチルフェニルであり;ならびにL1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちnが0であり、R1がメチルであり、R2がCF3であり、mが1であり;R3が4−メチルフェニルであり;L1がSであり、L2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちnが0であり、R1がメチルであり、R2がCF3であり、mが1であり;R3が4−メチルフェニルであり;L1がSであり、L2がOであり;ならびにL3がNR1である。
さらなる実施形態において、サーチュイン活性化化合物は式42の化合物であって、その付随する定義のうちnが0であり、R1がメチルであり、R2がCF3であり、mが1であり;R3が4−メチルフェニルであり;L1がSであり、L2がOであり;L3がNR1であり、L4がNR1である。
別の実施形態において、サーチュイン活性化化合物は、式43:
RおよびR1は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R2およびR3は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;ならびに
L1およびL2は、O、NR2またはSである)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式43の化合物であって、その付随する定義のうちRがシアノである。
さらなる実施形態において、サーチュイン活性化化合物は式43の化合物であって、その付随する定義のうちR1がNH2である。
さらなる実施形態において、サーチュイン活性化化合物式43の化合物であって、その付随する定義のうちR2が4−ブロモフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式43の化合物であって、その付随する定義のうちR3が3−ヒドロキシ−4−メトキシフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式43の化合物であって、その付随する定義のうちL1がOである。
さらなる実施形態において、サーチュイン活性化化合物は式43の化合物であって、その付随する定義のうちL2がNR2である。
さらなる実施形態において、サーチュイン活性化化合物は式43の化合物であって、その付随する定義のうちRがシアノであり、R1がNH2である。
さらなる実施形態において、サーチュイン活性化化合物は式43の化合物であって、その付随する定義のうちRがシアノであり、R1がNH2であり、R2が4−ブロモフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式43の化合物であって、その付随する定義のうちRがシアノであり、R1がNH2であり、R2が4−ブロモフェニルであり、R3が3−ヒドロキシ−4−メトキシフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式43の化合物であって、その付随する定義のうちRがシアノであり、R1がNH2であり、R2が4−ブロモフェニルであり、R3が3−ヒドロキシ−4−メトキシフェニルであり、L1がOである。
さらなる実施形態において、サーチュイン活性化化合物は式43の化合物であって、その付随する定義のうちRがシアノであり、R1がNH2であり、R2が4−ブロモフェニルであり、R3が3−ヒドロキシ−4−メトキシフェニルであり、L1がOであり、L2がNR2である。
別の実施形態において、サーチュイン活性化化合物は、式44:
Rは、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R1は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1、L2およびL3は、O、NRまたはSであり;ならびに
nは、0〜5(両端を含む)整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちRが3−トリフルオロメチルフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちR1がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちL1がNRである。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちL2がSである。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちL3がNRである。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちnが2である。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちRが3−トリフルオロメチルフェニルであり、R1がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちRが3−トリフルオロメチルフェニルであり、R1がC(O)OCH3であり、L1がNRである。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちRが3−トリフルオロメチルフェニルであり、R1がC(O)OCH3であり、L1がNRであり、L2がSである。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちRが3−トリフルオロメチルフェニルであり、R1がC(O)OCH3であり、L1がNRであり、L2がSであり、L3がNRである。
さらなる実施形態において、サーチュイン活性化化合物は式44の化合物であって、その付随する定義のうちRが3−トリフルオロメチルフェニルであり、R1がC(O)OCH3であり、L1がNRであり、L2がSであり、L3がNRであり、nが2である。
別の実施形態において、サーチュイン活性化化合物は、式45:
Rは、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R1およびR2は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1およびL2は、O、NR1またはSであり;ならびに
nは、0〜4(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式45の化合物であって、その付随する定義のうちnが0である。
さらなる実施形態において、サーチュイン活性化化合物は式45の化合物であって、その付随する定義のうちR1が2−テトラヒドロフラニルメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式45の化合物であって、その付随する定義のうちR2が−CH2CH2C6H4SO2NH2である。
さらなる実施形態において、サーチュイン活性化化合物は式45の化合物であって、その付随する定義のうちL1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式45の化合物であって、その付随する定義のうちL2がNR1である。
さらなる実施形態において、サーチュイン活性化化合物は式45の化合物であって、その付随する定義のうちnが0であり、R1が2−テトラヒドロフラニルメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式45の化合物であって、その付随する定義のうちnが0であり、R1が2−テトラヒドロフラニルメチルであり、R2が−CH2CH2C6H4SO2NH2である。
さらなる実施形態において、サーチュイン活性化化合物は式45の化合物であって、その付随する定義のうちnが0であり、R1が2−テトラヒドロフラニルメチルであり、R2が−CH2CH2C6H4SO2NH2であり、L1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式45の化合物であって、その付随する定義のうちnが0であり、R1が2−テトラヒドロフラニルメチルであり、R2が−CH2CH2C6H4SO2NH2であり、L1がSであり、L2がNR1である。
別の実施形態において、サーチュイン活性化化合物は、式46:
R、R1、R2およびR3は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1およびL2は、O、NR4またはSであり;
R4は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
nは、0〜4(両端を含む)の整数であり;
mは、0〜3(両端を含む)の整数であり;
oは、0〜4(両端を含む)の整数であり;ならびに
pは、0〜5(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちnが0である。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちmが1である。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちR1がClである。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちoが1である。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちR2がClである。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちpが3である。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちR3がOHまたはIである。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちnが0であり、mが1である。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちnが0であり、mが1であり、oが1である。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちnが0であり、mが1であり、oが1であり、R1がClである。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちnが0であり、mが1であり、oが1であり、R1がClであり、pが3である。
さらなる実施形態において、サーチュイン活性化化合物は式46の化合物であって、その付随する定義のうちnが0であり、mが1であり、oが1であり、R1がClであり、pが3であり、R2がOHまたはIである。
別の実施形態において、サーチュイン活性化化合物は、式47:
RおよびR1は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1およびL2は、O、NR4またはSであり;
R4は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;ならびに
mおよびnは、0〜4(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちnが2である。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちRがメチルまたはt−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちmが2である。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちR1がメチルまたはt−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちL1がOである。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちL2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちnが2であり、Rがメチルまたはt−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちnが2であり、Rがメチルまたはt−ブチルであり、mが2である。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちnが2であり、Rがメチルまたはt−ブチルであり、mが2であり、R1がメチルまたはt−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちnが2であり、Rがメチルまたはt−ブチルであり、mが2であり、R1がメチルまたはt−ブチルであり、L1がOである。
さらなる実施形態において、サーチュイン活性化化合物は式47の化合物であって、その付随する定義のうちnが2であり、Rがメチルまたはt−ブチルであり、mが2であり、R1がメチルまたはt−ブチルであり、L1がOであり、L2がOである。
別の実施形態において、サーチュイン活性化化合物は、式48:
R、R1、R2、R3、R4、R5およびR6は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R7は、Hまたは置換もしくは非置換のアルキル、アシル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1、L2およびL3は、O、NR7またはSであり、ならびに
nは、0〜4(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちRがメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちR1がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちR2がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちR3がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちR4がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちR5がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちR6がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちR7がC(O)CF3である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちL1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちL2がSである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちL3がSである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がC(O)OCH3であり、R4がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がC(O)OCH3であり、R4がC(O)OCH3であり、R5がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がC(O)OCH3であり、R4がC(O)OCH3であり、R5がメチルであり、R6がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がC(O)OCH3であり、R4がC(O)OCH3であり、R5がメチルであり、R6がメチルであり、R7がC(O)CF3である。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がC(O)OCH3であり、R4がC(O)OCH3であり、R5がメチルであり、R6がメチルであり、R7がC(O)CF3であり、L1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がC(O)OCH3であり、R4がC(O)OCH3であり、R5がメチルであり、R6がメチルであり、R7がC(O)CF3であり、L1がSであり、L2がSである。
さらなる実施形態において、サーチュイン活性化化合物は式48の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がC(O)OCH3であり、R4がC(O)OCH3であり、R5がメチルであり、R6がメチルであり、R7がC(O)CF3であり、L1がSであり、L2がSであり、L3がSである。
別の実施形態において、サーチュイン活性化化合物は、式49:
R、R1、R2、R3、R4およびR5は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1、L2およびL3は、O、NR6またはSであり;
R6は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;ならびに
nは、0〜4(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちRがメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちR1がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちR2がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちR3がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちR4がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちR5がCH2CH(CH3)2である。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちL1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちL2がSである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちL3がSである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3である。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がメチルであり、R4がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がメチルであり、R4がメチルであり、R5がCH2CH(CH3)2である。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がメチルであり、R4がメチルであり、R5がCH2CH(CH3)2であり、L1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がメチルであり、R4がメチルであり、R5がCH2CH(CH3)2であり、L1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がメチルであり、R4がメチルであり、R5がCH2CH(CH3)2であり、L1がSであり、L2がSである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がメチルであり、R4がメチルであり、R5がCH2CH(CH3)2であり、L1がSであり、L2がSである。
さらなる実施形態において、サーチュイン活性化化合物は式49の化合物であって、その付随する定義のうちnが1であり、Rがメチルであり、R1がC(O)OCH3であり、R2がC(O)OCH3であり、R3がメチルであり、R4がメチルであり、R5がCH2CH(CH3)2であり、L1がSであり、L2がSであり、L3がSである。
別の実施形態において、サーチュイン活性化化合物は、式50:
RおよびR1は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R2は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1およびL2は、O、NR3またはSであり;
R3は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
nは、0〜5(両端を含む)の整数であり;ならびに
mは、0〜4(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちRがCO2Etである。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちmが0である。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちR2がシアノである。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちL1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちL2がSである。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちnが1であり、RがCO2Etである。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちnが1であり、RがCO2Etであり、mが0である。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちnが1であり、RがCO2Etであり、mが0であり、R2がシアノである。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちnが1であり、RがCO2Etであり、mが0であり、R2がシアノであり、L1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式50の化合物であって、その付随する定義のうちnが1であり、RがCO2Etであり、mが0であり、R2がシアノであり、L1がSであり、L2がSである。
別の実施形態において、サーチュイン活性化化合物は、式51:
別の実施形態において、サーチュイン活性化化合物は、式51:
RおよびR1は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
nは、0〜4(両端を含む)の整数であり;ならびに
mは、0〜2(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちnが2である。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちRがClまたはトリフルオロメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちmが2である。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちR1がフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちnが2であり、RがClまたはトリフルオロメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちnが2であり、RがClまたはトリフルオロメチルであり、mが2である。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちnが2であり、RがClまたはトリフルオロメチルであり、mが2であり、R1がフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちRがFである。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちR1が4−メチルフェニルである。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちnが1であり、RがFである。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちnが1であり、RがFであり、mが2である。
さらなる実施形態において、サーチュイン活性化化合物は式51の化合物であって、その付随する定義のうちnが1であり、RがFであり、mが2であり、R1が4−メチルフェニルである。
別の実施形態において、サーチュイン活性化化合物は、式52:
Rは、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R1およびR6は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R2は、アルキレン、アルケニレンまたはアルキニレンであり;
R3、R4およびR5は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1、L2およびL3は、O、NRまたはSであり;
nおよびpは、0〜3(両端を含む)の整数であり;ならびに
mおよびoは、0〜2(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちR1がIである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちR2がアルキニレンである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちmが1である。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちR3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちR4がC(O)OEtである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちoが1である。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちR5がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちpが0である。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちL1がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちL2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちL3がOである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1である。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIであり、R2がアルキニレンである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIであり、R2がアルキニレンであり、mが1である。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIであり、R2がアルキニレンであり、mが1であり、R3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIであり、R2がアルキニレンであり、mが1であり、R3がOHであり、R4がC(O)OEtである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIであり、R2がアルキニレンであり、mが1であり、R3がOHであり、R4がC(O)OEtであり、oが1である。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIであり、R2がアルキニレンであり、mが1であり、R3がOHであり、R4がC(O)OEtであり、oが1であり、R5がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIであり、R2がアルキニレンであり、mが1であり、R3がOHであり、R4がC(O)OEtであり、oが1であり、R5がOHであり、pが0である。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIであり、R2がアルキニレンであり、mが1であり、R3がOHであり、R4がC(O)OEtであり、oが1であり、R5がOHであり、pが0であり、L1がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIであり、R2がアルキニレンであり、mが1であり、R3がOHであり、R4がC(O)OEtであり、oが1であり、R5がOHであり、pが0であり、L1がNHであり、L2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式52の化合物であって、その付随する定義のうちRがCH2CH2OHであり、nが1であり、R1がIであり、R2がアルキニレンであり、mが1であり、R3がOHであり、R4がC(O)OEtであり、oが1であり、R5がOHであり、pが0であり、L1がNHであり、L2がOであり、L3がOである。
別の実施形態において、サーチュイン活性化化合物は、式53:
R、R1、R2、R3、R4およびR5は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1、L2、L3およびL4は、O、NR6もしくはSであり;
R6は、(is and)Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;ならびに
nは、0〜5(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちR1がt−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちR2がO−t−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちR3がt−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちR4がC(O)OMeである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちR5がC(O)OMeである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちL1がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちL2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちL3がOである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちL4がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルであり、R1がt−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルであり、R1がt−ブチルであり、R2がO−t−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルであり、R1がt−ブチルであり、R2がO−t−ブチルであり、R3がt−ブチルである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルであり、R1がt−ブチルであり、R2がO−t−ブチルであり、R3がt−ブチルであり、R4がC(O)OMeである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルであり、R1がt−ブチルであり、R2がO−t−ブチルであり、R3がt−ブチルであり、R4がC(O)OMeであり、R5がC(O)OMeである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルであり、R1がt−ブチルであり、R2がO−t−ブチルであり、R3がt−ブチルであり、R4がC(O)OMeであり、R5がC(O)OMeであり、L1がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルであり、R1がt−ブチルであり、R2がO−t−ブチルであり、R3がt−ブチルであり、R4がC(O)OMeであり、R5がC(O)OMeであり、L1がNHであり、L2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルであり、R1がt−ブチルであり、R2がO−t−ブチルであり、R3がt−ブチルであり、R4がC(O)OMeであり、R5がC(O)OMeであり、L1がNHであり、L2がOであり、L3がOである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルであり、R1がt−ブチルであり、R2がO−t−ブチルであり、R3がt−ブチルであり、R4がC(O)OMeであり、R5がC(O)OMeであり、L1がNHであり、L2がOであり、L3がOであり、L4がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式53の化合物であって、その付随する定義のうちRがO−t−ブチルであり、R1がt−ブチルであり、R2がO−t−ブチルであり、R3がt−ブチルであり、R4がC(O)OMeであり、R5がC(O)OMeであり、L1がNHであり、L2がOであり、L3がOであり、L4がNHであり、nが1である。
別の実施形態において、サーチュイン活性化化合物は、式54:
RおよびR1は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R2、R4およびR5は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R3、R6およびR7は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアラルキルであり;
Lは、O、NRまたはSであり;
nおよびoは、0〜4(両端を含む)の整数であり;ならびに
mは、0〜3(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちRがエチルである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちR1がエチルである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちmが0である。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちR3がHである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちoが0である。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちR5がClである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちR6がHである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちR7がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちLがNHである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちRがエチルであり、R1がエチルである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちRがエチルであり、R1がエチルであり、mが0である。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちRがエチルであり、R1がエチルであり、mが0であり、R3がHである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちRがエチルであり、R1がエチルであり、mが0であり、R3がHであり、oが0である。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちRがエチルであり、R1がエチルであり、mが0であり、R3がHであり、oが0であり、R5がClである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちRがエチルであり、R1がエチルであり、mが0であり、R3がHであり、oが0であり、R5がClであり、R6がHである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちRがエチルであり、R1がエチルであり、mが0であり、R3がHであり、oが0であり、R5がClであり、R6がHであり、R7がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちRがエチルであり、R1がエチルであり、mが0であり、R3がHであり、oが0であり、R5がClであり、R6がHであり、R7がメチルであり、LがNHである。
さらなる実施形態において、サーチュイン活性化化合物は式54の化合物であって、その付随する定義のうちRがエチルであり、R1がエチルであり、mが0であり、R3がHであり、oが0であり、R5がClであり、R6がHであり、R7がメチルであり、LがNHであり、nが1である。
別の実施形態において、サーチュイン活性化化合物は、式55:
R、R1、R4およびR5は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R2およびR3は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;ならびに
L1、L2、L3およびL4は、O、NRまたはSである)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちRがHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちR1がHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちR2がOEtである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちR3がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちR4がHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちR5がHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちL1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちL2がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちL3がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちL4がSである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちRがHであり、R1がHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がOEtである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がOEtであり、R3がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がOEtであり、R3がメチルであり、R4がHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がOEtであり、R3がメチルであり、R4がHであり、R5がHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がOEtであり、R3がメチルであり、R4がHであり、R5がHであり、L1がSである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がOEtであり、R3がメチルであり、R4がHであり、R5がHであり、L1がSであり、L2がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がOEtであり、R3がメチルであり、R4がHであり、R5がHであり、L1がSであり、L2がNHであり、L3がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式55の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がOEtであり、R3がメチルであり、R4がHであり、R5がHであり、L1がSであり、L2がNHであり、L3がNHであり、L4がSである。
別の実施形態において、サーチュイン活性化化合物は、式56:
RおよびR1は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1、L2およびL3は、O、NR2またはSであり;
R2は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
nは、0〜4(両端を含む)の整数であり;ならびに
mは、0〜5(両端を含む)整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式56の化合物であって、その付随する定義のうちnが0である。
さらなる実施形態において、サーチュイン活性化化合物は式56の化合物であって、その付随する定義のうちmが0である。
さらなる実施形態において、サーチュイン活性化化合物は式56の化合物であって、その付随する定義のうちL1がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式56の化合物であって、その付随する定義のうちL2がSである。
さらなる実施形態において、サーチュイン活性化化合物は式56の化合物であって、その付随する定義のうちL3がSである。
さらなる実施形態において、サーチュイン活性化化合物は式56の化合物であって、その付随する定義のうちmが0であり、nが0である。
さらなる実施形態において、サーチュイン活性化化合物は式56の化合物であって、その付随する定義のうちmが0であり、nが0であり、L1がNHである。
さらなる実施形態において、サーチュイン活性化化合物は式56の化合物であって、その付随する定義のうちmが0であり、nが0であり、L1がNHであり、L2がSである。
さらなる実施形態において、サーチュイン活性化化合物は式56の化合物であって、その付随する定義のうちmが0であり、nが0であり、L1がNHであり、L2がSであり、L3がSである。
別の実施形態において、サーチュイン活性化化合物は、式57:
別の実施形態において、サーチュイン活性化化合物は、式57:
R、R1、R2およびR3は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
Aは、アルキレン、アルケニレンまたはアルキニレンであり;
nは、0〜8(両端を含む)の整数であり;
mは、0〜3(両端を含む)の整数であり;
oは、0〜6(両端を含む)の整数であり;ならびに
pは、0〜4(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちnが2である。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちRがOHまたはメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちmが1である。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちR1がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちoが1である。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちR2がC(O)CH3である。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちpが2である。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちR3がCO2Hである。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちAがアルケニレンである。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちnが2であり、RがOHまたはメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちnが2であり、RがOHまたはメチルであり、mが1である。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちnが2であり、RがOHまたはメチルであり、mが1であり、R1がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちnが2であり、RがOHまたはメチルであり、mが1であり、R1がメチルであり、oが1である。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちnが2であり、RがOHまたはメチルであり、mが1であり、R1がメチルであり、oが1であり、R2がC(O)CH3である。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちnが2であり、RがOHまたはメチルであり、mが1であり、R1がメチルであり、oが1であり、R2がC(O)CH3であり、pが2である。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちnが2であり、RがOHまたはメチルであり、mが1であり、R1がメチルであり、oが1であり、R2がC(O)CH3であり、pが2であり、R3がCO2Hである。
さらなる実施形態において、サーチュイン活性化化合物は式57の化合物であって、その付随する定義のうちnが2であり、RがOHまたはメチルであり、mが1であり、R1がメチルであり、oが1であり、R2がC(O)CH3であり、pが2であり、R3がCO2Hであり、Aがアルケニレンである。
別の実施形態において、サーチュイン活性化化合物は、式58:
R、R1、R2、R3、R4、R5、R6、R7、R8およびR9は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1、L2およびL3は、O、NR10またはSであり;ならびに
R10は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルである)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちR1がCH2OHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちR2がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちR2がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちR3がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちR4がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちR5がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちR6がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちR7がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちR8がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちR9がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちL1がOである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちL2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちL3がOである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHであり、R3がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHであり、R3がメチルであり、R4がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHであり、R3がメチルであり、R4がOHであり、R5がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHであり、R3がメチルであり、R4がOHであり、R5がOHであり、R6がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHであり、R3がメチルであり、R4がOHであり、R5がOHであり、R6がOHであり、R7がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHであり、R3がメチルであり、R4がOHであり、R5がOHであり、R6がOHであり、R7がOHであり、R8がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHであり、R3がメチルであり、R4がOHであり、R5がOHであり、R6がOHであり、R7がOHであり、R8がOHであり、R9がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHであり、R3がメチルであり、R4がOHであり、R5がOHであり、R6がOHであり、R7がOHであり、R8がOHであり、R9がメチルであり、L1がOである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHであり、R3がメチルであり、R4がOHであり、R5がOHであり、R6がOHであり、R7がOHであり、R8がOHであり、R9がメチルであり、L1がOであり、L2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式58の化合物であって、その付随する定義のうちRがOHであり、R1がCH2OHであり、R2がOHであり、R3がメチルであり、R4がOHであり、R5がOHであり、R6がOHであり、R7がOHであり、R8がOHであり、R9がメチルであり、L1がOであり、L2がOであり、L3がOである。
別の実施形態において、サーチュイン活性化化合物は、式59:
R、R1、R2およびR3は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
Lは、O、NR、SまたはSeであり;ならびに
nおよびmは、0〜5(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちRがHである。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちR1がHである。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちR2がHである。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちR3がHである。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちLがSeである。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちmが1である。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちRがHであり、R1がHである。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がHである。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がHであり、R3がHである。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がHであり、R3がHであり、LがSeである。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がHであり、R3がHであり、LがSeであり、nが1である。
さらなる実施形態において、サーチュイン活性化化合物は式59の化合物であって、その付随する定義のうちRがHであり、R1がHであり、R2がHであり、R3がHであり、LがSeであり、nが1であり、mが1である。
別の実施形態において、サーチュイン活性化化合物は、式60:
Rは、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R1およびR2は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
Lは、O、NR3、SまたはSO2であり;
R3は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
nは、0〜4(両端を含む)の整数であり;ならびに
mは、1〜5(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちnが1である。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちRがClである。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちR1がNH2である。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちR2がCO2Hである。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちLがSO2である。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちmが1である。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちnが1であり、RがClである。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちnが1であり、RがClであり、R1がNH2である。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちnが1であり、RがClであり、R1がNH2であり、R2がCO2Hである。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちnが1であり、RがClであり、R1がNH2であり、R2がCO2Hであり、LがSO2である。
さらなる実施形態において、サーチュイン活性化化合物は式60の化合物であって、その付随する定義のうちnが1であり、RがClであり、R1がNH2であり、R2がCO2Hであり、LがSO2であり、mが1である。
別の実施形態において、サーチュイン活性化化合物は、式61:
R、R1、R2およびR3は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
nおよびmは、0〜5(両端を含む)の整数である)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちnが2である。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちRが3−ヒドロキシおよび5−ヒドロキシである。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちR1がHである。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちR2がHである。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちmが0である。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちmが1である。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちR3が4−ヒドロキシである。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちR3が4−メトキシである。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちnが2であり、Rが3−ヒドロキシおよび5−ヒドロキシである。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちnが2であり、Rが3−ヒドロキシおよび5−ヒドロキシであり、R1がHである。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちnが2であり、Rが3−ヒドロキシおよび5−ヒドロキシであり、R1がHであり、R2がHである。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちnが2であり、Rが3−ヒドロキシおよび5−ヒドロキシであり、R1がHであり、R2がHであり、mが0である。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちnが2であり、Rが3−ヒドロキシおよび5−ヒドロキシであり、R1がHであり、R2がHであり、mが1である。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちnが2であり、Rが3−ヒドロキシおよび5−ヒドロキシであり、R1がHであり、R2がHであり、mが1であり、R3が4−ヒドロキシである。
さらなる実施形態において、サーチュイン活性化化合物は式61の化合物であって、その付随する定義のうちnが2であり、Rが3−ヒドロキシおよび5−ヒドロキシであり、R1がHであり、R2がHであり、mが1であり、R3が4−メトキシである。
別の実施形態において、サーチュイン活性化化合物は、式62:
R、R1、R2、R3、R4、R5およびR6は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
Lは、O、NR7またはSであり;ならびに
R7は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルである)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちRがOHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちR1がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちR2がCH2OHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちR3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちR4がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちR5がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちR6がCH2OHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちLがOである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちRがOHであり、R1がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちRがOHであり、R1がOHであり、R2がCH2OHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちRがOHであり、R1がOHであり、R2がCH2OHであり、R3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちRがOHであり、R1がOHであり、R2がCH2OHであり、R3がOHであり、R4がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちRがOHであり、R1がOHであり、R2がCH2OHであり、R3がOHであり、R4がOHであり、R5がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちRがOHであり、R1がOHであり、R2がCH2OHであり、R3がOHであり、R4がOHであり、R5がOHであり、R6がCH2OHである。
さらなる実施形態において、サーチュイン活性化化合物は式62の化合物であって、その付随する定義のうちRがOHであり、R1がOHであり、R2がCH2OHであり、R3がOHであり、R4がOHであり、R5がOHであり、R6がCH2OHであり、LがOである。
別の実施形態において、サーチュイン活性化化合物は、式63:
R、R1およびR2は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルである)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式63の化合物であって、その付随する定義のうちRがCO2Hである。
さらなる実施形態において、サーチュイン活性化化合物は式63の化合物であって、その付随する定義のうちR1がエチルである。
さらなる実施形態において、サーチュイン活性化化合物は式63の化合物であって、その付随する定義のうちR2がN−1−ピロリジンである。
さらなる実施形態において、サーチュイン活性化化合物は式63の化合物であって、その付随する定義のうちRがCO2Hであり、R1がエチルである。
さらなる実施形態において、サーチュイン活性化化合物は式63の化合物であって、その付随する定義のうちRがCO2Hであり、R2がN−1−ピロリジンである。
さらなる実施形態において、サーチュイン活性化化合物は式63の化合物であって、その付随する定義のうちR1がエチルであり、R2がN−1−ピロリジンである。
さらなる実施形態において、サーチュイン活性化化合物は式63の化合物であって、その付随する定義のうちRがCO2Hであり、R1がエチルであり、R2がN−1−ピロリジンである。
別の実施形態において、サーチュイン活性化化合物は、式64:
R、R1、R2、R3、R4、R5、R6およびR7は、H、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
L1、L2およびL3は、CH2、O、NR8またはSであり;ならびに
R8は、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルである)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちR1がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちR2がN(Me)2である。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちR3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちR4がC(O)NH2である。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちR5がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちR6がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちR7がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちL1がCH2である。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちL2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちL3がOである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClであり、R1がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClであり、R1がOHであり、R2がN(Me)2である。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClであり、R1がOHであり、R2がN(Me)2であり、R3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2である。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHであり、R6がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHであり、R6がOHであり、R7がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHであり、R6がOHであり、R7がOHであり、L1がCH2である。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHであり、R6がOHであり、R7がOHであり、L1がCH2であり、L2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがClであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHであり、R6がOHであり、R7がOHであり、L1がCH2であり、L2がOであり、L3がOである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHであり、R1がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHであり、R1がOHであり、R2がN(Me)2である。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHであり、R1がOHであり、R2がN(Me)2であり、R3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2である。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHであり、R6がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHであり、R6がOHであり、R7がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHであり、R6がOHであり、R7がOHであり、L1がCH2である。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHであり、R6がOHであり、R7がOHであり、L1がCH2であり、L2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式64の化合物であって、その付随する定義のうちRがHであり、R1がOHであり、R2がN(Me)2であり、R3がOHであり、R4がC(O)NH2であり、R5がOHであり、R6がOHであり、R7がOHであり、L1がCH2であり、L2がOであり、L3がOである。
別の実施形態において、サーチュイン活性化化合物は、式65:
Rは、Hまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;
R1、R2およびR3は、ヒドロキシ、アミノ、シアノ、ハライド、アルコキシ、エーテル、エステル、アミド、ケトン、カルボン酸、ニトロまたは置換もしくは非置換のアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールもしくはヘテロアラルキルであり;ならびに
L1およびL2は、O、NRまたはSである)
の化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちRがメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちR1がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちR2がCO2Hである。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちR3がFである。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちL1がOである。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちL2がOである。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちRがメチルであり、R1がメチルである。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちRがメチルであり、R1がメチルであり、R2がCO2Hである。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちRがメチルであり、R1がメチルであり、R2がCO2Hであり、R3がFである。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちRがメチルであり、R1がメチルであり、R2がCO2Hであり、R3がFであり、L1がOである。
さらなる実施形態において、サーチュイン活性化化合物は式65の化合物であって、その付随する定義のうちRがメチルであり、R1がメチルであり、R2がCO2Hであり、R3がFであり、L1がOであり、L2がOである。
例示的なサーチュイン活性化化合物は、対照速度(control rate)に対して1より大きい比を有する添付の表に挙げたものである。式8の好ましい化合物はジピリダモールであり、式12の好ましい化合物はヒノキチオールであり、式13の好ましい化合物は、L−(+)−エルゴチオネンであり、式19の好ましい化合物はコーヒー酸フェノールエステルであり、式20の好ましい化合物はMCI−186であり、式21の好ましい化合物はHBEDである(別表6)。サーチュイン活性化化合物はまた、表21の化合物の酸化された形態であってもよい。
また、式1〜25、30、32〜65および69〜76のサーチュイン活性化化合物の薬学的に許容され得る付加塩および複合体も含まれる。該化合物が1つ以上のキラル中心を有する場合、特に記載のない限り、該化合物は、本明細書において単一の立体異性体、または立体異性体のラセミ混合物であり得ることが想定される。
一実施形態において、サーチュイン活性化化合物は、式7:
Mは、存在しないかまたはOであり;
R1、R2、R3、R4、R5、R’1、R’2、R’3、R’4およびR’5は、H、アルキル、アリール、ヘテロアリール、アラルキル、アルカリール、ヘテロアラルキル、ハライド、NO2、SR、OR、N(R)2またはカルボキシルを表し;
R3は、Hを表すか、またはRaの2つの実例が結合を形成し;
Rは、H、アルキルまたはアリールを表し;ならびに
nは0または1である)
で表されるスチルベン、カルコンまたはフラボン化合物である。
さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちnが0である。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちnが1である。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちMが存在しない。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちMがOである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちRaがHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちMがOであり、2つのRaが結合を形成している。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちR5がHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちR5がOHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちR1、R3およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちR2、R4、R’2およびR’3がOHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちR2、R’2およびR’3がOHである。
さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちnが0であり;Mが存在せず;R3がHであり;R5がHであり;R1、R3およびR’3がOHであり;ならびにR2、R4、R’1、R’2、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちnが1であり;Mが存在せず;R3がHであり;R5がHであり;R2、R4、R’2およびR’3がOHであり;ならびにR1、R3、R’1、R’4およびR’5がHである。さらなる実施形態において、サーチュイン活性化化合物は式7で表される化合物であって、その付随する定義のうちnが1であり;MがOであり;2つのRaが結合を形成し;R5がOHであり;R2、R’2およびR’3がOHであり;ならびにR1、R3、R4、R’1、R’4およびR’5がHである。
別の実施形態において、例示的なサーチュイン活性化化合物は、イソニコチンアミド類縁体、例えば、米国特許第5,985,848号;同第6,066,722号;同第6,228,847号;同第6,492,347号;同第6,803,455号;ならびに米国特許公開公報第2001/0019823号;同第2002/0061898号;同第2002/0132783号;同第2003/0149261号;同第2003/0229033号;同第2003/0096830号;同第2004/0053944号;同第2004/0110772号;および同第2004/0181063号(これらの開示は、引用によりその全体が本明細書に組み込まれる)に記載されたイソニコチンアミド類縁体などである。例示的な一実施形態(emobidment)において、サーチュイン活性化化合物は、下記の式69〜72のいずれかを有するイソニコチンアミド類縁体であり得る。一実施形態において、サーチュイン活性化化合物は、式69:
一例において、Aは、置換N連結アリールもしくは複素環式基、式−O−Yを有するO連結アリールもしくは複素環式基、または式−O−Yを有するS連結アリールもしくは複素環式基であり;BおよびCはともに、水素であるか、またはBまたはCの一方がハロゲン、アミノまたはチオール基であり、BまたはCの他方が水素であり;ならびにDは、第1級アルコールまたは水素である。Aの非限定的な好ましい例を以下に示す(式中、各RはHまたは電子寄与部分であり、Zはアルキル、アリール、ヒドロキシル、OZ1であり、式中、Z’はアルキルまたはアリール、アミノ、NHZ’であり、式中Z’はアルキルまたはアリールまたはNHZ’Z”であり、式中、Z’およびZ”は独立して、アルキルまたはアリールである)。
Aの例としては、下記のi〜xivが挙げられる。
ある特定の実施形態において、Aは、置換されたニコチンアミド基(上記i、式中、ZがHである)、置換されたピラゾロ基(上記vii)または置換された3−カルボキサミド−イミダゾロ基(上記x、式中、ZがHである)である。さらに、BおよびCは、ともに水素であり得るか、またはBまたはCの一方がハロゲン、アミノもしくはチオール基であり、BまたはCの他方が水素であり;ならびにDは第1級アルコールまたは水素である。
他の実施形態において、BまたはCの他方が水素である場合、BまたはCの一方はハロゲン、アミノまたはチオール基であり得る。さらにまた、Dは、水素、またはホスホジエステルまたは炭素、窒素もしくはイオウ置換ホスホジエステル結合を介してリン酸基、ホスホリル基、ピロリン酸基またはアデノシン一リン酸に、またはホスホジエステルまたは炭素、窒素もしくはイオウ置換ピロホスホジエステル結合を介してアデノシン二リン酸に連結された酸素、窒素、炭素もしくはイオウであり得る。また、アデノシン一リン酸またはアデノシン二リン酸の類縁体を、アデノシン一リン酸またはアデノシン二リン酸基と置き換えてもよい。
ある一部の実施形態において、Aは、2つ以上の電子寄与部分を有する。
他の実施形態において、サーチュイン活性化化合物は、下記の式70、71または72のイソニコチンアミド類縁体化合物である。
例示的な一実施形態において、該化合物は上記の式70であって、式中、EおよびFが独立して、H、CH3、OCH3またはOHである。ただし、好ましくは、EまたはFの一方がHである場合、EまたはFの他方はHでないものとする。
別の例示的な実施形態において、該化合物は、β−1’−5−メチル−ニコチンアミド−2’−デオキシリボース、β−D−1’−5−メチル−ニコ−チンアミド−2’−デオキシリボフラノシド、β−1’−4,5−ジメチル−ニコチンアミド−2’−デ−オキシリボースまたはβ−D−1’−4,5−ジメチル−ニコチンアミド−2’−デオキシリボフラノシドである。
また別の実施形態において、該化合物は、β−1’−5−メチル−ニコチンアミド−2’−デオキシリボースである。
なんら特定の機構に拘束されないが、A上の電子寄与部分が本発明の化合物を、該化合物の残部より加水分解に対して感受性が低くなるように安定化させると考えられる。この改善された化学的安定性により、加水分解による分解に対する抵抗性により生体の系内で、より長期間の作用に利用可能となるため、該化合物の価値が改善される。当業者には、この安定化機能を果たすことが期待され得る多くの電子寄与部分が構想され得よう。好適な電子寄与部分の非限定的な例は、メチル、エチル、O−メチル、アミノ、NMe2、ヒドロキシル、CMe3、アリールおよびアルキル基である。好ましくは、電子寄与部分は、メチル、エチル、O−メチル、アミノ基である。最も好ましい実施形態において、電子寄与部分はメチル基である。
式69〜72の化合物は、遊離形態および塩形態において両方で有用である。用語「薬学的に許容され得る塩」は、無機または有機酸から誘導される無毒性の塩に適用されることが意図され、例えば、以下の酸:塩酸、硫酸、リン酸、酢酸、乳酸、フマル酸、コハク酸、酒石酸、グルコン酸、クエン酸、メタンスルホン酸およびp−トルエンスルホン酸から誘導される塩が挙げられる。
また、本明細書において開示された阻害剤化合物の互変異性体、薬学的に許容され得る塩、エステルおよびプロドラッグである式69〜72の化合物が提供される。
式69〜72の化合物の生物学的利用可能性は、プロドラッグ形態への変換によって増強され得る。かかるプロドラッグは、非変換化合物と比べて改善された親油性を有するものであり得、これは、増強され膜透過性をもたらし得る。特に有用なプロドラッグの一形態は、エステル誘導体である。その有用性は、遍在性細胞内リパーゼが、エステル基の加水分解を触媒する作用、該活性化合物をその作用部位またはその付近に放出する作用の1つ以上に依存する。プロドラッグの一形態において、該化合物内の1つ以上のヒドロキシ基をO−アシル化し、アシル化誘導体を作製してもよい。
また、式69〜72の化合物の5−リン酸エステル誘導体のプロドラッグ形態を作製してもよい。これは、5−リン酸エステルのアニオン性の性質により、細胞膜を通るその能力が制限され得るため、特に有用であり得る。好都合には、かかる5−リン酸エステル誘導体は、非荷電性ビス(アシルオキシメチル)エステル誘導体に変換され得る。かかるプロドラッグの有用性は、遍在性細胞内リパーゼが、エステル基の加水分解を触媒する作用、ホルムアルデヒド分子および本発明の化合物をその作用部位またはその付近に放出する作用の1つ以上に依存する。リン酸化され炭水化物誘導体のかかるアシルオキシメチルエステルプロドラッグ形態の有用性の具体例および一般的な作製方法は記載されている(Kangら,1998;Jiangら,1998;Liら,1997;Kruppaら,1997)。
別の実施形態において、例示的なサーチュイン活性化化合物は、O−アセチル−ADP−リボース類縁体であり、2’−O−アセチル−ADP−リボースおよび3’−O−アセチル−ADP−リボースならびにその類縁体が挙げられる。例示的なO−アセチル−ADP−リボース類縁体は、例えば、米国特許公開公報第2004/0053944号;同第2002/0061898号;および同第2003/0149261(これらの開示は、引用によりその全体が本明細書に組み込まれる)に記載されている。例示的な一実施形態(emobidment)において、サーチュイン活性化化合物は、下記式73〜76のいずれかを有するO−アセチル−ADP−リボース類縁体であり得る。一実施形態において、サーチュイン活性化化合物は、式73:
Aは、N、CHおよびCR(式中、Rは、ハロゲン、任意選択で置換されたアルキル、アラルキルおよびアリール、OH、NH2、NHR1、NR1R2およびSR3から選択され(式中R1、R2およびR3は各々、任意選択で置換されたアルキル、アラルキルまたはアリール基である))から選択され;
Bは、OH、NH2、NHR4、Hおよびハロゲン(式中、R4は、任意選択で置換されたアルキル、アラルキルまたはアリール基である)から選択され;
Dは、OH、NH2、NHR5、H、ハロゲンおよびSCH3(式中、R5は、任意選択で置換されたアルキル、アラルキルまたはアリール基である)から選択され;
XおよびYは独立して、H、OHおよびハロゲンから選択され、ただし、XおよびYの一方がヒドロキシまたはハロゲンである場合、他方は水素であり;
ZがOHであるか、またはXがヒドロキシである場合、Zは、水素、ハロゲン、ヒドロキシ、SQおよびOQ(式中、Qは、任意選択で置換されたアルキル、アラルキルもしくはアリール基である)から選択され;ならびに
Wは、OHまたはHであり、ただし、WがOHである場合、AはCR(式中Rは、上記規定のとおりである)である)
のO−アセチル−ADP−リボース類縁体化合物;またはその互変異性体;またはその薬学的に許容され得る塩;またはそのエステル;またはそのプロドラッグである。
ある特定の実施形態において、BがNHR4であり、および/またはDがNHR5である場合、R4および/またはR5はC1〜C4アルキルである。
他の実施形態において、1種類以上のハロゲンが存在する場合、これらは、塩素およびフッ素から選択される。
別の実施形態において、ZがSQまたはOQである場合、QはC1〜C5アルキルまたはフェニルである。
例示的な一実施形態において、DはHであるか、またはDがH以外である場合、BはOHである。
別の実施形態において、BはOHであり、DはH、OHまたはNH2であり、XはOHまたはHであり、YはHであり、最も好ましくは、OH、Hまたはメチルチオ、特にOHであるZを伴う。
ある特定の実施形態において、WはOHであり、YはHであり、XはOHであり、AはCR(式中、Rはメチルまたはハロゲン、好ましくはフッ素である)である。
他の実施形態において、WはHであり、YはHであり、XはOHであり、AはCHである。
他の実施形態において、サーチュイン活性化化合物は、式74:
のO−アセチル−ADP−リボース類縁体化合物;またはその互変異性体、またはその薬学的に許容され得る塩、またはそのエステル、またはそのプロドラッグである。
ある特定の実施形態において、EはCONH2であり、GはNH2である。
他の実施形態において、EはCONH2であり、GはNH2であり、XはOHまたはHであり、Hであり、最も好ましくは、OH、Hまたはメチルチオ、特にOHであるZを伴う。
例示的なサーチュイン活性化化合物としては、以下:
(1S)−1,4−ジデオキシ−1−C−(4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−D−リビトール
(1S)−1−C−(2−アミノ−4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−ジデオキシ−1,4−イミノ−D−リビトール
(1R)−1−C−(4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ−ペンチトール
(1S)−1−C−(4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−5−メチルチオ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(2,4−ジヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−D−リビトール
(1R)−1−C−(2,4−ジヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ(erthro)−ペンチトール
(1S)−1−C−(2,4−ジヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(2,4−ジヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−5−エチルチオ−D−リビトール
(1R)−1−C−(2−アミノ−4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ−ペンチトール
(1S)−1−C−(2−アミノ−4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1−C−(2−アミノ−4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−ジデオキシ−1,4−イミノ−5−メチルチオ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−D−リビトール
(1R)−1−C−(7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ−ペンチトール
(1S)−1−C−(7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−5−エチルチオ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(5,7−ジヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−D−リビトール
(1R)−1−C−(5,7−ジヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ−ペンチトール
(1S)−1−C−(5,7−ジヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(5,7−ジヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−5−メチルチオ−D−リビトール
(1S)−1−C−(5−アミノ−7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−ジデオキシ−1,4−イミノ−D−リビトール
(1R)−1−C−(S−アミノ−7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ−ペンチトール
(1S)−1−C−(5−アミノ−7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1−C−(5−アミノ−7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−ジデオキシ−1,4−イミノ−5−メチルチオ−D−リビトール
(1S)−1−C−(3−アミノ−2−カルボキサミド−4−ピロリル)−1,4−ジデオキシ−1,4−イミノ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−D−リビトール5−ホスフェート
(1S)−1−C−(2−アミノ−4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−D−リビトール5−ホスフェート
(1S)−1−C−(3−アミノ−2−カルボキサミド−4−ピロリル)−1,4−ジデオキシ−1,4−イミノ−D−リビトール
が挙げられる。
(1S)−1,4−ジデオキシ−1−C−(4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−D−リビトール
(1S)−1−C−(2−アミノ−4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−ジデオキシ−1,4−イミノ−D−リビトール
(1R)−1−C−(4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ−ペンチトール
(1S)−1−C−(4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−5−メチルチオ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(2,4−ジヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−D−リビトール
(1R)−1−C−(2,4−ジヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ(erthro)−ペンチトール
(1S)−1−C−(2,4−ジヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(2,4−ジヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−5−エチルチオ−D−リビトール
(1R)−1−C−(2−アミノ−4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ−ペンチトール
(1S)−1−C−(2−アミノ−4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1−C−(2−アミノ−4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−ジデオキシ−1,4−イミノ−5−メチルチオ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−D−リビトール
(1R)−1−C−(7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ−ペンチトール
(1S)−1−C−(7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−5−エチルチオ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(5,7−ジヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−D−リビトール
(1R)−1−C−(5,7−ジヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ−ペンチトール
(1S)−1−C−(5,7−ジヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(5,7−ジヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−5−メチルチオ−D−リビトール
(1S)−1−C−(5−アミノ−7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−ジデオキシ−1,4−イミノ−D−リビトール
(1R)−1−C−(S−アミノ−7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,2,4−トリデオキシ−D−エリトロ−ペンチトール
(1S)−1−C−(5−アミノ−7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−イミノ−1,4,5−トリデオキシ−D−リビトール
(1S)−1−C−(5−アミノ−7−ヒドロキシピラゾロ[4,3−d]ピリミジン−3−イル)−1,4−ジデオキシ−1,4−イミノ−5−メチルチオ−D−リビトール
(1S)−1−C−(3−アミノ−2−カルボキサミド−4−ピロリル)−1,4−ジデオキシ−1,4−イミノ−D−リビトール
(1S)−1,4−ジデオキシ−1−C−(4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−D−リビトール5−ホスフェート
(1S)−1−C−(2−アミノ−4−ヒドロキシピロロ[3,2−d]ピリミジン−7−イル)−1,4−イミノ−D−リビトール5−ホスフェート
(1S)−1−C−(3−アミノ−2−カルボキサミド−4−ピロリル)−1,4−ジデオキシ−1,4−イミノ−D−リビトール
が挙げられる。
また他の実施形態において、サーチュイン活性化化合物は、式75および76のO−アセチル−ADP−リボース類縁体化合物、その互変異性体および薬学的に許容され得る塩である。
プロドラッグの一形態において、式(75)または式(76)の化合物内の1つ以上のヒドロキシ基をO−アシル化し、例えば、5−O−酪酸エステルまたは2,3−ジ−O−酪酸エステル誘導体を作製してもよい。
また、式(75)または式(76)の化合物の5−リン酸エステル誘導体のプロドラッグ形態を作製してもよく、これは、5−リン酸エステルのアニオン性の性質により、細胞膜を通るその能力が制限され得るため、特に有用であり得る。好都合には、かかる5−リン酸エステル誘導体は、非荷電性ビス(アシルオキシメチル)エステル誘導体に変換され得る。かかるプロドラッグの有用性は、遍在性細胞内リパーゼが、これらのエステル基(1つまたは複数)の加水分解を触媒する作用、ホルムアルデヒド分子および式(75)または式(76)の化合物をその作用部位またはその付近に放出する作用の1つ以上に依存する。
例示的な一実施形態において、2’−AADPRまたは3’−AADPRの類縁体は、エステラーゼ攻撃に供されるエステル酸素原子のためのよく知られた置換基の使用によって、エステラーゼの作用に対して増大した安定性を有するように設計される。2’−AADPRおよび3’−AADPR内のエステラーゼ不安定性酸素原子は、アセテート基をリボースと連結させるエステル酸素、および2つのリン原子間のエステル酸素であることは理解されよう。当該技術分野において理解されているように、CF2、NHまたはSによるこれらのエステル酸素原子のいずれかまたは両方の置換により、エステラーゼの作用に対する抵抗性の増大により実質的により安定な2’−AADPRまたは3’−AADPR類縁体が提供されることが予測され得る。
したがって、一部のある実施形態において、本発明は、細胞内で増大された安定性を示す類縁体2’−O−アセチル−ADP−リボースまたは3’−O−アセチル−ADP−リボースに関する。この好ましい類縁体は、アセチルエステル酸素または2つのリン原子間の酸素の代わりにCF2、NHまたはSを含む。最も好ましい置換基(substitute)はCF2である。アセチルエステル酸素の置換えは、特に好ましい。他の好ましい実施形態では、エステル酸素および2つのリン原子間の酸素の両方を、独立して、CF2、NHまたはSで置換する。
また、本明細書に記載するサーチュイン活性化合物の薬学的に許容され得る付加塩および複合体も含まれる。該化合物が1つ以上のキラル中心を有し得る場合、特に記載のない限り、該化合物は、本明細書において単一の立体異性体、または立体異性体のラセミ混合物であり得ることが想定される。
サーチュイン活性化化合物が不飽和炭素−炭素二重結合を有する場合、シス(Z)およびトランス(E)両方の異性体が本明細書において想定される。該化合物が、互変異性体形態、例えばケト−エノール互変異性体、例えば、
また、本明細書に示す方法には、本明細書に記載のサーチュイン活性化化合物のプロドラッグが含まれる。プロドラッグは、活性親薬物をインビボで放出する任意の共有結合された担体であるとみなされる。
本明細書に記載のサーチュイン活性化化合物の類縁体および誘導体はまた、サーチュインタンパク質ファミリーの構成員を活性化するために使用され得る。例えば、誘導体または類縁体は、該化合物をより安定にするもの、または細胞膜を横切る能力、または食作用もしくはピノサイトーシスを受ける能力を改善するものであり得る。例示的な誘導体としては、グリコシル化された誘導体が挙げられ、例えば、米国特許第6,361,815号にレスベラトロールについて記載されている。レスベラトロールの他の誘導体としては、シス−およびトランス−レスベラトロール、ならびに例えば、グルコシドを形成するための糖とのそのコンジュゲート(例えば、米国特許第6,414,037号参照)が挙げられる。グルコシドポリダチン(ピセイドまたはレスベラトロール3−O−β−D−グルコピラノシドという)もまた使用され得る。化合物をコンジュゲートさせ得る糖類としては、グルコース、ガラクトース、マルトース、ラクトースおよびスクロースが挙げられる。グリコシル化スチルベンは、Regev−Shoshaniら、Biochemical J.(4/16/03にBJ20030141として発行)にさらに記載されている。本明細書に記載の化合物の他の誘導体は、エステル、アミドおよびプロドラッグである。レスベラトロールのエステルは、例えば、米国特許第6,572,882号に記載されている。レスベラトロールおよびその誘導体は、当該技術分野において、例えば、米国特許第6,414,037号;同第6,361,815号;同第6,270,780号;同第6,572,882号;およびBrandoliniら(2002)J.Agric.Food.Chem.50:7407に記載されたようにして調製され得る。ヒドロキシフラボンの誘導体は、例えば、米国特許第4,591,600号に記載されている。また、レスベラトロールおよび他の活性化化合物は、例えば、Sigma製の市販品として入手可能である。
ある特定の実施形態において、サーチュイン活性化化合物が天然に存在する場合、これは、使用前にその天然環境から少なくとも部分的に単離されたものであり得る。例えば、植物ポリフェノールは、植物から単離され、本明細書に記載の方法における使用の前に一部または有意に精製され得る。活性化化合物はまた、合成により調製され得、この場合、天然では会合している他の化合物を含まなくてよい。例示的な実施形態において、活性化組成物は、天然では会合している化合物の約50%、10%、1%、0.1%、10−2%または10−3%未満を含むか、または活性化化合物がこれと会合している。
ある特定の実施形態において、ある特定の生物学的機能(例えば、紅潮および/または体重増加の低減)は、サーチュイン活性化化合物によってモジュレートされ、この場合、サーチュイン活性化化合物という用語は、1種類以上の特定の化合物を含まないことを条件とする。例えば、ある特定の実施形態において、サーチュイン活性化化合物は、サーチュインタンパク質の発現および/または活性のレベルを増大させることができる任意の化合物であり得、この場合、該化合物は、レスベラトロール、フラボンまたは本明細書に具体的に示した任意の他の化合物ではないことを条件とする。例示的な一実施形態において、サーチュイン活性化化合物は式1〜25、30、32〜65および69〜76いずれか1つの化合物であり得、この場合、該化合物は、レスベラトロール、フラボンまたは本明細書に具体的に示した任意の他の化合物ではないことを条件とする。ある特定の実施形態において、サーチュイン活性化化合物は、式69〜72のいずれか1つ、式73〜76のいずれか1つ、または式69〜76のいずれか1つの化合物を含まない。
ある特定の実施形態において、サーチュイン活性化化合物は、サーチュイン(例えば、SIRT1)の脱アセチル化酵素活性を活性化するのに有効な(例えば、インビボで)濃度において、PI3−キナーゼを阻害する、アルドレダクターゼ(aldoreductase)を阻害する、および/またはチロシンプロテインキナーゼを阻害する実質的な能力をなんら有しない。例えば、好ましい実施形態において、サーチュイン活性化化合物は、アルドレダクターゼおよび/またはチロシンプロテインキナーゼ1種類以上の阻害のためのEC50よりも少なくとも5倍小さい、さらにより好ましくは少なくとも10倍、100倍または1000倍も小さい、サーチュイン脱アセチル化酵素活性を活性化するためのEC50を有するように選択される。PI3−キナーゼ活性、アルドースレダクターゼ活性およびチロシンキナーゼ活性をアッセイするための方法は、当該技術分野でよく知られており、かかるアッセイを行なうためのキットは市販品として購入され得る。例えば、PI3−キナーゼアッセイについては米国特許公開公報第2003/0158212号;アルドースレダクターゼアッセイについては米国特許公開公報第2002/20143017号を参照のこと。チロシンキナーゼアッセイキットは、例えば、Promega(Madison,WI;ワールドワイドウェブにおけるpromega.com)、Invitrogen(Carlsbad,CA;ワールドワイドウェブにおけるinvitrogen.com)またはMolecular Devices(Sunnyvale,CA;ワールドワイドウェブにおけるmoleculardevices.com)から市販品として購入され得る。
ある特定の実施形態において、サーチュイン活性化化合物は、サーチュインの脱アセチル化酵素活性を活性化するのに有効な(例えば、インビボで)濃度において、EGFRチロシンキナーゼ活性をトランス活性化する実質的な能力をなんら有しない。例えば、好ましい実施形態において、サーチュイン活性化化合物は、EGFRチロシンキナーゼ活性をトランス活性化するためのEC50よりも少なくとも5倍小さい、さらにより好ましくは少なくとも10倍、100倍または1000倍も小さい、サーチュイン脱アセチル化酵素活性を活性化するためのEC50を有するように選択される。EGFRチロシンキナーゼ活性のトランス活性化をアッセイするための方法は、当該技術分野でよく知られており、例えば、Paiら、Nat.Med.8:289−93(2002)およびVaccaら、Cancer Research 60:5310−5317(2000)を参照のこと。
ある特定の実施形態において、サーチュイン活性化化合物は、サーチュインの脱アセチル化酵素活性を活性化するのに有効な(例えば、インビボで)濃度において、冠状動脈拡張を引き起こす実質的な能力をなんら有しない。例えば、好ましい実施形態において、サーチュイン活性化化合物は、冠状動脈拡張のためのEC50よりも少なくとも5倍小さい、さらにより好ましくは少なくとも10倍、100倍または1000倍も小さい、サーチュイン脱アセチル化酵素活性を活性化するためのEC50を有するように選択される。血管拡張をアッセイするための方法は、当該技術分野でよく知られており、例えば、米国特許公開公報第2004/0236153号を参照のこと。
ある特定の実施形態において、サーチュイン活性化化合物は、サーチュインの脱アセチル化酵素活性を活性化するのに有効な(例えば、インビボで)濃度において、実質的な鎮痙活性をなんら有しない。例えば、好ましい実施形態において、サーチュイン活性化化合物は、鎮痙効果(例えば、胃腸の筋肉に対して)のためのEC50よりも少なくとも5倍小さい、さらにより好ましくは少なくとも10倍、100倍または1000倍も小さい、サーチュイン脱アセチル化酵素活性を活性化するためのEC50を有するように選択される。鎮痙活性をアッセイするための方法は、当該技術分野でよく知られており、例えば、米国特許公開公報第2004/0248987号を参照のこと。
ある特定の実施形態において、主題のサーチュイン活性化剤は、サーチュインの脱アセチル化酵素活性を活性化するのに有効な(例えば、インビボで)濃度において、肝臓シトクロムP450 1B1(CYP)を阻害する実質的な能力をなんら有しない。例えば、好ましい実施形態において、サーチュイン活性化化合物は、P450 1B1の阻害のためのEC50よりも少なくとも5倍小さい、さらにより好ましくは少なくとも10倍、100倍または1000倍も小さい、サーチュイン脱アセチル化酵素活性を活性化するためのEC50を有するように選択される。シトクロムP450活性をアッセイするための方法は、当該技術分野でよく知られており、かかるアッセイを行なうためのキットは市販品として購入され得る。例えば、米国特許第6,420,131号および同第6,335,428号ならびにPromega(Madison,WI;ワールドワイドウェブにおけるpromega.com)を参照のこと。
ある特定の実施形態において、サーチュイン活性化化合物は、サーチュインの脱アセチル化酵素活性を活性化するのに有効な(例えば、インビボで)濃度において、核性因子−κB(NF−κB)を阻害する実質的な能力をなんら有しない。例えば、好ましい実施形態において、サーチュイン活性化化合物は、NF−κBの阻害のためのEC50よりも少なくとも5倍小さい、さらにより好ましくは少なくとも10倍、100倍または1000倍も小さい、サーチュイン脱アセチル化酵素活性を活性化するためのEC50を有するように選択される。NF−κB活性をアッセイするための方法は、当該技術分野でよく知られており、かかるアッセイを行なうためのキットは市販品として購入され得る(例えば、Oxford Biomedical Research(Ann Arbor,MI;ワールドワイドウェブにおけるoxfordbiomed.com)から)。
ある特定の実施形態において、サーチュイン活性化化合物は、サーチュインの脱アセチル化酵素活性を活性化するのに有効な(例えば、インビボで)濃度において、ヒストン脱アセチル化酵素(HDAC)クラスI、HDACクラスIIまたはHDAC IおよびIIを阻害する実質的な能力をなんら有しない。例えば、好ましい実施形態において、サーチュイン活性化化合物は、HDAC Iおよび/またはHDAC IIの阻害のためのEC50よりも少なくとも5倍小さい、さらにより好ましくは少なくとも10倍、100倍または1000倍も小さい、サーチュイン脱アセチル化酵素活性を活性化するためのEC50を有するように選択される。HDAC Iおよび/またはHDAC II活性をアッセイするための方法は、当該技術分野でよく知られており、かかるアッセイを行なうためのキットは市販品として購入され得る。例えば、BioVision,Inc.(Mountain View,CA;ワールドワイドウェブにおけるbiovision.com)およびThomas Scientific(Swedesboro,NJ;ワールドワイドウェブにおけるtomassci.com)を参照のこと。
ある特定の実施形態において、サーチュイン活性化化合物は、ヒトSIRT1の脱アセチル化酵素活性を活性化するのに有効な(例えば、インビボで)濃度において、下等真核生物、特に酵母またはヒト病原体においてSIRT1オルソログを活性化する実質的な能力をなんら有しない。例えば、好ましい実施形態において、サーチュイン活性化化合物は、酵母Sir2(例えば、Candida、S.cerevisiaeなど)を活性化するためのEC50よりも少なくとも5倍小さい、さらにより好ましくは少なくとも10倍、100倍または1000倍も小さい、ヒトSIRT1脱アセチル化酵素活性を活性化するためのEC50を有するように選択される。
ある特定の実施形態において、サーチュイン活性化化合物は、1種類以上のサーチュインタンパク質ホモログ、例えば、ヒトSIRT1、SIRT2、SIRT3、SIRT4、SIRT5、SIRT6またはSIRT7の1種類以上などを活性化する能力を有し得る。他の実施形態において、サーチュイン活性化化合物は、ヒトSIRT1の脱アセチル化酵素活性を活性化するのに有効な(例えば、インビボで)濃度において、他のサーチュインタンパク質ホモログ、例えば、ヒトSIRT2、SIRT3、SIRT4、SIRT5、SIRT6またはSIRT7の1種類以上などを活性化する実質的な能力をなんら有しない。例えば、サーチュイン活性化化合物は、ヒトSIRT2、SIRT3、SIRT4、SIRT5、SIRT6またはSIRT7の1種類以上を活性化するためのEC50よりも少なくとも5倍小さい、さらにより好ましくは少なくとも10倍、100倍または1000倍も小さい、ヒトSIRT1脱アセチル化酵素活性を活性化するためのEC5Oを有するように選択される。
他の実施形態において、サーチュイン活性化化合物は、サーチュインの脱アセチル化酵素活性を活性化するのに有効な(例えば、インビボで)濃度において、プロテインキナーゼを阻害し;マイトジェン活性化タンパク質(MAP)キナーゼをリン酸化し;シクロオキシゲナーゼ(例えば、COX−2など)の触媒活性もしくは転写活性を阻害し;一酸化窒素シンターゼ(iNOS)を阻害すし;またはI型コラーゲンへの血小板粘着を阻害する実質的な能力をなんら有しない。例えば、好ましい実施形態において、サーチュイン活性化化合物は、これらの活性のいずれかを発揮させるためのEC50よりも少なくとも5倍小さい、さらにより好ましくは少なくとも10倍、100倍または1000倍も小さい、サーチュイン脱アセチル化酵素活性を活性化するためのEC50を有するように選択される。プロテインキナーゼ活性、シクロオキシゲナーゼ活性、一酸化窒素シンターゼ活性および血小板粘着活性をアッセイするための方法は、当該技術分野でよく知られており、かかるアッセイを行なうためのキットは市販品として購入され得る。例えば、Promega(Madison,WI;ワールドワイドウェブにおけるpromega.com)、Invitrogen(Carlsbad,CA;ワールドワイドウェブにおけるinvitrogen.com);プロテインキナーゼアッセイキットについては、Molecular Devices(Sunnyvale,CA;ワールドワイドウェブにおけるmoleculardevices.com)またはAssay Designs(Ann Arbor,MI;ワールドワイドウェブにおけるアッセイdesigns.com);シクロオキシゲナーゼアッセイキットについては、Amersham Biosciences(Piscataway,NJ;ワールドワイドウェブにおけるamershambiosciences.com);一酸化窒素シンターゼアッセイキットについては、Amersham Biosciences(Piscataway,NJ;ワールドワイドウェブにおけるamershambiosciences.com)およびR&D Systems(Minneapolis,MN;ワールドワイドウェブにおけるrndsystems.com);ならびに血小板粘着アッセイについては、米国特許第5,321,010号;同第6,849,290号;および同第6,774,107号を参照のこと。
ある特定の実施形態において、本明細書に記載のサーチュイン活性化化合物は、当該技術分野で知られた任意の標準的なアッセイによって測定したとき、有意なまたは検出可能な抗酸化活性を有さない。例えば、サーチュイン活性化化合物は、O2ラジカルなどのフリーラジカルを有意にスカベンジしない。サーチュイン活性化化合物は、別のサーチュイン活性化化合物、例えばレスベラトロールと比べ、約2、3、5、10、30または100倍低い抗酸化活性を有し得る。
ある特定の実施形態において、サーチュイン活性化化合物は、約10−9M、10−10M、10−11M、10−12Mまたはそれ未満のサーチュインに対する結合親和性を有し得る。サーチュイン活性化化合物は、サーチュインのその基質またはNAD+に対するKmを、少なくとも約2、3、4、5、10、20、30、50または100倍低下させ得る。サーチュイン活性化化合物は、サーチュインのVmaxを少なくとも約2、3、4、5、10、20、30、50または100倍増加させ得る。サーチュインのVmaxを増加させ得る例示的なサーチュイン活性化化合物としては、例えば、イソニコチンアミドの類縁体、例えば、式69〜72の化合物など、および/またはO−アセチル−ADP−リボースの類縁体、例えば、式73〜76の化合物などが挙げられる。サーチュイン活性化化合物は、約1nM未満、約10nM未満、約100nM未満、約1μM未満、約10μM未満、約100μM未満、または約1〜10nM、約10〜100nM、約0.1〜1μM、約1〜10μMもしくは約10〜100μMのサーチュインの脱アセチル化酵素活性を活性化するためのEC50を有し得る。サーチュイン活性化化合物は、実施例に記載した無細胞アッセイまたは細胞系アッセイにおいて測定したとき、サーチュインの脱アセチル化酵素活性を少なくとも約5、10、20、30、50または100倍活性化させ得る。サーチュイン活性化化合物は、同じ濃度のレスベラトロールまたは他の本明細書に記載の化合物と比べ、少なくとも10%、30%、50%、80%、2倍、5倍、10倍、50倍または100倍大きいSIRT1の脱アセチル化酵素活性の誘導を引き起こし得る。サーチュイン活性化化合物はまた、SIRT1を活性化するためのEC50より、少なくとも約10倍、20倍、30倍、50倍大きいSIRT5を活性化するためのEC50を有し得る。
例示的な一実施形態において、本明細書に記載の方法および組成物は、(i)サーチュインのその基質またはNAD+に対するKmを少なくとも約2、3、4、5、10、20、30、50または100倍低下させる少なくとも1種類のサーチュイン活性化化合物、および(ii)サーチュインのVmaxを少なくとも約2、3、4、5、10、20、30、50または100倍増加させる少なくとも1種類のサーチュイン活性化化合物を含む併用療法を含み得る。一実施形態において、併用療法は、(i)式1〜25、30および32〜65の少なくとも1種類のサーチュイン活性化化合物、ならびに(ii)式69〜76の少なくとも1種類のサーチュイン活性化化合物を含み得る。
サーチュイン活性化化合物は、細胞の細胞質膜を横切ることができる。例えば、サーチュイン活性化化合物は、少なくとも約20%、50%、75%、80%、90%または95%の細胞透過性を有し得る。
本明細書に記載のサーチュイン活性化(activaing)化合物はまた、以下の特性:該化合物は、細胞または被験体に対して本質的に無毒性であり得;該化合物は、2000amu以下、1000amu以下の有機分子または小分子であり得;化合物は、標準大気圧条件下で少なくとも約30日間、60日間、120日間、6ヶ月間または1年の半減期を有し得;該化合物は、溶液中で少なくとも約30日間、60日間、120日間、6ヶ月間または1年の半減期を有し得;化合物は、溶液中で、レスベラトロールよりも少なくとも約50%、2倍、5倍、10倍、30倍、50倍または100倍安定であり得;化合物は、DNA修復因子Ku70の脱アセチル化を促進し得;化合物は、RelA/p65の脱アセチル化を促進し得;化合物は、一般的なターンオーバー速度を増加させ、TNF誘導アポトーシスに対する細胞の感受性を増強させ得る、のうちの1つ以上を有し得る。
3.例示的な使用
一態様において、サーチュイン活性化化合物は、ある障害の症状である紅潮(例えば、ほてり、赤み、掻痒および/または刺痛)および/またはのぼせの発生および/または重篤度を処置および/または予防するために使用され得る。例えば、主題の方法は、癌患者において紅潮および/またはのぼせの発生および/または重篤度を低下させるために、単独または他の薬剤との組み合わせでサーチュイン活性化化合物を使用することを含む。他の実施形態において、該方法は、閉経期および閉経後の女性において、紅潮および/またはのぼせの発生および/または重篤度を低下させるためのサーチュイン活性化化合物の使用を提供する。
一態様において、サーチュイン活性化化合物は、ある障害の症状である紅潮(例えば、ほてり、赤み、掻痒および/または刺痛)および/またはのぼせの発生および/または重篤度を処置および/または予防するために使用され得る。例えば、主題の方法は、癌患者において紅潮および/またはのぼせの発生および/または重篤度を低下させるために、単独または他の薬剤との組み合わせでサーチュイン活性化化合物を使用することを含む。他の実施形態において、該方法は、閉経期および閉経後の女性において、紅潮および/またはのぼせの発生および/または重篤度を低下させるためのサーチュイン活性化化合物の使用を提供する。
別の態様において、サーチュイン活性化化合物は、別の薬物治療の副作用である紅潮および/またはのぼせ(例えば、薬物誘発性紅潮)の発生または重篤度を低下させるための治療法として使用され得る。ある特定の実施形態において、薬物誘発性紅潮を処置および/または予防するための方法は、少なくとも1種類の紅潮誘発性化合物および少なくとも1種類のサーチュイン活性化化合物を含む製剤を、それを必要とする患者に投与することを含む。他の実施形態において、薬物誘発性紅潮を処置するための方法は、紅潮を誘発する1種類以上の化合物および1種類以上のサーチュイン活性化化合物を別々に投与することを含み、例えば、この場合、サーチュイン活性化化合物および紅潮誘発性薬剤は、同じ組成物中に製剤化されていない。個別の製剤を用いる場合、サーチュイン活性化化合物は、(1)紅潮誘発性薬剤の投与と同時、(2)紅潮誘発性薬剤とともに断続的に、(3)紅潮誘発性薬剤の投与に対して時差的、(4)紅潮誘発性薬剤の投与前、(5)紅潮誘発性薬剤の投与後、および(6)これらの種々の組合せで投与され得る。例示的な紅潮誘発性薬剤としては、例えば、ナイアシン、ファロキシフェン(faloxifene)、抗鬱薬、抗精神病薬、化学療法薬、カルシウムチャンネル遮断薬および抗生物質が挙げられる。
一実施形態において、サーチュイン活性化化合物は、血管拡張薬または抗高脂血症剤(例えば、抗コレステロール血症剤および脂好性剤)の紅潮副作用を低減させるために使用され得る。例示的な一実施形態において、サーチュイン活性化化合物は、ナイアシンの投与と関連している紅潮を低減させるために使用され得る。
ニコチン酸、3−ピリジンカルボン酸またはナイアシンは、例えば、Nicolar(登録商標)、SloNiacin(登録商標)、Nicobid(登録商標)およびTime Release Niacin(登録商標)の商標名で市販されている抗高脂血症剤である。ニコチン酸は、高脂血症性障害、例えば、高脂血症、高コレステロール血症およびアテローム性動脈硬化などの処置において長年使用されている。この化合物は、これまでヒトの身体において、総コレステロール、低密度リポタンパク質、すなわち「LDLコレステロール」、トリグリセリドおよびアポリポタンパク質a(Lp(a))を低下させるが、望ましい高密度リポタンパク質、すなわち「HDL コレステロール」は増加させるという有益な効果を示すことが知られている。
典型的な用量は、1日あたり約1グラム〜約3グラムの範囲である。ニコチン酸は、通常、選択される投薬形態に応じて、1日2〜4回食後に投与される。ニコチン酸は、現在、市販品として2つの投薬形態で入手可能である。一方の投薬形態のは即時または高速放出錠剤であり、これは、1日あたり3または4回投与されるのがよい。即時放出(「IR」)ニコチン酸製剤は、一般的に、ほぼすべてのそのニコチン酸を、摂取後約30〜60分以内に放出する。他方の投薬形態は、徐放性形態であり、これは、1日2〜4回の投与に適している。IR製剤とは対照的に、徐放性(「SR」)ニコチン酸製剤は、治療的レベルのニコチン酸を、摂取後長期間(例えば、12または24時間)にわたって維持するため、有意な量の薬物が特定の時間間隔で血流中に吸収されるように放出されるように設計される。
本明細書で用いる場合、用語「ニコチン酸」は、ニコチン酸、またはニコチン酸そのもの以外であって、身体によってニコチン酸に代謝され、したがってニコチン酸と本質的に同じ効果をもたらす化合物を包含することが意図される。ニコチン酸と同様の効果をもたらす例示的な化合物としては、例えば、ニコチニルアルコールの酒石酸エステル、d−グルシトールのヘキサニコチン酸エステル、ニコチン酸アルミニウム、ニセリトロールおよびd,l−α−トコフェリルニコチン酸が挙げられる。かかる化合物の各々を、本明細書において集合的に「ニコチン酸」とよぶ。
別の実施形態において、本発明は、紅潮副作用が低減した、高脂血症を処置および/または予防するための方法を提供する。該方法は、治療有効量のニコチン酸およびサーチュイン活性化化合物を、その必要がある被験体に、紅潮を低減させるのに充分な量で投与する工程を含む。例示的な一実施形態において、ニコチン酸および/またはサーチュイン活性化化合物は、夜間に投与され得る。
例示的な一実施形態において、サーチュイン活性化化合物は、併用療法の一部として、徐放性ニコチン酸、例えばナイアシンとともに投与され得る。徐放性ナイアシンの例としては、例えば、Niaspan(登録商標)およびAdvicor(登録商標)ならびに米国特許第6,746,691号;同第6,676,967号;同第6,818,229号;および同第6,406,715号に記載されたものが挙げられる。一実施形態において、サーチュイン活性化化合物は、ニコチン酸とともに徐放性製剤の一部として製剤化され得る。あるいはまた、サーチュイン活性化化合物は、ニコチン酸とは別々に、任意選択で徐放性製剤として投与され得る。
別の実施形態において、サーチュイン活性化化合物は、ラロキシフェンの紅潮副作用を低減させるために使用され得る。ラロキシフェンは、身体内のある特定の場所でエストロゲンと同様の作用をするが、ホルモンではない。これは、閉経期に達した女性における骨粗鬆症の予防を補助する。骨粗鬆症は、骨を徐々に細く脆くし、骨折し易くする。エビスタは、閉経期に伴って起こる骨量減少を遅延させ、骨粗鬆症による脊椎骨折のリスクを低下させる。ラロキシフェンの一般的な副作用はのぼせ(発汗および紅潮)である。これは、既に閉経期によるのぼせを有する女性にとって不快であり得る。
別の実施形態において、サーチュイン活性化化合物は、抗鬱薬または抗精神病剤の紅潮副作用を低減させるために使用され得る。例えば、サーチュイン活性化化合物は、セロトニン再取り込み阻害剤、5HT2受容体拮抗剤、抗痙攣薬、ノルエピネフリン再取り込み阻害剤、α−アドレナリン作用性受容体拮抗薬、NK−3拮抗剤、NK−1受容体拮抗剤、PDE4阻害剤、神経ペプチドY5受容体拮抗剤、D4受容体拮抗剤、5HT1A受容体拮抗剤、5HT1D受容体拮抗剤、CRF拮抗剤、モノアミンオキシダーゼ阻害剤または鎮静催眠薬と組み合わせて使用(別々または一緒に投与)され得る。
ある特定の実施形態において、サーチュイン活性化化合物は、セロトニン再取り込み阻害剤(SRI)による処置の一部として使用され得る。ある特定の好ましい実施形態において、SRIは、選択的セロトニン再取り込み阻害剤(SSRI)、例えば、フルオキセチノイド(フルオキセチン、ノルフルオキセチン)またはネファゾドノイド(ネファゾドン、ヒドロキシネファゾドン、オキソネファゾドン)などである。他の例示的なSSRIとしては、ドロキセチン、ベンラファキシン、ミルナシプラン、シタロプラム、フルボキサミン、パロキセチンおよびセルトラリンが挙げられる。STACはまた、鎮静催眠薬、例えば、ベンゾジアゼピン(例えば、アルプラゾラム、クロルジアゼポキシド、クロナゼパム、クロラゼペート、クロバザム、ジアゼパム、ハラゼパム、ロラゼパム、オキサゼパムおよびプラゼパムなど)、ゾルピデム、ならびにバルビツール酸系からなる群より選択されるものなどによる処置の一部として使用され得る。さらに他の実施形態において、サーチュイン活性化化合物は、5−HT1A受容体部分作用薬、例えば、ブスピロン、フレシノキサン、ゲピロンおよびイプサピロンからなる群より選択されるものなどによる処置の一部として使用され得る。サーチュイン活性化化合物はまた、ノルエピネフリン再取り込み阻害剤、例えば、第3級アミン三環系および第2級アミン三環系から選択されるものなどによる処置の一部として使用され得る。例示的な第3級アミン三環系としては、アミトリプチリン、クロミプラミン、ドキセピン、イミプラミンおよびトリミプラミンが挙げられる。例示的な第2級アミン三環系としては、アモキサピン、デシプラミン、マプロチリン、ノルトリプチリンおよびプロトリプチリンが挙げられる。ある特定の実施形態において、サーチュイン活性化化合物は、モノアミンオキシダーゼ阻害剤、例えば、イソカルボキサジド、フェネルジン、トラニルシプロミン、セレギリンおよびモクロベマイドなどによる処置の一部として使用され得る。
さらに別の実施形態において、サーチュイン活性化化合物は、化学療法薬、例えば、シクロホスファミドまたはタモキシフェンなどの紅潮副作用を低減させるために使用され得る。
別の実施形態において、サーチュイン活性化化合物は、カルシウムチャンネル遮断薬、例えば、アムロジピンなどの紅潮副作用を低減させるために使用され得る。
別の実施形態において、サーチュイン活性化化合物は、抗生物質の紅潮副作用を低減させるために使用され得る。例えば、サーチュイン活性化化合物は、レボフロキサシンと組み合わせて使用され得る。レボフロキサシンは、感染性細菌によって引き起こされる洞、皮膚、肺、耳、気道、骨および関節の感染症を処置するために使用される。レボフロキサシンはまた、尿路感染症(例えば、他の抗生物質に対して抵抗のもの、ならびに前立腺炎)を処置するために高頻度で使用される。レボフロキサシンは、大腸菌、Campylobacter jejuniおよび赤痢菌によって引き起こされる感染性の下痢の処置に有効である。レボフロキサシンはまた、種々の産科感染症、例えば乳腺炎を処置するために使用され得る。
別の態様において、サーチュイン活性化化合物は、別の薬物治療の副作用である体重増加(例えば、薬物誘発性体重増加)の発生または重篤度を低下させるための治療法として使用され得る。ある特定の実施形態において、薬物誘発性体重増加を処置および/または予防するための方法は、少なくとも1種類の体重増加誘発性化合物および少なくとも1種類のサーチュイン活性化化合物を含む製剤を、それを必要とする患者に投与することを含む。他の実施形態において、薬物誘発性体重増加を処置するための方法は、体重増加を誘発する1種類以上の化合物および1種類以上のサーチュイン活性化化合物を別々に投与することを含み、例えば、この場合、サーチュイン活性化化合物および体重増加誘発性薬剤は、同じ組成物中に製剤化されていない。個別の製剤を用いる場合、サーチュイン活性化化合物は、(1)体重増加誘発性薬剤の投与と同時、(2)体重増加誘発性薬剤とともに断続的に、(3)体重増加誘発性薬剤の投与に対して時差的、(4)体重増加誘発性薬剤の投与前、(5)体重増加誘発性薬剤の投与後、および(6)これらの種々の組合せで投与され得る。例示的な体重増加誘発性薬剤としては、例えば、抗糖尿病剤、抗鬱薬、ステロイド、ホルモン、β遮断薬、α遮断薬および避妊薬が挙げられる。
別の実施形態において、サーチュイン活性化化合物は、薬物誘発性体重増加を低減させるために投与され得る。例えば、サーチュイン活性化化合物は、併用療法として、食欲を刺激し得るか、または体重増加(特に、水分貯留以外の要因による体重増加)を引き起こし得る投薬とともに投与され得る。体重増加を引き起こし得る投薬の例としては、例えば、糖尿病処置薬、例えば、スルホニル尿素系(グリピジドおよびグリブリドなど)、チアゾリジンジオン(ピオグリタゾンおよびロシグリタゾンなど)、メグリチナイド、ナテグリニド、レパグリニド、スルホニル尿素薬ならびにインスリンなど;抗鬱薬、例えば、三環系抗鬱薬(アミトリプチリンおよびイミプラミンなど)、不可逆的モノアミンオキシダーゼ阻害剤(MAOI)、選択的セロトニン再取り込み阻害剤(SSRI)、ブプロピオン、パロキセチンならびにミルタザピンなど;ステロイド、例えば、プレドニゾンなど;ホルモン療法剤;炭酸リチウム;バルプロ酸;カルバマゼピン;クロルプロマジン;チオチキセン;β遮断薬(プロプラノロール(propranolo)など);α遮断薬(クロニジン、プラゾシンおよびテラゾシンなど);ならびに避妊薬、例えば、経口避妊薬(避妊用ピル)またはエストロゲンおよび/またはプロゲステロンを含有する他の避妊薬(Depo−Provera、Norplant、Ortho)、テストステロンまたはメゲストロールが挙げられる。別の例示的な実施形態において、サーチュイン活性化化合物は、禁煙プログラムの一部として体重増加を抑制するため、または既に増えた体重を減少させるために投与され得る。
ある特定の実施形態において、紅潮および/または薬物誘発性体重増加を低減、予防または処置するための方法はまた、ヒト細胞内のサーチュイン(SIRT1など)または他の生物体内のサーチュインのいずれかのホモログのタンパク質レベルを増大させることを含み得る。タンパク質レベルの増大は、細胞内にサーチュインをコードする核酸の1つ以上のコピーを導入することにより達成され得る。例えば、SIRT1のレベルは、哺乳動物細胞において、哺乳動物細胞内に、例えば、GenBank受託番号NP_036370に示されるアミノ酸配列を有するSIRT1をコードする核酸を導入することにより増大され得る。該核酸は、SIRT1核酸の発現を調節するプロモーターの制御下であり得る。あるいはまた、該核酸は、細胞においてゲノム内のプロモーターの下流の位置に導入され得る。このような方法を用いてタンパク質のレベルを増大させるための方法は、当該技術分野でよく知られている。
サーチュインのタンパク質レベルを増大させるために細胞内に導入される核酸は、サーチュイン、例えば、SIRT1(GenBank受託番号NP_036370)の配列と少なくとも約80%、85%、90%、95%、98%または99%同一であるタンパク質をコードし得る。例えば、該タンパク質をコードする核酸は、SIRT1核酸配列(GenBank受託番号NM_012238)と、少なくとも約80%、85%、90%、95%、98%または99%同一であり得る。該核酸はまた、好ましくはストリンジェントハイブリダイゼーション条件下で、野生型サーチュイン、例えば、SIRT1(GenBank受託番号NM_012238)をコードする核酸とハイブリダイズする核酸であり得る。ストリンジェントハイブリダイゼーション条件は、ハイブリダイゼーションおよび0.2×SSC中65℃での洗浄を含み得る。野生型サーチュインタンパク質を異なるタンパク質、例えば、野生型サーチュインの断片であるタンパク質などをコードする核酸を使用する場合、該タンパク質は、好ましくは生物学的に活性である、例えば、脱アセチル化することができる。細胞内で、サーチュインの生物学的に活性な一部分を発現させることだけが必要である。例えば、野生型SIRT1(GenBank受託番号NP_036370)と異なるタンパク質は、好ましくはそのコア構造を含む。コア構造は、場合によっては、SIRT1(GenBank受託番号NP_036370)のアミノ酸62〜293(これは、GenBank受託番号NM_012238のヌクレオチド237〜932にコードされている)を指し、これは、NAD結合ドメインならびに基質結合ドメインを含む。SIRT1のコアドメインはまた、SIRT1(GenBank受託番号NP_036370)のアミノ酸261〜447あたり(これは、GenBank受託番号NM_012238のヌクレオチド834〜1394にコードされている);SIRT1(GenBank受託番号NP_036370)アミノ酸242〜493あたり(これは、GenBank受託番号NM_012238のヌクレオチド777〜1532にコードされている);またはSIRT1(GenBank受託番号NP_036370)のアミノ酸254〜495あたり(これは、GenBank受託番号NM_012238のヌクレオチド813〜1538にコードされている)を指すこともある。タンパク質が生物学的機能(例えば、脱アセチル化能力)を保持しているか否かは、当該技術分野で知られた方法に従って判定され得る。
また、サーチュインタンパク質レベルを増大させるための方法には、サーチュインをコードする遺伝子の転写を刺激するための方法、対応するmRNAを安定化させるための方法、および当該技術分野において知られた他の方法も含まれる。
別の態様において、本発明は、サーチュインタンパク質のレベルまたは活性を増大させるため、細胞の寿命を増大させるため、ならびに多種多様な疾患および障害、例えば、加齢もしくはストレス、糖尿病、肥満、神経変性疾患、心血管疾患、血液凝固障害、炎症、癌および/または紅潮などと関連する疾患または障害などを処置および/または予防するための、ニコチン酸との組み合わせでのサーチュイン活性化化合物の使用を提供する。以下にさらに記載するように、該方法は、治療有効量のサーチュイン活性化化合物およびニコチン酸を、その必要がある被験体に投与することを含む。例示的な一実施形態において、該方法は、医薬的有効量のサーチュイン活性化化合物およびニコチン酸を含む組成物を、その必要がある被験体に投与することを含む。上記のように、用語「ニコチン酸」は、ニコチン酸、またはニコチン酸そのもの以外であって、身体によってニコチン酸に代謝され、したがってニコチン酸と本質的に同じ効果をもたらす化合物を包含することが意図される。ニコチン酸と同様の効果をもたらす例示的な化合物としては、例えば、ニコチニルアルコールの酒石酸エステル、d−ヘキサニコチン酸グルシトール、ニコチン酸アルミニウム、ニセリトロールおよびd,l−α−トコフェリルニコチン酸が挙げられる。
また別の実施形態において、サーチュイン活性化化合物およびニコチン酸は、併用療法の一部として、種々の疾患、例えば、癌、糖尿病、神経変性疾患、心血管疾患、血液凝固、炎症、紅潮、肥満、加齢、ストレスなどの処置または予防のための1種類以上の治療剤とともに投与され得る。種々の実施形態において、サーチュイン活性化化合物、ニコチン酸およびさらなる治療剤を含む併用療法は、(1)サーチュイン活性化化合物、ニコチン酸および1種類以上の治療剤を含む医薬組成物;ならびに(2)サーチュイン活性化化合物およびニコチン酸と1種類以上の治療剤との共投与(この場合、サーチュイン活性化化合物/ニコチン(nictonic)酸および該治療剤は、同じ組成物中に製剤化されていない)を指すものであり得る。個別の製剤を用いる場合、サーチュイン活性化化合物/ニコチン酸は、別の治療剤の投与と同時、断続的、時差的、その前、その後またはこれらの組合せで投与され得る。例示的な一実施形態において、サーチュイン活性化化合物および/またはニコチン酸は、徐放により投与され得る。
一実施形態において、本発明は、細胞をサーチュイン活性化化合物およびニコチン酸と接触させることにより、細胞の寿命を延長させる、細胞の増殖能力を伸ばす、細胞の加齢を遅滞させる、細胞の生存を促進する、細胞における細胞老化を遅延させる、カロリー制限の効果を模倣する、ストレスに対する細胞の抵抗性を増大させる、または細胞のアポトーシスを抑制するための方法を提供する。
本明細書に記載の方法は、細胞、特に一次細胞(すなわち、生物体、例えば、ヒトから得られた細胞)が、細胞培養において生存状態が維持され得る時間量を増大させるために使用され得る。また、胚性幹(ES)細胞および多能性細胞、ならびにこれらから分化した細胞を、サーチュイン活性化化合物およびニコチン酸で処理し、細胞またはその子孫を、培養状態でより長期間維持してもよい。また、かかる細胞は、例えば、エキソビボ修飾後、被験体内への移植のために使用され得る。
一実施形態において、長期間保存されることが意図される細胞が、サーチュイン活性化化合物およびニコチン酸で処理され得る。細胞は、懸濁状態(例えば、血液細胞、血清、生物学的成長培地など)または組織もしくは器官内であり得る。例えば、個体から輸血の目的で採取した血液が、血液細胞を長期間保存するためにサーチュイン活性化化合物およびニコチン酸で処理され得る。さらに、法医学的な目的に使用される血液もまた、本明細書に記載のサーチュイン活性化化合物を用いて保存され得る。その寿命を延長するため、またはアポトーシスに対する保護のために処理され得る他の細胞としては、消費のための細胞、例えば、非ヒト哺乳動物由来の細胞(例えば、食肉など)または植物細胞(例えば、野菜など)が挙げられる。
サーチュイン活性化化合物およびニコチン酸はまた、発生および/または成長過程を、例えば、改変、遅延または加速させるために、哺乳動物、植物、昆虫または微生物の発生期および成長期に適用され得る。
別の実施形態において、サーチュイン活性化化合物およびニコチン酸は、移植または細胞療法に有用な細胞、例えば、充実性組織移植片、移植臓器、細胞懸濁物、幹細胞、骨髄細胞などを処理するために使用され得る。細胞または組織は、自己移植片、同種移植片、同族移植片または異種移植であり得る。細胞または組織はサーチュイン活性化化合物およびニコチン酸で、被験体内への投与/移植前、投与/移植と同時および/または投与/移植後に処理され得る。細胞または組織は、ドナー個体から細胞を採取する前、ドナー個体から細胞もしくは組織を採取した後エキソビボで、またはレシピエントへの移植後に処理され得る。例えば、ドナーまたはレシピエント個体は、サーチュイン活性化化合物およびニコチン酸で全身処理されてもよく、サーチュイン活性化化合物およびニコチン酸で局所処理された細胞/組織のサブセットを有していてもよい。ある特定の実施形態において、細胞または組織(またはドナー/レシピエント個体)は、移植片の生存を延長させるのに有用な別の治療剤、例えば、免疫抑制剤、サイトカイン、血管形成因子などでさらに処理され得る。
また他の実施形態において、細胞は、例えば、その寿命を増大させるため、またはアポトーシスを抑制するために、インビボでサーチュイン活性化化合物およびニコチン酸により処理され得る。例えば、皮膚は、皮膚または上皮細胞をサーチュイン活性化化合物およびニコチン酸で処理することにより、加齢(例えば、しわの発生、弾力性の喪失など)から保護され得る。例示的な一実施形態において、皮膚を、サーチュイン活性化化合物およびニコチン酸を含む医薬用または化粧用組成物と接触させる。本明細書に記載の方法に従って処理され得る例示的な皮膚罹病状態または皮膚状態としては、炎症、日焼けによる損傷または自然な加齢と関連するか、またはこれらによって引き起こされる障害または疾患が挙げられる。例えば、該組成物には、接触皮膚炎(例えば、刺激性接触皮膚炎およびアレルギー性接触皮膚炎)、アトピー性皮膚炎(アレルギー性湿疹としても知られる)、光線性角化症、角質化障害(例えば、湿疹)、表皮水疱症疾患(例えば、天疱瘡(penfigus))、剥脱性皮膚炎、脂漏性皮膚炎、紅斑(例えば、多形性紅斑および結節性紅斑)、日光または他の光源によって引き起こされる損傷、円板状エリテマトーデス、皮膚筋炎、皮膚癌ならびに自然な加齢の影響の予防または処置における有用性が見出される。別の実施形態において、サーチュイン活性化化合物およびニコチン酸は、治癒を促進させるための創傷および/または火傷、例えば、1、2または3度の火傷および/または熱、化学薬品もしくは電気による火傷などの処置のために使用され得る。該製剤は、経表面的に皮膚または粘膜組織に、軟膏、ローション、クリーム、マイクロエマルジョン、ゲル、溶液などとして(本明細書においてさらに記載する)、所望の結果をもたらすのに有効な投薬レジメンの状況において投与され得る。
サーチュイン活性化化合物およびニコチン酸を含む経表面的製剤はまた、予防用、例えば、化学予防用組成物として使用され得る。化学予防的方法において使用される場合、感染性皮膚を、特定の個体においてなんらかの状態が現れる前に処理する。
サーチュイン活性化化合物およびニコチン酸は、被験体に対して局所または全身に送達され得る。一実施形態において、サーチュイン活性化化合物およびニコチン酸は、注射、経表面的製剤などによって、被験体の組織または器官に対して局所に送達される。
別の実施形態において、サーチュイン活性化化合物およびニコチン酸は、被験体において細胞老化によって誘発されるか、または悪化する疾患または状態を処置または予防するため;例えば、老化の開始後、被験体の老化の速度を減少させるための方法;被験体の寿命延長するための方法;寿命に関連する疾患または状態を処置または予防するための方法;細胞の増殖能力に関連する疾患または状態を処置または予防するための方法;および細胞損傷または細胞死に起因する疾患または状態を処置または予防するための方法に使用され得る。ある特定の実施形態において、該方法は、被験体の寿命を縮小させる疾患の発生速度を減少させることにより作用しない。ある特定の実施形態において、該方法は、癌などの疾患によって引き起こされる致死性を低下させることにより作用しない。
また別の実施形態において、サーチュイン活性化化合物およびニコチン酸は被験体に対して、一般的に、その細胞の寿命を増大させるため、およびその細胞をストレスおよび/またはアポトーシスから保護するために投与され得る。被験体をサーチュイン活性化化合物およびニコチン酸で処置することは、被験体を、ホルメシス、すなわち、生物体に有益であり、その寿命を延長し得る軽度のストレスに供することに似ていると考えられる。
サーチュイン活性化化合物およびニコチン酸は被験体に対して、加齢および加齢関連の影響または疾患、例えば、脳卒中、心臓疾患、心不全、関節炎、高血圧およびアルツハイマー病などを予防するために投与され得る。処置され得る他の状態としては、例えば、眼の加齢に伴う眼障害、例えば、白内障、緑内障および黄斑変性症などが挙げられる。サーチュイン活性化化合物およびニコチン酸はまた、被験体に対して、疾患、例えば、細胞死と関連する慢性疾患の処置のため、細胞を細胞死から保護するために投与され得る。例示的な疾患としては、神経細胞死または筋細胞死と関連するもの、例えば、パーキンソン病、アルツハイマー病、多発性硬化症、筋萎縮性側索硬化症(amniotropic lateral sclerosis)および筋ジストロフィ;AIDS;劇症肝炎;脳の変性に関連する疾患、例えば、クロイツフェルト−ヤーコプ病、色素性網膜炎および小脳変性など;骨髄異形成、例えば、無形成貧血など;虚血性疾患、例えば、心筋梗塞および脳卒中など;肝臓疾患、例えば、アルコール性肝炎、B型肝炎およびC型肝炎など;関節疾患、例えば、変形性関節症など;アテローム性動脈硬化;脱毛症;UV光による皮膚に対する損傷;扁平苔癬;皮膚の萎縮;白内障;ならびに移植片拒絶などが挙げられる。
別の実施形態において、サーチュイン活性化化合物はまた、ニコチン酸との組み合わせで、虚血および/または再灌流傷害を伴う疾患または障害を患う被験体に投与され得る。例示的な虚血性疾患および障害としては、例えば、虚血性脳卒中、虚血性組織損傷、例えば、器官の虚血性障害、心虚血、心臓の再灌流傷害および器官移植(例えば、腎臓、心臓および肝臓)または心肺バイパス外科処置に起因する合併症などの障害が挙げられる。
サーチュイン活性化化合物およびニコチン酸はまた、急性疾患、例えば器官または組織に対する損傷に苦しむ被験体、例えば、脳卒中もしくは心筋梗塞を患う被験体または脊髄損傷に苦しむ被験体に投与され得る。サーチュイン活性化化合物およびニコチン酸はまた、アルコール肝臓を修復するために使用され得る。
別の実施形態において、本発明は、サーチュイン活性化化合物およびニコチン酸を、その必要がある被験体に投与することによる、心血管疾患を処置および/または予防するための方法を提供する。
サーチュイン活性化化合物およびニコチン酸を用いて処置または予防され得る心血管疾患としては、心筋症または心筋炎;例えば、特発性心筋症、代謝性心筋症、アルコール性心筋症、薬物誘発性心筋症、虚血性心筋症および高血圧性心筋症などが挙げられる。また、本明細書に記載の方法を用いて処置可能または予防可能であるのは、主要血管(大血管疾患)、例えば、大動脈、冠状動脈、頚動脈、脳血管の動脈、腎動脈、腸管動脈、大腿動脈および膝窩動脈などのアテローム性障害である。処置または予防され得る他の血管疾患としては、網膜細動脈、糸球体細動脈、神経の脈管、心臓細動脈、ならびに目、腎臓、心臓ならびに中枢神経系および末梢神経系の関連する毛細血管床と関連するものが挙げられる。サーチュイン活性化化合物およびニコチン酸はまた、個体の血漿中HDLレベルを増大させるために使用され得る。
サーチュイン活性化化合物およびニコチン酸で処理され得るまた他の障害としては、再狭窄(例えば、冠動脈インターベンション後)ならびに高密度および低密度コレステロールの異常レベルに関連する障害が挙げられる。
一実施形態において、サーチュイン活性化化合物およびニコチン酸は、別の心血管作動薬、例えば、抗凝血剤、抗不整脈剤、抗高血圧性薬剤、カルシウムチャンネル遮断薬、心筋保護(cardioplegic)溶液、強心剤、線維素溶解性薬剤、硬化溶液、血管収縮剤、血管拡張剤、一酸化窒素供与体、カリウムチャネル遮断薬、ナトリウムチャネル遮断薬、スタチンまたはナトリウム利尿(naturiuretic)薬剤などとの併用療法の一部として投与され得る。
サーチュイン活性化化合物およびニコチン酸はまた、最近、ある線量の放射線を受けたか、またはおそらく受けた被験体に投与され得る。一実施形態において、該線量の放射線は、仕事関連または医療処置、例えば、原子力発電所内での作業、航空機の飛行、X線、CATスキャンまたは医療用イメージングのための放射線染料の投与の一部として受けたものであり;かかる実施形態において、該化合物は、予防的手段として投与される。別の実施形態において、放射線曝露は、例えば、産業事故、テロ行為または放射性材料を伴う戦争行為の結果として無意識に受けたものである。かかる場合において、サーチュイン活性化化合物およびニコチン酸は、好ましくは、アポトーシスおよび後の急性放射線症候群の発症を抑制するため、曝露後できるだけ早期に投与される。
少なくとも、ある特定濃度のサーチュイン活性化化合物が細胞内でp53の脱アセチル化を抑制し、それにより、細胞内でアポトーシスを誘発し得るという知見に基づき、サーチュイン活性化化合物およびニコチン酸はまた、ある種の細胞のアポトーシスが所望される状態の被験体に投与(administ)され得る。例えば、癌が処置または予防され得る。例示的な癌は、脳および腎臓のもの;ホルモン依存性癌、例えば、乳癌、前立腺癌、精巣癌および卵巣癌など;リンパ腫ならびに白血病である。充実性腫瘍を伴う癌では、サーチュイン活性化化合物およびニコチン酸は、腫瘍内に直接投与され得る。血液細胞の癌、例えば白血病は、サーチュイン活性化化合物およびニコチン酸を血流中または骨髄内に投与することにより処置され得る。良性細胞の増殖(例えば、いぼ)もまた処置され得る。処置され得る他の疾患としては、自己免疫細胞が除去されるべきである自己免疫疾患、例えば、全身性エリテマトーデス、強皮症および関節炎が挙げられる。ウイルス感染症、例えば、ヘルペス、HIV、アデノウイルスならびにHTLV−I関連の悪性および良性障害などもまた、該化合物の投与によって処置され得る。あるいはまた、細胞を被験体から採取し、エキソビボで処理して特定の望ましくない細胞(例えば、癌細胞)を除去し、同じまたは異なる被験体に投与して戻してもよい。
一実施形態において、サーチュイン活性化化合物およびニコチン酸は、別の化学療法薬との併用療法の一部として投与され得る。
ある特定の態様において、サーチュイン活性化化合物およびニコチン酸は、神経変性疾患、および中枢神経系(CNS)または末梢神経系(PNS)に対する外傷性または機械性損傷に苦しむ患者を処置するために使用され得る。神経変性疾患は、典型的には、ヒトの脳の質量および容積の減少を伴い、これは、健常人のものよりもずっとより顕著であり、加齢に起因し得る脳細胞の萎縮および/または死によるものであり得る。神経変性疾患は、長期間の正常な脳機能の後、特定の脳領域での進行性の変性(例えば、神経細胞の機能不全および死)により、徐々に進展する。脳変性の実際の開始は、臨床的に発現するまでに何年もかかり得る。神経変性疾患の例としては、限定されないが、アルツハイマー病(AD)、パーキンソン病(PD)、ハンティングトン病(HD)、筋萎縮性側索硬化症(ALS;ルー・ゲーリグ病)、びまん性レヴィー小体病、舞踏病有棘赤血球増加症、原発性側索硬化症、およびフリートライヒ運動失調が挙げられる。サーチュイン活性化化合物をニコチン酸との組み合わせで使用して処置され得るニューロン疾患または障害の他の例を以下に記載する。
テイ−サックス病およびザントホフ病は、リソソームβ−ヘキソサミニダーゼの欠乏によって引き起こされる糖脂質蓄積病である(Gravelら,The Metabolic Basis of Inherited Disease,Scriverら編,McGraw−Hill,New York,pp.2839−2879,1995)。両障害では、GM2ガングリオシドおよび関連するβ−ヘキソサミニダーゼの糖脂質基質が神経系内に蓄積し、急性神経変性の誘因となる。最も重篤な形態では、症状の発現は早期幼児期に始まる。次いで、急激な神経変性過程が続いて起こり、罹患した幼児は、運動機能不全、発作、視力障害および聴覚障害を示す。通常、2〜5歳で死亡する。アポトーシス機構によるニューロン減少が示されている(Huangら,Hum.MoI.Genet.6:1879−1885,1997)。
アポトーシスが、免疫系においてAIDSの病因にある役割を果たしていることはよく知られている。しかしながら、HIV−Iはまた、神経疾患も誘発する。Shiら(J.Clin.Invest.98:1979−1990,1996)は、CNSのHIV−I感染によって誘発されるアポトーシスを、インビトロモデルおよびAIDS患者由来の脳組織において調べ、脳初代培養物のHIV−I感染により、ニューロンおよび星状細胞においてインビトロでアポトーシスが誘発されることを見出した。ニューロンおよび星状細胞のアポトーシスはまた、10例/11例のAIDS患者由来の脳組織においても検出され、そのうち、5例/5例の患者がHIV−I痴呆であり、4例/5例が痴呆でない患者であった。
また、ニューロン減少は、プリオン疾患、例えば、ヒトのクロイツフェルト−ヤーコプ病、畜牛のBSE(狂牛病)、ヒツジおよびヤギのスクラピー病、およびネコのネコ海綿状脳症(FSE)の顕著な特徴である。サーチュイン活性化化合物およびニコチン酸は、これらのプリオン(prior)疾患によるニューロン減少を処置または予防するのに有用であり得る。
別の実施形態において、サーチュイン活性化化合物およびニコチン酸は、軸索障害を伴う任意の疾患または障害を処置または予防するために使用され得る。遠位軸索障害は、末梢神経系(PNS)ニューロンのなんらかの代謝性または毒性錯乱に起因する末梢神経障害の一類型である。これは、代謝性または毒性の錯乱に対する最も一般的な神経の応答であり、したがって、代謝性疾患、例えば、糖尿病、腎不全、欠損症候群(栄養失調およびアルコール中毒など)、または毒素もしくは薬物の影響によって引き起こされ得る。遠位軸索障害の最も一般的な原因は糖尿病であり、最も一般的な遠位軸索障害は、糖尿病性神経障害である。通常、軸索の最も遠位部分がまず変性し、軸索の萎縮がゆっくりと神経の細胞体に向かって進行する。有害な刺激が除かれたら再生は起こり得るが、刺激の持続期間および重篤度に応じて予後は低下する。遠位軸策障害を有する人は、通常、対称性の靴下・手袋型感覚運動障害(stocking−glove sensori−motor disturbance)を示す。深部腱反射および自律神経系(ANS)機能もまた、罹患領域において失われるか、または減退する。
糖尿病性神経障害は、真性糖尿病に伴う神経病性障害である。このような状態は、通常、神経に供給された小血管(神経の脈管)が関与する糖尿病性微小血管の損傷の結果生じる。糖尿病性神経障害に伴い得る比較的よく見られる状態としては、第三神経麻痺;単神経障害;多発性単神経炎;糖尿病性筋萎縮症;有痛多発神経障害;自律神経障害;および胸腹神経障害が挙げられる。糖尿病性神経障害の臨床徴候としては、例えば、感覚運動多発神経障害、例えば、しびれ、感覚低下、知覚不全および夜間痛など;自律神経障害、例えば、胃内容物排出の遅延または胃不全麻痺など;ならびに脳神経障害、例えば、眼球運動(第三)神経障害または胸神経もしくは腰部脊髄神経の単神経障害などが挙げられる。
末梢神経障害は、末梢神経系の神経に対する損傷の医学用語であり、神経の疾患または全身性疾病の副作用のいずれかによって引き起こされ得る。末梢神経障害は、その発現症状および起源が種々であり、神経または神経筋接合部が冒され得る。末梢神経障害の主な原因としては、発作、栄養不足およびHIVが挙げられるが、おそらく糖尿病が最大の原因である。また、1箇所の位置にあまりに長い間留まることによる機械的圧力、腫瘍、神経内出血、放射線、低温または有毒物質などの極端な条件への身体の曝露によっても末梢神経障害が引き起こされ得る。
例示的な一実施形態において、サーチュイン活性化化合物およびニコチン酸は、多発性硬化症(MS)、例えば、再発性MSおよび単一症状MS、ならびに他の脱髄性状態、例えば、慢性炎症性脱髄性多発神経障害(CIDP)またはそれに伴う症状などを処置または予防するために使用され得る。
また別の実施形態において、サーチュイン活性化化合物およびニコチン酸は、神経に対する外傷、例えば、疾患、損傷(例えば、外科的介入)による外傷、または環境性外傷(例えば、神経毒、アルコール中毒など)を処置するために使用され得る。
ニコチン酸との組合せでのサーチュイン活性化化合物はまた、以下に記載するものなどの種々のPNS障害の症状を予防、処置および緩和するのに有用であり得る。PNSは、CNSに通じているか、CNSから分岐している神経から構成されている。末梢神経は、身体内の多様な機能群を例えば、感覚、運動および自律機能を司る。個体が末梢神経障害を有する場合、PNSの神経が損傷されている。神経損傷は、いくつかの原因、例えば、疾患、身体の損傷、中毒または栄養失調などにより生じ得る。これらの因子により、求心性神経または遠心性神経のいずれかが冒され得る。損傷の原因に応じて、神経細胞軸索、その保護的ミエリン鞘または両方が損傷または破壊され得る。
用語「末梢神経障害」は、脳および脊髄の外側の神経、すなわち末梢神経が損傷された広範な障害を包含する。末梢神経障害はまた、末梢神経炎を指すものであり得、または多くの神経が関与する場合は、多発神経障害または多発神経炎という用語が使用され得る。
末梢神経障害は、広く知られた障害であり、潜在的原因がたくさんある。このような原因のあるものは一般的であり(例えば、糖尿病など)、あるものは、極めて稀である(アクリルアミド中毒および特定の遺伝性障害など)。末梢神経障害の最も一般的に広く知られた原因は、らい病である。らい病は、細菌(らい菌)によって引き起こされ、これは、罹患した人の末梢神経を攻撃する。
米国では、らい病は極めて稀であり、糖尿病が最も一般的に知られた末梢神経障害の原因である。欧米では1700万人より多くの人が糖尿病関連多発神経障害を有すると推定されている。多くの神経障害は特発性であり、既知原因は見出され得ない。米国において遺伝性末梢神経障害で最も一般的なものはシャルコー−マリー−ツース病であり、およそ125,000人が罹患している。
よく知られた別の末梢神経障害はギヤン−バレー症候群であり、これは、ウイルス性の疾病(例えば、サイトメガロウイルス、エプスタイン−バーウイルスおよびヒト免疫不全ウイルス(HIV)など)または細菌感染(例えば、Campylobacter jejuni)およびライム病に伴う合併症に起因する。全世界での発症率は、年間で100,000人あたりおよそ1.7例である。他のよく知られた末梢神経障害の原因としては、慢性アルコール中毒、水痘−帯状疱疹ウイルス感染、ボツリヌス中毒および灰白髄炎が挙げられる。末梢神経障害は、初期症状として発現され得るか、または別の疾患によるものであり得る。例えば、末梢神経障害は、アミロイド神経障害、ある種の癌または遺伝性神経病性障害などの疾患の唯一の症状である。かかる疾患により、PNSおよびCNSならびに他の身体組織が冒され得る。
ニコチン酸との組合せでサーチュイン活性化化合物により処置可能な他のPNS疾患としては、腕神経叢ニューロパシー(腕神経叢の頚部および第1胸部根(first thoracic root)、神経幹、索(cord)、および末梢神経成分の疾患が挙げられる。臨床徴候としては、限局性痛覚、感覚異常;筋衰弱および上肢の感覚低下が挙げられる。このような障害は、外傷、例えば、分娩外傷;胸郭出口症候群;新生物、神経炎、放射線療法と関連するものなどの状態(Adamsら,Principles of Neurology,第6版,pp1351−2を参照);糖尿病性神経障害(真性糖尿病に伴う末梢、自律および脳神経障害)であり得る。これらの状態は、通常、神経に供給された小血管(神経の脈管)が関与する糖尿病性微小血管の損傷の結果生じる。糖尿病性神経障害に伴い得る比較的よく見られる状態としては、第三神経麻痺;単神経障害;多発性単神経炎;糖尿病性筋萎縮症;有痛多発神経障害;自律神経障害;および胸腹神経障害(Adamsら,Principles of Neurology,第6版,p1325参照);単神経障害(びまん性末梢神経機能不全の徴候に対して孤立性、または釣り合いを失った単一の末梢神経が関与する疾患または外傷が挙げられる。多発性単神経炎は、多数の孤立性(isolated)の神経損傷を特徴とする状態をいう。単神経障害は、多種多様な原因、例えば、虚血;外傷性損傷;圧迫;結合組織病;蓄積外傷疾患などの状態;神経痛(末梢または脳神経の体系(course)または分布に沿って起こる激痛またはうずく痛み);末梢神経系新生物(末梢神経組織から生じる新生物)の結果、生じ得る。これには、神経線維腫;神経鞘腫;顆粒細胞腫;および悪性末梢神経鞘腫瘍が含まれる。DeVita Jrら,Cancer:Principles and Practice of Oncology,第5版,ppl750−1参照);神経圧迫症候群(内因または外因による神経または神経根の機械的圧迫。これらは、例えば、ミエリン鞘機能不全または軸索消失により、神経インパルスに対して伝導ブロックをもたらし得る。神経および神経鞘損傷は、虚血;炎症;または直接的な機械的影響;神経炎(末梢神経もしくは脳神経の炎症を示す一般用語)によって引き起こされ得る。臨床徴候としては、痛覚;感覚異常;不全麻痺;または知覚過敏(hyperthesia);多発神経障害(多数の末梢神経の疾患)が挙げられ得る。種々の形態は、罹患神経の型(例えば、感覚、運動または自律神経)、神経損傷の分布(例えば、遠位対近位)、主な罹患神経成分(例えば、脱髄性対軸索性)、病因または遺伝パターンによって分類される。
一実施形態において、サーチュイン活性化化合物およびニコチン酸は、神経変性障害またはこのような状態と関連する続発性状態を処置または予防するのに有用な別の治療剤との併用療法の一部として投与され得る。したがって、複合薬レジメンは、サーチュイン活性化化合物、ニコチン酸および1種類以上の抗神経変性剤を含むものであり得る。ニューロン疾患または障害を処置または予防するための例示的な治療剤としては、例えば、L−DOPA;ドパミン作動薬;アデノシンA2A受容体拮抗剤;COMT阻害剤;MAO阻害剤;NOS阻害剤;ナトリウムチャネル拮抗剤;選択的N−メチルD−アスパラギン酸(NMDA)受容体拮抗剤;AMPA/カイニン酸受容体拮抗剤;カルシウムチャンネル拮抗剤;GABA−A受容体作動薬;アセチルコリンエステラーゼ阻害剤;マトリックスメタロプロテアーゼ阻害剤;p38MAPキナーゼまたはc−jun−N末端キナーゼの阻害剤;TPA;NDA拮抗剤;β−インターフェロン;増殖因子;グルタミン酸阻害剤;および/または細胞療法の一部としてのものが挙げられる。
他の態様において、サーチュイン活性化化合物およびニコチン酸は、血液凝固障害(または止血障害)を処置または予防するために使用され得る。本明細書において互換的に用いられる用語「止血」、「血液凝固」および「血液凝固」は、出血の制御、例えば、血管収縮および凝固の生理学的特性をいう。血液凝固は、損傷、炎症、疾患、先天的欠陥、機能不全または他の破壊後の哺乳動物の血液循環の完全性の維持を補助する。凝血の開始後、血液凝固は、ある種の血漿プロ酵素のその酵素形態への逐次的活性化により進行する(例えば、Coleman、R.W.ら(編)Hemostasis and Thrombosis,Second Edition,(1987)を参照のこと)。このような血漿糖タンパク質、例えば、第XII因子、第XI因子、第IX因子、第X因子、第VII因子およびプロトロンビンは、セリンプロテアーゼのチモーゲンである。これらの血液凝固酵素のほとんどは、生理学的規模において、膜表面でタンパク質補因子(例えば、第VIII因子および第V因子など)との複合体に組織化された場合のみ有効である。他の血液因子は、血餅形成をモジュレートし、局在させるか、または血餅を溶解させるものである。活性化されたプロテインCは、凝血促進成分を不活化させる特異的酵素である。カルシウムイオンは、該成分の反応の多くに関与している。血液凝固は、固有の経路(この場合、タンパク質成分のすべてが血液中に存在する)、または外因性経路(この場合、細胞膜タンパク質組織因子が重要な役割を果たす)のいずれかに従う。血餅形成は、フィブリノゲンがトロンビンによって切断され、フィブリンが形成された場合に起こる。血餅は、活性化された血小板およびフィブリンで構成されている。
さらに、血餅の形成は、損傷の場合の出血を制限するだけでなく(止血)、重要な動脈または静脈の閉塞によって、アテローム硬化性疾患の状況では重篤な器官の損傷および死がもたらされ得る。したがって、血栓症は、誤った時点および場所における血餅形成である。これは、循環血液タンパク質(凝固因子)、血液細胞(特に、血小板)および損傷血管壁の要素間の複雑で規制された生化学的反応のカスケードを伴う。
したがって、本発明は、血液凝固障害、例えば、心筋梗塞、脳卒中、末梢動脈疾患による肢部の喪失または肺動脈塞栓症などを予防または処置するために、血餅形成の阻害を目的とする抗凝固処置および抗血栓処置を提供する。
本明細書において互換的に用いる「止血をモジュレートすること、またはモジュレーション」および「止血を調節すること、または調節」は、止血の誘導(例えば、刺激または増大)、ならびに止血の阻害(例えば、低下または減少)を含む。
本発明の一態様において、本発明は、ニコチン酸との組合せでサーチュイン活性化化合物を投与することにより、被験体において止血を低下または減少させるための方法を提供する。本明細書に開示した組成物および方法は、血栓性障害の処置または予防に有用である。本明細書で用いる場合、用語「血栓性障害」は、過度もしくは不要な凝固もしくは止血活性、または凝固能亢進状態を特徴とする任意の障害または状態を含む。血栓性障害としては、血小板粘着および血栓形成を伴う疾患または障害が挙げられる。血栓を形成する傾向の増大、例えば、血栓の数の増大、早期の血栓症、血栓症に対する家族性傾向、および異例な部位における血栓症として発現され得る。血栓性障害の例としては、限定されないが、血栓塞栓症、深静脈血栓症、肺動脈塞栓症、脳卒中、心筋梗塞、流産、アンチトロンビンIII欠損と関連する栓友病、プロテインC欠損、プロテインS欠損、活性化されプロテインCに対する抵抗性、異常フィブリノゲン血症、線維素溶解性障害、ホモシスチン尿症、妊娠、炎症性障害、骨髄増殖性障害、動脈硬化、狭心症、例えば、不安定狭心症、播種性血管内凝固症候群、血栓性血小板減少性紫斑病、癌転移、鎌状赤血球症、糸球体腎炎および薬物誘発性血小板減少症(例えば、ヘパリン誘発性血小板減少症など)が挙げられる。また、サーチュイン活性化化合物およびニコチン酸は、血栓性事象を予防するため、または治療的血餅溶解または血管形成術もしくは外科処置などの手順の間またはその後の再閉塞を予防するために投与され得る。
一実施形態において、サーチュイン活性化化合物およびニコチン酸は、血液凝固障害またはこのような状態と関連する続発性状態の処置または予防に有用な別の治療剤との併用療法の一部として投与され得る。したがって、複合薬レジメンは、サーチュイン活性化化合物、ニコチン酸および1種類以上の抗凝固剤または抗血栓症剤を含むものであり得る。例示的な抗凝固剤または抗血栓症剤としては、例えば、アスピリン、ヘパリン、およびVit K依存性因子を阻害する経口ワルファリン、第X因子および第II因子を阻害する低分子量ヘパリン、トロンビン阻害剤、血小板GP IIbIIIa受容体の阻害剤、組織因子(TF)の阻害剤、ヒトフォン・ヴィレブランド因子の阻害剤、止血に関与している(特に、凝固カスケードにおいて)1種類以上の因子の阻害剤が挙げられる。また、サーチュイン活性化化合物およびニコチン酸は、血栓溶解剤、例えば、t−PA、ストレプトキナーゼ、レプチラーゼ、TNK−t−PAおよびスタフィロキナーゼなどと組合せ得る。
別の態様において、ニコチン酸との組合せでのサーチュイン活性化化合物は、被験体において体重増加または肥満を処置または予防するために使用され得る。例えば、サーチュイン活性化化合物およびニコチン酸は、例えば、遺伝性肥満、食事性肥満、ホルモン関連肥満、薬物投与と関連する肥満を処置または予防するため、被験体の体重を減少させるため、または被験体において体重増加(例えば、薬物誘発性体重増加)を低減もしくは抑制するために使用され得る。かかる処置を必要とする被験体は、肥満である、おそらく肥満になる、太り過ぎ、またはおそらく太り過ぎになる被験体であり得る。おそらく肥満または太り過ぎになる被験体は、例えば、家族歴、遺伝的特徴、食事、活動レベル、治療薬摂取またはこれらの種々の組合せに基づいて特定され得る。
また他の実施形態において、サーチュイン活性化化合物およびニコチン酸は、被験体において体重減少を促進させることにより処置または予防され得る種々の他の疾患および状態に苦しむ被験体に投与され得る。かかる疾患としては、例えば、高血圧、高血圧症、高血中コレステロール、脂質代謝異常、2型糖尿病、インスリン抵抗性、耐糖能障害、高インスリン血症、冠動脈心臓疾患、狭心症、うっ血性心不全、脳卒中、胆石、胆嚢炎および胆石症、痛風、変形性関節症、閉塞性睡眠時無呼吸および呼吸困難、ある種の癌(子宮内膜、乳房、前立腺および結腸)、妊娠合併症、女性の不充分な生殖上の健康(例えば、月経不順、不妊、不規則な排卵)、膀胱制御困難(例えば、緊張性尿失禁);尿酸腎結石症;精神的障害(例えば、鬱病、摂食障害、身体イメージの崩壊および低い自己評価など)が挙げられる。Stunkard AJ,Wadden TA.(編)Obesity:theory and therapy,第2版.New York:Raven Press,1993。最後に、AIDS患者は、AIDSの併用療法に応答したリポジストロフィまたはインスリン抵抗性を発現し得る。
別の実施形態において、サーチュイン活性化化合物およびニコチン酸は、脂肪生成または脂肪細胞分化を、インビトロであろうとインビボであろうと抑制するために使用され得る。特に、高循環レベルのインスリンおよび/またはインスリン様増殖因子(IGF)1が、前駆脂肪細胞を漸増させて脂肪細胞に分化させることが抑制される。かかる方法は、肥満を処置または予防するために使用され得る。
他の実施形態において、サーチュイン活性化化合物およびニコチン酸は、食欲の低下および/または満腹感の増大により、体重減少を引き起こすか、または体重増加回避するために使用され得る。かかる処置を必要とする被験体は、太り過ぎ、肥満である被験体、またはおそらく太り過ぎ、もしくは肥満になる被験体であり得る。該方法は、毎日または1日おき、または週1回、ある用量を、例えば丸剤の形態で被験体に投与することを含み得る。用量は、「食欲低下用量」であり得る。
該方法は、被験体の体重および/または、例えば脂肪組織におけるサーチュインの活性化レベルをモニタリングすることをさらに含み得る。
例示的な一実施形態において、サーチュイン活性化化合物およびニコチン酸は、体重増加または肥満を処置または予防するための併用療法として投与され得る。例えば、サーチュイン活性化化合物およびニコチン酸は、1種類以上の抗肥満剤と組み合わせて投与され得る。例示的な抗肥満剤としては、例えば、フェニルプロパノールアミン、エフェドリン、プソイドエフェドリン、フェンテルミン、コレシストキニン−A作動薬、モノアミン再取り込み阻害剤(例えば、シブトラミンなど)、交感神経様作用剤、セロトニン作動剤(例えば、デキスフェンフルラミンもしくはフェンフルラミンなど)、ドパミン作動薬(例えば、ブロモクリプチンなど)、メラニン細胞刺激ホルモン受容体作動薬または模倣薬、メラニン細胞刺激ホルモン類縁体、カンナビノイド受容体拮抗剤、メラニン凝集ホルモン拮抗剤、OBタンパク質(レプチン)、レプチン類縁体、レプチン受容体作動薬、ガラニン拮抗剤またはGIリパーゼ阻害剤もしくは減少剤(decreaser)(例えば、オーリスタットなど)が挙げられる。他の食欲抑制剤としては、ボンベシン作動薬、デヒドロエピアンドロステロンまたはその類縁体、グルココルチコイド受容体作動薬および拮抗剤、オレキシン受容体拮抗剤、ウロコルチン結合タンパク質拮抗剤、グルカゴン様ペプチド−1受容体(例えば、エキセンディンなど)および毛様体神経栄養因子(例えば、アクソカインなど)の作動薬が挙げられる。
別の態様において、サーチュイン活性化化合物およびニコチン酸は、代謝性障害、例えば、インスリン抵抗性、プレ糖尿病性状態、II型糖尿病および/またはその合併症などを処置または予防するために使用され得る。サーチュイン活性化化合物およびニコチン酸の投与により、被験体においてインスリン感受性が増大および/またはインスリンレベルが減少され得る。かかる処置を必要とする被験体は、インスリン抵抗性もしくはII型糖尿病の他の前兆症状を有する被験体、II型糖尿病を有する被験体、、またはおそらく任意のこれらの状態を発現する被験体であり得る。例えば、被験体は、インスリン抵抗性を有する被験体、例えば、高循環レベルのインスリンおよび/または関連状態、例えば、高脂血症、脂質生成不全(dyslipogenesis)、高コレステロール血症、グルコース寛容減損、高血中ブドウ糖レベル、X症候群の他の徴候、高血圧症、アテローム性動脈硬化およびリポジストロフィを有する被験体であり得る。
例示的な一実施形態において、サーチュイン活性化化合物およびニコチン酸は、代謝性障害を処置または予防するための併用療法として投与され得る。例えば、サーチュイン活性化化合物およびニコチン酸は、1種類以上の抗糖尿病剤と組み合わせて投与され得る。例示的な抗糖尿病剤としては、例えば、アルドースレダクターゼ阻害剤、グリコーゲンホスホリラーゼ阻害剤、ソルビトールデヒドロゲナーゼ阻害剤、タンパク質チロシンホスファターゼ1B阻害剤、ジペプチジルプロテアーゼ阻害剤、インスリン(例えば、経口用の生物学的利用可能なインスリン調製物)、インスリン模倣薬、メトホルミン、アクラボス、ペルオキシソーム増殖薬活性化受容体−γ(PPAR−γ)リガンド、例えば、トログリタゾン、ロシグリタゾン(rosaglitazone)、ピオグリタゾンまたはGW−1929など、スルホニル尿素、グリパジド(glipazide)、グリブリドまたはクロルプロパミドが挙げられ、ここで、第1および第2の化合物の量が治療効果をもたらす。他の化合物抗糖尿病剤としてはグルコシダーゼ阻害剤、グルカゴン様ペプチド−1(GLP−1)、インスリン、PPARα/γデュアル作動薬、メグリチミド(meglitimide)およびαP2阻害剤が挙げられる。例示的な一実施形態において、抗糖尿病剤は、ジペプチジルペプチダーゼIV(DP−IVまたはDPP−IV)阻害剤、例えば、LAF237(Novartis製)(NVP DPP728;1−[[[2−[(5−シアノピリジン−2−イル)アミノ]エチル]アミノ]アセチル]−2−シアノ−(S)−ピロリジン)またはMK−04301(Merck製)などであり得る(例えば、Hughesら,Biochemistry 38:11597−603(1999)参照)。
他の態様において、サーチュイン活性化化合物およびニコチン酸は、炎症と関連する疾患または障害を処置または予防するために使用され得る。サーチュイン活性化化合物およびニコチン酸は、炎症の発生の前、発生時または発生後に投与され得る。予防的に用いる場合、サーチュイン活性化化合物およびニコチン酸は、好ましくは、任意の炎症性応答または症状の前に提供される。サーチュイン活性化化合物およびニコチン酸の投与により、炎症性応答または症状が予防または減弱され得る。
例示的な炎症性状態としては、例えば、多発性硬化症、関節リウマチ、乾癬性関節炎、変形性関節症、脊椎性関節症(spondouloarthropathies)、痛風性関節炎、全身性エリテマトーデス、若年性関節炎、関節リウマチ、変形性関節症、骨粗鬆症、糖尿病(例えば、インスリン依存性真性糖尿病もしくは若年発症糖尿病)、月経痛、嚢胞性線維症、炎症性腸疾患、過敏性腸症候群、クローン病、粘液性大腸炎、潰瘍性大腸炎、胃炎、食道炎、膵炎、腹膜炎、アルツハイマー病、ショック、強直性脊椎炎、胃炎、結膜炎、膵炎(pancreatis)(急性もしくは慢性)、多臓器機能障害症候群(例えば、敗血症もしくは外傷に続発性)、心筋梗塞、アテローム性動脈硬化、脳卒中、再灌流傷害(例えば、心肺バイパスもしくは腎臓透析による)、急性糸球体腎炎、脈管炎、熱傷(すなわち、日焼け)、壊死性腸炎、顆粒球輸血関連症候群および/またはシェーグレン症候群が挙げられる。例示的な皮膚の炎症性状態としては、例えば、湿疹、アトピー性皮膚炎、接触皮膚炎、じんま疹、強皮症(schleroderma)、乾癬および急性炎症性成分による皮膚病が挙げられる。
別の実施形態において、サーチュイン活性化化合物およびニコチン酸は、アレルギーおよび呼吸器病、例えば、喘息、気管支炎、肺線維症、アレルギー性鼻炎、酸素毒性、気腫、慢性気管支炎、急性呼吸促迫症候群、および任意の慢性閉塞性肺疾患(COPD)を処置または予防するために使用され得る。該化合物は、慢性肝炎感染、例えば、B型肝炎およびC型肝炎を処置するために使用され得る。
さらに、サーチュイン活性化化合物およびニコチン酸は、自己免疫疾患および/または自己免疫疾患と関連する炎症、例えば、器官−組織自己免疫疾患(例えば、レイノー症候群)、強皮症、重症筋無力症、移植拒絶、内毒素性ショック、セプシス、乾癬、湿疹、皮膚炎、多発性硬化症、自己免疫甲状腺炎、ブドウ膜炎、全身性エリテマトーデス、アディソン病、多腺性自己免疫疾患(多腺性自己免疫症候群としても知られる)およびグレーヴズ病などを処置するために使用され得る。
ある特定の実施形態において、サーチュイン活性化化合物およびニコチン酸は、炎症を処置または予防するのに有用な他の化合物と組み合わせて摂取され得る。例示的な抗炎症性薬剤としては、例えば、ステロイド(例えば、コルチゾル、コルチゾン、フルドロコルチゾン、プレドニゾン、6α−メチルプレドニゾン、トリアムシノロン、ベータメタゾンもしくはデキサメタゾン)、非ステロイド系抗炎症性薬(NSAIDS(例えば、アスピリン、アセトアミノフェン、トルメチン、イブプロフェン、メフェナム酸、ピロキシカム、ナブメトン、ロフェコキシブ、セレコキシブ、エトドラクもしくはニメスリド)、PDE4阻害剤(例えば、ロフルミラストもしくはロリプラム)、または抗ヒスタミン剤(例えば、シクリジン、ヒドロキシジン、プロメタジンもしくはジフェンヒドラミン)が挙げられる。
ニコチン酸との組合せでのサーチュイン活性化化合物は、ウイルス性感染症(例えば、インフルエンザ、ヘルペスまたはパピローマウイルスによる感染症など)を処置または予防するため、または抗真菌剤として使用され得る。
本明細書に記載のようにして処置され得る被験体としては、真核生物、例えば、哺乳動物、例えば、ヒト、ヒツジ、ウシ、ウマ、ブタ、イヌ、ネコ、非ヒト霊長類、マウスおよびラットなどが挙げられる。処理され得る細胞としては、真核生物細胞、例えば、上記の被験体由来のもの、または植物細胞、酵母細胞および原核生物細胞、例えば、細菌細胞が挙げられる。例えば、サーチュイン活性化化合物およびニコチン酸は家畜用動物に対し、飼育条件に対してより長期間耐えられる能力を改善するために投与され得る。
サーチュイン活性化化合物およびニコチン酸はまた、植物において寿命、ストレス抵抗性およびアポトーシスに対する抵抗性を増大させるために使用され得る。一実施形態において、サーチュイン活性化化合物およびニコチン酸は、植物に対して例えば定期的に、または真菌に対して適用される。別の実施形態において、植物は、化合物をもたらすように遺伝的に修飾されたものである。別の実施形態において、植物および果実はサーチュイン活性化化合物およびニコチン酸で、輸送中での損傷に対する抵抗性を増大させるために収穫および輸送前に処理される。また、植物の種子を、例えば保存するためにサーチュイン活性化化合物およびニコチン酸と接触させてもよい。
他の実施形態において、サーチュイン活性化化合物およびニコチン酸は、酵母細胞において寿命をモジュレートするために使用され得る。酵母細胞の寿命を延長させることが望まれ得る状況としては、酵母が用いられる任意のプロセス、例えば、ビール、ヨーグルトおよびベーカリー製品、例えばパンの製造が挙げられる。寿命が延長された酵母の使用により、酵母の使用量が少なくなり得るか、または酵母をより長期間活性にし得る。また、タンパク質を組換えにより作製するために使用される酵母または他の哺乳動物細胞も、本明細書に記載のようにして処置され得る。
サーチュイン活性化化合物およびニコチン酸はまた、昆虫において寿命、ストレス抵抗性およびアポトーシスに対する抵抗性を増大させるために使用され得る。この実施形態では、サーチュイン活性化化合物およびニコチン酸は、有用な昆虫、例えば、ハチおよび植物の受粉に関与している他の昆虫に適用され得る。具体的な一実施形態において、サーチュイン活性化化合物およびニコチン酸は、ハチミツの製造に関与しているハチに適用され得る。一般的に、本明細書に記載の方法は、商業的重要性を有し得る任意の生物体(例えば、真核生物)に適用され得る。例えば、該方法は、魚(水産養殖)ならびに鳥類(例えば、ニワトリおよび家禽)に適用され得る。
高用量のサーチュイン活性化化合物およびニコチン酸はまた、発生中でのサイレンス遺伝子の調節およびアポトーシスの調節を妨げることにより、殺虫剤として使用され得る。この実施形態では、サーチュイン活性化化合物およびニコチン酸は植物に、該化合物が昆虫の幼虫に対して生物学的利用可能であるが植物に対してはそうでないことを確実にする、当該技術分野において知られた方法を用いて適用され得る。
少なくとも、生殖と長寿性との連関に鑑みると(LongoおよびFinch,Science,2002)、サーチュイン活性化化合物およびニコチン酸は、生物体(例えば、昆虫、動物および微生物など)の生殖に影響を及ぼすために適用され得る。
4.アッセイ
ある特定の態様において、本発明は、紅潮および/または薬物誘発性体重増加を処置および/または予防するための化合物(薬剤)を同定するためのスクリーニング方法を提供する。主題のスクリーニング方法によって同定された候補化合物は、被験体、例えば、その必要がある被験体に投与され得る。かかる処置を必要とする被験体は、紅潮および/または薬物誘発性体重増加に苦しむ被験体、あるいはこれらを有する被験体、あるいは、例えば家族歴、年齢、処方された薬剤などから、おそらくこれらの状態を有することが予測される被験体であり得る。例示的な薬剤は、本明細書に記載されたものである。
ある特定の態様において、本発明は、紅潮および/または薬物誘発性体重増加を処置および/または予防するための化合物(薬剤)を同定するためのスクリーニング方法を提供する。主題のスクリーニング方法によって同定された候補化合物は、被験体、例えば、その必要がある被験体に投与され得る。かかる処置を必要とする被験体は、紅潮および/または薬物誘発性体重増加に苦しむ被験体、あるいはこれらを有する被験体、あるいは、例えば家族歴、年齢、処方された薬剤などから、おそらくこれらの状態を有することが予測される被験体であり得る。例示的な薬剤は、本明細書に記載されたものである。
サーチュイン(SIRT1など)の活性に対する該化合物の効果は、例えば、Howitzら(前掲)記載のようにして、または以下のようにして測定され得る。例えば、サーチュインタンパク質を化合物とインビトロで、例えば、溶液中または細胞内で接触させ得る。一実施形態において、サーチュインタンパク質を化合物と溶液中で接触させ、サーチュインの活性(例えば、ヒストン、p53などのタンパク質またはその一部を脱アセチル化する能力)を測定する。一般的に、サーチュインは、その生物学的活性の少なくとも1つ(例えば、脱アセチル化活性)が、化合物の存在下においてその不在下よりも高い場合、該化合物によって活性化されている。活性化は、少なくとも約10%、30%、50%、100%(すなわち、2倍)、3、10、30または100倍であり得る。
サーチュインの活性化は、例えば、サーチュインまたはサーチュインを含有する細胞もしくは細胞抽出物を、脱アセチル化標的、例えば、ヒストン、p53タンパク質またはその一部と接触させ、脱アセチル化標的のアセチル化レベル測定することにより測定され得る。試験対象のサーチュインとともにインキュベートされた標的のアセチル化レベルが、対照サーチュインのアセチル化レベルと比べて高いことは、試験対象のサーチュインが活性化されていることを示す。対照サーチュインは、サーチュイン−活性化または−阻害化合物と接触させていない、組換えにより作製されたサーチュインであり得る。
被験体が紅潮または薬物誘発性体重増加を有するか、または発現する可能性を測定するためのアッセイは、当該技術分野でよく知られている。例えば、かかるアッセイは、被験体において、サーチュイン(例えば、SIRT1など)の活性または発現(例えば、mRNA、プレ−mRNAまたはタンパク質)のレベルを測定することを含むものであり得る。被験体においてサーチュインの活性または発現のレベルが低いことは、被験体が、紅潮もしくは薬物誘発性体重増加またはその続発性状態を発現したか、またはおそらく発現することを示すと思われる。あるいはまた、被験体においてサーチュインの活性または発現のレベルが高いことは、被験体が、紅潮または薬物誘発性体重増加の発現から保護されているか、おそらく保護されていることを示すと思われる。他のアッセイとしては、サーチュインの活性または発現レベルの測定が挙げられる。
ある特定の実施形態において、該方法は、例えば、Howitzら(前掲)に記載のような、サーチュインを試験薬剤と接触させることおよびサーチュイン(例えば、SIRT1)の活性に対する試験薬剤の効果を測定することを含むものであり得る。また、該方法の第1工程は、サーチュインを含む細胞を試験薬剤と接触させること、およびサーチュインの活性または発現レベルに対する試験薬剤の効果を測定することを含み得る。サーチュインの発現レベルは、サーチュインのmRNA、プレ−mRNAまたはタンパク質のレベルを測定することにより測定され得る。該方法の他の工程は、薬剤を、動物モデルにおいて紅潮または薬物誘発性体重増加について試験することを含み得る。かかる動物モデルは、当該技術分野でよく知られている。スクリーニング方法は、薬剤の毒性または有害効果を測定する工程をさらに含み得る。
5.医薬用製剤
サーチュイン活性化化合物を含む医薬組成物は、従来の様式で、1種類以上の生理学的に許容され得る担体または賦形剤を用いて製剤化され得る。したがって、サーチュイン活性化化合物ならびにその生理学的に許容され得る塩および溶媒和物は、例えば、注射、吸入もしくは吹入(口または鼻のいずれかにより)による投与、または経口、口腔内、非経口もしくは経直腸投与用に製剤化され得る。一実施形態において、サーチュイン活性化化合物は、標的細胞、例えば、ニューロン性細胞または血液細胞部位に局所投与される。
5.医薬用製剤
サーチュイン活性化化合物を含む医薬組成物は、従来の様式で、1種類以上の生理学的に許容され得る担体または賦形剤を用いて製剤化され得る。したがって、サーチュイン活性化化合物ならびにその生理学的に許容され得る塩および溶媒和物は、例えば、注射、吸入もしくは吹入(口または鼻のいずれかにより)による投与、または経口、口腔内、非経口もしくは経直腸投与用に製剤化され得る。一実施形態において、サーチュイン活性化化合物は、標的細胞、例えば、ニューロン性細胞または血液細胞部位に局所投与される。
例示的な一実施形態において、医薬組成物は、1種類以上のサーチュイン活性化化合物および紅潮を誘発する1種類以上の化合物を含む。紅潮を誘発する例示的な化合物としては、例えば、ナイアシン、ファロキシフェン、抗鬱薬、抗精神病薬、化学療法薬、カルシウムチャンネル遮断薬および抗生物質が挙げられる。別の実施形態において、医薬組成物は、1種類以上のサーチュイン活性化化合物および体重増加を誘発する1種類以上の化合物を含む。体重増加を誘発する例示的な化合物としては、例えば、抗糖尿病剤、抗鬱薬、ステロイド、ホルモン、β遮断薬、α遮断薬および避妊薬が挙げられる。
サーチュイン活性化化合物は、種々の投与負荷、例えば、全身性および経表面的または限局的投与のために製剤化され得る。手法および製剤は、一般的に、Remmington’s Pharmaceutical Sciences,Meade Publishing Co.,Easton,PAを見るとよい。全身投与には、注射が好ましく、例えば、筋肉内、静脈内、腹腔内および皮下である。注射用では、サーチュイン活性化化合物は、液状溶液、好ましくは、生理学的適合性バッファー(例えば、ハンクス溶液またはリンゲル溶液)中に製剤化され得る。また、サーチュイン活性化化合物は、固形形態に製剤化され、使用直前に再溶解または懸濁され得る。凍結乾燥形態もまた含まれる。
経口投与用では、医薬組成物には、例えば、薬学的に許容され得る賦形剤、例えば、結合剤(例えば、アルファー化トウモロコシデンプン、ポリビニルピロリドンもしくはヒドロキシプロピルメチルセルロース);充填剤(例えば、ラクトース、微晶質セルロースもしくはリン酸水素カルシウム);滑沢剤(例えば、ステアリン酸マグネシウム、タルクもしくはシリカ);崩壊剤(例えば、イモデンプンもしくはナトリウムデンプングリコーレート);または湿潤剤(例えば、ラウリル硫酸ナトリウム)などを用いて慣用的な手段によって調製される錠剤、ロゼンジ剤またはカプセル剤の形態が採用され得る。錠剤は、当該技術分野でよく知られた方法によってコーティングしてもよい。経口投与用の液状調製物では、例えば、液剤、シロップ剤または懸濁剤の形態が採用され得るか、あるいは、使用前に水または他の適当なビヒクルとともに構成するための乾燥品として提示され得る。かかる液状調製物は、慣用的な手段により、薬学的に許容され得る添加剤、例えば、懸濁剤(例えば、ソルビトールシロップ、セルロース誘導体または水素添加食用脂);乳化剤(例えば、レシチンまたはアカシア);非水性ビヒクル(例えば、分別(ationd)油、油状エステル、エチルアルコールまたは分別(fractionated)植物油);および保存料(例えば、メチルまたはプロピル−p−ヒドロキシベンゾエートまたはソルビン酸)などを用いて調製され得る。また、該調製物には、適宜、緩衝塩、フレーバー剤、着色剤および甘味剤を含めてもよい。経口投与用の調製物は、該活性化合物の制御放出がもたらされるように適当に製剤化され得る。
ポリフェノール(例えば、レスベラトロールなど)は、特に、液状または半固形形態では、酸化され、サーチュイン刺激活性が損なわれ得る。ポリフェノール含有化合物の酸化を抑制し、サーチュイン刺激活性を保持するため、該化合物は、窒素雰囲気中で保存され得るか、または酸素を排除する型のカプセルおよび/またはホイルパッケージ(例えば、Capsugel(商標))内に封入され得る。
吸入による投与用では、サーチュイン活性化化合物は、適当なスプレー用高圧ガス、例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素または他の適当なガスの使用を伴う、加圧パックまたはネブライザーからのエーロゾルスプレー提示の形態で、簡便に送達され得る。加圧エーロゾルの場合、投薬形態は、定量を送達するための弁を設けることにより決定され得る。吸入器または吸入器における使用のための、該化合物と適当な粉末基剤(例えば、ラクトースまたはデンプンなど)との粉末ミックスを含む、例えばゼラチン製のカプセルおよびカートリッジが製剤化され得る。
サーチュイン活性化化合物は、注射、例えば、ボーラス注射または連続注入による非経口投与用に製剤化され得る。注射用製剤は、単位投薬形態、例えば、アンプルまたは反復投与用容器で提示され得、保存料が添加されている。該組成物には、懸濁液、溶液または油性もしくは水性ビヒクル中エマルジョンなどの形態が採用され得、懸濁剤、安定化剤および/または分散剤などの製剤用剤が含まれ得る。あるいはまた、活性成分は、使用前に適当なビヒクル(例えば、滅菌パイロジェンフリー水)とともに構成するための粉末形態であり得る。
サーチュイン活性化化合物はまた、経直腸組成物、例えば、坐剤または停留注腸剤などに製剤化され得、例えば、慣用的な坐剤基剤(例えば、ココアバターまたは他のグリセリド類など)を含有する。
先に記載した製剤に加え、サーチュイン活性化化合物はまた、デポ調製物として製剤化され得る。かかる長期作用性製剤は、埋入(例えば、皮下もしくは筋肉内)または筋肉内注射によって投与され得る。したがって、例えば、サーチュイン活性化化合物は、適当な高分子材料もしくは疎水性材料(例えば、許容され得る油中のエマルジョンとして)またはイオン交換樹脂を用いて製剤化され得るか、またはやや溶けにくい誘導体として(例えば、やや溶けにくい塩として)製剤化され得る。また、制御放出形式には、パッチも含まれる。
医薬組成物(化粧用調製物を含む)は、重量基準で約0.00001〜100%、例えば、0.001〜10%または0.1%〜5%の1種類以上の本明細書に記載のサーチュイン活性化化合物を含むものであり得る。例示的な一実施形態において、医薬組成物は、重量基準で約0.00001〜100%、例えば、0.001〜10%または0.1%〜5%の紅潮を誘発する1種類以上の化合物または体重増加を誘発する1種類以上の化合物をさらに含み得る。
一実施形態において、本明細書に記載のサーチュイン活性化化合物は、一般的に経表面的薬物投与に適した経表面的担体を含有し、当該技術分野で知られた任意のかかる材料を含む経表面的製剤に組み込まれる。経表面的担体は、該組成物が所望の形態、例えば、軟膏、ローション剤、クリーム剤、マイクロエマルジョン剤、ゲル剤、油状物、液剤などとして提供されるように選択され得、天然起源もしくは合成起源のいずれかの材料で構成され得る。選択される担体は、活性剤または経表面的製剤の他の成分に有害な影響を及ぼさないことが好ましい。本明細書において使用され得る適当な経表面的担体の例としては、水、アルコールおよび他の無毒性有機溶媒、グリセリン、鉱油、シリコーン、ワセリン、ラノリン、脂肪酸、植物油、パラベン、ワックスなどが挙げられる。
製剤は、無色無臭の軟膏、ローション剤、クリーム剤、マイクロエマルジョン剤およびゲル剤であり得る。
サーチュイン活性化化合物は、一般的に半固形調製物であり、典型的にはワセリンまたは他の石油誘導体を基剤とする軟膏に組み込まれ得る。使用される具体的な軟膏基材は、当業者に認識されようが、最適な薬物送達を提供するもの、好ましくは、さらに他の所望される特性(例えば、皮膚軟化性など)も提供するものである。他の担体またはビヒクルと同様、軟膏基剤は、不活性、安定、非刺激性および非感作性であるのがよい。先のセクションで挙げたRemington’sに説明されているように、軟膏基剤は4つの類型:油性基剤;乳化性基剤;エマルジョン基剤;および水溶性基剤に分類され得る。油性軟膏基剤としては、例えば、植物油、動物から得られる脂肪、および石油から得られる半固形炭化水素が挙げられる。乳化性軟膏基剤は、吸収性軟膏基剤としても知られ、水分をほとんど、または全く含有せず、例えば、硫酸ヒドロキシステアリン、無水ラノリンおよび親水性ワセリンが挙げられる。エマルジョン軟膏基剤は、油中水型(W/O)エマルジョンまたは水中油型(O/W)エマルジョンのいずれかであり、例えば、セチルアルコール、モノステアリン酸グリセリル、ラノリンおよびステアリン酸が挙げられる。例示的な水溶性軟膏基剤は、種々の分子量のポリエチレングリコール(PEG)から調製されるものである。これらについても、さらなる情報についてはRemington’s(前掲)を参照されたい。
サーチュイン活性化化合物はローション剤に組み込まれ得、これは、一般的には、摩擦なしで皮膚表面に適用される調製物であり、典型的には液状、または固形粒子(例えば、活性剤)を水またはアルコール基剤中に存在させた半液状調製物である。ローション剤は、通常、固形物の懸濁液であるが、水中油型の液状油性エマルジョンを含んでもよい。ローション剤は、組成物がより流動性で適用し易いため、広い体表面積の処置に好ましい製剤である。一般的に、ローション剤中の不溶物は微細化されていることが必要である。ローション剤は、典型的には、活性剤を局在化させ、皮膚との接触を保持するのに有用なより良好な分散液ならびに化合物をもたらす懸濁剤、例えば、メチルセルロース、カルボキシメチルセルロースナトリウムなどを含有する。本発明の方法と共に使用のための例示的なローション製剤は、親水性ワセリンと混合されたプロピレングリコールを含有するもの、例えば、Beiersdorf,Inc.(Norwalk,Conn.)から商標AquaphorRTMで入手され得るものである。
サーチュイン活性化化合物はクリーム剤に組み込まれ得、これは、一般的に、水中油型または油中水型いずれかの粘性液状または半固形のエマルジョンである。クリーム剤の基剤は水洗性であり、油相、乳化剤および水相を含むものである。油相は、一般的に、ワセリンおよび脂肪族アルコール(例えば、セチルまたはステアリルアルコールなど)で構成され、水相は、通常(必ずしもそうでないが)、油相よりも容量が大きく、一般的に、湿潤剤(加湿剤)を含有する。クリーム製剤中の乳化剤は、Remington’s(前掲)に説明されているように、一般的に、ノニオン系、アニオン系、カチオン系または両性界面活性剤である。
サーチュイン活性化化合物はマイクロエマルジョン剤に組み込まれ得、これは、一般的に、2種類の非混和性の液体(例えば、油と水など)の熱力学的に安定で等方的に透明な分散液である(Encyclopedia of Pharmaceutical Technology(New York:Marcel Dekker, 1992),第9巻)。マイクロエマルジョン剤の調製には、界面活性剤(乳化剤)、補助(co−)界面活性剤(補助乳化剤)、油相および水相が必要である。好適な界面活性剤としては、エマルジョンの調製に有用な任意の界面活性剤、例えば、クリーム剤の調製に典型的に使用される乳化剤が挙げられる。補助界面活性剤(または「補助乳化剤」)は、一般的に、ポリグリセロール誘導体、グリセロール誘導体および脂肪族アルコールの群から選択される。好ましい乳化剤/補助乳化剤の組合せは、一般的に(必ずしもそうでないが)、モノステアリン酸グリセリルと酒石酸ポリオキシエチレン;ポリエチレングリコールとエチレングリコールパルミトステアリン酸エステル(palmitostearate);ならびにカプリリン酸(caprilic)およびカプリン酸(capric)トリグリセリドとオレイルマクロゴールグリセリド(macrogolglyceride)からなる群より選択される。水相は、水だけでなく、典型的には、バッファー、グルコース、プロピレングリコール、ポリエチレングリコール、好ましくは低分子量ポリエチレングリコール(例えば、PEG300やPEG400)および/またはグリセロールなども含有し、一方、油相は、一般的に、例えば、脂肪酸エステル、改質植物油、シリコーン油、モノ−、ジ−およびトリグリセリドの混合物、PEGのモノ−およびジエステル(例えば、オレイルマクロゴールグリセリド)などを含む。
サーチュイン活性化化合物はゲル製剤に組み込まれ得、これは、一般的に、小無機粒子から構成される懸濁液(2相系)または担体液全体に実質的に均一に分散された大有機分子(単一相ゲル)のいずれかからなる半固形系である。単一相ゲルは、例えば、活性剤、担体液および適当なゲル化剤、例えば、トラガカント(2〜5%で)、アルギン酸ナトリウム(2〜10%で)、ゼラチン(2〜15%で)、メチルセルロース(3〜5%で)、カルボキシメチルセルロースナトリウム(2〜5%で)、カルボマー(0.3〜5%で)またはポリビニルアルコール(10〜20%で)などを一緒に合わせ、特徴的な半固形生成物が生成されるまで混合することにより作製され得る。他の適当なゲル化剤としては、メチルヒドロキシセルロース、ポリオキシエチレン−ポリオキシプロピレン、ヒドロキシエチルセルロースおよびゼラチンが挙げられる。ゲルには、一般的に担体水溶液が用いられるが、アルコールおよび油もまた、担体液として使用され得る。
当業者に知られた種々の添加剤を製剤(例えば、経表面的製剤など)に含め得る。添加剤の例としては、限定されないが、可溶化剤、皮膚浸透剤、乳濁剤、保存料(例えば、抗酸化剤)、ゲル化剤、緩衝剤、界面活性剤(特に、ノニオン系および両性界面活性剤)、乳化剤、エモリエント剤、増粘剤、安定化剤、湿潤剤、着色剤、香料などが挙げられる。可溶化剤および/または皮膚浸透剤を、乳化剤、エモリエント剤および保存料とともに含めることは特に好ましい。最適な経表面的製剤は、およそ2wt%〜60wt%、好ましくは2wt%〜50wt%の可溶化剤および/または皮膚浸透剤;2wt%〜50wt%、好ましくは2wt%〜20wt%の乳化剤;2wt%〜20wt%のエモリエント剤;および0.01〜0.2wt%の保存料を、該製剤の残部を構成する活性剤および担体(例えば、水)とともに含む。
皮膚浸透剤は、治療的レベルの活性剤の通過を助長し、無傷の皮膚の妥当な大きさの面積全体に通過させる機能を果たす。好適な向上剤は当該技術分野でよく知られており、例えば、低級アルカノール、例えば、メタノール、エタノールおよび2−プロパノールなど;アルキルメチルスルホキシド、例えば、ジメチルスルホキシド(DMSO)、デシルメチルスルホキシド(C10MSO)およびテトラデシルメチルスルホキシドなど;ピロリドン、例えば、2−ピロリドン、N−メチル−2−ピロリドンおよびN−(−ヒドロキシエチル)ピロリドンなど;尿素;N,N−ジエチル−m−トルアミド;C2〜C6アルカンジオール;種々雑多な溶媒、例えば、ジメチルホルムアミド(DMF)、N,N−ジメチルアセトアミド(DMA)およびテトラヒドロフルフリルアルコールなど;ならびに1−置換アザシクロヘプタン−2−オン、特に、1−n−ドデシルシクロ(cycl)アザシクロヘプタン−2−オン(ラウロカプラム;Whitby Research Incoporated(Richmond、Va)製の商標AzoneRTMで入手可能)が挙げられる。
可溶化剤の例としては、限定されないが、以下:親水性エーテル、例えば、ジエチレングリコールモノエチルエーテル(エトキシジグリコール、TranscutolRTMとして市販)およびジエチレングリコールモノエチルエーテルオレエート(SoftcutolRTMとして市販)など;ポリエチレンヒマシ油誘導体、例えば、ポリオキシ35ヒマシ油、ポリオキシ40水素添加ヒマシ油など;ポリエチレングリコール、特に、低分子量ポリエチレングリコール、例えば、PEG300およびPEG400など、ならびにポリエチレングリコール誘導体、例えば、PEG−8カプリル/カプリングリセリド(LabrasolRTMとして市販)など;アルキルメチルスルホキシド、例えば、DMSOなど;ピロリドン、例えば、2−ピロリドンおよびN−メチル−2−ピロリドンなど;ならびにDMAが挙げられる。また、多くの可溶化剤が吸収向上剤としての機能を果たし得る。単一の可溶化剤を製剤に組み込んでもよく、可溶化剤の混合物を組み込んでもよい。
好適な乳化剤および補助乳化剤としては、限定されないが、マイクロエマルジョン製剤に関して記載した乳化剤および補助乳化剤が挙げられる。エモリエント剤としては、例えば、プロピレングリコール、グリセロール、ミリスチン酸イソプロピル、ポリプロピレングリコール−2(PPG−2)ミリスチルエーテルプロピオン酸エステルなどが挙げられる。
また、他の活性剤、例えば、抗炎症性薬剤、鎮痛薬、抗菌剤、抗真菌剤、抗生物質、ビタミン類、抗酸化剤、ならびにサンスクリーン剤に一般に見られる日焼け止め、例えば、限定されないが、アントラニレート、ベンゾフェノン系(特に、ベンゾフェノン−3)、樟脳誘導体、シンナメート(例えば、オクチルメトキシシンナメート)、ジベンゾイルメタン(例えば、ブチルメトキシジベンゾイルメタン)、p−アミノ安息香酸(PABA)およびその誘導体、およびサリチレート(例えば、オクチルサリチレート)を製剤に含めてもよい。
ある特定の経表面的製剤では、活性剤は、製剤のおよそ0.25wt%〜75wt%の範囲、好ましくは製剤のおよそ0.25wt%〜30wt%の範囲、より好ましくは製剤のおよそ0.5wt%〜15wt%の範囲、最も好ましくは製剤のおよそ1.0wt%〜10wt%の範囲の量で存在する。
経表面的皮膚処置組成物は、その粘性および消費者に意図される用途に適した適当な容器内にパッケージングされ得る。例えば、ローション剤またはクリーム剤は、ボトルもしくはボール回転式アプリケータ、またはスプレー用高圧ガス駆動式エーロゾルデバイス、または指操作に適したポンプを取り付けた容器内にパッケージングされ得る。該組成物がクリーム剤の場合、単に、非変形可能なボトルまたは搾り出し容器(例えば、チューブもしくは蓋付き瓶)内に保存され得る。また、該組成物は、米国特許第5,063,507号に記載のようなカプセル剤に内包させてもよい。したがって、本明細書に規定されたような化粧用として許容され得る組成物を入れた閉鎖容器もまた提供される。
択一的な実施形態において、医薬製剤は、経口または非経口投与のために提供され、この場合、製剤は、上記のようなサーチュイン活性化化合物含有マイクロエマルジョンを含み得、特に経口または非経口薬物投与に適した択一的な薬学的に許容され得る担体、ビヒクル、添加剤などを含有し得る。あるいはまた、サーチュイン活性化化合物含有マイクロエマルジョンは、修正なしで実質的に上記のようにして、経口または非経口投与され得る。
サーチュイン活性化化合物の投与後に、被験体において因子(factor)の測定、例えば、サーチュインの活性の測定を行なってもよい。例示的な実施形態において、細胞は、被験体への活性化化合物または阻害化合物の投与後の被験体から、例えば、生検で入手することにより採取され、サーチュインの活性またはサーチュイン発現レベルを生検において測定する。あるいはまた、バイオマーカー、例えば血漿バイオマーカーを追跡してもよい。細胞は、被験体の任意の細胞であり得るが、活性化化合物が局所投与される場合では、細胞は、好ましくは、投与部位付近に位置する細胞である。例えば、細胞は、ニューロン細胞または血液細胞であり得る。
サーチュインまたは細胞内のサーチュインのタンパク質レベルを低下(reduced)させる分子をコードする核酸(例えば、siRNA)の導入および発現は、発現ベクターを用いて行なわれ得る。例示的な発現ベクターとしては、アデノウイルス系ベクターまたはアデノ随伴ウイルス(AAV)が挙げられる。これらおよび他のベクター、ならびに標的細胞を感染させるための方法は、当該技術分野でよく知られている。あるいはまた、核酸は細胞内に、リポソームまたは類似の手法を用いても導入され得る。
6.キット
また、本明細書において、キット、例えば、治療目的のためのキット、例えば、紅潮もしくは薬物誘発性体重増加またはその続発性状態を処置または予防するためのキットが提供される。キットは、サーチュインタンパク質活性またはレベルをモジュレートする1種類以上の薬剤、例えばサーチュイン活性化化合物(例えば、本明細書に記載されたものなど)、および任意選択で細胞を該薬剤と接触させるためのデバイスを含み得る。デバイスとしては、シリンジ、ステントおよび化合物を被験体に導入するため、または化合物を被験体の皮膚に適用するための他のデバイスが挙げられる。
6.キット
また、本明細書において、キット、例えば、治療目的のためのキット、例えば、紅潮もしくは薬物誘発性体重増加またはその続発性状態を処置または予防するためのキットが提供される。キットは、サーチュインタンパク質活性またはレベルをモジュレートする1種類以上の薬剤、例えばサーチュイン活性化化合物(例えば、本明細書に記載されたものなど)、および任意選択で細胞を該薬剤と接触させるためのデバイスを含み得る。デバイスとしては、シリンジ、ステントおよび化合物を被験体に導入するため、または化合物を被験体の皮膚に適用するための他のデバイスが挙げられる。
さらに、キットはまた、例えば、組織試料内の因子、例えば、上記のサーチュインの活性タンパク質などを測定するための成分を含み得る。
他のキットとしては、紅潮または薬物誘発性体重増加またはその続発性状態を有するか、または発現する可能性を診断するためのキットが挙げられる。キットは、サーチュインの活性およびまたは発現レベルを測定するための薬剤を含み得る。
スクリーニングアッセイのためのキットもまた提供される。例示的なキットは、スクリーニングアッセイを行なうための1種類以上の薬剤、例えば、サーチュインもしくは生物学的に活性なその部分、またはそれを含む細胞もしくは細胞抽出物を含む。任意の該キットはまた、使用のための使用説明書を備えていてもよい。
本発明の記載を以下の実施例によってさらに説明するが、実施例は、なんら限定するものと解釈されるべきでない。ここに挙げたすべての参考文献(例えば、本出願書類の至るところで挙げた参考資料文献、発行特許、特許公開公報およびGenBank受託番号)の内容は、引用により本明細書に明白に組み込まれる。
本発明の方法の実施には、特に記載のない限り、当業者の技量範囲内である細胞生物学、細胞培養、分子生物学、トランスジェニック生物学、微生物学、組換えDNAおよび免疫学の慣用的な手法が用いられる。かかる手法は、文献に充分に説明されている。例えば、Molecular Cloning A Laboratory Manual,第2版,Sambrook編、FritschおよびManiatis(Cold Spring Harbor Laboratory Press:1989);DNA Cloning,第IおよびII巻(D.N.Glover編,1985);Oligonucleotide Synthesis(M.J.Gait編,1984);Mullisらの米国特許第4,683,195号;Nucleic Acid Hybridization(B.D.Hames & S.J.Higgins編 1984);Transcription And Translation(B.D.Hames & S.J.Higgins編 1984);Culture Of Animal 細胞(R.I.Freshney,Alan R.Liss,Inc.,1987);Immobilized Cells And Enzymes(IRL Press,1986);B.Perbal,A Practical Guide To Molecular Cloning(1984);専門書、Methods In Enzymology(Academic Press,Inc.,N.Y.);Gene Transfer Vectors For Mammalian Cells(J.H.MillerおよびM.P.Calos編,1987,Cold Spring Harbor Laboratory);Methods In Enzymology,第154および155巻(Wuら編),Immunochemical Methods In Cell And Molecular Biology(Mayer and Walker編,Academic Press,London,1987);Handbook Of Experimental Immunology,第I〜IV巻(D.M.WeirおよびC.C.Blackウェル編,1986);Manipulating the Mouse Embryo,(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,1986)を参照のこと。
実施例1:SIRT1の小分子活性化剤
SIRT1活性モジュレートする化合物を同定するため、いくつかの小分子ライブラリーを、96ウェルプレート26内での蛍光脱アセチル化アッセイを用いてスクリーニングした。アッセイに用いた基質は、インビボでのSIRT1の既知標的20,21,27であるp53−K382アセチル化部位を含む配列を主体とする蛍光発生性ペプチドであった。この基質は、他の既知HDAC標的を主体とする種々の他の蛍光発生性ペプチド基質と比べて好ましかった(図5)。小分子ライブラリーは、ニコチンアミドの類縁体、ε−アセチルリシン、NAD+、ヌクレオチド、ヌクレオチド類縁体およびプリン作動性リガンドを含んだ。初期スクリーニングから、いくつかのサーチュイン阻害剤が見出された(別表7)。しかしながら、最も著しい結果は、2つの化合物、ケルセチンおよびピセアタンノールの同定であり、これらはSIRT1活性を、それぞれ5倍および8倍刺激した(表1)。ケルセチンおよびピセアタンノールはともに、以前に、プロテインキナーゼ阻害剤と同定されていた28,29。
SIRT1活性モジュレートする化合物を同定するため、いくつかの小分子ライブラリーを、96ウェルプレート26内での蛍光脱アセチル化アッセイを用いてスクリーニングした。アッセイに用いた基質は、インビボでのSIRT1の既知標的20,21,27であるp53−K382アセチル化部位を含む配列を主体とする蛍光発生性ペプチドであった。この基質は、他の既知HDAC標的を主体とする種々の他の蛍光発生性ペプチド基質と比べて好ましかった(図5)。小分子ライブラリーは、ニコチンアミドの類縁体、ε−アセチルリシン、NAD+、ヌクレオチド、ヌクレオチド類縁体およびプリン作動性リガンドを含んだ。初期スクリーニングから、いくつかのサーチュイン阻害剤が見出された(別表7)。しかしながら、最も著しい結果は、2つの化合物、ケルセチンおよびピセアタンノールの同定であり、これらはSIRT1活性を、それぞれ5倍および8倍刺激した(表1)。ケルセチンおよびピセアタンノールはともに、以前に、プロテインキナーゼ阻害剤と同定されていた28,29。
2つの活性化化合物の構造の比較により、構造活性相関の可能性が示された。ピセアタンノールは、連結エチレン部に対して互いにトランスである2つのフェニル基を含む。ピセアタンノールのトランス−スチルベン環構造は、ケルセチンのフラボノイドAおよびB環に対して重ね合わせることができ、C環のエーテル酸素および炭素−2は、ピセアタンノールのエチレン炭素と整列している(表1の構造を参照)。さらに、ケルセチンの5、7、3’および4’ヒドロキシル基の位置は、それぞれ、ピセアタンノールの3、5、3’および4’ヒドロキシルと整列している。
S.cerevisiae7およびC.elegans19において示されたサーチュイン活性の長寿性向上効果を考慮すると、当然、SIRT1を刺激する化合物間での構造活性相関をさらに調べることが重要であった。ケルセチンおよびピセアタンノールはともにポリフェノールであり、これは、フラボン、スチルベン、フラバノン、イソフラボン、カテキン(フラバン−3−オール)、カルコン、タンニンおよびアントシアニジン植物の二次代謝産物の多様性のある大きな一群の構成員である30,31。長寿性向上効果の潜在性に関して注目すべきポリフェノールとしては、赤ワインに見られるスチルベンであるレスベラトロール、および緑茶に含まれるエピガロカテキンガレート(EGCG)が挙げられる。両者は、疫学的および機械的調査に基づき、癌の化学予防効果および心臓保護効果30,32を奏することが示されている。したがって、レスベラトロール、EGCGおよび上記のいくつかのポリフェノール類のさらなる代表的な物質を含めた二次スクリーニングを行なった。スクリーニングでは、非常に多くのヒドロキシル位バリアントがこの群内で入手可能である31ため、フラボンを重要視した。このスクリーニングの結果を別表1〜6にまとめる。表中、1より大きい「対照速度に対する比」は、かかるレートを有する化合物が、試験したサーチュインの活性化剤であることこと意味し、1より小さい数は、化合物が阻害剤であることを示す。
さらなる強力なSIRT1活性化剤が、スチルベン、カルコンおよびフラボンにおいて見出された(表1、別表1および2)。6種類の最も活性なフラボンは、3’および4’ヒドロキシルを有した(別表2)が、全体的に最も活性な化合物であるレスベラトロール(3,5,4’−トリヒドロキシスチルベン)は、ピセアタンノールよりも活性であり、その違いは、さらなる3’−ヒドロキシルだけである(表1)ことに注目されたい。活性に対する4’−ヒドロキシルの重要性は、12種類の最も刺激性のフラボンの各々がこの特徴を共有している(別表1および2)という事実によって強調される。
全部ではないが、多くの最も活性な化合物は、環(A環)の2つのメタ位にヒドロキシルを含み(例えば、5,7−ジヒドロキシル化フラボン)、4’または3‘,4’パターンを有するものに対してトランスである(B環、表1、別表1および2を参照)。トランスフェニル環が潜在的に同一平面上である配置は、2,3二重結合のないカテキンおよびフラバノンが、種々の刺激性フラボンと同等のヒドロキシル化パターンを有するにもかかわらず弱い活性を有するため(別表2および3を4および5と比較)、活性に重要であり得る。イソフラボンゲニステインにおける活性の不在は、刺激性化合物であるアピゲニンおよびレスベラトロールと同等の様式でヒドロキシル化されているが(別表1、2および4参照)、トランスに位置すること、およびヒドロキシル化された環の間隔が開いていることが、活性に強く寄与するという見解と一致する。
ポリフェノールの生物学的効果は、多くの場合、抗酸化活性、金属イオンキレート化活性および/またはフリーラジカルスカベンジング活性30,32によるものである。SIRT1の明白なポリフェノール刺激が単に酸化的および/または金属イオン誘発性損傷の修復を表し得る可能性は、組換えタンパク質の調製中に生じた。結果の2つの特徴は、これがそうである場合に対して議論される。第1に、種々のフリーラジカル保護化合物(例えば、抗酸化剤、キレート化剤およびラジカルスカベンジャーなど)は、SIRT1を刺激することができなかった(別表6参照)。第2に、同等な抗酸化能力の種々のポリフェノール間で、多様なSIRT1刺激活性(例えば、別表1、2および5のレスベラトロール、ケルセチンおよびエピカテキンを比較、参照33)が観察された。
実施例2:SIRT1反応速度論に対するレスベラトロールの効果
詳細な酵素反応速度論の調査を、最も強力な活性化剤レスベラトロールを用いて行なった。ポリフェノールスクリーニングアッセイ(25μM NAD+、25μM p53−382アセチル化ペプチド)条件下で行なった用量応答実験により、活性化効果により該速度が約11μMで2倍になり、100μMレスベラトロールで本質的に飽和状態となったことが示された(図1a)。100μMレスベラトロールの存在下または不在下での初期の酵素反応速度を、高NAD+(3mM NAD+、図1b)でのアセチル−ペプチド濃度の関数として、または高アセチル−ペプチド(1mM p53−382アセチル化ペプチド、図1c)でのNAD+濃度の関数としてのいずれかで測定した。レスベラトロールは、2つのVmax測定値に対して有意な効果を有しなかったが(図1b、1c)、2つの見かけ上のKmに対しては著しい効果を有した。アセチル化ペプチドKmに対するその効果は特に顕著であり、35倍減少に相当した(図1b)。レスベラトロールはまた、NAD+のKmを5倍より大きく低下させた(図1c)。レスベラトロールはKmに対してのみ作用するため、「K系」型34のアロステリックエフェクターに分類され得る。これは、律速酵素反応段階ではなく、酵素の基質結合親和性のみが改変されたことを示唆し得る。
実施例2:SIRT1反応速度論に対するレスベラトロールの効果
詳細な酵素反応速度論の調査を、最も強力な活性化剤レスベラトロールを用いて行なった。ポリフェノールスクリーニングアッセイ(25μM NAD+、25μM p53−382アセチル化ペプチド)条件下で行なった用量応答実験により、活性化効果により該速度が約11μMで2倍になり、100μMレスベラトロールで本質的に飽和状態となったことが示された(図1a)。100μMレスベラトロールの存在下または不在下での初期の酵素反応速度を、高NAD+(3mM NAD+、図1b)でのアセチル−ペプチド濃度の関数として、または高アセチル−ペプチド(1mM p53−382アセチル化ペプチド、図1c)でのNAD+濃度の関数としてのいずれかで測定した。レスベラトロールは、2つのVmax測定値に対して有意な効果を有しなかったが(図1b、1c)、2つの見かけ上のKmに対しては著しい効果を有した。アセチル化ペプチドKmに対するその効果は特に顕著であり、35倍減少に相当した(図1b)。レスベラトロールはまた、NAD+のKmを5倍より大きく低下させた(図1c)。レスベラトロールはKmに対してのみ作用するため、「K系」型34のアロステリックエフェクターに分類され得る。これは、律速酵素反応段階ではなく、酵素の基質結合親和性のみが改変されたことを示唆し得る。
以前のSIRT1およびSir2の反応速度論解析26および酵母寿命延長におけるSir2’の役割の遺伝学的解析6,35では、ニコチンアミド(サーチュイン反応の生成物)がサーチュイン活性の生理学的に重要な阻害剤と示唆されていた。したがって、ニコチンアミド阻害に対するレスベラトロールの効果を試験した。図1bおよび1cのものと同様の実験において、50μMのニコチンアミドの存在下での反応速度定数を、種々のNAD+濃度またはp53−382アセチル化ペプチド濃度のいずれかで測定した(図1d)。ニコチンアミドは、レスベラトロールとは対照的に、SIRT1 Vmaxに影響を及ぼす(レスベラトロールの不在下での30%および36%のVmax低下、図1dに注目、および参考文献26参照)。50μMのニコチンアミドの存在下では、レスベラトロールは、SIRT1の反応速度論に対して複雑な濃度依存性効果を有するようである(図1d)。NAD+見かけ上のKmおよびアセチル化基質は、実際には、ニコチンアミドが存在する場合、5μMのレスベラトロールによってもたらされるようである。20および100μMにおいて、50μMのニコチンアミドの存在下では、レスベラトロールは、ニコチンアミド誘発性Vmax減少を逆転させることなく、NAD+およびアセチル化ペプチド両方のKmを低下させる。サーチュインはニコチンアミドに、NAD+のニコチンアミド部分と相互作用する「B」部位とは異なる「Cポケット」として知られる第の部位に結合し得ると提案されている26。この潜在的な複雑性に鑑み、ニコチンアミドとポリフェノールとの効果の間の相互作用を充分に解明するためには、構造的/結晶学的情報に補足されるさらなる反応速度論試験が、おそらく必要である。
実施例3:化合物の活性化により酵母寿命が延長される
これらの化合物がサーチュインをインビボで刺激し得るか否かを調べるため、Sir2の上流調節因子および下流標的が比較的よく理解された生物体であるS.cerevisiaeを使用した。Sir2脱アセチル化速度のレスベラトロール用量応答試験(図2a)により、実際に、レスベラトロールがSir2をインビトロで刺激し、活性化剤の最適な濃度は2〜5μMであることが示された。活性化のレベルはSIRT1よりもいくぶん低く、SIRT1とは異なり、阻害は、約100μMより高い濃度で見られた。
実施例3:化合物の活性化により酵母寿命が延長される
これらの化合物がサーチュインをインビボで刺激し得るか否かを調べるため、Sir2の上流調節因子および下流標的が比較的よく理解された生物体であるS.cerevisiaeを使用した。Sir2脱アセチル化速度のレスベラトロール用量応答試験(図2a)により、実際に、レスベラトロールがSir2をインビトロで刺激し、活性化剤の最適な濃度は2〜5μMであることが示された。活性化のレベルはSIRT1よりもいくぶん低く、SIRT1とは異なり、阻害は、約100μMより高い濃度で見られた。
レスベラトロールならびにスチルベン、フラボンおよびカルコンファミリーを代表する他の4種類の強力なサーチュイン活性化剤を、その酵母寿命に対する効果について試験した。酵母細胞壁またはプラズマ細胞膜ならびに培地中での該化合物の低速酸化が疑われることによる潜在的な障害により、インビトロでの最適レスベラトロール濃度よりもやや高い濃度(10μM)を選択した。図2bに示されるように、ケルセチンおよびピセアタンノールは、寿命に対して有意な効果を有さなかった。対照的に、ブテイン、フィセチンおよびレスベラトロールは、平均寿命を、それぞれ31、55および70%増大させ、3種類ともすべて、最大寿命を有意に増大させた(図2c)。10μMより高いレスベラトロールの濃度では、さらなる寿命の利点はもたらされず、前処理した幼若細胞の寿命に対する該化合物の持続性効果はなかった(図2d、データ示さず)。
続く酵母遺伝学的実験には、最も強力なSIRT1活性化剤であり、最大寿命延長をもたらしたという理由で、レスベラトロールを用いた。酵母におけるCRの一形態であるグルコース制限により、長寿レスベラトロール処理細胞の有意な延長はもたらされず(図3a)、これは、レスベラトロールが、おそらくCRと同じ経路を介して作用することを示す。これと一致して、レスベラトロールは、sir2ヌル変異型の寿命に対する効果を有さなかった(図3b)。レスベラトロールは高濃度で殺真菌特性を有することが報告されていること36、および軽度のストレスはPNC1を活性化することにより酵母寿命を延長し得ること6を考慮すると、レスベラトロールが、Sir2に直接作用するのではなくPNC1を誘導することにより寿命を延長していることはもっともらしく思われた。しかしながら、レスベラトロールは、pnc1ヌル変異型の寿命を、ほぼ野生型細胞と同程度に延長した(図3b)。これらのデータを合わせると、レスベラトロールは、PNC1の下流で作用し、その効果のためにSIR2を必要とすることが示される。したがって、これらの観察結果の最も単純な説明は、レスベラトロールが、Sir2活性を直接刺激することにより寿命を増大させるということである。
酵母加齢の主な原因は、反復性のrDNA遺伝子座の固有の不安定性が原因であると考えられる2,5,37〜39。rDNA反復配列間の相同組換えにより、染色体外環状形態のrDNA(ERC)が生成され得、これは、古い細胞内で毒性レベルに達するまで複製される。Sir2は、rDNAの複製フォーク障壁における組換えを抑制することにより寿命を延長させると考えられる40。レスベラトロールで観察された寿命延長と一致して、この化合物は、rDNA組換えの頻度を約60%まで(図3c)、SIR2依存的に(図3d)低下させた。Sir2阻害剤ニコチンアミドの存在下ではまた、組換えもレスベラトロールによって減少され(図3c)、反応速度論データと一致した(図1d参照)。興味深いことに、レスベラトロールおよび他のサーチュイン活性化剤は、rDNAサイレンシングに対してわずかな効果しか有さないことがわかった(図3eおよびf)。これらの種々の化合物がどのようにしてrDNA安定性およびサイレンシングに差異的に影響を及ぼし得るのかを解明するための研究は進行中である。
S.cerevisiaeにおける寿命の別の測定は、代謝的に活性だが栄養不足状態において細胞が生存し得る時間の長さである。このような条件での加齢(すなわち、経年的(chronological)加齢)は、主に、酸化的損傷によるものである41。レスベラトロール(10μMまたは100μM)は、経年的寿命を延長することができず(表示せず)、これは、レスベラトロールのサーチュイン刺激効果がその抗酸化剤活性よりも、インビボでより関連性があり得ることを示す30,31。
実施例4:ヒト細胞における活性化剤の効果
これらの化合物がヒトSIRT1をインビボで刺激し得るか否かを試験するため、細胞内脱アセチル化酵素アッセイを使用した。アッセイ手順の概略を図4aに示す。細胞を、蛍光発生性ε−アセチル−リシン基質「Fluor de Lys」(FdL)を含有する培地を用いてインキュベートする。この基質は、アセチル化されている場合は中性であるが、脱アセチル化されると正の電荷を有し、細胞内に蓄積される(図6a参照)。細胞の溶解および非細胞透過性「顕色剤」試薬の添加により、フルオロフォアが、脱アセチル化された基質分子から特異的的に放出される(図4a、方法参照)。粘着的に増殖したHeLa細胞により、このアッセイで生成されたシグナルの5〜10%は、クラスIおよびII HDACの強力な阻害剤であるがサーチュイン(クラスIII)に対してはそうでない421μMのトリコスタチンA(TSA)に対して非感受性である(図6bおよび6c)。
実施例4:ヒト細胞における活性化剤の効果
これらの化合物がヒトSIRT1をインビボで刺激し得るか否かを試験するため、細胞内脱アセチル化酵素アッセイを使用した。アッセイ手順の概略を図4aに示す。細胞を、蛍光発生性ε−アセチル−リシン基質「Fluor de Lys」(FdL)を含有する培地を用いてインキュベートする。この基質は、アセチル化されている場合は中性であるが、脱アセチル化されると正の電荷を有し、細胞内に蓄積される(図6a参照)。細胞の溶解および非細胞透過性「顕色剤」試薬の添加により、フルオロフォアが、脱アセチル化された基質分子から特異的的に放出される(図4a、方法参照)。粘着的に増殖したHeLa細胞により、このアッセイで生成されたシグナルの5〜10%は、クラスIおよびII HDACの強力な阻害剤であるがサーチュイン(クラスIII)に対してはそうでない421μMのトリコスタチンA(TSA)に対して非感受性である(図6bおよび6c)。
選択した一群のSIRT1刺激性および非刺激性ポリフェノールを、このTSA非感受性シグナルに対するその効果について試験した(図4b)。各化合物の存在下での細胞内脱アセチル化シグナル(y軸、図4b)を、インビトロでのSIRT1のその刺激倍数(x軸、図4b、別表1〜3のデータ)に対してプロットした。該化合物のほとんどで、インビトロ活性は、おおよそ細胞シグナルに対応した。インビトロ活性をほとんど又は全くもたない化合物は、陰性対照周辺でクラスター化した(A群、図4b)。強いインビトロ活性化剤の別の群は、低活性クラスターから両軸方向において明白に離れている(B群、図4b)。注目に値する離れた物質は、インビトロでのSIRT1の強力な活性化剤であるブテインであり、細胞シグナルに対する効果は有さなかった。これらの化合物間で、直接的なサーチュイン刺激とは関連しない特性、例えば、細胞透過性および代謝速度などにおけるばらつきの可能性を考慮すると、これらのデータは、ある種のポリフェノールが、天然サーチュインをインビボで活性化し得るという見解と一致する。
インビボでのSIRT1の既知標的の1つは、p53のリシン382である。SIRT1によるこの残基の脱アセチル化により、p53の活性および半減期が減少する20,21,27。K382のアセチル化状態を追跡するため、全細胞ライセートのウエスタンブロットにおいてアセチル化形態のK382(Ac−K382)を認識するウサギポリクローナル抗体を作製した。対照として、シグナルは、電離放射線に曝露した細胞由来の抽出物において特異的に検出されことが示されたが(図4c)、p53を欠く細胞由来の抽出物またはアルギニンがリシン382で置換された場合(データ示さず)では検出されなかった。U2OS骨肉種細胞を、4時間レスベラトロール(0.5および50μM)で前処理し、UV放射線に曝露した。未処理細胞と比べ、Ac−K382のレベルにおける著しい減少が、0.5μMレスベラトロールの存在下で一貫して観察された(図4d)。より高濃度のレスベラトロール(>50μM)では、効果は逆転し(図4d、データ示さず)、かかる濃度でのp53活性の増大という先の報告と一致した43。低濃度のレスベラトロールがp53の脱アセチル化を促進する能力は、ドミナントネガティブSIRT1対立遺伝子(H363Y)を発現する細胞において減退し(図4e)、これは、SIRT1がこの効果に必要であることを示す。レスベラトロールのこの二相性用量応答は、細胞生存に対するレスベラトロールの効果に関する文献における両断論理30,43,44の説明となり得る。
したがって、最初の既知類型の小分子サーチュイン活性化剤が見出され、これらはすべて、植物ポリフェノールである。これらの化合物は、サーチュイン活性をインビトロで劇的に刺激し得、インビボでのサーチュイン活性の増大と一致する効果を促進し得る。ヒト細胞では、レスベラトロールは、K382のSIRT1媒介性p53脱アセチル化を促進する。酵母では、寿命に対するレスベラトロールの効果は、任意の長寿性促進性遺伝子操作6と同程度に大きく、Sir2の直接的活性化と納得いくように関連付けらる。寿命と、サイレンシングではなくrDNA組換えとの相関性は、酵母加齢が遺伝子機能不全45ではなくDNA不安定性2,5,37〜39によるものであるという一連の証拠に付加される。
これほど多くの植物代謝産物による酵母およびヒトサーチュインの活性化は、どのようにして説明され得るだろうか?サーチュインは、多様な真核生物、例えば、真菌、原生動物、後生動物および植物46,47に見出されており、おそらく生活史の早期に進化している1。植物は、脱水、栄養不足、UV放射線および病原体などのストレスに応答して種々のポリフェノール(例えば、レスベラトロールなど)を産生することが知られている48,49。したがって、これらの化合物が、サーチュイン媒介性植物ストレス応答を調節するために合成され得ることは、もっともらしい。これは、最近見出された環境性ストレスと酵母におけるSir2活性間の関係と一致し得る6。おそらく、これらの化合物は、アヘン剤/エンドルフィン、カンナビノール/エンドカンナビノイドおよびエストロゲン様活性を有する種々のポリフェノール30,31の場合のように、内在性活性化剤を模倣するため、真菌および動物由来のサーチュインに対して刺激活性を有する。あるいはまた、動物および新規のサーチュインは、環境および/または食糧供給の悪化の有用なインジケータであるため、これらの植物代謝産物に応答する能力を保持または発現した可能性がある。
実施例5:実施例1〜4の材料および方法
化合物ライブラリーおよび脱アセチル化アッセイ
His6タグ化組換えSIRT1およびGSTタグ化組換えSir2を、既報26の通りに調製した。0.1〜1μgのSIRT1および1.5μgのSir2を、既報26の通りに、脱アセチル化アッセイ(50μl全反応液中)ごとに使用した。SIRT1アッセイおよびSir2のためのある種のアッセイでは、FdLではなくp53−382アセチル化基質(「Fluor de Lys−SIRT1」、BIOMOL)を用いた。
実施例5:実施例1〜4の材料および方法
化合物ライブラリーおよび脱アセチル化アッセイ
His6タグ化組換えSIRT1およびGSTタグ化組換えSir2を、既報26の通りに調製した。0.1〜1μgのSIRT1および1.5μgのSir2を、既報26の通りに、脱アセチル化アッセイ(50μl全反応液中)ごとに使用した。SIRT1アッセイおよびSir2のためのある種のアッセイでは、FdLではなくp53−382アセチル化基質(「Fluor de Lys−SIRT1」、BIOMOL)を用いた。
テーマの(themed)化合物ライブラリー(BIOMOL)を、1次および2次スクリーニングに使用した。ほとんどのポリフェノール化合物は、アッセイの日に、10mMでジメチルスルホキシド(DMSO)に溶解した。水溶性化合物および陰性対照では、1%v/v DMSOをアッセイに加えた。インビトロ蛍光アッセイの結果を、白色1/2容量96ウェルマイクロプレート(Corning Costar 3693)において、CytoFluor(商標)II蛍光プレートリーダー(PerSeptive Biosystems,励起360nm、発光460nm、ゲイン=85)を用いて読取りを行なった。HeLa細胞を増殖させ、細胞脱アセチル化アッセイを行ない、上記のようにして読取りを行なったが、全容量96ウェルマイクロプレート(Corning Costar 3595)において行なった。特に記載のない限り、すべての初期速度測定値は、最初に存在した基質の5%以下が脱アセチル化された単一のインキュベーション時間を用いて得た3回以上の反復実験の平均とした。正味の蛍光増加の計算には、Sir2の場合では該酵素を反応から除くことにより、SIRT1の場合では、阻害剤(200μMのスラミンまたは1mMのニコチンアミド)を反応に、アセチル化された基質の前に添加することにより得られるブランク値の減算を含めた。いくつかのポリフェノールは、アッセイにおいて生成された蛍光を一部消光し、FdL脱アセチル化標準(BIOMOL、カタログ番号KI−142)の3μM急増(spike)による蛍光増加を測定することにより補正因子を得た。すべてのエラーバーは、平均の標準誤差を表す。
培地および菌株
すべての酵母株は、特に記載がある場合以外は、30℃で、完全酵母抽出物/バクトペプトン、2.0%(w/v)グルコース(YPD)培地中で成長させた。カロリー制限を0.5%グルコースにおいて誘発した。合成完全(SC)培地は、1.67%酵母窒素塩基、2%グルコース、40mg/リットルの各栄養素要求性マーカーからなるものであった。SIR2を、記載5のようにして、さらなるコピーに組込み、破壊した。他の菌株は別途記載26されている。細胞内脱アセチル化アッセイには、HeLa S3細胞を用いた。U2OS骨肉種およびヒト胚性腎(HEK293)細胞を、10%ウシ胎児血清(FCS)を1.0%グルタミンおよび1.0%ペニシリン/ストレプトマイシンとともに含有するダルベッコ改変イーグル培地(DMEM)中で接着的に培養した。ドミナントネガティブSIRT1 H363Yを過剰発現するHEK293は、R.Frye氏(ピッツバーグ大学)から贈与されたものであった。
寿命測定
寿命の測定は、PSY316AT MATαを用いて既報35の通りに行なった。寿命解析用のすべての化合物を95%エタノールに溶解し、プレートを乾燥させ、24時間以内に使用した。寿命解析の前に、細胞を、そのそれぞれの培地において少なくとも15時間、予備インキュベートした。新たなプレートに移した後、細胞を、顕微操作する前に、培地上で最低4時間平衡化させた。各実験につき少なくとも30個の細胞を調べ、各実験は、少なくとも2回行なった。寿命の差の統計学的有意性を、ウイルコクソンの順位和検定を用いて決定した。差は、信頼性が95%より高い場合、有意であるという。
サイレンシングおよび組換えアッセイ
URA3レポーターを用いたリボソームDNAサイレンシングアッセイを、既報26の通りに行なった。リボソームDNA組換え頻度を、既報35の通りに、W303AR細胞37を少量のアデニン/ヒスチジンを含むYPD培地上にプレーティングし、半分赤くなった部分のコロニーの割合を、Bio−Rad Quantity Oneソフトウエアを用いて計測することにより測定した。各実験につき少なくとも6000個の細胞を解析し、すべての実験を3連で行なった。すべての菌株を、プレーティング前に、15時間、関連する化合物とともに予備増殖させた。
タンパク質およびウエスタン解析
組換えSir2−GSTを、超音波処理26を用いてライセートを調製したこと以外は、既報の通りに大腸菌で発現させ、精製した。大腸菌由来の組換えSIRT1を既報26の通りに調製した。p53−AcK382に対するポリクローナル抗血清を、アセチル化ペプチド抗原を用い、以下の変形を伴って既報20の通りに生成させた。抗Ac−K382抗体は、非アセチル化p53−K382ペプチドを用いてアフィニティ精製し、PBS中に−70℃で保存し、アセチル化p53ペプチドを認識したが、非アセチル化p53ペプチドは認識しなかった。抗アセチル化K382または抗アクチン(Chemicon)抗体を用いたウエスタンハイブリダイゼーションを、抗体希釈度1:1000で行なった。ポリクローナルp53抗体(Santa Cruz Biotech.)を用いたハイブリダイゼーションでは、1:500の抗体希釈度を用いた。全細胞抽出物を、150mM NaCl、1mM MgCl2、10%グリセロール、1%NP40、1mM DTTおよび抗プロテアーゼカクテル(Roche)を含有するバッファー中で細胞を溶解させることにより調製した。
培地および菌株
すべての酵母株は、特に記載がある場合以外は、30℃で、完全酵母抽出物/バクトペプトン、2.0%(w/v)グルコース(YPD)培地中で成長させた。カロリー制限を0.5%グルコースにおいて誘発した。合成完全(SC)培地は、1.67%酵母窒素塩基、2%グルコース、40mg/リットルの各栄養素要求性マーカーからなるものであった。SIR2を、記載5のようにして、さらなるコピーに組込み、破壊した。他の菌株は別途記載26されている。細胞内脱アセチル化アッセイには、HeLa S3細胞を用いた。U2OS骨肉種およびヒト胚性腎(HEK293)細胞を、10%ウシ胎児血清(FCS)を1.0%グルタミンおよび1.0%ペニシリン/ストレプトマイシンとともに含有するダルベッコ改変イーグル培地(DMEM)中で接着的に培養した。ドミナントネガティブSIRT1 H363Yを過剰発現するHEK293は、R.Frye氏(ピッツバーグ大学)から贈与されたものであった。
寿命測定
寿命の測定は、PSY316AT MATαを用いて既報35の通りに行なった。寿命解析用のすべての化合物を95%エタノールに溶解し、プレートを乾燥させ、24時間以内に使用した。寿命解析の前に、細胞を、そのそれぞれの培地において少なくとも15時間、予備インキュベートした。新たなプレートに移した後、細胞を、顕微操作する前に、培地上で最低4時間平衡化させた。各実験につき少なくとも30個の細胞を調べ、各実験は、少なくとも2回行なった。寿命の差の統計学的有意性を、ウイルコクソンの順位和検定を用いて決定した。差は、信頼性が95%より高い場合、有意であるという。
サイレンシングおよび組換えアッセイ
URA3レポーターを用いたリボソームDNAサイレンシングアッセイを、既報26の通りに行なった。リボソームDNA組換え頻度を、既報35の通りに、W303AR細胞37を少量のアデニン/ヒスチジンを含むYPD培地上にプレーティングし、半分赤くなった部分のコロニーの割合を、Bio−Rad Quantity Oneソフトウエアを用いて計測することにより測定した。各実験につき少なくとも6000個の細胞を解析し、すべての実験を3連で行なった。すべての菌株を、プレーティング前に、15時間、関連する化合物とともに予備増殖させた。
タンパク質およびウエスタン解析
組換えSir2−GSTを、超音波処理26を用いてライセートを調製したこと以外は、既報の通りに大腸菌で発現させ、精製した。大腸菌由来の組換えSIRT1を既報26の通りに調製した。p53−AcK382に対するポリクローナル抗血清を、アセチル化ペプチド抗原を用い、以下の変形を伴って既報20の通りに生成させた。抗Ac−K382抗体は、非アセチル化p53−K382ペプチドを用いてアフィニティ精製し、PBS中に−70℃で保存し、アセチル化p53ペプチドを認識したが、非アセチル化p53ペプチドは認識しなかった。抗アセチル化K382または抗アクチン(Chemicon)抗体を用いたウエスタンハイブリダイゼーションを、抗体希釈度1:1000で行なった。ポリクローナルp53抗体(Santa Cruz Biotech.)を用いたハイブリダイゼーションでは、1:500の抗体希釈度を用いた。全細胞抽出物を、150mM NaCl、1mM MgCl2、10%グリセロール、1%NP40、1mM DTTおよび抗プロテアーゼカクテル(Roche)を含有するバッファー中で細胞を溶解させることにより調製した。
(実施例1〜4および背景に関する参考文献)
酵母Sir2およびヒトSIRT1は、非常に相同的であり、ヒトSIRT2とは、SIRT2には存在しないN末端ドメインが付加されていることが異なる。レスベラトロールの効果を、ヒト組換えSIRT2において以下のようにしてアッセイした。ヒト組換えSIRT2を1.25μg/ウェルの濃度で、25μMのFluor de Lys−SIRT2(BIOMOLカタログ番号KI−179)および25μM NAD+とともに20分間37℃で、上記のようにしてインキュベートした。結果(図7に示す)は、SIRT1とは対照的に、レスベラトロール濃度の増大によりSIRT2活性が減少することを示す。したがって、SIRT1とSIRT2との構造の違い、すなわちN末端ドメインの不在(図8参照)に基づき、SIRT1およびSir2のN末端ドメインは、本明細書に記載の化合物による活性化に必要であると考えられる。特に、おそらく、本明細書に記載の活性化剤化合物はサーチュインのN末端部分と相互作用する。該化合物の作用に必要であるSIRT1のN末端部分は、アミノ酸1あたりからアミノ酸176あたりであり、Sir2のN末端部分はアミノ酸1あたりからアミノ酸175あたりである。
実施例7:レスベラトロールは、C.elegansの寿命を延長させる
50匹のC.elegans虫(N2系統)を、100μMレスベラトロールの存在下または不在下で17日間成長させた。第17日目、レスベラトロールなしの対照群では5匹の虫が生存していたが、レスベラトロールで処理した群では17匹の虫が生存していた。したがって、C.elegansの成長培地中におけるレスベラトロールの存在は、その寿命を延長させる。
実施例8:サーチュインのさらなる活性化剤の同定
実施例1に記載したスクリーニングアッセイを用い、さらに5種類のサーチュイン活性化剤が同定された。これらを別表8に示す。
実施例9:サーチュインの阻害剤の同定
実施例1に記載したスクリーニングアッセイを用い、さらに阻害剤が同定された。これらを添付の別表8に示す。これらは、1未満の対照速度比を有する化合物に相当する。
実施例10:サーチュインのさらなる活性化剤および阻害剤の同定
サーチュインのさらなる活性化剤および阻害剤を同定し、表9〜13に示す。これらの表において、「SE」は、平均の標準誤差を表し、Nは、対照速度に対する比の平均および標準誤差を計算するために用いた反復実験の数である。
「対照速度に対する比」の計算に用いたすべてのSIRT1レート測定値は、25μM NAD+および25μM p53−382アセチル化ペプチド基質を用いて得、(were)上記およびK.T.Howitzら Nature(2003)425:191に記載のようにして行なった。すべての比率データは、対照反応における全脱アセチル化が0.25〜1.25μMのペプチドまたはアセチル化ペプチドの初期濃度の1〜5%である実験から計算した。
SIRT1レート測定値から誘導される安定性測定値(t1/2)の測定を、25μMではなく5μMのp53−382アセチル化ペプチド基質を用いたこと以外は、上記のものと同様にして行なった。熟成ストック溶液で希釈した化合物を用いて得られた刺激倍数(対照に対する比)を、固形の該化合物から新たに調製したストック溶液での同一の希釈度と比較した。「t1/2」は、熟成溶液の化合物のSIRT1刺激倍数が、新たに調製した溶液で得られるものの2分の1になるのに要する時間と規定する。レスベラトロール、BML−212およびBML−221のエタノールストック液を2.5mMで調製し、該化合物を50μMの終濃度でアッセイした。レスベラトロールのストック水は100μMとし、アッセイは10μMで行なった。ストック液は、窒素雰囲気下、室温でガラスバイアル内での保存によって熟成させた。
寿命に対する一部のこれらの化合物の効果を、酵母およびC.elegansにおいて上記のようにして調べた。結果を以下の表19に示す。
b.N2の虫で大腸菌を食糧として用いて標準的な条件下で行なった寿命アッセイ
ND.測定せず
結果は、レスベラトロールが、酵母およびC.elegansにおいて寿命を有意に延長させることを示す。BML−233は、サーチュインの強い活性化剤であることが示されたため(上記参照)、C.elegansで得られた結果は、該化合物が該細胞に対して毒性であることを示し得る。
特定の構造に限定されることを望まないが、以下の構造/活性関連性が存在すると思われる。これらの新しい類縁体によるSIRT1活性化の結果により、該活性化合物の2つの環の間および環内での平面性または少なくとも平面性の潜在性の重要性が確認された。2つの環の間のエチレン官能性の二重結合の還元により、本質的に、活性が破壊される(レスベラトロール、表Aおよびジヒドロレスベラトロール、表Eを比較)。シクロヘキシル基によるフェニル部の置き換えは、SIRT1刺激活性に対してほぼ決定的である(ピノシルビン、表9およびBML−224、表12を比較)。アミド結合は、部分二重結合特性を有すると考えられる。しかしながら、カルボキサミドによるエチレン官能性の置き換えによって活性が破壊された(ピノシルビン、表9とBML−219、表13とを比較)。この効果は、一部、カルボニル酸素が2つの環を互いにトランスに位置させるコンホメーションであるに違いないと想定される配置によるものであり得ることが考えられ得る。そうであれば、アミド窒素とカルボニルの位置が反対である化合物は、より大きな活性を有することが予測され得る。
類縁体のうち12種類において、レスベラトロールの4’−ヒドロキシを種々の官能基で置き換えた(表9および10、表11のBML−221、表12のBML−222参照)。試行試験した置き換えは、いずれもSIRT1刺激活性の実質的な増加をもたらさなかったが、このパラメータは、一般に、この位置での置換に著しく耐性であった。小さな基(ピノシルビンのH−、BML−217のCl−、BML−228の−CH3)は、最も活性を減少させなかった。非分枝鎖(BML−225のエチル、BML−232のアジド、BML−230の−SCH3)および疎水性官能基に対する酵素のスチルベン結合/活性化部位の優先性の証拠がいくつかある(BML−231のイソプロピルとBML−221のアセトキシ、BML−222のアセトアミドとを比較)。レスベラトロールに対する溶解安定性は、これについてこれまでに試験された2つの4’−置換基(アセトキシ、BML−221)の一方によって強く増大された。
レスベラトロールは、現在、SIRT1の最も強力な既知活性化剤の1つである。上記の類縁体の集合、特に、4’位における置換を可能にする群は、改善された薬理学的特性を有する新たなSIRT1リガンドの設計の情報提供において有益であり得る。この点に関して重要であり得るパラメータの1つは、安定性である。4’置換類縁体の1つであるBML−221は、レスベラトロールと比べ、溶解安定性において非常に大きな改善を示し、インビトロSIRT1活性化能力は減弱されているが、レスベラトロールの生物学的活性の多くを保持していおる(寿命データを参照)。レスベラトロールの4’−ヒドロキシルは、レスベラトロールのフリーラジカルスカベンジング反応性に対して第1に重要であると考えられる(S.Stojanovicら、Arch.Biochem.Biophys.2001 391 79)。4’−置換類縁体のほとんどは、溶解安定性についてまだ試験していないが、レスベラトロールの溶解における不安定性がレドックス反応性によるものであれば、その他の類縁体の多くもまた、改善された安定性を示すことが予測され得る。
4’−置換類縁体で得られた結果は、SIRT1結合親和性の増大を模索しながら探求する有望な経路を示し得る。例えば、4’−エチル化合物(BML−225)の有効性は、レスベラトロールの4’末端に対応するSIRT1部位における狭くて疎水性の接合性ポケットの存在を示し得る。いくつかの一連の新たな4’−置換類縁体を計画し、最も単純なものは、種々の長さの直鎖脂肪族基を含むものである。
実施例11:表9〜13の化合物の合成方法
ほとんどのレスベラトロール類縁体は、1対の中間体、ホスホン酸ベンジルおよびアルデヒドから同じ一般手順によって合成した。これらの中間体の合成または供給源をセクションIIに記載する。セクションIII.には、最終化合物を、いずれかのホスホン酸ベンジル/アルデヒドペアから合成するための手順を記載する。カップリング反応(セクションIII.A.)の後、中間体がメトキシメチル(セクションIII.B.)を含むものであったか、メトキシ(セクションIII.C.)保護基を含むものであったかに応じて2つの脱保護反応の一方を行なう。セクションIVは表14〜18に対応し、これは、具体的な最終化合物の合成に用いた具体的なホスホン酸ベンジルおよびアルデヒドの一覧である。レスベラトロール、3,5−ジヒドロキシ−4’−メトキシ−トランス−スチルベン、ラポンチンアグリコン、BML−227、BML−221、ジヒドロレスベラトロール、BML−219の7種類の化合物は、一般手順によって合成せず、表中のその記入事項(entry)の横に「N/A」を示す。レスベラトロールはBIOMOL製であり、残りの化合物の合成はセクションVに記載する。
II.合成中間体
A.ホスホン酸ベンジル(合成したもの)
ジエチル4−アセトアミドホスホン酸ベンジルの合成:ジエチル4−アミノホスホン酸ベンジルを含む1:1塩化メチレン/ピリジンに、触媒性DMAPおよび無水酢酸(1.1当量)を添加した。3時間後、反応物を蒸発乾固し、フラッシュクロマトグラフィー(シリカゲル)によって精製した。
実施例11:表9〜13の化合物の合成方法
ほとんどのレスベラトロール類縁体は、1対の中間体、ホスホン酸ベンジルおよびアルデヒドから同じ一般手順によって合成した。これらの中間体の合成または供給源をセクションIIに記載する。セクションIII.には、最終化合物を、いずれかのホスホン酸ベンジル/アルデヒドペアから合成するための手順を記載する。カップリング反応(セクションIII.A.)の後、中間体がメトキシメチル(セクションIII.B.)を含むものであったか、メトキシ(セクションIII.C.)保護基を含むものであったかに応じて2つの脱保護反応の一方を行なう。セクションIVは表14〜18に対応し、これは、具体的な最終化合物の合成に用いた具体的なホスホン酸ベンジルおよびアルデヒドの一覧である。レスベラトロール、3,5−ジヒドロキシ−4’−メトキシ−トランス−スチルベン、ラポンチンアグリコン、BML−227、BML−221、ジヒドロレスベラトロール、BML−219の7種類の化合物は、一般手順によって合成せず、表中のその記入事項(entry)の横に「N/A」を示す。レスベラトロールはBIOMOL製であり、残りの化合物の合成はセクションVに記載する。
II.合成中間体
A.ホスホン酸ベンジル(合成したもの)
ジエチル4−アセトアミドホスホン酸ベンジルの合成:ジエチル4−アミノホスホン酸ベンジルを含む1:1塩化メチレン/ピリジンに、触媒性DMAPおよび無水酢酸(1.1当量)を添加した。3時間後、反応物を蒸発乾固し、フラッシュクロマトグラフィー(シリカゲル)によって精製した。
ジエチル4−メチルチオホスホン酸ベンジルの合成:塩化4−メチルチオベンジルを
亜リン酸トリエチル(溶媒として)とともに120℃で一晩加熱した。過剰の亜リン酸トリエチルを高真空下で留去し、加熱した。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
亜リン酸トリエチル(溶媒として)とともに120℃で一晩加熱した。過剰の亜リン酸トリエチルを高真空下で留去し、加熱した。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
3,5−ジメトキシベンジルホスホン酸ジエチルの合成:臭化3−5−ジメトキシベンジルから。4−メチルチオベンジルホスホン酸ジエチルの合成を参照のこと。
4−フルオロベンジルホスホン酸ジエチルの合成:4−フルオロベンジルホスホン酸エステルから。4−メチルチオベンジルホスホン酸ジエチルの合成を参照のこと。
4−アジドベンジルホスホン酸ジエチルの合成:ジエチル4−アミノベンジルホスホン酸を含むアセトニトリル(2.5mL)に0℃で、6M HCl(1mL)を添加した。亜硝酸ナトリウム(1.12当量)を含む水(1mL)を滴下し、得られた溶液を0℃で30分間攪拌した。アジ化ナトリウム(8当量)を含む水(1mL)を滴下し(起泡下)、溶液を0℃で30分間、次いで室温で1時間攪拌した。反応液を酢酸エチルで希釈し、水およびブラインで洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
B.アルデヒド(合成したもの)
3,5−ジメトキシメトキシベンズアルデヒドの合成:3,5−ジヒドロキシベンズアルデヒドを含むDMFに0℃で、水素化ナトリウム(2.2当量)を添加した。反応液を30分間0℃で攪拌した。クロロメチルメチルエーテル(2.2当量)をニートで添加し、滴下し、反応液を室温まで1.5時間かけて昇温させた。反応混合物ジエチルエーテルで希釈し、水(2×)およびブライン(1×)で洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
C.購入した中間体:上記のもの以外、すべての合成中間体は、Sigma−Aldrichから購入した。
III.レスベラトロール類縁体の合成の一般手順
A.ホスホン酸ベンジル/アルデヒドカップリング手順
適切なホスホン酸ベンジル(1.2当量)を含むジメチルホルムアミド(DMF)に室温で、ナトリウムメトキシド(1.2当量)を添加した。この溶液を室温でおよそ45分間攪拌した。次いで、適切なアルデヒド(1当量)を添加した(ニートまたはジメチルホルムアミドの溶液で)。次いで、得られた溶液を一晩室温で攪拌した。薄層クロマトグラフィー(TLC)を用いて反応の終了を調べた。反応が完了していない場合、終了するまで溶液を45〜50℃で加熱した。反応混合物水に注入し、酢酸エチルで抽出した(2×)。合わせた有機層をブラインで洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
B.メトキシメチルレスベラトロール類縁体の脱保護の一般手順
適切なメトキシメチルスチルベン誘導体を含むメタノールに、2滴の濃HClを添加した。得られた溶液一晩50℃で加熱した。反応が終了したら、溶液を蒸発乾固した。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
C.メトキシレスベラトロール類縁体の脱保護の一般手順
適切なメトキシスチルベン誘導体を含む塩化メチレンに、ヨウ化テトラブチルアンモニウム(1.95当量/メトキシ基)を添加した。反応液を0℃まで冷却し、三塩化ホウ素(塩化メチレン中1M;2当量/メトキシ基)を滴下した。三塩化ホウ素の添加後、冷却浴を除き、反応液を、終了(TLCによって表示される)まで室温で攪拌させた。飽和重炭酸ナトリウム溶液を添加し、反応液を1時間激しく攪拌した。反応を冷1M HClに注入し、酢酸エチルで抽出した(3×)。合わせた有機層を水(1×)およびブライン(1×)で洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
V.特別な合成
BML−219(N−(3,5−ジヒドロキシフェニル)ベンズアミド)の合成:塩化ベンゾイル(1当量)を含む乾燥塩化メチレンに室温で、トリエチルアミン(1.5当量)および触媒性量のDMAPを添加した後、3,5−ジメトキシアニリン(1当量)を添加した。反応液を一晩室温で攪拌させた。終了したら、反応液を酢酸エチルで希釈し、1M HCl、水およびブラインで洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)によりメトキシスチルベン誘導体を得た。メトキシスチルベンを含む乾燥塩化メチレンに0℃で、ヨウ化テトラブチルアンモニウム(3.95当量)を添加した後、三塩化ホウ素(4当量;塩化メチレン中1M)を添加した。反応が終了したら(TLC)、飽和重炭酸ナトリウムを添加し、混合物を1時間激しく攪拌した。反応液を酢酸エチルで希釈し、1M HClおよびブラインで洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
B.アルデヒド(合成したもの)
3,5−ジメトキシメトキシベンズアルデヒドの合成:3,5−ジヒドロキシベンズアルデヒドを含むDMFに0℃で、水素化ナトリウム(2.2当量)を添加した。反応液を30分間0℃で攪拌した。クロロメチルメチルエーテル(2.2当量)をニートで添加し、滴下し、反応液を室温まで1.5時間かけて昇温させた。反応混合物ジエチルエーテルで希釈し、水(2×)およびブライン(1×)で洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
C.購入した中間体:上記のもの以外、すべての合成中間体は、Sigma−Aldrichから購入した。
III.レスベラトロール類縁体の合成の一般手順
A.ホスホン酸ベンジル/アルデヒドカップリング手順
適切なホスホン酸ベンジル(1.2当量)を含むジメチルホルムアミド(DMF)に室温で、ナトリウムメトキシド(1.2当量)を添加した。この溶液を室温でおよそ45分間攪拌した。次いで、適切なアルデヒド(1当量)を添加した(ニートまたはジメチルホルムアミドの溶液で)。次いで、得られた溶液を一晩室温で攪拌した。薄層クロマトグラフィー(TLC)を用いて反応の終了を調べた。反応が完了していない場合、終了するまで溶液を45〜50℃で加熱した。反応混合物水に注入し、酢酸エチルで抽出した(2×)。合わせた有機層をブラインで洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
B.メトキシメチルレスベラトロール類縁体の脱保護の一般手順
適切なメトキシメチルスチルベン誘導体を含むメタノールに、2滴の濃HClを添加した。得られた溶液一晩50℃で加熱した。反応が終了したら、溶液を蒸発乾固した。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
C.メトキシレスベラトロール類縁体の脱保護の一般手順
適切なメトキシスチルベン誘導体を含む塩化メチレンに、ヨウ化テトラブチルアンモニウム(1.95当量/メトキシ基)を添加した。反応液を0℃まで冷却し、三塩化ホウ素(塩化メチレン中1M;2当量/メトキシ基)を滴下した。三塩化ホウ素の添加後、冷却浴を除き、反応液を、終了(TLCによって表示される)まで室温で攪拌させた。飽和重炭酸ナトリウム溶液を添加し、反応液を1時間激しく攪拌した。反応を冷1M HClに注入し、酢酸エチルで抽出した(3×)。合わせた有機層を水(1×)およびブライン(1×)で洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
V.特別な合成
BML−219(N−(3,5−ジヒドロキシフェニル)ベンズアミド)の合成:塩化ベンゾイル(1当量)を含む乾燥塩化メチレンに室温で、トリエチルアミン(1.5当量)および触媒性量のDMAPを添加した後、3,5−ジメトキシアニリン(1当量)を添加した。反応液を一晩室温で攪拌させた。終了したら、反応液を酢酸エチルで希釈し、1M HCl、水およびブラインで洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)によりメトキシスチルベン誘導体を得た。メトキシスチルベンを含む乾燥塩化メチレンに0℃で、ヨウ化テトラブチルアンモニウム(3.95当量)を添加した後、三塩化ホウ素(4当量;塩化メチレン中1M)を添加した。反応が終了したら(TLC)、飽和重炭酸ナトリウムを添加し、混合物を1時間激しく攪拌した。反応液を酢酸エチルで希釈し、1M HClおよびブラインで洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
BML−220(3,3’,5−トリヒドロキシ−4’−メトキシスチルベン)の合成:ラポンチンを含むメタノールに触媒性p−トルエンスルホン酸を添加した。反応液を一晩還流させた。反応が終了したら(TLC)、反応混合物を蒸発乾固し、酢酸エチルに溶解した。有機層を水およびブラインで洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
BML−233(3,5−ジヒドロキシ−4’−メトキシスチルベン)の合成:デオキシラポンチンを含むメタノールに触媒性p−トルエンスルホン酸を添加した。反応液を一晩還流させた。反応が終了したら(TLC)、反応混合物を蒸発乾固し、酢酸エチルに溶解した。有機層を水およびブラインで洗浄し、硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィー(シリカゲル)により所望の生成物を得た。
BML−221および227(4’および3モノアセチルレスベラトロール)の合成:レスベラトロールを含むテトラヒドロフランに室温で、ピリジン(1当量)を添加した後、無水酢酸(1当量)を添加した。48時間攪拌後、さらに0.25当量の無水酢酸を添加した後、24時間攪拌した。反応液を塩化メチレン(反応は終了していなかった)で希釈し、冷0.5M HCl、水およびブラインで洗浄した。有機層を硫酸ナトリウム上で乾燥させた。フラッシュクロマトグラフィーにより、4’−および3−アセチルレスベラトロールの混合物を得た。分取用HPLCにより両方のモノアセチルレスベラトロールを得た。
ジヒドロレスベラトロールの合成:Parr振動とう装置内で、レスベラトロールを含むアルゴンパージした酢酸エチルに10%パラジウム担持炭素(10wt%)を添加した。混合物を、水素雰囲気下で(30psi)5時間振とうした。セライトパッドを通す濾過により、所望の材料を得た。
実施例12:レスベラトロールおよびBML−230によるSIRT1脱アセチル化の用量応答解析
活性化剤濃度の関数としてのSIRT1初期速度を、25μMの各NAD+およびp53−382アセチル化ペプチドで20分間のインキュベーションを伴って測定した。BML−230およびレスベラトロールに対するSIRT1の用量応答のプロットは、BML−230刺激活性は、試験したすべてび濃度においてレスベラトロールによる刺激活性を超えることを示す(図9a)。これは、BML−230に対するSIRT1のより大きな結合親和性、SIRT1/BML−230複合体のより大きな活性またはこの2つのなんらかの組合せによるものであり得る。レスベラトロール刺激酵素のレートに対するBML−230刺激酵素反応速度の比プロットは、結合親和性の増大は、BML−230の活性の改善に寄与しないことを示す(図9b)。結合プロセスおよび活性化プロセスの単純な2状態モデルは、観察された速度(v)が非リガンドおよびリガンド酵素の部分寄与の合計であると仮定しており、式中、voは非刺激の速度であり、vjは結合リガンド−1(L1)を有する酵素の速度であり、KL1は、酵素/リガンド−1複合体の解離定数である。
実施例12:レスベラトロールおよびBML−230によるSIRT1脱アセチル化の用量応答解析
活性化剤濃度の関数としてのSIRT1初期速度を、25μMの各NAD+およびp53−382アセチル化ペプチドで20分間のインキュベーションを伴って測定した。BML−230およびレスベラトロールに対するSIRT1の用量応答のプロットは、BML−230刺激活性は、試験したすべてび濃度においてレスベラトロールによる刺激活性を超えることを示す(図9a)。これは、BML−230に対するSIRT1のより大きな結合親和性、SIRT1/BML−230複合体のより大きな活性またはこの2つのなんらかの組合せによるものであり得る。レスベラトロール刺激酵素のレートに対するBML−230刺激酵素反応速度の比プロットは、結合親和性の増大は、BML−230の活性の改善に寄与しないことを示す(図9b)。結合プロセスおよび活性化プロセスの単純な2状態モデルは、観察された速度(v)が非リガンドおよびリガンド酵素の部分寄与の合計であると仮定しており、式中、voは非刺激の速度であり、vjは結合リガンド−1(L1)を有する酵素の速度であり、KL1は、酵素/リガンド−1複合体の解離定数である。
v=vo(1−[L1]/(KL1+[L1]))+V1([L1]/KL1+[L1])
同様の等式、図9の条件を考慮すると置換[L]=[L1]=[L2]を含む等式がリガンド−2について作製され得、2つの速度の比(R)が計算され得る。2つのリガンド解離定数が等しい(KL1=KL2=KL)場合、この比は、
R=(v0KL+V1[L])/(V0KL+v2[L])
となり得ることが示され得、
もし、KL1≠KL2の場合、この比は代わりに、
R=(v1[L]2+(voKL1+v1KL2)[L]+v0KL1KL2)/(V2[L]2+(v0KL2+v2KL1)[L]+V0KL1KL2)
となり得る。最初の場合、R対[L]のプロットは、[L]が増加するにつれて単調にv1/v2に近づく単純な双曲線となり得る。図9bのような第2の場合では、プロットは、より高い[L]値でv1/v2に近づく前に最大を通過し得る。図9bのデータは、v1/v2(純粋なSIRT1/BML−230の速度で除算した純粋なSIRT1/レスベラトロールの速度)が、約1.4であること(500μMでのR)、およびSIRT1/BML−230複合体は、実際に、SIRT1/レスベラトロールよりも小さい解離定数を有する(KL1<KL2)ことを示唆し得る。
同様の等式、図9の条件を考慮すると置換[L]=[L1]=[L2]を含む等式がリガンド−2について作製され得、2つの速度の比(R)が計算され得る。2つのリガンド解離定数が等しい(KL1=KL2=KL)場合、この比は、
R=(v0KL+V1[L])/(V0KL+v2[L])
となり得ることが示され得、
もし、KL1≠KL2の場合、この比は代わりに、
R=(v1[L]2+(voKL1+v1KL2)[L]+v0KL1KL2)/(V2[L]2+(v0KL2+v2KL1)[L]+V0KL1KL2)
となり得る。最初の場合、R対[L]のプロットは、[L]が増加するにつれて単調にv1/v2に近づく単純な双曲線となり得る。図9bのような第2の場合では、プロットは、より高い[L]値でv1/v2に近づく前に最大を通過し得る。図9bのデータは、v1/v2(純粋なSIRT1/BML−230の速度で除算した純粋なSIRT1/レスベラトロールの速度)が、約1.4であること(500μMでのR)、およびSIRT1/BML−230複合体は、実際に、SIRT1/レスベラトロールよりも小さい解離定数を有する(KL1<KL2)ことを示唆し得る。
レスベラトロールを薬理学的薬剤として使用することにおける難点の1つは、経口投与した場合に達成および維持され得るアグリコン形態の血清濃度比較的低いことである(<<1μM;例えば、D.M Goldbergら、Clin.Biochem.2003 36 79を参照)。合成誘導体のSIRT1結合親和性を増大させると、薬物のこの側面は改善される。上記(sest)のように、レスベラトロール4’−ヒドロキシルの種々の置き換え、例えば、ピノシルビンのH−またはBML−217のCl−は、SIRT1活性化効果を有意に減弱させなかった。BML−230で得られた結果は、該部位の修飾によって実際に、SIRT1/活性化剤結合親和性を増大させることが可能であることを示す。したがって、BML−230の4’−チオメチルは、関連誘導体(例えば、4’−チオエチルなど)の合成によるSIRT1結合親和性のさらなる改善の模索における新たな出発点を表す。
実施例13:生存率
ヒト293を、標準的な条件下で対象増殖期まで増殖させ、ある用量の化合物(50マイクロモル)に96時間に供した。各時点の生細胞の数を、コールターカウンターを用いて計測した。
表24:293細胞の生存の統計学:
実施例13:生存率
ヒト293を、標準的な条件下で対象増殖期まで増殖させ、ある用量の化合物(50マイクロモル)に96時間に供した。各時点の生細胞の数を、コールターカウンターを用いて計測した。
表24:293細胞の生存の統計学:
カロリー制限(CR)は、数多くの種において寿命を延長させる。出芽中の酵母S.cerevisiaeでは、この効果にはNAD+依存性脱アセチル化酵素のサーチュインファミリーの構成員であるSir21が必要とされる2,3。サーチュイン活性化化合物(STAC)は、ヒト細胞の生存を促進させ、酵母の複製寿命を延長4させ得る。ここに、レスベラトロールおよび他のSTACがCaenorhabditis elegansおよびDrosophila melanogaster由来のサーチュインを活性化し、これらの動物の寿命を、繁殖力を低下させることなく29%まで延長させることを示す。寿命延長は、機能性Sir2に依存し、栄養が制限された場合は観察されない。これらのデータを合わせると、STACは、CRと関連する機構によって後生動物加齢を遅滞させることが示される。
Sir2様タンパク質(サーチュイン)は、大腸菌からヒトまで保存されたNAD+依存性脱アセチル化酵素のファミリーの1つであり5〜9(図10a)、モデル生物体において、ジーンサイレンシング、DNA修復、rDNA組換えおよび加齢に重要な役割を果たす2,10〜12。食事が制限された場合(カロリー制限、CR)、寿命は多様な種において延長され、これは、加齢の栄養調節のための保存された機構が存在することを示す13〜17。出芽中の酵母では、この遺伝子のさらなるコピーにより、見かけ上のCRの模倣によって寿命が30%延長される1,18。酵母およびヒトサーチュインの触媒活性を刺激し、酵母の複製寿命細胞を60%まで延長させる一群の化合物(STAC)が、最近、報告された4。
STACが多細胞動物由来のサーチュインを活性化し得るか否かを確立するため、細胞系脱アセチル化アッセイを、D.melanogaster S2細胞用に開発した。ポリフェノールSTACいくつかの類型、例えば、カルコン、フラボンおよびスチルベンは、脱アセチル化速度をNAD+依存的に増大させた(図10b)。この活性がSir2ホモログの直接的な刺激によるものであるか否かを調べるため、C.elegansの組換えSIR−2.1およびD.melanogasterのdSir2を精製し、インビトロ酵素的活性に対する種々のSTACの効果を調べた(図10c、d)。用量依存的に、レスベラトロールは脱アセチル化を、SIR−2.1では2.5倍まで(図10e)およびdSir2では2.4倍まで(図10f)刺激した。酵母およびヒトSir2酵素で先に観察されたように、レスベラトロールは、補助基質NAD+に対するSIR−2.1のKmを低下させた(図10g)。
レスベラトロールは酵母の複製寿命有意に延長させ得るため4、STACが、後生動物C.elegansおよびD.melanogasterにおいてもまた寿命を延長させ得るか否かを調べた。野生型の虫を、成虫期に達した直後に、0または100μMのレスベラトロールを入れたプレートに移した。寿命は、加熱殺菌または生きた大腸菌のいずれかを食糧供給として使用し、生殖可能に15%まで延長され(それぞれ、図11a、c)、死亡率は全成虫期にわたって減少した(図14)。寿命延長が機能性SIR−2.1に依存するか否かを試験するため、sir−2.1ヌル変異型を構築した。この系統の寿命は、野生型N2対照よりも感知できるほど短くなかった。レスベラトロールで処理した成虫は、未処理の虫と比べて有意な寿命延長を示さなかった(図11b、d)。レスベラトロール処理と関連する繁殖力の低減は認められなかった(図11e)。レスベラトロールが動物の減食を引き起こし、それによりCR効果を間接的に誘発している可能性を葉所するため、L4幼虫および成虫両方の摂食率を、レスベラトロールありまたはなしで測定したが、差は見られなかった(図11f)。
また、STACが、D.melanogasterの寿命を延長させ得るか否かを、標準的な実験用野生型系統Canton−Sおよび通常のハエ培養条件(バイアル)、ならびにyw表示野生型系統およびデモグラフィ培養条件(ケージ)(表20)を用いて試験した。雄および雌における個々の試験全体で、寿命は、フィセチンで23%まで、レスベラトロールで29%まで延長された(図12a、c、e)。長寿性の増大は、第40目前は死亡率の低減と関連していた(図14)。食事制限により、寿命は、雌で40%および雄で14%増大され(試行試験全体の平均)、このような条件下では、レスベラトロールもフィセチンも長寿性さらに増大せず(図12b、d、f)、これは、レスベラトロールが、CRと関連する機構により寿命を延長させることを示す。
驚くべきことに、D.melanogasterの長寿性を延長させる食事操作は、典型的には、繁殖力を低下させるが19,20、長寿性延長用量のレスベラトロールは、産卵を中等度に増大させ(10μMレスベラトロール:69.8卵/5日、s.e.=2.2;対照:59.9卵/5日、s.e.=2.2;t=3.17,P=0.0017)、特に、成虫期の早期にそうであった(図12g)。産卵の増加は、D.melanogasterにおけるレスベラトロールの寿命延長効果が、食嫌いまたは食欲不振によって誘発されるCRによるものでなかったことを示す。これと一致して、レスベラトロール摂取ハエでは、食物摂取の低減はみられなかった(図12h)。さらにまた、レスベラトロール摂取ハエは、第3日から、レスベラトロール摂取雌が、対照摂取雌よりも有意に多くの産卵状態である間を除き、正常体重を維持した(図12i)。
レスベラトロールがハエ寿命をSir2依存的に延長させるか否かを調べるため、dSir2量の漸増を伴って、一連のdSir2対立遺伝子を解析した。独立して誘導したdSir2の対立遺伝子間の交雑由来の成虫子孫を試験した。レスベラトロールは、機能性dSir2が完全に欠失したハエ(dSir24.5/dSir25.26)(図13a、b)またはdSir2が大幅に減少しているハエ(dSir217/dSir2KG00871)(図13c、d)の寿命を延長させることができなかった。レスベラトロールは、長寿性を、低次形態のdSir2対立遺伝子についてホモ接合性ハエにおいて、少量だが統計学的に有意な量で増大させ(dSir2KG0087/dSir2KG0087)(表20、試行試験6)、1コピーの低次形態の対立遺伝子および1コピーの野生型dSir2を有するハエにおいて寿命を17%まで寿命を増大させた(Canton−S/dSir2KG0087)(表20、試行試験7)。これらのデータは、レスベラトロールがハエ寿命を延長させる能力が機能性Sir2を必要とすることを示す。
以前に、STACが、CRを模倣することにより複製性酵母細胞を寿命の延長させることが報告された4。酵母では、経年的および生殖的加齢は、複製寿命の測定において切り離すことができない。ここに、STACが、ともに成虫として主に非分裂性(有糸分裂後)細胞で構成され、その体細胞の加齢および生殖的加齢が老化の非依存的な尺度であるC.elegansおよびD.melanogasterの寿命を延長させ得ることを示す。両方の種において、レスベラトロールは寿命をSir2依存的に増大させ、少なくともこのハエでは、この作用は、CRと共通する経路により機能を果たすようである。
レスベラトロールが明白な生殖の犠牲なしで長寿性を増大させ得るという観察結果は、老化の進化論の普及している概念と反対である。しかしながら、STACは、なんかの環境条件下21,22または適応性を決定する形質のネットワークに作用する選択状況下23,24で、なお、妥協点必要とし得る。植物は、ストレスおよび栄養制限に応答してレスベラトロールなどのSTACを合成し25、おそらく、自身のサーチュイン経路を活性化する4。これらの分子は、消費者に対する植物防御機構としての機能を果たすため、または後生動物において内在性活性化剤に対して先祖代々オーソロガスであるため、動物サーチュインを活性化し得る。あるいはまた、動物は、植物ストレス分子を、環境または食糧供給の低下に準備するための手掛りとしてを用い得る4。サーチュイン活性化剤の適応的意義、内在性機能および進化起源を理解することにより、長寿性調節の潜在的なメカニズムへのさらなる洞察がもたらされる。CRの健康上の有益性を提供する介入の開発が補助される。
実施例15:実施例14の材料および方法
サーチュイン精製
His6タグ化組換えSIR−2.1およびdSir2を、pET28a−sir−2.1またはpRSETc−dSir2いずれかのプラスミドを保有する大腸菌BL21(DE3)plysS細胞から精製した。細胞を、pET28a−sir−2.1ではカナマイシン(50μg/mL)またはpRSETc−dSir2ではアンピリシン(100μg/ml)およびクロラムフェニコール(25μg/ml)を含有するLB培地中で、30℃(dSir2)または37℃(SIR−2.1)で0.6〜0.8のOD600まで増殖させた。IPTG(1mM)の添加後、フラスコを16℃に20時間シフトさせた。細胞ペレットを300mM NaCl、0.5mM DTT、0.5mM PMSFおよびEDTA無含有プロテアーゼ阻害剤錠剤を含有する冷PBSバッファーに再懸濁し、超音波処理によって溶解させた。Ni2+−NTAビーズを清澄化した抽出物に添加し、1〜3時間後、カラム上に負荷し、バッファー(50mM Tris.Cl pH7.4、200mM NaCl、30mMイミダゾール)で洗浄し、次いで、600mMイミダゾールを含有する同じバッファーで溶出した。
脱アセチル化アッセイ
各脱アセチル化アッセイにつき0.1〜1μgのSIR−2.1および1μgのdSir2を、変形を伴って既報の通りに使用した(SIR−2.1:200μM NAD+、10μM Fluor de Lys、FdL;dSir2:25μM NAD+、10μM FdL)26。アッセイに日に、STACを10mMでジメチルスルホキシド(DMSO)に溶解した。インビトロ蛍光アッセイの結果を、96ウェルマイクロプレート(Corning Costar 3693)内で、Wallac Victor Multilabelカウンター(Perkin Elmer、360nmで励起、450nmで発光)を用いて読取りを行なった。Drosophila S2細胞をウシ胎児血清を含むSchneider培地中にて23〜28℃で増殖させ、9×104細胞/ウェルで播種し、一晩増殖させ、次いで、1μM TSA、500μMポリフェノールおよび200μM FdLに2時間曝露した。全細胞由来のライセートによるFdLの脱アセチル化を記載4のようにして測定した。特に記載のない限り、すべての初期速度測定値は、最初に存在した基質の5%以下が脱アセチル化された単一のインキュベーション時間を用いて得た3回以上の反復実験の平均とした。
C.elegansの培地、系統、寿命および摂食アッセイ
Bristol N2(Caenorhabditis Genetics Center)を、野生型系統として用いた。sir−2.1変異型系統は、VC199(sir−2.1(ok434))をN2に4回戻し交配させることにより作製した。培養物は、標準的なNGM培地上で増殖させ、大腸菌系統OP50で維持した。寿命アッセイのため、同調動物を処理プレートに、幼若成虫のとき(孵化の2日後、アッセイの第0日)に移し、アッセイの最初の6〜8日間、2日ごとに新たな処理プレートに移した。処理プレートは、生殖抑制剤FUdR(Sigma;100mg/L)を含み、注入前に寒天に直接(生存OP50試行試験のため)、またはPBS中で希釈して乾燥プレートの表面に表示された終濃度まで添加するか(死滅OP50試行試験のため)のいずれかで添加したレスベラトロールまたは溶媒(DMSO、これは寿命に影響を及ぼさない)を含有する標準的なNGM培地とした。いくつかの寿命試行試験では、加熱殺菌OP50を食糧源として用いた。OP50培養物を65℃まで30分間加熱し、次いでペレット化し、10mM MgSO4を補給したS Basal中に1/10容量で再懸濁した。すべてのアッセイにおいて、白金ピックで静かに触ることにより、虫を毎日、死亡率についてモニターした。アッセイは24℃で行なった。
実施例15:実施例14の材料および方法
サーチュイン精製
His6タグ化組換えSIR−2.1およびdSir2を、pET28a−sir−2.1またはpRSETc−dSir2いずれかのプラスミドを保有する大腸菌BL21(DE3)plysS細胞から精製した。細胞を、pET28a−sir−2.1ではカナマイシン(50μg/mL)またはpRSETc−dSir2ではアンピリシン(100μg/ml)およびクロラムフェニコール(25μg/ml)を含有するLB培地中で、30℃(dSir2)または37℃(SIR−2.1)で0.6〜0.8のOD600まで増殖させた。IPTG(1mM)の添加後、フラスコを16℃に20時間シフトさせた。細胞ペレットを300mM NaCl、0.5mM DTT、0.5mM PMSFおよびEDTA無含有プロテアーゼ阻害剤錠剤を含有する冷PBSバッファーに再懸濁し、超音波処理によって溶解させた。Ni2+−NTAビーズを清澄化した抽出物に添加し、1〜3時間後、カラム上に負荷し、バッファー(50mM Tris.Cl pH7.4、200mM NaCl、30mMイミダゾール)で洗浄し、次いで、600mMイミダゾールを含有する同じバッファーで溶出した。
脱アセチル化アッセイ
各脱アセチル化アッセイにつき0.1〜1μgのSIR−2.1および1μgのdSir2を、変形を伴って既報の通りに使用した(SIR−2.1:200μM NAD+、10μM Fluor de Lys、FdL;dSir2:25μM NAD+、10μM FdL)26。アッセイに日に、STACを10mMでジメチルスルホキシド(DMSO)に溶解した。インビトロ蛍光アッセイの結果を、96ウェルマイクロプレート(Corning Costar 3693)内で、Wallac Victor Multilabelカウンター(Perkin Elmer、360nmで励起、450nmで発光)を用いて読取りを行なった。Drosophila S2細胞をウシ胎児血清を含むSchneider培地中にて23〜28℃で増殖させ、9×104細胞/ウェルで播種し、一晩増殖させ、次いで、1μM TSA、500μMポリフェノールおよび200μM FdLに2時間曝露した。全細胞由来のライセートによるFdLの脱アセチル化を記載4のようにして測定した。特に記載のない限り、すべての初期速度測定値は、最初に存在した基質の5%以下が脱アセチル化された単一のインキュベーション時間を用いて得た3回以上の反復実験の平均とした。
C.elegansの培地、系統、寿命および摂食アッセイ
Bristol N2(Caenorhabditis Genetics Center)を、野生型系統として用いた。sir−2.1変異型系統は、VC199(sir−2.1(ok434))をN2に4回戻し交配させることにより作製した。培養物は、標準的なNGM培地上で増殖させ、大腸菌系統OP50で維持した。寿命アッセイのため、同調動物を処理プレートに、幼若成虫のとき(孵化の2日後、アッセイの第0日)に移し、アッセイの最初の6〜8日間、2日ごとに新たな処理プレートに移した。処理プレートは、生殖抑制剤FUdR(Sigma;100mg/L)を含み、注入前に寒天に直接(生存OP50試行試験のため)、またはPBS中で希釈して乾燥プレートの表面に表示された終濃度まで添加するか(死滅OP50試行試験のため)のいずれかで添加したレスベラトロールまたは溶媒(DMSO、これは寿命に影響を及ぼさない)を含有する標準的なNGM培地とした。いくつかの寿命試行試験では、加熱殺菌OP50を食糧源として用いた。OP50培養物を65℃まで30分間加熱し、次いでペレット化し、10mM MgSO4を補給したS Basal中に1/10容量で再懸濁した。すべてのアッセイにおいて、白金ピックで静かに触ることにより、虫を毎日、死亡率についてモニターした。アッセイは24℃で行なった。
虫の摂食率をアッセイするため、表示された段階の虫を処理プレート(no FUdR)上に4〜5時間置き、次いで、Pixelink PL−662カメラを用いて1分間ビデオ撮影した。フレーム速度を下げ、咽頭のポンピング速度を計測した。繁殖力をアッセイするため、卵を抱えた雌雄同体(5匹/プレート、通常または処理プレート上で同調L1から生育させたもの)に、そのそれぞれの培地で5時間産卵させ、卵の総数を計測した。
D.melanogaster培地、系統、摂食アッセイおよび寿命アッセイ
生存アッセイを、成虫D.melanogasterを用いて、2つの研究室で独立して行なった。第1の研究室では、すべての試行試験でyw表示野生型系統を使用した。幼虫を標準的なコーンミール−糖−酵母(CSY)寒天飼料(コーンミール5%、スクロース10.5%、SAF酵母2%および寒天0.7%)上で生育させた。新たに孵化した成虫を、ILデモグラフィケージ内におよそ75匹の雄および75匹の雌で入れた。各試行実験では、各処理群において3〜4連ILデモグラフィケージを使用した。2日ごとに、死亡したハエを除き、記録し、食糧用バイアルを補充した。食糧用バイアルには、コーンミール−糖−酵母飼料を2%重量または3%重量いずれかのSAF酵母とともに入れた。試験化合物を含む100μlのEtOH(または対照ではブランクEtOH)を、成虫用食糧培地の融液アリコートと混合し、0、10または100μM終濃度にした。新たなストック溶液および成虫用培地を、毎週調製した。第2の研究室では、寿命試行試験は、野生型系統Canton−S、dSir24.5およびdSir25.26(S.Smolik,University of Oregon)、dSir217(S.Astrom,Stockholm University,Sweden)、ならびにdSir2KG000871(Drosophila Stock Center,Bloomington,IN)を用いて行なった。すべての試験のための幼虫は、標準的なコーンミール−糖−酵母飼料上で生育させた。新たに孵化した成虫を、5mlの15%糖−酵母飼料(15%SY)または5%糖−酵母(5%SY)飼料(15%SY:15%酵母、15%スクロース、2%寒天;5%SY:5%酵母、5%スクロース、2%寒天、参考文献20のとおり)を入れたプラスチックシェルバイアル内でインキュベートした。試行試験において、約20匹の雄を約20匹の雌ともに10個バイアル/処理群の各々に入れた。2日ごとにハエを新たなバイアルに移し、死亡したハエを計測した。レスベラトロールを含むEtOH(または対照ではEtOH単独)を培地に、その調製中、65℃まで激しく混合した後、添加した。最終化合物濃度は0、10、100または200μMであった。新たなストック溶液および成虫用培地を、毎週調製した。
D.melanogaster培地、系統、摂食アッセイおよび寿命アッセイ
生存アッセイを、成虫D.melanogasterを用いて、2つの研究室で独立して行なった。第1の研究室では、すべての試行試験でyw表示野生型系統を使用した。幼虫を標準的なコーンミール−糖−酵母(CSY)寒天飼料(コーンミール5%、スクロース10.5%、SAF酵母2%および寒天0.7%)上で生育させた。新たに孵化した成虫を、ILデモグラフィケージ内におよそ75匹の雄および75匹の雌で入れた。各試行実験では、各処理群において3〜4連ILデモグラフィケージを使用した。2日ごとに、死亡したハエを除き、記録し、食糧用バイアルを補充した。食糧用バイアルには、コーンミール−糖−酵母飼料を2%重量または3%重量いずれかのSAF酵母とともに入れた。試験化合物を含む100μlのEtOH(または対照ではブランクEtOH)を、成虫用食糧培地の融液アリコートと混合し、0、10または100μM終濃度にした。新たなストック溶液および成虫用培地を、毎週調製した。第2の研究室では、寿命試行試験は、野生型系統Canton−S、dSir24.5およびdSir25.26(S.Smolik,University of Oregon)、dSir217(S.Astrom,Stockholm University,Sweden)、ならびにdSir2KG000871(Drosophila Stock Center,Bloomington,IN)を用いて行なった。すべての試験のための幼虫は、標準的なコーンミール−糖−酵母飼料上で生育させた。新たに孵化した成虫を、5mlの15%糖−酵母飼料(15%SY)または5%糖−酵母(5%SY)飼料(15%SY:15%酵母、15%スクロース、2%寒天;5%SY:5%酵母、5%スクロース、2%寒天、参考文献20のとおり)を入れたプラスチックシェルバイアル内でインキュベートした。試行試験において、約20匹の雄を約20匹の雌ともに10個バイアル/処理群の各々に入れた。2日ごとにハエを新たなバイアルに移し、死亡したハエを計測した。レスベラトロールを含むEtOH(または対照ではEtOH単独)を培地に、その調製中、65℃まで激しく混合した後、添加した。最終化合物濃度は0、10、100または200μMであった。新たなストック溶液および成虫用培地を、毎週調製した。
摂食率を、yw雌において、作物充填(crop−filling)アッセイを用いて測定した。雌を一晩、水とともに保持し、食品色素(FDA Blue 1)および0、10または100μMのレスベラトロールをEtOHとともに含有する2%CSY飼料に入れた。作物中の色素標識された食糧の存在を、一組20匹の雌において5分間隔で5回わたって記録した。体質量の測定のため、各々野生型CS−5ハエである20匹の雄および20匹の雌を入れた10個のバイアルを、EtOHまたはレスベラトロール含有EtOH(10μM)を含む15%SY飼料上に維持した。雄および雌は、毎日重量測定した。
(実施例14および15のための参考文献)
以下の高処理量スクリーニングプロトコルを用いて、さらなる小分子サーチュイン活性化剤および阻害剤をICCBライブラリーから同定した。
以下のウェルを、対照反応:a)酵素含有;DMSOブランク、b)酵素含有;レスベラトロール(50μM)含有を陽性対照とした。反応混合物は、(最終):0.5単位/反応SIRT1脱アセチル化酵素(BIOMOL);200μMNAD+;5μM Fluor de Lys−SIRT1基質(BIOMOL);バッファー(25mM Tris/Cl、pH8.0、137mM NaCl、2.7mM KCl、1mM MgCl2および1mg/ml BSA)を含むものである。また、化合物を含む各ウェルが対応する「酵素なし対照」ウェルを有するようにするため、酵素を含まない反応混合物を作製した。反応は、黒色384ウェルプレート(NUNC)内で、25μl/ウェルの最終容量でで行なった。
反応は、プレート内のアリコート(または「酵素なし対照」プレートでは基質のみ)を採取する直前に酵素と基質を反応混合物に合わせることにより開始させた。Biotek μFill(Biotek Instruments)を用い、混合物のアリコートをプレートに採取した。対照混合物は、指定されたウェルに手作業で添加した。ライブラリー化合物を所望の濃度で、ピントランスファー(pin transfer)によって、「酵素あり」および「酵素なし」の両方のプレートに添加した。化合物は、少なくとも3連で(酵あり素反応では2連、酵素対照ではなし)、おおよそ50μMの終濃度で添加した。プレートを37℃で30〜60分間インキュベートした。次いで、25μlの1×顕色剤II(BIOMOL)+2mMニコチンアミドを、すべてのウェルに添加し、反応を停止させた。反応を少なくとも30分間37℃で放置し、シグナルを顕色させた。プレートを、マイクロプレート読取蛍光光度計(350〜380nmの範囲の波長での励起、および440〜460nmの範囲の発光の検出が可能)で読み取りを行なった。0.1秒/ウェルの読取り時間を使用した。
以下の陽性対照:レスベラトロール、レスベラトロール4”−メチルエーテル(3,5−ジヒドロキシ−4’−メトキシ−トランス−スチルベン(本明細書においてBML−233ともいう、表10に記載)、およびピノシルビンを使用し、これらは、それぞれ、SIRT1を2.2倍、2.1倍および3.28倍活性化した。活性化剤を表21に示し、阻害剤を表22に示す。
実施例17:レスベラトロールは脂肪動員を促進する
この実施例は、サーチュイン、レスベラトロールを活性化する化合物が、C.elegansにおいて脂肪蓄積を低減することにより脂肪代謝を刺激することを示す。
実施例17:レスベラトロールは脂肪動員を促進する
この実施例は、サーチュイン、レスベラトロールを活性化する化合物が、C.elegansにおいて脂肪蓄積を低減することにより脂肪代謝を刺激することを示す。
野生型N2 C.elegans虫を、OP50細菌において生育させ、一晩、ビヒクル(0.1%エタノール)単独または10、50または100μMのレスベラトロール(エタノール中)に曝露した。脂肪蓄積を、以下にさらに記載およびAshrafi K,ら Nature 421:268−27(2003)に記載のようにしてナイルレッド染色を用いて可視化した。
結果(図37に示す)は、100Μmでのレスベラトロール処理が、脂肪蓄積の90%低減をもたらしたことを示す。同様に、10μMまたは50μMのレスベラトロールの存在下での虫のインキュベーションにより、脂肪蓄積の著しい減少が示された。脂肪蓄積の減少は、AMPKおよび脂肪酸酸化の既知の活性化剤であるAICARでの処理の場合と同等またはより顕著である。
レスベラトロールによって活性化されるSir2.1は、転写因子DAF−16を介して作用し、酵母において寿命を延長させる(TissenbaumおよびGuarente(2001)Nature410:227)。野生型C.elegansと同様に、インスリンシグナル伝達に欠陥を有するDAF−16変異型虫(mgDf47)では(Wolkow,ら、Science 290:147,2000)、レスベラトロールは脂肪動員を刺激し、脂肪蓄積を減少させる(図38)。これは、成虫における脂肪代謝に対するレスベラトロールシグナル伝達は、DAF−16に非依存的な経路を介して起こることを示す。
したがって、レスベラトロール類型のサーチュインタンパク質を刺激する化合物は、野生型および変異型両方のC.elegansにおいて脂肪動員を促進させ得る。
実施例18:ニコチンアミドを促進する脂肪蓄積
サーチュインタンパク質の刺激因子が脂肪蓄積を低減させるならば、サーチュインタンパク質の阻害剤(例えば、ニコチンアミドなど)は、脂肪蓄積を増加させるはずである。
実施例18:ニコチンアミドを促進する脂肪蓄積
サーチュインタンパク質の刺激因子が脂肪蓄積を低減させるならば、サーチュインタンパク質の阻害剤(例えば、ニコチンアミドなど)は、脂肪蓄積を増加させるはずである。
C.elegans虫を、0、1または10mMのニコチンアミドの存在下で一晩インキュベートし、ナイルレッドで上記のようにして染色した。結果(図39に示す)は、該虫が、脂肪蓄積のニコチンアミド濃度依存的増加を示したことを示す。
実施例19:Sir2は、レスベラトロール媒介性脂肪動員に必要である
脂肪代謝におけるSir2.1の役割が、Sir2.1が不活化されたRNAであるC.elegans虫において示された。幼若成虫をRNAiベクター単独またはSir2.1 RNAi(R11A8.4)をコードするベクターを保有する細菌の存在下で、以下に記載のようにして、成虫期まで生育させた。これらの虫を、以下に記載のようにして、レスベラトロールの存在下または不在下で生育させ、ナイルレッドで染色した。結果(図4に示す)は、Sir2.1 RNAiを保有する細菌の存在下で培養した虫が、レスベラトロール誘発性脂肪動員を示さなかったことを示す。これらの結果により、Sir2が、レスベラトロールの脂肪動員効果の媒介に必要であることがさらに確認される。
実施例20:AMPKは、レスベラトロール媒介性脂肪動員に必要である
上記において、Sir2は、脂肪動員に対するレスベラトロールの効果の媒介に必要であることが示された。この実施例では、AMPKもまた、この効果媒介に必要であることを示す。AMPKは、細胞代謝、グルコース取込みおよび脂肪酸酸化の多様な側面を調節する。インスリン感受性を改善する多くの治療剤およびホルモン、例えば、5−アミノイミダゾール−4−カルボキサミド−1−β−D−リボフラノシド(AICAR)およびメトホルミン(循環インスリンレベルを減少させる)は、グルコース取込みおよび脂肪酸酸化に対するAMPKシグナル伝達を活性化することが知られている。哺乳動物においては、AMPKは、脂肪酸酸化を、アセチルcoAカルボキシラーゼのリン酸化/不活性化、マロニルcoAによる最終生成物阻害に起因するカルニチン−パルミトイルトランスフェラーゼ−1(CPT−1)およびカルニチンオクタノイルトランスフェラーゼ(COT)の放出、ならびに酸化されるミトコンドリアへの脂肪酸の輸送を伴う一連の複雑な工程によって刺激することにより脂肪代謝を調節する。
実施例19:Sir2は、レスベラトロール媒介性脂肪動員に必要である
脂肪代謝におけるSir2.1の役割が、Sir2.1が不活化されたRNAであるC.elegans虫において示された。幼若成虫をRNAiベクター単独またはSir2.1 RNAi(R11A8.4)をコードするベクターを保有する細菌の存在下で、以下に記載のようにして、成虫期まで生育させた。これらの虫を、以下に記載のようにして、レスベラトロールの存在下または不在下で生育させ、ナイルレッドで染色した。結果(図4に示す)は、Sir2.1 RNAiを保有する細菌の存在下で培養した虫が、レスベラトロール誘発性脂肪動員を示さなかったことを示す。これらの結果により、Sir2が、レスベラトロールの脂肪動員効果の媒介に必要であることがさらに確認される。
実施例20:AMPKは、レスベラトロール媒介性脂肪動員に必要である
上記において、Sir2は、脂肪動員に対するレスベラトロールの効果の媒介に必要であることが示された。この実施例では、AMPKもまた、この効果媒介に必要であることを示す。AMPKは、細胞代謝、グルコース取込みおよび脂肪酸酸化の多様な側面を調節する。インスリン感受性を改善する多くの治療剤およびホルモン、例えば、5−アミノイミダゾール−4−カルボキサミド−1−β−D−リボフラノシド(AICAR)およびメトホルミン(循環インスリンレベルを減少させる)は、グルコース取込みおよび脂肪酸酸化に対するAMPKシグナル伝達を活性化することが知られている。哺乳動物においては、AMPKは、脂肪酸酸化を、アセチルcoAカルボキシラーゼのリン酸化/不活性化、マロニルcoAによる最終生成物阻害に起因するカルニチン−パルミトイルトランスフェラーゼ−1(CPT−1)およびカルニチンオクタノイルトランスフェラーゼ(COT)の放出、ならびに酸化されるミトコンドリアへの脂肪酸の輸送を伴う一連の複雑な工程によって刺激することにより脂肪代謝を調節する。
C.elegansデータベースを調べることにより、哺乳動物AMPK、TOCl.8およびPar2.3;CPT−Iのホモログをコードする5つの遺伝子およびCOTのホモログをコードする1つの遺伝子と高度に関連する2つの遺伝子産物を見出すことに至った。C.elegans虫を、RNAiベクター単独、またはCOTのC.elegansホモログであるTOC1.8またはF41E7.3に対する干渉性RNAを保有する細菌とともに、AICARの存在下または不在下でインキュベートした。脂肪蓄積を、以下に記載のようにしてナイルレッドで可視化した。結果は、TOC1.8またはCOTのRNA不活性化により、AICAR刺激性脂肪動員が阻害されることを示す。したがって、脂肪酸酸化に対するAICAR/AMPKシグナル伝達は、虫および哺乳動物細胞において保存されている。
次いで、TOC1.8およびCOT不活性化の効果を、レスベラトロールとともにインキュベートしたC.elegansにおいて調べた。C.elegans虫は、RNAiベクター単独またはTOC1.8もしくはCOT干渉性RNAをコードするベクターを保有する細菌とともに、レスベラトロールの存在下または不在下で、インキュベートした。脂肪蓄積を、以下に記載のようにしてナイルレッドで可視化した。
結果を図41AおよびBに示す。RNAiベクター単独の存在下では、レスベラトロールは、正常な虫の脂肪含有量を75%低減させる(図41A、パネルa)。しかしながら、哺乳動物AMPKまたはF41E7.3のホモログ、哺乳動物COTのホモログであるTOC1.8のRNA不活性化により、レスベラトロール刺激性脂肪動員はブロックされた(図41Aのパネルbおよびc参照)。したがって、AMPKは、レスベラトロール誘発性脂肪動員に必要である。したがって、レスベラトロールは、直接的AMPK活性化剤であるAICARと同様、虫において脂肪代謝に対するAMPKシグナル伝達カスケードを刺激すると思われる。対照的に、長寿性に対するインスリンシグナル伝達の下流の転写因子であるDAF−16のRNA不活性化、または変異によるDAF−16の不活性化は、レスベラトロール刺激性脂肪動員に対する効果を有さなかった(図41Aのパネルd参照)。
したがって、AMPKおよびCOTのRNA不活性化によるレスベラトロール効果の阻害は、脂肪の動員に脂肪酸酸化に対するAMPKシグナル伝達カスケードの活性化が必要とされることを示す。
実施例21:AICARおよびレスベラトロールはAMPKおよびACCのリン酸化を刺激する
AMPKおよびCOTのRNA不活性化により、レスベラトロールおよびAICARが虫において脂肪を動員させる効果は、脂肪酸酸化に対するAMPKシグナル伝達カスケードの活性化に依存することが示された。AMPK活性化の直接的な証拠を得るため、レスベラトロール刺激細胞が、それぞれ、AMPKの活性化およびACCの不活性化と相関する修飾である、AMPKのトレオニン残基172におけるリン酸化の増大、またはセリン79におけるアセチルcoAカルボキシラーゼ(ACC)のリン酸化の増大を示すか否かを調べた。
実施例21:AICARおよびレスベラトロールはAMPKおよびACCのリン酸化を刺激する
AMPKおよびCOTのRNA不活性化により、レスベラトロールおよびAICARが虫において脂肪を動員させる効果は、脂肪酸酸化に対するAMPKシグナル伝達カスケードの活性化に依存することが示された。AMPK活性化の直接的な証拠を得るため、レスベラトロール刺激細胞が、それぞれ、AMPKの活性化およびACCの不活性化と相関する修飾である、AMPKのトレオニン残基172におけるリン酸化の増大、またはセリン79におけるアセチルcoAカルボキシラーゼ(ACC)のリン酸化の増大を示すか否かを調べた。
CHO−HIR哺乳動物細胞をPBS中で洗浄し、500μM AICAR(陽性対照)または12.5μM、25μMもしくは50μMレスベラトロールでの処理の前に、血清無含有DMEM中で一晩インキュベートした。細胞を30分間後に回収し、ライセートを直接SDS中で煮沸し、部位特異的抗体を用いたウエスタン解析に供した。Thr172におけるAMPKのリン酸化は、該キナーゼの活性化を示す。活性AMPKは、セリン79におけるACCをリン酸化および不活化させる。
結果(図42を示す)は、トレオニン172におけるAMPKのリン酸化およびセリン79におけるACCのリン酸化を示す。したがって、AICARと同様、レスベラトロールは、AMPKおよびACCのリン酸化を刺激する。したがって、レスベラトロールが脂肪生成組織から脂肪を動員する能力は、少なくとも一部は、脂肪酸酸化に対するAMPKの活性化シグナル伝達によるものである。
また、CHO細胞も、上記のようにして、500μM AICAR(陽性対照)、DMSO、100nM、500nM、2.5μM、12.5μM、25μMまたは50μMレスベラトロールで処理し、ウエスタンブロット解析に供した。ウエスタンブロットをストリッピングし、リン酸化された(活性)AMPK、全AMPK、リン酸化されたアセチルCoAカルボキシラーゼ(ACC)(これは、AMPKの下流標的である)、およびチューブリン(これは、負荷対照とする)について再検索した。図43は、漸増濃度のレスベラトロールでのCHO細胞におけるAMPKの活性化を示す。
また、ACCのリン酸化(これは、AMPK活性を反映する)が、エタノールまたはレスベラトロールのいずれかで処理した3T3−L1脂肪細胞で観察された。3T3−L1細胞をエタノールまたはレスベラトロールのいずれかとともにインキュベートし、次いで、親3T3線維芽細胞株から脂肪細胞に分化するように誘発した6日後または10日後のいずれかに回収した。図44は、レスベラトロールが第6日および第10日の両方においてACCのリン酸化を刺激したことを示す。ACCはまた、細胞を、回収する前に血清無含有培地中で一晩インキュベートした場合、リン酸化された(「SF」と表示したレーン)。第6日でのSIRT1ブロットにおけるさらなるバンドの理由は、不明であるが、SIRT1の修飾形態であり得る。チューブリンを負荷対照とした。
同様の結果が、HEP3Bヒトヘパトーマ細胞でも観察された。この場合、ACCのリン酸化は、SIRT1が過剰発現された(were)細胞(図45、4つの右レーン参照)SIRT1がノックダウンされた細胞(図45、左レーン)において測定した。ACCのリン酸化は影響を受けず、これは、レスベラトロールがこの場合、SIRT1を介して作用しているのでないかもしれないことを示す。チューブリンを負荷対照とした。
レスベラトロールがSIRT1を介して作用しているのか否かをさらに調べるため、3T3−L1脂肪細胞を、対照(GFP)レトロウイルス、SIRT1、SIRT1 siRNAまたはSIRT1ドミナントネガティブ(ΔHY)に感染させた。細胞をAICAR、エタノールまたはレスベラトロールで処理した。上記のように、細胞を回収し、ライセートを、部位特異的抗体を用いるウエスタンブロット解析用に調製した。図46は、ACCおよびAMPKのリン酸化を示し、これは、AMPK活性を反映する。各々の総タンパク質もまた示す。また、負荷対照であるGAPDHおよびチューブリンが極めて低レベルでこれらの細胞内で発現されているが、未分化3T3細胞の存在を反映しているがけかもしれないことに注目されたい。図46はまた、別途用量応答曲線を右端に示す。
同様の結果が、マウス胚性線維芽(MEF)においても観察された。図47は、レスベラトロールが、既知のAMPKキナーゼLKB1の不在下でもなお効果を有することを示す。左パネルの細胞を、回収する前に血清なしで一晩インキュベートし、右側の細胞は、血清無含有条件下でインキュベートしなかった。負荷はLKB1−/−細胞では低かったが、レスベラトロールは、なお、AMPKおよびACC両方のリン酸化の上方調節を引き起こす。チューブリンを負荷対照とした。
実施例22:レスベラトロールは、脂肪動員を刺激し、哺乳動物細胞における脂肪生成を阻害する
レスベラトロールが、生理学的に関連する細胞において脂肪代謝に影響を及ぼすという証拠を得るため、3T3−L1およびNIH3T3の細胞分化ならびに脂肪含有量に対する漸増濃度のレスベラトロールの効果を調べた。3T3−L1またはNIH3T3細胞をコンフルエントまで増殖させ、2日間パックイン(pack in)させ、この時点で、ビヒクル(エタノール単独)または0、12.5および25μMの濃度のレスベラトロールの存在下でのイソブチルメチルキサンチン、デキサメタゾンおよびインスリンの添加によって分化を開始させた。10日間の分化後、脂肪含有量を、Oil Red O染色によって以下に記載のようにして評価した。結果(図48に示す)は、25μM以上の濃度のレスベラトロールが3T3−L1およびNIH3T3細胞内の細胞脂肪の量を低減させたことを示す。NIH3T3細胞における結果により、C.elegansで得られた結果が確認される。結果は、レスベラトロールが脂肪生成(または脂肪細胞分化)を阻害することを示す。
実施例22:レスベラトロールは、脂肪動員を刺激し、哺乳動物細胞における脂肪生成を阻害する
レスベラトロールが、生理学的に関連する細胞において脂肪代謝に影響を及ぼすという証拠を得るため、3T3−L1およびNIH3T3の細胞分化ならびに脂肪含有量に対する漸増濃度のレスベラトロールの効果を調べた。3T3−L1またはNIH3T3細胞をコンフルエントまで増殖させ、2日間パックイン(pack in)させ、この時点で、ビヒクル(エタノール単独)または0、12.5および25μMの濃度のレスベラトロールの存在下でのイソブチルメチルキサンチン、デキサメタゾンおよびインスリンの添加によって分化を開始させた。10日間の分化後、脂肪含有量を、Oil Red O染色によって以下に記載のようにして評価した。結果(図48に示す)は、25μM以上の濃度のレスベラトロールが3T3−L1およびNIH3T3細胞内の細胞脂肪の量を低減させたことを示す。NIH3T3細胞における結果により、C.elegansで得られた結果が確認される。結果は、レスベラトロールが脂肪生成(または脂肪細胞分化)を阻害することを示す。
AICARは、AMPKシグナル伝達を刺激し、3T3細胞における脂肪生成を阻害する。レスベラトロールの効果が、分化の阻害であるのか、3T3細胞からの脂肪の動員であるのかを識別するため、レスベラトロールが、PPAR−γなどの脂肪生成転写調節因子の発現を阻害するか否かを調べた。レスベラトロールに曝露した細胞は、脂肪細胞への細胞の分化に典型的に付随するPPAR−γRNAの増加を示さないことがわかった。これは、レスベラトロールが脂肪細胞への細胞の分化を阻害することを示す。これはまた、レスベラトロールがPPAR−γ活性または発現を阻害することも示し得る。
3T3前駆脂肪細胞/脂肪細胞を、pMX単独またはPPAR−γをコードするpMXに感染させ、3T3細胞分化に対するレスベラトロールの効果を調べた。3T3−L1およびNIH3T3細胞をGFPまたはPPAR−γを発現するプラスミドに感染させ、コンフルエンスまで増殖させた。細胞を脂肪細胞に、以下に記載のようにして、ビヒクル(エタノール)中0μM、25μMまたは50μMレスベラトロールの存在下で分化させた。8日間の分化後、細胞を固定し、Oil red Oで染色した。予測したとおり、PPAR−γの過剰発現により、一部、レスベラトロールによる3T3前駆脂肪細胞分化の阻害が無効とされた(図49)。この観察結果は、レスベラトロールが、PPAR−γ活性化脂肪細胞分化を阻害することを示す。
sir2のレスベラトロール活性化により哺乳動物細胞における脂肪動員または分化の阻害が促進され得るか否かをさらに調べるため、増殖中の細胞を、野生型SIRT1またはSIRT1の脱アセチル化酵素欠損形態に感染させた。NIH3T3細胞を、GFP、SIRT1またはSIRT1の脱アセチル化酵素欠損形態(SIRT1ΔHY)(Vaziriら(2001)Cell 107:149に記載)をコードするウイルスの存在下で増殖させた。細胞を脂肪細胞に、ビヒクル(エタノール)中0μM、12.5μMまたは25μMのレスベラトロールの存在下で分化させた。8日間の分化後、細胞を固定し、Oil red Oで染色した。結果(図50に示す)は、野生型SIRT1を過剰発現する3T3細胞が、GFPをコードするウイルスに感染させた細胞(陰性対照)と比べて、脂肪含有量の減少を示すが、SIRT1の脱アセチル化酵素欠損形態を過剰発現する3T3細胞は、脂肪含有量の増加を示すことを示す。これらの結果により、虫において見られた効果、すなわち、レスベラトロールによるSIRT活性化は、脂肪含有量を減少させるようであり、ニコチンアミドによるSIRT1不活性化は脂肪含有量を増加させるようであることが確認される。したがって、サーチュインは、脂肪細胞分化および含量の調節に直接的な役割を果たすようである。
SIRT1過剰発現で見られたOil Red O染色の減少は、細胞をレスベラトロールで刺激した場合に見られたレベルに近づく。この観察結果により、SIRT1脱アセチル化酵素欠損変異型がレスベラトロールの効果を逆転させ得るかどうかという疑問が生じた。SIRT1脱アセチル化酵素欠損変異体において、通常レスベラトロールによって誘発される脂肪含有量の減少が、実際に一部されることがわかった。
したがって、これらの結果は、脂肪蓄積の低減に加え、レスベラトロールが、脂肪生成を阻害すること、およびこの阻害はまた、少なくとも一部Sir2によって媒介されることを示す。
実施例23:実施例3〜6の材料および方法
系統
C.elegans系統は、特に記載する以外は記載のようにして25℃で維持した(Brenner(1974)Genetics 77:71)。野生型参照系統はN2 Bristolとし、変異型系統は、sir−2.1(ok434)、T01C8.1(ok524)およびdaf−16(mgDf47)とした。Daf−16(mgDf47)は、Ruvkun研究室,MGHから入手した。他のすべての系統は、Caenorhabditis Genetics Center(C.Elegans Gene Knockout Consortium)から入手した。
増殖条件およびレスベラトロール曝露
同調させた空腹のL1虫をナイルレッドの存在下で生育させた。系統を、NGMプレート上で25℃にておよそ48時間、幼若成虫期に達するまで生育させた。次いで、20〜30匹の幼若成虫をM9バッファーで2回洗浄し、OP50またはL4440 RNAi対照ベクターを保有するHTT5大腸菌のいずれかを入れた新たなNGM/ナイルレッド実験プレートに移した。脂肪動員に対するニコチンアミドとレスベラトロールの効果を比較する実験では、OP50プレートをビヒクル単独もしくはニコチンアミド(PBS中)、またはビヒクル単独およびレスベラトロール(エタノールまたはDMSO中)でコーティングした。
実施例23:実施例3〜6の材料および方法
系統
C.elegans系統は、特に記載する以外は記載のようにして25℃で維持した(Brenner(1974)Genetics 77:71)。野生型参照系統はN2 Bristolとし、変異型系統は、sir−2.1(ok434)、T01C8.1(ok524)およびdaf−16(mgDf47)とした。Daf−16(mgDf47)は、Ruvkun研究室,MGHから入手した。他のすべての系統は、Caenorhabditis Genetics Center(C.Elegans Gene Knockout Consortium)から入手した。
増殖条件およびレスベラトロール曝露
同調させた空腹のL1虫をナイルレッドの存在下で生育させた。系統を、NGMプレート上で25℃にておよそ48時間、幼若成虫期に達するまで生育させた。次いで、20〜30匹の幼若成虫をM9バッファーで2回洗浄し、OP50またはL4440 RNAi対照ベクターを保有するHTT5大腸菌のいずれかを入れた新たなNGM/ナイルレッド実験プレートに移した。脂肪動員に対するニコチンアミドとレスベラトロールの効果を比較する実験では、OP50プレートをビヒクル単独もしくはニコチンアミド(PBS中)、またはビヒクル単独およびレスベラトロール(エタノールまたはDMSO中)でコーティングした。
RNAiプレートにL4440 RNAiベクター対照または特異的RNAiクローンT01C8.1,AMPK;R11A8.4,sir−2.1;もしくはF41E7.6COTのいずれかを保有するHTT5大腸菌を、100μMレスベラトロールの存在下または不在下で播種した。幼若成虫を適切なベクター、ナイルレッド染料および薬物を入れたプレートに移し、次いで、25℃で維持した。ナイルレッド染色を、レスベラトロール処理の24時間後にUV顕微鏡によって評価した。
レスベラトロール/ニコチンアミド希釈度
レスベラトロール(Indofme#024964)をエタノールまたはDMSOに溶解し、10mMストック溶液とした。OP50または細菌(HT115)を発現するRNAiのいずれかを入れた60mm NGM寒天皿に、レスベラトロールを、10μm、50μmおよび100μMの終濃度まで添加した。また、ナイルレッドをプレートに、0.05μg/mlの終濃度まで添加した。ニコチンアミド(Supelco#47865−U)を、ナイルレッドを含有するPBS中で希釈し、OP50を入れた60mM皿に、1mM、10mMまたは100mMの終濃度まで添加した。
脂肪染色
ナイルレッド:ナイルレッド粉末(Sigma#N−3013)をアセトンに500μg/mlで溶解し、適切な薬物を含む1×リン酸緩衝生理食塩水(PBS)中に希釈し、事前にOP50またはRNAi細菌を播種しておいたネマトーダ生育培地(NGM)プレートの表面に、0.05μg/mlの終濃度で適用した。脂肪含有量を、蛍光顕微鏡検査によってモニターおよび記録した。
蛍光顕微鏡検査および画像取得
ナイルレッド染色は、CY3フィルター(発光535〜685nm)を取り付けたNikon TE2000S顕微鏡を使用することによって可視化した。画像は、Nikon Microscopeに取り付けたSPOT RTモノクロデジタルカメラを用いて取得し、SPOT RTソフトウエアv3.5を使用した。すべてのナイルレッド画像は、同一の設定および露光時間を用いて取得し、次いで、赤パレットに変更した。フィーディング(feeding)RNAi
RNAiベクターL4440を保有するHT115大腸菌を、維持フィーディングに使用した。実験RNAiクローンを含む細菌を、50μg/mlのアンピリシンを含有する10mlのLuriaブイヨン培地中で18時間培養した。350μlの各培養物を、NGM寒天、6mM IPTGおよび25μg/mlのカルベニシリンを入れた60mm皿にスポッティングした。一晩インキュベーション(室温で)後、ナイルレッドを各皿の上面に0.05μg/mlの終濃度まで、図の説明に表示した実験化合物とともに添加した。ナイルレッド染色を、24時間後にUV顕微鏡によって評価した。試験したRNAiクローンの各バッチには、L4440(ベクター単独)を含めた。大部分の動物がある表現型を示した場合のみ、その表現型を割り当てた。すべての表現型は、少なくとも3回のさらなる試験サイクルによって確認した。
細胞培養およびOil red O染色
3T3−L1およびNIH3T3細胞は、DMEM+10%ウシ血清中に維持した。3T3−L1細胞の脂肪細胞分化は、既報のようにして行なった(MacDougald, O.A.およびLane,M.D.(1995).Transcriptional regulation of gene expression during adipocyte differentiation.Annu.Rev.Biochem.64,345−373)。NIH3T3細胞を、脂肪細胞を形成するように、3T3−L1細胞と同じ条件下で誘導したが、細胞がコンフルエンスに達した後、インスリン、デキサメタゾンおよびイソブチルメチルキサンチン(10%ウシ胎児血清中)での6日間の処理を伴った。Oil Red−Oでの脂肪細胞の染色および定量化を、既報のようにして行なった(Ramirez−Zacarias JL,Castro−Munozledo F,Kuri−Harcuch W.Histochemistry.1992 97(6):493−7)。
レトロウイルス作製および感染
哺乳動物レトロウイルス発現ベクターpMX(Tontonozら(1994)Genes Dev.8:1224に記載、Gary Nolan氏によって提供)を用いて、完全長マウスPPARγ2(Tontonozら(前掲))、ヒトSIRT1、ヒトSIRT1ΔHY(Vaziriら(前掲))およびeGFPを構築し、発現させた。組換えレトロウイルスは、Phoenixエコトロピックパック加齢細胞(Tontonozら(前掲)に記載、Gary Nolan氏によって提供)内へのレトロウイルス構築物のリン酸カルシウムトランスフェクションによって作製し、これを、DMEM+10%ウシ胎児血清中に維持した。培地を翌日交換し、ウイルス液上清みを、パック加齢細胞のトランスフェクションの48時間後および72時間後の2回回収した。ウイルス液上清みを0.2μMシリンジフィルターに通し、コンフルエント前の3T3−L1およびNIH3T3細胞に、ポリブチレンの添加後、6μg/mlの終濃度まで適用した。培地を翌日交換し、脂肪細胞への分化前に、細胞をコンフルエンスまで増殖させた。
実施例24:さらなるサーチュイン活性化剤は、脂肪動員を刺激する
C.elegans虫を、100μMのSIRT1活性化剤であるブテイン、フィセチン、ピセアタンノールおよびケルセチンの存在下または不在下でインキュベートした。虫の脂肪含有量を上記のようにして測定した。結果(図51に示す)は、これらのSIRT1活性化剤がレスベラトロールと同様の効果を有する、すなわち、脂肪動員を刺激することを示した。さらにまた、図52および53に示されるように、ケルセチンおよびフィセチンは、10μMという低濃度でも脂肪蓄積を低減させる。
レスベラトロール/ニコチンアミド希釈度
レスベラトロール(Indofme#024964)をエタノールまたはDMSOに溶解し、10mMストック溶液とした。OP50または細菌(HT115)を発現するRNAiのいずれかを入れた60mm NGM寒天皿に、レスベラトロールを、10μm、50μmおよび100μMの終濃度まで添加した。また、ナイルレッドをプレートに、0.05μg/mlの終濃度まで添加した。ニコチンアミド(Supelco#47865−U)を、ナイルレッドを含有するPBS中で希釈し、OP50を入れた60mM皿に、1mM、10mMまたは100mMの終濃度まで添加した。
脂肪染色
ナイルレッド:ナイルレッド粉末(Sigma#N−3013)をアセトンに500μg/mlで溶解し、適切な薬物を含む1×リン酸緩衝生理食塩水(PBS)中に希釈し、事前にOP50またはRNAi細菌を播種しておいたネマトーダ生育培地(NGM)プレートの表面に、0.05μg/mlの終濃度で適用した。脂肪含有量を、蛍光顕微鏡検査によってモニターおよび記録した。
蛍光顕微鏡検査および画像取得
ナイルレッド染色は、CY3フィルター(発光535〜685nm)を取り付けたNikon TE2000S顕微鏡を使用することによって可視化した。画像は、Nikon Microscopeに取り付けたSPOT RTモノクロデジタルカメラを用いて取得し、SPOT RTソフトウエアv3.5を使用した。すべてのナイルレッド画像は、同一の設定および露光時間を用いて取得し、次いで、赤パレットに変更した。フィーディング(feeding)RNAi
RNAiベクターL4440を保有するHT115大腸菌を、維持フィーディングに使用した。実験RNAiクローンを含む細菌を、50μg/mlのアンピリシンを含有する10mlのLuriaブイヨン培地中で18時間培養した。350μlの各培養物を、NGM寒天、6mM IPTGおよび25μg/mlのカルベニシリンを入れた60mm皿にスポッティングした。一晩インキュベーション(室温で)後、ナイルレッドを各皿の上面に0.05μg/mlの終濃度まで、図の説明に表示した実験化合物とともに添加した。ナイルレッド染色を、24時間後にUV顕微鏡によって評価した。試験したRNAiクローンの各バッチには、L4440(ベクター単独)を含めた。大部分の動物がある表現型を示した場合のみ、その表現型を割り当てた。すべての表現型は、少なくとも3回のさらなる試験サイクルによって確認した。
細胞培養およびOil red O染色
3T3−L1およびNIH3T3細胞は、DMEM+10%ウシ血清中に維持した。3T3−L1細胞の脂肪細胞分化は、既報のようにして行なった(MacDougald, O.A.およびLane,M.D.(1995).Transcriptional regulation of gene expression during adipocyte differentiation.Annu.Rev.Biochem.64,345−373)。NIH3T3細胞を、脂肪細胞を形成するように、3T3−L1細胞と同じ条件下で誘導したが、細胞がコンフルエンスに達した後、インスリン、デキサメタゾンおよびイソブチルメチルキサンチン(10%ウシ胎児血清中)での6日間の処理を伴った。Oil Red−Oでの脂肪細胞の染色および定量化を、既報のようにして行なった(Ramirez−Zacarias JL,Castro−Munozledo F,Kuri−Harcuch W.Histochemistry.1992 97(6):493−7)。
レトロウイルス作製および感染
哺乳動物レトロウイルス発現ベクターpMX(Tontonozら(1994)Genes Dev.8:1224に記載、Gary Nolan氏によって提供)を用いて、完全長マウスPPARγ2(Tontonozら(前掲))、ヒトSIRT1、ヒトSIRT1ΔHY(Vaziriら(前掲))およびeGFPを構築し、発現させた。組換えレトロウイルスは、Phoenixエコトロピックパック加齢細胞(Tontonozら(前掲)に記載、Gary Nolan氏によって提供)内へのレトロウイルス構築物のリン酸カルシウムトランスフェクションによって作製し、これを、DMEM+10%ウシ胎児血清中に維持した。培地を翌日交換し、ウイルス液上清みを、パック加齢細胞のトランスフェクションの48時間後および72時間後の2回回収した。ウイルス液上清みを0.2μMシリンジフィルターに通し、コンフルエント前の3T3−L1およびNIH3T3細胞に、ポリブチレンの添加後、6μg/mlの終濃度まで適用した。培地を翌日交換し、脂肪細胞への分化前に、細胞をコンフルエンスまで増殖させた。
実施例24:さらなるサーチュイン活性化剤は、脂肪動員を刺激する
C.elegans虫を、100μMのSIRT1活性化剤であるブテイン、フィセチン、ピセアタンノールおよびケルセチンの存在下または不在下でインキュベートした。虫の脂肪含有量を上記のようにして測定した。結果(図51に示す)は、これらのSIRT1活性化剤がレスベラトロールと同様の効果を有する、すなわち、脂肪動員を刺激することを示した。さらにまた、図52および53に示されるように、ケルセチンおよびフィセチンは、10μMという低濃度でも脂肪蓄積を低減させる。
実施例25:C.elegansにおける脂肪蓄積に対するレスベラトロール類縁体の効果
C.elegans虫を、100μM 3,5−ジヒドロキシ−4’−チオメチル−トランス−スチルベンの不在下(1%v/v DMSO)または存在下で、24時間インキュベートした。3,5−ジヒドロキシ−4’−チオメチル−トランス−スチルベンによる脂肪染色の有意な低減が観察された(図54)。また、L1の動物も、100μMレスベラトロールまたは100μMシス−スチルベンの不在下(2.5%v/v DMSO)または存在下で48時間インキュベートした。レスベラトロールによる脂肪染色の有意な低減が観察される。虫の脂肪染色に対する有意な効果は、対照と比べ、シス−スチルベンでは観察されない(図55)。脂肪蓄積を、親油性染料であるナイルレッドで、Ashrafiら、Nature 421:268−27(2003)に記載のようにして可視化した。
実施例26:インスリン抵抗性であるTNF−α処理脂肪細胞に対するレスベラトロールの効果
この実施例は、レスベラトロールが、脂肪細胞のインスリン感受性を追加刺激することを示す。Kabayamaら、Glycobiology 15:21−29(2005)およびWuら、Mol.Cell 3:151−8(1999)に記載のようにして、脂肪細胞をTNF−αで処理し、インスリン抵抗性を誘導した。陽性対照ロシグリタゾン(roziglitazone)での処理により、放射性グルコースの取込みが増大し、TNF−α処理脂肪細胞のインスリン感受性の増大を示す。図56に示すように、5μMまたは15μMレスベラトロールでの処理は、処理細胞において、TNF−α処理脂肪細胞のインスリン感受性の回復を一部低下させた。図56の矢印は、増大され放射性グルコース取込みの所望の効果を示す。
実施例27:レスベラトロールは、他のAMPK活性化剤と同様、脂肪生成細胞における脂肪酸酸化を刺激し得る
インスリンは、脂肪として余分なエネルギーの保存の促進を担う主要なホルモンである。脂肪生成能を有する細胞では、インスリンシグナル伝達により脂肪蓄積が促進される。脂肪蓄積が過度になった場合、このプロセスを脂質生成不全という。脂質生成不全は、インスリン抵抗性ならびに循環インスリンおよびトリグリセリドレベルの進行性の増加、高血圧症の蛍光、ならびにメタボリックシンドロームに特徴的なアテローム性動脈硬化と関連している(Muller−Wieland,D.ら Ann N Y Acad Sci 967:19−27(2002))。インスリン感作因子、例えば、AICAR(5−アミノイミダゾール−4−カルボキサミド−1−β−D−リボフラノシド)およびメトホルミンなどは、AMPキナーゼを活性化し、脂肪を非脂肪細胞から代謝し、それによりインスリン抵抗性および血清脂質レベルを低下させる(Lin,H.Z.,ら Nat Med, 2000.6(9):998−1003;Bergeron、R.,ら、Diabetes(2001)50(5):1076−82)。ワインに含まれるポリフェノール系化合物は血清脂質レベルおよびアテローム硬化性プラークを低減させるという多くの証拠が存在している(Waddington,E.,ら、Am J Clin Nutr(2004)79(1):54−61)。レスベラトロールがAMPキナーゼを活性化するという観察結果は、この薬物が、AICARおよびメトホルミンと同様、脂質生成不全の低減およびインスリン感受性の増大に有効であり得ることを示した。
C.elegans虫を、100μM 3,5−ジヒドロキシ−4’−チオメチル−トランス−スチルベンの不在下(1%v/v DMSO)または存在下で、24時間インキュベートした。3,5−ジヒドロキシ−4’−チオメチル−トランス−スチルベンによる脂肪染色の有意な低減が観察された(図54)。また、L1の動物も、100μMレスベラトロールまたは100μMシス−スチルベンの不在下(2.5%v/v DMSO)または存在下で48時間インキュベートした。レスベラトロールによる脂肪染色の有意な低減が観察される。虫の脂肪染色に対する有意な効果は、対照と比べ、シス−スチルベンでは観察されない(図55)。脂肪蓄積を、親油性染料であるナイルレッドで、Ashrafiら、Nature 421:268−27(2003)に記載のようにして可視化した。
実施例26:インスリン抵抗性であるTNF−α処理脂肪細胞に対するレスベラトロールの効果
この実施例は、レスベラトロールが、脂肪細胞のインスリン感受性を追加刺激することを示す。Kabayamaら、Glycobiology 15:21−29(2005)およびWuら、Mol.Cell 3:151−8(1999)に記載のようにして、脂肪細胞をTNF−αで処理し、インスリン抵抗性を誘導した。陽性対照ロシグリタゾン(roziglitazone)での処理により、放射性グルコースの取込みが増大し、TNF−α処理脂肪細胞のインスリン感受性の増大を示す。図56に示すように、5μMまたは15μMレスベラトロールでの処理は、処理細胞において、TNF−α処理脂肪細胞のインスリン感受性の回復を一部低下させた。図56の矢印は、増大され放射性グルコース取込みの所望の効果を示す。
実施例27:レスベラトロールは、他のAMPK活性化剤と同様、脂肪生成細胞における脂肪酸酸化を刺激し得る
インスリンは、脂肪として余分なエネルギーの保存の促進を担う主要なホルモンである。脂肪生成能を有する細胞では、インスリンシグナル伝達により脂肪蓄積が促進される。脂肪蓄積が過度になった場合、このプロセスを脂質生成不全という。脂質生成不全は、インスリン抵抗性ならびに循環インスリンおよびトリグリセリドレベルの進行性の増加、高血圧症の蛍光、ならびにメタボリックシンドロームに特徴的なアテローム性動脈硬化と関連している(Muller−Wieland,D.ら Ann N Y Acad Sci 967:19−27(2002))。インスリン感作因子、例えば、AICAR(5−アミノイミダゾール−4−カルボキサミド−1−β−D−リボフラノシド)およびメトホルミンなどは、AMPキナーゼを活性化し、脂肪を非脂肪細胞から代謝し、それによりインスリン抵抗性および血清脂質レベルを低下させる(Lin,H.Z.,ら Nat Med, 2000.6(9):998−1003;Bergeron、R.,ら、Diabetes(2001)50(5):1076−82)。ワインに含まれるポリフェノール系化合物は血清脂質レベルおよびアテローム硬化性プラークを低減させるという多くの証拠が存在している(Waddington,E.,ら、Am J Clin Nutr(2004)79(1):54−61)。レスベラトロールがAMPキナーゼを活性化するという観察結果は、この薬物が、AICARおよびメトホルミンと同様、脂質生成不全の低減およびインスリン感受性の増大に有効であり得ることを示した。
多くの報告によって、AICARおよびメトホルミンがAMPKを活性化し、これにより、アセチルcoAカルボキシラーゼ(ACC)をリン酸化し、阻害することが示されている。(Kemp,B.E.,ら、Trends Biochem Sci(1999)24(1):22−5;Kemp,B.E.,ら、Biochem Soc Trans(2003)31(Pt1):162−8;Viollet,B.,ら、J Clin Invest(2003)111(1):91−8;Viollet,B.,ら、Biochem Soc Trans(2003)31(Pt1):216−9;Ruderman,N.B.,ら、Am J Physiol(1999)276(1Pt1):E1−E18;Mu,J.,ら、Biochem Soc Trans(2003)31(Pt1):236−41;およびZhou,G.,ら、J Clin Invest(2001)108(8):1167−74に概説)。ACCの不活性化は、新たな脂肪生合成の阻害と、マロニルcoAによる最終生成物阻害に起因する脂肪酸トランスフェラーゼカルニチン−パルミトイル(palmatoyl)トランスフェラーゼ−1(CPT−1)およびカルニチンオクタノイルトランスフェラーゼ(COT)の放出との二重効果を有する(Morillas,M.,ら、FEBS Lett(2000)466(1):p.183−6)。その結果、新たな脂肪生合成の減少および脂肪酸酸化FAOの増大がもたらされ、細胞脂肪含有量の減少という結果を伴う。
レスベラトロールがAMPキナーゼおよびACCのリン酸化を増大させることが示されたため(図43参照)、レスベラトロールが2つのヘパトーマ細胞株においてパルミテートからのCO2生成を刺激することが確認された(表23)。CO2生成の3〜6倍の増加は、AICARによりなされた刺激を反映する。まとめると、このデータは、レスベラトロールが、脂肪生成酵素ACCに対するAMPKシグナル伝達を活性化し、マロニルcoAの生成を低下させることにより脂肪動員を刺激し得ることを示す。後者の事象は、新たな脂肪生合成への基質の流動を阻害し、脂肪酸酸化を刺激する。
表23:レスベラトロールは、他のAMPK活性化剤と同様、脂肪酸酸化を刺激し得る。ヘパトーマ細胞内の14C−パルミテートの酸化を、ビヒクル対照(適宜1%DMSOまたはH2O)、レスベラトロール(10μM、1%DMSO中)、AICAR(500μM、H2O中)またはメトホルミン(1mM、H2O中)により、方法の項目に記載のようにして4時間刺激した。CO2生成に対するレスベラトロールの効果の倍数を示す。
表23:レスベラトロールは、他のAMPK活性化剤と同様、脂肪酸酸化を刺激し得る。ヘパトーマ細胞内の14C−パルミテートの酸化を、ビヒクル対照(適宜1%DMSOまたはH2O)、レスベラトロール(10μM、1%DMSO中)、AICAR(500μM、H2O中)またはメトホルミン(1mM、H2O中)により、方法の項目に記載のようにして4時間刺激した。CO2生成に対するレスベラトロールの効果の倍数を示す。
酸溶解性生成物への14C−パルミテートの酸化(H4IIEC3細胞から変形(Witters,L.A.およびB.E.Kemp,J Biol Chem(1992)267(5):2864−7)およびHepG2細胞を、上記のようにして維持した。細胞(106細胞/T25)は、実験の1日前にT25フラスコ内に播種した。実験の日、細胞をアッセイバッファー(114mM NaCl、4.7mM KCL、1.2mM KH2PO4、1.2mM MgSO4、11mMグルコース)で洗浄した後、ビヒクルまたはレスベラトロール(10μM)またはAICAR(500μM)の存在下で14C−パルミテート(0.4μCi/ml)により4時間標識した。
インキュベーションの最後に、各T25フラスコのキャップをストッパーおよび250μlの2N NaOHを浸した1’×1.5”Whatman濾紙と交換した。各フラスコに2mlの6N HCLを注入し、水平な位置に10分間置き、一晩放置した。翌朝、1mlのH2Oおよび61μlのNaOHをガラスシンチレーションバイアルに添加し、濾紙を各T25フラスコから、そのそれぞれのバイアルに移した。10mlのAquasolを各バイアルに添加し、2時間放置した後、バイアルをボルテックスに供してNaH14CO2を溶解させ、シンチレーションカウンターで計測した。結果をnmol/h/106細胞で表示し、効果倍数として示す。14CO2生成は、0.3〜1.8nmol/h/106細胞の範囲であった。実験は3回繰り返した。
(均等物)
本発明は、とりわけ、サーチュイン活性化化合物およびその使用方法を提供する。主題の発明の具体的な実施形態について論考したが、本明細書の上記の記載は例示的であって、限定的でない。本明細書を読めば、本発明の多くの変形例が当業者に自明となろう。本発明の完全な範囲は、特許請求の範囲を、均等物のその完全な範囲、本明細書、かかる変形例とともに参照することによって決定されるべきである。
本発明は、とりわけ、サーチュイン活性化化合物およびその使用方法を提供する。主題の発明の具体的な実施形態について論考したが、本明細書の上記の記載は例示的であって、限定的でない。本明細書を読めば、本発明の多くの変形例が当業者に自明となろう。本発明の完全な範囲は、特許請求の範囲を、均等物のその完全な範囲、本明細書、かかる変形例とともに参照することによって決定されるべきである。
(引用による組み込み)
本明細書に挙げたすべての刊行物および特許(以下に記載のものを含む)は、引用により、その全体が、個々の各刊行物または特許が引用により組み込まれて具体的かつ個々に示されているかのように本明細書に組み込まれる。矛盾する場合は、本出願書類(本明細書における任意の定義を含む)が支配する。
本明細書に挙げたすべての刊行物および特許(以下に記載のものを含む)は、引用により、その全体が、個々の各刊行物または特許が引用により組み込まれて具体的かつ個々に示されているかのように本明細書に組み込まれる。矛盾する場合は、本出願書類(本明細書における任意の定義を含む)が支配する。
また、引用によりその全体が本明細書に組み込まれるのは、公共データベース、例えば、The Institute for Genomic Research(TIGR)(www.tigr.org)および/またはNational Center for Biotechnology Information(NCBI)(www.ncbi.nlm.nih.gov)によって維持されたものへのエントリーと関連する受託番号を示した任意のポリヌクレオチドおよびポリペプチド配列である。
また、引用により本明細書に組み込まれるのは、以下のもの:PCT公開公報WO2005/002672;2005/002555;および2004/016726;ならびに米国特許第6,746,691号である。
Claims (20)
- 治療有効量のサーチュイン活性化化合物を、その必要がある被験体に投与することを含む、薬物誘発性体重増加を処置または予防する方法。
- 前記体重増加が糖尿病処置薬の投与と関連している、請求項1に記載の方法。
- 前記糖尿病処置薬が、以下:スルホニル尿素、チアゾリジンジオン、メグリチナイド、ナテグリニド、レパグリニドまたはインスリンの少なくとも1種類である、請求項2に記載の方法。
- 前記体重増加が抗鬱薬の投与と関連している、請求項1に記載の方法。
- 前記抗鬱薬が、以下:三環系抗鬱薬、不可逆的モノアミンオキシダーゼ阻害剤(MAOI)、選択的セロトニン再取り込み阻害剤(SSRI)、ブプロピオン、パロキセチンまたはミルタザピンの少なくとも1種類である、請求項4に記載の方法。
- 前記体重増加がステロイドまたはホルモンの投与と関連している、請求項1に記載の方法。
- 前記体重増加がβ遮断薬の投与と関連している、請求項1に記載の方法。
- 前記体重増加がα遮断薬の投与と関連している、請求項1に記載の方法。
- 前記体重増加が避妊薬の投与と関連している、請求項1に記載の方法。
- 前記サーチュイン活性化化合物が、式1〜25、30、32〜65および69〜76からなる群より選択される式を含む、請求項1に記載の方法。
- 前記サーチュイン活性化化合物が、レスベラトロール、フィセチン、ブテイン、ピセアタンノールまたはケルセチンである、請求項1に記載の方法。
- 前記被験体がヒトである、請求項1に記載の方法。
- 少なくとも1種類のサーチュイン活性化化合物および少なくとも1種類の体重増加を誘発する薬物を含む組成物。
- 治療有効量のサーチュイン活性化化合物を、その必要がある被験体に投与することを含む、紅潮を処置または予防する方法。
- 前記紅潮が薬物誘発性紅潮である、請求項14に記載の方法。
- 前記紅潮が化学療法薬の投与と関連している、請求項15に記載の方法。
- 前記紅潮がニコチン酸の投与と関連している、請求項15に記載の方法。
- 前記サーチュイン活性化化合物が、式1〜25、30、32〜65および69〜76からなる群より選択される式を含む、請求項14に記載の方法。
- 前記サーチュイン活性化化合物が、レスベラトロール、フィセチン、ブテイン、ピセアタンノールまたはケルセチンである、請求項14に記載の方法。
- 前記被験体がヒトである、請求項14に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US64591605P | 2005-01-20 | 2005-01-20 | |
| US64596205P | 2005-01-21 | 2005-01-21 | |
| PCT/US2006/002267 WO2006079021A2 (en) | 2005-01-20 | 2006-01-20 | Use of sirtuin-activating compounds for treating flushing and drug induced weight gain |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008528510A true JP2008528510A (ja) | 2008-07-31 |
| JP2008528510A5 JP2008528510A5 (ja) | 2009-01-29 |
Family
ID=36578920
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007552335A Withdrawn JP2008528510A (ja) | 2005-01-20 | 2006-01-20 | 紅潮および/または薬物誘発性体重増加を処置するためのサーチュイン活性化化合物の使用 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20060276416A1 (ja) |
| EP (1) | EP1841415A2 (ja) |
| JP (1) | JP2008528510A (ja) |
| AU (1) | AU2006206274A1 (ja) |
| CA (1) | CA2595486A1 (ja) |
| WO (1) | WO2006079021A2 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012236793A (ja) * | 2011-05-11 | 2012-12-06 | Kikkoman Corp | Ampk活性化剤 |
| WO2013100111A1 (ja) * | 2011-12-27 | 2013-07-04 | 油田 正樹 | サーチュイン活性化剤 |
| JP2016516040A (ja) * | 2013-03-15 | 2016-06-02 | ニューサート サイエンシーズ, インコーポレイテッド | 脂質レベルを低下させるロイシンおよびニコチン酸 |
Families Citing this family (65)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20090169585A1 (en) * | 2003-10-23 | 2009-07-02 | Resveratrol Partners, Llc | Resveratrol-Containing Compositions And Their Use In Modulating Gene Product Concentration Or Activity |
| US20050158376A1 (en) * | 2003-10-23 | 2005-07-21 | Sardi William F. | Dietary supplement and method of processing same |
| AU2004312072B2 (en) * | 2003-12-29 | 2011-06-23 | President And Fellows Of Harvard College | Compositions for treating or preventing obesity and insulin resistance disorders |
| US8017634B2 (en) | 2003-12-29 | 2011-09-13 | President And Fellows Of Harvard College | Compositions for treating obesity and insulin resistance disorders |
| CA2593576C (en) * | 2004-01-20 | 2013-04-23 | Brigham Young University | Novel sirtuin activating compounds and methods for making the same |
| WO2006001982A2 (en) * | 2004-06-04 | 2006-01-05 | Washington University | Methods and compositions for treating neuropathies |
| ZA200701232B (en) | 2004-07-15 | 2008-08-27 | Amr Technology Inc | Aryl-and heteroaryl-substituted tetrahydroisoquinolines and use thereof to block reuptake of norepinephrine, dopamine and serotonin |
| JP2008527002A (ja) * | 2005-01-13 | 2008-07-24 | サートリス ファーマシューティカルズ, インコーポレイテッド | 神経変性障害および血液凝固障害を予防および処置するための新規組成物 |
| US20090142335A1 (en) * | 2005-02-15 | 2009-06-04 | Joslin Diabetes Center | Methods of diagnosis and treatment of metabolic disorders |
| US20090215681A1 (en) * | 2005-02-15 | 2009-08-27 | Joslin Diabetes Center | Methods of Diagnosis and Treatment of Metabolic Disorders |
| US20070014833A1 (en) * | 2005-03-30 | 2007-01-18 | Sirtris Pharmaceuticals, Inc. | Treatment of eye disorders with sirtuin modulators |
| WO2006105440A2 (en) * | 2005-03-30 | 2006-10-05 | Sirtris Pharmaceuticals, Inc. | Nicotinamide riboside and analogues thereof |
| US7728013B2 (en) | 2005-05-10 | 2010-06-01 | Intermune, Inc. | Method of modulating stress-activated protein kinase system |
| US8524735B2 (en) | 2005-05-18 | 2013-09-03 | Mpex Pharmaceuticals, Inc. | Aerosolized fluoroquinolones and uses thereof |
| US20060292099A1 (en) * | 2005-05-25 | 2006-12-28 | Michael Milburn | Treatment of eye disorders with sirtuin modulators |
| WO2006138418A2 (en) | 2005-06-14 | 2006-12-28 | President And Fellows Of Harvard College | Improvement of cognitive performance with sirtuin activators |
| US20070149466A1 (en) * | 2005-07-07 | 2007-06-28 | Michael Milburn | Methods and related compositions for treating or preventing obesity, insulin resistance disorders, and mitochondrial-associated disorders |
| CN101176786A (zh) * | 2006-11-08 | 2008-05-14 | 中国科学院上海生命科学研究院 | 增加胰岛素敏感性的方法和组合物 |
| US20080249103A1 (en) * | 2006-11-15 | 2008-10-09 | Sirtris Pharmaceuticals, Inc. | Sirtuin polymorphisms and methods of use thereof |
| MY154869A (en) * | 2007-01-16 | 2015-08-14 | Ipintl Llc | Composition for treating metabolic syndrome |
| WO2008119070A1 (en) * | 2007-03-28 | 2008-10-02 | Trustees Of Boston University | Methods of treatment using sirt modulators and compositions containing sirt1 modulators |
| US8404275B2 (en) * | 2007-07-01 | 2013-03-26 | Vitalis Llc | Combination tablet with chewable outer layer |
| WO2009005803A1 (en) * | 2007-07-01 | 2009-01-08 | Joseph Peter Habboushe | Combination tablet with chewable outer layer |
| EP2018861A1 (en) * | 2007-07-26 | 2009-01-28 | Laboratorios del Dr. Esteve S.A. | 5HT6-Ligands such as sulfonamide derivatives in drug-induced weight-gain |
| JP5337405B2 (ja) | 2007-09-17 | 2013-11-06 | ザ・ホスピタル・フォー・シック・チルドレン | ゴーシェ病の治療方法 |
| US9339500B2 (en) * | 2008-03-04 | 2016-05-17 | Intra-Cellular Therapies, Inc. | Methods of treating vasomotor symptoms |
| WO2009138437A1 (en) * | 2008-05-13 | 2009-11-19 | Genmedica Therapeutics Sl | Salicylate conjugates useful for treating metabolic disorders |
| CA2666036C (en) * | 2008-05-16 | 2017-09-12 | Chien-Hung Chen | Novel compositions and methods for treating hyperproliferative diseases |
| EP2296653B1 (en) | 2008-06-03 | 2016-01-27 | Intermune, Inc. | Compounds and methods for treating inflammatory and fibrotic disorders |
| US9156812B2 (en) | 2008-06-04 | 2015-10-13 | Bristol-Myers Squibb Company | Crystalline form of 6-[(4S)-2-methyl-4-(2-naphthyl)-1,2,3,4-tetrahydroisoquinolin-7-yl]pyridazin-3-amine |
| EP2323649A4 (en) * | 2008-07-25 | 2011-09-07 | Univ Emory | TREATMENT OF VARIOUS DISORDERS WITH 7,8-DIHYDROXY FLAVONE AND ITS DERIVATIVES |
| US8815838B2 (en) | 2008-10-07 | 2014-08-26 | David C. Griffith | Aerosol fluoroquinolone formulations for improved pharmacokinetics |
| PL2346509T3 (pl) | 2008-10-07 | 2021-03-08 | Horizon Orphan Llc | Lewofloksacyna w postaci aerozolu dla zmniejszania stanu zapalnego płuc |
| CA2755072A1 (en) * | 2009-03-16 | 2010-09-23 | Genmedica Therapeutics Sl | Combination therapies for treating metabolic disorders |
| JP2012520342A (ja) * | 2009-03-16 | 2012-09-06 | ジェンメディカ・セラピューティックス・ソシエダッド・リミターダ | 代謝障害を処置するのに有用な抗炎症剤および抗酸化剤のコンジュゲート |
| WO2010107702A1 (en) * | 2009-03-16 | 2010-09-23 | Ipintl, Llc | Treating alzheimer's disease and osteoporosis and reducing aging |
| KR20120034644A (ko) | 2009-05-12 | 2012-04-12 | 알바니 몰레큘라 리써치, 인크. | 아릴, 헤테로아릴, 및 헤테로사이클 치환된 테트라하이드로이소퀴놀린 및 이의 용도 |
| CN102638982B (zh) | 2009-05-12 | 2015-07-08 | 百时美施贵宝公司 | (S)-7-([1,2,4]三唑并[1,5-a]吡啶-6-基)-4-(3,4-二氯苯基)-1,2,3,4-四氢异喹啉的晶型及其用途 |
| CA2760837C (en) * | 2009-05-12 | 2018-04-03 | Albany Molecular Research, Inc. | 7-([1,2,4]triazolo[1,5-.alpha.]pyridin-6-yl)-4-(3,4-dichlorophenyl)-1,2,3,4-tetrahydroisoquinoline and use thereof |
| US8980843B2 (en) | 2009-07-01 | 2015-03-17 | Temple University—Of the Commonwealth System of Higher Education | Leptin agonist and methods of use |
| AU2010289397B2 (en) | 2009-09-03 | 2016-05-26 | Bioenergenix | Heterocyclic compounds for the inhibition of PASK |
| MX353288B (es) | 2009-09-04 | 2018-01-08 | Raptor Pharmaceuticals Inc | Uso de levofloxacina aerosolizada para el tratamiento de fibrosis quistica. |
| FI20106119A0 (fi) * | 2010-10-27 | 2010-10-27 | Sirtuin Valley Oy | Energia-aineenvaihduntaan vaikuttava koostumus |
| US8466197B2 (en) | 2010-12-14 | 2013-06-18 | Genmedica Therapeutics Sl | Thiocarbonates as anti-inflammatory and antioxidant compounds useful for treating metabolic disorders |
| CN103391932B (zh) | 2011-01-05 | 2015-10-14 | 拜奥埃内杰尼克斯公司 | 用于抑制pask的杂环化合物 |
| US8916561B2 (en) | 2011-03-02 | 2014-12-23 | Bioenergenix, Llc | Substituted quinoxaline compounds for the inhibition of PASK |
| WO2012119046A2 (en) | 2011-03-02 | 2012-09-07 | Bioenergenix | Heterocyclic compounds for the inhibition of pask |
| EP2696692A4 (en) * | 2011-04-15 | 2014-10-01 | Nestec Sa | METHOD FOR REGULATING SIRTUINE GENE EXPRESSION |
| MX2014000419A (es) | 2011-07-15 | 2014-09-22 | Nusirt Sciences Inc | Composicones y metodos para modular trayectorias metabolicas. |
| WO2013063078A1 (en) | 2011-10-28 | 2013-05-02 | Vitalis Llc | Anti-flush compositions |
| WO2013074948A1 (en) | 2011-11-16 | 2013-05-23 | Resveratrol Partners, Llc | Compositions containing resveratrol and nucleotides |
| JO3407B1 (ar) | 2012-05-31 | 2019-10-20 | Eisai R&D Man Co Ltd | مركبات رباعي هيدرو بيرازولو بيريميدين |
| AR092742A1 (es) | 2012-10-02 | 2015-04-29 | Intermune Inc | Piridinonas antifibroticas |
| TWI485145B (zh) | 2012-10-26 | 2015-05-21 | Ind Tech Res Inst | P型有機半導體材料與光電元件 |
| CN108452311A (zh) | 2012-11-13 | 2018-08-28 | 纽斯尔特科学公司 | 用于增强能量代谢的组合物和方法 |
| EP2801357A1 (en) | 2013-05-10 | 2014-11-12 | IMD Natural Solutions GmbH | Carboxylated stilbenes for activating AMPK and sirtuins |
| CA2943363A1 (en) | 2014-04-02 | 2015-10-08 | Intermune, Inc. | Anti-fibrotic pyridinones |
| JP6762308B2 (ja) | 2015-02-19 | 2020-09-30 | パーデュー、ファーマ、リミテッド、パートナーシップ | 胃排出の減少方法及び組成物 |
| CN105153090A (zh) * | 2015-07-17 | 2015-12-16 | 浙江海洋学院 | 4′-溴-7-异戊烯氧基-2,3-二氢黄酮和制备方法以及在制备抗抑郁药物中的应用 |
| CN105380955A (zh) * | 2015-09-24 | 2016-03-09 | 成都普瑞法科技开发有限公司 | 土大黄苷在治疗溃疡性结肠炎药物中的应用 |
| US20180169085A1 (en) * | 2016-12-19 | 2018-06-21 | Augusta University Reserch Institute, Inc. | Combination Therapy for Hemorrhagic Injury |
| US11254700B2 (en) | 2017-12-01 | 2022-02-22 | University Of Hawaii | GSK-3β inhibitors and use thereof in methods of treatment |
| IT201900003325A1 (it) * | 2019-03-07 | 2020-09-07 | C I A M S R L | Composizione per la prevenzione e trattamento della dermatite atopica |
| WO2021096882A1 (en) * | 2019-11-11 | 2021-05-20 | Nusirt Sciences, Inc. | Compositions, methods and kits for altering adipocytes |
| CA3235146A1 (en) | 2021-10-14 | 2023-04-20 | Incyte Corporation | Quinoline compounds as inhibitors of kras |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5827898A (en) * | 1996-10-07 | 1998-10-27 | Shaman Pharmaceuticals, Inc. | Use of bisphenolic compounds to treat type II diabetes |
| JP4738592B2 (ja) * | 1997-10-31 | 2011-08-03 | アーチ・デヴェロップメント・コーポレイション | 5α−還元酵素活性を調節するための方法及び組成物 |
| US6331633B1 (en) * | 1998-05-08 | 2001-12-18 | Calyx Therapeutics Inc. | Heterocyclic analogs of diphenylethylene compounds |
| US6448450B1 (en) * | 1998-05-08 | 2002-09-10 | Calyx Therapeutics, Inc. | 1-(3,5-dimethoxyphenyl)-2-(4-hydroxyphenyl)-ethylene for diabetes treatment |
| US7452664B2 (en) * | 1999-12-15 | 2008-11-18 | Massachusetts Institute Of Technology | Methods for identifying agents which alter histone protein acetylation |
| AU2001245977A1 (en) * | 2000-03-23 | 2001-10-03 | Interhealth Nutraceuticals Incorporated | Method and composition for preventing or reducing the symptoms of menopause |
| US6475530B1 (en) * | 2000-05-31 | 2002-11-05 | Eric H. Kuhrts | Methods and compositions for producing weight loss |
| US6552085B2 (en) * | 2000-08-16 | 2003-04-22 | Insmed Incorporated | Compositions containing hypoglycemically active stilbenoids |
| KR100407399B1 (ko) * | 2000-08-22 | 2003-11-28 | 주식회사 뉴로넥스 | 세로토닌 n-아세틸트란스퍼라제의 활성 억제제 |
| IT1320080B1 (it) * | 2000-10-25 | 2003-11-18 | Giuliani Spa | Composizione per uso farmaceutico o dietetico. |
| EP1343502A2 (en) * | 2000-11-17 | 2003-09-17 | Idenix (Cayman) Limited | Methods for inhibiting the transmission of hiv using topically applied substituted 6-benzyl-4-oxopyrimidines |
| BR0204228A (pt) * | 2001-02-20 | 2004-06-22 | Randy Ziegler | Métodos para melhorar os sintomas de uma psicose e de esquizofrenia e para triar moléculas de teste, e, composto orgânico |
| GB0123991D0 (en) * | 2001-10-05 | 2001-11-28 | Arachnova Ltd | New therapeutic use |
| EP1623704A4 (en) * | 2003-05-02 | 2009-04-01 | Takara Bio Inc | THERAPEUTIC AGENT |
| AU2004249123A1 (en) * | 2003-05-20 | 2004-12-29 | Erimos Pharmaceuticals Llc | Methods and compositions for delivery of catecholic butanes for treatment of obesity |
| WO2005002672A2 (en) * | 2003-07-01 | 2005-01-13 | President And Fellows Of Harvard College | Sirt1 modulators for manipulating cells/organism lifespan/stress response |
| US20050136429A1 (en) * | 2003-07-03 | 2005-06-23 | Massachusetts Institute Of Technology | SIRT1 modulation of adipogenesis and adipose function |
| AU2004312072B2 (en) * | 2003-12-29 | 2011-06-23 | President And Fellows Of Harvard College | Compositions for treating or preventing obesity and insulin resistance disorders |
| US7838503B2 (en) * | 2005-06-15 | 2010-11-23 | Children's Medical Center Corporation | Methods for extending the replicative lifespan of cells |
-
2006
- 2006-01-20 AU AU2006206274A patent/AU2006206274A1/en not_active Abandoned
- 2006-01-20 US US11/336,258 patent/US20060276416A1/en not_active Abandoned
- 2006-01-20 CA CA002595486A patent/CA2595486A1/en not_active Abandoned
- 2006-01-20 WO PCT/US2006/002267 patent/WO2006079021A2/en active Application Filing
- 2006-01-20 JP JP2007552335A patent/JP2008528510A/ja not_active Withdrawn
- 2006-01-20 EP EP06719216A patent/EP1841415A2/en not_active Withdrawn
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012236793A (ja) * | 2011-05-11 | 2012-12-06 | Kikkoman Corp | Ampk活性化剤 |
| WO2013100111A1 (ja) * | 2011-12-27 | 2013-07-04 | 油田 正樹 | サーチュイン活性化剤 |
| JPWO2013100111A1 (ja) * | 2011-12-27 | 2015-05-11 | 株式会社常磐植物化学研究所 | サーチュイン活性化剤 |
| US9745279B2 (en) | 2011-12-27 | 2017-08-29 | Tokiwa Phytochemical Co., Ltd. | Sirtuin activator |
| JP2018199680A (ja) * | 2011-12-27 | 2018-12-20 | 油田 正樹 | サーチュイン活性化剤 |
| JP2016516040A (ja) * | 2013-03-15 | 2016-06-02 | ニューサート サイエンシーズ, インコーポレイテッド | 脂質レベルを低下させるロイシンおよびニコチン酸 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2006079021A3 (en) | 2007-03-22 |
| WO2006079021A2 (en) | 2006-07-27 |
| CA2595486A1 (en) | 2006-07-27 |
| EP1841415A2 (en) | 2007-10-10 |
| AU2006206274A1 (en) | 2006-07-27 |
| US20060276416A1 (en) | 2006-12-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2008528510A (ja) | 紅潮および/または薬物誘発性体重増加を処置するためのサーチュイン活性化化合物の使用 | |
| AU2004253579B2 (en) | Sirt1 modulators for manipulating cells/organism lifespan/stress response | |
| CA2599125C (en) | Sirtuin related therapeutics and diagnostics for neurodegenerative diseases | |
| JP2008527002A (ja) | 神経変性障害および血液凝固障害を予防および処置するための新規組成物 | |
| JP2015187141A (ja) | 肥満及びインシュリン耐性障害を治療又は予防するための組成物 | |
| JP2007527418A (ja) | 肥満及びインシュリン耐性障害を治療又は防止するための組成物 | |
| JP2009500357A (ja) | 肥満、インスリン抵抗性障害およびミトコンドリア関連障害を処置または予防するための方法および関連する組成物 | |
| JP2009521408A (ja) | Cdc2様キナーゼ(CLK)のモジュレータおよびその使用方法 | |
| AU2013201279B2 (en) | Sirt1 modulators for manipulating cells/organism lifespan/stress response |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081208 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20081208 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20100303 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20100408 |