JP2007504273A - 種々の作用剤を用いた、線維性癒着の抑制に関する医薬組成物及び方法 - Google Patents
種々の作用剤を用いた、線維性癒着の抑制に関する医薬組成物及び方法 Download PDFInfo
- Publication number
- JP2007504273A JP2007504273A JP2006529506A JP2006529506A JP2007504273A JP 2007504273 A JP2007504273 A JP 2007504273A JP 2006529506 A JP2006529506 A JP 2006529506A JP 2006529506 A JP2006529506 A JP 2006529506A JP 2007504273 A JP2007504273 A JP 2007504273A
- Authority
- JP
- Japan
- Prior art keywords
- agent
- adhesion
- adhesions
- fibrotic
- therapeutically effective
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/18—Sulfonamides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/196—Carboxylic acids, e.g. valproic acid having an amino group the amino group being directly attached to a ring, e.g. anthranilic acid, mefenamic acid, diclofenac, chlorambucil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/337—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having four-membered rings, e.g. taxol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/365—Lactones
- A61K31/366—Lactones having six-membered rings, e.g. delta-lactones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/401—Proline; Derivatives thereof, e.g. captopril
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/436—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having oxygen as a ring hetero atom, e.g. rapamycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
- A61K31/573—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone substituted in position 21, e.g. cortisone, dexamethasone, prednisone or aldosterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/65—Tetracyclines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/716—Glucans
- A61K31/717—Celluloses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/716—Glucans
- A61K31/718—Starch or degraded starch, e.g. amylose, amylopectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/716—Glucans
- A61K31/722—Chitin, chitosan
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/734—Alginic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/164—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
- A61K38/166—Streptokinase
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
- A61K38/1841—Transforming growth factor [TGF]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/39—Connective tissue peptides, e.g. collagen, elastin, laminin, fibronectin, vitronectin, cold insoluble globulin [CIG]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7007—Drug-containing films, membranes or sheets
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/16—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P41/00—Drugs used in surgical methods, e.g. surgery adjuvants for preventing adhesion or for vitreum substitution
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1136—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against growth factors, growth regulators, cytokines, lymphokines or hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/424—Anti-adhesion agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/10—Applications; Uses in screening processes
- C12N2320/11—Applications; Uses in screening processes for the determination of target sites, i.e. of active nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
Abstract
【選択図】 図3
Description
そのほかの出願に対するクロスリファレンス
Ellis, H., Surg. Gynecol. Obstet., 133:497, 1971 diZerega, G. S., Prog. Clin. Biol. Res., 381:1-18, 1993 diZerega, G. S., Fertil. Steril., 61:219-235, 1994 Dobell, A. R., Jain, A. K., Ann. Thorac. Surg., 37:273-278, 1984 Holtz, G., Fertl. Steril., 41:497-507, 1984 Webel M.A. and Majvo, G., Am. J. Surg., 126:345-353, 1973 Buckman, R. F. et al., J. Surg. Res., 21:67-78, 1976 Raferty, A. T., J. Anat., 129:659-664, 1979 Adhesion Study Group, Fertil. Steril., 40:612-619, 1983 Elkins, T. E., et al., Fertil. Steril., 41:926-928, 1984 Burns, J. W. et al., Eur. J. Surg. Suppl., 577:40-48, 1997 Burns, J. W. et al., Fertil. Steril., 66:814-821, 1996 Becker, J. M. et al., J. Am. Coll. Surg., 183:297-306, 1996 Ellis, H., Br. J. Surg., 50:10-16, 1963
例示となる繊維性癒着抑制剤の一般的考察
本明細書の組成物の薬剤成分は、他の組成物及び目的で通常、周知である。以下は、それらの一部に関する情報の一部を提供する。
その作用は、アラキドン酸をプロスタグランジン及びトロボキサンに変換するのに関与するシクロオキシゲナーゼ(COX)酵素の阻害を中心とする。1991年、COXには2つの異なったアイソザイムが存在し、そのうちの1つ、COX−2は主として炎症に関与するが、消化管の整合性又は血小板の凝集には明らかに関与しないことが開示された。この理由で、最近、このアイソザイムに選択性がある新規の化合物、抗炎症活性は保持するが、消化管毒性及び出血のリスクを最小限に抑えた、いわゆる選択性COX−2阻害剤又はCOXIBが開発された。COX−2阻害剤のCOX非依存性のメカニズムの一部には、タンパク質キナーゼGの活性化、NFκB活性化の阻害、抗アポトーシスタンパク質Bcl−XLの下方制御、PPARδの阻害及びPPARγの活性化が挙げられる。
細胞傷害性抗生物質の例には、ミトタン(CAS53−19−0)が挙げられる。
抗凝固剤の例には、ペントキシフィリン(CAS6493−05−6)が挙げられる。
プラスミノーゲン活性化剤の例には、ストレプトキナーゼ(CAS9002−01−1)が挙げられる。
サイトカイン類の例には、形質転換増殖因子β(TGF−β、J. Biol. Chem., Aug, 30:277(35):31938-48, 2002)が挙げられる。
特定のそのほかの所望の作用剤の例には、レフルノミド(アラバ)が挙げられ、それは、ミトコンドリアにおけるジヒドロ−オロテートデヒドロゲナーゼ(DHO−DH)を阻害することによりピリミジンの代謝を妨害し、それによってT細胞及びB細胞の増殖を阻止するイソキサゾール免疫モジュレータである(Expert Opin. Pharmacother., Jun, 4(6):987-97, 2003)。そのほかの例には、エリスロマイシン、デキストラン硫酸、アルギン酸、デキストロース、デキストランT70、デンプン、ケルセチン二水和物、カフェイン、γカラギーナン、λカラギーナン、ヒドロキシプロピルセルロース、スタキオース、コンドロイチン硫酸Aが挙げられる。
フカン(フコイダンを含む)は、褐色海草から抽出された高分子量の硫酸化多糖類であり(Percival E. & McDowell R. H., 海洋藻類の多糖類の化学及び酵素学、157〜175ページ、Academic Press, New York, 1967)、周知のように、同様にそのほかの出典、Vasseur E., 紫ウニ卵のゼリー被膜の化学的研究、Acta Chem. Scand., 2:900-913, 1948; Muorao, PAS & Bastos IG, ナマコの酸性度の高いグリカン、Eur. J. Biochem., 166:639-645, 1987; Pereira et al., 硫酸化フカンの構造及び抗凝固、J. Biol. Chem., 274:12. 7656-7667, 1999に見い出すことができる。フコイダン(又はフコイジン)は、褐色海草に由来するフカンを指す。米国特許2003064958。フカンは、単独でありうるし、又は混合物、たとえば、キシロース、ガラクトース、グルコース及び/又はマンノースのような糖の混合物でありうる。これらの糖は、海洋藻類に含有されることが知られており、フカンとともに抽出されてもよい。Duarte, Maria ER, Cardoso, Marc A, Noseda, Miguel D., Cerezo, Alberto S., 「ワカメ、Sargassum stenophyllumのフコイダンにおける構造的研究」、Carbohydrate Research 333:281-293, 2001。
本明細書で考察される作用剤は、線維性癒着の治療のためにヒトを含む動物に直接適用するのに好適なフィルムとして製剤化することができる。フィルムの所望の特性には、薄く、柔軟で、取り扱うことができ、組織に貼ることができることが挙げられる。本明細書で考察される各作用剤をポリマーに組み入れてフィルムを創製することができる。好適な賦形剤の添加によってポリマーフィルム製剤の特性を高めることができる。実施態様の1つでは、作用剤をヒアルロン酸ポリマーと組み合わせてフィルムを作製することができる。添加できる賦形剤には、1−エチル−3−[3−(ジメチルアミノ)プロピル]カルボジイミド(EDAC)及びグリセロールが挙げられる。
本明細書で考察される各作用剤は、本明細書でゲルと呼ばれる粘性溶液に組み入れることができる。このゲルは、ヒトを含む動物の体腔に投与することができ、線維性癒着の形成の抑制及び予防に有効である。
本明細書で考察される各作用剤を液体に溶解又は懸濁し、それをヒトを含む動物の体腔に投与することができ、増大した増殖を含む繊維性癒着の形成を抑制する、治療する、予防する等に使用することができる。これらの製剤を本明細書では点滴用剤製剤と呼ぶ。これらの製剤を、たとえば、手術後の患者の腹腔内に投与して術後癒着を防ぐことができ、又はそのほかの所望の傷、病変等の部位の中/上に投与することができる。この液体は溶媒であることができ、続いて作用剤の溶液を製造することができる。さらに、作用剤を溶解するのに使用される溶媒は水系であってもよい。電解溶液への作用剤の溶解が点滴用剤製剤を作製する。次いで、線維性癒着の形成を防ぐ好適な体腔に点滴用剤を投与する。
ケモカインは、炎症過程の間、白血球の移動、活性化及び走化性の主な調節剤として機能する低分子量(6〜14kd)の構造的に類似したタンパク質の大きなファミリーを構成する(概説には、Rollins BJ., Blood 90:909-928, 1997を参照のこと)。今日までこのサイトカインスーパーファミリーの30を超えるメンバーが同定されており、必須のジスルフィド結合を形成するNH2−末端のシステインの位置に基づいて4つの亜群、C、CC、CXC及びCX3Cに大別される。
実施態様の1つでは、所定の薬剤又は薬剤の組み合わせの有効性は、手術の線維性癒着について、ラットの盲腸側壁モデルにて、薬剤又は組み合わせに対する所定の標準、たとえば、薬剤を負荷したヒアルロン酸ナトリウムフィルムに対する偽物を負荷した又はヒアルロン酸ナトリウムフィルムのみの平均合計癒着値(強さx面積「TAV」)の低下として評価することができる。他の標準には、そのほかのフィルム、溶液等、及びそのほかのモデル、たとえば、ウサギの子宮角モデル又はヒトにおける有効性を挙げることができる。種々の実施態様では、薬剤は、対照の値、たとえば、手術の線維性癒着に関するラットの盲腸側壁モデルを用いたヒアルロネートフィルムのみの値の0.001%、1%、5%、10%、25%、50%、又は75%以下の平均TAVを有することができる。他の測定パラメータでは、薬剤は、患者における線維性癒着の形成を実質的にすべて抑制することができる。
簡単に要約すると、実施例1及び2は、動物モデルを用い、手術の癒着に対する種々の作用剤の有効性の解析を指向し、実施例3〜7は、アンチセンス及びそのほかのSDF−1阻害剤に関する。実施例8〜10は、ラパマイシンに関する。実施例11〜14は、線維性癒着抑制剤の種々の製剤に関する。実施例15は、様々な起源に由来するフコイダンの有効性に関する。
手術癒着のラット盲腸側壁モデルを用いて、本明細書で考察した各作用剤(以下、薬剤と呼ぶ)の投与の効果を術後型の線維性癒着の防止について検討した。このモデルではラットを4匹の群に分けた。手術の損傷後、ラットを処置しないか、又は架橋したヒアルロン酸(HA)フィルム又はフィルムに以下の濃度(%w/w)の薬剤を含有するHAフィルムで処理した。
癒着によって覆われた面積の尺度:
1〜25% 1
25〜50% 2
51〜75% 3
76〜100% 4
癒着の強度の尺度
0 癒着がない
1 鈍い剥離で引き離し可能な癒着
2 容易には分離できない癒着
3 癒着の鋭い剥離を必要とする(壁又は角を引き裂く)
ウサギにおける子宮角手術癒着モデルを用いて、本明細書で考察し、選択された各作用剤(以下、薬剤と呼ぶ)の投与の効果を術後型の線維性癒着の防止について検討する。このモデルではウサギを4匹の群に分ける。手術の損傷後、ウサギを、架橋したヒアルロン酸(HA)フィルム、5%w/wで負荷した薬剤を含有する架橋したHAフィルム、2%w/wで負荷した薬剤を含有する架橋したHAフィルム、30%w/wで負荷した薬剤を含有する架橋したHAフィルム、5%w/w〜99%w/wの間の濃度で負荷した薬剤を含有する架橋したHAフィルムで処理し、又は処理しない(対照群)。他の処理群は、0.0001%w/w〜1%w/wの間の濃度の薬剤の溶液(懸濁液)又は1%w/w〜2%w/wの間の濃度の薬剤の溶液(懸濁液)、又は2%w/w〜5%w/wの間の濃度の薬剤の溶液(懸濁液)、又は5%w/w〜10%w/wの間の濃度の薬剤の溶液(懸濁液)、又は10%w/w〜25%w/wの間の濃度の薬剤の溶液(懸濁液)、又は25%w/w〜50%w/wの間の濃度の薬剤の溶液(懸濁液)を含む。
適当量の薬剤を水性溶液(たとえば、乳酸加リンガー液、USP)に溶解する。これらの溶液をろ過して粗い粒子を除き、22μmのフィルター又はオートクレーブ又はそのほかの適当な手段によって滅菌する。薬剤を溶液ではなく懸濁液として投与するならば、ろ過工程は使用しない。手術処置の終わり、手術切開を閉じるためのウサギの最後の縫合の直前に、滅菌した点滴用剤の薬剤を腹腔に直接投与する。
ウサギにおける子宮角手術癒着モデルを用いてこれらの製剤を調べる。簡単に言えば、ウサギの腹部に切開を作る。子宮角を見つけ、角の基部を指定した(及び一貫した)時間、つかむことによって傷つける。外科用メスでこすることによって特定の領域でウサギの腹膜の側壁を傷つける。腹膜の側壁のこすった領域に載せるような方法で子宮角を置き、角の先端を縫い合わせる。縫い合わせは、側壁のこすった領域の外にあるが、子宮角がこすった領域から外れるのを防ぐ。
癒着の強度の尺度
0 癒着がない
1 鈍い剥離で引き離し可能な癒着
2 容易には分離できない癒着
3 癒着の鋭い剥離を必要とする(壁又は角を引き裂く)
癒着によって覆われた面積の尺度:
1〜25% 1
25〜50% 2
51〜75% 3
76〜100% 4
SDF−1mRNAのアンチセンスの可能性がある配列を決定するために、SDF−1のmRNA配列をバイオテクノロジー情報国立センター(NCBI)のデータベースから先ず入手した。http://www.ncbi.nlm.nih.govnにてデータベースにアクセスできる。検索パラメータにおいて、「SDF」を入力し、ヒトSDF−1mRNAに相当する受託番号NM_000609を持つ配列を見い出した。
10%(w/w)の濃度にて60℃にてスパーテルですり潰すことによりSDF−1阻害剤をポリカプロラクトン(PCL、バーミンガムポリマーズ、分子量54K)と混合する。次いで、この混合物を1mLのプラスチック製注射器に装填し、冷却する。この製剤を18ゲージの針を介して56℃にて注射することができる。
ニワトリの受精卵を地方の孵化場から入手し、3日と半日、自動回転式の37℃のインキュベータに入れる。卵の尖った先端を5〜10分間上に向けて内膜から卵の内容物が剥離するように卵を手動で回転させる。70%及びキムワイプを用いて卵全体をぬぐい、卵の外側を清潔且つ衛生的に保つ。層流フードの中で、鈍い方を上にして卵を保持し、ピンセットの先端で慎重に殻を割ることによって卵の鈍い先端に穴を1つ開ける。殻の膜をピンセットで穏やかに取り除き、鈍い先端に穴を形成する。内膜を損傷せずに、この丸い穴を直径2〜3cmほどに大きくすることができる。いったん、殻に穴を創ると内側の殻の膜(卵の内容物を格納する)を穏やかに剥がし、ピンセットで取り除くが、絨毛尿膜(CAM)(黄身を格納し、ニワトリ胚を発生させている)を損傷しないように注意すること。
0 抗血管形成活性なし
1 微細な血管の減少
2 薬剤ペレット(直径2mm)のサイズに相当する小さな無血管域
3 直径4〜5mmの無血管域
ヒト臍帯内皮細胞(HUVEC)を単離し、10%FCS、8%のプールしたヒト血清、50mg/mLの内皮細胞増殖因子、10U/mLのヘパリン及び抗生物質を含有するM199培地(シグマ−アルドリッチ)で一次培養を樹立し、継代する。サイトカイン添加の1日前に、フィブロネクチンをコートしたプレートに細胞を事前に播き、次いで、SDF−1阻害剤の存在下でTNF−α(12ng/mL、R&Dシステムズ)を補完した培養培地で18時間刺激する。
SDF−1阻害剤を1.2mLのジメチルスルホキシドに溶解し、2%w/vの酢酸中2.5%w/vのキトサン(フルカサイエンティフィック、低分子量)4mLにピペットで入れる。この混合物をスパーテルで撹拌し、沈殿した薬剤をキトサン溶液に均質に懸濁する。次いで、この粘性混合物4mLを2.5cmのペトリ皿に注ぎ、37℃にて一晩乾燥する。キトサンは、ペトリ皿から外される薄いフィルムに乾燥する。これらのフィルムは、中程度に柔軟性があり、約35mmの厚さで、阻害剤は、10%(キトサンに対してw/w)の濃度でキトサンマトリクスに均一に懸濁されている。これらキトサンフィルムからの薬剤の放出を測定するには、10mLのPBS(pH7.4)に20mg入れ、管に蓋をして特定の時間、37℃にて転倒させる。フィルムからPBSに放出された阻害剤の量を260nmの吸収によって測定する。薬剤の放出は、最初の突発に続く緩慢な徐放を特徴とする。阻害剤のこの投与形態は、制御された方式で薬剤を放出する、SDF−1阻害剤の生体適合性の、粘膜付着性の製剤を表す。
10%(w/w)の濃度にて60℃にてスパーテルですり潰すことによりラパマイシンをポリカプロラクトン(PCL、バーミンガムポリマーズ、分子量54K)と混合する。次いで、この混合物を1mLのプラスチック製注射器に装填し、冷却する。この製剤を18ゲージの針を介して56℃にて注射することができる。
ニワトリの受精卵を地方の孵化場から入手し、3日と半日、自動回転式の37℃のインキュベータに入れる。卵の尖った先端を5〜10分間上に向けて内膜から卵の内容物が剥離するように卵を手動で回転させる。70%及びキムワイプを用いて卵全体をぬぐい、卵の外側を清潔且つ衛生的に保つ。層流フードの中で、鈍い方を上にして卵を保持し、ピンセットの先端で慎重に殻を割ることによって卵の鈍い先端に穴を1つ開ける。殻の膜をピンセットで穏やかに取り除き、鈍い先端に穴を形成する。内膜を損傷せずに、この丸い穴を直径2〜3cmほどに大きくすることができる。いったん、殻に穴を創ると内側の殻の膜(卵の内容物を格納する)を穏やかに剥がし、ピンセットで取り除くが、絨毛尿膜(CAM)(黄身を格納し、ニワトリ胚を発生させている)を損傷しないように注意すること。
0 抗血管形成活性なし
1 微細な血管の減少
2 薬剤ペレット(直径2mm)のサイズに相当する小さな無血管域
3 直径4〜5mmの無血管域
ラパマイシンを1.2mLのジメチルスルホキシドに溶解し、次いで2%w/vの酢酸中2.5%w/vのキトサン(フルカサイエンティフィック、低分子量)4mLにピペットで入れる。この混合物をスパーテルで撹拌し、沈殿した薬剤をキトサン溶液に均質に懸濁する。次いで、この粘性混合物4mLを2.5cmのペトリ皿に注ぎ、37℃にて一晩乾燥する。キトサンは、ペトリ皿から外される薄いフィルムに乾燥する。これらのフィルムは、中程度に柔軟性があり、約35mmの厚さで、阻害剤は、10%(キトサンに対してw/w)の濃度でキトサンマトリクスに均一に懸濁されている。これらキトサンフィルムからの薬剤の放出を測定するには、10mLのPBS(pH7.4)に20mg入れ、管に蓋をして特定の時間、37℃にて転倒させる。フィルムからPBSに放出されたラパマイシンの量を260nmの吸収によって測定する。薬剤の放出は、最初の突発に続く緩慢な徐放を特徴とする。ラパマイシンのこの投与形態は、制御された方式で薬剤を放出する、薬剤の生体適合性の、粘膜付着性の製剤を表す。
蒸留水中にグリセロールと共にヒアルロン酸(HA)を溶解することによって33%フコイダンのフィルムを製剤化した。37℃のオーブンで逆さに反転することによってHAの溶解は2時間以内に生じた。混合しながらHA/グリセロールの溶液にフコイダン(シグマケミカルズ)を加えた。激しく混合しながら、EDAC、架橋剤を製剤に加えた。この溶液をペトリ皿に注入し、それを60℃のオーブンに一晩入れ、製剤を乾燥させてフィルムにした。次いで、得られたフィルム(33%フコイダンw/w)をピンセットでペトリ皿から外し、適当な大きさに切断した。
癒着の強度の尺度
0 癒着がない
1 鈍い剥離で引き離し可能な癒着
2 容易には分離できない癒着
3 癒着の鋭い剥離を必要とする(壁又は角を引き裂く)
癒着によって覆われた面積の尺度:
1〜25% 1
25〜50% 2
51〜75% 3
76〜100% 4
一連のゲルがこの実験のために製剤化された:
1.5.5%w/vヒアルロン酸ゲル中の0%w/vフコイダン
2.5.5%w/vヒアルロン酸ゲル中の1.5%w/vフコイダン
3.5.5%w/vヒアルロン酸ゲル中の3%w/vフコイダン
4.5.5%w/vヒアルロン酸ゲル中の6%w/vフコイダン
ラットの盲腸側壁の手術癒着モデルを用いこれらのゲルを評価して手術癒着の防止に対する有効性を決定した。
癒着の強度の尺度
0 癒着がない
1 鈍い剥離で引き離し可能な癒着
2 容易には分離できない癒着
3 癒着の鋭い剥離を必要とする(壁又は角を引き裂く)
癒着によって覆われた面積の尺度:
1〜25% 1
25〜50% 2
51〜75% 3
76〜100% 4
適当量のフコイダンを乳酸加リンガー液に溶解し所定の濃度を達成することによって0.001%、0.003%及び0.01%w/vのフコイダン点滴用剤の溶液を製造した。フコイダンは、褐色海洋藻類、Fucus vesiculosisからの抽出物であり、シグマケミカルズから入手した。対照として乳酸加リンガー液注射液USPを用い、ラットの子宮角の手術癒着モデルを用いて、ラットでの手術癒着の予防における有効性についてこれらの製剤を評価した。
癒着の強度の尺度
0 癒着がない
1 鈍い剥離で引き離し可能な癒着
2 容易には分離できない癒着
3 癒着の鋭い剥離を必要とする(壁又は角を引き裂く)
癒着によって覆われた面積の尺度:
1〜25% 1
25〜50% 2
51〜75% 3
76〜100% 4
ウサギで行われた有効性試験は、ウサギにおける手術癒着病態の子宮角モデルを利用した。ニュージーランドホワイト種のウサギを入手し、処理の少なくとも3日前に収容した。ウサギはウサギ用の餌及び水に自由にアクセスさせた。手順は以下のとおりであった。
癒着強度のランク分け尺度
0〜0.5 ほとんど癒着がない
0.5〜1.5 鈍い剥離で引き離し可能
1.5〜2 単一領域で容易には分離できない
2〜3 鋭い剥離を必要とする
3 穿孔又は引き裂きを回避できない
癒着面積の尺度
1〜25% 1
25〜50% 2
51〜75% 3
76〜100% 4
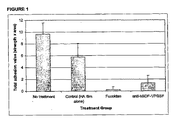
この実験には合計19匹のウサギを使用した。ウサギはすべて上述の子宮角処置の対象とした。ウサギを3群に分け、8匹の動物は無処理であり、3匹には30mLの0.3%w/vのフコイダン点滴用剤を与え(90mgのフコイダン用量)、8匹の動物には、30mLの3%w/vのフコイダン点滴用剤を与えた(900mgのフコイダン用量)。術後14日目に各動物の癒着スコアを評価し、図9にプロットする。
ラットの子宮角の手術癒着モデルを用いた手術癒着の予防における有効性についてFucus vesiculosis及びLaminaria japonica(コンブ)に由来するフコイダンを評価した。0.001%w/vの濃度でフコイダンの各起源を乳酸加リンガー注射液USPに溶解した。子宮角の手術癒着モデルを用いた手術に続いて、これを5mLの用量で腹腔内でラットに投与した。これら製剤の有効性を乳酸加リンガー注射液USPの対照(ラット当たり5mL)と比較した。
癒着の強度の尺度
0 癒着がない
1 鈍い剥離で引き離し可能な癒着
2 容易には分離できない癒着
3 癒着の鋭い剥離を必要とする(壁又は角を引き裂く)
癒着によって覆われた面積の尺度:
1〜25% 1
25〜50% 2
51〜75% 3
76〜100% 4
Claims (133)
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がアルギン酸を含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がドキシサイクリンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がコルチゾンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がメクロフェナメートを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がコラーゲンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がブデソニドを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がエナラプリルを含む、動物において線維性癒着を抑制する方法。
- 該エナラプリルがマレイン酸エナラプリルである請求項7の方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤が線維性癒着を有することが疑われる部位へのスタチンを含む、動物において線維性癒着を抑制する方法。
- 該スタチンがシムバスタチンである請求項9の方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がカプトプリルを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がキトサンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がミノサイクリンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がメソトレキセートを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がシスプラチンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がSDF−1阻害剤を含む、動物において線維性癒着を抑制する方法。
- 該SDF−1阻害剤が、抗SDF−1アンチセンスオリゴヌクレオチド(ASO)である請求項16の方法。
- 該SDF−1阻害剤が、抗SDF−1小分子RNAである請求項16の方法。
- 該SDF−1阻害剤が、抗SDF−1siRNAである請求項16の方法。
- 該SDF−1阻害剤が、抗SDF−1リボザイムである請求項16の方法。
- 該SDF−1阻害剤が、SDF−1の小分子阻害剤である請求項16の方法。
- 該SDF−1阻害剤が、抗SDF−1抗体又は抗SDF−1アプタマーである請求項16の方法。
- 該SDF−1阻害剤が、抗hSDF−1/PBSFである請求項22の方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がラパマイシンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がヒドロキシプロピルセルロースを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がダカルバジンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がドセタキセルを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がニメスリドを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がジフルシナルを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がベタメタゾンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がデキサメタゾンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がストレプトキナーゼを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がTGF−βを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がTIMP−2を含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がデンプンを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がケルセチン二水和物を含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がレフルノミドを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がスタキオースを含む、動物において線維性癒着を抑制する方法。
- 線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の該作用剤を投与することを含み、該作用剤がコンドロイチン硫酸Aを含む、動物において線維性癒着を抑制する方法。
- 部位が外科的部位である請求項1〜39のいずれか1項の方法。
- 部位が動物の腹部の中である請求項1〜39のいずれか1項の方法。
- 部位が動物の四肢の中である請求項1〜39のいずれか1項の方法。
- 部位が動物の背骨の中である請求項1〜39のいずれか1項の方法。
- 部位が動物の頭部の中である請求項1〜39のいずれか1項の方法。
- 部位が動物の生殖器の中である請求項1〜39のいずれか1項の方法。
- 部位が動物の消化器の中である請求項1〜39のいずれか1項の方法。
- 部位が動物の呼吸器系の中である請求項1〜39のいずれか1項の方法。
- 部位が動物の胸腔の中である請求項1〜39のいずれか1項の方法。
- 部位が動物の循環器系の中である請求項1〜39のいずれか1項の方法。
- 部位が動物の泌尿器系の中である請求項1〜39のいずれか1項の方法。
- 部位が骨盤炎症病変部位である請求項1〜39のいずれか1項の方法。
- 部位が機械的損傷部位である請求項1〜39のいずれか1項の方法。
- 部位が放射線暴露部位である請求項1〜39のいずれか1項の方法。
- 部位が外来物質の存在に冒された部位である請求項1〜39のいずれか1項の方法。
- 薬剤が、ポリマーの投与形態からの制御放出を介して実質的に連続して病変部位に投与される請求項1〜39のいずれか1項の方法。
- ポリマーの投与形態が、フィルム、貼付剤、ペースト、ミクロスフェア、インプラント、ゲル、スプレー又は液体を含む請求項55の方法。
- 薬剤が、溶液又は懸濁液として病変部位に実質的に送達される請求項1〜39のいずれか1項の方法。
- 溶液又は懸濁液が、乳酸加リンガー注射液USPである請求項57の方法。
- 作用剤がフカンとの併用で投与される請求項1〜39のいずれか1項の方法。
- フカンがフコイダンである請求項59の方法。
- フカンが点滴用剤の形態である請求項59又は60の方法。
- 作用剤が、請求項1〜39のいずれか1項の第2の作用剤との併用で投与される請求項1〜61のいずれか1項の方法。
- 作用剤が、治療上許容可能な量のそのほかの治療剤との併用で投与される請求項1〜61のいずれか1項の方法。
- 線維性癒着を抑制することを決定すること、及び線維性癒着を有することが疑われる部位に、治療上有効量のフカン及び、イオンキレート剤、トリエンマクロライド抗生物質、3−ヒドロキシ−3−メチルグルテリル−CoA、還元酵素阻害剤、レチノイド、抗血栓剤、抗凝固剤、プラスミノーゲン活性化剤、サイトカイン、マトリクスメタロプロテイナーゼ阻害剤、テトラサイクリン、ACE阻害剤、デキストラン糖、又はカラギーナンの少なくとも1種を投与することを含む動物で線維性癒着を抑制する方法。
- 線維性癒着を抑制することを決定すること、及び線維性癒着を有することが疑われる部位に、治療上有効量のフカン及び、デフェロキサミンメシレート、シムバスタチン、レチノイン酸、ヘパリン、ペントキシフィリン、ストレプトキナーゼ、TGF−β、TIMP−2、ラパマイシン、テトラサイクリン、ミノサイクリン、カプトプリル、ドキシサイクリン、エナラプリル、デキストラン硫酸、デキストロース、デキストランT70、コハク酸、コラーゲン、デンプン、ケルセチン二水和物、カフェイン、ラムダ−カラギーナン、イオタ−カラギーナン、ヒドロキシプロピルセルロース、スタキオース、コンドロイチン硫酸A又はレフルノミドの少なくとも1種を投与することを含む動物で線維性癒着を抑制する方法。
- 線維性癒着を抑制することを決定すること、及び線維性癒着を有することが疑われる部位に、治療上有効量のフカン及び少なくとも1種の抗腫瘍剤を投与することを含む動物で線維性癒着を抑制する方法。
- 抗腫瘍剤が、アルキル化剤、代謝抑制剤、リボヌクレオチド還元酵素阻害剤、細胞傷害性抗生物質、タキサン、ビンカアルカロイド又はプロテアーゼ阻害剤の少なくとも1種を含む請求項66の方法。
- 線維性癒着を抑制することを決定すること、及び線維性癒着を有することが疑われる部位に、治療上有効量のフカン及び、ブスルファン、シクロホスファミド、エストラムスチン、シスプラチン、デカルバジン、ヒドロキシウレア、ミトタン、ドセタキセル、硫酸ビンブラスチン又はMG132の少なくとも1種を投与することを含む動物で線維性癒着を抑制する方法。
- 線維性癒着を抑制することを決定すること、及び線維性癒着を有することが疑われる部位に、治療上有効量のフカン及び少なくとも1種の抗炎症剤を投与することを含む動物で線維性癒着を抑制する方法。
- 抗炎症剤が、COX−2阻害剤、フェナメート、オキシカム、アセチル酸誘導体、サリチル酸誘導体又はコルチコステロイドの少なくとも1種を含む請求項69の方法。
- 線維性癒着を抑制することを決定すること、及び線維性癒着を有することが疑われる部位に、治療上有効量のフカン及び、ニメスリド、メクロフェナン酸、ジクロフェナック、メクロフェナン酸ナトリウム一水和物、テノキシカム、インドメタシン、アセチルサリチル酸、ジフルニサル、ベタメタゾン、ブデソニド、デキサメタゾン又は酢酸コルチゾンの少なくとも1種を投与することを含む動物で線維性癒着を抑制する方法。
- 線維性癒着を抑制することを決定すること、及び線維性癒着を有することが疑われる部位に、治療上有効量のフカン及び少なくとも1種のSDF−1阻害剤を投与することを含む動物で線維性癒着を抑制する方法。
- SDF−1阻害剤が、抗SDF−1アンチセンスオリゴヌクレオチド、(ASO)、抗SDF−1小分子RNA、抗SDF−1siRNA、抗SDF−1リゾチーム、SDF−1の小分子阻害剤、抗SDF−1アプタマー、抗SDF−1抗体又は抗hSDF−1/PBSFの少なくとも1種を含む請求項72の方法。
- 線維性癒着を抑制することを決定すること、及び線維性癒着を有することが疑われる部位に、治療上有効量のフカン及び、デキストラン硫酸、SDF−1阻害剤、シスプラチン、ドセタキセル、ベタメタゾン、TIMP−2、エリスロマイシン、及びコンドロイチン硫酸Aの少なくとも1種を投与することを含む動物で線維性癒着を抑制する方法。
- 部位が外科的部位である請求項64〜74のいずれか1項の方法。
- 部位が動物の腹部の中である請求項64〜74のいずれか1項の方法。
- 部位が動物の皮膚の中である請求項64〜74のいずれか1項の方法。
- 部位が動物の頭部の中である請求項64〜74のいずれか1項の方法。
- 部位が動物の生殖器の中である請求項64〜74のいずれか1項の方法。
- 部位が動物の消化器の中である請求項64〜74のいずれか1項の方法。
- 部位が機械的損傷部位である請求項64〜74のいずれか1項の方法。
- 部位が放射線暴露部位である請求項64〜74のいずれか1項の方法。
- 薬剤が、ポリマーの投与形態からの制御放出を介して実質的に連続して病変部位に投与される請求項64〜82のいずれか1項の方法。
- 薬剤が、溶液又は懸濁液として病変部位に実質的に送達される請求項64〜83のいずれか1項の方法。
- フカンがフコイダンである請求項64〜84のいずれか1項の方法。
- フカンが点滴用剤の形態である請求項64〜85の方法。
- 作用剤が、請求項64〜74のいずれか1項の第2の作用剤との併用で投与される請求項64〜86のいずれか1項の方法。
- 動物がヒトである請求項1〜87のいずれか1項の方法。
- 線維性癒着を抑制するように構成される医薬組成物であって、線維性癒着を抑制するように選択される治療上有効量のフカン、及び治療上有効量の、イオンキレート剤、トリエンマクロライド抗生物質、3−ヒドロキシ−3−メチルグルテリル−CoA還元酵素阻害剤、レチノイド、抗血栓剤、抗凝固剤、プラスミノーゲン活性化剤、サイトカイン、マトリクスメタロプロテイナーゼ阻害剤、テトラサイクリン、ACE阻害剤、デキストラン糖、又はカラギーナンの少なくとも1種を含む少なくとも1種の治療上有効な線維性癒着抑制剤、及び少なくとも1種の薬学上許容可能な賦形剤、キャリア又は希釈剤を含む組成物。
- 線維性癒着を抑制するように構成される医薬組成物であって、線維性癒着を抑制するように選択される治療上有効量のフカン、及び治療上有効量の、デフェロキサミンメシレート、シムバスタチン、レチノイン酸、ヘパリン、ペントキシフィリン、ストレプトキナーゼ、TGF−β、TIMP−2、ラパマイシン、テトラサイクリン、ミノサイクリン、カプトプリル、ドキシサイクリン、エナラプリル、デキストラン硫酸、デキストロース、デキストランT70、コハク酸、コラーゲン、デンプン、ケルセチン二水和物、カフェイン、ラムダ−カラギーナン、イオタ−カラギーナン、ヒドロキシプロピルセルロース、スタキオース、コンドロイチン硫酸A又はレフルノミドの少なくとも1種を含む少なくとも1種の治療上有効な線維性癒着抑制剤、及び少なくとも1種の薬学上許容可能な賦形剤、キャリア又は希釈剤を含む組成物。
- 線維性癒着を抑制するように構成される医薬組成物であって、線維性癒着を抑制するように選択される治療上有効量のフカン、及び治療上有効量の少なくとも1種の抗腫瘍剤を含む少なくとも1種の治療上有効な線維性癒着抑制剤、及び少なくとも1種の薬学上許容可能な賦形剤、キャリア又は希釈剤を含む組成物。
- 抗腫瘍剤が、アルキル化剤、代謝抑制剤、リボヌクレオチド還元酵素阻害剤、細胞傷害性抗生物質、タキサン、ビンカアルカロイド又はプロテアーゼ阻害剤の少なくとも1種を含む請求項91の医薬組成物。
- 線維性癒着を抑制するように構成される医薬組成物であって、線維性癒着を抑制するように選択される治療上有効量のフカン、及び治療上有効量の、ブスルファン、シクロホスファミド、エストラムスチン、シスプラチン、デカルバジン、ヒドロキシウレア、ミトタン、ドセタキセル、硫酸ビンブラスチン又はMG132の少なくとも1種を含む少なくとも1種の治療上有効な線維性癒着抑制剤、及び少なくとも1種の薬学上許容可能な賦形剤、キャリア又は希釈剤を含む組成物。
- 線維性癒着を抑制するように構成される医薬組成物であって、線維性癒着を抑制するように選択される治療上有効量のフカン、及び治療上有効量の少なくとも1種の抗炎症剤を含む少なくとも1種の治療上有効な線維性癒着抑制剤、及び少なくとも1種の薬学上許容可能な賦形剤、キャリア又は希釈剤を含む組成物。
- 抗炎症剤が、COX−2阻害剤、フェナメート、オキシカム、アセチル酸誘導体、サリチル酸誘導体又はコルチコステロイドの少なくとも1種を含む請求項94の医薬組成物。
- 線維性癒着を抑制するように構成される医薬組成物であって、線維性癒着を抑制するように選択される治療上有効量のフカン、及び治療上有効量の、ニメスリド、メクロフェナン酸、ジクロフェナック、メクロフェナン酸ナトリウム一水和物、テノキシカム、インドメタシン、アセチルサリチル酸、ジフルニサル、ベタメタゾン、ブデソニド、デキサメタゾン又は酢酸コルチゾンの少なくとも1種を含む少なくとも1種の治療上有効な線維性癒着抑制剤、及び少なくとも1種の薬学上許容可能な賦形剤、キャリア又は希釈剤を含む組成物。
- 線維性癒着を抑制するように構成される医薬組成物であって、線維性癒着を抑制するように選択される治療上有効量のフカン、及び治療上有効量の少なくとも1種のSDF−1阻害剤を含む少なくとも1種の治療上有効な線維性癒着抑制剤、及び少なくとも1種の薬学上許容可能な賦形剤、キャリア又は希釈剤を含む組成物。
- SDF−1阻害剤が、抗SDF−1アンチセンスオリゴヌクレオチド(ASO)、抗SDF−1小分子RNA、抗SDF−1siRNA、抗SDF−1リゾチーム、SDF−1の小分子阻害剤、抗SDF−1アプタマー、抗SDF−1抗体又は抗hSDF−1/PBSFの少なくとも1種を含む請求項97の医薬組成物。
- 線維性癒着を抑制するように構成される医薬組成物であって、線維性癒着を抑制するように選択される治療上有効量のフカン、並びに治療上有効量の、デキストラン硫酸、SDF−1阻害剤、シスプラチン、ドセタキセル、ベタメタゾン、TIMP−2、エリスロマイシン、及びコンドロイチン硫酸Aの少なくとも1種を含む少なくとも1種の治療上有効な線維性癒着抑制剤、並びに少なくとも1種の薬学上許容可能な賦形剤、キャリア又は希釈剤を含む組成物。
- フカンがフコイダンである請求項89〜99のいずれか1項の医薬組成物。
- 線維性癒着を治療するための薬物の製造における使用のための請求項89〜99のいずれか1項の医薬組成物。
- ヒト患者において線維性癒着に関連する症状を軽減できる薬物の製造方法であって、薬学上有効量のフコイダン、線維性癒着を抑制するように選択されるフコイダン以外の、治療上有効量の、請求項89〜99のいずれか1項の少なくとも1種の治療上有効な作用剤、及び薬学上許容可能な賦形剤又は緩衝液を含む方法。
- 動物において少なくとも1種の非線維性癒着の疾患又は非線維性癒着の症状を治療する方法であって、非線維性癒着の疾患又は症状を同定すること、非線維性癒着の疾患又は症状のための少なくとも1種の治療剤を選択すること、少なくとも1種の線維性癒着抑制剤を選択すること、治療上有効量の、非線維性癒着の疾患又は症状のための少なくとも1種の治療剤及び治療量の、少なくとも1種の線維性癒着抑制剤を含む少なくとも1種の医薬組成物を動物を投与することを含む方法。
- 症状が少なくとも1種の外科的又は機械的な損傷である請求項103の方法。
- 疾患が、癌、PID、放射線暴露、関節炎、乾癬、手術、局所症状、又は消化器の疾患の少なくとも1つである請求項103の方法。
- 少なくとも1種の線維性癒着抑制剤がフカンを含む請求項103〜105のいずれか1項の方法。
- 少なくとも1種の線維性癒着抑制剤がフコイダンである請求項103〜105のいずれか1項の方法。
- 少なくとも1種の線維性癒着抑制剤が、抗hSDF−1/PBSF抗体、及びベタメタゾン、コンドロイチン硫酸A、デキストラン硫酸、エリスロマイシン及びTIMP−2の少なくとも1種を含む請求項103〜107のいずれか1項の方法。
- 非線維性癒着の疾患又は症状のための少なくとも1種の治療剤が抗炎症剤及び抗腫瘍剤を含む請求項103〜107のいずれか1項の方法。
- 非線維性癒着の疾患又は症状のための少なくとも1種の治療剤が、SDF−1阻害剤、イオンキレート剤、トリエンマクロライド抗生物質、3−ヒドロキシ−3−メチルグルテリル−CoA還元酵素阻害剤、レチノイド、抗血栓剤、抗凝固剤、プラスミノーゲン活性化剤、サイトカイン、マトリクスメタロプロテイナーゼ阻害剤、テトラサイクリン、ACE阻害剤、エリスロマイシン、デキストラン糖、コハク酸、コラーゲン、ケルセチン二水和物、レフルノミド、ヒドロキシプロピルセルロース、スタキオース、コンドロイチン硫酸A、アルキル化剤、代謝抑制剤、リボヌクレアーゼ還元酵素阻害剤、細胞傷害性抗生物質、タキサン、ビンカ・アルカロイド、プロテアーゼ阻害剤、COX−2阻害剤、フェナメート、オキシカム、アセチル酸誘導体、サリチル酸誘導体、又はコルチコステロイドの少なくとも1種を含む請求項103〜107のいずれか1項の方法。
- 非線維性癒着の疾患又は症状のための少なくとも1種の治療剤及び治療量の少なくとも1種の線維性癒着抑制剤が少なくとも2種の異なった組成物にあり、方法が、該組成物を実質的に同時に投与することをさらに含む請求項103〜107のいずれか1項の方法。
- 動物がヒトである請求項103〜111のいずれか1項の方法。
- 動物において少なくとも1種の非線維性癒着の疾患又は非線維性癒着の症状を治療し、且つ繊維性癒着を抑制するように構成された医薬組成物であって、非線維性癒着の疾患又は症状を治療するように選択される非線維性癒着の疾患又は症状のための治療上有効量の少なくとも1種の治療剤、繊維性癒着を抑制するように選択される治療上有効量の少なくとも1種の線維性癒着抑制剤、及び少なくとも1種の薬学上許容可能な賦形剤、キャリア又は希釈剤を含む組成物。
- 組成物が、フィルム、貼付剤、ペースト、ミクロスフェア、インプラント、ゲル、スプレー、液体又は点滴用剤を含むポリマー投与形態である請求項113の医薬組成物。
- 少なくとも1種の線維性癒着抑制剤がフカンを含む請求項113の医薬組成物。
- 動物において少なくとも1種の非線維性癒着の疾患又は非線維性癒着の症状を治療するための、且つ繊維性癒着を抑制するための薬物の製造における使用のための請求項113〜115のいずれか1項の医薬組成物。
- ヒト患者において少なくとも1種の非線維性癒着の疾患又は非線維性癒着の症状に関連する症状を軽減し、且つ繊維性癒着に関連する症状を抑制することができる薬物の製造方法であって、非線維性癒着の疾患又は症状を治療するように選択される非線維性癒着の疾患又は症状のための少なくとも1種の治療上有効量の治療剤、繊維性癒着を抑制するように選択される治療上有効量の少なくとも1種の線維性癒着抑制剤、及び少なくとも1種の薬学上許容可能な賦形剤、キャリア又は希釈剤を単一の組成物において組み合わせることを含む方法。
- 動物において線維性癒着を抑制する方法であって、線維性癒着を抑制する作用剤を選択すること及び線維性癒着を有することが疑われる部位に治療上有効量の作用剤を含む医薬組成物を投与することを含み、該組成物が、いかなる線維性癒着抑制剤も含まないヒアルロン酸フィルムに比べて少なくとも約90%の線維性癒着を抑制するように構成される方法。
- 組成物が、いかなる線維性癒着抑制剤も含まないヒアルロン酸フィルムに比べて少なくとも約99%の線維性癒着を抑制するように構成される請求項118の方法。
- 組成物が、実質的にすべての線維性癒着を抑制するように構成される請求項118の方法。
- 組成物がフカンを含む請求項118〜120のいずれか1項の方法。
- 組成物がフコイダンを含む請求項118〜120のいずれか1項の方法。
- 組成物が点滴用剤を含む請求項118〜122のいずれか1項の方法。
- 動物において線維性癒着を抑制するように構成された医薬組成物であって、選択された線維性癒着抑制剤を含み、該組成物が、いかなる線維性癒着抑制剤も含まないヒアルロン酸フィルムに比べて少なくとも約90%の線維性癒着を抑制するように構成される組成物。
- 組成物が、いかなる線維性癒着抑制剤も含まないヒアルロン酸フィルムに比べて少なくとも約99%の線維性癒着を抑制するように構成される請求項124の医薬組成物。
- 組成物が、実質的にすべての線維性癒着を抑制するように構成される請求項請求項124のいずれか1項の医薬組成物。
- 組成物がフカンを含む請求項124〜126のいずれか1項の医薬組成物。
- 組成物がフコイダンを含む請求項124〜126のいずれか1項の医薬組成物。
- 組成物が点滴用剤を含む請求項124〜128のいずれか1項の医薬組成物
- 請求項89〜101、113〜116、124〜129のいずれか1項に記載の組成物を含有する容器及び線維性癒着を抑制するために医薬的に使用するための指示書を含むラベルを含むキット。
- ラベルがFDA認可のラベルである請求項130のキット。
- 容器が点滴用剤を保持するように構成されるバイアルである請求項130又は131のキット。
- ラベルが、少なくとも1種の非線維性癒着の疾患又は非線維性癒着の症状を治療するための組成物の医薬的使用に関する指示書をさらに含む請求項130〜132のいずれか1項のキット。
Applications Claiming Priority (10)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US47490703P | 2003-05-30 | 2003-05-30 | |
| US47765403P | 2003-06-10 | 2003-06-10 | |
| US50525703P | 2003-09-22 | 2003-09-22 | |
| US50525803P | 2003-09-22 | 2003-09-22 | |
| US52080403P | 2003-11-17 | 2003-11-17 | |
| US52057403P | 2003-11-17 | 2003-11-17 | |
| US52080803P | 2003-11-17 | 2003-11-17 | |
| US52913603P | 2003-12-11 | 2003-12-11 | |
| US53366903P | 2003-12-31 | 2003-12-31 | |
| PCT/CA2004/000800 WO2004105737A2 (en) | 2003-05-30 | 2004-05-28 | Pharmaceutical compositions and methods relating to inhibiting fibrous adhesions using various agents |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2007504273A true JP2007504273A (ja) | 2007-03-01 |
| JP2007504273A5 JP2007504273A5 (ja) | 2007-07-19 |
Family
ID=33494425
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006529506A Withdrawn JP2007504273A (ja) | 2003-05-30 | 2004-05-28 | 種々の作用剤を用いた、線維性癒着の抑制に関する医薬組成物及び方法 |
Country Status (8)
| Country | Link |
|---|---|
| EP (1) | EP1631265A2 (ja) |
| JP (1) | JP2007504273A (ja) |
| KR (1) | KR20060034227A (ja) |
| AU (1) | AU2004243513A1 (ja) |
| BR (1) | BRPI0418384A (ja) |
| CA (1) | CA2527429A1 (ja) |
| TW (1) | TW200509949A (ja) |
| WO (1) | WO2004105737A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021531305A (ja) * | 2018-07-27 | 2021-11-18 | エーアールシー メディカル デバイス,インク. | 線維性癒着の処置のための高硫酸化フカン |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2729826T3 (es) * | 2004-09-23 | 2019-11-06 | Arc Medical Devices Inc | Composiciones farmacéuticas y métodos relacionados para inhibir adherencias fibrosas o enfermedad inflamatoria usando fucanos con bajo contenido de sulfato |
| WO2006114115A1 (de) * | 2005-04-26 | 2006-11-02 | Trion Pharma Gmbh | Kombination von antikörpern mit glukokortikoiden zur behandlung von krebs |
| CA2607913C (en) * | 2005-05-05 | 2014-03-18 | Cook Biotech Incorporated | Implantable materials and methods for inhibiting tissue adhesion formation |
| DE102005023170A1 (de) * | 2005-05-19 | 2006-11-23 | Curevac Gmbh | Optimierte Formulierung für mRNA |
| US8426381B2 (en) | 2005-09-09 | 2013-04-23 | Lucas Meyer Cosmetics Canada Inc. | Polysaccharides compositions comprising fucans and galactans and their use to reduce extravasation and inflammation |
| DE102008005172A1 (de) * | 2008-01-19 | 2009-07-23 | Mike Ehrlich | Pharmazeutische Zusammensetzung zur Verhinderung von post-operativen Adhäsionen |
| US8865668B2 (en) | 2008-02-20 | 2014-10-21 | Devgen N.V. | Methods and compositions for increasing RNA interference |
| US8440237B2 (en) | 2009-04-27 | 2013-05-14 | Mary Kay Inc. | Botanical anti-acne formulations |
| JO3676B1 (ar) | 2009-07-27 | 2020-08-27 | Arc Medical Devices Inc | مركبات صيدلانية تضم فوكانات معدلة وطرق تتعلق بها |
| SG185389A1 (en) | 2010-05-03 | 2012-12-28 | Teikoku Pharma Usa Inc | Non-aqueous taxane pro-emulsion formulations and methods of making and using the same |
| TWI382841B (zh) | 2010-10-29 | 2013-01-21 | Univ China Medical | 用於抑制發炎之醫藥組合物 |
| US8936635B2 (en) | 2011-03-23 | 2015-01-20 | Palmetto Pharmaceuticals Llc | Bioresorbable nitric oxide agonist prodrug scaffolds for vascular stents |
| US20130095160A1 (en) * | 2011-09-12 | 2013-04-18 | Gautam S. GHATNEKAR | Resorbable polystatin biomaterials |
| CN107961192B (zh) | 2011-12-19 | 2021-09-24 | 玫琳凯有限公司 | 包含红豆提取物的组合物的用途 |
| JO3685B1 (ar) | 2012-10-01 | 2020-08-27 | Teikoku Pharma Usa Inc | صيغ التشتيت الجسيمي للتاكسين غير المائي وطرق استخدامها |
| US9707323B2 (en) | 2012-11-12 | 2017-07-18 | Warsaw Orthopedic, Inc. | Devices and methods for inhibiting adhesion formation |
| US9474767B2 (en) | 2012-11-12 | 2016-10-25 | Warsaw Orthopedic, Inc. | Compositions and methods for inhibiting bone growth |
| US9421221B2 (en) | 2012-11-12 | 2016-08-23 | Warsaw Orthopedic, Inc. | Compositions and methods for inhibiting adhesion formation |
| ITTO20130317A1 (it) * | 2013-04-19 | 2014-10-20 | Idea Medical Devices S R L | Dispositivo medico comprendente una struttura di supporto a base di chitosano |
| CN103267842B (zh) * | 2013-05-15 | 2016-03-02 | 郭杰标 | 检测中成药违法添加双氯芬酸的免疫胶体金方法 |
| CN105339019A (zh) | 2013-05-29 | 2016-02-17 | 株式会社大塚制药工场 | 防粘连材料 |
| US9566296B2 (en) | 2013-11-08 | 2017-02-14 | Warsaw Orthopedic, Inc. | Multi-layered anti-adhesion device |
| US9849077B2 (en) | 2014-03-10 | 2017-12-26 | Mary Kay Inc. | Skin lightening compositions |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS57167919A (en) * | 1981-04-07 | 1982-10-16 | Hirozo Ohira | Preventing agent for intraperitoneal adhesion |
| US5605938A (en) * | 1991-05-31 | 1997-02-25 | Gliatech, Inc. | Methods and compositions for inhibition of cell invasion and fibrosis using dextran sulfate |
| US5266326A (en) * | 1992-06-30 | 1993-11-30 | Pfizer Hospital Products Group, Inc. | In situ modification of alginate |
| US6150581A (en) * | 1995-06-07 | 2000-11-21 | United States Surgical Corporation | Chitosan/alginate anti-adhesion barrier |
| KR20010010151A (ko) * | 1999-07-16 | 2001-02-05 | 김윤 | 수용성 알긴산염과 카르복시메틸 셀룰로오스를 주성분으로 하는 유착방지제 및 그의 제조방법 |
| KR20010107067A (ko) * | 2000-05-25 | 2001-12-07 | 김정식 | 유착방지제 |
| US6812220B2 (en) * | 2001-08-29 | 2004-11-02 | University Of British Columbia | Pharmaceutical compositions and methods relating to fucans |
| KR100523953B1 (ko) * | 2002-08-27 | 2005-10-25 | 주식회사 엘지생명과학 | 천연다당류와 히알루론산의 마이크로비드 및 이의 제조 방법 |
-
2004
- 2004-05-28 AU AU2004243513A patent/AU2004243513A1/en not_active Abandoned
- 2004-05-28 WO PCT/CA2004/000800 patent/WO2004105737A2/en active Application Filing
- 2004-05-28 KR KR1020057022983A patent/KR20060034227A/ko not_active Application Discontinuation
- 2004-05-28 EP EP04735180A patent/EP1631265A2/en not_active Withdrawn
- 2004-05-28 CA CA002527429A patent/CA2527429A1/en not_active Abandoned
- 2004-05-28 BR BRPI0418384-3A patent/BRPI0418384A/pt not_active IP Right Cessation
- 2004-05-28 JP JP2006529506A patent/JP2007504273A/ja not_active Withdrawn
- 2004-05-31 TW TW093115497A patent/TW200509949A/zh unknown
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021531305A (ja) * | 2018-07-27 | 2021-11-18 | エーアールシー メディカル デバイス,インク. | 線維性癒着の処置のための高硫酸化フカン |
| US11628183B2 (en) | 2018-07-27 | 2023-04-18 | ARC Medical Ine. | Highly purified fucans for the treatment of fibrous adhesions |
| US11642368B2 (en) | 2018-07-27 | 2023-05-09 | ARC Medical Inc. | Highly purified and/or modified fucan compositions for the treatment of fibrous adhesions |
| JP7272707B2 (ja) | 2018-07-27 | 2023-05-12 | エーアールシー メディカル デバイス,インク. | 線維性癒着の処置のための高硫酸化フカン |
Also Published As
| Publication number | Publication date |
|---|---|
| TW200509949A (en) | 2005-03-16 |
| WO2004105737A2 (en) | 2004-12-09 |
| KR20060034227A (ko) | 2006-04-21 |
| BRPI0418384A (pt) | 2007-06-26 |
| CA2527429A1 (en) | 2004-12-09 |
| AU2004243513A1 (en) | 2004-12-09 |
| WO2004105737A3 (en) | 2005-06-09 |
| EP1631265A2 (en) | 2006-03-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20200338114A1 (en) | Pharmaceutical compositions and methods relating to inhibiting fibrous adhesions or inflammatory disease using low sulphate fucans | |
| JP2007504273A (ja) | 種々の作用剤を用いた、線維性癒着の抑制に関する医薬組成物及び方法 | |
| JP2007504273A5 (ja) | ||
| AU2002325113B2 (en) | Use of fucans in the treatment of adhesions, arthritis and psoriasis | |
| AU2002325113A1 (en) | Use of fucans in the treatment of adhesions, arthritis and psoriasis | |
| US20070238697A1 (en) | Pharmaceutical compositions and methods relating to fucans | |
| JP2019142896A (ja) | 線維性癒着及び他の疾患の治療に用いる変性フカンを含む医薬組成物 | |
| US20170252367A1 (en) | Pharmaceutical compositions and methods relating to inhibiting fibrous adhesions or inflammatory disease using low sulphate fucans | |
| AU2007200318A1 (en) | Use of fucans in the treatment of adhesions, arthritis and psoriasis | |
| EP1870105A1 (en) | Use of fucans in the treatment of psoriasis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070525 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070525 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070601 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20090529 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20090529 |