JP2006510740A - 出血と関連した神経系障害を治療する方法 - Google Patents
出血と関連した神経系障害を治療する方法 Download PDFInfo
- Publication number
- JP2006510740A JP2006510740A JP2005507039A JP2005507039A JP2006510740A JP 2006510740 A JP2006510740 A JP 2006510740A JP 2005507039 A JP2005507039 A JP 2005507039A JP 2005507039 A JP2005507039 A JP 2005507039A JP 2006510740 A JP2006510740 A JP 2006510740A
- Authority
- JP
- Japan
- Prior art keywords
- tudca
- bleeding
- administration
- bcl
- patient
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/575—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of three or more carbon atoms, e.g. cholane, cholestane, ergosterol, sitosterol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
Landscapes
- Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Steroid Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Saccharide Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
ウルソデオキシコール酸(UDCA)、その塩、およびその類似物(たとえば糖、タウロ(tauro)、ウルソデオキシコール酸(UDCA)、および他の共結合誘導体)などの親水性胆汁酸を投与することにより出血を伴う神経系障害を治療するための方法。
Description
出血性発作は脳血管に破壊的な症状を残し、推定される発生率が100,000人当り15から35人であり、そして死亡率が50%に近づいている。最近の発作による生存者が約2.9百万人であり、その大部分が身体に重篤な障害を負っている。データでは、発作の10-15%が脳内出血の結果であり、従って発作生存者が300.000から450,000人占めている。主な脳内出血(ICH)のリスク要因は、高血圧、外傷性傷害(trauma)、動静脈の奇形や腫瘍があげられる。
出血性発作や虚血性発作などの中枢神経系の急性疾患は、通常遅発性の神経細胞死の結果である。正確な脳障害の機構がまだ十分に理解されていないが、計画的細胞死としてのアポトーシスが、重要な役割を果たしていると、多くの研究が示唆している。浸出する血液産生物と組織反応を起こし、その結果虚血、浮腫、強い炎症が起こり、最終的に細胞死となることから、塊状の血餅による影響が二次障害を高めると考えられる。出血性発作から細胞死への機構は複雑であり、ネクローシスからアポトーシスに及ぶ相互作用に関与すると見られる。
しかしながら、脳内虚血から再潅流した後に細胞は、クロマチンの縮重、TUNELの標識化、およびカスパーゼの活性化を含む幾つかのアポトーシスの特徴を示すことが認められた。さらにアポトーシスの特徴的兆候が、出血性発作後の脳内に示されている。それにもかかわらず出血発作後の神経細胞の欠失機構が、実験モデルが十分ではないことから記載があまり十分でない。
ウルソデオキシコール酸(UDCA)は内在性の胆汁酸であり、その胆汁酸がここ数十年にわたり種々の肝臓疾患の治療に臨床的に使用されてきた。UDCAやタウロ・ウルソデオキシコール酸(TUDCA)などの結合誘導体が、肝細胞と非肝細胞の両方のアポトーシス閾値を調節する際に独特の役割を果たすという、こうした観察が、これらの分子の生物的役割を拡大した。UDCAとTUDCAがミトコンドリア膜を安定にし、ミトコンドリア膜の脱分極やチャンネルの生成、ある種の活性酸素種の産生、シトクローム Cの放出、カスパーゼの活性化、および核様酵素ポリ(ADP-リボース)ポリメラーゼの切断を含む、アポトーシス事態(events)の幾つかを防止する。
さらにUDCAが、マイトゲン-活性化タンパク質キナーゼの生存経路の強力な活性化剤である。最後に最近の報告においてTUDCAを投与すると、ハンチントン病を化学的に誘発された動物、およびその病気のトランスゲニックな動物モデルばかりか、急性虚血性発作に対する神経細胞が保護された。ラットの中脳動脈を閉塞した後にTUDCAを静脈内へ投与すると、ミトコンドリア膜の異状(perturbation)や、下流のアポトーシスと関連するカスパーゼ活性を有意に減少させながら、細胞死を保護し閉塞ザイズを減少させ、そして神経機能を改善させる。
外科治療や医薬治療は共に、出血性発作後の罹病率や死亡率の減少に全く効果がなく、そして虚血性発作の患者の治療のこうした患者の臨床試験が、全く遅れている。出血性発作に伴い拡大する細胞死を緩和し、そして出血に伴う他の神経系障害を緩和する治療剤が、切迫して必要となっている。
要約
本発明は、出血と関連した神経系障害(特定例として中枢神経系の障害)を有する患者の治療方法を提供する。好ましくは患者がヒトであり、そして投与工程が、ウルソデオキシコール酸(UDCA)、その塩、その類似物、又はそれを組み合わせた物の有効量の投与を含む。 本発明の1の観点は、ウルソデオキシコール酸(UDCA)、その塩、その類似物(たとえば糖結合物、タウロ結合物およびその他の結合誘導物)又はそれを組み合わせた物の有効量にて、患者へ投与する工程を含む方法を提供する。好ましい投与工程は、非経口又は経口投与があげられる。
本発明は、出血と関連した神経系障害(特定例として中枢神経系の障害)を有する患者の治療方法を提供する。好ましくは患者がヒトであり、そして投与工程が、ウルソデオキシコール酸(UDCA)、その塩、その類似物、又はそれを組み合わせた物の有効量の投与を含む。 本発明の1の観点は、ウルソデオキシコール酸(UDCA)、その塩、その類似物(たとえば糖結合物、タウロ結合物およびその他の結合誘導物)又はそれを組み合わせた物の有効量にて、患者へ投与する工程を含む方法を提供する。好ましい投与工程は、非経口又は経口投与があげられる。
神経系障害は、典型的に出血の存在と特徴付けがされ、そしてそれと関連付けられた脳、および/又は脊髄障害である。たとえば出血に関連した神経系障害が、出血性発作、頭部外傷障害(head trauma)、脊髄損傷又は抹消神経障害となる可能性がある。本明細書における「患者」が、ヒツジ、ウマ、家畜、ブタ、イヌ、ネコなどを含む。好ましい対象が、ヒト又は他の哺乳動物である。
図示的な例による詳細な説明
本発明は、出血に関連した神経系障害を有する患者の治療方法を提供する。現段階で、出血に関連した細胞死を減少させる有効な治療法がない。神経系障害は、出血の存在で特徴付けられる神経線維の傷害である。たとえば、出血に関連した神経系障害は、出血性発作、頭部外傷、脊髄傷害又は抹消神経傷害の可能性がある。好ましくはその障害が、出血性の発作であり、それが一体性のある血管の破断により、実際に脳物質へ血流することを特徴付ける。これは、主に脳内の所定領域への血流閉塞により特徴付けられる、虚血性発作と明らかに相違する。典型的に虚血性発作が、関連する出血を有しないが、その領域の浮腫と関連可能である。
本発明は、出血に関連した神経系障害を有する患者の治療方法を提供する。現段階で、出血に関連した細胞死を減少させる有効な治療法がない。神経系障害は、出血の存在で特徴付けられる神経線維の傷害である。たとえば、出血に関連した神経系障害は、出血性発作、頭部外傷、脊髄傷害又は抹消神経傷害の可能性がある。好ましくはその障害が、出血性の発作であり、それが一体性のある血管の破断により、実際に脳物質へ血流することを特徴付ける。これは、主に脳内の所定領域への血流閉塞により特徴付けられる、虚血性発作と明らかに相違する。典型的に虚血性発作が、関連する出血を有しないが、その領域の浮腫と関連可能である。
本明細書に記載された化合物が、虚血性発作の治療物質として知られ、出血性発作又は出血性発作と関連した固有の傷害としての他の神経系障害の治療物質として使用できることは、予期されないことであった。細胞死が、アポトーシス、ネクローシス、そして/又はネクロープトシスと関連しているかどうか判らなかった。早期細胞死(典型的に虚血性発作において発生する)が、典型的なネクローシスの結果であり、一方遅発性細胞死(典型的に出血性発作に発生)が、典型的なアポトーシスの結果である。
本発明の方法は、親水性胆汁酸、その塩、その類似物又はその組み合わせた物を使用することを含む。本明細書に使用された親水性胆汁酸は、デオキシコール酸(DCA)より有意な親水性物質である。これは、水とオクタノール間の分画係数を評価することにより決定でき、ここで親水性が有意的に高い胆汁酸が、水に対して非常に好ましい。選択肢として、親水性胆汁酸が有意に高くなると、高速液化クロマトグラフィを使用する逆相カラム上での保持時間が有意に早くなる。
特に好ましい親水性胆汁酸は、ウルソデオキシコール酸を含む。親水性胆汁酸に類似する例が、胆汁酸の結合誘導体を含む。特に好ましい2種の結合誘導体は、グリコ-ウルソデオキシコール酸とタウロ-ウルソデオキシコール酸を含む。他の結合誘導体は、ウルソデオキシコール酸の3-サルフェート、ウルソデオキシコール酸の7-サルフェート、およびウルソデオキシコール酸の3,7-サルフェートを含む。
全ての親水性胆汁酸が、本発明の全ての方法に有効であるわけではないが、これらが、アポトーシスを誘発する周知の薬剤を使用し、細胞培養系におけるアポトーシスを抑制できることを、試験により容易に評価することができる。こうした化合物が、神経系障害の治療のための有効量にて使用され、これは予防的治療と療法的治療の両方の意味がある。その治療は療法的治療が好ましい。たとえばその治療を、出血性発作、自動車事故による頭部外傷、たとえば仕事などと関連し抹消神経の障害を有する患者へ適用する。典型的治療をできるだけ早く開始し、切迫した細胞死を減少させることである。予防的な使用は、主に重篤な高血圧患者など出血性発作の危険性の高い患者に対しそれを取り除くことである。
本発明の方法に使用する化合物の「有効量」は、その投与レベルが、出血による障害発生を予防し、減少させ、阻害又は抑制させるに有効な量である。
本発明の方法においてこうした化合物が、もしそれを所望する場合、さらに医薬的に受け入れ可能な担体を含む組成物の形にて使用できる。典型的に好ましい例として、本明細書に記載の化合物を医薬組成物にて処方し、さらに本発明の方法に従って、ヒトの患者などへ、典型的に哺乳動物へ、選択された投与経路に適合した多様な形にて投与する。その処方が、経口、直腸、膣、局所的、鼻、眼又は非経口(皮下、筋肉内、腹腔内、静脈内、鞘内、心室内、脳組織へ直接注入などを含む)により投与に適した処方を含む。
本発明の方法においてこうした化合物が、もしそれを所望する場合、さらに医薬的に受け入れ可能な担体を含む組成物の形にて使用できる。典型的に好ましい例として、本明細書に記載の化合物を医薬組成物にて処方し、さらに本発明の方法に従って、ヒトの患者などへ、典型的に哺乳動物へ、選択された投与経路に適合した多様な形にて投与する。その処方が、経口、直腸、膣、局所的、鼻、眼又は非経口(皮下、筋肉内、腹腔内、静脈内、鞘内、心室内、脳組織へ直接注入などを含む)により投与に適した処方を含む。
従来のようにその処方が投与量単位の形で提示でき、そして薬理技術によるいずれか周知の方法で調製できる。全ての方法が、担体に関連した化合物の活性をもたらす工程を含み、それが1又は複数の補助成分を含むことができる。一般的な処方剤は、液体の担体、細分割した固体担体、又はその両方の担体に関係付けられた化合物の活性を均一にそして緊密に発生させ、さらに必要であればその生成物を所望の処方物中へ成型し、調製することができる。
経口投与として適切な本発明の処方剤が、錠剤、トローチ、カプセル、ロゼンジ、ウエハー、又はカシエー(cachets)などの個別単位に提示でき、それぞれが、粉末状の顆粒状として、リポゾーム内に組み入れられた状態、あるいはシロップ、エレキシル、乳液、又はドラウト(draught)などの水溶性又は非水溶性の溶液又は懸濁液に、所定量のアポトーシス制限化合物を含む。
さらに錠剤、トローチ、ピル、カプセルなどが、1又は複数の以下のものを含むことができる、すなわちガム・トラガカント、アカシア、コーンスターチ又はゲラチンなどの結合剤;燐酸二カルシウムなどの賦形剤;コーンスターチ、ポテトスターチ、アルギン酸などの膨化剤;ステアリン酸マグネシウムなどの潤滑剤、サッカローズ、フラクトース、ラクトース又はアスパルテームなどの甘味剤;および天然又は人工香味剤があげられる。さらにカプセルの場合の単位投与量の形状が、植物油又はポリエチレン・グリコールなど液状担体を含むことができる。
その他種々の物質を、被覆剤として又はその他には固体の単位投与量の形として、物理的形状を変更し提示することができる。たとえば錠剤、ピル、又はカプセルは、ゲラチン、ワックス、シェラック、又は砂糖などによって被覆することができる。シロップ又はエレキシルは、1又は複数の甘味剤、メチルパラベン又はプロピルパラベンなどの防腐剤、砂糖の結晶化を遅延させる素剤、多価アルコール、たとえばグリセロール又はソルビトールなど他のいずれかの成分の溶解性を増大させる素剤、染料、および香味剤を含むことができる。単位投与量のいずれかの形状を調製する場合使用される素材が、使用される量で実質的に毒性のないことである。その化合物が継続的に放出される調製物、およびデバイスに組み入れることができる。
本発明の方法において使用に適した化合物が、患者の飲食物としての食品、添加物、補給物などへ直接組み入れることができる。従ってさらに本発明は食品生成物を提供する。すでにパン、穀粒、ミルクなど滋養補給又は滋養強化資源として使用されている処理食品を、本目的のために使用することが極めて都合が良く、本食品のいずれかがこの目的に適合している。
従来の非経口投与として適切な処方剤が、所望の化合物の無菌の水溶性調製物、又は所望の化合物の分散性の無菌粉末物を含み、それが受容者の血液と等張であることが好ましい。液体調製物に含むことができる等張剤は、砂糖、緩衝液および食塩などの塩を含む。所望の化合物の溶液を水にて調製可能であり、所望により非毒性界面活性剤と混合し調製することができる。
所望の化合物の分散液を水、エタノール、ポリオール(グリセロール、プロピレングリコール、液化ポリエチレン・グリコールなど)、植物オイル、グリセロール・エステル、およびその混合液にて調製することができる。最終的に投与された状態は、製造および保存状態で無菌であり、液状で且つ安定なことである。たとえば必要な流動性はリポソームを使用し、分散には適切な粒子サイズを使用し又は界面活性剤を用いて行われる。液体調製物の無菌化は、所望の化合物の生物活性を保持する従来方法によって、好ましくは滅菌フイルターにより行うことができる。
粉末を調製する好ましい方法は、注入可能な滅菌溶液の真空乾燥および凍結乾燥を含む。その結果微生物に対する汚染が、種々の抗菌剤を用いて防止することができ、たとえばパラベン、クロロブタノール、フェノール、ソルビン酸、チロメサールなどを含む抗菌剤、抗ウイルス剤および抗真菌剤があげられる。延長期間を越える所望の化合物の吸着は、たとえばモノステアリン酸アルミニウムやゲラチンなどの遅延剤を含むことにより、実現できる。
鼻中へ噴霧する調製剤が、保存剤および等張剤と所望の純正な化合物の水溶液を含むことができる。こうした調製剤を、鼻の粘膜に適合したpHと等張状態に調節することが好ましい。pHと等張因子を眼の因子と適合するよう適切に調節することを除いて、眼炎の調製剤が、鼻へ噴霧する方法と類似の方法により調製される。直腸又は膣へ投与する調製剤が、ココアバターなど適切な担体、又は水素付加された脂肪又は水素付加された脂肪性カルボン酸を伴う座薬として提示できる。
典型的な調製物が、鉱油、石油、ポリヒドロキシアルコールなどの1又は複数の媒体に溶解され又は懸濁された所望の化合物、又は典型的な医薬調製物として使用するための別の基剤(base)を含むことができる。こうした調製物の例は、皮膚に使用する化粧用ローション、クリーム、又はサンクリームを含む。さらに前記成分に加え本発明の調製物が、希釈剤、緩衝液、結合剤、分解剤、表面活性剤、増粘剤、潤滑剤、保存剤(抗酸化剤)などを含む1又は複数のアクセサリー成分を含む。
本明細書に記載された所望化合物の有効な投与量を、動物モデルにおけるin vitroの活性とin vivoの活性とを比較し決定することができる。マウスや他の動物の有効量からヒトへの有効量を推定する方法が、技術的に周知である。一般的に成人のヒトに対して、注射、注入又は摂取投与量を、一般に約200 mg/日から約7000mg/日(すなわち1日当り、体重kg当り約15mgから50mgの投与量)まで変更可能である。
それは、1リットル以上の血清当り約10から約15μmolのレベルを生成するためには、たとえば1日当り1乃至3回投与することができる。これは、1回の薬物量を注射し更に傷害により24-48時間継続して滴下することができる。本発明の利点が以下の例により示されている。しかしながらこれらの例および他の条件そして詳細な事項に引用された特定物質およびその量は、技術的に広く適用できるよう解釈すべきであり、本発明を過度に限定して構成すべきでない。
以下の実施例において、さらにコラゲナーゼ誘発ICHモデルのアポトーシスの役割が、特徴付けられ、そしてTUDCAにて誘発され神経細胞を保護する性質および機構が正確に示された。特にTUDCAにて治療すると、神経細胞の死や変性が著しく減少する。さらにNF-κBの活性を有意に減少させ、Bcl-2のレベルを高い状態に維持し、そしてラットでは神経細胞の機能の改良が示された。さらにTUDCAの治療はAktを活性化し、Badの燐酸化を誘発し、そのため細胞の生存が促進される。従ってTUDCAなどの化合物が、独特で、非毒性の内因性の化合物であり、そして脳に対する出血性発作の治療のため、そして恐らく脳に対する他のアポトーシス関連障害の治療のための潜在的に有力な治療剤であると、決定することができる。
材料および方法
ICHのラットモデル、
アメリカ国内科学アカデミーにて作成され、そして(アメリカ厚生省の)国立衛生研究所(NIH公開番号86-23,改定1985)にて公開された「Guid for the Care and Use of Laboratory Animals」に記載されている研究所の案内指針に従って、全動物がヒトのケアーを受けている。メスのSprague-Dawleyラット(250-300グラム(g);Harlan Sprague-Dawley,Inc.,Indianapolis,IN)を、ケタミンとキシラジンの混合液による筋肉内注射にて麻酔し、コフ・ヘッドホルダー(Kopf headholder)に仰臥した位置に設定した。
ICHのラットモデル、
アメリカ国内科学アカデミーにて作成され、そして(アメリカ厚生省の)国立衛生研究所(NIH公開番号86-23,改定1985)にて公開された「Guid for the Care and Use of Laboratory Animals」に記載されている研究所の案内指針に従って、全動物がヒトのケアーを受けている。メスのSprague-Dawleyラット(250-300グラム(g);Harlan Sprague-Dawley,Inc.,Indianapolis,IN)を、ケタミンとキシラジンの混合液による筋肉内注射にて麻酔し、コフ・ヘッドホルダー(Kopf headholder)に仰臥した位置に設定した。
内側と外側へ分岐する右頚動脈を露出させ、その外部頚動脈の遠位端部を遊離し、内部頚動脈を直線的に引き入れた(retracted)。次にポリエチレン管、PE-10(Becton-Dickinson,Sparks,MD)を外側頚動脈から内側頚動脈へ導入し、そして前方を結合し、外部頚動脈を固定した。TUDCA(Calbicochem-Novabiochem Corp.,San Diego,CA)を、燐酸緩衝液にてpH7.4、ミリリッター当り400ミリグラム(mg/ml)にて溶解した。生理食塩水又はTUDCA溶液(体重キログラム当り1ミリリットル(ml/kg bw))を、内部頚動脈へ5分以内に直接注入した。異なる濃度のTUDCA(10,50,100および200mg/kg bw)を、コラゲナーゼ注入1時間前、又は注入1,3および6時間後に投与した。
最終的にポリエチレン管を取り出し、外部頚動脈の端部を焼杓し、さらにその傷を塞いだ。発作傷害を誘導するために動物を固定装置(stereotaxic apparatus)に配置し、さらにコラゲナイザーを注入しICHを誘導した(Rosenbergら、Stroke 1990;21:801-807 and Chesneyら、Stroke 1995;26:312-316)。簡単に言うと頭骨を曝して頭皮を介し正中線から切開を行った。0.5単位(U)の細菌性コラゲナーゼ(type VII;Sigma Chemical Co.,St.Louis,MO)を含む生理食塩水1-μlの(1分当り0.5μl(μl/min))の注入を、ハミルトン・シリンジ(Hamilton syringe)を用い、以下の座標位置に従い線条体に固定して行った、すなわちプレグマに対し前方に0.4ミリメータ(mm)、そして側方3.0mm、皮質面に対し下方5.0mmにて固定した。
いったん注入が終了すると、ハミルトン・シリンジ(Hamilton syringe)を所定の位置に3分間維持した。外科的操作を介してCMA/150温度調節装置により、体内の温度を37℃に維持した。そのラットを食料を有する籠内へ取り出し、そして白熱電球にて加温した。ICHに誘導2日後に神経細胞の試験を行った。次にその動物を犠牲にし、そして脳を取り出し、一連の冷却による切断処理か、RNAとタンパク質の抽出のいずれかに対し、-70℃に冷凍した。胆汁分析のために動物のサブセットにおける血清および脳の試料を採取した。
神経的試験
その動物を外科術後2日にアポモルヒネに応答した回転行動を試験した。アポモルヒネ(1mg/kg bw;Sigma Chemical Co.)を皮下注射し、そして回転を、コンピュータ制御によるColumbus Instruments Videomex-V system(Columbus,OH)により決定した。注射後5分毎に計数を行い60分間継続した。ICH2日後に最初の工程を、左右の前脚の歩く挙動を独立的に分析することにより評価した。この試験における動物を、一方の前肢と両方の後肢を拘束する方法にて固定した。自由な肢を、動物の体重が肢の中心となるように平面上に位置付けした。ラットが歩行運動を開始し、そして動物の体重が再度肢の中心となるように観察者がラットの位置を調節した。各肢により開始された歩数を、1分間計数した。
その動物を外科術後2日にアポモルヒネに応答した回転行動を試験した。アポモルヒネ(1mg/kg bw;Sigma Chemical Co.)を皮下注射し、そして回転を、コンピュータ制御によるColumbus Instruments Videomex-V system(Columbus,OH)により決定した。注射後5分毎に計数を行い60分間継続した。ICH2日後に最初の工程を、左右の前脚の歩く挙動を独立的に分析することにより評価した。この試験における動物を、一方の前肢と両方の後肢を拘束する方法にて固定した。自由な肢を、動物の体重が肢の中心となるように平面上に位置付けした。ラットが歩行運動を開始し、そして動物の体重が再度肢の中心となるように観察者がラットの位置を調節した。各肢により開始された歩数を、1分間計数した。
血腫の容量
行動試験の後ラットを犠牲にし、その脳を取り出し一連の冷凍切断をした。ICHのコアおよび周囲領域を含む出血損傷部の容量を、Nissl法により染色した後20μmの冷凍断面を均一な立体容量分析を用い定量した。容量分析を、Cavalieri's法(Howardら、Unbiiased stereology:three-dimensional measurement in microscopy.New York:BIOS Scientific Publishers Ltd 1998)により行った。損傷領域を、各動物が900μm離れた厚さ20μmの11のNissl染色断面部にて判定した。容積(mm3)を、公式V=Txa/pΣPiにより計算した、ここでV=関係容積、T=両断面部間の距離(mm)、a/p=各点との関連面積(mm2)、およびPi=各断面において対象をヒットする点である。
行動試験の後ラットを犠牲にし、その脳を取り出し一連の冷凍切断をした。ICHのコアおよび周囲領域を含む出血損傷部の容量を、Nissl法により染色した後20μmの冷凍断面を均一な立体容量分析を用い定量した。容量分析を、Cavalieri's法(Howardら、Unbiiased stereology:three-dimensional measurement in microscopy.New York:BIOS Scientific Publishers Ltd 1998)により行った。損傷領域を、各動物が900μm離れた厚さ20μmの11のNissl染色断面部にて判定した。容積(mm3)を、公式V=Txa/pΣPiにより計算した、ここでV=関係容積、T=両断面部間の距離(mm)、a/p=各点との関連面積(mm2)、およびPi=各断面において対象をヒットする点である。
TUNELの染色処理
コラゲナーゼ注入から2日後に、ラットを、アポトーシス細胞の末端のデオキシヌクレオチジルトランスフェラーゼ介在のdUTPのニック(nick)末端標識(TUNEL)のため犠牲にした。厚さ10μmの脳切片を、1%のホルムアルデヒドにて固定し、酢酸とエタノールとの溶液でー20℃にて後固定し、そしてpH7.4の燐酸緩衝液にて洗浄した。In situにおけるアポトーシス検出キットのApotag(Intergen Co.,Purchase,NY)を、製造業者の推薦によりTUNEL染色に使用した。簡単にいうと各動物に一連の同じ脳切片を、平衡緩衝液にてインキュウベートした。
コラゲナーゼ注入から2日後に、ラットを、アポトーシス細胞の末端のデオキシヌクレオチジルトランスフェラーゼ介在のdUTPのニック(nick)末端標識(TUNEL)のため犠牲にした。厚さ10μmの脳切片を、1%のホルムアルデヒドにて固定し、酢酸とエタノールとの溶液でー20℃にて後固定し、そしてpH7.4の燐酸緩衝液にて洗浄した。In situにおけるアポトーシス検出キットのApotag(Intergen Co.,Purchase,NY)を、製造業者の推薦によりTUNEL染色に使用した。簡単にいうと各動物に一連の同じ脳切片を、平衡緩衝液にてインキュウベートした。
末端のデオキシヌクレオチジルトランスフェラーゼとジゴキシゲニン-dNTPを、その切片へ加え37℃にて1時間(h)インキュウベートした。次にスライドを、抗-ジゴキシゲニン・パーオキシダーゼ溶液にて、30分間(min)処理し、DAB基質にて着色し、そして0.5%のメチルグリーンにて対比染色した。各動物に対し出血コアーに隣接する領域内において、少なくとも3個の無作為領域(400x)からコンピュータ・スクリーングリット上にて、TUNEL-正細胞の数を計数した。
DEVD特異的カスパーゼ活性
カスパーゼ活性を、同一半球領域や相当する対向領域から切断脳組織において判定した。その組織を、10mM Tris-HCl緩衝液、pH7.6、5mMのMgCl2、1.5mMのKAc、2mMのDTT、およびプロテアーゼ阻害剤カクテル錠剤(COMPLETE;Roche Diagnostics,GmbH,Mannheim,Germany)を含む単離緩衝液にて均一化(homogenized)した。
カスパーゼ活性を、同一半球領域や相当する対向領域から切断脳組織において判定した。その組織を、10mM Tris-HCl緩衝液、pH7.6、5mMのMgCl2、1.5mMのKAc、2mMのDTT、およびプロテアーゼ阻害剤カクテル錠剤(COMPLETE;Roche Diagnostics,GmbH,Mannheim,Germany)を含む単離緩衝液にて均一化(homogenized)した。
一般にカスパーゼ活性が、基質N-アセチル-Asp-Glu-Val-Asp-pNA(DEVD-pNA;Sigma CHemical Co.)から、発色団p-ニトロアニリド(pNA)の酵素切断により評価される。タンパク質分解反応を、50μgの細胞質ゾルタンパク質、および50μMのDEVD-pNAを含む単離緩衝液中で行った。反応混合物を37℃にて1時間インキュベートし、pNAの調製物を、96ウエル・プレートリーダを使用し405nmにて測定した。タンパク質濃度を、製造業者の明細書によりBio-Radタンパク質アッセイ・キット(Bio-Rad Laboratories,Hercules,CA)を用いて決定した。
RNAの単離およびRT-PCR
Bcl-2ファミリーにおける発現の変化を、RT-PCRにより判定した。全RNAをLife Technologies,Inc.(Grand Island,NY)からのTRIZOL試薬を使用し、脳組織から抽出した。RT-PCRのため5μgの全RNAを、オリゴ(dT)(IDT,Inc.,Coralville,IA)、およびSUPERSCRIPT II逆転写酵素(Life Technologies Inc.)を用い逆転写した。特定のオリゴヌクレオチド・プライマー対を、Roche Diagnostics,GmbHからExpand High Fidelity PCR Systemを用いPCR増幅のためcDNA鋳型を用いてインキュベートした。
Bcl-2ファミリーにおける発現の変化を、RT-PCRにより判定した。全RNAをLife Technologies,Inc.(Grand Island,NY)からのTRIZOL試薬を使用し、脳組織から抽出した。RT-PCRのため5μgの全RNAを、オリゴ(dT)(IDT,Inc.,Coralville,IA)、およびSUPERSCRIPT II逆転写酵素(Life Technologies Inc.)を用い逆転写した。特定のオリゴヌクレオチド・プライマー対を、Roche Diagnostics,GmbHからExpand High Fidelity PCR Systemを用いPCR増幅のためcDNA鋳型を用いてインキュベートした。
以下の配列を、プライマーとして使用した、すなわちBcl-2センスプライマーが、5'-CTGGTGGCAACATCGCTCTG-3'(配列番号1)、Bcl-2 抗センスプライマーが、5'-GGTCTGCTGACCTCACTTGTG-3'(配列番号2)、Bax センスプライマーが、5'-TGGTTGCCCTTTTCTACTTTG-3'(配列番号3)、およびBax 抗センスプライマーが、5'-GAAGTAGGAAAGGAGGCCATC-3'(配列番号4)、Bcl-x センスプライマー、5'-AGGTCGGCGATGAGTTTGAA-3'(配列番号5)、およびBcl-x 抗センスプライマーが、5'-CGGCTCTCGGCTGCTGCATT-3'(配列番号6)、β-アクチンセンスプライマーが、5'-TGCCCATCTATGAGGGTTACG-3'(配列番号7)、およびβ-アクチン抗センスプライマーが、5'-TAGAAGCATTTGCGGTGCACG-3'(配列番号8)である。構成的に発現されるβ-アクチンmRNAの産生物をコントロールとして使用した。増幅されたPCR産生物を、アガロース・ゲル電気泳動と臭化エチジュウム染色により分析した。
免疫ブロッテングと免疫組織化学法
Bcl-2ファミリー、NF-κB、IκB、p-Akt、およびp-Badタンパク質レベルを、12%のドデシル硫酸ナトリウムのポリアクリルアミドゲル電気泳動(SDS-PAGE)法により分離された全タンパク質ホモジネート(homogenates)から決定した。ブロットを、1:500(Santa Cruz Biotechnology,Santa Cruz,CA)に希釈したBcl-2とNF-κBと反応性のあるマウスの一次モノクロナール抗体、か同じく希釈したBcl-xS/L,Bax,IκB, p-Akt、およびp-Badと反応性のあるラビットの一次モノクロナール抗体のいずれかにてプローブし、その後西洋わさびペルオキシダーゼに結合した二次抗マウス抗体か抗ラビット抗体にてインキュベートした。
Bcl-2ファミリー、NF-κB、IκB、p-Akt、およびp-Badタンパク質レベルを、12%のドデシル硫酸ナトリウムのポリアクリルアミドゲル電気泳動(SDS-PAGE)法により分離された全タンパク質ホモジネート(homogenates)から決定した。ブロットを、1:500(Santa Cruz Biotechnology,Santa Cruz,CA)に希釈したBcl-2とNF-κBと反応性のあるマウスの一次モノクロナール抗体、か同じく希釈したBcl-xS/L,Bax,IκB, p-Akt、およびp-Badと反応性のあるラビットの一次モノクロナール抗体のいずれかにてプローブし、その後西洋わさびペルオキシダーゼに結合した二次抗マウス抗体か抗ラビット抗体にてインキュベートした。
最後にSUPERSIGNAL基質(Pierce Rockford,IL)を使用して、特定の膜タンパク質を検出するために膜を処理した。NF-κB活性化の免疫組織化学法は、1%のホルムアルデヒドにて固定し、さらに-20℃にて酢酸-エタノール溶液にて後固定し、次に燐酸緩衝液をpH7.4にて洗浄し、厚み10μmの前頭部の冷凍切片を、IMMUNOCRUZS染色系(Santa Cruz Biotechnology)を使用し、製造業者の指示に従って行った。
簡単に言うと、正常なヤギの血清にてブロッキングした後、冷凍切片を、NF-κB p65のサブユニット(Santa Cruz Biotechnology)に対しつまりIκBの解離後、結合のためにのみ利用できるエピトープに対し、活性化した特異的モノクロナール抗体にてプローブした。ビオチンと結合した二次抗-マウス抗体が適用され、次にそのスライドを、HRP-ステップアビジン複合体にて処理し、HRP基質混合物にて染色し、そして0.5%のメチルグリーンにて対比染色した。各ラットから複数の切片を、血腫に隣接した領域において試験した。
血清および脳の胆汁酸の分析
正常なコントロールと線条体内に血腫を有するラットを、TUDCA又は担体を注入して1,3,および6時間後に犠牲にした。血液を採取し、血餅化(clotted)させ、回転(spun)させて、その血清を取り出し、さらに-20℃にて凍結した。それに加え5%の抱水クロラールにて麻酔しそしてトランスカーデアル燐酸緩衝液を注入した後に、脳を取り出し、フラッシュ凍結し、-70℃にて保存した。
正常なコントロールと線条体内に血腫を有するラットを、TUDCA又は担体を注入して1,3,および6時間後に犠牲にした。血液を採取し、血餅化(clotted)させ、回転(spun)させて、その血清を取り出し、さらに-20℃にて凍結した。それに加え5%の抱水クロラールにて麻酔しそしてトランスカーデアル燐酸緩衝液を注入した後に、脳を取り出し、フラッシュ凍結し、-70℃にて保存した。
胆汁酸を有機溶媒により抽出、Lipidex 1000で精製、液体-固体の抽出、加水分解、親脂質アニオン交換クロマトグラフィによる単離、そしてメチルエステル-トリメチルシリルエーテル誘導体への変換、その後ガスクロマトグラフィにより評価した(Setchellら、Gastroenterology 1997;112:226-235)。胆汁酸の濃度を、nmol/gの組織又はμmol/lの血清として表わした。
濃度測定および統計分析
ImageMaster 1D Elite 濃度測定分析プログラム(Amersham Pharmacia Biotech,Uppsala,Sweden)を用い、タンパク質および核酸バンドの相対強度を分析した。統計分析を、ANOVAおよびBonferroni'sの複数比較試験に対しWindow 95向けGraphPad InStat version 3.00(GraphPad Software,San Diego,CA)を用いて行った。P<0.05の値が有意値と考えられる。
ImageMaster 1D Elite 濃度測定分析プログラム(Amersham Pharmacia Biotech,Uppsala,Sweden)を用い、タンパク質および核酸バンドの相対強度を分析した。統計分析を、ANOVAおよびBonferroni'sの複数比較試験に対しWindow 95向けGraphPad InStat version 3.00(GraphPad Software,San Diego,CA)を用いて行った。P<0.05の値が有意値と考えられる。
結果
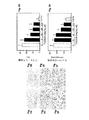
TUDCAが、出血発作後の血餅容量とアポトーシスを減少させている。ヒトの発作により繰り返し損傷により引き起こされるICHを、成人ラットの脳内の柔組織(parenchyma)へ細菌性コラゲナーゼ注入により誘発することができ、それが、血管の拡大的損傷を引き起こしている。図1A乃至1Dを参照。一連の切片内をNissl染色し、コンピュータによる容積分析では、コラゲナーゼ注入から2日後で右線条体に大きな出血損傷部が現出した(図1A)。損傷部の容積が、線条体の萎縮程度と関連し、従って同一側半球の線条体の容積が減少すると、同一側半球の脳室サイズが増大することで相殺している(データが示されていない)。さらにコラゲナーゼを注入する1時間前に投与されたTUDCAの投与量が増大するにつれ、受けいれた動物の損傷サイズが顕著に減少した。
TUDCAが、出血発作後の血餅容量とアポトーシスを減少させている。ヒトの発作により繰り返し損傷により引き起こされるICHを、成人ラットの脳内の柔組織(parenchyma)へ細菌性コラゲナーゼ注入により誘発することができ、それが、血管の拡大的損傷を引き起こしている。図1A乃至1Dを参照。一連の切片内をNissl染色し、コンピュータによる容積分析では、コラゲナーゼ注入から2日後で右線条体に大きな出血損傷部が現出した(図1A)。損傷部の容積が、線条体の萎縮程度と関連し、従って同一側半球の線条体の容積が減少すると、同一側半球の脳室サイズが増大することで相殺している(データが示されていない)。さらにコラゲナーゼを注入する1時間前に投与されたTUDCAの投与量が増大するにつれ、受けいれた動物の損傷サイズが顕著に減少した。
脳の出血損傷が、100mg/kg bwのTUDCAにて処理されたラット(担体対処理群において278.4±39.2mm3対143.9±46.5mm3、それぞれp<0.05)と比較して担体の注入グループにおいて約50%有意に大きいことが判った。200mg/kg bwのTUDCAにて、さらに損傷容積の約60%の減少が観察され(p<0.01),ここで10と50mg/kg bwの投与形態では、保護性が有意に低かった。最後にTUDCAを受けた動物の脳が、出血したコア(core)(データに示されていない)から外側の炎症性細胞の存在が言われたより有意に少ないことを示した。
TUNELの染色を、核様DNAの断片にて細胞を同定するために使用した。アポトーシス細胞が、対向側半球の両実験グループ(図2A乃至2G)にほとんど観察されなかった。しかしながら、TUNELに正の細胞が、擬似作用(sham-operated)ラット(p<0.01)の同一側半球に顕著に増大した。
さらに出血した脳の損傷側半球から抽出されたDNAを電気泳動にかけると、約200-bpの断片(データに示されていない)のDNAの特徴的ラダリング(laddering)を実証的に示した。TUDCAにて処理すると、100mg/kg bwの投与後(p<0.05)、ほぼ30%から約10%にアポトーシスの細胞数が減少した。さらにTUDCAを、より多い投与量にて投与した場合、>65%(p<0.01)だけアポトーシスが減少した。
さらにコラゲナーゼ注入後の同一側半球と対向側半球の両半球のカスパーゼ活性を試験した。タンパク質抽出物を、関係する脳組織から調製し、カスパーゼ-3様の酵素に好ましい基質、DEVD-pNAにてインキュベートした。正常な脳組織と比較し対向側半球にカスパーゼ活性が有意に増大することがない(データを示していない)。
対照的にカスパーゼ活性が、担体注入のラット(p<0.01)脳の同一側半球部でほぼ4倍増大した(図2H)。100と200mg/kg bwのTUDAを投与(それぞれp<0.05、およびp<0.01)した後に、TUDCAが、損傷した半球におけるカスパーゼ活性を45-60%だけ減少させた。実際において、最も高い投与量のTUDCAにて処理された同一側領域と対向側領域との間に統計的な差がなかった。これらの知見では、出血性発作のコラゲナーゼ・モデルにおいて、コアー領域の外側の神経細胞がアポトーシスにて死に、そしてTUDCAにより効率的に救うことを示唆している。
次にTUDCA投与の療法的ウインドウ(window)を決定した。同じモデルを使用する場合、コラゲナーゼ注入1時間前又は注入1、3および6時間後に、100mg/kg bwにて担体又はTUDCAを注入した。出血の発生の1時間前又は発生から最大3時間後までに投与されたTUDCAを受けた動物において、出血から2日後の損傷した脳の容量が顕著に減少した(p<0.05)(図3A)。6時間までこの40乃至50%の保護効果が、1部失われたがまだ明示している。全出血性損傷部の72%まで表している周辺のICH (Peri-ICH)容量が、任意の時間点でTUDCAによって有意に減少した(p<0.05)(以下の表1を参照)。
しかしながら、TUDCAが、出血6時間後に与えられた時の損傷部のコア容量に明確な保護を提示していないことは、TUDCAによる効果が、出血のより小さなコア部の外側に有意に強力であり、そしてより早期に投与さた場合極めて明確であることを示唆している。TUNELの染色、そしてカスパーゼの活性が、時間経過の実験を通して担体を注入した動物よりもTUDCAにて処理された動物に顕著に低くなっている(図3Bおよび3C)。従ってこの発作のモデルにおいて、TUDCAを前処理と同様の保護効果を表すように、1時間又は3時間でTUDCAを受け入れた動物として、出血後少なくとも3時間までのウインドウ(window)が、TUDCAを使用することにより介在のため開くと考えられる。
表1 TUDCAによるICHのコアおよびその周辺(Peri-ICH)の減少
保護(%)
時間 ICHコアー Peri-ICH
TUDCA 投与(h)
1 47.7±3.2* 48.6±3.5*
3 30.0±18.9* 42.8±14.9*
6 20.9±12.9 48.7±12.9 *
データが、平均値±SEM(1群当りn=3乃至5匹の動物)
担体注入動物から、各時間点にて*p<0.05
表1 TUDCAによるICHのコアおよびその周辺(Peri-ICH)の減少
保護(%)
時間 ICHコアー Peri-ICH
TUDCA 投与(h)
1 47.7±3.2* 48.6±3.5*
3 30.0±18.9* 42.8±14.9*
6 20.9±12.9 48.7±12.9 *
データが、平均値±SEM(1群当りn=3乃至5匹の動物)
担体注入動物から、各時間点にて*p<0.05
胆汁の分析では、TUDCAの動脈投与により血清および脳における濃度が増大する結果を示した。実際に1回100mg/kg bwのTUDCAの容量により、注入3時間後にて0.3から10.6μmol/l(p<0.01)まで血清内の胆汁酸が有意に高くなった。この変化を、担体注入のコントロール(p<0.01)と比較してこの胆汁酸の脳内濃度が10倍増大することと関連付けられる。加えてTUDCAを受けたラットに発作のある動物と正常コントロール(p<0.05)間の脳内の全胆汁酸の濃度が、ほぼ2倍高くなり、血液脳間門を交差する輸送の増大を示唆している。
TUDCAが神経的欠陥を改良
出血2日後の神経的な機能欠陥が、TUDCAにて処理されたラットにおいて改良され、その神経機能の改良により、損傷部の回避(sparing)を伴うことを示唆している。外科的術後2日に担体注入のグループにおいて、アポモルフィネ投与に応答して強力ネットの同一側回転が注目された。対照的にTUDCAを投与すると、モータ活性の通常応答を減衰した。担体が注入されたコントロールにおいて、応答回転が5分当り約20回から、TUDCAにより処理されたラットにおいて(p<0.05)10回以下に減少した。ICH 6時間後にTUDCAが与えられた時により有意であることを除いて、投与期がより早期であれば保護効果がより明確となった。さらに1肢を置き、そして動物の歩行運動の開始能力を評価した。
出血2日後の神経的な機能欠陥が、TUDCAにて処理されたラットにおいて改良され、その神経機能の改良により、損傷部の回避(sparing)を伴うことを示唆している。外科的術後2日に担体注入のグループにおいて、アポモルフィネ投与に応答して強力ネットの同一側回転が注目された。対照的にTUDCAを投与すると、モータ活性の通常応答を減衰した。担体が注入されたコントロールにおいて、応答回転が5分当り約20回から、TUDCAにより処理されたラットにおいて(p<0.05)10回以下に減少した。ICH 6時間後にTUDCAが与えられた時により有意であることを除いて、投与期がより早期であれば保護効果がより明確となった。さらに1肢を置き、そして動物の歩行運動の開始能力を評価した。
De Ryck(De Ryck.Eur.Neurol.1990;30(suppl.2):21-27)の変化からの1肢配置試験では、TUDCA投与の時間経過実験を介して25乃至40%の運動活性の改善を示した。担体注入ラット(p<0.05)より、片側の線条体を出血した動物をTUDCAで処理すると、実際1分間に、左側の前肢がより有意な歩行を開始した。加えて後の時間点にて処理されたラットよりコラゲナーゼ注入1時間前又は注入1時間後のいずれかにて、TUDCAを受けたラットの右前肢と左前肢との間の差が、有意に小さかった。
TUDCAにて処理されたラットのNF-κBの活性が減少した。
出血発作におけるシグナル経路、およびTUDCAの保護的役割を探求するために、さらにタンパク質の合成が可能なコアー損傷部に隣接した脳組織、およびコントロールとして対向側半球の同一の組織を使用した。図4A乃至4Dを参照。NF-κB/IκBαタンパク質の複合体、細胞中の酸化ストレスの主要センサーおよびエフェクターの変化が、擬似作用ラット(sham-operated rat)の同一側半球に極めて顕著であるが、TUDCA処理後の明示が有意的に少ない。
出血発作におけるシグナル経路、およびTUDCAの保護的役割を探求するために、さらにタンパク質の合成が可能なコアー損傷部に隣接した脳組織、およびコントロールとして対向側半球の同一の組織を使用した。図4A乃至4Dを参照。NF-κB/IκBαタンパク質の複合体、細胞中の酸化ストレスの主要センサーおよびエフェクターの変化が、擬似作用ラット(sham-operated rat)の同一側半球に極めて顕著であるが、TUDCA処理後の明示が有意的に少ない。
IκBαに対するWestern blot分析が、対向側半球と比較して(p<0.05)担体注入コントロールにおいてほぼ40%減少したが、TUDCAの投与量を増大するにつれ治療により復帰する可能性が大きくなる。さらに擬似作用ラット(sham-operated rat)において、NF-κBp65のサブユニットの発現が、有意に増大した(p<0.05)、しかしTUDCAが注入された動物では、さらなる差が示されなかった(図4Cおよび4D)。
免疫組織化学法としてICH後のNF-κBの活性を確認するために、そこにおける活性化依存抗NF-κB抗体が用いられた。同一側半球における免疫化学的なNF-κBが、擬似コントロール動物(sham)において明らかに検出できる、しかしTUDCA治療ではICH周辺領域でNF-κBの活性が顕著に減少した(図4Aおよび図4B)。さらに、NF-κBの活性化の分散領域が、TUUNEL染色(データが示されていない)により測定されたDNA断片領域と一致した。
これまでの報告では、Bcl-2が、ミトコンドリアから細胞質の基質にシトクローム Cを放出し、そしてその後機能的に細胞死を阻害することを実証した(Kluckら、Science 1997;275:1132乃至1136およびYangら、Science 1997;275乃至1132)。そのため、線条体内の出血が、Bcl-2タンパク質と他のファミリー要素を誘発させるかどうか、NF-κBの活性化に関連したBcl-xおよびBaxを試験した。図5A乃至5Dを参照。ウエスタン・ブロットにより、コラゲナーゼ注入の後(p<0.01)同一側半球のBcl-2タンパク質レベルが、約6倍と顕著な増大を示すが、Bcl-xL(p<0.05)において明確な上昇が見られなかった(図5Aおよび5C)。
さらに前アポトーシスBaxが、有意に増大した(p<0.05)。あらゆる投与応答研究によりBcl-2が上昇するにつれ、TUDCA存在下のBcl-2タンパク質レベルが、NF-κBの活性化と関連していないが、転写因子の活性が著しく減少した。Bcl-xLタンパク質レベルが、TUDCAにより僅かに減少したが、Baxタンパク質が、処理中に対向側半球の値に戻った。RT-PCRの分析では、線条体の出血後のbcl-2(p<0.05)およびbcl-xL(p<0.01)mRNAのレベルが有意に増大することを示したがbax mRNAを変化しなかった(図5Bおよび5D)。さらにTUDCAが、Bcl-2の転写活性を増大させたが、Bcl-xLmRNAを減少させた。
出血性発作のコラゲナーゼ・モデルにおいてこうした知見では、、bcl-2とbc1-xL発現の上限調節が、NF-κBの活性と関連付け、さらにTUDCAによりそのNF-κBの活性を有意に減少させる。さらに、ICH前のTUDCAの投与が、NF-κBの活性と独立したおそらく別の選択肢としての経路を介しBcl-2産生そして/又は安定性の増大と関連付けられる。
TUDCAが、出血性発作の後の神経細胞を保護するためにAKtを活性にする。ウイルス性原ガンタンパク質v-AKtと細胞的に相同であるAKtが、種々の細胞種のアポトーシスによる細胞死を抑制する。さらにAKtが、Bcl-2ファミリーを伴う生存経路に潜在的に結合する、Badの燐酸化と結び付けられている。TUDCAのシグナリング経路を探査すると、燐酸化形状のAKt-1の発現が、ICHと同一側半球(p<0.01)側に顕著に減少したが、TUDCAで処理することにより、大きく復帰する可能性が見出された。図6Aおよび6Bを参照。同様にTUDCAを受けたラットの脳において燐酸化されたBadレベルが、未処理の擬似コントロール(sham-controls)(p<0.05)と比較してほぼ2倍に上昇した。ホスファチジルイノシチド3'-OHキナーゼ(PI3K)の経路を介し細胞内のシグナリングが、TUDCAに対し必須であろうとなかろうと、in vitroにおけるAKtの燐酸化を停止するよう、PI3Kの選択的阻害剤を使用することにより、神経細胞内の影響が評価された。大脳皮質神経細胞をウオルトマンニンにて処理すると、TUDCAにて誘発されるAKtの燐酸化が一部阻害されるが、細胞変動性が有意に減少する(データが示されていない)。
結論
UDCAおよびTUDCAが、強力な抗-アポトーシス剤としてin vitroとin vivoの両方に作用し、内在的に産生される非毒性な胆汁酸である。膜の脱分極およびチャンネルの形成を阻害することにより(Rodriguesら、J Clin Invest 1998;101:2790-2799 and Rodrigues ら、Cell death Differ 1999;6:842-854)、ミトコンドリアの機能不全を防止する効果に加え、さらにこれらの分子が、細胞質のカルシウムレベルを調節することにより、シグナル導入経路における、そして転写を調節することにより遺伝子発現における重要な調節的役割を果たすことが可能である(Guicciariら、Hepatology2002;35:971-973)。遺伝的なハンチントン病のマウスモデルにTUDCAを投与すること、線条体の変性を有意に減少させ、そして運動および知覚の欠陥を有意に改良した(Keeneら、Proc Natl Acad Sci USA 2002;99:10671-10676)。さらに発作による虚血後に中脳動脈の閉塞モデルが与えられた場合、TUDCAがアポトーシス、梗塞容量部、および神経系行動障害を有意に減少させる(Rodriguesら、J Cereb Blood Flow Metab 2002;22:463-471)。現段階の研究では、これまでの記載を拡張し、そして発作をコラゲナーゼにて誘発されたICHの発作性モデルにおけるTUDCAの神経細胞への保護効果を示している。
結論
UDCAおよびTUDCAが、強力な抗-アポトーシス剤としてin vitroとin vivoの両方に作用し、内在的に産生される非毒性な胆汁酸である。膜の脱分極およびチャンネルの形成を阻害することにより(Rodriguesら、J Clin Invest 1998;101:2790-2799 and Rodrigues ら、Cell death Differ 1999;6:842-854)、ミトコンドリアの機能不全を防止する効果に加え、さらにこれらの分子が、細胞質のカルシウムレベルを調節することにより、シグナル導入経路における、そして転写を調節することにより遺伝子発現における重要な調節的役割を果たすことが可能である(Guicciariら、Hepatology2002;35:971-973)。遺伝的なハンチントン病のマウスモデルにTUDCAを投与すること、線条体の変性を有意に減少させ、そして運動および知覚の欠陥を有意に改良した(Keeneら、Proc Natl Acad Sci USA 2002;99:10671-10676)。さらに発作による虚血後に中脳動脈の閉塞モデルが与えられた場合、TUDCAがアポトーシス、梗塞容量部、および神経系行動障害を有意に減少させる(Rodriguesら、J Cereb Blood Flow Metab 2002;22:463-471)。現段階の研究では、これまでの記載を拡張し、そして発作をコラゲナーゼにて誘発されたICHの発作性モデルにおけるTUDCAの神経細胞への保護効果を示している。
TUDCAを投与すると、TUNEL陽性細胞の出現、カスパーゼ-3 様プロテアーゼの活性化、ICH周辺領域の組織的な損傷をほぼ完全に無くした。これらの知見が、TUDCAにより神経および細胞のアポトーシスの阻害と矛盾していない。さらに出血の開始から3時間まで、ある場合に6時間までにほとんどの神経細胞をTUDCAによって助けることができ、それが神経細胞死の活性化を遅延させることと矛盾していない。従って、少なくともこのモデルの多くの細胞が数時間の生存可能な状態であり、治療がこの時間ウインドウ(time window)内にて開始さた場合に抗-アポトーシス剤によって復帰することができる。最後にさらにTUDCAが、ブラント・ヘッド外傷(blunt head trauma)のラットモデルの脳に傷を与えた後、アポトーシスの減少に極めて効果的であった。
実際に高力領域(high power field)当りTUNEL陽性細胞の数が、外傷的な脳障害を有する担体注入動物において約27であるが、TUDCAを受けているラットにおいてわずか12であった。TUDCAによりアポトーシスを50%以上の減少が実現した。損傷前処理24時間、その後2回の後損傷処理をヘッド外傷の時間と24時間後の2回の後損傷で行われた。ICHが、100,000当り15乃至35と想定される発生を有する脳血管の破壊的事象の状態であり(Broderickら、N Engl J Med 1992;326:733-736 and Hankeyら、Stroke 1997; 28:2126-2132)そして約50%の死亡率(Juvela,Arch Neuro 1995;52:1193-1200)に近づいている。
外科的療法および医薬的療法が、ICH後の罹患率又は死亡率の減少に有効ではなく、そうしてこれらの患者の臨床試験では、虚血性発作を有する患者に対する治療は極めて遅れている。血餅の塊状部が影響する2次的な損傷は、血液産生物の浸入に対し組織反応から引き起こされると考えられ、その結果虚血、浮腫、強度の炎症(Mendelow,Stroke 1993;24:1115-7)となり、そして最終的に細胞死となる。急性の発作から細胞死の機構が複雑で、さらに事象の相互作用を関与すると見られる。
しかしながら大脳虚血後の再灌流により、クロマチンの縮重、TUNELの標識化、およびカスパーゼの活性化(Choi,Curr Opin Neurobiol 1996;6:667-672)を含むアポトーシスの幾つかの特徴を示すことが認められた。さらにアポトーシスの特徴的兆候が、出血性発作後の脳において記載されている(Gongら、Neurosurgery 2001;48:875-882 and Matzら、J Cereb Blood Flow Metab 2001;21:921-928)。これらの観察と一貫しTUNEL陽性細胞の数が劇的に増大し、そして血餅のすぐ周辺の領域における有意なカスパーゼ活性が検出された。実際に種々のアポトーシス関連タンパク質が発現される選択的な神経細胞の障害のこの狭い領域が、発作の帰結に重要であることを、実証的に示唆している。
これは、カスパーゼ阻害剤にて処理された動物、および一般的な遺伝子操作されたカスパーゼ欠陥マウスが、虚血性脳外傷が減少したことを示している(Loddickら、NeuroReport 1996;7:1465-1468 and Haraら、Proc Natl Acad Sci USA 1997;94:2007-2012 and Cheng ら、J Clin Invest 1998;101:1992-1999 and Endres ら、J Cereb Blood Flow Metab 1998;18:238-247 and Schielkeら、J Cereb Blood Flow Metab 1998;18:180-185 and Rabuffettiら、J Neurosci 2000;20:4398-4404)。
ICHから3時間後までに投与されたTUDCAが、神経細胞機能の改良と関連し、アポトーシス細胞死を防止することにより、線条体の損傷容積を有意に減少させた。TUDCAが、ある種の活性酸素の産生、膜電位の崩壊、およびミトコンドリアの外側膜の破壊を直接阻害する(Rodriguesら、Mol Med 1998;4:165-178 and Rodriguesら、Biochem Biophys Res Commun 2001;281:468-471)。追加的にTUDCAが、細胞性基質からミトコンドリアにBaxの転座を阻害することにより、ミトコンドリアの非効率性、および毒性を緩和する(Rodringuesら、J Neurochem 2000;75:2368-2379 and Rodriguesら、Mol Med 1998;4:165-178 and Rodriguesら、Cell Death Differ 1999;6:842-854)。膜の安定性が、シトクロム Cの放出を阻害し、それによりカスパーゼの活性化および基質の切断などの下流の事象を介在する(Rodriguesら、Mol Med 1998;4:165-178 and Rodriguesら、Cell Death Differ 1999;6:842-854 and Benzら、J Hepatol 1998;28:99-106)。NF-κBの活性化が、発作外傷脳に重要な役割を有することが、現段階で十分に確立されている(Sharpら、J Cereb Blood Flow Metab 2000;20:1011-1032)。
ICHが、NF-κBの早期活性化により特に随伴され(Hickenbottomら、Stroke 1999;30:2472-2477)、次に幾つか炎症に関与するもの、そしてアポトーシスに示唆される他のものを含む多くの異なる遺伝子の転写を増大させることができる。しかしながら幾つかの研究では、NF-κBが外傷を介在することを示し、その外には脳を保護できることを示唆することから、発作におけるNF-κBの正確な役割が明らかでない。p50とp65の絶対量は予測できないが、実験的ICHの後にNF-κB DNA結合活性が増大し、そしてその活性が、断片化されたDNAを含む細胞にしばしば同一場所に局在され(colocalized)(HickenbottomらStroke 1999;30:2472-2477)、それが、NF-κBに有害な役割を示唆している。
逆説的には、NF-κB活性の中核的介在物の発現が減少すると、抗センスオリゴデオキシヌクレオチドの使用を介し前炎症性サイトカイン腫瘍壊死因子-α(Mayneら、Stroke 2001;32:240-248)が、ICH後に神経細胞を保護する可能性がある。前の記載と一致して、ICHより2日後の血餅に近接する周辺領域にて、NF-κBの有意な活性が検出された。抗アポトーシスタンパク質Bcl-2に対しコードし、そして有意に少ない程度のBcl-xLへのNF-κBの下流の標的遺伝子が、同じ脳領域にて高く発現され、それが、細胞傷害に関与する初期炎症反応対し脳を保護する生存経路の活性を示唆している。
興味深いことにNF-κBの活性が有意に減少するにもかかわらず、Bcl-2のレベルがTUDCA投与後継続して上昇する。従ってICHの設定において、初期炎症反応そして/又は酸化ストレスが、重要なNF-κBの活性となり、Bcl-2とBcl-xLの発現が増大するが、細胞死を介在する他の遺伝子の活性を介し同時に傷害を再発する可能性のあることから、それが脳を保護すると見られる。実際にアポトーシスが、ICHの周辺領域におけるさらに顕著な形状の細胞死である。初期傷害を防止するために、TUDCAがNF-κBの活性を間接的に減少させる可能性がある。同時にBcl-2レベルが、TUDCAによる別の生存経路の活性を介しておそらく上昇した状態である。血液生成細胞および他の細胞種において特徴とされる特異的シグナリング・カスケード(Ihle,Nature 1995;377:591-594 and Sirenら、Proc Natle Acad Sci USA 2001;98:4044-4049)が、ラットの脳において機能的で、そしてTUDCAにより調節することができる、という証明をこれらの研究から確認される。
より重要なことはこれらの経路が、TUDCAの神経細胞の保護効果として必須であると考えられる。TUDCAによるAktの燐酸化が、Badの燐酸化と潜在的に結合され、それが抗アポトーシスBcl-2ファミリー群への結合、およびそのファミリー群を不活性化させる能力を破壊することにより(Dattaら、Genes Dev 1999;13:2905-2927)、生存を促進することが知られている。TUDCAがNF-κBの活性をいかに減少させ、そして生存を促進すべきアポトーシス分子の能力を変更させるため、タンパク質キナーゼ経路をいかに活性化させるかが、本研究から十分には明確でないが、神経細胞傷害を復帰する能力が、出血性発作の治療の考察に重要である。
本明細書に引用された全ての特許、特許文献、および刊行物の完全な開示が、引用により組み入れられている。上記詳細な記載および試料を、理解を明確にするためにのみ提示している。不必要な限定が全くないことが、理解されるであろう。本発明が正確に、詳細に明示し、記載されている点に限定されるものでなく、それは当業者に対する自明性が、クレームにより定義される本発明の範囲内に含まれることになる。
代表的なNisslにて染色した線条体の断片部を、各処理グループとして示す。担体を注入した線条体損傷部(1B)を引用のため輪郭を示しそしてTUDCA処理動物(1C)の線条体上に重ね合せた。図1Dでは、損傷部の容積を定量し平均値±SEM(n=グループ当り5匹の動物)をグラフとして示し、担体を注射した動物の同一側(ipsilateral(Ipsi))半球から、*p<0.05且つ§p<0.01である。
断面部が、0.5%のメチルグリーンにて対比染色される。もとからの倍率が200xである。図2Gでは、アポトーシス細胞を定量化し棒グラフにて示す。担体を注入したラッドは、コラゲナーゼ1時間前に投与されたTUDCAの投与量を増大させ(10-200mg/kg bw)、それを受ける動物と比較し全細胞に対しアポトーシス細胞が比例的に増大することを示した。データが、平均値±SEM(n=グループ当り5匹の動物)である。図2Hでは、DEVDと特異的カスパーゼ活性を棒グラフにて示す。プロテアーゼ様カスパーゼ-3の活性が、対向側半球と比較して担体注入のコントロールの同一側(ipsilateral)半球において有意に高いが、TUDCAの投与量を多くするにつれ、ガスパーゼの活性が急激に減少してくる。データが、平均値±SEM(n=グループ当り5匹の動物)を示し、担体注射の動物における同一側(ipsilateral(Ipsi))半球から、*p<0.05、且つ§p<0.01である。
擬似処理ラットの同一側(ipsilateral(Ipsi))半球に、NF-κB/IκBαタンパク質複合体の変化を、視覚的に見ることができるが、コラゲナーゼ1時間前に投与されたTUDCA(10-200mg/kg bw)の用量を増大させることを、実証することが難しい。全タンパク質抽出物をSDS-PAGEにかけて、そしてそのブロットを、NF-κB/p65とIκBαに対する抗体にてプローブした。図4Dでは、NF-κB/IκBαタンパク質複合体の変化を定量化して、平均値±SEM(n=グループ当り3-5匹の動物)であることを図式的に示している。担体注射の動物における同一側(ipsilateral(Ipsi))半球から*p<0.05である。
図5Bでは、Bcl-2,Bcl-xL,およびBaxのmRNAのレベルが、対向側半球と比較して担体を注射したラットの脳内において、上昇したことを示した。コラゲナーゼ1時間前に、投与されたTUDCA(10-200mg/kg bw)の用量が増大するにつれ、Bcl-xLの転写活性を逐次減少させたが、Bcl-2のそれを減少させなかった。全RNA量が単離され、そしてBcl-2,Bcl-xL,およびBaxのmRNAがRT-PCRにより増幅された。増幅されたPCR産生物を、アガロース・ゲル電気泳動、および臭化エチジウム染色により分析した。構成的に発現されたβアクチンmRNAの産生物を、コントロールとして使用した。データを、図5Cと図5Dにて平均値±SEM(n=グループ当り3-5匹の動物)として示した。担体注射の動物における同一側(ipsilateral(Ipsi))半球から*p<0.05、且つ§p<0.01である。
Claims (17)
- 親水性胆汁酸、その塩、その類似物及びその組み合わせた物から成る群から選択される化合物の有効量を患者に投与することを含み、出血と関連した神経系障害を有する患者を治療する方法。
- 患者がヒト患者である請求項1記載の方法。
- 化合物が、医薬的に受け入れ可能な担体と組み合わせて投与される請求項1記載の方法。
- 投与が非経口投与を含む、請求項1記載の方法。
- 投与が経口投与を含む、請求項1記載の方法。
- 出血と関連した神経系障害が、出血性発作、頭部の外傷性傷害、脊髄傷害、又は抹消神経障害を含む請求項1記載の方法。
- 出血と関連した神経系障害が出血性発作を含む、請求項1記載の方法。
- ウルソデオキシコール酸、その塩、その類似物、およびそれを組み合わせた物から成る群から選択される化合物の有効量を患者へ投与することを含む、神経系障害を有する患者を治療する方法。
- 患者がヒト患者である請求項8記載の方法。
- 化合物が、医薬的に受け入れ可能な担体と組み合わせて投与される請求項8記載の方法。
- 投与が非経口投与を含む、請求項8記載の方法。
- 投与が経口投与を含む、請求項8記載の方法。
- 出血に関連した神経系障害が、出血性発作、頭部の外傷性傷害、脊髄障害、又は抹消神経障害を含む請求項8記載の方法。
- 出血に関連した神経系障害が、出血性発作を含む請求項8記載の方法。
- ウルソデオキシコール酸の類似物が、グリコ-ウルソデオキシコール酸である請求項8記載の方法。
- ウルソデオキシコール酸の類似物が、タウロ-ウルソデオキシコール酸である請求項8記載の方法。
- ウルソデオキシコール酸の類似物が、他と結合したウルソデオキシコール酸誘導体である請求項8記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US42521002P | 2002-11-07 | 2002-11-07 | |
| US45161503P | 2003-03-03 | 2003-03-03 | |
| PCT/US2003/031989 WO2004043342A2 (en) | 2002-11-07 | 2003-10-08 | Methods of treating injuries of the nervous system associated with hemorrhage |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006510740A true JP2006510740A (ja) | 2006-03-30 |
| JP2006510740A5 JP2006510740A5 (ja) | 2006-11-24 |
Family
ID=32314576
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005507039A Pending JP2006510740A (ja) | 2002-11-07 | 2003-10-08 | 出血と関連した神経系障害を治療する方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20060135494A1 (ja) |
| EP (1) | EP1575578B1 (ja) |
| JP (1) | JP2006510740A (ja) |
| KR (1) | KR20050103185A (ja) |
| AT (1) | ATE451108T1 (ja) |
| AU (1) | AU2003275495A1 (ja) |
| DE (1) | DE60330501D1 (ja) |
| HK (1) | HK1086479A1 (ja) |
| WO (1) | WO2004043342A2 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7772220B2 (en) | 2004-10-15 | 2010-08-10 | Seo Hong Yoo | Methods and compositions for reducing toxicity of a pharmaceutical compound |
| US20030044413A1 (en) * | 2000-08-15 | 2003-03-06 | Regents Of The University Of Minnesota | Methods of limiting apoptosis of cells |
| US20060204481A1 (en) * | 2003-04-02 | 2006-09-14 | Steer Clifford J | Methods of promoting cell viability |
| US8173627B2 (en) | 2004-08-30 | 2012-05-08 | Seo Hong Yoo | Neuroprotective effect of solubilized UDCA in focal ischemic model |
| ATE506955T1 (de) | 2004-10-15 | 2011-05-15 | Seo Hong Yoo | Zusammensetzungen zur verringerung der toxizität von cisplatin, carboplatin und oxaliplatin |
| JP2008530100A (ja) * | 2005-02-10 | 2008-08-07 | リージェンツ オブ ザ ユニバーシティ オブ ミネソタ | 視覚障害の治療方法 |
| WO2007111992A2 (en) * | 2006-03-22 | 2007-10-04 | President And Fellows Of Harvard College | Methods and compositions for treating hypercholesterolemia and atherosclerosis |
| KR20180029317A (ko) * | 2016-09-12 | 2018-03-21 | 경상대학교산학협력단 | 간손상 예방, 개선 또는 치료용 조성물 |
| KR101953298B1 (ko) * | 2017-07-18 | 2019-02-28 | 의료법인 성광의료재단 | 우르소데옥시콜산을 함유하는 염증성 질환 또는 척수 손상 예방 또는 치료용 조성물 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002011708A2 (en) * | 2000-08-04 | 2002-02-14 | Symphar S.A. | Methods for inducing apolipoprotein e secretion |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2090876A1 (en) * | 1991-07-03 | 1993-01-04 | Satoru Nakai | Apoptosis regulating composition |
| US5656725A (en) * | 1995-05-12 | 1997-08-12 | Apoptosis Technology, Inc. | Peptides and compositions which modulate apoptosis |
| WO1999015179A1 (en) * | 1997-09-25 | 1999-04-01 | Regents Of The University Of Minnesota | Methods of limiting apoptosis of cells |
| WO1999043336A1 (en) * | 1998-02-27 | 1999-09-02 | Nutramax Laboratories, Inc. | L-ergothioneine, milk thistle, and s-adenosylmethionine for the prevention, treatment and repair of liver damage |
| US20030044413A1 (en) * | 2000-08-15 | 2003-03-06 | Regents Of The University Of Minnesota | Methods of limiting apoptosis of cells |
-
2003
- 2003-10-08 EP EP03759773A patent/EP1575578B1/en not_active Expired - Lifetime
- 2003-10-08 JP JP2005507039A patent/JP2006510740A/ja active Pending
- 2003-10-08 KR KR1020057008192A patent/KR20050103185A/ko not_active Application Discontinuation
- 2003-10-08 US US10/532,039 patent/US20060135494A1/en not_active Abandoned
- 2003-10-08 AT AT03759773T patent/ATE451108T1/de not_active IP Right Cessation
- 2003-10-08 WO PCT/US2003/031989 patent/WO2004043342A2/en active Application Filing
- 2003-10-08 AU AU2003275495A patent/AU2003275495A1/en not_active Abandoned
- 2003-10-08 DE DE60330501T patent/DE60330501D1/de not_active Expired - Lifetime
-
2006
- 2006-06-06 HK HK06106459.5A patent/HK1086479A1/xx not_active IP Right Cessation
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002011708A2 (en) * | 2000-08-04 | 2002-02-14 | Symphar S.A. | Methods for inducing apolipoprotein e secretion |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2003275495A1 (en) | 2004-06-03 |
| EP1575578A4 (en) | 2007-10-10 |
| US20060135494A1 (en) | 2006-06-22 |
| EP1575578A2 (en) | 2005-09-21 |
| DE60330501D1 (de) | 2010-01-21 |
| ATE451108T1 (de) | 2009-12-15 |
| KR20050103185A (ko) | 2005-10-27 |
| EP1575578B1 (en) | 2009-12-09 |
| HK1086479A1 (en) | 2006-09-22 |
| WO2004043342A2 (en) | 2004-05-27 |
| WO2004043342A3 (en) | 2004-07-15 |
| AU2003275495A8 (en) | 2004-06-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Lin et al. | Curcumin provides neuroprotection after spinal cord injury | |
| KR102459500B1 (ko) | 퀘르세틴 배당체를 함유하는 근위축 억제제 | |
| MXPA01005598A (es) | Metodo y composicion para el tratamiento de cancer que utiliza aceites esenciales vegetales naturales con moduladores de transduccion de senal. | |
| Wakade et al. | Curcumin attenuates vascular inflammation and cerebral vasospasm after subarachnoid hemorrhage in mice | |
| Ye et al. | Hydroxysafflor yellow A protects neuron against hypoxia injury and suppresses inflammatory responses following focal ischemia reperfusion in rats | |
| Zhang et al. | Isosteviol sodium protects against permanent cerebral ischemia injury in mice via inhibition of NF-κB–mediated inflammatory and apoptotic responses | |
| TW201002315A (en) | Anti-tumoural effects of cannabinoid combinations | |
| Soysal et al. | A novel angiogenesis inhibitor bevacizumab induces apoptosis in the rat endometriosis model | |
| JP2011505385A (ja) | 良性前立腺過形成の治療のための医薬製剤 | |
| JP2002544229A (ja) | 癌の化学的予防および治療のために組み合わせたdfmoおよびセレコキシブ | |
| KR20020035855A (ko) | 약용인삼을 포함하는 뇌세포 또는 신경세포 보호제 | |
| KR100927958B1 (ko) | 금속의 흡수를 촉진시키는 금속-산성아미노산 킬레이트를함유하는 조성물 | |
| KR102358632B1 (ko) | 스트렙토니그린 및 항암제를 포함하는 대장암 예방 또는 치료용 약학적 조성물 | |
| JP2019537628A (ja) | 併用療法 | |
| JP2006510740A (ja) | 出血と関連した神経系障害を治療する方法 | |
| Fan et al. | Parthenolide alleviates microglia‐mediated neuroinflammation via MAPK/TRIM31/NLRP3 signaling to ameliorate cognitive disorder | |
| JP2003530353A (ja) | オルチプラズの肝繊維化及び肝硬変症進行の予防及び治療剤としての使用方法、及びオルチプラズを主成分として含有する製薬組成物 | |
| Santing et al. | Bronchodilatory and anti-inflammatory properties of inhaled selective phosphodiesterase inhibitors in a guinea pig model of allergic asthma | |
| US11376233B2 (en) | Composition, containing sarpogrelate as active ingredient, for preventing or treating sensorineural hearing loss | |
| Yu et al. | Effects of MPSS and a potent iNOS inhibitor on traumatic spinal cord injury | |
| TW201929871A (zh) | 神經系統疾患治療劑 | |
| KR20180035739A (ko) | 조직 재생 및 저하된 조직 기능의 회복을 자극하기 위한 제제로서의 디카르복시산의 비스아미드 유도체 | |
| KR20010079495A (ko) | 혈관 보호제 | |
| JP2006504769A (ja) | 病理学的プロセスに関する遺伝子発現を制御するためのキナゾリノン組成物 | |
| CN100421656C (zh) | 乌索脱氧胆酸在制备治疗与出血相关的神经系统损伤的药物中的用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060928 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060928 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100302 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100727 |