JP2005534429A - 塞栓症予防デバイス - Google Patents
塞栓症予防デバイス Download PDFInfo
- Publication number
- JP2005534429A JP2005534429A JP2004526448A JP2004526448A JP2005534429A JP 2005534429 A JP2005534429 A JP 2005534429A JP 2004526448 A JP2004526448 A JP 2004526448A JP 2004526448 A JP2004526448 A JP 2004526448A JP 2005534429 A JP2005534429 A JP 2005534429A
- Authority
- JP
- Japan
- Prior art keywords
- embolic protection
- protection device
- tube
- polymer
- embolism prevention
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12027—Type of occlusion
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12027—Type of occlusion
- A61B17/12036—Type of occlusion partial occlusion
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12099—Occluding by internal devices, e.g. balloons or releasable wires characterised by the location of the occluder
- A61B17/12109—Occluding by internal devices, e.g. balloons or releasable wires characterised by the location of the occluder in a blood vessel
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/12168—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/12168—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure
- A61B17/12172—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure having a pre-set deployed three-dimensional shape
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/12181—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device formed by fluidized, gelatinous or cellular remodelable materials, e.g. embolic liquids, foams or extracellular matrices
- A61B17/1219—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device formed by fluidized, gelatinous or cellular remodelable materials, e.g. embolic liquids, foams or extracellular matrices expandable in contact with liquids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/01—Filters implantable into blood vessels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/04—Macromolecular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/01—Filters implantable into blood vessels
- A61F2002/016—Filters implantable into blood vessels made from wire-like elements
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/01—Filters implantable into blood vessels
- A61F2002/018—Filters implantable into blood vessels made from tubes or sheets of material, e.g. by etching or laser-cutting
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2230/00—Geometry of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2230/0063—Three-dimensional shapes
- A61F2230/0073—Quadric-shaped
- A61F2230/008—Quadric-shaped paraboloidal
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2230/00—Geometry of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2230/0063—Three-dimensional shapes
- A61F2230/0091—Three-dimensional shapes helically-coiled or spirally-coiled, i.e. having a 2-D spiral cross-section
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0067—Means for introducing or releasing pharmaceutical products into the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/36—Materials or treatment for tissue regeneration for embolization or occlusion, e.g. vaso-occlusive compositions or devices
Abstract
Description
本願は、Ogleの米国仮特許出願第60/400,341号「塞栓症予防デバイス」に対する優先権を主張し、これは参照により本明細書に組み込むものとする。
世界全体では、毎年、心肺バイパス(CPB)を伴う約800,000人の心臓外科患者が発生している(2)。こうした心臓外科患者のうち、約48,000人は、発作に見舞われており、300,000人近くは、神経認知障害を経験している(3)。これは大きな臨床的問題である。こうした合併症は、大部分がCPBにより発生した塞栓によるものである。心肺バイパスを受けた患者において経頭蓋ドプラ(TCD)によって測定した塞栓の平均数は、183である(3乃至947の範囲)(2)。塞栓の大部分は、最終的に、非常に末梢の脳の階層、終細動脈、及び毛細血管へと進み、微小梗塞(即ち、周囲組織への血液の喪失)を引き起こす(4)。罹患組織の病理学的評価では、SCADとして知られるソーセージ型の動脈拡張を示す。脳微小梗塞は、意識混濁、言語障害、麻痺、視覚障害、平衡障害、及びその他の神経学的逸脱を引き起こす(5)。こうした機能障害は、短期間である場合が多いが、恒久的となる可能性もある。
塞栓の形成は、血管疾患の領域においても問題を生み出す可能性があり、但し、こうした事例において、臨床転帰は、肺塞栓症(PE)となる可能性がある。米国では、約600,000人が、肺塞栓となる可能性のある静脈血栓を患っている。未治療のPEに伴う死亡率は、約30%である(7)。心臓外科に次いでではあるが、この分野は、重要な臨床的兆候を示している。
塞栓を発生させる可能性があるその他の手技には、例えば、冠状動脈、頸動脈、及び末梢での介入が含まれる(8)。これらのケースでは、例えば、プラーク、組織片、及び血栓を含む粒子状物質が、介入部位の末梢側で塞栓を形成する可能性がある。結果として、末梢血管床への血流が減少し、手技周囲の末端器官での虚血及び梗塞が生じ得る。バルーン膨張又はステント留置といった介入時に発生した大きな粒子による末梢での塞栓形成は、大きな心外膜血管を遮蔽する恐れがあり、小さな粒子(15乃至100ミクロン程度)は、微小梗塞及び/又は心筋梗塞と左心室機能不全とを引き起こす可能性がある(8)。心筋梗塞とは、心筋の区画又は心筋の中間層の死亡を指す。心筋梗塞は、冠状動脈又はその分枝の少なくとも部分的な閉塞によって発生する可能性がある。冠状動脈に付随する毛細血管の閉塞は、対応する微小梗塞形成/微小梗塞を発生させる可能性がある。
その他の体内の管部の閉塞が生じる可能性もある。例えば、腎臓結石は、最も痛みの強い泌尿器疾患の一つである。腎臓結石は、最も一般的な尿路の疾患でもあり、1996年には100万人を越える患者が診断を受けたと推定される。更には、米国の国民の10パーセントは、人生のいずれかの時点で腎臓結石を有すると推定されている。殆どの腎臓結石は、介入なしで体内から消え去るが、長期的な症状又はその他の合併症を引き起こす結石は除去が必要である。したがって、脈管系において生成された他の塞栓と同様に、泌尿器学においても、尿路内の結石を除去及び再吸収するデバイスから恩恵を受ける可能性がある。こうした結石は、シュウ酸カルシウムで形成される。比較的硬い物質であるため、尿路を通過する際には、大きな苦痛を引き起こす場合がある。こうした除去は、閉塞、即ち塞栓症のケースにおいて必要となる場合が多い。
流れの中の異物が乱流又は低流動を発生させる時、これが感染率を増大させることが明らかになっている。血栓は、塞栓を生成するだけでなく、感染症の危険性も増加させる(9)。同様に、腎臓結石は、更なる感染症のリスクを生み出す可能性がある。
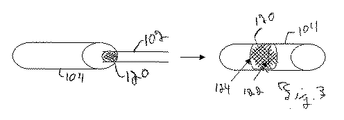
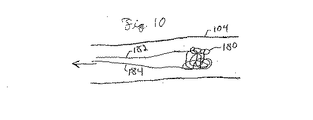
塞栓症予防デバイスは、配置前後の外部表面と、構造の断面に渡る材料の配列との両方について、様々なサイズ及び形状を有することができる。デバイスの外部形状は、デバイスの配置、除去、及び/又は性能の性質に影響を与える可能性がある。デバイス全体での材料の配列の性質は、一般に、適切なサイズを超える塞栓がデバイスを通過して流れないように捕獲すると同時に、デバイスを通る流動を維持することに適合するように策定される。
塞栓症予防デバイスは、限定された管部の外傷と共に生体内に送給可能で、一部の実施形態においては、捕獲した塞栓を分解する能力を保有可能な、生体適合性材料で作成できる。一部の材料はマトリクスを有し、マトリクスは、一部の実施形態において送給時に拡張する能力を有し、移動を最小限にするために生体内圧力に耐える能力を有し、及び/又は、制御された形で血栓溶解剤を送給する能力を有する。本明細書で説明する塞栓症予防デバイスは、一般に一つ以上のポリマーを含み、一般に少なくとも一つのポリマーは、患者の体内の管部での放出時に拡張可能なポリマーであり、例えば、膨張、形状調節、及び/又は圧縮ポリマーである。膨張するものについては、例えば、高吸収性の親水性ポリマー(例えば、ポリエーテル−ポリウレタン)又はヒドロゲルを含む、様々な適切なポリマーを使用可能であり、一方、形状調節ポリマーは、下で説明するように、形状記憶ポリマーにすることができる。圧縮ポリマーは、物理的に変形可能で、或いは伸縮性を有し、患者の管部内へ送給するためのシース又はその他の内部へ押し込むことが可能となり、シースから取り出した後でポリマーが拡張するようになる。一部の実施形態において、デバイスは、混合物内で複数のポリマーを含み、及び/又は、ブロック共重合体にすることが可能な共重合体内で複数のモノマを含む。複数のポリマーを使用することの利点には、例えば、個別の各ポリマー、或いは共重合体に組み込まれる各モノマ群の特徴となる特性を取り入れる能力が含まれる。
塞栓症予防デバイスは、単体で、患者の管部内における塞栓の移動の制御を提供する。しかしながら、デバイスの機械的特徴を生物活性物質と組み合わせ、治療に別の特質を提供することが望ましい場合がある。生物活性物質のデバイスとの関連性は、デバイス内の塞栓を縮小又は除去し、及び/又は、デバイスの下流に更に生物活性物質を送給する治療を共に提供できる。適切な生物活性物質には、例えば、血栓溶解(抗血栓形成)剤と、抗血小板剤と、抗凝固剤と、成長因子と、これらの組み合わせとが含まれる。
ほぼ全ての心臓外科的手技、更には、特定の心臓以外の手技、及び腎臓結石形成のような自然の事象では、本明細書で使用する広い意味において、塞栓の生成が起こる。塞栓の生成は、生活を変え、更に場合によっては生命を脅かす神経障害を頻繁に引き起こす。本明細書で説明する塞栓症予防デバイスは、心臓手術及びその他の手技を受けた全ての患者にとって有用となる可能性がある。一部の実施形態では、簡潔な設計において、FDA承認済みの材料と治療薬との独自の組み合わせを利用し、塞栓事象を制御する使いやすく効果的な手段を提供する。塞栓症予防デバイスの送給後の何らかの時点では、デバイス又はその一部を除去することが望ましい場合がある。
実施例1 ヒドロゲルグラフトポリマーの合成
この例では、PETポリエステルポリマーにグラフトしたポリアクリルアミドヒドロゲルポリマーの合成を実証する。
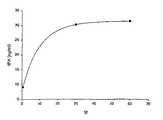
この例では、ポリアクリルアミド(PAM)ポリマーへのtPAの組み込みと、その後のtPAの放出とを実証する。
この例では、生体外でのブタの血栓塞栓の溶解に関する溶解剤としての組み換えヒト組織プラスミノーゲンアクチベータ(tPA)の有効性を実証する。
この例では、塞栓症予防デバイスを評価するための生体外流動ループの実用性を実証し、tPAを備えるもの及びtPAを備えないものの二種類の塞栓症予防デバイスの実施形態の評価を提供する。
媒体の循環は、30乃至120ml/分の流動を発生可能な遠心ポンプにより実行した。チューブは、自然の動脈血管と同様の4乃至6mmの内径を有するビニルポリマーとした。実験は、37℃の試験室において実施した。塞栓症予防デバイスの上流にある注入ポート358は、試験用塞栓を導入するのに使用した。システムを流動する媒体は、リン酸緩衝生理食塩水とした。塞栓は、ブタの血液1mlを注射器に入れ、凝固させることで生成した(塞栓サイズの決定については上記参照)。流動ループは、較正した流量計を使用して妥当性を確認した。
1秒−媒体(緩衝生理食塩水)の流動開始
10秒−流速を測定
15秒−塞栓を注入
30秒−アリコート#1を収集(廃液、即ち、デバイスを通過した媒体)
60秒−アリコート#2を収集
100秒−アリコート#3を収集
200秒−アリコート#4を収集
300秒−アリコート#5を収集
約5分後、流動を停止させ、デバイスを取り外し、顕微鏡写真を撮影した。その後、組織学的分析のため、デバイスを固定した。収集した液体のアリコートは、塞栓について分析を行った。固定したデバイスは、瞬間凍結し、切断し、組織学的分析のためにスライド上に配置した。断面では、フィブリン及び血小板のマーカを免疫組織化学的に染色した。
1.Barbut D, Yao F, Lo W, Dilverman R, Hager DN, Trifiletti RR, Gold JP、大動脈塞栓のサイズの決定及び塞栓充填冠状動脈バイパスグラフト、Ann. Throac. Surg. 1997; 63:1262-7.
2.Barbut D, Caplan LR、心臓手術の脳合併症、Curr. Probl. Cardiol. 1997 Sep;22(9):449-80.
3.Wolman RL, Nussmeier NA, Aggarwal A, Kanchuger MS, Roach GW, Newman MF, Mangano CM, Marschall KE, Ley C, Boisvert DM, Ozanne GM, Herskowitz A, Graham SH, Mangano DT、心臓手術後の脳損傷:異常な危険性のあるグループの特定、周術期虚血研究グループの多施設共同研究(McSPI)及び虚血研究教育財団(IREF)研究員、Stroke 1999. Mar;30(3):514-22.
4.Schoen FJ、介入及び外科的心臓血管病理学、13ページ. W.B.Saunders Company, Philadelphia, PA1989.
5.Llinas R, Barbut D, Caplan LR、心臓手術の神経学的合併症、Prog. Cardiovasc. Dis. 2000 Sep-Oct;43(2):101-12.
6.Barbut D, Lo YW, Gold JP, Trifiletti RR, Yao FS, Hager DN, Hinton RB, Isorn OW、冠状動脈バイパスグラフト中の塞栓形成が転帰及び入院の長さに与える影響、Ann. Thorac. Surg. 1997 Apr;63(4):998-1002.
7.Bick RL、遺伝的及び後天的血栓形成傾向、Preface. Semin. Thromb. Hemost. 1999;25:251-253.
8.Fasseas P, Orford JL, Denktas AE, Berger PB、経皮的冠状動脈及び頚動脈介入中の末梢予防デバイス、Curr. Control Trials Cardiovasc. Med. 2001;2(6):286-291.
9.Mohammad SF、デバイスに関連する血栓による感染リスクの増加、American Scciety of Artificial Internal Organs J. 2000 Nov-Dec;46(6);S63-8.
10.Allcock HR, Lampe FW、現在のポリマー化学、第二版八ページ、Prentice Hall, Engle Cliffs, New Jersey, USA 1990.
11.Chapiro A、ポリマー系の放射線化学、Interscience, New York, 1962.
12.Bos GW, Poot AA, Beugeling T, Van Aken WG, Feijen J、小口径血管グラフトプロテーゼ:現在の状況、Arch. Physiol. Biochem. 1998 Apr;106(2):100-15.
13.Chu C, Vonfaunldofer JA, Greisler HP、創縫合生体材料及びデバイス、CRC Press New York 1996.
14.Karadag E, Saraydin D, Caldiran Y, Guven O、農業用担体としての共重合アクリルアミド/クロトン酸ヒドロゲルの膨張の研究、Polymers for Advanced Technologies 2000 Feb;11(2):59-68.
15.Kim SW, Bae YH, Okano T、ヒドロゲル:膨張、薬物充填、及び放出、Pharm. Res. 1992 Mar;9(3):283-90.
16.Gehrke SH, Andrews GP, Cussler EL、ゲル抽出の化学的側面、Chemical Engineering Science 1986; 41:2153-2160.
17.Trimnell D, Fanta CF、ポリアクリルアミド及び澱粉から調合した製剤、J. Polym. Mate. 1994; 11:271-277.
18.FDA文書番号02D−074、義歯洗浄剤、接着剤、緩衝材、及び修復材料:5.ポリアクリルアミドポリマー義歯接着剤(21 C.F.R.872.3480)
19.Reichenspurner H, Navia JA, Berry G, Robbins RC, Barbut D, Gold JP, Reichart B、心臓手術中の大動脈内フィルタデバイスによる粒子塞栓の捕獲、J. Thorac. Cardiovasc. Surg. 2000 Feb;119(2):233-41.
20.Harringer W、大動脈クロスクランプを使用する心臓手技中の粒子塞栓の捕獲、Ann. Thorac. Surg. 2000 Feb;119(2)701119-23.
21.Vestraete M、理想的な血栓溶解剤の研究、J. Am. Coll. Cardiol. 1987 Nov;10(5 Suppl B):4B-10B.
22.Loscalzo J, Braunwald E、組織プラスミノーゲンアクチベータ、New England J. Med. 1988 Oct 6;319(14):925-31.
23.Vestraete M, Collen D、血栓溶解薬の薬理学、J. Am. College Cardiol. 1986 Dec;8(6 suppl B):33B-40B.
24.Hoyle CE, Clark D、ポリマー、38, 5698(1997).
25.Kaetsu I、生物医学的用途で生成する放射線合成、Radiat. Physics. Chem. 46(4-6)1995.
26.Tanaka T, ゲル及び単重合体における相転移、Polymer 1979 20:1404-1412.
27.Patras G, Qiao GG, Solomon DH、改良された分離特性を備えた新規の架橋均質ポリアクリルアミドゲル:架橋剤機能の調査、Electrophoresis 2001, 22, 4303-4310.
28.Mandeville, III, et al., 抗感染生薬としてのイオンポリマー、米国特許第6,395,777号、2002年5月28日
29.Pharm. Res. 1989, Volume 3, page 368.(20も参照せよ)
30.Vrachliotis TG, Rabkin DJ, Berbaum K, Lang EV、総腸骨静脈閉塞がグリーンフィールドのフィルタの捕獲有効性に与える影響:生体外での研究、Acad. Radiol. 2001 Jun;8(6):494-500.
31.Wu JH and Diamond SL、組織プラスミノーゲンアクチベータ(tPA)はフィブリンのプラスミン分解を阻害する。tPA仲介フィブリン溶解を減速するが、アルファ2−アンチプラスミン又は内因性プラスミノーゲンの漏出を必要としないメカニズム。Journal Clinical Investigation 1995;95(6):2483-2490.
32.Hrach CJ, Johnson MW, Hassan AS, Lei B, Sieving PA, and Elner VM、ネコの眼における市販の硝子体組織プラスミノーゲンアクチベータ溶液の網膜毒性、Archive Opthalmology 2000 May;118(5)659-63.
Claims (55)
- 生体適合性拡張可能ポリマーを含む塞栓症予防デバイスであって、前記拡張可能ポリマーは、患者の管部内での放出時に、前記管部内の流動を濾過するように構成された構造へと拡張する、塞栓症予防デバイス。
- 前記拡張可能ポリマーは、ヒドロゲルを含む、請求項1記載の塞栓症予防デバイス。
- 前記ポリマーは、水溶液との接触時に拡張する、請求項2記載の塞栓症予防デバイス。
- 前記拡張可能ポリマーは、ポリアクリルアミドを含む、請求項1記載の塞栓症予防デバイス。
- 前記拡張可能ポリマーは、ポリエーテル−ポリウレタンポリマー又はポリカーボネート−ポリウレタンポリマーを含む、請求項1記載の塞栓症予防デバイス。
- 前記拡張可能ポリマーは、形状記憶ポリマーを含む、請求項1記載の塞栓症予防デバイス。
- 前記ポリマーは、体温までの加熱字に拡張する、請求項6記載の塞栓症予防デバイス。
- 圧縮可能ポリマーを含む、請求項1記載の塞栓症予防デバイス。
- 前記圧縮可能ポリマーは、発泡体を含む、請求項8記載の塞栓症予防デバイス。
- 構造用ポリマーを含む、請求項1記載の塞栓症予防デバイス。
- 織物を含む、請求項1記載の塞栓症予防デバイス。
- 前記織物は、前記管部の壁と接触するように配向された塞栓症予防デバイスの外面を覆う、請求項11記載の塞栓症予防デバイス。
- 前記織物は、デバイスを通る流動を通過させるように配向された前記塞栓症予防デバイスの一方の端部を覆うが、他方の端部を覆わない、請求項11記載の塞栓症予防デバイス。
- 前記生体適合性拡張可能ポリマーは、織り合わせた繊維のマットを含む、請求項1記載の塞栓症予防デバイス。
- ブロック共重合体を含む、請求項1記載の塞栓症予防デバイス。
- 前記ブロック共重合体は、ヒドロゲルブロックを含む、請求項15記載の塞栓症予防デバイス。
- 前記ブロック共重合体は、ポリエステルブロック及びポリアクリルアミドブロックを含む、請求項15記載の塞栓症予防デバイス。
- 前記デバイスは、少なくとも約50体積パーセント拡張する、請求項1記載の塞栓症予防デバイス。
- 前記拡張済みデバイスは、約50ミクロン乃至約35ミリメートルの直径を有する、請求項1記載の塞栓症予防デバイス。
- 前記デバイスは、哺乳類の管部内に挿入するのに適切な寸法を有する、請求項1記載の塞栓症予防デバイス。
- 前記デバイスは、ヒト大動脈内での配置に適切な寸法を有する、請求項1記載の塞栓症予防デバイス。
- 前記デバイスは、ヒト冠状動脈内での配置に適切な寸法を有する、請求項1記載の塞栓症予防デバイス。
- 拡張後、前記デバイスは、少なくとも約0.2ミリメートルの直径を有する粒子の実質的大多数の通過を遮断し、約0.001ミリメートル以下の直径を有する粒子の実質的大多数の前記デバイスを通る前記流動を可能にする、請求項1記載の塞栓症予防デバイス。
- 再吸収可能ポリマーを含む、請求項1記載の塞栓症予防デバイス。
- 更に、患者の管部内の前記流動と接触した時に前記デバイスから溶出する生物活性物質を含む、請求項1記載の塞栓症予防デバイス。
- 前記生物活性物質は、血栓溶解剤を含む、請求項25記載の塞栓症予防デバイス。
- 前記生物活性物質は、tPAを含む、請求項25記載の塞栓症予防デバイス。
- 前記多孔性構造は、少なくとも約0.1ミリメートルの直径を有する粒子の実質的大多数を遮断し、約0.01ミリメートル以下の直径を有する粒子の実質的大多数の前記デバイスを通る前記流動を可能にする、請求項1記載の塞栓症予防デバイス。
- 塞栓により生じる細胞の損傷を低減する方法であって、請求項1の塞栓症予防デバイスを患者の管部に送給するステップを備える前記方法。
- 更に、前記患者の管部内の前記塞栓症予防デバイス付近で血栓溶解剤を投与するステップを備える、請求項29記載の方法。
- 患者の管部を通る流動を濾過する構成を有する多孔性構造を形成する生体適合性の再吸収性ポリマーを含む、塞栓症予防デバイス。
- 前記再吸収性ポリマーは、多糖類と、ヒドロキシエチル澱粉と、ゼラチンの誘導体と、ポリビニルピロリドンと、ポリビニルアルコールと、ポリ[N−(2−ヒドロキシプロピル)メタクリルアミド]と、ポリ(ヒドロキシ酸)と、ポリ(イプシロン−カプロラクトン)と、ポリ乳酸と、ポリグリコール酸と、ポリ(ジメチルグリコール酸)と、ポリ(ヒドロキシブチレート)と、これらの共重合体と、これらの混合物とで構成されたグループから選択される、請求項31記載の塞栓症予防デバイス。
- 塞栓により生じる細胞の損傷を低減する方法であって、請求項31の塞栓症予防デバイスを患者の管部に送給するステップを備える前記方法。
- 多孔性構造を形成する生体適合性の再吸収性ポリマーと、前記デバイスが患者の管部内の流動と接触した時に前記デバイスから溶出する生物活性物質とを含む塞栓症予防デバイスであって、前記多孔性構造は、前記患者の管部を通る流動を濾過する構成を有する、塞栓症予防デバイス。
- 前記生物活性物質は、血栓溶解剤、抗血小板剤、抗凝固剤、成長因子、又はこれらの組み合わせを含む、請求項34記載の塞栓症予防デバイス。
- 前記生物活性物質は、tPAを含む、請求項34記載の塞栓症予防デバイス。
- 前記生物活性物質は、tPAの生体内生成を発生させるベクターを含む、請求項34記載の塞栓症予防デバイス。
- 前記ポリマーは、ヒドロゲルを含む、請求項34記載の塞栓症予防デバイス。
- 前記ポリマーは、ブロック共重合体を含む、請求項34記載の塞栓症予防デバイス。
- 塞栓により生じる細胞の損傷を低減する方法であって、請求項34の塞栓症予防デバイスを患者の管部に送給するステップを備える前記方法。
- 第一の区域と組成的に別個の第二の区域とを備える塞栓症予防デバイスであって、前記第一の区域は、前記第二の区域の平均組成とは異なる平均組成を有し、前記第一の区域及び前記第二の区域は、流動の実質的な部分が前記第一の区域及び前記第二の区域を連続して通過する状態で、患者の管部内に配置される構成となる、塞栓症予防デバイス。
- 前記第一の区域は、再吸収性ポリマーを含む、請求項41記載の塞栓症予防デバイス。
- 前記第一の区域は、生物活性物質を含む、請求項41記載の塞栓症予防デバイス。
- 前記第一の区域は、前記第二の区域から分離可能である、請求項41記載の塞栓症予防デバイス。
- 塞栓により生じる細胞の損傷を低減する方法であって、請求項41の塞栓症予防デバイスを患者の管部に送給するステップを備える前記方法。
- 塞栓症予防デバイスと、カテーテルから管部へ前記塞栓症予防デバイスを放出するように構成された送給ツールとを備える、塞栓からの保護を提供するシステムであって、前記塞栓症予防デバイスは、生体適合性拡張可能ポリマーを含むシステム。
- 前記送給ツールは、前記塞栓症予防デバイスを内部に配置可能なシースを備える、請求項46記載のシステム。
- 前記送給ツールは、前記塞栓症予防デバイスを送給可能なカニューレを備える、請求項46記載のシステム。
- 更に、前記患者の管部からの除去のために、前記塞栓症予防デバイスに結び付ける回収デバイスを備える、請求項46記載のシステム。
- 更に、中空コアのガイドワイヤを備える、請求項46記載のシステム。
- 更に、前記ガイドワイヤへの取り付けに適したカニューレ状の注射器を備える、請求項50記載のシステム。
- 塞栓の悪影響を低減又は排除する方法であって、
患者の管部内に塞栓症予防デバイスを送給するステップを備え、前記デバイスは、テザーにより繋留され、前記塞栓症予防デバイスは、管部内の流動を濾過し、更に
前記テザーを介して生物活性物質を投与するステップを備える方法。 - 前記生物活性物質は、適切な生体適合性担体中のtPAを含む、請求項52記載の方法。
- 前記塞栓症予防デバイスは、拡張可能ポリマーを含む、請求項52記載の方法。
- 更に、前記患者の管部から前記塞栓症予防デバイスを除去するステップを備える、請求項53記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US40034102P | 2002-08-01 | 2002-08-01 | |
| US10/414,909 US7303575B2 (en) | 2002-08-01 | 2003-04-16 | Embolism protection devices |
| PCT/US2003/024459 WO2004012587A2 (en) | 2002-08-01 | 2003-08-01 | Embolism protection devices |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005534429A true JP2005534429A (ja) | 2005-11-17 |
| JP2005534429A5 JP2005534429A5 (ja) | 2006-09-07 |
Family
ID=31498612
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004526448A Pending JP2005534429A (ja) | 2002-08-01 | 2003-08-01 | 塞栓症予防デバイス |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US7303575B2 (ja) |
| EP (1) | EP1545322B1 (ja) |
| JP (1) | JP2005534429A (ja) |
| AU (1) | AU2003257182A1 (ja) |
| WO (1) | WO2004012587A2 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010505526A (ja) * | 2006-10-04 | 2010-02-25 | ボストン サイエンティフィック リミテッド | アテローム硬化性プラークを治療するための装置及び方法 |
| JP2012521258A (ja) * | 2009-03-25 | 2012-09-13 | リシブロック リミテッド | フィルター装置及びそれを使用する方法 |
| US10368974B2 (en) | 2014-10-27 | 2019-08-06 | Lithiblock Ltd. | Gallbladder implants and systems and methods for the delivery thereof |
Families Citing this family (150)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7790192B2 (en) | 1998-08-14 | 2010-09-07 | Accessclosure, Inc. | Apparatus and methods for sealing a vascular puncture |
| US7314477B1 (en) | 1998-09-25 | 2008-01-01 | C.R. Bard Inc. | Removable embolus blood clot filter and filter delivery unit |
| US6402771B1 (en) | 1999-12-23 | 2002-06-11 | Guidant Endovascular Solutions | Snare |
| US6660021B1 (en) | 1999-12-23 | 2003-12-09 | Advanced Cardiovascular Systems, Inc. | Intravascular device and system |
| US6575997B1 (en) | 1999-12-23 | 2003-06-10 | Endovascular Technologies, Inc. | Embolic basket |
| US7918820B2 (en) | 1999-12-30 | 2011-04-05 | Advanced Cardiovascular Systems, Inc. | Device for, and method of, blocking emboli in vessels such as blood arteries |
| US6695813B1 (en) | 1999-12-30 | 2004-02-24 | Advanced Cardiovascular Systems, Inc. | Embolic protection devices |
| US6964670B1 (en) | 2000-07-13 | 2005-11-15 | Advanced Cardiovascular Systems, Inc. | Embolic protection guide wire |
| US6506203B1 (en) | 2000-12-19 | 2003-01-14 | Advanced Cardiovascular Systems, Inc. | Low profile sheathless embolic protection system |
| US7338510B2 (en) | 2001-06-29 | 2008-03-04 | Advanced Cardiovascular Systems, Inc. | Variable thickness embolic filtering devices and method of manufacturing the same |
| US6599307B1 (en) | 2001-06-29 | 2003-07-29 | Advanced Cardiovascular Systems, Inc. | Filter device for embolic protection systems |
| US6638294B1 (en) | 2001-08-30 | 2003-10-28 | Advanced Cardiovascular Systems, Inc. | Self furling umbrella frame for carotid filter |
| US6592606B2 (en) | 2001-08-31 | 2003-07-15 | Advanced Cardiovascular Systems, Inc. | Hinged short cage for an embolic protection device |
| US8262689B2 (en) | 2001-09-28 | 2012-09-11 | Advanced Cardiovascular Systems, Inc. | Embolic filtering devices |
| US7241304B2 (en) | 2001-12-21 | 2007-07-10 | Advanced Cardiovascular Systems, Inc. | Flexible and conformable embolic filtering devices |
| US9204956B2 (en) | 2002-02-20 | 2015-12-08 | C. R. Bard, Inc. | IVC filter with translating hooks |
| US7303575B2 (en) * | 2002-08-01 | 2007-12-04 | Lumen Biomedical, Inc. | Embolism protection devices |
| US7331973B2 (en) | 2002-09-30 | 2008-02-19 | Avdanced Cardiovascular Systems, Inc. | Guide wire with embolic filtering attachment |
| US7252675B2 (en) | 2002-09-30 | 2007-08-07 | Advanced Cardiovascular, Inc. | Embolic filtering devices |
| US20040088000A1 (en) | 2002-10-31 | 2004-05-06 | Muller Paul F. | Single-wire expandable cages for embolic filtering devices |
| US8591540B2 (en) | 2003-02-27 | 2013-11-26 | Abbott Cardiovascular Systems Inc. | Embolic filtering devices |
| US7879062B2 (en) * | 2003-07-22 | 2011-02-01 | Lumen Biomedical, Inc. | Fiber based embolism protection device |
| US8048042B2 (en) * | 2003-07-22 | 2011-11-01 | Medtronic Vascular, Inc. | Medical articles incorporating surface capillary fiber |
| US20070135907A1 (en) | 2003-10-02 | 2007-06-14 | The Regents Of The University Of California | Stent with expandable foam |
| US7892251B1 (en) | 2003-11-12 | 2011-02-22 | Advanced Cardiovascular Systems, Inc. | Component for delivering and locking a medical device to a guide wire |
| US20050107867A1 (en) * | 2003-11-17 | 2005-05-19 | Taheri Syde A. | Temporary absorbable venous occlusive stent and superficial vein treatment method |
| EP1557128B1 (en) * | 2004-01-23 | 2007-03-07 | Cathenet Corporation | Atherectomy head and atherectomy catheter using the same |
| US8092483B2 (en) | 2004-03-06 | 2012-01-10 | Medtronic, Inc. | Steerable device having a corewire within a tube and combination with a functional medical component |
| US7678129B1 (en) | 2004-03-19 | 2010-03-16 | Advanced Cardiovascular Systems, Inc. | Locking component for an embolic filter assembly |
| US7976516B2 (en) * | 2004-06-25 | 2011-07-12 | Lumen Biomedical, Inc. | Medical device having mechanically interlocked segments |
| US20060020269A1 (en) * | 2004-07-20 | 2006-01-26 | Eric Cheng | Device to aid in stone removal and laser lithotripsy |
| US7704267B2 (en) | 2004-08-04 | 2010-04-27 | C. R. Bard, Inc. | Non-entangling vena cava filter |
| US20060047301A1 (en) * | 2004-09-02 | 2006-03-02 | Ogle Matthew F | Emboli removal system with oxygenated flow |
| US7927346B2 (en) * | 2004-09-10 | 2011-04-19 | Stryker Corporation | Diversion device to increase cerebral blood flow |
| US8262693B2 (en) * | 2004-11-05 | 2012-09-11 | Accessclosure, Inc. | Apparatus and methods for sealing a vascular puncture |
| US7794473B2 (en) | 2004-11-12 | 2010-09-14 | C.R. Bard, Inc. | Filter delivery system |
| EP1681068A1 (en) * | 2004-12-16 | 2006-07-19 | NOLabs AB | Anti-pathogen and anti-cancer filtering device and method comprising nitric oxide |
| WO2006064056A2 (en) * | 2004-12-16 | 2006-06-22 | Nolabs Ab | Anti-pathogen and anti-cancer filtering device and method comprising nitric oxide |
| US20060161241A1 (en) * | 2005-01-14 | 2006-07-20 | Denise Barbut | Methods and devices for treating aortic atheroma |
| EP1841368B1 (en) * | 2005-01-25 | 2015-06-10 | Covidien LP | Structures for permanent occlusion of a hollow anatomical structure |
| US8267954B2 (en) | 2005-02-04 | 2012-09-18 | C. R. Bard, Inc. | Vascular filter with sensing capability |
| US8945169B2 (en) * | 2005-03-15 | 2015-02-03 | Cook Medical Technologies Llc | Embolic protection device |
| US9259305B2 (en) | 2005-03-31 | 2016-02-16 | Abbott Cardiovascular Systems Inc. | Guide wire locking mechanism for rapid exchange and other catheter systems |
| US20060224178A1 (en) * | 2005-04-05 | 2006-10-05 | Boston Scientific Scimed, Inc. | Expandable medical retrieval device and related methods of use |
| CA2607580C (en) | 2005-05-12 | 2016-12-20 | C.R. Bard Inc. | Removable embolus blood clot filter |
| US20080172066A9 (en) * | 2005-07-29 | 2008-07-17 | Galdonik Jason A | Embolectomy procedures with a device comprising a polymer and devices with polymer matrices and supports |
| CA2616818C (en) | 2005-08-09 | 2014-08-05 | C.R. Bard, Inc. | Embolus blood clot filter and delivery system |
| US20070112372A1 (en) * | 2005-11-17 | 2007-05-17 | Stephen Sosnowski | Biodegradable vascular filter |
| EP1948074A2 (en) | 2005-11-18 | 2008-07-30 | C.R.Bard, Inc. | Vena cava filter with filament |
| US8052714B2 (en) | 2005-11-22 | 2011-11-08 | Medtronic Vascular, Inc. | Radiopaque fibers and filtration matrices |
| EP1954341A2 (en) * | 2005-12-02 | 2008-08-13 | C.R.Bard, Inc. | Helical vena cava filter |
| WO2007090130A2 (en) * | 2006-01-30 | 2007-08-09 | Surgica Corporation | Porous intravascular embolization particles and related methods |
| EP1986707A2 (en) * | 2006-01-30 | 2008-11-05 | Surgica Corporation | Compressible intravascular embolization particles and related methods and delivery systems |
| US20070185520A1 (en) * | 2006-02-07 | 2007-08-09 | Boston Scientific Scimed, Inc. | Detachable medical immobilization device and related methods of use |
| US20070203564A1 (en) * | 2006-02-28 | 2007-08-30 | Boston Scientific Scimed, Inc. | Biodegradable implants having accelerated biodegradation properties in vivo |
| US8795709B2 (en) | 2006-03-29 | 2014-08-05 | Incept Llc | Superabsorbent, freeze dried hydrogels for medical applications |
| US7846175B2 (en) | 2006-04-03 | 2010-12-07 | Medrad, Inc. | Guidewire and collapsable filter system |
| US9017361B2 (en) | 2006-04-20 | 2015-04-28 | Covidien Lp | Occlusive implant and methods for hollow anatomical structure |
| WO2007133366A2 (en) | 2006-05-02 | 2007-11-22 | C. R. Bard, Inc. | Vena cava filter formed from a sheet |
| US20100030251A1 (en) * | 2006-05-24 | 2010-02-04 | Mayo Foundation For Medical Education And Research | Devices and methods for crossing chronic total occlusions |
| WO2007143602A2 (en) | 2006-06-05 | 2007-12-13 | C.R. Bard Inc. | Embolus blood clot filter utilizable with a single delivery system or a single retrieval system in one of a femoral or jugular access |
| EP3338735A1 (en) * | 2006-07-19 | 2018-06-27 | Novate Medical Limited | A vascular filter |
| US8460335B2 (en) | 2006-09-11 | 2013-06-11 | Embrella Cardiovascular, Inc. | Method of deflecting emboli from the cerebral circulation |
| US9339367B2 (en) | 2006-09-11 | 2016-05-17 | Edwards Lifesciences Ag | Embolic deflection device |
| US9480548B2 (en) | 2006-09-11 | 2016-11-01 | Edwards Lifesciences Ag | Embolic protection device and method of use |
| US8216209B2 (en) | 2007-05-31 | 2012-07-10 | Abbott Cardiovascular Systems Inc. | Method and apparatus for delivering an agent to a kidney |
| US7867273B2 (en) | 2007-06-27 | 2011-01-11 | Abbott Laboratories | Endoprostheses for peripheral arteries and other body vessels |
| US20090069790A1 (en) * | 2007-09-07 | 2009-03-12 | Edward Maxwell Yokley | Surface properties of polymeric materials with nanoscale functional coating |
| US8962097B1 (en) | 2007-09-07 | 2015-02-24 | Edward Maxwell Yokley | Surface properties of polymeric materials with nanoscale functional coating |
| US9138307B2 (en) | 2007-09-14 | 2015-09-22 | Cook Medical Technologies Llc | Expandable device for treatment of a stricture in a body vessel |
| US9034007B2 (en) | 2007-09-21 | 2015-05-19 | Insera Therapeutics, Inc. | Distal embolic protection devices with a variable thickness microguidewire and methods for their use |
| JP2011502582A (ja) | 2007-11-02 | 2011-01-27 | インセプト,エルエルシー | 血管穿刺を塞ぐ装置および方法 |
| US8636670B2 (en) | 2008-05-13 | 2014-01-28 | The Invention Science Fund I, Llc | Circulatory monitoring systems and methods |
| US20090287120A1 (en) | 2007-12-18 | 2009-11-19 | Searete Llc, A Limited Liability Corporation Of The State Of Delaware | Circulatory monitoring systems and methods |
| US9717896B2 (en) | 2007-12-18 | 2017-08-01 | Gearbox, Llc | Treatment indications informed by a priori implant information |
| US20100152646A1 (en) * | 2008-02-29 | 2010-06-17 | Reshma Girijavallabhan | Intravitreal injection device and method |
| JP5391407B2 (ja) * | 2008-04-03 | 2014-01-15 | クック・メディカル・テクノロジーズ・リミテッド・ライアビリティ・カンパニー | 自浄式装置、システムおよびその使用方法 |
| WO2010008451A2 (en) | 2008-06-23 | 2010-01-21 | Lumen Biomedical, Inc. | Embolic protection during percutaneous heart valve replacement and similar procedures |
| US8070694B2 (en) | 2008-07-14 | 2011-12-06 | Medtronic Vascular, Inc. | Fiber based medical devices and aspiration catheters |
| JP2012507562A (ja) * | 2008-10-30 | 2012-03-29 | ダビド リウ | 微小球性多孔質生体適合性足場並びにその製造方法及び装置 |
| EP2358280A4 (en) * | 2008-12-19 | 2015-05-06 | Covidien Lp | METHOD AND DEVICE FOR STORING AND / OR INTRODUCING IMPLANTS FOR HIGH ANATOMICAL STRUCTURES |
| US8388644B2 (en) | 2008-12-29 | 2013-03-05 | Cook Medical Technologies Llc | Embolic protection device and method of use |
| JP5643226B2 (ja) * | 2009-01-16 | 2014-12-17 | ノベート・メディカル・リミテッド | 血管フィルタデバイス |
| US20170202657A1 (en) | 2009-01-16 | 2017-07-20 | Claret Medical, Inc. | Intravascular blood filters and methods of use |
| WO2010082189A1 (en) | 2009-01-16 | 2010-07-22 | Novate Medical Limited | A vascular filter system |
| WO2010082187A1 (en) | 2009-01-16 | 2010-07-22 | Novate Medical Limited | A vascular filter device |
| US9326843B2 (en) | 2009-01-16 | 2016-05-03 | Claret Medical, Inc. | Intravascular blood filters and methods of use |
| US8057507B2 (en) * | 2009-01-16 | 2011-11-15 | Novate Medical Limited | Vascular filter |
| ES2516066T3 (es) | 2009-01-16 | 2014-10-30 | Claret Medical, Inc. | Filtro sanguíneo intravascular |
| WO2010088520A2 (en) * | 2009-01-29 | 2010-08-05 | Claret Medical, Inc. | Illuminated intravascular blood filter |
| US20100228280A1 (en) * | 2009-03-09 | 2010-09-09 | Adam Groothuis | Methods and devices for treatment of lumenal systems |
| US20100274277A1 (en) * | 2009-04-27 | 2010-10-28 | Cook Incorporated | Embolic protection device with maximized flow-through |
| CA2760704C (en) | 2009-05-04 | 2017-10-03 | Incept, Llc | Biomaterials for track and puncture closure |
| US8814903B2 (en) | 2009-07-24 | 2014-08-26 | Depuy Mitek, Llc | Methods and devices for repairing meniscal tissue |
| US8828053B2 (en) | 2009-07-24 | 2014-09-09 | Depuy Mitek, Llc | Methods and devices for repairing and anchoring damaged tissue |
| US8974489B2 (en) | 2009-07-27 | 2015-03-10 | Claret Medical, Inc. | Dual endovascular filter and methods of use |
| CN104825247B (zh) | 2009-07-29 | 2017-05-03 | C·R·巴德公司 | 管式过滤器 |
| BR112012003804B1 (pt) * | 2009-08-21 | 2019-02-19 | Novan, Inc. | Curativo para ferimentos, método para formar um curativo para ferimentos, e, kit de curativo para ferimento |
| EP3925572A1 (en) | 2009-09-21 | 2021-12-22 | Boston Scientific Scimed Inc. | Intravascular blood filters |
| NZ599527A (en) | 2009-11-09 | 2014-04-30 | Spotlight Technology Partners Llc | Fragmented hydrogels |
| CN102695500A (zh) | 2009-11-09 | 2012-09-26 | 聚光灯技术合伙有限责任公司 | 多糖基水凝胶 |
| WO2011130256A2 (en) | 2010-04-13 | 2011-10-20 | Lumen Biomedical, Inc. | Embolectomy devices and methods for treatment of acute ischemic stroke condition |
| US9451938B2 (en) | 2010-04-27 | 2016-09-27 | DePuy Synthes Products, Inc. | Insertion instrument for anchor assembly |
| WO2011137159A1 (en) | 2010-04-27 | 2011-11-03 | Synthes Usa, Llc | Anchor assembly including expandable anchor |
| US9743919B2 (en) | 2010-04-27 | 2017-08-29 | DePuy Synthes Products, Inc. | Stitch lock for attaching two or more structures |
| US9597064B2 (en) | 2010-04-27 | 2017-03-21 | DePuy Synthes Products, Inc. | Methods for approximating a tissue defect using an anchor assembly |
| US9307978B2 (en) | 2010-11-04 | 2016-04-12 | Linvatec Corporation | Method and apparatus for securing an object to bone, including the provision and use of a novel suture assembly for securing an object to bone |
| US9307977B2 (en) | 2010-11-04 | 2016-04-12 | Conmed Corporation | Method and apparatus for securing an object to bone, including the provision and use of a novel suture assembly for securing suture to bone |
| WO2012092377A1 (en) | 2010-12-30 | 2012-07-05 | Claret Medical, Inc. | Intravascular blood filters and methods of use |
| US9820728B2 (en) | 2011-01-19 | 2017-11-21 | Access Closure, Inc. | Apparatus and methods for sealing a vascular puncture |
| EP3461422B1 (en) | 2011-01-19 | 2020-12-30 | Access Closure, Inc. | Methods for sealing a vascular puncture |
| JP5981459B2 (ja) | 2011-02-16 | 2016-08-31 | リンバテック・コーポレーション | 物体を骨に固定するための新規な縫合糸組立品の提供および使用を含む、物体を骨に結合する方法および装置 |
| EP4101399A1 (en) | 2011-08-05 | 2022-12-14 | Route 92 Medical, Inc. | System for treatment of acute ischemic stroke |
| US9795470B2 (en) | 2012-01-17 | 2017-10-24 | Lumen Biomedical, Inc. | Aortic arch filtration system for carotid artery protection |
| US9888994B2 (en) | 2012-05-15 | 2018-02-13 | Transverse Medical, Inc. | Catheter-based apparatuses and methods |
| GB2507053A (en) * | 2012-10-16 | 2014-04-23 | Jonathan Featherstone | Nephroureterectomy apparatus |
| US10285797B2 (en) | 2013-01-22 | 2019-05-14 | St. Jude Medical, Llc | Protecting against cerebral embolism |
| GB2510151B (en) * | 2013-01-25 | 2015-07-22 | Cook Medical Technologies Llc | Vascular plug |
| JP6437517B2 (ja) | 2013-03-15 | 2018-12-12 | インセラ セラピューティクス,インク. | 血管治療装置及び方法 |
| US10687930B2 (en) | 2013-03-15 | 2020-06-23 | Novate Medical Limited | Vascular filter device |
| US8715314B1 (en) | 2013-03-15 | 2014-05-06 | Insera Therapeutics, Inc. | Vascular treatment measurement methods |
| US8679150B1 (en) | 2013-03-15 | 2014-03-25 | Insera Therapeutics, Inc. | Shape-set textile structure based mechanical thrombectomy methods |
| US8690907B1 (en) | 2013-03-15 | 2014-04-08 | Insera Therapeutics, Inc. | Vascular treatment methods |
| WO2014185969A2 (en) | 2013-05-14 | 2014-11-20 | Transverse Medical, Inc. | Catheter-based apparatuses and methods |
| WO2017142874A2 (en) | 2016-02-16 | 2017-08-24 | Insera Therapeutics, Inc. | Aspiration devices and anchored flow diverting devices |
| US9265512B2 (en) | 2013-12-23 | 2016-02-23 | Silk Road Medical, Inc. | Transcarotid neurovascular catheter |
| CN103751856B (zh) * | 2014-01-22 | 2015-07-29 | 同济大学 | 一种具有良好分散性的聚乳酸类栓塞微球 |
| US9782247B2 (en) | 2014-02-18 | 2017-10-10 | Cook Medical Technologies, LLC | Flexible embolic double filter |
| US9820761B2 (en) | 2014-03-21 | 2017-11-21 | Route 92 Medical, Inc. | Rapid aspiration thrombectomy system and method |
| WO2015143357A2 (en) * | 2014-03-21 | 2015-09-24 | Boston Scientific Scimed, Inc. | Devices and methods for treating a lung |
| US10426497B2 (en) | 2015-07-24 | 2019-10-01 | Route 92 Medical, Inc. | Anchoring delivery system and methods |
| ES2932764T3 (es) | 2015-02-04 | 2023-01-26 | Route 92 Medical Inc | Sistema de trombectomía por aspiración rápida |
| US11065019B1 (en) | 2015-02-04 | 2021-07-20 | Route 92 Medical, Inc. | Aspiration catheter systems and methods of use |
| US9566144B2 (en) | 2015-04-22 | 2017-02-14 | Claret Medical, Inc. | Vascular filters, deflectors, and methods |
| US10463386B2 (en) | 2015-09-01 | 2019-11-05 | Mivi Neuroscience, Inc. | Thrombectomy devices and treatment of acute ischemic stroke with thrombus engagement |
| US10716915B2 (en) | 2015-11-23 | 2020-07-21 | Mivi Neuroscience, Inc. | Catheter systems for applying effective suction in remote vessels and thrombectomy procedures facilitated by catheter systems |
| EP3522798A4 (en) | 2016-10-06 | 2020-05-13 | Mivi Neuroscience, Inc. | HYDRAULIC DISPLACEMENT AND ELIMINATION OF THROMBUS CLOTS AND CATHETERS TO PERFORM HYDRAULIC DISPLACEMENT |
| EP3568186B1 (en) | 2017-01-10 | 2022-09-14 | Route 92 Medical, Inc. | Aspiration catheter systems |
| JP7032446B2 (ja) | 2017-02-22 | 2022-03-08 | ボストン サイエンティフィック サイムド,インコーポレイテッド | 脳血管系を保護するための保護システム |
| WO2018183624A1 (en) | 2017-03-29 | 2018-10-04 | The Regents Of The University Of Colorado, A Body Corporate | Reverse thermal gels and their use as vascular embolic repair agents |
| US10478535B2 (en) | 2017-05-24 | 2019-11-19 | Mivi Neuroscience, Inc. | Suction catheter systems for applying effective aspiration in remote vessels, especially cerebral arteries |
| US11234723B2 (en) | 2017-12-20 | 2022-02-01 | Mivi Neuroscience, Inc. | Suction catheter systems for applying effective aspiration in remote vessels, especially cerebral arteries |
| CN111565673A (zh) | 2017-10-27 | 2020-08-21 | 波士顿科学医学有限公司 | 用于保护脑血管的系统和方法 |
| US11033411B2 (en) * | 2017-12-14 | 2021-06-15 | Boston Scientific Scimed, Inc. | Stent including an expandable member |
| EP4212127A1 (en) | 2017-12-19 | 2023-07-19 | Boston Scientific Scimed, Inc. | System for protecting the cerebral vasculature |
| WO2019210118A1 (en) | 2018-04-26 | 2019-10-31 | Boston Scientific Scimed, Inc. | Systems for protecting the cerebral vasculature |
| JP2021523793A (ja) | 2018-05-17 | 2021-09-09 | ルート92メディカル・インコーポレイテッドRoute 92 Medical, Inc. | 吸引カテーテルシステム及び使用方法 |
| CN108742927B (zh) * | 2018-06-27 | 2020-02-04 | 李林 | 一种血栓诱发实验装置 |
| US11351023B2 (en) | 2018-08-21 | 2022-06-07 | Claret Medical, Inc. | Systems and methods for protecting the cerebral vasculature |
| US11617865B2 (en) | 2020-01-24 | 2023-04-04 | Mivi Neuroscience, Inc. | Suction catheter systems with designs allowing rapid clearing of clots |
Family Cites Families (80)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4422939A (en) | 1979-11-07 | 1983-12-27 | Texas Medical Products, Inc. | Blood and perfusate filter |
| US4429939A (en) * | 1981-09-09 | 1984-02-07 | Thomas & Betts Corporation | Electrical cable assembly |
| SE434715B (sv) * | 1982-01-20 | 1984-08-13 | Tetra Pak Dev | Sett vid sammanfogning av laminatmaterial innefattande lager av orienteringsstreckt polyester |
| US4494531A (en) * | 1982-12-06 | 1985-01-22 | Cook, Incorporated | Expandable blood clot filter |
| US4512338A (en) * | 1983-01-25 | 1985-04-23 | Balko Alexander B | Process for restoring patency to body vessels |
| US4550126A (en) | 1985-01-25 | 1985-10-29 | Hydromer, Inc. | Hydrophilic, flexible, open cell polyurethane-poly(N-vinyl lactam) interpolymer foam and dental and biomedical products fabricated therefrom |
| US4793348A (en) | 1986-11-15 | 1988-12-27 | Palmaz Julio C | Balloon expandable vena cava filter to prevent migration of lower extremity venous clots into the pulmonary circulation |
| US5061276A (en) * | 1987-04-28 | 1991-10-29 | Baxter International Inc. | Multi-layered poly(tetrafluoroethylene)/elastomer materials useful for in vivo implantation |
| US4817600A (en) | 1987-05-22 | 1989-04-04 | Medi-Tech, Inc. | Implantable filter |
| US4832055A (en) | 1988-07-08 | 1989-05-23 | Palestrant Aubrey M | Mechanically locking blood clot filter |
| US5972505A (en) * | 1989-04-04 | 1999-10-26 | Eastman Chemical Company | Fibers capable of spontaneously transporting fluids |
| US5059205A (en) | 1989-09-07 | 1991-10-22 | Boston Scientific Corporation | Percutaneous anti-migration vena cava filter |
| CA2071960C (en) | 1990-02-20 | 1994-08-23 | Hugh Ansley Thompson | Open capillary channel structures, improved process for making capillary channel structures, and extrusion die for use therein |
| AU7998091A (en) | 1990-05-17 | 1991-12-10 | Harbor Medical Devices, Inc. | Medical device polymer |
| GB9102660D0 (en) | 1991-02-07 | 1991-03-27 | Ultra Lab Ltd | Wound dressing materials |
| US5350398A (en) | 1991-05-13 | 1994-09-27 | Dusan Pavcnik | Self-expanding filter for percutaneous insertion |
| US5288489A (en) | 1991-08-28 | 1994-02-22 | Orion Therapeutic Systems, Inc. | Fibrinolysis and fibrinogenolysis treatment |
| US5277976A (en) * | 1991-10-07 | 1994-01-11 | Minnesota Mining And Manufacturing Company | Oriented profile fibers |
| US5626605A (en) | 1991-12-30 | 1997-05-06 | Scimed Life Systems, Inc. | Thrombosis filter |
| US5527338A (en) * | 1992-09-02 | 1996-06-18 | Board Of Regents, The University Of Texas System | Intravascular device |
| US5807306A (en) * | 1992-11-09 | 1998-09-15 | Cortrak Medical, Inc. | Polymer matrix drug delivery apparatus |
| US5540707A (en) * | 1992-11-13 | 1996-07-30 | Scimed Life Systems, Inc. | Expandable intravascular occlusion material removal devices and methods of use |
| US5836868A (en) | 1992-11-13 | 1998-11-17 | Scimed Life Systems, Inc. | Expandable intravascular occlusion material removal devices and methods of use |
| ES2116384T3 (es) * | 1993-10-20 | 1998-07-16 | Schneider Europ Ag | Endoprotesis. |
| US5599298A (en) * | 1993-12-30 | 1997-02-04 | Boston Scientific Corporation | Bodily sample collection balloon catheter method |
| DE9409484U1 (de) | 1994-06-11 | 1994-08-04 | Naderlinger Eduard | Vena-cava Thromben-Filter |
| US6099864A (en) | 1994-12-02 | 2000-08-08 | The United States Of America As Represented By The Administrator Of The National Aeronautics And Space Administration | In situ activation of microcapsules |
| US5651765A (en) | 1995-04-27 | 1997-07-29 | Avecor Cardiovascular Inc. | Blood filter with concentric pleats and method of use |
| US5938645A (en) | 1995-05-24 | 1999-08-17 | Boston Scientific Corporation Northwest Technology Center Inc. | Percutaneous aspiration catheter system |
| US5704910A (en) | 1995-06-05 | 1998-01-06 | Nephros Therapeutics, Inc. | Implantable device and use therefor |
| US6491965B1 (en) | 1995-11-30 | 2002-12-10 | Hamilton Civic Hospitals Research Development, Inc. | Medical device comprising glycosaminoglycan-antithrombin III/heparin cofactor II conjugates |
| NL1002423C2 (nl) * | 1996-02-22 | 1997-08-25 | Cordis Europ | Tijdelijk-filtercatheter. |
| US5935139A (en) | 1996-05-03 | 1999-08-10 | Boston Scientific Corporation | System for immobilizing or manipulating an object in a tract |
| US5839443A (en) | 1996-05-16 | 1998-11-24 | The Trustees Of Columbia University In The City Of New York | Method for inhibiting thrombosis in a patient whose blood is subjected to extracorporeal circulation |
| US6544276B1 (en) | 1996-05-20 | 2003-04-08 | Medtronic Ave. Inc. | Exchange method for emboli containment |
| US5972019A (en) * | 1996-07-25 | 1999-10-26 | Target Therapeutics, Inc. | Mechanical clot treatment device |
| US6103376A (en) | 1996-08-22 | 2000-08-15 | Eastman Chemical Company | Bundles of fibers useful for moving liquids at high fluxes and acquisition/distribution structures that use the bundles |
| US5977429A (en) | 1996-08-22 | 1999-11-02 | Eastman Chemical Company | Synthetic polyester absorbent materials |
| US6391044B1 (en) * | 1997-02-03 | 2002-05-21 | Angioguard, Inc. | Vascular filter system |
| US5882329A (en) * | 1997-02-12 | 1999-03-16 | Prolifix Medical, Inc. | Apparatus and method for removing stenotic material from stents |
| US5814064A (en) * | 1997-03-06 | 1998-09-29 | Scimed Life Systems, Inc. | Distal protection device |
| US5911734A (en) | 1997-05-08 | 1999-06-15 | Embol-X, Inc. | Percutaneous catheter and guidewire having filter and medical device deployment capabilities |
| US6245088B1 (en) | 1997-07-07 | 2001-06-12 | Samuel R. Lowery | Retrievable umbrella sieve and method of use |
| US5928260A (en) * | 1997-07-10 | 1999-07-27 | Scimed Life Systems, Inc. | Removable occlusion system for aneurysm neck |
| US6361545B1 (en) * | 1997-09-26 | 2002-03-26 | Cardeon Corporation | Perfusion filter catheter |
| US6395014B1 (en) * | 1997-09-26 | 2002-05-28 | John A. Macoviak | Cerebral embolic protection assembly and associated methods |
| US6066149A (en) | 1997-09-30 | 2000-05-23 | Target Therapeutics, Inc. | Mechanical clot treatment device with distal filter |
| WO1999023952A1 (en) | 1997-11-12 | 1999-05-20 | William Dubrul | Biological passageway occlusion removal |
| US6254563B1 (en) * | 1997-12-15 | 2001-07-03 | Cardeon Corporation | Perfusion shunt apparatus and method |
| KR100382568B1 (ko) | 1998-02-23 | 2003-05-09 | 메사츄세츠 인스티튜트 어브 테크놀로지 | 생물분해성 형상기억 중합체 |
| US6123681A (en) | 1998-03-31 | 2000-09-26 | Global Vascular Concepts, Inc. | Anti-embolism stocking device |
| US6450989B2 (en) * | 1998-04-27 | 2002-09-17 | Artemis Medical, Inc. | Dilating and support apparatus with disease inhibitors and methods for use |
| AU756080B2 (en) * | 1998-06-04 | 2003-01-02 | New York University | Endovascular thin film devices and methods for treating and preventing stroke |
| US6306163B1 (en) | 1998-08-04 | 2001-10-23 | Advanced Cardiovascular Systems, Inc. | Assembly for collecting emboli and method of use |
| US6083239A (en) | 1998-11-24 | 2000-07-04 | Embol-X, Inc. | Compliant framework and methods of use |
| US6373970B1 (en) | 1998-12-29 | 2002-04-16 | General Electric Company | Image registration using fourier phase matching |
| US6368338B1 (en) * | 1999-03-05 | 2002-04-09 | Board Of Regents, The University Of Texas | Occlusion method and apparatus |
| US6231589B1 (en) | 1999-03-22 | 2001-05-15 | Microvena Corporation | Body vessel filter |
| US6267776B1 (en) | 1999-05-03 | 2001-07-31 | O'connell Paul T. | Vena cava filter and method for treating pulmonary embolism |
| GB2365356A (en) * | 1999-05-07 | 2002-02-20 | Salviac Ltd | An embolic protection device |
| EP1176993B1 (en) | 1999-05-07 | 2003-06-04 | Salviac Limited | Biostable polyurethane products |
| US6371970B1 (en) | 1999-07-30 | 2002-04-16 | Incept Llc | Vascular filter having articulation region and methods of use in the ascending aorta |
| US6346116B1 (en) | 1999-08-03 | 2002-02-12 | Medtronic Ave, Inc. | Distal protection device |
| US6273901B1 (en) | 1999-08-10 | 2001-08-14 | Scimed Life Systems, Inc. | Thrombosis filter having a surface treatment |
| US6364895B1 (en) | 1999-10-07 | 2002-04-02 | Prodesco, Inc. | Intraluminal filter |
| US6368344B1 (en) * | 1999-12-16 | 2002-04-09 | Advanced Cardiovascular Systems, Inc. | Stent deployment system with reinforced inner member |
| WO2001067989A2 (en) * | 2000-03-10 | 2001-09-20 | Don Michael T Anthony | Vascular embolism preventon device employing filters |
| US6514273B1 (en) | 2000-03-22 | 2003-02-04 | Endovascular Technologies, Inc. | Device for removal of thrombus through physiological adhesion |
| US6602271B2 (en) * | 2000-05-24 | 2003-08-05 | Medtronic Ave, Inc. | Collapsible blood filter with optimal braid geometry |
| US6527746B1 (en) * | 2000-08-03 | 2003-03-04 | Ev3, Inc. | Back-loading catheter |
| US6485501B1 (en) * | 2000-08-11 | 2002-11-26 | Cordis Corporation | Vascular filter system with guidewire and capture mechanism |
| ES2438147T3 (es) | 2001-01-09 | 2014-01-16 | Microvention, Inc. | Catéteres de embolectomía |
| US6610077B1 (en) | 2001-01-23 | 2003-08-26 | Endovascular Technologies, Inc. | Expandable emboli filter and thrombectomy device |
| US20020128680A1 (en) * | 2001-01-25 | 2002-09-12 | Pavlovic Jennifer L. | Distal protection device with electrospun polymer fiber matrix |
| US6878153B2 (en) * | 2001-07-02 | 2005-04-12 | Rubicon Medical, Inc. | Methods, systems, and devices for providing embolic protection and removing embolic material |
| US6616682B2 (en) | 2001-09-19 | 2003-09-09 | Jomed Gmbh | Methods and apparatus for distal protection during a medical procedure |
| US7052500B2 (en) | 2001-10-19 | 2006-05-30 | Scimed Life Systems, Inc. | Embolus extractor |
| US20050021075A1 (en) | 2002-12-30 | 2005-01-27 | Bonnette Michael J. | Guidewire having deployable sheathless protective filter |
| US7303575B2 (en) * | 2002-08-01 | 2007-12-04 | Lumen Biomedical, Inc. | Embolism protection devices |
| US7220271B2 (en) * | 2003-01-30 | 2007-05-22 | Ev3 Inc. | Embolic filters having multiple layers and controlled pore size |
-
2003
- 2003-04-16 US US10/414,909 patent/US7303575B2/en not_active Expired - Lifetime
- 2003-08-01 WO PCT/US2003/024459 patent/WO2004012587A2/en active Application Filing
- 2003-08-01 EP EP03767200.3A patent/EP1545322B1/en not_active Expired - Lifetime
- 2003-08-01 JP JP2004526448A patent/JP2005534429A/ja active Pending
- 2003-08-01 AU AU2003257182A patent/AU2003257182A1/en not_active Abandoned
-
2004
- 2004-03-22 US US10/806,311 patent/US8123775B2/en active Active
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010505526A (ja) * | 2006-10-04 | 2010-02-25 | ボストン サイエンティフィック リミテッド | アテローム硬化性プラークを治療するための装置及び方法 |
| JP2012521258A (ja) * | 2009-03-25 | 2012-09-13 | リシブロック リミテッド | フィルター装置及びそれを使用する方法 |
| US9427299B2 (en) | 2009-03-25 | 2016-08-30 | Lithiblock Ltd. | Filter apparatuses and methods of using same |
| US10368974B2 (en) | 2014-10-27 | 2019-08-06 | Lithiblock Ltd. | Gallbladder implants and systems and methods for the delivery thereof |
| US10702368B2 (en) | 2014-10-27 | 2020-07-07 | Lithiblock Ltd. | Gallbladder implant and systems and methods for the delivery thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2004012587A2 (en) | 2004-02-12 |
| EP1545322A4 (en) | 2008-12-03 |
| AU2003257182A8 (en) | 2004-02-23 |
| US20040093015A1 (en) | 2004-05-13 |
| EP1545322A2 (en) | 2005-06-29 |
| US7303575B2 (en) | 2007-12-04 |
| US20040220611A1 (en) | 2004-11-04 |
| US8123775B2 (en) | 2012-02-28 |
| AU2003257182A1 (en) | 2004-02-23 |
| WO2004012587A3 (en) | 2004-06-10 |
| EP1545322B1 (en) | 2019-10-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2005534429A (ja) | 塞栓症予防デバイス | |
| US7879067B2 (en) | Fiber based embolism protection device | |
| JP4916854B2 (ja) | ぜい弱性プラークを治療するための装置 | |
| US5823198A (en) | Method and apparatus for intravasculer embolization | |
| US5891192A (en) | Ion-implanted protein-coated intralumenal implants | |
| US8048042B2 (en) | Medical articles incorporating surface capillary fiber | |
| JP4416151B2 (ja) | 環境の変化に応答して体積が膨潤するヒドロゲルならびにそれらの製造法および利用法 | |
| JP4856339B2 (ja) | ヒドロゲルからなる血管塞栓材及びそれを使用した治療方法 | |
| US5456693A (en) | Embolization plugs for blood vessels | |
| US20030014075A1 (en) | Methods, materials and apparatus for deterring or preventing endoleaks following endovascular graft implanation | |
| JP2007521041A (ja) | 重合性の再拘束可能で再配置可能で取外し可能な経皮的血管内ステントグラフト | |
| EP0853465A1 (en) | Endovascular support device and method of use | |
| JP2004531331A (ja) | 薬剤投与器具 | |
| ES2248398T3 (es) | Dispositivos medicos revestidos y su esterilizacion. | |
| JP4687174B2 (ja) | ステント | |
| JP2004261218A (ja) | 血管塞栓用組成物 | |
| JP2004527268A (ja) | 罹患した動脈の血管再構築のための方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060721 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060721 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090602 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090827 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100224 |