JP2005527510A - 癌の治療において一酸化窒素模倣体を使用するための製剤および方法 - Google Patents
癌の治療において一酸化窒素模倣体を使用するための製剤および方法 Download PDFInfo
- Publication number
- JP2005527510A JP2005527510A JP2003572598A JP2003572598A JP2005527510A JP 2005527510 A JP2005527510 A JP 2005527510A JP 2003572598 A JP2003572598 A JP 2003572598A JP 2003572598 A JP2003572598 A JP 2003572598A JP 2005527510 A JP2005527510 A JP 2005527510A
- Authority
- JP
- Japan
- Prior art keywords
- nitric oxide
- cells
- cancer
- malignant
- mimic
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/662—Phosphorus acids or esters thereof having P—C bonds, e.g. foscarnet, trichlorfon
- A61K31/663—Compounds having two or more phosphorus acid groups or esters thereof, e.g. clodronic acid, pamidronic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Abstract
Description
本発明出願は2002年3月6日に出願された米国仮出願第60/362,969号、および2002年3月7日に出願された第60/362,20号、および、2001年10月25日に出願された米国出願第10/042,039号の利益を請求し、前記出願は参照として本明細書に組み入れられる。米国出願第10/042,039号は2001年4月26日出願の米国出願第09/842,547号の継続出願であり、これは2001年3月21日に出願された米国仮出願第60/277/469号および2000年4月26日出願の第60/199,757号の利益を請求し、前記出願は参照として本明細書に組み入れられる。
本発明は、悪性細胞表現型、細胞および/または疾患を阻害、処置および防止する方法ならびに処方に関する。本発明者らは、低酸素症および低窒素症が細胞表現型に影響を及ぼす機構は、必ずしも低酸素によって媒介されるのではなく、むしろ一酸化窒素を介するシグナル伝達(signaling)の欠損によることを今回発見した。従って本明細書において明らかにされるように、一酸化窒素模倣体の投与(例えば低用量)は、細胞の一酸化窒素媒介シグナル伝達を増加、回復または維持し、その結果悪性細胞表現型、細胞、腫瘍および/または疾患が阻害または防止されるのに十分である。従って本明細書において、悪性細胞表現型、細胞、腫瘍および/または疾患を阻害し、および/または悪性細胞表現型、細胞、腫瘍および/または疾患の発生を防止するが、NO模倣体の望ましくない作用の発生は低下または回避するようなレベルで、低用量一酸化窒素模倣体を細胞に送達するための処方およびこれらの処方を使用する方法が提供される。これらの方法および処方は、動物における癌の治療および防止に特に有用である。
低酸素症または細胞における正常な生理レベル以下の酸素圧は、細胞の生理学的、更には病理学的変化を生じ、その変化は示差的遺伝子発現に関連する。例えば低酸素症は、血管作動性物質の転写により調節された発現の変調または血管および周囲組織の再構築を含む様々な方法で、インビボおよびインビトロにおいて、内皮細胞の生理に影響を及ぼす(Faller, D.V.、Clin. Exp. Pharmacol. and Physiol.、26:74-84(1999))。固形腫瘍における低酸素症は、癌細胞をX線照射により殺傷されることから守り、かつある種の抗癌剤に対する抵抗性をもたらすことが示されている。更に低酸素症は、悪性進行を促進しかつ転移を増大すると考えられる(Brown, J.M.、Cancer Res.、59:5863-5870(1999))。
本発明者らは本明細書において、低酸素症および低窒素症が細胞表現型に影響を及ぼす機構が、酸素の欠乏によってのみではなく、むしろ一酸化窒素模倣活性の欠損によって媒介されることを明らかにする。更に本発明者らは本明細書において、低用量一酸化窒素模倣体の投与は、細胞の一酸化窒素模倣活性のレベルを増加、回復または維持し、その結果悪性細胞表現型が阻害または防止されるのに十分であることを明らかにする。この阻害および防止は、細胞が低酸素状態環境にある場合および/または内因性一酸化窒素生成の阻害と組合わせた場合にも生じる。一酸化窒素模倣体は、正常酸素圧下ならびに低酸素条件下において、効果的である。非常に低用量の一酸化窒素模倣体の投与は、例え顕著に低下した酸素レベル(1%O2)条件下であっても、悪性細胞表現型の生成を防止し、かつ細胞の悪性細胞表現型を阻害する。
「治療すること」または「治療」とは、長期化した癌の後退、再発の防止、癌マーカーの低減、癌容量の低減、疼痛、不快感および障害(病的状態)の低減、抗悪性疾患治療手段に伴う生活の質の向上、粘液性の低減、および、抗嘔吐剤および麻薬性鎮痛剤の必要性の低減を含むものとする。「作用の増大」とは、抗悪性疾患治療手段の力価および/もしくは活性の増大、ならびに/または抗悪性疾患治療手段への耐性の発生の低減、ならびに/または、抗悪性疾患治療手段に対する悪性細胞および/もしくは腫瘍の感受性の増大を含むものとする。本発明はまたNO模倣体(例えば低用量)療法の存在下での動物における腫瘍選択性マーカーの測定を介して動物における悪性細胞の表現型のモニタリングおよび/または診断の方法に関する。腫瘍の進行および転移のモニタリングおよび診断において有用な腫瘍マーカーの例としては、例えば、前立腺癌に関する前立腺特異的抗原(PSA)、胃腸癌に関する癌胎児性抗原(CEA)およびガストリンまたはグルカゴンのようなポリペプチド、精巣癌に関するα-フェトプロテイン(AFP)およびβhCG、生殖細胞癌におけるα-フェトプロテイン(AFP)、ヒト絨毛ゴナドトロピン(HCG)およびラクテート脱水素酵素(LDH)、絨毛癌におけるHCG、肝細胞癌における血清AFP、小細胞肺癌におけるニューロン特異的エノラーゼ(NSE)、骨髄腫における予後指標となるパラプロテイン濃度およびB2-ミクログロブリン、カルチノイド腫瘍における5-ヒドロキシインドール酢酸(5HIAA)尿レベル(urine level)、扁平上皮細胞癌に関する扁平上皮細胞癌抗原(SCC)およびサイトケラチンフラグメント、頚部癌における予後的情報に関するSCCおよびCA125、胃がんに関するCA19-9およびCA72-4、非小細胞肺癌におけるp-セレクチンリガンドを含む種々の癌に関するCD24、前立腺癌の予後に関するNFκB、卵巣癌に関する血清腫瘍マーカーCA125、悪性中皮腫に関する診断マーカーとしてのCDKN2A、膵臓腺管癌におけるジスアドヘリンの過剰発現、結腸直腸癌患者における予後マーカーとしてのSMAD7、進行した疾患を有する乳癌患者に関する潜在的予後マーカーとしてのTGFβ1、小細胞肺癌の予後的決定因子としての神経内分泌性およびサイトケラチン性の血清マーカー、転移性骨肉腫細胞に関するマーカーとしてのErbB2および骨シアロタンパク質、乳癌に関するサイクリンEおよびCA15-3、ならびに乳癌に関するエストロゲンおよびHer-2に対する細胞表面受容体が挙げられる。診断目的のためにモニタリングできる更なるマーカーとしては、例えば、髄質甲状腺癌の診断およびスクリーニングのためのカルシトニンおよびカルシトニン関連ペプチド、NDRG-1としても知られているOXYgen-1により調節されるタンパク質(PROXY-1)、プラスミノーゲンアクチベーターインヒビター(PAI-1)、ウロキナーゼ型プラスミノーゲンアクチベーター受容体(uPAR)および血管内皮成長因子(VEGF)が挙げられる。更にまた、本明細書を読むことにより当業者に理解されるように、本明細書に記載したもの以外の腫瘍マーカーもまた本発明において挙げることができる。好ましい態様においては、腫瘍マーカーは血清、血漿または尿のような生物体液中で検出可能なものである。低用量の一酸化窒素模倣体の投与の前の動物におけるマーカーの濃度と比較した場合に低用量の一酸化窒素模倣体の投与後の動物においてそのマーカーの一つまたは複数の濃度の変化、低下、または上昇緩徐化があることは、動物における悪性細胞の表現型を示している。
好ましい態様においては、本発明の化合物はNOドナーである。一酸化窒素ドナーは種々のNOドナーのいずれか、例えば有機NOドナー、無機NOドナーおよびNOドナーのプロドラッグを含むことができる。更なる適当なNOドナーには、インビボで代謝されて一酸化窒素を供給する化合物となる化合物(例えば、NOドナーのプロドラッグ型;NO放出非ステロイド抗炎症剤(NO-NSAID)のようなNO放出薬剤、例えばニトロアスピリン、NCX4016、ニトロ-(フルルビプロフェン)、HCT1026、NCX2216;もしくはバイナリNO発生システム(例えば酸性化ニトレート等)またはL-アルギニンおよびL-アルギニン塩のような一酸化窒素の生理学的前駆体として作用する化合物が含まれる。NOドナーは少なくとも1個の有機性ニトレート(硝酸のエステルを含む)を含み、環状または非環状の化合物の何れかであることができる。例えば、適当なNOドナーには、ニトログリセリン(NTG)、イソソルビドジニトレート(ISDN)、イソソルビドモノニトレート(ISMN)例えばイソソルビド-2-モノニトレート(IS2N)および/またはイソソルビド-5-モノニトレート(IS5N)、エリスリチルテトラニトレート(ETN)、ペンタエリスリトールテトラニトレート(PETN)、エチレングリコールジニトレート、イソプロピルニトレート、グリセリル-1-モノニトレート、グリセリル-1,2-ジニトレート、グリセリル-1,3-ジニトレート、ブタン-1,2,4-チオールトリニトレート等が含まれる。ニトログリセリンおよび他の有機性のニトレート、例えば、ISDN、ETNおよびPETNは、ヒトを対象とした医療の他の分野における治療における使用について法的に認可されている。更なるNOドナーには、ナトリウムニトロプルシド、N,O-ジアセチル-N-ヒドロキシ-4-クロロベンゼンスルホンアミド、N-ヒドロキシ-L-アルギニン(NOHA)、ヒドロキシグアニジンスルフェート、モルシドミン、3-モルホリノシドノニミン(SIN-1)、(±)-S-ニトロソ-N-アセチルペニシラミン(SNAP)、S-ニトオソグルタチオン(GSNO)、(±)-(E)-エチル-2-[(E)-ヒドロキシイミノ]-5-ニトロ-3-ヘキセンアミド(FK409)、(±)-N-[(E)-4-エチル-3-[(Z)-ヒドロキシイミノ]-5-ニトロ-3-ヘキセン-1-イル]-3-ピリジンカルボキサミド(FR144420)および4-ヒドロキシメチル-3-フルオロキサカルボキサミドが含まれる。更に、インビボでNOの分解を妨害する化合物を投与してもよい。
特定の態様において、本発明の化合物および方法は上記した伝統的な一酸化窒素模倣体に限定されない。後により詳述するとおり、これらの一酸化窒素模倣体化合物は、例えば、カルシウムチャンネルブロッカー、α-アドレナリン受容体アンダゴニストおよびβ-アドレナリン受容体アゴニスト、ホスホジエステラーゼインヒビター、cAMP依存性タンパク質キナーゼアクチベーター、スーパーオキシドスカベンジャー、カリウムチャンネルアクチベーター、ベンゾジアゼピン、アドレナリン作用性神経インヒビター、抗下痢剤、HMG-CoA還元酵素インヒビター、アデノシン受容体モジュレーター、アデニリルシクラーゼアクチベーター、エンドセリン受容体アンダゴニスト、ビスホスホネート、cGMP依存性タンパク質キナーゼアクチベーター、グアニリルシクラーゼアクチベーターおよびSOCインヒビターを含む。特定の局面において、化合物は低用量に限定されない。当然ながら低用量を使用できるが、これらの化合物の用量はそのように限定されるわけではない。以下に記載する化合物(例えばPDEインヒビター)は高用量および低用量のような種々の用量で使用できる。
Ca2+チャンネルブロッカーは細胞外の液体から細胞内へのCa2+の進入を抑制する化合物である。本発明の方法とともに使用するための適当なCa2+チャンネルブロッカーは、例えば、ニフェジピン、ニモジピン、フェロピジン、ニカルジピン、イスラジピン、アムロジピン、ジルチアゼム、ベプリジル、ベラパミル等を含む(例えばWO98/36733参照)。L-型Ca2+チャンネルブロッカーもまた利用される。
本発明の文脈内で使用するための別の好ましい化合物には、例えばα-アドレナリン受容体アンダゴニストおよびβ-アドレナリン受容体アゴニストが含まれる。適当なα-アドレナリン受容体アンダゴニストには、例えばα1-アドレナリン受容体アンダゴニスト、α2-アドレナリン受容体アンダゴニストおよび他の非特異的α-アドレナリン受容体アゴニストが含まれる。好ましいα1-アドレナリン受容体アンダゴニストには例えば、プラゾシン、ドキサゾシン、フェノキシベンザミン、フェントラミン、テラゾシン、トラゾリン等が包含され、例えばGoodmanおよびGilman,「The Pharmaceutical Basis of Therapeutics」,9th Edition,Hardman,ら、(ed.),McGraw-Hill(1996)に記載されている。適当なα2-アドレナリン受容体アンダゴニストには例えばヨヒンビンが包含され、そしてやはり、Goodman and Gilman,「The Pharmaceutical Basis of Therapeutics」,9th Edition,Hardman,ら、(ed.),McGraw-Hill(1996)に記載されている。他の適当なアンダゴニストはα2-アドレナリン作用性アンダゴニストであり、例えばシナプス後のα2-アドレナリン作用性アンダゴニストが含まれる。シナプス後のα2-アドレナリン作用性アンダゴニストには、例えばイミロキサン、2塩酸ARC239および他の薬学的に許容されるその塩が含まれる。2塩酸ARC239は2-[2-(4-(2-メトキシフェニル)ピペラジン-1-イル)エチル]-4,4-ジメチル-1,3-(2H,4H)-イソキノリンドンジハイドクロライドである。他の適当なシナプス後のα2-アドレナリン作用性アンダゴニストには、例えばイダゾキサン、ラウオルシン、エファロキサン、ミアンセリンおよびミルタザピンが含まれる。これらのうち、ミアンセリンおよびミルタザピンが特に好ましい。本発明の方法とともに使用するための適当なβ-アドレナリン受容体アゴニストには、例えば、β1-アドレナリン受容体アゴニスト、β2-アドレナリン受容体アゴニスト、β3-アドレナリン受容体アゴニストおよび他の非特異的なβ-アドレナリン受容体アゴニストが含まれる。好ましい態様においては、β-アドレナリン受容体アゴニストはβ2-アドレナリン受容体アゴニストまたはβ3-アドレナリン受容体アゴニストである。本発明の方法とともに使用するための適当なβ-アドレナリン受容体アゴニストの例は、例えば、アルブテロール、ビトルテロール、サルブタモール、テルブタリン、メタプロテレノール、プロカテロール、サルメテロール、クレンブテロール、イソプロテレノール、ジンテロール、BRL37344、CL316243、CGP-12177A、GS332、L-757793、L-760087、L-764646およびL-766892等である(例えば前記のGoodman and Gilman参照)。
別の好ましい態様においては、化合物はホスホジエステラーゼインヒビターである。環状ヌクレオチドの第2のメッセンジャー(cAMPおよびcGMP)はシグナル伝達および生理学的応答の調節において中心的役割を果たしている。その細胞内濃度は環状ヌクレオチドホスホジエステラーゼ(PDE)酵素の複合的なスーパーファミリーにより制御されている。ホスホジエステラーゼ(PDE)のインヒビターは酵素とのアロステリックな相互作用または酵素の活性部位への結合を介してPDEを活性化または抑制することができる物質である。PDEファミリーには少なくとも19種の遺伝子および少なくとも11種のPDEアイソザイムファミリーが含まれ、50を超えるアイソザイムがこれまでに同定されている。PDEは(a)基質特異性、即ち、cGMP特異的、cAMP特異的または非特異的PDE、(b)組織、細胞または細胞成分の分布、および(c)異なるアロステリックアクチベーターまたはインヒビターによる調節により、識別される。PDEインヒビターには非特異的PDEインヒビターおよび特異的PDEインヒビター(ホスホジエステラーゼのいずれかの他の型に対してはほとんど作用を有さずにホスホジエステラーゼの単一の型を抑制するもの)の両方が含まれる。更に別の有用なPDEインヒビターはデュアル選択的PDEインヒビター(例えばPDE III/IVインヒビターまたはPDE II/IVインヒビター)である。本発明の方法において有用な種々のPDEインヒビターを示す表を以下に示す。
別の好ましい態様において、本明細書に記載する障害を治療するために使用する化合物はcAMP依存性タンパク質キナーゼアクチベーターである。cAMP依存性タンパク質キナーゼアクチベーターの例には、cAMP模倣体またはデュアルcGMP/cAMP依存性タンパク質キナーゼアクチベーターが含まれる。適当なcAMP模倣体または類縁体にはcAMPと構造的に同じであり、cAMPと同様の機能、例えば活性を有する化合物が含まれる。適当なcAMP模倣体の例には、例えば、8-ブロモ-cAMP、ジブチル-cAMP、Rp-cAMPSおよびSp-cAMPSが包含され、そして有用なデュアルアクチベーターには例えばSp-8-pCPT-cGMPS、Sp-8-ブロモ-cGMPSおよび8-CPT-cAMPが含まれる。
別の態様において、本発明の組成物および方法において使用される化合物はスーパーオキシドアニオン(O2)スカベンジャーである。スーパーオキシドはNOと反応してその生物学的作用を劇的に低下させることができる。従って、スーパーオキシドアニオンを除去する(scavenge)物質はNOの作用を増強できる。スーパーオキシドスカベンジャーの例は、例えば、外因性のMnまたはCu/Znスーパーオキシドジスムターゼ(SOD)または小分子SOD模倣体、例えば塩化Mn(III)テトラ(4-安息香酸)ポルフィリン(MnTBAP)およびM40403である(例えばSalveminiら、Science,286(5438):304-306(1999)参照)。
別の局面において、本発明はカリウムチャンネルアクチベーターを含む薬学的組成物を提供する。1つの態様において、カリウムチャンネルアクチベーターはATP感受性のカリウムチャンネルアクチベーターである。ATP感受性Kチャンネルを活性化する合成化合物は平滑筋弛緩物質である。このような化合物は例えば、モノキシジル、モノキシジルスルフェート、ピノシジル、ジオゾキシド、レブクロモカリム、クロモカリム等である(例えばWhiteら、Eur.J.Pharmacol.,357:41-51(1998)参照)。別の適当なATP感受性Kチャンネルアクチベーターは、例えばBristolら、「Annual Reports in Medicinal Chemistry」Vol.29,Chap.8,pp.73-82,Academic Press(1991)に記載されている。別の態様において、カリウムチャンネルアクチベーターはMaxi-Kチャンネルアクチベーターである。Maxi-Kチャンネルのアクチベーターの例は、例えばエストロゲン様化合物、例えばエストラジオールである(例えばValverdeら、SCIENCE,285:1929-1931)。
別の局面において、本発明はベンゾジアゼピンを含む薬学的組成物を提供する。適当なベンゾジアゼピンは、これらに限定するわけではないが、例えば、アルプラゾラム、ブロチゾラム、クロルジアゼポキシド、クロバザム、クロナゼパム、クロアゼペート、デモキセパム、ジアゼパム、エスタゾラム、フルマゼニル、フルラゼパム、ハラゼパム、ロラゼパム、ミダゾラム、ニトラゼパム、ノルダゼパム、オキサゼパム、プラゼパム、クアゼパム、テマゼパムおよびトリアゾラムである(例えば前記のGoodmanおよびGillman参照)。
別の局面において、本発明の化合物はアドレナリン作用性神経を抑制する化合物である。アドレナリン作用性神経インヒビターは、交感神経末端を破壊する化合物、例えば、6-ヒドロキシドーパミンおよびその類縁体を含む(例えば前記のGoodmanおよびGillman参照)。アドレナリン作用性神経インヒビターはまた、ノルエピネフリンの生合成を抑制するか貯留量を枯渇させることのいずれかによりノルエピネフリンの貯蔵を枯渇させる化合物およびノルエピネフリンの放出を抑制する化合物を含む。ノルエピネフリンの生合成を抑制する化合物は、例えばα-メチルチロシンである。ノルエピネフリンの貯留量を枯渇させる化合物は、例えばレセルピン、グアネチジンおよびブレチリウムである。ノルエピネフリンの放出を抑制する化合物は、例えばクロニジンおよび他のα2-アドレナリン受容体アンダゴニストである。交感神経末端破壊物質の例は、例えばα2-アドレナリン受容体アンダゴニストである。
別の局面において、本発明の化合物は抗下痢剤である。適当な抗下痢剤の例は、これらに限定するわけではないが、ジフェノキシレート、ロペルアミド、ビスマスサブサリシレート、オクトレオチド等である(例えば前記のGoodmanおよびGillman参照)。
別の局面において、本発明の化合物はHMG-CoA還元酵素インヒビターである。HMG-CoA還元酵素インヒビターの例は、これらに限定するわけではないが、メバスタチン、ロバスタチン、シンバスタチン、プラバスタチン、セリバスタチン、デルバスタチン、アトロバスタチン、フルバスタチン等である(例えば前記のGoodmanおよびGillman参照)。
別の態様において、本発明の化合物は平滑筋弛緩剤、例えばヒドララジン、パパベリン、チロプラミド、シクランデレート、イソキスプリンおよびニリドリンである。
別の局面において、本発明はアデノシン受容体モジュレーターを単独または他の薬剤と組み合わせて含む悪性細胞の表現型の治療のための組成物を提供する。これらの組成物の使用方法も提供する。態様における1つのグループでは、アデノシン受容体モジュレーターは単独で使用される。態様における別のグループでは、アデノシン受容体モジュレーターは他の筋肉弛緩剤一つまたは複数と組み合わせられる。別の態様においては、本発明の化合物はメチルキサンチンのようなアデノシン受容体モジュレーターである。アデノシン受容体モジュレーターの例はテオフィリンおよびジフィリンを含む。他の例については前記のGoodmanおよびGillmanを参照できる。好ましい薬剤は上記した単独薬剤または複合剤の組成物を参照しながら説明されるものから選択される。
別の局面において、本発明はアデニリルシクラーゼアクチベーターを単独または本明細書に記載した他の化合物または薬剤と組み合わせて含む組成物を提供する。アデニリルシクラーゼアクチベーターであるフォルスコリンが好ましい。アデニリルシクラーゼアクチベーターの他の例は、N6、O2’-ジブチリル-cAMP、8-クロロ-cAMPおよびアデノシン3’、5’-環状モノホスホロチオエートのRp-ジアステレオマー、ならびに関連の類縁体、例えばRp-8-ブロモ-アデノシン3’、5’-環状モノホスホロチオエート、および塩酸コルフォルシンダロペートを含むフォルスコリンの誘導体を含む。
別の局面において、本発明はエンドセリン受容体アンダゴニストを単独または本明細書に記載した他の化合物と組み合わせて含む組成物を提供する。エンドセリン受容体アンダゴニストの例は、BE1827B、JKC-301、JKC-302、BQ-610、W-7338A、IRL-1038、LRL-1620、ボセタン、ABT627、Ro48-5695、Ro61-1790、テソセンタン(Ro61-0612、ZD1611、BMS-187308、BMS-182874、BMS-193884、シタキセンタン(TBC11251)、TBC2576、TBC3214、TBC-10950、ABT-627、アトラセタン、A-192621、A-308165、A-216546、CI-1020、EMD122946、J-104132(L753037)、LU127043、LU135252、LU302872、TAK-044(69)、SB209670、SB234551、SB247083、ATZ1993、PABSA、L-749,329、RPR111723、RPR11801A、PD164800、PD180988(CI1034)、IRL3630、IRL2500およびこれらの誘導体などを含む(Doherty,Annual Reports in Medicinal Chemistry,Volume 35,pp.73-82,Academic Press,2000参照)。エンドセリン受容体アンダゴニストであり本発明の方法において有用な他のエテンスルホンアミド誘導体はHaradaら、Chem.Pharm.Bull.,49(12):1593-1603(2001)に記載されている。
別の局面において、本発明はビスホスホネートを単独または他の薬剤と組み合わせて含む組成物を提供する。本発明の方法において使用するための適当なビスホスホネートは、例えば、アレンドロネートナトリウム(Fosamax)、パミドロネートジナトリウム(Aredia)、エチドロネート2ナトリウム(Ididronel)等である。
別の局面において、本発明は、cGMP依存性タンパク質キナーゼアクチベーターを単独または本明細書に記載した他の薬剤と組み合わせて提供する。適当なcGMP依存性タンパク質キナーゼアクチベーターの例は、cGMP模倣体またはデュアルcGMP/cAMP依存性タンパク質キナーゼアクチベーターである。適当なcGMP模倣体または類縁体には、構造的にcGMPと同様であり、cGMPと同様の機能、例えば活性を有する化合物を含む。適当なcGMP模倣体の例には、8-ブロモ-cGMP、ジブチリル-cGMP、Rp-cGMPS、およびSp-cGMPSが包含され、有用なデュアルアクチベーターは例えばSp-8-pCPT-cGMPS、Sp-8-ブロモ-cGMPSおよび8-CPT-cAMPを含む。
例えば、BAY41-2272はNOと相乗作用的方法において精製された酵素を活性化させる可溶性グアニリルシクラーゼの新しいの非NO系の直接の促進剤である。
別の局面において本発明は貯留作動性カルシウム流入(SOC)インヒビターを提供し、これは、細胞内カルシウム貯留プールの促進物質媒介の枯渇に応答した非興奮細胞内へのカルシウム取り込みを阻害する。SOCインヒビターは好ましくは以下の物質、即ち、活性化T細胞の核因子(NFAT)、各因子kB(NF-kB)、ストレスキナーゼc-JunN-末端キナーゼ(JNK)のカルシウム依存性活性化およびエキソサイトーシスの一つまたは複数を抑制し、これにより炎症メディエータの放出または同化をもたらす。SOCインヒビターの例としては、δ-ラクトン型のスタチン類、例えばロバスタチン、メバスタチン、フルバスタチン、パラバスタチン、ダルバスタチン、セリバスタチン、アトロバスタチンおよびシンバスタチンが含まれる。
実施例1:材料および方法
A.材料
組織培養培地(RPMI 1640)およびウシ胎仔血清(FBS)は、Gibco BRL社(グランドアイランド、NY)から購入した。低酸素条件は、BellCo Biotechnology社(ビネランド、NJ)の密閉チャンバーを用いて作り出した。GTNは、DuPont Pharmaceuticals社(スカボロー、ON)から、エタノール、プロピレングリコールおよび水(1:1:1.33)を溶媒とする溶液(TRIDIL、5mg/mlまたは2.22M)として入手した。ニトロプルシドナトリウム(SNP)は、Sigma Chemical社(セントルイス、MO)から購入した。RNA抽出は、Gentra Systems社(ミネアポリス、MN)のPURESCRIPT RNA単離キットを用いて行った。ノーザンブロットアッセイ法のために、RNA転写に使用したナイロン膜は、Micron Separations社(ウェストボロ、MA)から購入し;uPARおよびPAI-1 cDNAプローブは、Bluescriptプラスミドベクターにクローニングし;[32P]-dCTPおよびReflection NEFフィルムは、Dupont/New England Nuclear社(ミシソーガ、ON)から購入し;ならびに、オリゴ標識キットは、Pharmacia Biotech社(ピスカタウェイ、NJ)から入手した。In vitro浸潤アッセイについて、血清非含有EX-CELL 300培養培地を、JRH Biosciences社(レネキサ、KS)から購入し、Costar TRANSWELLインサート(insert)(直径6.5mmのポリカーボネート、膜、孔径8μm)は、Corning Costar社(ケンブリッジ、MA)から購入し、および再構成された基底膜(Materigel)は、Collaborative Biomedical Products社(ベッドフォード、MA)から得た。プラスミノーゲンアクチベーターインヒビター-1(PAI-1)酵素結合免疫吸着アッセイ(ELISA)キットは、American Diagnostica社(グリーンウィッチ、CT)から入手した。uPARのウェスタンブロットアッセイ法のために、溶解したタンパク質を、Millipore社(ベッドフォード、MA)のImmobilon-P膜に転写し、抗uPAR抗体(モノクローナル抗体[MoAb]3937)は、American Diagnostica社(グリーンウィッチ、CT)から購入し、ブロッティング用の等級のアフィニティ精製したヤギ抗マウスIgG(H+L)ホースラディッシュペルオキシダーゼ複合体は、BIO-RAD社(ヘラクレス、CA)から購入し、かつこの抗原は、Amersham Canada社(ミシソーガ、ON)の試薬を用いる増強型ケミルミネッセンス(ECL)により検出した。ザイモグラフ分析用のゼラチンをBDH社(トロント、ON)から購入し、カゼインをSigma Chemical社(セントルイス、MO)から、およびプラスミノーゲンをAmerican Diagnostica社(グリーンウィッチ、CT)から購入した。
これらの実験においては、HTR-8/SVneo浸潤性栄養芽層細胞株およびMDA-MB-231転移性乳癌細胞株を用いた。HTR-8/SVneoおよびMDA-MB-231細胞は両方とも、5%FBSを補充したRPMI-1640培地において培養した。
MDA-MB-231細胞株は、1973年に51歳の乳癌患者の胸腔滲出液から始めて単離された(Callieauら、J. Nat. Cancer Inst.、53:661-674(1974))。
細胞を、密閉チャンバーに入れ、5% CO2:95% N2を含有する混合ガスを、酸素濃度のMinioxi Oxygen Analyzer(Catalyst Research社、オーイングミル、MD)による測定値が0%となるまで、フラッシュした。次に細胞を、37℃でインキュベーションした。インキュベーションの最初の2時間以内に、チャンバー内の酸素レベルはおよそ1%に平衡化し、かつこのレベルにインキュベーションの残りの期間維持した。
これらの実験において、細胞は、様々な濃度のGTNおよびSNPにより処理した。GTN保存液は最初に、リン酸緩衝生理食塩水(PBS)により、濃度10-4Mへ希釈した。濾過後、GTN溶液を、培養培地で、濃度10-4M〜10-11Mの範囲に希釈した。SNP(当初は結晶形)は、蒸留水に溶解し、濃度10-5Mに希釈した。濾過後、このSNPを培養培地で濃度10-6M〜10-12Mの範囲に希釈した。
細胞を、様々な濃度のGTNおよびSNPと共に、低酸素(1%O2)または対照(20%O2)条件下、37℃で培養した。別の実験セットにおいて、MDA-MB-231細胞を、LMMA(0.5mM)の存在または非存在下で、様々なレベルの酸素(1%、5%または20%O2)下、37℃で24時間インキュベーションした。インキュベーション後、これらの細胞から全細胞RNAを、Gentra社のPURESCRIPT RNA単離キットを用いて単離した。その後単離したRNAは、電気泳動により分離し、かつ帯電したナイロン膜へと転写した。これらの膜を、50%ホルムアミド、5X Denhardt液、0.5%ドデシル硫酸ナトリウム(SDS)、6X SSC(1xSSC=0.15M NaCl、15mMクエン酸ナトリウム、pH7.0)および100μg/mL変性サケ精子DNAを含有する溶液中、42℃でおよそ2時間プレハイブリダイゼーションした。その後これらを、6X SSC、0.5%SDS、100μg/mL変性サケ精子DNAおよび50%ホルムアミドで構成され、およびPharmacia Oligolabellingキットを用い[32P]-dCTPで標識されたcDNAプローブ(uPARまたはPAI-1)を含有する溶液中で、およそ24時間42℃で、[32P]-dCTP標識したcDNAプローブ(uPARまたはPAI-1)とハイブリダイゼーションした。連続洗浄した後この膜を用い、Dupont Reflection NEFフィルムを露光した。1〜4日後、フィルムを現像し分析した。各試料に負荷したRNA量の差異を補正するために、28S rRNAを用いた。
uPARタンパク質のレベルを試験するために、最初に細胞を、様々な濃度のSNPまたはGTNが存在する20%O2または1%O2中で培養した。インキュベーション後、これらの細胞を、40mM HEPES(pH7.2)、100mM NaCl、20%グリセロール、0.1mM EDTA(pH8.0)、0.2%トリトンX100、1mM DTT、および2mM PMSFを含有する緩衝液を用いて溶解した。その後これらの溶解液に、ホモジネーション、DNA剪断(25 5/8ゲージ針を用い10回)、煮沸(5分間)および遠心(15分間, 14000g)を施した。上清を収集し、かつ使用時まで-80℃で貯蔵した。試料に、SDS-ポリアクリルアミドゲル電気泳動(PAGE)を施し、溶解したタンパク質を、湿式転写装置(Bio-Rad Laboratories社、ミシソーガ、ON)を用い、Immobilon-P膜に転写した。これらの膜を、1%PBS、および0.01%Tween20(PBS-T)に加え、5%カゼインを含有する溶液中で、4℃で一晩ブロックした。これらのブロットを引き続き、モノクローナル抗uPAR抗体[MoAb 3937]と共に1.5時間インキュベーションし、引き続きPBS-Tで5分間6回洗浄した。その後これらの膜を、ホースラディッシュペルオキシダーゼ標識したヤギ抗マウスIgG二次抗体と共に1.5時間インキュベーションした。更にPBS-Tで5分間6回洗浄した後、抗原を、増強型ケミルミネッセンスにより検出し、かつブロットを、Dupont Reflection NEFフィルム上で露光した。
メタロプロテアーゼおよびプラスミノーゲンアクチベーター活性のレベルを測定するために、これらの細胞を、様々な濃度のSNPまたはGTNの存在下、低酸素または対照条件下でインキュベーションした。これらの細胞を、血清非含有培地(EX-CELL300)を用いて培養した。インキュベーション後、この培地を抽出し、かつ5,000rpmで5分間遠心した。その後上清を収集し、使用時まで-80℃で貯蔵した。SDS-ポリアクリルアミドゲルを、周知の手法に従い調製した。メタロプロテアーゼ分泌の分析のためのゲルは0.1%(w/v)ゼラチンを含有し、プラスミノーゲンアクチベーター分泌の分析のためのゲルには0.1%(w/v)カゼイン、更にはプラスミノーゲン(50μg/mL)を補充した。その後血清非含有馴化培地を、非還元(nonreducing)試料負荷緩衝液(グリセロール2mL中、0.5M Tris、10%SDS、1%ブロモフェノールブルー)と比4:1で一緒にし、煮沸しなかった。電気泳動後、ゲルに2.5%TritonX-100による15分洗浄を2回行った。この工程はSDSを除去した。H2Oで洗浄した後、ゲルを、Tris-HCl(pH7.0)およびCaCl2(5mM)含有溶液中で、37℃で一晩インキュベーションした。これらのゲルを、40%メタノール/10%氷酢酸/50%蒸留水中の0.4%クマシーブリリアントブルーR-250で、およそ1時間染色し、その後30%メタノール/10%氷酢酸/60%蒸留水中で約2時間脱色した。分子量標準品は、比較的明るい青色背景に対し、暗色のバンドを示し、かつ溶解が生じた無色のゾーンが出現した。ゼラチン含有ゲルにおいて、これらの領域は、メタロプロテアーゼ(ゼラチナーゼ)活性に対応しており、カゼインゲルにおいてはこれらのバンドは、プラスミノーゲンアクチベーター活性に対応していた。これらのゲルは、保存液(10%氷酢酸/10%グリセロール/80%蒸留水)を用いて1時間保存し、60℃で1時間セロファン上で乾燥した。
Materigel浸潤チャンバー(Boydenチャンバーの変形)を用い、様々な濃度のGTNまたはSNPの存在または非存在下で、低酸素および標準の条件下での細胞の浸潤性を評価した。これらのチャンバーは、直径6.5mmおよび孔径8μm膜の細胞培養インサートからなる。膜は各々、冷血清非含有培養培地(EX-CELL300)中に希釈した1mg/mL Materigel溶液100μLで被覆し、層流(laminar flow)キャビネット内でおよそ12時間かけて乾燥させた。その後Materigelを、100μL血清非含有培地と共におよそ1時間インキュベーションすることにより、再水和した。再水和後、血清および一酸化窒素処置物の両方を含む、培地100μL中に細胞5.0x104または1.0x105個を含む細胞浮遊液を、各ウェルに添加した。血清および各一酸化窒素処置物を含む培養培地を、各インサートに添加した。これらの細胞を、低酸素(1%O2)または対照(20%O2)のいずれかの条件下で24時間インキュベーションした。インキュベーション後、非浸潤細胞を、綿棒で拭うことにより、膜の上面から取除いた。膜の下面の細胞は、Carnoy固定液(25%酢酸、75%メタノール)により10分間固定し、その後およそ3時間、1%トルイジンブルー、1%ホウ酸ナトリウムで染色した。リン酸緩衝生理食塩水(PBS)ですすいだ後、膜を、小さい外科用メスを収容しているインサートから取除き、顕微鏡スライドガラス上に載せ、カバーグラスをかけた。次に浸潤している細胞を、倍率40Xで顕微鏡観察し、計数した。各処理に対する浸潤インデックスは、浸潤細胞数を、標準条件下で浸潤した細胞数で除算することにより算出した。その後この値を100倍し、百分率を得た。標準は100%値とし、処理値は標準についての百分率へと変換した。これらの結果を、統計学的有意性について、対のある多重比較法のためのターキー検定を、または対のある多重比較法のためのスチューデント-ニューマン-クールズ法のいずれかを用い検定した。図1参照のこと。
C57BL6マウスに、5x104〜105個のB16F1O転移性黒色腫細胞をボーラス静脈内注射した(尾静脈)。尾静脈注射直後に、マウスを無作為に15群に分け、各群のマウスを、各々、20%O2:バランス量のN2および10%O2:バランス量のN2の混合ガスを連続フラッシュしているプレキシガラスチャンバー(およそ3L)に入れた。ガス流は、チャンバー内にCO2蓄積が生じないレベルに調節した。20%O2または10%O2のいずれかの大気に24時間曝露後、マウスをチャンバーから取り出し、室内大気に維持した通常のケージに移した。13日後、マウスを、頸部脱臼により屠殺し、肺を摘出し、Bouin固定液(Sigma社)で固定した。肺表面上の転移性結節(その多くはメラニンの存在により黒色に見える)を、解剖学顕微鏡下で肉眼により計数した。データは、注射した104個細胞当りの肺結節数で表し、ノンパラメトリック値に関する統計学的検定を用いて解析した。
実験の第二セットにおいて、B16F10マウス黒色腫細胞を、2x10-11M GTNの存在または非存在下、1%または20%酸素中で12時間インキュベーションした以外は、同じプロトコールを用いた。その後細胞を、トリプシンでプレートから取除き、かつC57BL6雌マウスへ5x104個の細胞を静脈内注射した(尾静脈)。図2参照のこと。In vitroにおいて処理した細胞の一部は、組織培養皿上に配置し、I節、J節に説明したプロトコールを用い、コロニー形成能について決定した。
MDA-MB-231乳癌細胞のドキソルビシンに対する耐性を、20%または1%酸素中で培養後、形成されたコロニー数を計数することにより決定した。MDA-MB-231細胞は、1%O2または20%O2中で24時間インキュベーションした。インキュベーション後、細胞を、希釈液(対照)、25μMドキソルビシン、25μMドキソルビシン+10-6M GTNまたは25μMドキソルビシン+10-10M GTNに、1時間曝露した。これらの細胞を洗浄し、その後35mmプレート上に異なる希釈で置いた。これらの細胞を、細胞コロニーを形成させるために、更に1〜2週間インキュベーションした。インキュベーション期間の最後に、細胞をCarnoy固定液で固定し、クリスタルバイオレットで染色し、すすぎかつ風乾した。コロニーを肉眼により計数した。各条件下での生存細胞を、コロニー数を計数することにより決定し、ドキソルビシン曝露なしに生存したコロニー数の分数として表した。
A. 材料
濃度2.22Mのグリセリン三硝酸(GNT;サベックス、バウチャービル、QC)およびヂエチレントリアミン/酸化窒素付加物(DETA-NONOate;シグマケミカル、セントルイス、MO)をNO-模倣体として使用した。デスフェロキサミンメシレート(DFO;シグマケミカル、セントルイス、MO)を鉄キレート剤として使用した。1H-[1,2,4]オキサジアゾール-[4,3-a]キノキサリン-1-オン(ODQ)(シグマケミカル、セントルイス、MO )を可溶性グアニジルシクラーゼの選択阻害に使用した。様々な濃度の8-ブロモグアノシン-3’,5’-サイクリックモノホスフェート(8-Br-cGMP;シグマケミカル、セントルイス、MO )をcGMP-依存性タンパク質キナーゼの活性化に使用し、KT5823(カルビオケム、ラヨロラ、CA)をPKG選択阻害に使用した。
HRT-8/SVネオ株をヒト妊娠初期胎盤の体外移植培養で確立し、サルウイルス40の巨大T抗原をトランスフェクションして不死化した。これらの細胞はインビトロでその親株HTR-8細胞に類似した侵襲能を示し、ヌードマウスで腫瘍発生性を示さなかった。その細胞を130代にわたって維持され、インビトロで増殖を維持するためには少なくとも5%の血清を要求した(Graham,Hawleyら、1993ID:1080)。
低酸素条件にするため、所定の酸素濃度に達するまで5%CO2/95%N2を吹き込んだ混合ガス気密チャンバー(ベルコバイオテクノロジー、ヴィネランド、NJ)内に細胞を置いた。Pro-Oxモデル110酸素レギュレーター(レミングバイオスフェリックス、レッドフィールド、NY)を用いて酸素レベルを維持した。
インキュベーション後、GENTRA PURESCRIPT(登録商標)RNA単離キット(ジェントラシステムズミネアポリス、MN)を用いて全細胞RNAを単離した。単離したRNAを次に電気泳動で分離し、荷電ナイロン膜(ミクロンセパレーション社、ウエストボロ、MA)に移し、UVクロスリンカー(商品名)を用いてUV光線で固定した。膜を余熱した紫外線感受性ハイブリダイゼーション緩衝液ULTRAAhyb(商標)(アンビオン、オースチン、TX)中で68℃、約1時間で予備ハイブリダイゼーションした。次いで膜をDIGラベルuPARプローブと68℃で一晩ハイブリダイゼーションした。プローブを作製するため、ブルースクリプトプラスミドベクター中にクローン化したuPAR cDNAを直線化した。次いで直線状のcDNAをDIGラベルRNAラベリングミックスとT3RNAポリメラーゼ(モレキュラーバイオケミカルズ、インディアナポリス、IN)でインビトロ転写した。ハイブリダイゼーション後、膜を2× SSC、0.1%SDS中で2回洗浄し(68℃、5分)、次いで0.1× SCC、0.1%SDS中で2回洗浄した(68℃、15分)。バンドをDIG発光性検出キット(ロッシュモレキュラーバイオロジーズ、インディアナポリス、IN)を用いて検出し、膜をデュポン反射NEF(DuPont Reflection NEF)フィルム(デュポン/ニューイングランドニュークレア、ミシサーガ、ON)に露光した。
インキュベーション後、細胞を40mM HEPES pH7.2、100mM NaCl、20%グリセロール、0.1mM EDTA pH8.0、0.2%Triton-X100、1mMジチオトレイトール(DTT)および2mMフェニルメチルスルフォニルフルオライド(PMSF)を含む緩衝液を用いて溶解した。溶解物を均一化、DNAシェアリング(255/8ゲージ注射針で10回)、煮沸(5分間)および遠心(14,000×gで15分間)した。上澄を集め、使用するまで-80℃で保存した。試料をSDSポリアクリルアミドゲル電気泳動(PAGE)にかけ、湿式移動装置を用いて(バイオラッドラボラトリーズ、ミッシサウガ、ON)分離したタンパク質をイモビリオン-P-膜(ミリポア社、ベッドフォード、MA)に移行した。膜を1%PBS、0.01% Tween20(PBS-T)および5%乾燥粉末乳を含む溶液中、4℃で一晩ブロックした。次いでブロットをモノクローナル抗uPAR(MoAb3937;アメリカンダイアグノスティック社、グリーンヴィッチ、CT)またはポリクローン可溶性グアニレートシクラーゼ(sGC)抗血清(カイマンケミカル、アンアーバー、MI)と共に1.5時間インキュベートし、続いてPBS-Tで5分間、5回洗浄した。次にuPAR膜をセイヨウワサビペルオキシダーゼ標識ヤギ抗マウスIgG 2次抗体(バイオラッド、ヘラキュレス、CA)と共に1時間インキュベートし、sGC膜をヤギ抗ウサギIgG-セイヨウワサビ複合体(ベクターラボラトリーズ社、バーリンゲーム、CA)と共に1時間インキュベートした。さらに6回、PBS-Tで5分間洗浄後、抗原を増幅ケミルミネッセンス(アマーシャムカナダ社、ミッシッサウガ、ON)で検出し、ブロットをデュポン反射NEF(DuPont Reflection NEF)フィルム上に露光した。
8-Br-cGMPの細胞の細胞外マトリックスを貫通する能力に対する効果を評価するため、Matrigel侵襲分析を用いた。チャンバーは8μmポア膜を有する6.5mmのインサート(コーニングコスター社、ケンブリッジ、MA)で構成される。各膜を冷無血清培地(EX-CELL300、JRHバイオサイエンス、レナックス、KS)中で希釈した100mLの2.6mg/mLMatrigel溶液(コラボラティブバイオケミカルプロダクツ、ベッドフォード、MA)で被覆し、層流キャビネット中で約12時間乾燥した。次いでMatrigelを100mLの無血清培地で約1時間再水和した。再水和後、100mLのRPMI中の5.0×104個の細胞と血清(5%FBS)および8-Br-cGMPを含む細胞懸濁液を各ウェルに加えた。細胞を1%または20%酸素中で24時間インキュベートした。インキュベーション後、非侵襲性の細胞を毛羽立った綿棒で膜の上部表面から取り除いた。膜の株表面上の細胞は氷冷メタノールで2分間固定し、1%トルイジンブルーおよび1%ホウ酸ナトリウム溶液に一晩浸し染色した。リン酸緩衝生理食塩水ですすいだ後、膜を小型メスの刃でインサートから離し、顕微鏡スライドおよびカバースライド上に載せた。次いで侵襲した細胞を40倍の顕微鏡で観察し、計数した。各処理における侵襲インデックスを侵襲した細胞の数を標準条件(20%酸素)で侵襲した細胞の数で割って計算した。侵襲インデックスは対照(20%酸素)の百分率で表現した。結果を分散の解析を用いる統計的有意性と、ペアワイズ多重比較のためのターキーまたはスチューデント-ニューマン-キール検定で検定した。
B16-F10黒色腫細胞の転移能に対する8-Br-cGMPの効果を評価するため、ネズミ転移モデルを使用した。細胞を1%または20%酸素中、8-Br-cGMP(1mM)のある場合とない場合で12時間インキュベートした。培養プレートから収穫後、5〜7週齢C57B1/6雌マウス中に5×104個の細胞を静脈注入した。インビトロコロニー形成能に対する培養条件の効果を決めるため、細胞を組織培養プレート中にも散布した。静脈接種の40日後、マウスを屠殺し、ハイブリダイゼーションを摘出してボウイン固定剤中に固定した。黒色腫および非黒色腫転移性コロニーを解剖顕微鏡下で計数した。データを5×104個の注入した生きた細胞(インビトロコロニー形成能で測定)当たりの肺リンパ節の数で表し、非パラメトリック値に対する統計的検定を用いて解析した。
低酸素およびNO-模倣体処理のsGCレベルへの影響をウエスタンブロット解析を用いて測定した。sGC活性を決めるため、cGMPレベルを測定した。つまり、細胞を1mLの6%トリクロロ酢酸(BDHラボラトリーサプライス、ポール、イングランド)中で氷上に抽出した。次いでホモジェネートを13、000gで10分間遠心した。上澄部分を除き、2mlの水飽和ジエチルエーテル(BDM)で5回抽出した。次にこの部分に含まれるcGMPをアセチル化し、酵素結合免疫吸着体分析(ELISA)キット(STIシグナルトランスダクションプロダクツ、サンクレメント、CA)を用いて定量分析した。
I. 低酸素誘導性uPARアップレギュレーションのNO模倣体阻害における可溶性グアニレートシクラーゼの役割
sGC等のヘムタンパク質がNO模倣体のuPAR低酸素性アップレギュレーション阻害能においてある役割を果たすかどうかを決めるため、鉄配位子デスフェロキサミン(DFO;100μM)を使用した。DFOによるヘム撹乱に反応して生じるuPARのアップレギュレーションがGTN(10-10M、10-6M)により阻害されないことが見出された。これらの結果はNO-模倣体の効果はヘム部分で媒介されることを示唆している。
uPARの酸素仲介制御におけるPKGの役割を決めるため、PKGアクチベーター8-Br-cGMP(10-3〜10-7M)を20%および0.5%酸素中、またはDFOの存在下で培養した細胞に添加した。先の研究によれば、uPARの発現は、タンパク質およびmRNAレベルの双方で低酸素条件下およびDFOの存在でで顕著に増加した。興味深いことに、この誘導は8-BR-cGMPを添加すると有意に減少した。 8-BR-cGMPがPKGを活性化することを確認するため、PKGインヒビター(KT5823、10μM)を培地中に添加した。 酸素が存在してもKT5823はuPARの発現を誘導しすることができ、8-Br-cGMPの効果を有意に鈍らせることが見出された。
uPARの発現の機能的関連として、インビトロ分析を行った。 8-BR-cGMPが低酸素関連侵襲を有意に阻害し得ることが見出された。
インビトロ侵襲性に対するNO模倣体の影響を調べるため、インビトロ侵襲分析を行った。低酸素はMDA-MB-231乳癌細胞のインビトロ侵襲性を5倍以上増加させたが(図5)、低濃度の2種の異なったNO模倣体、すなわちグリセリル三硝酸(GTN;1pMおよび0.1μM;それぞれP<0.002およびP<0.001;一方向ANOVA後にフィッシャー試験)およびニトロプルシドナトリウム(SNP、10pM;P<0.001)を24時間侵襲アッセイ法の最初に投与した。
内因性NOがuPAR発現を阻害するかどうかを評価するため、NDA-MB-231細胞中のNO合成をNOSインヒビターN-モノメチル-L-アルギニン(L-NMMA、0.5mM)と共にインキュベートして妨害した。低酸素にさらされた細胞に特徴的な様式では、20%O2中で培養した場合でも(図6B;P<0.04)L-NMMAを1回投与した24時間インキュベーションで、MDA-MB-231細胞中で全体としてuPARタンパク質レベルが50%増加し(図6B;P<0.004)、uPAR mRNAレベルが2.8倍に増加する結果となった。対照的に、20%O2中のみでインキュベートした細胞中のuPAR発現と比較して、L-NMMA(0.5mM)とGTN(0.1mM)の組み合わせで20%O2中でインキュベートした細胞中ではuPARタンパク質(P=0.89)または転写(P=0.35)レベルの有為の増加は認められなかった(図6Bおよび6D)。
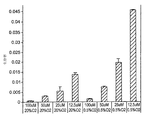
cGMPレベルに対する低酸素の効果を測定するため、MDA-MB-231乳癌細胞をIBMX(500mM)の存在下に0.5%O2中で6時間インキュベートした。cGMPに対するELISAの結果から、20%O2中でインキュベートした細胞と比較して、0.5%O2中でインキュベートした細胞では蓄積されたcGMPレベルが50%減少(P<0.002、図7A)していることが明らかとなった。このcGMPレベルに対する低酸素の効果はNO模倣体GTN(1mM)との共インキュベーションで阻止された。
sGCのuPAR mRNAブロッカーに対するsGCの効果を決めるため、MDA-MB-231細胞を選択的sGCブロッカー(ODQ、0.5μM)と共に24時間インキュベートした。制御された条件(20%O2のみ)下での細胞のインキュベーションと比較して、上記の処理はuPER mRNAのレベルが2.8倍増加する(p<0.05)結果となった(図8A)。GTN(1μM)が存在するとuPARの発現の低酸素性アップレギュレーションが阻止されたが、培地中にODQも存在する場合、GTNは低酸素の効果を妨害することはできなかった(図8A)。
uPARの発現におけるNOシグナル伝達の役割をさらに説明するため、MDA-MB-231細胞をPKGインヒビターKT5823(10μM)と共に6時間インキュベートした。20%O2中でもPKGを選択的に阻害するとuPARタンパク質とmRNAの発現が1.8倍増加する(P<0.05)結果となることが、ノーザン及びウェスタンブロットアッセイ法により明らかとなった(図10Aおよび10B)。これらの結果は、cGMPによるPKGの活性化がNOによるuPAR発現の阻害に必要であることを示している。
8-Br-cGMPの低酸素誘導性侵襲に対する効果を調べるため、インビトロ分析を行った。侵襲に対する基質としてのMatrigelを用いるインビトロ侵襲分析の結果は、20%O2中でインキュベートした細胞の侵襲性と比較して、低酸素がMDA-MB-213細胞の侵襲性を3.9倍に刺激したことを明らかにした(P<0.0001;図11)。この低酸素の侵襲性に対する効果は、様々な濃度(0.1μM〜1μM)の9-Br-cGMPの存在により完全に阻害された(図11)。
腫瘍の酸素化が低いこと(低酸素)は、転移の増加と、放射線治療と化学治療に対する抵抗性の増加と関連している。低酸素はヒト前立腺癌を伴い、前立腺癌は化学療法に高い抵抗性をもつことが示されている。低酸素が前立腺癌における薬剤感受性の減少の主な要因であるかどうか、および前立腺癌細胞における低酸素誘導性薬剤耐性が低濃度の一酸化窒素(NO)模倣体で阻害できることを試験するため、ヒトPC-3およびマウスTRAMP-C2前立腺癌細胞を、グリセロール三硝酸(GTN、0.1nM)を加えた場合と加えない場合につき、20%O2または0.5%O2中で12時間インキュベートした。その後ドキソルビシンと共に1時間インキュベートし、コロニー形成アッセイ法で生存率を評価した。ウェスタンブロットアッセイ法により、20%および0.5% O2中で培養した細胞中のNOシンセターゼ(NOS)タンパク質レベルを測定した。低酸素下での2つの細胞株の前インキュベーションの結果、ドキソルビシン暴露後のの生存率が増加した( PC-3細胞で最大8倍、TRAMP-C2細胞で最大12倍;P<0.0001)。PC-3とTRAMP-C」細胞を1nMのGTNと共インキュベートした結果、低酸素誘導性抗ドキソルビシンが完全に阻害された(P<0.0001)。両細胞株は3種のNOSアイソフォーム(NOS I、NOS IIおよびNOS III)全てを発現したが、0.5%O2中でインキュベートしたPC-3細胞では、20%O2中でインキュベートした細胞に比べNOS IIIの発現みが有意に増加していた(P<0.05)。これらの発見は、前立腺癌細胞の化学療法感受性(chemosensitivity)の制御にNOが重要な役割を果たすことを示している。さらに、その結果はGTNの投与が前立腺癌腫を化学療法感受性にする手段を提供することを示している(図12および13)。
以前の研究では、単層培養における腫瘍細胞の低酸素誘導性薬剤耐性は酸化窒素(NO)産生障害によることを明らかにした。単層培養と比較して、多層集合として培養された腫瘍細胞(スフェロイド)が有意に高いレベルの化学療法剤耐性を示すことは十分に確立されている。本研究は、スフェロイド培養に伴う薬剤耐性はNOシグナル伝達の減少によることを示した。クローン原性分析でヒトMDA-MB-231乳癌腫細胞を用いて、単層培養およびスフェロイド培養双方にドキソルビシン暴露とNO模倣体投与を行った後、生存率を測定した。20%O2中のインキュベーションと比較して、1%O2中でインキュベートした単層細胞はドキソルビシン耐性が3倍増加した。1mMのグリセリル三硝酸(GNT)の添加の結果、耐性が50%減少した。200mMのドキソルビシンでインキュベートした結果、スフェロイドとして培養された腫瘍細胞の生存率は90%減少した。0.1μMおよび2μMのジエチレントリアミン/酸化窒素付加物(DETA)、および0.1nM及び1mMのGTNは対照細胞(ドキソルビシン未処理)の生存率に影響しなかった。しかしながら、NO模倣体は3次元培養における200mMのドキソルビシン耐性をそれぞれ90%および30%、効果的に減少させた。これらの結果は、NO模倣体処理を固形癌の化学療法感受性を増加させる新しいアプローチとして使用し得ることを示している(図14および15)。
本実施例は、低酸素によって誘導されたuPARの発現と侵襲性の増加が、cGMP依存性シグナル伝達の減少で仲介されることを示す。cGMP系とcAMP系は密接に関連し、cGMPレベルがcAMPレベルを変化させることが示されている。cGMPシグナル伝達が侵襲性制御に重要であること、およびそのcAMPシグナル伝達変化能を基に、本研究はcAMPとそのエフェクター、cAMP依存性タンパク質キナーゼ(PKA)の癌腫細胞侵襲性における役割を示す。
方法: ASTROの基準(3回の連続PSA昂進)による生化学的不全を経験し、PSA<10(ユニット)であり、無症状性の疾患を有する安定な、前立腺切除の病歴を持つ患者を、インフォームドコンセントにサインした後に研究に加えた。全ての患者に連続して低用量経皮ニトログリセリン治療を行った(〜0.03mg/hr、1日24時間)。被検者は毎月のPSA測定のために研究センターへ戻った。病気の進展またはその他の予期しない医学的な問題を生じた場合、被験者を試験から除外した。
子宮頚癌は発展途上国でごく普通である。子宮頚部は子宮の下から3番目である。子宮頚部癌は膣表面上または子宮管内で発症する。毎年、世界中で500,000の新しい症例があると見積もられ、これらの女性の約250、000人がその病気のために死ぬ運命にある。発生率と死亡率を子宮頚部スクリーニング計画の実施により減少させ得ることを示す十分な証拠がある(Cain JMら、Science,288:1753〜1754、2000)。現在、ヒトパピロマウイルス(HPV)、特にHPV16および18がこの病気の主な原因物質であると考えられている。子宮頚癌の症状には膣の出血、性交後の汚点、膣排泄物、および進行した症例では下肢の後半部へ広がる挫骨神経に響く苦痛を伴う骨盤または下部背痛がある。
乳癌は女性にとってもっとも普通の癌であり、死亡の二番目に多い癌である。米国では、転移性乳癌を持つ生存する女性の数は100,000人である。一度転移を生じたら、乳癌が治療できるのは極めて希である。転移性疾患を扱う場合、治療効果を最適化し、生存率を上げ、これらの目的と可能な限り最高の生活の質の維持とをバランスさせることである。ハーセプチン(HER2癌タンパク質に特異的)を除いて、依然として細胞毒性化学療法剤が進行したホルモン非感受性乳癌の標準である。
前立腺癌は公衆衛生の重要な関心事であり、最も普通の内臓癌であると同時に北アメリカの男性の癌による死亡の2番目に多い原因である。1999年にアメリカ癌協会は約179,300の前立腺癌の新しい症例が米国で診断され、約37,000人の男性がこの病気で死亡すると見積もった(Landisら、CA Cancer J. Clin.、1999、49:8-31)。これだけ多く蔓延しているにもかかわらず、局所および転移性疾患の最適処置法は漠然としている。スクリーニングの努力で癌を初期に検出しようとしているが、前立腺癌と診断された男性の25%は実際に転移性疾患に侵されている(Landisら、CA Cancer J. Clin. 1999 49:8-31)。
腫瘍の局部的ミクロ環境が腫瘍細胞の挙動を決定する上で重要な役割を果たすという事実がある。固形腫瘍塊内の低酸素(pO2値10mmHg以下)は、様々な癌患者、特に乳癌患者で臨床結果が悪いという独立したマーカーである。原発癌が体内の離れた部位へ転移する場合、死亡の危険性が有意に増加する。
前立腺癌再発の生化学的マーカーであるPSAレベルを、前立腺がまだ無傷である前立腺癌患者でGTN投与の後に測定した。
前立腺癌は現在では最も普通に診断される癌であり、男性の癌による死亡の2番目に多い原因である。前立腺癌はほとんど、重度の前立腺上皮内異常増殖(PIN)が原因の腺癌であり、注射針バイオプシーの4〜16.5%で存在し、共存する癌腫を強く予言し、バイオプシーの繰り返しを必要とする。初期の前立腺患者は既存のアンドロゲン抑制療法で効果的に治療される。
局所初期非転移性乳癌患者を、悪性組織を除去するための乳腺腫瘤摘出手術を行うするために選んだ。手術に先立ち、腫瘍の体積を減少させるため、第1系列抗悪性治療を患者に始めた。この治療の有効性を改善するため、患者はバイアグラ等の酸化窒素模倣体(25mgまたは50mg)を継続的に毎日、第1系列の治療期間中の服用を開始した。乳癌または他の癌の再発を防止するため、服用は手術直後、および手術後は継続的である。病歴データーベースを参照して再発期間が延長されること、および/または改善された生活の質は治療の成功と考えられる。
Claims (16)
- 癌、悪性疾患、新生物、過形成、肥大、形成異常および/または腫瘍の血管形成を調節、治療および/または予防するために動物に一酸化窒素模倣体を投与する段階を含む、癌、悪性疾患、新生物、過形成、肥大、形成異常および/または腫瘍の血管形成を調節、治療および/または予防する方法。
- 一酸化窒素模倣体が低用量で投与される請求項1記載の方法。
- 頭痛、潮紅および低血圧を含む一酸化窒素模倣体への耐容性の発生および/または不要な副作用を遅延および/または低減させる濃度で一酸化窒素模倣体を投与する、請求項1または2記載の方法。
- 一酸化窒素模倣体が単独または抗悪性疾患治療薬と組み合わせて投与される、請求項1記載の方法。
- 一酸化窒素模倣体が、
(1)好ましくは、悪性表現型を示す細胞の侵襲性、進行、生育および/または転移を低減する段階;悪性表現型を示す細胞の生存および/または生育を抑制する段階;悪性表現型を示す細胞の進行および/または転移を低減する段階;悪性表現型を示す細胞の後退を増強する段階;および/または、悪性表現型を示す細胞の殺傷を促進することにより腫瘍または悪性細胞の表現型の転移の潜在性を抑制する段階;
(2)悪性腫瘍をその原発および/または二次的部位において休止状態または静穏状態に維持する段階;
(3)抗悪性疾患治療手段の効果を増強、および/または、それへの耐性を防止または低減し;または、
(4)癌の発症の危険性が高い動物における、および/または、動物の一酸化窒素の活性を低減することが既知の因子に曝露された動物における、腫瘍の血管形成を抑制または防止し、そして選択的に該因子は低下したアルギニン濃度、一酸化窒素合成酵素アンダゴニストへの曝露、一酸化窒素スカベンジャーへの曝露、一酸化窒素合成酵素発現の変化、コファクターの変化、グルコース枯渇、外科的処置、麻酔薬の投与、循環を改変する薬理学的物質の投与、外傷的傷害、身体的傷害、血液の損失、血液量の低下、もしくは出血、またはこれらの組み合わせである、請求項1記載の方法。 - 悪性疾患を示す細胞が、悪性細胞、侵襲性細胞、悪性の過程を促進する細胞および組織、ならびにこれらの組み合わせから選択され、ここにおいて随意的に、悪性細胞の表現型が、抗悪性疾患治療手段への応答を向上させることにより調節、治療または予防される、請求項1記載の方法。
- 動物に存在する腫瘍選択性マーカーを測定することにより癌が診断またはモニタリングされる、請求項1記載の方法。
- 一酸化窒素模倣体が腫瘍マーカーの濃度を低下するか、または上昇を遅延させる、請求項7記載の方法。
- 癌が胃癌、胃腸癌、精巣癌、前立腺癌、前立腺の腺癌、乳癌、転移性黒色腫、もしくは肺癌、またはこれらの組み合わせを含み;ここにおいて随意的に、動物における癌もしくは他の悪性疾患、新生物、過形成、肥大、形成異常および/または腫瘍の血管形成が良性の前立腺過形成または奇胎妊娠を含む、請求項1記載の方法。
- 一酸化窒素模倣体が一酸化窒素、一酸化窒素ドナー、生体変換を介して一酸化窒素を発生または放出する化合物、一酸化窒素を自発的に生成するか一酸化窒素を自発的に放出する化合物、または、一酸化窒素を発生する化合物、またはこれらの組み合わせを含む、請求項1記載の方法。
- 一酸化窒素模倣体が、
(1)ニトログリセリン(GTN)、イソソルビド5-モノニトレート(ISMN)、イソソルビドジニトレート(ISDN)、ペンタエリスリトールテトラニトレート(PETN)、エリスリチルテトラニトレート(ETN)、N-ヒドロキシル-L-アルギニン(NOHA)、N6-(1-イミノエチル)リジン)(L-NIL)、L-N5-(1-イミノエチル)オルニチン(LN-NIO)、NW-メチル-L-アルギニン(L-NMMA)、S-ニトロソグルタチオン(SNOG)、S,S-ジニトロソジチオール(SSDD)、[N-[2(ニトロキシエチル)]-3-ピリジンカルボキシアミド(ニコランジル)、ナトリウムニトロプルシド(SNP)、S-ニトロソ-N-アセチルペニシラミン(SNAP)、3-モルホリノ-シドノニミン(SIN-1)、モルシドミン、DEA-NONOエート(2(N,N-ジエチルアミノ)-ジアゼノレート-2-オキシド)、および、スペルミンNONOエート(N-[4-[1-(3-アミノプロピル)-2-ヒドロキシ-2-ニトロソヒドラジノ]ブチル-1,3-プロパンジアミンから選択される一酸化窒素ドナー;
(2)NO経路の段階を活性化する化合物、細胞によるNOの利用を可能にするか促進する化合物、グアニリルシクラーゼを直接活性化する化合物またはホスホジエステラーゼインヒビターまたはこれらの組み合わせ;
(3)I、II、III、IVまたはV型ホスホジエステラーゼインヒビターまたはこれらの組み合わせ;または、
(4)タンパク質キナーゼGアクチベーター、
である、請求項10記載の方法。 - 抗悪性疾患治療薬が放射線療法、温熱療法、免疫療法または化学療法またはこれらの組み合わせを含み、ここにおいて随意的に抗悪性疾患治療手段が放射線療法を含み、そして一酸化窒素模倣体が一酸化窒素、一酸化窒素ドナー、生体変換を介して一酸化窒素を発生もしくは放出する化合物、酸素の存在下においてのみ一酸化窒素を自発的に生成するかもしくは一酸化窒素を自発的に放出する化合物、またはこれらの組み合わせであり、該一酸化窒素模倣体が放射線療法の間に投与される、請求項4記載の方法。
- 化学療法が、抗血管形成剤、代謝拮抗物質、抗生物質、エンドセリンアクチベーター、酵素インヒビター、ホルモン剤、オクレオチドアセテート、微小管撹乱剤、微小管安定化剤、ビンカアルカロイド、エピポドフィロトキシン、トポイソメラーゼインヒビター、プレニルタンパク質転移酵素インヒビター、ヒドロキシ尿素、プロカルバジン、ミトーテン、ヘキサメチルメラミン、白金配位鎖体、生物学的応答変調剤、成長因子、免疫モジュレーターもしくはモノクローナル抗体、またはこれらの組み合わせである化学療法剤の投与を含む、請求項12記載の方法。
- 一酸化窒素模倣体の用量が血管拡張をもたらす一酸化窒素模倣体の用量よりも少なくとも3〜10,000倍低値、好ましくは100〜10,000倍低値である、請求項1記載の方法。
- 一酸化窒素模倣体が既知の血管拡張化合物であり、模倣体が血管拡張をもたらすことが、既知の一酸化窒素模倣体の用量よりも少なくとも3〜10,000倍低値、好ましくは100〜10,000倍低値の用量で投与される、請求項1記載の方法。
- 一酸化窒素模倣体がカルシウムチャンネルブロッカー、α-アドレナリン受容体アンダゴニスト、β-アドレナリン受容体アゴニスト、ホスホジエステラーゼインヒビター、cAMP依存性タンパク質キナーゼアクチベーター、スーパーオキシドスカベンジャー、カリウムチャンネルアクチベーター、ベンゾジアゼピン、アドレナリン作用性神経インヒビター、抗下痢剤、HMG-CoA還元酵素インヒビター、アデノシン受容体モジュレーター、アデニリルシクラーゼアクチベーター、エンドセリン受容体アンダゴニスト、ビスホスホネート、cGMP依存性タンパク質キナーゼアクチベーター、グアニリルシクラーゼアクチベーターおよびSOCインヒビターからなる群より選択される、請求項1記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US36296902P | 2002-03-06 | 2002-03-06 | |
| US36262002P | 2002-03-07 | 2002-03-07 | |
| PCT/CA2003/000313 WO2003074082A1 (en) | 2002-03-06 | 2003-03-06 | Formulations and methods of using nitric oxide mimetics in cancer treatment |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005527510A true JP2005527510A (ja) | 2005-09-15 |
| JP2005527510A5 JP2005527510A5 (ja) | 2006-04-20 |
Family
ID=27791719
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003572598A Pending JP2005527510A (ja) | 2002-03-06 | 2003-03-06 | 癌の治療において一酸化窒素模倣体を使用するための製剤および方法 |
Country Status (5)
| Country | Link |
|---|---|
| EP (1) | EP1492567A1 (ja) |
| JP (1) | JP2005527510A (ja) |
| AU (1) | AU2003208228A1 (ja) |
| CA (1) | CA2478145A1 (ja) |
| WO (1) | WO2003074082A1 (ja) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009242378A (ja) * | 2008-03-13 | 2009-10-22 | Chiba Univ | シスプラチン効果増強剤及び抗癌剤キット |
| JP2011507968A (ja) * | 2007-12-27 | 2011-03-10 | エイヤーズ ファーマシューティカルズ、インク. | エアロゾル化ニトライトおよび一酸化窒素供与性化合物ならびにそれらの使用 |
| JP2011521908A (ja) * | 2008-05-09 | 2011-07-28 | デューク ユニバーシティ | チオレドキシンが細胞における一酸化窒素放出を調節するという知見に基づく疾患の治療法 |
| WO2012118042A1 (ja) * | 2011-02-28 | 2012-09-07 | 独立行政法人国立循環器病研究センター | 悪性腫瘍転移抑制用医薬 |
| JP2012219050A (ja) * | 2011-04-07 | 2012-11-12 | Nipro Corp | 抗癌剤増感剤 |
| JP2017515800A (ja) * | 2014-04-08 | 2017-06-15 | ザ・メソジスト・ホスピタル | iNOS阻害組成物および乳がん治療薬としてのその使用 |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE10135815A1 (de) * | 2001-07-23 | 2003-02-06 | Bayer Ag | Verwendung von 2-Alkoxyphenyl-substituierten Imidazotriazinonen |
| HUE039448T2 (hu) | 2004-04-21 | 2018-12-28 | Alexion Pharma Inc | Csontba szállító konjugátumok és alkalmazási módszerük a fehérjék csontba juttatására |
| US7329495B2 (en) | 2004-06-09 | 2008-02-12 | Board Of Regents, The University Of Texas System | Mutations in KIT confer imatinib resistance in gastrointestinal stromal tumors |
| CN101001623B (zh) * | 2004-06-10 | 2010-11-17 | 日本化药株式会社 | 抗癌效果增强剂 |
| DK1759700T3 (da) * | 2004-08-19 | 2009-10-12 | Switch Biotech Llc | Anvendelse af en PDE5-inhibitor til behandling og forebyggelse af hypopigmentlidelser |
| AU2005274546B2 (en) | 2004-08-19 | 2011-02-03 | Switch Biotech, Llc | Use of a PDE5 inhibitor for treating and preventing hypopigmentary disorders |
| AU2012203798B2 (en) * | 2005-08-12 | 2013-11-07 | Northrop Grumman Systems Corporation | O-nitro compounds, pharmaceutical compositons thereof and uses thereof |
| US20070135380A1 (en) | 2005-08-12 | 2007-06-14 | Radiorx, Inc. | O-nitro compounds, pharmaceutical compositions thereof and uses thereof |
| US9266939B2 (en) | 2010-12-27 | 2016-02-23 | Alexion Pharmaceuticals, Inc. | Compositions comprising natriuretic peptides and methods of use thereof |
| US10052366B2 (en) | 2012-05-21 | 2018-08-21 | Alexion Pharmaceuticsl, Inc. | Compositions comprising alkaline phosphatase and/or natriuretic peptide and methods of use thereof |
| WO2016007873A1 (en) | 2014-07-11 | 2016-01-14 | The Regents Of The University Of Michigan | Compositions and methods for treating craniosynostosis |
| JP6787894B2 (ja) | 2014-12-05 | 2020-11-18 | アレクシオン ファーマシューティカルズ, インコーポレイテッド | 組換えアルカリホスファターゼを用いた発作の処置 |
| AU2016211447B2 (en) | 2015-01-28 | 2021-09-23 | Alexion Pharmaceuticals, Inc. | Methods of treating a subject with an alkaline phosphatase deficiency |
| KR102644116B1 (ko) | 2015-08-17 | 2024-03-05 | 알렉시온 파마슈티칼스, 인코포레이티드 | 알칼린 포스파타제의 제조 |
| JP6868617B2 (ja) | 2015-09-28 | 2021-05-12 | アレクシオン ファーマシューティカルズ, インコーポレイテッド | 低ホスファターゼ血症の組織非特異的アルカリホスファターゼ(tnsalp)酵素補充療法に有効な投薬計画の特定 |
| JP2018533571A (ja) | 2015-10-30 | 2018-11-15 | アレクシオン ファーマシューティカルズ, インコーポレイテッド | 患者の頭蓋縫合早期癒合症を治療するための方法 |
| WO2017155569A1 (en) | 2016-03-08 | 2017-09-14 | Alexion Pharmaceuticals, Inc. | Methods for treating hypophosphatasia in children |
| US10898549B2 (en) | 2016-04-01 | 2021-01-26 | Alexion Pharmaceuticals, Inc. | Methods for treating hypophosphatasia in adolescents and adults |
| WO2017173413A1 (en) | 2016-04-01 | 2017-10-05 | Alexion Pharmaceuticals, Inc. | Treating muscle weakness with alkaline phosphatases |
| WO2017214130A1 (en) | 2016-06-06 | 2017-12-14 | Alexion Pharmaceuticals, Inc. | Metal impact on manufacturing of alkaline phosphatases |
| WO2018035420A1 (en) | 2016-08-18 | 2018-02-22 | Alexion Pharmaceuticals, Inc. | Methods for treating tracheobronchomalacia |
| CN110719786A (zh) | 2017-03-31 | 2020-01-21 | 阿雷克森制药公司 | 用于治疗成人和青少年的低磷酸酯酶症(hpp)的方法 |
| JP2021519590A (ja) | 2018-03-30 | 2021-08-12 | アレクシオン ファーマシューティカルズ, インコーポレイテッド | 糖タンパク質の製造 |
| CN114869894A (zh) * | 2022-05-10 | 2022-08-09 | 福州大学 | 一种小分子化合物在制备作为尿激酶受体抑制剂药物中的应用 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| LV11542B (en) * | 1995-03-30 | 1997-02-20 | Latvijas Organiskas Sintezes Instituts | Substituted 1,3,9,11-tetraoxa-4,5,7,8-tetraazaundecadien-4,7-dioxides-5,7, preparation and use thereof |
| AU8398398A (en) * | 1997-07-14 | 1999-02-10 | Brigham And Women's Hospital | Modification of nitric oxide activity to treat fas-induced pathologies |
| WO2001054680A2 (en) * | 2000-01-26 | 2001-08-02 | Cedars-Sinai Medical Center | Method for using potassium channel activation for delivering a medicant to an abnormal brain region and/or a malignant tumor |
| US20010038832A1 (en) * | 2000-04-11 | 2001-11-08 | Benjamin Bonavida | Nitric oxide and analogues thereof effectuate sensitization of neoplasm and immunologically undesired tissues to cytotoxicity |
| JP2003531179A (ja) * | 2000-04-26 | 2003-10-21 | クイーンズ ユニバーシティ アット キングストン | 悪性細胞表現型に対し一酸化窒素模倣体を使用する処方および方法 |
-
2003
- 2003-03-06 CA CA002478145A patent/CA2478145A1/en not_active Abandoned
- 2003-03-06 JP JP2003572598A patent/JP2005527510A/ja active Pending
- 2003-03-06 AU AU2003208228A patent/AU2003208228A1/en not_active Abandoned
- 2003-03-06 EP EP03706181A patent/EP1492567A1/en not_active Withdrawn
- 2003-03-06 WO PCT/CA2003/000313 patent/WO2003074082A1/en active Application Filing
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011507968A (ja) * | 2007-12-27 | 2011-03-10 | エイヤーズ ファーマシューティカルズ、インク. | エアロゾル化ニトライトおよび一酸化窒素供与性化合物ならびにそれらの使用 |
| JP2009242378A (ja) * | 2008-03-13 | 2009-10-22 | Chiba Univ | シスプラチン効果増強剤及び抗癌剤キット |
| JP2011521908A (ja) * | 2008-05-09 | 2011-07-28 | デューク ユニバーシティ | チオレドキシンが細胞における一酸化窒素放出を調節するという知見に基づく疾患の治療法 |
| WO2012118042A1 (ja) * | 2011-02-28 | 2012-09-07 | 独立行政法人国立循環器病研究センター | 悪性腫瘍転移抑制用医薬 |
| JP5948683B2 (ja) * | 2011-02-28 | 2016-07-06 | 国立研究開発法人国立循環器病研究センター | 悪性腫瘍転移抑制用医薬 |
| JP2012219050A (ja) * | 2011-04-07 | 2012-11-12 | Nipro Corp | 抗癌剤増感剤 |
| JP2017515800A (ja) * | 2014-04-08 | 2017-06-15 | ザ・メソジスト・ホスピタル | iNOS阻害組成物および乳がん治療薬としてのその使用 |
| US10420838B2 (en) | 2014-04-08 | 2019-09-24 | The Methodist Hospital | Methods for treating cancer using iNOS-inhibitory compositions |
| JP2020128445A (ja) * | 2014-04-08 | 2020-08-27 | ザ・メソジスト・ホスピタル | iNOS阻害組成物および乳がん治療薬としてのその使用 |
| US11357850B2 (en) | 2014-04-08 | 2022-06-14 | The Methodist Hospital | Methods for treating breast cancer using INOS-inhibitory compositions |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1492567A1 (en) | 2005-01-05 |
| WO2003074082A1 (en) | 2003-09-12 |
| AU2003208228A1 (en) | 2003-09-16 |
| CA2478145A1 (en) | 2003-09-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7678391B2 (en) | Formulations and methods of using nitric oxide mimetics against a malignant cell phenotype | |
| JP2005527510A (ja) | 癌の治療において一酸化窒素模倣体を使用するための製剤および方法 | |
| AU2001250221B2 (en) | Formulations and methods of using nitric oxide mimetics against a malignant cell phenotype | |
| US20050142217A1 (en) | Formulations and methods of using nitric oxide mimetics against a malignant cell phenotype | |
| AU2001250221A1 (en) | Formulations and methods of using nitric oxide mimetics against a malignant cell phenotype | |
| EP2034835B1 (en) | Non-toxic anti-cancer drug combining ascorbate, magnesium and a naphthoquinone | |
| US20140187495A1 (en) | Methods for treating glioblastoma | |
| US11129830B2 (en) | PAC-1 combination therapy | |
| TW201912153A (zh) | 用於治療b型肝炎的化合物、醫藥組合物及方法 | |
| EP1502604A1 (en) | Use of nitric oxide mimetics in cancer treatment | |
| US20190076407A1 (en) | Combination therapy for proliferative diseases | |
| WO2021048417A1 (en) | Combination therapies comprising dasatinib for the treatment of cholangiocarcinoma | |
| WO2009108755A2 (en) | Pharmaceutical combinations for the treatment of cancer | |
| US20190046564A1 (en) | Compositions and methods for treating inflammatory arthritis | |
| TW201904579A (zh) | Mcl-1抑制劑與血液癌症標準療法之組合,其用途及醫藥組合物 | |
| US20220409582A1 (en) | Combination therapies comprising panobinostat for the treatment of cholangiocarcinoma | |
| TW202045155A (zh) | 用於治療癌症之組合療法 | |
| US20200009085A1 (en) | Methods For Treating Ovarian Cancer | |
| JP2019529556A (ja) | 血管遮断剤として有用なベンゾフェノンチアゾール誘導体およびトポイソメラーゼ抑制剤を含む癌の予防または治療用薬学的調合物 | |
| JP2015505313A (ja) | 癌を治療するための併用療法 | |
| US11052101B2 (en) | Methods for treating cancer using purine analogs by depleting intracellular ATP | |
| WO2022181514A1 (ja) | 慢性骨髄性白血病幹細胞阻害剤 | |
| WO2021048418A1 (en) | Combination therapies comprising bortezomib for the treatment of cholangiocarcinoma | |
| WO2011056663A1 (en) | Method of treating cancer using combination of a bifunctional alkylating agent and dna repair inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050819 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20050819 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060303 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060303 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20060308 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20060308 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090420 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090717 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090727 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100310 |