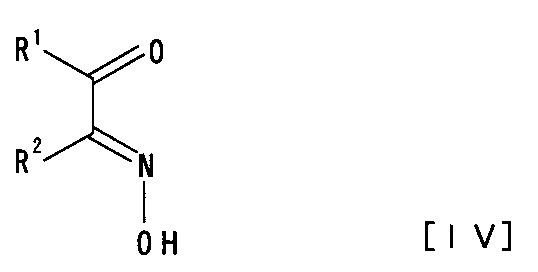JP2005320249A - 2−アミノピラジン誘導体の製造方法 - Google Patents
2−アミノピラジン誘導体の製造方法 Download PDFInfo
- Publication number
- JP2005320249A JP2005320249A JP2002130136A JP2002130136A JP2005320249A JP 2005320249 A JP2005320249 A JP 2005320249A JP 2002130136 A JP2002130136 A JP 2002130136A JP 2002130136 A JP2002130136 A JP 2002130136A JP 2005320249 A JP2005320249 A JP 2005320249A
- Authority
- JP
- Japan
- Prior art keywords
- iron
- iii
- compound
- addition salt
- acid addition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/02—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings
- C07D241/10—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D241/14—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D241/20—Nitrogen atoms
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J27/00—Catalysts comprising the elements or compounds of halogens, sulfur, selenium, tellurium, phosphorus or nitrogen; Catalysts comprising carbon compounds
- B01J27/06—Halogens; Compounds thereof
- B01J27/128—Halogens; Compounds thereof with iron group metals or platinum group metals
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
【課 題】鉄化合物を有効成分とする新規なピラジン環形成反応の促進剤の提供及び工業的に優れた2−アミノピラジン誘導体の製造方法の提供。
【解決手段】鉄化合物を有効成分とするピラジン環形成反応の促進剤及び 一般式IV
[式中、R1は水素原子、炭素数1個〜6個のアルキル基又はアリール基を、R2は水素原子、炭素数1個〜6個のアルキル基、アリール基又はハロゲン原子を示す]で表される化合物又はその酸付加塩と、一般式III
[式中、R3は水素原子、炭素数1個〜6個のアルキル基、アリール基又はアラルキル基を示す]で表されるアミノアセトニトリル化合物又はその酸付加塩とを、鉄化合物の存在下で反応させて、一般式II
で表されるN−オキシド化合物又はその酸付加塩を製造し、次いでこの化合物又はその酸付加塩を還元することを特徴とする一般式I
で表される2−アミノピラジン誘導体又はその酸付加塩の製造方法。
【選択図】なし
【解決手段】鉄化合物を有効成分とするピラジン環形成反応の促進剤及び 一般式IV
[式中、R1は水素原子、炭素数1個〜6個のアルキル基又はアリール基を、R2は水素原子、炭素数1個〜6個のアルキル基、アリール基又はハロゲン原子を示す]で表される化合物又はその酸付加塩と、一般式III
[式中、R3は水素原子、炭素数1個〜6個のアルキル基、アリール基又はアラルキル基を示す]で表されるアミノアセトニトリル化合物又はその酸付加塩とを、鉄化合物の存在下で反応させて、一般式II
で表されるN−オキシド化合物又はその酸付加塩を製造し、次いでこの化合物又はその酸付加塩を還元することを特徴とする一般式I
で表される2−アミノピラジン誘導体又はその酸付加塩の製造方法。
【選択図】なし
Description
【0001】
【発明の属する技術分野】
本発明は、医薬等のファインケミカルの分野で有用な発明である。さらに詳しくは、本発明は、医薬等の分野で製造中間体として有用な化合物の新規な製造方法及びその製造に有用な新規な反応促進剤に関するものである。
【0002】
【従来の技術】
本発明の製造方法により製造される2−アミノピラジン誘導体は、例えば、国際公開特許公報WO 01/14376に開示されている神経ペプチド Y受容体拮抗剤として有用な化合物の製造中間体として、また、例えば、過酸化物、ATP、カルシウムイオン又はステロイドホルモン等の生体の微量成分の分析に使用される発光試薬の製造中間体として有用である(シモムラ等(Shimomura et al)バイオケミカル ジャナール(Biochemical Journal)第270巻、第309頁〜第312頁(1990年)参照)。
【0003】
当該ピラジン誘導体の公知の製造方法としては、例えば、薬学雑誌 第89巻、第1646頁〜第1651頁(1969年)及びジャーナル・オブ・ケミカル・ソサエティ(Journal of Chemical Society)第932頁(1951年)が挙げられるが、これらの製造方法は、当該ピラジン誘導体の収率が低く、工業的な製造方法としては好ましくない。
【0004】
さらに、当該ピラジン誘導体の公知の製造方法としては、ジャーナル・オブ・ザ・アメリカン・ケミカル・ソサイエティ(Journal of the American Chemical Society)第93巻、第2333頁〜第2335頁(1971年)が挙げられる。この製造方法では、当該ピラジン誘導体の収率は、高価な四塩化チタンを使用することにより向上しているが、それでも工業的には満足すべきレベルではないことから、製造方法としては工業的に有利な製造方法とはいえない。
【0005】
【発明が解決しようとする課題】
本発明は、従来公知の2−アミノピラジン誘導体の製造方法の上述の問題点を改善し、工業的に優れた2−アミノピラジン誘導体の製造方法及びそのために使用されうる反応促進剤を提供することにある。
【0006】
【課題を解決するための手段】
本発明者らは、2−アミノピラジン誘導体の製造方法に関して、鋭意検討した結果、驚くべきことに、鉄化合物が反応促進作用を有することを見出した。本発明者らはさらに、本発明方法が目的とする2−アミノピラジン誘導体を従来方法よりも高収率で製造できるという特長を有し、さらに反応工程管理が容易であることから工業的にすぐれた製造方法であることを見出し、さらに検討を重ねて本発明を完成した。
【0007】
すなわち、本発明は、
(1) 鉄化合物を有効成分とするピラジン環形成反応の促進剤、
(2) 鉄化合物が、塩化鉄(III)、硝酸鉄(III)、硫酸鉄(III)、臭化鉄(III)、硫酸アンモニウム鉄(III)、クエン酸鉄(III)、シュウ酸鉄(II)又はフマル酸鉄(II)であることを特徴とする前記(1)記載のピラジン環形成反応の促進剤、
(3) 一般式[IV]:
【化5】
[式中、R1は水素原子、炭素数1個〜6個のアルキル基又はアリール基を、R2は水素原子、炭素数1個〜6個のアルキル基、アリール基又はハロゲン原子を示す]で表される化合物又はその酸付加塩と、一般式[III]:
【化6】
[式中、R3は水素原子、炭素数1個〜6個のアルキル基、アリール基又はアラルキル基を示す]で表されるアミノアセトニトリル化合物又はその酸付加塩とを、鉄化合物の存在下で反応させて、一般式[II]:
【化7】
[式中、R1、R2及びR3は前記の意味を示す]で表されるN−オキシド化合物又はその酸付加塩を製造し、次いでこのN−オキシド化合物又はその酸付加塩を還元することを特徴とする一般式[I]:
【化8】
[式中、R1、R2及びR3は前記の意味を示す]で表される2−アミノピラジン誘導体又はその酸付加塩の製造方法、
(4) 鉄化合物が、塩化鉄(III)、硝酸鉄(III)、硫酸鉄(III)、臭化鉄(III)、硫酸アンモニウム鉄(III)、クエン酸鉄(III)、シュウ酸鉄(II)又はフマル酸鉄(II)であることを特徴とする前記(3)記載の2−アミノピラジン誘導体又はその酸付加塩の製造方法、
(5) 還元が、パラジウム炭素又は白金炭素を触媒とする接触還元であることを特徴とする前記(3)又は(4)記載の2−アミノピラジン誘導体の製造方法、
に関するものである。
【0008】
【発明の実施の形態】
本発明について、具体的且つ詳細に説明する。
【0009】
「鉄化合物」とは、例えば、塩化鉄(III)、硝酸鉄(III)、硫酸鉄(III)、臭化鉄(III)、硫酸アンモニウム鉄(III)、クエン酸鉄(III)、シュウ酸鉄(II)又はフマル酸鉄(II)等の鉄原子を含有する化合物を意味し、好ましくは塩化鉄(III)、硝酸鉄(III)又は硫酸鉄(III)等が挙げられる。
【0010】
「炭素数1個〜6個のアルキル基」とは、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基、sec−ブチル基、n−ペンチル基、イソペンチル基、ネオペンチル基、n−ヘキシル基又はイソヘキシル基等の直鎖状又は分岐状の炭素数1個〜6個のアルキル基が挙げられ、なかでもメチル基、エチル基、n−プロピル基、n−ブチル基又はn−ヘキシル基が好ましい。
【0011】
「アリール基」とは、例えば、フェニル基、o−トリル基、p−トリル基、m−トリル基、1−ナフチル基、2−ナフチル基又はインダニル基等の炭素数6個〜12個のアリール基を意味し、なかでもフェニル基、1―ナフチル基又は2−ナフチル基が好ましい。
従って、反応を阻害しない通常の基(例えば、炭素数1個〜6個のアルキル基、炭素数3個〜6個のシクロアルキル基)を置換基として有していてもよい。ここにおいて、炭素数1個〜6個のアルキル基は前記の意味を有し、炭素数3個〜6個のシクロアルキル基としては、例えば、シクロプロピル基、シクロペンチル基又シクロヘキシル基等が挙げられる。
【0012】
「アラルキル基」とは、例えば、ベンジル基、(1−ナフチル)メチル基、(2−ナフチル)メチル基又は2−フェニルエチル基等の炭素数7個〜12個のアリール基が挙げられる。また、これらの基は上記の反応を阻害しない置換基を有していてもよい。
【0013】
「ハロゲン原子」とは、例えば、塩素原子、臭素原子、フッ素原子又はヨウ素原子が挙げられる。
【0014】
次に、本発明の製造方法について説明する。
一般式[IV]:
【化9】
[式中、R1は水素原子、炭素数1個〜6個のアルキル基又はアリール基を、R2は水素原子、炭素数1個〜6個のアルキル基、アリール基又はハロゲン原子を示す]で表される化合物又はその酸付加塩と、一般式[III]:
【化10】
[式中、R3は水素原子、炭素数1個〜6個のアルキル基、アリール基又はアラルキル基を示す]で表されるアミノアセトニトリル化合物又はその酸付加塩とを、鉄化合物の存在下で反応させて、一般式[II]:
【化11】
[式中、R1、R2及びR3は前記の意味を示す]で表されるN−オキシド化合物又はその酸付加塩を製造し、次いでこのN−オキシド化合物又はその酸付加塩を還元することにより行われる。この方法は、好ましくは、以下の(1)及び(2)の処理を順に連続して行うことにより工業的に有利に実施することができる。
【0015】
(1)溶媒に、一般式[IV]で表される化合物又はその酸付加塩、一般式[III]で表されるアミノアセトニトリル化合物又はその酸付加塩、及び鉄化合物を加え、約50℃〜約100℃、好ましくは約70℃〜約100℃で約1時間〜約36時間、好ましくは約2時間〜約21時間反応させて、一般式[II]で表されるN−オキシド化合物又はその酸付加塩を製造する。
本工程で使用される一般式[IV]で表される化合物の使用量は、一般式[III]で表されるアミノアセトニトリル化合物に対して約1当量〜約5当量である。
一般式[III]で表されるアミノアセトニトリル化合物が酸付加塩の場合、例えば、N−メチルモルホリン、水酸化ナトリウム、水酸化カリウム、トリエチルアミン又はジイソプロピルアミン等の塩基を、当該アミノアセトニトリル化合物に対して約1当量〜約6当量、好ましくは約1当量〜約5当量アミノアセトニトリル化合物酸付加塩に加えた後、上記(1)の処理を行う。
(2)(1)で得られた一般式[II]で表されるN−オキシド化合物又はその酸付加塩を含む反応液を還元反応容器に移し、例えばパラジウム炭素又は白金炭素等の触媒を当該アミノアセトニトリル化合物に対して約1mol%〜約5mol%加え、約2気圧〜約6気圧、好ましくは約2気圧〜約5気圧の水素加圧下で、約30℃〜約100℃、好ましくは約30℃〜約80℃で約1時間〜約24時間、好ましくは約8時間〜約15時間反応させる。
【0016】
本発明の反応(1)及び(2)はいずれも溶媒の存在下に行われてよく、そのような溶媒としては、例えば、水、N,N−ジメチルホルムアミド、ジメチルスホキシド、メタノール、エタノール、クロロホルム、テトラヒドロフラン又はイソプロパノール又はそれらの混合溶媒等が挙げられる。
【0017】
本工程で使用される鉄化合物としては、例えば、塩化鉄(III)、硝酸鉄(III)、硫酸鉄(III)、臭化鉄(III)、硫酸アンモニウム鉄(III)、クエン酸鉄(III)、シュウ酸鉄(II)又はフマル酸鉄(II)等が挙げられ、その使用量は、当該アミノアセトニトリル化合物に対して約0.5当量〜約1当量である。
【0018】
以上の工程で得られる生成物は、それ自体既知の方法、例えばシリカゲル又は吸着樹脂等を用いるカラムクロマトグラフィー、液体クロマトグラフィー、薄層クロマトグラフィー、溶媒抽出又は再結晶・再沈殿等の常用の分離精製法を必要に応じて単独又は適宜組み合わせて用いることにより精製・単離することができる。
なお、一般式[I]〜[IV]で表される化合物の酸付加塩における酸としては、例えば、塩酸、硫酸、硝酸等の無機酸、例えば、シュウ酸、酢酸等の有機酸が挙げられる。
【0019】
【発明の実施の形態】
以下に実施例を挙げて、本発明を具体的に説明するが、本発明は、これらにより何ら限定されるものではない。
【0020】
実施例1
2−アミノ−5−フェニルピラジンの製造:
窒素気流下、10Lガラス製ナス型フラスコにアミノアセトニトリル塩酸塩(124g、1.34mol)とメタノール(4L)、12N水酸化ナトリウム水溶液(123mL、1.48mol)を滴下し溶液とする。この溶液にイソニトロソアセトフェノン(100g、0.67mol)と塩化鉄(III)(109g、0.67mol)を20℃以下で加える。反応溶液を50℃で2時間、還流で4時間攪拌反応させる。高速液体クロマトグラフィー(以下、「HPLC」と略)による分析により、イソニトロソアセトフェノンの消失を確認した後に、反応液を室温にまで冷却し、ステンレス製加圧反応容器(内容器はテフロン(登録商標)製)に移液する。反応溶液にパラジウム炭素(10w/w%)を加え、水素加圧下(5atm)、50℃で18時間攪拌する。HPLCで2−アミノ−5−フェニルピラジン=1−オキシド(核磁気共鳴法(以下、「NMR」法と略)による測定値を下記する)が消失したのを確認した後に、反応溶液を12N水酸化ナトリウム水溶液を用いてアルカリ性(pH>10)とする。これをセライトに通し、不溶物を除去した後に濾液を減圧下、メタノールを濃縮する。水層に酢酸エチルを加え、2回抽出する。得られた酢酸エチル溶液を7重量%食塩水で洗浄した後に分液し、酢酸エチル溶液を無水硫酸ナトリウムで脱水する。酢酸エチル溶液を減圧下、一定量まで濃縮した後に、活性炭(商標:Darco−G60)を加え、室温で1時間攪拌する。セライトを通し、活性炭を除去した後に、酢酸エチル溶液を減圧下、一定量まで濃縮すると結晶が析出してくる。得られる懸濁液にn−ヘプタンを滴下し、室温で1時間攪拌した後に、グラスフィルターを用いて濾過し、結晶を酢酸エチル/n−ヘプタン(容量比、1:5)で洗浄する。得られた結晶を室温で減圧乾燥し、2−アミノ−5−フェニルピラジンが黄色結晶として、77g(収率67%)得られた。
【0021】
2−アミノ−5−フェニルピラジン=1−オキシド:
1H−NMR(500MHz,DMSO)δ ppm:8.79(s,1H),8.22(s,1H),7.96(d,J=7.5Hz,2H),7.44(dd,J=7.3,7.5Hz,2H),7.38(dd,J=7.3Hz,1H),7.11(s,2H)
【0022】
2−アミノ−5−フェニルピラジン:
1H−NMR(500MHz,DMSO)δ ppm:8.53(s,1H),8.01(s,1H),7.94(d,J=7.6Hz,1H),7.93(d,J=7.6Hz,1H),7.43(dd,J=7.4,7.6Hz,2H),7.32(dd,J=7.4Hz,1H),6.59(s,1H)
【0023】
13C−NMR(125MHz,DMSO)δ ppm:125.0,127.7,129.0,131.8,137.5,139.2,139.4,155.3
【0024】
HPLCの測定条件
カラム:シンメトリー(symmetry)C8,
4.6mm×250mm
測定温度:25℃
移動層:
グラジェント(gradient):
流速:1.0mL/分
0分(A:B=95:5(体積比))
35分(A:B=50:50(体積比))
A:0.1%リン酸;B:アセトニトリル
検出波長:243nm
保持時間(retention time):
イソニトロアセトフェノン:20.69分
2−アミノ−5−フェニルピラジン=1−オキシド:14.37分
2−アミノ−5−フェニルピラジン:16.03分
【0025】
実施例2〜7
実施例1の製法と同様にして、実施例2〜7の化合物を製造した。ただし、目的物の精製に関しては、実施例1の結晶化法に代えて、シリカゲルカラムクロマトグラフィー(シリカゲル:ワコーゲル(和光純薬製);展開剤:n−ヘプタン及び酢酸エチルの混合溶媒)により行った。
実施例2
2−アミノ−3−メチル−5−フェニルピラジン:(収率:63%)
1H−NMR(500MHz,DMSO)δ ppm:8.40(s,1H),7.94(d,J=7.4,8.3Hz,2H),7.43(d,J=7.6Hz,1H),7.41(d,J=7.8Hz,1H),7.31(d,J=7.2Hz,1H),6.35(s,2H),2.40(s,3H)
【0026】
13C−NMR(125MHz,CDCl3)δ ppm:21.1,125.1,127.6,129.0,136.8,137.6,138.8,138.9,153.6,176.5
【0027】
実施例3
2−アミノ−3−エチル−5−フェニルピラジン:(収率:67%)
1H−NMR(270MHz,CDCl3)δ ppm:8.32(s,1H),7.93(d,J=7.3,8.6Hz,2H),7.45(d,J=7.3Hz,1H),7.42(d,J=7.6Hz,1H),7.34(dd,J=6.9,7.6Hz,1H),4.61(s,2H),2.73(q,J=7.3,7.6Hz,2H),1.41(t,J=7.3,7.6Hz,3H)
【0028】
13C−NMR(125MHz,CDCl3)δ ppm:11.0,26.0,125.0,127.5,129.0,136.5,137.8,138.8,142.5,153.0
【0029】
実施例4
2−アミノ−3,5−ジフェニルピラジン:(収率:58%)
1H−NMR(270MHz,DMSO)δ ppm:8.57(s,1H),8.00(d,J=7.3,8.6Hz,2H),7.82(d,J=6.9,8.3Hz,2H),7.57−7.47(m,4H),7.43(d,J=7.6Hz,1H),7.34(dd,J=6.9,7.6Hz,1H),6.31(s,2H)
【0030】
13C−NMR(67.5MHz,DMSO)δ ppm:124.9,127.8,128.1,128.5,128.6,128.8,128.9,129.0,136.9,137.5,137.8,137.9,139.7,152.0
【0031】
実施例5
2−アミノ−3−ベンジル−5−フェニルピラジン:(収率:72%)
1H−NMR(270MHz,DMSO)δ ppm:8.44(s,1H),7.92(d,J=7.3Hz,2H),7.44−7.17(m,8H),6.41(s,2H),4.11(s,2H)
【0032】
13C−NMR(67.5MHz,DMSO)δ ppm:124.7,126.1,127.3,128.2,128.6,128.9,136.9,137.1,138.1,138.7,140.0,152.7
【0033】
実施例6
2−アミノ−5−フェニル−6−メチルピラジン:(収率:60%)
1H−NMR(270MHz,DMSO)δ ppm:7.82(s,1H),7.51(d,J=6.6Hz,1H),7.43(d,J=6.6Hz,1H),7.41(d,J=7.9Hz,1H),7.34(d,J=6.6Hz,1H),7.32(d,J=7.6Hz,1H),6.40(s,2H),2.35(s,3H)
【0034】
13C−NMR(67.5MHz,DMSO)δ ppm:22.7,127.2,128.2,129.1,129.2,139.7,140.1,147.8,154.2
【0035】
実施例7
2−アミノ−5−メチルピラジン:(収率:55%)
1H−NMR(500MHz,DMSO)δ ppm:7.81(s,1H),7.78(s,1H),6.10(s,2H),2.25(s,3H)
【0036】
13C−NMR(125MHz,DMSO)δ ppm:20.0,131.4,139.6,140.7,154.4,176.5
【0037】
比較例
塩化鉄(III)の代わりに同モル量の四塩化チタンを用いて実施例1の方法に従い、2−アミノ−5−フェニルピラジンを製造すると、その収率は10%であった。
【0038】
【発明の効果】
本発明で提供される鉄化合物を有効成分とするピラジン環の反応促進剤は、従来公知の2−アミノピラジン誘導体の製造方法よりも収率向上を図ることができるため、工業的に優れた2−アミノピラジン誘導体の製造方法を提供することができる。
【発明の属する技術分野】
本発明は、医薬等のファインケミカルの分野で有用な発明である。さらに詳しくは、本発明は、医薬等の分野で製造中間体として有用な化合物の新規な製造方法及びその製造に有用な新規な反応促進剤に関するものである。
【0002】
【従来の技術】
本発明の製造方法により製造される2−アミノピラジン誘導体は、例えば、国際公開特許公報WO 01/14376に開示されている神経ペプチド Y受容体拮抗剤として有用な化合物の製造中間体として、また、例えば、過酸化物、ATP、カルシウムイオン又はステロイドホルモン等の生体の微量成分の分析に使用される発光試薬の製造中間体として有用である(シモムラ等(Shimomura et al)バイオケミカル ジャナール(Biochemical Journal)第270巻、第309頁〜第312頁(1990年)参照)。
【0003】
当該ピラジン誘導体の公知の製造方法としては、例えば、薬学雑誌 第89巻、第1646頁〜第1651頁(1969年)及びジャーナル・オブ・ケミカル・ソサエティ(Journal of Chemical Society)第932頁(1951年)が挙げられるが、これらの製造方法は、当該ピラジン誘導体の収率が低く、工業的な製造方法としては好ましくない。
【0004】
さらに、当該ピラジン誘導体の公知の製造方法としては、ジャーナル・オブ・ザ・アメリカン・ケミカル・ソサイエティ(Journal of the American Chemical Society)第93巻、第2333頁〜第2335頁(1971年)が挙げられる。この製造方法では、当該ピラジン誘導体の収率は、高価な四塩化チタンを使用することにより向上しているが、それでも工業的には満足すべきレベルではないことから、製造方法としては工業的に有利な製造方法とはいえない。
【0005】
【発明が解決しようとする課題】
本発明は、従来公知の2−アミノピラジン誘導体の製造方法の上述の問題点を改善し、工業的に優れた2−アミノピラジン誘導体の製造方法及びそのために使用されうる反応促進剤を提供することにある。
【0006】
【課題を解決するための手段】
本発明者らは、2−アミノピラジン誘導体の製造方法に関して、鋭意検討した結果、驚くべきことに、鉄化合物が反応促進作用を有することを見出した。本発明者らはさらに、本発明方法が目的とする2−アミノピラジン誘導体を従来方法よりも高収率で製造できるという特長を有し、さらに反応工程管理が容易であることから工業的にすぐれた製造方法であることを見出し、さらに検討を重ねて本発明を完成した。
【0007】
すなわち、本発明は、
(1) 鉄化合物を有効成分とするピラジン環形成反応の促進剤、
(2) 鉄化合物が、塩化鉄(III)、硝酸鉄(III)、硫酸鉄(III)、臭化鉄(III)、硫酸アンモニウム鉄(III)、クエン酸鉄(III)、シュウ酸鉄(II)又はフマル酸鉄(II)であることを特徴とする前記(1)記載のピラジン環形成反応の促進剤、
(3) 一般式[IV]:
【化5】
[式中、R1は水素原子、炭素数1個〜6個のアルキル基又はアリール基を、R2は水素原子、炭素数1個〜6個のアルキル基、アリール基又はハロゲン原子を示す]で表される化合物又はその酸付加塩と、一般式[III]:
【化6】
[式中、R3は水素原子、炭素数1個〜6個のアルキル基、アリール基又はアラルキル基を示す]で表されるアミノアセトニトリル化合物又はその酸付加塩とを、鉄化合物の存在下で反応させて、一般式[II]:
【化7】
[式中、R1、R2及びR3は前記の意味を示す]で表されるN−オキシド化合物又はその酸付加塩を製造し、次いでこのN−オキシド化合物又はその酸付加塩を還元することを特徴とする一般式[I]:
【化8】
[式中、R1、R2及びR3は前記の意味を示す]で表される2−アミノピラジン誘導体又はその酸付加塩の製造方法、
(4) 鉄化合物が、塩化鉄(III)、硝酸鉄(III)、硫酸鉄(III)、臭化鉄(III)、硫酸アンモニウム鉄(III)、クエン酸鉄(III)、シュウ酸鉄(II)又はフマル酸鉄(II)であることを特徴とする前記(3)記載の2−アミノピラジン誘導体又はその酸付加塩の製造方法、
(5) 還元が、パラジウム炭素又は白金炭素を触媒とする接触還元であることを特徴とする前記(3)又は(4)記載の2−アミノピラジン誘導体の製造方法、
に関するものである。
【0008】
【発明の実施の形態】
本発明について、具体的且つ詳細に説明する。
【0009】
「鉄化合物」とは、例えば、塩化鉄(III)、硝酸鉄(III)、硫酸鉄(III)、臭化鉄(III)、硫酸アンモニウム鉄(III)、クエン酸鉄(III)、シュウ酸鉄(II)又はフマル酸鉄(II)等の鉄原子を含有する化合物を意味し、好ましくは塩化鉄(III)、硝酸鉄(III)又は硫酸鉄(III)等が挙げられる。
【0010】
「炭素数1個〜6個のアルキル基」とは、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基、sec−ブチル基、n−ペンチル基、イソペンチル基、ネオペンチル基、n−ヘキシル基又はイソヘキシル基等の直鎖状又は分岐状の炭素数1個〜6個のアルキル基が挙げられ、なかでもメチル基、エチル基、n−プロピル基、n−ブチル基又はn−ヘキシル基が好ましい。
【0011】
「アリール基」とは、例えば、フェニル基、o−トリル基、p−トリル基、m−トリル基、1−ナフチル基、2−ナフチル基又はインダニル基等の炭素数6個〜12個のアリール基を意味し、なかでもフェニル基、1―ナフチル基又は2−ナフチル基が好ましい。
従って、反応を阻害しない通常の基(例えば、炭素数1個〜6個のアルキル基、炭素数3個〜6個のシクロアルキル基)を置換基として有していてもよい。ここにおいて、炭素数1個〜6個のアルキル基は前記の意味を有し、炭素数3個〜6個のシクロアルキル基としては、例えば、シクロプロピル基、シクロペンチル基又シクロヘキシル基等が挙げられる。
【0012】
「アラルキル基」とは、例えば、ベンジル基、(1−ナフチル)メチル基、(2−ナフチル)メチル基又は2−フェニルエチル基等の炭素数7個〜12個のアリール基が挙げられる。また、これらの基は上記の反応を阻害しない置換基を有していてもよい。
【0013】
「ハロゲン原子」とは、例えば、塩素原子、臭素原子、フッ素原子又はヨウ素原子が挙げられる。
【0014】
次に、本発明の製造方法について説明する。
一般式[IV]:
【化9】
[式中、R1は水素原子、炭素数1個〜6個のアルキル基又はアリール基を、R2は水素原子、炭素数1個〜6個のアルキル基、アリール基又はハロゲン原子を示す]で表される化合物又はその酸付加塩と、一般式[III]:
【化10】
[式中、R3は水素原子、炭素数1個〜6個のアルキル基、アリール基又はアラルキル基を示す]で表されるアミノアセトニトリル化合物又はその酸付加塩とを、鉄化合物の存在下で反応させて、一般式[II]:
【化11】
[式中、R1、R2及びR3は前記の意味を示す]で表されるN−オキシド化合物又はその酸付加塩を製造し、次いでこのN−オキシド化合物又はその酸付加塩を還元することにより行われる。この方法は、好ましくは、以下の(1)及び(2)の処理を順に連続して行うことにより工業的に有利に実施することができる。
【0015】
(1)溶媒に、一般式[IV]で表される化合物又はその酸付加塩、一般式[III]で表されるアミノアセトニトリル化合物又はその酸付加塩、及び鉄化合物を加え、約50℃〜約100℃、好ましくは約70℃〜約100℃で約1時間〜約36時間、好ましくは約2時間〜約21時間反応させて、一般式[II]で表されるN−オキシド化合物又はその酸付加塩を製造する。
本工程で使用される一般式[IV]で表される化合物の使用量は、一般式[III]で表されるアミノアセトニトリル化合物に対して約1当量〜約5当量である。
一般式[III]で表されるアミノアセトニトリル化合物が酸付加塩の場合、例えば、N−メチルモルホリン、水酸化ナトリウム、水酸化カリウム、トリエチルアミン又はジイソプロピルアミン等の塩基を、当該アミノアセトニトリル化合物に対して約1当量〜約6当量、好ましくは約1当量〜約5当量アミノアセトニトリル化合物酸付加塩に加えた後、上記(1)の処理を行う。
(2)(1)で得られた一般式[II]で表されるN−オキシド化合物又はその酸付加塩を含む反応液を還元反応容器に移し、例えばパラジウム炭素又は白金炭素等の触媒を当該アミノアセトニトリル化合物に対して約1mol%〜約5mol%加え、約2気圧〜約6気圧、好ましくは約2気圧〜約5気圧の水素加圧下で、約30℃〜約100℃、好ましくは約30℃〜約80℃で約1時間〜約24時間、好ましくは約8時間〜約15時間反応させる。
【0016】
本発明の反応(1)及び(2)はいずれも溶媒の存在下に行われてよく、そのような溶媒としては、例えば、水、N,N−ジメチルホルムアミド、ジメチルスホキシド、メタノール、エタノール、クロロホルム、テトラヒドロフラン又はイソプロパノール又はそれらの混合溶媒等が挙げられる。
【0017】
本工程で使用される鉄化合物としては、例えば、塩化鉄(III)、硝酸鉄(III)、硫酸鉄(III)、臭化鉄(III)、硫酸アンモニウム鉄(III)、クエン酸鉄(III)、シュウ酸鉄(II)又はフマル酸鉄(II)等が挙げられ、その使用量は、当該アミノアセトニトリル化合物に対して約0.5当量〜約1当量である。
【0018】
以上の工程で得られる生成物は、それ自体既知の方法、例えばシリカゲル又は吸着樹脂等を用いるカラムクロマトグラフィー、液体クロマトグラフィー、薄層クロマトグラフィー、溶媒抽出又は再結晶・再沈殿等の常用の分離精製法を必要に応じて単独又は適宜組み合わせて用いることにより精製・単離することができる。
なお、一般式[I]〜[IV]で表される化合物の酸付加塩における酸としては、例えば、塩酸、硫酸、硝酸等の無機酸、例えば、シュウ酸、酢酸等の有機酸が挙げられる。
【0019】
【発明の実施の形態】
以下に実施例を挙げて、本発明を具体的に説明するが、本発明は、これらにより何ら限定されるものではない。
【0020】
実施例1
2−アミノ−5−フェニルピラジンの製造:
窒素気流下、10Lガラス製ナス型フラスコにアミノアセトニトリル塩酸塩(124g、1.34mol)とメタノール(4L)、12N水酸化ナトリウム水溶液(123mL、1.48mol)を滴下し溶液とする。この溶液にイソニトロソアセトフェノン(100g、0.67mol)と塩化鉄(III)(109g、0.67mol)を20℃以下で加える。反応溶液を50℃で2時間、還流で4時間攪拌反応させる。高速液体クロマトグラフィー(以下、「HPLC」と略)による分析により、イソニトロソアセトフェノンの消失を確認した後に、反応液を室温にまで冷却し、ステンレス製加圧反応容器(内容器はテフロン(登録商標)製)に移液する。反応溶液にパラジウム炭素(10w/w%)を加え、水素加圧下(5atm)、50℃で18時間攪拌する。HPLCで2−アミノ−5−フェニルピラジン=1−オキシド(核磁気共鳴法(以下、「NMR」法と略)による測定値を下記する)が消失したのを確認した後に、反応溶液を12N水酸化ナトリウム水溶液を用いてアルカリ性(pH>10)とする。これをセライトに通し、不溶物を除去した後に濾液を減圧下、メタノールを濃縮する。水層に酢酸エチルを加え、2回抽出する。得られた酢酸エチル溶液を7重量%食塩水で洗浄した後に分液し、酢酸エチル溶液を無水硫酸ナトリウムで脱水する。酢酸エチル溶液を減圧下、一定量まで濃縮した後に、活性炭(商標:Darco−G60)を加え、室温で1時間攪拌する。セライトを通し、活性炭を除去した後に、酢酸エチル溶液を減圧下、一定量まで濃縮すると結晶が析出してくる。得られる懸濁液にn−ヘプタンを滴下し、室温で1時間攪拌した後に、グラスフィルターを用いて濾過し、結晶を酢酸エチル/n−ヘプタン(容量比、1:5)で洗浄する。得られた結晶を室温で減圧乾燥し、2−アミノ−5−フェニルピラジンが黄色結晶として、77g(収率67%)得られた。
【0021】
2−アミノ−5−フェニルピラジン=1−オキシド:
1H−NMR(500MHz,DMSO)δ ppm:8.79(s,1H),8.22(s,1H),7.96(d,J=7.5Hz,2H),7.44(dd,J=7.3,7.5Hz,2H),7.38(dd,J=7.3Hz,1H),7.11(s,2H)
【0022】
2−アミノ−5−フェニルピラジン:
1H−NMR(500MHz,DMSO)δ ppm:8.53(s,1H),8.01(s,1H),7.94(d,J=7.6Hz,1H),7.93(d,J=7.6Hz,1H),7.43(dd,J=7.4,7.6Hz,2H),7.32(dd,J=7.4Hz,1H),6.59(s,1H)
【0023】
13C−NMR(125MHz,DMSO)δ ppm:125.0,127.7,129.0,131.8,137.5,139.2,139.4,155.3
【0024】
HPLCの測定条件
カラム:シンメトリー(symmetry)C8,
4.6mm×250mm
測定温度:25℃
移動層:
グラジェント(gradient):
流速:1.0mL/分
0分(A:B=95:5(体積比))
35分(A:B=50:50(体積比))
A:0.1%リン酸;B:アセトニトリル
検出波長:243nm
保持時間(retention time):
イソニトロアセトフェノン:20.69分
2−アミノ−5−フェニルピラジン=1−オキシド:14.37分
2−アミノ−5−フェニルピラジン:16.03分
【0025】
実施例2〜7
実施例1の製法と同様にして、実施例2〜7の化合物を製造した。ただし、目的物の精製に関しては、実施例1の結晶化法に代えて、シリカゲルカラムクロマトグラフィー(シリカゲル:ワコーゲル(和光純薬製);展開剤:n−ヘプタン及び酢酸エチルの混合溶媒)により行った。
実施例2
2−アミノ−3−メチル−5−フェニルピラジン:(収率:63%)
1H−NMR(500MHz,DMSO)δ ppm:8.40(s,1H),7.94(d,J=7.4,8.3Hz,2H),7.43(d,J=7.6Hz,1H),7.41(d,J=7.8Hz,1H),7.31(d,J=7.2Hz,1H),6.35(s,2H),2.40(s,3H)
【0026】
13C−NMR(125MHz,CDCl3)δ ppm:21.1,125.1,127.6,129.0,136.8,137.6,138.8,138.9,153.6,176.5
【0027】
実施例3
2−アミノ−3−エチル−5−フェニルピラジン:(収率:67%)
1H−NMR(270MHz,CDCl3)δ ppm:8.32(s,1H),7.93(d,J=7.3,8.6Hz,2H),7.45(d,J=7.3Hz,1H),7.42(d,J=7.6Hz,1H),7.34(dd,J=6.9,7.6Hz,1H),4.61(s,2H),2.73(q,J=7.3,7.6Hz,2H),1.41(t,J=7.3,7.6Hz,3H)
【0028】
13C−NMR(125MHz,CDCl3)δ ppm:11.0,26.0,125.0,127.5,129.0,136.5,137.8,138.8,142.5,153.0
【0029】
実施例4
2−アミノ−3,5−ジフェニルピラジン:(収率:58%)
1H−NMR(270MHz,DMSO)δ ppm:8.57(s,1H),8.00(d,J=7.3,8.6Hz,2H),7.82(d,J=6.9,8.3Hz,2H),7.57−7.47(m,4H),7.43(d,J=7.6Hz,1H),7.34(dd,J=6.9,7.6Hz,1H),6.31(s,2H)
【0030】
13C−NMR(67.5MHz,DMSO)δ ppm:124.9,127.8,128.1,128.5,128.6,128.8,128.9,129.0,136.9,137.5,137.8,137.9,139.7,152.0
【0031】
実施例5
2−アミノ−3−ベンジル−5−フェニルピラジン:(収率:72%)
1H−NMR(270MHz,DMSO)δ ppm:8.44(s,1H),7.92(d,J=7.3Hz,2H),7.44−7.17(m,8H),6.41(s,2H),4.11(s,2H)
【0032】
13C−NMR(67.5MHz,DMSO)δ ppm:124.7,126.1,127.3,128.2,128.6,128.9,136.9,137.1,138.1,138.7,140.0,152.7
【0033】
実施例6
2−アミノ−5−フェニル−6−メチルピラジン:(収率:60%)
1H−NMR(270MHz,DMSO)δ ppm:7.82(s,1H),7.51(d,J=6.6Hz,1H),7.43(d,J=6.6Hz,1H),7.41(d,J=7.9Hz,1H),7.34(d,J=6.6Hz,1H),7.32(d,J=7.6Hz,1H),6.40(s,2H),2.35(s,3H)
【0034】
13C−NMR(67.5MHz,DMSO)δ ppm:22.7,127.2,128.2,129.1,129.2,139.7,140.1,147.8,154.2
【0035】
実施例7
2−アミノ−5−メチルピラジン:(収率:55%)
1H−NMR(500MHz,DMSO)δ ppm:7.81(s,1H),7.78(s,1H),6.10(s,2H),2.25(s,3H)
【0036】
13C−NMR(125MHz,DMSO)δ ppm:20.0,131.4,139.6,140.7,154.4,176.5
【0037】
比較例
塩化鉄(III)の代わりに同モル量の四塩化チタンを用いて実施例1の方法に従い、2−アミノ−5−フェニルピラジンを製造すると、その収率は10%であった。
【0038】
【発明の効果】
本発明で提供される鉄化合物を有効成分とするピラジン環の反応促進剤は、従来公知の2−アミノピラジン誘導体の製造方法よりも収率向上を図ることができるため、工業的に優れた2−アミノピラジン誘導体の製造方法を提供することができる。
Claims (5)
- 鉄化合物を有効成分とするピラジン環形成反応の促進剤。
- 鉄化合物が、塩化鉄(III)、硝酸鉄(III)、硫酸鉄(III)、臭化鉄(III)、硫酸アンモニウム鉄(III)、クエン酸鉄(III)、シュウ酸鉄(II)又はフマル酸鉄(II)であることを特徴とする請求項1記載のピラジン環形成反応の促進剤。
- 一般式[IV]:
- 鉄化合物が、塩化鉄(III)、硝酸鉄(III)、硫酸鉄(III)、臭化鉄(III)、硫酸アンモニウム鉄(III)、クエン酸鉄(III)、シュウ酸鉄(II)又はフマル酸鉄(II)であることを特徴とする請求項3記載の2−アミノピラジン誘導体又はその酸付加塩の製造方法。
- 還元が、パラジウム炭素又は白金炭素を触媒とする接触還元であることを特徴とする請求項3又は4記載の2−アミノピラジン誘導体又はその酸付加塩の製造方法。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002130136A JP2005320249A (ja) | 2002-05-01 | 2002-05-01 | 2−アミノピラジン誘導体の製造方法 |
| PCT/JP2003/005409 WO2003092889A1 (en) | 2002-05-01 | 2003-04-25 | Process for the preparation of 2-aminopyrazine derivatives |
| AU2003235951A AU2003235951A1 (en) | 2002-05-01 | 2003-04-25 | Process for the preparation of 2-aminopyrazine derivatives |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002130136A JP2005320249A (ja) | 2002-05-01 | 2002-05-01 | 2−アミノピラジン誘導体の製造方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005320249A true JP2005320249A (ja) | 2005-11-17 |
Family
ID=29397319
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002130136A Pending JP2005320249A (ja) | 2002-05-01 | 2002-05-01 | 2−アミノピラジン誘導体の製造方法 |
Country Status (3)
| Country | Link |
|---|---|
| JP (1) | JP2005320249A (ja) |
| AU (1) | AU2003235951A1 (ja) |
| WO (1) | WO2003092889A1 (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007041052A2 (en) | 2005-09-29 | 2007-04-12 | Merck & Co., Inc. | Acylated spiropiperidine derivatives as melanocortin-4 receptor modulators |
| WO2008039327A2 (en) | 2006-09-22 | 2008-04-03 | Merck & Co., Inc. | Method of treatment using fatty acid synthesis inhibitors |
| JP5319518B2 (ja) | 2007-04-02 | 2013-10-16 | Msd株式会社 | インドールジオン誘導体 |
| CA2741644C (en) | 2008-10-30 | 2013-05-07 | Merck Sharp & Dohme Corp. | Isonicotinamide orexin receptor antagonists |
| AR088352A1 (es) | 2011-10-19 | 2014-05-28 | Merck Sharp & Dohme | Antagonistas del receptor de 2-piridiloxi-4-nitrilo orexina |
| CR20200464A (es) | 2018-03-08 | 2021-04-14 | Incyte Corp | Compuestos diólicos de aminopirazina como inhibidores de pi3k-y |
| US11046658B2 (en) | 2018-07-02 | 2021-06-29 | Incyte Corporation | Aminopyrazine derivatives as PI3K-γ inhibitors |
| US12331018B2 (en) | 2019-02-13 | 2025-06-17 | Merck Sharp & Dohme Llc | Pyrrolidine orexin receptor agonists |
| WO2020167706A1 (en) | 2019-02-13 | 2020-08-20 | Merck Sharp & Dohme Corp. | 5-alkyl pyrrolidine orexin receptor agonists |
| WO2021026047A1 (en) | 2019-08-08 | 2021-02-11 | Merck Sharp & Dohme Corp. | Heteroaryl pyrrolidine and piperidine orexin receptor agonists |
| CA3189908A1 (en) | 2020-08-18 | 2022-02-24 | Stephane L. Bogen | Bicycloheptane pyrrolidine orexin receptor agonists |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5337675A (en) * | 1976-09-20 | 1978-04-06 | Tokai Electro Chemical Co | Production of pyrazines |
| JPS60169468A (ja) * | 1984-02-15 | 1985-09-02 | Koei Chem Co Ltd | ピラジン類を製造する方法 |
| CA2209465C (en) * | 1996-07-11 | 2008-04-29 | Lonza Ag | Process for preparing 3-alkoxy-5-alkylpyrazin-2-amines |
| US6066736A (en) * | 1997-07-03 | 2000-05-23 | Lonza Ag | Process for preparing alkoxypyrazine derivatives |
| JP2002173486A (ja) * | 2000-12-01 | 2002-06-21 | Koei Chem Co Ltd | 2,6−ジ置換ピラジンの製造方法 |
-
2002
- 2002-05-01 JP JP2002130136A patent/JP2005320249A/ja active Pending
-
2003
- 2003-04-25 AU AU2003235951A patent/AU2003235951A1/en not_active Abandoned
- 2003-04-25 WO PCT/JP2003/005409 patent/WO2003092889A1/ja not_active Ceased
Also Published As
| Publication number | Publication date |
|---|---|
| AU2003235951A1 (en) | 2003-11-17 |
| WO2003092889A1 (en) | 2003-11-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3803292B2 (ja) | チアゾリジンの製造方法 | |
| EP3601268B1 (en) | Process for the preparation of 6-(cyclopropaneamido)-4-((2-methoxy-3-(1-methyl-1h-1,2,4-triazol-3-yl)phenyl)amino)-n-(methyl-d3)pyridazine-3-carboxamide | |
| JP2005320249A (ja) | 2−アミノピラジン誘導体の製造方法 | |
| JPH069536A (ja) | ビフェニル誘導体の製造方法 | |
| JPH11322721A (ja) | 環式4―オキソアミジンの製造方法 | |
| CZ304198A3 (cs) | Způsob výroby čistých enantiomerů derivátů pyridazinonu | |
| WO2002014325A1 (en) | Crystals of penicillin and process for the production thereof | |
| HK1204611A1 (en) | Crystal of n-[2-({2-[(2s)-2-cyanopyrrolidin-1-yl]-2- oxoethyl}amino)-2-methylpropyl]-2-methylpyrazolo[1,5-a]pyrimidine-6-carboxamide | |
| JP2010241805A (ja) | アンモニア含有濾液の再使用によるアミノマロンアミドの製造法 | |
| JP2011098975A (ja) | キラル純n−(トランス−4−イソプロピル−シクロヘキシルカルボニル)−d−フェニルアラニン及びそれらの結晶構造変性体の生成方法 | |
| US6177564B1 (en) | Process for the synthesis of N-benzyl-3-(4-fluorophenyl)-1-4-oxazin-2-one | |
| JP3125101B2 (ja) | 光学異性ヒダントインの分割方法 | |
| JP2025523682A (ja) | 複素環式化合物の調製方法 | |
| JP3489116B2 (ja) | 新規合成中間体およびアミノピペラジン誘導体の製造法 | |
| US6340773B1 (en) | Preparation of halogenated primary amines | |
| JP2011528693A (ja) | 置換4−アミノ−ピリミジンの新規合成 | |
| DE60021859T2 (de) | 1, 2, 3, 4-tetrahydro-1-naphthalenamin verbindungen zur therapeutsichen verwendung | |
| US20040053967A1 (en) | 3-(3-Amidinophenyl)-5-[({[1-(1-(iminoethyl)-4-piperidyl}amino)methyl]benzoic acid dihydrochloride and process for preparing the same | |
| EA011763B1 (ru) | Способы получения венлафаксина и формы i венлафаксина гидрохлорида | |
| EP1807401B1 (en) | Process for the preparation of phenyl 2-pyrimidinyl ketones and their novel intermediates | |
| JP2007530504A (ja) | ガバペンチンの調製方法 | |
| JP2959811B2 (ja) | 酸塩化物の製造法 | |
| JPH08198876A (ja) | トランス−N−(1H−ピラゾロ〔3,4−b〕ピリジン−4−イル)−4−グアニジノメチルシクロヘキサンカルボキサミド・1メタンスルホン酸塩・1水和物 | |
| JP2002193933A (ja) | 光学活性ピペリジン誘導体またはその酸塩の製造方法 | |
| JP2767295B2 (ja) | インドール―3―カルボニトリル化合物の製造方法 |