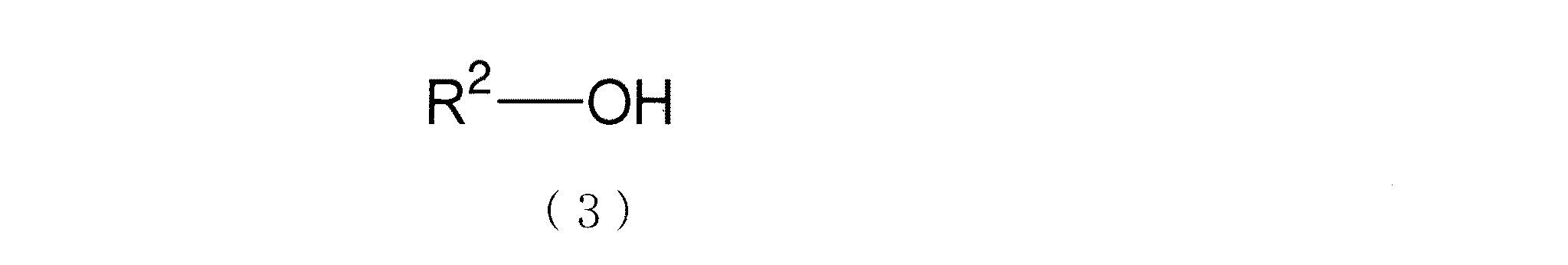JP2005298433A - ジアルキルスズアルコキシド - Google Patents
ジアルキルスズアルコキシド Download PDFInfo
- Publication number
- JP2005298433A JP2005298433A JP2004119779A JP2004119779A JP2005298433A JP 2005298433 A JP2005298433 A JP 2005298433A JP 2004119779 A JP2004119779 A JP 2004119779A JP 2004119779 A JP2004119779 A JP 2004119779A JP 2005298433 A JP2005298433 A JP 2005298433A
- Authority
- JP
- Japan
- Prior art keywords
- carbon atoms
- tin
- group
- dialkyltin
- mol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 CNCCC(C*)CO Chemical compound CNCCC(C*)CO 0.000 description 2
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/141—Feedstock
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
【課題】 有害なトリアルキルスズ化合物や金属腐食やポリマー劣化をもたらす塩素含有化合物を含有したジアルキルスズアルコキシドを有機合成に使用し、結果として製品にこれら有害物が混入するといった問題を解決し、有害物を含まない製品を簡便に得ることができるジアルキルスズアルコキシドを提供すること。
【解決手段】 ジアルキルスズアルコキシド含有組成物であって、該組成物中のジアルキルスズアルコキシドのスズ原子モル数に対してトリアルキルスズ化合物含有量が0.01mol%以上1mol%以下、及び塩素原子含有量が1000ppm以下であることを特徴とするジアルキルスズアルコキシド含有組成物である。
【選択図】 なし
【解決手段】 ジアルキルスズアルコキシド含有組成物であって、該組成物中のジアルキルスズアルコキシドのスズ原子モル数に対してトリアルキルスズ化合物含有量が0.01mol%以上1mol%以下、及び塩素原子含有量が1000ppm以下であることを特徴とするジアルキルスズアルコキシド含有組成物である。
【選択図】 なし
Description
本発明は、エステル製造に用いる触媒としてのジアルキルスズアルコキシドに関するものである。
ジアルキルスズアルコキシドは、エステル合成触媒、エステル交換反応触媒、シリコンポリマーやウレタン硬化触媒等の触媒として極めて有用である。ところで、一般に、トリアルキルスズ化合物のいくつかは毒性の点から多くの規制を受けているし、塩素含有化合物の存在は金属腐食やポリマーの劣化等を引き起こすことも知られている。従来のジアルキルスズアルコキシドの製造方法として、特許文献1,2あるいは非特許文献1,2等が知られているが、従来のジアルキルスズアルコキシドを上記触媒用途に使用した際に、上記した有害なトリアルキルスズ化合物や塩素含有化合物の製品への混入があった。しかし、どの工程で、あるいはどの化合物から由来してくるかについては知られていなかった。
これら有害なトリアルキルスズ化合物や塩素含有化合物を製品に混入させないジアルキルスズアルコキシドが望まれている。
US−5545600
US−2700675
工業化学雑誌 72,7(1969),1543
Journal of Chemical Society C:Organic,23(1971),3972
これら有害なトリアルキルスズ化合物や塩素含有化合物を製品に混入させないジアルキルスズアルコキシドが望まれている。
本発明者等は鋭意検討を重ねた結果、ジアルキルスズアルコキシドを用いた際に製品に混入するトリアルキルスズ化合物や塩素含有化合物が、主に、用いたジアルキルスズアルコキシドに当初から含有されていることを突き止めた。
従来のジアルキルスズアルコキシドの製造方法としては、ジアルキルスズオキシドを原料とする方法(例えば上記特許文献1参照)とジアルキル−ジクロロ−スズを原料とする方法(例えば上記特許文献2参照)等が挙げられる。
例えば、上記した製造法のうち、ジアルキルスズオキシドを用いる方法は、下記式(10)に示す脱水を伴う平衡反応であると推定した。
従来のジアルキルスズアルコキシドの製造方法としては、ジアルキルスズオキシドを原料とする方法(例えば上記特許文献1参照)とジアルキル−ジクロロ−スズを原料とする方法(例えば上記特許文献2参照)等が挙げられる。
例えば、上記した製造法のうち、ジアルキルスズオキシドを用いる方法は、下記式(10)に示す脱水を伴う平衡反応であると推定した。
また、ジアルキルスズオキシドを用いた別の例としては、ジアルキルスズオキシドとアルコールとから脱水反応させて、化学式(8)に相当するジアルキル−ジアルコキシ−ジスタンオキサンを得、次いでジアルキル−ジアルコキシ−ジスタンオキサンの不均化反応によって化学式(7)のジアルキルスズジアルコキシドを蒸留で得る方法(例えば非特許文献2)もある。この方法では、高温で不均化反応をおこなうことから、得られたジアルキル−ジアルコキシ−ジスタンオキサンが不均化反応中あるいは蒸留中にトリアルキルスズ化合物に熱分解して、得られるジアルキルスズジアルコキシド中に多量に混入するといった問題点もある。
本発明者らの検討結果、例えば1,1,3,3−テトラブチル−1,3−ビス(2−エチルヘキシルオキシ)―ジスタンオキサンを長時間にわたって、加熱すれば、図1に示すように1,1,3,3−テトラブチル−1,3−ビス(2−エチルヘキシルオキシ)―ジスタンオキサンが減少し、トリブチル−(2−エチルヘキシルオキシ)スズが多量に生成することが明らかになった。
即ち、上記した式(11)、式(12)に従ってジアルキルスズアルコキシドを従来の方法によって得ようとすれば、長時間にわたってジアルキル−ジアルコキシ−ジスタンオキサンを加熱することになり、トリアルキルスズ化合物を含有することは避けられなかったし、また、ジアルキルスズジアルコキシド製造過程で生成することは知られていなかった。一方で、ジアルキルスズアルコキシドなどの金属アルコキシドは、加水分解を受けやすく、その精製方法は一般的に困難であり、ジアルキルスズアルコキシドの精製方法は、これまでに知られていないし、上記したジアルキルスズアルコキシドの製造方法にも記載されていない。従って、上記した製造方法で得られたジアルキルスズアルコキシド中には、トリアルキルスズ化合物を多量に含有するという問題点があった。従って、ジアルキルスズアルコキシドを従来公知のジアルキルスズオキシドとアルコールから得る方法では、該ジアルキルスズアルコキシドを、エステル合成触媒、エステル交換反応触媒、シリコンポリマーやウレタン硬化触媒等の触媒や原料として使用した際に、製品中にトリアルキルスズ化合物が製品中に混入しやすいといった問題点があった。
一方で、ジアルキル−ジクロロ−スズを用いる方法は、下記式(14)に示す反応で製造される。常温(例えば20℃)であってもジアルキルスズアルコキシドを得ることができる。従ってジアルキルスズオキシドを原料とした際のように長時間の加熱工程を必ずしも必要としないため、トリブチルスズ化合物の生成は少ない。しかし、該ジアルキル−ジクロロ−スズを原料とした場合には、生成物から塩素由来の不純物を取り除くことは困難である。この場合にも生成したジアルキルスズアルコキシドから塩素含有化合物を充分除去する方法が知られていないからである。
即ち、ジアルキル−ジクロロ−スズを原料として製造したジアルキルスズアルコキシド中には、塩素含有化合物を多量に含んでおり、その除去方法も知られていないため、該ジアルキルスズアルコキシドを原料としたり、触媒として使用した場合には、腐食等の原因となる塩素含有化合物が製品中に混入しやすいといった問題点がある。また、高価な金属アルコラートを使用し、また、得られるジアルキルスズアルコキシドに対して2倍molの金属塩が生成するために、廃棄物等の問題もあって、コスト、廃棄物の観点からも工業的製造方法として問題がある。
上述のとおり、ジアルキルスズアルコキシドを製造する方法は知られているが、生成物に含まれる副生成物や不純物についての記述や除去方法の記載はなく、有害なトリアルキルスズ化合物や金属腐食やポリマー劣化をもたらす塩素含有化合物を含有したジアルキルスズアルコキシドを有機合成に使用し、結果として製品にこれら有害物が混入するといった問題があった。この問題を解決し、これらの有害な化合物の含有量を大幅に低減したジアルキルスズアルコキシドおよびその製造方法を提供し、また該ジアルキルスズアルコキシドを触媒としてこれらの有害な化合物を実質上含まない各種製品を簡便に得るために使用し、該各種製品を提供することが本発明の目的である。
本発明者等は鋭意検討を重ねた結果、ジアルキルスズアルキシドを有機合成の触媒として用いた際に製品に混入するトリブチルスズ化合物や塩素含有化合物といった有害物が、用いたジアルキルスズアルコキシドに当初から含有されていることを突き止め、後述のジアルキルスズアルコキシドを提供することによって、従来解決できなかった製品への有害物の混入といった課題を解決し、本発明を完成させた。即ち本発明は、以下のとおりである。
[1] ジアルキルスズアルコキシド含有組成物であって、該組成物中のジアルキルスズアルコキシドのスズ原子モル数に対してトリアルキルスズ化合物含有量が0.01mol%以上1mol%以下、及び塩素原子含有量が1000ppm以下であることを特徴とするジアルキルスズアルコキシド含有組成物。
[2] 下記式(1)に示すジアルキルスズオキシド及び/または下記式(2)に示すジアルキルスズアルコキシドを含む出発物質と、下記式(3)に示すアルコールを含む反応物質とを脱水反応し、出発物質と反応物質に対応するジアルキルスズジアルコキシドの製造方法であって、下記式(4)によって定められる脱水速度条件を満足する脱水速度で製造することを特徴とする[1]記載のジアルキルスズアルコキシド含有組成物の製造方法。
(式中:
R1は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表す。)
(式中:
R1は、上記した化学式(1)のR1と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R2は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
(式中:
R2は、上記した化学式(2)のR2と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
(式中、
脱水速度:脱水反応で形成される水のうち、単位時間当りに系外に抜き出す水量[mol・hr-1]、X:出発物質に含まれる化学式(1)で表すジアルキルスズオキシド中のスズ原子モル数[mol]、Y:出発物質に含まれる化学式(2)で表すジアルキルスズアルコキシド中のスズ原子モル数[mol]、T:脱水反応温度[K]、R:気体定数=8.314J・mol-1・K-1を表し、A及びBは化学式(2)で表すジアルキルスズアルコキシドの種類に依存する係数である。)
但し、出発物質に化学式(2)で表すジアルキルスズアルコキシドが含まれる場合は、上記A及びBはそれぞれ化学式(2)で表すジアルキルスズアルコキシドの熱分解反応の頻度因子及び活性化エネルギーを表すものであって、下記式(5)で得られるA及びBであり、そして出発物質に化学式(2)で表すジアルキルスズアルコキシドが含まれない場合は、A及びBはそれぞれ出発物質に含まれる化学式(1)と反応物質とから形成される化学式(2)に相当するジアルキルスズアルコキシドの熱分解反応の頻度因子及び活性化エネルギーを表すものであって、下記式(5)で得られるA及びBである。
(式中、
k:1次反応速度定数[hr-1]、A:頻度因子[hr-1]、B:活性化エネルギー[J・mol-1]、R:気体定数=8.314J・mol-1・K-1、T:熱分解反応温度[K]を表す。)
上記kは該熱分解反応の1次反応速度定数を表し、下記式(6)で得られるkである。
(式中、
k:1次反応速度定数[hr-1]、t:熱分解反応時間[hr]、C:化学式(2)で表すジアルキルスズアルコキシドの初期濃度に対する減少率[mol/mol]を表す。)
[3] [1]記載の該ジアルキルスズアルコキシド含有組成物中のジアルキルスズアルコキシドが下記式(7)または下記式(8)の少なくとも1つを含むことを特徴とする[1]記載のジアルキルスズアルコキシド含有組成物。
(式中:
R3は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R4は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
(式中:
R3は前述したR3と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R4は前述したR4と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
[4] ジアルキルスズジアルコキシドが、下記式(7)または下記式(8)の少なくとも1つを含むことを特徴とする[2]記載のジアルキルスズアルコキシド含有組成物の製造方法。
(式中:
R3は、該出発物質に対応するR1と同じあり、R4は、該出発物質及び/または該反応物質に対応するR2と同じである。)
(式中:
R3は、該出発物質に対応するR1と同じであり、R4は、該出発物質及び/または該反応物質に対応するR2と同じある。)
[5] ジアルキルスズアルコキシド含有組成物であって、該組成物中のジアルキルスズアルコキシドのスズ原子モル数に対してトリアルキルスズ化合物含有量が0.01mol%以上1mol%以下、及び塩素原子含有量が1000ppm以下であることを特徴とする[1]記載のジアルキルスズアルコキシド含有組成物。
[6] 該出発物質に含まれるトリアルキルスズ化合物含有量が、該出発物質中の全スズ原子モル数に対して1mol%以下および塩素原子含有量1000ppm以下であることを特徴とする[2]記載のジアルキルスズアルコキシド製造方法。
[7] 脱水速度が下記式(9)によって定められる脱水速度条件を満足する脱水速度であることを特徴とする[2]記載のジアルキルスズアルコキシド含有組成物の製造方法。
(式中、
脱水速度:脱水反応で形成される水のうち、単位時間当りに系外に抜き出す水量[mol・hr-1]、X:出発物質に含まれる化学式(1)で表すジアルキルスズオキシド中のスズ原子モル数[mol]、Y:出発物質に含まれる化学式(2)で表すジアルキルスズアルコキシド中のスズ原子モル数[mol]、T:脱水反応温度[K]、R:気体定数=8.314J・mol-1・K-1を表し、A及びBは化学式(2)で表すジアルキルスズアルコキシドの種類に依存する係数である。)
[8] [1]または[3]記載のジアルキルスズアルコキシド含有組成物を触媒としてエステルの製造に使用する方法。
[9] [1]または[3]記載のジアルキルスズアルコキシド含有組成物を触媒として炭酸エステルの製造に使用する方法。
[10] [2]記載の製造方法で得られるジアルキルスズアルコキシド含有組成物を触媒としてエステルの製造に使用する方法。
[11] [2]記載の製造方法で得られるジアルキルスズアルコキシド含有組成物触媒として炭酸エステルの製造に使用する方法。
[12] [1]または[3]記載のジアルキルスズアルコキシド含有組成物を触媒として用いて製造される炭酸エステル。
[13] [2]記載の製造方法で得られるジアルキルスズアルコキシド含有組成物触媒として用いて製造される炭酸エステル。
[14] [1]または[3]記載のジアルキルスズアルコキシド含有組成物を触媒として用いて製造される炭酸エステルから得られる芳香族炭酸エステル、ポリカーボネート、またはイソシアネート類。
[15] [2]記載の製造方法で得られるジアルキルスズアルコキシド含有組成物を触媒として用いて製造される炭酸エステルから得られる芳香族炭酸エステル、ポリカーボネート、またはイソシアネート類。
[2] 下記式(1)に示すジアルキルスズオキシド及び/または下記式(2)に示すジアルキルスズアルコキシドを含む出発物質と、下記式(3)に示すアルコールを含む反応物質とを脱水反応し、出発物質と反応物質に対応するジアルキルスズジアルコキシドの製造方法であって、下記式(4)によって定められる脱水速度条件を満足する脱水速度で製造することを特徴とする[1]記載のジアルキルスズアルコキシド含有組成物の製造方法。
R1は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表す。)
R1は、上記した化学式(1)のR1と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R2は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
R2は、上記した化学式(2)のR2と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
脱水速度:脱水反応で形成される水のうち、単位時間当りに系外に抜き出す水量[mol・hr-1]、X:出発物質に含まれる化学式(1)で表すジアルキルスズオキシド中のスズ原子モル数[mol]、Y:出発物質に含まれる化学式(2)で表すジアルキルスズアルコキシド中のスズ原子モル数[mol]、T:脱水反応温度[K]、R:気体定数=8.314J・mol-1・K-1を表し、A及びBは化学式(2)で表すジアルキルスズアルコキシドの種類に依存する係数である。)
但し、出発物質に化学式(2)で表すジアルキルスズアルコキシドが含まれる場合は、上記A及びBはそれぞれ化学式(2)で表すジアルキルスズアルコキシドの熱分解反応の頻度因子及び活性化エネルギーを表すものであって、下記式(5)で得られるA及びBであり、そして出発物質に化学式(2)で表すジアルキルスズアルコキシドが含まれない場合は、A及びBはそれぞれ出発物質に含まれる化学式(1)と反応物質とから形成される化学式(2)に相当するジアルキルスズアルコキシドの熱分解反応の頻度因子及び活性化エネルギーを表すものであって、下記式(5)で得られるA及びBである。
k:1次反応速度定数[hr-1]、A:頻度因子[hr-1]、B:活性化エネルギー[J・mol-1]、R:気体定数=8.314J・mol-1・K-1、T:熱分解反応温度[K]を表す。)
上記kは該熱分解反応の1次反応速度定数を表し、下記式(6)で得られるkである。
k:1次反応速度定数[hr-1]、t:熱分解反応時間[hr]、C:化学式(2)で表すジアルキルスズアルコキシドの初期濃度に対する減少率[mol/mol]を表す。)
[3] [1]記載の該ジアルキルスズアルコキシド含有組成物中のジアルキルスズアルコキシドが下記式(7)または下記式(8)の少なくとも1つを含むことを特徴とする[1]記載のジアルキルスズアルコキシド含有組成物。
R3は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R4は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
R3は前述したR3と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R4は前述したR4と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
[4] ジアルキルスズジアルコキシドが、下記式(7)または下記式(8)の少なくとも1つを含むことを特徴とする[2]記載のジアルキルスズアルコキシド含有組成物の製造方法。
R3は、該出発物質に対応するR1と同じあり、R4は、該出発物質及び/または該反応物質に対応するR2と同じである。)
R3は、該出発物質に対応するR1と同じであり、R4は、該出発物質及び/または該反応物質に対応するR2と同じある。)
[5] ジアルキルスズアルコキシド含有組成物であって、該組成物中のジアルキルスズアルコキシドのスズ原子モル数に対してトリアルキルスズ化合物含有量が0.01mol%以上1mol%以下、及び塩素原子含有量が1000ppm以下であることを特徴とする[1]記載のジアルキルスズアルコキシド含有組成物。
[6] 該出発物質に含まれるトリアルキルスズ化合物含有量が、該出発物質中の全スズ原子モル数に対して1mol%以下および塩素原子含有量1000ppm以下であることを特徴とする[2]記載のジアルキルスズアルコキシド製造方法。
[7] 脱水速度が下記式(9)によって定められる脱水速度条件を満足する脱水速度であることを特徴とする[2]記載のジアルキルスズアルコキシド含有組成物の製造方法。
脱水速度:脱水反応で形成される水のうち、単位時間当りに系外に抜き出す水量[mol・hr-1]、X:出発物質に含まれる化学式(1)で表すジアルキルスズオキシド中のスズ原子モル数[mol]、Y:出発物質に含まれる化学式(2)で表すジアルキルスズアルコキシド中のスズ原子モル数[mol]、T:脱水反応温度[K]、R:気体定数=8.314J・mol-1・K-1を表し、A及びBは化学式(2)で表すジアルキルスズアルコキシドの種類に依存する係数である。)
[8] [1]または[3]記載のジアルキルスズアルコキシド含有組成物を触媒としてエステルの製造に使用する方法。
[9] [1]または[3]記載のジアルキルスズアルコキシド含有組成物を触媒として炭酸エステルの製造に使用する方法。
[10] [2]記載の製造方法で得られるジアルキルスズアルコキシド含有組成物を触媒としてエステルの製造に使用する方法。
[11] [2]記載の製造方法で得られるジアルキルスズアルコキシド含有組成物触媒として炭酸エステルの製造に使用する方法。
[12] [1]または[3]記載のジアルキルスズアルコキシド含有組成物を触媒として用いて製造される炭酸エステル。
[13] [2]記載の製造方法で得られるジアルキルスズアルコキシド含有組成物触媒として用いて製造される炭酸エステル。
[14] [1]または[3]記載のジアルキルスズアルコキシド含有組成物を触媒として用いて製造される炭酸エステルから得られる芳香族炭酸エステル、ポリカーボネート、またはイソシアネート類。
[15] [2]記載の製造方法で得られるジアルキルスズアルコキシド含有組成物を触媒として用いて製造される炭酸エステルから得られる芳香族炭酸エステル、ポリカーボネート、またはイソシアネート類。
本発明により、トリアルキルスズ化合物や塩素含有化合物の含有量を大幅に低減したジアルキルスズアルコキシドを得ることができ、このジアルキルスズアルコキシドを有機合成触媒として用いた際にトリブチルスズ化合物や塩素含有化合物を実質的に含まない製品、たとえばカルボン酸エステル、炭酸エステル、あるいはこれらの誘導品等を複雑な分離精製工程を必要とせず、簡便に得ることができ、工業分野において大変有用である。
本発明のジアルキルスズアルコキシド含有組成物はジアルキルスズアルコキシドのみであっても、無機物や有機物などとの混合物であってもよい。そして該ジアルキルスズアルコキシド含有組成物中のジアルキルスズアルコキシドのスズ原子モル数に対してトリアルキルスズ化合物含有量が0.01mol%以上1mol%以下、及び塩素原子含有量が1000ppm以下であるジアルキルスズアルコキシド含有組成物で、更に好ましくは該ジアルキルスズアルコキシド含有組成物中のジアルキルスズアルコキシドのスズ原子モル数に対してトリアルキルスズ化合物含有量が0.01mol%以上1mol%以下、及び塩素原子含有量が1000ppm以下であるジアルキルスズアルコキシド含有組成物である。トリアルキルスズ化合物が1mol%以下のレベルであればその毒性は実質上解消することができ、また塩素原子含有量が1000ppm以下のレベルであれば金属腐食やポリマーの劣化の問題も実質的に解消できる。更に、微量に含まれるトリアルキルスズ化合物はジアルキルスズアルコキシドの熱安定性を向上させたり、物理的または化学的特性を向上する場合があるためである。
本発明のジアルキルスズアルコキシドは、化学式(7)及び/または化学式(8)で表すジアルキルスズ化合物であり、化学式(7)及び/または化学式(8)で表すジアルキルスズアルコキシド化合物の群の中から選ばれる少なくとも1種のジアルキルスズアルコキシドである。化学式(7)及び化学式(8)は一般式として単量体構造を示しているが、これら化合物は会合体であっても多量体であっても構わない。
(式中:
R3は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R4は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
R3は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R4は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
(式中:
R3は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R4は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
R3は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R4は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
上記したような化学式(7)で示されるジアルキルスズアルコキシドの例としては、ジメチル−ジメトキシ−スズ、ジメチル−ジエトキシ−スズ、ジメチル−ジプロポキシ−スズ(各異性体)、ジメチル−ジブトキシ−スズ(各異性体)、ジメチル−ビスペンチルオキシ−スズ(各異性体)、ジメチル−ビスヘキシルオキシ−スズ(各異性体)、ジメチル−ビスヘプチルオキシ−スズ(各異性体)、ジメチル−ビスオクチルオキシ−スズ(各異性体)、ジメチル−ビスノニルオキシ−スズ(各異性体)、ジメチル−ビスデシルオキシ−スズ(各異性体)、ジブチル−ジメトキシ−スズ、ジブチル−ジエトキシ−スズ、ジブチル−ジプロポキシ−スズ(各異性体)、ジブチル−ジブトキシ−スズ(各異性体)、ジブチル−ビスペンチルオキシ−スズ(各異性体)、ジブチル−ビスヘキシルオキシ−スズ(各異性体)、ジブチル−ビスヘプチルオキシ−スズ(各異性体)、ジブチル−ビスオクチルオキシ−スズ(各異性体)、ジブチル−ビスノニルオキシ−スズ(各異性体)、ジブチル−ビスデシルオキシ−スズ(各異性体)、ジブチル−ビスベンジルオキシ−スズ、ジブチル−ビスフェニルエトキシ−スズ、ジフェニル−ジメトキシ−スズ、ジフェニル−ジエトキシ−スズ、ジフェニル−ジプロポキシ−スズ(各異性体)、ジフェニル−ジブトキシ−スズ(各異性体)、ジフェニル−ビスペンチルオキシ−スズ(各異性体)、ジフェニル−ビスヘキシルオキシ−スズ(各異性体)、ジフェニル−ビスヘプチルオキシ−スズ(各異性体)、ジフェニル−ビスオクチルオキシ−スズ(各異性体)、ジフェニル−ビスノニルオキシ−スズ(各異性体)、ジフェニル−ビスデシルオキシ−スズ(各異性体)、ジフェニル−ビスベンジルオキシ−スズ、ジフェニル−ビスフェニルエトキシ−スズ、ジメトキシ−ビス−(トリフルオロ−ブチル)−スズ、ジエトキシ−ビス−(トリフルオロ−ブチル)−スズ、ジプロポキシ−ビス−(トリフルオロ−ブチル)−スズ(各異性体)、ジブトキシ−ビス−(トリフルオロ−ブチル)−スズ(各異性体)、ビスペンチルオキシビス−(トリフルオロブチル)−スズ(各異性体)、ビスヘキシルオキシ−ビス−(トリフルオロブチル)−スズ(各異性体)、ビスヘプチルオキシ−ビス−(トリフルオロブチル)−スズ(各異性体)、ビスオクチルオキシ−ビス−(トリフルオロブチル)−スズ(各異性体)、ビスノニルオキシ−ビス−(トリフルオロブチル)−スズ(各異性体)、ビスデシルオキシ−ビス−(トリフルオロブチル)−スズ(各異性体)、ビスベンジルオキシ−ビス−(トリフルオロブチル)−スズ、ビスフェニルエトキシ−ビス−(トリフルオロブチル)−スズ、ジメトキシ−ビス−(ペンタフルオロブチル)−スズ、ジエトキシ−ビス−(ペンタフルオロブチル)−スズ、ジプロポキシ−ビス−(ペンタフルオロブチル)−スズ(各異性体)、ジブトキシ−ビス−(ペンタフルオロブチル)−スズ(各異性体)、ビスペンチルオキシビス−(ペンタフルオロブチル)−スズ(各異性体)、ビスヘキシルオキシ−ビス−(ペンタフルオロブチル)−スズ(各異性体)、ビスヘプチルオキシ−ビス−(ペンタフルオロブチル)−スズ(各異性体)、ビスオクチルオキシ−ビス−(ペンタフルオロブチル)−スズ(各異性体)、ビスノニルオキシ−ビス−(ペンタフルオロブチル)−スズ(各異性体)、ビスデシルオキシ−ビス−(ペンタフルオロブチル)−スズ(各異性体)、ビスベンジルオキシ−ビス−(ペンタフルオロブチル)−スズ、ビスフェニルエトキシ−ビス−(ペンタフルオロブチル)−スズ、ジメトキシ−ビス−(ヘプタフルオロブチル)−スズ、ジエトキシ−ビス−(ヘプタフルオロブチル)−スズ、ジプロポキシ−ビス−(ヘプタフルオロブチル)−スズ(各異性体)、ジブトキシ−ビス−(ヘプタフルオロブチル)−スズ(各異性体)、ビスペンチルオキシビス−(ヘプタフルオロブチル)−スズ(各異性体)、ビスヘキシルオキシ−ビス−(ヘプタフルオロブチル)−スズ(各異性体)、ビスヘプチルオキシ−ビス−(ヘプタフルオロブチル)−スズ(各異性体)、ビスオクチルオキシ−ビス−(ヘプタフルオロブチル)−スズ(各異性体)、ビスノニルオキシ−ビス−(ヘプタフルオロブチル)−スズ(各異性体)、ビスデシルオキシ−ビス−(ヘプタフルオロブチル)−スズ(各異性体)、ビスベンジルオキシ−ビス−(ヘプタフルオロブチル)−スズ、ビスフェニルエトキシ−ビス−(ヘプタフルオロブチル)−スズ、ジメトキシ−ビス−(ノナフルオロブチル)−スズ、ジエトキシ−ビス−(ノナフルオロブチル)−スズ、ジプロポキシ−ビス−(ノナフルオロブチル)−スズ(各異性体)、ジブトキシ−ビス−(ノナフルオロブチル)−スズ(各異性体)、ビスペンチルオキシビス−(ノナフルオロブチル)−スズ(各異性体)、ビスヘキシルオキシ−ビス−(ノナフルオロブチル)−スズ(各異性体)、ビスヘプチルオキシ−ビス−(ノナフルオロブチル)−スズ(各異性体)、ビスオクチルオキシ−ビス−(ノナフルオロブチル)−スズ(各異性体)、ビスノニルオキシ−ビス−(ノナフルオロブチル)−スズ(各異性体)、ビスデシルオキシ−ビス−(ノナフルオロブチル)−スズ(各異性体)、ビスベンジルオキシ−ビス−(ノナフルオロブチル)−スズ、ビスフェニルエトキシ−ビス−(ノナフルオロブチル)−スズ等のアルキルアルコキシスズなどが挙げられ、好ましい例としては、ジブチル−ジメトキシ−スズ、ジブチル−ジエトキシ−スズ、ジブチル−ジプロポキシ−スズ(各異性体)、ジブチル−ジブトキシ−スズ(各異性体)、ジブチル−ビスペンチルオキシ−スズ(各異性体)、ジブチル−ビスヘキシルオキシ−スズ(各異性体)、ジブチル−ビスヘプチルオキシ−スズ(各異性体)、ジブチル−ビスオクチルオキシ−スズ(各異性体)、ジブチル−ビスノニルオキシ−スズ(各異性体)、ジブチル−ビスデシルオキシ−スズ(各異性体)などが挙げられる。
化学式(8)で示されるジアルキルスズアルコキシドの例としては、1,1,3,3−テトラメチル−1,3−ジメトキシ―ジスタンオキサン、1,1,3,3−テトラメチル−1,3−ジエトキシ―ジスタンオキサン、1,1,3,3−テトラメチル−1,3−ジプロポキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラメチル−1,3−ジブトキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラメチル−1,3−ビスペンチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラメチル−1,3−ビスヘキシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラメチル−1,3−ビスヘプチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラメチル−1,3−ビスオクチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラメチル−1,3−ビスノニルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラメチル−1,3−ビスデシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラメチル−1,3−ビスベンジルオキシ―ジスタンオキサン、1,1,3,3−テトラメチル−1,3−ビスフェニルエトキシ―ジスタンオキサン、1,1,3,3−テトラブチル−1,3−ジメトキシ―ジスタンオキサン、1,1,3,3−テトラブチル−1,3−ジエトキシ―ジスタンオキサン、1,1,3,3−テトラブチル−1,3−ジプロポキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ジブトキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスペンチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスヘキシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスヘプチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスオクチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスノニルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスデシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスベンジルオキシ―ジスタンオキサン、1,1,3,3−テトラブチル−1,3−ビスフェニルエトキシ―ジスタンオキサン、1,1,3,3−テトラフェニル−1,3−ジメトキシ―ジスタンオキサン、1,1,3,3−テトラフェニル−1,3−ジエトキシ―ジスタンオキサン、1,1,3,3−テトラフェニル−1,3−ジプロポキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラフェニル−1,3−ジブトキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラフェニル−1,3−ビスペンチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラフェニル−1,3−ビスヘキシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラフェニル−1,3−ビスヘプチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラフェニル−1,3−ビスオクチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラフェニル−1,3−ビスノニルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラフェニル−1,3−ビスデシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラフェニル−1,3−ビスベンジルオキシ―ジスタンオキサン、1,1,3,3−テトラフェニル−1,3−ビスフェニルエトキシ―ジスタンオキサン、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ジメトキシ―ジスタンオキサン、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ジエトキシ―ジスタンオキサン、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ジプロポキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ジブトキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ビスペンチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ビスヘキシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ビスヘプチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ビスオクチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ビスノニルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ビスデシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ビスベンジルオキシ―ジスタンオキサン、1,1,3,3−テトラキス(トリフルオロブチル)−1,3−ビスフェニルエトキシ―ジスタンオキサン、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ジメトキシ―ジスタンオキサン、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ジエトキシ―ジスタンオキサン、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ジプロポキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ジブトキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ビスペンチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ビスヘキシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ビスヘプチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ビスオクチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ビスノニルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ビスデシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ビスベンジルオキシ―ジスタンオキサン、1,1,3,3−テトラキス(ペンタフルオロブチル)−1,3−ビスフェニルエトキシ―ジスタンオキサン、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ジメトキシ―ジスタンオキサン、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ジエトキシ―ジスタンオキサン、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ジプロポキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ジブトキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ビスペンチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ビスヘキシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ビスヘプチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ビスオクチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ビスノニルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ビスデシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ビスベンジルオキシ―ジスタンオキサン、1,1,3,3−テトラキス(ヘプタフルオロブチル)−1,3−ビスフェニルエトキシ―ジスタンオキサン、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ジメトキシ―ジスタンオキサン、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ジエトキシ―ジスタンオキサン、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ジプロポキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ジブトキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ビスペンチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ビスヘキシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ビスヘプチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ビスオクチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ビスノニルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ビスデシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ビスベンジルオキシ―ジスタンオキサン、1,1,3,3−テトラキス(ノナフルオロブチル)−1,3−ビスフェニルエトキシ―ジスタンオキサンのようなアルコキシジスタンオキサン、アラルキルオキシジスタンオキサンなどが挙げられ、好ましい例としては、1,1,3,3−テトラブチル−1,3−ジメトキシ―ジスタンオキサン、1,1,3,3−テトラブチル−1,3−ジエトキシ―ジスタンオキサン、1,1,3,3−テトラブチル−1,3−ジプロポキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ジブトキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスペンチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスヘキシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスヘプチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスオクチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスノニルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスデシルオキシ―ジスタンオキサン(各異性体)が挙げられる。
また、トリアルキルスズ化合物の例としては、トリメチル−メトキシ−スズ、トリメチル−エトキシ−スズ、トリメチル−プロポキシ−スズ(各異性体)、トリメチル−ブトキシ−スズ(各異性体)、トリメチル−ペンチルオキシ−スズ(各異性体)、トリメチル−ヘキシルオキシ−スズ(各異性体)、トリメチル−ヘプチルオキシ−スズ(各異性体)、トリメチル−オクチルオキシ−スズ(各異性体)、トリメチル−ノニルオキシ−スズ(各異性体)、トリメチル−デシルオキシ−スズ(各異性体)、トリメチル−ベンジルオキシ−スズ、トリメチル−フェニルエトキシ−スズ、トリブチル−メトキシ−スズ、トリブチル−エトキシ−スズ、トリブチル−プロポキシ−スズ(各異性体)、トリブチル−ブトキシ−スズ(各異性体)、トリブチル−ペンチルオキシ−スズ(各異性体)、トリブチル−ヘキシルオキシ−スズ(各異性体)、トリブチル−ヘプチルオキシ−スズ(各異性体)、トリブチル−オクチルオキシ−スズ(各異性体)、トリブチル−ノニルオキシ−スズ(各異性体)、トリブチル−デシルオキシ−スズ(各異性体)、トリブチル−ベンジルオキシ−スズ、トリブチル−フェニルエトキシ−スズ、トリフェニル−メトキシ−スズ、トリフェニル−エトキシ−スズ、トリフェニル−プロポキシ−スズ(各異性体)、トリフェニル−ブトキシ−スズ(各異性体)、トリフェニル−ペンチルオキシ−スズ(各異性体)、トリフェニル−ヘキシルオキシ−スズ(各異性体)、トリフェニル−ヘプチルオキシ−スズ(各異性体)、トリフェニル−オクチルオキシ−スズ(各異性体)、トリフェニル−ノニルオキシ−スズ(各異性体)、トリフェニル−デシルオキシ−スズ(各異性体)、トリフェニル−ベンジルオキシ−スズ、トリフェニル−フェニルエトキシ−スズ、メトキシ−トリス−(トリフルオロブチル)−スズ、エトキシ−トリス−(トリフルオロブチル)−スズ、プロポキシ−トリス−(トリフルオロブチル)−スズ(各異性体)、ブトキシ−トリス−(トリフルオロブチル)−スズ(各異性体)、ペンチルオキシ−トリス−(トリフルオロブチル)−スズ(各異性体)、ヘキシルオキシ−トリス−(トリフルオロブチル)−スズ(各異性体)、ヘプチルオキシ−トリス−(トリフルオロブチル)−スズ(各異性体)、オクチルオキシ−トリス−(トリフルオロブチル)−スズ(各異性体)、ノニルオキシ−トリス−(トリフルオロブチル)−スズ(各異性体)、デシルオキシ−トリス−(トリフルオロブチル)−スズ(各異性体)、ベンジルオキシ−トリス−(トリフルオロブチル)−スズ、フェニルエトキシ−トリス−(トリフルオロブチル)−スズ、メトキシ−トリス−(ペンタフルオロブチル)−スズ、エトキシ−トリス−(ペンタフルオロブチル)−スズ、プロポキシ−トリス−(ペンタフルオロブチル)−スズ(各異性体)、ブトキシ−トリス−(ペンタフルオロブチル)−スズ(各異性体)、ペンチルオキシ−トリス−(ペンタフルオロブチル)−スズ(各異性体)、ヘキシルオキシ−トリス−(ペンタフルオロブチル)−スズ(各異性体)、ヘプチルオキシ−トリス−(ペンタフルオロブチル)−スズ(各異性体)、オクチルオキシ−トリス−(ペンタフルオロブチル)−スズ(各異性体)、ノニルオキシ−トリス−(ペンタフルオロブチル)−スズ(各異性体)、デシルオキシ−トリス−(ペンタフルオロブチル)−スズ(各異性体)、ベンジルオキシ−トリス−(ペンタフルオロブチル)−スズ、フェニルエトキシ−トリス−(ペンタフルオロブチル)−スズ、メトキシ−トリス−(ヘプタフルオロブチル)−スズ、エトキシ−トリス−(ヘプタフルオロブチル)−スズ、プロポキシ−トリス−(ヘプタフルオロブチル)−スズ(各異性体)、ブトキシ−トリス−(ヘプタフルオロブチル)−スズ(各異性体)、ペンチルオキシ−トリス−(ヘプタフルオロブチル)−スズ(各異性体)、ヘキシルオキシ−トリス−(ヘプタフルオロブチル)−スズ(各異性体)、ヘプチルオキシ−トリス−(ヘプタフルオロブチル)−スズ(各異性体)、オクチルオキシ−トリス−(ヘプタフルオロブチル)−スズ(各異性体)、ノニルオキシ−トリス−(ヘプタフルオロブチル)−スズ(各異性体)、デシルオキシ−トリス−(ヘプタフルオロブチル)−スズ(各異性体)、ベンジルオキシ−トリス−(ヘプタフルオロブチル)−スズ、フェニルエトキシ−トリス−(ヘプタフルオロブチル)−スズ、メトキシ−トリス−(ナノフルオロブチル)−スズ、エトキシ−トリス−(ナノフルオロブチル)−スズ、プロポキシ−トリス−(ナノフルオロブチル)−スズ(各異性体)、ブトキシ−トリス−(ナノフルオロブチル)−スズ(各異性体)、ペンチルオキシ−トリス−(ナノフルオロブチル)−スズ(各異性体)、ヘキシルオキシ−トリス−(ナノフルオロブチル)−スズ(各異性体)、ヘプチルオキシ−トリス−(ナノフルオロブチル)−スズ(各異性体)、オクチルオキシ−トリス−(ナノフルオロブチル)−スズ(各異性体)、ノニルオキシ−トリス−(ナノフルオロブチル)−スズ(各異性体)、デシルオキシ−トリス−(ナノフルオロブチル)−スズ(各異性体)、ベンジルオキシ−トリス−(ナノフルオロブチル)−スズ、フェニルエトキシ−トリス−(ナノフルオロブチル)−スズ等のトリアルキルスズアルコキシドなどが挙げられる。
塩素含有化合物については、特定はできないが、例えば、ジメチル−ジクロロ−スズ、ブチル−メチル−ジクロロ−スズ(各異性体)、ブチル−エチル−ジクロロ−スズ(各異性体)、ブチル−プロピル−ジクロロ−スズ(各異性体)、ジブチル−ジクロロ−スズ(各異性体)、ジフェニル−ジクロロ−スズ、ビス−(トリフルオロブチル)−ジクロロ−スズ(各異性体)、ビス−(ペンタフルオロブチル)−ジクロロ−スズ(各異性体)、ビス−(ヘプタフルオロブチル)−ジクロロ−スズ(各異性体)、ビス−(ナノフルオロブチル)−ジクロロ−スズ(各異性体)、トリメチル−クロロ−スズ、ジブチル−メチル−クロロ−スズ(各異性体)、ブチル−ジメチル−クロロ−スズ(各異性体)、ジブチル−エチル−クロロ−スズ(各異性体)、ブチル−ジエチル−クロロ−スズ(各異性体)、ジブチル−プロピル−クロロ−スズ(各異性体)、ブチル−ジプロピル−クロロ−スズ(各異性体)、トリブチル−クロロ−スズ(各異性体)、トリフェニル−クロロ−スズ、トリス−(トリフルオロブチル)−クロロ−スズ(各異性体)、トリス−(ペンタフルオロブチル)−クロロ−スズ(各異性体)、トリス−(ヘプタフルオロブチル)−クロロ−スズ(各異性体)、トリス−(ナノフルオロブチル)−クロロ−スズ(各異性体)、メチル−トリクロロ−スズ、エチル−トリクロロ−スズ、プロピル−トリクロロ−スズ(各異性体)、ブチル−トリクロロ−スズ(各異性体)、フェニル−トリクロロ−スズ、トリフルオロブチル−トリクロロ−スズ(各異性体)、ペンタフルオロ−トリクロロ−スズ(各異性体)、ヘプタフルオロ−トリクロロ−スズ(各異性体)、ナノフルオロ−トリクロロ−スズ(各異性体)、塩化リチウム、塩化ナトリウム、塩化カリウム、塩化セシウム、塩化マグネシウム、塩化カルシウム、塩化バリウムなどの塩素含有化合物が挙げられる。
化学式(7)と(8)で表すジアルキルスズアルコキシド及びトリアルキルスズ化合物は119Sn−NMRによって分析し、いくつかの測定例を下記の表に示す。119Sn−NMRによる分析ではこれらスズ化合物のシフト値は濃度や溶媒などの影響を受けやすいため13C及び1H−NMRの併用が好ましい。
化学式(7)で表すジアルキルスズジアルコキシドは119Sn−NMRシフト値が濃度によって変化し、高濃度であるほど高磁場側に推移する。その測定例として下記の表1にジブチルスズ−ビス(2−エチルヘキシルオキシ)−スズの分析結果を示す。
化学式(7)で表すジアルキルスズジアルコキシドは119Sn−NMRシフト値が濃度によって変化し、高濃度であるほど高磁場側に推移する。その測定例として下記の表1にジブチルスズ−ビス(2−エチルヘキシルオキシ)−スズの分析結果を示す。
一方、化学式(8)で表すジアルキルスズアルコキシド及びトリアルキルスズ化合物については119Sn−NMRシフト値が濃度や溶媒などによる影響を受けにくい。その測定例としていくつかの1,1,3,3−テトラブチル−1,3ビス(アルコキシ)−ジスタンオキサン及びトリブチル−(アルコキシ)−スズの分析結果を表2に示す。
本発明のジアルキルスズアルコキシド含有組成物中のジアルキルスズアルコキシドは、公知の方法であるジアルキルスズオキシドとアルコールとからの脱水反応で好適に製造される。使用原料について以下に記述する。
本発明のジアルキルスズアルコキシド含有組成物中のジアルキルスズアルコキシドは、出発物質として、下記式(1)に示すジアルキルスズオキシド及び/または下記式(2)に示すジアルキルスズアルコキシドが使用できる。
本発明のジアルキルスズアルコキシド含有組成物中のジアルキルスズアルコキシドは、出発物質として、下記式(1)に示すジアルキルスズオキシド及び/または下記式(2)に示すジアルキルスズアルコキシドが使用できる。
(式中:
R1は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表す。)
R1は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表す。)
(式中:
R1は、上記した化学式(1)のR1と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R2は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
R1は、上記した化学式(1)のR1と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R2は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
上記式(1)で示されるジアルキルスズオキシドの例としては、ジメチルスズオキシド、ジエチルスズオキシド、ジプロピルスズオキシド(各異性体)、ジブチルスズオキシド(各異性体)、ジペンチルスズオキシド(各異性体)、ジヘキシルスズオキシド(各異性体)、ジヘプチルスズオキシド(各異性体)、ジオクチルスズオキシド(各異性体)、ブチルメチルスズオキシド(各異性体)、ブチルエチルスズオキシド(各異性体)、ブチルプロピルスズオキシド(各異性体)、ジビニルスズオキシド、ジアリルスズオキシド、ジシクロヘキシルスズオキシド、ジシクロオクチルスズオキシド、ビス(トリフルオロブチル)スズオキシド、ビス(ペンタフルオロブチル)スズオキシド、ビス(ヘプタフルオロブチル)スズオキシド、ビス(ナノフルオロブチル)スズオキシド、ジフェニルスズオキシド、ジベンジルスズオキシド、ジフェネチルスズオキシド、ジトリルスズオキシドなどが挙げられ、好ましい例として、ジメチルスズオキシド、ジエチルスズオキシド、ジプロピルスズオキシド(各異性体)、ジブチルスズオキシド(各異性体)、ジペンチルスズオキシド(各異性体)、ジヘキシルスズオキシド(各異性体)、ジヘプチルスズオキシド(各異性体)、ジオクチルスズオキシド(各異性体)などが挙げられる。炭素数の制限はないが、融点や流動性などの理由から上記範囲が好ましい。上記式(1)は単量体構造のジアルキルスズオキシドを示しているが、多量体構造であってもかまわない。
上記したジアルキルスズオキシドは、公知の方法で製造されたものでよいが、ジアルキルスズオキシドに塩素含有化合物やトリアルキルスズ化合物を多く含有するジアルキルスズオキシドを出発物質として使用した場合には、生成するジアルキルスズアルコキシド中に残存する恐れがあるので予め除去して使用する。塩素化合物含有量が2000ppm以下、好ましくは1000ppm以下、トリアルキルスズ化合物含有量が全スズ含有量の1mol%以下、好ましくは0.8mol%以下のジアルキルスズオキシドが使用できる。
これらジアルキルスズオキシド中に含まれる塩素化合物やトリアルキルスズ化合物の除去は公知のいかなる方法(例えば文献EP346506に記載の方法)によって除去してよい。例えば、有機溶媒洗浄や酸洗浄、アルカリ洗浄、蒸留などの方法が使用できる。
これらジアルキルスズオキシド中に含まれる塩素化合物やトリアルキルスズ化合物の除去は公知のいかなる方法(例えば文献EP346506に記載の方法)によって除去してよい。例えば、有機溶媒洗浄や酸洗浄、アルカリ洗浄、蒸留などの方法が使用できる。
化学式(2)で示されるジアルキルスズアルコキシドの例としては前記したような化学式(8)で示されるジアルキルスズアルコキシドと同じ例が挙げられる。好ましい例としては、1,1,3,3−テトラブチル−1,3−ジメトキシ―ジスタンオキサン、1,1,3,3−テトラブチル−1,3−ジエトキシ―ジスタンオキサン、1,1,3,3−テトラブチル−1,3−ジプロポキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ジブトキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスペンチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスヘキシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスヘプチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスオクチルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスノニルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスデシルオキシ―ジスタンオキサン(各異性体)、1,1,3,3−テトラブチル−1,3−ビスベンジルオキシ―ジスタンオキサン、1,1,3,3−テトラブチル−1,3−ビスフェニルエトキシ―ジスタンオキサンが挙げられ、特に好ましくは、該ジアルキルスズアルコキシドの製造の容易さから、該ジアルキルスズアルコキシドのアルコキシ基に相当するアルコールが常圧で水より沸点の高い1級のアルコールであるアルコキシ基をもつジアルキルスズアルコキシドであって、例えばR2がn−ブチル、iso−ブチル、または炭素数が5以上の直鎖状、分岐状のアルキル基で、R1が炭素数が4から8の直鎖状、分岐状の飽和アルキル基であるジアルキルスズアルコキシドである。
本発明のジアルキルスズアルコキシド含有組成物中のジアルキルスズアルコキシドは、反応物質として、下記式(3)で表されるアルコールが使用できる。
(式中:
R2は、上記した化学式(2)のR2と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
R2は、上記した化学式(2)のR2と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
上記式(3)で表すアルコールの例としては、メタノール、エタノール、プロパノール(各異性体)、ブタノール(各異性体)、ペンタノール(各異性体)、ヘキサノール(各異性体)、ヘプタノール(各異性体)、オクタノール(各異性体)、ノナノール(各異性体)、デカノール(各異性体)、シクロヘキサノール、シクロヘプタノール、シクロオクタノール、フェニルメタノール、2−フェニル−エタノールなどが挙げられ、好ましい例として、メタノール、エタノール、プロパノール(各異性体)、ブタノール(各異性体)、ペンタノール(各異性体)、ヘキサノール(各異性体)、ヘプタノール(各異性体)、オクタノール(各異性体)などが挙げられる。これらアルコールのうち、脱水反応の容易さから、好ましい例としては、常圧で水より沸点の高い1級のアルコールであって、例えばR2がn−ブチル、iso−ブチル、または炭素数が5以上の直鎖状、鎖状のアルキル基であるアルコールである。
上記した出発物質と反応物質とを脱水反応し、出発物質と反応物質に対応するジアルキルスズアルコキシドが製造できる。即ち、前述した化学式(7)及び/または化学式(8)で表すジアルキルスズアルコキシドであって、R3は、該出発物質に対応し、出発物質のR1と同じであり、R4は、該出発物質及び/または該反応物質に対応し、出発物質該出発物質及び/または該反応物質のR2と同じであるジアルキルスズアルコキシドが製造できる。このような化合物の例は、前述した化学式(7)及び化学式(8)と同じである。
次に、本発明のジアルキルスズアルコキシドまたは、本発明のジアルキルスズアルコキシド組成物中のジアルキルスズアルコキシドの製造条件について述べる。
本発明者らは、ジアルキルスズアルコキシドの生成は、前記したように、ジアルキルスズオキシドとアルコールとの脱水反応であり、ジアルキルスズアルコキシドの生成は下式(15)及び下式(16)の平衡反応と推定した。
本発明者らは、ジアルキルスズアルコキシドの生成は、前記したように、ジアルキルスズオキシドとアルコールとの脱水反応であり、ジアルキルスズアルコキシドの生成は下式(15)及び下式(16)の平衡反応と推定した。
ジアルキルスズオキシドに対するアルコールのモル比は、アルコールの種類によって異なるが、通常1〜10000倍、より好ましくは3〜100倍である。脱水反応は平衡反応であるため、ジアルキルスズオキシドのモル数に対して過剰のアルコールを使用した場合が一般に反応を早く進行させることができるが、大過剰のアルコールを使用した場合には、反応後のアルコールの留去に多大なエネルギーを必要とするので、上記範囲が好ましい。該反応温度は、原料アルコールの種類や溶媒との組成比によって異なるが、通常60〜200℃である。高温ではトリアルキルスズ化合物が生成しやすいし、低温では反応が非常に遅いため、より好ましくは100〜160℃である。反応圧力についても原料アルコールの種類などによって異なり、減圧から加圧条件で行うことが可能であるが、好ましくは200Pa〜1MPaという圧力範囲で行う。効率よく反応系から水を除去するために、さらに好ましくは10kPa〜0.5MPaの範囲である。
上記したように、反応は平衡反応と推定され、平衡を生成物側にずらしてジアルキルスズアルコキシドを得る。即ち、反応液の中から水を除去してジアルキルスズアルコキシドを得る。脱水方法は公知の脱水方法が使用できる。例えば、蒸留、膜分離、脱水剤などの方法が挙げられる。蒸留は減圧蒸留、加圧蒸留、薄膜蒸留、共沸蒸留などの方法が使用でき、膜分離はパーベーパレーションなどの方法が使用でき、脱水剤はモレキュラーシーブなどの公知の脱水剤が使用できる。
化学式(7)で表すジアルキルスズアルコキシドは、前記した平衡反応式(15)と(16)に従って、ジアルキルスズオキシドを出発物質としなくても、化学式(2)で表すジアルキルスズアルコキシドを出発物質とし、反応物質である化学式(3)で表すアルコールとから製造することもできる。反応条件は上記したジアルキルスズオキシドを出発物質とした場合と同じである。
溶媒は必ずしも使用する必要はないが、流動性を向上させて反応操作を容易にしたり、あるいは生成する水を速やかに系外へ出す目的で水と共沸する不活性溶媒を添加することができる。使用できる溶媒は、ジアルキルスズオキシドや得られるジアルキルスズアルコキシドと反応しないものであれば、どのような溶媒であってもよい。このような溶媒の例としては例えば、ヘキサン(各異性体)、ヘプタン(各異性体)、オクタン(各異性体)などの直鎖状、鎖状、環状の脂肪族炭化水素類、ベンゼン、トルエン、キシレンなどの芳香族炭化水素類、エーテル類を反応溶媒として用いることができる。これら溶媒は水分をなるべく含有しないように予め脱水しておくことが好ましい。
反応時間は、ジアルキルスズオキシドやアルコールの種類、反応温度によって異なるが、5分から100時間の範囲でおこなう。理論量の50%以上好ましくは60%以上の水を除去して反応を終了して構わない。高温で長時間反応させると、ジアルキルスズアルコキシドの熱分解によってトリアルキルスズ化合物が多量に生成するので、なるべく低温で速やかに反応させることが好ましい。
出発物質として、化学式(1)で表すジアルキルスズオキシド及び/または化学式(2)で表すジアルキルスズアルコキシドと反応物質である化学式(3)で表すアルコールからジアルキルスズアルコキシドを製造する場合、下記式(4)によって定められる脱水速度を満足する条件で脱水反応を行えば化学式(7)及び/または化学式(8)で表すジアルキルスズアルコキシドを得ることができる。化学式(1)で表すジアルキルスズオキシドと化学式(3)で表すアルコールの混合液を用いても良いが、溶解性や混合液の輸送等の観点から化学式(2)で表すジアルキルスズアルコキシドと化学式(3)で表すアルコールを用いることが好ましい。
(式中、
脱水速度:脱水反応で形成される水のうち、単位時間当りに系外に抜き出す水量[mol・hr-1]、X:出発物質に含まれる化学式(1)で表すジアルキルスズオキシド中のスズ原子モル数[mol]、Y:出発物質に含まれる化学式(2)で表すジアルキルスズアルコキシド中のスズ原子モル数[mol]、T:脱水反応温度[K]、R:気体定数=8.314J・mol-1・K-1を表し、A及びBは化学式(2)で表すジアルキルスズアルコキシドの種類に依存する係数である。)
脱水速度:脱水反応で形成される水のうち、単位時間当りに系外に抜き出す水量[mol・hr-1]、X:出発物質に含まれる化学式(1)で表すジアルキルスズオキシド中のスズ原子モル数[mol]、Y:出発物質に含まれる化学式(2)で表すジアルキルスズアルコキシド中のスズ原子モル数[mol]、T:脱水反応温度[K]、R:気体定数=8.314J・mol-1・K-1を表し、A及びBは化学式(2)で表すジアルキルスズアルコキシドの種類に依存する係数である。)
出発物質に化学式(2)で表すジアルキルスズアルコキシドが含まれる場合は、上記A及びBはそれぞれ化学式(2)で表すジアルキルスズアルコキシドの熱分解反応の頻度因子及び活性化エネルギーを表すものであって、下記式(5)で得られるA及びBであり、そして出発物質に化学式(2)で表すジアルキルスズアルコキシドが含まれない場合は、A及びBはそれぞれ出発物質に含まれる化学式(1)と反応物質とから形成される化学式(2)に相当するジアルキルスズアルコキシドの熱分解反応の頻度因子及び活性化エネルギーを表すものであって、下記式(5)で得られるA及びBである。
上記kは該熱分解反応の1次反応速度定数を表し、下記式(6)で得られるkである。
上記式(4)で定めた脱水速度条件を満足する脱水速度で製造すれば、トリアルキルスズ化合物の少ないジアルキルスズアルコキシドを得ることができるが、化学式(7)で表すジアルキルスズアルコキシドをより多く得るために下記式(9)に示す脱水速度以上で製造することがより好ましい。
(式中、
脱水速度:脱水反応で形成される水のうち、単位時間当りに系外に抜き出す水量[mol・hr-1]、X:出発物質に含まれる化学式(1)で表すジアルキルスズオキシド中のスズ原子モル数[mol]、Y:出発物質に含まれる化学式(2)で表すジアルキルスズアルコキシド中のスズ原子モル数[mol]、T:脱水反応温度[K]、R:気体定数=8.314J・mol-1・K-1を表し、A及びBは化学式(2)で表すジアルキルスズアルコキシドの種類に依存する係数である。)
脱水速度:脱水反応で形成される水のうち、単位時間当りに系外に抜き出す水量[mol・hr-1]、X:出発物質に含まれる化学式(1)で表すジアルキルスズオキシド中のスズ原子モル数[mol]、Y:出発物質に含まれる化学式(2)で表すジアルキルスズアルコキシド中のスズ原子モル数[mol]、T:脱水反応温度[K]、R:気体定数=8.314J・mol-1・K-1を表し、A及びBは化学式(2)で表すジアルキルスズアルコキシドの種類に依存する係数である。)
上記した熱分解反応とは、化学式(2)で表すジアルキルスズアルコキシドが含まれる場合は、化学式(2)で表すジアルキルスズアルコキシドの熱分解反応であり、化学式(2)で表すジアルキルスズアルコキシドが含まれない場合は、A及びBはそれぞれ出発物質に含まれる化学式(1)と反応物質とから形成される化学式(2)に相当するジアルキルスズアルコキシドの熱分解反応であって、下記式(10)で示す反応である。
(式中:
R1は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R2は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
R1は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R2は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
加熱温度は100℃から200℃までの任意の温度(例えば120℃、140℃、160℃など)であり、化学式(2)で表される化合物の含有量が95%以上であって、化学式(2)の分解を促進するような化合物(例えば酸素や水分など)の影響を受けないような条件下で、加熱して実施する熱分解反応であって、上記式(10)に従って加熱による化学式(2)に相当する化合物の減少量を119Sn−NMRで経時的に測定して、その定量値の減少を熱分解反応と定義する反応を指している。熱分解物はどのようなものか定義はできないが、トリブチルスズアルコキシドを含有した熱分解物である。
メタノールやエタノールなどの、水より沸点の低いアルコールについては、アルコール沸点より低い共沸組成を構成する共沸剤を用いれば上記方法で本発明のジアルキルスズアルコキシドを製造することができるし、モレキュラーシーブなどの脱水剤を用いても同様に製造することができる。
上記脱水反応によるジアルキルスズアルコキシドの製造はいかなる反応器、例えば、バッチ型反応器、セミバッチ型反応器、完全混合槽型反応器及び流通型反応器、またはこれらの反応器を連結させた複合型反応器を用いてもよい。
反応終了後には、過剰のアルコールや溶媒等を除去してもよいし、そのまま使用してもよい。
上記脱水反応によるジアルキルスズアルコキシドの製造はいかなる反応器、例えば、バッチ型反応器、セミバッチ型反応器、完全混合槽型反応器及び流通型反応器、またはこれらの反応器を連結させた複合型反応器を用いてもよい。
反応終了後には、過剰のアルコールや溶媒等を除去してもよいし、そのまま使用してもよい。
さらに、出発物質として、塩素化合物含有量が1000ppm以下であって、トリアルキルスズ化合物を含有したジアルキルスズアルコキシドからも、本発明のジアルキルスズアルコキシドを得ることができる。本発明者らが鋭意検討した結果、ジアルキルスズアルコキシドの熱分解で生成するトリアルキルスズ化合物は、化学式(7)及び化学式(8)で表されるジアルキルスズアルコキシドよりも沸点が低く、蒸留によって分離できることが明らかになった。蒸留は減圧蒸留、加圧蒸留、薄膜蒸留などの方法が使用でき、トリアルキルスズ化合物の含有量がジアルキルスズアルコキシドのスズ原子モル数に対して1mol%以下となるように蒸留除去する。
本発明のジアルキルスズアルコキシドの使用は、化学式(7)及び化学式(8)で表すジアルキルスズアルコキシドの少なくとも1つを、例えば、エステル交換反応や炭酸エステルのなどのジアルキルスズアルコキシドを用いる公知の反応に使用することができる。本発明のジアルキルスズアルコキシドを使用すれば、トリアルキルスズ化合物や塩素含有化合物の少ないエステルや炭酸エステルを得ることができる。
本発明のジアルキルスズアルコキシドは従来技術で得られるジアルキルスズアルコキシドと異なり、トリアルキルスズ化合物や塩素含有化合物の含有量が極めて少ないが、上記した反応に適用した場合、反応中に熱分解してトリアルキルスズ化合物が生成する場合があるので、生成物中の該トリアルキルスズ化合物の含有量を分析して、反応温度、時間を選択することが好ましい。
本発明のジアルキルスズアルコキシドは高純度、低コストであって、エステル交換反応や炭酸エステル合成反応、アルキルフェニルカーボネート、ジアリールカーボネートなどの芳香族炭酸エステル、ポリカーボネート、ウレタンなどの有機化合物製造触媒としても好適に用いられるし、本発明のジアルキルスズアルコキシドを用いて製造した炭酸エステルから、アルキルフェニルカーボネート、ジアリールカーボネートなどの芳香族炭酸エステル、ポリカーボネートや、該芳香族炭酸エステルからポリカーボネート、ヘキサメチレンージーイソシアネートやトルイジンージーイソシアネート、メシチレンージーイソシアネートなどの有機イソシアネート類を好適に得ることができる。
以下、本発明を実施例に基づき具体的に説明するが、本発明はこれら実施例に限定されるものではない。
<分析方法>
1)NMR分析方法
装置:日本電子(株)社製JNM−A400 FT−NMRシステム
(1)1H−NMR、13C−NMR、119Sn−NMR分析サンプルの調製
スズ化合物を0.3g〜1gの範囲で秤量し、重クロロホルム(アルドリッチ社製、99.8%)を0.05g〜0.7gの範囲で秤量し、更に119Sn−NMR内部標準としてテトラメチルスズ(和光社製、和光一級)を約0.05g加えて均一に混ぜた溶液をNMR分析サンプルとする。
<分析方法>
1)NMR分析方法
装置:日本電子(株)社製JNM−A400 FT−NMRシステム
(1)1H−NMR、13C−NMR、119Sn−NMR分析サンプルの調製
スズ化合物を0.3g〜1gの範囲で秤量し、重クロロホルム(アルドリッチ社製、99.8%)を0.05g〜0.7gの範囲で秤量し、更に119Sn−NMR内部標準としてテトラメチルスズ(和光社製、和光一級)を約0.05g加えて均一に混ぜた溶液をNMR分析サンプルとする。
2)水の分析方法
装置:三菱化学(株)社製CA−05微量水分計
(1)定量分析法
分析サンプルをシリンジを用いて約0.12ml採取し重量を測った後、そのまま水分計に注入し、水の定量を行う。その後再びシリンジの重量を測り、サンプル注入量を割り出し、サンプル中の水含有量を求める。
装置:三菱化学(株)社製CA−05微量水分計
(1)定量分析法
分析サンプルをシリンジを用いて約0.12ml採取し重量を測った後、そのまま水分計に注入し、水の定量を行う。その後再びシリンジの重量を測り、サンプル注入量を割り出し、サンプル中の水含有量を求める。
3)炭酸エステル合成及びエステル交換反応における反応液のガスクロマトグラフィー分析法
装置:(株)島津製作所製GC−2010システム
(1)分析サンプルの調製
反応溶液約0.1g秤量し、内部標準としてジフェニルエーテル(東京化成社製、>99.0%)約0.03gを加えて、アセトン(和光社製、有機合成用)を約1.3g加える。混合液をろ過した溶液をガスクロマトグラフィー分析サンプルとする。
(2)ガスクロマトグラフィー分析条件
検出法:水素フレームイオン化検出器
カラム:液相として100%ジメチルポリシロキサンを有するキャピラリーカ ラム(DB−1カラム、J&W Scientific社製)
カラム昇温プログラム:50℃を5分保持し、10℃/minの速度で200 ℃まで昇温したのち5分保持し、さらに同じ速度で3 00℃まで昇温する。
気化室温度:300℃
検出器温度:300℃
(3)定量分析法
各標準物質を用いて標準サンプルを調製し、ガスクロマトグラフィー分析を行い、内部標準であるジフェニルエーテルを基準として作成した検量線に基づいて、分析サンプルの定量を行う。
装置:(株)島津製作所製GC−2010システム
(1)分析サンプルの調製
反応溶液約0.1g秤量し、内部標準としてジフェニルエーテル(東京化成社製、>99.0%)約0.03gを加えて、アセトン(和光社製、有機合成用)を約1.3g加える。混合液をろ過した溶液をガスクロマトグラフィー分析サンプルとする。
(2)ガスクロマトグラフィー分析条件
検出法:水素フレームイオン化検出器
カラム:液相として100%ジメチルポリシロキサンを有するキャピラリーカ ラム(DB−1カラム、J&W Scientific社製)
カラム昇温プログラム:50℃を5分保持し、10℃/minの速度で200 ℃まで昇温したのち5分保持し、さらに同じ速度で3 00℃まで昇温する。
気化室温度:300℃
検出器温度:300℃
(3)定量分析法
各標準物質を用いて標準サンプルを調製し、ガスクロマトグラフィー分析を行い、内部標準であるジフェニルエーテルを基準として作成した検量線に基づいて、分析サンプルの定量を行う。
4)ジアルキルスズオキシド、ジアルキルスズアルコキシド、炭酸エステル合成及びエステル交換反応における生成物の塩素の分析
(1)酸素燃焼による前処理
装置: 三菱化学製 TOX−100
燃焼温度:800℃
分析対象を0.1g採取し、上記の装置による酸素燃焼を行う。
(2)イオンクロマトグラフ法による定量分析
装置: 日本ダイオネクス製 DX−300
検出法: 電気伝導度検出器
カラム: AG−4A+AS−4A
除去液: 12.5mmol/L H2SO4
溶離液: 10mmol/L Na2B4O7
前処理から得た残渣物を水溶液に調製したのち、塩素の標準サンプルを用いて作成した検量線に基づいて、分析サンプル中の塩素の定量を行う。
(1)酸素燃焼による前処理
装置: 三菱化学製 TOX−100
燃焼温度:800℃
分析対象を0.1g採取し、上記の装置による酸素燃焼を行う。
(2)イオンクロマトグラフ法による定量分析
装置: 日本ダイオネクス製 DX−300
検出法: 電気伝導度検出器
カラム: AG−4A+AS−4A
除去液: 12.5mmol/L H2SO4
溶離液: 10mmol/L Na2B4O7
前処理から得た残渣物を水溶液に調製したのち、塩素の標準サンプルを用いて作成した検量線に基づいて、分析サンプル中の塩素の定量を行う。
[1,1,3,3−テトラブチル−1,3ビス(2−エチルヘキシルオキシ)−ジスタンオキサンの熱分解反応の頻度因子(A)および活性化エネルギー(B)を求める方法]
温度計、三方コック、ジムロート冷却器と連結した水分定量受器を備えた容積2Lの三口フラスコにジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)199.8g(0.80mol)、2−エチル−1−ヘキサノール(アルドリッチ社製、脱水99.6%)1045g(8.0mol)及びトルエン(和光社製、有機合成用)500gを入れた。白色スラリー状の混合物を入れた該フラスコを130℃に設定したオイルバス(Fine社製、FWB−240)に浸漬した。約30分間攪拌及び加熱した後、混合物の温度が119℃になり水分定量受器に水とトルエンの回収が始まった。この状態を約3時間保った後、水分定量受器に約7.2mLの水を回収した。
温度計、三方コック、ジムロート冷却器と連結した水分定量受器を備えた容積2Lの三口フラスコにジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)199.8g(0.80mol)、2−エチル−1−ヘキサノール(アルドリッチ社製、脱水99.6%)1045g(8.0mol)及びトルエン(和光社製、有機合成用)500gを入れた。白色スラリー状の混合物を入れた該フラスコを130℃に設定したオイルバス(Fine社製、FWB−240)に浸漬した。約30分間攪拌及び加熱した後、混合物の温度が119℃になり水分定量受器に水とトルエンの回収が始まった。この状態を約3時間保った後、水分定量受器に約7.2mLの水を回収した。
その後、オイルバスの温度を90℃に下げ、混合物温度を下げた後、水分定量受器をはずし、該フラスコを枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器と連結した。系内を29kPaに減圧し該フラスコからトルエンを蒸留した後、さらに系内を0.6kPaに減圧し過剰な2−エチル−ヘキサノールを蒸留した。蒸留によって回収した液は1420gであって、該フラスコには295.6gの生成物を得た。
119Sn,1H,13C−NMRの分析結果から生成物は純度95%以上の1,1,3,3−テトラブチル−1,3ビス(2−エチルヘキシルオキシ)−ジスタンオキサンであった。次いで、三方コックと連結したリービッヒ冷却器、シリコン製キャップ及び温度計を備えた容積50mLの三口フラスコに窒素ガス0.3L/分を流しながら、該1,1,3,3−テトラブチル−1,3ビス(2−エチルヘキシルオキシ)−ジスタンオキサンをガスタイト型シリンジ(Hamilton社製、1050TLL)によって20g入れた。該フラスコを168℃に加熱したオイルバスに浸漬した。
攪拌及び加熱を約8分間行った後、該ジスタンオキサン温度が164℃となってこの状態を熱分解反応の開始時間とし攪拌及び加熱を続けた。反応時間が1.5、3、6時間になったところでフラスコ内の液体を採取し、119Sn−NMR分析によって該ジスタンオキサンの定量分析を行いそれぞれの反応時間における該ジスタンオキサンの減少率を求めた。減少率と反応時間から1次反応速度定数を求め、その値は0.040hr-1であった。該ジスタンオキサンについて同様な熱分解反応を145℃及び180℃において行った結果、それぞれの1次反応速度定数は0.0093と0.15hr-1であった。熱分解反応から求めた1次反応速度定数と反応温度との関係から求めた頻度因子(A)及び活性化エネルギー(B)はそれぞれ1.4×1013及び12kJであった。
実施例1
ジブチル−ビス(2−エチルブチルオキシ)−スズ
容積1Lのなすフラスコに、ジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)20.1g(0.081mol)及び2−エチル−1−ブタノール(アルドリッチ社製、98%)835g(8.2mol)を入れた。白色スラリー状の該混合物を入れたフラスコを、温度調節器のついたオイルバス(増田理化工業社製、OBH−24)と真空ポンプ(ULVAC社製、G−50A)と真空コントローラー(岡野製作所社製、VC−10S)を接続したエバポレーター(柴田社製、R−144)に取り付けた。
ジブチル−ビス(2−エチルブチルオキシ)−スズ
容積1Lのなすフラスコに、ジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)20.1g(0.081mol)及び2−エチル−1−ブタノール(アルドリッチ社製、98%)835g(8.2mol)を入れた。白色スラリー状の該混合物を入れたフラスコを、温度調節器のついたオイルバス(増田理化工業社製、OBH−24)と真空ポンプ(ULVAC社製、G−50A)と真空コントローラー(岡野製作所社製、VC−10S)を接続したエバポレーター(柴田社製、R−144)に取り付けた。
オイルバス温度を148℃に設定し、該フラスコを該オイルバスに浸漬してエバポレーターの回転を開始した。エバポレーターのパージバルブを開放したまま常圧で約20分間回転攪拌と加熱した後、エバポレーターのパージバルブを閉め、系内を真空ポンプと真空コントローラーを用いて徐々に減圧し、54〜75kPaとした。この状態を1.5時間保った後、該フラスコをオイルバスからあげた。反応液は透明な液になっていた。パージバルブを徐々に開いて系内の圧力を常圧に戻した。留去した液は99.2gであり、透明で、2層に分離していた。留去した液を分析したところ1.5g(0.083mol)の水を含んでいた。除去した水量から計算した脱水速度は0.055mol/hrであり、式(4)で表す脱水速度式から計算した値(0.014mol/hr)よりも大きかった。その後、オイルバスの温度を80℃に下げ、該フラスコを再びオイルバスに浸漬し、常圧で約20分間回転攪拌と攪拌した後、過剰の2−エチル−1−ブタノールを留去するため、エバポレーターのパージバルブを閉め、系内を真空ポンプと真空コントローラーを用いて徐々に減圧し、1.8〜2.5kPaとした。この状態を3時間保った後、該フラスコをオイルバスからあげてパージバルブを徐々に開き系内の圧力を常圧に戻した。留去した液は718gであった。
一方、該フラスコには生成物35.5gを得た。119Sn,1H,13C−NMRの分析結果から生成物は99%以上ジブチル−ビス(2−エチルブチルオキシ)−スズを含んでいた。さらに生成物中のスズ原子モル数に対してトリブチル−(2−エチルブチルオキシ)−スズを0.01%含有していた。得られた化合物の沸点は0.054kPaにおいて133.5℃であった。塩素分析結果から塩素原子含有量は40ppmであった。
1H−NMR(δ(テトラメチルスズ基準)/CDCl3):0.7−0.9(m、18H)、1.2−1.4(m、18H)、1.5−1.7(m、4H)、3.6(d、4H)
13C−NMR(ppm/CDCl3):11.01、13.36、18.35、22.73、26.82、27.11、45.23、67.75
119Sn−NMR(ppm(テトラメチルスズ基準)/CDCl3):100.8(tr)、−39.26
1H−NMR(δ(テトラメチルスズ基準)/CDCl3):0.7−0.9(m、18H)、1.2−1.4(m、18H)、1.5−1.7(m、4H)、3.6(d、4H)
13C−NMR(ppm/CDCl3):11.01、13.36、18.35、22.73、26.82、27.11、45.23、67.75
119Sn−NMR(ppm(テトラメチルスズ基準)/CDCl3):100.8(tr)、−39.26
実施例2
ジブチル−ビス(2−エチルブチルオキシ)−スズ
容積200mLのなすフラスコに、ジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)49.8g(0.2mol)及び2−エチル−1−ブタノール(アルドリッチ社製、98%)102.2g(1.0mol)を入れた。白色スラリー状の該混合物を入れたフラスコを、温度調節器のついたオイルバス(増田理化工業社製、OBH−24)と真空ポンプ(ULVAC社製、G−50A)と真空コントローラー(岡野製作所社製、VC−10S)を接続したエバポレーター(柴田社製、R−144)に取り付けた。
ジブチル−ビス(2−エチルブチルオキシ)−スズ
容積200mLのなすフラスコに、ジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)49.8g(0.2mol)及び2−エチル−1−ブタノール(アルドリッチ社製、98%)102.2g(1.0mol)を入れた。白色スラリー状の該混合物を入れたフラスコを、温度調節器のついたオイルバス(増田理化工業社製、OBH−24)と真空ポンプ(ULVAC社製、G−50A)と真空コントローラー(岡野製作所社製、VC−10S)を接続したエバポレーター(柴田社製、R−144)に取り付けた。
オイルバス温度を148℃に設定し、該フラスコを該オイルバスに浸漬してエバポレーターの回転を開始した。エバポレーターのパージバルブを開放したまま常圧で約20分間回転攪拌と加熱した後、エバポレーターのパージバルブを閉め、系内を真空ポンプと真空コントローラーを用いて徐々に減圧し、54〜75kPaとした。この状態を3.0時間保った後、該フラスコをオイルバスから取り出した。反応液は透明な液になっていた。パージバルブを徐々に開いて系内の圧力を常圧に戻した。留去した液は71gであり、透明で、2層に分離していた。
留去した液を分析したところ2.2g(0.12mol)の水を含んでいた。除去した水量から計算した脱水速度は0.04mol/hrであり、式(4)で表す脱水速度式から計算した値(0.034mol/hr)よりも大きかった。一方、該フラスコには生成物79.6gを得た。119Sn−NMRの分析結果から生成物はジブチル−ビス(2−エチルブチルオキシ)−スズ及び1,1,3,3−テトラブチル−1,3ビス(2−エチルブチルオキシ)−ジスタンオキサンを含んでおり、それぞれの濃度は20mol%及び79mol%であり、さらにトリブチル−(2−エチルブチルオキシ)−スズの含有量は約0.7mol%であり、塩素分析結果から塩素原子含有量は約30ppmであった。
実施例3
ジブチル−ビス(2−エチルブチルオキシ)−スズ
容積1Lのなすフラスコに、ジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)20.1g(0.081mol)及び2−エチル−1−ブタノール(アルドリッチ社製、98%)417g(4.1mol)を入れた。白色スラリー状の該混合物を入れたフラスコを、温度調節器のついたオイルバス(増田理化工業社製、OBH−24)と真空ポンプ(ULVAC社製、G−50A)と真空コントローラー(岡野製作所社製、VC−10S)を接続したエバポレーター(柴田社製、R−144)に取り付けた。
ジブチル−ビス(2−エチルブチルオキシ)−スズ
容積1Lのなすフラスコに、ジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)20.1g(0.081mol)及び2−エチル−1−ブタノール(アルドリッチ社製、98%)417g(4.1mol)を入れた。白色スラリー状の該混合物を入れたフラスコを、温度調節器のついたオイルバス(増田理化工業社製、OBH−24)と真空ポンプ(ULVAC社製、G−50A)と真空コントローラー(岡野製作所社製、VC−10S)を接続したエバポレーター(柴田社製、R−144)に取り付けた。
オイルバス温度を160℃に設定し、該フラスコを該オイルバスに浸漬してエバポレーターの回転を開始した。エバポレーターのパージバルブを開放したまま常圧で約3時間回転攪拌と加熱した後、エバポレーターのパージバルブを閉め、系内を真空ポンプと真空コントローラーを用いて徐々に減圧し、38〜42kPaとした。この状態を約0.5時間保持した後、該フラスコをオイルバスからあげてパージバルブを徐々に開き系内の圧力を常圧に戻した。反応液は透明な液になっていた。留去した液は400gであり、透明で、2層に分離していた。
留去した液を分析したところ1.4g(0.077mol)の水を含んでいた。除去した水量から計算した脱水速度は0.026mol/hrであり、式(4)で表す脱水速度式から計算した値(0.014mol/hr)よりも大きかった。一方、該フラスコには生成物35.0gを得た。119Sn,1H,13C−NMRの分析結果から生成物は92mol%のジブチル−ビス(2−エチルブチルオキシ)−スズと7mol%の1,1,3,3−テトラブチル−1,3ビス(2−エチルブチルオキシ)−ジスタンオキサンと約0.9mol%のトリブチル−(2−エチルブチルオキシ)−スズを含んでいて、塩素分析結果から塩素原子含有量は約30ppmであった。
実施例4
蒸留によってトリブチルスズ化合物を除去したジブチル−ビス(2−エチルへキシルオキシ)−スズ
温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた容積2Lの三口フラスコにジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)を124.5g(0.5mol)と2−エチル−1−ヘキサノール(アルドリッチ社製、脱水99.6%)を1302.0g(10mol)を仕込んだ。白色スラリー状の混合物を入れた該フラスコを160℃に設定したオイルバス(Fine社製、FWB−240)に浸漬した。常圧において約0.5hr加熱及び攪拌を行った後、混合液温度が150℃まで達した。その後、系内を真空ポンプ(佐藤真空社製、DW−120C)と真空コントローラー(岡野製作所社製、VC−30S)を用いて26.7〜33.3kPaに減圧し、この状態を約2hr保持した後、反応液は透明な液になっていた。
蒸留によってトリブチルスズ化合物を除去したジブチル−ビス(2−エチルへキシルオキシ)−スズ
温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた容積2Lの三口フラスコにジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)を124.5g(0.5mol)と2−エチル−1−ヘキサノール(アルドリッチ社製、脱水99.6%)を1302.0g(10mol)を仕込んだ。白色スラリー状の混合物を入れた該フラスコを160℃に設定したオイルバス(Fine社製、FWB−240)に浸漬した。常圧において約0.5hr加熱及び攪拌を行った後、混合液温度が150℃まで達した。その後、系内を真空ポンプ(佐藤真空社製、DW−120C)と真空コントローラー(岡野製作所社製、VC−30S)を用いて26.7〜33.3kPaに減圧し、この状態を約2hr保持した後、反応液は透明な液になっていた。
該フラスコをオイルバスから出し、オイルバス温度を120℃に下げた後、再び該フラスコをオイルバスに浸漬し、約0.5hr加熱及び攪拌を行った後、系内を2.7〜4.0kPaに減圧し、この状態を約2hr保ち過剰な2−エチル−1−ヘキサノールの留去を行った。その後、該フラスコに245.0gの液体を得、119Sn−NMRによる分析を行った結果、該液体にはジブチル−ビス(2−エチルヘキシルオキシ)−スズ、1,1,3,3−テトラブチル−1,3ビス(2−エチルヘキシルオキシ)−ジスタンオキサン、トリブチル−(2−エチルヘキシルオキシ)−スズが含まれており、濃度はそれぞれ96、1.1、2.9mol%であった。
次いで、温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた容積500mLの三口フラスコに該液体を仕込み、180℃に設定したオイルバスに浸す。常圧において約0.5hr加熱及び攪拌した後、系内を真空ポンプと真空コントローラーを用いて0.067kPaに減圧し、蒸留を行った。1hr蒸留を続けた結果、フラスコ内に残存したジブチル−ビス(2−エチルヘキシルオキシ)−スズは80gとなった。一方、蒸留から得た最初の留出液(留出液1)は約30mL回収した後、次に留出した液(留出液2)を別の容器に回収した。蒸留から得た液体(留出液1と2)はそれぞれ39、105gであった。フラスコ内残存液及び留出液の119Sn−NMR解析結果を以下の表に示す。
実施例5
水洗による塩素含有化合物の除去を施したジブチルスズオキシドを用いたジブチル−ビス(2−エチルブチルオキシ)−スズ
温度計、ジムロート冷却器、滴下ロートを備えた500mL三口フラスコにジブチル−ジクロロ−スズ(和光社製、97%)100.0g(0.33mol)及びトルエン(和光社製、有機合成用)150gを入れた。一方、該フラスコに取り付けた滴下ロートには水酸化ナトリウム溶液(和光社製、25w/v%)95mlを入れた。該フラスコを82℃に設定したオイルバス(Fine社製、FWB−240)に浸漬し、約0.5hr攪拌及び加熱を行った。その後、混合液を75℃に保ち、水酸化ナトリウム溶液の滴下を開始し、滴下に伴いジブチルスズオキシドが白い沈殿物として生成した。約0.5hrで滴下が終了し、そのまま攪拌及び加熱を1時間続けた。
水洗による塩素含有化合物の除去を施したジブチルスズオキシドを用いたジブチル−ビス(2−エチルブチルオキシ)−スズ
温度計、ジムロート冷却器、滴下ロートを備えた500mL三口フラスコにジブチル−ジクロロ−スズ(和光社製、97%)100.0g(0.33mol)及びトルエン(和光社製、有機合成用)150gを入れた。一方、該フラスコに取り付けた滴下ロートには水酸化ナトリウム溶液(和光社製、25w/v%)95mlを入れた。該フラスコを82℃に設定したオイルバス(Fine社製、FWB−240)に浸漬し、約0.5hr攪拌及び加熱を行った。その後、混合液を75℃に保ち、水酸化ナトリウム溶液の滴下を開始し、滴下に伴いジブチルスズオキシドが白い沈殿物として生成した。約0.5hrで滴下が終了し、そのまま攪拌及び加熱を1時間続けた。
その後、該フラスコをオイルバスから取り出し、混合液を放冷した。得た白い沈殿物をろ過し、適量の純水を加え攪拌した。沈殿物を再びろ過し、真空乾燥した後、73gの白色固体を得た。固体の塩素分析を行った結果、塩素原子含有量は約2000ppmであった。該固体を70gビーカーに入れ、適量の純水を加え室温において攪拌した後、固体をろ過し、真空乾燥を行った後、65gの固体を得、塩素原子含有量が約1000ppmであった。さらにこの固体について水洗を行い、60gの固体をビーカーに入れ、適量の純水を加え室温において1時間攪拌を行った。その後、固体をろ過し、真空乾燥を行った後、65gの固体を得た。
固体の塩素分析を行った結果、塩素原子含有量は50ppmであった。次いで、容積200mLのなすフラスコに、該固体50g及び2−エチル−1−ブタノール(アルドリッチ社製、98%)102.2g(1.0mol)を入れた。白色スラリー状の該混合物を入れたフラスコを、温度調節器のついたオイルバス(増田理化工業社製、OBH−24)と真空ポンプ(ULVAC社製、G−50A)と真空コントローラー(岡野製作所社製、VC−10S)を接続したエバポレーター(柴田社製、R−144)に取り付けた。オイルバス温度を148℃に設定し、該フラスコを該オイルバスに浸漬してエバポレーターの回転を開始した。エバポレーターのパージバルブを開放したまま常圧で約20分間回転攪拌と加熱した後、エバポレーターのパージバルブを閉め、系内を真空ポンプと真空コントローラーを用いて徐々に減圧し、54〜75kPaとした。
この状態を3.0時間保った後、該フラスコをオイルバスからあげた。反応液は透明な液になっていた。パージバルブを徐々に開いて系内の圧力を常圧に戻した。留去した液は70gであり、透明で、2層に分離していた。留去した液を分析したところ2.2g(0.12mol)の水を含んでいた。除去した水量から計算した脱水速度は0.04mol/hrであり、式(4)で表す脱水速度式から計算した値(0.034mol/hr)よりも大きかった。一方、該フラスコには生成物79.6gを得た。119Sn−NMRの分析結果から生成物はジブチル−ビス(2−エチルブチルオキシ)−スズ及び1,1,3,3−テトラブチル−1,3ビス(2−エチルブチルオキシ)−ジスタンオキサンを含んでおり、それぞれの濃度は20mol%及び79mol%であり、トリブチル−(2−エチルブチルオキシ)−スズの含有量は0.8mol%であった。さらに生成物中の塩素原子含有量は45ppmであった。
実施例6
ジブチル−ビス(2−エチルブチルオキシ)−スズによる炭酸エステル合成
三方コックを備えた100mLなすフラスコに0.3L/分の窒素ガスを流し、実施例1と同じ方法で製造したジブチル−ビス(2−エチルブチルオキシ)−スズを22.2g(0.051mol)及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)を24.2g(0.27mol)ガスタイト型シリンジ(Hamilton社製、1050TLL)によって仕込んだ後、該フラスコを振り液体を均一に混ぜた。混合液を、バルブを備えた150mLのSUS316L製圧力容器(Swagelok社製、316L−50DF4−150)にシリンジによって移し、バルブを閉め容器を密閉した。
ジブチル−ビス(2−エチルブチルオキシ)−スズによる炭酸エステル合成
三方コックを備えた100mLなすフラスコに0.3L/分の窒素ガスを流し、実施例1と同じ方法で製造したジブチル−ビス(2−エチルブチルオキシ)−スズを22.2g(0.051mol)及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)を24.2g(0.27mol)ガスタイト型シリンジ(Hamilton社製、1050TLL)によって仕込んだ後、該フラスコを振り液体を均一に混ぜた。混合液を、バルブを備えた150mLのSUS316L製圧力容器(Swagelok社製、316L−50DF4−150)にシリンジによって移し、バルブを閉め容器を密閉した。
磁気誘導式攪拌機、マントル型ヒーター、温度計、圧力計、2つのガスパージバルブ及び液体サンプリングバルブを備えた容積200mlの高圧容器(東洋高圧社製、FCシリーズオートクレーブシステム)に、減圧弁を備えた窒素ボンベとSUS316製チューブによって接続した。窒素ボンベの圧力を減圧弁によって0.5MPaに設定し、該高圧容器のガスパージバルブを開き容器内の圧力が0.5MPaになるまで窒素を導入した。別のガスパージバルブを開き容器の圧力を常圧に戻した。この操作を3回繰り返し容器内の窒素置換を行った。混合液の入った該圧力容器の重量を測り、該高圧容器の液体サンプリングバルブに接続した後、圧力容器を窒素によって0.5MPa昇圧した。
液体サンプリングバルブを徐々に開き、混合液を高圧容器に導入した。圧力容器の重量変化から高圧容器に仕込んだ混合液量を求めた。ヒーターを高圧容器に取り付け加熱を開始し、攪拌機を回転数450rpmで運転し、混合液を120℃に加熱した後、減圧弁を備えた炭酸ガスボンベ(昭和炭酸社製、純度99.99vol%)を高圧容器のガスパージバルブに接続した。炭酸ガスボンベの2次圧を減圧弁によって4.5MPaに設定し、ガスパージバルブを開き、炭酸ガスを高圧容器の導入し、圧力を4.0MPaに調整した。加熱及び攪拌を2時間行った後、ヒーターを容器から取り外し、容器内温度が常温になるまで放冷した。その後、ガスパージバルブを開き、容器内圧力が0.1MPaになるまで炭酸ガスを除いた。液体サンプリングバルブに三方コックを備えた100mL三口フラスコにテフロン(登録商標)チューブによって接続し、該バルブを開き混合液をフラスコに移した。フラスコの重量測定より採取した混合液量を求めたところ、24.0gであった。
次いで、該フラスコに枝管付連結管、温度計、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器に接続した。該フラスコをオイルバス(Fine社製、FWB−240)に浸漬し、混合液温度120℃に昇温した後、真空ポンプ(佐藤真空社製、DW−120C)と真空コントローラー(岡野製作所社製、VC−30S)によって約16kPaに徐々に減圧し約1.5時間保持し、蒸気温度89℃の留分1を11.3g得た。次いで、系内をさらに0.06〜0.2kPaに減圧し約1時間保持し、蒸気温度112℃の留分2を0.75g得た。留分2についてGC−FID分析を行った結果、炭酸ジ−3−メチルブチルが0.12g含まれており、さらに119Sn−NMR分析を行った結果、該炭酸エステルにトリブチル−(2−エチルブチルオキシ)−スズが検出されなかった。さらに、塩素分析結果から生成物には塩素も検出されなかった。
実施例7
ジブチル−ビス(2−エチルブチルオキシ)−スズによる炭酸エステル合成
実施例3と同じ方法で製造したジブチル−ビス(2−エチルブチルオキシ)−スズ(トリブチル−(2−エチルブチルオキシ)−スズ22.2g(0.051mol)及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)24.2g(0.27mol)を実施例6と同様な方法によって高圧容器に仕込み、同様に加熱及び攪拌を行った。その後、同様に混合液温度を下げ、炭酸ガスを除いた後、混合液を24.0g三方コックを備えた100mL三口フラスコに採取した。次いで、該フラスコに枝管付連結管、温度計、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器に接続した。
ジブチル−ビス(2−エチルブチルオキシ)−スズによる炭酸エステル合成
実施例3と同じ方法で製造したジブチル−ビス(2−エチルブチルオキシ)−スズ(トリブチル−(2−エチルブチルオキシ)−スズ22.2g(0.051mol)及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)24.2g(0.27mol)を実施例6と同様な方法によって高圧容器に仕込み、同様に加熱及び攪拌を行った。その後、同様に混合液温度を下げ、炭酸ガスを除いた後、混合液を24.0g三方コックを備えた100mL三口フラスコに採取した。次いで、該フラスコに枝管付連結管、温度計、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器に接続した。
該フラスコをオイルバス(Fine社製、FWB−240)に浸漬し、混合液温度120℃に昇温した後、真空ポンプ(佐藤真空社製、DW−120C)と真空コントローラー(岡野製作所社製、VC−30S)によって約16kPaに徐々に減圧し約1.5時間保持し、蒸気温度89℃の留分1を11.3g得た。次いで、系内をさらに0.06〜0.2kPaに減圧し約1時間保持し、蒸気温度112℃の留分2を0.75g得た。留分2についてGC−FID分析を行った結果、炭酸ジ−3−メチルブチルが0.12g含まれており、さらに119Sn−NMR分析を行った結果、該炭酸エステルにはトリブチル−(2−エチルブチルオキシ)−スズが検出されなかった。さらに、塩素分析結果から生成物には塩素も検出されなかった。
実施例8
ジブチル−ビス(2−エチルブチルオキシ)−スズによる炭酸エステル合成
温度計、ジムロート冷却器、滴下ロートを備えた500mL三口フラスコにジブチル−ジクロロ−スズ(和光社製、97%)100.0g(0.33mol)及びトルエン(和光社製、有機合成用)150gを入れた。一方、該フラスコに取り付けた滴下ロートには水酸化ナトリウム溶液(和光社製、25w/v%)95mlを入れた。該フラスコを82℃に設定したオイルバス(Fine社製、FWB−240)に浸漬し、約0.5hr攪拌及び加熱を行った。その後、混合液を75℃に保ち、水酸化ナトリウム溶液の滴下を開始し、滴下に伴い白い沈殿物が生成した。約0.5hrで滴下が終了し、そのまま攪拌及び加熱を1時間続けた。
ジブチル−ビス(2−エチルブチルオキシ)−スズによる炭酸エステル合成
温度計、ジムロート冷却器、滴下ロートを備えた500mL三口フラスコにジブチル−ジクロロ−スズ(和光社製、97%)100.0g(0.33mol)及びトルエン(和光社製、有機合成用)150gを入れた。一方、該フラスコに取り付けた滴下ロートには水酸化ナトリウム溶液(和光社製、25w/v%)95mlを入れた。該フラスコを82℃に設定したオイルバス(Fine社製、FWB−240)に浸漬し、約0.5hr攪拌及び加熱を行った。その後、混合液を75℃に保ち、水酸化ナトリウム溶液の滴下を開始し、滴下に伴い白い沈殿物が生成した。約0.5hrで滴下が終了し、そのまま攪拌及び加熱を1時間続けた。
その後、該フラスコをオイルバスから取り出し、混合液を放冷した。得た白い沈殿物をろ過し、適量の純水を加え攪拌した。沈殿物を再びろ過し、真空乾燥した後、73gの白色固体を得た。固体の塩素分析を行った結果、塩素原子含有量は約2000ppmであった。該固体を70gビーカーに入れ、適量の純水を加え室温において攪拌した後、固体をろ過し、真空乾燥を行った後、65gの固体を得、塩素原子含有量が約1000ppmであった。容積1Lのなすフラスコに、この白色固体のうち20.1g(0.081mol)及び2−エチル−1−ブタノール(アルドリッチ社製、98%)835g(8.2mol)を入れた。白色スラリー状の該混合物を入れたフラスコを、温度調節器のついたオイルバス(増田理化工業社製、OBH−24)と真空ポンプ(ULVAC社製、G−50A)と真空コントローラー(岡野製作所社製、VC−10S)を接続したエバポレーター(柴田社製、R−144)に取り付けた。
オイルバス温度を148℃に設定し、該フラスコを該オイルバスに浸漬してエバポレーターの回転を開始した。エバポレーターのパージバルブを開放したまま常圧で約20分間回転攪拌と加熱した後、エバポレーターのパージバルブを閉め、系内を真空ポンプと真空コントローラーを用いて徐々に減圧し、54〜75kPaとした。この状態を1.5時間保った後、該フラスコをオイルバスからあげた。反応液は透明な液になっていた。パージバルブを徐々に開いて系内の圧力を常圧に戻した。留去した液は99.2gであり、透明で、2層に分離していた。留去した液を分析したところ1.5g(0.083mol)の水を含んでいた。除去した水量から計算した脱水速度は0.055mol/hrであり、式(4)で表す脱水速度式から計算した値(0.014mol/hr)よりも大きかった。その後、オイルバスの温度を80℃に下げ、該フラスコを再びオイルバスに浸漬し、常圧で約20分間回転攪拌と攪拌した後、過剰の2−エチル−1−ブタノールを留去するため、エバポレーターのパージバルブを閉め、系内を真空ポンプと真空コントローラーを用いて徐々に減圧し、1.8〜2.5kPaとした。この状態を3時間保った後、該フラスコをオイルバスからあげてパージバルブを徐々に開き系内の圧力を常圧に戻した。留去した液は718gであった。一方、該フラスコには生成物35.5gを得た。119Sn,1H,13C−NMRの分析結果から生成物は99%以上ジブチル−ビス(2−エチルブチルオキシ)−スズを含んでいた。塩素分析結果から塩素原子含有量は1000ppmであった。該ジブチル−ビス(2−エチルブチルオキシ)−スズ22.2g(0.051mol)及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)24.2g(0.27mol)を実施例6と同様な方法によって高圧容器に仕込み、同様に加熱及び攪拌を行った。その後、同様に混合液温度を下げ、炭酸ガスを除いた後、混合液を24.0g三方コックを備えた100mL三口フラスコに採取した。
次いで、該フラスコに枝管付連結管、温度計、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器に接続した。該フラスコをオイルバス(Fine社製、FWB−240)に浸漬し、混合液温度120℃に昇温した後、真空ポンプ(佐藤真空社製、DW−120C)と真空コントローラー(岡野製作所社製、VC−30S)によって約16kPaに徐々に減圧し約1.5時間保持し、蒸気温度89℃の留分1を11.3g得た。次いで、系内をさらに0.06〜0.2kPaに減圧し約1時間保持し、蒸気温度112℃の留分2を0.75g得た。留分2についてGC−FID分析を行った結果、炭酸ジ−3−メチルブチルが0.12g含まれており、さらに、塩素分析結果から生成物には塩素が検出されなかった。
実施例9
ジブチル−ビス(2−エチルブチルオキシ)−スズによるエステル交換反応
温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた三口100mlフラスコに実施例1で述べた方法で合成したジブチル−ビス(2−エチルブチルオキシ)−スズを21.42g(0.049mol)、酢酸エチル(和光社製、有機合成用)を8.89g(0.10mol)、及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)17.68g(0.20mol)をシリンジによって仕込んだ。フラスコをオイルバスに浸漬し、混合液を90℃に加熱し、加熱及び攪拌を2時間行った。
ジブチル−ビス(2−エチルブチルオキシ)−スズによるエステル交換反応
温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた三口100mlフラスコに実施例1で述べた方法で合成したジブチル−ビス(2−エチルブチルオキシ)−スズを21.42g(0.049mol)、酢酸エチル(和光社製、有機合成用)を8.89g(0.10mol)、及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)17.68g(0.20mol)をシリンジによって仕込んだ。フラスコをオイルバスに浸漬し、混合液を90℃に加熱し、加熱及び攪拌を2時間行った。
その後、真空ポンプと真空コントローラーによって91〜46kPaに徐々に減圧し約1.5時間保持し、低沸成分を留去した。留出液が出なくなったところ、混合液温度を125℃に昇温し、圧力を約24kPaに減圧し約1時間保持し、さらに圧力を徐々に0.06kPaまで減圧し約30分間保持し、高沸成分を留去した。高沸成分を3.64g得てGC−FID分析結果、酢酸−3−メチルブチルが1.02g含まれていた。得られた酢酸エステル液について119Sn−NMR分析を行った結果、トリブチルスズ化合物が検出されなかった。さらに、塩素分析結果から生成物には塩素含有量も検出されなかった。
実施例10
ジブチル−ビス(2−エチルブチルオキシ)−スズによるエステル交換反応
温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた三口100mlフラスコに実施例3で述べた方法で合成したジブチル−ビス(2−エチルブチルオキシ)−スズ(トリブチル−(2−エチルブチルオキシ)−スズ含有量0.9mol%)を21.32g(0.049mol)、酢酸エチル(和光社製、有機合成用)を8.95g(0.10mol)、及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)17.56g(0.20mol)をシリンジによって仕込んだ。フラスコをオイルバスに浸漬し、混合液を90℃に加熱し、加熱及び攪拌を2時間行った。
ジブチル−ビス(2−エチルブチルオキシ)−スズによるエステル交換反応
温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた三口100mlフラスコに実施例3で述べた方法で合成したジブチル−ビス(2−エチルブチルオキシ)−スズ(トリブチル−(2−エチルブチルオキシ)−スズ含有量0.9mol%)を21.32g(0.049mol)、酢酸エチル(和光社製、有機合成用)を8.95g(0.10mol)、及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)17.56g(0.20mol)をシリンジによって仕込んだ。フラスコをオイルバスに浸漬し、混合液を90℃に加熱し、加熱及び攪拌を2時間行った。
その後、真空ポンプと真空コントローラーによって91〜46kPaに徐々に減圧し約1.5時間保持し、低沸成分を留去した。留出液が出なくなったところ、混合液温度を125℃に昇温し、圧力を約24kPaに減圧し約1時間保持し、さらに圧力を徐々に0.06kPaまで減圧し約30分間保持し、高沸成分を留去した。高沸成分を3.56g得てGC−FID分析結果、酢酸−3−メチルブチルが1.12g含まれていた。得られた酢酸エステル液について119Sn−NMR分析を行った結果、トリブチルスズ化合物が検出されなかった。
実施例11
温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた容積2Lの三口フラスコにジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)32.7g(0.13mol)と2−エチル−1−ヘキサノール(アルドリッチ社製、脱水99.6%)848.3g(6.5mol)を入れた。白色スラリー状の混合物を入れた該フラスコを149℃に設定したオイルバス(Fine社製、FWB−240)に浸漬した。約40分間攪拌及び加熱を行った後、混合物の温度が140℃に達した。真空ポンプ(佐藤真空社製、DW−120C)と真空コントローラー(岡野製作所社製、VC−30S)によって系内を徐々に21〜27kPaに減圧し、該フラスコから生成する水を蒸留した。この状態を1.5hr保った後、該フラスコ内混合物の温度を100℃に下げた。その後、系内を徐々に0.6kPaまで減圧し過剰な2−エチル−ヘキサノールを蒸留した。蒸留によって回収した液は815.6gであり、これに含まれている水は2.5g(0.14mol)であった。除去した水量から計算した脱水速度は0.093mol/hrであり、式(4)で表す脱水速度式から計算した値(0.043mol/hr)よりも大きかった。該フラスコには64.8gの生成物を得た。119Sn−NMRの分析結果から生成物はジブチル−ビス(2−エチルへキシルオキシ)−スズ及び1,1,3,3−テトラブチル−1,3ビス(2−エチルヘキシルオキシ)−ジスタンオキサンを含んでおり、それぞれの濃度は98mol%及び1mol%であり、さらにトリブチル−(2−エチルヘキシルオキシ)−スズの含有量は0.6mol%であった。
温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた容積2Lの三口フラスコにジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)32.7g(0.13mol)と2−エチル−1−ヘキサノール(アルドリッチ社製、脱水99.6%)848.3g(6.5mol)を入れた。白色スラリー状の混合物を入れた該フラスコを149℃に設定したオイルバス(Fine社製、FWB−240)に浸漬した。約40分間攪拌及び加熱を行った後、混合物の温度が140℃に達した。真空ポンプ(佐藤真空社製、DW−120C)と真空コントローラー(岡野製作所社製、VC−30S)によって系内を徐々に21〜27kPaに減圧し、該フラスコから生成する水を蒸留した。この状態を1.5hr保った後、該フラスコ内混合物の温度を100℃に下げた。その後、系内を徐々に0.6kPaまで減圧し過剰な2−エチル−ヘキサノールを蒸留した。蒸留によって回収した液は815.6gであり、これに含まれている水は2.5g(0.14mol)であった。除去した水量から計算した脱水速度は0.093mol/hrであり、式(4)で表す脱水速度式から計算した値(0.043mol/hr)よりも大きかった。該フラスコには64.8gの生成物を得た。119Sn−NMRの分析結果から生成物はジブチル−ビス(2−エチルへキシルオキシ)−スズ及び1,1,3,3−テトラブチル−1,3ビス(2−エチルヘキシルオキシ)−ジスタンオキサンを含んでおり、それぞれの濃度は98mol%及び1mol%であり、さらにトリブチル−(2−エチルヘキシルオキシ)−スズの含有量は0.6mol%であった。
比較例1
従来法により得られたジブチル−ビス(2−エチルブチルオキシ)−スズによる炭酸エステル合成
温度計、ジムロート冷却器、滴下ロートを備えた500mL三口フラスコにジブチル−ジクロロ−スズ(和光社製、97%)100.0g(0.33mol)及びトルエン(和光社製、有機合成用)150gを入れた。一方、該フラスコに取り付けた滴下ロートには水酸化ナトリウム溶液(和光社製、25w/v%)95mlを入れた。該フラスコを82℃に設定したオイルバス(Fine社製、FWB−240)に浸漬し、約0.5hr攪拌及び加熱を行った。その後、混合液を75℃に保ち、水酸化ナトリウム溶液の滴下を開始し、滴下に伴い白い沈殿物が生成した。約0.5hrで滴下が終了し、そのまま攪拌及び加熱を1時間続けた。その後、該フラスコをオイルバスから取り出し、混合液を放冷した。得た白い沈殿物をろ過し、適量の純水を加え攪拌した。沈殿物を再びろ過し、真空乾燥した後、73gの白色固体を得た。
従来法により得られたジブチル−ビス(2−エチルブチルオキシ)−スズによる炭酸エステル合成
温度計、ジムロート冷却器、滴下ロートを備えた500mL三口フラスコにジブチル−ジクロロ−スズ(和光社製、97%)100.0g(0.33mol)及びトルエン(和光社製、有機合成用)150gを入れた。一方、該フラスコに取り付けた滴下ロートには水酸化ナトリウム溶液(和光社製、25w/v%)95mlを入れた。該フラスコを82℃に設定したオイルバス(Fine社製、FWB−240)に浸漬し、約0.5hr攪拌及び加熱を行った。その後、混合液を75℃に保ち、水酸化ナトリウム溶液の滴下を開始し、滴下に伴い白い沈殿物が生成した。約0.5hrで滴下が終了し、そのまま攪拌及び加熱を1時間続けた。その後、該フラスコをオイルバスから取り出し、混合液を放冷した。得た白い沈殿物をろ過し、適量の純水を加え攪拌した。沈殿物を再びろ過し、真空乾燥した後、73gの白色固体を得た。
固体の塩素分析を行った結果、塩素原子含有量は約2000ppmであった。容積1Lのなすフラスコに、この白色固体を20.0g(0.080mol)及び2−エチル−1−ブタノール(アルドリッチ社製、98%)835g(8.2mol)を入れた。白色スラリー状の該混合物を入れたフラスコを、温度調節器のついたオイルバス(増田理化工業社製、OBH−24)と真空ポンプ(ULVAC社製、G−50A)と真空コントローラー(岡野製作所社製、VC−10S)を接続したエバポレーター(柴田社製、R−144)に取り付けた。オイルバス温度を148℃に設定し、該フラスコを該オイルバスに浸漬してエバポレーターの回転を開始した。エバポレーターのパージバルブを開放したまま常圧で約20分間回転攪拌と加熱した後、エバポレーターのパージバルブを閉め、系内を真空ポンプと真空コントローラーを用いて徐々に減圧し、54〜75kPaとした。この状態を1.5時間保った後、該フラスコをオイルバスからあげた。反応液は透明な液になっていた。パージバルブを徐々に開いて系内の圧力を常圧に戻した。留去した液は99.2gであり、透明で、2層に分離していた。留去した液を分析したところ1.5g(0.083mol)の水を含んでいた。
その後、オイルバスの温度を80℃に下げ、該フラスコを再びオイルバスに浸漬し、常圧で約20分間回転攪拌と攪拌した後、過剰の2−エチル−1−ブタノールを留去するため、エバポレーターのパージバルブを閉め、系内を真空ポンプと真空コントローラーを用いて徐々に減圧し、1.8〜2.5kPaとした。この状態を3時間保った後、該フラスコをオイルバスからあげてパージバルブを徐々に開き系内の圧力を常圧に戻した。留去した液は718gであった。一方、該フラスコには生成物35.5gを得た。119Sn,1H,13C−NMRの分析結果から生成物は99%以上ジブチル−ビス(2−エチルブチルオキシ)−スズを含んでいた。塩素分析結果から塩素原子含有量は2000ppmであった。
該ジブチル−ビス(2−エチルブチルオキシ)−スズ22.2g(0.051mol)及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)24.2g(0.27mol)を実施例6と同様な方法によって高圧容器に仕込み、同様に加熱及び攪拌を行った。その後、同様に混合液温度を下げ、炭酸ガスを除いた後、混合液を24.0g三方コックを備えた100mL三口フラスコに採取した。次いで、該フラスコに枝管付連結管、温度計、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器に接続した。該フラスコをオイルバス(Fine社製、FWB−240)に浸漬し、混合液温度120℃に昇温した後、真空ポンプ(佐藤真空社製、DW−120C)と真空コントローラー(岡野製作所社製、VC−30S)によって約16kPaに徐々に減圧し約1.5時間保持し、蒸気温度89℃の留分1を11.3g得た。次いで、系内をさらに0.06〜0.2kPaに減圧し約1時間保持し、蒸気温度110℃の留分2を0.80g得た。留分2についてGC−FID分析を行った結果、炭酸ジ−3−メチルブチルが0.16g含まれており、さらに、塩素分析結果から生成物の塩素原子含有量は25ppmであった。
比較例2
多量にトリブチルスズ化合物を含有するジブチルスズアルコキシドによる炭酸エステル合成
ジブチルスズジメトキシド(アルドリッチ社製、トリブチルスズ化合物3.5mol%含有)を23.56g(0.079mol)及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)33.06g(0.38mol)を実施例3と同様な方法によって高圧容器に仕込み、同様に加熱及び攪拌を行った。その後、同様に混合液温度を下げ、炭酸ガスを除いた後、混合液を37.51g三方コックを備えた100mL三口フラスコに採取した。次いで、該フラスコに枝管付連結管、温度計、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器に接続した。該フラスコをオイルバスに浸漬し、混合液温度120℃に昇温した後、真空ポンプと真空コントローラーによって97〜13kPaに徐々に減圧し約1.5時間保持し、蒸気温度54〜98℃の留分1を16.85g得た。次いで、系内をさらに0.06〜0.2kPaに減圧し約1時間保持し、蒸気温度79〜81℃の留分2を1.71g得た。留分2についてGC−FID分析を行った結果、炭酸ジ−3−メチルブチルが1.61g含まれており、さらに119Sn−NMR分析を行った結果、該炭酸エステルに含まれているトリブチルスズ化合物が1.2wt%混入したことを確認した。
多量にトリブチルスズ化合物を含有するジブチルスズアルコキシドによる炭酸エステル合成
ジブチルスズジメトキシド(アルドリッチ社製、トリブチルスズ化合物3.5mol%含有)を23.56g(0.079mol)及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)33.06g(0.38mol)を実施例3と同様な方法によって高圧容器に仕込み、同様に加熱及び攪拌を行った。その後、同様に混合液温度を下げ、炭酸ガスを除いた後、混合液を37.51g三方コックを備えた100mL三口フラスコに採取した。次いで、該フラスコに枝管付連結管、温度計、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器に接続した。該フラスコをオイルバスに浸漬し、混合液温度120℃に昇温した後、真空ポンプと真空コントローラーによって97〜13kPaに徐々に減圧し約1.5時間保持し、蒸気温度54〜98℃の留分1を16.85g得た。次いで、系内をさらに0.06〜0.2kPaに減圧し約1時間保持し、蒸気温度79〜81℃の留分2を1.71g得た。留分2についてGC−FID分析を行った結果、炭酸ジ−3−メチルブチルが1.61g含まれており、さらに119Sn−NMR分析を行った結果、該炭酸エステルに含まれているトリブチルスズ化合物が1.2wt%混入したことを確認した。
比較例3
トリブチルスズ化合物及び塩素含有化合物を含むジブチルスズアルコキシドによる炭酸エステル合成
ジブチルスズジブトキシド(アズマックス社製、トリブチルスズ化合物含有量1.5mol%、塩素原子含有量7600ppm)23.80g(0.063mol)及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)26.44g(0.30mol)を実施例3と同様な方法によって高圧容器に仕込み、同様に加熱及び攪拌を行った。その後、同様に混合液温度を下げ、炭酸ガスを除いた後、混合液を22.07g三方コックを備えた100mL三口フラスコに採取した。次いで、該フラスコに枝管付連結管、温度計、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器に接続した。該フラスコをオイルバスに浸漬し、混合液温度120℃に昇温した後、真空ポンプと真空コントローラーによって約32kPaに徐々に減圧し約1.5時間保持し、蒸気温度96℃の留分1を11.51g得た。次いで、系内をさらに0.15〜0.06kPaに減圧し約1時間保持し、蒸気温度64〜80℃の留分2を2.30g得た。留分2についてGC−FID分析を行った結果、炭酸ジ−3−メチルブチルが0.20g含まれており、さらに塩素分析を行った結果、塩素原子含有量が70ppmであり、119Sn−NMRの分析結果から、トリブチルスズ化合物が0.7wt%であった。
トリブチルスズ化合物及び塩素含有化合物を含むジブチルスズアルコキシドによる炭酸エステル合成
ジブチルスズジブトキシド(アズマックス社製、トリブチルスズ化合物含有量1.5mol%、塩素原子含有量7600ppm)23.80g(0.063mol)及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)26.44g(0.30mol)を実施例3と同様な方法によって高圧容器に仕込み、同様に加熱及び攪拌を行った。その後、同様に混合液温度を下げ、炭酸ガスを除いた後、混合液を22.07g三方コックを備えた100mL三口フラスコに採取した。次いで、該フラスコに枝管付連結管、温度計、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器に接続した。該フラスコをオイルバスに浸漬し、混合液温度120℃に昇温した後、真空ポンプと真空コントローラーによって約32kPaに徐々に減圧し約1.5時間保持し、蒸気温度96℃の留分1を11.51g得た。次いで、系内をさらに0.15〜0.06kPaに減圧し約1時間保持し、蒸気温度64〜80℃の留分2を2.30g得た。留分2についてGC−FID分析を行った結果、炭酸ジ−3−メチルブチルが0.20g含まれており、さらに塩素分析を行った結果、塩素原子含有量が70ppmであり、119Sn−NMRの分析結果から、トリブチルスズ化合物が0.7wt%であった。
比較例4
多量にトリブチルスズ化合物を含有するジブチルスズアルコキシドによるエステル交換反応
ジブチルスズジメトキシド(アルドリッチ社製、トリブチルスズ化合物3.5mol%)を14.89g(0.05mol)、酢酸エチル(和光社製、有機合成用)を8.96g(0.10mol)、及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)17.75g(0.20mol)を実施例4と同様な方法によってフラスコに仕込み、同様に加熱及び攪拌を2時間行った。その後、真空ポンプと真空コントローラーによって46〜91kPaに徐々に減圧し約1.5時間保持し、低沸成分を留去した。留出液が出なくなったところ、混合液温度を125℃に昇温し、圧力を約24kPaに減圧し約1時間保持し、さらに圧力を徐々に0.06kPaまで減圧し約30分間保持し、高沸成分を留去した。高沸成分を6.31g得てGC−FID分析結果、酢酸−3−メチルブチルが1.56g含まれていた。得られた酢酸エステル液について119Sn−NMR分析を行った結果、トリブチルスズ化合物が0.24wt%混入していることを確認した。
多量にトリブチルスズ化合物を含有するジブチルスズアルコキシドによるエステル交換反応
ジブチルスズジメトキシド(アルドリッチ社製、トリブチルスズ化合物3.5mol%)を14.89g(0.05mol)、酢酸エチル(和光社製、有機合成用)を8.96g(0.10mol)、及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)17.75g(0.20mol)を実施例4と同様な方法によってフラスコに仕込み、同様に加熱及び攪拌を2時間行った。その後、真空ポンプと真空コントローラーによって46〜91kPaに徐々に減圧し約1.5時間保持し、低沸成分を留去した。留出液が出なくなったところ、混合液温度を125℃に昇温し、圧力を約24kPaに減圧し約1時間保持し、さらに圧力を徐々に0.06kPaまで減圧し約30分間保持し、高沸成分を留去した。高沸成分を6.31g得てGC−FID分析結果、酢酸−3−メチルブチルが1.56g含まれていた。得られた酢酸エステル液について119Sn−NMR分析を行った結果、トリブチルスズ化合物が0.24wt%混入していることを確認した。
比較例5
トリブチルスズ化合物及び塩素含有化合物を含むジブチルスズアルコキシドによるエステル交換反応
ジブチルスズジブトキシド(アズマックス社製、塩素含有量7600ppm)19.04g(0.05mol)、酢酸エチル(和光社製、有機合成用)を9.02g(0.10mol)、及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)18.12g(0.21mol)を実施例4と同様な方法によってフラスコに仕込み、同様に加熱及び攪拌を2時間行った。その後、真空ポンプと真空コントローラーによって46〜91kPaに徐々に減圧し約1.5時間保持し、低沸成分を留去した。留出液が出なくなったところ、混合液温度を125℃に昇温し、圧力を約24kPaに減圧し約1時間保持し、さらに圧力を徐々に0.06kPaまで減圧し約30分間保持し、高沸成分を留去した。高沸成分を1.98g得てGC−FID分析結果、酢酸−3−メチルブチルが0.68g含まれていた。得られた酢酸エステル液について119Sn−NMR分析を行った結果、トリブチルスズ化合物が0.11wt%混入していることを確認した。塩素分析を行った結果、塩素原子含有量が60ppmであった。
トリブチルスズ化合物及び塩素含有化合物を含むジブチルスズアルコキシドによるエステル交換反応
ジブチルスズジブトキシド(アズマックス社製、塩素含有量7600ppm)19.04g(0.05mol)、酢酸エチル(和光社製、有機合成用)を9.02g(0.10mol)、及び3−メチル−1−ブタノール(アルドリッチ社製、脱水99+%)18.12g(0.21mol)を実施例4と同様な方法によってフラスコに仕込み、同様に加熱及び攪拌を2時間行った。その後、真空ポンプと真空コントローラーによって46〜91kPaに徐々に減圧し約1.5時間保持し、低沸成分を留去した。留出液が出なくなったところ、混合液温度を125℃に昇温し、圧力を約24kPaに減圧し約1時間保持し、さらに圧力を徐々に0.06kPaまで減圧し約30分間保持し、高沸成分を留去した。高沸成分を1.98g得てGC−FID分析結果、酢酸−3−メチルブチルが0.68g含まれていた。得られた酢酸エステル液について119Sn−NMR分析を行った結果、トリブチルスズ化合物が0.11wt%混入していることを確認した。塩素分析を行った結果、塩素原子含有量が60ppmであった。
比較例6
温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた容積0.5Lの三口フラスコにジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)37.47g(0.15mol)と2−エチル−1−ヘキサノール(アルドリッチ社製、脱水99.6%)196.45g(1.5mol)を入れた。白色スラリー状の混合物を入れた該フラスコを160℃に設定したオイルバス(Fine社製、FWB−240)に浸漬した。約30分間攪拌及び加熱を行った後、混合物の温度が151℃に達した。真空ポンプ(佐藤真空社製、DW−120C)と真空コントローラー(岡野製作所社製、VC−30S)によって系内を徐々に28kPaに減圧し、該フラスコから生成する水を蒸留した。この状態を1.5hr保った後、該フラスコ内混合物の温度を90℃に下げた。その後、系内を徐々に0.6kPaまで減圧し過剰な2−エチル−ヘキサノールを蒸留した。蒸留によって回収した液は162.33gであり、これに含まれている水は2.6g(0.14mol)であった。除去した水量から計算した脱水速度は0.093mol/hrであり、式(4)で表す脱水速度式から計算した値(0.11mol/hr)よりも小さかった。該フラスコには71.25gの生成物を得た。119Sn−NMRの分析結果から生成物はジブチル−ビス(2−エチルへキシルオキシ)−スズ及び1,1,3,3−テトラブチル−1,3ビス(2−エチルヘキシルオキシ)−ジスタンオキサンを含んでおり、それぞれの濃度は89mol%及び9mol%であり、さらにトリブチル−(2−エチルヘキシルオキシ)−スズの含有量は2mol%であった。
温度計、三方コック、枝管付連結管、リービッヒ冷却器、減圧連結管及び2つの蒸留液回収容器を備えた容積0.5Lの三口フラスコにジブチルスズオキシド(アルドリッチ社製、98%、塩素原子含有量40ppm)37.47g(0.15mol)と2−エチル−1−ヘキサノール(アルドリッチ社製、脱水99.6%)196.45g(1.5mol)を入れた。白色スラリー状の混合物を入れた該フラスコを160℃に設定したオイルバス(Fine社製、FWB−240)に浸漬した。約30分間攪拌及び加熱を行った後、混合物の温度が151℃に達した。真空ポンプ(佐藤真空社製、DW−120C)と真空コントローラー(岡野製作所社製、VC−30S)によって系内を徐々に28kPaに減圧し、該フラスコから生成する水を蒸留した。この状態を1.5hr保った後、該フラスコ内混合物の温度を90℃に下げた。その後、系内を徐々に0.6kPaまで減圧し過剰な2−エチル−ヘキサノールを蒸留した。蒸留によって回収した液は162.33gであり、これに含まれている水は2.6g(0.14mol)であった。除去した水量から計算した脱水速度は0.093mol/hrであり、式(4)で表す脱水速度式から計算した値(0.11mol/hr)よりも小さかった。該フラスコには71.25gの生成物を得た。119Sn−NMRの分析結果から生成物はジブチル−ビス(2−エチルへキシルオキシ)−スズ及び1,1,3,3−テトラブチル−1,3ビス(2−エチルヘキシルオキシ)−ジスタンオキサンを含んでおり、それぞれの濃度は89mol%及び9mol%であり、さらにトリブチル−(2−エチルヘキシルオキシ)−スズの含有量は2mol%であった。
本発明のジアルキルスズアルコキシドは高品質炭酸エステルの製造、エステル交換反応、ポリマー硬化剤等の分野において好適に利用できる。
Claims (15)
- ジアルキルスズアルコキシド含有組成物であって、該組成物中のジアルキルスズアルコキシドのスズ原子モル数に対してトリアルキルスズ化合物含有量が0.01mol%以上1mol%以下、及び塩素原子含有量が1000ppm以下であることを特徴とするジアルキルスズアルコキシド含有組成物。
- 下記式(1)に示すジアルキルスズオキシド及び/または下記式(2)に示すジアルキルスズアルコキシドを含む出発物質と、下記式(3)に示すアルコールを含む反応物質とを脱水反応し、出発物質と反応物質に対応するジアルキルスズジアルコキシドの製造方法であって、下記式(4)によって定められる脱水速度条件を満足する脱水速度で製造することを特徴とする請求項1記載のジアルキルスズアルコキシド含有組成物の製造方法。
R1は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表す。)
R1は、上記した化学式(1)のR1と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R2は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
R2は、上記した化学式(2)のR2と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
脱水速度:脱水反応で形成される水のうち、単位時間当りに系外に抜き出す水量[mol・hr-1]、X:出発物質に含まれる化学式(1)で表すジアルキルスズオキシド中のスズ原子モル数[mol]、Y:出発物質に含まれる化学式(2)で表すジアルキルスズアルコキシド中のスズ原子モル数[mol]、T:脱水反応温度[K]、R:気体定数=8.314J・mol-1・K-1を表し、A及びBは化学式(2)で表すジアルキルスズアルコキシドの種類に依存する係数である。)
但し、出発物質に化学式(2)で表すジアルキルスズアルコキシドが含まれる場合は、上記A及びBはそれぞれ化学式(2)で表すジアルキルスズアルコキシドの熱分解反応の頻度因子及び活性化エネルギーを表すものであって、下記式(5)で得られるA及びBであり、そして出発物質に化学式(2)で表すジアルキルスズアルコキシドが含まれない場合は、A及びBはそれぞれ出発物質に含まれる化学式(1)と反応物質とから形成される化学式(2)に相当するジアルキルスズアルコキシドの熱分解反応の頻度因子及び活性化エネルギーを表すものであって、下記式(5)で得られるA及びBである。
k:1次反応速度定数[hr-1]、A:頻度因子[hr-1]、B:活性化エネルギー[J・mol-1]、R:気体定数=8.314J・mol-1・K-1、T:熱分解反応温度[K]を表す。)
上記kは該熱分解反応の1次反応速度定数を表し、下記式(6)で得られるkである。
k:1次反応速度定数[hr-1]、t:熱分解反応時間[hr]、C:化学式(2)で表すジアルキルスズアルコキシドの初期濃度に対する減少率[mol/mol]を表す。) - 請求項1記載の該ジアルキルスズアルコキシド含有組成物中のジアルキルスズアルコキシドが下記式(7)または下記式(8)の少なくとも1つを含むことを特徴とする請求項1記載のジアルキルスズアルコキシド含有組成物。
R3は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し;
R4は、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。)
R3は前述したR3と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基、又は無置換又は置換された炭素数6〜20のアリール基を表し、R4は前述したR4と同じであり、直鎖状または分岐状の炭素数1〜12のアルキル基、炭素数5〜12のシクロアルキル基、直鎖状または分岐状の炭素数2〜12のアルケニル基、又は無置換又は置換された炭素数6〜19のアリール及び直鎖状または分岐状の炭素数1〜14のアルキルと炭素数5〜14のシクロアルキルよりなる群から選ばれるアルキルからなる炭素数7〜20のアラルキル基を表す。) - ジアルキルスズアルコキシド含有組成物であって、該組成物中のジアルキルスズアルコキシドのスズ原子モル数に対してトリアルキルスズ化合物含有量が1mol%以下、及び塩素原子含有量が1000ppm以下であることを特徴とする請求項1記載のジアルキルスズアルコキシド含有組成物。
- 該出発物質に含まれるトリアルキルスズ化合物含有量が、該出発物質中の全スズ原子モル数に対して1mol%以下および塩素原子含有量1000ppm以下であることを特徴とする請求項2記載のジアルキルスズアルコキシド含有組成物の製造方法。
- 脱水速度が下記式(9)によって定められる脱水速度条件を満足する脱水速度であることを特徴とする請求項2記載のジアルキルスズアルコキシド含有組成物の製造方法。
脱水速度:脱水反応で形成される水のうち、単位時間当りに系外に抜き出す水量[mol・hr-1]、X:出発物質に含まれる化学式(1)で表すジアルキルスズオキシド中のスズ原子モル数[mol]、Y:出発物質に含まれる化学式(2)で表すジアルキルスズアルコキシド中のスズ原子モル数[mol]、T:脱水反応温度[K]、R:気体定数=8.314J・mol-1・K-1を表し、A及びBは化学式(2)で表すジアルキルスズアルコキシドの種類に依存する係数である。) - 請求項1または請求項3記載のジアルキルスズアルコキシド含有組成物を触媒としてエステルの製造に使用する方法。
- 請求項1または請求項3記載のジアルキルスズアルコキシド含有組成物を触媒として炭酸エステルの製造に使用する方法。
- 請求項2記載の製造方法で得られるジアルキルスズアルコキシド含有組成物を触媒としてエステルの製造に使用する方法。
- 請求項2記載の製造方法で得られるジアルキルスズアルコキシド含有組成物を触媒として炭酸エステルの製造に使用する方法。
- 請求項1または請求項3記載のジアルキルスズアルコキシド含有組成物を触媒として用いて製造される炭酸エステル。
- 請求項2記載の製造方法で得られるジアルキルスズアルコキシド含有組成物を触媒として用いて製造される炭酸エステル。
- 請求項1または請求項3記載のジアルキルスズアルコキシド含有組成物を触媒として用いて製造される炭酸エステルから得られる芳香族炭酸エステル、ポリカーボネート、またはイソシアネート類。
- 請求項2記載の製造方法で得られるジアルキルスズアルコキシド含有組成物を触媒として用いて製造される炭酸エステルから得られる芳香族炭酸エステル、ポリカーボネート、またはイソシアネート類。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004119779A JP2005298433A (ja) | 2004-04-15 | 2004-04-15 | ジアルキルスズアルコキシド |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004119779A JP2005298433A (ja) | 2004-04-15 | 2004-04-15 | ジアルキルスズアルコキシド |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005298433A true JP2005298433A (ja) | 2005-10-27 |
Family
ID=35330410
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004119779A Pending JP2005298433A (ja) | 2004-04-15 | 2004-04-15 | ジアルキルスズアルコキシド |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005298433A (ja) |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007254329A (ja) * | 2006-03-22 | 2007-10-04 | Asahi Kasei Chemicals Corp | ジアルキルスズジアルコキシド |
| WO2008044575A1 (en) | 2006-10-11 | 2008-04-17 | Asahi Kasei Chemicals Corporation | Process for production of dialkyltin dialkoxides |
| WO2010016297A1 (ja) * | 2008-08-08 | 2010-02-11 | 旭化成ケミカルズ株式会社 | アルキルスズアルコキシド化合物の製造方法、及び当該化合物を用いた炭酸エステルの製造方法 |
| US7842828B2 (en) | 2006-02-23 | 2010-11-30 | Asahi Kasei Chemicals Corporation | Method for separating out and recovering dialkyltin dialkoxide |
| RU2414474C2 (ru) * | 2006-10-11 | 2011-03-20 | Асахи Касеи Кемикалз Корпорейшн | Способ получения диалкоксидов диалкилолова |
| WO2015046167A1 (ja) | 2013-09-26 | 2015-04-02 | 旭化成ケミカルズ株式会社 | アルキルスズ化合物 |
| JP2021519340A (ja) * | 2018-04-11 | 2021-08-10 | インプリア・コーポレイションInpria Corporation | ポリアルキル汚染が少ないモノアルキルスズ化合物、それらの組成物及び方法 |
| JP2023036627A (ja) * | 2017-08-02 | 2023-03-14 | シースター ケミカルズ アンリミティッド ライアビリティ カンパニー | 有機金属化合物及びその精製法 |
-
2004
- 2004-04-15 JP JP2004119779A patent/JP2005298433A/ja active Pending
Cited By (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7842828B2 (en) | 2006-02-23 | 2010-11-30 | Asahi Kasei Chemicals Corporation | Method for separating out and recovering dialkyltin dialkoxide |
| JP2007254329A (ja) * | 2006-03-22 | 2007-10-04 | Asahi Kasei Chemicals Corp | ジアルキルスズジアルコキシド |
| US8008518B2 (en) | 2006-10-11 | 2011-08-30 | Asahi Kasei Chemicals Corporation | Process for producing dialkyl tin dialkoxides |
| WO2008044575A1 (en) | 2006-10-11 | 2008-04-17 | Asahi Kasei Chemicals Corporation | Process for production of dialkyltin dialkoxides |
| RU2414474C2 (ru) * | 2006-10-11 | 2011-03-20 | Асахи Касеи Кемикалз Корпорейшн | Способ получения диалкоксидов диалкилолова |
| JP4827927B2 (ja) * | 2006-10-11 | 2011-11-30 | 旭化成ケミカルズ株式会社 | ジアルキルスズジアルコキシドの製造方法 |
| CN102112482B (zh) * | 2008-08-08 | 2016-01-20 | 旭化成化学株式会社 | 烷基锡醇盐化合物的制造方法及使用该化合物的碳酸酯的制造方法 |
| CN104151162B (zh) * | 2008-08-08 | 2016-08-24 | 旭化成株式会社 | 使用烷基锡醇盐化合物的碳酸酯的制造方法 |
| US8168812B2 (en) | 2008-08-08 | 2012-05-01 | Asahi Kasei Chemicals Corporation | Process for producing alkyl tin alkoxide compound and process for producing carbonic acid ester using said compound |
| JP5069793B2 (ja) * | 2008-08-08 | 2012-11-07 | 旭化成ケミカルズ株式会社 | アルキルスズアルコキシド化合物の製造方法、及び当該化合物を用いた炭酸エステルの製造方法 |
| CN104151162A (zh) * | 2008-08-08 | 2014-11-19 | 旭化成化学株式会社 | 使用烷基锡醇盐化合物的碳酸酯的制造方法 |
| CN102112482A (zh) * | 2008-08-08 | 2011-06-29 | 旭化成化学株式会社 | 烷基锡醇盐化合物的制造方法及使用该化合物的碳酸酯的制造方法 |
| WO2010016297A1 (ja) * | 2008-08-08 | 2010-02-11 | 旭化成ケミカルズ株式会社 | アルキルスズアルコキシド化合物の製造方法、及び当該化合物を用いた炭酸エステルの製造方法 |
| EA024850B1 (ru) * | 2008-08-08 | 2016-10-31 | Асахи Касеи Кабусики Кайся | Способ получения соединения алкоксида алкилолова и способ получения эфира карбоновой кислоты с использованием указанного соединения |
| WO2015046167A1 (ja) | 2013-09-26 | 2015-04-02 | 旭化成ケミカルズ株式会社 | アルキルスズ化合物 |
| KR20160048171A (ko) | 2013-09-26 | 2016-05-03 | 아사히 가세이 케미칼즈 가부시키가이샤 | 알킬주석 화합물 |
| US9844775B2 (en) | 2013-09-26 | 2017-12-19 | Asahi Kasei Kabushiki Kaisha | Alkyl tin compound |
| JP2023036627A (ja) * | 2017-08-02 | 2023-03-14 | シースター ケミカルズ アンリミティッド ライアビリティ カンパニー | 有機金属化合物及びその精製法 |
| JP7577104B2 (ja) | 2017-08-02 | 2024-11-01 | シースター ケミカルズ アンリミティッド ライアビリティ カンパニー | 有機金属化合物及びその精製法 |
| JP2021519340A (ja) * | 2018-04-11 | 2021-08-10 | インプリア・コーポレイションInpria Corporation | ポリアルキル汚染が少ないモノアルキルスズ化合物、それらの組成物及び方法 |
| JP7305671B2 (ja) | 2018-04-11 | 2023-07-10 | インプリア・コーポレイション | ポリアルキル汚染が少ないモノアルキルスズ化合物、それらの組成物及び方法 |
| JP2023123712A (ja) * | 2018-04-11 | 2023-09-05 | インプリア・コーポレイション | ポリアルキル汚染が少ないモノアルキルスズ化合物、それらの組成物及び方法 |
| JP7608526B2 (ja) | 2018-04-11 | 2025-01-06 | インプリア・コーポレイション | ポリアルキル汚染が少ないモノアルキルスズ化合物、それらの組成物及び方法 |
| JP2025013880A (ja) * | 2018-04-11 | 2025-01-28 | インプリア・コーポレイション | ポリアルキル汚染が少ないモノアルキルスズ化合物、それらの組成物及び方法 |
| JP7796839B2 (ja) | 2018-04-11 | 2026-01-09 | インプリア・コーポレイション | ポリアルキル汚染が少ないモノアルキルスズ化合物、それらの組成物及び方法 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100976993B1 (ko) | 디알킬주석 디알콕사이드의 분리 회수 방법 | |
| JP4257798B2 (ja) | アルキルスズアルコキシド類の製造方法 | |
| EP2226328B1 (en) | Process for production of alkyl tin alkoxide compound, and process for production of carbonate ester using the compound | |
| KR101042664B1 (ko) | 디알킬주석 디알콕시드의 제조 방법 | |
| JP2005298433A (ja) | ジアルキルスズアルコキシド | |
| JP2012140355A (ja) | 炭酸エステルの製造方法 | |
| EP3050889B1 (en) | Alkyl tin compound | |
| JP2007254366A (ja) | テトラアルキルジアルコキシジスタンオキサン | |
| JP2007254365A (ja) | テトラアルキルジアルコキシジスタンオキサン | |
| JP2007269653A (ja) | アルキルスズアルコキシドの製造方法 | |
| JP2007254331A (ja) | ジアルキルスズジアルコキシド | |
| JP2007254367A (ja) | テトラアルキルジアルコキシジスタンオキサン | |
| JP2007254329A (ja) | ジアルキルスズジアルコキシド | |
| JP2007254400A (ja) | テトラアルキルジアルコキシジスタンオキサン | |
| JP2007254369A (ja) | テトラアルキルジアルコキシジスタンオキサン | |
| JP2007254401A (ja) | テトラアルキルジアルコキシジスタンオキサン | |
| JP2007254328A (ja) | ジアルキルスズジアルコキシド | |
| JP2007254330A (ja) | ジアルキルスズジアルコキシド | |
| JP2007254368A (ja) | テトラアルキルジアルコキシジスタンオキサン | |
| JP2007254327A (ja) | ジアルキルスズジアルコキシド | |
| JP2007099738A (ja) | アルキルスズアルコキシドの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20051227 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20090630 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090706 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100301 |