JP2005043350A - 免疫比濁計測方法及び計測装置 - Google Patents
免疫比濁計測方法及び計測装置 Download PDFInfo
- Publication number
- JP2005043350A JP2005043350A JP2004195803A JP2004195803A JP2005043350A JP 2005043350 A JP2005043350 A JP 2005043350A JP 2004195803 A JP2004195803 A JP 2004195803A JP 2004195803 A JP2004195803 A JP 2004195803A JP 2005043350 A JP2005043350 A JP 2005043350A
- Authority
- JP
- Japan
- Prior art keywords
- peak
- concentration
- optical sensor
- test solution
- turbidity
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Landscapes
- Investigating Or Analysing Materials By Optical Means (AREA)
Abstract
【解決手段】 濁度変化の過渡現象を観察し、濁度の極大値または極小値を検出し、これら極大値または極小値を示す時間と、濁度、ならびに極大値および/または極小値から被検液の濃度を決定する。
【選択図】図1
Description
そこで、得られた前記混合液の濁度を離散的に複数回または連続的に計測し、得られた濁度の計測値と混合後の経過時間との関係を求める。そして、前記関係に基づき、前記計測値の極大値または極小値であるSpeakを検出し、前記Speakを示す経過時間Tpeakを求める。
これらの工程を行うことによって前記濁度の変化を調べ、当該変化に基づいて前記被検液にプロゾーン現象が発生するか否かを確認し、プロゾーン現象の有無によって前記分析対象物の濃度を決定することができる。
また、前記Speakと前記Tpeakとの関係より、前記分析対象物の濃度を決定することが好ましい。
前記混合後に時間Tが経過した時点の前記濁度の計測値S(T)と、前記経過時間Tpeakとの関係より、前記分析対象物の濃度を決定することが好ましい。ただし、この場合、T>Tpeakを満たすのが好ましい。
また、前記混合後時間tが経過した時点の前記濁度の計測値S(T)の微分値dS(T)/dTを算出し、前記微分値の極性が反転する時点を前記Tpeakとしこの時点の計測値S(T)をSpeakとすることによって、Speakを検出するとともに前記Speakを示す前記Tpeakを求めることが好ましい。
また、前記分析対象物がヒト血清アルブミンであることが好ましい。
また、前記抗体がモノクローナル抗体であり、前記試薬中に前記モノクローナル抗体が2種類以上含まれており、前記2種以上のモノクローナル抗体が、それぞれヒト血清アルブミンの異なる部位と特異結合することが好ましい。
また、前記被検液が尿であることが好ましい。
この免疫比濁計測装置は、前記被検液に光を照射する光源と、前記光が前記被検液を透過するように前記被検液を保持するサンプルセルと、前記被検液を透過した透過光を検知する光センサ1および/または前記光が前記被検液中を伝搬する際に発生した散乱光を検知するための光センサ2と、前記サンプルセルにおいて前記被検液と前記抗体を含んだ試薬とを混合する混合機と、前記混合機を制御し、前記光センサ1および/または前記光センサ2の出力信号を解析するコンピューターとを備える。
そして、前記被検液と前記試薬との混合後の前記光センサ1および/または前記光センサ2の出力信号より、前記被検液中の抗原濃度を計測する。
そして、前記被検液と前記試薬との混合後の前記光センサ1および/もしくは前記光センサ2の出力信号、または前記微分器1および/または前記微分器2の出力信号より、前記被検液中の抗原濃度を計測する。
なお、前記混合機は省略してもよい。
矢印10で示される試薬の注入方向は、光学窓と平行で、後述する略平行光4の光軸と垂直である。このように配置することで、注入口2の断面の中心から注入方向へ伸びる注入軸と略平行光4の光軸とが、前記サンプルセルの溶液中で交点を有する。ここでは、x=0.15cm、z=0.1cmの場合を示す。
光センサ5は、被検液中を略平行光4が伝搬する際に発生した散乱光11を検知する。また、ポンプは、試薬液を注入口2より、サンプルセル中の被検液に注入し、コンピューター7は光センサ5の出力信号を解析し、ポンプの制御もする。
このサンプルセル1は内壁の角にrを有する。すなわち、角部が厳密には直角でないため、h=0.8cmの時、約0.23mlの液体を保持している。なお、本発明では、液面9の最下部に接する面を液面と定義する。この定義に基づくと、本実施の形態では、注入方向が、液面に対して平行になる。
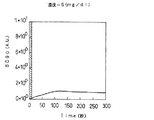
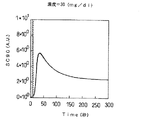
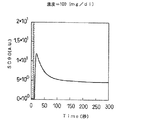
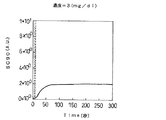
まず、ヒト血清アルブミン濃度が0.03mg/dl以下と確認された尿を溶媒として用い、この溶媒にヒト血清アルブミンを添加し、濃度=1mg/dl、3mg/dl、5mg/dl、10mg/dl、15mg/dl、20mg/dl、30mg/dl、50mg/dl、および100mg/dlの被検液を調製する。
さらに、ウサギ由来のポリクローナルヒトアルブミン抗体を、0.05Mモプス水溶液(pH7.4)に溶解し、抗体濃度が2.5mg/dlの試薬(抗体水溶液)を調製する。
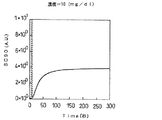
ここで、コンピューター7は、光センサ5の出力信号の記録を開始する。開始以降の、光センサ5の出力信号の時間変化を図18に示す。図18において、横軸は、出力信号の記録開始後の経過時間を示し、縦軸は光センサ5の出力信号(SC90と記載)を示す。なお、被検液中で発生した散乱光のうち、略平行光4の伝搬方向に対して90度の方向へ伝搬する散乱光を光センサ5が検出しているため、「SC90」と記載する。
なお、図18で、試薬の混合を開始する5秒経過時点から3秒以上の期間は、混合された試薬の流束そのものが略平行光4の光路に侵入するため、透過光の強度および伝搬方向が乱れ、光センサ5の出力信号は激しく変化する。このように出力信号が変化している領域をハッチングで示す。
このうち、ヒト血清アルブミン濃度が3mg/dl、10mg/dl、および100mg/dlの被検液に対する光センサ5の出力信号の時間変化をそれぞれ図19〜21に示す。これらの図においても、図18と同様に、光センサ5の出力信号が激しく変化する領域をハッチングで示す。
図22から、濃度が0〜30mg/dlの領域が図17のA〜Bの領域に相当し、濃度が50mg/dlの領域が領域Cに相当し、濃度が100mg/dl付近の領域が領域Dに相当していることがわかる。
しかし、被検液の濃度が約50mg/dl以上である場合は、被検液と試薬を混合して一定時間経過後の濁度からのみでは、プロゾーン現象によって、濃度を一意的に決定できないことがある。例えば、濁度(300秒経過時点の光センサ5の出力信号)が7.5の場合には、被検液の濃度は約20mg/dlであるか、50〜100mg/dlであるかが区別できない。
したがって、被検液のヒト血清アルブミン濃度が50mg/dl以下であることを、何らかの方法で別途確認する必要がある。換言すると、上記計測方法で計測できる被検液の濃度域は、50mg/dl以下に制限されていた。
本実施の形態は、ヒト血清アルブミンと特異結合するモノクローナル抗体を用いて、尿を被検液として、尿中のアルブミンを計測した例を示す。
免疫比濁法の場合、抗原抗体反応により抗原と抗体が凝集する必要がある。即ち、抗原と抗体が結合し、この結合物が抗体分子よって架橋して大きな粒子(抗原抗体複合物)が生成される必要がある。したがって、抗原と結合する結合部位が互いに異なる抗体が少なくとも2種類必要である。
また、抗原抗体複合物の粒径は、前記計測値が極大値または最小値を示す程度の大きさであることが必要であり、種々の条件によって異なるが、例えば約25μm以上であることが好ましい。
まず、従来の技術と同様にヒト血清アルブミン濃度が0.03mg/dl以下と確認された尿を溶媒として用い、当該溶媒にヒト血清アルブミンを添加して、濃度が3mg/dl、5mg/dl、10mg/dl、30mg/dl、50mg/dl,100mg/dl、150mg/dl、250mg/dl、300mg/dl、および500mg/dlの被検液を調製した。
さらに、ヒト血清アルブミンの互いに異なる結合部位と特異結合するマウス由来のモノクローナル抗体を3種類(AHSA1、AHSA2、AHSA3)準備した。AHSA1、AHSA2、AHSA3としては、それぞれ独立行政法人産業技術総合研究所特許生物寄託センター受託番号FERM BP−8308号、FERM BP−8309号およびFERM BP−7938号で示される細胞株により産生されるモノクローナル抗体である。
そして、従来の技術と同様に、ヒト血清アルブミン濃度が0mg/dl(溶媒として用いた尿(ヒト血清アルブミンを添加していないためその濃度は実質的にゼロとみなせる))、3mg/dl、5mg/dl、10mg/dl、30mg/dl、50mg/dl、100mg/dl、150mg/dl、250mg/dl、300mg/dl、および500mg/dlの被検液9μlをサンプルセル1へ導入し、さらに、上記試薬145μlをサンプルセル1へ導入して攪拌した。
なお、図3〜13で、試薬の混合を開始する5秒経過時点から3秒以上の期間は、混合された試薬の流束そのものが略平行光4の光路に侵入したため、透過光の強度及び伝搬方向が乱れ、光センサ5の出力信号は激しく変化した。この変化している領域をハッチングで示した。
しかし、これらとは異なり、濃度が5mg/dl、10mg/dl、30mg/dl、50mg/dl、100mg/dl、150mg/dl、250mg/dl、300mg/dl、および500mg/dlの被検液についての図5〜13では、試薬混合後、光センサ5の出力信号は、一旦急激に増加し極大値を示し、その後単調に減少し、300秒経過すると飽和し一定値に至る。
そこで、被検液と試薬を混合後の濁度の過渡現象を、次のように分析した。まず、図5〜13における各被検液の濃度を横軸に、濁度の極大値(Speak)を縦軸に示し図15を作成した。
次に、本極大値を示す経過時間(Tpeak)を横軸に、濁度の極大値(Speak)を縦軸に示し、図16を作成した。図16において、各点の横の数字は濃度(mg/dl)を示す。図16から、濃度が高くなるに従って、極大値を示す経過時間(Tpeak)が短くなり、濃度が100mg/dl以上になると、約18秒に漸近することがわかった。
ただし、濃度が0mg/dlおよび3mg/dlのような低濃度の場合は、濁度の計測値の極大値が存在しない。この場合は、抗体過剰域である図17のA〜B領域とみなせるので、所定時間Tが経過した時点の濁度の計測値S(T)のみで、濃度を一意的に決定できる。
ここで、所要時間Tは、T>Tpeakを満たすことが好ましい。このようにすると、再現性を向上させることができる。さらに、Tは、Sが飽和する時間であるのが好ましい。一方、T<Tpeakであってもよい。この場合は、より短い計測時間で濃度を決定することができる。
さらに、散乱光および透過光とを双方検出し、これらの結果をお互い参照し、計測信頼性を向上させても良い。
本発明の第2の実施の形態について図15を用いて説明する。本実施の形態は、図15と図16を用いて濃度を決定する例である。
例えば、濁度の極大値が5.5の場合、図15のみからでは、被検液の濃度は約30mg/dlであるか、150〜250mg/dlであるかが区別できないが、図16を併用するとこれらを区別でき濃度を決定することができる。すなわち、このときの極大値を示す経過時間(Tpeak)が約35秒であれば、濃度は30mg/dlと判定でき、極大値を示す経過時間(Tpeak)が、約18秒であれば、150〜250mg/dlであると判定できる。
このように、被検液と試薬を混合して、濁度の極大値(Speak)(図15)と、極大値を示す経過時間(Tpeak)との関係から、濃度を一意的に決定できる。これにより、本実施の形態で示した例では、計測できる被検液の濃度域を〜500mg/dlまで拡大することに成功した。
本発明の第3の実施の形態について図16を用いて説明する。図16からわかるように、極大値を示す経過時間(Tpeak)が所定値T0(図16の場合T0≒18秒)以上のときは、Tpeakのみから濃度を一意的に決定できる。したがって、経過時間(Tpeak)が所定値T0以下のときは、濃度を所定値C0(図16の場合C0は100mg/dl)と判定し、所定値T0以上のときは、図16から読み取れるTpeakに応じた濃度と判定することができる。本実施の形態も、濁度の極大値を検出した時点で、濃度を決定できるので、実施の形態1より、計測の高速化に有利である。
ただし、極大値が存在しない低濃度の場合は、所定時間経過後の濁度で決定する。このように、本実施の形態と実施の形態1を併用すると効果が大きい。
本発明の第4の実施の形態について図23を用いて説明する。図23は、本発明において用いることのできる免疫比濁計測装置の別の実施の形態である。図23において、符号1〜11で示される構成要素は、図1の符号1〜11で示される構成要素と同じものである。12は、光センサ5の出力信号を微分する微分器で、その出力信号はコンピューター7によって分析される。この装置は、微分器12の出力信号の符号が反転した時点を極大値とするため、より高精度かつ高速に極大値を認識できる。
以上のように、本実施の形態によれば、より微小な極大値を高速に認識できるので、低濃度の被検液の濃度を高速に決定できる。
これは、散乱光強度は、散乱光の伝搬方向によって変化することと関連がある。すなわち、溶液中に浮遊する粒子の粒径が、励起光(略平行光4に相当)の波長に対して十分小さい場合(波長の1/20以下)は、散乱光強度の分布はその伝搬方向には依存しない。
これらから、抗原抗体反応の進行に従って抗原抗体複合物が成長すると、一旦は、SC90は増加するが、更に抗原抗体複合物が成長し粒径が大きくなると、前方散乱光強度は増加による反動と、粒子濃度が小さくなる影響により、SC90は低下する。即ち、極大値が現れる。
これは、図1の光センサ5を、溶液中で発生した散乱光のうち、略平行光4の伝搬方向に対して45度の方向へ伝搬する散乱光を検出するように配置した場合の光センサ5の出力信号である。これをSC45と記載する。アルブミン濃度が10mg/dlの場合のSC45を点線で示した。
また、このように、SC90が極大値を示す一例の粒径は、図1の装置で、上記した抗体の組合せの場合、およそ25μm以上のときであった。
2 注入口
3 半導体レーザモジュール
4 略平行光
5 光センサ
6 混合機
7 コンピューター
8 液体の流束方向を示す矢印
9 液面
10 液体の注入方向を示す矢印
11 散乱光
12 微分器
Claims (12)
- 分析対象物である抗原を含む被検液と、前記分析対象物と特異結合反応する抗体を含む試薬とを混合し、前記特異結合反応により生じた抗原抗体複合物に由来して発生した濁度に関する信号を検出することによって前記分析対象物を定性または定量する免疫比濁計測方法であって、
(1)前記被検液および前記試薬を混合して混合液を得る工程、
(2)得られた前記混合液の濁度を、離散的に複数回または連続的に計測する工程、
(3)得られた濁度の計測値と混合後の経過時間との関係を求める工程、ならびに
(4)前記関係に基づいて、前記計測値の極大値または極小値であるSpeakを検出し、前記Speakを示す経過時間Tpeakを求める工程を含むことを特徴とする免疫比濁計測方法。 - 前記工程(2)において散乱光によって前記濁度を計測し、前記工程(4)において極大値を検出する請求項1記載の免疫比濁計測方法。
- 前記Speakと前記Tpeakとの関係より、前記分析対象物の濃度を決定する請求項1記載の免疫比濁計測方法。
- 前記混合後に時間Tが経過した時点の前記濁度の計測値S(T)と、前記経過時間Tpeakとの関係より、前記分析対象物の濃度を決定する請求項1記載の免疫比濁計測方法。
- T>Tpeakを満たす請求項4記載の免疫比濁計測方法。
- 前記混合後に時間Tが経過した時点の前記濁度の計測値S(T)の微分値dS(T)/dTを算出し、前記微分値の極性が反転する時点を前記Tpeakとしこの時点の計測値S(T)をSpeakとすることによって、Speakを検出するとともに前記Speakを示す前記Tpeakを求める請求項1記載の免疫比濁計測方法。
- 前記Tpeakが所定値T0以下であるとき、前記被検液中の前記分析対象物の濃度が所定値C0以上と判定する請求項1記載の免疫比濁計測方法。
- 前記分析対象物がヒト血清アルブミンである請求項1〜7のいずれかに記載の免疫比濁計測方法。
- 前記抗体がモノクローナル抗体であり、前記試薬中に前記モノクローナル抗体が2種類以上含まれており、前記2種以上のモノクローナル抗体が、それぞれヒト血清アルブミンの異なる部位と特異結合する請求項8記載の免疫比濁計測方法。
- 前記被検液が尿である請求項9記載の免疫比濁計測方法。
- 前記被検液に光を照射する光源と、
前記光が前記被検液を透過するように前記被検液を保持し、前記被検液と抗体を含んだ試薬とが混合されるサンプルセルと、
前記被検液を透過した透過光を検知する光センサ1および/または前記光が前記被検液 中を伝搬する際に発生した散乱光を検知するための光センサ2と、
前記光センサ1および/または前記光センサ2の出力信号を解析するコンピューターとを備え、
前記被検液と前記試薬との混合後の前記光センサ1および/または前記光センサ2の出力信号より、前記被検液中の抗原濃度を計測することを特徴とする請求項1〜10のいずれかに記載の免疫比濁計測方法を実施するための免疫比濁計測装置。 - 前記被検液に光を照射する光源と、
前記光が前記被検液を透過するように前記被検液を保持し、前記被検液と前記抗体を含んだ試薬とが混合されるサンプルセルと、
前記被検液を透過した透過光を検知する光センサ1および/または前記光が前記被検液中を伝搬する際に発生した散乱光を検知する光センサ2と、
前記光センサ1および/または前記光センサ2の出力信号を微分する微分器1および/または微分器2と、
前記光センサ1、前記光センサ2、前記微分器1および/または前記微分器2の出力信号を解析するコンピューターとを備え、
前記被検液と前記試薬との混合後の前記微分器1および/または前記微分器2の出力信号より、前記被検液中の抗原濃度を計測することを特徴とする請求項1〜10のいずれかに記載の免疫比濁計測方法を実施するための免疫比濁計測装置。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004195803A JP2005043350A (ja) | 2003-07-09 | 2004-07-01 | 免疫比濁計測方法及び計測装置 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003272357 | 2003-07-09 | ||
| JP2004195803A JP2005043350A (ja) | 2003-07-09 | 2004-07-01 | 免疫比濁計測方法及び計測装置 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005043350A true JP2005043350A (ja) | 2005-02-17 |
| JP2005043350A5 JP2005043350A5 (ja) | 2008-08-21 |
Family
ID=34277440
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004195803A Withdrawn JP2005043350A (ja) | 2003-07-09 | 2004-07-01 | 免疫比濁計測方法及び計測装置 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005043350A (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013160768A (ja) * | 2012-02-06 | 2013-08-19 | Ortho-Clinical Diagnostics Inc | アッセイ法のレンジを拡大するための多重時間窓 |
| US20210311046A1 (en) * | 2020-04-07 | 2021-10-07 | Washington University | Methods of reducing interference in immunoassays |
| WO2022042706A1 (zh) * | 2020-08-28 | 2022-03-03 | 深圳市帝迈生物技术有限公司 | 判断产生钩状效应的方法、免疫分析方法以及装置 |
-
2004
- 2004-07-01 JP JP2004195803A patent/JP2005043350A/ja not_active Withdrawn
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013160768A (ja) * | 2012-02-06 | 2013-08-19 | Ortho-Clinical Diagnostics Inc | アッセイ法のレンジを拡大するための多重時間窓 |
| US20210311046A1 (en) * | 2020-04-07 | 2021-10-07 | Washington University | Methods of reducing interference in immunoassays |
| WO2022042706A1 (zh) * | 2020-08-28 | 2022-03-03 | 深圳市帝迈生物技术有限公司 | 判断产生钩状效应的方法、免疫分析方法以及装置 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3033620B1 (en) | Method for the detection of the prozone effect of photometric assays | |
| US7226777B2 (en) | Turbidimetric immunoassay and an apparatus therefor | |
| US20100240150A1 (en) | Measuring reagent and turbidimetric immunoassay and sample analysis tool using the same | |
| JP5855246B2 (ja) | 校正不要分析による活性濃度の決定方法 | |
| JP2010522336A (ja) | 全血分析 | |
| EP1096248B1 (en) | Method for measuring concentration of a solution | |
| US9568488B2 (en) | Biological sample analyzing apparatus | |
| JP2002116145A (ja) | 溶液濃度計測方法および溶液濃度計測装置 | |
| JPS638560A (ja) | 免疫分析システム | |
| JP2005043350A (ja) | 免疫比濁計測方法及び計測装置 | |
| JPWO2003076913A1 (ja) | 均一化・反応完了判定方法およびこれを用いた溶液濃度計測方法 | |
| CN111323574A (zh) | 一种基于等离子光学纳米孔增强免疫比浊的含量测定方法 | |
| JP6437390B2 (ja) | 自動分析装置 | |
| JP2011069755A (ja) | 免疫測定方法および装置 | |
| JPWO2003010513A1 (ja) | 溶液濃度計測方法、これに用いるサンプルセルおよび溶液濃度計測装置 | |
| JP3694449B2 (ja) | 溶液濃度計測方法および溶液濃度計測装置 | |
| US8133693B2 (en) | Measurement of binding rate of a binding substance and an analyte | |
| JP4556605B2 (ja) | 標的物質の測定方法および測定試薬 | |
| US20050009100A1 (en) | Immunoassay method and immunoassay system | |
| Ledue et al. | Development and validation of 14 human serum protein assays on the Roche cobas® c 501 | |
| JP2005189245A (ja) | 溶液濃度計測方法および溶液濃度計測装置 | |
| JP6736797B1 (ja) | 自動分析装置での免疫測定における異常検出抑制方法、及び免疫測定試薬 | |
| JPWO2002046755A1 (ja) | 溶液濃度計測方法および尿検査方法 | |
| JPH0843393A (ja) | 免疫学的測定方法及び分析装置 | |
| JPH09318632A (ja) | ラテックス比濁免疫測定法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20061225 |
|
| A521 | Written amendment |
Effective date: 20070511 Free format text: JAPANESE INTERMEDIATE CODE: A523 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070511 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080703 |
|
| A761 | Written withdrawal of application |
Effective date: 20090414 Free format text: JAPANESE INTERMEDIATE CODE: A761 |