ES2955019T3 - Composiciones de hierro novedosas y métodos para preparar y utilizar las mismas - Google Patents
Composiciones de hierro novedosas y métodos para preparar y utilizar las mismas Download PDFInfo
- Publication number
- ES2955019T3 ES2955019T3 ES20717359T ES20717359T ES2955019T3 ES 2955019 T3 ES2955019 T3 ES 2955019T3 ES 20717359 T ES20717359 T ES 20717359T ES 20717359 T ES20717359 T ES 20717359T ES 2955019 T3 ES2955019 T3 ES 2955019T3
- Authority
- ES
- Spain
- Prior art keywords
- iron
- composition
- aqueous
- sucrose
- samples
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 title claims abstract description 108
- 239000000203 mixture Substances 0.000 title claims abstract description 70
- 229910052742 iron Inorganic materials 0.000 title claims abstract description 52
- 238000000034 method Methods 0.000 title claims description 27
- 230000001681 protective effect Effects 0.000 claims abstract description 7
- FWZTTZUKDVJDCM-CEJAUHOTSA-M disodium;(2r,3r,4s,5s,6r)-2-[(2s,3s,4s,5r)-3,4-dihydroxy-2,5-bis(hydroxymethyl)oxolan-2-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol;iron(3+);oxygen(2-);hydroxide;trihydrate Chemical compound O.O.O.[OH-].[O-2].[O-2].[O-2].[O-2].[O-2].[O-2].[O-2].[O-2].[Na+].[Na+].[Fe+3].[Fe+3].[Fe+3].[Fe+3].[Fe+3].O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 FWZTTZUKDVJDCM-CEJAUHOTSA-M 0.000 claims description 28
- 229940032961 iron sucrose Drugs 0.000 claims description 28
- 210000003734 kidney Anatomy 0.000 claims description 12
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 claims description 9
- CWYNVVGOOAEACU-UHFFFAOYSA-N Fe2+ Chemical compound [Fe+2] CWYNVVGOOAEACU-UHFFFAOYSA-N 0.000 claims description 8
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 claims description 7
- KSFOVUSSGSKXFI-GAQDCDSVSA-N CC1=C/2NC(\C=C3/N=C(/C=C4\N\C(=C/C5=N/C(=C\2)/C(C=C)=C5C)C(C=C)=C4C)C(C)=C3CCC(O)=O)=C1CCC(O)=O Chemical compound CC1=C/2NC(\C=C3/N=C(/C=C4\N\C(=C/C5=N/C(=C\2)/C(C=C)=C5C)C(C=C)=C4C)C(C)=C3CCC(O)=O)=C1CCC(O)=O KSFOVUSSGSKXFI-GAQDCDSVSA-N 0.000 claims description 7
- 229950003776 protoporphyrin Drugs 0.000 claims description 7
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 claims description 6
- 210000000056 organ Anatomy 0.000 claims description 6
- 235000017557 sodium bicarbonate Nutrition 0.000 claims description 4
- 229910000030 sodium bicarbonate Inorganic materials 0.000 claims description 4
- 239000008194 pharmaceutical composition Substances 0.000 claims description 3
- 239000008365 aqueous carrier Substances 0.000 claims description 2
- 208000020832 chronic kidney disease Diseases 0.000 claims description 2
- 208000017169 kidney disease Diseases 0.000 claims description 2
- 230000002265 prevention Effects 0.000 claims description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims 4
- 201000010099 disease Diseases 0.000 claims 2
- 208000035475 disorder Diseases 0.000 claims 2
- 230000005484 gravity Effects 0.000 claims 2
- 206010052779 Transplant rejections Diseases 0.000 claims 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 abstract description 19
- 229930006000 Sucrose Natural products 0.000 abstract description 19
- 239000005720 sucrose Substances 0.000 abstract description 19
- DKIDFDYBDZCAAU-UHFFFAOYSA-L carbonic acid;iron(2+);carbonate Chemical compound [Fe+2].OC([O-])=O.OC([O-])=O DKIDFDYBDZCAAU-UHFFFAOYSA-L 0.000 abstract description 4
- 239000000523 sample Substances 0.000 description 39
- 238000009826 distribution Methods 0.000 description 22
- 239000000463 material Substances 0.000 description 18
- 238000004458 analytical method Methods 0.000 description 17
- 238000005227 gel permeation chromatography Methods 0.000 description 16
- 239000002245 particle Substances 0.000 description 14
- 239000000243 solution Substances 0.000 description 14
- 238000002360 preparation method Methods 0.000 description 13
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 12
- 239000000126 substance Substances 0.000 description 12
- 238000005259 measurement Methods 0.000 description 11
- 229920000642 polymer Polymers 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- XLYOFNOQVPJJNP-ZSJDYOACSA-N Heavy water Chemical compound [2H]O[2H] XLYOFNOQVPJJNP-ZSJDYOACSA-N 0.000 description 10
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 238000002441 X-ray diffraction Methods 0.000 description 8
- 229910052799 carbon Inorganic materials 0.000 description 8
- 229940035081 venofer Drugs 0.000 description 8
- IEECXTSVVFWGSE-UHFFFAOYSA-M iron(3+);oxygen(2-);hydroxide Chemical compound [OH-].[O-2].[Fe+3] IEECXTSVVFWGSE-UHFFFAOYSA-M 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- 229920002307 Dextran Polymers 0.000 description 6
- 235000014633 carbohydrates Nutrition 0.000 description 6
- 150000001875 compounds Chemical class 0.000 description 6
- 238000002296 dynamic light scattering Methods 0.000 description 6
- 238000001157 Fourier transform infrared spectrum Methods 0.000 description 5
- 238000005481 NMR spectroscopy Methods 0.000 description 5
- 238000004364 calculation method Methods 0.000 description 5
- 238000009616 inductively coupled plasma Methods 0.000 description 5
- MVZXTUSAYBWAAM-UHFFFAOYSA-N iron;sulfuric acid Chemical compound [Fe].OS(O)(=O)=O MVZXTUSAYBWAAM-UHFFFAOYSA-N 0.000 description 5
- 238000002411 thermogravimetry Methods 0.000 description 5
- 238000003221 volumetric titration Methods 0.000 description 5
- 238000005160 1H NMR spectroscopy Methods 0.000 description 4
- VTLYFUHAOXGGBS-UHFFFAOYSA-N Fe3+ Chemical compound [Fe+3] VTLYFUHAOXGGBS-UHFFFAOYSA-N 0.000 description 4
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 4
- 102000002737 Heme Oxygenase-1 Human genes 0.000 description 4
- 108010018924 Heme Oxygenase-1 Proteins 0.000 description 4
- -1 Iron carbohydrate Chemical class 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 4
- 238000001990 intravenous administration Methods 0.000 description 4
- 229910021519 iron(III) oxide-hydroxide Inorganic materials 0.000 description 4
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 4
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 4
- 238000010926 purge Methods 0.000 description 4
- 238000012764 semi-quantitative analysis Methods 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 238000001228 spectrum Methods 0.000 description 4
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 238000003991 Rietveld refinement Methods 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 125000004429 atom Chemical group 0.000 description 3
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 3
- 239000013078 crystal Substances 0.000 description 3
- 238000000113 differential scanning calorimetry Methods 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 229940090044 injection Drugs 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000010253 intravenous injection Methods 0.000 description 3
- 230000005291 magnetic effect Effects 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 238000003921 particle size analysis Methods 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 239000003223 protective agent Substances 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 150000003384 small molecules Chemical class 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 239000008215 water for injection Substances 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- MFBBZTDYOYZJGB-HAONTEFVSA-L (2s,3s,4s,5r)-4-[(2r,3r,4r,5s,6r)-5-[(2r,3r,4r,5s,6r)-3,4-dihydroxy-6-(hydroxymethyl)-5-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-3,4-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-2,3,5,6-tetrahydroxyhexanoate;iron(3+);oxyg Chemical compound O.[OH-].[O-2].[Fe+3].O[C@@H]1[C@@H](O)[C@@H](O[C@@H]([C@H](O)CO)[C@@H](O)[C@H](O)C([O-])=O)O[C@H](CO)[C@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)[C@@H](CO)O1 MFBBZTDYOYZJGB-HAONTEFVSA-L 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- 102000008015 Hemeproteins Human genes 0.000 description 2
- 108010089792 Hemeproteins Proteins 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 206010022971 Iron Deficiencies Diseases 0.000 description 2
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N Iron oxide Chemical compound [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- CUPCBVUMRUSXIU-UHFFFAOYSA-N [Fe].OOO Chemical compound [Fe].OOO CUPCBVUMRUSXIU-UHFFFAOYSA-N 0.000 description 2
- 239000003463 adsorbent Substances 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 238000001636 atomic emission spectroscopy Methods 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 238000011088 calibration curve Methods 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 238000001938 differential scanning calorimetry curve Methods 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 229960004131 ferric carboxymaltose Drugs 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 229910052598 goethite Inorganic materials 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- AEIXRCIKZIZYPM-UHFFFAOYSA-M hydroxy(oxo)iron Chemical compound [O][Fe]O AEIXRCIKZIZYPM-UHFFFAOYSA-M 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 238000001095 inductively coupled plasma mass spectrometry Methods 0.000 description 2
- 229940090441 infed Drugs 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 150000002505 iron Chemical class 0.000 description 2
- 229940097452 iron sucrose injection Drugs 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 210000000865 mononuclear phagocyte system Anatomy 0.000 description 2
- 239000002086 nanomaterial Substances 0.000 description 2
- 239000002105 nanoparticle Substances 0.000 description 2
- 235000015097 nutrients Nutrition 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 238000004062 sedimentation Methods 0.000 description 2
- 238000001998 small-angle neutron scattering Methods 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 238000004611 spectroscopical analysis Methods 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 238000001757 thermogravimetry curve Methods 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 238000002054 transplantation Methods 0.000 description 2
- QJZYHAIUNVAGQP-UHFFFAOYSA-N 3-nitrobicyclo[2.2.1]hept-5-ene-2,3-dicarboxylic acid Chemical compound C1C2C=CC1C(C(=O)O)C2(C(O)=O)[N+]([O-])=O QJZYHAIUNVAGQP-UHFFFAOYSA-N 0.000 description 1
- 230000005653 Brownian motion process Effects 0.000 description 1
- 229910002588 FeOOH Inorganic materials 0.000 description 1
- 102000008857 Ferritin Human genes 0.000 description 1
- 108050000784 Ferritin Proteins 0.000 description 1
- 238000008416 Ferritin Methods 0.000 description 1
- HSRJKNPTNIJEKV-UHFFFAOYSA-N Guaifenesin Chemical compound COC1=CC=CC=C1OCC(O)CO HSRJKNPTNIJEKV-UHFFFAOYSA-N 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- 238000003070 Statistical process control Methods 0.000 description 1
- 102000004338 Transferrin Human genes 0.000 description 1
- 108090000901 Transferrin Proteins 0.000 description 1
- 229930003779 Vitamin B12 Natural products 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002730 additional effect Effects 0.000 description 1
- 238000004164 analytical calibration Methods 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 238000004630 atomic force microscopy Methods 0.000 description 1
- 238000005102 attenuated total reflection Methods 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 238000005537 brownian motion Methods 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 230000003139 buffering effect Effects 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- AGVAZMGAQJOSFJ-WZHZPDAFSA-M cobalt(2+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(1r,2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2 Chemical compound [Co+2].N#[C-].[N-]([C@@H]1[C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@@H](C)OP(O)(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O AGVAZMGAQJOSFJ-WZHZPDAFSA-M 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000002485 combustion reaction Methods 0.000 description 1
- 238000004320 controlled atmosphere Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229940109239 creatinine Drugs 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000004455 differential thermal analysis Methods 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000000921 elemental analysis Methods 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- MSNWSDPPULHLDL-UHFFFAOYSA-K ferric hydroxide Chemical group [OH-].[OH-].[OH-].[Fe+3] MSNWSDPPULHLDL-UHFFFAOYSA-K 0.000 description 1
- 229940042644 ferrlecit Drugs 0.000 description 1
- 229940102709 ferumoxytol Drugs 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 239000004021 humic acid Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- UCNNJGDEJXIUCC-UHFFFAOYSA-L hydroxy(oxo)iron;iron Chemical compound [Fe].O[Fe]=O.O[Fe]=O UCNNJGDEJXIUCC-UHFFFAOYSA-L 0.000 description 1
- 238000002354 inductively-coupled plasma atomic emission spectroscopy Methods 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 229940019742 injectafer Drugs 0.000 description 1
- 239000011256 inorganic filler Substances 0.000 description 1
- 229910003475 inorganic filler Inorganic materials 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- JEIPFZHSYJVQDO-UHFFFAOYSA-N iron(III) oxide Inorganic materials O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 230000031700 light absorption Effects 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 239000010445 mica Substances 0.000 description 1
- 229910052618 mica group Inorganic materials 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000004570 mortar (masonry) Substances 0.000 description 1
- 239000002707 nanocrystalline material Substances 0.000 description 1
- 230000036542 oxidative stress Effects 0.000 description 1
- 230000005298 paramagnetic effect Effects 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000005464 sample preparation method Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000009738 saturating Methods 0.000 description 1
- 229940062350 sodium ferric gluconate complex Drugs 0.000 description 1
- UDJMEHOEDIAPCK-UHFFFAOYSA-N sodium iron(2+) oxygen(2-) Chemical compound [O-2].[Fe+2].[Na+] UDJMEHOEDIAPCK-UHFFFAOYSA-N 0.000 description 1
- MQBDAEHWGRMADS-XNHLMZCASA-M sodium;(2r,3r,4s,5s,6r)-2-[(2s,3s,4s,5r)-3,4-dihydroxy-2,5-bis(hydroxymethyl)oxolan-2-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol;iron(3+);oxygen(2-);(2r,3s,4r,5r)-2,3,4,5,6-pentahydroxyhexanoate Chemical compound [O-2].[O-2].[O-2].[Na+].[Fe+3].[Fe+3].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O.O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1.O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1.O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1.O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1.O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 MQBDAEHWGRMADS-XNHLMZCASA-M 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000012306 spectroscopic technique Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 150000003445 sucroses Chemical class 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 238000005979 thermal decomposition reaction Methods 0.000 description 1
- 239000011573 trace mineral Substances 0.000 description 1
- 235000013619 trace mineral Nutrition 0.000 description 1
- 239000012581 transferrin Substances 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 239000011715 vitamin B12 Substances 0.000 description 1
- 235000019163 vitamin B12 Nutrition 0.000 description 1
- 238000000733 zeta-potential measurement Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H23/00—Compounds containing boron, silicon or a metal, e.g. chelates or vitamin B12
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/409—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil having four such rings, e.g. porphine derivatives, bilirubin, biliverdine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
- A61K33/26—Iron; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/08—Plasma substitutes; Perfusion solutions; Dialytics or haemodialytics; Drugs for electrolytic or acid-base disorders, e.g. hypovolemic shock
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Inorganic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Dermatology (AREA)
- Urology & Nephrology (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Gastroenterology & Hepatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
La presente invención implica una nueva composición acuosa de hierro. La composición acuosa de hierro incluye sacarosa y bicarbonato de hierro. La composición acuosa de hierro de la invención exhibe efectos protectores renales mejorados con respecto a las composiciones convencionales de hierro y sacarosa. (Traducción automática con Google Translate, sin valor legal)
Description
DESCRIPCIÓN
Composiciones de hierro novedosas y métodos para preparar y utilizar las mismas
Esta solicitud reivindica la prioridad a la solicitud provisional n°. 62/812.028, presentada el 28 de febrero de 2019, titulada Novel Iron Compositions and Methods of Marking and Using the Same.
Antecedentes de la invención
Los agentes de hierro intravenoso (IV) son coloides que consisten en nanopartículas de hierro-hidrato de carbono esferoidales como se muestra en la Figura 1. En el núcleo de cada partícula hay un gel de hierro-oxihidróxido y el núcleo está rodeado por una cáscara de hidrato de carbono que estabiliza el hierro-oxihidróxido (la función principal del ligando es estabilizar el complejo y protegerlo contra una mayor polinuclearización).
Los complejos de carbohidratos de hierro se comportan como profármacos, ya que el hierro debe liberarse del núcleo de hidróxido de hierro (III). Según el mecanismo propuesto, tras la administración, los complejos estables (Tipo 1) como la carboximaltosa férrica y el dextrano de hierro son captados por endocitosis por los macrófagos del sistema reticuloendotelial (RES). Véase Danielson, J. Structure, chemistry, and pharmacokinetics of intravenous iron agents. Am. Soc. Nephrol. 2004, 15, S93-S98.
En el caso de carbohidratos de hierro (III) menos estables (Tipo 2), pueden liberarse cantidades significativas de hierro lábil del complejo y provocar la saturación de transferrina y, por lo tanto, a cantidades significativas de hierro no ligado (NTBI), particularmente si se administran dosis altas. Este Fe3+ débilmente unido se absorbe fácilmente de una manera no regulada por las células y puede inducir estrés oxidativo. Evans, R.W.; Rafique, R.; Zarea, A.; Rapisarda, C.; Cammack, R.; Evans, P.J.; Porter, J.B.; Hider, R.C. Nature of non-transferrin-bound iron: studies on iron citrate complexes and the thalassemic era. J. Biol. Inorg. Chem. 2008, 13, 57-74.
Existen cinco tipos de productos inyectables de hierro-carbohidratos aprobados actualmente por la FDA (1) INFeD®/ Dexferum® (hierro dextrano), Ferahem® (ferumoxitol), Injectafer® (carboximaltosa férrico), Venofer® (sacarosa de hierro), Ferrlecit® (complejo de gluconato férrico de sodio). La sacarosa de hierro, comercializada con el nombre Venofer®, se formula como una suspensión coloidal que tiene un peso molecular (Mw) de aproximadamente 34.000 60.000 dáltones y una fórmula molecular de la siguiente manera:
donde n es el grado de polimerización de hierro y m es el número de moléculas de sacarosa (C.sub.12 H.sub.22 O.sub.11) en complejo con el núcleo de hierro polimerizado polinuclear:
Cada ml contiene 20 mg de hierro elemental como sacarosa de hierro en agua para inyección. El Venofador® está disponible en viales de dosis única de 5 ml (100 mg de hierro elemental por 5 ml) y viales de dosis única de 10 ml (200 mg de hierro elemental por 10 ml). El producto farmacéutico contiene aproximadamente 30 % de sacarosa p/v (300 mg/ml) y tiene un pH de 10,5-11,1. El producto no contiene conservantes. La osmolaridad de la inyección es de 1.250 mOsmol/l.
Los métodos para sintetizar carbohidratos de hierro se describen en la patente WO 97/11711 (1997) por Lawrence y col., que describen composiciones de oxihidróxido-dextrano fermentadas para tratar la deficiencia de hierro que tiene partículas elipsoidales con un rango de peso molecular preferido de aproximadamente 250.000 a 300.000 dáltones. Recientemente, se ha utilizado hierro sacarosa en combinación con protoporfirina de estaño (SnPP) para inducir la citorresistencia adquirida sin causar lesiones en el órgano. Véase la patente US- 9.844.563 de Zager y col. Los presentes inventores han descubierto la necesidad de una formulación de sacarosa de hierro que pueda combinarse fácilmente con protoporfirina de estaño (SnPP), que sea estable y pueda inyectarse en un paciente para tratar la deficiencia de hierro o por sus efectos protectores renales, ya sea sola o en combinación con otro agente como la SnPP.
La patente alemana número DE862482 describe un proceso para preparar soluciones inyectables estables de sal de hierro trivalente. La publicación de solicitud de patente de Estados Unidos número US-2005/309187 describe un proceso para preparar un complejo de sacarosa de hierro, sustancialmente libre de excipientes, para proporcionar un complejo de sacarosa de hierro coprecipitado con sacarosa, y para proporcionar complejos de sacarosa de hierro en solución acuosa. La patente alemana número DE19547356 describe un adsorbente para fosfato de un medio acuoso, en particular para fosfato inorgánico o unido a nutrientes de fluidos corporales o nutrientes. El adsorbente contiene hidróxido de beta-hierro polinuclear estabilizado por carbohidratos y/o ácido húmico. El número de publicación PCT de la patente WO2018148217A1 describe composiciones, kits y métodos para proteger a los órganos mediante la inducción de la citorresistencia adquirida sin causar lesiones en el órgano. Las composiciones,
kits y métodos utilizan complejos de Me-porfirina, proteínas hemo, moléculas que contienen hierro y/o vitamina B12 y, opcionalmente, agentes que inciden en el metabolismo de las proteínas hemo.
Resumen de la invención
La descripción se refiere a composiciones acuosas de sacarosa de hierro que tienen propiedades deseables. En un aspecto de la descripción, la composición acuosa de sacarosa de iones comprende sacarosa de hierro y bicarbonato. En un aspecto, la invención se refiere a una composición farmacéutica de hierro acuosa que comprende: sacarosa; bicarbonato; y un portador acuoso farmacéuticamente aceptable. En otro aspecto, la invención se refiere a una composición de hierro acuosa que comprende sacarosa de hierro y bicarbonato para usar en un método para la prevención o el tratamiento de una enfermedad o trastorno renal que comprende administrar por vía intravenosa una composición de hierro acuosa en una cantidad terapéuticamente eficaz, en donde la composición de hierro acuosa comprende sacarosa de hierro y bicarbonato.
Descripción de las figuras
La Figura 1 muestra la estructura de un carbohidrato de hierro.
La Figura 2 es una transferencia Western de riñón a las 18 horas después de la administración de composiciones acuosas de hierro.
La Figura 3 muestra cromatogramas de GPC de tres preparaciones S1.
La Figura 4 muestra una vista ampliada de la Figura 3.
La Figura 5 muestra cromatogramas de GPC de tres preparaciones S1.
La Figura 6 muestra una vista ampliada de la Figura 5.
La Figura 7 muestra cromatogramas de GPC de tres preparaciones S1.
La Figura 8 muestra una vista ampliada de la Figura 7
La Figura 9 muestra una comparación de GPC para S1, S2 y S3.
La Figura 10 muestra una vista superior y lateral de AFM para S1.
La Figura 11 muestra el análisis de tamaño de partículas S1 en la ubicación 1.
La Figura 12 muestra el análisis de sección manual S1 de tres partículas.
La Figura 13 muestra los espectros de FTIR de S1 y la mejor coincid lean bciibalioteca, d lea sacarosa.
La Figura 14 muestra los espectros de FTIR de S2 y la mejor coincid lean bciibalioteca, d lea sacarosa.
La Figura 15 muestra los espectros de FTIR de S3 y la mejor coincid lean bciibalioteca, de l dextrano.
La Figura 16 muestra los espectros de RMN 1H de la preparación S1 1
La Figura 17 muestra los espectros de RMN 1H de la preparación S21
La Figura 18 muestra los espectros de RMN 1H de la preparación S31
La Figura 19 muestra los espectros de RMN 13C de la preparación S1 1
La Figura 20 muestra los espectros de RMN 13C de la preparación S2 1
La Figura 21 muestra los espectros de RMN 13C de la preparación S3 1
La Figura 22 muestra la comparación de datos sin procesar para las tres muestras (liofilizadas)
La Figura 23 muestra la superposición de desplazamiento de los datos de las tres muestras (dos repeticiones para S3)
La Figura 24 muestra el termograma de TGA de S1, S2 y S3 en condiciones de purga de nitrógeno.
La Figura 25 muestra termogramas de DSC de S1, S2 y S3.
Descripción detallada de la invención
En un aspecto, la presente descripción implica una composición acuosa de sacarosa de hierro (FeS) y bicarbonato (FeS-bicarbonato). Los presentes inventores han descubierto que esta composición tiene propiedades beneficiosas. En un aspecto, la composición de FeS-bicarbonato de la presente descripción puede utilizarse como un agente protector renal. Los inventores han descubierto que la composición de FeS-bicarbonato según aspectos de la descripción se absorbe preferiblemente en el riñón en comparación con las formas disponibles comercialmente de FeS. Además, los inventores han descubierto que FeS-bicarbonato da como resultado una regulación positiva preferencial de la(s) molécula(s) protectora(s) del riñón en relación con el FeS solo. En otro aspecto, la composición de FeS-bicarbonato de la presente descripción puede combinarse de forma ventajosa con otros agentes protectores renales tales como la protoporfirina de estaño (SnPP) para formar fácilmente agentes protectores renales inyectables.
Una ventaja de utilizar el FeS-bicarbonato es que esta composición da como resultado efectos de protección renal elevados. Específicamente, los inventores encontraron que FeS-bicarbonato se reguló de forma preferencial por las moléculas protectoras renales con respecto a FeS solo. Sin pretender imponer ninguna teoría, los presentes inventores han propuesto que el bicarbonato añadido al FeS puede alterar los niveles relativos de Fe (lll) y Fe (ll) presentes. Debido al enrojecimiento observado en el producto FeS-bicarbonato, los inventores han propuesto que las composiciones de la descripción pueden incluir niveles elevados de Fe (ll). Esto podría explicar los efectos protectores renales elevados, dada la mayor reactividad de Fe (ll) con respecto a Fe (lll).
Una ventaja de utilizar el FeS-bicarbonato es que el bicarbonato tiene un efecto tamponador. Cuando se utiliza una composición de protoporfirina de estaño, esto puede ser ventajoso, ya que la SnPP se almacena mejor a pH bajo para evitar la dimerización no deseada durante el almacenamiento. Según la presente descripción, la composición de SnPP puede combinarse con la composición de FeS-bicarb en una relación inferior que o igual a aproximadamente 1:1 SnPP:FeS, tal como aproximadamente 1:2, aproximadamente 1:4, aproximadamente 1:8, aproximadamente 1:10, aproximadamente 1:20, aproximadamente 1:50, aproximadamente 1:100, aproximadamente 1:1000, aproximadamente 1:10.000, aproximadamente 1:100.000, aproximadamente 1:1.000.000.
En un aspecto, la composición tiene un peso molecular medido mediante la utilización de GPC como se describe en el Ejemplo 1. El PM está preferiblemente dentro del rango de entre 25.000 y 35.000 dáltones, más preferiblemente entre 28.000 y 32.000 dáltones, y con máxima preferencia aproximadamente 29.000 dáltones. El PM está preferiblemente dentro del rango de entre 25.000 y 45.000 dáltones, más preferiblemente entre 30.000 y 40.000 dáltones, aún más preferiblemente entre 33.000 y 38.000 dáltones, y con máxima preferencia aproximadamente 34.000 dáltones. La M está preferiblemente dentro del rango de entre 15.000 y 30.000 dáltones, más preferiblemente entre 20.000 y 25.000 dáltones, y con máxima preferencia aproximadamente 24.000 dáltones. La polidispersidad (PDI) está preferiblemente dentro del rango de 1,35 a 1,60, más preferiblemente dentro del rango de 1,38 a 1,5, aún más preferiblemente dentro del rango de 1,40 a 1,48, y con máxima preferencia aproximadamente 1,4.
En un aspecto, la composición tiene un potencial zeta estable de -3,0 mV o menos, más preferiblemente -7,0 mV o menos, y con máxima preferencia aproximadamente -10mV. En un aspecto, la composición tiene un carbono orgánico total inferior a 8,5 %, preferiblemente inferior a 8,0 % y, con máxima preferencia, aproximadamente 7,7 %. En un aspecto, la osmolalidad medida según el Ejemplo 1 está dentro del rango de 550 a 1600 m0sm/kg, dentro del rango de 1500 a 1580 mOsm/kg, y con máxima preferencia aproximadamente 1540 m0sm/kg.
Cualquier ejemplo que quede fuera del alcance de las reivindicaciones se proporciona únicamente con fines comparativos.
Ejemplo 1
La presente descripción implica una composición que se prepara disolviendo suficiente complejo de sacarosa de hierro en agua (aproximadamente 3,5 l) para dar una solución de 12 mg/ml (expresada como hierro) cuando se diluye a 6,0 l. La cantidad de sacarosa de hierro necesaria se calculó para el volumen final de líquido, 6100 ml (6,1 l) de modo que la concentración final es 12 mg/ml. Esto requiere 73,2 g de hierro. La potencia de utilización de la sacarosa de hierro es 0,0550. Por lo tanto, se necesita 73,2 g/0,0550 o 1331 g ±1 g de sacarosa de hierro. Se pesó sacarosa de hierro, 1331 g ±1 g directamente en un matraz Erlenmeyer de 6,0 l. Aproximadamente 3-3,5 l de agua se añaden al frasco Erlenmeyer, y el contenido del frasco se agita.
Se añade bicarbonato de sodio en una cantidad tal que la concentración final de bicarbonato de sodio es 10 mg/ml cuando se diluye a 6,0 l. Se pesa bicarbonato de sodio, 109,8 ± 0,1 g, y se añade al frasco de 6,0 l.
Se añade cloruro de sodio en una cantidad tal que la concentración final de cloruro de sodio es de 9,0 mg/ml tras la dilución. Se pesa cloruro de sodio, 54,9 ± 0,1, y se añade al frasco de 6,0 l. La suspensión se agita durante 30-120 minutos para dar una solución opaca negra.
El pH de la solución se controla con un medidor de pH mientras se añade hidróxido de sodio 1M en pequeñas porciones hasta que se alcanza el pH 10,30 y permanece estable. Se añadió hidróxido de sodio, 40,0 ± 0,1 g, a un frasco Erlenmeyer de 1,0 l. Se añade 1,0 ± 0,1 l de agua al frasco Erlenmeyer de 1,0 l y se agita hasta que se disuelve todo el hidróxido de sodio. Se fija una sonda de pH para controlar el pH del frasco Erlenmeyer de 6,0 l y se añade el hidróxido de sodio en<porciones de 100 ml hasta el pH = 10,3 ± 0,1. Después, la solución se agita durante 10 minutos. El pH se comprueba de nuevo transcurridos 10 minutos y, si es necesario, se ajusta a un pH = 10,3 ± 0,1.
Después, la solución se transfiere a un frasco preciso volumétricamente y se diluye a 6,1 l con agua. Se utiliza un frasco volumétrico de 2 l dos veces para transferir exactamente 4 l de la solución de pH 10,3 a un frasco Erlenmeyer de 6 l. La solución restante de pH de 10,3 se diluye a 2 l en un frasco volumétrico y se añade al frasco Erlenmeyer de 6 l. Se utiliza el cilindro graduado de 100 ml para añadir 100 ±0,1 ml al frasco Erlenmeyer de 6,0 l, y la solución resultante se agita durante 10 minutos.
La solución de producto resultante parece de rojo oscuro a marrón. Dos isótopos de hierro están presentes en la preparación de la muestra en una relación consistente con la de la preparación estándar. El material resultante tenía un pH de 10,3, que está dentro de los límites preferidos de 10,1-10,4. El material resultante tenía 11,5/11,6 partes por mil (mg/ml) de hierro según SOP 174472, que determina el hierro a través de espectroscopía de masas con plasma acoplado inductivamente.
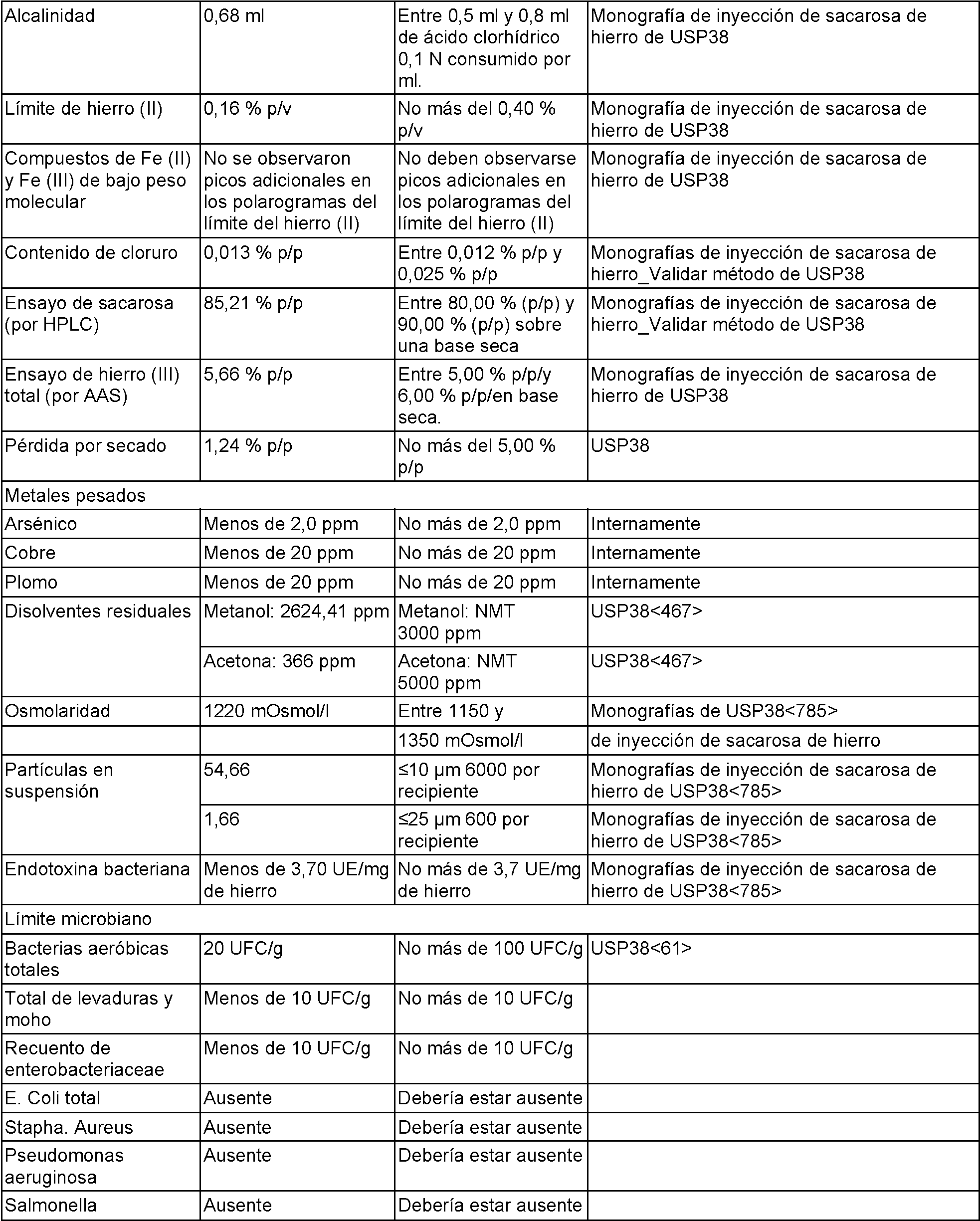
Las propiedades adicionales de la composición resultante se encuentran en la Tabla 1 a continuación:
(continuación)
La composición de FeS-bicarbonato resultante tiene la siguiente estequiometría y constantes físicas se muestran en la Tabla 2 a continuación:
Ejemplo 2
La administración intravenosa de la composición de bicarbonato de hierro de hierro (FeS) del Ejemplo 1 se realizó durante 4 horas y dio como resultado una elevada hemo oxigenasa renal 1 (HO-1) en relación con la composición de sacarosa de hierro (FeS) comercializada con la marca, Venofer®. Los resultados se muestran en la Tabla 3 a continuación.
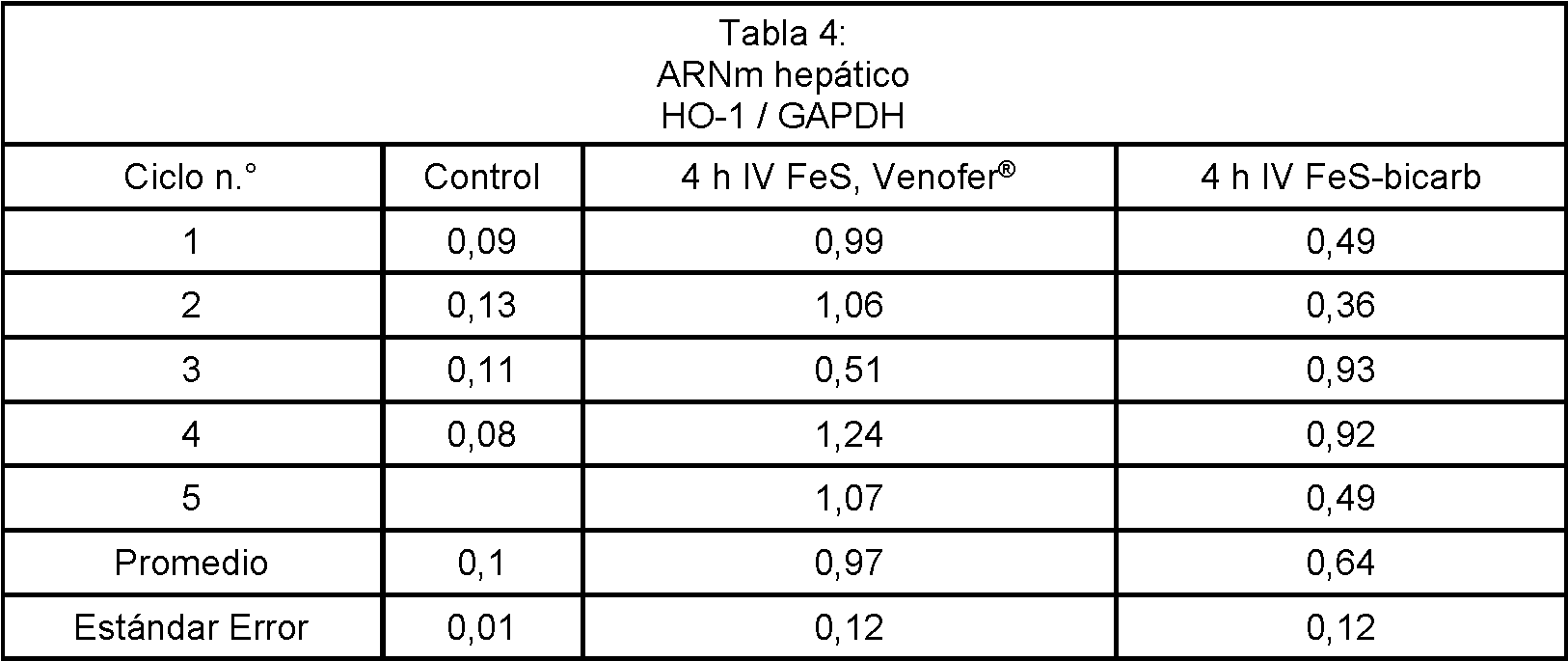
El nivel elevado de HO-1 observado en el riñón no se observó en el hígado. En cambio, no se observó que el nivel de HO-1 aumentara para el FeS-bicarbonato en relación con lo que se observó para Venofer®. Los resultados se muestran en la Tabla 4 a continuación.
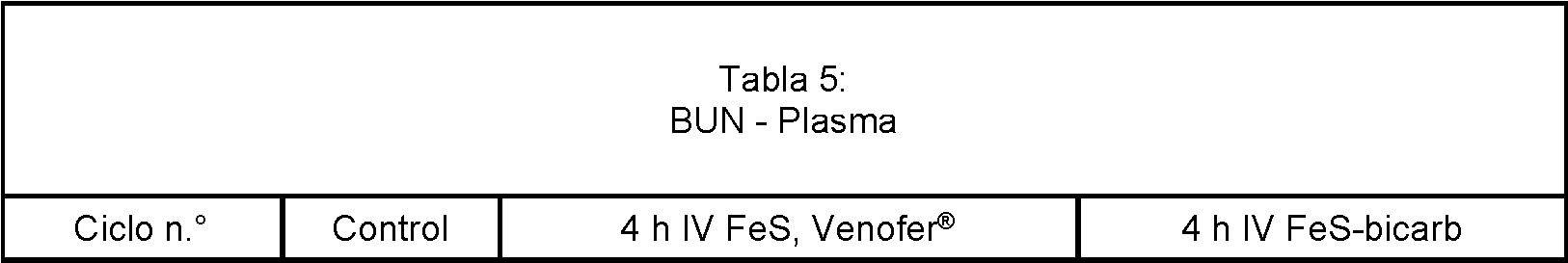
El BUN y la creatinina en plasma fueron similares para FeS, Venofer® y FeS-bicarbonato como se muestra en las Tablas 5 y 6 más a continuación.
Ejemplo 3
La composición de FeS-bicarbonato del Ejemplo 1 se filtró y se colocó en un vial y tenía una concentración de FeS de 12 mg/ml (CoreRx, lote n.° 111002-18011). La osmolaridad de esta solución de 12 mg/ml fue de 831 mOsm. Para la inyección de sacarosa de 20 mg/ml de Venofer®, American Regent, Lote núm. 8243A, la osmolaridad fue de 1742 mOsm. Estas mediciones de osmolaridad se realizaron sin dilución.
Ejemplo 4
En la Figura 2 y la Tabla 7 se muestra una transferencia Western de riñón a las 18 horas después de la administración de composiciones acuosas de hierro:
Tabla 7
(continuación)
A la izquierda, hay una transferencia Western específica de cadena pesada de riñón a las 18 h después de SnPP, FeS (Venofer) o Fe+ SnPP. N = control normal. Glyc es glicerol, utilizado como control de ferritina de cadena H positiva. N= muestras normales (controles). Como es evidente, el Fe induce un aumento de la cadena pesada en el riñón.
Ejemplo 5
Un paciente que padece enfermedad renal crónica se trata mediante inyección intravenosa utilizando la composición de hierro acuosa de sacarosa de hierro y bicarbonato del ejemplo 1.
Ejemplo 6
Un paciente sometido a trasplante de órganos se trata mediante inyección intravenosa utilizando la composición de hierro acuosa de sacarosa de hierro y bicarbonato del ejemplo 1.
Ejemplo 7
Un paciente sometido A trasplante de órganos se trata mediante inyección intravenosa utilizando la composición de hierro acuosa de sacarosa de hierro y bicarbonato del ejemplo 1, en combinación con protoporfirina de estaño. Ejemplo 8
Se caracterizaron tres muestras de hierro-sacarosa (S1, S2) e hierro-dextrano (S3) mediante una variedad de técnicas analíticas. S1 se preparó según el Ejemplo 1 anterior. S2 es el producto disponible comercialmente, Venofer® (inyección de sacarosa de hierro). S3 es el producto disponible comercialmente INFeD® (Inyección de dextrano de hierro). Los resultados se resumen en la Tabla 8 a continuación.
connuac n
Finalmente, la muestra recibida S1 se tituló por triplicado con HCl diluido para determinar el valor de hidróxido en solución inyectable de hierro-sacarosa. Los puntos finales de las valoraciones volumétricas tuvieron pH = 7,0. Partiendo del supuesto de que todas las especies básicas valoradas volumétricamente procedían del hidróxido asociado a los núcleos de oxihidróxido férrico, se supuso que el número total de moles de H+ utilizados en la valoración volumétrica era igual al número de moles de OH-. Considerando el TOC, y el PM (o M) por GPC, la fórmula molecular de la sacarosa de hierro en S1 se calculó como sigue:
Cálculo basado en PM: [Na6Fe5O8(OH)5 ■ 3H2O]13 ■ 73(C12H22O11) Cálculo basado en Mn: [Na6Fe5O8(OH)5 ■ 3H2O]9 ■ 51(C12H22Oll). La Tabla 9 a continuación muestra detalles de la preparación e identificación de muestras.
Preparación de muestras: Las muestras se liofilizaron hasta un residuo seco antes del análisis a menos que se indique lo contrario.
Cromatografía de permeación en Gel (GPC): LA GPC se utiliza para determinar la distribución de peso molecular de los polímeros. En el análisis de GPC, una solución del polímero se pasa a través de una columna compactada con un gel poroso. La muestra se separa en función del tamaño molecular con moléculas más grandes que eluyen más rápidamente que las moléculas más pequeñas. El tiempo de retención de cada componente se detecta y se
compara con una curva de calibración, y los datos resultantes se usan entonces para calcular la distribución de peso molecular para la muestra.
Una distribución de pesos moleculares en lugar de un peso molecular único es característica de todos los tipos de polímeros sintéticos. Para caracterizar esta distribución, se utilizan promedios estadísticos. El más común de estos promedios es el “ peso molecular promedio en número” (M) y el “ peso molecular promedio en peso” (PM).
El peso molecular promedio en número es similar a la media aritmética estándar asociada a un grupo de números. Cuando se aplica a polímeros, el peso molecular promedio en número se refiere al peso molecular promedio de las moléculas en el polímero. El peso molecular promedio en número se establece dando la misma cantidad de significancia a cada molécula independientemente de su peso molecular individual. El peso molecular promedio en número se establece mediante la siguiente fórmula donde Ni es el número de moléculas con una masa molar igual a Mi.
Un cálculo ligeramente diferente y un significado mucho diferente es el peso molecular promedio en peso, PM. El peso molecular promedio en peso es otro descriptor estadístico de la distribución de peso molecular que proporciona más importancia a las moléculas más grandes que a las moléculas más pequeñas de la distribución. La siguiente fórmula muestra el cálculo estadístico del peso molecular promedio en peso.
Para GPC, las muestras se prepararon diluyendo en tampón fosfato (según el método de la monografía de la USP) y se analizaron para determinar las distribuciones de peso molecular en cada muestra. Los resultados se resumen a continuación en las Tablas 10-12. Los cromatogramas representativos del análisis se presentan en las Figuras 3-9. Existen dos razones generales para el peso molecular promedio en peso. En primer lugar, si se compara, por ejemplo, la tenacidad, las moléculas más largas influyen en la tenacidad de la distribución del polímero más de las moléculas más cortas realizadas. El cálculo del peso molecular promedio en peso da énfasis a estas moléculas más largas, y proporciona un número comparativo que puede describir la contribución relativa de las moléculas largas presentes en una distribución de peso molecular. El peso molecular promedio en peso también es un número que está directamente correlacionado con la determinación del peso molecular de los polímeros mediante dispersión de luz, dispersión de neutrones de ángulo pequeño (SANS) y velocidad de sedimentación.
En segundo lugar, el peso molecular promedio en peso proporciona información de la forma de una distribución de peso molecular. Este valor, en relación con el peso molecular promedio en número, proporciona una determinación de la relación de la ampliación de la distribución de peso molecular denominada como el índice de polidispersidad o PI. El PI se define como la relación de PM/M. Cuanto mayor sea el PI, más dispersa es la distribución. El valor más bajo de PI puede ser 1. Esto representa una muestra monodispersa, un polímero con todas las moléculas en la distribución que es el mismo peso molecular.
El “ peso molecular promedio z” (Mz) no es tan común, pero también se proporciona. Este promedio del peso molecular es un valor que describe aún más la distribución del peso molecular. Este valor puede determinarse fácilmente a partir del equilibrio de sedimentación.
También se incluye a veces el peso molecular máximo, Mp. El valor del peso molecular máximo se define como el modo de distribución del peso molecular. Indica el peso molecular que es más abundante en la distribución. Este valor también proporciona información de la distribución del peso molecular.
La mayoría de las mediciones de GPC se realizan en relación con un patrón de polímero diferente (normalmente poliestireno). La precisión de los resultados depende de lo estrechamente que las características del polímero que se analizan coincidan con las de la norma usada. El error esperado en reproducibilidad entre diferentes series de determinaciones, calibrado por separado, es aproximadamente un 5-10 % y es característico de la precisión limitada de las determinaciones de GPC. Por lo tanto, los resultados de GPC son más útiles cuando se realiza una comparación entre la distribución de peso molecular de diferentes muestras durante la misma serie de determinaciones.
Las precisiones y sesgo de GPC se basan en datos estadísticos tales como un promedio de mediciones, desviación estándar, diferencia de porcentaje relativa y/o porcentaje de desviación estándar relativa. Para los análisis cuantitativos, las cantidades enumeradas en las tablas anteriores se referenciaron a una cantidad conocida de estándar y son cuantitativas. Se prepararon curvas de calibración y se hace referencia a la desviación estándar relativa y la información de diferencia porcentual relativa en el informe anterior. Para la reproducibilidad típica semicuantitativa, según lo determinado por el control del proceso estadístico del sistema de medición se estima en aproximadamente el 10 % (con un nivel de confianza del 95 %, k ~2). Esta reproducibilidad es una estimación de la incertidumbre de una única medición estándar a lo largo del tiempo, y la incertidumbre en una medición específica debe determinarse caso por caso. Para los análisis cualitativos, los estándares de referencia analítica no se analizaron para confirmar la presencia de los componentes individuales. En tales casos, no es posible asignar un valor numérico a la “ incertidumbre” de las coincidencias proporcionadas.
Obsérvese que las muestras S1 y S2 contenían dos picos con distribuciones de peso molecular únicas mientras que la muestra S3 contenía tres picos. Obsérvese también que un Mp no pudo calcularse para el “ Pico 2” (pico de molécula pequeña, probablemente sacarosa) porque el pico saturó el detector; las muestras se analizaron a una concentración que fue apropiada para la caracterización de las especies de mayor peso molecular, con el gasto de saturación del detector con las especies de menor peso molecular de menor interés.
connuac n
Dispersión dinámica de la luz
El análisis PSD se realizó con un difractar láser. La medición calcula una distribución de volumen a partir del patrón de difracción láser de una nube de partículas. A continuación, estos datos de dispersión sin procesar se procesan con un algoritmo y se presentan sobre la base del diámetro esférico equivalente. Los resultados se han resumido en una base de volumen (masa) en un histograma que proporciona el porcentaje de volumen diferencial menor y mayor que el tamaño indicado.
El análisis del tamaño de las partículas se realizó en un instrumento de dispersión dinámica de la luz (DLS) Malvern® Zetasizer Nano ZS. d Ls es una técnica de conjunto que analiza la luz dispersada por partículas que se mueven en movimiento browniano y genera una distribución de tamaño de partícula basada en la velocidad de difusión de la partícula. Los datos de dispersión sin procesar se procesan utilizando un algoritmo complejo y se presentan sobre la base de un diámetro hidrodinámico ponderado por intensidad. La técnica analítica se resume en la ISO 22412:2008 Particle Size Analysis - Dynamic Light Scattering (DLS), así como en la ASTM E2490-09(2015) Standard Guide for Measurement of Particle Size Distribution of Nanomaterials in Suspension by Photon Correlation Spectroscopy (PCS).
Las muestras recibidas fueron agua para inyección (WFI) y se analizaron mediante DLS para dar la dimensión física global de las partículas. Los resultados ponderados de intensidad y volumen del análisis se presentan en la Tabla 13 y la Tabla 14, respectivamente.
Potencial zeta
Las muestras se prepararon para el potencial zeta mediante dilución en tampón (el instrumento no pudo lograr lecturas estables cuando se diluyó en NaCl 10 nm por nanomateriales 2018, 8, 25). El pH y la temperatura se registraron en el momento del análisis de potencial zeta. Los resultados se resumen de la Tabla 6 a la Tabla 8 a continuación. No se pudo obtener una lectura estable de S2. Los resultados del ensayo de potencial zeta se presentan en las Tablas 15-17.
Microscopía de fuerza atómica (afm)
Las muestras tal como se recibieron se diluyeron 50x utilizando agua filtrada MilliQ (18,2 MQ/cm, 4ppb T0C). Aproximadamente 10 j l de estas soluciones diluidas se depositaron sobre piezas recién cortadas de mica y se dejaron incubar durante aproximadamente un minuto. A continuación, las muestras se enjuagaron 5x con agua MilliQ y se secaron con nitrógeno. Se obtuvieron imágenes de dos áreas de 1 jm x 1 jm en cada muestra. Las diferencias topográficas de estas imágenes se presentan en colores donde el color marrón es bajo y el blanco es alto. Los rangos z se indican en la barra de escala vertical a la derecha de las imágenes. También se incluyen vistas en perspectiva (3-D) de estas superficies con exageraciones verticales señaladas en los pies de foto.
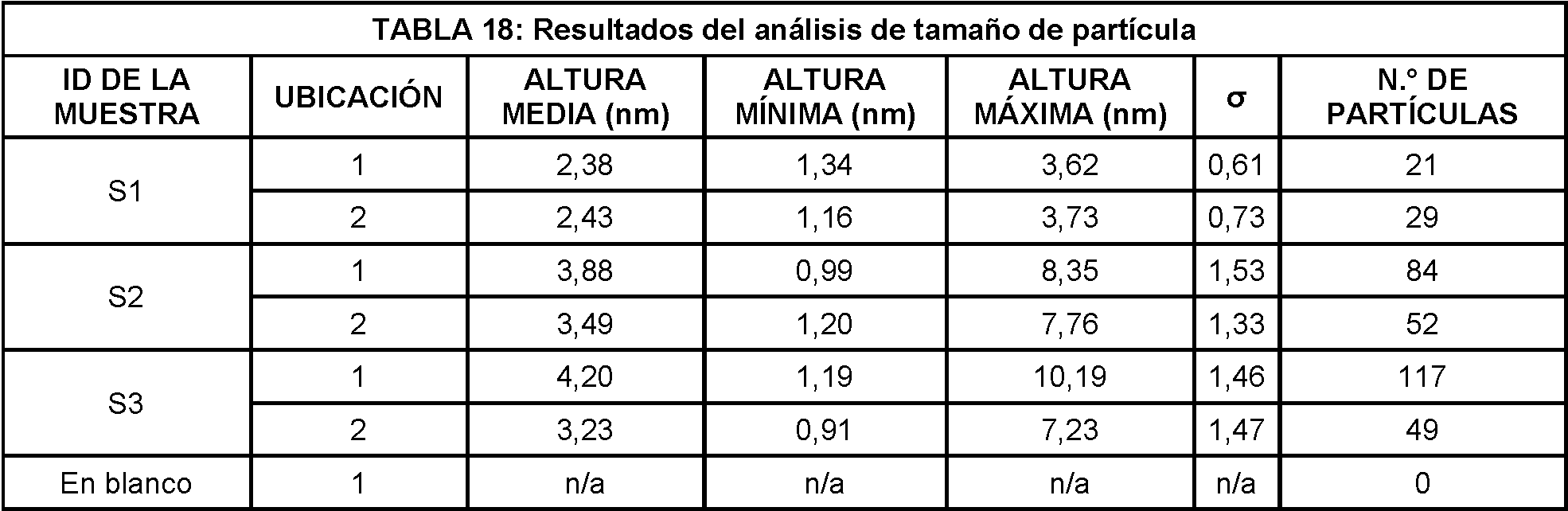
Se realizaron análisis del tamaño de partícula para caracterizar las alturas de las partículas presentes dentro de cada área. Se utilizó un umbral de altura de 0,5 nm para identificar las partículas de interés mientras se excluye las características no representativas. La altura máxima, la altura mínima y los resultados de la altura media se resumen en la Tabla 18.
Se realizaron análisis de sección para medir manualmente las alturas de las partículas representativas. El análisis seccional para S1 en la ubicación 1 se muestra en las Figuras 10, 11 y 12. Los resultados se resumen en la Tabla 19 para cada uno de S1, S2, un S3.
Carbón orgánico total (toc)
El carbono orgánico total (TOC) en las muestras se calculó restando el carbono inorgánico del carbono total (determinado mediante la utilización del analizador de carbono de combustión). Los resultados se resumen en la Tabla 20 a continuación.
Osmolalidad
La osmolalidad de las muestras se midió utilizando el método de presión de vapor. El método de presión de vapor determina la osmolalidad a temperatura ambiente con la muestra en equilibrio natural. Los resultados de la prueba de osmolalidad se resumen en la Tabla 21.
Fe+3 vs. Fe+2
Una alícuota de cada muestra se diluyó en ácido clorhídrico concentrado según la referencia del método proporcionada por el cliente, Gupta y col.1 Las muestras se analizaron según el método descrito por Stookey.2 Los resultados se muestran en la Tabla 22.
Análisis elemental por espectrometría de masas/plasma acoplado inductivamente (icp/ms) y contenido total de hierro y sodio por espectroscopia de emisión óptica/plasma acoplado inductivamente (icp/oes)
ICP/OES es una técnica espectroscópica utilizada para identificar y cuantificar componentes por elementos. En ICP, el acoplamiento inductivo transfiere energía de alta frecuencia a un flujo de gas inerte, que contiene la muestra como aerosol. La energía hace que el aerosol se vaporice, mientras que excita los átomos libres resultantes para que emitan luz. La intensidad de esta luz se relaciona entonces con la concentración de los átomos emisores. Esta técnica requiere la calibración del instrumento y una verificación de calibración de segunda fuente antes, durante y después de la finalización de la secuencia de ejecución analítica. Además, los instrumentos en blanco siguen cada estándar de verificación. Esto asegura que no se lleve a cabo durante la secuencia analítica. Las mediciones de concentración de los elementos principales realizados por ICP tienen una incertidumbre típicamente en el intervalo del 3 al 5 % (con un nivel de confianza del 95 %). La incertidumbre en las concentraciones de oligoelementos podría ser significativamente mayor.
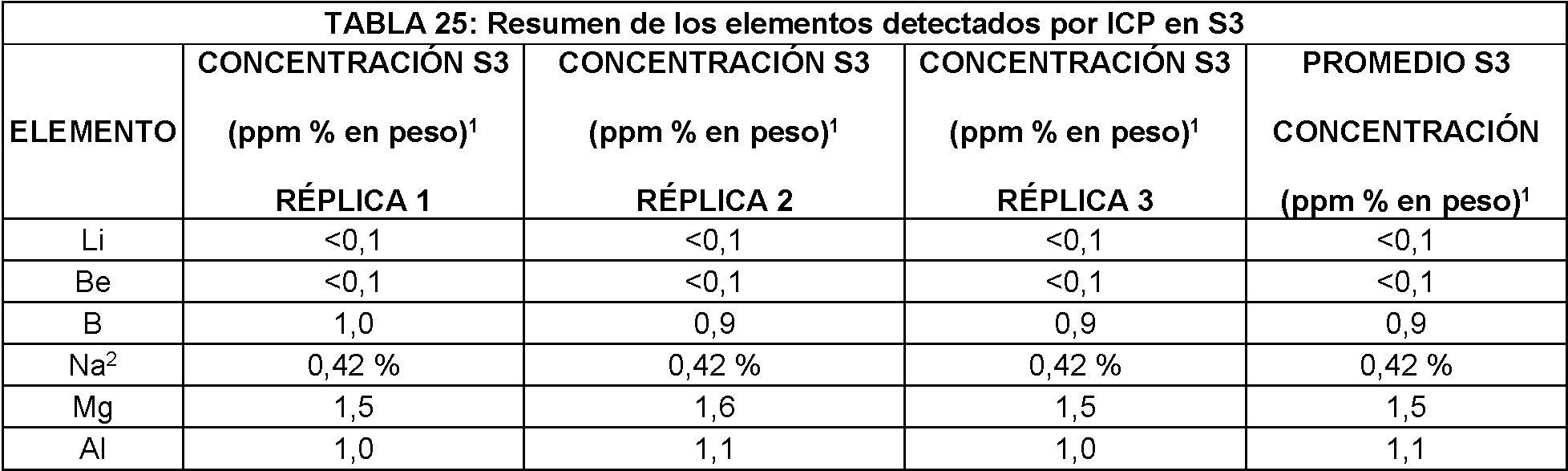
Las muestras S1 a S3 se analizaron mediante ICP-MS para metales y/u otros elementos. Las muestras también se analizaron por ICP-OES para determinar el contenido total de hierro y sodio. Las muestras se analizaron tal como se recibieron por triplicado. Los resultados se resumen en las Tablas 23-25.
Espectroscopia infrarroja por transformada de fourier (ft-ir)
La espectroscopía infrarroja por transformada de Fourier (FT-IR) es una herramienta de elección para la identificación de materiales. En FT-IR, las bandas de absorción de infrarrojos se asignan a grupos funcionales característicos. Basándose en la presencia de varias de tales bandas, puede identificarse el material en cuestión. La disponibilidad de espectros de compuestos conocidos aumenta la probabilidad de realizar una identificación positiva. Las muestras liofilizadas se analizaron mediante reflectancia total atenuada horizontal (HATR), basada en la reflexión interna de la radiación infrarroja (IR). El espectro FT-IR de S1 con una coincidencia espectral de biblioteca se presenta en la Figura 13 a continuación. Los datos sugieren que el material es consistente con la sacarosa. Los espectros de FT-IR de S2 y S3 se presentan en la Figura 14 y la Figura 15. La asignación de la absorción frente a los grupos funcionales se muestra en la Tabla 26 -Tabla 28.
Espectroscopia de resonancia magnética nuclear 1h (rmn)
La espectroscopia de RMN es un método extremadamente útil para la caracterización de materiales. La RMN es un fenómeno físico basado en la propiedad magnética del núcleo de un átomo. La RMN estudia un núcleo magnético (normalmente el de un átomo de hidrógeno), alineándolo con un campo magnético externo muy potente y perturbando esta alineación mediante un impulso electromagnético. Se registra la respuesta a la perturbación, proporcionando cada núcleo individual una respuesta específica a su entorno químico, electrónico y espacial.
Las muestras liofilizadas se reconstituyeron en óxido de deuterio (D2O) y se analizaron mediante espectroscopía de RMN 1H.
La estructura para sacarosa se muestra anteriormente con la anotación de hidrógeno de la Fórmula (I). La RMN 1H para S1 se muestra en la Tabla 29 a continuación:
Formula (II)
La estructura del dextrano se muestra más arriba con la anotación de hidrógeno de la Fórmula (II). La siguiente Tabla 30 muestra la RMN 1H para S3.
Los espectros de RMN de las muestras preparadas se presentan en las Figuras 16-18. Cuando sea posible, las asignaciones provisionales de los principales desplazamientos químicos observados en los espectros de RMN se basaron en los espectros de referencia de los compuestos relacionados disponibles en la bibliografía.
Los datos indican que la sacarosa está presente en la muestra S1, y los desplazamientos químicos coinciden bien con los informados en la bibliografía. Sin embargo, no se observaron patrones de división de pico, que podrían deberse a múltiples razones tales como la presencia de nanopartículas o el propio hierro paramagnético.
Los espectros de RMN 1H para la muestra S2 muestran una cantidad significativa de ensanchamiento de los picos. Se desconoce si esto se debe a partículas que crean un mayor número de entornos químicos, o si la naturaleza del hierro en la muestra podría ser responsable de la falta de resolución. Debido a la extensión del ensanchamiento, no se podrían realizar asignaciones de picos. Sin embargo, las intensidades de pico generales y los desplazamientos químicos son consistentes con los observados para sacarosa, ya que se observó una gran respuesta amplia a partir del cambio químico 2,5-4,2 ppm, con un ligero hombro visible en el pico de disolvente cerca de 5,5 ppm.
Espectroscopía de resonancia magnética nuclear 13c (rmn)
Las muestras liofilizadas se reconstituyeron en óxido de deuterio (D2O) y se analizaron mediante espectroscopía de RMN 13C.
Los resultados se resumen en las Tablas 28-30. Los espectros de RMN de las muestras preparadas se presentan en las Figuras 19-21. Cuando sea posible, las asignaciones provisionales de los principales desplazamientos químicos observados en los espectros de RMN se basaron en los espectros de referencia de los compuestos relacionados disponibles en la bibliografía.
Los datos indican que la sacarosa está presente en la muestra S1 y S2, y los desplazamientos químicos coinciden bien con los informados en la bibliografía. Obsérvese que, al igual que los espectros de protones, la muestra S2 parecía haber aumentado en un mayor grado que la muestra S1. Finalmente, los picos observados en la muestra S3 coinciden bien con los valores de la literatura para el dextrano, lo que indica que está presente en la muestra.
La estructura de sacarosa se muestra anteriormente con la anotación de carbono. Los resultados de RMN 13C se muestran en las Tablas 31 a continuación:
(continuación)
Fórmula (III)
La estructura del dextrano se muestra anteriormente con anotaciones de carbono de la Fórmula (III). La siguiente Tabla 33 muestra la RMN 13C para el dextrano de S3 en D2O:
Análisis de difracción de rayos x (xrd) (material liofilizado)
El análisis XRD es un método mediante el cual una muestra inorgánica cristalina se irradia con rayos x monoenergéticos. La interacción de la estructura reticular de la muestra con estas rayos x se registra y proporciona información sobre la estructura cristalina que se irradia. La “ huella dactilar” característica resultante permite la identificación de los compuestos cristalinos presentes en la muestra. Mediante un análisis de ajuste de patrón completo (el refinado de Rietveld), es posible realizar análisis cuantitativos en muestras que contienen más de un compuesto cristalino.
Las muestras liofilizadas se analizaron mediante XRD para caracterizar la estructura química y las fases presentes en las muestras. Los resultados del análisis se presentan en la Tabla 34. Obsérvese que este método de preparación de muestras dio como resultado muestras pegajosas para S1 y S2 específicamente (S3 era menos pegajosa). Para S1 y S2, se añadió una gota de metanol a la muestra y el material se extendió sobre el portamuestras. La muestra S3 se trituró en un mortero.
La Figura 22 superpone los datos sin procesar de XRD de las tres muestras con pequeños desplazamientos para mayor claridad. La muestra S2 es diferente de las otras dos muestras en términos de intensidades generales, posiciones de pico, así como la forma de los picos. Las formas de los picos amplias en las muestras S1 y S3 indican que estas muestras consisten en una mezcla de materiales nanocristalinos y amorfos.
Utilizando mejores coincidencias obtenidas comparando los datos experimentales modelados de fondo con la base de datos de difracción ICDD/ICSD para la muestra S1, S2 y S3, respectivamente, se determinó que las muestras S1 y S3 contenían una mezcla de materiales amorfos y nanocristalinos. El patrón de referencia del óxido de hierro sódico se superpuso a estos datos experimentales. Los marcadores indican la ubicación de los picos de difracción esperados para cada fase y las alturas de los marcadores indican las intensidades relativas de los picos para un material de grano fino orientado aleatoriamente. A diferencia de las otras dos muestras, la muestra s 3 se compone principalmente de sacarosa y materiales amorfos.
El análisis semicuantitativo se realizó mediante la utilización de WPF (ajuste de patrón completo), que es un subconjunto del refinado de Rietveld que representa todas las áreas por encima de la curva de fondo. Esta técnica requiere que los factores de estructura y las ubicaciones atómicas o la relación de intensidad de referencia (una forma de comparar la potencia difractante de diferentes fases) son conocidas para todas las fases identificadas. Durante este proceso, el factor estructural (que se relaciona con la concentración), los parámetros de red (que se relacionan con la posición máxima), la anchura pico y la forma de pico se refinan para cada fase para minimizar el valor R, una estimación del acuerdo entre el modelo y los datos experimentales sobre todo el patrón.
Para obtener resultados cuantitativos de la muestra que contiene cantidades medibles de material amorfo, la densidad de la amorfa debe asignarse para determinar cuánto material amorfo está presente. Como resultado, la concentración de material amorfo es incierta. Se supone que las ubicaciones de los picos amorfos en estas muestras son de la sacarosa amorfa que tiene una densidad de aproximadamente 1,59 g/cm3. Dado que WPF intenta tener en cuenta todo en la muestra, cualquier error en la concentración amorfa dará como resultado errores en las fases
cristalinas también. Esto significa que las concentraciones relativas de las fases cristalinas son correctas, pero los valores absolutos serán en error por cantidades proporcionales al error en la concentración amorfa.
Análisis de difracción de rayos x (xrd) (material sin azúcar)
Las muestras recibidas se diluyeron en agua y se colocaron en un filtro de corte de peso molecular (MWCO) de 10000 Da y se centrifugaron para eliminar las moléculas pequeñas en la formulación (azúcares) que produjo material amorfo en el análisis de XRD anterior. A continuación, las muestras se lavaron cinco veces más con agua para eliminar las moléculas pequeñas residuales. El material resultante (en capacidad para pasar a través del filtro) se liofilizó y se analizó mediante XRD para caracterizar la estructura química y las fases presentes en las muestras. Obsérvese que la muestra S3 contenía dos capas distintas después de la centrifugación, una capa viscosa espesa y una capa superior más delgada. Estas capas se separaron y se liofilizaron por separado y se analizaron como dos muestras. Los resultados se promediaron para proporcionar los valores observados en la Tabla 35, pero las réplicas individuales de cada capa se presentan en las figuras siguientes. Los resultados del análisis se presentan en la Tabla 35.
En la Figura 23 se muestra una superposición de los patrones XRD de las cuatro muestras (dos réplicas de S3). Los patrones están desplazados para mayor claridad. La identificación de la fase se realizó comparando las mejores coincidencias entre los datos experimentales de XRD modelados en segundo plano y la base de datos de difracción ICDD/ICSD de la muestra Los marcadores de referencia para la fase muestran donde en dos theta los picos experimentales esperados deben ubicarse y la altura de los marcadores indica la intensidad esperada de los picos experimentales, si la muestra está fina y orientada aleatoriamente. Obsérvese que XRD es sensible a la estructura cristalina pero relativamente insensible a la composición de estado elemental o químico. La identificación de fase para estas muestras fue difícil debido a la naturaleza nanocristalina de las muestras que ensanchan significativamente el pico en los patrones de XRD.
Las mejores coincidencias con los picos presentes en las cuatro muestras son una fase de óxido de hierro conocida como maghemita y una fase de hidróxido de óxido de hierro. La fase de hidróxido de óxido de hierro es atípica ya que se forma a partir del calentamiento del hidróxido de óxido de hierro en fase beta a aproximadamente 300 °C. Desafortunadamente, esta tarjeta de referencia no tiene la relación de intensidad de referencia (RIR) incluida la que se necesita para el análisis semicuantitativo. Pero como la simetría y las composiciones son similares a las del goetita mineral de hidróxido de óxido de hierro (alfa - FeOOH), el RIR promedio de goetita se usó para el hidróxido de óxido de hierro para el análisis semicuantitativo.
El análisis semicuantitativo se realizó mediante la utilización de WPF (ajuste de patrón completo), que es un subconjunto del refinado de Rietveld que representa toda la intensidad por encima de la curva de fondo. Esta técnica requiere que los factores de estructura y las ubicaciones atómicas o la relación de intensidad de referencia (una forma de comparar la potencia difractante de diferentes fases) son conocidas para todas las fases identificadas. Durante este proceso, el factor estructural (que se relaciona con la concentración), los parámetros de red (que se relacionan con la posición máxima), la anchura pico y la forma de pico se refinan para cada fase para minimizar el valor R, una estimación del acuerdo entre el modelo y los datos experimentales sobre todo el patrón.
Degradación ácida del hierro (iii) lábil mediante espectroscopia uv-visible
La espectroscopia UV/Vis se utiliza para determinar la concentración de analitos, ya sea de una sola vez o con frecuencia a lo largo de un período de tiempo deseado. La técnica mide la absorción de luz a través de las longitudes de onda de luz ultravioleta y visible a través de una muestra líquida. Las muestras se dispensan en un vial pequeño y se colocan entre la trayectoria de una luz UV/Vis y un detector. Según la ley de Beer-Lambert, con una longitud de trayectoria de luz constante y un coeficiente de absorción conocido dependiendo de la longitud de onda, la concentración de un compuesto en cuestión puede determinarse a partir de la luz absorbida por la muestra a esa longitud de onda.
Las muestras se analizaron mediante el método adaptado de B. S. Barot y col. (2014) que determina la cantidad de hierro lábil (III) en las muestras utilizando espectroscopía UV-Visible. Los resultados se resumen en la Tabla 36 a continuación.
Análisis termogravimétrico (tga)
El TGA consiste en medir el cambio de peso de un material en función de la temperatura en una atmósfera controlada. La técnica requiere mediciones precisas de peso, temperatura y cambio de temperatura. El termograma resultante generado a partir del análisis puede determinar el contenido de clases de ingredientes (por ejemplo, disolventes, polímeros, cargas inorgánicas, etc.) y estabilidad térmica de los polímeros. La precisión y el sesgo típicos de las mediciones de TGA se analizan en ASTM E2040.
Las muestras liofilizadas se analizaron por análisis termogravimétrico (TGA) bajo purga de nitrógeno y purga de aire. La descomposición térmica de las muestras se produce en tres etapas distintas como se muestra en la Figura 24. Los resultados de estas etapas se resumen en la Tabla 37.
Calorimetría diferencial de barrido (dsc) y análisis térmico diferencial (dta)
Las muestras liofilizadas se analizaron mediante calorimetría diferencial de barrido (DSC) bajo purga de argón. La calorimetría diferencial de barrido (DSC) mide la diferencia en los flujos de calor asociados a las transiciones entre una muestra y una referencia inerte en función de la temperatura y el tiempo. Dichas mediciones proporcionan información cuantitativa y cualitativa sobre cambios físicos y químicos que implican procesos endotérmicos o exotérmicos, o cambios en la capacidad calorífica. Véanse los termogramas DSC en la Figura 25. El resumen del DTA se presenta en la Tabla 38 a continuación.
Valor de hidróxido por valoración volumétrica y determinación de la fórmula molecular
Los puntos finales de las valoraciones volumétricas tuvieron pH = 7,0. La Tabla 39 resume los resultados de esta valoración volumétrica en S1.
Partiendo del supuesto de que todas las especies básicas valoradas volumétricamente procedían del hidróxido asociado a los núcleos de oxihidróxido férrico, se supuso que el número total de moles de H+ utilizados en la valoración volumétrica era igual al número de moles de OH-. Considerando TOC y PM por GPC, la fórmula molecular de la sacarosa de hierro en S1 se calculó como sigue:
[Na6Fe5O8(OH)5 ■ 3H2O]13 ■ 73(C12H22O11)
Si se considera M para este cálculo, la fórmula molecular es:
[Na6Fe5O8(OH)5 ■ 3H2O]9 ■ 51(C12H22O11)
0tras realizaciones de la invención serán evidentes para los expertos en la técnica a partir de la consideración de la descripción y la práctica de la invención descrita en la presente memoria.
Claims (15)
1. Una composición de hierro acuosa que comprende sacarosa de hierro y bicarbonato para usar en un método para la prevención o el tratamiento de una enfermedad o trastorno renal que comprende administrar por vía intravenosa dicha composición de hierro acuosa en una cantidad terapéuticamente eficaz.
2. La composición de hierro acuosa para usar de la reivindicación 1, en donde la composición tiene un pH mayor de 9.
3. La composición de hierro acuosa para usar de las reivindicaciones 1 o 2, en donde la composición tiene un pH que varía de aproximadamente 10,5 a aproximadamente 11,5.
4. La composición de hierro acuosa para usar de las reivindicaciones 1-3, en donde la composición tiene una gravedad específica entre 1,135 y 1,165 a 20 °C.
5. La composición de hierro acuosa para usar de las reivindicaciones 1-4, en donde la composición tiene un PM según GPC de entre 30.000 y 40.000 dáltones.
6. La composición de hierro acuosa para usar de las reivindicaciones 1-5, en donde la composición tiene un PM según GPC de entre 33.000 y 38.000 dáltones.
7. La composición de hierro acuosa para usar de las reivindicaciones 1-6, en donde la composición tiene una concentración máxima de hierro (II) de 0,40 % p/v.
8. La composición de hierro acuosa para usar de las reivindicaciones 1-7, en donde la composición tiene una concentración de hierro (II) del 0,05 % p/v al 0,40 % p/v.
9. La composición de hierro acuosa para usar de las reivindicaciones 1-8, en donde la composición tiene una concentración de hierro (II) del 0,10 % p/v al 0,20 % p/v.
10. La composición de hierro acuosa para usar de las reivindicaciones 1-9, en donde el método comprende además administrar una protoporfirina.
11. La composición de hierro acuosa para usar de las reivindicaciones 1-10, en donde el método comprende además administrar protoporfirina de estaño.
12. La composición de hierro acuosa para usar de las reivindicaciones 1-11, en donde la enfermedad o trastorno es una enfermedad renal crónica, o, en donde la enfermedad o trastorno es el rechazo de trasplante de órganos.
13. Una composición farmacéutica de hierro acuosa que comprende:
sacarosa de hierro;
bicarbonato; y
un portador acuoso farmacéuticamente aceptable,
en donde la sacarosa de hierro está presente en una cantidad farmacéuticamente eficaz para proporcionar un efecto protector al riñón de un paciente, la composición farmacéutica tiene un pH que varía de aproximadamente 10,5 a aproximadamente 11,5, una concentración de hierro (II) de 0,05 % p/v a 0,40 % p/v, y un PM según GPC está entre 30.000 y 40.000 dáltones.
14. La composición de hierro acuosa de la reivindicación 13, en donde la composición tiene una gravedad específica entre 1,135 y 1,165 a 20 °C; y/o, en donde el PM según GPC está entre 30.000 y 40.000 dáltones.
15. La composición de hierro acuosa de cualquiera de las reivindicaciones 13 o 14, en donde la composición tiene una concentración de hierro (II) del 0,10 % p/v al 0,20 % p/v.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962812028P | 2019-02-28 | 2019-02-28 | |
| PCT/US2020/020517 WO2020176894A1 (en) | 2019-02-28 | 2020-02-28 | Novel iron compositions and methods of making and using the same |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2955019T3 true ES2955019T3 (es) | 2023-11-28 |
Family
ID=70190086
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES20717359T Active ES2955019T3 (es) | 2019-02-28 | 2020-02-28 | Composiciones de hierro novedosas y métodos para preparar y utilizar las mismas |
Country Status (20)
| Country | Link |
|---|---|
| US (4) | US11292813B2 (es) |
| EP (2) | EP4234020A3 (es) |
| JP (3) | JP7320611B2 (es) |
| KR (1) | KR20210133243A (es) |
| CN (2) | CN119488480A (es) |
| AU (2) | AU2020229381A1 (es) |
| CA (1) | CA3131596A1 (es) |
| DK (1) | DK3930686T3 (es) |
| ES (1) | ES2955019T3 (es) |
| FI (1) | FI3930686T3 (es) |
| HR (1) | HRP20230989T1 (es) |
| HU (1) | HUE063182T2 (es) |
| LT (1) | LT3930686T (es) |
| PL (1) | PL3930686T3 (es) |
| PT (1) | PT3930686T (es) |
| RS (1) | RS64652B1 (es) |
| SG (1) | SG11202109323UA (es) |
| SI (1) | SI3930686T1 (es) |
| SM (1) | SMT202300276T1 (es) |
| WO (1) | WO2020176894A1 (es) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4210691A4 (en) * | 2020-09-11 | 2025-02-26 | Renibus Therapeutics, Inc. | METHODS OF TREATING CANCER WITH KIDNEY PROTECTION |
| WO2024069644A1 (en) * | 2022-09-30 | 2024-04-04 | West Bengal Chemical Industries Limited | A pharmaceutically acceptable ferric carboxymaltose and preparation thereof |
| CN115969714B (zh) * | 2022-11-03 | 2025-03-11 | 华熙生物科技股份有限公司 | 具有光谱选择性的防晒组合物及其应用 |
Family Cites Families (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE862482C (de) | 1950-05-14 | 1953-01-12 | Merck Chem Fab E | Verfahren zur Darstellung haltbarer, injizierbarer Loesungen von Salzen des dreiwertigen Eisens |
| US5624668A (en) | 1995-09-29 | 1997-04-29 | Luitpold Pharmaceuticals, Inc. | Iron dextran formulations |
| DE19547356A1 (de) | 1995-12-19 | 1997-06-26 | Vifor Int Ag | Adsorbens für Phosphat aus wäßrigem Medium, dessen Herstellung und Verwendung |
| AU2002226209A1 (en) * | 2000-12-20 | 2002-07-01 | Dialysis Solutions Inc. | Sterile low bicarbonate dialysis concentrate solutions |
| WO2004019032A1 (en) * | 2002-08-26 | 2004-03-04 | Luitpold Pharmaceuticals, Inc. | Bioequivalence test for iron-containing formulations |
| EP1733058B8 (en) * | 2004-03-16 | 2012-10-24 | Navinta LLC | Iron sucrose complexes and method of manufacture thereof |
| US8030480B2 (en) | 2004-12-06 | 2011-10-04 | Emcure Pharmaceuticals Limited | Cost-effective process for preparation of manufacture of iron sucrose |
| ITMO20050056A1 (it) | 2005-03-15 | 2006-09-16 | Biofer Spa | Processo per la preparazione di complessi del ferro trivalente con zuccheri mono-, di- e polisaccaridi. |
| CN100528237C (zh) | 2005-04-26 | 2009-08-19 | 重庆医药工业研究院有限责任公司 | 多核的氢氧化铁-糖复合物的制备方法 |
| EP1757299A1 (de) | 2005-08-25 | 2007-02-28 | Vifor (International) Ag | Eisen(III)-Komplexverbindungen zur Behandlung von Eisenmangel-Zuständen bei Patienten mit chronisch-entzündlicher Darmerkrankung |
| KR101573013B1 (ko) | 2006-10-04 | 2015-12-04 | 인파케어 파마슈티칼 코포레이션 | 스탄소포르핀의 고순도 대규모 제조법 |
| EP1947120A1 (de) | 2007-01-19 | 2008-07-23 | Vifor (International) Ag | Eisen-Kohlenhydrat-Komplex-Verbindungen |
| IN269965B (es) | 2007-06-25 | 2015-11-27 | Claris Lifescienses Ltd | |
| TWI592159B (zh) | 2007-11-16 | 2017-07-21 | 威佛(國際)股份有限公司 | 藥學組成物 |
| AU2010220396B2 (en) | 2009-03-02 | 2013-10-17 | Vifor (International) Ag | Phosphate adsorbent |
| CN106176808A (zh) | 2010-10-19 | 2016-12-07 | 长春纳米生技公司 | 金属离子纳米簇组合物 |
| EP2548562A1 (de) | 2011-07-18 | 2013-01-23 | SeBo GmbH | Kombinationstherapie mit Eisen-basierenden Phosphatadsorbern |
| EP2647389A1 (en) * | 2012-04-04 | 2013-10-09 | Charité - Universitätsmedizin Berlin | Magnetic nanoparticle dispersion, its preparation and diagnostic and therapeutic use |
| CN103340827B (zh) * | 2013-07-16 | 2014-12-10 | 成都天台山制药有限公司 | 蔗糖铁注射液及其制法 |
| CN104558064A (zh) * | 2013-10-29 | 2015-04-29 | 北京京卫信康医药科技发展有限公司 | 蔗糖铁的制备方法 |
| IN2013CH05383A (es) | 2013-11-21 | 2015-08-28 | Reddy’S Lab Ltd Dr | |
| CN104098616B (zh) | 2014-05-27 | 2016-04-20 | 广西壮族自治区化工研究院 | 一种蔗糖铁的制备方法 |
| JP6894837B2 (ja) * | 2014-09-29 | 2021-06-30 | フレッド ハッチンソン キャンサー リサーチ センター | ストレスタンパク質誘導剤を使用して獲得細胞抵抗性を誘導するための組成物、キット及び方法 |
| US20190106454A1 (en) * | 2016-03-23 | 2019-04-11 | Fred Hutchinson Cancer Research Center | Compounds linked with a saccharide metal complex and uses thereof |
| WO2018148217A1 (en) | 2017-02-08 | 2018-08-16 | Fred Hutchinson Cancer Research Center | Compositions, kits, and methods to induce acquired cytoresistance using stress protein inducers |
| KR20200044030A (ko) | 2017-09-11 | 2020-04-28 | 파르마코스모스 홀딩 에이/에스 | 치료용 철 착화합물 |
| CN109912675B (zh) | 2017-12-13 | 2020-09-15 | 北京市林业果树科学研究院 | 一种蔗糖亚铁及其制备方法 |
| CN110063965A (zh) | 2019-06-04 | 2019-07-30 | 吉林省富生医疗器械有限公司 | 一种血液透析浓缩物 |
| CN112315902B (zh) | 2019-08-05 | 2022-05-13 | 南京恒生制药有限公司 | 一种低易变铁含量蔗糖铁注射液制备方法 |
| CN112168844A (zh) | 2020-09-29 | 2021-01-05 | 神奈纳米医药技术(珠海)有限公司 | 一种氢氧化铁碳水化合物复合物的制备方法 |
| CN112156109A (zh) | 2020-09-29 | 2021-01-01 | 神奈纳米医药技术(珠海)有限公司 | 氢氧化铁-糖络合物的制备方法及其应用 |
| MX2023003647A (es) | 2020-09-29 | 2023-06-09 | Lg Bionano Llc | Metodos para preparar complejos de hierro. |
| CN115531414A (zh) | 2021-06-30 | 2022-12-30 | 南京恒生制药有限公司 | 一种新型蔗糖铁复合物及其制备方法 |
| JP2024534172A (ja) | 2021-08-27 | 2024-09-18 | ヴァイフォー(インターナショナル)アーゲー | 鉄組成物並びにそれらを作製及び使用する方法 |
-
2020
- 2020-02-28 ES ES20717359T patent/ES2955019T3/es active Active
- 2020-02-28 SM SM20230276T patent/SMT202300276T1/it unknown
- 2020-02-28 US US16/805,223 patent/US11292813B2/en active Active
- 2020-02-28 HU HUE20717359A patent/HUE063182T2/hu unknown
- 2020-02-28 DK DK20717359.2T patent/DK3930686T3/da active
- 2020-02-28 EP EP23176202.2A patent/EP4234020A3/en active Pending
- 2020-02-28 CN CN202411305791.9A patent/CN119488480A/zh active Pending
- 2020-02-28 SI SI202030257T patent/SI3930686T1/sl unknown
- 2020-02-28 PT PT207173592T patent/PT3930686T/pt unknown
- 2020-02-28 JP JP2021550178A patent/JP7320611B2/ja active Active
- 2020-02-28 CN CN202080031484.XA patent/CN113825496B/zh active Active
- 2020-02-28 EP EP20717359.2A patent/EP3930686B1/en active Active
- 2020-02-28 PL PL20717359.2T patent/PL3930686T3/pl unknown
- 2020-02-28 WO PCT/US2020/020517 patent/WO2020176894A1/en not_active Ceased
- 2020-02-28 RS RS20230725A patent/RS64652B1/sr unknown
- 2020-02-28 KR KR1020217030370A patent/KR20210133243A/ko active Pending
- 2020-02-28 HR HRP20230989TT patent/HRP20230989T1/hr unknown
- 2020-02-28 SG SG11202109323UA patent/SG11202109323UA/en unknown
- 2020-02-28 AU AU2020229381A patent/AU2020229381A1/en not_active Abandoned
- 2020-02-28 LT LTEPPCT/US2020/020517T patent/LT3930686T/lt unknown
- 2020-02-28 FI FIEP20717359.2T patent/FI3930686T3/fi active
- 2020-02-28 CA CA3131596A patent/CA3131596A1/en active Pending
-
2022
- 2022-02-15 US US17/672,072 patent/US11840552B2/en active Active
- 2022-11-02 US US17/979,490 patent/US11834471B2/en active Active
-
2023
- 2023-07-21 JP JP2023118851A patent/JP7646750B2/ja active Active
- 2023-09-07 US US18/243,584 patent/US20240002427A1/en active Pending
-
2025
- 2025-03-04 JP JP2025033475A patent/JP2025084949A/ja active Pending
- 2025-09-10 AU AU2025230678A patent/AU2025230678A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7646750B2 (ja) | 新規鉄組成物及びその製造方法と使用方法 | |
| CN104880428B (zh) | 一种胶体果胶铋或含胶体果胶铋制剂中铋含量的测定方法 | |
| Alanazi et al. | Selective and reliable fluorometric quantitation of anti-cancer drug in real plasma samples using nitrogen-doped carbon dots after MMIPs solid phase microextraction: Monitoring methotrexate plasma level | |
| Nazarova et al. | Monosubstituted pillar [5] arene functionalized with (amino) phosphonate fragments are “smart” building blocks for constructing nanosized structures with some s-and p-metal cations in the organic phase | |
| Cappellari et al. | Synthesis of ultra-small cysteine-capped gold nanoparticles by pH switching of the Au (I)–cysteine polymer | |
| Raval et al. | Preparation, characterization, and in-vitro assessment of calixarene nanovesicles: a supramolecular based nano-carrier for paclitaxel drug delivery | |
| Minzanova et al. | Synthesis and physicochemical properties of antianemic iron and calcium complexes with sodium polygalacturonate | |
| Kästele et al. | 13C NMR spectroscopy as a tool for the in situ characterisation of iron-supplementing preparations | |
| HK40066891B (en) | Novel iron compositions and methods of making and using the same | |
| HK40066891A (en) | Novel iron compositions and methods of making and using the same | |
| HK40098133A (en) | Novel iron compositions and methods of making and using the same | |
| HK40066204B (zh) | 新型铁组合物及其制造和使用方法 | |
| HK40066204A (zh) | 新型铁组合物及其制造和使用方法 | |
| Barui et al. | Dual drug loaded nanotheranostic platforms as a novel synergistic approach to improve pancreatic cancer treatment | |
| Barot et al. | Physicochemical and toxicological characterization of sucrose-bound polynuclear iron oxyhydroxide formulations | |
| Lian et al. | The revolutionizing osteosarcoma therapy of carbon monoxide and doxorubicin synergy via mesoporous silica nanoparticles | |
| Jackson et al. | Solution equilibria and the X-ray structure of Cu (II) complexation with 3-amino-N-(pyridin-2-ylmethyl) propanamide, a pseudo-mimic of human serum albumin | |
| Eriksson | Cerium Oxide Nanoparticles and Gadolinium Integration Synthesis, Characterization and Biomedical Applications | |
| Yang et al. | Analysis on the interaction of coumarin isomers with human serum albumin in the presence of cisplatin | |
| Ricci et al. | Paramagnetic and Luminescent Properties of Gd (III)/Eu (III) Ascorbate Coordination Polymers | |
| Marcinkowska et al. | Cisplatin Derivatives and Their Complexes with PAMAM Dendrimers—A Way to Improve the Efficacy of Anticancer Drugs | |
| Vasquez et al. | A nanocarrier delivery system of oxaliplatin for glioblastoma: synthesis and cytotoxicity of Fe 3 O 4@ SiO 2/OXA nanocomposites | |
| Rodallec et al. | Model-driven scheduling of a novel anti-cancer polymer prodrug administered subcutaneously | |
| Cardona Mejías | Characterization of Ti (IV)-transferring binding interactions | |
| Bhai | Development and validation of analytical methods for estimation of citicoline in bulk and pharmaceutical formulations |