ES2803099B2 - Procedimiento de obtención de besilato de remimazolam amorfo - Google Patents
Procedimiento de obtención de besilato de remimazolam amorfo Download PDFInfo
- Publication number
- ES2803099B2 ES2803099B2 ES201930677A ES201930677A ES2803099B2 ES 2803099 B2 ES2803099 B2 ES 2803099B2 ES 201930677 A ES201930677 A ES 201930677A ES 201930677 A ES201930677 A ES 201930677A ES 2803099 B2 ES2803099 B2 ES 2803099B2
- Authority
- ES
- Spain
- Prior art keywords
- remimazolam
- temperature
- besilate
- process according
- hours
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- QMTKNJZIWGTNTE-LMOVPXPDSA-N benzenesulfonic acid;methyl 3-[(4s)-8-bromo-1-methyl-6-pyridin-2-yl-4h-imidazo[1,2-a][1,4]benzodiazepin-4-yl]propanoate Chemical compound OS(=O)(=O)C1=CC=CC=C1.N([C@H](C1=NC=C(C)N1C1=CC=C(Br)C=C11)CCC(=O)OC)=C1C1=CC=CC=N1 QMTKNJZIWGTNTE-LMOVPXPDSA-N 0.000 title claims description 90
- 238000000034 method Methods 0.000 title claims description 47
- 239000002904 solvent Substances 0.000 claims description 55
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 claims description 42
- 239000000203 mixture Substances 0.000 claims description 33
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 32
- 239000000843 powder Substances 0.000 claims description 26
- 238000007710 freezing Methods 0.000 claims description 24
- 230000008014 freezing Effects 0.000 claims description 24
- 238000004108 freeze drying Methods 0.000 claims description 19
- 238000010438 heat treatment Methods 0.000 claims description 12
- 239000003960 organic solvent Substances 0.000 claims description 10
- 229910052799 carbon Inorganic materials 0.000 claims description 6
- 238000002360 preparation method Methods 0.000 claims description 6
- 238000012360 testing method Methods 0.000 description 45
- 239000007787 solid Substances 0.000 description 34
- 239000000243 solution Substances 0.000 description 28
- 229950004245 remimazolam Drugs 0.000 description 20
- CYHWMBVXXDIZNZ-KRWDZBQOSA-N methyl 3-[(4s)-8-bromo-1-methyl-6-pyridin-2-yl-4h-imidazo[1,2-a][1,4]benzodiazepin-4-yl]propanoate Chemical compound N([C@H](C1=NC=C(C)N1C1=CC=C(Br)C=C11)CCC(=O)OC)=C1C1=CC=CC=N1 CYHWMBVXXDIZNZ-KRWDZBQOSA-N 0.000 description 18
- 238000004458 analytical method Methods 0.000 description 17
- 230000000052 comparative effect Effects 0.000 description 13
- 238000000113 differential scanning calorimetry Methods 0.000 description 11
- 238000001035 drying Methods 0.000 description 11
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 8
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 8
- 150000001720 carbohydrates Chemical class 0.000 description 8
- 235000014633 carbohydrates Nutrition 0.000 description 7
- 238000001556 precipitation Methods 0.000 description 7
- 238000000859 sublimation Methods 0.000 description 7
- 230000008022 sublimation Effects 0.000 description 7
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 238000002441 X-ray diffraction Methods 0.000 description 6
- 238000011109 contamination Methods 0.000 description 6
- 238000010586 diagram Methods 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 239000002253 acid Substances 0.000 description 5
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical class OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 150000003839 salts Chemical class 0.000 description 5
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 4
- 229910016523 CuKa Inorganic materials 0.000 description 4
- 229920002307 Dextran Polymers 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- -1 amnesiating Substances 0.000 description 4
- 229910052802 copper Inorganic materials 0.000 description 4
- 239000010949 copper Substances 0.000 description 4
- 229910052757 nitrogen Inorganic materials 0.000 description 4
- 230000005855 radiation Effects 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- 206010039897 Sedation Diseases 0.000 description 3
- 239000012296 anti-solvent Substances 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
- 229940092714 benzenesulfonic acid Drugs 0.000 description 3
- 239000002178 crystalline material Substances 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 238000012792 lyophilization process Methods 0.000 description 3
- 239000012931 lyophilized formulation Substances 0.000 description 3
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 3
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 3
- 230000036280 sedation Effects 0.000 description 3
- 239000011877 solvent mixture Substances 0.000 description 3
- 238000001694 spray drying Methods 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- 238000002411 thermogravimetry Methods 0.000 description 3
- 238000004448 titration Methods 0.000 description 3
- 238000001195 ultra high performance liquid chromatography Methods 0.000 description 3
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 2
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 2
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 2
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 2
- 229940049706 benzodiazepine Drugs 0.000 description 2
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 150000002016 disaccharides Chemical class 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 229960001375 lactose Drugs 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 229920001542 oligosaccharide Polymers 0.000 description 2
- 150000002482 oligosaccharides Chemical class 0.000 description 2
- 229920000620 organic polymer Polymers 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 229940069328 povidone Drugs 0.000 description 2
- 238000000634 powder X-ray diffraction Methods 0.000 description 2
- 238000005057 refrigeration Methods 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- SVUOLADPCWQTTE-UHFFFAOYSA-N 1h-1,2-benzodiazepine Chemical compound N1N=CC=CC2=CC=CC=C12 SVUOLADPCWQTTE-UHFFFAOYSA-N 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- WSVLPVUVIUVCRA-KPKNDVKVSA-N Alpha-lactose monohydrate Chemical compound O.O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O WSVLPVUVIUVCRA-KPKNDVKVSA-N 0.000 description 1
- 229920000945 Amylopectin Polymers 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 238000003109 Karl Fischer titration Methods 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 208000034809 Product contamination Diseases 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 230000003109 amnesic effect Effects 0.000 description 1
- 230000003444 anaesthetic effect Effects 0.000 description 1
- 230000000573 anti-seizure effect Effects 0.000 description 1
- 239000002249 anxiolytic agent Substances 0.000 description 1
- 230000000949 anxiolytic effect Effects 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 238000000889 atomisation Methods 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical class [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 150000001557 benzodiazepines Chemical group 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000003874 central nervous system depressant Substances 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 230000005496 eutectics Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 238000002695 general anesthesia Methods 0.000 description 1
- 239000003193 general anesthetic agent Substances 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 238000011141 high resolution liquid chromatography Methods 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 229960001021 lactose monohydrate Drugs 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 239000003158 myorelaxant agent Substances 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 239000003507 refrigerant Substances 0.000 description 1
- 239000000932 sedative agent Substances 0.000 description 1
- 230000001624 sedative effect Effects 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 238000003221 volumetric titration Methods 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D243/00—Heterocyclic compounds containing seven-membered rings having two nitrogen atoms as the only ring hetero atoms
- C07D243/06—Heterocyclic compounds containing seven-membered rings having two nitrogen atoms as the only ring hetero atoms having the nitrogen atoms in positions 1 and 4
- C07D243/10—Heterocyclic compounds containing seven-membered rings having two nitrogen atoms as the only ring hetero atoms having the nitrogen atoms in positions 1 and 4 condensed with carbocyclic rings or ring systems
- C07D243/14—1,4-Benzodiazepines; Hydrogenated 1,4-benzodiazepines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Description
DESCRIPCIÓN
Procedimiento de obtención de besilato de remimazolam amorfo
Campo de la invención
La presente invención se relaciona con un procedimiento para la obtención de besilato de remimazolam amorfo.
Antecedentes de la invención
El remimazolam, CNS 7056 o 3-{(4S)-8-bromo-1-metil-6-(piridin-2-il)-4H-imidazo[1,2-a][1,4] benzodiazepin-4-il}propanoato de metilo es una benzodiazepina desarrollada por Paion, que presenta la siguiente estructura química:
El remimazolam es un agente depresivo del sistema nervioso central de corta actuación. Posee propiedades ansiolíticas, amnesiantes, sedantes, miorrelajantes y anticomiciales. Debido a estas propiedades es adecuado para su uso en la práctica anestésica y en cuidados intensivos, como por ejemplo en sedación preoperatoria, ansiolisis, uso amnésico para casos perioperatorios, sedación en estado consciente durante procedimientos cortos de diagnóstico, operatorios o endoscópicos, como componente para la inducción y mantenimiento de anestesia general, antes y/o concomitante a la administración de otros agentes anestésicos, así como en la sedación en cuidados intensivos. La administración más adecuada de este compuesto es por vía intravenosa.
La patente EP 1 183 243 B1 da a conocer el remimazolam y su procedimiento de preparación en el ejemplo Ic-8.
El documento de patente WO 2008/007071 A1 revela que el remimazolam (en forma de base libre) es estable al almacenarlo a 5 °C, pero se comporta como un sólido delicuescente al almacenarlo a 40 °C y 75% de humedad relativa (en vial abierto) o a 60 °C y humedad ambiente (en vial cerrado), disminuyendo apreciablemente el contenido inicial de remimazolam y tornándose de color amarillo a naranja. Según el documento WO 2008/007071 A1, el estudio por cromatografía líquida de alta resolución (HPLC, siglas de “high-performance liquid chromatography’) de remimazolam sugiere que la degradación se debe a la formación de la impureza correspondiente a la hidrólisis del éster metílico.
En el documento WO 2008/007071 A1 se propone solucionar dicho problema de estabilidad al almacenamiento de remimazolam mediante la formación de la sal de besilato (sal de ácido bencenosulfónico) de dicho producto en forma de un sólido altamente cristalino, fácilmente aislable y que presenta buenas propiedades térmicas, baja higroscopicidad y buena solubilidad acuosa. En el documento WO 2008/007071 A1 concretamente se divulga la sal de monobesilato de remimazolam, en donde la relación molar de ácido bencenosulfónico y remimazolam es 1:1, en varias formas cristalinas designadas Forma 1, Forma 2, Forma 3 y Forma 4.
En WO 2008/007071 A1 (ejemplo 5) se describe un estudio de polimorfismo del besilato de remimazolam en el que se sometió la sal a pruebas de maduración de la forma cristalina 1 en quince disolventes diferentes y sus correspondientes mezclas acuosas. En la mayoría de los casos se obtuvo o bien la forma 1 o bien un aceite. Solamente se obtuvo besilato de remimazolam en forma de sólido amorfo al utilizar isopropanol, diclorometano o una solución de THF acuoso. Sin embargo, en WO 2008/007071 A1 no se incluye ningún dato de caracterización de la forma amorfa obtenida ni de su pureza o estabilidad. Al reproducir los ejemplos que según WO 2008/007071 A1 rindieron la forma amorfa del besilato de remimazolam, los presentes inventores no han obtenido esta forma sólida sino una forma cristalina del sólido, concretamente la forma 2.
El documento EP 2 852 389 B1 se relaciona con composiciones liofilizadas estables de benzodiazepinas, incluyendo el remimazolam. Dicho documento explica que la liofilización es una técnica conocida para estabilizar compuestos lábiles al agua. Sin embargo, también explica que la liofilización del besilato de remimazolam solo (sin excipientes) no dio resultados satisfactorios de estabilidad de dicha sal. En el documento EP 2852389 B1 se propone solucionar el problema de falta de estabilidad del besilato de remimazolam
proporcionando composiciones liofilizadas que comprenden un excipiente higroscópico y/o dextrano, siendo la formulación liofilizada parcialmente amorfa.
En los ejemplos del documento EP 2 852 389 B1 se evalúa el material cristalino en una formulación liofilizada de besilato de remimazolam y monohidrato de lactosa. Los estudios realizados sobre dicha formulación demostraron la presencia de material cristalino, concretamente de la sal de besilato de remimazolam en forma cristalina, en esta formulación liofilizada.
La principal ventaja de los productos en forma de sólidos amorfos respecto a sus equivalentes cristalinos es que presentan una solubilidad y biodisponibilidad mejoradas. Sin embargo, su principal desventaja es que son menos estables que los sólidos cristalinos y evolucionan con el tiempo hacia una forma cristalina. El problema derivado de la presencia de besilato de remimazolam cristalino en una matriz de besilato de remimazolam amorfo es precisamente que dicho compuesto amorfo no se mantiene estable al almacenarlo sino que evoluciona hacia una de las formas cristalinas de la sal de besilato.
Por tanto, existe en el estado de la técnica una necesidad de un procedimiento para la preparación de besilato de remimazolam en forma amorfa que permita obtener dicho producto sin contaminación de formas cristalinas de la sal de besilato. El besilato de remimazolam amorfo sin contaminación de formas cristalinas es ventajoso ya que se mantiene más estable al almacenarlo.
Sumario de la invención
Tal como se muestra en los ejemplos, los inventores han realizado múltiples experimentos para intentar obtener besilato de remimazolam amorfo sin contaminación de producto en forma cristalina, incluyendo pruebas diversas de cristalización/precipitación con combinaciones de disolventes y variedad de condiciones, así como pruebas de secado por pulverización, sin lograr obtener el producto amorfo libre de material cristalino. Sorprendentemente, pese a los resultados insatisfactorios de estabilidad descritos en EP 2 852 389 B1 para el besilato de remimazolam liofilizado, los inventores han descubierto un procedimiento de liofilización para la preparación de besilato de remimazolam amorfo estable, sin contaminación de formas cristalinas de dicho producto.
Por ello, en un primer aspecto, la presente invención se relaciona con un procedimiento de preparación de besilato de remimazolam amorfo que comprende las siguientes etapas: a) proveer una disolución que consiste esencialmente en besilato de remimazolam y un disolvente seleccionado del grupo que consiste en disolvente orgánico miscible en agua, agua y mezclas de los mismos, y
b) liofilizar la disolución provista en la etapa a), en donde la liofilización comprende b1) congelar la disolución provista en la etapa a) a una temperatura inferior a -45 °C, y b2) eliminar el disolvente del producto obtenido en la etapa b1) mediante calentamiento desde la temperatura de dicho producto hasta una temperatura de 10 °C a 40 °C, a una presión inferior a 101325 Pa (1,01325 bar) y durante un periodo de tiempo inferior a 5 días.
En un segundo aspecto, la presente invención se relaciona con besilato de remimazolam amorfo estable caracterizado porque presenta un difractograma de rayos X en polvo que presenta un pico ancho entre 10 y 40 °20 ±2°0.
Descripción de los dibujos
La figura 1 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ejemplo 1.3.
La figura 2 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ejemplo 1.5.
La figura 3 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ejemplo 1.6.
La figura 4 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ejemplo comparativo 3.
La figura 5 muestra el diagrama de calorimetría diferencial de barrido (DSC) del besilato de remimazolam obtenido en el ejemplo comparativo 3.
La figura 6 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ejemplo comparativo 4.1.
La figura 7 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ejemplo comparativo 4.2.
La figura 8 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ejemplo comparativo 4.3.
La figura 9 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ejemplo comparativo 3 tras una semana de almacenamiento a 40 °C y 80% HR.
La figura 10 muestra el diagrama de calorimetría diferencial de barrido (DSC) del besilato de remimazolam obtenido en el ejemplo comparativo 3 tras una semana de almacenamiento a 40 °C y 80% HR.
La figura 11 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ejemplo comparativo 3 tras un mes de almacenamiento a 4 °C.
La figura 12 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ensayo 1.5 tras 15 días de almacenamiento a 40 °C y 80% HR.
La figura 13 muestra el diagrama de calorimetría diferencial de barrido (DSC) del besilato de remimazolam obtenido en el ensayo 1.5 tras 15 días de almacenamiento a 40 °C y 80% HR.
La figura 14 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ensayo 1.6 tras 15 días de almacenamiento a 40 °C y 80% HR.
La figura 15 muestra el diagrama de calorimetría diferencial de barrido (DSC) del besilato de remimazolam obtenido en el ensayo 1.6 tras 15 días de almacenamiento a 40 °C y 80% HR.
La figura 16 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ensayo 1.5 tras 30 días de almacenamiento a 40 °C y 80% HR.
La figura 17 muestra el diagrama de calorimetría diferencial de barrido (DSC) del besilato de remimazolam obtenido en el ensayo 1.5 tras 30 días de almacenamiento a 40 °C y 80% HR.
La figura 18 muestra el difractograma de rayos X en polvo (XRPD) del besilato de remimazolam obtenido en el ensayo 1.6 tras 30 días de almacenamiento a 40 °C y 80% HR.
La figura 19 muestra el diagrama de calorimetría diferencial de barrido (DSC) del besilato de remimazolam obtenido en el ensayo 1.6 tras 30 días de almacenamiento a 40 °C y 80% HR.
Descripción detallada de la invención
En un primer aspecto, la presente invención se relaciona con un procedimiento para la preparación de besilato de remimazolam amorfo que comprende las siguientes etapas: a) proveer una disolución que consiste esencialmente en besilato de remimazolam y un disolvente seleccionado del grupo que consiste en disolvente orgánico miscible en agua, agua y mezclas de los mismos, y
b) liofilizar la disolución provista en la etapa a), en donde la liofilización comprende b1) congelar la disolución provista en la etapa a) a una temperatura inferior a -45 °C, y b2) eliminar el disolvente del producto obtenido en la etapa b1) mediante calentamiento desde la temperatura de dicho producto hasta una temperatura de 10 °C a 40 °C, a una presión inferior a 101325 Pa (1,01325 bar) y durante un periodo de tiempo inferior a 5 días.
El besilato de remimazolam hace referencia a la sal de remimazolam y ácido bencenosulfónico en una proporción molar de 1:1. Por ello, el besilato de remimazolam es un compuesto de fórmula (I):
En el contexto de la presente invención, el término "amorfo” o "sólido amorfo” hace referencia a un estado sólido de la materia, en particular del besilato de remimazolam, en el que las partículas que conforman el sólido carecen de una estructura ordenada. Estos
sólidos carecen de formas bien definidas. Esta clasificación contrasta con la de sólidos cristalinos, cuyos átomos están dispuestos de manera regular y ordenada formando redes cristalinas. En un sólido cristalino la disposición de sus átomos guarda una simetría. Por esa razón, su diagrama de difracción por rayos X muestra varios picos muy bien definidos a unos ángulos determinados. En un sólido amorfo, los átomos están colocados al azar, debido a lo cual, en su diagrama de difracción se observan pocos picos, en general uno, que se caracteriza por una gran anchura angular. En particular, el besilato de remimazolam amorfo se caracteriza por un difractograma de rayos X en polvo que presenta un pico ancho entre 10 y 40 °20 ±2°0. El difractograma de rayos-X se puede registrar utilizando un sistema de difracción en polvo con un ánodo de cobre que emite radiación CuKa con una longitud de onda de 1,541838 Á, en particular, siguiendo el método descrito en los ejemplos.
La expresión "besilato de remimazolam cristalino” hace referencia a besilato de remimazolam en forma de sólido cristalino, es decir, en el que los átomos están dispuestos de manera regular y ordenada formando redes cristalinas. Por ello, el diagrama de difracción por rayos X de las formas cristalinas muestra varios picos muy bien definidos a unos ángulos determinados. En particular, el besilato de remimazolam cristalino hace referencia a la forma 1, forma 2, forma 3 y forma 4 definidas en WO 2008/007071 A1.
En el contexto de la presente invención, la expresión "una disolución que consiste esencialmente en besilato de remimazolam y un disolvente” se emplea para caracterizar disoluciones en las que la suma de las cantidades en peso de besilato de remimazolam y de disolvente representan al menos 95%, más preferiblemente al menos 97%, más preferiblemente al menos 99%, más preferiblemente al menos 99,5% y más preferiblemente al menos 99,9% en peso de la disolución.
El procedimiento de la presente invención permite obtener besilato de remimazolam amorfo estable en el tiempo debido a la ausencia de formas cristalinas. Dicha estabilidad hace referencia a que el producto no evoluciona a formas cristalinas al ser almacenado, en particular al almacenarlo a 40 °C y 80% de humedad relativa y/o al almacenarlo a 25 °C y 60% de humedad relativa durante al menos 15 días, preferiblemente durante al menos 30 días, más preferiblemente al almacenarlo durante al menos 15 días a 40 °C y 80% de humedad relativa, aún más preferiblemente durante al menos 30 días. La presencia/ausencia de formas cristalinas se puede determinar mediante análisis por difracción de rayos X en polvo, en particular utilizando un sistema de difracción en polvo con un ánodo de cobre que emite radiación CuKa con una longitud de onda de 1,541838 Á,
siguiendo el protocolo experimental descrito en los ejemplos. En particular, el besilato de remimazolam amorfo se caracteriza por un difractograma de rayos X en polvo que presenta un pico ancho entre 10 y 40 °20 ±2°0, mientras que, el diagrama de difracción por rayos X de las formas cristalinas muestra varios picos muy bien definidos a unos ángulos determinados, en particular, según los difractogramas de rayos X en polvo mostrados en WO 2008/007071 A1 para el besilato de remimazolam cristalino forma 1, forma 2, forma 3 y forma 4.
La primera etapa del procedimiento de la invención, la etapa a), es proveer una disolución que consiste esencialmente en besilato de remimazolam y un disolvente seleccionado del grupo que consiste en disolvente orgánico miscible en agua, agua y mezclas de los mismos.
Se puede utilizar cualquier forma del besilato de remimazolam, ya sea un sólido amorfo, o un sólido cristalino, como por las designadas como Forma 1, Forma 2, Forma 3 y Forma 4 en WO 2008/007071 A1, así como mezclas de cualquiera de dichas formas sólidas. En este documento también se describe el procedimiento de obtención de dichas formas cristalinas. Preferiblemente, en la etapa a) de la presente invención se utiliza la Forma 1 (según se designa en WO 2008/007071 A1) del besilato de remimazolam.
El disolvente utilizado para la disolución de la etapa a) se selecciona del grupo que consiste en disolvente orgánico miscible en agua, agua y mezclas de los mismos.
La expresión “disolvente orgánico miscible en agua” hace referencia a un compuesto líquido que contiene carbono y que al mezclarlo con agua en cualquier proporción a una temperatura de entre 20 y 25 °C se obtiene una mezcla que presenta una única fase líquida. Ejemplos de disolventes orgánicos miscibles en agua son acetonitrilo, dimetilsulfóxido, metanol, etanol e isopropanol, preferiblemente acetonitrilo.
Las mezclas de disolventes pueden tener dos o más disolventes, como por ejemplo 2, 3 o 4 disolventes, preferiblemente dos disolventes, más preferiblemente en donde uno de los disolventes de la mezcla es agua o acetonitrilo, aún más preferiblemente en donde uno de los disolventes de la mezcla es agua. Los disolventes de la mezcla pueden estar en cualquier proporción volumétrica entre ellos. En particular cuando se utilizan mezclas de agua y otro disolvente seleccionado de acetonitrilo y dimetilsulfóxido. En particular, cuando se utilizan mezclas de agua y otro disolvente seleccionado de metanol, etanol e isopropanol, el contenido en agua es al menos el 70%.
Preferiblemente, el disolvente de la etapa a) se selecciona del grupo que consiste en agua, acetonitrilo y mezclas de los mismos, más preferiblemente el disolvente es agua.
En las mezclas de agua y acetonitrilo dichos disolventes pueden estar en cualquier proporción volumétrica entre ellos, por ejemplo de en una proporción en volumen de agua a acetonitrilo de 0,1:1 a 10:1, preferiblemente de 0,2:1 a 5:1, más preferiblemente de 0,25:1 a 4:1, más preferiblemente de 0,3:1 a 3:1, más preferiblemente de 0,5:1 a 2:1, más preferiblemente de 0,6:1 a 1,5:1, más preferiblemente de 0,8:1 a 1,2:1, aún más preferiblemente de 0,9:1 a 1,1:1, lo más preferido de 1:1.
Más preferiblemente, el disolvente de la etapa a) se selecciona del grupo que consiste en agua, acetonitrilo y una mezcla de agua y acetonitrilo en una proporción en volumen de 0,5:1 a 2:1.
En una realización particular, la concentración de besilato de remimazolam en la disolución provista en la etapa a) es de 5 a 15 mg/mL (mg de besilato de remimazolam/mL de disolución), más preferiblemente de 7 a 13 mg/mL.
La siguiente etapa del procedimiento de la invención, etapa b), es liofilizar la disolución provista en la etapa anterior, etapa a).
El término “liofilizar” o "liofilización” hace referencia a un proceso que tiene como objetivo separar el agua, un disolvente orgánico o mezcla los mismos de una disolución, que en la presente invención contiene como soluto el besilato de remimazolam, mediante congelación de la disolución y posterior sublimación del disolvente congelado (sólido). El término “sublimación” o “sublimar” hacen referencia al proceso de cambio de estado sólido a estado gaseoso sin pasar por el estado líquido. La liofilización implica una etapa de congelación de la disolución por debajo de su punto eutéctico (que es la temperatura mínima a la que congelan todos los componentes de la disolución) y una etapa de sublimación del disolvente (agua, disolvente orgánico o mezcla de los mismos) del producto congelado y eliminación del disolvente sublimado. Generalmente la sublimación y eliminación del disolvente se realiza a presión reducida, es decir, presión inferior a 101325 Pa.
La etapa b) de liofilización del procedimiento de la presente invención comprende:
b1) congelar la disolución provista en la etapa a) a una temperatura inferior a -45 °C, y
b2) eliminar el disolvente del producto obtenido en la etapa b1) mediante calentamiento desde la temperatura de dicho producto hasta una temperatura de 10 °C a 40 °C, a una presión inferior a 101325 Pa (1,01325 bar) y durante un periodo de tiempo inferior a 5 días.
La etapa b1) de congelación de la disolución provista en la etapa a) a una temperatura inferior a -45 °C se puede realizar enfriando la disolución de la etapa a) a la temperatura inferior a -45 °C, por ejemplo mediante el uso de nitrógeno líquido o una mezcla de nieve carbónica (CO2 sólido) y acetona, hasta que la disolución se congela totalmente.
En una realización preferida, la temperatura de congelación de la etapa b1) es inferior a -55 °C; preferiblemente la temperatura de congelación de la etapa b1) es de -55 °C a -85 °C; más preferiblemente de -55 °C a -65 °C o de -75 °C a -85 °C; aún más preferiblemente de -58 °C a -62 °C o de -78 °C a -82 °C.
Preferiblemente la temperatura de la etapa b1) se mantiene de 10 minutos a 36 horas, más preferiblemente de 10 minutos a 1 hora o de 15 horas a 30 horas; aún más preferiblemente de 10 minutos a 40 minutos o de 20 horas a 25 horas.
Preferiblemente, la temperatura de congelación de la etapa b1) es de -55 °C a -65 °C y se mantiene en este rango de temperatura de 15 horas a 30 horas, o en donde la temperatura de congelación de la etapa b1) es de -75 °C a -85 °C y se mantiene en este rango de temperatura de 10 minutos a 1 hora.
Preferiblemente, la temperatura de congelación de la etapa b1) es de -58 °C a -62 °C y se mantiene en este rango de temperatura de 20 horas a 25 horas, o en donde la temperatura de congelación de la etapa b1) es de -78 °C a -82 °C y se mantiene en este rango de temperatura de 10 minutos a 40 minutos.
Una vez finalizada la etapa b1) se procede con la siguiente etapa de la liofilización, la etapa b2), en la que se elimina el disolvente (agua, disolvente orgánico miscible en agua o mezcla de los mismos tal como se ha definido anteriormente) del producto obtenido (congelado) en la etapa b1) mediante calentamiento desde la temperatura de dicho producto hasta una temperatura de 10 °C a 40 °C, a una presión inferior a 101325 Pa (1,01325 bar) y durante un periodo de tiempo inferior a 5 días.
El término "eliminar” significa reducir total o parcialmente el contenido de disolvente del producto congelado obtenido en la etapa b1). Dicha eliminación del disolvente rinde un producto que presenta un contenido en disolvente inferior al 5%, preferiblemente un contenido en disolvente inferior al 3% en peso, más preferiblemente inferior al 2% en peso, más preferiblemente inferior al 1% en peso, más preferiblemente inferior al 0,5% en peso, en donde el porcentaje en peso es peso de disolvente presente en el producto obtenido tras la etapa b2) respecto al peso total del producto obtenido en la etapa b2). El porcentaje de disolvente presente en el producto obtenido en la etapa b2) se puede determinar mediante análisis de termogravimetría o mediante análisis por valoración volumétrica de Karl-Fisher.
El procedimiento para determinar el porcentaje de disolvente presente en el producto obtenido en la etapa b2) mediante análisis de termogravimetría se puede realizar empleando una termobalanza (por ejemplo, modelo Mettler Toledo TGA/SDTA851e) disponiendo la muestra a analizar en un crisol de alúmina de 70 microlitros con un flujo de nitrógeno sobre la muestra de 50 mL/min. El calentamiento de la muestra se realiza de 30 a 300 °C con un aumento de la temperatura mediante gradiente de 10 °C/min. Previamente al análisis de la muestra, se realiza un blanco en las mismas condiciones, el cual se resta al resultado del análisis de la muestra.
Alternativamente, el procedimiento para determinar el porcentaje de disolvente presente en el producto obtenido en la etapa b2) cuando dicho disolvente es agua también puede realizarse mediante análisis por valoración de Karl-Fischer. En este caso se puede emplear un valorador volumétrico (por ejemplo, modelo Mettler Toledo V30) disponiendo la muestra a analizar exactamente pesada en el vaso de valoración y realizando la valoración con el reactivo correspondiente de concentración en mg/mL conocida (por ejemplo, Hydranal Composite 5K) hasta llegar al punto final de valoración.
Preferiblemente, la presión en la etapa b2) es de 0,01 Pa (0,0001 mbar) a 101000 Pa (1,01 bar); más preferiblemente la presión en la etapa b2) es de 0,01 Pa (0,0001 mbar) a 100 Pa (1 mbar) o de 50000 Pa (0,5 bar) a 101000 Pa (1,01 bar); aún más preferiblemente la presión en la etapa b2) es de 0,05 Pa (0,0005 mbar) a 50 Pa (0,5 mbar) o de 90000 Pa (0,9 bar) a 101000 Pa (1,01 bar).
Preferiblemente, el calentamiento en la etapa b2) se realiza hasta una temperatura de 15 a 30 °C, más preferiblemente hasta una temperatura de 20 a 25 °C.
Preferiblemente, la variación de temperatura en la etapa b2) del procedimiento de la invención es de 0,5 a 1,5 °C/minuto, más preferiblemente de 0,8 a 1,2 °C/min, aún más preferiblemente de 0,9 a 1,1 °C/min.
La etapa b2) se realiza hasta que se ha eliminado todo el disolvente, con la condición de que tenga una duración de menos de 5 días. Preferiblemente, la etapa b2) se realiza durante un periodo de tiempo de menos de 4 días, más preferiblemente menos de 3 días, más preferiblemente de 20 a 60 horas, aún más preferiblemente de 20 a 30 horas o de 40 a 60 horas.
En una realización preferida, la etapa b2) se realiza a una presión de 50000 Pa (0,5 bar) a 101000 Pa (1,01 bar) durante un periodo de tiempo de 20 a 30 horas; más preferiblemente a una presión de 90000 Pa (0,9 bar) a 101000 Pa (1,01 bar) durante un periodo de tiempo de 20 a 30 horas.
En una realización particular, la temperatura de congelación de la etapa b1) es de -75 °C a -85 °C y se mantiene en este rango de temperatura de 10 minutos a 1 hora, y etapa b2) se realiza a una presión de 50000 Pa (0,5 bar) a 101000 Pa (1,01 bar) durante un periodo de tiempo de 20 a 30 horas, con calentamiento hasta una temperatura de 15 a 30 °C.
En otra realización preferida, la etapa b2) se realiza a una presión de 0,01 Pa (0,0001 mbar) a 100 Pa (1 mbar) durante un periodo de tiempo de 40 a 50 horas; más preferiblemente a una presión de 0,05 Pa (0,0005 mbar) a 50 Pa (0,5 mbar) durante un periodo de tiempo de 40 a 50 horas.
En una realización particular, la temperatura de congelación de la etapa b1) es de -55 °C a -65 °C y se mantiene en este rango de temperatura de 20 a 30 horas, y la etapa b2) se realiza a una presión de 0,01 Pa (0,0001 mbar) a 100 Pa (1 mbar) durante un periodo de tiempo de 40 a 50 horas, con calentamiento hasta una temperatura de 15 a 30 °C, más preferiblemente hasta una temperatura de 15 a 25 °C.
Preferiblemente, la etapa b2) del procedimiento de la invención comprende:
(i) mantener una temperatura de -30 °C a -20 °C y una presión de 10 Pa (0,1 mbar) a 50 Pa (0,5 mbar) durante un periodo de tiempo de 15 a 24 h,
(ii) mantener una temperatura de -5 °C a 5 °C y una presión de 10 Pa (0,1 mbar) a 50 Pa (0,5 mbar) durante un periodo de tiempo de 6 a 18 h,
(iii) mantener una temperatura de 8 °C a 15 °C y una presión de 10 Pa (0,1 mbar) a 50 Pa (0,5 mbar) durante un periodo de tiempo de 12 a 24 h, y
(iv) mantener una temperatura de 15 °C a 25 °C y una presión de 0,01Pa (0,0001 mbar) a 1 Pa (0,01 mbar) durante un periodo de tiempo de 3 a 18 h.
En particular, las etapas (i)-(iv) ser realizan de forma secuencial, es decir, primero se realiza la etapa (i), a continuación la etapa (ii), a continuación la etapa (iii) y por último la etapa (iv).
En una realización particular, la temperatura de congelación de la etapa b1) es de -55 °C a -65 °C y se mantiene en este rango de temperatura de 20 a 30 horas, y la etapa b2) comprende las etapas (i)-(iv) descritas arriba.
Preferiblemente, la variación de temperatura en la etapa b2) del procedimiento de la invención es de 0,5 a 1,5 °C/minuto, más preferiblemente de 0,8 a 1,2 °C/min, aún más preferiblemente de 0,9 a 1,1 °C/min.
En una realización preferida, la liofilización de la etapa b) del procedimiento de la invención se lleva a cabo en ausencia de un excipiente higroscópico seleccionado del grupo que consiste en lactosa, manitol, trehalosa, sacarosa, maltosa, dextrano, povidona, glicina y mezcla de los mismos, es decir, los excipientes higroscópicos mencionados no están presentes en la disolución de besilato de remimazolam provista en la etapa a), congelada en la etapa b1) y tratada en la etapa b2) no contiene ninguno de los excipientes higroscópicos anteriormente mencionados.
En una realización particular, la liofilización de la etapa b) del procedimiento de la invención se lleva a cabo en ausencia de un excipiente higroscópico seleccionado del grupo que consiste en carbohidratos y/o polímeros orgánicos.
El término “carbohidrato” se refiere a un compuesto orgánico de fórmula empírica Cm(H2O)n. Estructuralmente, los carbohidratos se pueden describir como aldehidos y cetonas polihidroxilados. Los carbohidratos se dividen en cuatro grupos químicos: monosacáridos, disacárido, oligosacáridos y polisacáridos. Los carbohidratos definidos en el presente documento incluyen todas las modificaciones, derivados y análogos de carbohidrato tales como sacáridos acídicos que contiene grupos carboxilo, grupos fosfato y/o grupos éster sulfúrico. Ejemplos de carbohidratos son amilosa, amilopectina, alginato, dextranos, almidones, mono-, di- y oligosacáridos. Ejemplos de disacáridos son lactosa, maltosa,
sacarosa y trehalosa. Ejemplos de polisacáridos son los dextranos. El polímero orgánico es preferiblemente un poliacrilato o polímero vinílico, más preferiblemente polivinilpirrolidona (o povidona)
La liofilización se puede llevar a cabo en un liofilizador, que es un aparato que generalmente comprende de los siguientes elementos: una cámara seca, un condensador con circuito de refrigeración y un sistema de vacío.
La cámara seca o cámara de liofilización es el lugar donde se coloca la disolución a liofilizar. Puede tener formas diferentes con compartimentos donde se realiza la sublimación, pasando el agua de sólido a vapor. El cierre es hermético y se trabaja a presión reducida.
El condensador con circuito de refrigeración comunica con la cámara seca y es donde se condensa el vapor que se va produciendo en la sublimación. Un refrigerante lo mantiene a una temperatura más baja que la cámara seca (generalmente entre -50 y -125 °C).
El sistema de vacío produce vacío (presión reducida, es decir, presión inferior a 101325 Pa) con una bomba de aceite que trabaja conectada a una trampa para que no pasen vapores del disolvente a su interior. El sistema de vacío elimina primero el aire de la cámara seca al iniciar el proceso de liofilización, y luego ayuda a la sublimación.
El liofilizador también comprende un sistema de regulación de la temperatura que permite alcanzar las temperaturas deseadas de congelación del producto a liofilizar así como un sistema de regulación de la temperatura que permite alcanzar hasta al menos 40 °C.
Un aspecto adicional de la presente invención está dirigido a besilato de remimazolam amorfo estable caracterizado por un difractograma de rayos X en polvo que presenta un pico ancho entre 10 y 40 °20 ±2°0, preferiblemente un difractograma de rayos X en polvo sustancialmente como el que se muestra en las Figura 1,2 o 3.
El término "estable” hace referencia a que el besilato de remimazolam amorfo no evoluciona a formas cristalinas al ser almacenado, en particular al almacenarlo a 40 °C y 80% de humedad relativa y/o al almacenarlo a 25 °C y 60% de humedad relativa durante al menos 15 días, preferiblemente durante al menos 30 días; más preferiblemente al almacenarlo durante al menos 15 días a 40 °C y 80% de humedad relativa, aún más preferiblemente durante al menos 30 días.
La presencia/ausencia de formas cristalinas se puede determinar mediante análisis por difracción de rayos X en polvo, en particular utilizando un sistema de difracción en polvo con un ánodo de cobre que emite radiación CuKa con una longitud de onda de 1,541838 Á, siguiendo el protocolo experimental descrito en los ejemplos. En particular, el besilato de remimazolam amorfo se caracteriza por un difractograma de rayos X en polvo que presenta un pico ancho entre 10 y 40 °20 ±2°0, mientras que, el diagrama de difracción por rayos X de las formas cristalinas muestra varios picos muy bien definidos a unos ángulos determinados, en particular, según los difractogramas de rayos X en polvo mostrados en WO 2008/007071 A1 para el besilato de remimazolam cristalino forma 1, forma 2, forma 3 y forma 4.
Preferiblemente, el besilato de remimazolam amorfo estable se caracteriza por un difractograma de rayos X con ausencia de picos característicos de la forma cristalina 1, es decir, ausencia de picos a 7,3, 7,8, 9,4, 12,1, 14,1, 14,7 y/o 15,6 °20 ±0,2°, ausencia de picos característicos de la forma cristalina 2, es decir, ausencia de picos a 8,6, 10,5, 12,0, 13,1, 14,415,9 y/o 16,2 °20 ±0,2°, ausencia de picos característicos de la forma cristalina 3, es decir, ausencia de picos a 7,6, 11,2, 12,4, 14,6, 15,2, 16,4 y/o 17,7 °20 ±0,2°, y ausencia de picos característicos de la forma cristalina 4, es decir, ausencia de picos a 7,6, 10,8, 15,2, 15,9 y/o 22,0 °20 ±0,2°.
La presente invención también se relaciona con el besilato de remimazolam amorfo obtenible mediante el procedimiento de liofilización del primer aspecto, descrito anteriormente.
Con el fin de facilitar la comprensión de las ideas precedentes, se describen a continuación algunos ejemplos de los procedimientos experimentales y ejemplos de realización de la presente invención. Dichos ejemplos son de carácter meramente ilustrativo.
Ejemplos
Métodos de análisis
El análisis de XRPD se realizó utilizando un difractómetro de polvo de rayos X de modelo Siemens D-5000 equipado con un ánodo de Cobre. La radiación utilizada es la CuKa con
una longitud de onda de 1,541838 Á. Parámetros de escaneado: 4-50 grados 20, escaneo continuo, ratio: 1,2 grados/minuto. .
El análisis de calorimetría diferencial de barrido (DSC) se realizó en un aparato Mettler Toledo 822e con software STARe SW15.00. Parámetros: rango de calentamiento de 25 a 300 °C con una rampa de 20 °C/min y flujo de N2 de 50 ml/min. La medida se hace con una cápsula cerrada perforada.
El análisis de termogravimetría para obtener el porcentaje en peso de agua se realizó en una termobalanza Mettler Toledo TGA/STDA851e utilizando aproximadamente 3 mg de muestra a analizar y un flujo de nitrógeno de 50 mL/min. La muestra se calentó de 30 a 300 °C con una rampa de 10 °C/min. Previamente se realizó un blanco en las mismas condiciones de análisis y se restó del resultado obtenido para la muestra.
La pureza de los productos obtenidos se analizó mediante la técnica de Cromatografía Líquida de Ultra-Alta Resolución (UHPLC) en un aparato de la marca Waters, modelo Acquity, provisto de detector de fotodiodos y horno termostatizado para la columna. Se ha utilizado una columna CSH C18 (3 x 50 mm y 1,7 ^m) y las fases móviles A (KH2PO45 mM pH 2) y B (acetonitrilo) con las condiciones de análisis siguientes:
- Caudal: (mL/min): 0,5
- Ta columna (°C): 40
- Longitud de onda (nm): 230
- Volumen de inyección (^L): 1
- Tiempo de adquisición (min): 10
- Diluyente: acetonitrilo/agua (1:1)
- Gradiente:
Ejemplo 1. Obtención de besilato de remimazolam amorfo por liofilización
En los ensayos de liofilización se ha utilizado como material de partida besilato de remimazolam obtenido mediante el procedimiento divulgado en el ejemplo 7 del documento WO 2019/072944 A, el cual corresponde a la Forma 1.
Los ensayos de liofilización se realizaron o en un liofilizador de la marca Telstar, serie LyoQuest (protocolo A) o en un liofilizador de la marca Telstar, serie LyoBeta 35 (protocolo B).
En el protocolo A la temperatura de congelación fue de -80 °C. El tiempo de secado fue de 24 horas, durante el cual se dejó evolucionar la temperatura de -80 °C a 25 °C. La rampa de variación de temperatura fue de 1 °C/min. La presión de vacío durante el secado fue de 100000 Pa (1,0 bar).
En el protocolo B la temperatura de congelación fue de -60 °C. El tiempo de secado se dividió en secado primario (18 horas a -25 °C, 8 h a 0 °C y 15 horas a 10 °C) y secado secundario (5 horas a 20 °C). Las rampas de variación de temperatura se establecieron en 1 °C/min. La presión de vacío durante el secado fue de 20 Pa (0,2 mbar) durante el secado primario y de 0,1 Pa (0,001 mbar) durante el secado secundario.
El sólido resultante en cada uno de los ensayos se guardó bajo atmósfera de N2.
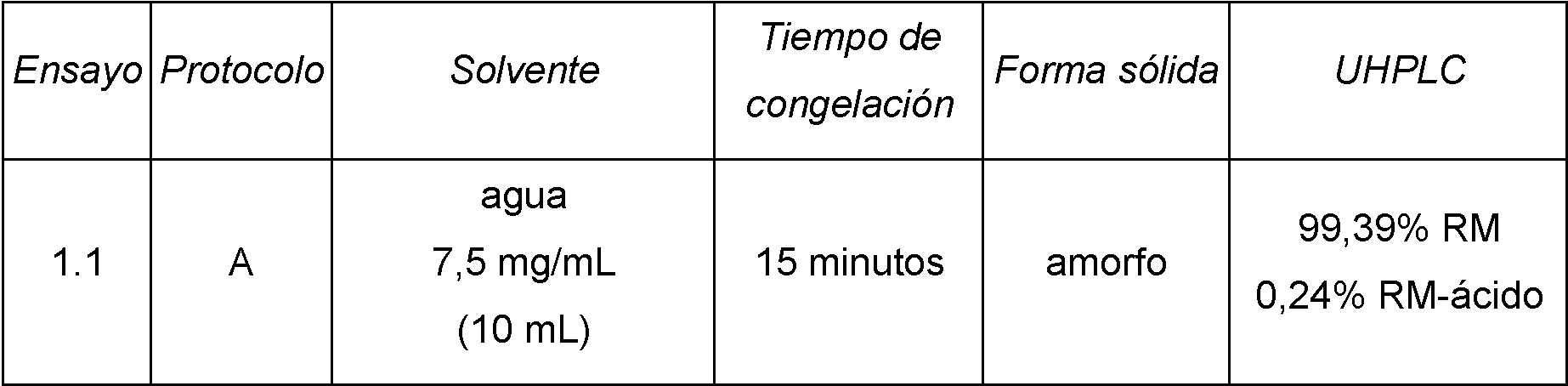
Las condiciones particulares de los ensayos 1.1-1.5 así como los resultados obtenidos se recogen en la Tabla 1, en donde RM se refiere a remimazolam y RM-ácido se refiere al producto ácido carboxílico obtenido por hidrólisis del éster metílico de remimazolam. En la columna de solvente se indica el solvente utilizado, la concentración de besilato de remimazolam en la disolución y el volumen de disolución.
Tabla 1
En todos los ensayos realizados se obtuvo la forma amorfa de la sal besilato de remimazolam, sin observarse presencia de ninguna forma cristalina, ya sea la Forma 1, Forma 2, Forma 3 o Forma 4 descritas en WO 2008/007071 A1. Adicionalmente, en los ensayos utilizando el protocolo B y agua como disolvente se ha obtenido la forma amorfa de la sal besilato de remimazolam con un contenido en agua que varía entre 0,1% y 0,4% en peso. Particularmente en el ensayo 1.6 se obtuvo un porcentaje de agua correspondiente a un 0,22%.
Ejemplo comparativo 2. Intento de obtención de forma amorfa mediante precipitación
En los ensayos de precipitación se ha utilizado como material de partida besilato de remimazolam obtenido mediante el procedimiento divulgado en el ejemplo 7 del documento WO 2019/072944 A, el cual corresponde a la Forma 1.
Se realizaron diferentes pruebas de precipitación para intentar obtener la forma amorfa del besilato de remimazolam siguiendo los protocolos de procedimiento C, D y E, tal como se describe a continuación:
Protocolo C: x g de besilato de remimazolam se disolvieron en la cantidad de disolvente o mezcla de disolventes indicada en la Tabla 2 (1 Vol hace referencia a 1 mL del disolvente correspondiente por cada 1 mg de besilato de remimazolam inicial) a la temperatura de aproximadamente 50 °C. La solución así obtenida se adicionó sobre el antisolvente previamente calentado a la temperatura de aproximadamente 50 °C. Prácticamente de inmediato se observó precipitación de un sólido y la mezcla así obtenida se enfrió a la temperatura de aproximadamente 0 °C. El sólido resultante en cada uno de los ensayos se filtró y secó en estufa, almacenándose en atmósfera de N2 hasta su análisis de XRPD.
Protocolo D: x g de besilato de remimazolam se disolvieron en la cantidad de disolvente o mezcla de disolventes indicada en la Tabla 2 (1 Vol hace referencia a 1 mL del disolvente correspondiente por cada 1 mg de besilato de remimazolam inicial) a la temperatura de aproximadamente 50 °C. La solución así obtenida se adicionó sobre el antisolvente previamente enfriado a la temperatura de aproximadamente 0 °C. Prácticamente de inmediato se observa precipitación de un sólido (con la excepción del ensayo 10) y la mezcla así obtenida se mantuvo 30 minutos a la temperatura de aproximadamente 0 °C. El sólido resultante en cada uno de los ensayos se filtró y secó en estufa, almacenándose en atmósfera de N2 hasta su análisis de XRPD.
Protocolo E: x g de besilato de remimazolam se disolvieron en la cantidad de disolvente o mezcla de disolventes indicada en la Tabla 2 (1V o 1Vol hace referencia a 1 mL del disolvente correspondiente por cada 1 mg de besilato de remimazolam inicial) a la temperatura de aproximadamente 20 °C. La solución así obtenida se adicionó sobre el antisolvente previamente enfriado a la temperatura de aproximadamente 0 °C. Prácticamente de inmediato se observa precipitación de un sólido y la mezcla así obtenida se mantuvo 30 minutos a la temperatura de aproximadamente 0 °C. El sólido resultante en cada uno de los ensayos se filtró y secó en estufa, almacenándose en atmósfera de N2 hasta su análisis de XRPD.
Las condiciones particulares de los ensayos 2.1-2.14 así como los resultados obtenidos se recogen en la Tabla 2.
Tabla 2
Como se puede observar, ninguno de los ensayos rindió la forma amorfa de besilato de remimazolam. En uno de los ensayos no se obtuvo un sólido (ensayo 2.10) y en los demás ensayos (ensayos 2.1-2.9 y 2.11-2.14) se obtuvo o bien la forma 1 o la forma 2 descritas en WO 2008/007071 A1.
Ejemplo comparativo 3. Intento de obtención de forma amorfa mediante secado por atomización (“spray-drying” )
Las pruebas de secado por atomización se realizaron en un equipo Büchi B-290, que permite temperaturas de entrada de aire de hasta 220 °C, caudales máximos de aire de 35 m3/h y un caudal máximo de aire comprimido de 800 L/h. El sistema consiste en un circuito cerrado, donde se intercalan un deshumidificador y un condensador de disolventes entre la
entrada y la salida de aire de secado al equipo de atomización. El circuito de aire se llenó inicialmente con nitrógeno y se inició a atomizar la mezcla de alimentación en el momento en el que prácticamente desaparece el oxígeno del circuito.
Se realizaron pruebas experimentales diferentes utilizando metanol o acetonitrilo como disolventes, diferentes caudales de aire comprimido (L/h) y diferentes temperaturas de entrada y salida (°C). El caudal de aire de secado se mantuvo en todos los ensayos constante a 38 m3/h.
En los ensayos de secado por atomización se ha utilizado como material de partida besilato de remimazolam obtenido mediante el procedimiento divulgado en el ejemplo 6 del documento WO 2019/072944 A, el cual corresponde a la Forma 1.
Las condiciones particulares de los ensayos realizados (ensayos 3.1-3.4) así como los resultados obtenidos se recogen en la Tabla 3.
Tabla 3
Únicamente en un caso, en el ensayo 3.2, se obtuvo un producto que presentaba estructura amorfa. El sólido obtenido presentaba estructura amorfa con contaminación de trazas de formas cristalinas, tal como se puede comprobar por la presencia de las señales a 15,8 y 16,2 grados 20 en el patrón de difracción de rayos X de la Figura 4, correspondientes a la forma 2 de WO 2008/007071 A1. El DSC de este sólido se reproduce en la Figura 5. En el
DSC la presencia de forma amorfa se ve claramente por la exoterma presente en el rango de entre 130 y 140 °C, que corresponde al proceso de cristalización de dicha forma al calentar. Las endotermas siguientes corresponden a la fusión de las formas cristalinas 1 y 3 y la endoterma de la forma 2 debería salir un poco antes (180°C) que el de la forma 1 (190°C), pero en este caso se observa una endoterma bastante amplia, lo que dificulta concluir mediante dicha técnica la presencia de la forma cristalina 2 presente como contaminación de la forma amorfa. No obstante, la contaminación con formas cristalinas se observó claramente en el patrón de difracción de rayos X, tal como se ha indicado anteriormente.
Ejemplo comparativo 4. Reproducción de la obtención de la forma amorfa del estudio de polimorfismo del ejemplo 5 de la patente EP 2081921 B1
Con el propósito de reproducir la obtención de la forma amorfa tal como se indica en las entradas 3, 5 y 17 de la tabla 11 (pág. 12 de la patente europea EP 2 081 921 B1) se realizaron los siguientes experimentos considerándose como representativos de la descripción divulgada en el Ejemplo 5, estudio de polimorfismo, de la patente europea mencionada.
Se mezclaron, a la temperatura de aproximadamente 20 °C, 3 muestras diferentes de 5 g cada una de ellas correspondientes a la forma cristalina 1 del besilato de remimazolam (forma 1 según WO 2008/007071 A1) con 10 mL de isopropanol (ensayo 4.1), 10 mL de diclorometano (ensayo 4.2) y 10 mL de una mezcla de THF y 2.5% de agua (V/V) (ensayo 4.3), respectivamente. Las 3 mezclas obtenidas de esta manera se sometieron al siguiente ciclo realizado de manera consecutiva durante 172 horas mediante un aparato Mettler Toledo EasyMax 102:
a) calentamiento a la temperatura de 60-62 °C en 30 minutos,
b) mantenimiento durante 10 minutos a la temperatura de 60-62 °C
c) enfriamiento a la temperatura de 20-25 °C en 15 minutos
d) mantenimiento durante 10 minutos a la temperatura de 20-25 °C
Una vez terminado los ciclos indicados, se evaporó el disolvente de cada una de las tres mezclas obtenidas en un rotavapor con la temperatura del baño a aproximadamente 35 ° C y los 3 sólidos resultantes fueron analizados mediante XRPD y UHPLC).
Los tres ensayos condujeron a la obtención de la forma cristalina 2 del besilato de remimazolam (forma 2 según WO 2008/007071 A1), sin observarse presencia de la forma amorfa de dicha sal, tal como se puede observar en los XRPD de los sólidos obtenidos en cada uno de los ensayos 4.1 (Figura 6), 4.2 (Figura 7) y 4.3 (Figura 8). El análisis por UHPLC reveló la siguiente pureza para los productos obtenidos, en donde RM se refiere a remimazolam y RM-ácido se refiere al producto ácido carboxílico obtenido por hidrólisis del éster metílico de remimazolam:
- Ensayo 4.1: Remimazolam: 99,64%; RM-ácido: 0,22%
- Ensayo 4.2: Remimazolam: 99,74%; RM-ácido: 0,17%
- Ensayo 4.3: Remimazolam: 90,92%; RM-ácido: 8,53%
Ejemplo 5. Estudio de estabilidad
El besilato de remimazolam obtenido en el ejemplo comparativo 3 (forma amorfa contaminada con trazas de la forma cristalina 2) se almacenó a 40 °C y 80% HR. Tras una semana de almacenamiento en estas condiciones, se obtiene la forma cristalina 2 descrita en WO 2008/007071 A1) sin observarse presencia de la forma inicial, tal como se puede apreciar en el XRPD (Figura 9) y en el DSC (Figura 10).
El besilato de remimazolam obtenido en el ejemplo comparativo 3 (forma amorfa contaminada con trazas de la forma cristalina 2) también se almacenó a 4 °C. Tras un mes de almacenamiento en estas condiciones, se obtiene la forma cristalina 2 descrita en WO 2008/007071 A1 sin observarse presencia de la forma inicial, tal como se puede apreciar en el XRPD (Figura 11).
Sin embargo, cuando se obtiene besilato de remimazolam en forma amorfa sin observarse presencia de forma cristalina, dicha forma amorfa es estable en el tiempo y no evoluciona hacia la conversión en una forma cristalina. Esto se evidencia en los resultados de estabilidad del producto en forma amorfa obtenido según los ensayos 1.5 (liofilización en acetonitrilo) y 1.6 (liofilización en agua) indicados en la Tabla 1. Para determinar dicha estabilidad se almacenó en cámaras climáticas en dos condiciones diferentes: a) temperatura de 40 °C y 80% de humedad relativa y b) temperatura de 25 °C y 60% de humedad relativa. El producto almacenado en las condiciones a) durante 15 días y durante 30 días continúa manteniendo las características iniciales en cuanto a forma amorfa, tal como se muestra en los patrones de XRPD y DSC determinados a los 15 días citados (Figuras 12 a 15) así como a los 30 días citados (Figuras 16-19).
Claims (18)
1. Procedimiento para la preparación de besilato de remimazolam amorfo que comprende las siguientes etapas:
a) proveer una disolución que consiste esencialmente en besilato de remimazolam y un disolvente seleccionado del grupo que consiste en disolvente orgánico miscible en agua, agua y mezclas de los mismos, y
b) liofilizar la disolución provista en la etapa a), en donde la liofilización comprende b1) congelar la disolución provista en la etapa a) a una temperatura inferior a -45 °C, y b2) eliminar el disolvente del producto obtenido en la etapa b1) mediante calentamiento desde la temperatura de dicho producto hasta una temperatura de 10 °C a 40 °C, a una presión inferior a 101325 Pa y durante un periodo de tiempo inferior a 5 días.
2. Procedimiento según la reivindicación 1, en el que el disolvente de la disolución de besilato de remimazolam provista en la etapa a) se selecciona del grupo que consiste en agua, acetonitrilo y mezclas de los mismos.
3. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que la concentración de besilato de remimazolam en la disolución provista en la etapa a) es de 5 a 15 mg/mL.
4. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que la temperatura de congelación de la etapa b1) es inferior a -55 °C.
5. Procedimiento según la reivindicación 4, en el que la temperatura de congelación de la etapa b1) es de -55 °C a -85 °C.
6. Procedimiento según la reivindicación 5, en el que la temperatura de congelación de la etapa b1) es de -55 °C a -65 °C o de -75 °C a -85 °C.
7. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que temperatura de la etapa b1) se mantiene de 10 minutos a 36 horas.
8. Procedimiento según la reivindicación 7, en el que la temperatura de la etapa b1) se mantiene de 10 minutos a 1 hora o de 15 horas a 30 horas.
9. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que la temperatura de congelación de la etapa b1) es de -55 °C a -65 °C y se mantiene en este rango de temperatura de 15 horas a 30 horas, o en donde la temperatura de congelación de la etapa b) es de -75 °C a -85 °C y se mantiene en este rango de temperatura de 10 minutos a 1 hora.
10. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que la presión en la etapa b2) es de 0,01 Pa a 101000 Pa.
11. Procedimiento según la reivindicación 10, en el que la presión en la etapa b2) es de 0,01 Pa a 100 Pa o de 50000 Pa a 101000 Pa.
12. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que calentamiento en la etapa b2) se realiza hasta una temperatura de 15 a 30 °C.
13. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que la etapa b2) se realiza durante un periodo de tiempo de 20 a 60 horas.
14. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que la etapa b2) se realiza a una presión de 50000 Pa a 101000 Pa durante un periodo de tiempo de 20 a 30 horas.
15. Procedimiento según una cualquiera de las reivindicaciones 1 a 13, en el que en la etapa b2) se realiza a una presión de 0,01 Pa a 100 Pa durante un periodo de tiempo de 40 a 60 horas.
16. Procedimiento según la reivindicación 15, en el que la etapa b2) comprende:
(i) mantener una temperatura de -30 °C a -20 °C y una presión de 10 Pa a 50 Pa durante un periodo de tiempo de 15 a 24 h,
(ii) mantener una temperatura de -5 °C a 5 °C y una presión de 10 Pa a 50 Pa durante un periodo de tiempo de 6 a 18 h,
(iii) mantener una temperatura de 8 °C a 15 °C y una presión de 10 Pa a 50 Pa durante un periodo de tiempo de 12 a 24 h, y
(iv) mantener una temperatura de 15 °C a 25 °C y una presión de 0,01Pa a 1 Pa durante un periodo de tiempo de 3 a 18 h.
17. Procedimiento según una cualquiera de las reivindicaciones anteriores, en el que la variación de temperatura en la etapa b2) es de 0,5 a 1,5 °C/minuto.
18. Besilato de remimazolam amorfo estable caracterizado porque presenta un difractograma de rayos X en polvo que presenta un pico ancho entre 10 y 40 °20 ±2°0.
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| ES201930677A ES2803099B2 (es) | 2019-07-22 | 2019-07-22 | Procedimiento de obtención de besilato de remimazolam amorfo |
| US17/627,275 US12331053B2 (en) | 2019-07-22 | 2020-07-21 | Method for obtaining amorphous remimazolam besylate |
| PCT/EP2020/070528 WO2021013826A1 (en) | 2019-07-22 | 2020-07-21 | Method for obtaining amorphous remimazolam besylate |
| JP2022504142A JP2022542866A (ja) | 2019-07-22 | 2020-07-21 | 非晶質レミマゾラムベシル酸塩を得るための方法 |
| EP20747351.3A EP4003995A1 (en) | 2019-07-22 | 2020-07-21 | Method for obtaining amorphous remimazolam besylate |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| ES201930677A ES2803099B2 (es) | 2019-07-22 | 2019-07-22 | Procedimiento de obtención de besilato de remimazolam amorfo |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| ES2803099A1 ES2803099A1 (es) | 2021-01-22 |
| ES2803099A8 ES2803099A8 (es) | 2021-03-04 |
| ES2803099B2 true ES2803099B2 (es) | 2021-11-08 |
Family
ID=71846360
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES201930677A Active ES2803099B2 (es) | 2019-07-22 | 2019-07-22 | Procedimiento de obtención de besilato de remimazolam amorfo |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US12331053B2 (es) |
| EP (1) | EP4003995A1 (es) |
| JP (1) | JP2022542866A (es) |
| ES (1) | ES2803099B2 (es) |
| WO (1) | WO2021013826A1 (es) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2025038446A2 (en) * | 2023-08-11 | 2025-02-20 | Eagle Pharmaceuticals, Inc. | Use of remimazolam for pediatric sedation |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9911152D0 (en) | 1999-05-14 | 1999-07-14 | Glaxo Group Ltd | Short-acting benzodiazepines |
| DK2081921T3 (da) * | 2006-07-10 | 2011-01-03 | Paion Uk Ltd | Korttidsvirkende benzodiazepinsalte og deres polymorfe former |
| CN102964349A (zh) * | 2011-08-31 | 2013-03-13 | 江苏恒瑞医药股份有限公司 | 苯并二氮杂*衍生物的托西酸盐及其多晶型、它们的制备方法和用途 |
| PT2852389T (pt) * | 2012-05-22 | 2017-12-13 | Paion Uk Ltd | Composições que compreendem benzodiazepinas de ação rápida |
| BR112015004477A8 (pt) * | 2012-08-31 | 2019-08-27 | Paion Uk Ltd | uso de composto na preparação de um sedativo e composição farmacêutica |
| FR3045383B1 (fr) * | 2015-12-18 | 2019-06-14 | Maat Pharma | Procede de lyophilisation d'un echantillon de microbiote fecal |
| ES2709298B2 (es) | 2017-10-13 | 2019-08-21 | Moehs Iberica Sl | Procedimiento para preparar metil ester de acido 3-[(4s)-8-bromo-1-metil-6-(piridin-2-il)-4h-imidazo[1,2-a][1,4]benzodiazepin-4-il]-propionico, y compuestos utiles en ese procedimiento |
-
2019
- 2019-07-22 ES ES201930677A patent/ES2803099B2/es active Active
-
2020
- 2020-07-21 WO PCT/EP2020/070528 patent/WO2021013826A1/en not_active Ceased
- 2020-07-21 EP EP20747351.3A patent/EP4003995A1/en active Pending
- 2020-07-21 JP JP2022504142A patent/JP2022542866A/ja active Pending
- 2020-07-21 US US17/627,275 patent/US12331053B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2022542866A (ja) | 2022-10-07 |
| US20220402923A1 (en) | 2022-12-22 |
| US12331053B2 (en) | 2025-06-17 |
| ES2803099A8 (es) | 2021-03-04 |
| ES2803099A1 (es) | 2021-01-22 |
| WO2021013826A1 (en) | 2021-01-28 |
| EP4003995A1 (en) | 2022-06-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100744917B1 (ko) | 신규한 결정형의N-[4-[2-(2-아미노-4,7-디히드로-4-옥소-3H-피롤로[2,3-d]피리미딘-5-일)에틸]벤조일]-L-글루탐산 및 이의 제조방법 | |
| US8344139B2 (en) | Process for preparing crystalline polymorphic forms of (6R)-L-erythro-tetrahydrobiopterin dihydrochloride | |
| PT2820001T (pt) | Sais de sódio e de cálcio de um derivado de dihidroquinazolina e a sua utilização como agentes antivirais | |
| ES2933504T3 (es) | Sal farmacéuticamente aceptable de alquilcarbamoil naftaleniloxi octenoil hidroxiamida o de sus derivados y método para preparar la misma | |
| ES2610756T3 (es) | Formas cristalinas y amorfas de beta-l-2 desoxitimidina | |
| ES2803099B2 (es) | Procedimiento de obtención de besilato de remimazolam amorfo | |
| ES2738638T3 (es) | Sales de cabozantinib y su uso como agentes anticancerígenos | |
| ES2553639T3 (es) | Método para purificar bromuro de rocuronio | |
| RU2476440C2 (ru) | Кристаллические формы мононатриевой соли d-изоглутамил-d-триптофана | |
| RU2536685C2 (ru) | Фармацевтически приемлемые соли тимодепрессина и способ их получения | |
| ES2815924T3 (es) | Forma D1 cristalina altamente estable de la sal de monoetanolamina de eltrombopag | |
| WO2014185797A1 (en) | Process for the preparation of high purity amorphous pemetrexed disodium and crystalline forms of n-[4-[2-(2-amino-4,7-dihydro-4-oxo-3h-pyrrolo[2,3- d] pyrimidin-5-yl)ethyl] benzoyl]-l-glutamic acid | |
| CN115160186A (zh) | 氨基甲酸苯酯晶型及其制备方法 | |
| ES2266863T3 (es) | Procedimiento para controlar la mezcla de hidratos de la sal disodica de fosfluconazol. | |
| JP7792906B2 (ja) | カテコール基を有するセファロスポリン類を含有する凍結乾燥製剤およびその製造方法 | |
| TWI680977B (zh) | c-Met抑制劑之多晶形式及共晶 | |
| RU2616976C1 (ru) | Кристаллическая β-модификация 3-(4-амино-1-оксо-1,3-дигидро-2Н-изоиндол-2-ил)-пиперидин-2,6-диона, способ её получения и фармацевтическая композиция на её основе | |
| RU2656228C1 (ru) | Слабозакристаллизованная β-модификация (S)-изопропил 2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-(2Н)-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси)фосфориламино)пропаноата, способ её получения и фармацевтическая композиция на её основе | |
| RU2711106C2 (ru) | Кристаллическая μ-модификация 1-[(3R)-3-[4-амино-3-(4-фенокси-фенил)-1Н-пиразоло[3,4-d]пиримидин-1-ил]-1-пиперидил]-2-пропенил-1-она, способ её получения и фармацевтическая композиция на её основе | |
| RU2603943C1 (ru) | КРИСТАЛЛИЧЕСКАЯ γ-МОДИФИКАЦИЯ N-{3-ХЛОР-4-[(3-ФТОРБЕНЗИЛ)ОКСИ] ФЕНИЛ}-6-[5-({[2-(МЕТАНСУЛЬФОНИЛ)ЭТИЛ]АМИНО}МЕТИЛ)-2-ФУРИЛ]-4-ХИНАЗОЛИНАМИНА БИС (4-МЕТИЛБЕНЗОЛСУЛЬФОНАТА) МОНОГИДРАТА, СПОСОБ ЕЁ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЁ ОСНОВЕ | |
| WO2022025091A1 (ja) | カテコール基を有するセファロスポリン類を含有する凍結乾燥製剤およびその製造方法 | |
| EP4085062A1 (en) | Novel salts and/or co-crystals of tenofovir alafenamide |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| BA2A | Patent application published |
Ref document number: 2803099 Country of ref document: ES Kind code of ref document: A1 Effective date: 20210122 |
|
| FG2A | Definitive protection |
Ref document number: 2803099 Country of ref document: ES Kind code of ref document: B2 Effective date: 20211108 |