ES2787039T3 - Composición de suspensión oftálmica - Google Patents
Composición de suspensión oftálmica Download PDFInfo
- Publication number
- ES2787039T3 ES2787039T3 ES18209003T ES18209003T ES2787039T3 ES 2787039 T3 ES2787039 T3 ES 2787039T3 ES 18209003 T ES18209003 T ES 18209003T ES 18209003 T ES18209003 T ES 18209003T ES 2787039 T3 ES2787039 T3 ES 2787039T3
- Authority
- ES
- Spain
- Prior art keywords
- suspension
- ophthalmic
- weight
- formulation
- poloxalene
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 146
- 229940100654 ophthalmic suspension Drugs 0.000 title claims abstract description 15
- 238000009472 formulation Methods 0.000 claims abstract description 118
- 239000002245 particle Substances 0.000 claims abstract description 93
- 239000000725 suspension Substances 0.000 claims abstract description 57
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 claims abstract description 35
- 229960005278 poloxalene Drugs 0.000 claims abstract description 35
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 claims abstract description 30
- 239000004480 active ingredient Substances 0.000 claims abstract description 29
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 claims abstract description 27
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 claims abstract description 27
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 claims abstract description 26
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 claims abstract description 26
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims abstract description 23
- 239000004094 surface-active agent Substances 0.000 claims abstract description 20
- 229920000148 Polycarbophil calcium Polymers 0.000 claims abstract description 18
- 229950005134 polycarbophil Drugs 0.000 claims abstract description 18
- 238000003860 storage Methods 0.000 claims abstract description 13
- 239000000375 suspending agent Substances 0.000 claims abstract description 12
- 235000011187 glycerol Nutrition 0.000 claims abstract description 11
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 claims abstract description 7
- 229920002678 cellulose Polymers 0.000 claims abstract description 7
- 239000001913 cellulose Substances 0.000 claims abstract description 7
- 239000006172 buffering agent Substances 0.000 claims abstract description 4
- 229960000686 benzalkonium chloride Drugs 0.000 claims description 35
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 claims description 35
- 229950009769 etabonate Drugs 0.000 claims description 16
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 13
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 claims description 12
- 239000004327 boric acid Substances 0.000 claims description 12
- 239000011780 sodium chloride Substances 0.000 claims description 7
- 206010061218 Inflammation Diseases 0.000 claims description 6
- 239000000872 buffer Substances 0.000 claims description 6
- 230000004054 inflammatory process Effects 0.000 claims description 6
- 230000004968 inflammatory condition Effects 0.000 claims description 5
- 238000001356 surgical procedure Methods 0.000 claims description 5
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 claims 4
- 230000003110 anti-inflammatory effect Effects 0.000 claims 2
- 239000002736 nonionic surfactant Substances 0.000 claims 2
- XMEKHKCRNHDFOW-UHFFFAOYSA-N O.O.[Na].[Na] Chemical compound O.O.[Na].[Na] XMEKHKCRNHDFOW-UHFFFAOYSA-N 0.000 claims 1
- 206010046851 Uveitis Diseases 0.000 claims 1
- 229940009662 edetate Drugs 0.000 claims 1
- 239000000499 gel Substances 0.000 description 55
- WYQPLTPSGFELIB-JTQPXKBDSA-N Difluprednate Chemical compound C1([C@@H](F)C2)=CC(=O)C=C[C@]1(C)[C@]1(F)[C@@H]2[C@@H]2CC[C@@](C(=O)COC(C)=O)(OC(=O)CCC)[C@@]2(C)C[C@@H]1O WYQPLTPSGFELIB-JTQPXKBDSA-N 0.000 description 54
- 230000000699 topical effect Effects 0.000 description 48
- 241000283973 Oryctolagus cuniculus Species 0.000 description 44
- 239000003981 vehicle Substances 0.000 description 29
- DMKSVUSAATWOCU-HROMYWEYSA-N loteprednol etabonate Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)OCCl)(OC(=O)OCC)[C@@]1(C)C[C@@H]2O DMKSVUSAATWOCU-HROMYWEYSA-N 0.000 description 27
- 210000001519 tissue Anatomy 0.000 description 23
- 229940080267 lotemax Drugs 0.000 description 22
- 238000009826 distribution Methods 0.000 description 21
- 241001465754 Metazoa Species 0.000 description 20
- 238000000034 method Methods 0.000 description 19
- 239000008186 active pharmaceutical agent Substances 0.000 description 18
- 229960004875 difluprednate Drugs 0.000 description 17
- 239000012530 fluid Substances 0.000 description 16
- 210000001742 aqueous humor Anatomy 0.000 description 15
- 239000011324 bead Substances 0.000 description 14
- 239000003795 chemical substances by application Substances 0.000 description 14
- 210000004087 cornea Anatomy 0.000 description 14
- 210000000554 iris Anatomy 0.000 description 14
- 210000004240 ciliary body Anatomy 0.000 description 13
- 210000000795 conjunctiva Anatomy 0.000 description 13
- 230000000694 effects Effects 0.000 description 13
- 239000000178 monomer Substances 0.000 description 13
- 239000000047 product Substances 0.000 description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 11
- 239000011049 pearl Substances 0.000 description 11
- 235000010338 boric acid Nutrition 0.000 description 10
- 238000010296 bead milling Methods 0.000 description 9
- 238000003801 milling Methods 0.000 description 9
- 229920000642 polymer Polymers 0.000 description 9
- 229920002125 Sokalan® Polymers 0.000 description 8
- 238000004090 dissolution Methods 0.000 description 8
- 239000003755 preservative agent Substances 0.000 description 8
- 239000003246 corticosteroid Substances 0.000 description 7
- 239000003814 drug Substances 0.000 description 7
- 238000000227 grinding Methods 0.000 description 7
- 239000007788 liquid Substances 0.000 description 7
- 229940100655 ophthalmic gel Drugs 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 239000000839 emulsion Substances 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 238000010899 nucleation Methods 0.000 description 6
- 230000006911 nucleation Effects 0.000 description 6
- 239000003381 stabilizer Substances 0.000 description 6
- 239000002253 acid Substances 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 239000003889 eye drop Substances 0.000 description 5
- 239000011159 matrix material Substances 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 239000002674 ointment Substances 0.000 description 5
- 230000009885 systemic effect Effects 0.000 description 5
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 229920006037 cross link polymer Polymers 0.000 description 4
- 230000001186 cumulative effect Effects 0.000 description 4
- KUQWZSZYIQGTHT-UHFFFAOYSA-N hexa-1,5-diene-3,4-diol Chemical compound C=CC(O)C(O)C=C KUQWZSZYIQGTHT-UHFFFAOYSA-N 0.000 description 4
- 230000006872 improvement Effects 0.000 description 4
- 238000011065 in-situ storage Methods 0.000 description 4
- 230000002335 preservative effect Effects 0.000 description 4
- 238000011002 quantification Methods 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 230000000087 stabilizing effect Effects 0.000 description 4
- 150000003431 steroids Chemical class 0.000 description 4
- 230000000153 supplemental effect Effects 0.000 description 4
- 210000000707 wrist Anatomy 0.000 description 4
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 3
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 3
- 229920001213 Polysorbate 20 Polymers 0.000 description 3
- 238000004364 calculation method Methods 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000003431 cross linking reagent Substances 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 229940097575 durezol Drugs 0.000 description 3
- 229940012356 eye drops Drugs 0.000 description 3
- 210000000744 eyelid Anatomy 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 238000011835 investigation Methods 0.000 description 3
- 229960001798 loteprednol Drugs 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 239000002207 metabolite Substances 0.000 description 3
- QEFAQIPZVLVERP-UHFFFAOYSA-N nepafenac Chemical compound NC(=O)CC1=CC=CC(C(=O)C=2C=CC=CC=2)=C1N QEFAQIPZVLVERP-UHFFFAOYSA-N 0.000 description 3
- 229960001002 nepafenac Drugs 0.000 description 3
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 3
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 3
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 3
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 3
- 229940068977 polysorbate 20 Drugs 0.000 description 3
- 229960004063 propylene glycol Drugs 0.000 description 3
- 239000012929 tonicity agent Substances 0.000 description 3
- MDYZKJNTKZIUSK-UHFFFAOYSA-N tyloxapol Chemical compound O=C.C1CO1.CC(C)(C)CC(C)(C)C1=CC=C(O)C=C1 MDYZKJNTKZIUSK-UHFFFAOYSA-N 0.000 description 3
- 229920001664 tyloxapol Polymers 0.000 description 3
- 229960004224 tyloxapol Drugs 0.000 description 3
- MYRTYDVEIRVNKP-UHFFFAOYSA-N 1,2-Divinylbenzene Chemical compound C=CC1=CC=CC=C1C=C MYRTYDVEIRVNKP-UHFFFAOYSA-N 0.000 description 2
- DSAYAFZWRDYBQY-UHFFFAOYSA-N 2,5-dimethylhexa-1,5-diene Chemical compound CC(=C)CCC(C)=C DSAYAFZWRDYBQY-UHFFFAOYSA-N 0.000 description 2
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 208000003556 Dry Eye Syndromes Diseases 0.000 description 2
- 206010013774 Dry eye Diseases 0.000 description 2
- OVBJJZOQPCKUOR-UHFFFAOYSA-L EDTA disodium salt dihydrate Chemical compound O.O.[Na+].[Na+].[O-]C(=O)C[NH+](CC([O-])=O)CC[NH+](CC([O-])=O)CC([O-])=O OVBJJZOQPCKUOR-UHFFFAOYSA-L 0.000 description 2
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 2
- 206010020751 Hypersensitivity Diseases 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 208000004550 Postoperative Pain Diseases 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 229960001631 carbomer Drugs 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 230000007012 clinical effect Effects 0.000 description 2
- 239000002131 composite material Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 229960001334 corticosteroids Drugs 0.000 description 2
- 239000006184 cosolvent Substances 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 2
- 229960003957 dexamethasone Drugs 0.000 description 2
- 239000002270 dispersing agent Substances 0.000 description 2
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 2
- FAOZLTXFLGPHNG-KNAQIMQKSA-N fluorometholone Chemical compound C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@]2(F)[C@@H](O)C[C@]2(C)[C@@](O)(C(C)=O)CC[C@H]21 FAOZLTXFLGPHNG-KNAQIMQKSA-N 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 239000003862 glucocorticoid Substances 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 229960003744 loteprednol etabonate Drugs 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 229920001993 poloxamer 188 Polymers 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229940068968 polysorbate 80 Drugs 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 2
- 229960005205 prednisolone Drugs 0.000 description 2
- 230000003134 recirculating effect Effects 0.000 description 2
- 238000000518 rheometry Methods 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- 239000001632 sodium acetate Substances 0.000 description 2
- 235000017281 sodium acetate Nutrition 0.000 description 2
- 239000004334 sorbic acid Substances 0.000 description 2
- 235000010199 sorbic acid Nutrition 0.000 description 2
- 229940075582 sorbic acid Drugs 0.000 description 2
- 230000003637 steroidlike Effects 0.000 description 2
- 238000010557 suspension polymerization reaction Methods 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- AXTGDCSMTYGJND-UHFFFAOYSA-N 1-dodecylazepan-2-one Chemical compound CCCCCCCCCCCCN1CCCCCC1=O AXTGDCSMTYGJND-UHFFFAOYSA-N 0.000 description 1
- FZWBNHMXJMCXLU-UHFFFAOYSA-N 2,3,4,5-tetrahydroxy-6-[3,4,5-trihydroxy-6-[[3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxymethyl]oxan-2-yl]oxyhexanal Chemical compound OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OCC(O)C(O)C(O)C(O)C=O)O1 FZWBNHMXJMCXLU-UHFFFAOYSA-N 0.000 description 1
- HGEFWFBFQKWVMY-DUXPYHPUSA-N 2,4-dihydroxy-trans cinnamic acid Chemical compound OC(=O)\C=C\C1=CC=C(O)C=C1O HGEFWFBFQKWVMY-DUXPYHPUSA-N 0.000 description 1
- GOXQRTZXKQZDDN-UHFFFAOYSA-N 2-Ethylhexyl acrylate Chemical compound CCCCC(CC)COC(=O)C=C GOXQRTZXKQZDDN-UHFFFAOYSA-N 0.000 description 1
- FQHUWSPRTMWLFA-UHFFFAOYSA-N 2-cyclohexylprop-2-enoic acid Chemical compound OC(=O)C(=C)C1CCCCC1 FQHUWSPRTMWLFA-UHFFFAOYSA-N 0.000 description 1
- WROUWQQRXUBECT-UHFFFAOYSA-N 2-ethylacrylic acid Chemical compound CCC(=C)C(O)=O WROUWQQRXUBECT-UHFFFAOYSA-N 0.000 description 1
- 229940044192 2-hydroxyethyl methacrylate Drugs 0.000 description 1
- HGJDNBZIDQOMEU-UHFFFAOYSA-N 2-methyl-n,n-bis(prop-2-enyl)prop-2-enamide Chemical compound CC(=C)C(=O)N(CC=C)CC=C HGJDNBZIDQOMEU-UHFFFAOYSA-N 0.000 description 1
- ONPJWQSDZCGSQM-UHFFFAOYSA-N 2-phenylprop-2-enoic acid Chemical compound OC(=O)C(=C)C1=CC=CC=C1 ONPJWQSDZCGSQM-UHFFFAOYSA-N 0.000 description 1
- QZPSOSOOLFHYRR-UHFFFAOYSA-N 3-hydroxypropyl prop-2-enoate Chemical compound OCCCOC(=O)C=C QZPSOSOOLFHYRR-UHFFFAOYSA-N 0.000 description 1
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 1
- UIERETOOQGIECD-UHFFFAOYSA-N Angelic acid Natural products CC=C(C)C(O)=O UIERETOOQGIECD-UHFFFAOYSA-N 0.000 description 1
- 229940123208 Biguanide Drugs 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- 229920001287 Chondroitin sulfate Polymers 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 1
- 108010036949 Cyclosporine Proteins 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- JIGUQPWFLRLWPJ-UHFFFAOYSA-N Ethyl acrylate Chemical compound CCOC(=O)C=C JIGUQPWFLRLWPJ-UHFFFAOYSA-N 0.000 description 1
- 206010015946 Eye irritation Diseases 0.000 description 1
- 238000001134 F-test Methods 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 208000010412 Glaucoma Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- WOBHKFSMXKNTIM-UHFFFAOYSA-N Hydroxyethyl methacrylate Chemical compound CC(=C)C(=O)OCCO WOBHKFSMXKNTIM-UHFFFAOYSA-N 0.000 description 1
- 206010022941 Iridocyclitis Diseases 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- BRUQQQPBMZOVGD-XFKAJCMBSA-N Oxycodone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C BRUQQQPBMZOVGD-XFKAJCMBSA-N 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 1
- 206010047513 Vision blurred Diseases 0.000 description 1
- 238000001790 Welch's t-test Methods 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- -1 acetate-polyethylene Chemical group 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 229910000272 alkali metal oxide Inorganic materials 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- UIERETOOQGIECD-ARJAWSKDSA-N angelic acid Chemical compound C\C=C(\C)C(O)=O UIERETOOQGIECD-ARJAWSKDSA-N 0.000 description 1
- 201000004612 anterior uveitis Diseases 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- KHSLHYAUZSPBIU-UHFFFAOYSA-M benzododecinium bromide Chemical compound [Br-].CCCCCCCCCCCC[N+](C)(C)CC1=CC=CC=C1 KHSLHYAUZSPBIU-UHFFFAOYSA-M 0.000 description 1
- 229940073464 benzododecinium bromide Drugs 0.000 description 1
- QFFGVLORLPOAEC-SNVBAGLBSA-N besifloxacin Chemical compound C1[C@H](N)CCCCN1C1=C(F)C=C2C(=O)C(C(O)=O)=CN(C3CC3)C2=C1Cl QFFGVLORLPOAEC-SNVBAGLBSA-N 0.000 description 1
- 229960004024 besifloxacin Drugs 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 150000004283 biguanides Chemical class 0.000 description 1
- 230000002146 bilateral effect Effects 0.000 description 1
- 230000002902 bimodal effect Effects 0.000 description 1
- 238000011953 bioanalysis Methods 0.000 description 1
- 238000004638 bioanalytical method Methods 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 229910021538 borax Inorganic materials 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- CQEYYJKEWSMYFG-UHFFFAOYSA-N butyl acrylate Chemical compound CCCCOC(=O)C=C CQEYYJKEWSMYFG-UHFFFAOYSA-N 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 229940059329 chondroitin sulfate Drugs 0.000 description 1
- 229960001265 ciclosporin Drugs 0.000 description 1
- 230000001886 ciliary effect Effects 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 239000013065 commercial product Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- LDHQCZJRKDOVOX-NSCUHMNNSA-N crotonic acid Chemical compound C\C=C\C(O)=O LDHQCZJRKDOVOX-NSCUHMNNSA-N 0.000 description 1
- 229930182912 cyclosporin Natural products 0.000 description 1
- 230000001066 destructive effect Effects 0.000 description 1
- 229940119743 dextran 70 Drugs 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 229940124274 edetate disodium Drugs 0.000 description 1
- 239000003974 emollient agent Substances 0.000 description 1
- 238000007720 emulsion polymerization reaction Methods 0.000 description 1
- HQPMKSGTIOYHJT-UHFFFAOYSA-N ethane-1,2-diol;propane-1,2-diol Chemical compound OCCO.CC(O)CO HQPMKSGTIOYHJT-UHFFFAOYSA-N 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 208000030533 eye disease Diseases 0.000 description 1
- 231100000013 eye irritation Toxicity 0.000 description 1
- 230000000193 eyeblink Effects 0.000 description 1
- 239000013020 final formulation Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 229960005150 glycerol Drugs 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 230000036449 good health Effects 0.000 description 1
- 229920000578 graft copolymer Polymers 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- IXHBTMCLRNMKHZ-LBPRGKRZSA-N levobunolol Chemical compound O=C1CCCC2=C1C=CC=C2OC[C@@H](O)CNC(C)(C)C IXHBTMCLRNMKHZ-LBPRGKRZSA-N 0.000 description 1
- 229960000831 levobunolol Drugs 0.000 description 1
- 229940089459 loteprednol etabonate ophthalmic gel Drugs 0.000 description 1
- 238000005461 lubrication Methods 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000000691 measurement method Methods 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 125000005397 methacrylic acid ester group Chemical group 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 230000036651 mood Effects 0.000 description 1
- BLYOHBPLFYXHQA-UHFFFAOYSA-N n,n-bis(prop-2-enyl)prop-2-enamide Chemical compound C=CCN(CC=C)C(=O)C=C BLYOHBPLFYXHQA-UHFFFAOYSA-N 0.000 description 1
- 239000006070 nanosuspension Substances 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 230000003534 oscillatory effect Effects 0.000 description 1
- RVTZCBVAJQQJTK-UHFFFAOYSA-N oxygen(2-);zirconium(4+) Chemical compound [O-2].[O-2].[Zr+4] RVTZCBVAJQQJTK-UHFFFAOYSA-N 0.000 description 1
- 238000010979 pH adjustment Methods 0.000 description 1
- 238000003921 particle size analysis Methods 0.000 description 1
- 238000010951 particle size reduction Methods 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- WEXRUCMBJFQVBZ-UHFFFAOYSA-N pentobarbital Chemical compound CCCC(C)C1(CC)C(=O)NC(=O)NC1=O WEXRUCMBJFQVBZ-UHFFFAOYSA-N 0.000 description 1
- 229960001412 pentobarbital Drugs 0.000 description 1
- PNJWIWWMYCMZRO-UHFFFAOYSA-N pent‐4‐en‐2‐one Natural products CC(=O)CC=C PNJWIWWMYCMZRO-UHFFFAOYSA-N 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 229940067107 phenylethyl alcohol Drugs 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920001992 poloxamer 407 Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 239000002685 polymerization catalyst Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 150000003117 prednisolones Chemical class 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 238000003908 quality control method Methods 0.000 description 1
- 238000013139 quantization Methods 0.000 description 1
- 238000010526 radical polymerization reaction Methods 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000005070 ripening Effects 0.000 description 1
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000035807 sensation Effects 0.000 description 1
- 229960002668 sodium chloride Drugs 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- 235000010339 sodium tetraborate Nutrition 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- 108010019783 tear proteins Proteins 0.000 description 1
- UEUXEKPTXMALOB-UHFFFAOYSA-J tetrasodium;2-[2-[bis(carboxylatomethyl)amino]ethyl-(carboxylatomethyl)amino]acetate Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]C(=O)CN(CC([O-])=O)CCN(CC([O-])=O)CC([O-])=O UEUXEKPTXMALOB-UHFFFAOYSA-J 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- LDHQCZJRKDOVOX-UHFFFAOYSA-N trans-crotonic acid Natural products CC=CC(O)=O LDHQCZJRKDOVOX-UHFFFAOYSA-N 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- BSVBQGMMJUBVOD-UHFFFAOYSA-N trisodium borate Chemical compound [Na+].[Na+].[Na+].[O-]B([O-])[O-] BSVBQGMMJUBVOD-UHFFFAOYSA-N 0.000 description 1
- 238000001238 wet grinding Methods 0.000 description 1
- 229910001928 zirconium oxide Inorganic materials 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
- A61K31/573—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone substituted in position 21, e.g. cortisone, dexamethasone, prednisone or aldosterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/32—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. carbomers, poly(meth)acrylates, or polyvinyl pyrrolidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
- A61K47/38—Cellulose; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/146—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Inorganic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Ophthalmology & Optometry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Dispersion Chemistry (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Una suspension oftalmica que comprende un ingrediente activo oftalmico suspendido en un vehiculo de la formulacion, en donde el ingrediente activo oftalmico es loteprednol etabonato y esta presente como particulas que tienen Dv90 < 5 μm y Dv50 < 1 μm, y el vehiculo de la formulacion comprende policarbofilo como un agente de suspension, hidroxipropilmetilcelulosa como un derivado de celulosa no ionico, un tensioactivo de poloxaleno, glicerina, propilenglicol y un agente tampon de borato, y en donde la suspension es estable en almacenamiento durante al menos un ano.
Description
DESCRIPCIÓN
Composición de suspensión oftálmica
Antecedentes
La presente invención se refiere a una composición de suspensión oftálmica, especialmente una composición de suspensión oftálmica que contiene un corticosteroide que proporciona eficacia terapéutica mejorada.
Las composiciones oftálmicas se usan para proporcionar alivio de una variedad de afecciones oculares y estados de enfermedad ocular. A menudo, las composiciones oftálmicas se administran o instilan al ojo a través de gotas oculares desde un recipiente de múltiples dosis en forma de soluciones, suspensiones, pomadas o geles. Si el componente activo oftálmico es suficientemente soluble en agua, la formulación puede tener la forma de un producto de solución de gotas oculares. Sin embargo, si el producto de solución tiene una viscosidad demasiado baja, por ejemplo, menos de aproximadamente 30 cp (o mPa s), tras la instilación, el activo oftálmico puede eliminarse rápidamente del área precorneal del ojo debido a la secreción lagrimal y el drenaje nasolagrimal. Como un resultado, se ha estimado que aproximadamente el 80-99 % del componente activo oftálmico simplemente se lava o se expulsa del ojo antes de que el activo realmente entre en contacto con el tejido ocular deseado para lograr su efecto clínico deseado. El pobre tiempo de residencia del activo en el ojo requiere, por lo tanto, la instilación frecuente o el uso de un producto activo más concentrado para lograr el efecto clínico deseado. Para alargar el tiempo de residencia del activo oftálmico y, por lo tanto, para mejorar la biodisponibilidad del activo oftálmico por instilación, se han desarrollado vehículos oftálmicos no basados en solución. Los ejemplos de tales vehículos oftálmicos incluyen pomadas, suspensiones y geles acuosos. Sin embargo, estos vehículos oftálmicos también pueden tener sus inconvenientes. Por ejemplo, el uso de pomadas a menudo causa visión borrosa justo después de la instilación. En algunos casos, el paciente puede sentir una "sensación gomosa" en sus ojos, lo cual es indeseable.
Algunas formulaciones oftálmicas tienen la forma de los llamados sistemas formadores de gel in situ. Estos vehículos oftálmicos pueden extender el tiempo de residencia precorneal y mejorar la biodisponibilidad ocular del activo oftálmico. Típicamente, los sistemas formadores de gel in situ son soluciones acuosas que contienen un sistema polimérico. Los productos oftálmicos tienden a existir como un líquido de baja viscosidad durante el almacenamiento en el recipiente dispensador y forman un gel tras al contacto con el fluido lagrimal. La transición de líquido a gel puede desencadenarse por un cambio en la temperatura, el pH, la fuerza iónica o la presencia de proteínas lagrimales, en dependencia del sistema polimérico particular empleado. Aunque un gel rígido puede tener una residencia prolongada en el ojo y ayudar a promover una mayor biodisponibilidad del fármaco, y tal vez mejorar el resultado clínico por instilación, tales sistemas formadores de gel in situ, tal como las pomadas, pueden interferir negativamente con la visión y resultar en la insatisfacción del paciente. Además, tales composiciones a menudo deben formularse a un pH significativamente ácido, que no es cómodo tras la instilación en el ojo del paciente.
En algunas formulaciones, el activo oftálmico es prácticamente o completamente insoluble en una formulación acuosa basada en solución. Por ejemplo, las patentes de EE.UU. núm. 5,538,721 y 4,540,930 describen una composición farmacéutica que comprende un agente terapéutico esteroideo sustituido con amino y una cantidad estabilizadora efectiva de polímero ligeramente reticulado que contiene carboxi. La ciclodextrina también se ha usado para solubilizar al menos parcialmente el agente terapéutico en un medio acuoso.
Lotemax® (gel oftálmico loteprednol etabonato (LE), LE al 0,5 %) (Bausch & Lomb Incorporated) contiene 5 mg/g de loteprednol etabonato, como una suspensión de gel oftálmico conservado estéril, y ha demostrado ser efectiva para el tratamiento de la inflamación y el dolor postoperatorio después de una cirugía ocular. El gel oftálmico Lotemax®, LE al 0,5 %, contiene ácido bórico, edetato de dihidrato disódico, glicerina, policarbofilo, propilenglicol, cloruro de sodio, tiloxapol, agua e hidróxido de sodio para ajustar el pH entre 6 y 7, y se conserva con cloruro de benzalconio (BAK) al 0,003 %.
DUREZOL® (emulsión oftálmica de difluprednato al 0,05 %) (Alcon Laboratories, Inc.), una emulsión oftálmica conservada estéril para la administración oftálmica tópica, ha demostrado ser efectiva para el tratamiento de la inflamación y el dolor asociados con la cirugía ocular, y también se indica para el tratamiento de uveítis anterior endógena. La emulsión oftálmica DUREZOL® contiene difluprednato (0,05 %), ácido bórico, aceite de ricino, glicerina, acetato de sodio, EDTA sódico, hidróxido de sodio para ajustar el pH, polisorbato 80 y agua, y se conserva con ácido sórbico al 0,1 %
Resumen de la invención
Esta invención proporciona una suspensión oftálmica que comprende un ingrediente activo oftálmico suspendido en un vehículo de la formulación, en donde el ingrediente activo oftálmico está presente como partículas que tienen Dv90 < 5 |_im y Dv50 < 1 pm. Dv90 es el diámetro de partícula por debajo del cual están presentes las partículas que tienen el 90 % del volumen acumulado de todas las partículas, y Dv50 es el diámetro de partícula por debajo del cual están presentes las partículas que tienen el 50 % del volumen acumulado de todas las partículas.
En un aspecto, el ingrediente activo comprende un ingrediente farmacéutico activo ("API") oftálmico. En otro aspecto, el API oftálmico comprende un agente antiinflamatorio. En otro aspecto más, el API oftálmico comprende un esteroide (también conocido en la técnica como glucocorticosteroide o corticosteroide). En aún otro aspecto, el API oftálmico comprende un fármaco antiinflamatorio no esteroideo ("NSAID").
El vehículo de la formulación comprende un agente de suspensión y un derivado de celulosa no iónico. El agente de suspensión puede comprender un polímero de carboxivinilo, tal como policarbofilo o carbómero. El derivado de celulosa no iónico puede ser hidroxipropilmetilcelulosa.
La suspensión puede ser estable en almacenamiento durante al menos un año, o durante al menos dos años.
El ingrediente activo oftálmico puede ser un corticosteroide, tal como el loteprednol etabonato o difluprednato. El ingrediente activo puede ser un no esteroide, tal como el nepafenaco.
El vehículo de la formulación puede comprender además un conservante y/o un tensioactivo.
De acuerdo con diversos aspectos, el vehículo de la formulación comprende policarbofilo, hidroxipropilmetilcelulosa, cloruro de benzalconio, un tensioactivo de poloxaleno, glicerina, propilenglicol y un agente tampón de borato.
La suspensión puede tener la forma de un gel a temperatura ambiente que forma un líquido tras la instilación en un ojo.
De acuerdo con diversos aspectos, el ingrediente activo oftálmico puede estar presente como partículas que tienen Dv90 < 3 |_im y Dv50 < 1 pm, o presente como partículas que tienen Dygo < 3 pm y Dv50 < 0,6 pm, o presente como partículas que tienen Dv90 < 1 pm.
En otro aspecto, esta invención proporciona un método para tratar una afección inflamatoria oftálmica que comprende administrar a un ojo de un paciente que necesita dicho tratamiento una suspensión de acuerdo con cualquiera de los aspectos mencionados anteriormente. La suspensión puede administrarse con una frecuencia de una o dos veces por día, o con una frecuencia de tres o cuatro veces por día. La afección inflamatoria oftálmica puede ser inflamación resultante de una cirugía posocular o de una reacción alérgica.
Breve descripción de las figuras
La Figura 1 muestra la distribución del tamaño de partícula de las muestras LE molidas en un microfluidizador. La Figura 2 muestra el cambio en el tamaño de partícula Dv50 en el tiempo durante la molienda en un microfluidizador. La Figura 3 muestra la distribución del tamaño de partícula de las muestras de Microfluidizador por 30 minutos vs. Molidas con Perlas.
La Figura 4 muestra la distribución del tamaño de partícula de las muestras de Microfluidizador por 30-180 minutos vs. Molidas con Perlas.
La Figura 5 muestra la distribución del tamaño de partícula de las muestras Molidas con Perlas con y sin BAK mediante el uso de diámetros de perla de 2,0, 1,0 y 0,5 mm.
La Figura 6 muestra la distribución del tamaño de partícula de las muestras Molidas con Perlas con BAK a T=0 y T=3 semanas.
La Figura 7 muestra la distribución del tamaño de partícula de las muestras Molidas con Perlas sin BAK a T=0 y T=3 semanas.
La Figura 8 muestra la distribución del tamaño de partícula de las muestras Molidas con Perlas con diferentes relaciones de LE:Poloxaleno.
La Figura 9 muestra la distribución del tamaño de partícula de las muestras Molidas con Perlas con diferentes relaciones de LE:Poloxaleno.
La Figura 10 muestra la distribución del tamaño de partícula de las muestras Molidas con Perlas a las 17 horas vs. 34 horas.
La Figura 11 muestra las Concentraciones Individuales de LE en el Fluido Lagrimal después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 12 muestra las Concentraciones Medias (6 SD) de LE en el Fluido Lagrimal después de una Administración
Ocular Tópica Única a Conejos holandeses.
La Figura 13 muestra las Concentraciones Individuales de LE en la Conjuntiva Bulbar después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 14 muestra las Concentraciones Medias (6 SD) de LE en la Conjuntiva Bulbar después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 15 muestra las Concentraciones Individuales de LE en la Córnea después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 16 muestra las Concentraciones Medias (6 SD) de LE en la Córnea después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 17 muestra las Concentraciones Individuales de LE en el Humor Acuoso después de una Administración Ocular Tópica Única a Conejos holandeses
La Figura 18 muestra las Concentraciones Medias (± SD) de LE en el Humor Acuoso después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 19 muestra las Concentraciones Individuales de LE en el Iris/Cuerpo Ciliar después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 20 muestra las Concentraciones Medias (± SD) de LE en el Iris/Cuerpo Ciliar después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 21 muestra los Valores Medios de Cmáx (± SD) y AUC(0-24h) (± SE) en el Fluido Lagrimal después de una Administración Ocular Tópica Única a conejos holandeses.
La Figura 22 muestra los Valores Medios de Cmáx (± SD) y AUC(0-24h) (± SE) en la Conjuntiva Bulbar después de una Administración Ocular Tópica Única a conejos holandeses.
La Figura 23 muestra los Valores Medios de Cmáx (± SD) y AUC(0-24h) (± SE) en la Córnea después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 24 muestra los Valores Medios de Cmáx (± SD) y AUC(0-24h) (± SE) en e1Humor Acuoso después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 25 muestra los Valores Medios de Cmáx (± SD) y AUC(0-24h) (± SE) en el Iris/Cuerpo Ciliar después de una Administración Ocular Tópica Única a Conejos holandeses.
La Figura 26 enumera las Estadísticas Individuales y Resumidas para las Concentraciones de LE (pg/g) en el Fluido Lagrimal después de una Administración Ocular Tópica Única a Conejos (Grupos 1 y 2).
La Figura 27 enumera las Estadísticas Individuales y Resumidas para las Concentraciones de LE (pg/g) en el Fluido Lagrimal después de una Administración Ocular Tópica Única a Conejos (Grupos 3 y 4).
La Figura 28 enumera las Estadísticas Individuales y Resumidas para las Concentraciones de LE (pg/g) en la Conjuntiva Bulbar después de una Administración Ocular Tópica Única a Conejos (Grupos 1 y 2).
La Figura 29 enumera las Estadísticas Individuales y Resumidas para las Concentraciones de LE (pg/g) en la Conjuntiva Bulbar después de una Administración Ocular Tópica Única a Conejos (Grupos 3 y 4).
La Figura 30 enumera las Estadísticas Individuales y Resumidas para las Concentraciones de LE (pg/g) en la Córnea después de una Administración Ocular Tópica Única a Conejos (Grupos 1 y 2).
La Figura 31 enumera las Estadísticas Individuales y Resumidas para las Concentraciones de LE (pg/g) en la Córnea después de una Administración Ocular Tópica Única a Conejos holandeses (Grupos 3 y 4).
La Figura 32 enumera las Estadísticas Individuales y Resumidas para las Concentraciones de LE (pg/g) en e1Humor Acuoso después de una Administración Ocular Tópica Única a Conejos (Grupos 1 y 2).
La Figura 33 enumera las Estadísticas Individuales y Resumidas para las Concentraciones de LE (pg/g) en e1Humor Acuoso después de una Administración Ocular Tópica Única a Conejos (Grupos 3 y 4).
La Figura 34 enumera las Estadísticas Individuales y Resumidas para las Concentraciones de LE (pg/g) en el
Iris/Cuerpo Ciliar después de una Administración Ocular Tópica Única a Conejos (Grupos 1 y 2).
La Figura 35 enumera las Estadísticas Individuales y Resumidas para las Concentraciones de LE (|jg/g) en el Iris/Cuerpo Ciliar después de una Administración Ocular Tópica Única a Conejos holandeses (Grupos 3 y 4).
Las Figuras 36 a 38 muestran las Concentraciones de Metabolitos de Difluprednato en e1Humor Acuoso después de una Administración Ocular Tópica Única de Difluprednato a Conejos holandeses
La Figura 39 muestra las Concentraciones de Metabolitos de Difluprednato en el Iris/Cuerpo Ciliar después de una Administración Ocular Tópica Única de Difluprednato a Conejos holandeses
La Figura 40 muestra las Concentraciones de Metabolitos de Difluprednato en la Córnea después de una Administración Ocular Tópica Única de Difluprednato a Conejos holandeses
La Figura 41 muestra las Concentraciones de Metabolitos de Difluprednato en la Conjuntiva Bulbar después de una Administración Ocular Tópica Única de Difluprednato a Conejos holandeses
La Figura 42 muestra las Concentraciones de Metabolitos de Difluprednato en Plasma después de una Administración Ocular Tópica Única de Difluprednato a Conejos holandeses
Descripción detallada
Se puede emplear una variedad de ingredientes activos oftálmicos en esta invención. Generalmente, los ingredientes activos oftálmicos incluyen cualquier ingrediente activo para el tratamiento del ojo seco, alergia, glaucoma, inflamación o infección.
Una primera clase de ingredientes farmacéuticos activos (API) oftálmicos son los esteroides, también conocidos en la técnica como glucocorticoides o corticosteroides, especialmente para el tratamiento de afecciones inflamatorias oculares. Los ejemplos incluyen loteprednol etabonato, dexametasona, fluorometalona, prednisolona y difluprednato. Otra clase de API oftálmicos son los NSAID, tal como el nepafenaco. Otras clases de API oftálmicos incluyen agentes antibacterianos, tal como besifloxacina, e inmunosupresores, tal como ciclosporina.
De acuerdo con diversos aspectos, el corticosteroide suspendido en el vehículo de la formulación se selecciona de: dexametasona a concentraciones de 0,1 % a 0,2 % en peso, fluorometalona a concentraciones de 0,05 % a 0,25 % en peso, prednisolona a concentraciones de 0,1 % a 1 % en peso, loteprednol etabonato a concentraciones de 0,1 % a 0,5 % en peso y difluprednato a concentraciones de 0,01 a 0,1 % en peso. Alternativamente, de acuerdo con diversos aspectos, la suspensión no esteroidea en el vehículo de la formulación es nepafenaco a concentraciones de 0,1 a 0,5 % en peso.
Generalmente, las suspensiones de la invención incluirán un ingrediente activo oftálmico que tiene una solubilidad en agua a 25 °C y un pH de 7 que es inferior al 10 % de la concentración formulada en mg/ml en la formulación oftálmica. Por ejemplo, si el ingrediente activo oftálmico está presente en una formulación oftálmica a una concentración de 0,1 mg/ml, el activo oftálmico tendrá una solubilidad en agua a 25 °C y un pH de 7 inferior a 0,1x(0,1 mg/ml), es decir, inferior a 0,01 mg/ml. Del mismo modo, para un activo oftálmico que está presente en una formulación oftálmica a una concentración de 10 mg/ml, el ingrediente activo oftálmico tendrá una solubilidad en agua a 25 °C y un pH de 7 inferior a 0,1x(10 mg/ml), es decir, inferior a 1,0 mg/ml. En consecuencia, la solubilidad en agua de un agente específico en la suspensión y la concentración del agente en la suspensión en mg/ml se relacionan con respecto a la formación de una suspensión. En otras palabras, un ingrediente activo oftálmico presente a una concentración relativamente alta en una suspensión puede tener una solubilidad en agua algo mayor que otro agente con una solubilidad en agua menor presente en otra suspensión a una concentración menor, pero debido a la concentración más alta en la primera suspensión una porción significativa del primer agente permanece suspendida en la formulación.
De acuerdo con diversos aspectos, el ingrediente activo oftálmico es el loteprednol etabonato. El loteprednol etabonato (también denominado en la presente descripción "LE") es un compuesto conocido y puede sintetizarse mediante métodos descritos en la patente de EE.UU. núm. 4,996,335, cuyo contenido en su totalidad se incorpora aquí por referencia en la presente descripción. De acuerdo con diversos aspectos, la concentración de LE en el vehículo de la formulación está en el intervalo de 01 % en peso a 2 % en peso, o de 0,14 % en peso a 1,5 % en peso, o de 0,2 % en peso a 1 % en peso, o de 0,2 % en peso a 0,5 % en peso. Una concentración específica de LE puede ser 0,38 % en peso.
Otro ingrediente activo oftálmico es difluprednato. El difluprednato (también denominado en la presente descripción como "DFBA") es un derivado de prednisolona y un compuesto conocido, y puede sintetizarse por métodos conocidos en la técnica. De acuerdo con diversos aspectos, la concentración de DFBA en el vehículo de la formulación está en el intervalo de 0,01 a 0,1 % en peso, o de 0,02 a 0,07 % peso. Una concentración específica de DFBA puede ser 0,05 % en peso.
El vehículo de la formulación incluye al menos un agente de suspensión. Una clase de agentes de suspensión son polímeros preparados de al menos aproximadamente 90 %, o de al menos aproximadamente 95 %, en peso, basado en el peso total de los monómeros presentes, de uno o más monómeros monoetilénicamente insaturados que contienen carboxilo. El ácido acrílico es un monómero monoetilénicamente insaturado que contiene carboxilo adecuado, pero pueden emplearse otros monómeros polimerizables etilénicamente insaturados que contienen carboxilo. Estos incluyen: ácido metacrílico, ácido etacrílico, ácido p-metilacrílico (ácido crotónico), ácido cis-ametilcrotónico (ácido angélico), ácido trans-a-metilcrotónico (ácido tíglico), ácido a-butilcrotónico, ácido a-fenilacrílico, ácido a-bencilacrílico, ácido a-ciclohexilacrílico, ácido p-fenilacrílico (ácido cinámico), ácido cumárico (ácido ohidroxicinámico), ácido umbelico (ácido p-hidroxicumárico) y similares, que se pueden usar además de, o en lugar de ácido acrílico.
Los polímeros que contienen carboxilo preparados a partir de estos monómeros monetilénicamente insaturados se pueden reticular ligeramente al emplear un pequeño porcentaje, es decir, de aproximadamente 0,5 % a aproximadamente 5 %, o de aproximadamente 0,2 % a aproximadamente 3 %, basado en el peso total de los monómeros presentes, de un agente de reticulación polifuncional. Tales agentes de reticulación incluyen monómeros de reticulación difuncionales no polialquenil poliéter, tales como: divinilglicol; 3,4-dihidroxi-hexa-1,5-dieno; 2,5-dimetil-1,5-hexadieno; divinilbenceno; N,N-dialilacrilamida; N,N-dialilmetacrilamida; y similares.
Varios polímeros ligeramente reticulados están disponibles comercialmente, o pueden prepararse generalmente mediante polimerización en suspensión o en emulsión, mediante el uso de catalizadores convencionales de polimerización por radicales libres. En general, tales polímeros variarán en peso molecular de aproximadamente 250 000 a aproximadamente 4000000, o de aproximadamente 500000 a aproximadamente 2000000.
Los polímeros ligeramente reticulados pueden formarse a partir de un monómero o monómeros que contienen carboxilo como el único monómero monoetilénicamente insaturado presente, junto con el agente o agentes de reticulación. También pueden ser polímeros en los que hasta aproximadamente el 40 %, o dentro del intervalo de aproximadamente el 0 % a aproximadamente el 20 % en peso, del monómero o monómeros monoetilénicamente insaturados que contienen carboxilo han sido reemplazados por uno o más monómeros monoetilénicamente insaturados que no contienen carboxilo que contienen solo sustituyentes fisiológicamente y oftalmológicamente inocuos, que incluyen los ésteres de ácido acrílico y metacrílico tales como metacrilato de metilo, acrilato de etilo, acrilato de butilo, 2-etil-hexilacrilato, acetato de vinilo, 2-hidroxietilmetacrilato, 3-hidroxipropilacrilato, y similares.
Se conocen en la técnica diversos polímeros que contienen carboxi ligeramente reticulados. Por ejemplo, los descritos en Robinson patente de EE.UU núm. 4,615,697, la Publicación Internacional núm. WO 89/06964, y Davis y otros patente de e E.UU núm. 5,192,535. Un ejemplo de polímeros ligeramente reticulados son los polímeros de ácido acrílico en donde el monómero reticulante es 3,4-dihidroxihexa-1,5-dieno o 2,5-dimetilhexa-1,5-dieno.
Otra clase de polímeros ligeramente reticulados son los polímeros que contienen carboxilo preparados mediante polimerización en suspensión de ácido acrílico y divinilglicol, incluido el policarbofilo NOVEON a A-1 (disponible de Lubrizol). Otros polímeros que contienen carboxi ligeramente reticulados incluyen varios carbómeros, tales como los carbómeros Carbopol (disponibles de Lubrizol). De acuerdo con diversos aspectos, el agente de suspensión es un polímero de carboxivinilo seleccionado de policarbofilo y carbómero.
El agente de suspensión sirve para asegurar que el ingrediente activo oftálmico permanezca en suspensión en el vehículo de la formulación. El vehículo de la formulación proporciona una suspensión estable en almacenamiento del ingrediente activo oftálmico, tal como en forma de un gel. Sin embargo, una vez instilado en el ojo como gotas oculares, el gel pasa gradualmente a una forma líquida, es decir, pierde su carácter de gel debido a las propiedades de adelgazamiento por cizallamiento del gel. Después de la instilación, el párpado aplica cizallamiento a la formulación cuando el ojo parpadea, y este cizallamiento reduce drásticamente la viscosidad, evitando de esta manera la sensación pegajosa y "gomosa" que se encuentra en muchas pomadas y gotas oculares destinadas a permanecer en forma de gel mientras están en el ojo. Sin embargo, una vez que cesa el movimiento del párpado, eliminando así la fuerza de cizallamiento, la viscosidad ya no se reduce, lo que ayuda a mantener la residencia de la formulación en el ojo. Eventualmente, el gel pasa completamente a líquido. En ciertos aspectos, la suspensión oftálmica tiene un punto de elasticidad, en cuyo punto por debajo la composición es un gel sólido, de 2-8 Pascales, y más adecuadamente 3-5 Pa.
El término "estable en almacenamiento" indica que el API permanecerá efectivamente suspendido en el vehículo de la formulación durante un período prolongado de tiempo sin tener que agitar o sacudir la composición envasada. En otras palabras, la agitación de la formulación en su envase no es necesaria para resuspender el API en el vehículo de la formulación. Por el contrario, las suspensiones no estables en almacenamiento requieren que el usuario sacuda la composición envasada antes de la instilación para que el API se distribuya uniformemente en el vehículo portador; sin embargo, si el usuario descuida sacudir el envase, el usuario no puede instilar una dosificación consistente y adecuada.
De acuerdo con esto, las suspensiones oftálmicas estables en almacenamiento de esta invención suministrarán de manera consistente del 90 % al 110 % de una dosificación predeterminada de activo farmacéutico por gota ocular, sin
que un paciente tenga que agitar la suspensión en su recipiente.
De acuerdo con diversos aspectos, la composición es estable en almacenamiento en su envase durante al menos un año, en cuyo caso la vida útil del producto es de un año. De acuerdo con otros aspectos, la composición es estable en almacenamiento en su envase durante al menos dos años, en cuyo caso la vida útil del producto es de dos años.
De acuerdo con diversos aspectos, el vehículo de la formulación incluye un derivado de celulosa no iónico como agente de suspensión suplementario. Los agentes representativos incluyen hidroxipropilmetilcelulosa ("HPMC") o hidroxipropilcelulosa ("HPC").
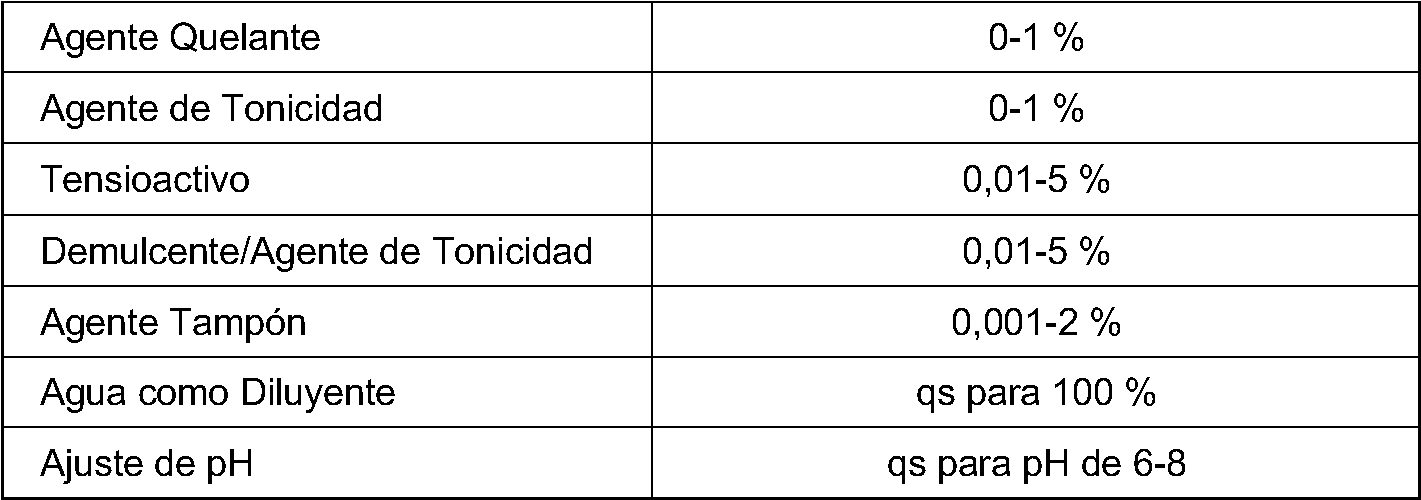
Las formulaciones de vehículos descritas en la presente descripción también pueden incluir varios otros ingredientes, que incluyen pero no se limitan a tensioactivos, agentes de tonicidad, tampones, conservantes, agentes quelantes, cosolventes y agentes viscosificantes.
Los tensioactivos que se pueden usar son agentes tensioactivos que son aceptables para las aplicaciones oftálmicas. Los agentes tensioactivos útiles incluyen polisorbato 80 (tal como el tensioactivo Tween® 80 de ICI America Inc), tiloxapol y diversos tensioactivos de poloxaleno, incluido el poloxaleno 188 (tal como el tensioactivo Pluronic® F-68 disponible de BASF) y el poloxaleno 407 (tal como Pluronic® F127 disponible de BASF). Estos tensioactivos son condensados de óxido alcalino no iónico de un compuesto orgánico que contiene grupos hidroxilo. La concentración en la que se puede usar el agente tensioactivo solo está limitada por la neutralización de los efectos bactericidas en los conservantes acompañantes (si están presentes), o por las concentraciones que pueden causar irritación en los ojos.
Se pueden emplear diversos agentes de tonicidad para ajustar la tonicidad de la formulación. Los ejemplos son cloruro de sodio, cloruro de potasio, cloruro de magnesio, cloruro de calcio y dioles no iónicos, tales como glicerol y propilenglicol, dextrosa y/o manitol. Estos agentes se pueden añadir a la formulación para aproximar la tonicidad fisiológica. Tal una cantidad de agente de tonicidad variará, en dependencia del agente particular a añadir. En general, sin embargo, las formulaciones tendrán un agente de tonicidad en una cantidad suficiente para provocar que la formulación final tenga una osmolalidad oftálmicamente aceptable (generalmente aproximadamente 150-450 mOsm/kg). De acuerdo con diversos aspectos, se puede emplear un agente de tonicidad no iónico que también funciona como un demulcente.
Se puede añadir un sistema tampón apropiado a las formulaciones para evitar el cambio del pH en condiciones de almacenamiento. Tales tampones incluyen tampones de fosfato (por ejemplo, dihidrógeno fosfato de sodio), tampones de acetato (por ejemplo, acetato de sodio), tampones de citrato (por ejemplo, citrato de sodio y/o ácido cítrico) y tampones de borato (por ejemplo, borato de sodio y/o ácido bórico). La concentración particular del tampón variará, en dependencia del agente específico empleado.
Los productos oftálmicos tópicos se envasan típicamente en forma de múltiples dosis, en cuyo caso generalmente se requiere un conservante para evitar la contaminación microbiana durante el uso. Los conservantes adecuados incluyen: biguanidas, peróxido de hidrógeno, productores de peróxido de hidrógeno, cloruro de benzalconio, clorobutanol, bromuro de benzododecinio, alcohol feniletílico, ácido sórbico, policuaternio-1 y otros agentes conocidos en la técnica. Tales conservantes se emplean típicamente a un nivel de 0,001 a 1 % (p/p). Se puede incluir un agente quelante, tal como el edetato disódico, para mejorar la eficacia del agente antimicrobiano usado como el conservante. En el caso en que la suspensión oftálmica se envase en una forma de dosis unitaria, la suspensión estéril generalmente no requiere un conservante.
Se pueden añadir cosolventes suplementarios o agentes viscosificantes a los vehículos de la formulación. Tales materiales pueden incluirse para proporcionar lubricación, para hacer que el vehículo de la formulación se aproxime a la consistencia de las lágrimas endógenas, para ayudar en el desarrollo natural de lágrimas, o de otra manera para proporcionar un alivio temporal de los síntomas y afecciones del ojo seco tras la administración ocular. Los agentes viscosificantes suplementarios incluyen polioles poliméricos, tales como polietilenglicol, dextranos tal como dextrano 70, proteínas solubles en agua tal como gelatina, alcoholes polivinílicos, polivinilpirrolidonas y polisacáridos tal como ácido hialurónico y sus sales y sulfato de condroitina y sus sales.
Una suspensión de gel representativa de esta invención comprende o consiste esencialmente en, o consiste en la siguiente composición:
De acuerdo con diversos aspectos, una suspensión de gel comprende o consiste esencialmente en, o consiste en la siguiente composición:
De acuerdo con otros varios aspectos, una suspensión de gel comprende o consiste esencialmente en, o consiste en la siguiente composición:
Una primera composición, de acuerdo con varios aspectos, comprende o consiste esencialmente en, o consiste en la siguiente Composición A:
De acuerdo con otros aspectos, una suspensión de gel comprende o consiste esencialmente en, o consiste en la siguiente composición:
Otra composición, de acuerdo con varios aspectos, comprende o consiste esencialmente en, o consiste en la siguiente Composición B:
Las composiciones adicionales, las Composiciones C y D, comprenden, consisten esencialmente en o consisten en:
Las composiciones adicionales, las Composiciones E y F, comprenden, consisten esencialmente en o consisten en:
Como se mencionó, la suspensión oftálmica de esta invención comprende un ingrediente activo oftálmico suspendido en un vehículo de formulación, en donde el ingrediente activo oftálmico está presente como partículas que tienen Dygo < 5 |_im y Dv5o < 1 pm. Dygo es el diámetro de partícula por debajo del cual están presentes las partículas que tienen el 90 % del volumen acumulado de todas las partículas, y Dv5o es el diámetro de partícula por debajo del cual están presentes las partículas que tienen el 50 % del volumen acumulado de todas las partículas. Dvgo y Dv5o puede medirse mediante técnicas de difracción de la luz generalmente conocidas en la técnica.
La difracción de la luz (LD) es un método conocido para determinar el tamaño de partícula de los materiales que están suspendidos en un líquido o dispersados en el aire. La técnica utiliza el principio de la difracción de la luz donde las partículas difractarán (dispersarán) la luz en ángulos que son inversamente proporcionales a sus diámetros. Es decir, las partículas grandes difractarán la luz en ángulos pequeños, mientras que las partículas pequeñas difractan la luz en ángulos más grandes. En la práctica, los instrumentos disponibles comercialmente incluyen una fuente de luz, tal como un láser de baja potencia, que ilumina las partículas que pasan a través de una zona de medición dentro de una celda de muestra. El cono de luz difractada producido donde el haz interactúa con las partículas produce un patrón de difracción estacionario que se enfoca en detectores, tal como dos conjuntos de detectores ópticos. Los detectores se componen típicamente de una serie de fotoelementos separados electrónicamente dispuestos para medir la dispersión radial de la energía de la luz. La cantidad y la dirección de la luz que incide en estos detectores se codifica electrónicamente y se transmite a una computadora para su procesamiento. Al realizar una medición durante un período de tiempo adecuado y al usar un flujo continuo de partículas a través del área iluminada, se obtiene un perfil representativo de difracción de la luz.
Después de medir el patrón de difracción, los instrumentos de medición disponibles comercialmente generalmente incluyen un CUP y un software que analiza la medición del patrón de difracción, la medición de fondo y cualquier información requerida ingresada por el operador (por ejemplo, índices de refracción, forma de partículas, esféricas o irregulares) para calcular un modelo de distribución de tamaño que "mejor se ajuste" al perfil de patrón de difracción observado. Una vez que se logra este "mejor ajuste", el instrumento generalmente proporcionará una impresión o visualización de los parámetros de distribución de tamaño que caracterizan el modelo. Típicamente, los resultados se proporcionan en términos de una distribución de tamaño de volumen, por ejemplo, Dvio = x, Dv5o = y, Dvgo = z, etc.
Para las suspensiones oftálmicas de esta invención, una técnica de medición apropiada es la siguiente. Se pesan 5 gramos del gel en un vaso de precipitados de vidrio de fondo plano. Se añaden 2o8 gramos de un dispersante salino al 6 % al vaso de precipitados. El contenido del vaso de precipitados se agita magnéticamente, y la punta de un procesador ultrasónico se sumerge por debajo de la superficie del contenido, y el contenido se sonica mientras se agita el contenido. Aproximadamente, se extrae una porción de 3 ml de la muestra sonicada y agitada, y toda la porción se dispensa rápidamente en el recipiente recirculador del instrumento de difracción de la luz, que contiene dispersante recirculado. Si es necesario, se pueden añadir porciones adicionales de la suspensión de la muestra hasta alcanzar un valor de transmisión de o,92-o,96. La recolección del patrón de difracción de la muestra se inicia en minutos después de la adición final de la suspensión de muestra al recirculador. La distribución de tamaños deseada (por ejemplo, Dvio, Dv5o, Dvgo) se genera por el software del instrumento. Un ejemplo de instrumento es el analizador difractivo láser S35oo disponible en Microtrac (York, PA, EE.UU. y Krefeld, Alemania).
Los ingredientes activos oftálmicos con tales tamaños de partículas pueden obtenerse por métodos generalmente conocidos en la técnica. Por ejemplo, una suspensión acuosa, que contiene el activo y el vehículo de la formulación, puede someterse a micronización de fluidos o molienda con perlas, durante un tiempo adecuado para obtener el tamaño de partícula deseado. En el Ejemplo 1 se proporcionan técnicas representativas para la micronización de fluidos y la molienda de perlas. En el Ejemplo 1, la molienda de perlas se optimizó para proporcionar un ingrediente activo oftálmico con el tamaño de partícula deseado, pero pueden emplearse otros métodos, o variaciones de los métodos de molienda de perlas descritos.
La invención se describirá ahora adicionalmente mediante varios ejemplos que pretenden describir pero no limitar el alcance de la invención definida por las reivindicaciones de la presente descripción.
Ejemplo 1 - Molienda del API
En los siguientes experimentos, se investigaron dos opciones para la reducción del tamaño de partícula del API: un microfluidizador homogeneizador de alta presión y molienda de perlas. El microfluidizador homogeneizador de alta presión empleado fue el microfluidizador Microfluidics modelo M-1ioEH. Además, se investigaron varios vehículos
para la molienda. Los análisis del tamaño de partícula se determinaron por difracción de la luz (LD) a menos que se indique lo contrario.
En un primer conjunto de experimentos, se realizaron estudios con el microfluidizador. Como se resume en la Tabla 1, varias formulaciones emplearon loteprednol etabonato (LE) al 10 % en Polisorbato 20 (Tw20) al 1 % y ácido bórico al 0,5 % con varios otros excipientes, que incluyen el tensioactivo Tiloxapol (Tylox), el tensioactivo Pluronic F68 (F68) y el cloruro de benzalconio (BAK). Además, se probó una formulación que incluye HPMC (hidroxipropilmetilcelulosa) al 1 % y BAK al 0,2 %. Los resultados se muestran en la Tabla 1. A partir de este experimento, se determinó que el Polisorbato 20 no era un excipiente crítico para la molienda.
Tabla 1 D istribución del Tamaño de Partícula de Molienda de LE en Polisorbato 20
En otro conjunto de experimentos, se probaron cuatro vehículos de molienda, cada uno de los cuales contiene LE al 10 % como el API. Adicionalmente, los vehículos de molienda contenían lo siguiente:
A -- ácido bórico al 0,5 %, BAK al 0,2 %, HPMC E3 al 0,5 %
B -- ácido bórico al 0,5 %, BAK al 0,2 %, Poloxaleno 407 al 0,5 %
C -- ácido bórico al 0,5 %, BAK al 0,2 %, PVP C30 al 0,5 %
D -- ácido bórico al 0,5 %, CMC LV al 0,5 %; Poloxaleno 407 al 0,2 %
Las muestras se molieron en el microfluidizador durante 20 minutos en forma de recirculación a 25k psi. La muestra B, que contiene poloxaleno 407 con BAK tiene la distribución más estrecha y más monomodal, como se observa en la Figura 1. La muestra D, que contiene CMC/Poloxaleno, apareció más grande y altamente agregada.
En otro conjunto de experimentos, se evaluó la concentración del API por su efecto en la molienda. Se emplearon vehículos similares a la Muestra B anterior, que contenían ácido bórico al 0,5 % Poloxaleno 4070,5 % BAK al 0,2 %, con LE al 10 %, 20 % o 30 %. Las suspensiones se procesaron de manera similar en forma de recirculación en el microfluidizador a 25k psi. Se tomaron muestras para análisis de tamaño de partícula a intervalos de 10 minutos, 20 minutos y 30 minutos. La muestra de 30 minutos con LE al 10 % tuvo resultados adecuados. Las muestras con mayores concentraciones del API no parecían ser más eficientes. Los resultados se informan en la Figura 2.
De la experiencia previa con la molienda de perlas, se sabía que el uso de BAK durante la molienda de perlas puede causar agregación. En consecuencia, esto se probó con LE al moler la suspensión de LE al 30 % (que contiene Poloxaleno 407 al 0,5 % BAK al 0,2 %) con perlas de óxido de circonio de 0,5 mm (ZrO2) durante 20 minutos en un mezclador Flacktek. Por microscopía óptica, la distribución del tamaño de partícula parecía peor. Esto puede deberse a la recristalización ya que el vial se calentó bastante. Para controlar mejor la temperatura durante la molienda, la muestra se colocó en un agitador de muñeca y se agitó durante la noche. También se colocó una muestra adicional que contenía LE al 30 % con Poloxaleno 407 pero sin BAK en el agitador de muñeca. El tamaño de partícula de ambas muestras molidas con perlas fue menor que las muestras de microfluidizador por 30 minutos (que contenían Poloxaleno 407 al 0,5% BAK al 0,2 %), sin diferencias apreciables para las muestras molidas con perlas con y sin BAK. Los datos se resumen en la Figura 3.
Para investigar más a fondo si la molienda en el microfluidizador podría proporcionar un tamaño de partícula comparable a la molienda de perlas, se realizó un estudio adicional usando el LE al 10 % en el vehículo Poloxaleno/BAK, con las suspensiones molidas en el microfluidizador a 25k psi hasta 180 minutos. Se tomaron muestras a intervalos de 30 minutos. A los 90 minutos, se logró un tamaño de partícula de Dv90 inferior a 1 mm. El tiempo de molienda adicional lentamente redujo aún más el tamaño de partícula pero no produjo los tamaños de partícula más pequeños que se pueden lograr mediante molienda de perlas. Los resultados se informan en la Figura 4.
Dado que los experimentos anteriores indicaron que se obtuvo un tamaño de partícula más pequeño mediante molienda de perlas, se realizó un trabajo adicional para optimizar aún más el proceso de molienda de perlas.
La Figura 5 informa la distribución del tamaño de partícula de las siguientes muestras molidas con perlas, agitadas en un agitador de muñeca durante 16 horas con el tamaños de perlas de Z O 2 indicado:
A - LE al 20 %, poloxaleno F127 al 8 % - perlas de 2,0 mm
B - LE al 20 %, poloxaleno F127 al 2 % - perlas de 1,0 mm
C - LE al 20 %, poloxaleno F127 al 2 % - perlas de 0,5 mm
D - LE al 22 %, poloxaleno F127 al 2,2 %, BAK al 0,225 % - perlas de 0,5 mm
E - LE al 20 %, poloxaleno F127 al 2,2 %, BAK al 0,225 % - perlas de 1,0 mm
F - LE al 20 %, poloxaleno F127 al 2,2 %, BAK al 0,225 % - perlas de 2,0 mm
La distribución de tamaño de partícula más pequeña se obtuvo con las perlas de 0,5 mm. El uso de BAK en la suspensión de molienda no tuvo un efecto inmediato sobre el tamaño de partícula.
La Figura 6 informa la distribución del tamaño de partícula de las suspensiones molidas con perlas que contienen LE al 30 %, poloxaleno 407 y BAK, y la Figura 7 informa la distribución del tamaño de partícula de las suspensiones molidas con perlas que contienen LE al 30 % y poloxaleno 407 pero sin BAK, en el tiempo = 0 y después de tres semanas (T = 3 semanas). La muestra BAK (Figura 6) mostró crecimiento de partículas, mientras que no hubo cambio significativo en la suspensión sin BAK (Figura 7).
Además, se estudió la relación de API:Tensioactivo. Se hicieron muestras que contenían LE al 30 % ácido bórico al 0,714 % Poloxaleno 407 (tensioactivo Pluronic F127) para obtener relaciones LE:Poloxaleno de 20:1, 10:1 y 5:1. Las muestras se molieron con perlas de ZO 2 de 0,5 mm en un agitador de muñeca durante toda la noche. Los resultados se resumen en la Figura 8. La concentración más baja de poloxaleno mostró mejores resultados que las concentraciones más altas (señalando que esto contradice la información de un artículo de la literatura (Liu y otros, "Nanosuspensions of poorly soluble drugs: preparation and development by wet milling", Int. J. of Pharm 411(1 -2):215-222, 2011).
Se hicieron muestras adicionales de LE al 30 % usando relaciones de LE:Poloxaleno de 30:1, 40:1 y 50:1. Las muestras de 20:1, 30:1 y 40:1 mostraron tamaños de partículas similares después de 17 horas de molienda (Figura 9). Estas tres muestras se molieron después durante 17 horas adicionales. Después de un total de 34 horas de molienda, la muestra de 40:1 se hizo más grande y bimodal posiblemente debido a una cantidad insuficiente de tensioactivo para el aumento del área superficial del LE. Tanto las muestras de 30:1 como de 20:1 continuaron disminuyendo con el tiempo, con la muestra de 20:1 obteniendo el tamaño de partícula más pequeño (Figura 10).
Ejemplo 2 - Estabilización de la Formulación de Policarbofilo
Los presentes inventores reconocieron que las partículas susbmicrométricas de LE en una formulación de policarbofilo no son físicamente estables y tienden a agregarse con el tiempo. Se cree que el polímero de policarbofilo forma un tipo de estructura de malla abierta que produce un gel de adelgazamiento por cizallamiento pero permite el movimiento sin obstáculos de las partículas dentro de la matriz. Por el contrario, la hidroxipropilmetilcelulosa (HPMC) forma una estructura más compacta que puede mejorar la viscosidad dentro de la matriz de policarbofilo reduciendo el movimiento de partículas. Además, la HPMC inhibe la nucleación estabilizando las partículas pequeñas al reducir el efecto de maduración de Oswald. En consecuencia, este estudio se diseñó para comprender la contribución de la mejora de la viscosidad y la inhibición de la nucleación en la propiedad estabilizadora de la hidroxipropilmetilcelulosa (HPMC), especialmente HPMC E4M, y otros estabilizadores potenciales.
Se prepararon varias muestras de gel de LE al 0,38 % empleando policarbofilo junto con HPMC E4M al 0,25 % u otros estabilizadores. Las suspensiones se molieron con perlas como en el Ejemplo 1. Estas muestras se colocaron en viales de vidrio y se incubaron a 25 °C y 40 °C. En varios momentos, las muestras se retiraron y se probaron para determinar el tamaño de partícula mediante la técnica de difracción de la luz. Los tamaños de partícula después de 8,5 meses, almacenados a 40 °C, se informan en la Tabla 2: VMD denota el diámetro medio del volumen, y Dv95 denota el diámetro de partícula por debajo del cual caen las partículas que tienen el 95 % del volumen acumulado de todas las partículas. La Tabla 2 resume los estabilizadores que funcionaron para mejorar la viscosidad y/o inhibir la nucleación.
Tabla 2
La titulación de HPMC E4M muestra que se necesitó una concentración crítica mínima de aproximadamente el 0,05 % para estabilizar las partículas de LE susbmicrométricas. La muestra de HPMC E3LV tiene propiedades de inhibición de nucleación similares a las de HPMC E4M pero proporciona una mejora de la viscosidad más baja y muestra una protección moderada similar a la muestra de HPMC E4M al 0,05 %. La muestra de polivinilpirrolidinona (PVP) proporciona una mejora de la viscosidad y presenta resultados similares a la muestra sin estabilizador. La carboximetilcelulosa (CMC) es un agente de suspensión conocido que proporciona tanto mejora de la viscosidad como actividad superficial. El grado usado aquí tiene baja viscosidad. Esta muestra también exhibe resultados similares a la muestra sin estabilizador. El estabilizador Soluplus™ (disponible de BASF), que contiene un copolímero de injerto de polivinil caprolactama-acetato de polivinilo-polietilenglicol, es un inhibidor fuerte de nucleación sin mejora de la viscosidad. Esta muestra presenta una estabilidad similar a la muestra de HPMC E4M al 0,25 %.
Este estudio muestra que HPMC proporcionó la combinación ideal de mejora de la viscosidad e inhibición de la nucleación, especialmente de grado e4 m , y este agente de suspensión suplementario fue efectivo para estabilizar las partículas submicrométricas.
Ejemplo 3 - Estudio de Reología
La efectividad de los corticosteroides tópicos puede verse limitada por su disolución y tiempo de residencia en la superficie ocular. Este estudio examinó la disolución y las características viscoelásticas de la Composición A (que contiene partículas de LE submicrométricas, 0,38 %) en comparación con el gel de LE comercial, gel oftálmico Lotemax®, 0,5 %.
Las mediciones de tensión de rendimiento y reología oscilatoria se realizaron mediante el uso de un reómetro TA Instruments equipado con un rotor de paletas y una copa que contenía 40 g de producto sin diluir a 25 °C. La disolución de partículas submicrométricas de LE (0,6 pm de diámetro) y partículas micronizadas de LE (diámetro de 3 pm usadas en el gel oftálmico Lotemax®, 0,5 %) se midió al 200 % de saturación en PBS/SDS al 0,45 % mediante el uso de un medidor de disolución VanKel. La disolución también se determinó en un ensayo de flujo continuo que simula el flujo lagrimal en el ojo. Se mezcló 8 ml de una suspensión submicrométrica o micronizada de LE con 3 ml de PBS/BAK al 3,75 %. A continuación, se hizo fluir después PBS/BAK al 3,75 % a través de la suspensión de LE diluida a 10 ml/min. Se tomaron muestras del flujo de salida y la cantidad de LE disuelto se determinó por HPLC. Este método simula un volumen de lágrima de 11 pL con una velocidad de flujo de 10 pl/min.
El análisis reológico del gel de LE susbmicrométrico al 0,38 % muestra un límite elástico de aproximadamente 4 Pa, lo que confirma que la estructura del gel es similar al gel oftálmico Lotemax®, 0,5 %. Hubo un aumento de 2,6 veces en la disolución con el LE susbmicrométrico (0,38 %) en comparación con el LE micrométrico (0,5 %) a los 30 segundos. La muestra susbmicrométrica al 0,38 % alcanzó la saturación a aproximadamente 1,5 minutos en comparación con aproximadamente 5 minutos para la muestra 0,5 micronizada. En el modelo de flujo continuo hubo un aumento en la disolución durante un período de tiempo más largo para el LE susbmicrométrico frente al micronizado. La comparación del AUC de la curva de concentración vs. tiempo al aumentar la concentración del fármaco indicó que hubo un aumento general de 1,3 veces en la velocidad de disolución con la formulación susbmicrométrica al 0,38 % vs. la micronizada al 0,5 %.
En consecuencia, el gel de LE susbmicrométrico al 0,38 % (Composición A) tiene características viscoelásticas
similares a las del Gel Oftálmico Lotemax® al 0,5 %, y por lo tanto se esperaba que fuera estable al almacenamiento, no se asentara y proporcionara un suministro uniforme del fármaco desde el recipiente.
Ejemplo 4 - Investigación del Efecto del Tamaño de Partícula y la Concentración en la Farmacocinética Ocular de Loteprednol Etabonato Después de una Adm inistración Ocular Tópica Única a Conejos holandeses
El propósito de este estudio fue evaluar el efecto del tamaño de partícula en la farmacocinética ocular (PK) del loteprednol etabonato (LE) después de una administración ocular tópica única a conejos holandeses, y determinar si una concentración mayor de LE proporciona una mayor exposición ocular. El Gel Lotemax® (gel oftálmico de Loteprednol etabonato al 0,5%) (LE) es un potente corticosteroide en una formulación de gel a base de policarbofilo aprobada para el tratamiento del dolor postoperatorio y la inflamación después de una cirugía ocular. Esta investigación se diseñó para evaluar el efecto de un tamaño de partícula reducido en la PK ocular del LE después de una administración ocular tópica única a conejos holandeses. También se evaluó una tercera formulación que contenía las partículas de LE del mismo tamaño que la formulación comercial pero a una concentración mayor para determinar si una dosis mayor de LE proporciona una mayor exposición ocular. Se usó Gel Lotemax® como la formulación de comparación.
Se usaron un total de 108 conejos holandeses en este estudio farmacocinético no cruzado y sin GLP. Los conejos tenían aproximadamente 7-8 meses de edad y pesaban entre 1,56-2,69 kg. Antes del inicio del estudio, los animales fueron asignados aleatoriamente a uno de los cuatro grupos de estudio. El día de la dosificación, los animales recibieron una dosis ocular tópica única de 35 |_il que contenía la formulación apropiada en cada ojo.
• Los animales del Grupo 1 recibieron una formulación de gel al 0,38 % preparada con partículas de LE de tamaño submicrométrico (Formulación 1)
• Los animales del Grupo 2 recibieron una formulación de gel al 0,38 % que contenía partículas micronizadas de LE (Formulación 2)
• Los animales del Grupo 3 recibieron una formulación de gel al 0,75 % que tenía el mismo tamaño de partícula que el producto de Gel Lotemax® actual (Formulación 3).
• Los animales del Grupo 4 recibieron el producto comercializado Gel Lotemax® (0,5 %) (Formulación 4).
Se observaron los animales durante todo el estudio para determinar la salud general y la apariencia. A intervalos de tiempo predeterminados después de la dosificación, los animales se sacrificaron y se colectaron muestras de tejido ocular seleccionado. Las concentraciones de LE en los tejidos oculares se determinaron por LC/MS/MS. Todos los procedimientos en vida se realizaron en PharmOptima (Portage, MI). El bioanálisis de muestras de tejido ocular se realizó en Bausch Lomb (Rochester, NY). Las formulaciones experimentales fueron preparadas por Bausch Lomb Formulations Development y enviadas al sitio de prueba como materiales listos para usar. El gel Lotemax® fue proporcionado por Bausch Lomb (Tampa, FL). Los detalles de las formulaciones de prueba se proporcionan en la Tabla 4-1.
Tabla 4-1 Resumen de la Formulación de Loteprednol Etabonato
Se realizó un examen oftálmico en ambos ojos de todos los animales de estudio antes del envío del proveedor a la instalación de prueba. El examen consistió en una evaluación del segmento anterior del ojo mediante el uso de un microscopio binocular con lámpara de hendidura para verificar que no hubiera anormalidades oftálmicas preexistentes que pudieran interferir con el resultado del estudio. Al llegar a la instalación de prueba, se realizó un examen visual de todos los animales para confirmar que gozaban de buena salud. Luego se pesaron los animales y se asignaron aleatoriamente a uno de los cuatro grupos de estudio de 27 animales, cada uno usando un generador de números aleatorios.
El día de la dosificación, los animales (alimentados) recibieron una administración ocular tópica única de 35 |_il de la formulación de prueba apropiada en cada ojo. Los animales en el Grupo 1 recibieron una formulación de gel al 0,38 % preparada con partículas de LE de tamaño susbmicrométrico (también denominadas Formulación y Formulación Submicrométrica). Los animales en el Grupo 2 recibieron una formulación de gel al 0,38 % que contenía partículas micronizadas de LE (también denominadas Formulación micronizada y Formulación 2). Los animales en el Grupo 3 recibieron una formulación de gel al 0,75 % que tenía el mismo tamaño de partícula que el producto de gel Lotemax® actual (también conocido como Formulación no Modificada y Formulación 3), y los animales en el Grupo 4 recibieron Gel Lotemax® (0,5 %) (también denominado Comparador y Formulación 4). Las formulaciones no se agitaron antes de la administración. Se instilaron dosis en el saco conjuntival inferior de cada ojo mediante el uso de una pipeta de desplazamiento positivo Gilson M-50 calibrada. Inmediatamente después de la dosificación, los párpados se mantuvieron cerrados suavemente durante varios segundos para facilitar la distribución uniforme de la sustancia de prueba sobre la superficie del ojo y minimizar el escurrimiento. Se observaron los animales durante todo el estudio para determinar la salud general y la apariencia.
A intervalos de tiempo predeterminados después de la dosificación, los animales (n = 3/grupo/tiempo de recolección) se sacrificaron humanitariamente mediante sobredosis intravenosa de pentobarbital sódico y se colectaron tejidos oculares de cada ojo. Se colectaron in situ fluido lagrimal (colectado con tiras de Schirmer), conjuntiva bulbar y humor acuoso (colectado con una aguja y una jeringa), mientras que la córnea y el iris/cuerpo ciliar se colectaron una vez que los ojos se habían enucleado y congelado instantáneamente en nitrógeno líquido. Se colectaron muestras de tejido ocular a 0,0833 (5 min), 0,25 (15 min), 0,5 (30 min), 1, 2, 4, 8, 12 y 24 horas después de la dosificación. Las muestras de tejido ocular se almacenaron congeladas hasta su envío en hielo seco a las instalaciones de Bausch+Lomb. A su llegada, las muestras se mantuvieron a o por debajo de -20 °C hasta el bioanálisis.
Las concentraciones de LE en los tejidos oculares se determinaron por LC/MS/MS. Con el fin de calcular las concentraciones medias, se asignó un valor de V2 del límite inferior de cuantificación (LLQ) a todas las muestras con concentraciones por debajo del LLQ (BLQ). Además, cualquier muestra con una concentración medida que fuera BLQ y al menos 10 veces inferior a la concentración mediana o más de 10 veces superior a la concentración mediana en el conjunto de muestras respectivo se consideró atípica y no se incluyó en ningún cálculo. Con base en estos criterios, 17 (-8 %) muestras de fluido lagrimal, 3 (-1 %) muestras de conjuntiva bulbar, 2 (-1 %) muestras de córnea, 3 (-1 %) muestras de humor acuoso y 1 (-0,5 %) muestra de iris/cuerpo ciliar se determinaron que eran atípicas.
El análisis farmacocinético de los datos compuestos de concentración vs. tiempo se realizó mediante el uso de métodos no compartimentales en WinNonlin Professional® (versión 5.3, Pharsight Corporation, St. Louis, MO). Debido a la naturaleza destructiva del régimen de muestreo empleado en este estudio, se usaron datos compuestos medios en el análisis PK. Los tiempos nominales de recolección de muestras se usaron en el análisis PK. Los parámetros PK incluyendo concentración máxima (Cmáx) y el momento en que se observó la concentración máxima (Tmáx) se determinaron directamente a partir de los perfiles de concentración vs. tiempo. Los valores del área bajo la curva de concentración vs. tiempo (AUC(0-24h)) y las estimaciones de error estándar (SE) correspondientes se calcularon
mediante el uso del método trapezoidal lineal en WinNonlin y/o Microsoft Excel (2010).
Para determinar si la exposición a LE en los tejidos oculares después de la administración de las formulaciones experimentales (Formulaciones 1-3) varió significativamente de la exposición obtenida con el producto comercial (Formulación 4), el (AUC(0-24h)) y las estimaciones de SE se compararon mediante el uso de la prueba t de Welch como lo demuestran Schoenwald (1987) y Tang- Liu y Burke (1988). Schoenwald RD, Harris RG, Turner D, y otros, Ophthalmic bioequivalence of steroid/antibiotic combination formulations. Biopharm Drug Dispos. 1987; 8:527-548; Tang-Liu DD, Burke PJ. The effect of azone on ocular levobunolol absorption: calculating the area under the curve and its standard error using tissue sampling compartments. Pharm Res. 1988; 5:238-241. Una prueba t de Student de dos colas se usó para determinar diferencias significativas en Cmáx después de que se usó una prueba F para determinar la varianza igual o desigual entre los valores de concentración individuales en Cmáx. Las diferencias se consideraron estadísticamente significativas cuando el valor de P calculado fue menor o igual a 0,05. Todos los cálculos estadísticos se realizaron con Microsoft Excel (2010).
Los valores de los parámetros farmacocinéticos obtenidos para LE después de una administración ocular tópica única bilateral se presentan en la Tabla 4-2. Los datos de concentración media e individual vs. tiempo se presentan en las Figuras 11 a 25, donde BLQ denota por debajo del nivel de cuantificación. En las Figuras 21-24, el asterisco (*) indica estadísticamente significativo (p<0,05) de Gel Lotemax® LE al 0,5 %. En las Figuras 26-35 se presenta un resumen de los datos de concentración media e individual vs. tiempo; en estas figuras, el superíndice (a) indica un resultado atípico aparente individual, diferido por >10 veces de otros resultados en ese tiempo de recolección, por lo que el valor no se incluyó en los cálculos. En las Figuras 33 y 34, un superíndice (b) indica un resultado por debajo del límite inferior de cuantificación, por lo que se asignó un valor igual a V2 del valor del LLQ con el fin de calcular estadísticas resumidas.
Tabla 4-2 Valores de los Parámetros Farmacocinéticos para el Loteprednol Etabonato Después de una Adm inistración Ocular Tópica Única a Conejos holandeses
Resumen del Método Bioanalítico -- Los métodos de LC/MS/MS para la cuantificación de loteprednol etabonato (LE) en tejidos oculares de conejos holandeses se desarrollaron en Bausch Lomb. Los métodos se evaluaron por su precisión y exactitud, pero no fueron completamente validados o no cumplían con GLP. En general, el rendimiento de los métodos analíticos se consideró aceptable para respaldar este estudio PK no clínico.
Un total de 1080 muestras de tejido ocular se analizaron con éxito en 6 análisis bioanalíticos. Las muestras consistieron en fluido lagrimal, conjuntiva bulbar, córnea, humor acuoso e iris/cuerpo ciliar. Se añadió una cantidad variable de acetonitrilo:agua 1:1 al fluido lagrimal, la conjuntiva bulbar, la córnea y las muestras de iris/cuerpo ciliar mediante el uso de un Tecan Freedom EVO 150. El volumen de solvente se ajustó para cada muestra en función del peso de la muestra individual para garantizar una concentración de matriz constante para todas las muestras, estándares y muestras de control de calidad. Todas las muestras se sonicaron y se sometieron a vórtice antes de transferir una alícuota a una placa de muestra de 96 pocillos. Todas las muestras por encima de1HLQ se diluyeron 100X con acetonitrilo:agua 1:1. Se incluyeron dos conjuntos de al menos 8 estándares y 3 controles de calidad (bajo, medio y alto, por triplicado) junto con dos muestras 'cero' (matriz en blanco con estándar interno) y 5 blancos de control (matriz en blanco) en cada corrida bioanalítica.
En la Tabla 4-3 se proporciona un resumen del intervalo bioanalítico para tejidos oculares de conejos holandeses.
Tabla 4-3 Resumen del Intervalo Bioanalítico
Discusión
Con la excepción del fluido lagrimal, la exposición a LE fue similar o mayor en todos los tejidos oculares examinados después de la administración de la formulación de LE no modificada de mayor concentración (0,75 %) (Formulación 3) en comparación con Gel Lotemax® (Formulación 4). En la mayoría de los casos, las diferencias observadas en la exposición fueron menos que proporcionales a la dosis (diferencia de 1,0 a 2,5 veces basada en Cmáx y AUC(0-24h)) y no estadísticamente significativas.
En comparación con el Gel Lotemax®, la exposición a LE después de la administración de la formulación micronizada al 0,38 % (Formulación 2) fue de 1,2 a 4,3 veces menor en todos los tejidos oculares examinados, basado en Cmáx y AUC(0-24h). En el fluido lagrimal y la córnea, las diferencias en la exposición fueron estadísticamente significativas.
La administración ocular tópica de la formulación de concentración menor (0,38 %) preparada con partículas submicrométricas de LE (Formulación 1) proporcionó una exposición significativamente (p < 0,05) mayor a LE en el humor acuoso (1,9 a 2,5 veces) y similar o ligeramente mayor exposición a LE en el iris/cuerpo ciliar (1,0 a 1,6 veces) y córnea (1,0 a 1,3 veces) en comparación con el Gel Lotemax® (Formulación 4), basado en los valores de Cmáx y AUC(0-24h). La exposición a LE fue menor en el fluido lagrimal (1,4 a 1,9 veces) y significativamente menor en la conjuntiva bulbar (1,4 a 2,8 veces), pero estos no se consideran tejidos diana. En resumen, basado en los valores de Cmáx y/o AUC(0-24h), la exposición a LE fue significativamente mayor en el humor acuoso, similar o mayor en el iris/cuerpo ciliar y córnea, y menor en el fluido lagrimal y la conjuntiva bulbar después de la administración de la formulación susbmicrométrica al 0,38 % (Formulación 1) en comparación con el Gel Lotemax®. A pesar de la reducción del 24 % en la dosis administrada, la exposición a LE fue estadísticamente mayor en el humor acuoso, un tejido diana clave, para la formulación susbmicrométrica al 0,38 % (Formulación 1). Estos datos indican que el tamaño de partícula submicrométrico mejora la penetración del fármaco en los tejidos oculares clave.
Las diferencias de veces para las formulaciones, en comparación con el Gel Lotemax® LE al 0,5 %, se resumen en las Tablas 4-4 a 4-6.
Tabla 4.4 - Diferencias de Veces - Formulación 1 (LE Subm icrométrico al 0,38 %) vs. Formulación 4 (Gel Lotemax al 0,5 %)
Tabla 4.5 - Diferencias de Veces - Formulación 2 (LE Micronizado al 0,38 %) vs. Formulación 4 (Gel Lotemax al 0,5 %)
Tabla 4.6 - Diferencias de Veces - Formulación 3 (LE No Modificado al 0,75 %) vs. Formulación 4 (Gel Lotemax al 0,5 %)
Ejemplo 5 - Investigación del Efecto del Tamaño de Partícula y la Concentración en la Farmacocinética Ocular y Sistémica de 21-Desacetil Difluprednato Después de una Adm inistración Ocular Tópica Única de Difluprednato en una Formulación de Gel a Conejos holandeses
Se usaron un total de 135 conejos holandeses en este estudio farmacocinético. El día de la dosificación, los animales recibieron una dosis ocular tópica única de 35 |_il que contenía la formulación apropiada en cada ojo. El difluprednato (DFBA) es un profármaco y se hidroliza rápidamente a 21-desacetil DFBA después de la instilación ocular. Los métodos LC/m S/MS para la cuantificación de 21-desacetil DFBA en tejidos oculares y plasma de conejos holandeses se evaluaron para determinar la precisión y exactitud, pero no fueron completamente validados o no cumplían con GLP. En general, el rendimiento de los métodos analíticos se consideró aceptable para respaldar este estudio PK no clínico.
• Formulación 5-1 - Suspensión de Gel de DFBA Submicrométrico al 0,05 % correspondiente a la Composición B con Dv50 de 0,2 |_im y pH 6,1-6,2.
• Formulación 5-2 - Suspensión de Gel de DFBA Submicrométrico al 0,2 % - Similar a la Formulación 5-1 pero que contiene DFBA al 0,2 %
• Formulación 5-3 - Suspensión de Gel de DFBA Submicrométrico al 0,8 % - Similar a la Formulación 5-1 pero que contiene DFBA al 0,8 %
• Formulación 5-4 - Suspensión de Gel de DFBA Micronizado al 0,8 % - Similar a la Formulación 5-3 pero que contiene DFBA al 0,8 % con Dv50 de 3 mm
• Formulación 5-5 - Emulsión oftálmica de difluprednato DUREZOL®, DFBA al 0,05 %, una emulsión oftálmica conservada estéril
Las Figuras 36-42 informan las concentraciones del metabolito de DFBA, 21-desacetil difluprednato, en diversos tejidos oculares y plasma. La Tabla 5.1 resume el efecto de la formulación y el tamaño de partícula de DFBA sobre la exposición del metabolito en el humor acuoso de conejo después de la administración ocular tópica única de DFBA. La Tabla 5.2 resume el efecto de la formulación y el tamaño de partícula de DFBA sobre la exposición sistémica de 21-desacetil DFBA en plasma después de la administración ocular tópica única de DFBA.
Tabla 5.1 - El efecto de la formulación y el tamaño de partícula sobre la exposición de 21-desacetil DFBA en humor acuoso después de una adm inistración ocular tópica única de DFBA a conejos
Tabla 5.2 - El efecto de la form ulación y el tamaño de partícula sobre la exposición sistémica de 21-desacetil DFBA después de una adm inistración ocular tópica única de DFBA a conejos
Las siguientes observaciones se realizaron a partir de este estudio.
Una administración ocular tópica única de DFBA al 0,05 % con una suspensión de gel de tamaño de partícula submicrométrica (Formulación 5-1) condujo a concentraciones y exposición significativamente mayores del metabolito activo en todos los tejidos oculares, en comparación con el producto de emulsión comercial de DFBA al 0,05 % (Formulación 5-5). Cmáx y el AUC aumentó aproximadamente 3 veces en el humor acuoso.
La mayor concentración de metabolito de DFBA y la exposición se encontraron en la conjuntiva y la córnea, seguidas por iris/cuerpo ciliar y humor acuoso.
La administración de concentraciones crecientes de DFBA en una formulación de gel susbmicrométrica condujo a un aumento en la exposición del metabolito activo en el humor acuoso y otros tejidos oculares; sin embargo, este aumento no fue proporcional a la dosis. No hubo diferencias significativas en Cmáx en el humor acuoso entre formulaciones de gel susbmicrométricas a concentraciones crecientes.
No hubo diferencias significativas entre las partículas susbmicrométricas y micronizadas a DFBA al 0,8 % (Formulaciones 5-3 y 5-4) en ningún tejido ocular, excepto el iris/cuerpo ciliar.
La exposición sistémica de la Formulación 5-1 fue significativamente mayor después de la administración tópica en comparación con la Formulación 5-5. La exposición sistémica también aumentó con el aumento de las concentraciones de DFBA (Formulaciones 5-2, 5-3 y 5-4).
Ejemplo 6 - Estudios de Estabilidad
Los estudios de estabilidad han demostrado que la Composición A es estable al almacenamiento durante una vida útil de dos años.
Claims (15)
1. Una suspensión oftálmica que comprende un ingrediente activo oftálmico suspendido en un vehículo de la formulación, en donde el ingrediente activo oftálmico es loteprednol etabonato y está presente como partículas que tienen Dygo < 5 pm y Dv50 < 1 pm, y el vehículo de la formulación comprende policarbofilo como un agente de suspensión, hidroxipropilmetilcelulosa como un derivado de celulosa no iónico, un tensioactivo de poloxaleno, glicerina, propilenglicol y un agente tampón de borato, y en donde la suspensión es estable en almacenamiento durante al menos un año.
2. La suspensión de la reivindicación 1, que es estable en almacenamiento durante al menos dos años.
3. La suspensión de la reivindicación 1, en donde el derivado de celulosa no iónico es hidroxipropilmetilcelulosa E4M.
4. La suspensión de la reivindicación 1, en donde el tensioactivo comprende poloxaleno 407.
5. La suspensión de la reivindicación 1, que comprende loteprednol etabonato al 0,1 % en peso al 0,4 % en peso.
6. La suspensión de la reivindicación 1, que comprende loteprednol etabonato al 0,38 % en peso.
7. La suspensión de la reivindicación 1, que comprende loteprednol etabonato al 0,1-0,4 % en peso, policarbofilo al 0,1 -0,5 % en peso, hidroxipropilmetilcelulosa al 0,1-0,5 % en peso, cloruro de benzalconio al 0,001-0,01 % en peso, edetato dihidrato disódico al 0,01-0,1 % en peso, cloruro de sodio al 0,01-0,1 % en peso, tensioactivo no iónico de poloxaleno al 0,1-1,0 % en peso, glicerina y propilenglicol al 0,1-2 % en peso, y un tampón de borato al 0,01-1 % en peso.
8. La suspensión de la reivindicación 1, que comprende loteprednol etabonato a 3,80 mg/ml, policarbofilo a 3,75 mg/ml, hidroxipropilmetilcelulosa E4M a 2,5 mg/ml, cloruro de benzalconio a 0,03 mg/ml, edetato de dihidrato disódico a 0,55 mg/ml, cloruro de sodio a 0,5 mg/ml, poloxaleno 407 a 2,0 mg/ml, glicerina a 8,8 mg/ml, propilenglicol a 4,4 mg/ml y ácido bórico a 5,0 mg/ml.
9. La suspensión de una cualquiera de las reivindicaciones 1-8, en donde el ingrediente activo oftálmico está presente como partículas que tienen Dv90 < 3 pm y Dv50 < 1 pm.
10. La suspensión de una cualquiera de las reivindicaciones 1-8, en donde el ingrediente activo oftálmico está presente como partículas que tienen Dv90 < 3 pm y Dv50 < 0,6 pm.
11. Una suspensión oftálmica para usar en el tratamiento de una afección inflamatoria oftálmica que comprende un ingrediente activo antiinflamatorio oftálmico suspendido en un vehículo de la formulación, en donde el ingrediente activo antiinflamatorio oftálmico es loteprednol etabonato y está presente como partículas que tienen Dv90 < 5 pm y Dv50 < 1 pm, y el vehículo de la formulación comprende policarbofilo como un agente de suspensión, hidroxipropilmetilcelulosa como un derivado de celulosa no iónico, un tensioactivo de poloxaleno, glicerina, propilenglicol y un agente tampón de borato, y en donde la suspensión es estable en almacenamiento durante al menos un año.
12. La suspensión oftálmica para usar de la reivindicación 11, en donde la suspensión es para usar a una frecuencia de una o dos veces por día.
13. La suspensión oftálmica para usar de la reivindicación 11, en donde la afección inflamatoria oftálmica es la inflamación resultante de la cirugía posocular o de la uveítis.
14. La suspensión oftálmica para usar de la reivindicación 11, que comprende loteprednol etabonato al 0,1-0,4 % en peso, policarbofilo al 0,1-0,5 % en peso, hidroxipropilmetilcelulosa al 0,1-0,5 % en peso, cloruro de benzalconio al 0,001-0,01 % en peso, edetato dihidrato disódico al 0,01-0,1 % en peso, cloruro de sodio al 0,01-0,1 % en peso, tensioactivo no iónico de poloxaleno al 0,1-1,0 % en peso, glicerina y propilenglicol al 0,1 2 % en peso, y un agente tampón de borato al 0,01-1 % en peso.
15. La suspensión oftálmica para usar de la reivindicación 11, que comprende loteprednol etabonato a 3,80 mg/ml, policarbofilo a 3,75 mg/ml, hidroxipropilmetilcelulosa E4M a 2,5 mg/ml, cloruro de benzalconio a 0,03 mg/ml, edetato de dihidrato disódico a 0,55 mg/ml, cloruro de sodio a 0,5 mg/ml, poloxaleno 407 a 2,0 mg/ml, glicerina a 8,8 mg/ml, propilenglicol a 4,4 mg/ml y ácido bórico a 5,0 mg/ml.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562107696P | 2015-01-26 | 2015-01-26 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2787039T3 true ES2787039T3 (es) | 2020-10-14 |
Family
ID=55359733
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES22175139T Active ES2966595T3 (es) | 2015-01-26 | 2016-01-26 | Composición de suspensión oftálmica |
| ES18209003T Active ES2787039T3 (es) | 2015-01-26 | 2016-01-26 | Composición de suspensión oftálmica |
| ES20166312T Active ES2924645T3 (es) | 2015-01-26 | 2016-01-26 | Composición de suspensión oftálmica |
| ES23196938T Active ES3031414T3 (en) | 2015-01-26 | 2016-01-26 | Ophthalmic suspension composition |
| ES16704744T Active ES2704125T3 (es) | 2015-01-26 | 2016-01-26 | Composición de suspensión oftálmica |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES22175139T Active ES2966595T3 (es) | 2015-01-26 | 2016-01-26 | Composición de suspensión oftálmica |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES20166312T Active ES2924645T3 (es) | 2015-01-26 | 2016-01-26 | Composición de suspensión oftálmica |
| ES23196938T Active ES3031414T3 (en) | 2015-01-26 | 2016-01-26 | Ophthalmic suspension composition |
| ES16704744T Active ES2704125T3 (es) | 2015-01-26 | 2016-01-26 | Composición de suspensión oftálmica |
Country Status (15)
| Country | Link |
|---|---|
| US (3) | US10596107B2 (es) |
| EP (5) | EP4082531B1 (es) |
| JP (1) | JP2018507252A (es) |
| KR (1) | KR102538370B1 (es) |
| CN (1) | CN107427464B (es) |
| AU (3) | AU2016211745A1 (es) |
| BR (1) | BR112017016016B1 (es) |
| CA (1) | CA2975106A1 (es) |
| ES (5) | ES2966595T3 (es) |
| HU (5) | HUE066045T2 (es) |
| MX (1) | MX390671B (es) |
| PL (5) | PL3250185T3 (es) |
| PT (3) | PT4268850T (es) |
| SI (1) | SI4268850T1 (es) |
| WO (1) | WO2016123079A1 (es) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2016211745A1 (en) | 2015-01-26 | 2017-08-31 | Bausch & Lomb Incorporated | Ophthalmic suspension composition |
| US11000475B2 (en) | 2015-10-16 | 2021-05-11 | Sun Pharma Advanced Research Company Limited | Ophthalmic solution of difluprednate |
| PL3245988T3 (pl) | 2016-05-18 | 2024-05-27 | Sonikure Holdings Limited | Układ do przeztwardówkowego podawania leków wspomaganego ultradźwiękami |
| US11344562B2 (en) | 2017-08-15 | 2022-05-31 | Nephron Pharmaceuticals Corporation | Aqueous nebulization composition |
| WO2020061249A2 (en) * | 2018-09-21 | 2020-03-26 | Ps Therapies Ltd. | Artificial tear, contact lens and drug vehicle compositions and methods of use thereof |
| JP6994061B2 (ja) * | 2019-02-15 | 2022-01-14 | ノバルティス アーゲー | 4-(7-ヒドロキシ-2-イソプロピル-4-オキソ-4h-キナゾリン-3-イル)-ベンゾニトリルの製剤 |
| EP3924345A1 (en) * | 2019-02-15 | 2021-12-22 | Novartis AG | Crystalline forms of 4-(7-hydroxy-2-isopropyl-4-oxo-4h-quinazolin-3-yl)-benzonitrile and formulations thereof |
| EP4013443A4 (en) * | 2019-08-18 | 2023-10-04 | IVIEW Therapeutics (Zhuhai) Co., Ltd. | IN-SITU GEL-CONTAINING CYCLOSPORINE MICELLARS AS A SYSTEM FOR THE DELAYED RELEASE OF OPHTHALMIC ACTIVE INGREDIENTS |
| KR102271247B1 (ko) * | 2020-11-04 | 2021-06-30 | 삼천당제약주식회사 | 안과용 현탁액 조성물의 제조방법 |
| CN115887372A (zh) * | 2022-10-25 | 2023-04-04 | 苏州欧康维视生物科技有限公司 | 丙酸氟替卡松混悬液及其制备方法 |
| CN115554238A (zh) * | 2022-10-25 | 2023-01-03 | 苏州欧康维视生物科技有限公司 | 眼用混悬液及其制备方法 |
Family Cites Families (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4996335A (en) | 1980-07-10 | 1991-02-26 | Nicholas S. Bodor | Soft steroids having anti-inflammatory activity |
| US4540930A (en) | 1983-09-12 | 1985-09-10 | Wisconsin Alumni Research Foundation | Plywheel-powered mobile X-ray apparatus |
| EP0501523B1 (en) | 1983-11-14 | 1997-04-09 | Columbia Laboratories, Inc. | Bioadhesive compositions |
| NZ226171A (en) | 1987-09-18 | 1990-06-26 | Ethicon Inc | Gel formulation containing polypeptide growth factor |
| US5192535A (en) | 1988-02-08 | 1993-03-09 | Insite Vision Incorporated | Ophthalmic suspensions |
| IE63392B1 (en) | 1988-02-08 | 1995-04-19 | Insite Vision Inc | Ophthalmic suspensions |
| US5124154A (en) | 1990-06-12 | 1992-06-23 | Insite Vision Incorporated | Aminosteroids for ophthalmic use |
| US5252318A (en) | 1990-06-15 | 1993-10-12 | Allergan, Inc. | Reversible gelation compositions and methods of use |
| CA2134376C (en) | 1993-12-20 | 2001-10-23 | Haresh G. Bhagat | Combinations of polymers for use in physiological tear compositions |
| AU684115B2 (en) * | 1993-12-27 | 1997-12-04 | Mitsubishi Chemical Corporation | Ophthalmic suspension containing diflupredonate |
| GB9718568D0 (en) * | 1997-09-03 | 1997-11-05 | Chauvin Pharmaceuticals Limite | Compositions |
| TWI227143B (en) | 1999-12-15 | 2005-02-01 | Guo-Jiun Sung | In situ gel formation for ophthalmic delivery by combining Pluronic/Carbopol medic composition and its preparing method |
| AR033151A1 (es) * | 2001-04-12 | 2003-12-03 | Sucampo Pharmaceuticals Inc | Agente para el tratamiento oftalmico topico de las enfermedades inflamatorias oculares |
| US7001615B1 (en) | 2001-12-07 | 2006-02-21 | Alcon, Inc. | Sustained release ophthalmic, otic and nasal suspension |
| WO2004006959A1 (en) * | 2002-07-16 | 2004-01-22 | Elan Pharma International, Ltd | Liquid dosage compositions of stable nanoparticulate active agents |
| CA2839928C (en) * | 2003-06-13 | 2016-10-04 | Alcon, Inc. | Ophthalmic compositions containing a synergistic combination of two polymers |
| US20050197303A1 (en) | 2003-10-31 | 2005-09-08 | Bausch & Lomb Incorporated | Combination of loteprednol etabonate and tobramycin for topical ophthalmic use |
| US20050182039A1 (en) * | 2004-02-13 | 2005-08-18 | Bausch & Lomb Incorporated | Use of Loteprednol etabonate for the treatment of dry eye |
| TWI358290B (en) | 2004-12-02 | 2012-02-21 | Alcon Inc | Topical nepafenac formulations |
| US7919483B2 (en) | 2005-06-24 | 2011-04-05 | Medicis Pharmaceutical Corporation | Method for the treatment of acne |
| US20120028947A1 (en) | 2005-11-14 | 2012-02-02 | Erning Xia | Ophthalmic Compositions |
| WO2007058935A2 (en) | 2005-11-14 | 2007-05-24 | Bausch & Lomb Incorporated | Ophthalmic composition for dry eye therapy |
| US20100234336A1 (en) | 2005-11-14 | 2010-09-16 | Erning Xia | Ophthalmic Compositions |
| US8846770B2 (en) * | 2008-06-18 | 2014-09-30 | Otonomy, Inc. | Controlled release aural pressure modulator compositions and methods for the treatment of OTIC disorders |
| US8501800B2 (en) | 2009-03-05 | 2013-08-06 | Insite Vision Incorporated | Controlled-release ophthalmic vehicles |
| CN101966143A (zh) | 2009-07-28 | 2011-02-09 | 胡容峰 | 加替沙星温度及pH敏感眼用凝胶的制备与应用 |
| SI2506831T1 (sl) | 2009-12-03 | 2014-01-31 | Alcon Research, Ltd. | Suspenzije nanodelcev, ki vsebujejo karbonilvinilni polimer |
| AU2012312816A1 (en) | 2011-09-22 | 2014-04-24 | Bausch & Lomb Incorporated | Ophthalmic gel compositions |
| EP4008355A1 (en) | 2012-05-03 | 2022-06-08 | Kala Pharmaceuticals, Inc. | Pharmaceutical nanoparticles showing improved mucosal transport |
| JP6285419B2 (ja) | 2012-05-08 | 2018-02-28 | ニコックス アフサァルミィクス、 インコーポレイテッドNicox Ophthalmics, Inc. | 疎水性治療剤の調製物、製造方法およびその使用 |
| US8765725B2 (en) * | 2012-05-08 | 2014-07-01 | Aciex Therapeutics, Inc. | Preparations of hydrophobic therapeutic agents, methods of manufacture and use thereof |
| CN104203217B (zh) * | 2012-05-11 | 2017-02-15 | 株式会社活效制药 | 有机化合物纳米粉体的制造方法 |
| US20160051503A1 (en) | 2012-08-31 | 2016-02-25 | Bausch & Lomb Incorporated | Ophthalmic compositions with omega-3 fatty acids |
| US20150190407A1 (en) | 2014-01-07 | 2015-07-09 | Insite Vision Incorporated | Methods for treatment of postoperative inflammation with reduced intraocular pressure |
| AU2015288644B2 (en) | 2014-07-11 | 2017-12-14 | Fujifilm Corporation | Aqueous ophthalmic composition |
| WO2016006701A1 (ja) | 2014-07-11 | 2016-01-14 | 富士フイルム株式会社 | 眼科用水性組成物の製造方法及び眼科用水性組成物 |
| US10172852B2 (en) | 2014-07-28 | 2019-01-08 | Sun Pharma Advanced Research Company Ltd. | Method of increasing bioavailability and/or prolonging ophthalmic action of a drug |
| AU2016211745A1 (en) | 2015-01-26 | 2017-08-31 | Bausch & Lomb Incorporated | Ophthalmic suspension composition |
-
2016
- 2016-01-26 AU AU2016211745A patent/AU2016211745A1/en not_active Abandoned
- 2016-01-26 CA CA2975106A patent/CA2975106A1/en not_active Abandoned
- 2016-01-26 SI SI201631905T patent/SI4268850T1/sl unknown
- 2016-01-26 PT PT231969387T patent/PT4268850T/pt unknown
- 2016-01-26 US US15/006,525 patent/US10596107B2/en active Active
- 2016-01-26 HU HUE22175139A patent/HUE066045T2/hu unknown
- 2016-01-26 ES ES22175139T patent/ES2966595T3/es active Active
- 2016-01-26 CN CN201680016825.XA patent/CN107427464B/zh active Active
- 2016-01-26 HU HUE18209003A patent/HUE048564T2/hu unknown
- 2016-01-26 WO PCT/US2016/014872 patent/WO2016123079A1/en not_active Ceased
- 2016-01-26 PL PL16704744T patent/PL3250185T3/pl unknown
- 2016-01-26 ES ES18209003T patent/ES2787039T3/es active Active
- 2016-01-26 ES ES20166312T patent/ES2924645T3/es active Active
- 2016-01-26 KR KR1020177023453A patent/KR102538370B1/ko active Active
- 2016-01-26 EP EP22175139.9A patent/EP4082531B1/en active Active
- 2016-01-26 JP JP2017558359A patent/JP2018507252A/ja active Pending
- 2016-01-26 PL PL23196938.7T patent/PL4268850T3/pl unknown
- 2016-01-26 ES ES23196938T patent/ES3031414T3/es active Active
- 2016-01-26 PL PL20166312.7T patent/PL3721868T3/pl unknown
- 2016-01-26 PL PL22175139.9T patent/PL4082531T3/pl unknown
- 2016-01-26 HU HUE16704744A patent/HUE041945T2/hu unknown
- 2016-01-26 BR BR112017016016-1A patent/BR112017016016B1/pt active IP Right Grant
- 2016-01-26 EP EP16704744.8A patent/EP3250185B1/en not_active Revoked
- 2016-01-26 EP EP23196938.7A patent/EP4268850B1/en active Active
- 2016-01-26 EP EP20166312.7A patent/EP3721868B2/en active Active
- 2016-01-26 ES ES16704744T patent/ES2704125T3/es active Active
- 2016-01-26 HU HUE20166312A patent/HUE059639T2/hu unknown
- 2016-01-26 HU HUE23196938A patent/HUE071679T2/hu unknown
- 2016-01-26 PL PL18209003T patent/PL3470059T3/pl unknown
- 2016-01-26 PT PT221751399T patent/PT4082531T/pt unknown
- 2016-01-26 EP EP18209003.5A patent/EP3470059B1/en active Active
- 2016-01-26 PT PT201663127T patent/PT3721868T/pt unknown
- 2016-01-26 MX MX2017009699A patent/MX390671B/es unknown
-
2020
- 2020-03-23 US US16/826,366 patent/US11534395B2/en active Active
-
2021
- 2021-05-12 AU AU2021203027A patent/AU2021203027B2/en active Active
-
2022
- 2022-12-21 US US18/086,286 patent/US20230140895A1/en active Pending
-
2023
- 2023-10-12 AU AU2023248145A patent/AU2023248145B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2787039T3 (es) | Composición de suspensión oftálmica | |
| MX2011009802A (es) | Formulaciones oftalmicas de cetirizina y metodos de uso. | |
| EA036820B1 (ru) | Фармацевтическая композиция, содержащая бринзоламид | |
| BR112012013503B1 (pt) | composição de suspensão oftálmica aquosa topicamente administrável, e método para manter sua viscosidade | |
| KR20140069210A (ko) | 안과적 겔 조성물 | |
| US20130079315A1 (en) | Ophthalmic Gel Compositions | |
| HK40101668B (en) | Ophthalmic suspension composition | |
| HK40101668A (en) | Ophthalmic suspension composition | |
| HK40082997A (en) | Ophthalmic suspension composition | |
| HK40082997B (en) | Ophthalmic suspension composition | |
| HK40037317A (en) | Ophthalmic suspension composition | |
| HK40037317B (en) | Ophthalmic suspension composition | |
| US20190060385A1 (en) | Compositions Providing Improved Eye Comfort |