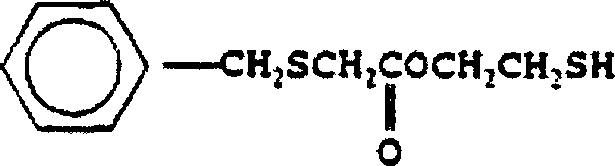
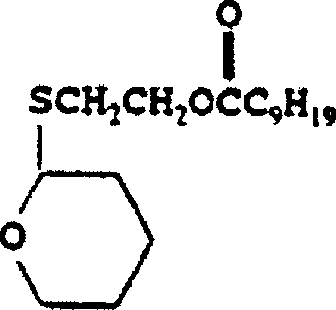
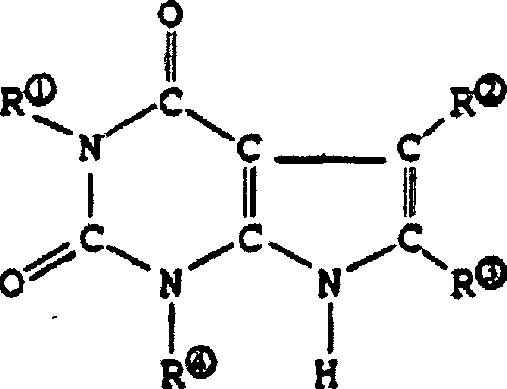
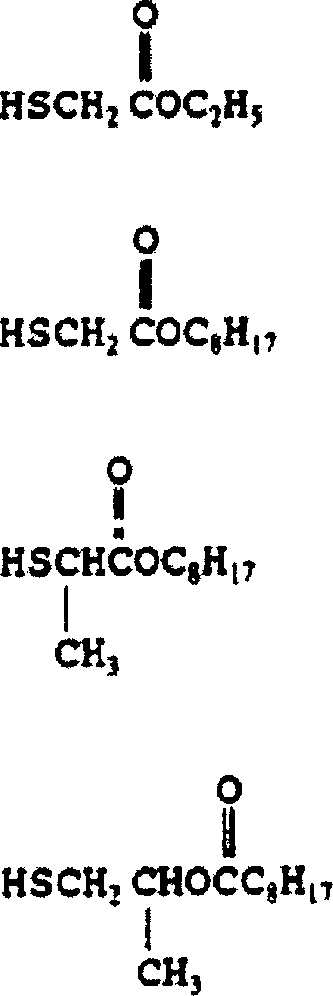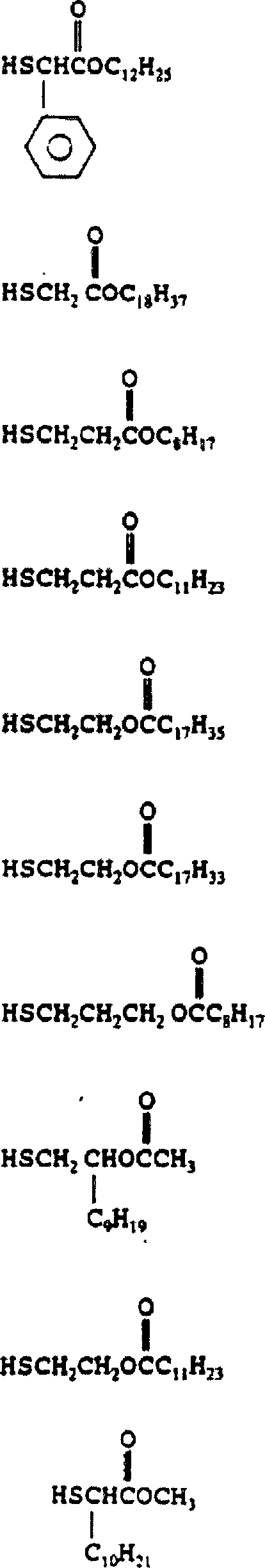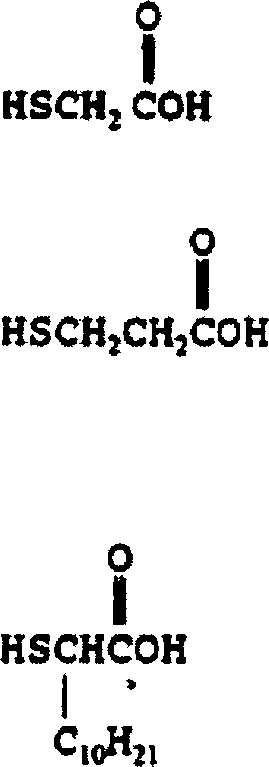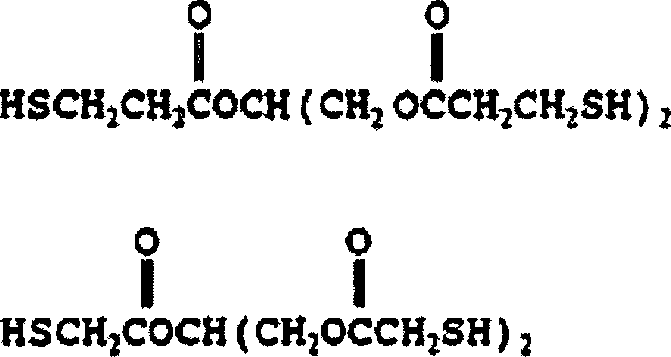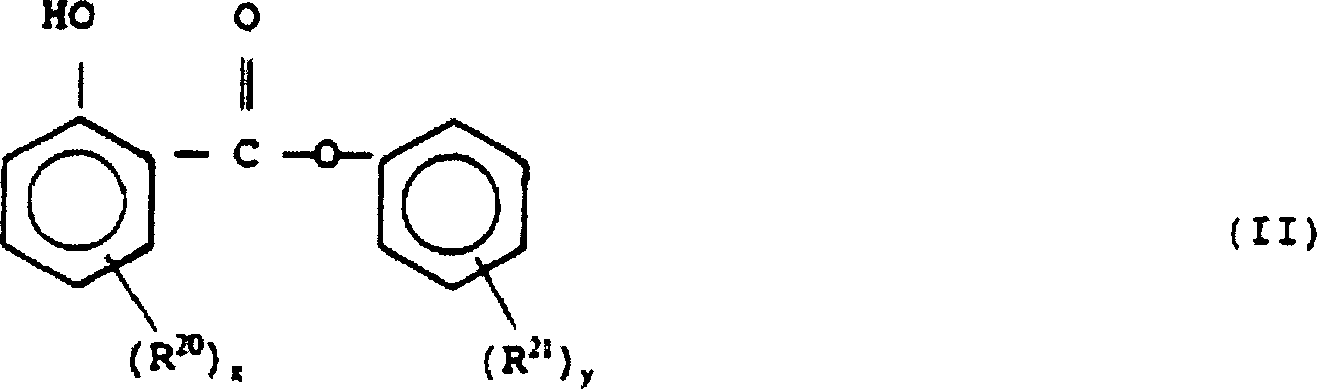DE69918779T2 - Latente Mercaptanstabilisatoren für verbesserte Witterungsbeständigkeit von klaren Halogenpolymerzusammensetzungen - Google Patents
Latente Mercaptanstabilisatoren für verbesserte Witterungsbeständigkeit von klaren Halogenpolymerzusammensetzungen Download PDFInfo
- Publication number
- DE69918779T2 DE69918779T2 DE69918779T DE69918779T DE69918779T2 DE 69918779 T2 DE69918779 T2 DE 69918779T2 DE 69918779 T DE69918779 T DE 69918779T DE 69918779 T DE69918779 T DE 69918779T DE 69918779 T2 DE69918779 T2 DE 69918779T2
- Authority
- DE
- Germany
- Prior art keywords
- radical
- mercaptan
- composition
- polyalkoxy
- stabilizer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 131
- LSDPWZHWYPCBBB-UHFFFAOYSA-N Methanethiol Chemical compound SC LSDPWZHWYPCBBB-UHFFFAOYSA-N 0.000 title claims abstract description 86
- 239000003381 stabilizer Substances 0.000 title claims abstract description 74
- 229920000642 polymer Polymers 0.000 title claims abstract description 66
- 229910052736 halogen Inorganic materials 0.000 title claims abstract description 47
- 150000002367 halogens Chemical class 0.000 title claims abstract description 46
- -1 phenyl salicylate compound Chemical class 0.000 claims abstract description 87
- 150000001875 compounds Chemical class 0.000 claims abstract description 45
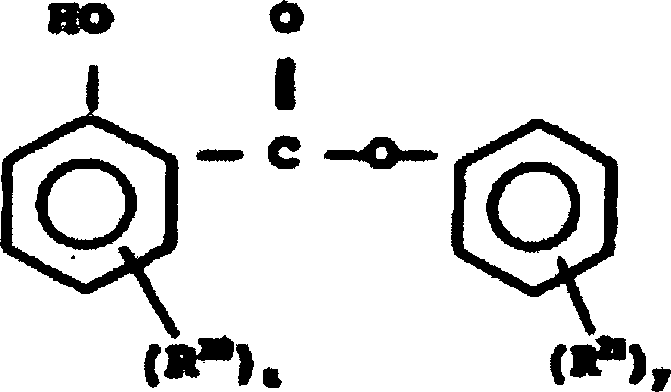
- ZQBAKBUEJOMQEX-UHFFFAOYSA-N salicylic acid phenyl ester Natural products OC1=CC=CC=C1C(=O)OC1=CC=CC=C1 ZQBAKBUEJOMQEX-UHFFFAOYSA-N 0.000 claims abstract description 44
- 239000012760 heat stabilizer Substances 0.000 claims abstract description 33
- 229960000969 phenyl salicylate Drugs 0.000 claims abstract description 26
- 229910052751 metal Inorganic materials 0.000 claims abstract description 22
- 239000002184 metal Substances 0.000 claims abstract description 22
- 238000012545 processing Methods 0.000 claims abstract description 15
- 230000000694 effects Effects 0.000 claims abstract description 7
- 150000007942 carboxylates Chemical class 0.000 claims abstract description 6
- 230000015556 catabolic process Effects 0.000 claims abstract description 6
- 238000006731 degradation reaction Methods 0.000 claims abstract description 6
- 239000000047 product Substances 0.000 claims description 31
- 125000000217 alkyl group Chemical group 0.000 claims description 25
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 18
- 125000004432 carbon atom Chemical group C* 0.000 claims description 15
- 229920001021 polysulfide Polymers 0.000 claims description 14
- 125000003118 aryl group Chemical group 0.000 claims description 13
- 125000005243 carbonyl alkyl group Chemical group 0.000 claims description 13
- 239000005077 polysulfide Substances 0.000 claims description 13
- 150000008117 polysulfides Polymers 0.000 claims description 13
- 239000001257 hydrogen Substances 0.000 claims description 12
- 229910052739 hydrogen Inorganic materials 0.000 claims description 12
- 125000003545 alkoxy group Chemical group 0.000 claims description 11
- 125000002877 alkyl aryl group Chemical group 0.000 claims description 11
- 239000002841 Lewis acid Substances 0.000 claims description 10
- 125000005027 hydroxyaryl group Chemical group 0.000 claims description 10
- 150000007517 lewis acids Chemical class 0.000 claims description 10
- 125000005041 acyloxyalkyl group Chemical group 0.000 claims description 9
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 9
- 125000004171 alkoxy aryl group Chemical group 0.000 claims description 8
- 125000005842 heteroatom Chemical group 0.000 claims description 8
- 125000004423 acyloxy group Chemical group 0.000 claims description 7
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 7
- 125000003106 haloaryl group Chemical group 0.000 claims description 7
- 229910052718 tin Inorganic materials 0.000 claims description 7
- 125000003368 amide group Chemical group 0.000 claims description 6
- 125000002768 hydroxyalkyl group Chemical group 0.000 claims description 6
- PXQLVRUNWNTZOS-UHFFFAOYSA-N sulfanyl Chemical class [SH] PXQLVRUNWNTZOS-UHFFFAOYSA-N 0.000 claims description 6
- 239000011135 tin Substances 0.000 claims description 6
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 5
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 claims description 5
- 125000004350 aryl cycloalkyl group Chemical group 0.000 claims description 5
- GDVKFRBCXAPAQJ-UHFFFAOYSA-A dialuminum;hexamagnesium;carbonate;hexadecahydroxide Chemical compound [OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[Mg+2].[Mg+2].[Mg+2].[Mg+2].[Mg+2].[Mg+2].[Al+3].[Al+3].[O-]C([O-])=O GDVKFRBCXAPAQJ-UHFFFAOYSA-A 0.000 claims description 5
- 229960001545 hydrotalcite Drugs 0.000 claims description 5
- 229910001701 hydrotalcite Inorganic materials 0.000 claims description 5
- 125000005358 mercaptoalkyl group Chemical group 0.000 claims description 5
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims description 4
- 125000002252 acyl group Chemical group 0.000 claims description 4
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 4
- 125000005078 alkoxycarbonylalkyl group Chemical group 0.000 claims description 4
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 claims description 4
- 125000005466 alkylenyl group Chemical group 0.000 claims description 4
- 125000005129 aryl carbonyl group Chemical group 0.000 claims description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 4
- 125000000623 heterocyclic group Chemical group 0.000 claims description 4
- 239000001301 oxygen Substances 0.000 claims description 4
- 229910052760 oxygen Inorganic materials 0.000 claims description 4
- 229910052717 sulfur Inorganic materials 0.000 claims description 4
- 239000011593 sulfur Substances 0.000 claims description 4
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 claims description 3
- 125000001231 benzoyloxy group Chemical group C(C1=CC=CC=C1)(=O)O* 0.000 claims description 3
- 125000005026 carboxyaryl group Chemical group 0.000 claims description 3
- 239000007857 degradation product Substances 0.000 claims description 3
- 125000005028 dihydroxyaryl group Chemical group 0.000 claims description 3
- 229910052757 nitrogen Inorganic materials 0.000 claims description 3
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 3
- 230000000087 stabilizing effect Effects 0.000 claims description 3
- 229940071127 thioglycolate Drugs 0.000 claims description 3
- 229910052725 zinc Inorganic materials 0.000 claims description 3
- 239000011701 zinc Substances 0.000 claims description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 claims description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 claims description 2
- 125000003282 alkyl amino group Chemical group 0.000 claims description 2
- 125000005157 alkyl carboxy group Chemical group 0.000 claims description 2
- 125000002947 alkylene group Chemical group 0.000 claims description 2
- 229910052787 antimony Inorganic materials 0.000 claims description 2
- WATWJIUSRGPENY-UHFFFAOYSA-N antimony atom Chemical compound [Sb] WATWJIUSRGPENY-UHFFFAOYSA-N 0.000 claims description 2
- 229910052788 barium Inorganic materials 0.000 claims description 2
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 claims description 2
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 claims description 2
- 229910052791 calcium Inorganic materials 0.000 claims description 2
- 239000011575 calcium Substances 0.000 claims description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 2
- 125000003055 glycidyl group Chemical group C(C1CO1)* 0.000 claims description 2
- 229910052749 magnesium Inorganic materials 0.000 claims description 2
- 239000011777 magnesium Substances 0.000 claims description 2
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 claims description 2
- 239000000344 soap Substances 0.000 claims description 2
- 150000003254 radicals Chemical class 0.000 claims 10
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims 4
- CIUQDSCDWFSTQR-UHFFFAOYSA-N [C]1=CC=CC=C1 Chemical compound [C]1=CC=CC=C1 CIUQDSCDWFSTQR-UHFFFAOYSA-N 0.000 claims 1
- MDFFNEOEWAXZRQ-UHFFFAOYSA-N aminyl Chemical compound [NH2] MDFFNEOEWAXZRQ-UHFFFAOYSA-N 0.000 claims 1
- TUJKJAMUKRIRHC-UHFFFAOYSA-N hydroxyl Chemical compound [OH] TUJKJAMUKRIRHC-UHFFFAOYSA-N 0.000 claims 1
- ORTFAQDWJHRMNX-UHFFFAOYSA-M oxidooxomethyl Chemical compound [O-][C]=O ORTFAQDWJHRMNX-UHFFFAOYSA-M 0.000 claims 1
- KHUXNRRPPZOJPT-UHFFFAOYSA-N phenoxy radical Chemical compound O=C1C=C[CH]C=C1 KHUXNRRPPZOJPT-UHFFFAOYSA-N 0.000 claims 1
- LEVJVKGPFAQPOI-UHFFFAOYSA-N phenylmethanone Chemical compound O=[C]C1=CC=CC=C1 LEVJVKGPFAQPOI-UHFFFAOYSA-N 0.000 claims 1
- 229920000915 polyvinyl chloride Polymers 0.000 abstract description 25
- 239000004800 polyvinyl chloride Substances 0.000 abstract description 25
- 150000003839 salts Chemical class 0.000 abstract description 10
- 238000004519 manufacturing process Methods 0.000 abstract description 7
- 230000002195 synergetic effect Effects 0.000 abstract description 7
- 125000002524 organometallic group Chemical group 0.000 abstract description 3
- 239000000654 additive Substances 0.000 abstract description 2
- 230000000996 additive effect Effects 0.000 abstract 1
- 238000002845 discoloration Methods 0.000 abstract 1
- 238000006243 chemical reaction Methods 0.000 description 23
- 238000000034 method Methods 0.000 description 22
- 229920005989 resin Polymers 0.000 description 22
- 239000011347 resin Substances 0.000 description 22
- RWSOTUBLDIXVET-UHFFFAOYSA-N Dihydrogen sulfide Chemical class S RWSOTUBLDIXVET-UHFFFAOYSA-N 0.000 description 18
- 239000000243 solution Substances 0.000 description 16
- 230000006641 stabilisation Effects 0.000 description 13
- 238000011105 stabilization Methods 0.000 description 13
- HGINCPLSRVDWNT-UHFFFAOYSA-N Acrolein Chemical compound C=CC=O HGINCPLSRVDWNT-UHFFFAOYSA-N 0.000 description 11
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 10
- BZHJMEDXRYGGRV-UHFFFAOYSA-N Vinyl chloride Chemical compound ClC=C BZHJMEDXRYGGRV-UHFFFAOYSA-N 0.000 description 9
- 229920000620 organic polymer Polymers 0.000 description 9
- QYKIQEUNHZKYBP-UHFFFAOYSA-N Vinyl ether Chemical class C=COC=C QYKIQEUNHZKYBP-UHFFFAOYSA-N 0.000 description 8
- 239000002904 solvent Substances 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 7
- 239000003377 acid catalyst Substances 0.000 description 7
- 230000007246 mechanism Effects 0.000 description 7
- 150000002894 organic compounds Chemical class 0.000 description 7
- 150000003568 thioethers Chemical class 0.000 description 7
- 229920002554 vinyl polymer Polymers 0.000 description 7
- GYZLOYUZLJXAJU-UHFFFAOYSA-N diglycidyl ether Chemical compound C1OC1COCC1CO1 GYZLOYUZLJXAJU-UHFFFAOYSA-N 0.000 description 6
- 239000012299 nitrogen atmosphere Substances 0.000 description 6
- 239000004014 plasticizer Substances 0.000 description 6
- 238000004448 titration Methods 0.000 description 6
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 6
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 5
- BUDQDWGNQVEFAC-UHFFFAOYSA-N Dihydropyran Chemical compound C1COC=CC1 BUDQDWGNQVEFAC-UHFFFAOYSA-N 0.000 description 5
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 5
- 239000007983 Tris buffer Substances 0.000 description 5
- 238000009833 condensation Methods 0.000 description 5
- 230000005494 condensation Effects 0.000 description 5
- 230000006866 deterioration Effects 0.000 description 5
- 235000014113 dietary fatty acids Nutrition 0.000 description 5
- 239000000194 fatty acid Chemical class 0.000 description 5
- 229930195729 fatty acid Chemical class 0.000 description 5
- 238000004817 gas chromatography Methods 0.000 description 5
- 229910052740 iodine Inorganic materials 0.000 description 5
- 239000011630 iodine Substances 0.000 description 5
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 5
- 235000019341 magnesium sulphate Nutrition 0.000 description 5
- 239000000178 monomer Substances 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 4
- 150000001299 aldehydes Chemical class 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 125000004181 carboxyalkyl group Chemical group 0.000 description 4
- 239000003054 catalyst Substances 0.000 description 4
- 150000001768 cations Chemical class 0.000 description 4
- 229920001577 copolymer Polymers 0.000 description 4
- 150000004665 fatty acids Chemical class 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 229960000834 vinyl ether Drugs 0.000 description 4
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Chemical compound C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 3
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 3
- 239000003963 antioxidant agent Substances 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 239000003139 biocide Substances 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- HDFRDWFLWVCOGP-UHFFFAOYSA-N carbonothioic O,S-acid Chemical class OC(S)=O HDFRDWFLWVCOGP-UHFFFAOYSA-N 0.000 description 3
- 230000000052 comparative effect Effects 0.000 description 3
- 239000000470 constituent Substances 0.000 description 3
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 3
- PWEVMPIIOJUPRI-UHFFFAOYSA-N dimethyltin Chemical compound C[Sn]C PWEVMPIIOJUPRI-UHFFFAOYSA-N 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- 239000000945 filler Substances 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 238000010438 heat treatment Methods 0.000 description 3
- 150000002431 hydrogen Chemical class 0.000 description 3
- 239000000543 intermediate Substances 0.000 description 3
- 239000000944 linseed oil Substances 0.000 description 3
- 235000021388 linseed oil Nutrition 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 239000000049 pigment Substances 0.000 description 3
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 3
- 239000012258 stirred mixture Substances 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- 125000003396 thiol group Chemical group [H]S* 0.000 description 3
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- 150000003751 zinc Chemical class 0.000 description 3
- 239000011592 zinc chloride Substances 0.000 description 3
- 235000005074 zinc chloride Nutrition 0.000 description 3
- VCRZAKVGPJFABU-UHFFFAOYSA-N 10-phenoxarsinin-10-yloxyphenoxarsinine Chemical compound C12=CC=CC=C2OC2=CC=CC=C2[As]1O[As]1C2=CC=CC=C2OC2=CC=CC=C21 VCRZAKVGPJFABU-UHFFFAOYSA-N 0.000 description 2
- XCYWUZHUTJDTGS-UHFFFAOYSA-N 2-methoxy-3,4-dihydro-2h-pyran Chemical compound COC1CCC=CO1 XCYWUZHUTJDTGS-UHFFFAOYSA-N 0.000 description 2
- PKRSYEPBQPFNRB-UHFFFAOYSA-N 2-phenoxybenzoic acid Chemical class OC(=O)C1=CC=CC=C1OC1=CC=CC=C1 PKRSYEPBQPFNRB-UHFFFAOYSA-N 0.000 description 2
- WEMJWKKJHSZRQT-KTKRTIGZSA-N 2-sulfanylethyl (z)-octadec-9-enoate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCCS WEMJWKKJHSZRQT-KTKRTIGZSA-N 0.000 description 2
- LSZCIZOHKPPEJD-UHFFFAOYSA-N 2-sulfanylethyl hexanoate Chemical compound CCCCCC(=O)OCCS LSZCIZOHKPPEJD-UHFFFAOYSA-N 0.000 description 2
- HXIQYSLFEXIOAV-UHFFFAOYSA-N 2-tert-butyl-4-(5-tert-butyl-4-hydroxy-2-methylphenyl)sulfanyl-5-methylphenol Chemical compound CC1=CC(O)=C(C(C)(C)C)C=C1SC1=CC(C(C)(C)C)=C(O)C=C1C HXIQYSLFEXIOAV-UHFFFAOYSA-N 0.000 description 2
- LJOGQXAWDBIDDP-UHFFFAOYSA-N 2h-pyrrolo[3,2-c]pyridazine-3,4-dione Chemical class O=C1C(=O)NN=C2C=CN=C21 LJOGQXAWDBIDDP-UHFFFAOYSA-N 0.000 description 2
- PLIKAWJENQZMHA-UHFFFAOYSA-N 4-aminophenol Chemical compound NC1=CC=C(O)C=C1 PLIKAWJENQZMHA-UHFFFAOYSA-N 0.000 description 2
- DBERHVIZRVGDFO-UHFFFAOYSA-N Acetoxyacetone Chemical compound CC(=O)COC(C)=O DBERHVIZRVGDFO-UHFFFAOYSA-N 0.000 description 2
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 2
- 239000005695 Ammonium acetate Substances 0.000 description 2
- SOGAXMICEFXMKE-UHFFFAOYSA-N Butylmethacrylate Chemical compound CCCCOC(=O)C(C)=C SOGAXMICEFXMKE-UHFFFAOYSA-N 0.000 description 2
- ZTQSAGDEMFDKMZ-UHFFFAOYSA-N Butyraldehyde Chemical compound CCCC=O ZTQSAGDEMFDKMZ-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- ZRALSGWEFCBTJO-UHFFFAOYSA-N Guanidine Chemical compound NC(N)=N ZRALSGWEFCBTJO-UHFFFAOYSA-N 0.000 description 2
- QIGBRXMKCJKVMJ-UHFFFAOYSA-N Hydroquinone Chemical compound OC1=CC=C(O)C=C1 QIGBRXMKCJKVMJ-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- BAPJBEWLBFYGME-UHFFFAOYSA-N Methyl acrylate Chemical compound COC(=O)C=C BAPJBEWLBFYGME-UHFFFAOYSA-N 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 239000004698 Polyethylene Substances 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 2
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 2
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- 235000019257 ammonium acetate Nutrition 0.000 description 2
- 229940043376 ammonium acetate Drugs 0.000 description 2
- 230000003078 antioxidant effect Effects 0.000 description 2
- XVNLXQKEGAWCFW-UHFFFAOYSA-N benzyl 3-(3-oxo-3-phenylmethoxypropyl)sulfanylpropanoate Chemical compound C=1C=CC=CC=1COC(=O)CCSCCC(=O)OCC1=CC=CC=C1 XVNLXQKEGAWCFW-UHFFFAOYSA-N 0.000 description 2
- 230000003115 biocidal effect Effects 0.000 description 2
- IISBACLAFKSPIT-UHFFFAOYSA-N bisphenol A Chemical compound C=1C=C(O)C=CC=1C(C)(C)C1=CC=C(O)C=C1 IISBACLAFKSPIT-UHFFFAOYSA-N 0.000 description 2
- 239000002981 blocking agent Substances 0.000 description 2
- WTEOIRVLGSZEPR-UHFFFAOYSA-N boron trifluoride Chemical compound FB(F)F WTEOIRVLGSZEPR-UHFFFAOYSA-N 0.000 description 2
- NPAIMXWXWPJRES-UHFFFAOYSA-N butyltin(3+) Chemical compound CCCC[Sn+3] NPAIMXWXWPJRES-UHFFFAOYSA-N 0.000 description 2
- NDWWLJQHOLSEHX-UHFFFAOYSA-L calcium;octanoate Chemical compound [Ca+2].CCCCCCCC([O-])=O.CCCCCCCC([O-])=O NDWWLJQHOLSEHX-UHFFFAOYSA-L 0.000 description 2
- HGAZMNJKRQFZKS-UHFFFAOYSA-N chloroethene;ethenyl acetate Chemical compound ClC=C.CC(=O)OC=C HGAZMNJKRQFZKS-UHFFFAOYSA-N 0.000 description 2
- 239000002285 corn oil Substances 0.000 description 2
- 235000005687 corn oil Nutrition 0.000 description 2
- 235000012343 cottonseed oil Nutrition 0.000 description 2
- 239000002385 cottonseed oil Substances 0.000 description 2
- 125000000753 cycloalkyl group Chemical group 0.000 description 2
- ILRSCQWREDREME-UHFFFAOYSA-N dodecanamide Chemical compound CCCCCCCCCCCC(N)=O ILRSCQWREDREME-UHFFFAOYSA-N 0.000 description 2
- FJKIXWOMBXYWOQ-UHFFFAOYSA-N ethenoxyethane Chemical compound CCOC=C FJKIXWOMBXYWOQ-UHFFFAOYSA-N 0.000 description 2
- DNJIEGIFACGWOD-UHFFFAOYSA-N ethyl mercaptane Natural products CCS DNJIEGIFACGWOD-UHFFFAOYSA-N 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 230000009931 harmful effect Effects 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 239000011133 lead Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 2
- LYRFLYHAGKPMFH-UHFFFAOYSA-N octadecanamide Chemical compound CCCCCCCCCCCCCCCCCC(N)=O LYRFLYHAGKPMFH-UHFFFAOYSA-N 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 230000001590 oxidative effect Effects 0.000 description 2
- WXZMFSXDPGVJKK-UHFFFAOYSA-N pentaerythritol Chemical compound OCC(CO)(CO)CO WXZMFSXDPGVJKK-UHFFFAOYSA-N 0.000 description 2
- AQSJGOWTSHOLKH-UHFFFAOYSA-N phosphite(3-) Chemical class [O-]P([O-])[O-] AQSJGOWTSHOLKH-UHFFFAOYSA-N 0.000 description 2
- OJMIONKXNSYLSR-UHFFFAOYSA-N phosphorous acid Chemical compound OP(O)O OJMIONKXNSYLSR-UHFFFAOYSA-N 0.000 description 2
- 230000000704 physical effect Effects 0.000 description 2
- 229920000573 polyethylene Polymers 0.000 description 2
- 230000002035 prolonged effect Effects 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- GHMLBKRAJCXXBS-UHFFFAOYSA-N resorcinol Chemical compound OC1=CC=CC(O)=C1 GHMLBKRAJCXXBS-UHFFFAOYSA-N 0.000 description 2
- CQRYARSYNCAZFO-UHFFFAOYSA-N salicyl alcohol Chemical compound OCC1=CC=CC=C1O CQRYARSYNCAZFO-UHFFFAOYSA-N 0.000 description 2
- 230000035943 smell Effects 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 125000004434 sulfur atom Chemical group 0.000 description 2
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- YFRLQYJXUZRYDN-UHFFFAOYSA-K trichloro(methyl)stannane Chemical compound C[Sn](Cl)(Cl)Cl YFRLQYJXUZRYDN-UHFFFAOYSA-K 0.000 description 2
- HVLLSGMXQDNUAL-UHFFFAOYSA-N triphenyl phosphite Chemical compound C=1C=CC=CC=1OP(OC=1C=CC=CC=1)OC1=CC=CC=C1 HVLLSGMXQDNUAL-UHFFFAOYSA-N 0.000 description 2
- 229920001959 vinylidene polymer Polymers 0.000 description 2
- VNDYJBBGRKZCSX-UHFFFAOYSA-L zinc bromide Chemical compound Br[Zn]Br VNDYJBBGRKZCSX-UHFFFAOYSA-L 0.000 description 2
- XOOUIPVCVHRTMJ-UHFFFAOYSA-L zinc stearate Chemical compound [Zn+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O XOOUIPVCVHRTMJ-UHFFFAOYSA-L 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- ZWAJLVLEBYIOTI-OLQVQODUSA-N (1s,6r)-7-oxabicyclo[4.1.0]heptane Chemical compound C1CCC[C@@H]2O[C@@H]21 ZWAJLVLEBYIOTI-OLQVQODUSA-N 0.000 description 1
- ARVUDIQYNJVQIW-UHFFFAOYSA-N (4-dodecoxy-2-hydroxyphenyl)-phenylmethanone Chemical compound OC1=CC(OCCCCCCCCCCCC)=CC=C1C(=O)C1=CC=CC=C1 ARVUDIQYNJVQIW-UHFFFAOYSA-N 0.000 description 1
- KJPRLNWUNMBNBZ-QPJJXVBHSA-N (E)-cinnamaldehyde Chemical compound O=C\C=C\C1=CC=CC=C1 KJPRLNWUNMBNBZ-QPJJXVBHSA-N 0.000 description 1
- PAWSVPVNIXFKOS-IHWYPQMZSA-N (Z)-2-aminobutenoic acid Chemical class C\C=C(/N)C(O)=O PAWSVPVNIXFKOS-IHWYPQMZSA-N 0.000 description 1
- MTKHTBWXSHYCGS-OWOJBTEDSA-N (e)-1-chloro-2-fluoroethene Chemical group F\C=C\Cl MTKHTBWXSHYCGS-OWOJBTEDSA-N 0.000 description 1
- DHPWGEOXBYBHOY-YPKPFQOOSA-N (z)-2-dodecylbut-2-enedioic acid Chemical compound CCCCCCCCCCCC\C(C(O)=O)=C\C(O)=O DHPWGEOXBYBHOY-YPKPFQOOSA-N 0.000 description 1
- OZDOQMMXEACZAA-NRFIWDAESA-L (z)-4-butoxy-4-oxobut-2-enoate;dibutyltin(2+) Chemical compound CCCCOC(=O)\C=C/C(=O)O[Sn](CCCC)(CCCC)OC(=O)\C=C/C(=O)OCCCC OZDOQMMXEACZAA-NRFIWDAESA-L 0.000 description 1
- LGXVIGDEPROXKC-UHFFFAOYSA-N 1,1-dichloroethene Chemical class ClC(Cl)=C LGXVIGDEPROXKC-UHFFFAOYSA-N 0.000 description 1
- QMMJWQMCMRUYTG-UHFFFAOYSA-N 1,2,4,5-tetrachloro-3-(trifluoromethyl)benzene Chemical compound FC(F)(F)C1=C(Cl)C(Cl)=CC(Cl)=C1Cl QMMJWQMCMRUYTG-UHFFFAOYSA-N 0.000 description 1
- VZXTWGWHSMCWGA-UHFFFAOYSA-N 1,3,5-triazine-2,4-diamine Chemical compound NC1=NC=NC(N)=N1 VZXTWGWHSMCWGA-UHFFFAOYSA-N 0.000 description 1
- FRASJONUBLZVQX-UHFFFAOYSA-N 1,4-dioxonaphthalene Natural products C1=CC=C2C(=O)C=CC(=O)C2=C1 FRASJONUBLZVQX-UHFFFAOYSA-N 0.000 description 1
- BOKGTLAJQHTOKE-UHFFFAOYSA-N 1,5-dihydroxynaphthalene Chemical compound C1=CC=C2C(O)=CC=CC2=C1O BOKGTLAJQHTOKE-UHFFFAOYSA-N 0.000 description 1
- MRWSNXVEXZNROC-UHFFFAOYSA-N 1-(2,4,4-trimethylpentan-2-yl)-7-thiabicyclo[4.1.0]hepta-2,4-dien-6-ol Chemical class C1=CC=CC2(C(C)(C)CC(C)(C)C)C1(O)S2 MRWSNXVEXZNROC-UHFFFAOYSA-N 0.000 description 1
- TXECTBGVEUDNSL-UHFFFAOYSA-N 1-acetyloxyprop-2-enyl acetate Chemical compound CC(=O)OC(C=C)OC(C)=O TXECTBGVEUDNSL-UHFFFAOYSA-N 0.000 description 1
- DNJRKFKAFWSXSE-UHFFFAOYSA-N 1-chloro-2-ethenoxyethane Chemical compound ClCCOC=C DNJRKFKAFWSXSE-UHFFFAOYSA-N 0.000 description 1
- SLBOQBILGNEPEB-UHFFFAOYSA-N 1-chloroprop-2-enylbenzene Chemical compound C=CC(Cl)C1=CC=CC=C1 SLBOQBILGNEPEB-UHFFFAOYSA-N 0.000 description 1
- DLYDGDHLODCOQF-UHFFFAOYSA-N 1-ethenoxyethenylcyclohexane Chemical compound C=COC(=C)C1CCCCC1 DLYDGDHLODCOQF-UHFFFAOYSA-N 0.000 description 1
- QJJDJWUCRAPCOL-UHFFFAOYSA-N 1-ethenoxyoctadecane Chemical compound CCCCCCCCCCCCCCCCCCOC=C QJJDJWUCRAPCOL-UHFFFAOYSA-N 0.000 description 1
- JWYVGKFDLWWQJX-UHFFFAOYSA-N 1-ethenylazepan-2-one Chemical compound C=CN1CCCCCC1=O JWYVGKFDLWWQJX-UHFFFAOYSA-N 0.000 description 1
- ICVRZXVMQZSFLB-UHFFFAOYSA-N 1-hydroxy-2-phenyl-2H-naphthalene-1-carboxylic acid Chemical compound C1=CC2=CC=CC=C2C(C(=O)O)(O)C1C1=CC=CC=C1 ICVRZXVMQZSFLB-UHFFFAOYSA-N 0.000 description 1
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 1
- KUIZKZHDMPERHR-UHFFFAOYSA-N 1-phenylprop-2-en-1-one Chemical compound C=CC(=O)C1=CC=CC=C1 KUIZKZHDMPERHR-UHFFFAOYSA-N 0.000 description 1
- HECLRDQVFMWTQS-RGOKHQFPSA-N 1755-01-7 Chemical compound C1[C@H]2[C@@H]3CC=C[C@@H]3[C@@H]1C=C2 HECLRDQVFMWTQS-RGOKHQFPSA-N 0.000 description 1
- KGRVJHAUYBGFFP-UHFFFAOYSA-N 2,2'-Methylenebis(4-methyl-6-tert-butylphenol) Chemical compound CC(C)(C)C1=CC(C)=CC(CC=2C(=C(C=C(C)C=2)C(C)(C)C)O)=C1O KGRVJHAUYBGFFP-UHFFFAOYSA-N 0.000 description 1
- JKTCBAGSMQIFNL-UHFFFAOYSA-N 2,3-dihydrofuran Chemical compound C1CC=CO1 JKTCBAGSMQIFNL-UHFFFAOYSA-N 0.000 description 1
- CZNRFEXEPBITDS-UHFFFAOYSA-N 2,5-bis(2-methylbutan-2-yl)benzene-1,4-diol Chemical compound CCC(C)(C)C1=CC(O)=C(C(C)(C)CC)C=C1O CZNRFEXEPBITDS-UHFFFAOYSA-N 0.000 description 1
- 150000003923 2,5-pyrrolediones Chemical class 0.000 description 1
- STMDPCBYJCIZOD-UHFFFAOYSA-N 2-(2,4-dinitroanilino)-4-methylpentanoic acid Chemical compound CC(C)CC(C(O)=O)NC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O STMDPCBYJCIZOD-UHFFFAOYSA-N 0.000 description 1
- OAYXUHPQHDHDDZ-UHFFFAOYSA-N 2-(2-butoxyethoxy)ethanol Chemical compound CCCCOCCOCCO OAYXUHPQHDHDDZ-UHFFFAOYSA-N 0.000 description 1
- DTBTTYFYSGBQRB-UHFFFAOYSA-N 2-(3,4-dihydro-2h-pyran-2-yloxy)-3,4-dihydro-2h-pyran Chemical class O1C=CCCC1OC1OC=CCC1 DTBTTYFYSGBQRB-UHFFFAOYSA-N 0.000 description 1
- NQOFGDFOEKXOBQ-UHFFFAOYSA-N 2-(3-chlorophenoxy)benzoic acid Chemical compound OC(=O)C1=CC=CC=C1OC1=CC=CC(Cl)=C1 NQOFGDFOEKXOBQ-UHFFFAOYSA-N 0.000 description 1
- OEPOKWHJYJXUGD-UHFFFAOYSA-N 2-(3-phenylmethoxyphenyl)-1,3-thiazole-4-carbaldehyde Chemical compound O=CC1=CSC(C=2C=C(OCC=3C=CC=CC=3)C=CC=2)=N1 OEPOKWHJYJXUGD-UHFFFAOYSA-N 0.000 description 1
- IFKOZECKOCUMKI-UHFFFAOYSA-N 2-(4-benzoyl-3-hydroxyphenoxy)acetic acid Chemical compound OC1=CC(OCC(=O)O)=CC=C1C(=O)C1=CC=CC=C1 IFKOZECKOCUMKI-UHFFFAOYSA-N 0.000 description 1
- WMNNWPSQMMOCGQ-UHFFFAOYSA-N 2-(4-methoxyphenoxy)benzoic acid Chemical compound C1=CC(OC)=CC=C1OC1=CC=CC=C1C(O)=O WMNNWPSQMMOCGQ-UHFFFAOYSA-N 0.000 description 1
- YSUQLAYJZDEMOT-UHFFFAOYSA-N 2-(butoxymethyl)oxirane Chemical compound CCCCOCC1CO1 YSUQLAYJZDEMOT-UHFFFAOYSA-N 0.000 description 1
- GOXQRTZXKQZDDN-UHFFFAOYSA-N 2-Ethylhexyl acrylate Chemical compound CCCCC(CC)COC(=O)C=C GOXQRTZXKQZDDN-UHFFFAOYSA-N 0.000 description 1
- LCZVSXRMYJUNFX-UHFFFAOYSA-N 2-[2-(2-hydroxypropoxy)propoxy]propan-1-ol Chemical compound CC(O)COC(C)COC(C)CO LCZVSXRMYJUNFX-UHFFFAOYSA-N 0.000 description 1
- CUIODKLCVPKRIF-UHFFFAOYSA-N 2-butoxy-3-methyloxirane Chemical class CCCCOC1OC1C CUIODKLCVPKRIF-UHFFFAOYSA-N 0.000 description 1
- QSKPIOLLBIHNAC-UHFFFAOYSA-N 2-chloro-acetaldehyde Chemical compound ClCC=O QSKPIOLLBIHNAC-UHFFFAOYSA-N 0.000 description 1
- OYUNTGBISCIYPW-UHFFFAOYSA-N 2-chloroprop-2-enenitrile Chemical compound ClC(=C)C#N OYUNTGBISCIYPW-UHFFFAOYSA-N 0.000 description 1
- VZJFPIXCMVSTID-UHFFFAOYSA-N 2-ethoxy-3,4-dihydro-2h-pyran Chemical compound CCOC1CCC=CO1 VZJFPIXCMVSTID-UHFFFAOYSA-N 0.000 description 1
- VHKGIWUCVBAITR-UHFFFAOYSA-K 2-ethylhexyl 2-[bis[[2-(2-ethylhexoxy)-2-oxoethyl]sulfanyl]-octylstannyl]sulfanylacetate Chemical compound CCCCC(CC)COC(=O)CS[Sn](CCCCCCCC)(SCC(=O)OCC(CC)CCCC)SCC(=O)OCC(CC)CCCC VHKGIWUCVBAITR-UHFFFAOYSA-K 0.000 description 1
- PRIUALOJYOZZOJ-UHFFFAOYSA-L 2-ethylhexyl 2-[dibutyl-[2-(2-ethylhexoxy)-2-oxoethyl]sulfanylstannyl]sulfanylacetate Chemical compound CCCCC(CC)COC(=O)CS[Sn](CCCC)(CCCC)SCC(=O)OCC(CC)CCCC PRIUALOJYOZZOJ-UHFFFAOYSA-L 0.000 description 1
- CASCSTLKRAIFKN-UHFFFAOYSA-N 2-methyl-3-phenoxyoxirane Chemical class CC1OC1OC1=CC=CC=C1 CASCSTLKRAIFKN-UHFFFAOYSA-N 0.000 description 1
- RMZNXRYIFGTWPF-UHFFFAOYSA-N 2-nitrosoacetic acid Chemical compound OC(=O)CN=O RMZNXRYIFGTWPF-UHFFFAOYSA-N 0.000 description 1
- YTYZQQAAOXLLCL-UHFFFAOYSA-N 2-phenoxy-3,4-dihydro-2h-pyran Chemical compound O1C=CCCC1OC1=CC=CC=C1 YTYZQQAAOXLLCL-UHFFFAOYSA-N 0.000 description 1
- KLLLJCACIRKBDT-UHFFFAOYSA-N 2-phenyl-1H-indole Chemical compound N1C2=CC=CC=C2C=C1C1=CC=CC=C1 KLLLJCACIRKBDT-UHFFFAOYSA-N 0.000 description 1
- WHGXZPQWZJUGEP-UHFFFAOYSA-N 2-prop-1-enylphenol Chemical compound CC=CC1=CC=CC=C1O WHGXZPQWZJUGEP-UHFFFAOYSA-N 0.000 description 1
- ZXNNPJMEFLZCMP-UHFFFAOYSA-N 2-sulfanylethyl decanoate Chemical compound CCCCCCCCCC(=O)OCCS ZXNNPJMEFLZCMP-UHFFFAOYSA-N 0.000 description 1
- WJQOZHYUIDYNHM-UHFFFAOYSA-N 2-tert-Butylphenol Chemical compound CC(C)(C)C1=CC=CC=C1O WJQOZHYUIDYNHM-UHFFFAOYSA-N 0.000 description 1
- NFURCTOGCBSGPX-UHFFFAOYSA-N 2-tert-butyl-4-dodecoxyphenol Chemical compound CCCCCCCCCCCCOC1=CC=C(O)C(C(C)(C)C)=C1 NFURCTOGCBSGPX-UHFFFAOYSA-N 0.000 description 1
- VMCYRTNAPHJORO-UHFFFAOYSA-N 2-tert-butyl-4-octadecoxyphenol Chemical compound CCCCCCCCCCCCCCCCCCOC1=CC=C(O)C(C(C)(C)C)=C1 VMCYRTNAPHJORO-UHFFFAOYSA-N 0.000 description 1
- XOUQAVYLRNOXDO-UHFFFAOYSA-N 2-tert-butyl-5-methylphenol Chemical compound CC1=CC=C(C(C)(C)C)C(O)=C1 XOUQAVYLRNOXDO-UHFFFAOYSA-N 0.000 description 1
- KGIGUEBEKRSTEW-UHFFFAOYSA-N 2-vinylpyridine Chemical compound C=CC1=CC=CC=N1 KGIGUEBEKRSTEW-UHFFFAOYSA-N 0.000 description 1
- NPWYTMFWRRIFLK-UHFFFAOYSA-N 3,4-dihydro-2h-pyran-2-carbaldehyde Chemical compound O=CC1CCC=CO1 NPWYTMFWRRIFLK-UHFFFAOYSA-N 0.000 description 1
- TUUHTXRXGNYVMY-UHFFFAOYSA-N 3-butylsulfanylpropanoic acid Chemical compound CCCCSCCC(O)=O TUUHTXRXGNYVMY-UHFFFAOYSA-N 0.000 description 1
- UHBAWOXYQROEIH-UHFFFAOYSA-N 3-chloro-4-(2-chlorobut-3-enoxy)but-1-ene Chemical compound C=CC(Cl)COCC(Cl)C=C UHBAWOXYQROEIH-UHFFFAOYSA-N 0.000 description 1
- MDWVSAYEQPLWMX-UHFFFAOYSA-N 4,4'-Methylenebis(2,6-di-tert-butylphenol) Chemical compound CC(C)(C)C1=C(O)C(C(C)(C)C)=CC(CC=2C=C(C(O)=C(C=2)C(C)(C)C)C(C)(C)C)=C1 MDWVSAYEQPLWMX-UHFFFAOYSA-N 0.000 description 1
- SLMZACPVHKRCOY-UHFFFAOYSA-N 4-(dodecoxyamino)phenol Chemical compound CCCCCCCCCCCCONC1=CC=C(O)C=C1 SLMZACPVHKRCOY-UHFFFAOYSA-N 0.000 description 1
- GWZWCGSQJZJFQC-UHFFFAOYSA-N 4-acetyl-2,4-dihydroxycyclohexa-1,5-diene-1-carboxylic acid Chemical compound CC(=O)C1(O)CC(O)=C(C(O)=O)C=C1 GWZWCGSQJZJFQC-UHFFFAOYSA-N 0.000 description 1
- UKWUOTZGXIZAJC-UHFFFAOYSA-N 4-nitrosalicylic acid Chemical compound OC(=O)C1=CC=C([N+]([O-])=O)C=C1O UKWUOTZGXIZAJC-UHFFFAOYSA-N 0.000 description 1
- OECTYKWYRCHAKR-UHFFFAOYSA-N 4-vinylcyclohexene dioxide Chemical compound C1OC1C1CC2OC2CC1 OECTYKWYRCHAKR-UHFFFAOYSA-N 0.000 description 1
- YIROYDNZEPTFOL-UHFFFAOYSA-N 5,5-Dimethylhydantoin Chemical compound CC1(C)NC(=O)NC1=O YIROYDNZEPTFOL-UHFFFAOYSA-N 0.000 description 1
- BISHACNKZIBDFM-UHFFFAOYSA-N 5-amino-1h-pyrimidine-2,4-dione Chemical compound NC1=CNC(=O)NC1=O BISHACNKZIBDFM-UHFFFAOYSA-N 0.000 description 1
- RBHIUNHSNSQJNG-UHFFFAOYSA-N 6-methyl-3-(2-methyloxiran-2-yl)-7-oxabicyclo[4.1.0]heptane Chemical compound C1CC2(C)OC2CC1C1(C)CO1 RBHIUNHSNSQJNG-UHFFFAOYSA-N 0.000 description 1
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 description 1
- OSDWBNJEKMUWAV-UHFFFAOYSA-N Allyl chloride Chemical group ClCC=C OSDWBNJEKMUWAV-UHFFFAOYSA-N 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- 229910015900 BF3 Inorganic materials 0.000 description 1
- SDDLEVPIDBLVHC-UHFFFAOYSA-N Bisphenol Z Chemical compound C1=CC(O)=CC=C1C1(C=2C=CC(O)=CC=2)CCCCC1 SDDLEVPIDBLVHC-UHFFFAOYSA-N 0.000 description 1
- 239000004604 Blowing Agent Substances 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- 239000004255 Butylated hydroxyanisole Substances 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- XNIBZZGDLYAUJS-ZBACLAMISA-H C(C)C(C/C(/C(=O)[O-])=C/C(=O)[O-])CCCC.C(C)C(C/C(/C(=O)[O-])=C/C(=O)[O-])CCCC.C(C)C(C/C(/C(=O)[O-])=C/C(=O)[O-])CCCC.C[Sn+3].C[Sn+3] Chemical compound C(C)C(C/C(/C(=O)[O-])=C/C(=O)[O-])CCCC.C(C)C(C/C(/C(=O)[O-])=C/C(=O)[O-])CCCC.C(C)C(C/C(/C(=O)[O-])=C/C(=O)[O-])CCCC.C[Sn+3].C[Sn+3] XNIBZZGDLYAUJS-ZBACLAMISA-H 0.000 description 1
- DBCDZOQTZBHXFU-UHFFFAOYSA-N C(C=C/C(=O)O)(=O)O.C(COCCOCCOCCO)O Chemical compound C(C=C/C(=O)O)(=O)O.C(COCCOCCOCCO)O DBCDZOQTZBHXFU-UHFFFAOYSA-N 0.000 description 1
- BTTBRRHZOOTDFD-UHFFFAOYSA-K CCCC[Sn+3].CCCCCCCC(C([O-])=O)CCS.CCCCCCCC(C([O-])=O)CCS.CCCCCCCC(C([O-])=O)CCS Chemical compound CCCC[Sn+3].CCCCCCCC(C([O-])=O)CCS.CCCCCCCC(C([O-])=O)CCS.CCCCCCCC(C([O-])=O)CCS BTTBRRHZOOTDFD-UHFFFAOYSA-K 0.000 description 1
- 101150041968 CDC13 gene Proteins 0.000 description 1
- 101100188540 Candida albicans (strain SC5314 / ATCC MYA-2876) OBPA gene Proteins 0.000 description 1
- 239000004801 Chlorinated PVC Substances 0.000 description 1
- 239000004709 Chlorinated polyethylene Substances 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- IEPRKVQEAMIZSS-UHFFFAOYSA-N Di-Et ester-Fumaric acid Natural products CCOC(=O)C=CC(=O)OCC IEPRKVQEAMIZSS-UHFFFAOYSA-N 0.000 description 1
- GHKOFFNLGXMVNJ-UHFFFAOYSA-N Didodecyl thiobispropanoate Chemical compound CCCCCCCCCCCCOC(=O)CCSCCC(=O)OCCCCCCCCCCCC GHKOFFNLGXMVNJ-UHFFFAOYSA-N 0.000 description 1
- 238000005698 Diels-Alder reaction Methods 0.000 description 1
- IEPRKVQEAMIZSS-WAYWQWQTSA-N Diethyl maleate Chemical compound CCOC(=O)\C=C/C(=O)OCC IEPRKVQEAMIZSS-WAYWQWQTSA-N 0.000 description 1
- 239000003508 Dilauryl thiodipropionate Substances 0.000 description 1
- SNRUBQQJIBEYMU-UHFFFAOYSA-N Dodecane Natural products CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 1
- BRLQWZUYTZBJKN-UHFFFAOYSA-N Epichlorohydrin Chemical compound ClCC1CO1 BRLQWZUYTZBJKN-UHFFFAOYSA-N 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- 238000005618 Fries rearrangement reaction Methods 0.000 description 1
- CTKINSOISVBQLD-UHFFFAOYSA-N Glycidol Chemical compound OCC1CO1 CTKINSOISVBQLD-UHFFFAOYSA-N 0.000 description 1
- 239000004609 Impact Modifier Substances 0.000 description 1
- BJIOGJUNALELMI-ONEGZZNKSA-N Isoeugenol Natural products COC1=CC(\C=C\C)=CC=C1O BJIOGJUNALELMI-ONEGZZNKSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 229920000877 Melamine resin Polymers 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 1
- CHJJGSNFBQVOTG-UHFFFAOYSA-N N-methyl-guanidine Natural products CNC(N)=N CHJJGSNFBQVOTG-UHFFFAOYSA-N 0.000 description 1
- 239000006057 Non-nutritive feed additive Substances 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 235000019482 Palm oil Nutrition 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- AWMVMTVKBNGEAK-UHFFFAOYSA-N Styrene oxide Chemical compound C1OC1C1=CC=CC=C1 AWMVMTVKBNGEAK-UHFFFAOYSA-N 0.000 description 1
- UWHCKJMYHZGTIT-UHFFFAOYSA-N Tetraethylene glycol, Natural products OCCOCCOCCOCCO UWHCKJMYHZGTIT-UHFFFAOYSA-N 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 1
- XSTXAVWGXDQKEL-UHFFFAOYSA-N Trichloroethylene Chemical group ClC=C(Cl)Cl XSTXAVWGXDQKEL-UHFFFAOYSA-N 0.000 description 1
- 239000005083 Zinc sulfide Substances 0.000 description 1
- NTPFJSYVROWMFR-CLFAGFIQSA-N [(z)-octadec-9-enyl] 3-[3-[(z)-octadec-9-enoxy]-3-oxopropyl]sulfanylpropanoate Chemical compound CCCCCCCC\C=C/CCCCCCCCOC(=O)CCSCCC(=O)OCCCCCCCC\C=C/CCCCCCCC NTPFJSYVROWMFR-CLFAGFIQSA-N 0.000 description 1
- XMUZQOKACOLCSS-UHFFFAOYSA-N [2-(hydroxymethyl)phenyl]methanol Chemical compound OCC1=CC=CC=C1CO XMUZQOKACOLCSS-UHFFFAOYSA-N 0.000 description 1
- KEGWKIFXLJBABA-UHFFFAOYSA-N [4-[8-(3-octyloxiran-2-yl)octanoyloxymethyl]-7-oxabicyclo[4.1.0]heptan-4-yl]methyl 8-(3-octyloxiran-2-yl)octanoate Chemical compound CCCCCCCCC1OC1CCCCCCCC(=O)OCC1(COC(=O)CCCCCCCC2C(O2)CCCCCCCC)CC2OC2CC1 KEGWKIFXLJBABA-UHFFFAOYSA-N 0.000 description 1
- PVLBCGCPMYERHM-UHFFFAOYSA-L [benzoyloxy(dimethyl)stannyl] benzoate Chemical compound C=1C=CC=CC=1C(=O)O[Sn](C)(C)OC(=O)C1=CC=CC=C1 PVLBCGCPMYERHM-UHFFFAOYSA-L 0.000 description 1
- UKLDJPRMSDWDSL-UHFFFAOYSA-L [dibutyl(dodecanoyloxy)stannyl] dodecanoate Chemical compound CCCCCCCCCCCC(=O)O[Sn](CCCC)(CCCC)OC(=O)CCCCCCCCCCC UKLDJPRMSDWDSL-UHFFFAOYSA-L 0.000 description 1
- WPNRZVONKRBZDU-UHFFFAOYSA-L [dodecanoyloxy(diethyl)stannyl] dodecanoate Chemical compound CC[Sn+2]CC.CCCCCCCCCCCC([O-])=O.CCCCCCCCCCCC([O-])=O WPNRZVONKRBZDU-UHFFFAOYSA-L 0.000 description 1
- TWIIVLKQFJBFPW-UHFFFAOYSA-N acetaminosalol Chemical compound C1=CC(NC(=O)C)=CC=C1OC(=O)C1=CC=CC=C1O TWIIVLKQFJBFPW-UHFFFAOYSA-N 0.000 description 1
- 229950007008 acetaminosalol Drugs 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical class OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 125000005250 alkyl acrylate group Chemical group 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- XYLMUPLGERFSHI-UHFFFAOYSA-N alpha-Methylstyrene Chemical compound CC(=C)C1=CC=CC=C1 XYLMUPLGERFSHI-UHFFFAOYSA-N 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- CEGOLXSVJUTHNZ-UHFFFAOYSA-K aluminium tristearate Chemical compound [Al+3].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CEGOLXSVJUTHNZ-UHFFFAOYSA-K 0.000 description 1
- 229940063655 aluminum stearate Drugs 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 150000003931 anilides Chemical class 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- 229940067597 azelate Drugs 0.000 description 1
- SBMJKCDBJMFHGS-UHFFFAOYSA-L barium(2+);2-nonylphenolate Chemical compound [Ba+2].CCCCCCCCCC1=CC=CC=C1[O-].CCCCCCCCCC1=CC=CC=C1[O-] SBMJKCDBJMFHGS-UHFFFAOYSA-L 0.000 description 1
- AGXUVMPSUKZYDT-UHFFFAOYSA-L barium(2+);octadecanoate Chemical compound [Ba+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O AGXUVMPSUKZYDT-UHFFFAOYSA-L 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- RWCCWEUUXYIKHB-UHFFFAOYSA-N benzophenone Chemical group C=1C=CC=CC=1C(=O)C1=CC=CC=C1 RWCCWEUUXYIKHB-UHFFFAOYSA-N 0.000 description 1
- 239000012965 benzophenone Substances 0.000 description 1
- KCXMKQUNVWSEMD-UHFFFAOYSA-N benzyl chloride Chemical compound ClCC1=CC=CC=C1 KCXMKQUNVWSEMD-UHFFFAOYSA-N 0.000 description 1
- 229940073608 benzyl chloride Drugs 0.000 description 1
- 150000001649 bromium compounds Chemical class 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- DGAODIKUWGRDBO-UHFFFAOYSA-N butanethioic s-acid Chemical compound CCCC(O)=S DGAODIKUWGRDBO-UHFFFAOYSA-N 0.000 description 1
- CQEYYJKEWSMYFG-UHFFFAOYSA-N butyl acrylate Chemical compound CCCCOC(=O)C=C CQEYYJKEWSMYFG-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 description 1
- 229940043253 butylated hydroxyanisole Drugs 0.000 description 1
- LUZSPGQEISANPO-UHFFFAOYSA-N butyltin Chemical compound CCCC[Sn] LUZSPGQEISANPO-UHFFFAOYSA-N 0.000 description 1
- YMLFYGFCXGNERH-UHFFFAOYSA-K butyltin trichloride Chemical compound CCCC[Sn](Cl)(Cl)Cl YMLFYGFCXGNERH-UHFFFAOYSA-K 0.000 description 1
- 229910052793 cadmium Inorganic materials 0.000 description 1
- BDOSMKKIYDKNTQ-UHFFFAOYSA-N cadmium atom Chemical compound [Cd] BDOSMKKIYDKNTQ-UHFFFAOYSA-N 0.000 description 1
- GWOWVOYJLHSRJJ-UHFFFAOYSA-L cadmium stearate Chemical compound [Cd+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O GWOWVOYJLHSRJJ-UHFFFAOYSA-L 0.000 description 1
- ITQVEYJXZXMBTR-UHFFFAOYSA-L cadmium(2+);dodecanoate Chemical compound [Cd+2].CCCCCCCCCCCC([O-])=O.CCCCCCCCCCCC([O-])=O ITQVEYJXZXMBTR-UHFFFAOYSA-L 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- LTPCXXMGKDQPAO-UHFFFAOYSA-L calcium;2-ethylhexanoate Chemical compound [Ca+2].CCCCC(CC)C([O-])=O.CCCCC(CC)C([O-])=O LTPCXXMGKDQPAO-UHFFFAOYSA-L 0.000 description 1
- HIAAVKYLDRCDFQ-UHFFFAOYSA-L calcium;dodecanoate Chemical compound [Ca+2].CCCCCCCCCCCC([O-])=O.CCCCCCCCCCCC([O-])=O HIAAVKYLDRCDFQ-UHFFFAOYSA-L 0.000 description 1
- HRBZRZSCMANEHQ-UHFFFAOYSA-L calcium;hexadecanoate Chemical compound [Ca+2].CCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCC([O-])=O HRBZRZSCMANEHQ-UHFFFAOYSA-L 0.000 description 1
- ZCZLQYAECBEUBH-UHFFFAOYSA-L calcium;octadec-9-enoate Chemical compound [Ca+2].CCCCCCCCC=CCCCCCCCC([O-])=O.CCCCCCCCC=CCCCCCCCC([O-])=O ZCZLQYAECBEUBH-UHFFFAOYSA-L 0.000 description 1
- LSFBQOPXRBJSSI-UHFFFAOYSA-L calcium;tetradecanoate Chemical compound [Ca+2].CCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCC([O-])=O LSFBQOPXRBJSSI-UHFFFAOYSA-L 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 239000006229 carbon black Substances 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- 238000002144 chemical decomposition reaction Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 229920000457 chlorinated polyvinyl chloride Polymers 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- DHZSIQDUYCWNSB-UHFFFAOYSA-N chloroethene;1,1-dichloroethene Chemical compound ClC=C.ClC(Cl)=C DHZSIQDUYCWNSB-UHFFFAOYSA-N 0.000 description 1
- BMZQPXKCLRADET-UHFFFAOYSA-N chloroethene;2-ethylhexyl prop-2-enoate Chemical compound ClC=C.CCCCC(CC)COC(=O)C=C BMZQPXKCLRADET-UHFFFAOYSA-N 0.000 description 1
- HLRNWZLPRFTCIO-IPZCTEOASA-N chloroethene;diethyl (e)-but-2-enedioate Chemical compound ClC=C.CCOC(=O)\C=C\C(=O)OCC HLRNWZLPRFTCIO-IPZCTEOASA-N 0.000 description 1
- QJNYIFMVIUOUSU-UHFFFAOYSA-N chloroethene;ethenyl acetate;furan-2,5-dione Chemical compound ClC=C.CC(=O)OC=C.O=C1OC(=O)C=C1 QJNYIFMVIUOUSU-UHFFFAOYSA-N 0.000 description 1
- MMIVZWZHLDUCKH-UHFFFAOYSA-N chloromethane;chloromethylbenzene Chemical compound ClC.ClCC1=CC=CC=C1 MMIVZWZHLDUCKH-UHFFFAOYSA-N 0.000 description 1
- BJIOGJUNALELMI-ARJAWSKDSA-N cis-isoeugenol Chemical compound COC1=CC(\C=C/C)=CC=C1O BJIOGJUNALELMI-ARJAWSKDSA-N 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 238000005056 compaction Methods 0.000 description 1
- 238000006482 condensation reaction Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- OCDXZFSOHJRGIL-UHFFFAOYSA-N cyclohexyloxycyclohexane Chemical compound C1CCCCC1OC1CCCCC1 OCDXZFSOHJRGIL-UHFFFAOYSA-N 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- YODSJFCDKPWAQA-UHFFFAOYSA-N decyl 3-(3-decoxy-3-oxopropyl)sulfanylpropanoate Chemical compound CCCCCCCCCCOC(=O)CCSCCC(=O)OCCCCCCCCCC YODSJFCDKPWAQA-UHFFFAOYSA-N 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- SASYSVUEVMOWPL-NXVVXOECSA-N decyl oleate Chemical compound CCCCCCCCCCOC(=O)CCCCCCC\C=C/CCCCCCCC SASYSVUEVMOWPL-NXVVXOECSA-N 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000003413 degradative effect Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 230000002542 deteriorative effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- UQLDLKMNUJERMK-UHFFFAOYSA-L di(octadecanoyloxy)lead Chemical compound [Pb+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O UQLDLKMNUJERMK-UHFFFAOYSA-L 0.000 description 1
- RJGHQTVXGKYATR-UHFFFAOYSA-L dibutyl(dichloro)stannane Chemical compound CCCC[Sn](Cl)(Cl)CCCC RJGHQTVXGKYATR-UHFFFAOYSA-L 0.000 description 1
- 239000012975 dibutyltin dilaurate Substances 0.000 description 1
- ZCBSOVVUFGCQSX-UHFFFAOYSA-L dibutyltin(2+);2-(2-sulfanylethyl)nonanoate Chemical compound CCCC[Sn+2]CCCC.CCCCCCCC(C([O-])=O)CCS.CCCCCCCC(C([O-])=O)CCS ZCBSOVVUFGCQSX-UHFFFAOYSA-L 0.000 description 1
- PKKGKUDPKRTKLJ-UHFFFAOYSA-L dichloro(dimethyl)stannane Chemical compound C[Sn](C)(Cl)Cl PKKGKUDPKRTKLJ-UHFFFAOYSA-L 0.000 description 1
- QGBSISYHAICWAH-UHFFFAOYSA-N dicyandiamide Chemical compound NC(N)=NC#N QGBSISYHAICWAH-UHFFFAOYSA-N 0.000 description 1
- IEPRKVQEAMIZSS-AATRIKPKSA-N diethyl fumarate Chemical compound CCOC(=O)\C=C\C(=O)OCC IEPRKVQEAMIZSS-AATRIKPKSA-N 0.000 description 1
- BXVLQFGQYHYURU-UHFFFAOYSA-N diethyltin Chemical compound CC[Sn]CC BXVLQFGQYHYURU-UHFFFAOYSA-N 0.000 description 1
- 235000019304 dilauryl thiodipropionate Nutrition 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- SWSQBOPZIKWTGO-UHFFFAOYSA-N dimethylaminoamidine Natural products CN(C)C(N)=N SWSQBOPZIKWTGO-UHFFFAOYSA-N 0.000 description 1
- YAHBZWSDRFSFOO-UHFFFAOYSA-L dimethyltin(2+);2-(2-ethylhexoxy)-2-oxoethanethiolate Chemical compound CCCCC(CC)COC(=O)CS[Sn](C)(C)SCC(=O)OCC(CC)CCCC YAHBZWSDRFSFOO-UHFFFAOYSA-L 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- MKZVQIIAAIPNGH-UHFFFAOYSA-N dioctyl phenyl phosphite Chemical compound CCCCCCCCOP(OCCCCCCCC)OC1=CC=CC=C1 MKZVQIIAAIPNGH-UHFFFAOYSA-N 0.000 description 1
- HZHREVFVFOBHSK-UHFFFAOYSA-L dioctyltin(2+);4-ethyl-2-sulfanyloctanoate Chemical compound CCCCC(CC)CC(S)C([O-])=O.CCCCC(CC)CC(S)C([O-])=O.CCCCCCCC[Sn+2]CCCCCCCC HZHREVFVFOBHSK-UHFFFAOYSA-L 0.000 description 1
- SBOSGIJGEHWBKV-UHFFFAOYSA-L dioctyltin(2+);dichloride Chemical compound CCCCCCCC[Sn](Cl)(Cl)CCCCCCCC SBOSGIJGEHWBKV-UHFFFAOYSA-L 0.000 description 1
- PWWSSIYVTQUJQQ-UHFFFAOYSA-N distearyl thiodipropionate Chemical compound CCCCCCCCCCCCCCCCCCOC(=O)CCSCCC(=O)OCCCCCCCCCCCCCCCCCC PWWSSIYVTQUJQQ-UHFFFAOYSA-N 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- NHOGGUYTANYCGQ-UHFFFAOYSA-N ethenoxybenzene Chemical class C=COC1=CC=CC=C1 NHOGGUYTANYCGQ-UHFFFAOYSA-N 0.000 description 1
- CMXXMZYAYIHTBU-UHFFFAOYSA-N ethenyl 2-hydroxybenzoate Chemical compound OC1=CC=CC=C1C(=O)OC=C CMXXMZYAYIHTBU-UHFFFAOYSA-N 0.000 description 1
- MEGHWIAOTJPCHQ-UHFFFAOYSA-N ethenyl butanoate Chemical compound CCCC(=O)OC=C MEGHWIAOTJPCHQ-UHFFFAOYSA-N 0.000 description 1
- UIWXSTHGICQLQT-UHFFFAOYSA-N ethenyl propanoate Chemical compound CCC(=O)OC=C UIWXSTHGICQLQT-UHFFFAOYSA-N 0.000 description 1
- SUPCQIBBMFXVTL-UHFFFAOYSA-N ethyl 2-methylprop-2-enoate Chemical compound CCOC(=O)C(C)=C SUPCQIBBMFXVTL-UHFFFAOYSA-N 0.000 description 1
- XSVPPHSTYOQMNU-UHFFFAOYSA-N ethyl(hexyl)tin Chemical compound C(C)[Sn]CCCCCC XSVPPHSTYOQMNU-UHFFFAOYSA-N 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 150000002222 fluorine compounds Chemical class 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- WSFSSNUMVMOOMR-UHFFFAOYSA-N formaldehyde Substances O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- JFCQEDHGNNZCLN-UHFFFAOYSA-N glutaric acid Chemical class OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229940075529 glyceryl stearate Drugs 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- PBZROIMXDZTJDF-UHFFFAOYSA-N hepta-1,6-dien-4-one Chemical compound C=CCC(=O)CC=C PBZROIMXDZTJDF-UHFFFAOYSA-N 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 239000010514 hydrogenated cottonseed oil Substances 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- 150000004694 iodide salts Chemical class 0.000 description 1
- 239000010699 lard oil Substances 0.000 description 1
- 229940116335 lauramide Drugs 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- JDSHMPZPIAZGSV-UHFFFAOYSA-N melamine Chemical compound NC1=NC(N)=NC(N)=N1 JDSHMPZPIAZGSV-UHFFFAOYSA-N 0.000 description 1
- SHOJXDKTYKFBRD-UHFFFAOYSA-N mesityl oxide Natural products CC(C)=CC(C)=O SHOJXDKTYKFBRD-UHFFFAOYSA-N 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- AWJZTPWDQYFQPQ-UHFFFAOYSA-N methyl 2-chloroprop-2-enoate Chemical compound COC(=O)C(Cl)=C AWJZTPWDQYFQPQ-UHFFFAOYSA-N 0.000 description 1
- CSHCPECZJIEGJF-UHFFFAOYSA-N methyltin Chemical compound [Sn]C CSHCPECZJIEGJF-UHFFFAOYSA-N 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- VYQNWZOUAUKGHI-UHFFFAOYSA-N monobenzone Chemical compound C1=CC(O)=CC=C1OCC1=CC=CC=C1 VYQNWZOUAUKGHI-UHFFFAOYSA-N 0.000 description 1
- 229960000990 monobenzone Drugs 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- TXSUIVPRHHQNTM-UHFFFAOYSA-N n'-(3-methylanilino)-n-phenyliminobenzenecarboximidamide Chemical compound CC1=CC=CC(NN=C(N=NC=2C=CC=CC=2)C=2C=CC=CC=2)=C1 TXSUIVPRHHQNTM-UHFFFAOYSA-N 0.000 description 1
- FTQWRYSLUYAIRQ-UHFFFAOYSA-N n-[(octadecanoylamino)methyl]octadecanamide Chemical compound CCCCCCCCCCCCCCCCCC(=O)NCNC(=O)CCCCCCCCCCCCCCCCC FTQWRYSLUYAIRQ-UHFFFAOYSA-N 0.000 description 1
- PNLUGRYDUHRLOF-UHFFFAOYSA-N n-ethenyl-n-methylacetamide Chemical compound C=CN(C)C(C)=O PNLUGRYDUHRLOF-UHFFFAOYSA-N 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 229920003052 natural elastomer Polymers 0.000 description 1
- 229920001194 natural rubber Polymers 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- BDJRBEYXGGNYIS-UHFFFAOYSA-N nonanedioic acid Chemical compound OC(=O)CCCCCCCC(O)=O BDJRBEYXGGNYIS-UHFFFAOYSA-N 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- JFOJYGMDZRCSPA-UHFFFAOYSA-J octadecanoate;tin(4+) Chemical compound [Sn+4].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O JFOJYGMDZRCSPA-UHFFFAOYSA-J 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-M octanoate Chemical compound CCCCCCCC([O-])=O WWZKQHOCKIZLMA-UHFFFAOYSA-M 0.000 description 1
- GOJKBIHROGSVIJ-UHFFFAOYSA-N octyl bis(2-octylphenyl) phosphite Chemical compound C=1C=CC=C(CCCCCCCC)C=1OP(OCCCCCCCC)OC1=CC=CC=C1CCCCCCCC GOJKBIHROGSVIJ-UHFFFAOYSA-N 0.000 description 1
- AXRSHKZFNKUGQB-UHFFFAOYSA-N octyl diphenyl phosphite Chemical compound C=1C=CC=CC=1OP(OCCCCCCCC)OC1=CC=CC=C1 AXRSHKZFNKUGQB-UHFFFAOYSA-N 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-M oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC([O-])=O ZQPPMHVWECSIRJ-KTKRTIGZSA-M 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- WBLPIVIXQOFTPQ-UHFFFAOYSA-N oxanamide Chemical compound CCCC1OC1(CC)C(N)=O WBLPIVIXQOFTPQ-UHFFFAOYSA-N 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- QQWAKSKPSOFJFF-UHFFFAOYSA-N oxiran-2-ylmethyl 2,2-dimethyloctanoate Chemical compound CCCCCCC(C)(C)C(=O)OCC1CO1 QQWAKSKPSOFJFF-UHFFFAOYSA-N 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 239000002540 palm oil Substances 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- UCUUFSAXZMGPGH-UHFFFAOYSA-N penta-1,4-dien-3-one Chemical class C=CC(=O)C=C UCUUFSAXZMGPGH-UHFFFAOYSA-N 0.000 description 1
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical class OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 1
- 239000002304 perfume Substances 0.000 description 1
- 239000002530 phenolic antioxidant Substances 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 125000005498 phthalate group Chemical class 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920001515 polyalkylene glycol Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 238000012667 polymer degradation Methods 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 229920002620 polyvinyl fluoride Polymers 0.000 description 1
- 229920000131 polyvinylidene Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- POSICDHOUBKJKP-UHFFFAOYSA-N prop-2-enoxybenzene Chemical compound C=CCOC1=CC=CC=C1 POSICDHOUBKJKP-UHFFFAOYSA-N 0.000 description 1
- 239000000473 propyl gallate Substances 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 238000007348 radical reaction Methods 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- CXMXRPHRNRROMY-UHFFFAOYSA-N sebacic acid Chemical class OC(=O)CCCCCCCCC(O)=O CXMXRPHRNRROMY-UHFFFAOYSA-N 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- RYYKJJJTJZKILX-UHFFFAOYSA-M sodium octadecanoate Chemical compound [Na+].CCCCCCCCCCCCCCCCCC([O-])=O RYYKJJJTJZKILX-UHFFFAOYSA-M 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 229940037312 stearamide Drugs 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 229910052712 strontium Inorganic materials 0.000 description 1
- CIOAGBVUUVVLOB-UHFFFAOYSA-N strontium atom Chemical compound [Sr] CIOAGBVUUVVLOB-UHFFFAOYSA-N 0.000 description 1
- RVEZZJVBDQCTEF-UHFFFAOYSA-N sulfenic acid Chemical class SO RVEZZJVBDQCTEF-UHFFFAOYSA-N 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000011885 synergistic combination Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229920003051 synthetic elastomer Polymers 0.000 description 1
- 239000005061 synthetic rubber Substances 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 150000007970 thio esters Chemical class 0.000 description 1
- CWERGRDVMFNCDR-UHFFFAOYSA-M thioglycolate(1-) Chemical compound [O-]C(=O)CS CWERGRDVMFNCDR-UHFFFAOYSA-M 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- BJIOGJUNALELMI-UHFFFAOYSA-N trans-isoeugenol Natural products COC1=CC(C=CC)=CC=C1O BJIOGJUNALELMI-UHFFFAOYSA-N 0.000 description 1
- KKFOMYPMTJLQGA-UHFFFAOYSA-N tribenzyl phosphite Chemical compound C=1C=CC=CC=1COP(OCC=1C=CC=CC=1)OCC1=CC=CC=C1 KKFOMYPMTJLQGA-UHFFFAOYSA-N 0.000 description 1
- XTTGYFREQJCEML-UHFFFAOYSA-N tributyl phosphite Chemical compound CCCCOP(OCCCC)OCCCC XTTGYFREQJCEML-UHFFFAOYSA-N 0.000 description 1
- IVIIAEVMQHEPAY-UHFFFAOYSA-N tridodecyl phosphite Chemical compound CCCCCCCCCCCCOP(OCCCCCCCCCCCC)OCCCCCCCCCCCC IVIIAEVMQHEPAY-UHFFFAOYSA-N 0.000 description 1
- ZIBGPFATKBEMQZ-UHFFFAOYSA-N triethylene glycol Chemical compound OCCOCCOCCO ZIBGPFATKBEMQZ-UHFFFAOYSA-N 0.000 description 1
- 125000005591 trimellitate group Chemical group 0.000 description 1
- ADQGXUHCBBVRGM-UHFFFAOYSA-N trinaphthalen-1-yl phosphite Chemical compound C1=CC=C2C(OP(OC=3C4=CC=CC=C4C=CC=3)OC=3C4=CC=CC=C4C=CC=3)=CC=CC2=C1 ADQGXUHCBBVRGM-UHFFFAOYSA-N 0.000 description 1
- QOQNJVLFFRMJTQ-UHFFFAOYSA-N trioctyl phosphite Chemical compound CCCCCCCCOP(OCCCCCCCC)OCCCCCCCC QOQNJVLFFRMJTQ-UHFFFAOYSA-N 0.000 description 1
- JBWKIWSBJXDJDT-UHFFFAOYSA-N triphenylmethyl chloride Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(Cl)C1=CC=CC=C1 JBWKIWSBJXDJDT-UHFFFAOYSA-N 0.000 description 1
- JBXUHJUOOSISGB-UHFFFAOYSA-N tris(2,3-dimethylphenyl) phosphite Chemical compound CC1=CC=CC(OP(OC=2C(=C(C)C=CC=2)C)OC=2C(=C(C)C=CC=2)C)=C1C JBXUHJUOOSISGB-UHFFFAOYSA-N 0.000 description 1
- XUHUMYVYHLHMCD-UHFFFAOYSA-N tris(2-cyclohexylphenyl) phosphite Chemical compound C1CCCCC1C1=CC=CC=C1OP(OC=1C(=CC=CC=1)C1CCCCC1)OC1=CC=CC=C1C1CCCCC1 XUHUMYVYHLHMCD-UHFFFAOYSA-N 0.000 description 1
- ILLOBGFGKYTZRO-UHFFFAOYSA-N tris(2-ethylhexyl) phosphite Chemical compound CCCCC(CC)COP(OCC(CC)CCCC)OCC(CC)CCCC ILLOBGFGKYTZRO-UHFFFAOYSA-N 0.000 description 1
- WGKLOLBTFWFKOD-UHFFFAOYSA-N tris(2-nonylphenyl) phosphite Chemical compound CCCCCCCCCC1=CC=CC=C1OP(OC=1C(=CC=CC=1)CCCCCCCCC)OC1=CC=CC=C1CCCCCCCCC WGKLOLBTFWFKOD-UHFFFAOYSA-N 0.000 description 1
- WSRKWWQBQDBQRH-UHFFFAOYSA-N tris(2-octylphenyl) phosphite Chemical compound CCCCCCCCC1=CC=CC=C1OP(OC=1C(=CC=CC=1)CCCCCCCC)OC1=CC=CC=C1CCCCCCCC WSRKWWQBQDBQRH-UHFFFAOYSA-N 0.000 description 1
- LRQDDWFPGOHSBH-UHFFFAOYSA-N tris(2-phenylethyl) phosphite Chemical compound C=1C=CC=CC=1CCOP(OCCC=1C=CC=CC=1)OCCC1=CC=CC=C1 LRQDDWFPGOHSBH-UHFFFAOYSA-N 0.000 description 1
- DAZUWKNHFLGZSN-UHFFFAOYSA-N tris(2-phenylphenyl) phosphite Chemical compound C=1C=CC=C(C=2C=CC=CC=2)C=1OP(OC=1C(=CC=CC=1)C=1C=CC=CC=1)OC1=CC=CC=C1C1=CC=CC=C1 DAZUWKNHFLGZSN-UHFFFAOYSA-N 0.000 description 1
- FEVFLQDDNUQKRY-UHFFFAOYSA-N tris(4-methylphenyl) phosphite Chemical compound C1=CC(C)=CC=C1OP(OC=1C=CC(C)=CC=1)OC1=CC=C(C)C=C1 FEVFLQDDNUQKRY-UHFFFAOYSA-N 0.000 description 1
- 239000002383 tung oil Substances 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 229940035893 uracil Drugs 0.000 description 1
- 238000003828 vacuum filtration Methods 0.000 description 1
- HGBOYTHUEUWSSQ-UHFFFAOYSA-N valeric aldehyde Natural products CCCCC=O HGBOYTHUEUWSSQ-UHFFFAOYSA-N 0.000 description 1
- KOZCZZVUFDCZGG-UHFFFAOYSA-N vinyl benzoate Chemical compound C=COC(=O)C1=CC=CC=C1 KOZCZZVUFDCZGG-UHFFFAOYSA-N 0.000 description 1
- FUSUHKVFWTUUBE-UHFFFAOYSA-N vinyl methyl ketone Natural products CC(=O)C=C FUSUHKVFWTUUBE-UHFFFAOYSA-N 0.000 description 1
- 229940102001 zinc bromide Drugs 0.000 description 1
- 229960001939 zinc chloride Drugs 0.000 description 1
- UGZADUVQMDAIAO-UHFFFAOYSA-L zinc hydroxide Chemical compound [OH-].[OH-].[Zn+2] UGZADUVQMDAIAO-UHFFFAOYSA-L 0.000 description 1
- 229910021511 zinc hydroxide Inorganic materials 0.000 description 1
- 229940007718 zinc hydroxide Drugs 0.000 description 1
- 229940098697 zinc laurate Drugs 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
- 229960001296 zinc oxide Drugs 0.000 description 1
- 229940057977 zinc stearate Drugs 0.000 description 1
- NWONKYPBYAMBJT-UHFFFAOYSA-L zinc sulfate Chemical compound [Zn+2].[O-]S([O-])(=O)=O NWONKYPBYAMBJT-UHFFFAOYSA-L 0.000 description 1
- 229910000368 zinc sulfate Inorganic materials 0.000 description 1
- 229960001763 zinc sulfate Drugs 0.000 description 1
- 229910052984 zinc sulfide Inorganic materials 0.000 description 1
- 229940063789 zinc sulfide Drugs 0.000 description 1
- IFNXAMCERSVZCV-UHFFFAOYSA-L zinc;2-ethylhexanoate Chemical compound [Zn+2].CCCCC(CC)C([O-])=O.CCCCC(CC)C([O-])=O IFNXAMCERSVZCV-UHFFFAOYSA-L 0.000 description 1
- GPYYEEJOMCKTPR-UHFFFAOYSA-L zinc;dodecanoate Chemical compound [Zn+2].CCCCCCCCCCCC([O-])=O.CCCCCCCCCCCC([O-])=O GPYYEEJOMCKTPR-UHFFFAOYSA-L 0.000 description 1
- CHJMFFKHPHCQIJ-UHFFFAOYSA-L zinc;octanoate Chemical compound [Zn+2].CCCCCCCC([O-])=O.CCCCCCCC([O-])=O CHJMFFKHPHCQIJ-UHFFFAOYSA-L 0.000 description 1
- DRDVZXDWVBGGMH-UHFFFAOYSA-N zinc;sulfide Chemical compound [S-2].[Zn+2] DRDVZXDWVBGGMH-UHFFFAOYSA-N 0.000 description 1
- 239000004711 α-olefin Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/36—Sulfur-, selenium-, or tellurium-containing compounds
- C08K5/37—Thiols
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K3/00—Use of inorganic substances as compounding ingredients
- C08K3/16—Halogen-containing compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/04—Oxygen-containing compounds
- C08K5/09—Carboxylic acids; Metal salts thereof; Anhydrides thereof
- C08K5/098—Metal salts of carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/04—Oxygen-containing compounds
- C08K5/13—Phenols; Phenolates
- C08K5/134—Phenols containing ester groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/56—Organo-metallic compounds, i.e. organic compounds containing a metal-to-carbon bond
- C08K5/57—Organo-tin compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K3/00—Use of inorganic substances as compounding ingredients
- C08K3/16—Halogen-containing compounds
- C08K2003/168—Zinc halides
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Compositions Of Macromolecular Compounds (AREA)
Description
- GEBIET DER ERFINDUNG
- Die Erfindung betrifft Stabilisatorzusammensetzungen, die klare halogenhaltige Polymerzusammensetzungen gegen die schädlichen Wirkungen von Hitze, Licht und Bewitterung stabilisieren können. Solche Stabilisatorzusammensetzungen umfassen ein latentes Mercaptan, welches während der Bearbeitung bei erhöhten Temperaturen sich zu entsprechenden Abbauprodukten entwickelt, wobei diese Produkte ein freies Mercaptan in Verbindung mit sehr niedrigen Gehalten an einer freien Phenylsalicylatverbindung einschließen. Diese Erfindung betrifft auch klare halogenhaltige Polymerzusammensetzungen, die normalerweise sowohl Hitze- als auch Ultraviolett-Licht-induzierte Verschlechterung unterliegen, und diese umfassen ein halogenhaltiges Polymer und die Abbauprodukte eines latenten Mercaptans, das während der Verarbeitung der Polymerzusammensetzung bei einer erhöhten Temperatur vorliegt, und wobei die Produkte ein freies Mercaptan und eine freie Phenylsalicylatverbindung einschließen. Die Erfindung betrifft auch solche Stabilisatoren und Polymerzusammensetzungen, die zusätzlich sehr geringe Gehalte eines Stabilisators auf Metallbasis, einer Lewis-Säure, eines Stabilisators auf organischer Basis, eines Stabilisators auf Hydrotalzit-Basis oder andere Stabilisator-Synergisten enthalten.
- HINTERGRUND DER ERFINDUNG
- Es ist bekannt, daß die physikalischen Eigenschaften verschiedener organischer Polymere sich während einer Verarbeitung verschiedener organischer Polymere und während man Polymerformprodukte bestimmten Umgebungen aussetzt, verschlechtert werden und daß Farbveränderungen auftreten. Die Hauptbeispiele von Polymeren, die empfänglich für einen Abbau während der Bearbeitung sind, sind die halogenhaltigen Polymere, wie die Vinyl- und Vinylidenpolymere in welchen das Halogen direkt an Kohlenstoffatome gebunden ist. Poly-(vinylchlorid) bzw. PVC, Copolymere von Vinylchlorid und Vinylacetat sowie Poly-(vinylidenchloride), das Hauptharz in selbsthaftenden transparenten Nahrungsmittelhüllen, sind die bekanntesten Polymere, die Stabilisierung für Ihr Überleben während der Fabrikation zu Röhren, Fensterkästen, Verkleidungen, Flaschen, Wandbezügen, Packungsfilm und dergleichen erfordern. Wenn solche Polymere bei erhöhten Temperaturen bearbeitet werden, treten oftmals unerwünschte Farbveränderungen in den ersten fünf bis zehn Minuten sowie während späterer Stufen der Verarbeitung auf. Trübheit, die manchmal die Farbveränderungen begleitet, ist besonders unerwünscht, wo klare Produkte benötigt werden.
- Der Zusatz von Hitzestabilisatoren zu solchen Polymeren war absolut wesentlich für die weitverbreitete Brauchbarkeit der Polymere. Aus einer großen Menge von Arbeit bei der Entwicklung von mehr und mehr wirksamen Hitzestabilisatoren ergaben sich zwei Hauptklassen: Organozinnverbindungen und gemischte Metallkombinationen. Hitzestabilisatoren auf Organozinnbasis sind die wirksamsten und am weitest verbreiteten Stabilisatoren für starres PVC. Synergistische Kombinationen von Alkylzinnmercaptiden und freien Mercaptanen sind besonders wirksame Hitzestabilisatoren für starres PVC während des Extrudierens. Sie waren jedoch nicht vollständig zufriedenstellend wegen mehrerer Fehler an dem Teil des Mercaptansynergisten und werden nicht in flexiblem PVC verwendet. Viele Mercaptane geben einen angreifenden Geruch ab, selbst bei Raumtemperatur, und der Geruch nimmt noch schlimmer bei PVC-Verarbeitungstemperaturen zu. Die oxidative Beständigkeit der Mercaptane ist sehr oft sehr gering. Oxidation der freien Mercaptane vermindert den Synergismus. So wäre eine Kombination mit einem verbesserten Synergismus von der PVC-Industrie zu begrüßen. Auch erfordern wegen der Endverwendung der aus einigen Polymeren hergestellten Gegenstände viele Polymerzusammensetzungen die Gegenwart sowohl von Bioziden als auch von Hitzestabilisatoren, doch die Verwendung der Organozinnmercaptid/mercaptan-Kombination in solch einer Zusammensetzung ist oftmals frustrierend wegen der Tendenz des freien Mercaptans, ein Biozid zu deaktivieren, wie das häufig verwendete OBPA (10,10'-Oxybisphenoxarsin).
- Ein anderer Nachteil mercaptanhaltiger Hitzestabilisatoren ist jener, daß sie die Polymerzusammensetzungen nicht gegen Abbauwirkungen von Ultraviolettlicht und Bewitterung schützen. Bei längerem Belichten mit Umgebungslicht und bei Bewitterungsbedingungen im Freien neigen aus diesen so stabilisierten Polymeren gebildete Produkte leicht dazu, sich zu verfärben und zu zersetzen mit begleitendem Verlust an physikalischen Eigenschaften, z. B. Zugfestigkeit, Flexibilität und Schlagfestigkeit, was die Standzeit solcher Gegenstände verkürzt.
- Mit zunehmender Verwendung von halogenhaltigen Polymerzusammensetzungen unter Bildung von Produkten, die für wetterfeste Anwendungen im Freien bestimmt sind, wie beispielsweise Vinylhausverkleidungen, Fensterrahmen, Fensterprofile, geriffelte Decken, Türabstreifer usw., ist es zunehmend wichtig, einen Stabilisator zu entwickeln, der nicht nur die Polymere gegen auftretende Hitze während der Bearbeitung und Herstellung schützt, sondern auch die Polymere gegen Langzeitwirkungen von Umgebungslicht und Bewitterung im Freien schützt. Ein solcher Stabilisator ist besonders erwünscht für klare Produkte, die sehr schlechte Lichtbeständigkeit und Wetterbeständigkeit haben, da sie allgemein keine opaken Füllstoffe und Pigmente, wie Titandioxid, enthalten, die das Licht daran hindern würden, einzudringen und so die Geschwindigkeit der Polymerzersetzung zu reduzieren.
- In der US-Patentschrift 3,660,331, lehrt Ludwig die Stabilisierung von Vinylhalogenidharzen durch bestimmte Thioether und Thioester von Tetrahydropyran. Bessere Hitzestabilisatorzusammensetzungen werden jedoch noch immer benötigt. Hitzestabilistoren, die verbesserte Ultraviolettlichtbeständigkeit und Bewitterungsbeständigkeit halogenhaltigen Polymerzusammtensetzungen, besonders klaren Polymeren verleihen, werden auch weiterhin benötigt. Die Stabilisator kombinationen von Thioethern und geringen Gehalten an Vinylsalicylat nach dieser Erfindung decken diesen Bedarf.
- ZUSAMMENFASSUNG DER ERFINDUNG
- Es ist daher ein Ziel dieser Erfindung, eine Wärmestabilisatorzusammensetzung mit dem Synergismus eines Mercaptans plus verbesserter Ultraviolettlichtstabilität und Bewitterungsfähigkeit.
- Es ist ein anderes Ziel dieser Erfindung, eine Hitzestabilisatorzusammensetzung mit dem Synergismus eines Mercaptans plus verbesserte oxidative Stabilität zu bekommen.
- Noch ein weiteres Ziel der Erfindung ist es, eine Hitzestabilisatorzusammensetzung zu liefern, die im wesentlichen frei von dem typischerweise mit Mercaptanen verbundenen angreifenden Geruch zu erlangen.
- Es ist noch ein weiteres Ziel dieser Erfindung, eine Hitzestabilisatorzusammensetzung mit dem Synergismus eines Mercaptans plus verbesserter biozider Verträglichkeit zu bekommen.
- Es ist noch ein weiteres Ziel dieser Erfindung, eine Hitzestabilisatorzusammensetzung zu tiefem, die einen latentes Mercaptan enthaltenden Hitzestabilisator in Kombination mit einer synergistischen Menge einer freien Phenylsalicylatverbindung zu erhalten.
- Ein verwandtes Ziel dieser Erfindung ist es, eine klare halogenhaltige Polymerzusammensetzung und im wesentlichen transparente, daraus gebildete Gegenstände zu liefern, die gegen Hitze, Licht und Bewitterung durch Einarbeitung eines latentes Mercaptan enthaltenden Hitzestabilisators in Kombination mit einer synergistischen Menge einer freien Phenylsalicylatverbindung stabilisiert sind.
- Diese und andere Ziele der Erfindung, die sich aus der folgenden Beschreibung ergeben, erreicht man durch eine Zusammensetzung, die klare halogenhaltige Polymerzusammensetzungen gegen die schädlichen Wirkungen von Hitze, Licht und Bewitterung stabilisieren kann und latentes Mercaptan umfasst, welches während der Bearbeitung der Zusammensetzung bei einer erhöhten Temperatur sich zersetzt, um ein freies Mercaptan freizusetzen. Das freie Mercaptan hat die Formel worin a 0 oder 1 ist, m und n 0 oder 1 sind; y = 1 bis 4; wenn y = 1, z ist 1 bis 4; und wenn y mehr als 1 ist, z ist 1; R1 ist ein Alkoxy-(acyloxyalkyl)-, Alkoxy-(polyalkoxy)-carbonylalkyl-, Carboxyalkyl-, Acylowyalkyl, Acyloxy-(hydroxyalkyl)-, Acyloxyalkoxyalkyl-, Acyloxy-(polyalkoxy)-Alkyl, Benzoyloxy(polyalkoxy)-alkyl-, Alkylen-bis-(acyloxyalkyl)-, Alkoxycarbonylalkyl, Alkoxycarbonylalkylenyl-, Hydroxyalkoxycarbonylalkyl-, Hydroxy-(polyalkoxy)-carbonylalkyl-, Mercaptoalkoxycarbonylalkyl-, Mercaptoalkoxycarbonylalkylenyl-, Alkoxycarbonyl-(amido)-alkyl-, Alkylcarbonyloxy-(polyalkoxy)-carbonylalkyl- oder Tetrahydropyranyloxy oder (Polyalkoxy) Carbonylalkyl, oder Carboxyaryl-Rest mit 1 bis 22 Kohlenstoffatomen; R2, R3, R4, R5, R6 und R7 voneinander unabhängig Wasserstoff sind, ein Hydroxyl-, Mercapto-, Acyl-, Alkyl-, Alkylenyl-, Aryl-, Halogenaryl-, Alkaryl-, Aralkyl-, Hydroxyalkyl-, Mercaptoalkyl-, Mercaptoalkylenyl-, Hydroxyaryl-, Alkoxyaryl-, Alkoxyhydroxyaryl-, Mercatoalkylenyl-, Mercaptoalkoxycarbonylalkylenyl-, Hydroxyaryl-, Arylcarbonyl-, Mercaptoaryl-, Carboxyalkyl-, Carboxyaryl-, oder Acyl-Rest mit 1 bis 22 Kohlenstoffatomen; X ist Aryl, Haloaryl, Alkaryl, Hydroxyaryl, Dihydroxyaryl, Aralkaryl, Alkoxyaryl, Arylcycloalkyl, oder ein Heteroatom ist, wenn a 1 und m 0 ist, R3 und R5 einen heterozyklischen Rest bilden in Verbindung mit X als ein Stickstoffatom unter der Voraussetzung, dass, wenn X Aralkaryl ist, R6 und R7 Hydroxyl bedeuten, a 1 ist und m 1 ist, dann z 1 oder 2 bedeutet, und mit der weiteren Maßgabe, dass, wenn R6 ≠ Hydroxyl oder Mercapto ist, z 1 ist. Die Zusammensetzung enthält auch eine freie Phenylsalicylatverbindung. Das freie Phenylsalicylat, so nimmt man an, wird einer Lichtumlagerung unterzogen, während man über längere Zeit die Zusammensetzung Umgebungslicht aussetzt, um eine Benzophenonverbindung freizusetzen, die relativ höhere Ultraviolettlicht-absorbierende Aktivität besitzt.
- Die oben genannten und andere Ziele der Erfindung erreicht man auch durch Einarbeitung eines blockierten Mercaptans und einer synergistischen Menge einer freien Phenylsalicylatverbindung in eine klare Polymerzusammensetzung, die ein halogenhaltiges Polymer enthält, das normalerweise für Wärme- und Ultraviolettlicht induzierte Verschlechterung empfänglich ist, und die Zusammensetzung bei erhöhter Temperatur bearbeitet, bei der das latente Mercaptan zerfällt, um ein freies Mercaptan freizusetzen. Die Begriffe "latentes Mercaptan" und "blockiertes Mercaptan" werden gegeneinander austauschbar hier verwendet. Das latente Mercaptan kann als der einzige Hitzestabilisator wirken, kann aber auch mit synergistischen Mengen anderer Hitzestabilisatoren verwendet werden, wie mit sehr niedrigen Werten von Hitzestabilisatoren auf organischer Basis, Hitzestabilisatoren auf Metallbasis oder Lewis-Säuren und dergleichen.
- Andere Produkte des Abbaus des blockierten Mercaptans dürften Karbo-Kationen des blockierenden Rests einschließen, die durch eine Molekularstruktur stabilisiert sind, in welcher der Elektronenmangel durch mehrere Gruppen anteilig gedeckt wird. Resonanzstabilisierung und Nachbargruppenstabilisierung sind zwei der möglichen Mechanismen, mit welchen die Karbo-Kationen stabilisiert werden können. Die Karbo-Kationen wirken als Zwischenprodukte bei der Bildung stabiler Verbindungen frühzeitig in der Heißbearbeitung halogenhaltiger Polymere. Obwohl solche Mechanismen und die resultierenden Karbo-Kationen der Antrieb für die Freisetzung des aktiven freien Mercaptans sein dürften, ist diese Erfindung keineswegs durch den obigen Versuch beschränkt, das Arbeiten der Erfindung zu erklären. Die Fachleute werden sehen, dass die Resonanzstabilisierung und die Nachbargruppenstabilisierung mögliche der folgenden Strukturen des blockierten Mercaptans sein können, während andere Mechanismen bei der Arbeit in anderen blockierten Mercaptanen durch diese Strukturen repräsentiert werden, die auch ein aktives freies Mercaptan bei thermischem und/oder chemischem Abbau während der Verarbeitung der Polymerzusammensetzungen, die solche blockierten Mercaptane enthalten, freisetzen.
- Außerdem ist die Foto-Fries-Umwandlung ein wesentlicher Teil des Phenylsalicylats für seine entsprechende Benzophenonstruktur während längerem Belichten mit Umgebungslicht ein möglicher Mechanismus, nach welchem die sehr-hochultraviolettlichtabsorbierende Aktivität solcher Stabilisatorzusammensetzungen erhalten wird. Obwohl solche Mechanismen und das resultierende Produkt wohl ein Antrieb für die Generation hochaktiver UV-absorbierender Verbindungen sein dürften, verstehen die Fachleute, dass auch andere Mechanismen zur Verbesserung der Ultraviolettlichtstabilität und Bewitterungsfähigkeit, die man bei solchen Zusammensetzungen bekommt, arbeiten können. Diese Erfindung ist somit keineswegs durch den obigen Versuch, das Arbeiten der Erfindung zu erklären, beschränkt.
- DETAILLIERTE BESCHREIBUNG DER ERFINDUNG
- Die polymeren Zusammensetzungen dieser Erfindung enthalten Polymere, die normalerweise empfindlich für Hitze-induzierte und Licht-induzierte Verschlechterung durch Autooxidation sind, wie beispielsweise die oben genannten halogenhaltigen Polymere. Der Begriff "halogenhaltige Polymere", wie er hier verwendet wird, bedeutet halogenhaltige Polymere von Harzen, in welchen das Halogen direkt an die Kohlenstoffatome gebunden ist. Von besonderem Interesse für diese Erfindung sind klare halogenhaltige Polymerzusammensetzungen, besonders die gewerblich bedeutsamen klaren Polyvinylchloridzusammensetzungen. Der Begriff "klar", wie er hier verwendet wird, bedeutet, dass die halogenhaltigen Polymerzusammensetzungen zu Gegenständen führen, die im wesentlichen transparent sind. Wie für den Fachmann auf der Hand liegen wird, sind solche Zusammensetzungen im wesentlichen frei von opaken Pigmenten und Füllstoffen.
- Die Stabilisatorzusammensetzungen dieser Erfindung sind besonders geeignet, entgegen den verschlechternden Effekten von Hitze, Ultraviolettlicht und Bewitterung im Vergleich mit Stabilisatorzusammensetzungen, die bereits vorher bekannt waren, überlegene Stabilisierung zu verleihen.
- Es wurde auch überraschenderweise gefunden, dass klare halogenhaltige Polymerzusammensetzungen, die für Bewitterung im Freien beabsichtigt waren, insbesondere effektiv gegen die abbauenden Effekte von Licht und Bewitterung zusätzlich zu Hitze durch Einführung einer stabilisierend wirksamen Menge einer Stabilisatorzusammensetzung, die A) wenigstens einen latenten Mercap tanstabilisator und B) wenigstens eine freie Phenylsalicylatverbindung umfasst, während in entsprechend opak pigmentierten oder gefüllten halogenhaltigen so stabilisierten Polymerzusammensetzungen kein Vorteil bezüglich der Ultraviolettlichstabilität und Bewitterungsmöglichkeit erkennbar ist.
- Die halogenhaltigen organischen Polymere, die gemäß der Erfindung stabilisiert werden können, enthalten chloriertes Polyethylen mit 14 bis 75 Gew.-%, zum Beispiel 27 Gew.-%, Chlor, chlorierten Natur- und Synthesekautschuk, Kautschukhydrochlorid, chloriertes Polystyrol, chloriertes Polyvinylchlorid, Polyvinylbromid, Polyvinylfluorid, Copolymere von Vinylchlorid mit 1 bis 90 %, vorzugsweise mit 1 bis 30 %, eines copolymerisierbaren ethylenisch ungesättigten Materials, wie beispielsweise Vinylacetat, Vinylbutyrat, Vinylbenzoat, Vinylidenchlorid, Diethylfumarat, Diethylmaleat, andere Alkylfumarate und Maleate, Vinylpropionat, Methylacrylat, 2-Ethylhexylacrylat, Butylacrylat und andere Alkylacrylate, Methylmethacrylat, Ethylmethacrylat, Butylmethacrylat und andere Alkylmethacrylate, Methyl-alpha-chloracrylat, Styrol, Trichlorethylen, Vinylether, wie Vinylethylether, Vinylchlorethylether und Vinylphenylether, Vinylketone, wie Vinylmethylketon und Vinylphenylketon, 1-Fluor-2-chlorethylen, Acrylnitril, Chloracrylnitril, Allylidendiacetat und Chlorallylidendiacetat. Typische Copolymere schließen Vinylchlorid-Vinylacetat (96:4, im Handel erhältlich bei VYNW), Vinylchlorid-Vinylacetat (87:13), Vinylchlorid-Vinylacetat-Maleinsäureanhydrid ((86:13:1), Vinylchlorid-Vinylidenchlorid (95:5); Vinylchlorid-Diethylfumarat (95:5), und Vinylchlorid-2-Ethylhexylacrylat (80:20).
- Vorzugsweise ist das halogenhaltige organische Polymer ein Vinylhalogenidpolymer, insbesondere Vinylchloridpolymer. Gewöhnlich wird das Vinylchloridpolymer aus Monomeren gemacht, die aus Vinylchlorid alleine oder einem Gemisch von Monomeren bestehen, das vorzugsweise wenigstens etwa 70 Gew.-%, bezogen auf das gesamte Monomergewicht von Vinylchlorid besteht. Wie hier verwendet, bedeutet der Ausdruck Polyvinylchlorid oder PVC-Zusammensetzung eine Zusammensetzung, die ein Vinylhalogenidpolymer umfasst. Eine starre PVC-Zusammensetzung ist eine solche, die keinen Weichmacher enthält. Eine halbstarre PVC-Zusammensetzung ist eine solche, die 1 bis etwa 25 Teile eines Weichmachers je 100 Gewichtsteile des halogenhaltigen Vinylpolymers enthält. Eine flexible PVC-Zusammensetzung enthält etwa 25 bis etwa 100 Gewichtsteile je 100 Gewichtsteile des halogenhaltigen Vinylpolymers. Alkylester von Carbonsäuren, in welche 1 bis 3 Alkylgruppen eingebaut sind, mit 8 bis 12 Kohlenstoffatomen sind repräsentativ für die Weichmacher. Die Alkylgruppe kann n-Octyl, 2-Ethylhexyl, Nonyl, Decyl oder Dodecyl sein. Geeignete Ester schließen Phthalate, Trimellitate, Benzoate, Adipate, Glutarate und Sebacate ein. Die Weichmacher können auch Pentaerythrit oder ein derartiger Ester hiervon sein. Ein Polymerweichmacher ist auch geeignet. Die Stabilisatorzusammensetzungen dieser Erfindung sind wirksam in flexiblen wie auch starren und halbstarren PVC-Zusammensetzungen.
- In den Stabilisatorzusammensetzungen dieser Erfindung hängen die Menge von latentem Mercaptan und von freiem Phenylsalicylat, die verwendet werden, von mehreren Faktoren einschließlich, aber nicht ausschließlich den speziell verwendeten Verbindungen, dem zu stabilisierenden teilchenförmigen Harz, der Schärfe der Hitze, des Lichtes und der Bewitterung ab, denen das Harz ausgesetzt wird, sowie von dem erwünschten Stabilisierungsgrad.
- In den Stabilisatorzusammensetzungen nach dieser Erfindung werden die Mengen an latentem Mercaptan und freiem Phenylsalicylat, die verwendet werden, von einigen Faktoren einschließlich, aber nicht ausschließlich der verwendeten teilchenförmigen Verbindungen, des zu stabilisierenden teilchenförmigen Harzes, der Stärke von Hitze, Licht und Bewitterung, denen das Harz ausgesetzt wird und des Grades an erwünschter Stabilisierung abhängen. So kann die Menge jeder Komponente stark variieren, wobei lediglich erforderlich ist, dass die Stabilisatorzusammensetzung genug von jeder Komponente enthält, um ein halogeniertes Polymer gegen Abbaueffekte der Hitze, des Lichts und der Bewitterung zu stabilisieren, und damit das freie Phenylsalicylat in einer Menge vorliegt, die einen synergistischen Effekt auf eine solche Stabilisierung ausübt. Die Stabilisatorzusammensetzungen nach dieser Erfindung enthalten allgemein A) 50 Gew.-% bis 98,8 Gew.-%, vorzugsweise 80 bis 96 Gew.-%, bezogen auf das vereinigte Gewicht von A) plus B) eines latenten Mercaptans oder eines Gemisches von latenten Mercaptanen und B) 1,2 bis 50 Gew.-%, vorzugsweise 4 bis 20 Gew.-%, bezogen auf das kombinierte Gewicht von A) plus B) einer freien Phenylsalicylatverbindung oder eines Gemisches von Phenylsalicylatverbindungen. Andere Verbindungen, die in die Stabilisatorzusammensetzungen eingeschlossen werden können, werden als Gewichtsprozente auf das Gewicht des halogenhaltigen Polymers bezogen.
- Die blockierten Mercaptane, die für die Zwecke dieser Erfindung geeignet sind, besitzen die Formel 1: worin a 0 oder 1 ist, m und n 0 oder 1 bedeuten; y = 1 bis 4 ist, wobei, wenn y = 1 ist, z 1 bis 4 ist; und wenn y mehr als 1 ist, z 1 ist; R1 ein Alkoxy-(acyloxyalkyl)-, Alkoxy-(polyalkoxy)-carbonylalkyl-, Carboxyalkyl-, Acyloxyalkyl-, Acyloxy-(hyroxyalkyl)-, Acyloxyalkoxyalkyl-, Acyloxy-(polyalkoxy)-alkyl-, Benzoyloxy-(polyalkoxy)-alkyl-, Alkylenbis-(acyloxyalkyl)-, Alkoxycarbonylalkyl-, Alkoxycarbonylalkylenyl-, Hydroxyalkoxycarbonylalkyl, Hydroxy-(polyalkoxy)-carbonylalkyl-, Mercaptoalkoxycarbonylalkyl-, Mercatoalkoxycarbonylalkylenyl-, Alkoxycarbonyl-(amido)-alkyl-, Alkylcarbonyloxy-(polyalkoxy)-carbonylalkyl-, oder Tetrahydropyranyloxy-(polyalkoxy)-carbonylalkyl-Rest oder Carboxyaryl-Rest mit 1 bis 22 Kohlenstoffatomen ist; R2, R3, R4, R5, R6 und R7 unabhängig voneinander Wasserstoff, eine Hydroxyl-, Mercapto-, Acyl-, Alkyl-, Alkylenyl-, Aryl, Halogenaryl-, Alkaryl-, Aralkyl, Hydroxyalkyl, Mercaptoalkyl-, Hydroxyaryl-, Alkoxyaryl-, Alkoxyhydroxyaryl-, Mercaptoalkylenyl-, Mercaptoalkoxycarbonylalkylenyl-, Hydroxyaryl-, Arylcarbonyl-, Mercaptoaryl-, Carboxyalkyl-, Carboxyaryl-, oder Acyl-Rest mit 1 bis 22 Kohlenstoffatomen sind, X Aryl-, Halogenaryl-, Alkaryl-, Hydroxyaryl-, Dihydroxyaryl-, Aralkaryl-, Alkoxyaryl-, Arylcycloalkyl-Rest oder ein Heteroatom mit der Option ist, dass, wenn a 1 und m 1 ist, R6 und R7 einen heterozyklischen Rest in Verbindung mit X als Stickstoff bilden und mit der weiteren Option, dass, wenn a gleich 1 und m gleich 0 ist, eine der Gruppen R1, R3 und R5 gemeinsam mit R7 und X einen heterozyklischen Rest mit X als Heteroatom von Sauerstoff oder Schwefel bilden, wobei z 1 oder 2 ist, wenn X Aralkaryl ist, R6 und R7 Hydroxyl sind, a 1 und m 1 ist, und mit der weiteren Maßgabe, dass, wenn R6 ≠Hydroxyl oder Mercapto ist, z 1 bedeutet.
- Die Mercaptane, die in latente Mercaptane zum Zwecke der vorliegenden Erfindung umgewandelt werden können, sind bekannte Verbindungen und schließen Alkylmercaptane, Mercaptoester, Mercaptoalkohole und Mercaptocarbonsäuren ein. Siehe beispielsweise US-A-3,503,924 und 3,507,827. Alkylmercaptane mit 1 bis etwa 200 Kohlenstoffatomen und 1 bis 4 Mercaptogruppen sind geeignet. Sie schließen die folgenden Verbindungen ein, die die S-R'-Gruppe enthalten, doch ist die Erfindung nicht hierauf beschränkt: worin R10 und R19 gleich oder verschieden sind und R11 -N, Aryl oder C1 bis C18 Alkyl ist,
R12 Cycloalkyl, Cycloalkenyl oder Phenyl ist,
R13 mit der Maßgabe, dass in der Formel (MC2), wenn R12 Phenyl ist, R13 -OH und i=0 ist, dann die SH-Gruppen an nicht benachbarte Kohlenstoffatomen gebunden sind,
R14 -H oder eine zweiwertige Gruppe ist, die Halogen-, Hydroxy-, Mercapto- oder Alkylsubstituenten enthalten kann und die, wenn R12 Phenyl ist, das Phenyl so kombiniert, dass es einen Naphthalinring bildet,
R15 ist,
R17 -H oder Alkyl, Alkenyl, Aryl, Aralkyl, Alkaryl, Cycloalkyl, Cycloalkylenyl ist,
R18 Arylen, C1 bis C8-Alkylenyl ist, worin b eine ganze Zahl von 1 bis 6 bedeutet,
i=0 oder eine ganze Zahl von 1 bis 6 einschließlich ist,
j=0, 1, 2 oder 3 ist und
f=1 oder 2 bedeutet. - Mercaptanhaltige organische Verbindungen bevorzugt als Zwischenprodukte bei der Herstellung der latenten Mercaptane dieser Erfindung sind jene Verbindungen gemäß der Formel (MC1), worin R11 -H, R19 -N, R10 OH oder und i=1, jene Verbindungen nach der Formel (MC2), worin R12 Phenyl ist, R11 -H ist, R13 -H ist, R14 -H ist, i=1 und j=1, jene Verbindungen nach der Formel (MC3), worin R11 -H ist, R15 und i=1, jene Verbindungen gemäß der Formel (MC4), worin R11 -H und i=1 ist, jene Verbindungen nach der Formel (MC5), worin R16 -C2H5 oder R11 -H ist und i=1 und jene Verbindungen nach der Formel (MC6), worin R11 -H und i=1 ist.
-
- Beispiele der mercaptanhaltigen organischen Verbindungen, die durch die Formel (MC2) beschrieben sind, schließen die folgenden Verbindungen ein, ohne hierauf beschränkt zu sein.
-
-
-
-
- Die Mercaptanverbindungen der Formeln (MC1) und (MC4) sind besonders bevorzugt.
- Einer der Vorteile dieser Erfindung besteht darin, dass der angreifende Geruch der Mercaptane durch die blockierende Gruppe derart maskiert wird, dass das so erzeugt latente Mercaptan in eine PVC-Zusammensetzung oder dergleichen mit wenig oder ohne Angriff auf den Anwender mit der Kenntnis ausübt, dass das freie Mercaptan als ein Zersetzungsprodukt abgegeben wird, wenn die behandelte Zusammensetzung während der üblichen Verarbeitung, zum Beispiel beim Extrudieren, erhitzt wird.
- Die blockierenden Verbindungen sind vorzugsweise jene, die ein stabilisiertes Carbocation einer Molekülstruktur geben können, in welcher der Elektronenmangel durch mehrere Gruppen anteilmäßig ausgeglichen wird. Resonanzstabilisierung und Nachbargruppenstabilisierung sind zwei der möglichen Mechanismen, durch welche die Karbokationen stabilisiert werden können. Polarisierte ungesättigte Verbindungen sind beispielsweise 3,4-Dihydropyran, 2-Methoxy-3, 4-dihydropyran, Styrol, α-Methylstyrol, Vinylbenzylchlorid, Inden, 2-Vinylpyridin, N-Vinylpyrrolidon, Vinylacetat, Octadecylvinylether Cyclohexyldivinylether, Äthyleneglyconmonovinylether, Allylphenylether, trans-Cinnamaldehyd, N-Methyl-N-Vinylacetamid, N-Vinylcaprolactam, Isoeugenol und 2-Propenylphenol sind geeignet. Verbindungen mit labilen Halogenatomen, die als Chlorwasserstoffsäure in einer Kondensationsreaktion mit dem Mercaptan abgespalten werden, wie beispielsweise durch Triphenylmethylchlorid, Benzylchlorid und Bis-(chlormethyl)-benzol sind auch geeignet. Das Mercaptan kann auch durch Kondensation mit einem Aldehyd, wie Butyraldehyd, oder mit einem Benzylalkohol, wie Benzoldimethanol, blockiert werden. Ein bevorzugtes Blockiermittel ist 2-Hydroxybenzylalkohol, ein bekanntes Zwischenprodukt in der Parfumindustrie, landwirtschaftlichen Industrie und Kunststoffindustrie.
- Besonders bevorzugte polarisierte ungesättigte Verbindungen sind beispielsweise die oben erwähnten Verbindungen 3,4-Dihydropyran und seine Derivate , wie 3,4-Dihydro-2-methoxy-2H-pyran, 3,4-Dihydro-2-ethoxy-2H-pyran, 3,4-Dihydro-2-phenoxy-2H-pyran, 3,4-Dihydro-2-fomtyl-2H-pyran und seine Homologen, wie 2,3-Dihydrofuran und Derivate hiervon. Das 3,4-Dihydro-2-formyl-2H-pyran wird durch die Diels-Alder-Dimerisierung von Akrolein bei hohen Temperaturen und Drücken gewonnen. Die 3,4-Dihydro-2-alkoxy-2H-pyrane und 3,4-Dihydro-2-phenoxy-2H-pyrane werden durch die Umsetzung des entsprechenden Vinylethers mit Akrolein in Gegenwart einer katalytischen Menge eines Zinksalzes, zum Beispiel Zinkchlorid, hergestellt. Eine Vielzahl von 3,4-Dihydro-2H-pyranen mit einem Substituenten in der 2-Stellung kann durch ähnliche Umsetzungen hergestellt werden. Die durch die Reaktion von 1 und 2 Mol Akrolein mit dem Divinylether eines Alkylen- oder Polyalkylenglykols gebildeten Produkte sind auch Blockiermittel. Die aus den Di-(3,4-dihydropyranyl)-ethern gewonnenen latenten Mercaptane haben auch das Potential, chelatisierende Mittel in den Polymerzusammensetzungen dieser Erfindung zu sein. In dem Fall der Umsetzung von einem Mol Akrolein je Mol eines Divinylethers erlaubt die Vinylethergruppe des resultierenden Monomers, dass das Produkt in ein Vinylchloridcopolymer geführt wird, worauf die Addition eines Mercaptans über die Doppelbindung des Pyranringes folgt, um ein latentes Mercaptan zu ergeben, das ein integraler Stabilisator für das Polymer ist. Die Umsetzung von einem Mol Akrolein mit einem Mol des Divinylethers gestattet auch die Bildung eines monomeren latenten Mercaptans des Mercaptan/Tetrahydropyranadduktes, in welchem die Vinylethergruppe des resultierenden Monomers erlaubt, dass das copolymerisierende Produkt mit einem oder mit mehreren von einer großen Vielzahl ethylenisch ungesättigter Verbindungen und Bildung latenter polymerer Mercaptane zu copolymensieren. Das Produkt aus der Umsetzung von Akrolein mit Chlorethylvinylether ergibt ein substituiertes 3,4-Dihydropyran, das weiter derivatisiert werden kann. Die Zugabe eines Mercaptans über der Doppelbindung des Pyranringes kann in Gegenwart des Zinksalzkatalysators vorgenommen werden, um eine Stabilisatorzusammensetzung dieser Erfindung zu ergeben.
- Im Allgemeinen ist das Verfahren zu Addition der Mercaptogruppe eines freien Mercaptans an der Doppenbindung des Pyranringes kann in Gegenwart des Zinksalzeskatalysators geschehen, um eine Stabilisatorzusammensetzung nach dieser Erfindung zu bekommen.
- Im Allgemeinen ist das Verfahren zu Addition der Mercaptogruppe eines freien Mercaptans an den Doppelbindungen polarisierter ungesättigter Verbindungen folgendermaßen:
Zu einem gerührten Gemisch des Mercaptans, des Säurekatalysators und gegebenenfalls eines kleinen Prozentsatzes an Antioxidationsmittel zur Hemmung von Radikalreaktionen wird unter einer Stickstoffatmosphäre tropfenweise die polarisierte ungesättigte Verbindung entweder pur oder in Lösung tropfenweise zugegeben, während die Temperatur zwischen 10° und 70°C gehalten wird. Das Gemisch oder die Lösung wird dann 1 bis 6 Stunden auf 35° bis 70°C erwärmt, und die Umwandlung zu einem Produkt wird gaschromatographisch und durch Jodtitration für SH überwacht. Der Säurekatalysator wird durch eine alkalische Waschflüssigkeit entfernt, und das resultierende Produkt wird mit Magnesiumsulfat getrocknet. Das Lösungsmittel wird, wenn erforderlich, unter reduziertem Druck bei <50°C entfernt, um das latente Mercaptan zu liefern. Ein Katalysator in fester Phase kann verwendet werden und dann aus dem Reaktionsgemisch wegfiltriert und für die Verwendung in einer nachfolgenden Synthese regeneriert werden. Auf diese Weise wird eine Waschstufe eingespart. Dieses generalisierte Verfahren wird nachfolgend als das Verfahren A bezeichnet. - Mercaptoethyldecanoat (oder Mercaptoethylcaproat oder Mercaptoethyltallat) reagiert mit 3,4-Dihydropyran in jenem Verfahren und ergibt 2-S-(tetrahydropyranyl)-thioethyldecanoat (oder 2-S-tetrahydropyranyl)-thioethylcaproat oder 2-S-(Tetrahydropyranyl)-thioethyltallat). Auf diese Weise bilden die entsprechenden Caprat-, Oleat- und Tallatester die entsprechenden Cyclohexylether. Auch Inden wird durch die Zugabe des Mercaptoethanols zu 2-H-Dihydroindenylthioethanol umgewandelt.
- Ein verallgemeinertes Verfahren für die Kondensation eines freien Mercaptans mit einer stabilen halogenhaltigen Verbindung ist folgendes:
Zu einem gerührten Gemisch des Mercaptans und der halogenhaltigen Verbindung unter Stickstoffatmosphäre wird tropfenweise eine Lösung von Natriummethoxid in Methanol zugegeben, während die Temperatur unter 50°C gehalten wird. Gegebenenfalls läßt man die Reaktion ohne Zugabe einer Basenquelle voranschreiten, und die freigesetzte Chlorwasserstoffsäure wird durch Spülen mit Stockstoffgas entfernt und mit Verwendung eines äußeren sauren Gaswäschers neutralisiert. Das Gemisch oder die Lösung wird dann zwischen 2 bis 24 Stunden auf 50° – 70°C erwärmt, und die Umwandlung in das Produkt wird durch Gaschromatographie und Jodtitration bezüglich des Prozentsatzes SH überwacht. Das Produkt wird dann neutralisiert, mit Wasser gewaschen, mit Magnesiumsulfat getrocknet und filtriert. Das Lösungsmittel wird gegebenenfalls unter vermindertem Druck bei < 50°C reduziert, um das latente Mercaptan zu ergeben. Dieses verallgemeinerte Verfahren wird hier als Verfahren B bezeichnet. - Ein verallgemeinertes Verfahren zur Kondensation eines freien Mercaptans mit einer labilen hydroxylhaltigen Verbindung ist folgendes:
Zu einer gerührten Lösung des Mercaptans, des sauren Katalysators und des Lösungsmittels wird unter einer Stickstoffatmosphäre die hydroxyhaltige Verbindung entweder nackt oder in Lösung zugegeben, während die Temperatur auf < 45°C gehalten wird. Die Lösung wird dann auf 45° – 75°C zwischen 1 und 10 Stunden erhitzt, und die Umwandlung des Produktes wird durch Gaschromatographie und Jod-Titration bezüglich des Prozentsatzes von SH überwacht. Gegebenenfalls wird ein azeotropes Lösungsmittel zur Entfernung von Reaktionswasser durch ein geeignetes Mittel bei Rückflußtemperaturen, typischerweise 60° bis 120°C, ausgewählt. Die Vervollständigung der Reaktion erreicht man nach der theoretischen Menge von Wasser, das aufgefangen wurde. Der Säurekatalysator wird durch eine Alkaliwaschung entfernt, und die resultierende Lösung wird über Magnesiumsulfat getrocknet und filtriert. Das Lösungsmittel wird unter vermindertem Druck bei < 55°C entfernt, um das latente Mercaptan zu ergeben. Dieses Verfahren wird nachfolgend als Verfahren C bezeichnet. - Ein verallgemeinertes Verfahren für die Reaktion eines freien Mercaptans mit einem Glycidylether ist folgendes:
Zu einem gerührten Gemisch des Mercaptans und des Säurekatalysators unter einer Stickstoffatmosphäre wird der Glycidylether zugegeben, entweder nackt oder in Lösung, während die Temperatur zwischen 25° – 60°C gehalten wird. Das Gemisch oder die Lösung wird dann auf 50° – 75°C während einer Zeitdauer von 1 bis 6 Stunden erhitzt und die Umwandlung zum Produkt wird durch Gaschromatographie und Jodtitration bezüglich des Prozentsatzes von SH überwacht. Der Säurekatalysator wird durch die alkalische Waschung entfernt, das resultierende Produkt wird mit Magnesiumsulfat getrocknet und filtriert. Das Lösungsmittel wird gegebenenfalls unter vermindertem Druck bei < 55°C entfernt und ergibt das latente Mercaptan. Beispielsweise ergibt die Reaktion zwischen Mercaptoethanol und Gycidylneodecanoat C9H19C(=O)OCH2CH(OH)CH2SCH2CH2OH. Dieses Verfahren wird nachfolgend als Verfahren D bezeichnet. - Ein verallgemeinertes Verfahren zur Kondensation eines freien Mercaptans mit einem Aldehyd ist folgendes:
Zu einer gerührten Lösung des Mercaptans, Säurekatalysators und azeotropen Lösungsmittels wird unter einer Stickstoffatmosphäre Aldehyd unter Erhitzen auf Rückflußbedingungen, typischerweise zwischen 65° – 120°C, zur Entfernung von Reaktionswasser zugegeben. Vervollständigung der Reaktion erreicht man, nachdem die theoretische Menge von Wasser aufgefangen wird. Gegebenenfalls wird zu einer gerührten Lösung von Mercaptan, Aldehyd und Ether BF3-Etherat tropfenweise unter Rückflußbedingungen zugesetzt. Die Lösung wird 1 bis 6 Stunden unter Rückfluß erhitzt, und die Umwandlung in das Produkt wird durch Gaschromatographie überwacht. Der Säurekatalysator wird durch alkalische Waschung entfernt, die Lösung wird mit Magnesiumsulfat getrocknet und filtriert. Das Lösungsmittel wird unter vermindertem Druck bei < 56°C entfernt, um das latente Mercaptan zu ergeben. Dieses verallgemeinerte Verfahren wird nachfolgend als Verfahren E bezeichnet. - Beispiele der blockierten Mercaptane nach dieser Erfindung schließen Verbindungen der folgenden Formeln ein, da jede der Formel I entspricht.
- a = 0, m = 0, n = 0, y = 1, X ist Phenyl, R4 und R3 bedeuten Wasserstoff und R1 ist Mercaptoethoxycarbonylmethyl.
- a = 1, m = 0, n = 0, Y = 1, z ist 1; X ist Sauerstoff, R5 und R7 sind verbunden, um die Form -CH2-CH2-CH2-CH2- zu bilden; R4 ist Wasserstoff und R1 Decanoyloxyethyl.
- Die in Kombination mit den latenten Mercaptanen in der Praxis dieser Erfindung verwendeten Verbindungen sind freie Phenylsalicylatverbindungen. Der Begriff „freies Phenylsalicylat", wie hier verwendet, bedeutet, daß das Phenylsalicylat unabhängig verwendet wird, d.h. physikalisch in der Stabilisatorzusammensetzung nach dieser Erfindung gebunden ist, statt als ein Ligand vorgesehen zu werden, der direkt an ein Zinnatom gebunden ist.
- Die für die Zwecke dieser Erfindung geeigneten Phenylsalicylate werden durch die Formel 2 wiedergegeben: worin R20 und R21 jeweils unabhängig voneinander unter Wasserstoff, einer Alkyl-, Phenyl-, Alkoxy-, Phenoxy-, Alkylcarboxy-, Hydroxyl-, Halogen-, Carboxyl-, Benzoyl-, Glycidyl-, Glycidylamino-, Alkylamino-, Amido-, Hydroxypolyalkoxy-, Alkoxypolyalkoxy- oder Acyloxypolyalkoxyrest ausgewählt sind, x eine ganze Zahl von 1 bis 4 bedeutet und y eine ganze Zahl von 1 bis 5 ist. Bevorzugte Phenylsalicylate sind jene der Formel 2, worin R20 Wasserstoff und x ist 4 und jedes R21 ein Wasserstoffatom ist und y 5 bedeutet oder R21 ein Alkylrest mit 1 bis 12 Kohlenstoffatomen und y 1 ist.
- Phenylsalicylatverbindungen sind beispielhalber Phenylsalicylat, 2'-Dodecylphenylsalicylat, 4'-Methoxyphenylsalicylat, 4-Methoxyphenylsalicylat, 4'-Chlorphenylsalicylat, 4-Acetamidophenylsalicylat, 1-Hydroxy-2-phenylnaphthoat, 5-Chlorphenylsalicylat und 4-H-Glycidylaminophenylsalicylat, die geeignet sind, obwohl Phenylsalicylat und 2'-Dodecylphenylsalicylat die bevorzugten Strukturen haben. Das (') bezeichnet R21-Substituenten und die R20-Substituenten sind ohne Apostroph. Die Fachleute werden verstehen, daß Derivate der Phenylsalicylate, wie beispielsweise entsprechende Anilid- oder Pyridinylstrukturen auch verwendet werden können, obwohl derzeit solche Derivate im Hinblick auf ihre relativ niedrige Hitzebeständigkeit nicht bevorzugt sind.
- Diese Phenylsalicylate können nach Standardtechniken hergestellt werden und sind bekannt.
- Bei Verwendung in den obigen Formeln und in dieser ganzen Beschreibung sind die angegebenen organischen Reste, wenn nichts anderes angezeigt ist, geradkettig oder verzweigtkettig und enthalten beispielsweise etwa 1 bis 20 Kohlenstoffatome, und der Begriff Poly bezeichnet zwei oder mehr sich wiederholende Einheiten des bezeichneten Restes.
- Wie oben festgestellt, umfassen die Stabilisatorzusammensetzungen nach der vorliegenden Erfindung ein latentes Mercaptan als den einzigen Stabilisator oder in einem System, welches einen Stabilisator auf Metallbasis umfaßt, eine Lewissäure, einen Stabilisator auf organischer Grundlage oder einen Stabilisator auf Hydrotalcitbasis im Gemisch mit dem latenten Mercaptan. Stabilisatoren auf Metallbasis sind für die vorliegende Erfindung als Metallsalzstabilisatoren und metallorganische Stabilisatoren definiert. Metallsalze sind so definiert, daß sie Oxide, Hydroxide, Sulfide, Sulfate, Chloride, Bromide, Fluoride, Jodide, Phosphate, Phenate, Perchlorate, Carboxylate und Carbonate einschließen. Die Metallsalzstabilisatoren sind beispielsweise Barium-, Strontium-, Calcium-, Cadmium-, Zink-, Blei-, Zinn-, Magnesium-, Cobalt-, Nickel-, Titan-, Antimon- und Aluminiumsalze von Phenolen, aromatischen Carbonsäuren, Fettsäuren, epoxidierten Fettsäuren, Oxalsäure, Carbonsäure, Schwefelsäure und Phosphorsäure. Calciumstearat, Calcium-2-ethylhexanoat, Calciumoctoat, Calciumoleat, Calciumricinoleat, Calciummyristat, Calciumpalmitat, Calciumlaurat, Bariumlaurat, Bariumstearat, Barium-di-(nonylphenolat), Magnesiumstearat, Zinkstearat, Zinkoctoat( oder -caprylat), Zink-2-Ethylhexanoat, Zinkstearat, Zinklaurat, Zinkoxid, Zinkchlorid, Zinkhydroxid, Zinksulfid, Zinksulfat, Zinkbromid, Cadmiumlaurat, Cadmiumoctoat, Cadmiumstearat, Natriumstearat und andere Metallseifen der Gruppe I und II sind Beispiele geeigneter Salze. Andere Metallsälze, wie Bleistearat, Zinnstearat, Aluminiumstearat und Hydrotalcit etwa können auch verwendet werden. Metallsalzstabilisatoren können etwa 0,01 bis etwa 10 Gew.-%, vorzugsweise 0,1 bis 5 Gew.-% des halogenhaltigen Harzes ausmachen.
- Herkömmliche Organo-Metallstabilisatoren schließen die Organozinn-Carboxylate und -Mercaptide ein. Solche Materialien enthalten Butylzinn-tris-dodecylmercaptid, Dibutylzinn-dilaurat, Dibutylzinn-Didodecylmercaptid, Dianhydrid-tris-dibutylstannandiol, Dihydrocarbon-Zinnsalze von Carboxymercaptalen, wie jenen, die in Heckenbleikner et al. (US-Patentschrift 3,078,290) beschrieben sind. Es können irgendwelche Vinylchloridharzstabilisatoren eingeschlossen werden, die in Salyer (US-Patent No. 2,985,617) beschrieben sind.
- Bevorzugte Organozinn-Mercaptide sind beispielhalber Mono- und Di-C1-C12-Alkylzinnmercaptide von Alkylthioglycolaten, wie Monometylzinn-tris-(2-methylhexylthioglycolat), Dimethylzinn-bis-(2-ethylhexylthioglycolat), Monobutylzinn-tris-(2-methylhexalthioglycolat), Dibutylzinn-bis-(2-ethylhexylthioglycolat), Monooctylzinn-tris-(2-ethylhexylthioglycolat) und Dioctylzinn-bis-(2-ethylhexylthioglycolat) sowie Mono- und Di-C1 bis C12-Alkylzinnmercaptide von Mercaptoalkylcarboxylaten, wie Monomethylzinn-tris-(mercaptoethyloleat), Dimethylzinn-bis-(mercaptoethyloleat), Monobutylzinntris-(mercaptoethylpelargonat) und Dibutylzinn-bis-(mercaptoethylpelargonat). Bevorzugte Organozinncarboxylate sind beispielhalber Mono- und Di-C1-C12-Alkylzinncarboxylate, wie Monobutylzinntris-(dodecylmaleat), Dibutylzinn -bis-(butylmaleat), Diethylzinnazelat, Diethylzinndilaurat, Dimethylzinndibenzoat, Dimethylzinn-bis-(butylcarbitolmaleat) und Dimethyl-bis-(tetraethylenglycolmaleat) sowie oligomere und polymere Salze hiervon. Besonders brauchbar in der Praxis dieser Erfindung sind Gemische von Mono- und Dialkylzinnmercaptiden.
- Die Mono-organozinnverbindungen, die in den Zusammensetzungen dieser Erfindung brauchbar sind, können nach bekannten Methoden hergestellt werden, wie durch Umsetzung eines Mono- oder Dialkylzinnchlorids mit einem Mercaptoalkylcarboxylat oder einem Alkylthioglycolat in Gegenwart einer Base, um Chlorwasserstoffsäure auszuwachsen. Methylzinntrichlorid, Dimethylzinndichlorid, Butylzinntrichlorid, Dibutylzinndichlorid, Ethylhexylzinntrichlorid und Dioctylzinndichlorid sind Beispiele von Organo-Zinnhalogeniden, die geeignet für die Herstellung brauchbarer Stabilisatoren für diese Erfindung sind. Siehe beispielsweise die US-Patentschriften 3,565,930, 3,869,487, 3,979,359, 4,118,371, 4,134,878 und 4,183,846, die alle durch Bezugnahme hier eingeführt werden.
- Monosulfide und/oder Polysulfide der Organozinn-Mercaptide von Mercaptoalkylcarboxylaten und/oder Alkylthioglycolaten sind auch geeignet als Stabilisatoren auf Metallbasis in den Zusammensetzungen dieser Erfindung, um die Beständigkeit gegen halogenhaltige Polymere sowie Verschlechterung zu verbessern, wenn man auf 350°F (177°C) während der Verarbeitung erhitzt. Diese Sulfide werden durch Erhitzen stöchiometrischer Mengen eines Mercaptoalkylesters oder Alkylthiocarboxylats und eines Organozinnchlorids in Wasser und Ammoniumhydroxid bis etwa 30°C, langsame Zugabe eines Alkalimetall-Mono- oder -Polysulfids und Erhitzen des Reaktionsgemisches weiter bis etwa 45°C vor der Abtrennung des Produktes von diesem Gemisch hergestellt. Alternativ kann das Sulfid durch Vermischen eines Monoalkyl- oder Dialkylzinnsulfids mit einem Organozinn mercaptid und durch andere Verfahren, die in der Stabilisatortechnik wohlbekannt sind, hergestellt werden.
- Die Sulfide der Alkylzinnmercaptocarbonsäureester oder Mercaptoalkylcarbonsäureester können durch ein Gleichgewichtsgemisch eines oder mehrerer Alkylzinnhalogenide, eines oder mehrerer Organozinn-Mercaptide und eines oder mehrerer Alkylzinnmono- oder -polysulfide oder Oligomere hiervon gekennzeichnet werden. Es sollte verstanden werden, daß die Strukturen der nach den oben erwähnten Verfahren hergestellten Sulfide sehr komplex sind. Die Reaktionen, so nimmt man an, sind dazu da, ein Gleichgewichtsgemisch herzustellen, das aus mehreren verschiedenen, aber verwandten Produkten besteht. Wie durch jene gewöhnlichen Chemiefachleute auf der Hand liegt, enthalten Gleichgewichtsgemische von Haus aus die Ausgangsmaterialien sowie die Produkte irgendeiner Reaktion zwischen Ihnen. Die chemische und Patentliteratur enthalten zahlreiche Beispiele, die demonstrieren, daß Glieder unterschiedlicher Klassen von Organozinnverbindungen miteinander unter bestimmten Bedingungen reagieren können, um Produkte zu erzeugen, die ein oder mehrere Zinnatome enthalten, worin wenigstens ein Teil der Zinnatome an unterschiedliche Kombinationen von Resten gebunden ist, und zwar an andere, als mit denen sie zusammengemischt wurden. Demnach wird angenommen, daß die Sulfide-bis-(monoorganozinn)-bis-(thioalkylcarboxylat)], Monosulfide und Polysulfide, Bis-[(diorganozinn)-mono-(thioalkylcarboxylat)]-monosulfide und -polysulfide sowie Produkte einschließen, die während der Gleichgewichtseinstellung Reaktionen unter den Mono- und Polysulfiden, einschließlich Monoalkylzinn-tris-(dioalkylcarboxylate), Diealkylzinn-bis-(thioalkylcarboxylate), Mono- und Diorgano-Zinn-Mono- und -Polysulfide und Oligomere hiervon sowie Ausgangsmaterialien selbst einschließen.
- Von dem Sulfidalkylesters einer Mercatocarbonsäure wird ebenfalls angenommen, dass er gleichermaßen Bis-[monoorganotin)-bis-(alkylmercaptocarboxylat)]-monosulfide und -polysulfide, Bis-[(diorganozinn)-mono-(thioalkylcarboxylat)]-monosulfide und -polysulfide, wie Produkte, die während der Gleichgewichtsreaktionen unter den Mono- und Polysulfiden einschließlich Monoalkylzinn-tris-(alkylmercaptocarboxylaten), Dialkylzinn-bis-(alkylmercaptocarboxylaten), Mono- und Di-organozinnmono- und -polysulfid sowie Oligomere hiervon auftauchen, enthält
- Die Polysulfide enthalten Gemische von Verbindungen mit 2 bis 10 Schwefelatomen, die miteinander verbunden sind. Gemische von Monosulfiden und Polysulfiden mit 2 bis 4 Schwefelatomen sind bevorzugt.
- Die organometallischen Stabilisatoren können etwa 0,01 bis etwa 10 %, vorzugsweise 0,1 – 5 Gew.-% des halogenhaltigen Harzes ausmachen.
- Andere Stabilisatoren, die in Kombination mit dem latenten Mercaptan verwendet werden können, sind beispielsweise Lewis-Säuren. Die Lewis-Säuren sind beispielsweise Bortrifluorid, Aluminium chlorid, Zinkchlorid und Methylzinntrichlorid. So gibt es etwas Überlappungen zwischen den Metallsalzen und den Lewis-Säuren, die in der vorliegenden Erfindung brauchbar sind. Die synergistischen Mengen der Lewis-Säuren für die Zwecke dieser Erfindung sind von etwa 0,005 bis 0,5 %, vorzugsweise von 0,01 bis etwa 0,1 Gew.-% des halogenhaltigen Harzes. Die Lewis-Säuren und die Stabilisatoren auf Metallbasis können in Kombination miteinander verwendet werden.
- Herkömmliche nicht metallische Stabilisatoren können auch in die Stabilisatorzusammensetzungen der vorliegenden Erfindung eingeschlossen werden, um die Eigenschaften des halogenhaltigen Harzes zu unterstützen und zu verbessern. So können dort 0,01 bis 10 %, vorzugsweise 0,1 bis 5 % auf der Basis halogenhaltigen Harzes von schwefelhaltigen Verbindungen, wie Dilauryl-thiodipropionat, Distearyl-3,3'-thiodipropionat, Dicyclohexyl-3,3-thiodipropionat, Dioleyl-3,3'-thiodipropionat, Dibenzyl-3,3'-thiodipropionat, Didecyl-3,3'-thiodipropionat, Dibenzyl-3,3'-thiodipropionat, Diethyl-3,3'-thiopropionat, Laurylester von 3-methylmercaptopropionssäure, Laurylester von 3-butylmercaptopropionssäure, Laurylester von 3-laurylmercaptopropionssäure und Phenylester von 3-octylmercaptopropionssäure.
- Zusätzlich zu den Stabilisatorzusammensetzungen dieser Erfindung können in die halogenhaltigen organischen Polymere herkömmliche Additive, wie Weichmacher, entsprechend den obigen Ausführungen in Bezug auf flexible PVC Blasmittel, Farbstoffe, Co-Ultraviolettlichtabsorbierende Reinigungsmittel, Antioxidantien, Verdichtungsmittel, Biozide, Schlagmodifiziermittel, Verfahrenshilfen, Co-Stabilisatoren, Toner und dergleichen.
- Die halogenhaltigen Polymerzusammensetzungen, die durch die Stabilisatorzusammensetzungen nach dieser Erfindung stabilisiert werden, sind allgemein auf klare Rezepturen beschränkt. Diese Rezepturen enthalten somit wenig oder keine Pigmente oder Füllstoffe, die sie opak machen. Obwohl keine Bindung an eine spezielle Theone erfolgen soll, wird doch angenommen, dass in klaren Rezepturen genügend Energie (hv) vorliegt, um eine Photo-Fries-Umlagerung in-sito der Phenylsalicylatverbindung zu ihrer entsprechenden, funktionell aktiven Benzophenontypstruktur umzuwandeln, die hohe Prozentsätze an Ultraviolettstrahlungen durch die klare Polymerzusammensetzung hindurch absorbieren kann. Obwohl in pigmentierten oder gefüllten (d. h. opaken) Rezepturen angenommen wird, dass Photo-Fries-Umlagerung der Phenylsalicylatverbindung in ihre funktionell aktive Form das meiste verhindert.
- Ein Antioxidationsmittel kann in einer Menge von 0,01 bis 10 Gew.-%, vorzugsweise 0,1 bis 5 Gew.-% des Harzes zugegeben werden. Phenolische Antioxidationsmittel sind besonders geeignet und beispielsweise 2,6-Di-t-butyl-p-cresol, butyliertes Hydroxyanisol, Propylgallat, 4,4'-Thio-bis-(6-t-butyl-m-cresol), 4,4'-Cyclohexyliden-diphenol, 2,5-Di-t-amyl-hydrochinon, 4,4'-Butyliden-bis(6-t-butyl-m-cresol=, Hydrochinon-monobenzylether, 2,2'-Methylen-bis-(4-methyl-6-t-butyl-phenol), 2,6-Butyl-4-decyloxyphenol, 2-t-Butyl-4-dodecyloxyphenol, 2-t-Butyl-4-octadecyloxyphenol, 4,4'-Methylen-bis- (2,6-di-t-butylphenol), p-Aminophenol, N-Lauryloxy-p-aminophenol, 4,4'-thiobis-(3-methyl-6-t-butylphenol), bis-[o-(1,1,3,3-Tetramethylbutyl)-phenol]-sulfide, 4-Acetyl-β-resorcylsäure, A-Stufen-p-t-butylphenolformaldehyd-Harz, 4-Dodecyloxy-2-hydroxybenzophenon-Harz, 3-Hydroxy-4-(phenylcarbonyl)-phenyl-palmitat, n-Dodecylester von 3-Hydroxy-4-(phenylcarbonyl)-phenoxyessigsäure und t-Butyl-phenol.
- Die Verwendung von Epoxy-Co-Stabilisatorverbindungen in einer Menge von 0,01 bis 30 % der Polymerzusammensetzungen ist auch wertvoll. Beispiele solcher Epoxy-Verbindungen sind etwa epoxidiertes Sojabohnenöl, epoxidiertes Schmalzöl, epoxidiertes Olivenöl, epoxidiertes Leinsamenöl, epoxidiertes Rizinusöl, epoxidiertes Erdnussöl, epoxidiertes Maisöl, epoxidiertes Tungöl, epoxidiertes Baumwollsamenöl, Epichlorhydrin/Bisphenol A-Harze, Phenoxypropylenoxide, Butoxypropylenoxide, epoxidiertes Neopentylenoleat, Glycidyl-epoxystearat, epoxidierte α-Olefine, epoxidiertes Glycidylsoyat, Dicyclopentadiendioxide, epoxidiertes Butyltoluat, Styrol-oxid, Dipentendioxid, Glycidol, Vinylcyclohexendioxid, Glycidylether von Resorcin, Glycidoether von Hydrochinon, Glycidylether von 1,5-Dihydroxynaphthalin, epoxidiertes Leinsamenöl, Fettsäuren, Allylglycidylether, Butylglycidylether, Cyclohexanoxid, 4-(2,3-epoxypropoxy)-acetophenon, Mesityloxidepoxid, 2-ethyl-3-propylglycidamid, Glycidylether von Glyzerin, Pentaerythrit und Sorbit sowie 3,4-Epoxycyclohexan-1,1-dimethanol-bis-9,10-epoxystearat.
- Gleichermaßen können organische Phosphite in einer Menge von 0,01 bis 10 %, vorzugsweise 0,1 bis 5 % des halogenhaltigen Harzes verwendet werden. Die organischen Phosphite enthalten ein oder mehrere bis zu insgesamt drei Aryl-, Alkyl-, Aralkyl- und Alkary-Gruppen in jeder Kombination. Der Begriff "Trialkylaryl" ist inklusive Alkyl-, Aryl-, Alkaryl- und Aralkyl-phosphiten, die in irgendeine der Alkyl-, Aryl-, Alkaryl- und Aralkyl-Gruppen gehören. Beispiele sind Triphenylphosphit, Tricresylphosphit, Tri-(dimethylphenyl)-phosphit, Tributyl-phosphit, Trioctyl-phosphit, Tridodecyl-phosphit, Octyl-diphenyl-phosphit, Dioctyl-phenyl-phosphit, Tri-(octylphenyl)-phophit, Tri-(nonylphenyl)-phophit, Tribenzyl-phophit, Butyl-dicreasyl-phophit, Octyl-di-(octyl-phenyl)-phosphit, Tri-(2-ethylhexyl)-phosphit, Tritolyl-phosphit, Tri-(2-cyclohexylphenyl)-phophit, Tri-alpha-naphthyl-phosphit, Tri-(phenylphenyl)-phosphit und Tri-(2-phenylethyl)-phosphit.
- Gleichermaßen können Polyolstabilisatoren für Vinylchloridharze in einer Menge von 0,01 bis 10 Gew.-% eingeschlossen werden. So kann Glyzerin, Sorbitol, Pentaerythrid und Mannitol sowie Polyether, wie Diethylenglycol, Triethylenglycol, Tetraethylenglycon, Tripropylenglycon und so weiter enthalten sein.
- Stickstoffhaltige Stabilisatoren, wie Dicyandiamid, Melamin, Harnstoff, Formoguanamin, Dimethylhydantoin, Guanidin, Thio-Harnstoff, 2-Phenylindole, Aminocrotonate, N-Alkyl- und N-Phenyl- substituierte Maleimide, worin die Alkylgruppe 1 bis 4 Kohlenstoffatome hat, Uracil und so ähnlich Verbindungen können auch in Mengen von 0,1 bis 10 Gew.-% des halogenhaltigen Harzes eingearbeitet werden. Besonders interessant für Verbindungen sind die 1,3-Dialkyl-6-aminouracilderivate, die in der deutschen Offenlegungsschrift 19,741,778 von Ciba Specialty Chemicals Holding Inc. beschrieben wurden, und die Pyrrolodiazindione, die in der veröffentlichten australischen Patentanmeldung No. AU-A-48232/96 von Ciba-Geigy beschrieben wurden, und diese können auch in Mengen von 0,1 bis 10 Gew.-% eingearbeitet werden. Besonderes Interesse erregen die Pyrrolodiazindione, die durch die Formel: beschrieben werden, worin R➀, R➁, R➂ und R➃ unabhängig Wasserstoff oder C1-C4-Alkyl bedeuten. Beispiele für die genannten Verbindungen, wie sie in dieser Erfindung gebraucht werden schließen die 1H-Pyrrolo-[2,3-d]-pyrimidin-2,4-(3H, 7H)-dione ein, die als Verbindungen Nr. 103, 111, 123, 129 und 131 der genannten australischen Patentanmeldung, welche die folgenden Substituenten haben:
Nr. 103 1,3,6-Trimethyl, Nr. 111 1,3,6,7-Tetramethyl Nr. 123 keine, Nr. 129 1,3-Diethyl,6-methyl, Nr. 131 1,3-Di-n-butyl,6-methyl. - Die genannten Verbindungen können durch die von S. Senda und K. Hirota, Chem. Pharm. Bull., 22(7), 1459-1467(1974) beschriebene Methode hergestellt werden oder durch die Reaktion des entsprechenden Aminouracil mit molaren Überschüssen von Chloracetaldehyd und Ammoniumacetat in Wasser bei etwa 65°C bis sich ein Niederschlag bildet, oder mit molaren Überschüssen von Acetoxyaceton und Ammoniumacetat in Wasser bei Rückfluss während 12 Stunden. Die deutsche Offenlegungsschrift 19,741,778 und die australische Patentanmeldung No. AU-A-48232/96 werden hier jeweils durch Bezugnahme einbezogen.
- Es können selbst herkömmliche Schmiermittel für Vinylchloridharze eingearbeitet werden, wie niedermolekulare Polyethylene, d. h. Polyethylenwachs, Fettsäureamide, z. B. Lauramid und Stearamid, Bisamide, z. B. Decamethylen, Bisamid und Fettsäureester, z. B. Butylstearat, Glycerylstearat, Leinsamenöl, Palmenöl, Decyloleate, Maisöl, Baumwollsamenöl, hydriertes Baumwollsamenöl usw.
- Die Stabilisatorzusammensetzungen dieser Erfindung können durch Vormischen ihrer Komponenten in irgendeiner bequemen Weise, die ein homogenes Gemisch produziert, wie durch Schütteln oder Rühren in einem Behälter hergestellt werden. Gleichermaßen können die stabilisierten Zusammen setzungen nach dieser Erfindung in das halogenhaltige organische Polymer durch Zumischen der Stabilisatorzusammensetzung und des Polymers beispielsweise in einer geeigneten Mühle oder in einem geeigneten Mischer oder durch irgendeine andere bekannte Methode zugemischt werden, die eine gleichmäßige Verteilung des Stabilisators in dem gesamten Polymer ergibt.
- Die Stabilisatorzusammensetzungen nach dieser Erfindung werden in einer ausreichenden Menge verwendet, um halogenhaltigen organischen Polymeren die erwünschte Widerstandsfähigkeit gegen Hitzeverschlechterung zu verleihen. Es wird leicht verständlich für einen der diesem Gebiet Fachmann ist, dass die genaue Menge der verwendeten Stabilisatorzusammensetzung von mehreren Faktoren abhängt einschließlich, aber nicht ausschließlich von dem verwendeten teilchenförmigen halogenhaltigen organischen Polymer, der Temperatur, welcher das Polymer ausgesetzt wird, und der möglichen Anwesenheit anderer stabilisierender Verbindungen. Im Allgemeinen wird die Menge an Stabilisatorzusammensetzungen, die erforderlich ist, umso größer sein, je länger einem Abbau widerstanden sein muss. Allgemein werden sowenig wie etwa 0,4 Gew.-%, bezogen auf das Gewicht des halogenhaltigen organischen Polymers, wirksam sein. Obwohl es keine kritische obere Grenze für die Menge der Stabilisatorzusammensetzung gibt, welche verwendet werden kann, ergeben doch Mengen oberhalb etwa 4 Gew.-%, bezogen auf das Gewicht von halogenhaltigem Polymer keine weitere Steigerung der Effektivitätsmessungen mit der verwendeten zusätzlichen Stabilisatormenge.
- Die folgenden Beispiele erläutern weiter die Herstellung eines exemplarischen latenten Mercaptans, die Herstellung von Stabilisatorzusammensetzungen nach dieser Erfindung und die Vorteile, dieser Stabilisatorzusammensetzungen in klaren halogenhaltigen Polymerzusammensetzungen. Wenn nichts anderes angegeben ist, sind die Stabilisatorkomponenten und andere Hilfsbestandteile in Gewichtsteilen je 100 Teile des halogenhaltigen Harzes angegeben ("phr").
- Beispiel 1
- Herstellung eines latenten Mercaptans
- 2-S-Tetrahydropyranyl)-thioethyltallat wurde durch Zugabe von 172,45 Gramm (2,05 Äquiv.) von 3,4-Dihydro-(2H)-pyran tropfenweise zu 760,00 Gramm (2,00 Äquiv.) von 2-Mercaptoethyltallat (8,70 % SH durch jodometrische Titration) mit einem Gehalt von 0,93 Gramm von Methansulfonsäure (70 % aktive) über eine Zeitdauer von 45 Minuten unter einer Stickstoffatmosphäre und bei einer Temperatur zwischen 25° und 35°C und erhitzen auf 35° bis 40°C während 2 Stunden hergestellt. Nach dem Kühlen der Lösung wurden 3 Gramm Norite-Ruß zugeführt, und das Produkt wurde der Vakuumfiltration unterzogen und ergab 932 Gramm gelbe Flüssigkeit mit einem SH-Gehalt von weniger als 0,4 %, bestimmt durch Titration mit 0,100 N-Jodlösung in Isopiopanol. Das 'H-NMR-Spektrum (CDC13,δ) war: 2,3 (2H, t, -C(=O)-CH-CH2-), 2,8 (2H, m, -S-CH 2-CH2-), 4,3 (2H, m, (-CC(=O)-O-CH 2), 4,9 (1H, m, -O-CH(-S-CH2)-CH2-CH2-). Das GC des Prodktes (1 % in Ether) zeigte einen Primärproduktpiek bei 26,3 Minuten alte Zeit (50-300°C; 10°C/min.; aufgespaltener Fluss, Injektor/FID).
- Beispiele 2 – 5
- Herstellung von starren klaren PVC-Zusammensetzungen
- (Beispiel 2 und 3 sind Vergleichsbeispiele)
- Die folgenden Bestandteile wurden miteinander in den angegebenen Mengen vermischt, um vier klare Polyvinylchloridzusammensetzungen zu bekommen, die ersten beiden wurden mit einem latenten Mercaptan alleine stabilisiert und die letzteren beiden mit einem latenten Mercaptan in Kombination mit einer Phenylsalicylatverbindung gemäß der Erfindung.
- Jede resultierende Polymerzusammensetzung wurde dann zu einem Plättchen geformt und hinsichtlich der Stabilität gegen Licht und Bewitterung getestet, indem es Ultraviolettlicht (UV) und Feuchtigkeit in einem Q-Panel-QUV, einem beschleunigten Bewitterungstester ausgesetzt wurde, der mit einer QUV-A-351-Glühbirne versehen war. Jedes Plättchen wurde bei 50°C bewittert, indem es 10 Stunden dem UV-Licht ausgesetzt wurde und dann 2 Stunden einem Feuchtigkeitskondensationszyklus. Dies wurde wiederholt, bis das Plättchen 960 Stunden so behandelt worden war. Proben wurden zur Bewertung alle 160 Stunden genommen. Die Farbwerte wurden unter Verwendung eines Hunter-Kolorimeters abgelesen. Delta E (Gesamtfarbveränderung)-Ablesungen für jede Zusammensetzung und Verwendung der Anfangsprobe (0 Stunden) als Farbvergleich, welcher in der Tabelle nachfolgend gegeben ist.
- Die obigen Ergebnisse demonstrieren: 1) dass latente Mercaptan-Systeme alleine schlechte Bewitterungsstabilisatoren sind und 2) die Bewitterungsstabilisierung von latenten Mercaptan-Systemen signifikant durch ihre Verwendung in Kombination mit Phenylsalicylatverbindungen in klaren Polyvinylchloridzusammensetzungen verbessert wird.
- Beispiele 6 – 7
- Herstellung von flexiblen klaren PVC-Zusammensetzungen
- (Beispiel 6 ist ein Vergleichsbeispiel)
- Die folgenden Bestandteile wurden miteinander in den angegebenen Mengen vermischt und hinsichtlich der Bewitterung nach dem in den Beispielen 2 – 5 angegebenen Verfahren getestet, jedoch mit der Ausnahme, dass ein 4-Stunden-UV/4-Stunden-Kondenstions-Zyklus für 1600 Stunden verwendet wurde.
- Die obigen Ergebnisse demonstrieren: 1) dass latente Mercaptan-Systeme alleine schlechte Bewitterungsstabilisatoren sind und 2) die Bewitterungsstabilisierung von latenten Mercaptan-Systemen signifikant durch ihre Verwendung in Kombination mit Phenylsalicylatverbindungen in klaren Polyvinylchloridzusammensetzungen verbessert wird.
- Beispiele 8 – 9
- Herstellung von flexiblen pigmentierten PVC-Zusammensetzungen
- (Beispiele 8 und 9 sind Vergleichsbeispiele)
- Die folgenden Bestandteile wurden miteinander in den angegebenen Mengen vermischt, um zwei pigmentierte Polyvinylchloridzusammensetzungen zu ergeben, wobei die erste mit einem latenten Mercaptan-System alleine stabilisiert wurde und die zweite mit einem latenten Mercapt-System in Kombination mit einer Phenylsalicylatverbindung stabilisiert wurde.
- Jede resultierende Polymerzusammensetzung wurde im QUV-Bewitterungstest gemäß dem Verfahren der Beispiele 6 – 7 geprüft. Delta E (Gesamtfarbveränderung)-Ablesungen für jede Zusammensetzung unter Verwendung der Anfangsprobe (0 Stunden) als Farbvergleich sind in der Tabelle nachfolgend angegeben.
- Die obigen Ergebnisse demonstrieren: 1) dass latente Mercaptanstabilisator-Systeme alleine schlechte Bewitterungsstabilisatoren sind und 2) kein Vorteil bezüglich der Bewitterungsstabilisierung durch ihre Verwendung in Kombination mit Phenylsalicylatverbindungen in pigmentierten Poly vinylchloridzusammensetzungen erzielt wird, da die Phenylsalicylatverbindungen darin nicht funktionell aktiv werden.
- Herstellungsgegenstände, die von dieser Erfindung in Betracht zu ziehen sind, wie Röhren, Filme, Verkleidungen, Fensterprofile, Fensterrahmen, gerippte Raumdecken, Türabbeizungen werden aus den stabilisierten Polymerzusammensetzungen nach dieser Erfindung mit irgendeiner der bekannten herkömmlichen Techniken zur Bildung von Formlingen aus Polymeren gebildet.
Claims (16)
- Zusammensetzung, die in der Lage ist, klare halogenierte Polymerzusammensetzungen gegen die Abbauwirkungen von Hitze, Licht und Bewitterung zu stabilisieren, mit: A) einem latenten Mercaptan, welches während der Verarbeitung der Zusammensetzung bei einer erhöhten Temperatur zur Freisetzung eines freien Mercaptans sich abbaut und die Formel worin a 0 oder 1 ist, m und n 0 oder 1 sind, y 1 bis 4 ist, wenn y = 1 ist, z 1 bis 4 bedeutet, und wenn y mehr als 1 ist, z 1 bedeutet, R1 ein Alkoxy-(acyloxyalkyl)-Rest, ein Alkoxy-(polyalkoxy)-carbonylalkylrest, Carboxyalkylrest, Acyloxyalkylrest, Acyloxy-(hydroxyalkyl)-Rest, Acyloxyalkoxyalkylrest, Acyloxy-(polyalkoxy-)-alkylrest, Benzoyloxy-(polyalkoxy)-alkylrest, Alkylen-bis-(acyloxyalkyl)rest, Alkoxycarbonylalkylrest, Alkoxycarbonylalkylenylrest, Hydroxyalkoxycarbonylalkylrest, Hydroxy-(polyalkoxy)-carbonylalkylrest, Alkoxy-(polyalkoxy)-carbonylalkylrest, Mercaptoalkylrest, Mercaptoalkoxycarbonylalkylrest, Mercaptoalkoxycarbonylalkylenylrest, Alkoxycarbonyl-(amido-)-alkylrest, Alkylcarbonyloxy-(polyalkoxy-)-carbonylalkylrest oder Tetrahydropyranyloxy-(polyalkoxy)-carbonylalkylrest oder Carboxyarylrest mit 1 bis 22 Kohlenstoffatomen ist, R2, R3, R4, R5, R6 und R7 unabhängig voneinander Wasserstoff, eine Hydroxyl-, Mercapto-, Acyl-, Alkyl-, Alkylenyl-, Aryl-, Halogenaryl-, Alkaryl-, Aralkyl-, Hydroxyaralkyl-, Mercaptoalkyl-, Hydroxyaryl-, Alkoxyaryl-, Alkoxyhydroxyaral-, Mercaptoalkylenyl-, Mercaptoalkoxycarbonylalkylenyl-, Hydroxyaryl-, Arylcarbonyl-, Mercaptoaryl-, Carboxyaryl-, oder Acylrest mit 1 bis 22 Kohlenstoffatomen ist, x Aryl, Halogenaryl, Alkaryl, Hydroxyaryl, Dihydroxyaryl, Aralkaryl-, Alkoxyaryl-, Arylcycloalkyl oder ein Heteroatom haben, mit der Option, daß, wenn a 1 ist und m 0 ist, einer der Reste R1, R3 und R5 gemeinsam mit R7 und X einen heterozyklischen Rest mit x als ein Heteroatom oder Sauerstoff oder Schwefel zu bilden, und mit der weiteren Option, daß, wenn m 1 ist, R6 und R7 einen heterozyklischen Rest in Verbindung mit x als ein Stickstoffatom bereitet, unter der Voraussetzung, daß, wenn X Aralkaryl ist, R6 und R7 Hydroxyl sind, a 1 ist und m auch 1 ist, z 1 oder 2 ist, und mit der weiteren Voraussetzung, daß, wenn m 1 ist, x 1 oder 2 ist, und mit der weiteren Einschränkung, daß, wenn R6 Hydroxyl oder Mercapto ist, z 1 bedeutet, und B) eine freie Phenylsalicylatverbindung umfaßt.
- Zusammensetzung nach Anspruch 1, die 50 Gew.-% bis 98,8 Gew.-%, bezogen auf das Gesamtgewicht von (A) plus (B) des latenten Mercaptans und von 1,2 Gew.-% bis 50 Gew.-%, bezogen auf das Gesamtgewicht von (A) plus (B) der freien Phenylsalicylatverbindung ist.
- Zusammensetzung nach Anspruch 1 oder Anspruch 2, in welcher das freie Phenylsalycilat die Formel hat, worin R20 und R21 jeweils unabhängig vom Vorkommen aus Wasserstoff, einem Alkylrest, Phenylrest, Alkoxyrest, Phenoxyrest, Alkylcarboxyrest, Hydroxylrest, Halogenrest, Carboxylrest, Benzoylrest, Glycidylrest, Glycidylaminorest, Alkylaminorest, Amidorest, Hydroxypolyalkoxyrest, Alkoxypolyalkoxyrest oder Acyloxypolyalkoxyrest ausgewählt sind, x eine ganze Zahl von 1 bis 4 bedeutet und y eine ganze Zahl von 1 bis 5 bedeutet.
- Zusammensetzung nach einem der vorausgehenden Ansprüche, welche 50 bis 98,8 Gew.-% latentes Mercaptan (A) und 1,2 bis 50 Gew.-% Phenylsalicylatverbindung (B), bezogen auf das gesamte (A) plus (B) umfaßt.
- Zusammensetzung nach einem der vorausgehenden Ansprüche, weiterhin gekennzeichnet durch das Vorhandensein eines Wärmestabilisators, der unter Wärmestabilisatoren auf Metallbasis, Lewis-Säuren, Hitzestabilisatoren auf organischer Basis und Hitzestabilisatoren auf Hydrotalcit-Basis ausgewählt ist.
- Zusammensetzung nach Anspruch 5, worin der Wärmestabilisator wenigstens einen Wärmestabilisator auf Metallbasis umfaßt, der aus Stabilisatoren auf Antimon-, Barium-, Magnesium- und Calcium-, Zinn- und Zink-Basis ausgewählt ist.
- Zusammensetzung nach Anspruch 6, worin der Stabilisator auf Metallbasis eine Zinkseife ist.
- Zusammensetzung nach Anspruch 5, worin der Wärmestabilisator wenigstens einen Wärmestabilisator auf Metallbasis umfaßt, der eine Organozinnverbindung ist.
- Zusammensetzung nach Anspruch 8, worin die Organozinnverbindung aus Organozinnmercaptiden, Mono- und Polysulfiden von Organozinnmercaptiden sowie Organozinncarboxylaten ausgewählt ist.
- Zusammensetzung nach Anspruch 9, die ein Organozinnmercaptid enthält, worin der Mercaptidrest ein Alkylthioglycolat ist.
- Zusammensetzung nach Anspruch 9, die ein Organozinnmercaptid enthält, worin der Mercaptidrest ein Mercaptoalkylcarboxylat ist.
- Zusammensetzung nach einem der voraufgehenden Ansprüche, welche in eine klare, halogenhaltige Polymerzusammensetzung in einer Menge von wenigstens 0,4 Gew.-%, bezogen auf das Gewicht des Polymers, eingearbeitet ist.
- Klare halogenhaltige Polymerzusammensetzung, die gegen Abbauwirkungen von Wärme, Licht und Bewitterung stabilisiert ist, wobei diese Zusammensetzung ein halogeniertes Polymer und wenigstens 0,4 Gew.-%, bezogen auf das Gewicht des Polymers, einer Stabilisatorzusammensetzung umfaßt, welche die Kombination von A) Abbauprodukten eines latenten Mercaptans ist, welche während der Bearbeitung der Zusammensetzung bei einer erhöhten Temperatur diese Produkte einschließlich eines freien Mercaptans und B) 1,2 bis 50 Gew.-%, bezogen auf das Gesamtgewicht von (A) + (B) einer freien Phenylsalicylatverbindung einschließt, worin dieses latente Mercaptan die Strukturformel worin a 0 oder 1 ist, m und n 0 oder 1 sind, y 1 bis 4 ist, wenn y = 1 ist, z 1 bis 4 bedeutet, und wenn y mehr als 1 ist, z 1 bedeutet, R1 ein Alkoxy-(acyloxyalkyl)-Rest, Alkoxy-(polyalkoxy)-carbonylalkylrest, Carboxyalkylrest, Acyloxyalkylrest, Acyloxy-(hydroxyalkyl)-Rest, Acyloxyalkoxyalkylrest, Acyloxy-(polyalkoxy-)-alkylrest, Benzoyloxy-(polyalkoxy)-alkylrest, Alkylen-bis-(acyloxyalkyl)Rest, Alkoxycarbonylalkylrest, Alkoxycarbonylalkylenylrest, Hydroxyalkoxycarbonylalkylrest, Hydroxy-(polyalkoxy)-carbonylalkylrest, Alkoxy-(polyalkoxy)-carbonylalkylrest, Mercaptoalkoxycarbonylalkylrest, Mercaptoalkoxycarbonylalkylenylrest, Alkoxycarbonyl-(amido-)-alkylrest, Alkylcarbonyloxy-(polyalkoxy-)-carbonylalkylrest, Tetrahydropyranyloxy-(polyalkoxy)-carbonylalkylrest oder Carboxyarylrest mit 1 bis 22 Kohlenstoffatomen ist, R2, R3, R4, R5, R6 und R7 unabhängig voneinander Wasserstoff, einen Hydroxyl-, Mercapto-, Acyl-, Alkyl-, Alkylenyl-, Aryl-, Halogenaryl-, Alkaryl-, Aralkyl-, Hydroxyalkyl-, Mercaptoalkyl-, Mercaptoalkylenyl-, Hydroxyaryl-, Alkoxyaryl-, Alkoxyhydroxyaryl-, Arylcarbonyl-, oder Mercaptoarylrest mit 1 bis 22 Kohlenstoffatomen bedeuten, wenn a = 1, X Arylcycloalkyl oder ein Heteroatom ist, und wenn a = 0, X Aryl, Halogenaryl, Alkaryl, Alkoxyaryl, Arylcycloalkyl oder ein Heteroatom ist, mit der Option, daß wenn a 1 ist und m 0 ist, einer der Reste R3 und R5 sich mit R7 und X unter Bildung eines heterozyklischen Restes verbindet, wobei x ein Heteroatom, Sauerstoff oder Schwefel ist und mit der weiteren Option, daß, wenn a 1 ist und m 1 ist, R8 und R7 einen heterozyklischen Rest in Verbindung mit x als ein Stickstoffatom bilden.
- Polymerzusammensetzung nach Anspruch 13, worin das freie Phenylsalicylat die Formel hat, worin R20 und R21 jeweils unabhängig vom Vorkommen unter Wasserstoff, einem Alkyl-, Phenyl-, Alkoxy-, Phenoxy-, Alkylcarboxy-, Hydroxyl-, Halogen-, Carboxyl-, Benzoyl-, Glycidyl-, Glycidylamino-, Alkylamino-, Amido-, Hydroxypolyalkoxy-, Alkoxypolyalkoxy- oder Acyloxypolyalkoxyrest ausgewählt sind und x eine ganze Zahl von 1 bis 4 bedeutet und y eine ganze Zahl von 1 bis 5 bedeutet.
- Zusammensetzung nach einem der Ansprüche 13 oder 14, welche 0,4 bis 4 Gew.-% der Stabilisatorzusammensetzung, bezogen auf das Gewicht des halogenhaltigen Polymers, enthält.
- Zusammensetzung nach einem der Ansprüche 13 bis 15, weiter gekennzeichnet durch die Anwesenheit eines Wärmestabilisators, der unter Wärmestabilisatoren auf Metallbasis, Lewis-Säuren, Wärmestabilisatoren auf organischer Basis und Wärmestabilisatoren auf Hydrotalcit-Basis ausgewählt ist.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/200,145 US6232380B1 (en) | 1995-05-10 | 1998-11-25 | Latent mercaptan stabilizers for improved weatherability of clear halogen-containing polymer compositions |
| US200145 | 1998-11-25 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69918779D1 DE69918779D1 (de) | 2004-08-26 |
| DE69918779T2 true DE69918779T2 (de) | 2005-08-25 |
Family
ID=22740524
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69918779T Expired - Lifetime DE69918779T2 (de) | 1998-11-25 | 1999-11-05 | Latente Mercaptanstabilisatoren für verbesserte Witterungsbeständigkeit von klaren Halogenpolymerzusammensetzungen |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US6232380B1 (de) |
| EP (1) | EP1004624B1 (de) |
| JP (1) | JP2000159961A (de) |
| KR (1) | KR20000035638A (de) |
| CN (1) | CN1254731A (de) |
| AT (1) | ATE271582T1 (de) |
| AU (1) | AU724300B2 (de) |
| BR (1) | BR9905395A (de) |
| CA (1) | CA2286517A1 (de) |
| DE (1) | DE69918779T2 (de) |
| SG (1) | SG83160A1 (de) |
| TW (1) | TW506984B (de) |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU682287B2 (en) * | 1995-05-10 | 1997-09-25 | Morton International, Inc. | Latent mercaptans as multi-functional additives for halogen-containing polymer compositions |
| US6706792B2 (en) * | 1995-05-10 | 2004-03-16 | Rohm And Haas Company | Method for improving adhesion of water-based inks to halogen-containing resin articles |
| US7105109B2 (en) * | 1995-05-10 | 2006-09-12 | Rohm And Haas Company | Latent mercaptans as stabilizers for halogen-containing polymer compositions |
| FR2811324B1 (fr) * | 2000-07-04 | 2003-08-29 | Rhodia Chimie Sa | Stabilisation de polymeres halogenes au moyen de pyrroles ou derives et compositions les comprenant |
| EP1201706A1 (de) * | 2000-10-24 | 2002-05-02 | Rohm And Haas Company | Halogen enthaltende Polymerzusammensetzung stabilisiert durch ein latentes Mercaptan und durch eine Mischung aus Zinkcarboxylat und Zinkchlorid |
| WO2002042369A1 (en) * | 2000-11-27 | 2002-05-30 | Akzo Nobel N.V. | Mercaptide-free organotin heat stabilizer |
| US6762231B2 (en) | 2000-12-15 | 2004-07-13 | The College Of William And Mary | Organic thiol metal-free stabilizers and plasticizers for halogen-containing polymers |
| US7312266B2 (en) * | 2000-12-15 | 2007-12-25 | The College Of William And Mary | Organic thiol metal-free stabilizers and plasticizers for halogen-containing polymers |
| US6667357B2 (en) * | 2000-12-15 | 2003-12-23 | The College Of William And Mary | Organic thiol metal-free stabilizers and plasticizers for halogen-containing polymers |
| US6927247B2 (en) * | 2000-12-15 | 2005-08-09 | The College Of William And Mary | Organic thiol metal-free stabilizers and plasticizers for halogen-containing polymers |
| US6653380B2 (en) | 2001-07-18 | 2003-11-25 | R. T. Vanderbilt Company, Inc. | Latex film compound with improved tear resistance |
| US7048977B2 (en) | 2001-07-18 | 2006-05-23 | R.T. Vanderbilt Company, Inc. | Latex film compound with improved tear resistance |
| MXPA02011789A (es) * | 2001-12-06 | 2005-08-26 | Rohm & Haas | Composicion estabilizada de polimero, que contiene halogeno. |
| TW200303887A (en) * | 2002-03-07 | 2003-09-16 | Rohm & Haas | Organic based thermal stabilizers and heat stabilized polymer compositions |
| US20040063826A1 (en) * | 2002-09-30 | 2004-04-01 | Sobieski Robert T. | Halogen-containing vinyl polymer compounds |
| US7029759B2 (en) * | 2002-09-30 | 2006-04-18 | Omnova Solutions Inc. | Halogen-containing vinyl polymer compositions |
| US20040061095A1 (en) * | 2002-09-30 | 2004-04-01 | Sobieski Robert T. | Halogen-containing vinyl polymer stabilizers |
| JP2005113114A (ja) * | 2003-10-03 | 2005-04-28 | Rohm & Haas Co | ハロゲン含有ビニルポリマー用熱安定剤組成物 |
| WO2012143794A1 (en) | 2011-04-18 | 2012-10-26 | Galata Chemicals Gmbh | Polymer stabilizer system for polymers containing halogen |
| CN105131737A (zh) * | 2015-09-28 | 2015-12-09 | 常州大学 | 一种棉包防火预警系统用基包装涂层及制备方法 |
| CN113774507B (zh) * | 2021-09-16 | 2023-07-11 | 东莞市博斯蒂新材料有限公司 | 一种tpee单丝 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2824079A (en) | 1954-06-08 | 1958-02-18 | Exxon Research Engineering Co | Vinyl chloride polymer composition containing phenyl salicylate and a bisphenol |
| GB1001344A (en) | 1962-02-13 | 1965-08-18 | Bx Plastics Ltd | Improvements in and relating to halogen-containing polymer compositions |
| US3498947A (en) | 1966-07-26 | 1970-03-03 | Nitto Kasei Co Ltd | Resins stabilized with organotin compounds containing the benzophenone moiety |
| US3505383A (en) | 1966-09-09 | 1970-04-07 | Nitto Kasei Co Ltd | Resins stabilized with organotin compounds containing a phenyl salicylate moiety |
| US3600416A (en) | 1966-09-09 | 1971-08-17 | Toshio Seki | Organotin (phenyloxycarbonyl) phenolates |
| US4062881A (en) | 1974-07-26 | 1977-12-13 | Cincinnati Milacron Chemicals, Inc. | Sulfide containing tin stabilizers |
| US4179432A (en) | 1975-09-02 | 1979-12-18 | Cincinnati Milacron Chemicals, Inc. | Stabilized polypropylene compositions |
| US4681907A (en) | 1984-11-20 | 1987-07-21 | Morton Thiokol, Inc. | Stabilizers for halogen-containing organic polymers comprising an organotin mercaptide and a diester of an unsaturated dicarboxylic acid |
| US4772405A (en) * | 1985-08-26 | 1988-09-20 | Ciba-Geigy Corporation | Lubricant compositions which contain sulfur-containing phenol derivatives, and novel sulfur-containing phenol derivatives |
| US5030676A (en) | 1989-07-14 | 1991-07-09 | Certainteed Corporation | UV light stabilized polyvinyl chloride composition |
| AU682287B2 (en) * | 1995-05-10 | 1997-09-25 | Morton International, Inc. | Latent mercaptans as multi-functional additives for halogen-containing polymer compositions |
-
1998
- 1998-11-25 US US09/200,145 patent/US6232380B1/en not_active Expired - Lifetime
-
1999
- 1999-10-12 TW TW088117624A patent/TW506984B/zh not_active IP Right Cessation
- 1999-10-13 AU AU53994/99A patent/AU724300B2/en not_active Ceased
- 1999-10-18 CA CA002286517A patent/CA2286517A1/en not_active Abandoned
- 1999-10-22 SG SG9905324A patent/SG83160A1/en unknown
- 1999-10-29 CN CN99123632A patent/CN1254731A/zh active Pending
- 1999-11-05 AT AT99308830T patent/ATE271582T1/de not_active IP Right Cessation
- 1999-11-05 EP EP99308830A patent/EP1004624B1/de not_active Expired - Lifetime
- 1999-11-05 DE DE69918779T patent/DE69918779T2/de not_active Expired - Lifetime
- 1999-11-24 KR KR1019990052348A patent/KR20000035638A/ko not_active Ceased
- 1999-11-24 BR BR9905395-0A patent/BR9905395A/pt not_active Application Discontinuation
- 1999-11-25 JP JP11334454A patent/JP2000159961A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| DE69918779D1 (de) | 2004-08-26 |
| CA2286517A1 (en) | 2000-05-25 |
| EP1004624A1 (de) | 2000-05-31 |
| BR9905395A (pt) | 2000-08-15 |
| AU5399499A (en) | 2000-06-01 |
| JP2000159961A (ja) | 2000-06-13 |
| SG83160A1 (en) | 2001-09-18 |
| KR20000035638A (ko) | 2000-06-26 |
| EP1004624B1 (de) | 2004-07-21 |
| ATE271582T1 (de) | 2004-08-15 |
| CN1254731A (zh) | 2000-05-31 |
| TW506984B (en) | 2002-10-21 |
| AU724300B2 (en) | 2000-09-14 |
| US6232380B1 (en) | 2001-05-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69918779T2 (de) | Latente Mercaptanstabilisatoren für verbesserte Witterungsbeständigkeit von klaren Halogenpolymerzusammensetzungen | |
| DE69610660T2 (de) | Latente Merkaptane als multifunktionelle Additive für halogenhaltige Polymerzusammensetzungen | |
| DE69912338T2 (de) | Ein latentes Merkaptan als Wärmestabilisator | |
| DE2454986A1 (de) | Vinylhalogenidharz-stabilisatorzusammensetzung | |
| JPH11310676A (ja) | 熱安定化されたハロゲン含有ポリマ―組成物 | |
| DE2501331A1 (de) | Monoalkylzinnstabilisatoren und diese stabilisatoren enthaltende thermoplastische formmassen aus oder auf der grundlage von vinylchloridpolymerisaten | |
| KR100309914B1 (ko) | 열 안정화제로서의 잠재성 머캅탄 | |
| DE60024164T2 (de) | Verfahren zur Verbesserung der Haftung von wässrigen Tinten auf Halogen-enthaltenden Harzgegenständen | |
| US20020091179A1 (en) | Halogen-containing polymer composition stabilized by a latent mercaptan and a mixture of a zinc carboxylate and zinc chloride | |
| DE2703904A1 (de) | Stabilisatorzusammensetzung und sie enthaltende kunststoffzusammensetzung | |
| EP2361282B1 (de) | Schwermetallfreie stabilisatorzusammensetzung für halogenhaltige polymere | |
| DE69913909T2 (de) | Ein wohlriechendes Verfahren zum Stabilisieren von Halogen-enthaltenden Polymeren | |
| DE60212307T2 (de) | Stabilisierte Halogenhaltige Polymerzusammensetzung | |
| DE602005000555T2 (de) | Thermische Stabilisatorzusammensetzungen für halogenhaltige Vinylpolymere | |
| DE60317591T2 (de) | Thermische Stabilisatoren auf organischer Basis und wärmestabilisierte Polymerzusammensetzungen | |
| US20020183424A1 (en) | Latent mercaptan as a heat stabilizer | |
| US4358555A (en) | Stabilizers for halogen containing polymers comprising alkyltin compounds, zinc mercaptoesters and basic alkali or alkaline earth metal compounds | |
| US7105109B2 (en) | Latent mercaptans as stabilizers for halogen-containing polymer compositions | |
| DE1669861B2 (de) | Stabilisatorgemisch zum stabilisieren von halogenhaltigen polymerisaten | |
| HK1025108A (en) | Latent mercaptan stabilizers for improved weatherability of clear halogen-containing polymer compositions | |
| MXPA99009858A (en) | Stabilizers of latent mercaptano to improve the weather resistance of transparent polymer compositions containing halog | |
| HK1005142B (en) | Latent mercaptans as multi-functional additives for halogen-containing polymer compositions |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8328 | Change in the person/name/address of the agent |
Representative=s name: MUELLER-BORE & PARTNER, PATENTANWAELTE, EUROPEAN PAT |
|
| 8327 | Change in the person/name/address of the patent owner |
Owner name: ROHM AND HAAS CHEMICALS LLC, PHILADELPHIA, PA., US |
|
| 8364 | No opposition during term of opposition |