DE69918076T2 - Verfahren zur oligomerisierung von propen - Google Patents
Verfahren zur oligomerisierung von propen Download PDFInfo
- Publication number
- DE69918076T2 DE69918076T2 DE69918076T DE69918076T DE69918076T2 DE 69918076 T2 DE69918076 T2 DE 69918076T2 DE 69918076 T DE69918076 T DE 69918076T DE 69918076 T DE69918076 T DE 69918076T DE 69918076 T2 DE69918076 T2 DE 69918076T2
- Authority
- DE
- Germany
- Prior art keywords
- hydrogen
- hydrocarbyl
- independently represent
- alkyl
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000000034 method Methods 0.000 title claims description 32
- 230000003606 oligomerizing effect Effects 0.000 title 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 claims abstract description 65
- 125000001183 hydrocarbyl group Chemical group 0.000 claims abstract description 62
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 46
- 239000001257 hydrogen Substances 0.000 claims abstract description 46
- 150000001450 anions Chemical group 0.000 claims abstract description 32
- 125000000524 functional group Chemical group 0.000 claims abstract description 25
- -1 hydride group Chemical group 0.000 claims description 37
- 150000001875 compounds Chemical class 0.000 claims description 32
- 125000000217 alkyl group Chemical group 0.000 claims description 29
- 150000002431 hydrogen Chemical class 0.000 claims description 29
- 239000002841 Lewis acid Substances 0.000 claims description 25
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 21
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 20
- 150000007517 lewis acids Chemical class 0.000 claims description 19
- 125000004432 carbon atom Chemical group C* 0.000 claims description 16
- 239000003446 ligand Substances 0.000 claims description 16
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 16
- 230000007935 neutral effect Effects 0.000 claims description 16
- 125000004429 atom Chemical group 0.000 claims description 14
- 150000004678 hydrides Chemical class 0.000 claims description 13
- 238000006384 oligomerization reaction Methods 0.000 claims description 13
- 125000003118 aryl group Chemical group 0.000 claims description 12
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 12
- 229910052736 halogen Inorganic materials 0.000 claims description 8
- 150000002367 halogens Chemical class 0.000 claims description 8
- 125000003107 substituted aryl group Chemical group 0.000 claims description 7
- 229910052799 carbon Inorganic materials 0.000 claims description 6
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 4
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 4
- 230000003647 oxidation Effects 0.000 claims description 4
- 238000007254 oxidation reaction Methods 0.000 claims description 4
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 3
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical group [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 claims description 2
- 150000001805 chlorine compounds Chemical group 0.000 claims description 2
- 150000001336 alkenes Chemical class 0.000 abstract description 4
- 150000001868 cobalt Chemical class 0.000 abstract description 4
- 239000000543 intermediate Substances 0.000 abstract description 3
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 abstract description 2
- 239000000126 substance Substances 0.000 abstract description 2
- 125000004435 hydrogen atom Chemical class [H]* 0.000 abstract 1
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 52
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 45
- 238000006243 chemical reaction Methods 0.000 description 19
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 19
- 229910017052 cobalt Inorganic materials 0.000 description 17
- 239000010941 cobalt Substances 0.000 description 17
- 229910052751 metal Inorganic materials 0.000 description 17
- 239000002184 metal Substances 0.000 description 17
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 16
- 239000003054 catalyst Substances 0.000 description 12
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 12
- 239000007787 solid Substances 0.000 description 12
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 11
- 238000006116 polymerization reaction Methods 0.000 description 11
- 238000001035 drying Methods 0.000 description 10
- 239000012298 atmosphere Substances 0.000 description 9
- 238000002474 experimental method Methods 0.000 description 9
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 8
- 239000012071 phase Substances 0.000 description 8
- 239000002244 precipitate Substances 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 6
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- 229910052782 aluminium Inorganic materials 0.000 description 6
- 235000019253 formic acid Nutrition 0.000 description 6
- 238000004817 gas chromatography Methods 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- JRZJOMJEPLMPRA-UHFFFAOYSA-N 1-nonene Chemical compound CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 5
- 239000007848 Bronsted acid Substances 0.000 description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- 150000002466 imines Chemical class 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 239000012299 nitrogen atmosphere Substances 0.000 description 5
- 238000005160 1H NMR spectroscopy Methods 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 239000002879 Lewis base Substances 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 238000011065 in-situ storage Methods 0.000 description 4
- 150000007527 lewis bases Chemical class 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N tetrahydrofuran Substances C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- BEZVGIHGZPLGBL-UHFFFAOYSA-N 2,6-diacetylpyridine Chemical compound CC(=O)C1=CC=CC(C(C)=O)=N1 BEZVGIHGZPLGBL-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 239000005977 Ethylene Substances 0.000 description 3
- 238000005481 NMR spectroscopy Methods 0.000 description 3
- 125000005234 alkyl aluminium group Chemical group 0.000 description 3
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 3
- 239000007795 chemical reaction product Substances 0.000 description 3
- 150000004700 cobalt complex Chemical class 0.000 description 3
- GVPFVAHMJGGAJG-UHFFFAOYSA-L cobalt dichloride Chemical compound [Cl-].[Cl-].[Co+2] GVPFVAHMJGGAJG-UHFFFAOYSA-L 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 2
- KZDCMKVLEYCGQX-UDPGNSCCSA-N 2-(diethylamino)ethyl 4-aminobenzoate;(2s,5r,6r)-3,3-dimethyl-7-oxo-6-[(2-phenylacetyl)amino]-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid;hydrate Chemical compound O.CCN(CC)CCOC(=O)C1=CC=C(N)C=C1.N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 KZDCMKVLEYCGQX-UDPGNSCCSA-N 0.000 description 2
- PCTJPPBMHPZOLS-UHFFFAOYSA-N 2-phenylcyclohexa-2,4-dien-1-imine Chemical compound N=C1CC=CC=C1C1=CC=CC=C1 PCTJPPBMHPZOLS-UHFFFAOYSA-N 0.000 description 2
- AEIOZWYBDBVCGW-UHFFFAOYSA-N 2-tert-butylaniline Chemical compound CC(C)(C)C1=CC=CC=C1N AEIOZWYBDBVCGW-UHFFFAOYSA-N 0.000 description 2
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 241000287181 Sturnus vulgaris Species 0.000 description 2
- JJLKTTCRRLHVGL-UHFFFAOYSA-L [acetyloxy(dibutyl)stannyl] acetate Chemical compound CC([O-])=O.CC([O-])=O.CCCC[Sn+2]CCCC JJLKTTCRRLHVGL-UHFFFAOYSA-L 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000002152 alkylating effect Effects 0.000 description 2
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical group [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical group [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 125000001246 bromo group Chemical group Br* 0.000 description 2
- 150000001721 carbon Chemical group 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 150000001768 cations Chemical class 0.000 description 2
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical compound C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 2
- 150000002170 ethers Chemical class 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- 238000005227 gel permeation chromatography Methods 0.000 description 2
- 125000005843 halogen group Chemical group 0.000 description 2
- 125000002346 iodo group Chemical group I* 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- CPOFMOWDMVWCLF-UHFFFAOYSA-N methyl(oxo)alumane Chemical compound C[Al]=O CPOFMOWDMVWCLF-UHFFFAOYSA-N 0.000 description 2
- JSCUFNQCEVUPJJ-UHFFFAOYSA-N n-[2,6-di(propan-2-yl)phenyl]-1-[6-[[2,6-di(propan-2-yl)phenyl]iminomethyl]pyridin-2-yl]methanimine Chemical compound CC(C)C1=CC=CC(C(C)C)=C1N=CC1=CC=CC(C=NC=2C(=CC=CC=2C(C)C)C(C)C)=N1 JSCUFNQCEVUPJJ-UHFFFAOYSA-N 0.000 description 2
- 150000002825 nitriles Chemical class 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 2
- WKBALTUBRZPIPZ-UHFFFAOYSA-N 2,6-di(propan-2-yl)aniline Chemical compound CC(C)C1=CC=CC(C(C)C)=C1N WKBALTUBRZPIPZ-UHFFFAOYSA-N 0.000 description 1
- GVNVAWHJIKLAGL-UHFFFAOYSA-N 2-(cyclohexen-1-yl)cyclohexan-1-one Chemical compound O=C1CCCCC1C1=CCCCC1 GVNVAWHJIKLAGL-UHFFFAOYSA-N 0.000 description 1
- WFNLHDJJZSJARK-UHFFFAOYSA-N 2-chloro-6-methylaniline Chemical compound CC1=CC=CC(Cl)=C1N WFNLHDJJZSJARK-UHFFFAOYSA-N 0.000 description 1
- TWBPWBPGNQWFSJ-UHFFFAOYSA-N 2-phenylaniline Chemical group NC1=CC=CC=C1C1=CC=CC=C1 TWBPWBPGNQWFSJ-UHFFFAOYSA-N 0.000 description 1
- 238000012584 2D NMR experiment Methods 0.000 description 1
- 238000003979 3D HSQC-TOCSY Methods 0.000 description 1
- CFDIFGZQSRRYEW-UHFFFAOYSA-N C=1(C(CC=CC1)=N)C1=CC=CC=C1.C=1(C(CC=CC1)=N)C1=CC=CC=C1.C(C)(=O)C1=NC(=CC=C1)C(C)=O Chemical compound C=1(C(CC=CC1)=N)C1=CC=CC=C1.C=1(C(CC=CC1)=N)C1=CC=CC=C1.C(C)(=O)C1=NC(=CC=C1)C(C)=O CFDIFGZQSRRYEW-UHFFFAOYSA-N 0.000 description 1
- 101150065749 Churc1 gene Proteins 0.000 description 1
- 241000204888 Geobacter sp. Species 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- 102100038239 Protein Churchill Human genes 0.000 description 1
- 229910018287 SbF 5 Inorganic materials 0.000 description 1
- 229910018286 SbF 6 Inorganic materials 0.000 description 1
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 150000004703 alkoxides Chemical group 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 150000001399 aluminium compounds Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- CZKMPDNXOGQMFW-UHFFFAOYSA-N chloro(triethyl)germane Chemical compound CC[Ge](Cl)(CC)CC CZKMPDNXOGQMFW-UHFFFAOYSA-N 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 150000001869 cobalt compounds Chemical class 0.000 description 1
- LBFUKZWYPLNNJC-UHFFFAOYSA-N cobalt(ii,iii) oxide Chemical compound [Co]=O.O=[Co]O[Co]=O LBFUKZWYPLNNJC-UHFFFAOYSA-N 0.000 description 1
- FCEOGYWNOSBEPV-FDGPNNRMSA-N cobalt;(z)-4-hydroxypent-3-en-2-one Chemical compound [Co].C\C(O)=C\C(C)=O.C\C(O)=C\C(C)=O FCEOGYWNOSBEPV-FDGPNNRMSA-N 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 150000001924 cycloalkanes Chemical class 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- GUJOJGAPFQRJSV-UHFFFAOYSA-N dialuminum;dioxosilane;oxygen(2-);hydrate Chemical compound O.[O-2].[O-2].[O-2].[Al+3].[Al+3].O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O GUJOJGAPFQRJSV-UHFFFAOYSA-N 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 150000008282 halocarbons Chemical class 0.000 description 1
- 125000001072 heteroaryl group Chemical group 0.000 description 1
- 238000003919 heteronuclear multiple bond coherence Methods 0.000 description 1
- 238000003929 heteronuclear multiple quantum coherence Methods 0.000 description 1
- 150000002505 iron Chemical class 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- COTNUBDHGSIOTA-UHFFFAOYSA-N meoh methanol Chemical compound OC.OC COTNUBDHGSIOTA-UHFFFAOYSA-N 0.000 description 1
- 229910001507 metal halide Inorganic materials 0.000 description 1
- 150000005309 metal halides Chemical class 0.000 description 1
- 229910052987 metal hydride Inorganic materials 0.000 description 1
- 150000004681 metal hydrides Chemical class 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 229910052901 montmorillonite Inorganic materials 0.000 description 1
- JYTZLLNFLIFUIS-UHFFFAOYSA-N n-(2-chloro-6-methylphenyl)-1-[6-[n-(2-chloro-6-methylphenyl)-c-methylcarbonimidoyl]pyridin-2-yl]ethanimine Chemical compound C=1C=CC(C(C)=NC=2C(=CC=CC=2C)Cl)=NC=1C(C)=NC1=C(C)C=CC=C1Cl JYTZLLNFLIFUIS-UHFFFAOYSA-N 0.000 description 1
- MDJXUNXXZJTMDW-UHFFFAOYSA-N n-(2-tert-butylphenyl)-1-[6-[n-(2-tert-butylphenyl)-c-methylcarbonimidoyl]pyridin-2-yl]ethanimine Chemical compound C=1C=CC(C(C)=NC=2C(=CC=CC=2)C(C)(C)C)=NC=1C(C)=NC1=CC=CC=C1C(C)(C)C MDJXUNXXZJTMDW-UHFFFAOYSA-N 0.000 description 1
- 230000001151 other effect Effects 0.000 description 1
- UUEVFMOUBSLVJW-UHFFFAOYSA-N oxo-[[1-[2-[2-[2-[4-(oxoazaniumylmethylidene)pyridin-1-yl]ethoxy]ethoxy]ethyl]pyridin-4-ylidene]methyl]azanium;dibromide Chemical compound [Br-].[Br-].C1=CC(=C[NH+]=O)C=CN1CCOCCOCCN1C=CC(=C[NH+]=O)C=C1 UUEVFMOUBSLVJW-UHFFFAOYSA-N 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- RGSFGYAAUTVSQA-UHFFFAOYSA-N pentamethylene Natural products C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- PMWXGSWIOOVHEQ-UHFFFAOYSA-N pyridine-2,6-dicarbaldehyde Chemical compound O=CC1=CC=CC(C=O)=N1 PMWXGSWIOOVHEQ-UHFFFAOYSA-N 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- WHRNULOCNSKMGB-UHFFFAOYSA-N tetrahydrofuran thf Chemical compound C1CCOC1.C1CCOC1 WHRNULOCNSKMGB-UHFFFAOYSA-N 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 238000001551 total correlation spectroscopy Methods 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2/00—Preparation of hydrocarbons from hydrocarbons containing a smaller number of carbon atoms
- C07C2/02—Preparation of hydrocarbons from hydrocarbons containing a smaller number of carbon atoms by addition between unsaturated hydrocarbons
- C07C2/04—Preparation of hydrocarbons from hydrocarbons containing a smaller number of carbon atoms by addition between unsaturated hydrocarbons by oligomerisation of well-defined unsaturated hydrocarbons without ring formation
- C07C2/06—Preparation of hydrocarbons from hydrocarbons containing a smaller number of carbon atoms by addition between unsaturated hydrocarbons by oligomerisation of well-defined unsaturated hydrocarbons without ring formation of alkenes, i.e. acyclic hydrocarbons having only one carbon-to-carbon double bond
- C07C2/08—Catalytic processes
- C07C2/26—Catalytic processes with hydrides or organic compounds
- C07C2/32—Catalytic processes with hydrides or organic compounds as complexes, e.g. acetyl-acetonates
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Catalysts (AREA)
- Transition And Organic Metals Composition Catalysts For Addition Polymerization (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Description
- GEBIET DER ERFINDUNG
- Ausgewählte Cobaltkomplexe aus 2,6-Pyridincarboxaldehyd-bis(iminen) und 2,6-Diacylpyridin-bis(iminen) sind Katalysatoren zur Oligomerisierung von Propen.
- HINTERGRUND DER ERFINDUNG
- Oligomere von Propen, wie zum Beispiel Propylentrimer und -tetramer werden gewerblich mittels mehrerer verschiedener Verfahren hergestellt. Diese Verbindungen sind als chemische Intermediärprodukte nützlich. Phenol kann zum Beispiel mit Propylentrimer und/oder -tetramer alkyliert und daran anschließend zur Bildung eines gewerblichen industriellen Detergens ethoxyliert werden.
- Bestimmte Eisen- und/oder Cobaltkomplexe von ausgewählten 2,6-Pyridincarboxaldehyd-bis(iminen) und 2,6-Diacylpyridin-bis(iminen) wurden in gleichzeitigen Anmeldungen zur Polymerisierung und/oder Oligomerisierung von Ethylen berichtet, siehe US-Patentanmeldungen 08/991372, angemeldet am 16. Dez. 1997 und 09/005965, angemeldet am 12. Januar 1998.
- Bestimmte Eisenkomplexe von ausgewählten 2,6-Pyridincarboxaldehyd-bis(intinen) und 2,6-Diacylpyridin-bis(iminen) wurden in der gleichzeitigen Anmeldung zur Polymerisierung und/oder Oligomerisierung von Propen berichtet, siehe US-Patentanmeldung 09/006031, angemeldet am 12. Januar 1998.
- ZUSAMMENFASSUNG DER ERFINDUNG
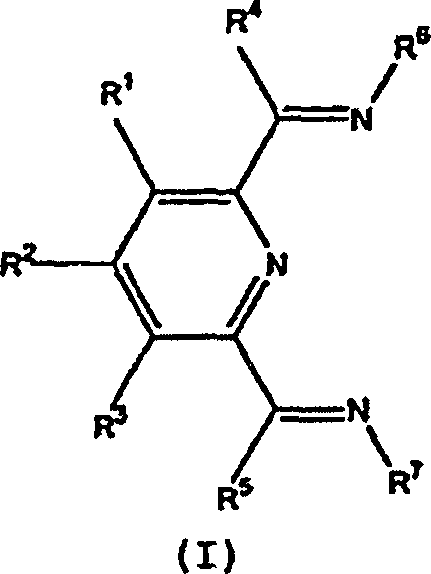
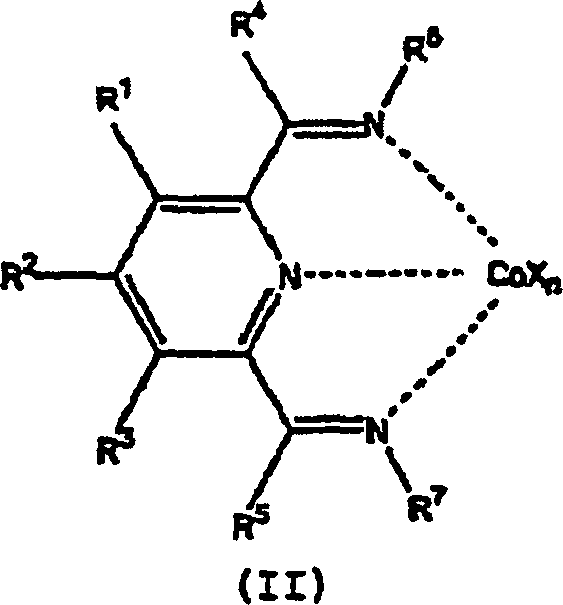
- Gegenstand dieser Erfindung ist ein Verfahren zur Oligomerisierung von Propen, umfassend das Kontaktieren, bei einer Temperatur von –100°C bis +200°C, eines Co[II]- oder Co[III]-Komplexes eines Tridentalliganden der Formel mit Propen, worin:
R1, R2 und R3 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen;
R4 und R5 jeweils unabhängig Wasserstoff, Hydrocarbyl, eine inerte funktionelle Gruppe oder substituiertes Hydrocarbyl darstellen; und
R6 und R7 Aryl oder substituiertes Aryl darstellen;
und vorausgesetzt, dass ein Co[II]- oder Co[III]-Atom (i) auch eine leere Koordinationsstelle oder an ihm gebunden einen Liganden, der von dem Propen verdrängt werden kann und (ii) einen Liganden, der an das Propen addiert werden kann, aufweist. -
- (a) einer ersten Verbindung W, die eine neutrale Lewis-Säure darstellt, die zur Abstraktion einer X–-Gruppe von Cobalt zur Bildung von WX– fähig ist und die auch zur Übertragung einer Alkylgruppe oder eines Hydrids an Cobalt fähig ist, vorausgesetzt, dass WX– ein schwach koordinierendes Anion darstellt; oder
- (b) einer Kombination aus einer zweiten Verbindung, die zur Übertragung einer Alkyl- oder Hydridgruppe an Cobalt fähig ist und einer dritten Verbindung, die eine neutrale Lewis-Säure darstellt, die für Abstraktion eines X– von Cobalt zur Bildung eines schwach koordinierenden Anions fähig ist;
- AUSFÜHRLICHE BESCHREIBUNG DER ERFINDUNG
- Hierin werden bestimmte Begriffe verwendet. Einige von ihnen sind:
- – Eine „Hydrocarbylgruppe" ist eine einwertige Gruppe, die nur Kohlenstoff und Wasserstoff enthält. Wenn nicht anderweitig angegeben, ist es bevorzugt, dass Hydrocarbylgruppen hierin 1 bis 30 Kohlenstoffatom(e) enthalten.
- – Unter „substituiertem Hydrocarbyl" versteht man hierin eine Hydrocarbylgruppe, die eine oder mehr Substituentengruppe(n) enthält, die unter den Verfahrensbedingungen, denen die Verbindung, enthaltend diese Gruppen, ausgesetzt wird, inert sind. Die Substituentengruppen greifen auch nicht weitgehend in das Verfahren ein. Wenn nicht anderweitig angegeben, ist es bevorzugt, dass substituierte Hydrocarbylgruppen hierin 1 bis 30 Kohlenstoffatom(e) enthalten. Eingeschlossen in die Bedeutung von „substituiert" sind heteroaromatische Ringe.
- – Unter „(inerter) funktioneller Gruppe" hierin versteht man eine Gruppe mit Ausnahme des Hydrocarbyls oder substituierten Hydrocarbyls, die unter den Verfahrensbedingungen, denen die Verbindung, enthaltend die Gruppe, ausgesetzt wird, inert ist. Die funktionellen Gruppen greifen auch nicht weitgehend in jedwedes hierin beschriebene Verfahren ein, an dem die Verbindung, worin sie vorliegen, teilnehmen könnte. Beispiele funktioneller Gruppen schließen Halo (Fluoro, Chloro, Bromo und Iodo), Ether, wie zum Beispiel -OR18, worin R18 Hydrocarbyl oder substituiertes Hydrocarbyl darstellt, ein. In Fällen, in denen sich die funktionelle Gruppe in der Nähe eines Cobaltatoms befinden kann, wie zum R4, R5, R8, R12, R13 und R17, sollte die funktionelle Gruppe nicht stärker koordinativ an das Metallatom gebunden werden als die Gruppen in Verbindungen, die R4, R5, R8, R12, R13 und R17 enthalten, von denen gezeigt wird, dass sie koordinativ an das Metallatom gebunden sind, das heißt, sie sollten die gewünschte Koordinationsgruppe nicht verdrängen.
- – Unter einer „Alkylaluminiumverbindung" versteht man eine Verbindung, worin mindestens eine Alkylgruppe an ein Aluminiumatom gebunden ist. Andere Gruppen, wie zum Beispiel Alkoxid, Hydrid und Halogen können auch an Aluminiumatome in der Verbindung gebunden werden.
- – Unter „neutraler Lewis-Base" versteht man eine Verbindung, die kein Ion ist, die als eine Lewis-Base wirken kann. Beispiele solcher Verbindungen schließen Ether, Amine, Sulfide und organische Nitrile ein.
- – Unter „kationischer Lewis-Säure" versteht man ein Kation, das als eine Lewis-Säure wirken kann. Beispiele solcher Kationen sind Natrium- und Silberkationen.
- – Unter relativ nicht koordinierenden (oder schwach koordinierenden) Anionen versteht man die Anionen, auf die im Allgemeinen im Fach auf diese Weise verwiesen wird, und die Koordinationsfähigkeit solcher Anionen ist bekannt und wurde in der Literatur besprochen, wie zum Beispiel W. Beck, et al., Chem. Rev., Vol. 88, S. 1405–1421 (1988) und S. H. Stares, Chem. Rev., Vol. 93. S. 927–942 (1993). Unter solchen Anionen befinden sich diejenigen, die aus Aluminiumverbindungen in dem unmittelbar vorangehenden Abschnitt und X–, einschließlich R9 3AlX–, R9 2AlClX–, R9AlCl2X– und „R9AlOX–", worin R9 Alkyl darstellt. Andere nützliche, nicht koordinierende Anionen schließen BAF– {BAF = Tetrakis[3,5-bis(trifluormethyl)phenyl]borat}, SbF6 –, PF6 – und BF4 –, Trifluormethansulfonat, p-Toluensulfonat, (RfSO2)2N– und (C6F5)4B– ein.
- – Unter einer leeren Koordinationsstelle versteht man eine potenzielle Koordinationsstelle, die keinen Liganden an sie gebunden aufweist. Wenn sich ein Propen-Molekül folglich in der Umgebung der leeren Koordinationsstelle befindet, kann das Propen-Molekül koordinativ an das Metallatom gebunden werden.
- – Unter einem Liganden, der an Propen addiert werden kann, versteht man einen Liganden, der an ein Metallatom koordinativ gebunden ist, in das ein Propen-Molekül (oder ein koordiniertes Ethylenmolekül) zum Beginn oder zur Fortsetzung einer Polymerisierung eingefügt werden kann. Dies kann zum Beispiel die Form der Reaktion (worin L einen Liganden darstellt) wie folgt annehmen: Zu beachten ist die Ähnlichkeit zwischen der Struktur auf der linken Seite dieser Gleichung und der Verbindung (IX) (siehe unten).
- – Unter Oligomerisierung versteht man, dass mindestens 50 Mol-% des oligomerisierten Produktes 18 oder weniger Kohlenstoffatome aufweisen.
- Verbindungen, die hierin als Liganden in Kobaltkomplexen nützlich sind, stellen Diimine von 2,6-Pyridindicarboxaldehyd oder 2,6-Diacylpyridine der allgemeinen Formel dar, worin R1, R2 und R3 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen, R4 und R5 jeweils unabhängig Wasserstoff, Hydrocarbyl, eine inerte funktionelle Gruppe oder substituiertes Hydrocarbyl darstellen und R6 und R7 Aryl oder substituiertes Aryl darstellen.
- (IV) kann durch die Reaktion einer Verbindung der Formel mit einer Verbindung der Formel H2NR6 oder H2NR7 hergestellt werden, worin R1, R2 und R3 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen, R4 und R5 jeweils unabhängig Wasserstoff, Hydrocarbyl oder substituiertes Hydrocarbyl darstellen. R4 und R5 sind jeweils bevorzugt Wasserstoff oder Hydrocarbyl, und R6 und R7 stellen Aryl oder substituiertes Aryl dar. Diese Reaktionen werden häufig mittels Carbonsäuren, wie zum Beispiel Ameisensäure, katalysiert.
- Bevorzugte Verbindungen der Formel (IV) und Verbindungen, worin (IV) ein Ligand darstellt, ungeachtet, ob er in Verbindungen, wie zum Beispiel (I), (II), (VII), (IX) und (XII) vorliegt, stellt eine bevorzugte Verbindung (III) dar, bei der es sich um einen Subset von (IV) handelt.
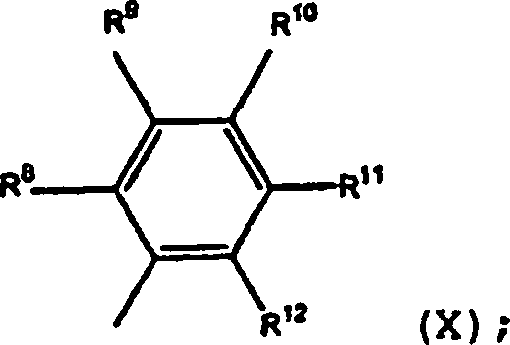
- In (III) und folglich in (I), (II), (IV), (VII), (IX) und (XII), die mit der Formel von (III) zusammenpassen, ist bevorzugt, dass:
R1, R2 und R3 Wasserstoff darstellen; und/oder
R9, R10, R11, R14, R15 und R16 jeweils unabhängig Halogen, Alkyl mit 1 bis 6 Kohlenstoffatom(en) oder Wasserstoff darstellen, und es ist bevorzugter, dass jeweils jedes dieser Wasserstoff darstellt; und/oder
R10 und R15 Methyl darstellen; und/oder
R8 und R13 jeweils unabhängig Halogen, Phenyl oder Alkyl mit 1 bis 6 Kohlenstoffatom(en) darstellen, und es ist besonders bevorzugt, dass jeweils jedes R8 und R13 Alkyl, enthaltend 1–6 Kohlenstoffatom(e) oder Phenyl darstellt, und es ist bevorzugter, dass R8 und R13 für i-Propyl oder t-Butyl stehen;
R12 und R17 jeweils unabhängig Halogen, Phenyl, Wasserstoff oder Alkyl mit 1 bis 6 Kohlenstoffatom(en) darstellen, und es ist besonders bevorzugt, dass jeweils jedes R12 und R17 Akyl darstellt, enthaltend 1–6 Kohlenstoffatom(e), und es ist bevorzugter, dass R12 und R17 für i-Propyl stehen, oder es ist besonders bevorzugt, dass R12 und R17 Wasserstoff darstellen;
R4 und R5 jeweils unabhängig Wasserstoff oder Alkyl mit 1 bis 6 Kohlenstoffatom(en) darstellen, und es ist besonders bevorzugt, dass R4 und R5 jeweils unabhängig Wasserstoff oder Methyl darstellen. - In (IV) und folglich in (I), (II), (VII), (IX) und (XII) ist es auch bevorzugt, dass:
R6 darstellt;
R7 darstellt;
R8 und R13 jeweils unabhängig Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen;
R9, R10, R11, R14, R15 und R16 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen;
R12 und R17 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen;
und vorausgesetzt, dass jedwede zwei von R8, R9, R10, R11, R12, R13, R14, R15, R16 und R17, die vicinal zueinander sind, zusammengenommen einen Ring bilden können. - Es besteht die Annahme, dass die Voluminosität von R6 und/oder R7 bei der Bestimmung hilfreich ist, welche Oligomere gebildet werden, das heißt wie viele Propen-Moleküle sich in dem resultierenden Oligomer durchschnittlich befinden. Eine andere Weise der Angabe desselben besteht darin, dass diese Voluminosität das durchschnittliche Molekulargewicht des Produktes kontrolliert. Es wird angenommen, wenn R6 und/oder R7 voluminöser werden, dass das durchschnittliche Molekulargewicht des hergestellten Oligomers zunimmt. Andere Effekte (einige unerwünscht), wie zum Beispiel Effekte auf die Ausbeuten, können jedoch auch auftreten.
- Spezifische bevorzugte Verbindungen (III) [und auch in (I), (II), (IV), (VII), (IX) und (XII)] sind:
R1, R2, R3, R9, R10, R11, R14, R15 und R16, die Wasserstoff darstellen, R8 und R13, die Chloro darstellen und R4, R5, R12 und R17, die Methyl darstellen;
R1, R2, R3, R9, R10, R11, R14, R15, R16 und R17, die Wasserstoff darstellen, R4 und R5, die Methyl darstellen, und R8 und R13, die Phenyl darstellen;
R1, R2, R3, R4, R10, R11, R14, R15, R16 und R17, die Wasserstoff darstellen, und R8 und R13, die Phenyl darstellen;
R1, R2, R3, R4, R5, R9, R10, R11, R14, R15, und R16, die Wasserstoff darstellen, und R8, R12, R13 und R17, die i-Propyl darstellen; und
R1, R2, R3, R9, R10, R11, R14, R15, R16 und R17, die Wasserstoff darstellen, R4 und R5, die Methyl darstellen, und R8 und R13, die t-Butyl darstellen. - Bei den hierin beschriebenen Oligomerisierungsverfahren ist aus den Ergebnissen ersichtlich, dass es bevorzugt ist, dass mindestens etwas sterische Abdrängung vorhanden ist, die durch den Tridentatliganden um das Co-Atom herum verursacht wird. Deshalb ist es bevorzugt, dass Gruppen dicht am Metallatom relativ groß sind. Es ist relativ einfach, die sterische Abdrängung zu kontrollieren, wenn (III) den Tridentatliganden darstellt, da die Kontrolle der sterischen Abdrängung einfach durch die Kontrolle der Größe von R8, R12, R13 und R16 erreicht werden kann. Diese Gruppen können auch Teil fusionierter Ringsysteme, wie zum Beispiel 9-Anthracenyl darstellen.
- Im bevorzugten Polymerisierungsverfahren, in dem der Komplex durch Kontaktieren einer Verbindung der Formel (II) gebildet wird mit:
- (a) einer ersten Verbindung W, die eine neutrale Lewis-Säure darstellt, die zur Abstraktion einer X–-Gruppe von Cobalt zur Bildung von WX– fähig ist und die auch zur Übertragung einer Alkylgruppe oder eines Hydrids an Cobalt fähig ist, vorausgesetzt, dass WX– ein schwach koordinierendes Anion darstellt; oder
- (b) einer Kombination aus einer zweiten Verbindung, die zur Übertragung einer Alkyl- oder Hydridgruppe an Cobalt fähig ist und einer dritten Verbindung, die eine neutrale Lewis-Säure darstellt, die zur Abstraktion einer X–-Gruppe von Cobalt zur Bildung eines schwach koordinierenden Anions fähig ist;
- Es ist bevorzugt, dass X Chlorid, Bromid und Tetrafluorborat, eine Alkylgruppe oder ein Hydrid darstellt.
- Im hierin beschriebenen bevorzugten Polymerisierungsverfahren wird ein Cobaltkomplex (II) mit Ethylen und einer neutralen Lewis-Säure W, die zur Abstraktion von X– von Cobalt zur Bildung von WX–, einem schwach koordinierenden Anion fähig ist, in Kontakt gebracht und muss zum Alkylieren an das Metallatom oder zum Addieren eines Hydridions an das Metallatom fähig sein, oder es muss ein zusätzliches Alkylierungsmittel oder ein Mittel zum Addieren eines Hydridanions an das Metallatom vorliegen. Die neutrale Lewis-Säure ist ursprünglich ungeladen (das heißt nicht ionisch) Geeignete neutrale Lewis-Säuren schließen SbF5, Ar3B (worin Ar für Aryl steht) und BF3 ein. Geeignete kationische Lewis-Säuren oder Brønsted-Säuren schließen NaBAF, Silbertrifluormethansulfonat, HBF4 oder [C6H5N(CH3)2]+ [B(C6F5)4]– ein. In den Fällen, in denen (Π) (und ähnliche Katalysatoren, die das Vorliegen einer neutralen Lewis-Säure oder einer kationischen Lewis oder Brønsted-Säure erforderlich machen), kein Alkyl- oder keine Hydridgruppe enthält, die bereits an das Metallatom gebunden ist, die neutrale Lewis-Säure oder eine kationische Lewis- oder Brønsted-Säure auch an das Metall alkyliert oder ein Hydrid an das Metall addiert oder ein getrenntes Alkylierungs- oder Hydrierungsmittel vorliegt, das heißt eine Alkylgruppe oder Hydrid veranlasst, an das Metallatom gebunden zu werden.
- Es ist bevorzugt, dass die Alkylgruppe (R20) 1 bis 4 Kohlenstoffatom(e) enthält und bevorzugter, dass R20 Methyl oder Ethyl darstellt.
- Alkylaluminiumverbindungen (siehe nächsten Abschnitt) können zum Beispiel alkylieren (II). Nicht alle Alkylaluminiumverbindungen können jedoch ausreichend starke Lewis-Säuren sein, um X– oder eine Alkylgruppe aus dem Metallion zu abstrahieren. In diesem Fall muss eine getrennte Lewis-Säure vorhanden sein, die zur Abstraktion stark genug ist. In Beispiel 39 wird zum Beispiel Polymethylaluminoxan als die „einzige" Lewis-Säure verwendet, die sowohl alkyliert als auch die Abstraktion aus dem Metallatom durchführt.
- Eine bevorzugte neutrale Lewis-Säure, die das Metall alkylieren kann, ist eine ausgewählte Alkylaluminiumverbindung, wie zum Beispiel R20 3Al, R20AlCl2, R20 2AlCl und „R20AlO" (Alkylaluminoxane), worin R20 für Alkyl steht, das 1 bis 25 Kohlenstoffatom(e), bevorzugt 1 bis 4 Kohlenstoffatom(e) enthält. Geeignete Alkylaluminiumverbindungen schließen Polymethylaluminoxan (bei dem es sich um ein Oligomer mit der allgemeinen Formel [MeAlO]n handelt), modifiziertes [MeAlO]n, worin eine Minderheit der Methylgruppen durch eine andere Alkylgruppe ersetzt werden, (C2H5)2AlCl, C2H5AlCl2 und [(CH3)2CHCH2]3Al ein.
- Metallhydride, wie zum Beispiel NaBH4 können zur Bindung der Hydridgruppen an das Metall M verwendet werden.
- Im hierin beschriebenen erfindungsgemäßen Polymerisierungsverfahren wird entweder ein Cobaltkomplex von (I) entweder dem Polymerisierungsverfahren zugefügt oder in situ im Verfahren gebildet. In der Tat kann während des Verfahrensablaufs mehr als ein solcher Komplex gebildet werden, wie zum Beispiel Bildung eines initialen Komplexes und dann Reaktion dieses Komplexes zur Bildung eines Polymers mit lebendem Ende, das einen derartigen Komplex enthält.
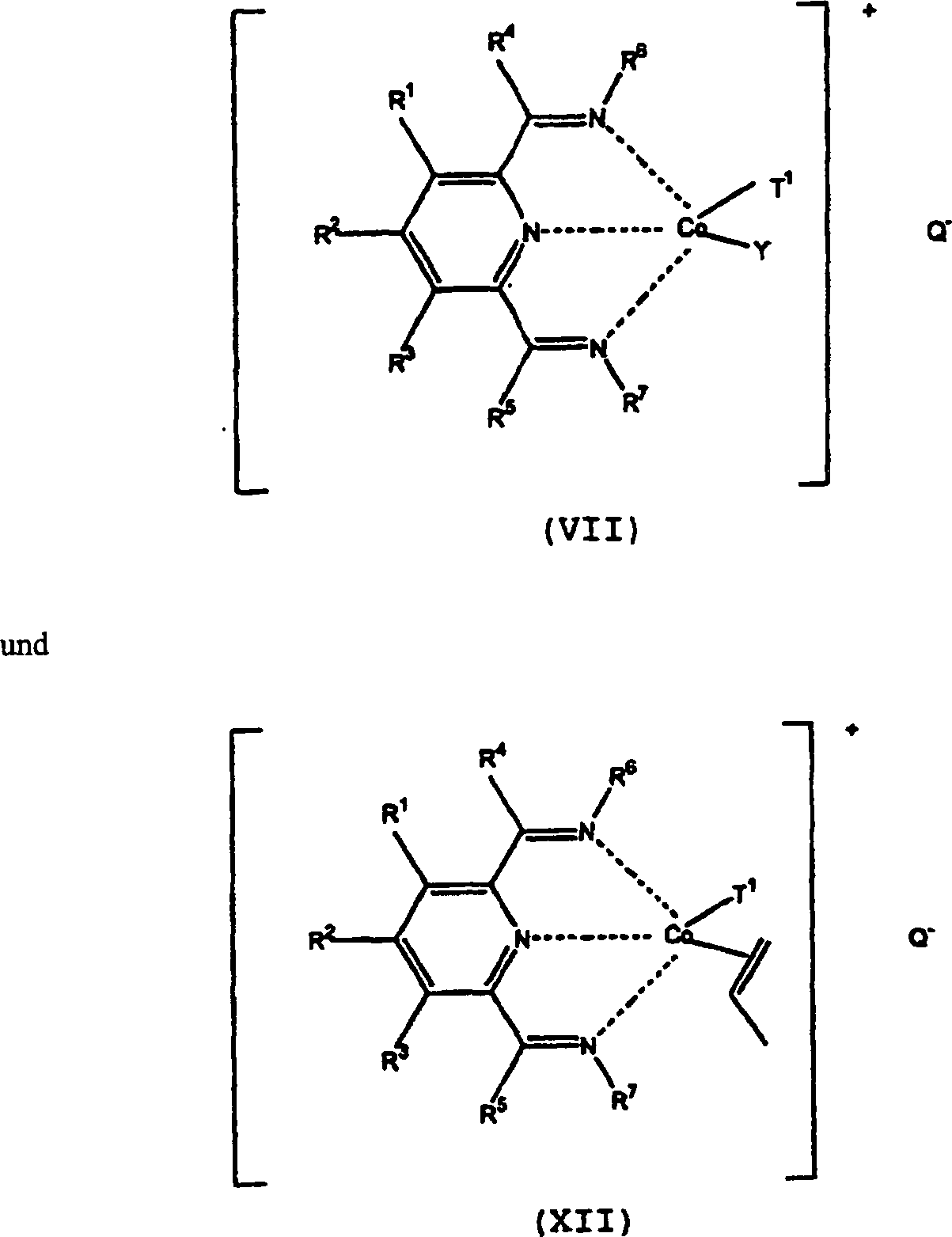
- Beispiele solcher Komplexe, die initial in situ gebildet werden können, schließen folgende ein: worin R1 bis R7 wie oben definiert sind, T1, Hydrid oder Alkyl oder jedweden anderen anionischen Liganden, in dem Propen eingefügt werden kann, darstellt, Y einen neutralen Liganden, der durch Propen verdrängt werden kann oder eine vakante Koordinationsstelle darstellt und Q ein relativ nicht koordinierendes Anion darstellt. Komplexe können dem Verfahren direkt zugefügt oder in situ gebildet werden. So kann (VII) zum Beispiel durch die Reaktion von (II) mit einer neutralen Lewis-Säure, wie zum Beispiel einer Alkylaluminiumverbindung, gebildet werden. Ein anderes Verfahren zur Bildung eines derartigen Komplexes in situ besteht im Zufügen einer geeigneten Cobaltverbindung, wie zum Beispiel Cobalt[II]-acetylacetonat, (I) und eine Alkylaluminiumverbindung. Andere Metallsalze, in denen dem Acetylacetonat ähnliche Anionen vorliegen können durch Reaktion mit der Lewis- oder Brønsted-Säure entfernt werden. Es können zum Beispiel Metallhalogenide und Carboxylate (wie zum Beispiel Acetate), insbesondere, wenn sie im Prozessmedium wenig löslich sind, verwendet werden. Es ist bevorzugt, dass diese Präkursor-Metallsalze im Prozessmedium mindestens etwas löslich sind.
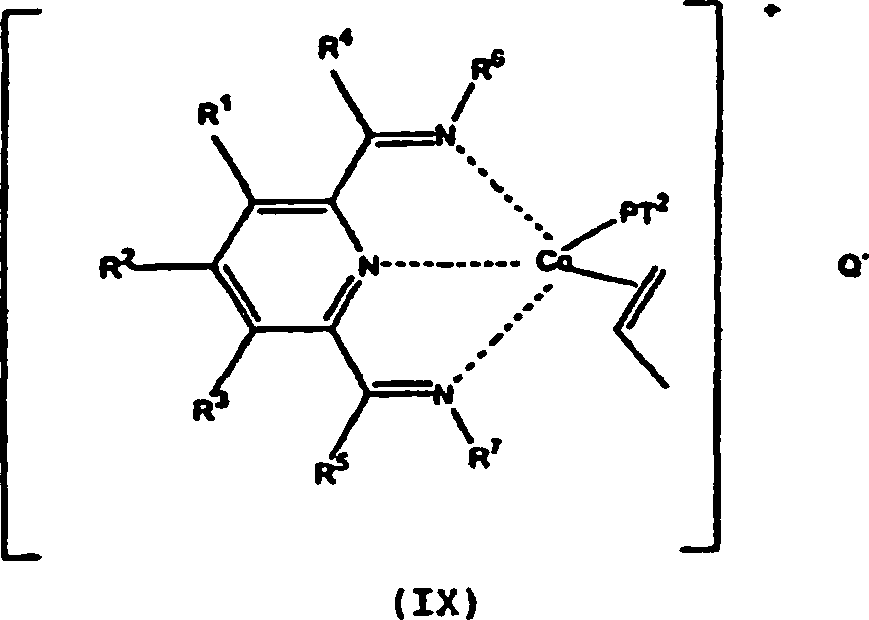
- Nachdem die Oligomerisierung des Propens begonnen hat, kann der Komplex in einer Form, wie zum Beispiel vorliegen, worin R1 bis R7 und Q wie vorstehend definiert sind und P eine divalente (Oligo)propengruppe darstellt und T2 eine Endgruppe, wie zum Beispiel die für T1 vorstehend aufgelisteten Gruppen, darstellt. Der Durchschnittsfachmann wird erkennen, dass (IX) im Wesentlichen ein Oligomer darstellt, das ein sogenanntes lebendes Ende enthält. Es ist bevorzugt, dass Co in (VII), (VIII) und (IX) im +2-Oxidationszustand vorliegt. Verbindungen, wie zum Beispiel (VII), (IX) und (XII) können oder können nicht von einer Umgebung entfernt, die der des Polymerisierungsverfahrens ähnlich ist, stabil sein, sie können aber anhand der NMR-Spektroskopie, insbesondere anhand einer oder beider, 1H- und 13C-NMR, und insbesondere bei niedrigeren Temperaturen, nachgewiesen werden. Derartige Verfahren, insbesondere für die Polymerisierung von „Intermediärprodukten" dieser Typen sind bekannt, siehe zum Beispiel Weltpatentanmeldung 96/23010, insbesondere Beispiele 197–203.
- In allen den Oligomerisierungsverfahren hierin liegt die Temperatur, bei der die Propen-Oligomerisierung durchgeführt wird, bei –100°C bis +200°C, bevorzugt –60°C bis 150°C, bevorzugter –50°C bis 100°C. Der Propendruck, bei dem die Polymerisierung durchgeführt wird, ist nicht kritisch, wobei ein atmosphärischer Druck bis ca. 275 MPa ein geeigneter Bereich ist.
- Die Oligomerisierungsverfahren hierin können in Gegenwart verschiedener Flüssigkeiten, insbesondere aprotischer organischer Flüssigkeiten durchgeführt werden. Das Katalysatorsystem, Propen und Propen-Oligomer können in diesen Flüssigkeiten löslich oder unlöslich sein, offensichtlich sollten diese Flüssigkeiten die Oligomerisierung aber nicht am Auftreten hindern. Geeignete Flüssigkeiten schließen Alkane, Cycloalkane, ausgewählte halogenierte Kohlenwasserstoffe, (flüssiges) Propen und aromatische Kohlenwasserstoffe ein. Spezifische nützliche Lösungsmittel schließen Hexan, Toluen und Benzen ein. Eine bevorzugte Flüssigkeit ist das Propen-Oligomer selbst.
- Die Propen-Oligomerisierungen hierin können auch initial im Festzustand durchgeführt werden [vorausgesetzt, dass (II), (IV) oder (VII) ein Feststoff ist] durch zum Beispiel Tragen von (II), (IV) oder (VII) auf ein Substrat, wie zum Beispiel Siliciumdioxid oder Aluminiumoxid, durch sein Aktivieren mit der Lewis-Säure (wie zum Beispiel W, zum Beispiel einer Alkylaluminiumverbindung) oder Brønsted-Säure und durch sein Aussetzen gegenüber einem polymerisierbaren oder oligomerisierbaren Olefin. Ein alternatives Verfahren besteht darin, den Träger mit W zur Reaktion zu bringen oder zu behandeln, dann den behandelten Träger mit (II), IV) oder (VII) zur Reaktion zu bringen; oder W und (II), (IV) oder (VII) können gemischt werden und der Träger dann mit der resultierenden Lösung behandelt werden. Der Träger kann auch dazu in der Lage sein, den Platz der Lewis- oder Brønsted-Säure, zum Beispiel eines sauren Tons, wie zum Beispiel Montmorillonit, einzunehmen. Ein anderes Verfahren zur Herstellung eines Trägerkatalysators besteht darin, eine Polymerisierung zu starten oder mindestens einen Cobaltkomplex aus einem anderen Olefin oder Oligomer eines Olefins, wie zum Beispiel Cyclopenten auf einem Träger, wie zum Beispiel Siliciumdioxid oder Aluminiumoxid, herzustellen. Diese "heterogenen" Katalysatoren können zum Katalysieren der Oligomerisierung in der Gasphase oder der Flüssigphase verwendet werden. Unter Gasphase versteht man, dass das Propen zum Kontakt mit dem Katalysatorpartikel transportiert wird, während sich das Propen in der Gasphase befindet.
- Die in den Beispielen und Experimenten angegebenen Drücke sind Überdrücke. Die folgenden Abkürzungen und Begriffe werden verwendet:
- Verzweigung – berichtet als die Zahl der Methylgruppen pro 1000 Methylgruppen im Oligomer. Sie sind nicht für Endgruppen bereinigt.
FG – Formelgewicht
GC – Gaschromatographie
GC/MS – Gaschromatographie mit anschließender Massenspektrometrie
GPC – Gelpermeationschromatographie
MeOH – Methanol
PMAO – Polymethylaluminoxan
RT – Raumtemperatur
THF – Tetrahydrofuran - EXPERIMENT 1
- 2,6-DIACETYLPYRIDIN-BIS(2-CHLOR-6-METHYLPHENYLIMIN)
- In einen 200 ml fassenden Rundkolben wurden 2,0 g 2,6-Diacetylpyridin (FG 163,18, 0,0122 Mol) und 50 ml Methanol gegeben. Als Nächstes wurden 3,45 g 2-Chlor-6-methylanilin (FG 141,60, 0,0245 Mol), gefolgt von drei Tropfen Ameisensäure zugefügt, und die Lösung wurde bei RT unter Stickstoff über 4 Tage gerührt, zu welcher Zeit sich kein Präzipitat gebildet hatte. Die Reaktion wurde dann 24 h unter Rückfluss erhitzt. Die GC-Analyse deutete darauf hin, dass die Reaktion unvollständig war. Das Erhitzen unter Rückfluss wurde insgesamt eine Woche fortgesetzt. Das Lösungsmittel wurde mittels Rotovap aus dem Reaktionsgemisch entfernt. Die Flash-Chromatographie durch eine basische Aluminiumoxidsäule (eluiert mit Hexan/Ethylacetat 20 : 1) führte zur Isolierung eines Öls. Das Öl wurde dann aus dem Methanol/Methylenchlorid kristallisiert. Gesammelt wurden 0,21 g (4,2% Ausbeute) blassgelber Kristalle. 1H-NMR (ppm, CDCl3): 2,12 (s, 6H), 2,32 (s, 6H), 6,95 (t, 2H), 7,13 (d, 2H), 7,30 (d, 2H), 7,92 (t, 1H), 8,5 (d, 2H).
- EXPERIMENT 2
- 2,6-DIACETYLPYRIDIN-BIS(2-BIPHENYLIMIN)
- In einen 100 ml fassenden Rundkolben wurden 0,48 g 2,6-Diacetylpyridin (FG 163,18, 0,0295 Mole), 1,0 g 2-Aminobiphenyl (FG 169,23, 0,0059 Mole) und 20 ml Methanol gegeben. Drei Tropfen Ameisensäure wurden zugefügt und die sich ergebende Lösung unter Stickstoff gerührt. Nach einem Tag bildete sich ein Präzipitat. Dies wurde abfiltriert, mit kaltem Methanol gewaschen und getrocknet. Gesammelt wurden 0,84 g (61% Ausbeute) eines blassgelben Feststoffes. 1H-NMR (ppm, CDCl3): 2,15 (s, 6H), 6,8 (d, 2H), 7,15–7,50 (m, 16H), 7,75 (t, 1H), 8,10 (d, 2H).
- EXPERIMENT 3
- 2,6-PYRIDINDICARBOXALDEHYD-BIS(2,6-DIISOPROPYLPHENYLIMIN)
- In einen 35 ml fassenden Rundkolben wurden 0,28 g 2,6-Pyridindicarboxyaldehyd (FG 135,12, 0,00207 Mole), 0,73 g 2,6-Diisopropylanilin (FG 177,29, 0,00414 Mole) und 15 ml Methanol gegeben. Drei Tropfen Ameisensäure wurden zugefügt und die sich ergebende Lösung gerührt. Innerhalb von 5 min bildete sich ein Präzipitat. Das Rühren wurde über Nacht fortgesetzt. Der Feststoff wurde abfiltriert, mit kaltem Methanol gewaschen und getrocknet. Gesammelt wurden 0,86 g (91,5% Ausbeute) eines blassgelben Feststoffes. 1H-NMR (ppm, CDCl3): 1,2 (d, 24H), 3,0 (m, 4H), 7,0–7,2 (m, 6H), 8,0 (t, 1H), 8,35 (s, 2H), 8,4 (d, 2H).
- EXPERIMENT 4
- 2,6-DIACETYLPYRIDIN-BIS(2-TERT-BUTYLPHENYLIMIN)
- In einen 200 ml fassenden Rundkolben wurden 2,0 g 2,6-Diacetylpyridin (FG 163,18, 0,0122 Mole) in 25 ml Methanol aufgelöst. Als Nächstes wurden 3,66 g 2-tert-Butylanilin (FG 149,24, 0,0245 Mole) und 3 Tropfen Ameisensäure zugefügt. Nach 30 min begann sich ein Präzipitat zu bilden. Die Lösung wurde über Nacht bei Raumtemperatur gerührt. Das Präzipitat wurde abfiltriert, mit kaltem Methanol gewaschen und dann getrocknet. Gesammelt wurden 3,88 g (75% Ausbeute) eines gelben Feststoffes. Die NMR ergab, dass der Feststoff hauptsächlich das Monoimin-Produkt war. Der vorstehende Feststoff (3,85 g, FG 294,4, 0,013 Mol) wurde in einen 200 ml fassenden Kolben gegeben. Es wurden 1,95 g 2-t-Butylanilin, Methanol und 4 Tropfen Ameisensäure zugefügt. Das Gemisch wurde unter Rückfluss erhitzt, bevor langsam Chloroform zugefügt wurde, bis sich alle Feststoffe aufgelöst hatten. Nach 48 Stunden wurde das Volumen reduziert und die Reaktion zur Präzipitation von mehr Feststoffen abgekühlt. Diese wurden aus dem Methanol und einer Minimummenge Chloroform isoliert und rekristallisiert, was eine Ausbeute des Produktes von 2,8 g ergab. 1H-NMR (ppm, CDCl3): 1,4 (s, 18H), 2,4 (s, 6H), 6,55 (d, 2H), 7,1 (t, 2H), 7,2 (t, 2H), 7,45 (d, 2H), 7,9 (t, 1H), 8,4 (d, 2H).
- EXPERIMENT 5
- [2,6-DIACETYLPYRIDIN-BIS(2-CHLOR-6-METHYLPHENYLIMIN)]COBALT[II]-CHLORID
- In einer trockenen, sauerstofffreien Atmosphäre wurde CoCl2 (wasserfrei, 0,062 g) in einem Minimum von trockenem THF aufgelöst. Es wurde 2,6-Diacetylpyridin-bis(2-chlor-6-methylphenylimin) (0,205 g) zugefügt, und die Lösung schlug nach grün um, und es bildete sich ein grünes Präzipitat. Das Gemisch wurde 2 Tage bei RT gerührt, wonach das Volumen der Lösung um die Hälfte reduziert wurde und zum Präzipitieren des Produkts Pentan zugefügt wurde, das abfiltriert, mit Pentan gewaschen und getrocknet wurde. Ausbeute: 0,240 g.
- EXPERIMENT 6
- [2,6-DIACETYLPYRIDIN-BIS(2-BIPHENYLIMIN)]COBALT[II]-CHLORID
- In einer trockenen, sauerstofffreien Atmosphäre wurde CoCl2 (wasserfrei, 0,135 g) in einem Minimum trockenem THF aufgelöst. Es wurde 2,6-Diacetylpyridin-bis(2-biphenylimin) (0,500 g) zugefügt, und die Lösung wurde dunkel, und es bildete sich ein braunes Präzipitat. Das Gemisch wurde 2 Tage bei RT gerührt, wonach das Volumen reduziert und Pentan zugefügt wurde. Das Produkt wurde abfiltriert, mit Pentan gewaschen und getrocknet. Ausbeute: 0,500 g.
- EXPERIMENT 7
- [2,6-PYRIDINDICARBOXALDEHYD-BIS(2,6-DIISOPROPYLPHENYLIMIN)]COBALT[II]-CHLORID
- In einer trockenen, sauerstofffreien Atmosphäre wurde CoCl2 (wasserfrei, 0,072 g) in einem Minimum von trockenem THF aufgelöst. Es wurde 2,6-Pyridindicarboxaldehyd-bis(2,6-diisopropylphenylimin) (0,256 g) zugefügt, und die Lösung wurde dunkel und schlug nach grün um. Das Gemisch wurde 4 Tage bei RT gerührt, wonach das Volumen reduziert und Pentan zugefügt wurde. Das Produkt wurde abfiltriert, mit Benzen und Pentan gewaschen und getrocknet. Ausbeute: 0,26 g.
- EXPERIMENT 8
- [2,6-DIACETYLPYRIDIN-BIS(2-T-BUTYLPHENYLIMIN))COBALT[II]-CHLORID
- In einer trockenen, sauerstofffreien Atmosphäre wurde CoCl2 (wasserfrei, 0,168 g) in einem Minimum trockenem THF aufgelöst. Es wurde 2,6-Diacetylpyridin-bis(2-t-butylphenylimin) (0,553 g) zugefügt, und die Lösung wurde dunkel, und es bildete sich rasch ein braunes Präzipitat. Das Gemisch wurde über Nacht bei RT gerührt, wonach Pentan zugefügt wurde. Das Produkt wurde abfiltriert, mit Pentan gewaschen und getrocknet. Ausbeute: 0,66 g.
- In den Beispielen wurden 13C-NMR-Spektren an einem Bruker DRX Avance 500 Hz Instrument bei 30°C mit einer Nalorac 10 mm Sonde unter Verwendung eines Pulses von 90°, digitaler Filtrierung und digitaler Sperre, einer Spektrumbreite von 29 Hz, einer Aquisitionszeit von 0,64 sec und einer Verzögerung zwischen den Pulsen von 10 sec erhalten. Die Proben betrugen in CDCl3 mit 0,05 M CrAcAc 10 oder 20 Gew.-%. Es wurden eine Reihe verschiedener 2D-NMR-Experimente zur Unterstützung der Zuordnungen, einschließlich HMQC, HMBC, HSQC-TOCSY und TOCSY verwendet.
- In den Beispielen werden bestimmte Verbindungen mit der Formel (II) als „Katalysatoren" verwendet. In diesen Verbindungen stellen R1, R2 und R3 Wasserstoff dar, n steht für 2 und X stellt Cl dar. Der Rest der Substituenten sind in Tabelle 1 ersichtlich.
- BEISPIEL 1
- Im Inneren einer Trockenkammer unter einer Stickstoffatmosphäre wurde Katalysator 1 (12,4 mg, 0,02 mmol) in wasserfreiem Toluen (25 ml) in einem Schlenk-Kolben aufgeschlämmt. Der Kolben wurde fest verschlossen, aus der Trockenkammer entfernt und in einer Atmosphäre aus Propen (35 kPa) gestellt und auf 0°C abgekühlt. Der Cokatalysator, PMAO (0,5 ml, 9,3 Gew.-% Al in Toluen, Akzo) wurde unter kräftigem Rühren zugefügt und der Reaktion ermöglicht, 5 h bei 0°C abzulaufen, wonach sie auf RT erwärmt wurde und ermöglicht wurde, dass sie weitere 16 h reagierte. Die Reaktion wurde durch die Zugabe von MeOH/10% HCl abgeschreckt, und die Toluenphase wurde dekantiert. Toluen und die Oligomere mit niedrigerem Molekulargewicht (bis zu und einschließlich eines bedeutenden Anteils der C9-Fraktion) wurden unter Vakuum entfernt. Die übrigen Oligomere wurden mithilfe der GC, GC/MS und 13C-NMR analysiert. Ausbeute = 2,3 g.
Spezies Mol-% 1-en 8,9 2-en trans 30,1 2-en cis 16,2 3-en trans 1,5 3-en cis NN 4-en trans 18,1 2-Methylen 1,5 3-Methylen NN 4+-Methylen 1,3 5+-en 22,5 Me pro en (%) 3 1B1/1000CH2 ca. 3 - NN
- Nicht nachgewiesen
- Me pro en (%)
- Zahl der Methylverzweigungen pro Auftreten einer Doppelbindung.
- 1B1/1000 CH2
- Zahl der Methylverzweigungen pro 1000 CH2.
- BEISPIEL 2
- Im Inneren einer Trockenkammer unter einer Stickstoffatmosphäre wurde Katalysator 2 (32 mg, 0,06 mmol) in wasserfreiem Toluen (25 ml) in einem Schlenk-Kolben aufgeschlämmt. Der Kolben wurde fest verschlossen, aus der Trockenkammer entfernt und in einer Atmosphäre aus Propen (35 kPa) gestellt und auf 0°C abgekühlt. Der Cokatalysator, PMAO (0,5 ml, 9,3 Gew.-% Al in Toluen, Akzo) wurde unter kräftigem Rühren zugefügt und der Reaktion ermöglicht, bei 0°C 5 h abzulaufen, wonach sie auf RT erwärmt wurde und erlaubt wurde, dass sie weitere 16 h reagierte. Die Reaktion wurde durch die Zugabe von MeOH/10% HCl abgeschreckt, und die Toluenphase dekantiert. Toluen und die Oligomere mit niedrigerem Molekulargewicht (bis zu und einschließlich eines bedeutenden Anteils der C9-Fraktion) wurden unter Vakuum entfernt. Die übrigen Oligomere wurden mithilfe der GC, GC/MS und 13C-NMR analysiert. Ausbeute = 3,7 g.
- Die gleichen Spezies, die in Beispiel 1 vorlagen, liegen auch in dieser Probe vor. Die nicht nachgewiesenen (NN) Spezies sind auch die gleichen. In dieser Probe traten jedoch mehrere zusätzliche olefinische Resonanzen auf. Es liegen ca. 50–100 1B1 Methyle pro 1000 Methylene vor.
- BEISPIEL 3
- Im Inneren einer Trockenkammer unter einer Stickstoffatmosphäre wurde Katalysator 3 (35 mg, 0,06 mmol) in wasserfreiem Toluen (25 ml) in einem Schlenk-Kolben aufgeschlämmt. Der Kolben wurde fest verschlossen, aus der Trockenkammer entfernt und in einer Atmosphäre aus Propen (35 kPa) gestellt und auf 0°C abgekühlt. Der Cokatalysator, PMAO (0,5 ml, 9,3 Gew.-% Al in Toluen, Akzo) wurde unter kräftigem Rühren zugefügt und der Reaktion erlaubt, 5 h bei 0°C abzulaufen, wonach sie auf RT erwärmt wurde und ihr erlaubt wurde, weitere 16 h zu reagieren. Die Reaktion wurde durch die Zugabe von MeOH/10% HCl abgeschreckt, und die Toluenphase wurde dekantiert. Die GC-Analyse dieses Rohreaktionsproduktes wies auf das Vorliegen einer kleinen Oligomermenge hin.
- BEISPIEL 4
- Im Inneren einer Trockenkammer unter einer Stickstoffatmosphäre wurde Katalysator 4 (34 mg, 0,06 mmol) in wasserfreiem Toluen (25 ml) in einem Schlenk-Kolben aufgeschlämmt. Der Kolben wurde fest verschlossen, aus der Trockenkammer entfernt und in einer Atmosphäre aus Propen (35 kPa) gestellt und auf 0°C abgekühlt. Der Cokatalysator, PMAO (0,5 ml, 9,3 Gew.-% Al in Toluen, Akzo) wurde unter kräftigem Rühren zugefügt und der Reaktion erlaubt, 5 h bei 0°C abzulaufen, wonach er auf RT erwärmt wurde und ihm erlaubt wurde, weitere 16 h zu reagieren. Die Reaktion wurde durch die Zugabe von MeOH/10% HCl abgeschreckt, und die Toluenphase dekantiert. Die GC-Analyse dieses Rohreaktionsproduktes wies auf das Vorliegen einer kleinen Oligomermenge hin.
- BEISPIEL 5
- Im Inneren einer Trockenkammer unter einer Stickstoffatmosphäre wurde Katalysator 5 (33 mg, 0,06 mmol) in wasserfreiem Toluen (25 ml) in einem Schlenk-Kolben aufgeschlämmt. Der Kolben wurde fest verschlossen, aus der Trockenkammer entfernt und in einer Atmosphäre aus Propen (35 kPa) gestellt und auf 0°C abgekühlt. Der Cokatalysator, PMAO (0,5 ml, 9,3 Gew.-% Al in Toluen, Akzo) wurde unter kräftigem Rühren zugefügt und der Reaktion erlaubt, 5 h bei 0°C abzulaufen, wonach er auf RT erwärmt wurde und ihm erlaubt wurde, weitere 16 h zu reagieren. Die Reaktion wurde durch die Zugabe von MeOH/10% HCl abgeschreckt, und die Toluenphase dekantiert. Die GC-Analyse dieses Rohreaktionsproduktes wies auf das Vorliegen einer kleinen Oligomermenge hin.
jedes X individuell ein Anion darstellt;
n für 1, 2 oder 3 steht, so dass die Gesamtzahl negativer Ladungen an dem besagten Anion oder an den Anionen gleich dem Oxidationszustand eines in (II) vorhandenen Co-Atoms darstellt;
R1, R2 und R3 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen;
R4 und R5 jeweils unabhängig Wasserstoff, Hydrocarbyl, eine inerte funktionelle Gruppe oder substituiertes Hydrocarbyl darstellen; und
R6 und R7 Aryl oder substituiertes Aryl darstellen.
jedes X individuell ein Anion darstellt;
n für 1, 2 oder 3 steht, so dass die Gesamtzahl negativer Ladungen an dem besagten Anion oder an den Anionen gleich dem Oxidationszustand eines in (II) vorhandenen Co-Atones ist;
R1, R2 und R3 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen;
R4 und R5 jeweils unabhängig Wasserstoff, Hydrocarbyl, eine inerte funktionelle Gruppe oder substituiertes Hydrocarbyl darstellen; und
R6 und R7 Aryl oder substituiertes Aryl darstellen.
Claims (14)
- Verfahren zur Oligomerisierung von Propen, umfassend den Schritt des Kontaktierens, bei einer Temperatur von –100°C bis +200°C, eines Co[II]- oder Co[III]-Komplexes eines dreizähnigen Liganden der Formel mit Propen, worin: R1, R2 und R3 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen; R4 und R5 jeweils unabhängig Wasserstoff, Hydrocarbyl, eine inerte funktionelle Gruppe oder substituiertes Hydrocarbyl darstellen; und R6 und R7 Aryl oder substituiertes Aryl darstellen; und vorausgesetzt, dass ein Co[II]- oder Co[III]-Atom (i) auch eine leere Koordinationsstelle oder an ihm gebunden einen Liganden, der von dem Propen verdrängt werden kann und (ii) einen Liganden, der an das Propen addiert werden kann, aufweist.
- Verfahren nach Anspruch 1, dadurch gekennzeichnet, dass der Komplex durch Kontaktieren einer Verbindung der Formel gebildet wird mit: (a) einer ersten Verbindung W, die eine neutrale Lewis-Säure darstellt, die zur Abstraktion einer X–-Gruppe von Co zur Bildung von WX– fähig ist und die auch zur Übertragung einer Alkylgruppe oder eines Hydrids an Co fähig ist, vorausgesetzt, dass WX– ein schwach koordinierendes Anion darstellt; oder (b) einer Kombination aus einer zweiten Verbindung, die zur Übertragung einer Alkyl- oder Hydridgruppe an Co fähig ist und einer dritten Verbindung, die eine neutrale Lewis-Säure darstellt, die zur Abstraktion einer X–-Gruppe von Co zur Bildung eines schwach koordinierenden Anions fähig ist; worin: jedes X individuell ein Anion darstellt; n für 1, 2 oder 3 steht, so dass die Gesamtzahl negativer Ladungen an dem Anion oder an den Anionen gleich dem Oxidationszustand eines in (II) vorhandenen Co-Atoms ist; R1, R2 und R3 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen; R4 und R5 jeweils unabhängig Wasserstoff, Hydrocarbyl, eine inerte funktionelle Gruppe oder substituiertes Hydrocarbyl darstellen; und R6 und R7 Aryl oder substituiertes Aryl darstellen.
- Verfahren nach Anspruch 2, dadurch gekennzeichnet, dass X Chlorid, Bromid, Tetrafluorborat, eine Alkylgruppe oder ein Hydrid darstellt.
- Verfahren nach Anspruch 2, dadurch gekennzeichnet, dass die neutrale Lewis-Säure eine Alkylaluminiumverbindung darstellt.
- Verfahren nach Anspruch 4, dadurch gekennzeichnet, dass die Alkylaluminiumverbindung Polymethylaluminoxan darstellt.
- Verfahren nach einem der Ansprüche 1–5, dadurch gekennzeichnet, dass: R6 darstellt; R7 darstellt; R8 und R13 jeweils unabhängig Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen; R9, R10, R11, R14, R15 und R16 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen; R12 und R17 jeweils unabhängig Wasserstoff, Hydrocarbyl, substituiertes Hydrocarbyl oder eine inerte funktionelle Gruppe darstellen; und vorausgesetzt, dass jedwede zwei von R8, R9, R10, R11, R12, R13, R14, R15, R16 und R17, die vicinal zueinander sind, zusammengenommen einen Ring bilden können.
- Verfahren nach Anspruch 6, dadurch gekennzeichnet, dass: R1, R2 und R3 Wasserstoff darstellen; R9, R10, R11, R14, R15 und R16 jeweils unabhängig Halogen, Alkyl mit 1 bis 6 Kohlenstoffatom(en) oder Wasserstoff darstellen; R8 und R13 jeweils unabhängig Halogen, Phenyl oder Alkyl mit 1 bis 6 Kohlenstoffatom(en) darstellen; R12 und R17 jeweils unabhängig Halogen, Phenyl, Wasserstoff oder Alkyl mit 1 bis 6 Kohlenstoffatom(en) darstellen; und R4 und R5 jeweils unabhängig Wasserstoff oder Alkyl mit 1 bis 6 Kohlenstoffatom(en) darstellen.
- Verfahren nach Anspruch 7, dadurch gekennzeichnet, dass R9, R10, R11, R14, R15 und R16 jeweils Wasserstoff darstellen.
- Verfahren nach Anspruch 7, dadurch gekennzeichnet, dass R8 und R13 jeweils Alkyl mit 1–6 Kohlenstoffatom(en) oder Phenyl darstellen und R12 und R17 Wasserstoff darstellen.
- Verfahren nach Anspruch 9, dadurch gekennzeichnet, dass R4 und R5 jeweils Wasserstoff oder Methyl darstellen.
- Verfahren nach Anspruch 7, dadurch gekennzeichnet, dass; R1, R2, R3, R9, R10, R11, R14, R15 und R16 Wasserstoff darstellen, R8 und R13 Chloro darstellen und R4, R5, R12 und R17 Methyl darstellen; oder R1, R2, R3, R9, R10, R11, R14, R15, R16 und R17 Wasserstoff darstellen, R4 und R5 Methyl darstellen und R8 und R13 Phenyl darstellen; oder R1, R2, R3, R4, R5, R10, R11, R14, R15, R16 und R17 Wasserstoff darstellen und R8 und R13 Phenyl darstellen; oder R1, R2, R3, R4, R5, R9, R10, R11, R14, R15 und R16 Wasserstoff darstellen und R8, R12, R13 und R17 i-Propyl darstellen; oder R1, R2, R3, R9, R10, R11, R14, R15, R16 und R17 Wasserstoff darstellen, R4 und R5 Methyl darstellen und R8 und R13 t-Butyl darstellen.
- Verfahren nach einem der Ansprüche 1–5, dadurch gekennzeichnet, dass die Temperatur –50°C bis 100°C beträgt.
- Verfahren nach einem der Ansprüche 1–5, dadurch gekennzeichnet, dass es sich bei einem Druck des Propens um atmosphärischen Druck bis 275 MPa handelt.
- Verfahren nach einem der Ansprüche 2–5, dadurch gekennzeichnet, dass das Alkyl 1 bis 4 Kohlenstoffatom(e) enthält.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US53944 | 1998-04-02 | ||
| US09/053,944 US6063881A (en) | 1998-04-02 | 1998-04-02 | Oligomerization of propylene |
| PCT/US1999/006817 WO1999051550A1 (en) | 1998-04-02 | 1999-03-30 | Oligomerization of propylene |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69918076D1 DE69918076D1 (de) | 2004-07-22 |
| DE69918076T2 true DE69918076T2 (de) | 2005-01-20 |
Family
ID=21987633
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69918076T Expired - Fee Related DE69918076T2 (de) | 1998-04-02 | 1999-03-30 | Verfahren zur oligomerisierung von propen |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US6063881A (de) |
| EP (1) | EP1066229B1 (de) |
| JP (1) | JP2002510661A (de) |
| CN (1) | CN1296466A (de) |
| AT (1) | ATE269286T1 (de) |
| DE (1) | DE69918076T2 (de) |
| WO (1) | WO1999051550A1 (de) |
Families Citing this family (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6417305B2 (en) * | 1996-12-17 | 2002-07-09 | E. I. Du Pont De Nemours And Company | Oligomerization of ethylene |
| US6214761B1 (en) * | 1996-12-17 | 2001-04-10 | E. I. Du Pont De Nemours And Company | Iron catalyst for the polymerization of olefins |
| US6432862B1 (en) * | 1996-12-17 | 2002-08-13 | E. I. Du Pont De Nemours And Company | Cobalt catalysts for the polymerization of olefins |
| JP2000001512A (ja) * | 1998-06-16 | 2000-01-07 | Mitsui Chemicals Inc | オレフィン重合用触媒およびオレフィンの重合方法 |
| GB9817004D0 (en) * | 1998-08-06 | 1998-09-30 | Bp Chem Int Ltd | Preparation of polymerisation catalysts |
| ATE275587T1 (de) * | 1998-11-30 | 2004-09-15 | Bp Chem Int Ltd | Polymerisationsverfahren |
| AU6866600A (en) * | 1999-09-02 | 2001-04-10 | Idemitsu Petrochemical Co., Ltd. | Transition metal compounds, catalysts for the production of alpha-olefins and process therefor |
| GB9923072D0 (en) * | 1999-09-29 | 1999-12-01 | Bp Chem Int Ltd | Polymerisation catalyst |
| US6710006B2 (en) * | 2000-02-09 | 2004-03-23 | Shell Oil Company | Non-symmetrical ligands and catalyst systems thereof for ethylene oligomerization to linear alpha olefins |
| US6521724B2 (en) | 2000-03-10 | 2003-02-18 | E. I. Du Pont De Nemours And Company | Polymerization process |
| US7037988B2 (en) | 2000-10-03 | 2006-05-02 | Shell Oil Company | Process for the co-oligomerisation of ethylene and alpha olefins |
| CN1255419C (zh) * | 2001-08-01 | 2006-05-10 | 国际壳牌研究有限公司 | 乙烯低聚生产直链α烯烃用配位体及其催化剂体系 |
| US20030191017A1 (en) * | 2002-04-09 | 2003-10-09 | Rinaldo Schiffino | Olefin polymerization catalyst |
| ES2260678T3 (es) * | 2002-09-25 | 2006-11-01 | Shell Internationale Research Maatschappij B.V. | Sistema cataliticos para la oligomerizacion de etileno a alfa-olefinas lineales. |
| US7001964B2 (en) * | 2002-10-04 | 2006-02-21 | Chevron Phillips Chemical Company, Lp | Selective isomerization and linear dimerization of olefins using cobalt catalysts |
| US6911505B2 (en) * | 2002-10-04 | 2005-06-28 | Chevron Phillips Chemical Company, Lp | Selective isomerization and linear dimerization of olefins using cobalt catalysts |
| US20050014983A1 (en) * | 2003-07-07 | 2005-01-20 | De Boer Eric Johannes Maria | Process for producing linear alpha olefins |
| US20050187418A1 (en) * | 2004-02-19 | 2005-08-25 | Small Brooke L. | Olefin oligomerization |
| US7384886B2 (en) * | 2004-02-20 | 2008-06-10 | Chevron Phillips Chemical Company Lp | Methods of preparation of an olefin oligomerization catalyst |
| US9550841B2 (en) | 2004-02-20 | 2017-01-24 | Chevron Phillips Chemical Company Lp | Methods of preparation of an olefin oligomerization catalyst |
| US20050187098A1 (en) * | 2004-02-20 | 2005-08-25 | Knudsen Ronald D. | Methods of preparation of an olefin oligomerization catalyst |
| US20070043181A1 (en) * | 2005-08-19 | 2007-02-22 | Knudsen Ronald D | Methods of preparation of an olefin oligomerization catalyst |
| WO2005090371A1 (en) * | 2004-03-24 | 2005-09-29 | Shell Internationale Research Maatschappij B.V. | Transition metal complexes |
| US7230054B2 (en) * | 2004-06-29 | 2007-06-12 | Equistar Chemicals, Lp | Polymer resins with improved environmental stress crack resistance |
| WO2006010065A2 (en) * | 2004-07-09 | 2006-01-26 | E.I. Dupont De Nemours And Company | Catalysts for olefin polymerization or oligomerization |
| AR049714A1 (es) * | 2004-07-13 | 2006-08-30 | Shell Int Research | Proceso de preparacion de alfa olefinas lineales |
| JP2006151947A (ja) * | 2004-11-02 | 2006-06-15 | Yokohama National Univ | 末端オレフィンの二量化反応による線状化合物の製法 |
| EP1716924A1 (de) * | 2005-04-29 | 2006-11-02 | Saudi Basic Industries Corporation | Katalysatorvorläufer für die Herstellung von Olefinen mit ungerader Anzahl von Kohlenstoffatomen, Verfahren zu seiner Herstellung und Verfahren zur Herstellung derartiger Olefine |
| US7271121B2 (en) * | 2005-07-21 | 2007-09-18 | Chevron Phillips Chemical Company Lp | Diimine metal complexes, methods of synthesis, and methods of using in oligomerization and polymerization |
| US7727926B2 (en) * | 2005-07-21 | 2010-06-01 | Chevron Phillips Chemical Company Lp | Diimine metal complexes, methods of synthesis, and method of using in oligomerization and polymerization |
| US7268096B2 (en) * | 2005-07-21 | 2007-09-11 | Chevron Phillips Chemical Company Lp | Diimine metal complexes, methods of synthesis, and methods of using in oligomerization and polymerization |
| US7902415B2 (en) * | 2007-12-21 | 2011-03-08 | Chevron Phillips Chemical Company Lp | Processes for dimerizing or isomerizing olefins |
| US9586872B2 (en) | 2011-12-30 | 2017-03-07 | Chevron Phillips Chemical Company Lp | Olefin oligomerization methods |
| ITMI20122206A1 (it) * | 2012-12-20 | 2014-06-21 | Versalis Spa | Procedimento per la preparazione di (co)polimeri di dieni coniugati in presenza di un sistema catalitico comprendente un complesso bis-immino-piridinico di cobalto |
| EP2767542A1 (de) * | 2013-02-18 | 2014-08-20 | Basell Polyolefine GmbH | Oligomerisierungskatalysator |
| US9944661B2 (en) | 2016-08-09 | 2018-04-17 | Chevron Phillips Chemical Company Lp | Olefin hydroboration |
| CN115785163B (zh) * | 2021-09-09 | 2025-10-17 | 中国科学院化学研究所 | 一类后过渡金属配合物及其制备方法和应用 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1348723A3 (de) * | 1995-01-24 | 2004-09-29 | E.I. Du Pont De Nemours And Company | Alpha-Olefine und Polyolefine und Verfahren zu deren Herstellung |
| IL129929A0 (en) * | 1996-12-17 | 2000-02-29 | Du Pont | Polymerization of ethylene with specific iron or cobalt complexes novel pyridinebis (imines) and novel complexes of pyridinebis(imines) with iron and cobalt |
| WO1998030612A1 (en) * | 1997-01-13 | 1998-07-16 | E.I. Du Pont De Nemours And Company | Polymerization of propylene |
| US6103946A (en) * | 1997-07-15 | 2000-08-15 | E. I. Du Pont De Nemours And Company | Manufacture of α-olefins |
| ID24448A (id) * | 1997-09-05 | 2000-07-20 | Bp Chemical Ltd | Katalis-katalis polimerisasi |
-
1998
- 1998-04-02 US US09/053,944 patent/US6063881A/en not_active Expired - Fee Related
-
1999
- 1999-03-30 CN CN99804842A patent/CN1296466A/zh active Pending
- 1999-03-30 DE DE69918076T patent/DE69918076T2/de not_active Expired - Fee Related
- 1999-03-30 WO PCT/US1999/006817 patent/WO1999051550A1/en not_active Ceased
- 1999-03-30 JP JP2000542274A patent/JP2002510661A/ja active Pending
- 1999-03-30 AT AT99915094T patent/ATE269286T1/de not_active IP Right Cessation
- 1999-03-30 EP EP99915094A patent/EP1066229B1/de not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| ATE269286T1 (de) | 2004-07-15 |
| CN1296466A (zh) | 2001-05-23 |
| US6063881A (en) | 2000-05-16 |
| JP2002510661A (ja) | 2002-04-09 |
| DE69918076D1 (de) | 2004-07-22 |
| WO1999051550A1 (en) | 1999-10-14 |
| EP1066229A1 (de) | 2001-01-10 |
| EP1066229B1 (de) | 2004-06-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69918076T2 (de) | Verfahren zur oligomerisierung von propen | |
| DE69710776T2 (de) | Ethylenpolymerisation mit spezifischen eisen- oder kobaltkomplexen, neue pyridinbis(imine) und neue komplexe von pyridinbis(iminen) mit eisen und kobalt | |
| DE60109773T2 (de) | Liganden und katalysatorsysteme für die oligomerisierung von ethylen zu linearen alpha olefinen | |
| DE60215830T2 (de) | Liganden und diese enthaltende katalysatorsysteme fur die herstellung von linearen alpha-olefinen aus ethylen | |
| DE69811077T2 (de) | Verfahren zur herstellung von alpha-olefinen | |
| DE60305715T2 (de) | Katalysatorsysteme für die ethylen-oligomerisierung zu linearen alpha-olefinen | |
| DE69730838T2 (de) | Polymerisationsverfahren für olefinen | |
| DE60222107T2 (de) | Geträgerte olefinpolymerisationskatalysatoren | |
| DE69912411T2 (de) | Olefinpolymerisation | |
| DE69825559T2 (de) | Polymerisation von olefinen | |
| DE60016206T2 (de) | Polymerisation von ethylen | |
| DE69633783T2 (de) | Olefin-polymerisationsverfahren | |
| DE69330943T3 (de) | Verfahren zur Herstellung eines Olefinpolymerisationskatalysator | |
| DE69924267T2 (de) | Olefinpolymerisation | |
| DE69816281T2 (de) | Katalysatorzusammensetzungen für die polymerisation von olefinen | |
| CA2398968A1 (en) | Non-symmetrical ligands and catalyst systems thereof for ehtylene oligomerisation to linear alpha olefins | |
| DE602005005185T2 (de) | Übergangsmetallkomplexe | |
| KR20170045736A (ko) | 리간드 기재 크롬 촉매 및 에틸렌 올리고머화를 촉매하는 데 있어서의 이의 용도 | |
| EP1204668B1 (de) | Bisimidinoverbindungen und ihre übergangsmetallkomplexe sowie deren verwendung als katalysatoren | |
| WO2003024902A1 (de) | Verfahren zur trimerisierung von alpha-olefinen | |
| DE60130570T2 (de) | Verfahren zur selektiven oligomerisierung von ethylen | |
| DE10303946B4 (de) | Aluminoxanhaltige katalytische Zusammensetzung für die Dimerisierung und Oligomerisierung der Olefine | |
| DE69917932T2 (de) | Katalysatorsystem für olefinpolymerisation | |
| DE60012878T2 (de) | Diiminverbindungen | |
| EP1171483A1 (de) | Verfahren zur polymerisation von olefinen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8339 | Ceased/non-payment of the annual fee |