DE69824652T2 - Silacyclopentadienderivate - Google Patents
Silacyclopentadienderivate Download PDFInfo
- Publication number
- DE69824652T2 DE69824652T2 DE69824652T DE69824652T DE69824652T2 DE 69824652 T2 DE69824652 T2 DE 69824652T2 DE 69824652 T DE69824652 T DE 69824652T DE 69824652 T DE69824652 T DE 69824652T DE 69824652 T2 DE69824652 T2 DE 69824652T2
- Authority
- DE
- Germany
- Prior art keywords
- group
- derivative
- bis
- gruppe
- alkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- -1 formyloxy group Chemical group 0.000 claims description 60
- 125000003118 aryl group Chemical group 0.000 claims description 59
- 125000000217 alkyl group Chemical group 0.000 claims description 53
- 150000003967 siloles Chemical class 0.000 claims description 48
- 125000000623 heterocyclic group Chemical group 0.000 claims description 41
- 125000001424 substituent group Chemical group 0.000 claims description 41
- 150000001875 compounds Chemical class 0.000 claims description 26
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 claims description 26
- 125000003277 amino group Chemical group 0.000 claims description 25
- 238000000034 method Methods 0.000 claims description 24
- 230000015572 biosynthetic process Effects 0.000 claims description 22
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 18
- 125000000547 substituted alkyl group Chemical group 0.000 claims description 17
- 125000004104 aryloxy group Chemical group 0.000 claims description 16
- 229910052783 alkali metal Inorganic materials 0.000 claims description 15
- 150000001340 alkali metals Chemical class 0.000 claims description 15
- 125000003545 alkoxy group Chemical group 0.000 claims description 15
- 125000003342 alkenyl group Chemical group 0.000 claims description 14
- 125000000304 alkynyl group Chemical group 0.000 claims description 14
- 125000005843 halogen group Chemical group 0.000 claims description 13
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 12
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 12
- 125000004432 carbon atom Chemical group C* 0.000 claims description 11
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 11
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 10
- 239000003153 chemical reaction reagent Substances 0.000 claims description 10
- 125000000018 nitroso group Chemical group N(=O)* 0.000 claims description 10
- 125000003107 substituted aryl group Chemical group 0.000 claims description 10
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 claims description 10
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 9
- 125000004448 alkyl carbonyl group Chemical group 0.000 claims description 9
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 claims description 9
- 229910052801 chlorine Inorganic materials 0.000 claims description 9
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 claims description 9
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims description 9
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 9
- 229910052710 silicon Inorganic materials 0.000 claims description 9
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 claims description 9
- 125000003396 thiol group Chemical group [H]S* 0.000 claims description 9
- 125000005129 aryl carbonyl group Chemical group 0.000 claims description 8
- 125000000751 azo group Chemical group [*]N=N[*] 0.000 claims description 8
- 229910052736 halogen Inorganic materials 0.000 claims description 8
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 7
- NBTFTXXPJDVTKF-UHFFFAOYSA-N [diamino(ethynyl)silyl]ethyne Chemical class C#C[Si](N)(N)C#C NBTFTXXPJDVTKF-UHFFFAOYSA-N 0.000 claims description 7
- 150000002367 halogens Chemical class 0.000 claims description 7
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 7
- QLCLYIFZQUCONF-UHFFFAOYSA-N 2,2-dichlorosilole Chemical class ClC1(C=CC=[SiH]1)Cl QLCLYIFZQUCONF-UHFFFAOYSA-N 0.000 claims description 6
- 229910052794 bromium Inorganic materials 0.000 claims description 6
- 238000005859 coupling reaction Methods 0.000 claims description 6
- IQPQWNKOIGAROB-UHFFFAOYSA-N isocyanate group Chemical group [N-]=C=O IQPQWNKOIGAROB-UHFFFAOYSA-N 0.000 claims description 6
- 229910001507 metal halide Inorganic materials 0.000 claims description 6
- 150000005309 metal halides Chemical class 0.000 claims description 6
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 6
- 239000000460 chlorine Substances 0.000 claims description 5
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 5
- 229910052731 fluorine Inorganic materials 0.000 claims description 5
- 125000001153 fluoro group Chemical group F* 0.000 claims description 5
- 229910052739 hydrogen Inorganic materials 0.000 claims description 5
- 239000001257 hydrogen Substances 0.000 claims description 5
- 230000003647 oxidation Effects 0.000 claims description 5
- 238000007254 oxidation reaction Methods 0.000 claims description 5
- 230000009467 reduction Effects 0.000 claims description 5
- 238000006722 reduction reaction Methods 0.000 claims description 5
- 150000003606 tin compounds Chemical class 0.000 claims description 5
- 238000006136 alcoholysis reaction Methods 0.000 claims description 4
- 230000007062 hydrolysis Effects 0.000 claims description 4
- 238000006460 hydrolysis reaction Methods 0.000 claims description 4
- 229910052740 iodine Inorganic materials 0.000 claims description 4
- 125000004663 dialkyl amino group Chemical group 0.000 claims description 3
- 125000005265 dialkylamine group Chemical group 0.000 claims description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 3
- 125000004076 pyridyl group Chemical group 0.000 claims description 3
- 125000001544 thienyl group Chemical group 0.000 claims description 3
- 239000004327 boric acid Substances 0.000 claims description 2
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 claims description 2
- 125000001810 isothiocyanato group Chemical group *N=C=S 0.000 claims 3
- 125000001261 isocyanato group Chemical group *N=C=O 0.000 claims 2
- 238000006243 chemical reaction Methods 0.000 description 38
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 33
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 29
- 239000000047 product Substances 0.000 description 24
- 239000000243 solution Substances 0.000 description 23
- 238000003786 synthesis reaction Methods 0.000 description 21
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 18
- 238000003756 stirring Methods 0.000 description 14
- 238000005481 NMR spectroscopy Methods 0.000 description 11
- 238000005160 1H NMR spectroscopy Methods 0.000 description 10
- 238000004519 manufacturing process Methods 0.000 description 10
- 238000005259 measurement Methods 0.000 description 10
- 239000000126 substance Substances 0.000 description 10
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 10
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 8
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 8
- 238000000921 elemental analysis Methods 0.000 description 8
- 238000002844 melting Methods 0.000 description 8
- 230000008018 melting Effects 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 6
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 238000001914 filtration Methods 0.000 description 6
- NQIVCQRCFQAERR-UHFFFAOYSA-N (1,1-dichloro-3,4-diphenyl-5-trimethylsilylsilol-2-yl)-trimethylsilane Chemical compound C[Si](C)(C)C=1[Si](Cl)(Cl)C([Si](C)(C)C)=C(C=2C=CC=CC=2)C=1C1=CC=CC=C1 NQIVCQRCFQAERR-UHFFFAOYSA-N 0.000 description 5
- DCFKHNIGBAHNSS-UHFFFAOYSA-N chloro(triethyl)silane Chemical compound CC[Si](Cl)(CC)CC DCFKHNIGBAHNSS-UHFFFAOYSA-N 0.000 description 5
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 5
- 238000004821 distillation Methods 0.000 description 5
- ZBKFYXZXZJPWNQ-UHFFFAOYSA-N isothiocyanate group Chemical group [N-]=C=S ZBKFYXZXZJPWNQ-UHFFFAOYSA-N 0.000 description 5
- 239000008204 material by function Substances 0.000 description 5
- 229910052751 metal Inorganic materials 0.000 description 5
- 239000002184 metal Substances 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- GBABKCBYPOJWBM-UHFFFAOYSA-N 1-n,1-n,1-n',1-n'-tetraethyl-2,5-dimethyl-3,4-diphenylsilole-1,1-diamine Chemical compound CC=1[Si](N(CC)CC)(N(CC)CC)C(C)=C(C=2C=CC=CC=2)C=1C1=CC=CC=C1 GBABKCBYPOJWBM-UHFFFAOYSA-N 0.000 description 4
- ZGKCSHKOYFLKHG-UHFFFAOYSA-N 1-n,1-n,1-n',1-n'-tetraethyl-3,4-diphenyl-2,5-bis(trimethylsilyl)silole-1,1-diamine Chemical compound C[Si](C)(C)C=1[Si](N(CC)CC)(N(CC)CC)C([Si](C)(C)C)=C(C=2C=CC=CC=2)C=1C1=CC=CC=C1 ZGKCSHKOYFLKHG-UHFFFAOYSA-N 0.000 description 4
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 4
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 4
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 4
- 239000003054 catalyst Substances 0.000 description 4
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 239000007789 gas Substances 0.000 description 4
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 4
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 4
- IWUHBAHBVDGXLD-UHFFFAOYSA-N hydroxysilyl(trimethyl)silane Chemical compound C[Si]([SiH2]O)(C)C IWUHBAHBVDGXLD-UHFFFAOYSA-N 0.000 description 4
- 229910052744 lithium Inorganic materials 0.000 description 4
- 235000005074 zinc chloride Nutrition 0.000 description 4
- 239000011592 zinc chloride Substances 0.000 description 4
- NQADBEYKETZIQM-UHFFFAOYSA-N 1,1-dichloro-2,5-dimethyl-3,4-diphenylsilole Chemical compound CC=1[Si](Cl)(Cl)C(C)=C(C=2C=CC=CC=2)C=1C1=CC=CC=C1 NQADBEYKETZIQM-UHFFFAOYSA-N 0.000 description 3
- TUCRZHGAIRVWTI-UHFFFAOYSA-N 2-bromothiophene Chemical compound BrC1=CC=CS1 TUCRZHGAIRVWTI-UHFFFAOYSA-N 0.000 description 3
- QGJOPFRUJISHPQ-UHFFFAOYSA-N Carbon disulfide Chemical compound S=C=S QGJOPFRUJISHPQ-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- RAHZWNYVWXNFOC-UHFFFAOYSA-N Sulphur dioxide Chemical compound O=S=O RAHZWNYVWXNFOC-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- PQLBVTLOAXGQPV-UHFFFAOYSA-N [Li]C=1[Si](N(CC)CC)(N(CC)CC)C([Li])=C(C=2C=CC=CC=2)C=1C1=CC=CC=C1 Chemical compound [Li]C=1[Si](N(CC)CC)(N(CC)CC)C([Li])=C(C=2C=CC=CC=2)C=1C1=CC=CC=C1 PQLBVTLOAXGQPV-UHFFFAOYSA-N 0.000 description 3
- 238000009835 boiling Methods 0.000 description 3
- 125000005842 heteroatom Chemical group 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 239000010703 silicon Substances 0.000 description 3
- PWYVVBKROXXHEB-UHFFFAOYSA-M trimethyl-[3-(1-methyl-2,3,4,5-tetraphenylsilol-1-yl)propyl]azanium;iodide Chemical compound [I-].C[N+](C)(C)CCC[Si]1(C)C(C=2C=CC=CC=2)=C(C=2C=CC=CC=2)C(C=2C=CC=CC=2)=C1C1=CC=CC=C1 PWYVVBKROXXHEB-UHFFFAOYSA-M 0.000 description 3
- NHDIQVFFNDKAQU-UHFFFAOYSA-N tripropan-2-yl borate Chemical compound CC(C)OB(OC(C)C)OC(C)C NHDIQVFFNDKAQU-UHFFFAOYSA-N 0.000 description 3
- VMIICIIXCSIWPF-UHFFFAOYSA-N (1,1-dihydroxy-3,4-diphenyl-5-trimethylsilylsilol-2-yl)-trimethylsilane Chemical compound C[Si](C)(C)C=1[Si](O)(O)C([Si](C)(C)C)=C(C=2C=CC=CC=2)C=1C1=CC=CC=C1 VMIICIIXCSIWPF-UHFFFAOYSA-N 0.000 description 2
- GTXOYHIPGOLITL-UHFFFAOYSA-N 1,1-difluoro-2,5-dimethyl-3,4-diphenylsilole Chemical compound CC=1[Si](F)(F)C(C)=C(C=2C=CC=CC=2)C=1C1=CC=CC=C1 GTXOYHIPGOLITL-UHFFFAOYSA-N 0.000 description 2
- OPLJSQXUSXJVCK-UHFFFAOYSA-N 1-n,1-n,1-n',1-n'-tetraethyl-3,4-diphenyl-2,5-dithiophen-2-ylsilole-1,1-diamine Chemical compound CCN(CC)[Si]1(N(CC)CC)C(C=2SC=CC=2)=C(C=2C=CC=CC=2)C(C=2C=CC=CC=2)=C1C1=CC=CS1 OPLJSQXUSXJVCK-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 2
- UEXCJVNBTNXOEH-UHFFFAOYSA-N Ethynylbenzene Chemical compound C#CC1=CC=CC=C1 UEXCJVNBTNXOEH-UHFFFAOYSA-N 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 2
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 125000005133 alkynyloxy group Chemical group 0.000 description 2
- 239000012300 argon atmosphere Substances 0.000 description 2
- RQNWIZPPADIBDY-UHFFFAOYSA-N arsenic atom Chemical compound [As] RQNWIZPPADIBDY-UHFFFAOYSA-N 0.000 description 2
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical class OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 2
- 125000001246 bromo group Chemical group Br* 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 125000000753 cycloalkyl group Chemical group 0.000 description 2
- VAYGXNSJCAHWJZ-UHFFFAOYSA-N dimethyl sulfate Chemical compound COS(=O)(=O)OC VAYGXNSJCAHWJZ-UHFFFAOYSA-N 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 125000001033 ether group Chemical group 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 238000011835 investigation Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- XWIIRBCVQKNFRO-UHFFFAOYSA-N n-[diethylamino-bis(2-phenylethynyl)silyl]-n-ethylethanamine Chemical compound C=1C=CC=CC=1C#C[Si](N(CC)CC)(N(CC)CC)C#CC1=CC=CC=C1 XWIIRBCVQKNFRO-UHFFFAOYSA-N 0.000 description 2
- JCZMXVGQBBATMY-UHFFFAOYSA-N nitro acetate Chemical compound CC(=O)O[N+]([O-])=O JCZMXVGQBBATMY-UHFFFAOYSA-N 0.000 description 2
- VPCDQGACGWYTMC-UHFFFAOYSA-N nitrosyl chloride Chemical compound ClN=O VPCDQGACGWYTMC-UHFFFAOYSA-N 0.000 description 2
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 2
- 238000007363 ring formation reaction Methods 0.000 description 2
- 229910000077 silane Inorganic materials 0.000 description 2
- 229910052938 sodium sulfate Inorganic materials 0.000 description 2
- 235000011152 sodium sulphate Nutrition 0.000 description 2
- 125000005504 styryl group Chemical group 0.000 description 2
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 125000000101 thioether group Chemical group 0.000 description 2
- BHHYHSUAOQUXJK-UHFFFAOYSA-L zinc fluoride Chemical compound F[Zn]F BHHYHSUAOQUXJK-UHFFFAOYSA-L 0.000 description 2
- TXUICONDJPYNPY-UHFFFAOYSA-N (1,10,13-trimethyl-3-oxo-4,5,6,7,8,9,11,12,14,15,16,17-dodecahydrocyclopenta[a]phenanthren-17-yl) heptanoate Chemical compound C1CC2CC(=O)C=C(C)C2(C)C2C1C1CCC(OC(=O)CCCCCC)C1(C)CC2 TXUICONDJPYNPY-UHFFFAOYSA-N 0.000 description 1
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 description 1
- WJIFKOVZNJTSGO-UHFFFAOYSA-N 1-bromo-3-methylbenzene Chemical compound CC1=CC=CC(Br)=C1 WJIFKOVZNJTSGO-UHFFFAOYSA-N 0.000 description 1
- CCGCLVWREGDHGU-UHFFFAOYSA-N 1-chloro-n,n-diethyl-3,4-diphenyl-2,5-bis(trimethylsilyl)silol-1-amine Chemical compound C[Si](C)(C)C=1[Si](N(CC)CC)(Cl)C([Si](C)(C)C)=C(C=2C=CC=CC=2)C=1C1=CC=CC=C1 CCGCLVWREGDHGU-UHFFFAOYSA-N 0.000 description 1
- ZWZSUMVBSJPSDD-UHFFFAOYSA-N 1-n,1-n,1-n',1-n'-tetraethyl-3,4-diphenyl-2,5-dipyridin-2-ylsilole-1,1-diamine Chemical compound CCN(CC)[Si]1(N(CC)CC)C(C=2N=CC=CC=2)=C(C=2C=CC=CC=2)C(C=2C=CC=CC=2)=C1C1=CC=CC=N1 ZWZSUMVBSJPSDD-UHFFFAOYSA-N 0.000 description 1
- IMRWILPUOVGIMU-UHFFFAOYSA-N 2-bromopyridine Chemical compound BrC1=CC=CC=N1 IMRWILPUOVGIMU-UHFFFAOYSA-N 0.000 description 1
- WWUSGXYHHUYLQT-UHFFFAOYSA-N 2-ethynylsilylethynamine Chemical class NC#C[SiH2]C#C WWUSGXYHHUYLQT-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical class C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- KWYHDKDOAIKMQN-UHFFFAOYSA-N N,N,N',N'-tetramethylethylenediamine Chemical compound CN(C)CCN(C)C KWYHDKDOAIKMQN-UHFFFAOYSA-N 0.000 description 1
- 239000004157 Nitrosyl chloride Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 229910007161 Si(CH3)3 Inorganic materials 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- FOIXSVOLVBLSDH-UHFFFAOYSA-N Silver ion Chemical compound [Ag+] FOIXSVOLVBLSDH-UHFFFAOYSA-N 0.000 description 1
- 229910021626 Tin(II) chloride Inorganic materials 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 125000003302 alkenyloxy group Chemical group 0.000 description 1
- 150000004703 alkoxides Chemical class 0.000 description 1
- 125000005336 allyloxy group Chemical group 0.000 description 1
- 238000007098 aminolysis reaction Methods 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 229910052785 arsenic Inorganic materials 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- KOPOQZFJUQMUML-UHFFFAOYSA-N chlorosilane Chemical class Cl[SiH3] KOPOQZFJUQMUML-UHFFFAOYSA-N 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 229920001940 conductive polymer Polymers 0.000 description 1
- 239000004020 conductor Substances 0.000 description 1
- DOBRDRYODQBAMW-UHFFFAOYSA-N copper(i) cyanide Chemical compound [Cu+].N#[C-] DOBRDRYODQBAMW-UHFFFAOYSA-N 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- ZSWFCLXCOIISFI-UHFFFAOYSA-N cyclopentadiene Chemical group C1C=CC=C1 ZSWFCLXCOIISFI-UHFFFAOYSA-N 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000006612 decyloxy group Chemical group 0.000 description 1
- 125000004986 diarylamino group Chemical group 0.000 description 1
- DENRZWYUOJLTMF-UHFFFAOYSA-N diethyl sulfate Chemical compound CCOS(=O)(=O)OCC DENRZWYUOJLTMF-UHFFFAOYSA-N 0.000 description 1
- 229940008406 diethyl sulfate Drugs 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 150000002019 disulfides Chemical class 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 125000001207 fluorophenyl group Chemical group 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 239000013067 intermediate product Substances 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 125000002462 isocyano group Chemical group *[N+]#[C-] 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 125000005647 linker group Chemical group 0.000 description 1
- XPIGOSZCSQQSSF-UHFFFAOYSA-N lithium;n,n-dimethyl-1h-naphthalen-1-id-2-amine Chemical compound [Li+].C1=CC=CC2=[C-]C(N(C)C)=CC=C21 XPIGOSZCSQQSSF-UHFFFAOYSA-N 0.000 description 1
- PDZGAEAUKGKKDE-UHFFFAOYSA-N lithium;naphthalene Chemical compound [Li].C1=CC=CC2=CC=CC=C21 PDZGAEAUKGKKDE-UHFFFAOYSA-N 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 125000002816 methylsulfanyl group Chemical group [H]C([H])([H])S[*] 0.000 description 1
- 125000006216 methylsulfinyl group Chemical group [H]C([H])([H])S(*)=O 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- SJHDWSADDRUNNE-UHFFFAOYSA-N n-[dichloro(diethylamino)silyl]-n-ethylethanamine Chemical compound CCN(CC)[Si](Cl)(Cl)N(CC)CC SJHDWSADDRUNNE-UHFFFAOYSA-N 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- IJJSYKQZFFGIEE-UHFFFAOYSA-N naphthalene;potassium Chemical compound [K].C1=CC=CC2=CC=CC=C21 IJJSYKQZFFGIEE-UHFFFAOYSA-N 0.000 description 1
- URXNVXOMQQCBHS-UHFFFAOYSA-N naphthalene;sodium Chemical compound [Na].C1=CC=CC2=CC=CC=C21 URXNVXOMQQCBHS-UHFFFAOYSA-N 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 238000006396 nitration reaction Methods 0.000 description 1
- 235000019392 nitrosyl chloride Nutrition 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 1
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 description 1
- 125000006678 phenoxycarbonyl group Chemical group 0.000 description 1
- 125000000286 phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- 125000005554 pyridyloxy group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 150000004756 silanes Chemical class 0.000 description 1
- SCPYDCQAZCOKTP-UHFFFAOYSA-N silanol Chemical compound [SiH3]O SCPYDCQAZCOKTP-UHFFFAOYSA-N 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 1
- 235000019345 sodium thiosulphate Nutrition 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000001119 stannous chloride Substances 0.000 description 1
- 235000011150 stannous chloride Nutrition 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 125000005346 substituted cycloalkyl group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 239000013076 target substance Substances 0.000 description 1
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000005297 thienyloxy group Chemical group S1C(=CC=C1)O* 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 125000005425 toluyl group Chemical group 0.000 description 1
- 238000006478 transmetalation reaction Methods 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- PZJJKWKADRNWSW-UHFFFAOYSA-N trimethoxysilicon Chemical group CO[Si](OC)OC PZJJKWKADRNWSW-UHFFFAOYSA-N 0.000 description 1
- 239000005051 trimethylchlorosilane Substances 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/10—Compounds having one or more C—Si linkages containing nitrogen having a Si-N linkage
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/12—Organo silicon halides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/18—Compounds having one or more C—Si linkages as well as one or more C—O—Si linkages
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
Description
- Diese Erfindung betrifft ein Silacyclopentadien-Derivat, mehr spezifisch ein Silacyclopentadien-Derivat, ein Zwischenprodukt davon und ein Verfahren zu seiner Erzeugung.
- Es wurde auf verschiedene Weise in vielen Labors versucht, organische Verbindungen der π-Elektronenserie für photofunktionelle Materialien oder elektronenfunktionelle Materialien zu verwenden. Unter diesen ist eine Gruppe von organischen Verbindungen der π-Elektronenserie mit einer 5-gliedrigen Heteroringstruktur als Grundstruktur, beispielsweise Thiophen oder Pyrrol als eine der typischen Verbindungs-Gruppen bekannt. Ein großer Teil dieser 5-gliedrigen Heteroringe ist jedoch elektronengebend und daher hat dieses Merkmal die Anwendung für Materialien eingeschränkt. Daher sind elektronenaufnehmende Verbindungen erforderlich.
- In den letzten Jahren wurde berichtet, daß ein Silacyclopentadien-Ring, bei dem ein Heteroatom sich aus Silicium zusammensetzt, eine elektronenaufnehmende Eigenschaft zeigt, und die Anwendung für verschiedene funktionelle Materialien wird erwartet. Beispielsweise ist in den offengelegten japanischen Patentanmeldungen Hei 6-100669 und Hei 6-166746 angegeben, daß die Anwendung für leitende Polymere bezweckt ist. Weiterhin werden Beispiele, bei denen Silacyclopentadien-Derivate für organische EL-Elemente verwendet wurden, in The Chemical Society of Japan, 70 Spring Annual Meeting Pre-Manuscript II, S. 700, 2D102 und S. 701, 2D103; und 71 Autumn Annual Meeting Pre-Manuscript, S. 32, 2P1α21 und 2P1α22 beschrieben.
- Wenn Silacyclopentadien-Derivate für verschiedene funktionelle Materialien verwendet werden, ist die Einführung der verschiedenen Substituenten in wahlweise Positionen der Silacyclopentadien-Ringe entsprechend den Zwecken mit der Steuerung der Qualität der Verbindungen verbunden und wird daher als sehr wichtige Technik zur Erhöhung der Leistung der funktionellen Materialien angesehen.
- Konventionelle synthetische Verfahren für die Silacyclopentadien-Ringe sind auf spezifische beschränkt, wie in Chemical Review, Bd. 90, S. 215 bis 263, 1990 beschrieben, und es ist unmöglich, verschiedene Derivate frei zu synthetisieren. Weiterhin sind Beispiele, bei denen reaktive Substituenten in 2- und 5-Positionen eines Silacyclopentadien-Rings eingefügt sind, in den offengelegten japanischen Patentanmeldungen Hei 7-179477 und Hei 7-300489 beschrieben, aber die Einfügung ist auf die 2- und 5-Positionen beschränkt.
-
- Chemical Abstracts, Bd. 85 (1976), 85: 192809 betrifft die Synthese und die physikochemischen Eigenschaften von Dialkoxy(aryloxy)siliacycloarylenen. U. Bankwitz et al. beschreiben in Journal of Organometallic Chemistry 499 (1995) C7-C9 die Herstellung von 1,1-Dichlor-2,3,4-tetramethyl-1-silacyclopenta-2,4-dien in einer Dreischrittsynthese.
- In J. Am. Chem. Soc. 1996, 118, 10457–19468 wird das analoge Ethylen-Derivat bezüglich der obigen Verbindung gezeigt.
- FR-1 468 482 A offenbart Cyclopolysiloxan-Verbindungen, umfassend als Substituenten ortho-ortho'-Biphenylen und die Herstellung davon.
- Schließlich beschreibt
EP 0 754 691 A einige Silacyclopentadien-Derivate, umfassend z. B. Alkyl-Gruppen mit 1 bis 6 Kohlenstoffatomen, die an das Si-Atom gebunden sind und worin die Radikale an den Positionen 2 bis 5 des Cyclopentadien-Rings unabhängig unter anderem eine Aryl-Gruppe oder Alkyl-Gruppe bedeuten. Entsprechend einigen Beispielen bedeuten diese vier Radikale jeweils eine Phenyl-Gruppe. - Ein Ziel dieser Erfindung besteht darin, ein neues Silacyclopentadien-Derivat, das für die Anwendung bei funktionellen Materialien geeignet ist, und ein Zwischenproduktprodukt dafür, ebenso wie ein Verfahren zur Herstellung dieses anzugeben.
- Intensive Untersuchungen, durchgeführt durch diese Erfinder, haben zur Feststellung einer neuen Verbindung geführt, bei der eine spezifische funktionelle Gruppe in ein Siliciumatom einer Silapentadiyn-Verbindung eingeführt ist, d. h. disubstituiertes Ethinylsilan, und diese Verbindung mit einem Alkalimetallkomplex reagiert wird, unter Erhalt eines neuen Silacyclopentadien-Derivates und eines Zwischenproduktes dafür. Weitere Untersuchungen führten zur Vollendung dieser Erfindung.
- Diese Erfindung umfaßt die folgenden Bestandteile:
- 1) Silacyclopentadien-Derivat mit der folgenden Formel (1): worin X1 und Y1 jeweils unabhängig ein Halogenatom, eine Amino-Gruppe, eine Hydroxyl-Gruppe oder Amino-Gruppe mit Substituenten sind; R1 und R4 jeweils unabhängig ein Wasserstoffatom, Halogenatom, eine Alkyl-Gruppe, Alkoxy-Gruppe, Aryloxy-Gruppe, Amino-Gruppe, Alkylcarbonyl-Gruppe, Arylcarbonyl-Gruppe, Alkoxycarbonyl-Gruppe, Aryloxycarbonyl-Gruppe, Azo-Gruppe, Alkylazo-Gruppe, Arylazo-Gruppe, Sulfinyl-Gruppe, Sulfonyl-Gruppe, Sulfanyl-Gruppe, Aryl-Gruppe, heterocyclische Gruppe, Alkenyl-Gruppe, Alkinyl-Gruppe, Nitro-Gruppe, Formyl-Gruppe, Nitroso-Gruppe, Formyloxy-Gruppe, Isocyanat-Gruppe, Isothiocyanat-Gruppe, Cyano-Gruppe oder Amino-Gruppe, Silyl-Gruppe, Aryl-Gruppe oder heterocyclische Gruppe mit jeweils einem Substituenten sind; R2 und R3 unabhängig ein Wasserstoffatom, Halogenatom, eine Alkoxy-Gruppe, Aryloxy-Gruppe, Amino-Gruppe, Silyl-Gruppe, Aryl-Gruppe, eine heterocyclische Gruppe, Alkenyl-Gruppe, Alkinyl-Gruppe, Azo-Gruppe, Alkylazo-Gruppe, Arylazo-Gruppe oder Cyano-Gruppe oder Alkyl-Gruppe, Alkoxy-Gruppe, Aryloxy-Gruppe, Amino-Gruppe, Silyl-Gruppe, Aryl-Gruppe, heterocyclische Gruppe, Alkenyl-Gruppe oder Alkinyl-Gruppe mit jeweils einem Substituenten sind.
- Bevorzugt sind X1 und Y1 jeweils unabhängig ein Chloratom, Fluoratom, Dialkylamino-Gruppe oder Hydroxyl-Gruppe und R2 und R3 bedeuten jeweils eine Phenyl-Gruppe oder substituierte Phenyl-Gruppe.
- Weiterhin bedeuten R1 und R4 bevorzugt eine Trimethylsilyl-Gruppe, Methyl-Gruppe, Thienyl-Gruppe, Pyridyl-Gruppe, 3-Methylphenyl-Gruppe oder ein Bromaton und R2 und R3 sind jeweils bevorzugt eine Phenyl-Gruppe, während X1 und Y1 jeweils unabhängig eine Diethylamino-Gruppe, Chloratom, Fluoratom oder Hydroxyl-Gruppe sind.
- Weiterhin ist das bevorzugte Silacyclopentadien-Derivat durch die folgende Formel (5) dargestellt: worin R21 bis R24 jeweils unabhängig eine Alkyl-Gruppe oder substituierte Alkyl-Gruppe sind; R5 und R8 jeweils unabhängig ein Wasserstoffatom, Halogenatom, eine Alkyl-Gruppe, Alkoxy-Gruppe, Aryloxy-Gruppe, Amino-Gruppe, Alkylcarbonyl-Gruppe, Arylcarbonyl-Gruppe, Alkoxycarbonyl-Gruppe, Aryloxycarbonyl-Gruppe, eine Azo-Gruppe, Alkylazo-Gruppe, Arylazo-Gruppe, Sulfinyl-Gruppe, Sulfonyl-Gruppe, Sulfanyl-Gruppe, Aryl-Gruppe, heterocyclische Gruppe, Alkenyl-Gruppe, Alkinyl-Gruppe, Nitro-Gruppe, Formyl-Gruppe, Nitroso-Gruppe, Formyloxy-Gruppe, Isocyanat-Gruppe, Isothiocyanat-Gruppe oder Cyano-Gruppe oder Amino-Gruppe oder Silyl-Gruppe mit jeweils einem Substituenten sind; und R9 und R10 jeweils eine Phenyl-Gruppe oder substituierte Phenyl-Gruppe sind.
- 2) 1,1-Bis(diamino)-2,5-dimetasiliacyclopentadien-Derivat mit der folgenden Formel (2): worin R21 bis R24 unabhängig eine Alkyl-Gruppe oder substituierte Alkyl-Gruppe sind; M ein Alkalimetall ist; R9 und R10 jeweils unabhängig eine Alkyl-Gruppe, Silyl-Gruppe, Aryl-Gruppe, heterocyclische Gruppe, Cyano-Gruppe oder Alkyl-Gruppe, Silyl-Gruppe, Aryl-Gruppe oder heterocyclische Gruppe mit jeweils einem Substituenten sind (vorausgesetzt, daß R9 und R10 zur Bildung eines Ringes an den Enden kombiniert sein können). In der Formel (2) bedeuten R9 und R10 bevorzugt jeweils unabhängig eine Alkyl-Gruppe oder substituierte Alkyl-Gruppe oder eine Aryl-Gruppe oder substituierte Aryl-Gruppe.
- 3) 3,3-Diamino-3-sila-1,4-pentadiyn-Derivat [d. h. Bis(diamino)-diethinylsilan-Derivat] mit der folgenden Formel (3): In der oben beschriebenen Formel (3) sind R21 bis R24, R9 und R10 synonym zu den Radikalen, die in bezug auf die Formel (2) definiert sind.
- 4) Verfahren zur Erzeugung eines 1,1-Bis(diamino)-3,4-disubstituierten-2,5-dimetallsilacyclopentadien-Derivats mit der folgenden Formel (2) gekennzeichnet durch Reaktion eines 3,3-Diamino-3-sila-1,4-pentadiyn-Derivats mit der folgenden Formel (3) mit einem Alkalimetallkomplex: worin R21 bis R24, M, R9 und R10 synonym zu jenen gemäß Formel (2), wie zuvor beschrieben. In den Formeln (3) und (2) bedeuten R9 und R10 jeweils bevorzugt eine Alkyl-Gruppe oder substituierte Alkyl-Gruppe oder eine Aryl-Gruppe oder substituierte Aryl-Gruppe.
- 5) Verfahren zur Erzeugung eines Silacyclopentadien-Derivates, gekennzeichnet durch folgende Schritte: Reaktion eines 1,1-Bis(diamino)-2,5-dimetallsilacyclopentadien-Derivats mit der folgenden Formel (2) mit einer Verbindung, ausgewählt aus der Gruppe bestehend aus einem elektrophilen Reagens, Metallhalogenid, Komplex aus einem Metallhalogenid, Borsäureester und einer organischen Zinnverbindung, zum Einfügen von aktiven Gruppen Ra in die 2- und 5-Positionen des obigen Derivats, und Durchführen einer Hydrolyse, Alkoholyse, Reduktion, Oxidation oder Kupplungsreaktion mit dem Derivat, unter Erhalt eines Bis(diamino)silacyclopentadien-Derivats mit der Formel (5): worin Ra Br, Cl, I, Si(CH3)3, Si(C2H5)3, Sn(CH3)3, Sn(C2H5)3, eine Alkyl-Gruppe mit 1 bis 4 Kohlenstoffatomen, ZnX, MgX oder B(OR)3 ist (worin X Halogen und R eine Alkyl-Gruppe mit 1 bis 4 Kohlenstoffatomen ist); R21 bis R24 unabhängig eine Alkyl-Gruppe oder substituierte Alkyl-Gruppe sind; M ein Alkalimetall ist; R5 und R8 unabhängig ein Wasserstoffatom, Halogenatom, eine Alkyl-Gruppe, Alkoxy-Gruppe, Aryloxy-Gruppe, Amino-Gruppe, Alkylcarbonyl-Gruppe, Arylcarbonyl-Gruppe, Alkoxycarbonyl-Gruppe, Aryloxycarbonyl-Gruppe, Azo-Gruppe, Alkylazo-Gruppe, Arylazo-Gruppe, Sulfinyl-Gruppe, Sulfonyl-Gruppe, Sulfanyl-Gruppe, Aryl-Gruppe, heterocyclische Gruppe, Alkenyl-Gruppe, Alkinyl-Gruppe, Nitro-Gruppe, Formyl-Gruppe, Nitroso-Gruppe, Formyloxy-Gruppe, Isocyanat-Gruppe, Isothiocyanat-Gruppe oder Cyano-Gruppe oder Amino-Gruppe, Silyl-Gruppe, Aryl-Gruppe oder heterocyclische Gruppe mit jeweils einem Substituenten sind; und R9 und R10 unabhängig eine Alkyl-Gruppe, Silyl-Gruppe, Aryl-Gruppe, heterocyclische Gruppe oder Cyano-Gruppe oder Alkyl-Gruppe, Silyl-Gruppe, Aryl-Gruppe oder heterocyclische Gruppe mit jeweils einem Substituenten sind (vorausgesetzt, dass R9 und R10 an den Enden unter Bildung eines Rings kombiniert sein können).
- 6) Verfahren zur Erzeugung eines Silacyclopentadien-Derivates, gekennzeichnet durch Reaktion des Bis(diamino)silacyclopentadien-Derivats der obigen Formel (5) mit Salzsäure, unter Erzeugung eines Dichlorsilacyclopentadien-Derivats mit der folgenden Formel (6): worin R21 bis R24, R5, R8, R9 und R10 synonym zu jenen der Formel (5), wie wie oben beschrieben, sind.
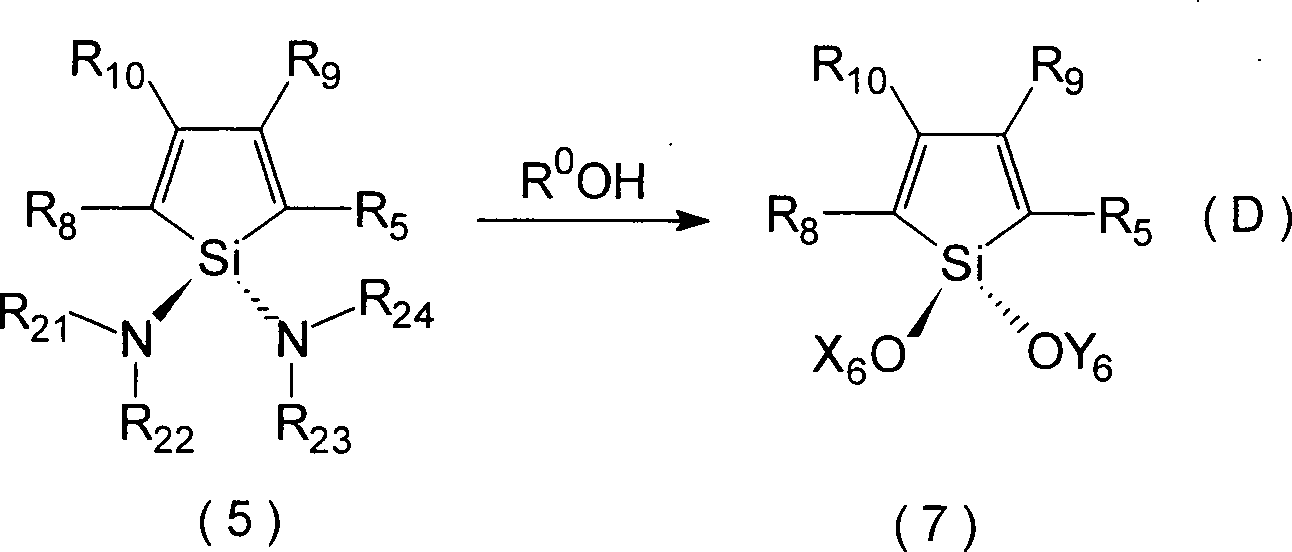
- 7) Verfahren zur Erzeugung eines Silacyclopentadien-Derivates, gekennzeichnet durch Reaktion des Bis(diamino)silacyclopentadien-Derivats mit der obigen Formel (5) mit einer Verbindung mit der folgenden Formel (9), zur Erzeugung eines Dialkoxysilacyclopentadien-Derivats mit der folgenden Formel (7): worin R21 bis R24, R5, R8, R9 und R10 synonym zu jenen der obigen Formel (5), wie oben definiert, sind; und R0, X6 und Y6 jeweils unabhängig eine Alkyl-Gruppe oder substituierte Alkyl-Gruppe, Aryl-Gruppe oder substituierte Aryl-Gruppe oder heterocyclische Gruppe oder substituierte heterocyclische Gruppe sind.
- 8) Verfahren zur Erzeugung eines Silacyclopentadien-Derivates, gekennzeichnet durch Reaktion des Dichlorsilacyclopentadien-Derivats mit der obigen Formel (6) mit Dialkylamin zur Erzeugung eines 1-Chlor-1-dialkylaminosilacyclopentadien-Derivats mit der folgenden Formel (8): worin R5, R8, R9 und R10 synonym zu jenen der obigen Formel (5), sind; und Z1 und Z2 unabhängig eine Alkyl-Gruppe mit 1 bis 50 Kohlenstoffatomen sind.
- Detaillierte Beschreibung der Erfindung
- Das erfindungsgemäße Silacyclopentadien-Derivat ist eine Verbindung mit der Formel (1). Mehr spezifische Formeln sind die Formeln (5), (6), (7) und (8), die oben beschrieben sind.
- Verschiedene Gruppen werden durch X1, Y1 und R1 bis R4 dargestellt, die in diesen Formeln wie zuvor beschrieben gezeigt sind.
- Ein Chloratom, Fluoratom und Bromatom sind als Halogenatom gezeigt.
- Als Hydroxyl-Gruppe mit einem Substituenten sind OX6 und OY6 in der Formel (7) gezeigt (worin X6 und Y6 jeweils eine Alkyl-Gruppe oder substituierte Alkyl-Gruppe, Cycloalkyl-Gruppe oder substituierte Cycloalkyl-Gruppe, Aryl-Gruppe oder substituierte Aryl-Gruppe oder eine heterocyclische oder substituierte heterocyclische Gruppe sind). Mehr spezifisch können Alkoxy-Gruppen mit 1 bis 50 Kohlenstoffatomen (bevorzugt 1 bis 10 Kohlenstoffatomen) wie Methoxy, Ethoxy, Isopropoxy, Propoxy, Butoxy, sek.-Butoxy, tert.-Butoxy, Pentyloxy, Cyclopentyloxy, Hexyloxy, Cyclohexyloxy und Decyloxy; Aryloxy-Gruppen wie Phenoxy, Biphenyloxy, Naphthoxy, Anthracenyloxy, Terphenyloxy, Quaterphenyloxy, Phenanthrenyloxy und Pyrenyloxy; substituierte Aryloxy-Gruppen wie 3-Methylphenyloxy, 4-tert.-Butylphenyloxy und Phenylanthracenyloxy; heterocyclische Oxy-Gruppen wie Furyloxy, Pyridyloxy, Thienyloxy, Pyrimidyloxy, Pyridanyloxy, Triazolyloxy, Indolyloxy, Carbazolyloxy, Phenoxyazyloxy, Phenothiazyloxy, Acridinyloxy, Thiadiazolyloxy, Thiazolyloxy, Oxadiazolyloxy, Oxazolyloxy, Chinolyloxy, Chinoxalyloxy, Silacyclopentadienyloxy und Pyrrolyloxy; und substituierte heterocyclische Oxy-Gruppen wie Benzothiazolyloxy und Benzoxazolyloxy genannt werden.
- Die Amino-Gruppen, dargestellt durch R21 bis R24 in der Formel (5) und Z1 und Z2 in der Formel (8) sind als Amino-Gruppe mit einem Substituenten gezeigt. Die Substituenten hierfür sind eine Alkyl-Gruppe, substituierte Alkyl-Gruppe, Aryl-Gruppe, substituierte Aryl-Gruppe, heterocyclische Gruppe und eine substituierte heterocyclische Gruppe mit jeweils 1 bis 50 Kohlenstoffatomen. Die spezifische Amino-Gruppe umfaßt Dialkylamino-Gruppen mit 1 bis 20 Kohlenstoffatomen wie Dimethylamino, Diethylamino, Di-n-propylamino, Diisopropylamino, Dibutylamino, Dicyclopentylamino und Dicyclohexylamino; Dialkenylamino-Gruppen wie Divinylamino, Diallylamino und Dibutenylamino; Dialkinylamino-Gruppen wie Diethinylamino, Dipropagylamino und Bis(phenylethinyl)amino; Diarylamino-Gruppen wie Ditoluylamino, Dinaphthylamino, Diphenylamino, Dibiphenylamino, Diphenanthrylamino, Phenylnaphthylamino, Dianthracenylamino und Distyrylamino; und disubstituierte Amino-Gruppen wie Dipyridylamino, Dihydrofurylamino, Dihydropyrenylamino, Dioxanylamino, Dithienylamino, Difurylamino, Dioxazolylamino, Dioxadiazolylamino, Dithiazolylamino, Dithiadiazolylamino, Dichinolylamino, Dichinoxaloylamino, Dibenzothienylamino, Dibenzothiazolylamino, Diindolylamino und Disilacyclopentadienylamino.
- Weiterhin können diese Substituenten miteinander an wahlweisen Positionen unter Bildung von Ringen kombiniert werden.
- Die folgenden Gruppen können als R1 bis R4 angegeben werden: Wasserstoffatom; Halogenatom wie Brom und Chlor; eine Alkyl-Gruppe (nur R1 und R4 können eine solche Alkyl-Gruppe bedeuten) wie Methyl, Ethyl, n-Propyl, Isopropyl und tert.-Butyl; eine Cycloalkyl-Gruppe wie Cyclopentyl und Cyclohexyl; Alkoxy-Gruppe wie Methoxy, Ethoxy, Propoxy, Butoxy, Hexyloxy, Isopropoxy, Isobutoxy, Isopentyloxy und tert.-Butoxy; Alkenyloxy-Gruppe wie Vinyloxy, Allyloxy und Butenyloxy; Alkinyloxy-Gruppe wie Ethinyloxy und Propenyloxy; Aryloxy-Gruppe wie Phenoxy, Naphthoxy, Biphenyloxy, Phenylacetyloxy, Pyrenyloxy, Phenanthrenyloxy und Terphenyloxy; Alkylcarbonyl-Gruppe wie Acetyl; Arylcarbonyl-Gruppe wie Benzoyl; Alkoxycarbonyl-Gruppe wie Methoxycarbonyl und Ethoxycarbonyl; Aryloxycarbonyl-Gruppe wie Phenoxycarbonyl; Sulfinyl-Gruppe wie Methylsulfinyl und Phenylsulfinyl; Sulfonyl-Gruppe wie Methylsulfonyl; Sulfanyl-Gruppe, wie Methylsulfanyl; Silyl-Gruppe; Aryl-Gruppe wie Phenyl, Biphenyl, Terphenyl, Naphthyl, Anthracenyl, Pyrenyl, Toluyl und Phenanthrenyl; heterocyclische Gruppe wie Thienyl, Furyl, Silacyclopentadienyl, Oxazolyl, Oxadiazolyl, Thiazolyl, Thiadiazolyl, Acridinyl, Chinolyl, Chinoxaloyl, Phenanthrolyl, Benzothienyl, Benzothiazolyl, Indolyl, Carbazolyl, Pyridyl, Pyrrolyl, Benzoxazolyl, Pyrimidyl und Imidazolyl; Alkenyl-Gruppe wie Vinyl, Allyl und Butenyl; Alkinyl-Gruppe wie Ethinyl und Propagyl; Nitro-Gruppe, Formyl-Gruppe, Nitroso-Gruppe, Formyloxy-Gruppe, Isocyano-Gruppe, Isocyanat-Gruppe, Isothiocyanat-Gruppe oder Cyano-Gruppe.
- Weiter enthalten sind eine Alkyl-Gruppe mit einem Substituenten wie Trifluormethyl und Phenylethyl; Alkoxy-Gruppe mit einem Substituenten wie Trifluormethoxy, Perfluorethoxy wie Pentafluorethoxy und Benzyloxy; substituierte Aryloxy-Gruppe wie 3-Methylphenyloxy; Amino-Gruppe mit einem Substituenten wie Dimethylamino, Diethylamino und Diphenylamino; Alkylcarbonyl-Gruppe mit einem Substituenten wie Phenylacetyl; Alkoxycarbonyl-Gruppe mit einem Substituenten wie Trifluormethoxycarbonyl; Aryloxycarbonyl-Gruppe mit einem Substituenten wie 4-Fluorphenyloxycarbonyl; Silyl-Gruppe mit einem Substituenten wie Trimethylsilyl, Dimethyl-tert.-butylsilyl, Trimethoxysilyl und Triphenylsilyl; Aryl-Gruppe mit einem Substituenten wie Styryl, Anisyl, Fluorphenyl, Diphenylaminophenyl, Dimethylaminophenyl, Diethylaminophenyl und Pyridylphenyl; heterocyclische Gruppe mit einem Substituenten wie Phenylpyridyl, Bithienyl und Phenyloxadiazolyl; Alkinyloxy-Gruppe mit einem Substituenten wie Phenylethinyloxy und Trimethylsilylethinyloxy; Alkenyl-Gruppe mit einem Substituenten wie Styryl und eine Alkinyl-Gruppe mit einem Substituenten wie Phenylethinyl und Trimethylsilylethinyl.
- Als Ausgangsmaterial oder Zwischenprodukt bei der Erzeugung des Silacyclopentadien-Derivates dieser Erfindung sind 1,1-Bis(disubstituiertes Amino)-2,5-dimetallsilol mit der obigen Formel (2) und 3,3-Diamino-3-sila-1,4-pentadiyn [d. h. Bis(di-substituiertes Amino)-bis(substituiertes ethinyl)silan] mit der Formel (3) gezeigt.
- Mehr spezifisch umfassen die Gruppe, dargestellt durch M, R9, R10 und R21 bis R24 die folgenden.
- R9 und R10 sind unter den Gruppen, dargestellt durch R1 bis R4 eine Alkyl-Gruppe, Alkoxy-Gruppe, Silyl-Gruppe, Aryl-Gruppe oder eine heterocyclische Gruppe oder Cyano-Gruppe oder Alkyl-Gruppe, Silyl-Gruppe, Aryl-Gruppe oder heterocyclische Gruppe jeweils mit einem Substituenten. M bedeutet ein Alkalimetall wie Lithium, Natrium und Kalium.
- Das erfindungsgemäße Silacyclopentadien-Derivat kann durch das folgende Verfahren erzeugt werden.
- (a) Dihalogen-disubstituiertes Silan wird mit einer Mischung reagiert, erhalten durch Reaktion eines Derivates von Acetylen mit Alkalimetall wie Butyllithium, unter Erzeugung eines 3,3-Bis-disubstituierten Amino-3-sila-1,4-pentadiyn-Derivat (Diaminodiethinylsilan-Derivat), dargestellt durch die Formel (3), das ein Zwischenprodukt für das erfindungsgemäße Silacyclopentadien-Derivat ist.
- (b) Dieses 3,3-disubstituierte Amino-3-sila-1,4-pendadiyn-Derivat wird mit einem Alkalimetallkomplex zur Erzeugung von 1,1-Bis(disubstituiertes Amino)-3,4-disubstituiertes 2,5-Metallsilol mit der Formel (2) durch eine sogenannte Cyclosoerimgsreaktion reagiert (zuvor beschriebene Gleichung A).
- (c) Dieses 1,1-Bis(disubstituiertes Amino)-3,4-disubstituiertes 2,5-Metallsilol wird mit einem elektrophilen Reagens (nachfolgend beschrieben), Zinnchlorid, Metallhalogenid, Magnesiumhalogenid oder einem Komplex davon, Borsäureester wie Triisopropylborat oder einem Reagens wie einer organischen Zinn-Verbindung reagiert (nachfolgend beschrieben), zur Einfügung einer aktiven Gruppe in die 2- und 5-Positionen. Weiterhin wird diese aktive Gruppe in eine gewünschte Gruppe durch Reaktion wie Hydrolyse, Alkoholyse, Reduktion und Kupplung umgewandelt, wodurch das Silacyclopentadien-Derivat [Bis(disubstituiertes Amino)silacyclopentadien-Derivat] dieser Erfindung erhalten werden kann.
-
- (d) Weiterhin werden diese Reaktionen weiter detailliert erläutert.
- (d1) Das 1,1-Bis(diamino)-2,5-dimetallsilacyclopentadien-Derivat (nachfolgend mit "2,5-Dimetallprodukt" bezeichnet) mit der Formel (2) kann mit einer substituierten Silyl-Gruppe wie Trimethylsilylchlorid und Triethylsilylchlorid zum Umwandeln des Metalls der 2- und 5-Positionen in eine substituierte Silyl-Gruppe reagiert werden.
- (d2) Diese substituierte Silyl-Gruppe kann in eine Nitro-Gruppe durch Nitrierung mit Acetylnitrat umgewandelt werden [vergleiche F. B. Deans und C. Eaborn, J. Chem. Soc., 1957, 498].
- (d3) Diese Nitro-Gruppe kann in eine Amino-Gruppe durch Reduktion umgewandelt werden.
- (d4) Die Amino-Gruppe kann in eine Nitroso-Gruppe durch Oxidation umgewandelt werden [vgl. R. R. Holmes et al., J. Org. Chem., 30, 3837 (1965)].
- (d5) Wenn Brom als elektrophiles Reagens für das 2,5-Dimetallprodukt mit der Formel (2) verwendet wird, wird ein 1,1-Bis(diamino)-2,5-dibromsilacyclopentadien-Derivat (nachfolgend "2,5-Dibromprodukt") erhalten.
- (d6) Dann kann das 2,5-Dibromprodukt mit Alkoxid oder Aryloxid zum Umwandeln der Bromatome in eine Alkoxy-Gruppe oder Aryloxy-Gruppe reagiert werden [vgl. Synthesis (1980), 921].
- (d7) Das oben beschriebene 2,5-Dibromprodukt kann durch Substitutionsreaktion mit einem anorganischen Cyanid zum Umwandeln von Bromatomen in eine Cyano-Gruppe reagiert werden [vgl. J. Org. Chem., 32, 855 (1967) und 56, 2522 (1961) und Org. Synth., III, 631 (1955)].
- (d8) Diese Cyano-Gruppe kann einer Hydrolyse, Alkoholyse oder Reduktion unterworfen werden, zum Umwandeln in eine Alkylcarbonyl-Gruppe, Arylcarbonyl-Gruppe, Alkoxycarbonyl-Gruppe, Aryloxycarbonyl-Gruppe oder Formyl-Gruppe.
- (d9) Das zuvor beschriebene 2,5-Dibromprodukt kann mit einem Silber(I)-cyan-Komplex, umfassend eine Kationenspezies wie Phosphor oder Arsen, reagiert werden, zum Umwandeln in 2,5-Isonitrilprodukt [vgl. J. Songstad, et al., Acta. Chem. Scand., 24, 355 (1970)].
- (d10) Das oben beschriebene 2,5-Dibromprodukt kann mit NH3 oder PhNH2 reagiert werden, zum Umwandeln in eine Amino-Verbindung oder substituierte Amino-Verbindung [vgl. C. K. Bradsher et al., J. Org. Chem., 22, 500 (1957)].
- (d11) Diese Amino-Verbindung kann mit einer Nitroso-Verbindung zur Bildung einer Azo-Verbindung reagiert werden.
- (d12) Diese Amino-Verbindung kann mit Phosgen oder Kohlenstoffdisulfid reagiert werden, zum Umwandeln in eine Isocyanat-Verbindung oder Isothiocyanat-Verbindung (vgl. J. Org. Chem., 34,3200 (1969) und Org. Synth., IV, 521 (1963).
- (d13) Das 2,5-Dimetallprodukt kann mit Wasser zum Umwandeln des Metalls in Wasserstoff behandelt werden.
- (d14) Das 2,5-Dimetallprodukt kann mit Schwefeldioxid zum Umwandeln des Metalls in eine Sulfinyl-Gruppe reagiert werden [vgl. J. Org. Chem., 44, 160 (1979)].
- (d15) Anschließend kann die Sulfinyl-Gruppe mit Sulfurylchlorid reagiert werden, zum Umwandeln in eine Sulfonyl-Gruppe [vgl. Synthesis (1986), 852].
- (d16) Weiterhin kann das 2,5-Dimetallprodukt mit Schwefel oder substituiertem Disulfid reagiert werden, zum Umwandeln des Metalls in eine Thiol-Gruppe oder Sulfid-Gruppe (vgl. B. M. Trost et al., J. Am. Chem. Soc., 99, 3101 (1977)).
- (d17) Das 2,5-Dimetallprodukt wird mit Dialkylschwefelsäure zum Umwandeln des 2,5-Dimetalls in eine Alkyl-Gruppe reagiert.
- (d18) Das 2,5-Dimetallprodukt wird mit einem Reagens wie Zinkchlorid oder einem Komplex von Zinkchlorid, Borat, Magnesiumhalogenid oder einer organischen Zinnverbindung reagiert (Transmetallierung), zum Umwandeln des 2,5-Dimetalls in eine aktive Gruppe, und
- (d19) wird dann einer Kupplungsreaktion (später beschrieben) mit verschiedenen halogenierten Verbindungen unterworfen, wodurch die 2- und 5-Positionen in eine Alkyl-Gruppe, Alkenyl-Gruppe, Alkinyl-Gruppe, Aryl-Gruppe oder heterocyclische Gruppe umgewandelt werden können.
- (d20) Alkylstannan wird mit Nitrosylchlorid zum Umwandeln in eine Nitroso-Gruppe reagiert (vgl. E. H. Bartlett et al., J. Chem. Soc., C (1970), 1717).
- Die erfindungsgemäße Verbindung kann durch allgemein bekannte Umwandlungsverfahren für funktionelle Gruppen zusätzlich zu den obigen Verfahren derivatisiert werden.
- Bei dem Produktionsverfahren gemäß (b), d. h. Gleichung (A), wird, wenn andere Gruppen als eine Alkyl-Gruppe, Silyl-Gruppe, Aryl-Gruppe, heterocyclische Gruppe, Cyano-Gruppe oder Alkyl-Gruppe, Silyl-Gruppe, Aryl-Gruppe oder heterocyclische Gruppe mit jeweils einem Substituenten, beispielsweise eine Ester-Gruppe, Isocyanat-Gruppe, Isothiocyanat-Gruppe, Carbonyl-Gruppe, Formyl-Gruppe, Sulfonyl-Gruppe, Sulfinyl-Gruppe und Nitroso-Gruppe in R9 und R10 eingeführt werden, die Gruppen sind, die an den 3- und 4-Positionen des Silacyclopentadien-Rings vorhanden sind, eine Cyclisierungsreaktion bei der Gleichung (A) inhibiert. Demzufolge werden R9 und R10 beispielsweise in eine Ether-Gruppe, Thioether-Gruppe, disubstituierte Amino-Gruppe und Cyano-Gruppe umgewandelt, zur Durchführung der Cyclisierungsreaktion gemäß Gleichung (A), dann kann sie in die gewünschte Gruppe durch eine Umwandlung der funktionellen Gruppe umgewandelt werden.
- (e) Die disubstituierte Amino-Gruppe des Bis(diamino)silacyclopentadien-Derivates mit der Formel (5), erhalten gemäß (d), kann in die gewünschte Gruppe dieser Erfindung beispielsweise durch das folgende Verfahren umgewandelt werden, unter Erhalt des Silacyclopentadien-Derivates dieser Erfindung.
- (e-1) Das Bis(disubstituierte Amino)silacyclopentadien-Derivat mit der Formel (5) wird mit Chlorwasserstoff entsprechend der folgenden Gleichung (C) zur Erzeugung eines Dichlorsilacyclopentadien-Derivates mit der folgenden Formel (6) reagiert:
- (e-2) Das Bis(disubstituierte Amino)silacyclopentadien-Derivat mit der Formel (5) wird mit einer Verbindung, dargestellt durch R0OH entsprechend der folgenden Gleichung (D) reagiert, zur Erzeugung eines Dialkoxysilacyclopentadien-Derivates mit der folgenden Formel (7):
- (e-3) Das Dichlorsilacyclopentadien-Derivat mit der Formel (6), erhalten gemäß (e-1), wird mit einem Dialkylamin entsprechend der folgenden Gleichung (E) reagiert, zur Erzeugung eines 1-Chlor-1-dialkylaminosilacyclopentadien-Derivates mit der folgenden Formel (8):
- Die Endgruppen (R9, R10 und R21 bis R24) des 3,3-Diamino-3-sila-1,4-pentadiyn-Derivates mit der Formel (3) sind bevorzugt weniger anfällig für die Inhibition der Reaktion eines Alkalimetallkomplexes mit Acetylen und sind insbesondere bevorzugt inert für den Alkalimetallkomplex. Bevorzugt sind R21 bis R24 unabhängig eine Alkyl-Gruppe oder substituierte Alkyl-Gruppe und R9 und R10 sind jeweils unabhängig eine Alkyl-Gruppe oder substituierte Alkyl-Gruppe oder eine Aryl-Gruppe oder substituierte Aryl-Gruppe.
- Das elektrophile Reagens, das bei dem Produktionsverfahren dieser Erfindung verwendet wird, umfaßt substituiertes Silylchlorid wie Trimethylsilylchlorid und Triethylsilylchlorid, Schwefelsäureester wie Dimethylsulfat und Diethylsulfat, Halogene wie Brom und Iod und saure Chloride.
- Metallhalogenid wie Magnesiumhalogenid oder Zinkchlorid oder ein Komplex davon, Borsäureester, wie Triisopropylborat oder ein Reagens wie eine organische Zinn-Verbindung wird durch das elektrophile Reagens substituiert. Diese Reagenzien sind bevorzugt ausreichend trocken und eine große Menge von Feuchtigkeit macht es schwierig, das Zielprodukt zu erhalten.
- Bis(diamino)-3,4-disubstituiertes 2,5-dimetallsilol mit der Formel (3) wird mit diesen Reagenzien reagiert, zur Durchführung einer Transmetallisierung und anschließend einer Kupplungsreaktion, wodurch das Silacyclopentadien-Derivat ebenso erzeugt werden kann.
- Die Ausbeute oder Reaktionsrate wird bei der Kupplungsreaktion durch Verwendung eines Katalysators erhöht. Der hierin verwendete Katalysator umfaßt Palladium-Katalysatoren wie Tetrakistriphenylphosphinpalladium- oder Dichlorbistriphenylphosphinpalladium- oder Nickel-Katalysatoren.
- Die Reaktionszeit ist bei einer Serie dieser Reaktionen nicht besonders beschränkt, und die Reaktionen können gestoppt werden, nachdem sie zufriedenstellend ablaufen. Die Reaktionen können durch konventionelle analytische Mittel wie NMR und Chromatographie verfolgt werden, zur Bestimmung der Endpunkte der Reaktionen beim optimalen Zeitpunkt.
- Der Alkalimetallkomplex, der bei dem Produktionsverfahren dieser Erfindung verwendet wird, umfaßt zum Beispiel Lithiumnaphthalinid, Natriumnaphthalinid, Kaliumnaphthalinid, Lithium-4,4'-di-tert.-butyl-2,2'-biphenylid oder Lithium(N,N-dimethylamino)naphthalinid.
- Ein für die Reaktionen bei dem Erzeugungsverfahren dieser Erfindung verwendetes Lösungsmittel ist nicht spezifisch beschränkt, solange es für das Alkalimetall und den Alkalimetallkomplex inert ist. Üblicherweise werden Ethergruppen-Lösungsmittel wie Ether oder Tetrahydrofuran verwendet.
- Die Reaktion zur Bildung des Silacyclopentadien-Ringes, gezeigt in der Gleichung (A) bei (b) wird bevorzugt in einem Inertgasstrom durchgeführt, und Argongas wird verwendet. Die Reaktionstemperatur ist bevorzugt niedrig und die Reaktion kann bei 0°C oder Raumtemperatur schwer glatt ablaufen. Eine Temperatur von –40°C oder weniger ist bevorzugt, und eine Temperatur von –78°C oder weniger ist besonders bevorzugt. Es ist in der japanischen offengelegten Patentanmeldung Hei 7-179477 beschrieben, daß eine Reaktionstemperatur bei der Synthesereaktion eines Silacyclopentadien-Derivates mit einem anderen Substituenten am Silicium bevorzugt –78°C bis Raumtemperatur, mehr bevorzugt –40 bis 0°C ist. Bei dieser Erfindung müssen jedoch die Temperaturen niedriger sein als dieser Temperaturbereich, sonst können manchmal Nebenreaktionen stattfinden.
- Das erfindungsgemäße Silacyclopentadien-Derivat ist als leitendes Material, organisches EL-Element und Ausgangsmaterial für organische Materialien bei der Elektrophotographie nützlich, weil es einen reaktiven Substituenten am Silicium aufweist, das ein Heteroatom ist, und verschiedene Substituenten werden in die 2- und 5-Positionen eingeführt. Die für verschiedenen Verwendungen geeigneten Verbindungen können durch deren Verwendung synthetisiert werden. weiterhin kann dieses Siliciumatom ebenso mit polymerisierbaren Substanzen kombiniert werden, und die Polymerisation kann leicht erzielt werden.
- Weiterhin kann ein weiter Bereich der Verbindungen durch das Produktionsverfahren dieser Erfindung synthetisiert werden, weil verschiedene Substituenten in die 2- und 5-Positionen des Silacyclopentadien-Derivates eingefügt werden können. Bei konventionellen Produktionsverfahren kann ein Substituent nur in ein Siliciumatom des Silacyclopentadien-Rings oder die 2- oder die 5-Position eingeführt werden, aber wahlweise Substituenten können in beide Positionen gleichzeitig entsprechend dem Produktionsverfahren dieser Erfindung eingefügt werden.
- Beispiele
- Diese Erfindung wird unter Bezugnahme auf die Beispiele spezifisch erläutert.
- Beispiel 1
- Synthese von Bis(diethylamino)-bis(phenylethinyl)silan
- 205 ml 1,6 N n-Butyllithium wurden tropfenweise zu einer Lösung mit 33 ml Ethinylbenzol und 300 ml Tetrahydrofuran (nachfolgend mit THF abgekürzt) bei 0°C unter Stickstoffgas gegeben und das Rühren wurde für 1,5 Stunden fortgesetzt. 36,5 g Dichlorbis(diethylamino)silan und 672 mg Kupfercyanid wurden zu der resultierenden Lösung gegeben und das Rühren wurde 20 Minuten bei Raumtemperatur zur Durchführung der Reaktion fortgesetzt. In der Reaktionslösung ausgefällte Feststoffe wurden durch Filtration entfernt und dann wurde das Filtrat konzentriert. Wasser wurde zu diesem Konzentrat zum Extrahieren des Produktes mit Ether gegeben. Diese Ether-Extraktionsschicht wurde mit Wasser gewaschen und dann auf Magnesiumsulfat getrocknet. Eine Ether-Komponente dieser Lösung wurde abdestilliert, und dann wurde der Rest durch Destillation raffiniert, unter Erhalt von 52 g Bis(diethylamino)bis(phenylethinyl)silan. Die Ausbeute war 93%.
- Die resultierende Verbindung hatte einen Siedepunkt von 230 bis 260°C (Vakuum: 0,5 Torr) und die Meßergebnisse, erhalten durch NMR, sind unten gezeigt:
1H-NMR (C6D6) δ = 1,26 (t, J = 6,9 Hz, 12H), 3,30 (q, J = 6,9 Hz, 8H), 6,88–7,03 (m, 6H), 7,42–7,55 (m, 4H). - Beispiel 2
- Synthese von 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-bis(trimethylsilyl)silol
- Ein Reaktionskolben wurde mit 280 mg Lithium, 5,13 g Naphthalin und 80 ml THF beladen, und das Rühren wurde 3 Stunden bei Raumtemperatur unter Argonatmosphäre fortgesetzt. Eine Lösung, umfassend 3,75 g Bisdiethylaminobisphenylethinylsilan und 10 ml THF, wurde bei –78°C zugegeben, unter Fortsetzung des Rührens für eine Stunde, wodurch 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dilithosilol synthetisiert wurde.
- Anschließend wurden 5,6 ml Trimethylchlorsilan zu der oben erhaltenen Reaktionslösung gegeben und das Rühren wurde 10 min zur Durchführung der Reaktion fortgesetzt. Die Reaktionslösung wurden stehengelassen, um Raumtemperatur zu erhalten, und dann wurde das Lösungsmittel von der resultierenden Reaktionslösung unter vermindertem Druck abdestilliert. Weiterhin wurde Naphthalin bei 70°C unter vermindertem Druck entfernt, unter Erhalt eines Produktes. Dieses Produkt wurde von Hexan rekristallisiert, unter Erhalt von 4,32 g 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-bis(trimethylsilyl)silol. Die Ausbeute war 83%.
- Die somit erhaltene Verbindung hatte einen Schmelzpunkt von 92 bis 94°C. Die Meßergebnisse, erhalten durch NMR und die Ergebnisse der Elementaranalyse sind unten gezeigt:
1H-NMR (CDCl3) δ = 0,18 (s, 18H), 1,07 (t, J = 7,0 Hz, 12H), 2,99 (q, J = 7,0 Hz, 8H), 6,72–6,82 (m, 4H), 6,92–7,06 (m, 6H).
Molekularformel: C30H48N2Si3
Theoretischer Wert C: 69,16, H: 9,29, N: 5,38
Experimenteller Wert C: 69,09, H: 9,33, N: 5,41 - Beispiel 3
- Synthese von 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dimethylsilol
- Ein Reaktionskolben wurde mit 280 mg Lithium, 5,13 g Naphthalin und 80 ml THF beladen und das Rühren wurde bei Raumtemperatur 3 Stunden unter Argonatmosphäre fortgesetzt. Eine Lösung mit 3,75 g Bisdiethylaminobisphenylethinylsilan und 10 ml THF wurde bei –78°C zugegeben, unter Fortsetzung des Rührens für 1 Stunde, wodurch 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dilithiosilol synthetisiert wurde.
- Anschließend wurden 4,16 ml Dimethylsulfat zu der erhaltenen Reaktionslösung gegeben und das Rühren wurde für weitere 10 Minuten zur Durchführung der Reaktion fortgesetzt. Die Reaktionslösung wurde stehengelassen, um auf Raumtemperatur zu kommen, und dann wurde das Lösungsmittel von der resultierenden Reaktionslösung unter vermindertem Druck abdestilliert. Weiterhin wurde Naphthalin bei 70°C unter vermindertem Druck entfernt, unter Erhalt eines Produktes. Dieses Produkt wurde durch Destillation raffiniert, unter Erhalt von 2,83 g 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dimethylsilol. Die Ausbeute war 70%.
- Die somit erhaltene Verbindung hatte einen Schmelzpunkt von 42 bis 43°C. Die Meßergebnisse, erhalten durch NMR und das Ergebnis der Elementaranalyse, sind unten gezeigt:
1H-NMR (C6D6) δ = 1,15 (t, J = 7,0 Hz, 12H), 2,00 (s, 6H), 3,11 (q, J = 7,0 Hz, 8H), 6,90–7,12 (m, 10H).
Molekularformel: C26H36N2Si
Theoretischer Wert C: 77,17, H: 8,97, N: 6,92
Experimenteller Wert C: 77,09, H: 8,87, N: 6,74 - Beispiel 4
- Synthese von 1,1-Dichlor-3,4-diphenyl-2,5-bis(trimethylsilyl)silol
- Trockenes Chlorwasserstoffgas wurde in eine Lösung, umfassend 2,22 g 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-bis(trimethylsilyl)silol und 50 ml Ether, bei –78°C eine Stunde geblasen. Nach Abdestillieren des Ethers von der Reaktionslösung wurde trockenes Hexan zur Entfernung von unlöslichen Stoffen durch Filtration zugegeben, und dann wurde Hexan abdestilliert, unter Erhalt eines Produktes. Dieses Produkt wurde durch Destillation raffiniert, unter Erhalt von 1,55 g 1,1-Dichlor-3,4-diphenyl-2,5-bis(trimethylsilyl)silol. Die Ausbeute war 81%.
- Die somit erhaltene Verbindung hatte einen Schmelzpunkt von 79 bis 81°C. Die Meßergebnisse, erhalten durch NMR und das Ergebnis der Elementaranalyse sind unten gezeigt:
1H-NMR (C6D6) δ = 0,17 (s, 18H), 6,72–6,91 (m, 10H).
Molekularformel: C22H28Si3Cl2
Theoretischer Wert C: 59,03, H: 6,30
Experimenteller Wert C: 59,43, H: 6,43 - Beispiel 5
- Synthese von 1,1-Dichlor-3,4-diphenyl-2,5-dimethylsilol
- Die gleiche Vorgehensweise wie bei Beispiel 4 wurde wiederholt unter Erhalt von 1,1-Dichlor-3,4-diphenyl-2,5- dimethylsilol, außer, daß 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dimethylsilol, erhalten in Beispiel 3, durch 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-bis(trimethylsilyl)silol substituiert wurde. Die Ausbeute war 80%.
- Die somit erhaltene Verbindung hatte einen Schmelzpunkt von 94 bis 96°C. Die Meßergebnisse, erhalten durch NMR, und die Ergebnisse der Elementaranalyse sind unten gezeigt:
1H-NMR (C6D6) δ = 1,87 (s, 6H), 6,66–6,78 (m, 4H), 6,82–6,98 (m, 6H).
Molekularformel: C19H16SiCl2
Theoretischer Wert C: 62,25, H: 4,87
Experimenteller Wert C: 65,45, H: 4,85 - Beispiel 6
- Synthese von 1,1-Difluor-3,4-diphenyl-2,5-bis(trimethylsilyl)silol
- Trockenes Chlorwasserstoffgas wurde in eine 60 ml-Etherlösung aus 3,12 g 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-bis(trimethylsilyl)silol bei –78°C für eine Stunde geblasen, zur Durchführung der Reaktion. Nach Abdestillation des Ethers von der resultierenden Reaktionslösung wurde trockenes Hexan zugegeben, zur Entfernung von unlöslichen Stoffen durch Filtration, und dann wurde Hexan abdestilliert, unter Erhalt von 1,1-Dichlor-3,4-diphenyl-2,5-bis(trimethylsilyl)silol.
- Anschließend wurden 20 ml Ether zu der erhaltenen Reaktionslösung, und weiterhin 1 ml Pyridiniumpolywasserstofffluorid bei –78°C zugegeben. Das Rühren wurde 30 Minuten fortgeführt, zur Durchführung der Reaktion. Nach Stehenlassen der Reaktionslösung bis auf Raumtemperatur zum Abdestillieren des Ethers wurde das Produkt mit trockenem Hexan extrahiert und in dem Extrakt enthaltenes Hexan wurde abdestilliert. Dann wurde der Extrakt destilliert, unter Erhalt von 1,70 g 1,1-Difluor-3,4-diphenyl-2,5-bis(trimethylsilyl)silol. Die Ausbeute war 69%.
- Die somit erhaltene Verbindung hatte einen Schmelzpunkt von 93 bis 95°C. Die Meßergebnisse, erhalten durch NMR und das Ergebnis der Elementaranalyse sind unten gezeigt:
1H-NMR (C6D6) δ = 0,09 (s, 18H), 6,72–6,92 (m, 10H).
Molekularformel: C22H28F2Si3
Theoretischer Wert C: 63,72, H: 6,81
Experimenteller Wert C: 63,53, H: 6,96 - Beispiel 7
- Synthese von 1,1-Difluor-3,4-diphenyl-2,5-dimethylsilol
- Die gleiche Vorgehensweise wie bei Beispiel 4 wurde wiederholt, unter Erhalt eines rohen Produktes von 1,1-Dichlor-3,4-diphenyl-2,5-dimethylsilol, außer daß 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dimethylsilol, erhalten gemäß Beispiel 3, durch 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-bis(trimethylsilyl)silol substituiert wurde.
- 25 ml Ether wurden zu diesem rohen Produkt gegeben, und 3,70 g Zinkfluorid wurden weiter zugegeben, mit anschließendem Fortsetzen des Rührens für zwei Stunden, zur Durchführung der Reaktion. Unlösliche Stoffe wurden von der somit erhaltenen Reaktionslösung durch Filtration entfernt, und Ether wurde von dem Filtrat abdestilliert. Dann wurde trockener Hexan zugegeben, um erneut unlösliche Stoffe zu entfernen, und Hexan wurde abdestilliert, unter Erhalt eines Produktes. Das Produkt wurde durch Destillation raffiniert, unter Erhalt von 2,49 g 1,1-Difluor-3,4-diphenyl-2,5-dimethylsilol. Die Ausbeute war 70%.
- Die Meßergebnisse der somit erhaltenen Verbindung durch NMR sind unten angegeben:
1H-NMR (CDCl3) δ = 1,77 (s, 6H), 6,75–6,85 (m, 4H), 7,02–7,18 (m, 6H). - Beispiel 8
- Synthese von 1,1-Dihydroxy-3,4-diphenyl-2,5-bis(trimethylsilyl)silol
- 2,5 ml einer gemischten Lösung aus THF und Wasser (4 : 1) wurde zu 100 mg 1,1-Dichlor-3,4-diphenyl-2,5-bis(trimethylsilyl)silol gegeben und das Rühren wurde bei Raumtemperatur für eine Stunde fortgesetzt. Ether wurde zu der somit erhaltenen Reaktionsmischung zum Extrahieren des Produktes gegeben. Der Extrakt wurde mit Wasser gewaschen und auf Natriumsulfat getrocknet. Natriumsulfat wurde durch Filtration entfernt und dann wurde das Filtrat konzentriert, unter Erhalt von 92 mg 1,1-Dihydroxy-3,4-diphenyl-2,5-bis(trimethylsilyl)silol. Die Ausbeute war 100%.
- Die somit erhaltene Verbindung hatte einen Schmelzpunkt von 205 bis 206°C. Die durch NMR erhaltenen Meßergebnisse und die Ergebnisse der Elementaranalyse sind unten gezeigt:
1H-NMR (CDCl3) δ = –0,12 (s, 18H), 2,52 (s, 2H), 6,75–6,86 (m, 4H), 6,98–7,07 (m, 6H).
Molekularformel: C22H30O2Si3
Theoretischer Wert C: 64,33, H: 7,36
Experimenteller Wert C: 64,20, H: 7,34 - Beispiel 9
- Synthese von 1-Fluor-1-hydroxy-3,4-diphenyl-2,5-bis(trimethylsilyl)silol
- Die gleiche Vorgehensweise wie bei Beispiel 8 wurde wiederholt, unter Erhalt von 91 mg 1-Fluor-1-hydroxy-3,4-diphenyl-2,5-bis(trimethylsilyl)silol, mit der Ausnahme, daß 1,1-Difluor-3,4-diphenyl-2,5-bis(trimethylsilyl)silol, erhalten gemäß Beispiel 6, durch 1,1-Dichlor-3,4-diphenyl-2,5-bis(trimethylsilyl)silol substituiert wurde. Die Ausbeute war 91%.
- Die somit erhaltene Verbindung hatte einen Schmelzpunkt von 101 bis 103°C. Die durch NMR erhaltenen Meßergebnisse und die Ergebnisse der Elementaranalyse sind unten gezeigt:
1H-NMR (CDCl3) δ = –0,10 (s, 18H), 2,92 (s, 1H), 6,77–6,88 (m, 4H), 6,98–7,09 (m, 6H).
Molekularformel: C22H29OFSi3
Theoretischer Wert C: 64,02, H: 7,08
Experimenteller Wert C: 63,65, H: 7,29 - Beispiel 10
- Synthese von 1-Chlor-1-diethylamino-3,4-diphenyl-2,5-bis(trimethylsilyl)silol
- Trockenes Chlorwasserstoffgas wurde in eine 100 ml-Etherlösung aus 4,17 g 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-bis(trimethylsilyl)silol bei –78°C für eine Stunde geblasen. Nach Abdestillieren des Ethers wurde Dichlormethan zugegeben und dann wurden 1,3 ml Triethylamin und 1 ml Diethylamin in dieser Reihenfolge zugegeben. Nach Fortsetzung des Rührens bei Raumtemperatur für 20 Stunden wurde das Lösungsmittel abdestilliert und trockenes Hexan wurde zur Entfernung von unlöslichen Stoffen durch Filtration zugegeben. Dann wurde Hexan von dem Filtrat abdestilliert unter Erhalt eines Produktes. Dieses Produkt wurde durch Destillation raffiniert, unter Erhalt von 3,0 g 1-Chlor-1-diethylamino-3,4-diphenyl-2,5-bis(trimethylsilyl)silol. Die Ausbeute war 78%.
- Die somit erhaltene Verbindung hatte einen Schmelzpunkt von 107 bis 108°C. Die durch NMR erhaltenen Meßergebnisse und die Ergebnisse der Elementaranalyse sind unten gezeigt:
1H-NMR (C6D6) δ = 0,16 (s, 18H), 1,15 (t, J = 7,0 Hz, 6H), 3,12 (q, J = 7,0 Hz, 4H), 6,78–6,97 (m, 10H).
Molekularformel: C26H38NClSi3
Theoretischer Wert C: 64,68, H: 7,91
Experimenteller Wert C: 64,42, H: 8,08, N: 2,76 - Beispiel 11 (Referenzbeispiel)
- Synthese von 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dithienylsilol
- Tetramethylethylendiamin-Komplex von Zinkchlorid wurde zu 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dilithiosilol, synthetisiert durch das gleiche Verfahren wie bei Beispiel 3, gegeben und ein einstündiges Rühren bei Raumtemperatur wurde durchgeführt. Eine THF-Lösung aus 2-Bromthiophen und Chlorbistriphenylphosphinpalladium wurde zugegeben und 10 Stunden unter Erwärmen unter Rückfluß gehalten. Die Reaktionslösung wurde auf Raumtemperatur gekühlt und dann wurden Wasser und Toluol zugefügt, zur Entfernung von ausgefällten unlöslichen Stoffen. Niedrigsiedende Stoffe wurden unter vermindertem Druck abdestilliert und der Rest wurde durch Säulenchromatographie raffiniert, unter Erhalt von 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dithienylsilol.
- Beispiel 12
- Synthese von 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dipyridylsilol
- Die gleiche Vorgehensweise wie bei Beispiel 11 (Referenzbeispiel) wurde wiederholt, mit der Ausnahme, daß 2-Brompyridin anstelle von 2-Bromthiophen, verwendet gemäß Beispiel 11, eingesetzt wurde.
- Beispiel 13
- Synthese von 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-bis(3-methylphenyl)silol
- Die gleiche Vorgehensweise wie bei Beispiel 11 wurde durchgeführt, mit der Ausnahme, daß das 2-Bromthiophen, verwendet gemäß Beispiel 11, durch 3-Methylbrombenzol ersetzt wurde.
- Beispiel 14
- Synthese von 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dibromsilol
- Brom wurde tropfenweise zu 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dilithiosilol synthetisiert auf gleiche Weise wie bei Beispiel 3, gegeben, und das Rühren wurde eine Stunde bei Raumtemperatur fortgesetzt. Dann wurde eine gesättigte wäßrige Natriumthiosulfat-Lösung zum Extrahieren des Zielstoffes mit Toluol in einer organischen Schicht zugegeben. Niedrigsiedende Stoffe wurden unter vermindertem Druck abdestilliert, und der Rest wurde durch Säulenchromatographie unter Rekristallisierung raffiniert, unter Erhalt von 1,1-Bis(diethylamino)-3,4-diphenyl-2,5-dibromsilol.
Claims (14)
- Silacyclopentadienderivat mit der folgenden Formel (1): worin X1 und Y1 jeweils unabhängig ein Halogenatom, eine Aminogruppe, eine Hydroxylgruppe oder eine Aminogruppe mit Substituenten sind; R1 und R4 jeweils unabhängig ein Wasserstoffatom, ein Halogenatom, eine Alkylgruppe, eine Alkoxygruppe, eine Aryloxygruppe, eine Aminogruppe, eine Alkylcarbonylgruppe, eine Arylcarbonylgruppe, eine Alkoxycarbonylgruppe, eine Aryloxycarbonylgruppe, eine Azogruppe, eine Alkylazogruppe, eine Arylazogruppe, eine Sulfinylgruppe, eine Sulfonylgruppe, eine Sulfanylgruppe, eine Arylgruppe, eine heterocyclische Gruppe, eine Alkenylgruppe, eine Alkinylgruppe, eine Nitrogruppe, eine Formylgruppe, eine Nitrosogruppe, eine Formyloxygruppe, eine Isocyanatgruppe, eine Isothiocyanatgruppe, eine Cyanogruppe oder eine Aminogruppe, eine Silylgruppe, eine Arylgruppe oder eine heterocyclische Gruppe mit jeweils einem Substituenten sind; R2 und R3 unabhängig ein Wasserstoffatom, ein Halogenatom, eine Alkoxygruppe, eine Aryloxygruppe, eine Aminogruppe, eine Silylgruppe, eine Arylgruppe, eine heterocyclische Gruppe, eine Alkenylgruppe, eine Alkinylgruppe, eine Azogruppe, eine Alkylazogruppe, eine Arylazogruppe oder eine Cyanogruppe oder eine Alkylgruppe, eine Alkoxygruppe, eine Aryloxygruppe, eine Aminogruppe, eine Silylgruppe, eine Arylgruppe, eine heterocyclische Gruppe, eine Alkenylgruppe oder eine Alkinylgruppe mit jeweils einem Substituenten sind.
- Silacyclopentadienderivat nach Anspruch 1, worin X1 und Y1 jeweils unabhängig ein Chloratom, ein Fluoratom, eine Dialkylaminogruppe oder eine Hydroxylgruppe sind; und R2 und R3 jeweils eine Phenylgruppe oder eine substituierte Phenylgruppe sind.
- Silacyclopentadienderivat nach Anspruch 1, worin X1 und Y1 jeweils unabhängig eine Diethylaminogruppe, ein Chloratom, ein Fluoratom oder eine Hydroxylgruppe sind; R1 und R4 jeweils eine Trimethylsilylgruppe, eine Methylgruppe, eine Thienylgruppe, eine Pyridylgruppe, eine 3-Methylphenylgruppe oder ein Bromatom sind; und R2 und R3 jeweils eine Phenylgruppe sind.
- Silacyclopentadienderivat mit der folgenden Formel (5): worin R21 bis R24 jeweils unabhängig eine Alkylgruppe oder eine substituierte Alkylgruppe sind; R5 und R8 jeweils unabhängig ein Wasserstoffatom, ein Halogenatom, eine Alkylgruppe, eine Alkoxygruppe, eine Aryloxygruppe, eine Aminogruppe, eine Alkylcarbonylgruppe, eine Arylcarbonylgruppe, eine Alkoxycarbonylgruppe, eine Aryloxycarbonylgruppe, eine Azogruppe, eine Alkylazogruppe, eine Arylazogruppe, eine Sulfinylgruppe, eine Sulfonylgruppe, eine Sulfanylgruppe, eine Arylgruppe, eine heterocyclische Gruppe, eine Alkenylgruppe, eine Alkinylgruppe, eine Nitrogruppe, eine Formylgruppe, eine Nitrosogruppe, eine Formyloxygruppe, eine Isocyanatgruppe, eine Isothiocyanatgruppe oder eine Cyanogruppe oder eine Aminogruppe oder eine Silylgruppe mit jeweils einem Substituenten sind; und R9 und R10 jeweils eine Phenylgruppe oder eine substituierte Phenylgruppe sind.
- 1,1-Bis(diamino)-2,5-dimetallsilacyclopentadien-Derivat mit der folgenden Formel (2): worin R21 bis R24 unabhängig eine Alkylgruppe oder eine substituierte Alkylgruppe sind; M ein Alkalimetall ist; R9 und R10 jeweils unabhängig eine Alkylgruppe, eine Silylgruppe, eine Arylgruppe, eine heterocyclische Gruppe, eine Cyanogruppe oder eine Alkylgruppe, eine Silylgruppe, eine Arylgruppe oder eine heterocyclische Gruppe mit jeweils einem Substituenten sind (vorausgesetzt, dass R9 und Rl0 zur Bildung eines Ringes an den Enden kombiniert sein können).
- 1,1-Bis(diamino)-2,5-dimetallsilacyclopentadien-Derivat, wie in Anspruch 5 definiert, worin R9 und R10 in der Formel (2) unabhängig eine Alkylgruppe oder eine substituierte Alkylgruppe oder eine Arylgruppe oder eine substituierte Arylgruppe sind.
- 3,3-Diamino-3-sila-1,4-pentadiyn-Derivat, wie in Anspruch 7 definiert, worin R9 und R10 in der Formel (3) unabhängig eine Alkylgruppe oder eine substituierte Alkylgruppe oder eine Arylgruppe oder eine substituierte Arylgruppe sind.
- Verfahren zur Erzeugung eines 1,1-Bis(diamino)-3,4-disubstituierten 2,5-Dimetallsilacyclopentadien-Derivats mit der folgenden Formel (2), gekennzeichnet durch Reaktion eines 3,3-Diamino-3-sila-1,4-pentadiyn-Derivats mit der folgenden Formel (3) mit einem Alkalimetallkomplex: worin R21 bis R24, M, R9 und R10 synonym zu jenen gemäss Formel (2), wie in Anspruch 5 definiert, sind.
- Verfahren zur Erzeugung eines 1,1-Bis(diamino)-3,4-disubstituierten 2,5-Dimetallsilacyclopentadien-Derivats, wie in Anspruch 9 definiert, worin R9 und R10 in den Formeln (3) und (2) unabhängig eine Alkylgruppe oder eine substituierte Alkylgruppe oder eine Arylgruppe oder eine substituierte Arylgruppe sind.
- Verfahren zur Erzeugung eines Silacyclopentadienderivats, gekennzeichnet durch folgende Schritte: Reaktion eines 1,1-Bis(diamino)-2,5-dimetallsilacyclopentadien-Derivats mit der folgenden Formel (2) mit einer Verbindung, ausgewählt aus der Gruppe bestehend aus einem elektrophilen Reagens, einem Metallhalogenid, einem Komplex aus einem Metallhalogenid, Borsäureester und einer organischen Zinnverbindung, zum Einfügen von aktiven Gruppen Ra in die 2- und 5-Positionen des obigen Derivats, und Durchführen einer Hydrolyse, Alkoholyse, Reduktion, Oxidation oder Kupplungsreaktion mit dem Derivat, unter Erhalt eines Bis(diamino)silacyclopentadien-Derivats mit der Formel (5): worin Ra Br, Cl, I, Si(CH3)3, Si(C2H5)3, Sn(CH3)3, Sn(C2H5)3, eine Alkylgruppe mit 1 bis 4 Kohlenstoffatomen, ZnX, MgX oder B(OR)3 ist (worin X Halogen und R eine Alkylgruppe mit 1 bis 4 Kohlenstoffatomen ist); R21 bis R24 unabhängig eine Alkylgruppe oder eine substituierte Alkylgruppe sind; M ein Alkalimetall ist; R5 und R8 unabhängig ein Wasserstoffatom, ein Halogenatom, eine Alkylgruppe, eine Alkoxygruppe, eine Aryloxygruppe, eine Aminogruppe, eine Alkylcarbonylgruppe, eine Arylcarbonylgruppe, eine Alkoxycarbonylgruppe, eine Aryloxycarbonylgruppe, eine Azogruppe, eine Alkylazogruppe, eine Arylazogruppe, eine Sulfinylgruppe, eine Sulfonylgruppe, eine Sulfanylgruppe, eine Arylgruppe, eine heterocyclische Gruppe, eine Alkenylgruppe, eine Alkinylgruppe, eine Nitrogruppe, eine Formylgruppe, eine Nitrosogruppe, eine Formyloxygruppe, eine Isocyanatgruppe, eine Isothiocyanatgruppe oder eine Cyanogruppe oder eine Aminogruppe, eine Silylgruppe, eine Arylgruppe oder eine heterocyclische Gruppe mit jeweils einem Substituenten sind; und R9 und R10 unabhängig eine Alkylgruppe, eine Silylgruppe, eine Arylgruppe, eine heterocyclische Gruppe oder eine Cyanogruppe oder eine Alkylgruppe, eine Silylgruppe, eine Arylgruppe oder eine heterocyclische Gruppe mit jeweils einem Substituenten sind (vorausgesetzt, dass R9 und R10 an den Enden unter Bildung eines Rings kombiniert sein können).
- Verfahren zur Erzeugung eines Silacyclopentadienderivats, gekennzeichnet durch Reaktion des Bis(diamino)silacyclopentadienderivats mit der obigen Formel (5) mit Salzsäure, unter Erzeugung eines Dichlorsilacyclopentadienderivats mit der folgenden Formel (6): worin R21 bis R24, R5, R8, R9 und R10 synonym zu jenen der Formel (5), wie in Anspruch 4 definiert, sind.
- Verfahren zur Erzeugung eines Silacyclopentadienderivats, gekennzeichnet durch Reaktion des Bis(diamino)silacyclopentadienderivats mit der obigen Formel (5) mit einer Verbindung mit der folgenden Formel (9), zur Erzeugung eines Dialkoxysilacyclopentadienderivats mit der folgenden Formel (7): worin R21 bis R24, R5, R8, R9 und R10 synonym zu jenen der obigen Formel (5), wie in Anspruch 4 definiert, sind; und R0, X6 und Y6 jeweils unabhängig eine Alkylgruppe oder eine substituierte Alkylgruppe, eine Arylgruppe oder eine substituierte Arylgruppe, oder eine heterocyclische Gruppe oder eine substituierte heterocyclische Gruppe sind.
- Verfahren zur Erzeugung eines Silacyclopentadienderivats, gekennzeichnet durch Reaktion des Dichlorsilacyclopentadienderivats mit der obigen Formel (6) mit Dialkylamin zur Erzeugung eines 1-Chlor-1-dialkylamino-silacyclopentadien-Derivats mit der folgenden Formel (8): worin R5, R8, R9 und R10 synonym zu jenen der obigen Formel (5), wie in Anspruch 4 definiert, sind; und Z1 und Z2 unabhängig eine Alkylgruppe mit 1 bis 50 Kohlenstoffatomen sind.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP7450097 | 1997-03-11 | ||
| JP7450097 | 1997-03-11 | ||
| JP36349897 | 1997-12-16 | ||
| JP36349897A JP3931409B2 (ja) | 1997-03-11 | 1997-12-16 | シラシクロペンタジエン誘導体 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69824652D1 DE69824652D1 (de) | 2004-07-29 |
| DE69824652T2 true DE69824652T2 (de) | 2005-07-07 |
Family
ID=26415650
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69824652T Expired - Lifetime DE69824652T2 (de) | 1997-03-11 | 1998-03-10 | Silacyclopentadienderivate |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US6005128A (de) |
| EP (1) | EP0864573B1 (de) |
| JP (1) | JP3931409B2 (de) |
| DE (1) | DE69824652T2 (de) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9922818B2 (en) * | 2014-06-16 | 2018-03-20 | Versum Materials Us, Llc | Alkyl-alkoxysilacyclic compounds |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB966131A (en) * | 1959-04-07 | 1964-08-06 | Union Carbide Corp | Process for the preparation of organic compounds |
| US3151140A (en) * | 1960-06-15 | 1964-09-29 | Union Carbide Corp | Heterolinear tetraphenylbutadiene compounds and process of preparing same |
| FR1468482A (fr) * | 1965-02-17 | 1967-02-03 | Gen Electric | Cyclopolysiloxanes substitués thermiquement stables |
| US4104295A (en) * | 1976-11-01 | 1978-08-01 | Dow Corning Corporation | Methylsilacyclopentenyl-containing silylating agents and method therefor |
| JP2862753B2 (ja) * | 1992-06-29 | 1999-03-03 | 信越化学工業株式会社 | チオフェン−シロ−ル共重合体およびその製造方法 |
| JP2750559B2 (ja) * | 1992-09-16 | 1998-05-13 | 信越化学工業株式会社 | 導電性重合体組成物 |
| US5498736A (en) * | 1993-12-21 | 1996-03-12 | Shin-Etsu Chemical Co., Ltd. | 2,5-reactive substituent group-containing siloles, silole polycondensates and preparation thereof |
| JP2903985B2 (ja) * | 1993-12-21 | 1999-06-14 | 信越化学工業株式会社 | 2,5−反応性置換基含有シロールの製造方法及び2,5−反応性置換基含有シロール |
| JP3089982B2 (ja) * | 1994-03-11 | 2000-09-18 | 信越化学工業株式会社 | 2,5−反応性置換基含有シロール及びシロール縮重合物並びにそれらの製造方法 |
| DE69635197D1 (de) * | 1995-07-17 | 2005-10-20 | Chisso Corp | Organische Elektrolumineszenzelemente enthaltend Silacyclopentadienderivate |
-
1997
- 1997-12-16 JP JP36349897A patent/JP3931409B2/ja not_active Expired - Fee Related
-
1998
- 1998-03-10 EP EP98104270A patent/EP0864573B1/de not_active Expired - Lifetime
- 1998-03-10 US US09/037,794 patent/US6005128A/en not_active Expired - Fee Related
- 1998-03-10 DE DE69824652T patent/DE69824652T2/de not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JPH10310591A (ja) | 1998-11-24 |
| EP0864573B1 (de) | 2004-06-23 |
| EP0864573A2 (de) | 1998-09-16 |
| EP0864573A3 (de) | 1999-11-17 |
| DE69824652D1 (de) | 2004-07-29 |
| JP3931409B2 (ja) | 2007-06-13 |
| US6005128A (en) | 1999-12-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JPH09169774A (ja) | ビス(シリルアルキル)ジスルファンの製造法 | |
| EP0955302B1 (de) | Verfahren zur Herstellung von Gemischen von Organosiliciumoligosulfanen mit einem hohen Anteil an Organosiliciumdisulfanen | |
| DE2642833A1 (de) | Oxysilan-verbindungen, verfahren zu ihrer herstellung und ihre verwendung | |
| EP1318153B1 (de) | Verfahren zur Herstellung von Styryl-funktionalisierten Silanen | |
| US4599440A (en) | Organocyclosiloxane | |
| DE112011104615B4 (de) | Organoborverbindung und Verfahren zum Herstellen derselben | |
| Karsch | A New Reagent for Nucleophilic Aminomethylation: Doubly Lithiated Bis (dimethylamino) methane and Its Use for the Synthesis of Si, N‐Heterocycles | |
| JP2010202554A (ja) | ヘテロ環縮環オリゴチオフェン及びその製造方法、並びにポリマー | |
| DE69824652T2 (de) | Silacyclopentadienderivate | |
| CA1153001A (en) | Hydantoinylsilanes and method for preparing same | |
| CH661928A5 (de) | Verfahren zur herstellung funktionell substituierter silane. | |
| EP0946487A1 (de) | An feste trägermaterialien fixierte umesterungskatalysatoren | |
| US5817837A (en) | Tetrathiafulvalene derivative precursors, tetrathiafulvalene derivatives, and processes for producing them | |
| US5412105A (en) | Thiophene-silole copolymer and its method of manufacture | |
| DE60303199T2 (de) | Ureido- oder carbamate derivate von kronenether und silizium, verwendbar zur herstellung von trägermaterialien zur chromatographischen trennung metallischer kationen und amine enthaltender organischer verbindungen | |
| JP3089982B2 (ja) | 2,5−反応性置換基含有シロール及びシロール縮重合物並びにそれらの製造方法 | |
| Almansour et al. | Preparation of (iPrMe2Si) 3CH and its use as a source of the bulky ligand (iPrMe2Si) 3C | |
| JP2991818B2 (ja) | 縮合2員環状ジシラニレン−アセチレン化合物およびその製法 | |
| JPH0135835B2 (de) | ||
| US4798903A (en) | Optically active 3,3'-disilylbinaphthol derivatives | |
| WO1999033844A1 (de) | Herstellung von organomagnesium-verbindungen unter einsatz von katalysatoren | |
| JP2814664B2 (ja) | キノキサリンオリゴマーおよびその製造方法 | |
| JPH03109389A (ja) | ビス(3,4―ジメチルフエニル)ジメチルシランの製造法 | |
| JPS63135393A (ja) | アルキルシリルシアニドの製造方法 | |
| Celebuski et al. | Intra-and intermolecular rearrangements in Fp (. eta. 1-allyl) and Fp (. eta. 2-olefin) complexes |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| R082 | Change of representative |
Ref document number: 864573 Country of ref document: EP Representative=s name: HOFFMANN - EITLE, 81925 MUENCHEN, DE |