-
TECHNISCHES
GEBIET
-
Die
vorliegende Erfindung betrifft neuartige Enzymvarianten, die in
einer Reihe von Reinigungszusammensetzungen geeignet sind, und solche
Reinigungszusammensetzungen.
-
ALLGEMEINER
STAND DER TECHNIK
-
Enzyme
stellen die größte Klasse
natürlich
vorkommender Proteine dar. Jede Enzym-Klasse katalysiert (beschleunigt
eine Reaktion, ohne verbraucht zu werden) im Allgemeinen eine andere
Art von chemischer Reaktion. Eine Klasse von Enzymen, die als Proteasen
bekannt sind, ist für
ihre Fähigkeit
zum Hydrolysieren (Aufbrechen einer Verbindung zu zwei oder mehr
einfacheren Verbindungen mit Aufnahme der H- und OH-Teile eines
Wassermoleküls
auf einer Seite der aufgespalteten chemischen Bindung) anderer Proteine
bekannt. Diese Fähigkeit
zum Hydrolysieren von Proteinen wird bereits durch Einbeziehung
natürlich
vorkommender und mit Protein erzeugter Proteasen als Zusatzstoff
für Wäschewaschmittelzubereitungen
genutzt. Viele Flecken auf Kleidung sind proteinhaltig, und weit
spezifizierte Proteasen können
die Entfernung solcher Flecken wesentlich verbessern.
-
Leider überträgt sich
der Wirksamkeitsgrad dieser Proteine in ihrer natürlichen,
bakteriellen Umgebung häufig
nicht in die relativ unnatürliche
Waschumgebung. Speziell sind Eigenschaften der Protease, wie Wärmebeständigkeit,
pH-Stabilität,
Oxidationsstabilität
und Substratspezifität,
bei der Verwendung außerhalb der
natürlich
Umgebung des Enzyms nicht unbedingt optimiert.
-
Die
Aminosäure-Sequenz
der Protease bestimmt die Eigenschaften der Protease. Eine Veränderung der
Aminosäure-Sequenz
der Protease kann die Eigenschaften des Enzyms in variierenden Graden ändern oder
kann das Enzym sogar deakti vieren, abhängig vom Ort, von der Art und/oder
vom Ausmaß der Änderung in
der Aminosäure-Sequenz.
Bei dem Versuch, ihre Eigenschaften zu verbessern, wurden mehrere
Ansätze vorgenommen,
um die Wildtyp-Aminosäure-Sequenz
von Proteasen zu verändern,
mit dem Ziel des Erhöhens der
Wirksamkeit der Protease in der Waschumgebung. Zu diesen Ansätzen gehört das Verändern der
Aminosäure-Sequenz, um unter
ganz verschiedenen Bedingungen die Wärmebeständigkeit zu erhöhen und
die Oxidationsstabilität
zu verbessern.
-
Trotz
der Vielfalt der in der Technik beschriebenen Ansätze besteht
eine fortdauernde Notwendigkeit für neue wirksame Proteasevarianten,
die zur Reinigung einer Reihe von Oberflächen geeignet sind.
-
Aufgaben der
vorliegenden Erfindung
-
Es
ist eine Aufgabe der vorliegenden Erfindung, Subtilisinenzymvarianten
bereitzustellen, die im Vergleich zum Wildtyp des Enzyms verbesserte
Hydrolyse aufweisen.
-
Es
ist auch eine Aufgabe der vorliegenden Erfindung, Reinigungszusammensetzungen
bereitzustellen, die diese Subtilisinenzymvariante umfassen.
-
ZUSAMMENFASSUNG
-
Die
vorliegende Erfindung betrifft eine Subtilisin-BPN'-Variante, die eine
Wildtyp-Aminosäure-Sequenz umfasst,
dadurch gekennzeichnet, dass die Wildtyp-Aminosäure-Sequenz eine der folgenden
Mutationen umfasst, wobei die ursprüngliche Aminosäure, die
im Wildtyp auftritt, als erstes, die Positionsnummer als zweites und
die substituierte Aminosäure
als drittes angegeben wird:
- – Einfache Mutation:
Lys213Glu;
Ala216Glu;
Ala216Asp;
Ala216Gly;
Ser204Glu;
Val203Glu;
- – Zweifache
Mutation:
Lys213Glu + Tyr217Leu;
Ile205Leu + Ala216Glu;
Ile205Leu
+ Ala216Asp;
Pro210Ala + Gly215Thr;
Lys213Glu + Ala216Glu;
Tyr214Phe
+ Tyr217Asn;
Gln206Glu + Ala216Glu;
Ala216Glu + Tyr217Leu;
Gln206Glu
+ Ala216Glu;
Ala216Glu + Tyr217Leu;
Gln206Glu + Tyr217Leu;
Gln206Glu
+ Lys213Glu;
- – Dreifache
Mutation:
Gln206Pro + Gly211Ala + Ala216Glu;
Lys213Glu
+ Ala216Glu + Tyr217Leu;
Ile205Val + Pro210Ala + Lys213Glu;
Gln206Glu
+ Ala216Glu + Tyr217Leu;
Gln206Glu + Lys213Glu + Tyr217Leu;
- – Vierfache
Mutation:
Pro210Ala + Lys213Glu + Ala216Glu + Tyr217Leu;
Gln206Glu
+ Lys213Glu + Ala216Glu + Tyr217Leu;
Ser204Glu + Gln206Glu
+ Ala216Glu + Tyr217Leu;
- – Fünffache
Mutation:
Ile205Leu + Pro210Ala + Lys213Glu + Ala216Glu + Tyr217Leu;
und
Ser204Glu
+ Gln206Glu + Lys213Glu + Ala216Glu + Tyr217Leu, dadurch gekennzeichnet,
dass die BPN'-Varianten
im Vergleich zu Wildtyp-Subtilisin-BPN' eine
verringerte Adsorption an und eine erhöhte Hydrolyse von einem unlöslichen
Substrat aufweisen. Die vorliegende Erfindung betrifft auch Reinigungszusammensetzungen,
ausgewählt
aus der Gruppe, bestehend aus einer Reinigungszusammensetzung für harte
Oberflächen, einer
Geschirrspülzusammensetzung,
einer Mundreinigungszusammensetzung, einer Zahnprothesenreinigungszusammensetzung
und einer Kontaktlinsenreinigungszusammensetzung, dadurch gekennzeichnet, dass
die Reinigungszusammensetzung die BPN'-Variante
und einen Träger
zur Hartoberflächenreinigung
umfasst.
-
BESCHREIBUNG
-
I. Subtilisinvarianten
-
Diese
Erfindung bezieht sich auf Subtilisinenzyme, insbesondere BPN', die durch Mutation
der verschiedenen Nucleotid-Sequenzen, die für das Enzym kodieren, modifiziert
wurden, wodurch die Aminosäure-Sequenz
des Enzyms modifiziert wird. Die modifizierten Subtilisinenzyme
(nachstehend „BPN'-Varianten") der vorliegenden Erfindung haben im
Vergleich zu dem Wildtyp- Subtilisin
eine verringerte Adsorption an und eine erhöhte Hydrolyse von einem unlöslichen
Substrat. Die vorliegende Erfindung bezieht sich auch auf die mutierten
Gene, die für
solche BPN'-Varianten
kodieren.
-
Die
Subtilisinenzyme dieser Erfindung gehören zu einer Klasse von Enzymen,
die als Proteasen bekannt sind. Eine Protease ist ein Katalysator
für die
Spaltung von Peptidbindungen. Eine Proteaseart ist eine Serinprotease.
Eine Serinprotease wird durch die Tatsache erkannt, dass an der
aktiven Stelle ein wesentlicher Serinrest vorhanden ist.
-
Die
Beobachtung, dass bei einem Enzym die Hydrolysegeschwindigkeit löslicher
Substrate mit der Enzymkonzentration zunimmt, ist hinlänglich dokumentiert.
Es würde
deshalb plausibel scheinen, dass für oberflächengebundene Substrate, wie
es bei vielen Reinigungsanwendungen anzutreffen ist, die Hydrolysegeschwindigkeit
mit steigender Oberflächenkonzentration
zunehmen würde.
Es wurde gezeigt, dass dies der Fall ist. (Brode, P.F. III und D.S.
Rauch, LANGMUIR, „Subtilisin
BPN': Activity on
an Immolbilized Substrate",
Bd. 8, S. 1325-1329 (1992)). Es hat sich für unlösliche Substrate tatsächlich eine
lineare Abhängigkeit
der Geschwindigkeit von der Oberflächenkonzentration herausgestellt,
wenn die Oberflächenkonzentration
des Enzyms variiert wurde. (Rubingh, D. N. und M. D. Bauer, „Catalysis
of Hydrolysis of Proteases at the Protein-Solution Interface", in POLYMER SOLUTION,
BLENDS AND INTERFACES, Hrsg. von I. Noda und D. N. Rubingh, Elsevier,
S. 464 (1992)). Bei dem Versuch, dieses Prinzip bei der Suche nach
Variantenproteasen, die eine bessere Reinigungsleistung bieten,
anzuwenden, haben wir überraschend
nicht herausgefunden, dass Enzyme, die mehr adsorbieren, eine bessere
Leistung bieten. In der Tat haben wir überraschend bestimmt, dass
das Gegenteil der Fall ist: verringerte Adsorption durch ein Enzym
an einem Substrat führte
zu erhöhter Hydrolyse
des Substrats (d. h. besserer Reinigungsleistung).
-
Ohne
an eine Theorie gebunden sein zu wollen, wird angenommen, dass verbesserte
Leistung, beim Vergleich einer Variante mit einer anderen, ein Ergebnis der
Tatsache ist, dass Enzyme, die weniger adsorbieren auch weniger
fest gebunden sind und auf der Oberfläche, von der das unlösliche Proteinsubstrat
entfernt werden soll, mobiler sind. Bei vergleichbaren Enzymlösungskonzentrationen
reicht diese gesteigerte Mobilität, um
jeglichen Vorteil, der durch die Lieferung einer höheren Enzymkonzentration
an die Oberfläche
bereitgestellt wird, aufzuheben.
-
Die
hierin beschriebenen Mutationen sind so gestaltet, dass sie die
Adsorption des Enzyms an oberflächengebundenen
Verschmutzungen ändern
(d. h. senken). In BPN' bilden
die Aminosäuren
von Position 200 bis Position 220 eine große Schleife auf dem Enzymmolekül. Es ist
entdeckt worden, dass diese Schleife eine erhebliche Rolle bei der
Adsorption des Enzymmoleküls
an einem oberflächengebundenen
Peptid spielt und spezifische Mutationen in dieser Schleife eine
erhebliche Auswirkung auf diese Adsorption haben. Ohne an eine Theorie
gebunden sein zu wollen, wird angenommen, dass diese Schleife aus
mindestens zwei Gründen
für die
Adsorption des BPN'-Moleküls bedeutsam
ist. Erstens können
die Aminosäuren,
die diese äußere Schleife
umfassen, engen Kontakt zu jeglichen Oberflächen, denen das Molekül ausgesetzt
ist, herstellen. Zweitens gibt die Nähe dieser Schleife zu der Aktivstellen-
und Bindungstasche des BPN'-Moleküls ihr Bedeutung
bei der katalytisch produktiven Adsorption des Enzyms an den oberflächengebundenen
Substraten (Peptiden/Proteinverschmutzungen).
-
Wie
hier verwendet, bedeutet „Variante" ein Enzym mit einer
Aminosäure-Sequenz, die von
der des Wildtyps abweicht.
-
Wie
hier verwendet, bedeutet „mutiertes
BPN'-Gen" ein Gen, das für eine BPN'-Variante kodiert.
-
Wie
hier verwendet, bezieht sich „Wildtyp-Subtilisin-BPN"' auf ein Subtilisinenzym, das durch
SEQ-ID NR.1 dargestellt wird. Die Aminosäure-Sequenz für Subtilitsin-BPN' wird von Wells,
J. A., E. Ferrari, D. J. Henner, D.A. Estell und E. Y. Chen, NUCLEIC
ACIDS RESEARCH, Bd. II, 7911-7925 (1983) weiter beschrieben.
-
Wie
hier verwendet, umfasst der Begriff „Wildtyp-Aminosäure-Sequenz" SEQ-ID NR.1 sowie SEQ-ID NR.1
mit anderen Modifikationen an der Aminosäure-Sequenz als denen an Positionen 199-220.
-
Wie
hier verwendet, bezieht sich „hydrophilere
Aminosäure" auf jegliche anderen
Aminosäuren
mit größerer Hydrophilie
als eine zugrunde liegende Aminosäure hinsichtlich der nachstehenden
Hydrophilietabelle. In der folgenden Hydrophilietabelle (Tabelle
1) sind Aminosäuren
in absteigender Reihenfolge zunehmender Hydrophilie aufgeführt (siehe
Hopp, T.P. und Woods, K.R., „Prediction
of Protein Antigenic Determinants from Amino Acid Sequences", PROCEEDINGS OF
THE NATIONAL ACADEMY OF SCIENCE USA, Bd. 78, S. 3824-3828, 1981,
OF durch Bezugnahme hierin eingeschlossen).
-
-
Tabelle
1 gibt auch an, welche Aminosäuren
eine Ladung tragen (wobei diese Eigenschaft auf einem pH von ungefähr 8-9 beruht).
Die positiv geladenen Aminosäuren
sind Arg und Lys, die negativ geladenen Aminosäuren sind Glu und Asp, und
die restlichen Aminosäuren
sind neutral. In einer bevorzugten Ausführungsform der vorliegenden
Erfindung ist die substituierende Aminosäure entweder neutral oder negativ
geladen, mehr bevorzugt negativ geladen (d. h. Glu oder Asp).
-
A. Herstellung von Enzymvarianten
-
Beispiel 1
-
Mutierte BPN'-Gene
-
Ein
Phagemid (pSS-5), das das Wildtyp-Subtilisin-BPN'-Gen enthält (Mitchinson, C. und J. A.
Wells, (1989), „Protein
Engineering of Disulfide Bonds in Subtilisin BPN', BIOCHEMISTRY, Bd. 28, S. 4807-4815), wird
zu Escherichia-coli-ung-Stamm CJ236 transformiert, und eine einsträngige uracilhaltige
DNA-Matrize wird mit dem VCSM13-Hilfsphagen produziert (Kunkel,
T.A., J.D. Roberts und R.A. Zakour, „Rapid and efficient site-specific
mutagenesis without phenotypic selection", METHODS IN ENZYMOLOGY, Bd. 154, S.
367-382, (1987); wie modifiziert durch Yuckenberg, P.D., F. Witney,
J. Geisselsoder und J. McClary, „Site-directed in vitro mutagenesis
using uracilcontaining DNA and phagemid vectors" DIRECTED MUTAGENESIS – A PRACTICAL APPROACH,
Hrsg. M.J. McPherson, S. 27-48, (1991). Eine Abwandlung der ortsgerichteten
Mutagenese mit einem einzigen Primer des Verfahrens von Zoller und
Smith (Zoller, M.J. und M. Smith, „Oligonucleotide-directed
mutagenesis using M13-derived vectors: an efficient and general
procedure for the production of point mutations in any fragment
of DNA", NUCLEIC
ACIDS RESEARCH, Bd. 10, S. 6487-6500 (1982)) wird verwendet, um
alle Mutanten zu produzieren (grundlegend wie von Yuckenberg et
al., 1991, vorstehend, dar gestellt). Oligonucleotide werden mit
einem DNA-Synthesizer 380B von Applied Biosystem Inc. hergestellt.
Mutagenese-Reaktionsprodukte werden zu Escherichia-coli-Stamm MM294
transformiert (American Type Culture Collection E. Coli. 33625).
Alle Mutanten werden durch DNA-Sequenzierung bestätigt, und
die isolierte DNA wird zu dem Bacillus-subtilis-Expressionsstamm
BG2036 transformiert (Yang, M. Y., E. Ferrari und D. J. Henner, (1984), „Cloning
of the Neutral Protease Gene of Bacillus subtillis and the Use of
the Cloned Gene to Create an In Vitro-derived Deletion Mutation", JOURNAL OF BACTERIOLOGY,
Bd. 160, S. 15-21). Für
einige der Mutanten wird ein modifiziertes pSS-5 mit einer Frameshift-Stop-Codonmutation
bei Aminosäure
217 verwendet, um die Uracil-Matrize zu produzieren. Oligonucleotide
sind so beschaffen, dass sie das richtige Leseraster an Position
217 wiederherstellen, und auch für
statistische Substitutionen an Positionen 199, 200, 201, 202, 203, 204,
205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217,
218, 219 und 220 kodiert (äquimolare und/oder
variable Mischungen aller vier Nucleotide für alle drei Basen an diesen
Codonen). Mutationen, die für den
Frameshift-Stop korrigieren und ein funktionelles Enzym produzieren,
werden anhand ihrer Fähigkeit,
Casein zu digerieren, erkannt. Die statistischen Substitutionen
werden durch DNA-Sequenzierung bestimmt.
-
Beispiel 2
-
Gärung
-
Die
Bacillus-subtilis-Zellen (BE2036), die einen betreffenden Subtilisinmutanten
enthalten, werden auf mittlere logarithmische Wachstumsphase in
einem Liter LB-Glucose-Kulturlösung
gezüchtet
und in einen Biostat-ED-Fermenter (B. Braun Biotech, Inc., Allentown,
Pennsylvania, USA) in einem Gesamtvolumen von 10 Litern eingeimpft.
Das Gärungsmittel
enthält
Hefeextrakt, Stärke,
Schaumunterdrücker,
Puffer und Spurenmineralien (siehe FERMENTATION: A PRACTICAL APPROACH,
Hrsg. B. McNeil und L M. Harvey, 1990). Die Kulturlösung wird
während
des Gärungsvorgangs
bei einem konstanten pH von 7,0 gehalten. Chloramphenical wird für antibiotische
Auswahl von mutagenisiertem Plasmid zugegeben. Die Zellen werden über Nacht
bei 37°C
auf einen A600 von ungefähr 60 gezüchtet und geerntet.
-
Beispiel 3
-
Reinigung
-
Die
Gärlösung wird
durch die folgenden Schritte entnommen, um reines Enzym zu erhalten.
Die Lösung
wird durch Zentrifugierung von Bacillus-subtilis-Zellen befreit
und durch Entfernen feiner Teilchen mit einer 100K-Abspemnembran
geklärt.
Darauf folgen eine Konzentration auf einer 10K-Absperrmembran und Flussdialyse
zum Reduzieren der Ionenstärke
und Einstellen des pH auf 5,5 mit 0,025 M MES-Puffer (2-N-Morpholino)ethansulfonsäure). Das
Enzym wird weiter gereinigt, indem es entweder auf eine Kationenaustauschchromatographiesäule oder
eine Affinitätsadsorptionschromatographiesäule geladen
wird und mit einem NaCl- oder einem Propylenglycolgradienten aus
der Säule
eluiert wird (siehe Scopes, R. K., PROTEIN PURIFICATION PRINCIPLES
AND PRACTICE, Springer-Verlag,
New York (1984)).
-
Der
pNA-Ansatz (DelMar, E.G., C. Largman, J.W. Brodrick und M.C. Geokas,
ANAL. BIOCHEM., Bd. 99, S. 316-320, (1979)) wird verwendet, um die
Konzentration aktiven Enzyms für
Fraktionen, die während
der Gradientenelution gesammelt wurden, zu bestimmen. Dieser Ansatz
misst die Geschwindigkeit, mit der p-Nitroanilin freigesetzt wird,
wenn das Enzym das lösliche
synthetische Substrat, Succinyl-Alanin-Alanin-Prolin-Phenylalanin
p-Nitroanilid (sAAPF-pNA),
hydrolysiert. Die Geschwindigkeit der Produktion von gelber Farbe aus
der Hydrolysereaktion wird bei 410 nm auf einem Spektralphotometer
gemessen und ist proportional zur Konzentration aktiven Enzyms.
Außerdem
werden Extinktionsmessungen bei 280 nm verwendet, um die gesamte
Proteinkonzentration zu bestimmen. Das Verhältnis von aktivem Enzym zum
gesamten Protein ergibt die Enzymreinheit und wird verwendet, um
Fraktionen zu identifizieren, die für die Stammlösung zusammengefasst
werden.
-
Um
Autolyse des Enzyms während
der Lagerung zu vermeiden, wird ein gleiches Gewicht an Propylenglycol
zu den zusammengefassten Fraktionen, die aus der Chromatographiesäule erhalten
wurden, gegeben. Nach Vollendung des Reinigungsverfahrens wird die
Reinheit der Enzymstammlösung
mit SDS-PAGE (Natriumdodecylsulfatpolyacrylamidgelelektrophorese) überprüft, und
die absolute Enzymkonzentration wird mit einem Aktivstellentitrationsverfahren
mit Trypsininhibitor Typ II=T: Turkey Egg White, erworben von Sigma Chemical
Company (St. Louis, Missouri), bestimmt. Die gemessenen Konversionsfaktoren
zeigen, welche Änderungen,
die in dem Enzymmolekül
an den verschiedenen Positionen vorgenommen wurden, zu der Enzymvariante
führen,
die eine erhöhte
Aktivität
im Vergleich zum Wildtyp gegenüber
dem löslichen
Substrat pNA aufweist.
-
Bei
der Vorbereitung auf die Verwendung wird die Enzymstammlösung durch
eine Größenausschlusssäule Sephadex-G25
(Pharmacia, Piscataway, New Jersey, USA) eluiert, um das Propylenglycol
zu entfernen und den Puffer auszutauschen. Der MES-Puffer in der
Enzymstammlösung
wird durch 0,1 M Trispuffer (Tris(hydroxymethylaminomethan), der
0,01 M CaCl2 enthält, ersetzt, und der pH wird
mit HCl auf 8,6 eingestellt. Alle Versuche werden bei pH 8,6 in
Trispuffer, der auf 25°C
eingestellt ist, durchgeführt.
-
B. Charakterisiert von
Enzymvarianten
-
Beispiel 4
-
Modelloberflächenvorbereitung
-
Aminopropylglas
mit geordneten Poren (CPG), erworben von CPG Inc. (Fairfield, New
Jersey, USA) wird als Trägermedium
für kovalentes
Anbringen des sAAPFpNA-Substrats, erworben von Bachem, Inc. (Torrence,
California, USA) verwendet.
-
Die
Reaktion wird in Dimethylsulfoxid durchgeführt, und (1-Ethyl-3-[3-(dimethylamino)propyl]carbodiimidhydrochlorid)
(EDC) wird als Haftverbesserer verwendet. Nach Vollendung (überwacht
mit dem pNA-Ansatz) wird das überschüssige Lösungsmittel
entfernt, und das CPG:sAAPF-pNA wird mit Dimethylsulfoxid (DMSO)
und zweifach destilliertem Wasser gespült. Darauf folgt eine Ofentrocknung
mit einer N2-Spülung bei etwa 70°C. Das Reaktionsschema
und die Herstellung des immobilisierten Substrats werden durchgeführt, wie
von Brode, P.F. III und D.S. Rauch, „Subtilisin BPN': Activity on an
Immobilized Substrate",
LANGMUIR, Bd. 8, S. 1325-1329, (1992) beschrieben.
-
Die
CPG-Oberfläche
besitzt 62.000 ± 7.000
pNA-Moleküle/μm2. Der Oberflächenbereich bleibt unverändert von
dem Wert von 50,0 m2/g, der von CPG Inc.
für CPG,
wie bei Erhalt, dokumentiert ist. Dies lässt darauf schließen, dass
das zum Zugeben von sAAPF-pNA zu CPG verwendete Verfahren die poröse Struktur nicht
schädigt
(mittlerer Durchmesser ist 486 A).
-
Beispiel 5
-
Oberflächenhydrolyseansatz
-
Mithilfe
von CPG:sAAPF-pNA können
Adsorption einer Enzymvariante und Hydrolyse eines CPG-gebundenen
Peptids in einem einzigen Versuch gemessen werden. Ein kleines Volumen
an Stammlösung
der Enzymvariante wird in einen Kolben gegeben, der Trispuffer und
CPG:aAAPF-pNA, das entgast wurde, enthält. Der Kolben wird auf einer
Handschüttelmaschine
für eine
Zeitspanne von 90 Minuten geschüttelt,
während
der die Schüttelmaschine
bei verschiedenen Zeitintervallen (zum Beispiel alle 2 Minuten während der
Anfangsstufen der Adsorptionshydrolyse – z. B. der ersten 20 Minuten – und alle
10 Minuten gegen Ende des Versuchs) geschüttelt wird. Das CPG:sAAPF-pNA
wird absetzen gelassen, und es werden Proben der Lösung genommen.
Sowohl der Versuchsablauf als auch die Berechnung der Adsorption
und der Hydrolyse werden durchgeführt, wie von Brode et al.,
1992, vorstehend, beschrieben.
-
Alle
Enzyme werden auf Beständigkeit
gegen Autolyse überwacht
und sollten über
den Zeitverlauf des Versuchs keinen nennenswerten autolytischen
Verlust zeigen. Deshalb kann die Enzymadsorption durch Messung der
Verarmung der Lösung
bestimmt werden. Der Unterschied zwischen der Anfangskonzentration
der Enzymvariante und der Konzentration, die bei jedem einzelnen
Zeitpunkt gemessen wird, ergibt die Menge an adsorbierter Enzymvariante.
Die Menge von pNA, das von der Oberfläche hydrolysiert wurde, wird
durch Ablesen eines Extinktionswertes auf einer Aliquote der Probe
bei 410 nm gemessen. Die Gesamtmenge an hydrolysiertem pNA wird
durch Addieren der der als Probe genommenen Menge und der im Kolben
verbliebenen Menge berechnet. Dieser Wert wird durch Subtrahieren
der Menge an pNA, die von Trispuffer bei pH 8,6 hydrolysiert wird,
wenn kein Enzym vorhanden ist, korrigiert. Diese Basenhydrolyse
reicht von 7-29% der gesamten Hydrolyse, je nach der Wirksamkeit
des Enzyms.
-
Beispiel 6
-
Kinetische Analyse löslichen
Substrats
-
Die
Geschwindigkeiten der Hydrolyse des löslichen Substrats sAAPF-pNA
werden überwacht,
indem die Zunahme des Adsorptionsvermögens als Funktion der Zeit
bei 410 nm mit einem DU-70-Spektralphotometer gemessen wird. Die
Enzymkonzentration wird konstant gehalten und im Bereich von 6-10
Nanomol hergestellt, während
die Substratkonzentration von 90-700 μM sAAPF-pNA für jede kinetische
Bestimmung variiert wird. Ein Datenpunkt des Adsorptionsvermögens wird über einen
Zeitraum von 900 Sekunden jede Sekunde genommen, und die Daten werden
in eine LOTUSTM-Tabelle (Lotus Development
Corporation, Cambridge, Massachusetts, USA) übertragen. Die Analyse für kinetische
Parameter wird mit der Standardanalyse von Lineweaver Burk durchgeführt, bei
der die Daten im ersten Teil des Durchgangs (generell der ersten
Minute) in eine lineare Regressionskurve zu vo eingepasst
werden.
-
Die
vo- und so-Daten
werden in der standardgemäßen umgekehrten
Weise aufgezeichnet, um KM und kcat zu ergeben.
-
C. Beispiel für BPN'-Varianten
-
BPN'-Varianten der vorliegenden
Erfindung, die verrigerte Adsorption an und erhöhte Hydrolyse von oberflächengebundenen
Substraten aufweisen, sind in Tabelle 2, nachstehend, erläutert. Bei
der Beschreibung der spezifischen Mutationen wird die ursprüngliche
Aminosäure,
die im Wildtyp auftritt, zuerst angegeben, die Positionsnummer als
Zweites und die substituierte Aminosäure als Drittes.
-
-
-
II. Reinigungszusammensetzungen
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung wird eine wirksame Menge einer oder mehrere
Enzymvarianten der vorliegenden Erfindung in Zusammensetzungen einbezogen,
die zur Reinigung einer Reihe von Oberflächen, die Entfernung proteinhaltiger
Flecken benötigen,
geeignet sind. Zu solchen Reinigungszusammensetzungen gehören Reinigungsmittelzusammensetzungen
zur Reinigung harter Oberflächen,
die in der Form nicht begrenzt sind (z. B. flüssig und granulös); Waschmittelzusammensetzung
zur Reinigung von Stoffen, die in der Form nicht begrenzt sind (z.
B. granulös,
flüssig
und stückförmige Formulierungen);
Geschirrspülzusammensetzungen
(die in der Form nicht begrenzt sind); Mundreinigungszusammensetzungen,
die in der Form nicht begrenzt sind (z. B. Zahncreme-, Zahnpasta-
und Mundspülungsformulierungen);
Zusammensetzungen zur Zahnprothesenreinigung, die in der Form nicht
begrenzt sind (z. B. flüssig,
tablettenförmig);
und Kontaktlinsenreinigungszusammensetzungen, die in der Form nicht
begrenzt sind (z. B. flüssig,
tablettenförmig).
Wie hier verwendet, bezieht sich „wirksame Menge an Enzymvariante" auf die Menge an
Enzymvariante, die erforderlich ist, um die in der speziellen Reinigungszusammensetzung
erforderliche Enzymaktivität
zu erreichen. Solche wirksamen Mengen werden von einem Fachmann
ohne weiteres ermittelt und beruhen auf vielen Faktoren, wie der
speziellen verwendeten Enzymvariante, der Reinigungsanwendung, der
speziellen Zusammensetzung der Reinigungszusammensetzung und davon,
ob eine flüssige
oder trockene (z. B. granulöse,
stückförmige) Zusammensetzung
benötigt
wird, und dergleichen. Vorzugsweise umfassen die Reinigungszusammensetzungen
der vorliegenden Erfindung von ungefähr 0,0001% bis ungefähr 10% eine oder
mehrere Enzymvarianten der vorliegenden Erfindung, mehr bevorzugt
von ungefähr
0,001% bis ungefähr 1%,
noch mehr bevorzugt von ungefähr
0,01% bis ungefähr
0,1%. Mehrere Beispiele für
verschiedene Reinigungszusammensetzungen, worin die Enzymvarianten
der vorliegenden Erfindung eingesetzt werden können, sind nachstehend ausführlicher
erläutert.
Alle hierin verwendeten Anteile, Prozentangaben und Verhältnisse sind
gewichtsbezogen, sofern nicht anders angegeben.
-
Wie
hier verwendet, schließen „Reinigungszusammensetzungen
für andere
Oberflächen
als Stoffe" Reinigungszusammensetzungen
für harte
Oberflächen,
Geschirrspülzusammensetzungen,
Mundreinigungszusammensetzungen, Zusammensetzungen zur Zahnprothesenreinigung
und Kontaktlinsenreinigungszusammensetzungen ein.
-
A. Reinigungszusammensetzungen
für harte
Oberflächen,
Geschirr und Stoffe
-
Die
Enzyme der vorliegenden Erfindung können in jeder Reinigungsmittelzusammensetzung
verwendet werden, wo hohe Schäumung
und gute Entfernung unlöslichen
Substrats gewünscht
sind. So können
die Enzymvarianten der vorliegenden Erfindung mit verschiedenen
herkömmlichen
Bestandteilen verwendet werden, um vollständig formulierte Reinigungsmittel
für harte
Oberflächen,
Ge schirrspülzusammensetzungen, Stoffwaschzusammensetzungen
und dergleichen bereitzustellen. Solche Zusammensetzungen können in
der Form von Flüssigkeiten,
Granalien, Stückformen
und dergleichen sein. Solche Zusammensetzungen können als moderne „konzentrierte" Reinigungsmittel,
die immerhin zu 30 Gew.-% – 60
Gew.-% Tenside enthalten, formuliert sein.
-
Die
Reinigungszusammensetzungen hierin können wahlweise, und vorzugsweise,
verschiedene anionische, nichtionische, zwitterionische usw. Tenside
enthalten. Solche Tenside sind in der Regel in Konzentrationen von
ungefähr
5% bis ungefähr
35% der Zusammensetzungen vorhanden.
-
Zu
nicht einschränkenden
Beispielen für
hierin geeignete Tenside gehören
die herkömmlichen C11-C18-Alkylbenzolsulfonate
und primären
und statistischen Alkylsulfate, die sekundären (2,3) C10-C18-Alkylsulfate der Formeln CH3(CH2)×(CHOSO3)-M+)CH3 und CH3(CH2)y(CHOSO3 -M+)CH2CH3, worin × und (y+1) ganze Zahlen von
mindestens ungefähr
7, vorzugsweise mindestens ungefähr
9 sind und M ein wasserlöslich machendes
Kation, besonders Natrium ist, die C10-C18-Alkylalkoxysulfate (besonders EO1-5-Ethoxysulfate), C10-C18-Alkylalkoxycarboxylate
(besonders die EO1-5-Ethoxycarboxylate), die C10-C18-Alkylpolyglycoside
und ihre entsprechenden sulfatierten Polyglycoside, alphasulfonierte
C12-C18-Fettsäureester,
C12-C18-Alkyl- und
-Alkylphenolalkoxylate (besonders Ethoxylate und gemischtes Ethoxy/Propoxy),
C12-C18-Betaine
und – Sulfobetaine
(„Sultaine"), C10-C18-Aminoxide und dergleichen. Die Alkylalkoxysulfate
(AES) und Alkylalkoxycarboxylate (AEC) sind hierin bevorzugt. (Die
Verwendung solcher Tenside in Kombination mit den vorstehend genannten
Aminoxid- und/oder Betain- oder Sultaintensiden ist ebenfalls bevorzugt,
je nach den Wünschen
des Herstellers.) Andere herkömmliche,
nützliche
Tenside sind in Standardtexten aufgeführt. Zu besonders geeigneten Tensiden
gehören
die C10-C18-N-Methylglucamide, die in US-Patent Nr.
5,194,639, Connor et al., erteilt am 16. März 1993, offenbart sind.
-
Eine
große
Vielfalt anderer Bestandteile, die in Reinigungsmittelzusammensetzungen
nützlich
sind, können
in die Zusammensetzungen hierin einbezogen werden, einschließlich anderer
aktiver Bestandteile, Träger,
hydrotroper Verbindungen, Verarbeitungshilfsmittel, Farbstoffe oder
Pigmente, Lösungsmittel
für flüssige Zubereitungen
usw. Wenn eine zusätzliche
Zunahme der Schäumung
gewünscht
wird, können
Schaumverstärker,
wie die C10-C16-Alkoholamide
in die Zusammensetzungen einbezogen werden, in der Regel in Konzentrationen
von ungefähr
1% bis ungefähr
10%. Die C10-C14-Monoethanol-
und -Diethanolamide veranschaulichen eine typische Klasse solcher
Schaumverstärker.
Die Benutzung solcher Schaumverstärker mit stark schäumenden
Zusätzen
und Tensiden, wie den oben genannten Aminoxiden, Betainen und Sultainen,
ist ebenfalls vorteilhaft. Falls gewünscht können lösliche Magnesiumsalze, wie
MgCl2, MgSO4 und
dergleichen, in Konzentrationen in der Regel von ungefähr 0,1%
bis ungefähr
2% zugegeben werden, um zusätzliche
Schäumung
bereitzustellen.
-
Die
flüssigen
Reinigungsmittelzusammensetzungen hierin können Wasser und andere Lösungsmittel als
Träger
enthalten. Niedermolekulare, primäre oder sekundäre Alkohole,
für die
Methanol, Ethanol, Propanol und Isopropanol Beispiele sind, sind
geeignet. Einwertige Alkohole werden für lösungsvermittelnde Tenside bevorzugt,
aber Polyole, wie solche, die etwa 2 bis etwa 6 Kohlenstoffatome
und etwa 2 bis etwa 6 Hydroxylgruppen (zum Beispiel 1,3-Propandiol,
Ethylenglycol, Glycerin und 1,2-Propandiol) aufweisen, können ebenfalls
benutzt werden. Die Zusammensetzungen können von ungefähr 5% bis
ungefähr
90%, in der Regel von ungefähr
10% bis ungefähr
50% solche Träger
enthalten.
-
Die
Reinigungsmittelzusammensetzungen hierin werden vorzugsweise so
formuliert, dass bei Verwendung in wässrigen Reinigungsvorgängen die
Waschflotte einen pH zwischen ungefähr 6,8 und ungefähr 11,0
aufweist. Fertige Produkte werden also in der Regel in diesem Bereich
formuliert. Verfahren zum Regulieren des pH bei empfohlenen Gebrauchskonzentrationen
schließen
die Verwendung von Puffern, Alkalien, Säuren usw. ein und sind Fachleuten
wohlbekannt.
-
Beim
Formulieren der Reinigungszusammensetzungen für harte Oberflächen und
Stoffreinigungszusammensetzungen der vorliegenden Erfindung möchte der
Hersteller eventuell verschiedene Builder in Konzentrationen von
ungefähr
5 Gew.-% bis ungefähr 50 Gew.-%
einsetzen. Zu typischen Buildern gehören die 1-10-Mikrometer-Zeolithe,
Polycarboxylate, wie Citrat und Oxydisuccinate, Schichtsilicate,
Phosphate und dergleichen. Andere herkömmliche Builder sind in standardgemäßen Formelbüchern aufgeführt.
-
Gleichfalls
möchte
der Hersteller eventuell verschiedene zusätzliche Enzyme, wie Cellulasen,
Lipasen, Amylasen und Proteasen in solchen Zusammensetzungen einsetzen,
in der Regel in Konzentrationen von ungefähr 0,001 Gew.-% bis ungefähr 1 Gew.-%.
Verschiedene Reinigungs- und Stoffpflegeenzyme sind in der Technik
der Wäschewaschmittel
gut bekannt.
-
Verschiedene
Bleichmittelverbindungen, wie die Percarbonate, Perborate und dergleichen,
können
in solchen Zusammensetzungen verwendet werden, in der Regel in Konzentrationen
von ungefähr
1 Gew.-% bis ungefähr
15 Gew.-%. Falls gewünscht,
können
solche Zusammensetzungen auch Bleichaktivatoren, wie Tetraacetylethylendiamin,
Nonanoyloxybenzolsulfonat und dergleichen, enthalten, die auch in
der Technik bekannt sind. Gebrauchskonzentrationen liegen in der
Regel im Bereich von ungefähr
1 Gew.-% bis ungefähr
10 Gew.-%.
-
Verschiedene
Schmutzabweisemittel, besonders die Art der anionischen Oligoester,
verschiedene Komplexbildner, besonders die Aminophosphonate und
Ethylendiamindisuccinate, verschiedene Lehmschmutzentfernungsmittel,
besonders ethoxyliertes Tetraethylenpentamin, verschiedene Dispergiermittel,
besonders Polyacrylate und Polyasparatate, verschiedene Aufheller,
besonders anionische Aufheller, verschiedene Schaumunterdrücker, besonders
Silikone und sekundäre
Alkohole, verschiedene Stoffweichmacher, besonders Smectit-Tonerde,
und der gleichen können
alle in solchen Zusammensetzungen in Konzentrationen im Bereich
von ungefähr
1 Gew.-% bis ungefähr
35 Gew.-% verwendet werden. Standardgemäße Formelbücher und veröffentlichte
Patente enthalten mehrfache ausführliche
Beschreibungen solcher herkömmlichen
Materialien.
-
Enzymstabilisatoren
können
in den Reinigungszusammensetzungen der vorliegenden Erfindung ebenfalls
verwendet werden. Zu solchen Enzymstabilisatoren gehören Propylenglycol
(vorzugsweise von ungefähr
1% bis ungefähr
10%), Natriumformiat (vorzugsweise von ungefähr 0,1% bis ungefähr 1%) und
Calciumformiat (vorzugsweise von ungefähr 0,1% bis ungefähr 1%).
-
1. Reinigungszusammensetzungen
für harte
Oberflächen
-
Wie
hier verwendet bezieht sich „Reinigungszusammensetzung
für harte
Oberflächen" auf flüssige und
granulöse
Reinigungsmittelzusammensetzungen zur Reinigung harter Oberflächen wie
Fußböden, Wände, Badezimmerfliesen
und dergleichen. Erfindungsgemäße Reinigungszusammensetzungen
für harte
Oberflächen
umfassen eine wirksame Menge einer oder mehrerer Enzymvarianten
der vorliegenden Erfindung, vorzugsweise von ungefähr 0,001
Gew.-% bis ungefähr
10 Gew.-%, mehr bevorzugt von ungefähr 0,01 Gew.-% bis ungefähr 5 Gew.-%,
noch mehr bevorzugt von ungefähr
0,05 Gew.-% bis ungefähr
1 Gew.-% der Zusammensetzung aktives Enzym. Zusätzlich dazu, dass sie eine
oder mehrere Enzymvarianten der vorliegenden Erfindung umfassen,
umfassen solche Reinigungszusammensetzungen für harte Oberflächen in
der Regel ein Tensid und einen wasserlöslichen maskierenden Builder.
In bestimmten Spezialprodukten, wie Scheibenreinigersprays, werden
die Tenside jedoch manchmal nicht verwendet, da sie einen film-/streifenartigen
Rückstand auf
der Glasoberfläche
erzeugen können.
-
Der
Tensidbestandteil, wenn vorhanden, kann eine so geringe Menge wie
0,1% der Zusammensetzungen hierin ausmachen, in der Regel enthalten
die Zusam mensetzungen jedoch von ungefähr 0,25% bis ungefähr 10%,
mehr bevorzugt von ungefähr
1% bis ungefähr
5% Tensid.
-
In
der Regel enthalten die Zusammensetzungen von ungefähr 0,5%
bis ungefähr
50% einen Reinigungsbuilder, vorzugsweise von ungefähr 1% bis
ungefähr
10%.
-
Vorzugsweise
sollte der pH im Bereich von ungefähr 8 bis 12 liegen. Herkömmliche
pH-Regler, wie Natriumhydroxid, Natriumcarbonat oder Salzsäure, können verwendet
werden, wenn eine Einstellung notwendig ist.
-
Es
können
Lösungsmittel
in die Zusammensetzungen einbezogen werden. Zu den Lösungsmitteln
gehören,
ohne jedoch darauf beschränkt
zu sein, Glycolether, wie Diethylenglycolmonohexylether, Diethylenglycolmonobutylether,
Ethylenglycolmonobutylether, Ethylenglycolmonohexylether, Propylenglycolmonobutylether,
Dipropylenglycolmonobutylether, und Diole, wie 2,2,4-Trimethyl-1,3-pentandiol
und 2-Ethyl-1,3-hexandiol. Wenn solche Lösungsmittel verwendet werden,
sind sie in der Regel in Konzentrationen von ungefähr 0,5% bis
ungefähr
15%, vorzugsweise von ungefähr
3% bis ungefähr
11% vorhanden.
-
Außerdem können stark
flüchtige
Lösungsmittel,
wie Isopropanol oder Ethanol, in den vorliegenden Zusammensetzungen
verwendet werden, um schnellere Verdampfung der Zusammensetzung
von Oberflächen
zu erleichtern, wenn die Oberfläche
nach „unverdünntem" Auftragen der Zusammensetzung
auf die Oberfläche
nicht abgespült
wird. Wenn flüchtige
Lösungsmittel
verwendet werden, sind sie in der Regel in Konzentrationen von ungefähr 2% bis
ungefähr
12% in den Zusammensetzungen vorhanden.
-
Die
Ausführungsform
der Reinigungszusammensetzung für
harte Oberflächen
der vorliegenden Erfindung wird durch die folgenden Beispiele veranschaulicht.
-
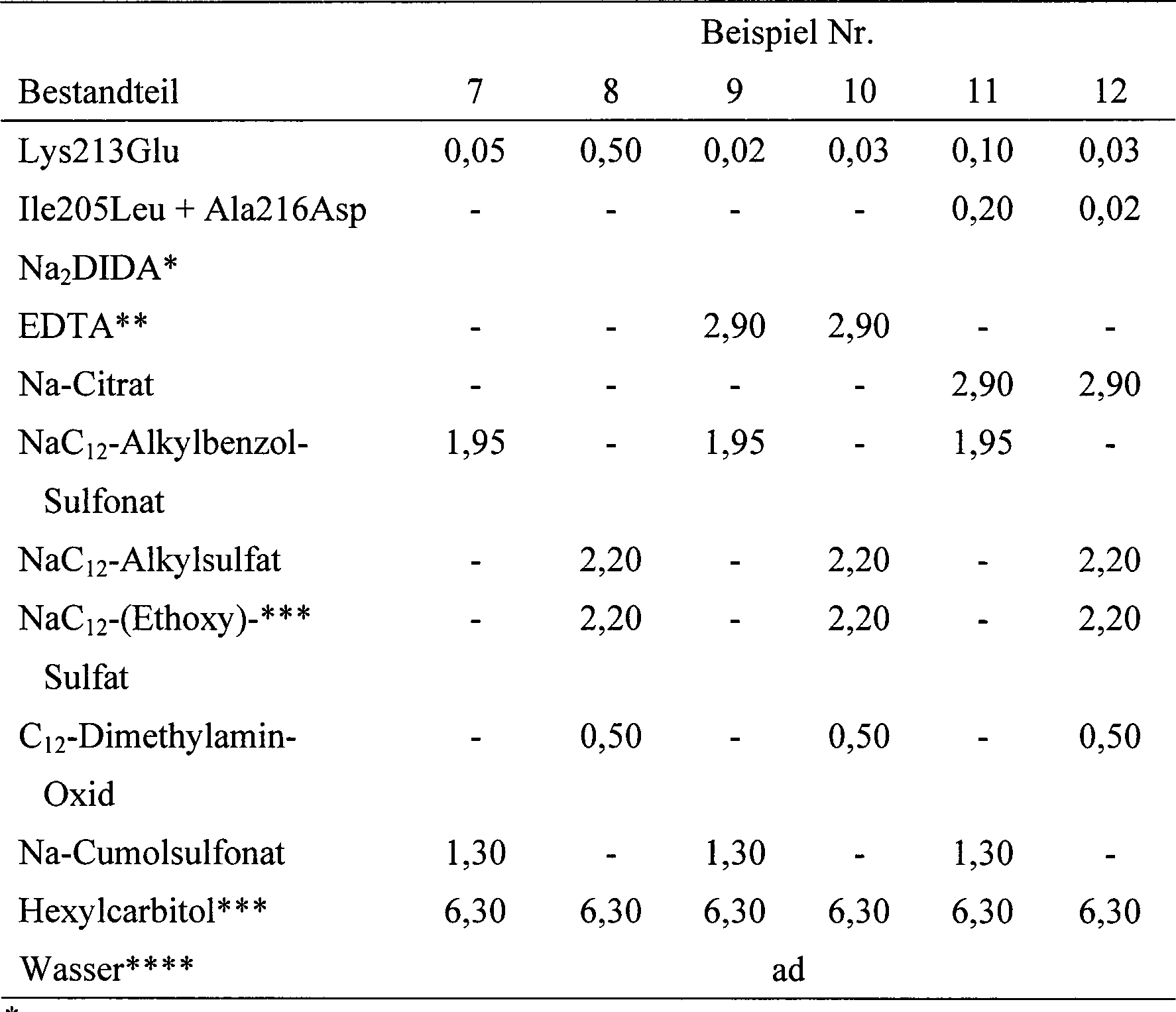
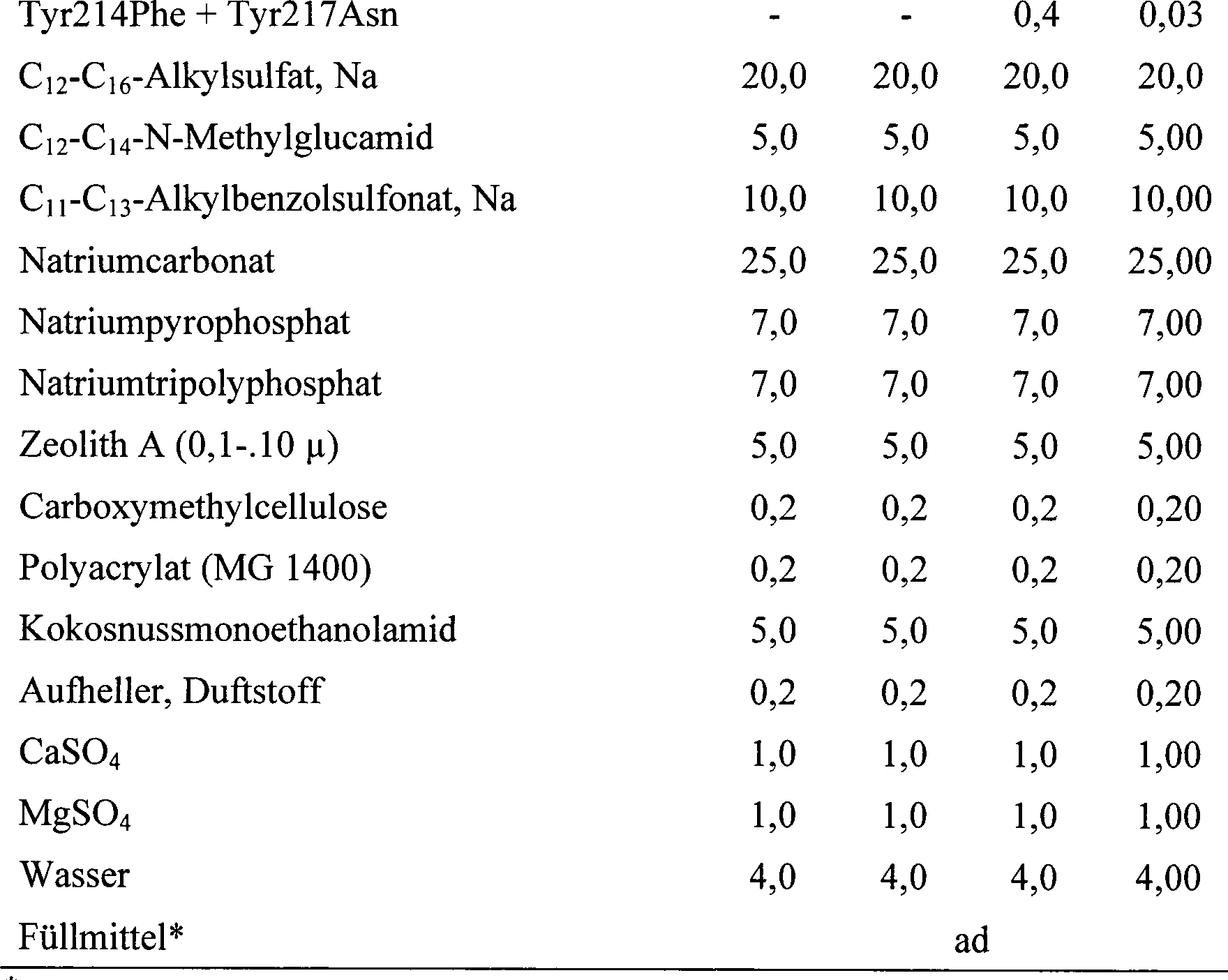
Beispiele
7-12 Flüssige Reinigungszusammensetzungen
für harte
Oberflächen
-
- * Dinatrium-N-diethylenglycol-N,N-iminodiacetat
- * * Na4-Ethylendiamindiessigsäure
- * * * Diethylenglycolmonohexylether
- * * * * Alle Formulierungen auf pH 7 eingestellt
-
In
Beispielen 7-10 wird Lys213Glu unter anderem durch die in Tabelle
2 genannten BPN'-Varianten substituiert,
mit im Wesentlichen ähnlichen
Ergebnissen.
-
In
Beispielen 11-12 werden Lys213Glu und Ile205Leu + Ala216Asp unter
anderem durch eine beliebige Kombination der in Tabelle 2 genannten
BPN'-Varianten substituiert,
mit im Wesentlichen ähnlichen
Ergebnissen.
Beispiele
13-18 Sprühzusammensetzungen
zur Reinigung harter Oberflächen
und Entfernung von Haushaltsschimmel
-
In
Beispielen 13-16 werden Lys213Glu + Tyr217Leu unter anderem durch
die in Tabelle 2 genannten BPN'-Varianten
substituiert, mit im Wesentlichen ähnlichen Ergebnissen.
-
In
Beispielen 17-18 werden Lys213Glu + Tyr217Leu und Ala216Glu unter
anderem durch eine beliebige Kombination der in Tabelle 2 genannten
BPN'-Varianten substituiert,
mit im Wesentlichen ähnlichen
Ergebnissen.
-
2. Geschirrspülzusammensetzungen
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung umfassen Geschirrspülzusammensetzungen eine oder
mehrere Enzymvarianten der vorliegenden Erfindung. Wie hier verwendet,
bezieht sich „Geschirrspülzusammensetzung" auf alle Formen
für Zusammensetzungen
zur Reinigung von Geschirr, einschließlich, jedoch nicht beschränkt auf
granulöse
und flüssige
Formen. Die Ausführungsform
der Geschirrspülzusammensetzung
der vorliegenden Erfindung wird durch die folgenden Beispiele veranschaulicht.
Beispiele
19-24 Geschirrspülzusammensetzung
- Produkt-pH wird auf 7 eingestellt.
-
In
Beispielen 19-22 werden Gln206Pro + Gly211Ala + Ala216Glu unter
anderem durch die in Tabelle 2 genannten BPN'-Varianten substituiert, mit im Wesentlichen ähnlichen
Ergebnissen.
-
In
Beispielen 23-24 werden Gln206Pro + Gly211Ala + Ala216Glu und Ile205Leu
+ Ala216Asp unter anderem durch eine beliebige Kombination der in
Tabelle 2 genannten BPN'-Varianten
substituiert, mit im Wesentlichen ähnlichen Ergebnissen.
-
3. Stoffreinigungszusammensetzungen
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung umfassen Stoffreinigungszusammensetzungen
eine oder mehrere Enzymvarianten der vorliegenden Erfindung. Wie
hier verwendet, bezieht sich „Stoffreinigungszusammensetzung" auf alle Formen
für Waschmittelzusammensetzung
zur Reinigung von Stoffen, einschließlich, jedoch nicht beschränkt auf
granulöse,
flüssige
Formen und Stückformen.
-
a. Granulöse Stoffreinigungszusammensetzungen
-
Die
granulösen
Stoffreinigungszusammensetzungen der vorliegenden Erfindung können eine
wirksame Menge einer oder mehrerer Enzymvarianten der vorliegenden
Erfindung enthalten, vorzugsweise von ungefähr 0,001 Gew.-% bis ungefähr 10 Gew.-%,
mehr bevorzugt von ungefähr
0,005 Gew.-% bis ungefähr
5 Gew.-%, mehr bevorzugt von ungefähr 0,01 Gew.-% bis ungefähr 1 Gew.-%
der Zusammensetzung aktives Enzym. Zusätzlich zu ein oder mehreren
Enzymvarianten umfassen die granulösen Stoffreinigungszusammensetzungen
in der Regel mindestens ein Tensid, einen oder mehrere Builder und,
in einigen Fällen,
ein Bleichmittel.
-
Die
Ausführungsform
der granulösen
Stoffreinigungszusammensetzung der vorliegenden Erfindung wird durch
die folgenden Beispiele veranschaulicht.
-
Beispiele
25-28 Granulöse
Textilreinigungszusammensetzung
-
-
In
Beispielen 25-26 wird Ala216Asp unter anderem durch die in Tabelle
2 genannten BPN'-Varianten substituiert,
mit im Wesentlichen ähnlichen
Ergebnissen.
-
In
Beispielen 27-28 werden Ala216Asp und Ala216Gly unter anderem durch
eine beliebige Kombination der in Tabelle 2 genannten BPN'-Varianten substituiert,
mit im Wesentlichen ähnlichen
Ergebnissen.
-
Beispiele
29-32 Granulöse Textilreinigungszusammensetzung
-
-
In
Beispielen 29-30 werden Lys213Glu + Ala216Glu + Tyr217Leu unter
anderem durch die in Tabelle 2 genannten BPN'-Varianten substituiert, mit im Wesentlichen ähnlichen
Ergebnissen.
-
In
Beispielen 31-32 werden Lys213Glu + Ala216Glu + Tyr217Leu und Ile205Val
+ Pro210Ala + Lys213Glu unter anderem durch eine beliebige Kombination
der in Tabelle 2 genannten BPN'-Varianten
substituiert, mit im Wesentlichen ähnlichen Ergebnissen.
-
b. Flüssige Stoffreinigungszusammensetzungen
-
Flüssige Stoffreinigungszusammensetzungen
der vorliegenden Erfindung umfassen eine wirksame Menge einer oder
mehrerer Enzymvarianten der vorliegenden Erfindung, vorzugsweise
von ungefähr
0,005 Gew.-% bis ungefähr
5 Gew.-%, mehr bevorzugt von ungefähr 0,01 Gew.-% bis ungefähr 1 Gew.-%
der Zusammensetzung aktives Enzym. Solche flüssigen Stoffreinigungszusammensetzungen
umfassen in der Regel zusätzlich
ein anionisches Tensid, eine Fettsäure, einen wasserlöslichen
Reinigungsbuilder und Wasser.
-
Die
Ausführungsform
der flüssigen
Stoffreinigungszusammensetzung der vorliegenden Erfindung wird durch
die folgenden Beispiele veranschaulicht.
-
Beispiele
33-37 Flüssige Textilreinigungszusammensetzungen
-
-
In
Beispielen 33-35 werden Pro210Ala + Gly215Thr unter anderem durch
die in Tabelle 2 genannten BPN'-Varianten
substituiert, mit im Wesentlichen ähnlichen Ergebnissen.
-
In
Beispielen 36-37 werden Pro210Ala + Gly215Thr und Pro210Ala + Lys213Glu
+ Ala216Glu + Tyr217Leu unter anderem durch eine beliebige Kombination
der in Tabelle 2 genannten BPN'-Varianten
substituiert, mit im Wesentlichen ähnlichen Ergebnissen.
-
c. Stückförmige Stoffreinigungszusammensetzungen
-
Stückförmige Stoffreinigungszusammensetzungen
der vorliegenden Erfindung, die zum Waschen verschmutzter Stoffe
von Hand geeignet sind, enthalten eine wirksame Menge einer oder
mehrerer Enzymvarianten der vorliegenden Erfindung, vorzugsweise
von ungefähr
0,001 Gew.-% bis ungefähr
10 Gew.-%, mehr bevorzugt von ungefähr 0,01 Gew.-% bis ungefähr 1 Gew.-%
der Zusammensetzung.
-
Die
Ausführungsform
der stückförmigen Stoffreinigungszusammensetzung
der vorliegenden Erfindung wird durch die folgenden Beispiele veranschaulicht.
Beispiele
38-41 Stückförmige Stoffreinigungszusammensetzungen
- *
Kann aus geeigneten Materialien wie CaCO3,
Talk, Ton, Silicaten und Ähnlichem
ausgewählt
werden.
-
In
Beispielen 38-39 werden Lys213Glu + Ala216Glu unter anderem durch
die in Tabelle 2 genannten BPN'-Varianten
substituiert, mit im Wesentlichen ähnlichen Ergebnissen.
-
In
Beispielen 40-41 werden Lys213Glu + Ala216Glu und Tyr214Phe + Tyr217Asn
unter anderem durch eine beliebige Kombination der in Tabelle 2
genannten BPN'-Varianten substituiert,
mit im Wesentlichen ähnlichen
Ergebnissen.
-
B. Zusätzliche Reinigungszusammensetzungen
-
Zusätzlich zu
den vorstehend erläuterten
Hartoberflächenreinigungs-,
Geschirrspül-
und Stoffreinigungszusammensetzungen können eine oder mehrere Enzymvarianten
der vorliegenden Erfindung in eine Reihe von anderen Reinigungs zusammensetzungen
einbezogen werden, wenn Hydrolyse eines unlöslichen Substrats gewünscht wird.
Zu solchen zusätzlichen
Reinigungszusammensetzungen gehören,
ohne jedoch darauf beschränkt
zu sein, Mundreinigungszusammensetzungen, Zusammensetzungen zur
Zahnprothesenreinigung und Kontaktlinsenreinigungszusammensetzungen.
-
1. Mundreinigungszusammensetzungen
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung wird eine pharmazeutisch unbedenkliche
Menge einer oder mehrerer Enzymvarianten der vorliegenden Erfindung
in Zusammensetzungen einbezogen, die zur Entfernung proteinhaltiger
Flecken von Zähnen
oder Zahnprothesen geeignet sind. Wie hier verwendet, bezieht sich „Mundreinigungszusammensetzungen" auf Zahncremes,
Zahnpasten, Zahngele, Zahnpulver, Mundspülungen, Mundsprays, Mundgele,
Kaugummis, Pastillen, Beutel, Tabletten, Biogele, Prophylaxepasten,
Zahnbehandlungslösungen
und dergleichen. Vorzugsweise umfassen Mundreinigungszusammensetzungen
der vorliegenden Erfindung von ungefähr 0,0001 Gew.-% bis ungefähr 20 Gew.-%
eine oder mehrere Enzymvarianten der vorliegenden Erfindung, mehr
bevorzugt von ungefähr
0,001 Gew.-% bis ungefähr
10 Gew.-%, noch
mehr bevorzugt von ungefähr
0,01 Gew.-% bis ungefähr
5 Gew.-% der Zusammensetzung, und einen pharmazeutisch unbedenklichen
Träger.
Wie hier verwendet, bedeutet "pharmazeutisch
unbedenklich", dass
verträgliche
Medikamente, Heilmittel oder inerte Inhaltsstoffe, die der Begriff
beschreibt, für
den Kontakt mit dem Gewebe von Menschen und niederen Tieren ohne übermäßige Toxizität, Unverträglichkeit,
Instabilität, Reizung,
Allergiereaktion und dergleichen geeignet sind und die ein angemessenes
Verhältnis
von Nutzen und Risiko aufweisen.
-
In
der Regel umfasst der pharmazeutisch unbedenkliche Mundreinigungsträgerbestandteil
des Mundreinigungsbestandteils der Mundreinigungszusammensetzungen
generell von ungefähr
50 Gew.-% bis ungefähr
99,99 Gew.-%, vorzugsweise von ungefähr 65 Gew.-% bis ungefähr 99,99
Gew.-%, mehr be vorzugt von ungefähr
65 Gew.-% bis ungefähr
99 Gew.-% der Zusammensetzung.
-
Die
pharmazeutisch unbedenklichen Trägerbestandteile
und fakultativen Bestandteile, die in die Mundreinigungszusammensetzungen
der vorliegenden Erfindung einbezogen werden können, sind Fachleuten gut bekannt.
Eine große
Vielfalt an Zusammensetzungsarten, Trägerbestandteilen und fakultativen
Bestandteilen, die in den Mundreinigungszusammensetzungen geeignet
sind, sind in US-Patent Nr. 5,096,700, Seibel, erteilt am 17. März 1992;
US-Patent Nr. 5,028,414, Sampathkumar, erteilt am 2. Juli 1991;
und US-Patent Nr. 5,028,415, Benedict, Bush und Sunberg, erteilt
am 2. Juli 1991, offenbart.
-
Die
Ausführungsform
der Mundreinigungszusammensetzung der vorliegenden Erfindung wird
durch die folgenden Beispiele veranschaulicht.
Beispiele
42-45 Zahncremezusammensetzung
- * PEG-6 = Polyethylenglycol
mit einem Molekulargewicht von 600.
- * * Ausgefälltes
Siliciumdioxid, gekennzeichnet als Zeodent 119, angeboten von J.M.
Huber.
- * * * Carbopol, angeboten von B.F. Goodrich Chemical Company.
- * * * * Iota-Carrageenan, angeboten von Hercules Chemical Company.
-
In
Beispielen 42-45 werden Ile205Leu + Pro210Ala + Lys213Glu + Ala216Glu
+ Tyr217Leu unter anderem durch die in Tabelle 2 genannten BPN'-Varianten substituiert,
mit im Wesentlichen ähnlichen
Ergebnissen.
Beispiele
46-49 Mundspülungszusammensetzung
-
In
Beispielen 46-49 wird Ala216Gly unter anderem durch die in Tabelle
2 genannten BPN'-Varianten substituiert,
mit im Wesentlichen ähnlichen
Ergebnissen.
-
Beispiele
50-53 Pastillenzusammensetzung
-
In
Beispielen 50-53 werden Tyr214Phe + Tyr217Asn unter anderem durch
die in Tabelle 2 genannten BPN'-Varianten
substituiert, mit im Wesentlichen ähnlichen Ergebnissen.
Beispiele
54-57 Kaugummizusammensetzung
- * Geliefert von L.A. Dreyfus Company.
-
In
Beispielen 54-57 werden Ile205Val + Pro210Ala + Lys213Glu unter
anderem durch die in Tabelle 2 genannten BPN'-Varianten substituiert, mit im Wesentlichen ähnlichen
Ergebnissen.
-
2. Zusammensetzungen zur
Zahnprothesenreinigung
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung umfassen Zusammensetzungen zur Zahnprothesenreinigung
zur Reinigung von Zahnprothesen außerhalb der Mundhöhle eine
oder mehrere Enzymvarianten der vorliegenden Erfindung. Solche Zusammensetzungen
zur Zahnprothesenreinigung umfassen eine wirksame Menge einer oder
mehrerer Enzymvarianten der vorliegenden Erfindung, vorzugsweise
von ungefähr
0,0001 Gew.-% bis ungefähr
50 Gew.-% an einer oder mehreren Enzymvarianten der vorliegenden Erfindung,
mehr bevorzugt von ungefähr
0,001 Gew.-% bis ungefähr
35 Gew.-%, noch mehr bevorzugt von ungefähr 0,01 Gew.-% bis ungefähr 20 Gew.-%
der Zusammensetzung, und einen Zahnprothesenreinigungsträger. Verschiedene
Zahnprothesenreinigungszusammensetzungsformate, wie Sprudeltabletten
und dergleichen, sind in der Technik gut bekannt (siehe zum Beispiel
US-Patent Nr. 5,055,305, Young) und sind zur Beimischung einer oder
mehrerer Enzymvarianten der vorliegenden Erfindung zur Entfernung
proteinhaltiger Flecken von Zahnprothesen generell geeignet.
-
Die
Ausführungsform
der Zahnprothesenreinigungszusammensetzung der vorliegenden Erfindung wird
durch das folgende Beispiel veranschaulicht.
Beispiele
58-61 Zweischichtige
sprudelnde Zahnprothesenreinigungstablette
- *
Tetraacetylethylendiamin
-
In
Beispielen 58-61 wird Ala216Glu unter anderem durch die in Tabelle
2 genannten BPN'-Varianten substituiert,
mit im Wesentlichen ähnlichen
Ergebnissen.
-
3. Kontaktlinsenreinigungszusammensetzungen
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung umfassen Kontaktlinsenreinigungszusammensetzungen
eine oder mehrere Enzymvarianten der vorliegenden Erfindung. Solche
Kontaktlinsenreinigungszusammensetzungen umfassen eine wirksame
Menge einer oder mehrerer Enzymvarianten der vorlie genden Erfindung,
vorzugsweise von ungefähr
0,01 Gew.-% bis ungefähr
50 Gew.-% an einer oder mehreren Enzymvarianten der vorliegenden
Erfindung, mehr bevorzugt von ungefähr 0,01 Gew.-% bis ungefähr 20 Gew.-%,
noch mehr bevorzugt von ungefähr
1 Gew.-% bis ungefähr
5 Gew.-% der Zusammensetzung, und einen Kontaktlinsenreinigungsträger. Verschiedene
Kontaktlinsenreinigungszusammensetzungsformate, wie Tabletten, Flüssigkeiten
und dergleichen, sind in der Technik gut bekannt (siehe zum Beispiel
US-Patent Nr. 4,863,627, Davies, Meaken und Rees, erteilt am 5.
September 1989; US-Patent Re.-Nr. 32,672, Huth, Lam und Kirai, erneut
erteilt am 24. Mai 1988; US-Patent Nr. 4,609,493, Schafer, erteilt
am 2. September 1986; US-Patent Nr. 4,690,793, Ogunbiyi und Smith,
erteilt am 1. September 1987; US-Patent Nr. 4,614,549, Ogunbiyi,
Riedhammer und Smith, erteilt am 30. September 1986; und US-Patent Nr. 4,285,738,
Ogata, erteilt am 25. August 1981) und sind zur Beimischung einer
oder mehrerer Enzymvarianten der vorliegenden Erfindung zum Entfernen
proteinhaltiger Flecken von Kontaktlinsen generell geeignet.
-
Die
Ausführungsform
der Kontaktlinsenreinigungszusammensetzung der vorliegenden Erfindung
wird durch die folgenden Beispiele veranschaulicht.
-
Beispiele
62-65 Enzymatische
Kontaktlinsenreinigungslösung
-
-
In
Beispielen 62-65 werden Ile205Leu + Ala216Asp unter anderem durch
die in Tabelle 2 genannten BPN'-Varianten
substituiert, mit im Wesentlichen ähnlichen Ergebnissen.
-
-
-
-