DE10304374A1 - Neue substituierte 2-Aminoimidazole, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament - Google Patents
Neue substituierte 2-Aminoimidazole, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament Download PDFInfo
- Publication number
- DE10304374A1 DE10304374A1 DE10304374A DE10304374A DE10304374A1 DE 10304374 A1 DE10304374 A1 DE 10304374A1 DE 10304374 A DE10304374 A DE 10304374A DE 10304374 A DE10304374 A DE 10304374A DE 10304374 A1 DE10304374 A1 DE 10304374A1
- Authority
- DE
- Germany
- Prior art keywords
- alkyl
- independently
- medicament
- atoms
- substituted
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 239000003814 drug Substances 0.000 title claims description 56
- 238000000034 method Methods 0.000 title claims description 11
- 238000002360 preparation method Methods 0.000 title claims description 8
- 230000008569 process Effects 0.000 title claims description 3
- DEPDDPLQZYCHOH-UHFFFAOYSA-N 1h-imidazol-2-amine Chemical class NC1=NC=CN1 DEPDDPLQZYCHOH-UHFFFAOYSA-N 0.000 title description 2
- 229940039227 diagnostic agent Drugs 0.000 title description 2
- 239000000032 diagnostic agent Substances 0.000 title description 2
- 150000001875 compounds Chemical class 0.000 claims abstract description 94
- 238000011282 treatment Methods 0.000 claims abstract description 52
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 45
- 201000010099 disease Diseases 0.000 claims abstract description 32
- 230000002265 prevention Effects 0.000 claims abstract description 16
- 208000035475 disorder Diseases 0.000 claims abstract description 13
- 230000001154 acute effect Effects 0.000 claims abstract description 9
- 208000023504 respiratory system disease Diseases 0.000 claims abstract description 9
- 208000020832 chronic kidney disease Diseases 0.000 claims abstract description 8
- 206010041235 Snoring Diseases 0.000 claims abstract description 6
- 201000002859 sleep apnea Diseases 0.000 claims abstract description 6
- 208000009304 Acute Kidney Injury Diseases 0.000 claims abstract description 5
- 208000033626 Renal failure acute Diseases 0.000 claims abstract description 5
- 201000011040 acute kidney failure Diseases 0.000 claims abstract description 5
- 210000000941 bile Anatomy 0.000 claims abstract description 5
- 208000022831 chronic renal failure syndrome Diseases 0.000 claims abstract description 5
- -1 (2,6-dichlorophenyl) - (4,5,6,7-tetrahydro-1 H-benzoimidazol-2-yl) -amine hydrochloride (2,6-dichlorophenyl) methyl (4,5,6,7-tetrahydro-1 H-benzoimidazol-2-yl) -amine hydrochloride Compounds Chemical class 0.000 claims description 76
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 60
- 150000003839 salts Chemical class 0.000 claims description 45
- 229910052739 hydrogen Inorganic materials 0.000 claims description 43
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 42
- 125000001153 fluoro group Chemical group F* 0.000 claims description 37
- 238000004519 manufacturing process Methods 0.000 claims description 34
- 239000003112 inhibitor Substances 0.000 claims description 33
- 239000001257 hydrogen Substances 0.000 claims description 25
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 24
- 238000011321 prophylaxis Methods 0.000 claims description 21
- 229910052794 bromium Inorganic materials 0.000 claims description 20
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical class OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 claims description 19
- 229910052801 chlorine Inorganic materials 0.000 claims description 18
- 229910052731 fluorine Inorganic materials 0.000 claims description 18
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 claims description 17
- 229940079593 drug Drugs 0.000 claims description 13
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 13
- 229910052740 iodine Inorganic materials 0.000 claims description 12
- 125000004432 carbon atom Chemical group C* 0.000 claims description 11
- 210000003169 central nervous system Anatomy 0.000 claims description 9
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 9
- 210000000056 organ Anatomy 0.000 claims description 9
- 125000006555 (C3-C5) cycloalkyl group Chemical group 0.000 claims description 8
- 201000001320 Atherosclerosis Diseases 0.000 claims description 8
- 206010012601 diabetes mellitus Diseases 0.000 claims description 8
- 230000000302 ischemic effect Effects 0.000 claims description 7
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 6
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 claims description 6
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 6
- 230000000694 effects Effects 0.000 claims description 6
- 208000028867 ischemia Diseases 0.000 claims description 6
- 230000002093 peripheral effect Effects 0.000 claims description 6
- 230000000241 respiratory effect Effects 0.000 claims description 6
- 206010020772 Hypertension Diseases 0.000 claims description 5
- 230000006378 damage Effects 0.000 claims description 5
- 230000010410 reperfusion Effects 0.000 claims description 5
- 230000035939 shock Effects 0.000 claims description 5
- 230000001960 triggered effect Effects 0.000 claims description 5
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 4
- 208000030090 Acute Disease Diseases 0.000 claims description 4
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims description 4
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 4
- 206010048554 Endothelial dysfunction Diseases 0.000 claims description 4
- 208000007530 Essential hypertension Diseases 0.000 claims description 4
- 208000007536 Thrombosis Diseases 0.000 claims description 4
- 208000012998 acute renal failure Diseases 0.000 claims description 4
- 230000004663 cell proliferation Effects 0.000 claims description 4
- 230000008694 endothelial dysfunction Effects 0.000 claims description 4
- 230000036541 health Effects 0.000 claims description 4
- 230000002829 reductive effect Effects 0.000 claims description 4
- 206010001497 Agitation Diseases 0.000 claims description 3
- 208000019901 Anxiety disease Diseases 0.000 claims description 3
- 206010061217 Infestation Diseases 0.000 claims description 3
- 208000028017 Psychotic disease Diseases 0.000 claims description 3
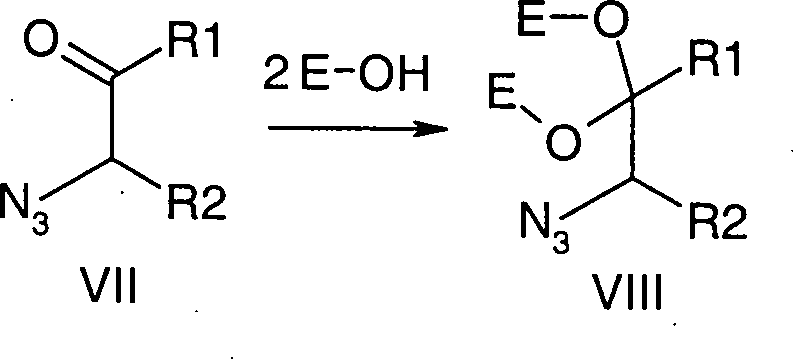
- 238000006359 acetalization reaction Methods 0.000 claims description 3
- 150000001298 alcohols Chemical class 0.000 claims description 3
- 244000078703 ectoparasite Species 0.000 claims description 3
- 230000006870 function Effects 0.000 claims description 3
- 238000005907 ketalization reaction Methods 0.000 claims description 3
- 238000003860 storage Methods 0.000 claims description 3
- 125000004399 C1-C4 alkenyl group Chemical group 0.000 claims description 2
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 claims description 2
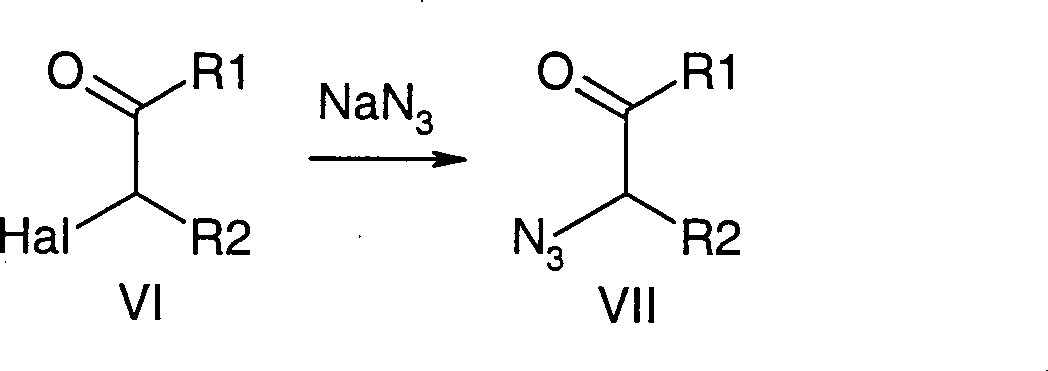
- 150000001540 azides Chemical class 0.000 claims description 2
- 125000004122 cyclic group Chemical group 0.000 claims description 2
- 238000012423 maintenance Methods 0.000 claims description 2
- 229920006395 saturated elastomer Polymers 0.000 claims description 2
- 238000001356 surgical procedure Methods 0.000 claims description 2
- 206010010904 Convulsion Diseases 0.000 claims 2
- 230000009692 acute damage Effects 0.000 claims 2
- 230000036506 anxiety Effects 0.000 claims 2
- 230000009693 chronic damage Effects 0.000 claims 2
- 230000036461 convulsion Effects 0.000 claims 2
- 206010015037 epilepsy Diseases 0.000 claims 2
- 125000002485 formyl group Chemical class [H]C(*)=O 0.000 claims 2
- 230000003871 intestinal function Effects 0.000 claims 2
- 201000004792 malaria Diseases 0.000 claims 2
- 210000001428 peripheral nervous system Anatomy 0.000 claims 2
- 238000004321 preservation Methods 0.000 claims 2
- 125000002777 acetyl group Chemical class [H]C([H])([H])C(*)=O 0.000 claims 1
- 239000013543 active substance Substances 0.000 claims 1
- 125000003282 alkyl amino group Chemical group 0.000 claims 1
- 125000004429 atom Chemical group 0.000 claims 1
- 125000004663 dialkyl amino group Chemical group 0.000 claims 1
- 229910052736 halogen Inorganic materials 0.000 claims 1
- 125000001475 halogen functional group Chemical group 0.000 claims 1
- 230000037356 lipid metabolism Effects 0.000 claims 1
- 230000004060 metabolic process Effects 0.000 claims 1
- 230000029058 respiratory gaseous exchange Effects 0.000 claims 1
- 208000017169 kidney disease Diseases 0.000 abstract description 2
- 208000006011 Stroke Diseases 0.000 abstract 1
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 66
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 24
- 102100022897 Sodium/hydrogen exchanger 10 Human genes 0.000 description 22
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 21
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 18
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 18
- 150000003254 radicals Chemical class 0.000 description 16
- 239000002904 solvent Substances 0.000 description 16
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 15
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 14
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 13
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 12
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 12
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 12
- 235000019341 magnesium sulphate Nutrition 0.000 description 12
- 239000000047 product Substances 0.000 description 12
- 108091006649 SLC9A3 Proteins 0.000 description 11
- 102100030375 Sodium/hydrogen exchanger 3 Human genes 0.000 description 11
- 210000004027 cell Anatomy 0.000 description 11
- 239000000203 mixture Substances 0.000 description 11
- 239000011734 sodium Substances 0.000 description 10
- 239000000243 solution Substances 0.000 description 9
- 239000000872 buffer Substances 0.000 description 8
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical group C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 7
- 239000012074 organic phase Substances 0.000 description 7
- 239000012071 phase Substances 0.000 description 7
- 229910000027 potassium carbonate Inorganic materials 0.000 description 7
- 238000002953 preparative HPLC Methods 0.000 description 7
- 238000011084 recovery Methods 0.000 description 7
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 230000005526 G1 to G0 transition Effects 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 238000001035 drying Methods 0.000 description 6
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical class CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 6
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 5
- 239000008103 glucose Substances 0.000 description 5
- 239000000546 pharmaceutical excipient Substances 0.000 description 5
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical class NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 5
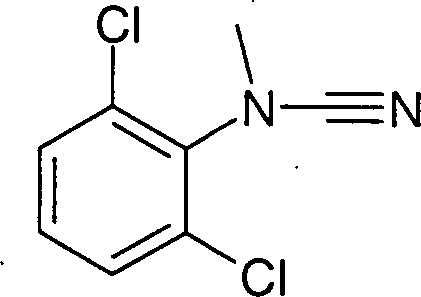
- WRDIIXFFFMAOHI-UHFFFAOYSA-N (2,6-dichlorophenyl)cyanamide Chemical compound ClC1=CC=CC(Cl)=C1NC#N WRDIIXFFFMAOHI-UHFFFAOYSA-N 0.000 description 4
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-N Formic acid Chemical compound OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 4
- ZRALSGWEFCBTJO-UHFFFAOYSA-N Guanidine Chemical compound NC(N)=N ZRALSGWEFCBTJO-UHFFFAOYSA-N 0.000 description 4
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 4
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 4
- YKIOKAURTKXMSB-UHFFFAOYSA-N adams's catalyst Chemical compound O=[Pt]=O YKIOKAURTKXMSB-UHFFFAOYSA-N 0.000 description 4
- 239000005557 antagonist Substances 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 235000019253 formic acid Nutrition 0.000 description 4
- 230000002401 inhibitory effect Effects 0.000 description 4
- 230000000144 pharmacologic effect Effects 0.000 description 4
- 230000003389 potentiating effect Effects 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 229910052708 sodium Inorganic materials 0.000 description 4
- 125000001424 substituent group Chemical group 0.000 description 4
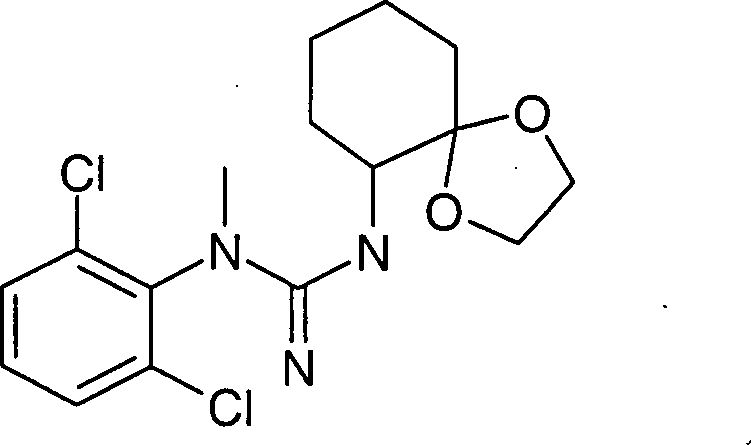
- RGEIMTZGJPZWDR-UHFFFAOYSA-N 1-(2,6-dichlorophenyl)-2-(1,4-dioxaspiro[4.5]decan-6-yl)-1-methylguanidine Chemical compound ClC=1C=CC=C(Cl)C=1N(C)C(=N)NC1CCCCC11OCCO1 RGEIMTZGJPZWDR-UHFFFAOYSA-N 0.000 description 3
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 206010021143 Hypoxia Diseases 0.000 description 3
- 206010061216 Infarction Diseases 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 230000003143 atherosclerotic effect Effects 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 229960002896 clonidine Drugs 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 230000007574 infarction Effects 0.000 description 3
- 230000000968 intestinal effect Effects 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 230000002475 laxative effect Effects 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
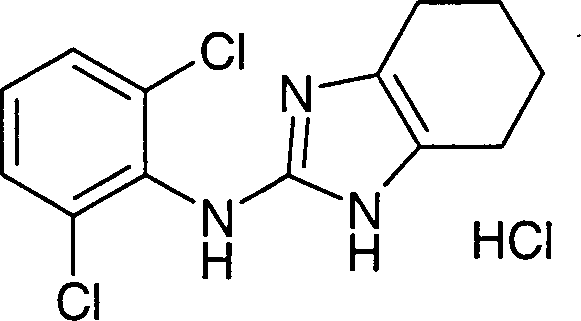
- FHTSVHSSNYHMQF-UHFFFAOYSA-N n-(2,6-dichlorophenyl)-4,5,6,7-tetrahydro-1h-benzimidazol-2-amine;hydrochloride Chemical compound Cl.ClC1=CC=CC(Cl)=C1NC(N1)=NC2=C1CCCC2 FHTSVHSSNYHMQF-UHFFFAOYSA-N 0.000 description 3
- YZWAGEFXDOAJOO-UHFFFAOYSA-N n-(2,6-dichlorophenyl)-5-methyl-1h-imidazol-2-amine;hydrochloride Chemical compound Cl.CC1=CNC(NC=2C(=CC=CC=2Cl)Cl)=N1 YZWAGEFXDOAJOO-UHFFFAOYSA-N 0.000 description 3
- MJTQJCSOCXYWIA-UHFFFAOYSA-N n-(2,6-dichlorophenyl)-n-methyl-4,5,6,7-tetrahydro-1h-benzimidazol-2-amine;hydrochloride Chemical compound Cl.N=1C=2CCCCC=2NC=1N(C)C1=C(Cl)C=CC=C1Cl MJTQJCSOCXYWIA-UHFFFAOYSA-N 0.000 description 3
- 230000001681 protective effect Effects 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- BUSCBOTVEVIIPM-UHFFFAOYSA-N (2,6-dichlorophenyl)methylcyanamide Chemical compound ClC1=CC=CC(Cl)=C1CNC#N BUSCBOTVEVIIPM-UHFFFAOYSA-N 0.000 description 2
- 0 *c([n]1)c(*)nc1N(*)c1c(*)c(*)c(*)c(*)c1* Chemical compound *c([n]1)c(*)nc1N(*)c1c(*)c(*)c(*)c(*)c1* 0.000 description 2
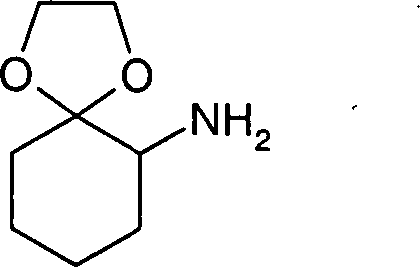
- OGSUWVLDPAKUDB-UHFFFAOYSA-N 1,4-dioxaspiro[4.5]decan-6-amine Chemical compound NC1CCCCC11OCCO1 OGSUWVLDPAKUDB-UHFFFAOYSA-N 0.000 description 2
- SBPCWNOMENALPT-UHFFFAOYSA-N 1-(2,6-dichlorophenyl)-2-(1,4-dioxaspiro[4.5]decan-6-yl)guanidine Chemical compound ClC1=CC=CC(Cl)=C1NC(=N)NC1C2(OCCO2)CCCC1 SBPCWNOMENALPT-UHFFFAOYSA-N 0.000 description 2
- LQMPMQNZHHKJCS-UHFFFAOYSA-N 1-(2,6-dichlorophenyl)-2-[(2-methyl-1,3-dioxolan-2-yl)methyl]guanidine;2,2,2-trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.ClC=1C=CC=C(Cl)C=1NC(=N)NCC1(C)OCCO1 LQMPMQNZHHKJCS-UHFFFAOYSA-N 0.000 description 2
- UUUHXMGGBIUAPW-UHFFFAOYSA-N 1-[1-[2-[[5-amino-2-[[1-[5-(diaminomethylideneamino)-2-[[1-[3-(1h-indol-3-yl)-2-[(5-oxopyrrolidine-2-carbonyl)amino]propanoyl]pyrrolidine-2-carbonyl]amino]pentanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]amino]-3-methylpentanoyl]pyrrolidine-2-carbon Chemical compound C1CCC(C(=O)N2C(CCC2)C(O)=O)N1C(=O)C(C(C)CC)NC(=O)C(CCC(N)=O)NC(=O)C1CCCN1C(=O)C(CCCN=C(N)N)NC(=O)C1CCCN1C(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C1CCC(=O)N1 UUUHXMGGBIUAPW-UHFFFAOYSA-N 0.000 description 2
- CHMYKADUZSMVOJ-UHFFFAOYSA-N 2-(2,6-dichloroanilino)-1h-imidazole-4,5-dicarbonitrile Chemical compound ClC1=CC=CC(Cl)=C1NC1=NC(C#N)=C(C#N)N1 CHMYKADUZSMVOJ-UHFFFAOYSA-N 0.000 description 2
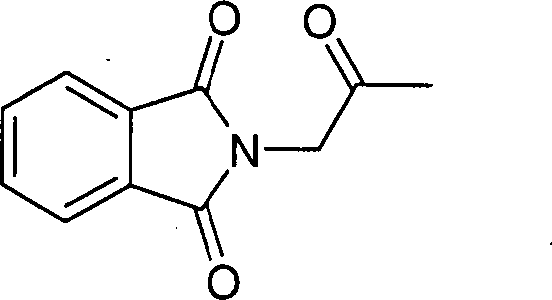
- STMRGLKPBJVVEG-UHFFFAOYSA-N 2-(2-oxopropyl)isoindole-1,3-dione Chemical compound C1=CC=C2C(=O)N(CC(=O)C)C(=O)C2=C1 STMRGLKPBJVVEG-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 102000006786 Chloride-Bicarbonate Antiporters Human genes 0.000 description 2
- 108010086832 Chloride-Bicarbonate Antiporters Proteins 0.000 description 2
- 208000017667 Chronic Disease Diseases 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 2
- 102000004895 Lipoproteins Human genes 0.000 description 2
- 108090001030 Lipoproteins Proteins 0.000 description 2
- CPLXHLVBOLITMK-UHFFFAOYSA-N Magnesium oxide Chemical compound [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 2
- CHJJGSNFBQVOTG-UHFFFAOYSA-N N-methyl-guanidine Natural products CNC(N)=N CHJJGSNFBQVOTG-UHFFFAOYSA-N 0.000 description 2
- 102000004270 Peptidyl-Dipeptidase A Human genes 0.000 description 2
- 108090000882 Peptidyl-Dipeptidase A Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- TUZYXOIXSAXUGO-UHFFFAOYSA-N Pravastatin Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(O)C=C21 TUZYXOIXSAXUGO-UHFFFAOYSA-N 0.000 description 2
- 108091006650 SLC9A2 Proteins 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 102100030382 Sodium/hydrogen exchanger 2 Human genes 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Natural products NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 150000001241 acetals Chemical class 0.000 description 2
- 229960000571 acetazolamide Drugs 0.000 description 2
- BZKPWHYZMXOIDC-UHFFFAOYSA-N acetazolamide Chemical compound CC(=O)NC1=NN=C(S(N)(=O)=O)S1 BZKPWHYZMXOIDC-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000003276 anti-hypertensive effect Effects 0.000 description 2
- 239000002220 antihypertensive agent Substances 0.000 description 2
- 230000036523 atherogenesis Effects 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 239000003489 carbonate dehydratase inhibitor Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 150000001912 cyanamides Chemical class 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- SWSQBOPZIKWTGO-UHFFFAOYSA-N dimethylaminoamidine Natural products CN(C)C(N)=N SWSQBOPZIKWTGO-UHFFFAOYSA-N 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- 210000002950 fibroblast Anatomy 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 2
- 230000000055 hyoplipidemic effect Effects 0.000 description 2
- 206010020718 hyperplasia Diseases 0.000 description 2
- 230000007954 hypoxia Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- 229960004844 lovastatin Drugs 0.000 description 2
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 2
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000003387 muscular Effects 0.000 description 2
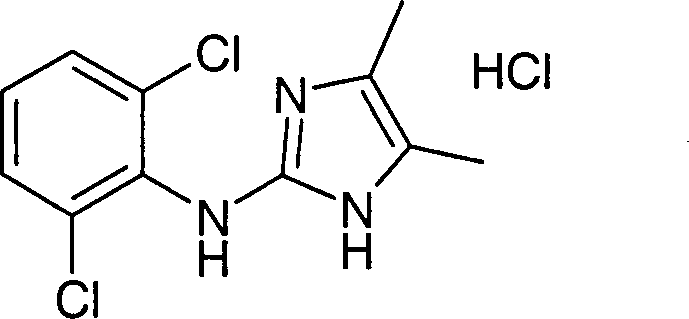
- QZTUIZMHEDGXFX-UHFFFAOYSA-N n-(2,6-dichlorophenyl)-1h-imidazol-2-amine;hydrochloride Chemical compound Cl.ClC1=CC=CC(Cl)=C1NC1=NC=CN1 QZTUIZMHEDGXFX-UHFFFAOYSA-N 0.000 description 2
- KAPVCURHFIAQLK-UHFFFAOYSA-N n-(2,6-dichlorophenyl)-4,5-dimethyl-1h-imidazol-2-amine;hydrochloride Chemical compound Cl.N1C(C)=C(C)N=C1NC1=C(Cl)C=CC=C1Cl KAPVCURHFIAQLK-UHFFFAOYSA-N 0.000 description 2
- 201000008383 nephritis Diseases 0.000 description 2
- 229960002965 pravastatin Drugs 0.000 description 2
- TUZYXOIXSAXUGO-PZAWKZKUSA-N pravastatin Chemical compound C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC(O)=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 TUZYXOIXSAXUGO-PZAWKZKUSA-N 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 210000002307 prostate Anatomy 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 229910000104 sodium hydride Inorganic materials 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000011477 surgical intervention Methods 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 1
- MRRBAEJGLOLWCX-UPHRSURJSA-N (z)-2,3-diaminobut-2-enedioic acid Chemical compound OC(=O)C(/N)=C(/N)C(O)=O MRRBAEJGLOLWCX-UPHRSURJSA-N 0.000 description 1
- FKTXDTWDCPTPHK-UHFFFAOYSA-N 1,1,1,2,3,3,3-heptafluoropropane Chemical group FC(F)(F)[C](F)C(F)(F)F FKTXDTWDCPTPHK-UHFFFAOYSA-N 0.000 description 1
- SUCGVQHNGIQXGD-UHFFFAOYSA-N 1,3-dichloro-2-isothiocyanatobenzene Chemical compound ClC1=CC=CC(Cl)=C1N=C=S SUCGVQHNGIQXGD-UHFFFAOYSA-N 0.000 description 1
- PLWANCOYVAFWCA-UHFFFAOYSA-N 1-amino-1-phenylpropan-2-one;hydrochloride Chemical compound Cl.CC(=O)C(N)C1=CC=CC=C1 PLWANCOYVAFWCA-UHFFFAOYSA-N 0.000 description 1
- 125000006018 1-methyl-ethenyl group Chemical group 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- CCHNWURRBFGQCD-UHFFFAOYSA-N 2-chlorocyclohexan-1-one Chemical compound ClC1CCCCC1=O CCHNWURRBFGQCD-UHFFFAOYSA-N 0.000 description 1
- 239000001763 2-hydroxyethyl(trimethyl)azanium Substances 0.000 description 1
- MELYYJJKRWTTNN-UHFFFAOYSA-N 2-quinazolin-2-ylguanidine Chemical compound C1=CC=CC2=NC(NC(=N)N)=NC=C21 MELYYJJKRWTTNN-UHFFFAOYSA-N 0.000 description 1
- BNBOUFHCTIFWHN-UHFFFAOYSA-N 3-bromobutan-2-one Chemical compound CC(Br)C(C)=O BNBOUFHCTIFWHN-UHFFFAOYSA-N 0.000 description 1
- 125000005917 3-methylpentyl group Chemical group 0.000 description 1
- BSYNRYMUTXBXSQ-FOQJRBATSA-N 59096-14-9 Chemical compound CC(=O)OC1=CC=CC=C1[14C](O)=O BSYNRYMUTXBXSQ-FOQJRBATSA-N 0.000 description 1
- 239000005541 ACE inhibitor Substances 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 241000238876 Acari Species 0.000 description 1
- 208000010444 Acidosis Diseases 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- PQSUYGKTWSAVDQ-ZVIOFETBSA-N Aldosterone Chemical compound C([C@@]1([C@@H](C(=O)CO)CC[C@H]1[C@@H]1CC2)C=O)[C@H](O)[C@@H]1[C@]1(C)C2=CC(=O)CC1 PQSUYGKTWSAVDQ-ZVIOFETBSA-N 0.000 description 1
- PQSUYGKTWSAVDQ-UHFFFAOYSA-N Aldosterone Natural products C1CC2C3CCC(C(=O)CO)C3(C=O)CC(O)C2C2(C)C1=CC(=O)CC2 PQSUYGKTWSAVDQ-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 206010002383 Angina Pectoris Diseases 0.000 description 1
- 206010003225 Arteriospasm coronary Diseases 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 206010048962 Brain oedema Diseases 0.000 description 1
- WTYQFWFKBABVJW-UHFFFAOYSA-N CC1(CN/C(/N)=N/c(c(Cl)ccc2)c2Cl)OCCO1 Chemical compound CC1(CN/C(/N)=N/c(c(Cl)ccc2)c2Cl)OCCO1 WTYQFWFKBABVJW-UHFFFAOYSA-N 0.000 description 1
- 229940122072 Carbonic anhydrase inhibitor Drugs 0.000 description 1
- 108090000209 Carbonic anhydrases Proteins 0.000 description 1
- 102000003846 Carbonic anhydrases Human genes 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 208000003417 Central Sleep Apnea Diseases 0.000 description 1
- JZUFKLXOESDKRF-UHFFFAOYSA-N Chlorothiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NCNS2(=O)=O JZUFKLXOESDKRF-UHFFFAOYSA-N 0.000 description 1
- 235000019743 Choline chloride Nutrition 0.000 description 1
- 206010056370 Congestive cardiomyopathy Diseases 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- OCUCCJIRFHNWBP-IYEMJOQQSA-L Copper gluconate Chemical class [Cu+2].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O OCUCCJIRFHNWBP-IYEMJOQQSA-L 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 1
- 201000010046 Dilated cardiomyopathy Diseases 0.000 description 1
- 241000255925 Diptera Species 0.000 description 1
- 206010014476 Elevated cholesterol Diseases 0.000 description 1
- 108010061435 Enalapril Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 108010054265 Factor VIIa Proteins 0.000 description 1
- 108010074860 Factor Xa Proteins 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 101000610640 Homo sapiens U4/U6 small nuclear ribonucleoprotein Prp3 Proteins 0.000 description 1
- 206010020591 Hypercapnia Diseases 0.000 description 1
- 208000035150 Hypercholesterolemia Diseases 0.000 description 1
- 206010020880 Hypertrophy Diseases 0.000 description 1
- 206010021137 Hypovolaemia Diseases 0.000 description 1
- WRYCSMQKUKOKBP-UHFFFAOYSA-N Imidazolidine Chemical compound C1CNCN1 WRYCSMQKUKOKBP-UHFFFAOYSA-N 0.000 description 1
- 206010022562 Intermittent claudication Diseases 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 208000007177 Left Ventricular Hypertrophy Diseases 0.000 description 1
- 101710097665 Leucine aminopeptidase 1 Proteins 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 206010027417 Metabolic acidosis Diseases 0.000 description 1
- 208000007101 Muscle Cramp Diseases 0.000 description 1
- 108091006315 Na+/HCO3 − co-transport proteins Proteins 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000018262 Peripheral vascular disease Diseases 0.000 description 1
- UJEWTUDSLQGTOA-UHFFFAOYSA-N Piretanide Chemical compound C=1C=CC=CC=1OC=1C(S(=O)(=O)N)=CC(C(O)=O)=CC=1N1CCCC1 UJEWTUDSLQGTOA-UHFFFAOYSA-N 0.000 description 1
- CYLWJCABXYDINA-UHFFFAOYSA-N Polythiazide Polymers ClC1=C(S(N)(=O)=O)C=C2S(=O)(=O)N(C)C(CSCC(F)(F)F)NC2=C1 CYLWJCABXYDINA-UHFFFAOYSA-N 0.000 description 1
- 101710082688 Probable leucine aminopeptidase 1 Proteins 0.000 description 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 1
- 101100421625 Rattus norvegicus Slc9a3 gene Proteins 0.000 description 1
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 1
- 101001110823 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-A Proteins 0.000 description 1
- 101000712176 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-B Proteins 0.000 description 1
- 241000258242 Siphonaptera Species 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 1
- 102000006633 Sodium-Bicarbonate Symporters Human genes 0.000 description 1
- 102000052126 Sodium-Hydrogen Exchangers Human genes 0.000 description 1
- 108091006672 Sodium–hydrogen antiporter Proteins 0.000 description 1
- 208000005392 Spasm Diseases 0.000 description 1
- UIRKNQLZZXALBI-MSVGPLKSSA-N Squalamine Chemical compound C([C@@H]1C[C@H]2O)[C@@H](NCCCNCCCCN)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@H](C)CC[C@H](C(C)C)OS(O)(=O)=O)[C@@]2(C)CC1 UIRKNQLZZXALBI-MSVGPLKSSA-N 0.000 description 1
- UIRKNQLZZXALBI-UHFFFAOYSA-N Squalamine Natural products OC1CC2CC(NCCCNCCCCN)CCC2(C)C2C1C1CCC(C(C)CCC(C(C)C)OS(O)(=O)=O)C1(C)CC2 UIRKNQLZZXALBI-UHFFFAOYSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000019486 Sunflower oil Nutrition 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 108090000190 Thrombin Proteins 0.000 description 1
- NGBFQHCMQULJNZ-UHFFFAOYSA-N Torsemide Chemical compound CC(C)NC(=O)NS(=O)(=O)C1=CN=CC=C1NC1=CC=CC(C)=C1 NGBFQHCMQULJNZ-UHFFFAOYSA-N 0.000 description 1
- 102100022147 Torsin-1A-interacting protein 1 Human genes 0.000 description 1
- FNYLWPVRPXGIIP-UHFFFAOYSA-N Triamterene Chemical compound NC1=NC2=NC(N)=NC(N)=C2N=C1C1=CC=CC=C1 FNYLWPVRPXGIIP-UHFFFAOYSA-N 0.000 description 1
- 102100040374 U4/U6 small nuclear ribonucleoprotein Prp3 Human genes 0.000 description 1
- 241000607479 Yersinia pestis Species 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- NTECHUXHORNEGZ-UHFFFAOYSA-N acetyloxymethyl 3',6'-bis(acetyloxymethoxy)-2',7'-bis[3-(acetyloxymethoxy)-3-oxopropyl]-3-oxospiro[2-benzofuran-1,9'-xanthene]-5-carboxylate Chemical compound O1C(=O)C2=CC(C(=O)OCOC(C)=O)=CC=C2C21C1=CC(CCC(=O)OCOC(C)=O)=C(OCOC(C)=O)C=C1OC1=C2C=C(CCC(=O)OCOC(=O)C)C(OCOC(C)=O)=C1 NTECHUXHORNEGZ-UHFFFAOYSA-N 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical class OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 229960002478 aldosterone Drugs 0.000 description 1
- 239000002170 aldosterone antagonist Substances 0.000 description 1
- 229940083712 aldosterone antagonist Drugs 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 102000030484 alpha-2 Adrenergic Receptor Human genes 0.000 description 1
- 108020004101 alpha-2 Adrenergic Receptor Proteins 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- XSDQTOBWRPYKKA-UHFFFAOYSA-N amiloride Chemical compound NC(=N)NC(=O)C1=NC(Cl)=C(N)N=C1N XSDQTOBWRPYKKA-UHFFFAOYSA-N 0.000 description 1
- 229960002576 amiloride Drugs 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 238000002399 angioplasty Methods 0.000 description 1
- 229940127282 angiotensin receptor antagonist Drugs 0.000 description 1
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 1
- 239000010775 animal oil Substances 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 230000000879 anti-atherosclerotic effect Effects 0.000 description 1
- 230000003556 anti-epileptic effect Effects 0.000 description 1
- 239000003416 antiarrhythmic agent Substances 0.000 description 1
- 229940127090 anticoagulant agent Drugs 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 229940006133 antiglaucoma drug and miotics carbonic anhydrase inhibitors Drugs 0.000 description 1
- 229940030600 antihypertensive agent Drugs 0.000 description 1
- 239000003524 antilipemic agent Substances 0.000 description 1
- 239000003430 antimalarial agent Substances 0.000 description 1
- 229940033495 antimalarials Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 239000000164 antipsychotic agent Substances 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- PXXJHWLDUBFPOL-UHFFFAOYSA-N benzamidine Chemical compound NC(=N)C1=CC=CC=C1 PXXJHWLDUBFPOL-UHFFFAOYSA-N 0.000 description 1
- 239000002876 beta blocker Substances 0.000 description 1
- 229940097320 beta blocking agent Drugs 0.000 description 1
- JEPPYVOSGKWVSJ-UHFFFAOYSA-N bicyclo[2.2.1]heptan-3-amine Chemical compound C1CC2C(N)CC1C2 JEPPYVOSGKWVSJ-UHFFFAOYSA-N 0.000 description 1
- 239000003613 bile acid Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000001772 blood platelet Anatomy 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 208000006752 brain edema Diseases 0.000 description 1
- 229960004064 bumetanide Drugs 0.000 description 1
- MAEIEVLCKWDQJH-UHFFFAOYSA-N bumetanide Chemical compound CCCCNC1=CC(C(O)=O)=CC(S(N)(=O)=O)=C1OC1=CC=CC=C1 MAEIEVLCKWDQJH-UHFFFAOYSA-N 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 229960000830 captopril Drugs 0.000 description 1
- FAKRSMQSSFJEIM-RQJHMYQMSA-N captopril Chemical compound SC[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O FAKRSMQSSFJEIM-RQJHMYQMSA-N 0.000 description 1
- 230000001269 cardiogenic effect Effects 0.000 description 1
- 230000003293 cardioprotective effect Effects 0.000 description 1
- 230000001364 causal effect Effects 0.000 description 1
- 238000000451 chemical ionisation Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- BULLHNJGPPOUOX-UHFFFAOYSA-N chloroacetone Chemical compound CC(=O)CCl BULLHNJGPPOUOX-UHFFFAOYSA-N 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- SGMZJAMFUVOLNK-UHFFFAOYSA-M choline chloride Chemical compound [Cl-].C[N+](C)(C)CCO SGMZJAMFUVOLNK-UHFFFAOYSA-M 0.000 description 1
- 229960003178 choline chloride Drugs 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 230000002566 clonic effect Effects 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 239000003026 cod liver oil Substances 0.000 description 1
- 235000012716 cod liver oil Nutrition 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000002934 diuretic Substances 0.000 description 1
- 229940030606 diuretics Drugs 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 239000013583 drug formulation Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- GBXSMTUPTTWBMN-XIRDDKMYSA-N enalapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)CC1=CC=CC=C1 GBXSMTUPTTWBMN-XIRDDKMYSA-N 0.000 description 1
- 229960000873 enalapril Drugs 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 230000001037 epileptic effect Effects 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 229940012414 factor viia Drugs 0.000 description 1
- 229940125753 fibrate Drugs 0.000 description 1
- 239000003527 fibrinolytic agent Substances 0.000 description 1
- 230000003176 fibrotic effect Effects 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 125000004991 fluoroalkenyl group Chemical group 0.000 description 1
- 125000003709 fluoroalkyl group Chemical group 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-L fumarate(2-) Chemical class [O-]C(=O)\C=C\C([O-])=O VZCYOOQTPOCHFL-OWOJBTEDSA-L 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 229960003883 furosemide Drugs 0.000 description 1
- ZZUFCTLCJUWOSV-UHFFFAOYSA-N furosemide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(C(O)=O)=C1NCC1=CC=CO1 ZZUFCTLCJUWOSV-UHFFFAOYSA-N 0.000 description 1
- 208000001130 gallstones Diseases 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000003349 gelling agent Substances 0.000 description 1
- 150000002306 glutamic acid derivatives Chemical class 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N glycerol 1-phosphate Chemical class OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 150000002357 guanidines Chemical class 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 229960002003 hydrochlorothiazide Drugs 0.000 description 1
- 208000020346 hyperlipoproteinemia Diseases 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 108010070995 imidazoline I1 receptors Proteins 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- NDDAHWYSQHTHNT-UHFFFAOYSA-N indapamide Chemical compound CC1CC2=CC=CC=C2N1NC(=O)C1=CC=C(Cl)C(S(N)(=O)=O)=C1 NDDAHWYSQHTHNT-UHFFFAOYSA-N 0.000 description 1
- 229960004569 indapamide Drugs 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 229940079865 intestinal antiinfectives imidazole derivative Drugs 0.000 description 1
- 208000003243 intestinal obstruction Diseases 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 230000012105 intracellular pH reduction Effects 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- 150000003893 lactate salts Chemical class 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000008141 laxative Substances 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000002171 loop diuretic Substances 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 235000014380 magnesium carbonate Nutrition 0.000 description 1
- 239000000395 magnesium oxide Substances 0.000 description 1
- 235000012245 magnesium oxide Nutrition 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- LUJWNOXGZIICLL-UHFFFAOYSA-N n-(2,6-dichlorophenyl)-5-methyl-4-phenyl-1h-imidazol-2-amine;hydrochloride Chemical compound Cl.N1C(C=2C=CC=CC=2)=C(C)N=C1NC1=C(Cl)C=CC=C1Cl LUJWNOXGZIICLL-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- OUAAURDVPDKVAK-UHFFFAOYSA-N n-phenyl-1h-benzimidazol-2-amine Chemical compound N=1C2=CC=CC=C2NC=1NC1=CC=CC=C1 OUAAURDVPDKVAK-UHFFFAOYSA-N 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005244 neohexyl group Chemical group [H]C([H])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 230000000414 obstructive effect Effects 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 230000020477 pH reduction Effects 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000035778 pathophysiological process Effects 0.000 description 1
- 125000006340 pentafluoro ethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 230000008855 peristalsis Effects 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical compound C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 229960001085 piretanide Drugs 0.000 description 1
- 229960005483 polythiazide Drugs 0.000 description 1
- 229920000046 polythiazide Polymers 0.000 description 1
- 230000002980 postoperative effect Effects 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000009117 preventive therapy Methods 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 201000004240 prostatic hypertrophy Diseases 0.000 description 1
- 239000011251 protective drug Substances 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 239000003586 protic polar solvent Substances 0.000 description 1
- 230000003236 psychic effect Effects 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- HDACQVRGBOVJII-JBDAPHQKSA-N ramipril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](C[C@@H]2CCC[C@@H]21)C(O)=O)CC1=CC=CC=C1 HDACQVRGBOVJII-JBDAPHQKSA-N 0.000 description 1
- 229960003401 ramipril Drugs 0.000 description 1
- 230000009103 reabsorption Effects 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 201000002793 renal fibrosis Diseases 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 229960002855 simvastatin Drugs 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 208000010110 spontaneous platelet aggregation Diseases 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 229950001248 squalamine Drugs 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000002600 sunflower oil Substances 0.000 description 1
- 239000002511 suppository base Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 150000003892 tartrate salts Chemical class 0.000 description 1
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 229940124591 thiazide-type diuretic Drugs 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 230000001256 tonic effect Effects 0.000 description 1
- 229960005461 torasemide Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 229960001288 triamterene Drugs 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 210000004509 vascular smooth muscle cell Anatomy 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 238000009423 ventilation Methods 0.000 description 1
- 108010047303 von Willebrand Factor Proteins 0.000 description 1
- 102100036537 von Willebrand factor Human genes 0.000 description 1
- 229960001134 von willebrand factor Drugs 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/04—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D233/28—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/44—Nitrogen atoms not forming part of a nitro radical
- C07D233/50—Nitrogen atoms not forming part of a nitro radical with carbocyclic radicals directly attached to said nitrogen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/10—Laxatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/16—Central respiratory analeptics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/12—Drugs for disorders of the metabolism for electrolyte homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/06—Antimalarials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/14—Ectoparasiticides, e.g. scabicides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/06—Drugs for disorders of the endocrine system of the anterior pituitary hormones, e.g. TSH, ACTH, FSH, LH, PRL, GH
- A61P5/08—Drugs for disorders of the endocrine system of the anterior pituitary hormones, e.g. TSH, ACTH, FSH, LH, PRL, GH for decreasing, blocking or antagonising the activity of the anterior pituitary hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/08—Plasma substitutes; Perfusion solutions; Dialytics or haemodialytics; Drugs for electrolytic or acid-base disorders, e.g. hypovolemic shock
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/02—Non-specific cardiovascular stimulants, e.g. drugs for syncope, antihypotensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Cardiology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Heart & Thoracic Surgery (AREA)
- Tropical Medicine & Parasitology (AREA)
- Obesity (AREA)
- Endocrinology (AREA)
- Immunology (AREA)
- Pain & Pain Management (AREA)
- Urology & Nephrology (AREA)
- Pulmonology (AREA)
- Psychiatry (AREA)
- Emergency Medicine (AREA)
- Vascular Medicine (AREA)
- Anesthesiology (AREA)
- Dermatology (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
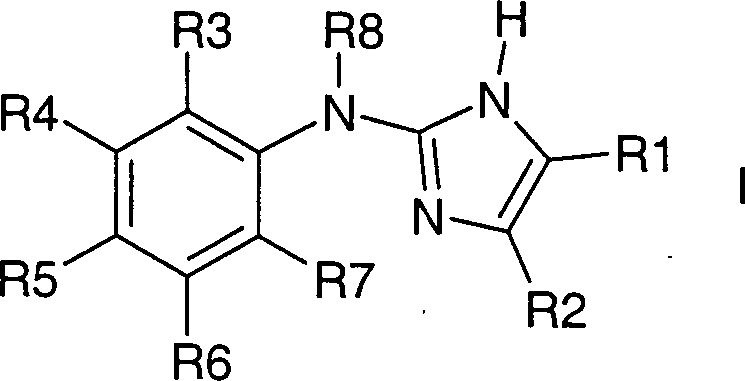
Die Erfindung betrifft Verbindungen vom Typ der Formel I, deren Reste R1-R8, wie in den Ansprüchen beschrieben, definiert sind. Verbindungen dieses Typs sind nützlich bei der Prävention oder Behandlung diverser Erkrankungen. So lassen sich die Verbindungen unter anderem bei Nierenerkrankungen wie akutem oder chronischem Nierenversagen, bei Störungen der Gallenfunktion, bei Atemstörungen wie Schnarchen oder Schlafapnoen oder bei Schlaganfall einsetzen. DOLLAR F1
Description
- Die Erfindung betrifft Verbindungen vom Typ der 2-Aminoimidazole, die den Natrium-Protonen-Austauscher Subtyp 3 (NHE3) hemmen und die nützlich bei der Prävention oder Behandlung diverser Erkrankungen sind. So lassen sich die Verbindungen unter anderem bei Nierenerkrankungen wie akutem oder chronischem Nierenversagen, bei Störungen der Gallenfunktion, bei Atemstörungen wie Schnarchen oder Schlafapnoen oder bei Schlaganfall einsetzen.
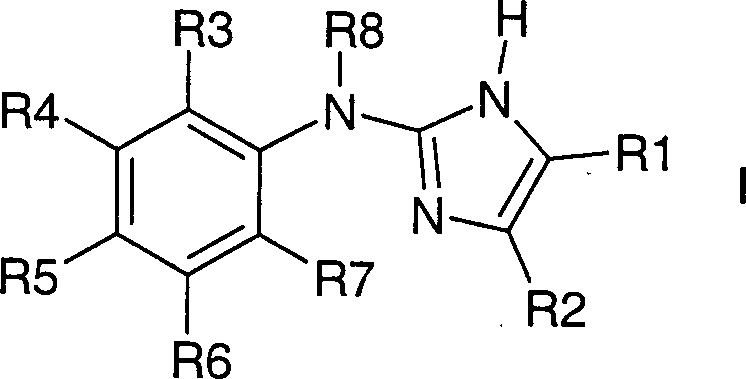
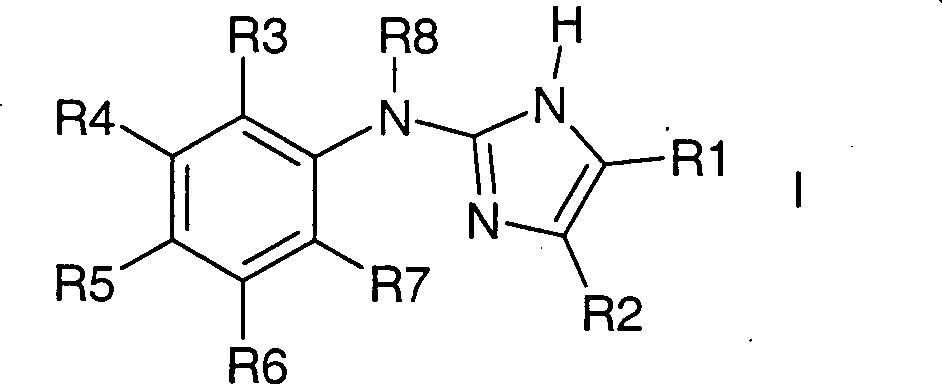
- Die Erfindung betrifft Verbindungen der Formel I, worin bedeuten:
R1 und R2 zusammen mit den beiden Kohlenstoffatomen, an die sie gebunden sind, einen fünf- bis achtgliedrigen, eine oder zwei Doppelbindungen enthaltenden Kohlenstoffring,
wobei der Ring unsubstituiert ist oder durch 1 – 12 F-Atome oder bis zu zwei Resten aus der Gruppe OH, NR9R10, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert ist mit
R9, R10 unabhängig voneinander H, (C1-C4)-Alkyl;
wobei der Ring vorzugsweise unsubstituiert oder unabhängig voneinander durch 1-12 F-Atome oder bis zu zwei Resten aus der Gruppe CH3 oder OCH3 substituiert ist;
oder
R1 und R2 unabhängig voneinander H, (C1-C4)-Alkyl, CN, Phenyl
wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind,
wobei R1 und R2 nicht beide gleichzeitig Wasserstoff entsprechen;
R3 bis R7 unabhängig voneinander H, F, Cl, Br, I, (C1-C4)-Alkyl, oder (C1-C4)-Alkoxy,
wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind,
wobei R3 und R7 nicht beide gleichzeitig Wasserstoff entsprechen;
R8 H, (C1-C4)-Alkyl, (C3-C5)-Cycloalkyl,
wobei die Kohlenstoffketten oder -ringe unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind;
sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze;
wobei R1 und R2 nicht beide gleichzeitig Methyl sind, wenn R3 Cl und R4 bis R8 Wasserstoff sind;
wobei Verbindungen bevorzugt sind, in denen R3 und R7 beide nicht Wasserstoff entsprechen. - Bevorzugt sind Verbindungen der Formel I, worin bedeuten
R1 und R2 zusammen mit den beiden Kohlenstoffatomen, an die sie gebunden sind, einen fünf- bis achtgliedrigen, eine oder zwei Doppelbindungen enthaltenden Kohlenstoffring,
wobei der Ring unsubstituiert oder durch 1 – 12 F-Atome oder bis zu zwei Resten aus der Gruppe CF3 oder OCH3 substituiert ist;
R3 bis R7 unabhängig voneinander H, F, Cl, Br, (C1-C4)-Alkyl, oder (C1-C4)-Alkoxy,
wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind,
wobei R3 und R7 nicht beide gleichzeitig Wasserstoff entsprechen;
R8 H, (C1-C4)-Alkyl, (C3-C5)-Cycloalkyl,
wobei die Kohlenstoffketten oder -ringe unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind;
sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze. - Besonders bevorzugt sind Verbindungen der Formel 1, worin bedeuten:
R1 und R2 zusammen mit den beiden Kohlenstoffatomen, an die sie gebunden sind, einen fünf- bis siebengliedrigen, eine Doppelbindung enthaltenden Kohlenstoffring,
R3 und R7 unabhängig voneinander F, Cl, Br oder (C1-C4)-Alkyl,
wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind;
R4 bis R6 H
R8 H, (C1-C4)-Alkyl,
wobei die Kohlenstoffketten unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind;
sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze. - Ganz besonders bevorzugt sind:
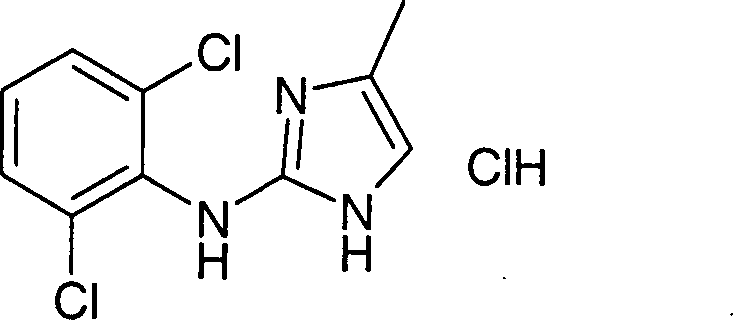
(2,6-Dichlorphenyl)-(4,5,6,7-tetrahydro-1H-benzoimidazol-2-yl)-amin-Hydrochlorid
oder
(2,6-Dichlorphenyl)-methyl-(4,5,6,7-tetrahydro-1H-benzoimidazol-2-yl)-amin-Hydrochlorid - Weiterhin sind Verbindungen der Formel I bevorzugt, worin bedeuten:
R1 und R2 unabhängig voneinander H, (C1-C4)-Alkyl, CN, Phenyl
wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind,
wobei beide Reste R1 und R2 nicht gleichzeitig Wasserstoff entsprechen;
R3 bis R7 unabhängig voneinander H, F, Cl, Br, (C1-C4)-Alkyl,
wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind,
wobei die Reste R3 und R7 nicht gleichzeitig Wasserstoff entsprechen;
R8 H, (C1-C4)-Alkyl, (C3-C5)-Cycloalkyl,
wobei die Kohlenstoffketten oder -ringe unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind;
sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze;
wobei R1 und R2 nicht beide gleichzeitig Methyl sind, wenn R3 Cl und R4 bis R8 Wasserstoff sind. - Besonders bevorzugt sind Verbindungen der Formel I, worin bedeuten:
R1 und R2 unabhängig voneinander H, (C1-C4)-Alkyl;
R3 und R7 unabhängig voneinander F, Cl, Br, (C1-C4)-Alkyl,
wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind;
R4 bis R6 H
R8 H, (C1-C4)-Alkyl,
wobei die Kohlenstoffketten unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind;
sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze;
wobei R1 und R2 nicht beide gleichzeitig Methyl sind, wenn R3 Cl und R4 bis R8 Wasserstoff sind. - Ganz besonders bevorzugt sind:
(2,6-Dichlorphenyl)-(4-methyl-1H-imidazol-2-yl)-amin-Hydrochlorid oder (2,6-Dichlorphenyl)-(4,5-dimethyl-1H-imidazol-2-yl)-amin-Hydrochlorid - Weiterhin umfasst die Erfindung die Verwendung von Verbindungen der Formel I zur Herstellung eines Medikaments zur Behandlung von Krankheiten, welche durch Inhibierung des Natrium-/ Wasserstoff-Austauschers (NHE), insbesondere des NHE3, beeinflusst werden können, worin bedeuten:
R1 und R2 unabhängig voneinander H, F, Cl, Br, I, CN, (C1-C6)-Alkyl, (C2-C6)-Alkenyl, (C2-C6)-Alkinyl, (C3-C6)-Cycloalkyl, (C4-C6)-Cycloalkenyl, Phenyl,
wobei Phenyl unsubstituiert oder unabhängig voneinander mit bis zu zwei Resten aus der Gruppe F, Cl, Br, I, OH, NR9R10, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert ist mit
R9, R10 unabhängig voneinander H, (C1-C4)-Alkyl;
und
wobei die Kohlenstoffketten oder -ringe unsubstituiert sind oder unabhängig voneinander mit 1 – 13 F-Atomen oder mit bis zu zwei Resten aus der Gruppe OH, NR9R10, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert sind mit
R9, R10 unabhängig voneinander H, (C1-C4)-Alkyl;
wobei vorzugsweise R1 und R2 nicht gleichzeitig Phenyl entsprechen;
oder
R1 und R2 zusammen mit den beiden Kohlenstoffatomen, an die sie gebunden sind, einen fünf- bis achtgliedrigen, eine oder zwei Doppelbindungen enthaltenden Kohlenstoffring,
wobei der Ring unsubstituiert ist oder unabhängig voneinander durch 1 – 12 F-Atome oder bis zu zwei Resten aus der Gruppe NR9R10, (C1-C4)-Alkyl, OH, CN, CF3 oder (C1-C4)-Alkoxy substituiert ist mit
R9, R10 unabhängig voneinander H, (C1-C4)-Alkyl;
R3 bis R7 unabhängig voneinander H, F, Cl, Br, I, (C1-C4)-Alkyl, (C2-C4)-Alkenyl, (C3-C6)-Cycloalkyl, OH, (C1-C4)-Alkoxy, CN, NO2, NH2, (C1-C4)-Alkylamino, (C1-C4)-Dialkylamino,
wobei die Kohlenstoffketten oder -ringe unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind;
wobei R3 und R7 nicht gleichzeitig Wasserstoff entsprechen;
R8 H, (C1-C4)-Alkyl, (C3-C5)-Cycloalkyl,
wobei die Kohlenstoffketten oder -ringe unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind;
sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze. - Enthalten die Verbindungen der Formel I ein oder mehrere Asymmetriezentren, so können diese sowohl S als auch R konfiguriert sein. Die Verbindungen können als optische Isomere, als Diastereomere, als Racemate oder als Gemische derselben vorliegen.
- Die vorliegende Erfindung umfasst alle tautomeren Formen der Verbindungen der Formel I.
- Alkylreste können geradkettig oder verzweigt sein. Dies gilt auch, wenn sie Substituenten tragen oder als Substituenten anderer Reste auftreten, beispielsweise in Fluoralkylresten oder Alkoxyresten. Beispiele für Alkylreste sind Methyl, Ethyl, n-Propyl, Isopropyl (= 1-Methylethyl), n-Butyl, Isobutyl (= 2-Methylpropyl), sec-Butyl (= 1-Methylpropyl), tert-Butyl (= 1,1-Dimethylethyl), n-Pentyl, Isopentyl, tert-Pentyl, Neopentyl, n-Hexyl, 3-Methylpentyl, Isohexyl, Neohexyl. Bevorzugte Alkylreste sind Methyl, Ethyl, Isopropyl. In Alkylresten können ein oder mehrere, zum Beispiel 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 oder 13, Wasserstoffatome durch Fluoratome substituiert sein. Beispiele für solche Fluoralkylreste sind Trifluormethyl, 2,2,2- Trifluorethyl, Pentafluorethyl, Heptafluorisopropyl. Substituierte Alkylreste können in beliebigen Positionen substituiert sein.
- Alkenylreste können geradkettig oder verzweigt sein. Dies gilt auch, wenn sie Substituenten tragen beispielsweise in Fluoralkenylresten. Die Alkenylreste können in unterschiedlichen Positionen ungesättigt und auch mehrfach ungesättigt sein. Beispiele für Alkenylreste sind Ethenyl, n-Prop-1-enyl, n-Prop-2-enyl, Isoprop-1-enyl (= 1-Methylethenyl), n-But-1-enyl, n-But-2-enyl, n-But-3-enyl, n-Buta-1,3-dienyl, Isobut-1-enyl (= 2-Methylprop-1-enyl), Isobut-2-enyl (= 2-Methylprop-2-enyl), sec-But-1-enyl (= 1-Methylprop-1-enyl). Bevorzugte Alkenylreste sind Ethenyl, n-Prop-1-enyl, n-Prop-2-enyl, n-But-1-enyl, n-But-2-enyl, n-Pentenyl, n-Pentadienyl, Isopentenyl, tert-Pentenyl, Neopentenyl; n-Hexenyl, n-Hexadienyl, n-Hexatrienyl, 3-Methylpentenyl, Isohexenyl, Neohexenyl. In Alkenylresten können ein oder mehrere, zum Beispiel 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 oder 11 Wasserstoffatome durch Fluoratome substituiert sein. Substituierte Alkenylreste können in beliebigen Positionen substituiert sein.
- Alkinylreste können geradkettig oder verzweigt sein. Dies gilt auch, wenn sie Substituenten tragen beispielsweise in Fluoralkinylresten. Die Alkinylreste können in unterschiedlichen Positionen ungesättigt und auch mehrfach ungesättigt sein. Beispiele für Alkinylreste sind Ethinyl, n-Prop-1-inyl, n-Prop-2-inyl, n-But-1-inyl, n-But-2-inyl, n-But-3-inyl, n-Buta-1,3-diinyl, sec-But-2-enyl (= 1-Methylprop-2-enyl), n-Pentinyl, n-Pentadiinyl, Isopentinyl, tert-Pentinyl, Neopentinyl, n-Hexinyl, n-Hexadiinyl, n-Hexatriinyl, 3-Methylpentinyl, Isohexinyl, Neohexinyl. Bevorzugte Alkinylreste sind n-Prop-1-inyl, n-Prop-2-inyl, n-But-1-inyl, n-But-2-inyl. In Alkinylresten können ein oder mehrere, zum Beispiel 1, 2, 3, 4, 5, 6, 7, 8 oder 9, Wasserstoffatome durch Fluoratome substituiert sein. Substituierte Alkinylreste können in beliebigen Positionen substituiert sein.
- Beispiele für Cycloalkylreste sind Cyclopropyl, Cyclobutyl, Cyclopentyl oder Cyclohexyl. In Cycloalkylresten können ein oder mehrere, zum Beispiel 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 oder 11 Wasserstoffatome durch Fluoratome substituiert sein. Substituierte Cycloalkylreste können in beliebigen Positionen substituiert sein.
- Die Cycloalkenylreste können in unterschiedlichen Positionen ungesättigt und auch mehrfach ungesättigt sein. Beispiele für Cycloalkenylreste sind Cycloprop-1-enyl, Cycloprop-2-enyl, Cyclobut-1-enyl, Cyclobut-2-enyl, Cyclopent-1-enyl, Cyclopent-2-enyl, Cyclopenta-1,3-dienyl, Cyclohexenyl oder Cyclohexadienyl. In Cycloalkenylresten können ein oder mehrere, zum Beispiel 1, 2, 3, 4, 5, 6, 7, 8 oder 9 Wasserstoffatome durch Fluoratome substituiert sein. Substituierte Cycloalkenylreste können in beliebigen Positionen substituiert sein.
- Beschrieben wird auch eine Methode zur Herstellung der verwendeten Verbindungen. So lassen sich die durch Formel I beschriebenen Verbindungen in dem Fachmann bekannter Weise unter sauren Bedingungen aus den zugrundeliegenden Guanidinen der Formel II oder einer tautomeren Form der Formel II darstellen, wobei die Reste R1 bis R8 entsprechend Formel I definiert sind, während E einem Alkylrest mit 1 bis 4 Kohlenstoffatomen entspricht, wobei die beiden Reste E auch zu einem Ring verbunden sein können.
- Verbindungen der Formel II können in literaturbekannter Weise aus den Cyanamiden III oder Thiuronium-Verbindungen IV und den entsprechenden Aminoketalen oder -acetalen V erhalten werden, wobei der Rest R in Formel IV einer Alkylgruppe, bevorzugt Methyl, entspricht.
- Der Zugang zu den obigen Intermediaten III bis V für R8 = Wasserstoff ist literaturbekannt (J. Med. Chem. 1975, 18, 90–99; Brit. 1,131,191).
- Es wurde gefunden, dass Verbindungen der Formel V sich in Abwandlung obiger Literatur ausgehend von α-Haloketonen oder -aldehyden vorteilhaft über die Sequenz Halogen-Azid-Austausch (bevorzugt mit Natriumazid), Ketalisierung oder Acetalisierung (bevorzugt mit Ethylenglykol) und Reduktion (bevorzugt mit Wasserstoff in Gegenwart von Palladium auf Kohle oder Platindioxid) darstellen lassen (Schema 1).
- Die vorliegende Erfindung betrifft somit ferner ein Verfahren zur Herstellung von α-Aminoketalen der Formel (V), worin bedeuten:
R1 und R2 H, (C1-C6)-Alkyl-, (C2-C6)-Alkenyl, (C2-C6)-Alkinyl, (C3-C6)-Cycloalkyl, (C4-C6)-Cycloalkenyl, Phenyl,
wobei Phenyl unsubstituiert oder unabhängig von einander mit bis zu zwei Resten aus der Gruppe mit bis zu zwei Resten aus der Gruppe F, Cl, Br, I, NR11R12, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert ist mit
R11, R12 unabhängig voneinander (C1-C4)-Alkyl, Benzyl, 4-Methoxybenzyl;
und
wobei die Kohlenstoffketten unsubstituiert sind oder unabhängig voneinander mit 1 – 9 F-Atomen oder mit bis zu zwei Resten aus der Gruppe NR11R12, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert sind mit
R11, R12 unabhängig voneinander (C1-C4)-Alkyl, Benzyl, 4-Methoxybenzyl;
oder
R1 und R2 zusammen mit den beiden Kohlenstoffatomen, an die sie gebunden sind, einen fünf- bis achtgliedrigen gesättigten oder eine Doppelbindungen enthaltenden Kohlenstoffring,
wobei der Ring unsubstituiert oder unabhängig voneinander durch 1 – 12 F-Atome oder mit bis zu zwei Resten aus der Gruppe NR11R12, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert ist mit
R11, R12 unabhängig voneinander (C1-C4)-Alkyl, Benzyl, 4-Methoxybenzyl;
E (C1-C4)-Alkyl oder beide Reste E ein cyclisches Ketal ausbilden, in dem E-E (C2-C4)-Alkylen ist;
Hal Cl, Br, I
dadurch gekennzeichnet,
dass ein α-Halogenketon oder -aldehyd der Formel VI mit einem Azid unter Halogen-Azid-Austausch in das entsprechende α-Azidketon oder -aldehyd der Formel VII das anschließend mit ein- oder zweiwertigen Alkoholen unter Ketalisierung oder Acetalisierung zum α-Azidketal oder -acetal der Formel VIII umgesetzt wird, welches dann bevorzugt mit Wasserstoff in Gegenwart katalytischer Mengen Palladium auf Kohle oder Platindioxid zu Verbindungen der Formel V reduziert wird. - Weiterhin lassen sich Verbindungen der Formel I ausgehend von Cyanamiden der Formel III und α-Aminoketonen der Formel IX in protischen Solvenzien wie Ethanol darstellen.
- Alternativ kommt auch die zweistufige Umsetzung geeigneter 1,2-Diaminoalkylenderivate der Formel X mit Isothiocyanaten der Formel in XI in Frage.
- Der intermediär gebildete Thioharnstoff XII wird dann bevorzugt mit N,N'-Dicyclohexylcarbodiimid oder Methyliodid zu Verbindungen der Formel I cyclisiert.
- Bei der vorliegenden Erfindung konnte überraschend gezeigt werden, dass die beschriebenen Verbindungen potente Inhibitoren des Natrium-/ Wasserstoff-Austauschers (NHE) darstellen, insbesondere des NHE3.
- Bekannte NHE3-Inhibitoren leiten sich beispielsweise von Verbindungen des Acylguanidin-Typs (
EP 825 178 A DE 199 60 204 ), 2-Guanidino-chinazolin-Typs (WO 01 79 186 A1, WO 02 20496 A1) oder Benzamidin-Typs (WO 01 21582 A1, WO 01 72 742 A1) ab. Das ebenfalls als NHE3-Inhibitor beschriebene Squalamin (M. Donowitz et al. Am. J. Physiol. 276 (Cell Physiol. 45: C136 – C144) wirkt nicht unmittelbar wie die Verbindungen nach Formel I, sondern erreicht seine maximale Wirkstärke erst nach einer Stunde. - In der deutschen Patentanmeldung
DE 10163239 werden NHE3-Inhibitoren vom Imidazolidin-Typ vorgeschlagen, in der deutschen PatentanmeldungDE 10224892 vom Thiophen-Typ. NHE3-Inhibitoren vom 2-Phenylamino-benzimidazol-Typ werden in WO 02 46169 A1 beschrieben. Überraschend wurde nun gefunden, dass die hier beschriebenen Imidazol-Derivate der Formel I ebenfalls potente Inhibitoren des NHE3 darstellen und dabei vorteilhafte pharmakologische Eigenschaften besitzen. - Das den hier beschriebenen Verbindungen ähnliche Clonidin ist als schwacher NHE-Inhibitor bekannt. Allerdings ist seine Wirkung auf den NHE3 der Ratte mit einer IC50 von 620 μM äußerst moderat. Stattdessen weist es eine gewisse Selektivität für den NHE2 auf, an dem es eine IC50 von 42 μM besitzt (J. Orlowski et al J. Biol. Chem. 268, 25536). Es ist daher eher als NHE2-Inhibitor zu bezeichnen. Neben der schwachen NHE-Wirkung besitzt das Clonidin eine hohe Affinität zum adrenergen α2-Rezeptor und Imidazolin I1-Rezeptor, wodurch eine starke blutdrucksenkende Wirkung vermittelt wird (Ernsberger et al Eur. J. Pharmacol. 134, 1, 1987). Verbindungen der Formel I zeichnen sich gegenüber den Clonidinen durch gesteigerte NHE3-inhibierende Wirkung aus.
- Der NHE3 wird im Körper verschiedener Spezies bevorzugt in der Galle, dem Darm und in der Niere gefunden (Larry Fliegel et al, Biochem. Cell. Biol. 76: 735 – 741, 1998), ließ sich aber auch im Gehirn nachweisen (E. Ma et al. Neuroscience 79: 591 – 603).
- Aufgrund dieser unerwarteten NHE-inhibitorischen Eigenschaften eignen sich die Verbindungen der Formel I zur Prävention und Behandlung von Krankheiten, die durch eine Aktivierung bzw. durch einen aktivierten NHE verursacht werden. Die Verwendung der erfindungsgemäßen Verbindungen betrifft die Prävention und die Behandlung akuter und chronischer Krankheiten in der Veterinär- und in der Humanmedizin.
- So eignen sich die erfindungsgemäßen Inhibitoren des NHE zur Behandlung von Krankheiten, die durch Ischämie und / oder durch Reperfusion hervorgerufen werden.
- Die hier beschriebenen Verbindungen sind infolge ihrer pharmakologischen Eigenschaften als antiarrhythmische Arzneimittel mit cardioprotektiver Komponente zur Infarktprophylaxe und der Infarktbehandlung sowie zur Behandlung der angina pectoris hervorragend geeignet, wobei sie auch präventiv die pathophysiologischen Vorgänge beim Entstehen ischämisch induzierter Schäden, insbesondere bei der Auslösung ischämisch induzierter Herzarrhythmien, inhibieren oder stark vermindern. Wegen ihrer schützenden Wirkungen gegen pathologische hypoxische und ischämische Situationen können die erfindungsgemäß verwendeten Verbindungen der Formel I infolge Inhibition des zellulären Na+/H+-Austauschmechanismus als Arzneimittel zur Behandlung aller akuten oder chronischen durch Ischämie ausgelösten Schäden oder dadurch primär oder sekundär induzierten Krankheiten verwendet werden. Dies betrifft ihre Verwendung als Arzneimittel für operative Eingriffe, z.B. bei Organ-Transplantationen, wobei die Verbindungen sowohl für den Schutz der Organe im Spender vor und während der Entnahme, zum Schutz entnommener Organe beispielsweise bei Behandlung mit oder deren Lagerung in physiologischen Badflüssigkeiten, wie auch bei der Überführung in den Empfängerorganismus verwendet werden können. Die Verbindungen sind ebenfalls wertvolle, protektiv wirkende Arzneimittel bei der Durchführung angioplastischer operativer Eingriffe beispielsweise am Herzen wie auch an peripheren Gefäßen.
- Entsprechend ihrer protektiven Wirkung gegen ischämisch induzierte Schäden sind die Verbindungen auch als Arzneimittel zur Behandlung von Ischämien des Nervensystems, insbesondere des ZNS, geeignet, wobei sie z.B. zur Behandlung des Schlaganfalls oder des Hirnödems geeignet sind.
- Darüber hinaus eignen sich die erfindungsgemäß verwendeten Verbindungen der Formel I ebenfalls zur Behandlung von Formen des Schocks, wie beispielweise des allergischen, cardiogenen, hypovolämischen und des bakteriellen Schocks.
- Weiterhin induzieren die Verbindungen eine Verbesserung des Atemantriebes und werden deshalb zur Behandlung von Atmungszuständen bei folgenden klinischen Zuständen und Krankheiten herangezogen: Gestörter zentraler Atemantrieb (z. B. zentrale Schlafapnoen, plötzlicher Kindstod, postoperative Hypoxie), muskulärbedingte Atemstörungen, Atemstörungen nach Langzeitbeatmung, Atemstörungen bei Adaptation im Hochgebirge, obstruktive und gemischte Form der Schlafapnoen, akute und chronische Lungenkrankheiten mit Hypoxie und Hyperkapnie.
- Zusätzlich erhöhen die Verbindungen den Muskeltonus der oberen Atemwege, so dass das Schnarchen unterdrückt wird.
- Eine Kombination eines NHE-Inhibitors mit einem Carboanhydrase-Hemmer (z. B. Acetazolamid), wobei letzterer eine metabolische Azidose herbeiführt und dadurch bereits die Atmungstätigkeit steigert, erweist sich als vorteilhaft durch verstärkte Wirkung und verminderten Wirkstoffeinsatz.
- Außerdem eignen sich die hier beschriebenen Verbindungen als Medikamente zur Therapie und Prophylaxe von Erkrankungen und Störungen, die durch Übererregbarkeit des Zentralnervensystems ausgelöst werden, insbesondere zur Behandlung von Erkrankungen des epileptischen Formenkreises, zentral ausgelösten klonischen und tonischen Spasmen, psychischen Depressionszuständen, Angsterkrankungen und Psychosen. Dabei können die hier beschriebenen NHE-Inhibitoren allein angewandt werden oder in Kombination mit anderen antiepileptisch wirkenden Substanzen oder antipsychotischen Wirkstoffen, oder Carboanhydratasehemmern, beispielweise mit Acetazolamid, sowie mit weiteren Inhibitoren des NHE oder des Natrium-abhängigen Chlorid-Bicarbonat-Austauschers (NCBE).
- Es hat sich gezeigt, dass die erfindungsgemäß verwendeten Verbindungen eine milde abführende Wirkung besitzen und demzufolge vorteilhaft als Abführmittel oder bei drohender Darmverstopfung verwendet werden können.
- Außerdem können die erfindungsgemäßen Verbindungen vorteilhaft zur Prävention und Therapie von akuten und chronischen Erkrankungen des Darmtrakts verwendet werden, die durch ischämische Zustände im Intestinalbereich und / oder durch nachfolgende Reperfusion ausgelöst werden. Solche Komplikationen können beispielweise durch mangelnde Darmperistaltik hervorgerufen werden, wie sie z.B. häufig nach chirurgischen Eingriffen, bei Darmverstopfung oder stark verminderter Darmtätigkeit zu beobachten sind.
- Weiterhin besteht die Möglichkeit, der Gallenstein-Bildung vorzubeugen.
- Darüber hinaus zeichnen sich die erfindungsgemäß verwendeten Verbindungen der Formel I durch starke inhibierende Wirkung auf die Proliferation von Zellen, beispielsweise der Fibroblasten-Zellproliferation und der Proliferation der glatten Gefäßmuskelzellen, aus. Deshalb kommen die Verbindungen der Formel I als wertvolle Therapeutika für Krankheiten in Frage, bei denen die Zellproliferation eine primäre oder sekundäre Ursache darstellt, und können deshalb als Antiatherosklerotika, Mittel gegen diabetische Spätkomplikationen, Mittel gegen das chronische Nierenversagen, Krebserkrankungen, fibrotische Erkrankungen des Herzens, sowie Lungenfibrose, Leberfibrose oder Nierenfibrose, Organhypertrophien und -hyperplasien, beispielsweise des Herzens und der Prostata verwendet werden, und somit zur Prävention und Behandlung der Herzinsuffizienz (congestive heart failure) oder bei Prostatahyperplasie bzw. Prostatahypertrophie benutzt werden. Die erfindungsgemäßen Verbindungen sind wirkungsvolle Inhibitoren des zellulären Natrium-Protonen-Antiporters (Na/H-Exchanger), der bei zahlreichen Erkrankungen (Essentielle Hypertonie, Atherosklerose, Diabetes usw.) auch in solchen Zellen erhöht ist, die Messungen leicht zugänglich sind, wie beispielsweise in Erythrocyten, Thrombocyten oder Leukozyten. Die erfindungsgemäß verwendeten Verbindungen eignen sich deshalb als hervorragende und einfache wissenschaftliche Werkzeuge, beispielsweise in ihrer Verwendung als Diagnostika zur Bestimmung und Unterscheidung bestimmter Formen der Hypertonie, aber auch der Atherosklerose, des Diabetes und diabetischer Spätkomplikationen, proliferativer Erkrankungen usw.
- Darüber hinaus sind die Verbindungen der Formel I für die präventive Therapie zur Verhinderung der Genese und zur Behandlung des Bluthochdrucks, beispielweise der essentiellen Hypertonie, geeignet, da sie die Rückresorption von NaCl im tubulären System der Niere vermindern oder vollständig inhibieren. Entsprechend sind sie auch hervorragend als Kombinations- und Formulierungspartner für Arzneimittel geeignet, die zur Bluthochdruckbehandlung verwendet werden. So können beispielsweise thiazid-artig wirkende Diuretika, Loop-Diuretika, Aldosteron- und Pseudoaldosteron-Antagonisten, wie Hydrochlorothiazid, Indapamid, Polythiazid, Furosemid, Piretanid, Torasemid, Bumetanid, Amiloride, Triamteren kombiniert werden. Weiterhin können die NHE-Inhibitoren der vorliegenden Erfindung in Kombination mit ACE-Hemmern, wie beispielsweise Ramipril, Enalapril oder Captopril verwendet werden. Weitere günstige Kombinationspartner sind auch β-Blocker.
- Die beschriebenen NHE-Inhibitoren können ebenfalls in der Prävention und zur Behandlung thrombotischer Erkrankungen verwendet werden, da sie als NHE-Inhibitoren sowohl die Plättchenaggregation selbst inhibieren können und darüber hinaus die überschießende Freisetzung von Gerinnungsmediatoren, insbesondere des von Willebrand Faktors hemmen bzw. verhindern können. Deshalb sind die NHE-Inhibitoren der vorliegenden Erfindung kombinierbar mit weiteren antikoagulativen Wirkstoffen wie beispielsweise Acetylsalizylsäure, Thrombinantagonisten, Faktor Xa-Antagonisten, fibrinolytisch wirkenden Arzneistoffen, Faktor-VIIa-Antagonisten usw. Eine kombinierte Anwendung der vorliegenden NHE-Inhibitoren mit NCBE-Inhibitoren ist besonders günstig.
- Es wurde außerdem gefunden, dass NHE-Inhibitoren eine günstige Beeinflussung der Serumlipoproteine zeigen. Es ist allgemein anerkannt, dass für die Entstehung arteriosklerotischer Gefäßveränderungen, insbesondere der koronaren Herzkrankheit, zu hohe Blutfettwerte, sogenannte Hyperlipoproteinämien, einen wesentlichen Risikofaktor darstellen. Für die Prophylaxe und die Regression von atherosklerotischen Veränderungen kommt daher der Senkung erhöhter Serum-Lipoproteine eine außerordentliche Bedeutung zu. Die erfindungsgemäß verwendeten Verbindungen können daher zur Prophylaxe und zur Regression von atherosklerotischen Veränderungen herangezogen werden, indem sie einen kausalen Risikofaktor ausschalten. Die erfindungsgemäßen Inhibitoren des NHE können in günstiger Weise auch mit anderen antiarteriosklerotischen Wirkstoffen kombiniert werden, wie einem Stoff aus der Klasse der Fibrate, einem Upregulator der LD2 Rezeptoraktivität, wie MD-700 und LY295427 oder einem Cholesterol- oder Gallensäure-Resorptionshemmer oder einem Antihyperchlesterolämikum aus der Klasse der Statine, wie beispielsweise Pravastatin, Lovastatin, Simvastatin.
- Mit diesem Schutz der Gefäße gegen das Syndrom der endothelialen Dysfunktion sind Verbindungen der Formel I wertvolle Arzneimittel zur Prävention und zur Behandlung koronarer Gefäßspasmen, peripherer Gefäßkrankheiten, wie claudicatio intermittens, der Atherogenese und der Atherosklerose, der linksventrikulären Hypertrophie und der dilatierten Kardiomyopathie, und thrombotischer Erkrankungen.
- Die genannten Verbindungen können ebenfalls zur Behandlung von Krankheiten verwendet werden, die durch Protozoen verursacht werden und eignen sich insbesondere als Antimalariamittel.
- Darüber hinaus eignen sich die Verbindungen zur Bekämpfung saugender Parasiten, wie Moskitos, Zecken, Flöhen und Pflanzenschädlingen.
- Entsprechend ihrer protektiven Wirkungen sind die Verbindungen auch als Arzneimittel zur Gesunderhaltung und Lebensverlängerung geeignet.
- Generell können die hier beschriebenen NHE-Inhibitoren in günstiger Weise mit anderen, den intrazellulären pH-regulierenden Verbindungen kombiniert werden, wobei Inhibitoren der Enzymgruppe der Carboanhydratase, Inhibitoren der Bicarbonationen transportierenden Systeme wie des Natrium-Bicarbonat-Cotransporters oder des Natrium abhängigen Chlorid-Bicarbonat-Austauschers, sowie andere NHE-Inhibitoren, beispielweise mit inhibitorischer Wirkung auf andere NHE-Subtypen, als Kombinationspartner infrage kommen, weil durch sie die pharmakologisch relevanten pH-regulierenden Effekte der hier beschriebenen NHE-inhibitoren verstärkt werden können.
- Die genannten Verbindungen finden deshalb vorteilhaft Verwendung zur Herstellung eines Medikaments zur Prävention und Behandlung von Schlafapnoen und muskulär bedingter Atemstörungen; zur Herstellung eines Medikaments zur Prävention und Behandlung des Schnarchens; zur Herstellung eines Medikaments zur Blutdrucksenkung; zur Herstellung eines Medikaments mit abführender Wirkung zur Prävention und Behandlung intestinaler Verstopfungen; zur Herstellung eines Medikaments zur Prävention und Behandlung von Erkrankungen, die durch Ischämie und Reperfusion von zentralen und peripheren Organen ausgelöst werden wie das akute Nierenversagen, der Schlaganfall, endogene Schockzustände, Darmerkrankungen etc.; zur Herstellung eines Medikamentes zur Behandlung diabetischer Spätschäden und chronischer Nierenerkrankungen, insbesondere von allen Nierenentzündungen (Nephritiden), die mit einer vermehrten Protein- /Albuminausscheidung verbunden sind; zur Herstellung eines Medikaments zur Behandlung von Hypercholesterinämie; zur Herstellung eines Medikaments zur Prävention der Atherogenese und der Atherosklerose; zur Herstellung eines Medikaments zur Prävention und Behandlung von Krankheiten, die durch erhöhte Cholesterinspiegel ausgelöst werden; zur Herstellung eines Medikaments zur Prävention und Behandlung von Krankheiten, die durch endotheliale Dysfunktion ausgelöst werden; zur Herstellung eines Medikaments zur Behandlung des Befalls durch Ektoparasiten; zur Herstellung eines Medikaments zur Behandlung der genannten Leiden in Kombinationen mit blutdrucksenkenden Stoffen, bevorzugt mit Angiotensin Converting Enzyme (ACE)-Hemmern, mit Diuretika, Aldosteron-Antagonisten und Angiotensin-Rezeptorantagonisten. Eine Kombination eines NHE-Inhibitors der Formel I mit einem blutfettspiegelsenkenden Wirkstoff, bevorzugt mit einem HMG-CoA-Reduktaseinhibitor (z. B. Lovastatin oder Pravastatin), wobei letzterer eine hypolipidämische Wirkung herbeiführt und dadurch die hypolipidämischen Eigenschaften des NHE-Inhibitors der Formel I steigert, erweist sich als günstige Kombination mit verstärkter Wirkung und vermindertem Wirkstoffeinsatz.
- Beansprucht wird die Gabe von Natrium-Protonen-Austausch-Hemmern der Formel I als neuartige Arzneimittel zur Senkung erhöhter Blutfettspiegel, sowie die Kombination von Natrium-Protonen-Austausch-Hemmern mit blutdrucksenkenden und/oder hypolipidämisch wirkenden Arzneimitteln.
- Die Erfindung betrifft auch Heilmittel für die humane, veterinäre oder phytoprotektive Anwendung enthaltend eine wirksame Menge einer Verbindung der Formel I und / oder eines pharmazeutisch verträglichen Salzes davon, ebenso wie Heilmittel für die humane, veterinäre oder phytoprotektive Anwendung enthaltend eine wirksame Menge einer Verbindung der Formel I und / oder eines pharmazeutisch verträglichen Salzes davon allein oder in Kombination mit anderen Pharmakologischen Wirkstoffen oder Arzneimitteln.
- Arzneimittel, die eine Verbindung I enthalten, können dabei oral, parenteral, intravenös, rektal, topisch oder durch Inhalation appliziert werden, wobei die bevorzugte Applikation von dem jeweiligen Erscheinungsbild der Erkrankung abhängig ist. Die Verbindungen I können dabei allein oder zusammen mit galenischen Hilfsstoffen zur Anwendung kommen, und zwar sowohl in der Veterinär- als auch in der Humanmedizin und im Pflanzenschutz.
- Welche Hilfsstoffe für die gewünschte Arzneimittelformulierung geeignet sind, ist dem Fachmann auf Grund seines Fachwissens geläufig. Neben Lösemitteln, Gelbildnern, Suppositorien-Grundlagen, Tablettenhilfsstoffen, und anderen Wirkstoffträgern können beispielsweise Antioxidantien, Dispergiermittel, Emulgatoren, Entschäumer, Geschmackskorrigentien, Konservierungsmittel, Lösungsvermittler oder Farbstoffe verwendet werden.
- Für eine orale Anwendungsform werden die aktiven Verbindungen mit den dafür geeigneten Zusatzstoffen, wie Trägerstoffen, Stabilisatoren oder inerten Verdünnungsmittel vermischt und durch die üblichen Methoden in die geeigneten Darreichungsformen gebracht, wie Tabletten, Dragees, Steckkapseln, wässrige, alkoholische oder ölige Lösungen. Als inerte Träger können z. B. Gummi arabicum, Magnesia, Magnesiumcarbonat, Kaliumphosphat, Milchzucker, Glucose oder Stärke, insbesondere Maisstärke, verwendet werden. Dabei kann die Zubereitung sowohl als Trocken- als auch als Feuchtgranulat erfolgen. Als ölige Trägerstoffe oder als Lösemittel kommen beispielsweise pflanzliche oder tierische Öle in Betracht, wie Sonnenblumenöl oder Lebertran.
- Zur subkutanen oder intravenösen Applikation werden die verwendeten aktiven Verbindungen, gewünschtenfalls mit den dafür üblichen Substanzen wie Lösungsvermittler, Emulgatoren oder weiteren Hilfsstoffen in Lösung, Suspension oder Emulsion gebracht. Als Lösungsmittel kommen z. B. in Frage: Wasser, Physiologische Kochsalzlösung oder Alkohole, z. B. Ethanol, Propanol, Glycerin, daneben auch Zuckerlösungen wie Glucose- oder Mannitlösungen, oder auch eine Mischung aus den verschiedenen genannten Lösungsmitteln.
- Als pharmazeutische Formulierung für die Verabreichung in Form von Aerosolen oder Sprays sind geeignet z. B. Lösungen, Suspensionen oder Emulsionen des Wirkstoffes der Formel I in einem pharmazeutisch unbedenklichen Lösungsmittel, wie insbesondere Ethanol oder Wasser, oder einem Gemisch solcher Lösungsmittel.
- Die Formulierung kann nach Bedarf auch noch andere pharmazeutische Hilfsstoffe wie Tenside, Emulgatoren und Stabilisatoren sowie ein Treibgas enthalten. Eine solche Zubereitung enthält den Wirkstoff üblicherweise in einer Konzentration von etwa 0,1 bis 10, insbesondere von etwa 0,3 bis 3 Gew.-%.
- Die Dosierung des zu verabreichenden Wirkstoffs der Formel I und die Häufigkeit der Verabreichung hängen von der Wirkstärke und Wirkdauer der verwendeten Verbindungen ab; außerdem auch von Art und Stärke der zu behandelnden Krankheit sowie von Geschlecht, Alter, Gewicht und individueller Ansprechbarkeit des zu behandelnden Säugers.
- Im Durchschnitt beträgt die tägliche Dosis einer Verbindung der Formel I bei einem etwa 75 kg schweren Patienten mindestens 0,001 mg/kg, vorzugsweise 0,1 mg/kg, bis höchstens 50 mg/kg, vorzugsweise 1 mg/kg Körpergewicht. Bei akuten Ausbrüchen der Krankheit, etwa unmittelbar nach Erleiden eines Herzinfarkts, können auch noch höhere und vor allem häufigere Dosierungen notwendig sein, z. B. bis zu 4 Einzeldosen pro Tag. Insbesondere bei i.v. Anwendung, etwa bei einem Infarktpatienten auf der Intensivstation können bis zu 200 mg/kg pro Tag notwendig werden.
- Pharmazeutisch verträgliche Salze werden z. B. über folgende Säuren hergestellt: aus anorganischen Säuren wie Salzsäure, Schwefelsäure oder Phosphorsäure oder aus organischen Säuren wie Essigsäure, Zitronensäure, Weinsäure, Milchsäure, Malonsäure, Methansulfonsäure, Fumarsäure. Als Säureadditionssalze kommen dabei Salze aller pharmakologisch verträglichen Säuren in Frage, beispielsweise Halogenide, insbesondere Hydrochloride, Lactate, Sulfate, Citrate, Tartrate, Acetate, Phosphate, Methylsulfonate, p-Toluolsulfonate, Adipinate, Fumarate, Gluconate, Glutamate, Glycerolphosphate, Maleinate und Pamoate (diese Gruppe entspricht auch den physiologisch akzeptablen Anionen); aber auch Trifluoracetate.
- Versuchsbeschreibungen und Beispiele:
- Liste der verwendeten Abkürzungen:
-
- Rt Retentionszeit
- TFA Trifluoressigsäure
- LCMS Liquid Chromatography Mass Spectroscopy
- MS Mass Spectroscopy
- Cl Chemical Ionisation
- ES Elektrospray
- Allgemeines:
- Die im Folgenden angegebenen Retentionszeiten (Rt) beziehen sich auf LCMS-Messungen mit den folgenden Parametern:
- Methode A:
stationäre Phase: Merck Purospher, 3μ, 2 × 55 mm
mobile Phase: 95% H2O (0,05% TFA) → 95% Acetonitril, 4 min; 95% Acetonitril, 1,5 min; → 5% Acetonitril, 1 min; 0,5 ml/min. - Methode B:
stationäre Phase: YMC J'sphere ODS H80, 2 × 33 mm
mobile Phase: 95% H2O (0,05% TFA) → 95% Acetonitril, 2,3 min; 95% Acetonitril, 1 min; → 5% Acetonitril, 0,1 min; 1 ml/min. - Methode C:
stationäre Phase: YMC J'sphere ODS H80, 2 × 33 mm
mobile Phase: 90% H2O (0,05% TFA) → 95% Acetonitril, 2,5 min; 95% Acetonitril, 0,8 min; → 10% Acetonitril; 0,05 min; 1 ml/min. - Methode D:
stationäre Phase: Merck Purospher, 3μ, 2 × 55 mm
mobile Phase: 95% H2O (0,1% HCOOH) → 95% Acetonitril (0,1% HCOOH), 5 min; → 95% Acetonitril (0,1% HCOOH), 2 min; → 95% H2O (0,1% HCOOH), 1 min; 0,45 ml/min. - Methode E:
stationäre Phase: YMC J'sphere ODS H80, 2 × 33 mm
mobile Phase: 98% H2O (0,05% TFA)+2% Acetonitril, 0,3 min; 98% H2O (0,05% TFA) → 95% Acetonitril, 2 min; 95% Acetonitril, 0,4 min; 1 ml/min. - Die präparative HPLC wurde unter folgenden Bedingungen durchgeführt:
stationäre Phase: Merck Purospher RP18 (10μM) 250 × 25 mm
mobile Phase: 90% H2O (0,05% TFA) → 90% Acetonitril, 40 min; 25 ml/min - (2,6-Dichlorphenyl)-(1H-imidazol-2-yl)-amin-Hydrochlorid wurde nach literaturbekannter Methode hergestellt (J. Med. Chem., 1975, 18, 90–99; Brit. 1,131,191).
MS-CI+: 228,1; LCMS-Rt (A) = 2,92 min - Phthalimid (3 g) wurde in trockenem Tetrahydrofuran (70 ml) gelöst und bei Raumtemperatur zu einer Suspension aus Natriumhydrid (539 mg) in Tetrahydrofuran (15 ml) getropft. Anschließend wurde eine Stunde auf 40°C erwärmt und dann eine Lösung aus Chloraceton (1,99 g) gelöst in Tetrahydrofuran (15 ml) zugetropft. Anschließend wurde das Gemisch 15 Stunden auf Rückflusstemperatur gehalten. Nach Abkühlen wurde auf ein Eis/Wasser-Gemisch gegeben und dreimal mit Essigester extrahiert. Die vereinigten organischen Phasen wurden einmal mit gesättigter Natriumchlorid-Lösung gewaschen und dann über Magnesiumsulfat getrocknet. Das Lösungsmittel wurde im Vakuum entfernt und der Rückstand über Kieselgel (n-Heptan/Essigester 2:1) chromatographiert. Es wurden 2,9 g der Titelverbindung isoliert.
MS-CI+: 204,2; LCMS-Rt (C) = 1,60 min - 2-(2-Oxo-propyl)-isoindol-1,3-dion (2,9 g) wurde in Toluol (60 ml) mit Ethylenglykol (1,71 ml) und para-Toluolsulfonsäure (271 mg) versetzt und 15 Stunden am Wasserabscheider erhitzt. Anschließend wurde im Vakkum zur Trockne gebracht und der Rückstand in Ethanol (120 ml) gelöst. Nach Zugabe von Hydrazin (1 g) wurde eine Stunde auf 65°C erhitzt und dann ein weiteres Gramm Hydrazin zugegeben. Nach weiteren 1,5 Stunden bei 65°C wurde das Heizen beendet. Nach Stehen über Nacht wurde der gebildete Niederschlag abgesaugt und das Filtrat im Vakuum eingeengt. Der Rückstand wurde in Ethanol aufgeschlämmt und erneut filtriert. Nach Einengen des Filtrats wurden 1,9 g des Amins erhalten, das direkt in der nächsten Stufe eingesetzt werden konnte.
MS-CI+: 118,2; LCMS-Rt (B) = 0,16 min - 2,6-Dichlorphenyl-cyanamid (100 mg, hergestellt, wie in J. Med. Chem., 1975, 18, 90–99 beschrieben) und C-(2-Methyl-[1,3]dioxolan-2-yl)-methylamin (69 mg) wurden im Kolben vermischt und 0,5 Stunden auf 150°C erhitzt. Das erkaltete Reaktionsgemisch wurde mit Wasser und Dichlormethan versetzt. Nach Trennen der Phasen wurde zweimal mit Dichlormethan extrahiert. Die vereinigten organischen Phasen wurden über Magnesiumsulfat getrocknet, filtriert und eingeengt. Der Rückstand wurde mittels präparativer HPLC gereinigt. Die Produkt enthaltenden Fraktionen wurden vereinigt, das Acetonitril am Rotationsverdampfer abgezogen und gefriergetrocknet. Es wurden 29 mg des gewünschten Guanidins erhalten.
MS-CI+: 304,2 ; LCMS-Rt (B) = 1,51 min - d) (2,6-Dichlorphenyl)-(4-methyl-1H-imidazol-2-yl)-amin-Hydrochlorid
- N-(2,6-Dichlorphenyl)-N'-(2-methyl-[1,3]dioxolan-2-ylmethyl)-guanidin – Trifluoressigsäuresalz (29 mg) wurde mit 1 ml konzentrierter Salzsäure versetzt und 30 min. auf 90°C erhitzt. Nach Abkühlen wurde mit Wasser verdünnt und mit Dichlormethan versetzt. Dann wurde mit gesättigter Natriumhydrogencarbonat-Lösung alkalisch gestellt und zweimal mit Dichlormethan extrahiert. Die vereinigten organischen Phasen wurden über Magnesiumsulfat getrocknet, filtriert und eingeengt. Der Rückstand wurde mit Salzsäure versetzt und gefriergetrocknet.
- Es wurden 14 mg der Titelverbindung erhalten.
MS-CI+: 242,2; LCMS-Rt (B) = 1,42 min - Ausgehend von 3-Brom-2-butanon wurde die Titelverbindung analog zu Beispiel 2 hergestellt.
MS-CI+: 256,2; LCMS-Rt (C)= 1,43 min - 1-Amino-1-phenylaceton-Hydrochlorid (189 mg), 2,6-Dichlorphenyl-cyanamid (187 mg, hergestellt, wie in J. Med. Chem., 1975, 18, 90–99 beschrieben) und Triethylamin (101 mg) wurden in Ethanol (10 ml) 3 Stunden auf Rückflusstemperatur gehalten. Nach Abkühlen wurde im Vakuum zur Trockne gebracht und über präparative HPLC gereinigt. Die Produkt enthaltenden Fraktionen wurden vereinigt, das Acetonitril am Rotationsverdampfer abgezogen, der wässrige Rückstand mit Kaliumcarbonat neutralisiert und dreimal mit Essigester extrahiert. Nach Trocknen über Magnesiumsulfat wurde zur Trockne gebracht und nach Zugabe von Salzsäure gefriergetrocknet. Es wurden 26 mg der Titelverbindung erhalten.
MS-CI+: 318,2; LCMS-Rt (A) = 4,14 min - 2-Chlorcyclohexanon (5 g) wurde in DMSO (10 ml) gelöst und Natriumazid (7,06 g) in DMSO (150 ml) gelöst langsam bei Raumtemperatur zugetropft. Anschließend wurde noch 60 Minuten bei Raumtemperatur gerührt. In das Reaktionsgemisch wurde Eiswasser gegeben und dann drei Mal mit n-Pentan (100 ml) extrahiert. Die vereinigten organischen Phasen wurden ein Mal mit Wasser gewaschen, über Magnesiumsulfat getrocknet und das Lösungsmittel nicht ganz zur Trockne eingeengt. Anschließend wurde mit Toluol koevaporiert, um restliches Pentan zu entfernen. Der Rückstand wurde mit abs. Toluol (120 ml) verdünnt, mit Ethylenglykol (4,8 g) und einer katalytischen Menge p-Toluolsulfonsäure versetzt und 5 Stunden am Wasserabscheider erhitzt. Nach Stehen über Nacht wurde weitere 6 Stunden am Wasserabscheider erhitzt. Außerdem wurden eine weitere Spatelspitze p-Toluolsulfonsäure und Ethylenglycol (6 ml) zugegeben. Anschließend wurde das Reaktionsgemisch mit Wasser gewaschen, und die organische Phase wurde noch einmal mit Toluol extrahiert. Die vereinigten organischen Phasen wurden über Magnesiumsulfat getrocknet und weitestgehend vom Lösungsmittel befreit. Der Rückstand wurde mit Methanol (40 ml) aufgenommen, in eine Schüttelapparatur überführt, mit Platindioxid (15 mg) versetzt und nach Zufuhr von Wasserstoff 2 Stunden hydriert. Das Platindioxid wurde abfiltriert und das Lösungsmittel eingeengt. Das Rohprodukt wurde über eine Kieselgelsäule chromatographiert (Laufmittel Dichlormethan/Methanol/konz. Ammoniak: 10:0,5:0,1). Es wurden 1,105 g eines öligen Produkts erhalten.
MS-ES+: 158,2; LCMS-Rt (E) = 0,38 min - 1,4-Dioxa-spiro[4.5]dec-6-ylamin (500 mg) wurde mit 2,6-Dichlorphenyl-cyanamid (595 mg, hergestellt, wie in J. Med. Chem., 1975, 18, 90–99 beschrieben) bei 130 ° C zur Reaktion gebracht. Nach 45 Minuten wurde die Reaktion abgebrochen und das Reaktionsprodukt über präparative HPLC gereinigt. Die Produkt enthaltenden Fraktionen wurden vereinigt, das Acetonitril am Rotationsverdampfer abgezogen, der wässrige Rückstand mit Kaliumcarbonat neutralisiert und dreimal mit Dichlormethan extrahiert. Nach Trocknen über Magnesiumsulfat wurde zur Trockne gebracht. Es wurden 476 mg des gewünschten Guanidins erhalten.
MS-ES+: 344,2; LCMS-Rt (D) = 2,10 min - c) (2,6-Dichlorphenyl)-(4,5,6,7-tetrahydro-1H-benzoimidazol-2-yl)-amin-Hydrochlorid
- N-(2,6-Dichlorphenyl)-N'-(1,4-dioxa-spiro[4.5]dec-6-yl)-guanidin 426 mg) wurde mit konzentrierter HCl (5 ml) versetzt und 5 Minuten bei Raumtemperatur gerührt. Der entstandene Niederschlag wurde abfiltriert und mit konzentrierter Salzsäure gewaschen. Bei der Verdünnung des Filtrats mit Wasser fiel erneut ein Niederschlag aus, der ebenfalls abfiltriert wurde. Die vereinigten Niederschläge ergaben 311 mg der gewünschten Verbindung.
MS-ES+: 282,19; LCMS-Rt (D) = 2,01 min - Diamino-maleinsäuredinitril (500 mg) wurde in absolutem Tetrahydrofuran (7,5 ml) gelöst und mit 2,6-Dichlorphenylisothiocyanat versetzt. Nach 3 Stunden Rühren bei Raumtemperatur und Stehenlassen über Nacht wurde das Lösungsmittel abgezogen und der Rückstand präparativ gereinigt. Die Produkt enthaltenden Fraktionen wurden vereinigt, das Acetonitril am Rotationsverdampfer abgezogen, der wässrige Rückstand mit Kaliumcarbonat neutralisiert und dreimal mit Essigester extrahiert.
- Nach Trocknen über Magnesiumsulfat wurde zur Trockne gebracht. Es wurden 73 mg des gewünschten Thioharnstoff-Intermediats erhalten. Dieses Produkt wurde mit N,N'-Dicyclohexylcarbodiimid (48 mg) in absolutem Tetrahydrofuran 5 Tage bei Raumtemperatur gerührt. Das Lösungsmittel wurde abgezogen und der Rückstand über präparative HPLC gereinigt. Die Produkt enthaltenden Fraktionen wurden vereinigt, das Acetonitril am Rotationsverdampfer abgezogen, der wässrige Rückstand mit Kaliumcarbonat neutralisiert und dreimal mit Essigester extrahiert. Nach Trocknen über Magnesiumsulfat wurde zur Trockne gebracht und der Rückstand gefriergetrocknet. Es wurden 16 mg des gewünschten Imidazols erhalten.
MS-CI+: 278,2; LCMS-Rt (B) = 2,14 min - 2,6-Dichlorphenyl-cyanamid (1 g, hergestellt, wie in J. Med. Chem., 1975, 18, 90–99 beschrieben) wurde in trockenem Dimethylformamid (25 ml) gelöst und mit gepulvertem Kaliumcarbonat (739 mg) versetzt. Nach fünf Minuten Rühren bei Raumtemperatur wurde Methyliodid (1,52 g) zugetropft und zwei Stunden bei Raumtemperatur gerührt. Nach Abziehen des Lösungsmittels wurde der Rückstand mit Wasser aufgenommen und drei Mal mit Ether extrahiert. Die vereinigten organischen Phasen wurde über Magnesiumsulfat getrocknet und filtriert. Nach Abziehen des Lösungsmittels wurde der Rückstand mittels präparativer HPLC gereinigt. Die Produkt enthaltenden Fraktionen wurden vereinigt, das Acetonitril am Rotationsverdampfer abgezogen, der wässrige Rückstand mit Kaliumcarbonat neutralisiert und drei Mal mit Essigester extrahiert. Nach Trocknen über Magnesiumsulfat wurde zur Trockne gebracht. Es wurden 600 mg des gewünschten Produkts erhalten.
MS-ES+: 201,1; LCMS-Rt (B) = 2,23 min - Zu einer siedenden Lösung aus 1,4-Dioxa-spiro[4.5]dec-6-ylamin (195 mg, Beispiel 5) in trockenem THF (5 ml) wurde eine Lösung aus (2,6-Dichlorphenyl)-methyl-cyanamid (25 mg) gelöst in trockenem Tetrahydrofuran (5 ml) getropft und das Tetrahydrofuran im Vakuum entfernt. Der Rückstand wurde dann 15 Minuten im Ölbad bei 130°C erhitzt und anschließend mittels präparativer HPLC gereinigt. Die Produkt enthaltenden Fraktionen wurden vereinigt, das Acetonitril am Rotationsverdampfer abgezogen, der wässrige Rückstand mit Kaliumcarbonat neutralisiert und dreimal mit Essigester extrahiert. Nach Trocknen über Magnesiumsulfat wurde zur Trockne gebracht und der Rückstand gefriergetrocknet. Es wurden 18 mg des gewünschten Produkts erhalten.
MS-ES+: 358,4; LCMS-Rt (E) = 1,48 min - c) (2,6-Dichlorphenyl)-methyl-(4,5,6,7-tetrahydro-1H-benzoimidazol-2-yl)-amin-Hydrochlorid
- Zu N-(2,6-Dichlorphenyl)-N'-(1,4-dioxa-spiro[4.5]dec-6-yl)-N-methyl-guanidin (18 mg) wurde konzentrierte HCl (1 ml) gegeben. Nach 10 Minuten wurde mit Wasser verdünnt und gefriergetrocknet. Das erhaltene Produkt wurde drei Mal mit Toluol koevaporiert.
- Es wurden 16 mg der Titelverbindung erhalten.
MS-ES+: 296,17; LCMS-Rt (D) = 2,12 min - Pharmakologische Daten:
- Testbeschreibung:
- In diesem Test wurde die Erholung des intrazellulären pHs (pHi) nach einer Ansäuerung ermittelt, die bei funktionsfähigem NHE3 auch unter bicarbonatfreien Bedingungen einsetzt. Dazu wurde der pHi mit dem pH-sensitiven Fluoreszenzfarbstoff BCECF (Calbiochem, eingesetzt wird die Vorstufe BCECF-AM) bestimmt. Die Zellen (Fibroblasten, LAP1 Zellen) wurden zunächst mit BCECF beladen. Die BCECF-Fluoreszenz wurde in einem "Ratio Fluorescence Spectrometer" (Photon Technology International, South Brunswick, N.J., USA) bei Anregungswellenlängen von 505 und 440 nm und einer Emissionswellenlänge von 535 nm bestimmt und mittels Kalibrierungskurven in den pHi umgerechnet. Die Zellen wurden bereits bei der BCECF-Beladung in NH4Cl-Puffer (pH 7,4) inkubiert (NH4Cl-Puffer: 115 mM NaCl, 20 mM NH4Cl, 5 mM KCl, 1 mM CaCl2, 1 mM MgSO4, 20 mM Hepes, 5 mM Glucose, 1 mg/ml BSA; mit 1 M NaOH wird ein pH von 7,4 eingestellt). Die intrazelluläre Ansäuerung wurde durch Zugabe von 975 μl eines NH4Cl-freien Puffers (s. u.) zu 25 μl Aliquots der in NH4Cl-Puffer inkubierten Zellen induziert. Die nachfolgende Geschwindigkeit der pH-Erholung wurde drei Minuten registriert. Für die Berechnung der inhibitorischen Potenz der getesteten Substanzen wurden die Zellen zunächst in Puffern untersucht, bei denen eine vollständige bzw. überhaupt keine pH-Erholung stattfand. Zur vollständigen pH-Erholung (100%) wurden die Zellen in Na+-haltigem Puffer inkubiert (133,8 mM NaCl, 4,7 mM KCl, 1,25 mM CaCl2, 1,25 mM MgCl2, 0,97 mM Na2HPO4, 0,23 mM NaH2PO4, 5 mM Hepes, 5 mM Glucose, mit 1 M NaOH wird ein pH von 7,0 eingestellt). Für die Bestimmung des 0%-Wertes wurden die Zellen in einem Na+-freien Puffer inkubiert (133,8 mM Cholinchlorid, 4,7 mM KCl, 1,25 mM CaCl2, 1,25 mM MgCl2, 0,97 mM K2HPO4, 0,23 mM KH2PO4, 5 mM Hepes, 5 mM Glucose, mit 1 M KOH wird ein pH von 7,0 eingestellt). Die zu testenden Substanzen wurden in dem Na+-haltigem Puffer angesetzt. Die Erholung des intrazellulären pH's bei jeder getesteten Konzentration einer Substanz wurde in Prozent der maximalen Erholung ausgedrückt. Aus den Prozentwerten der pH-Erholung wurde mittels des Programms Sigma-Plot der IC50-Wert der jeweiligen Substanz für die einzelnen NHE-Subtypen berechnet.
Claims (36)
- Verbindungen der Formel I, worin bedeuten: R1 und R2 zusammen mit den beiden Kohlenstoffatomen, an die sie gebunden sind, einen fünf- bis achtgliedrigen; eine oder zwei Doppelbindungen enthaltenden Kohlenstoffring, wobei der Ring unsubstituiert oder unabhängig voneinander durch 1 – 12 F-Atome oder bis zu zwei Resten aus der Gruppe OH, NR9R10, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert ist mit R9, R10 unabhängig voneinander H, (C1-C4)-Alkyl; oder R1 und R2 unabhängig voneinander H, (C1-C4)-Alkyl, CN, Phenyl wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind; wobei R1 und R2 nicht beide gleichzeitig Wasserstoff entsprechen; R3 bis R7 unabhängig voneinander H, F, Cl, Br, I, (C1-C4)-Alkyl, oder (C1-C4)-Alkoxy, wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind; wobei R3 und R7 nicht beide gleichzeitig Wasserstoff entsprechen; R8 H, (C1-C4)-Alkyl, (C3-C5)-Cycloalkyl, wobei die Kohlenstoffketten oder -ringe unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind; sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze; wobei R1 und R2 nicht beide gleichzeitig Methyl sind, wenn R3 Cl und R4 bis R8 Wasserstoff sind.
- Verbindungen der Formel I nach Anspruch 1, worin bedeuten: R1 und R2 zusammen mit den beiden Kohlenstoffatomen, an die sie gebunden sind, einen fünf- bis achtgliedrigen, eine oder zwei Doppelbindungen enthaltenden Kohlenstoffring, wobei der Ring unsubstituiert oder durch 1 – 12 F-Atome oder bis zu zwei Resten aus der Gruppe CF3 oder OCH3 substituiert ist; R3 bis R7 unabhängig voneinander H, F, Cl, Br, (C1-C4)-Alkyl, oder (C1-C4)-Alkoxy, wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind; wobei R3 und R7 nicht beide gleichzeitig Wasserstoff entsprechen; R8 H, (C1-C4)-Alkyl, (C3-C5)-Cycloalkyl, wobei die Kohlenstoffketten oder -ringe unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind; sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze.
- Verbindungen der Formel I nach Anspruch 2, worin bedeuten: R1 und R2 zusammen mit den beiden Kohlenstoffatomen, an die sie gebunden sind, einen fünf- bis siebengliedrigen, eine Doppelbindung enthaltenden Kohlenstoffring; R3 und R7 unabhängig voneinander F, Cl, Br oder (C1-C4)-Alkyl, wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind; R4 bis R6 H; R8 H, (C1-C4)-Alkyl, wobei die Kohlenstoffketten unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind; sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze.
- Verbindungen nach Anspruch 3, dadurch gekennzeichnet, dass sie ausgewählt sind aus der Gruppe: (2,6-Dichlorphenyl)-(4,5,6,7-tetrahydro-1H-benzoimidazol-2-yl)-amin-Hydrochlorid (2,6-Dichlorphenyl)-methyl-(4,5,6,7-tetrahydro-1H-benzoimidazol-2-yl)-amin-Hydrochlorid
- Verbindungen der Formel I nach Anspruch 1, worin bedeuten: R1 und R2 unabhängig voneinander H, (C1-C4)-Alkyl, CN, Phenyl, wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind; wobei beide Reste R1 und R2 nicht gleichzeitig Wasserstoff entsprechen; R3 bis R7 unabhängig voneinander H, F, Cl, Br, (C1-C4)-Alkyl, wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind; wobei die Reste R3 und R7 nicht gleichzeitig Wasserstoff entsprechen; R8 H, (C1-C4)-Alkyl, (C3-C5)-Cycloalkyl, wobei die Kohlenstoffketten oder -ringe unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind; sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze; wobei R1 und R2 nicht beide gleichzeitig Methyl sind, wenn R3 Cl und R4 bis R8 Wasserstoff sind.
- Verbindungen der Formel I nach Anspruch 5, worin bedeuten: R1 und R2 unabhängig voneinander H, (C1-C4)-Alkyl, R3 und R7 unabhängig voneinander F, Cl, Br, (C1-C4)-Alkyl, wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind; R4 bis R6 H R8 H, (C1-C4)-Alkyl, wobei die Kohlenstoffketten unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind; sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäuresalze; wobei R1 und R2 nicht beide gleichzeitig Methyl sind, wenn R3 Cl und R4 bis R8 Wasserstoff sind.
- Verbindungen nach Anspruch 6, dadurch gekennzeichnet, dass sie ausgewählt sind aus der Gruppe: (2,6-Dichlorphenyl)-(4-methyl-1H-imidazol-2-yl)-amin-Hydrochlorid (2,6-Dichlorphenyl)-(4,5-dimethyl-1H-imidazol-2-yl)-amin-Hydrochlorid
- Verbindungen der Formel I und deren pharmazeutisch verträgliche Salze nach einem oder mehreren der Ansprüche 1 bis 7 zur Verwendung als Medikament.
- Verbindungen der Formel I und/oder deren pharmazeutisch verträgliche Salze nach einem oder mehreren Anspruch 1 bis 7 zur Behandlung oder Prophylaxe von Störungen des Atemantriebs, von Atemstörungen, insbesondere Schlaf-bedingten Atemstörungen wie Schlafapnoen, von Schnarchen, von akuten und chronischen Nierenerkrankungen, besonders des akuten Nierenversagens und des chronischen Nierenversagens, von Störungen der Darmfunktion, des Bluthochdrucks, insbesondere der essentiellen Hypertonie, von Erkrankungen des Zentralnervensystems, insbesondere von Erkrankungen, die durch ZNS-Übererregbarkeit resultieren, wie Epilepsie und zentral ausgelöste Krämpfe oder von Angstzuständen, Depressionen und Psychosen, von ischämischen Zuständen des peripheren und zentralen Nervensystems und des Schlaganfalls, von akuten und chronischen Schäden und Erkrankungen peripherer Organe und Gliedmaßen, die durch Ischämie- oder durch Reperfusionsereignisse verursacht werden, von Atherosklerose, von Störungen des Fettstoffwechsels, von Thrombosen, von Störungen der Gallenfunktion, von Befall durch Ektoparasiten, von Erkrankungen infolge endothelialer Dysfunktion, von Protozoen-Erkrankungen, insbesondere der Malaria, zur Konservierung und Lagerung von Transplantaten für chirurgische Maßnahmen, für den Einsatz bei chirurgischen Operationen und Organtransplantationen, zur Behandlung von Schockzuständen, der Zuckerkrankheit und diabetischer Spätschäden, von Krankheiten, bei denen die Zellproliferation eine primäre oder sekundäre Ursache darstellt und zur Gesunderhaltung und Lebensverlängerung.
- Heilmittel für die humane, veterinäre oder phytoprotektive Anwendung enthaltend eine wirksame Menge einer oder mehreren Verbindungen der Formel I und/oder deren pharmazeutisch verträgliche Salze nach einem oder mehreren der Ansprüche 1 bis 7.
- Heilmittel für die humane, veterinäre oder phytoprotektive Anwendung enthaltend eine wirksame Menge einer oder mehrerer Verbindungen der Formel I und/oder deren pharmazeutisch verträgliche Salze nach einem oder mehreren der Ansprüche 1 bis 7 allein oder in Kombination mit anderen Pharmakologischen Wirkstoffen oder Arzneimitteln.
- Verwendung von Verbindungen der Formel I und/oder von deren pharmazeutisch verträglichen Salzen zur Herstellung eines Medikamentes zur Behandlung von Krankheiten, welche durch NHE-Inhibitoren beeinflusst werden können, worin bedeuten: R1 und R2 unabhängig voneinander H, F, Cl, Br, I, CN, (C1-C6)-Alkyl-, (C2-C6)-Alkenyl, (C2-C6)-Alkinyl, (C3-C6)-Cycloalkyl, (C4-C6)-Cycloalkenyl, Phenyl, wobei Phenyl unsubstituiert oder unabhängig von einander mit bis zu zwei Resten aus der Gruppe F, Cl, Br, I, OH, NR9R10, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert ist mit R9, R10 unabhängig voneinander H, (C1-C4)-Alkyl; und wobei die Kohlenstoffketten oder -ringe unsubstituiert oder unabhängig voneinander mit 1 – 13 F-Atomen oder mit bis zu zwei Resten aus der Gruppe OH, NR9R10, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert sind mit R9, R10 unabhängig voneinander H, (C1-C4)-Alkyl; oder R1 und R2 zusammen mit den beiden Kohlenstoffatomen, an die sie gebunden sind, einen fünf- bis achtgliedrigen, eine oder zwei Doppelbindungen enthaltenden Kohlenstoffring, wobei der Ring unsubstituiert oder unabhängig voneinander durch 1 – 12 F-Atome oder bis zu zwei Resten aus der Gruppe NR9R10, (C1-C4)-Alkyl, OH, CN, CF3 oder (C1-C4)-Alkoxy substituiert ist mit R9, R10 unabhängig voneinander H, (C1-C4)-Alkyl; R3 bis R7 unabhängig voneinander H, F, Cl, Br, I, (C1-C4)-Alkyl, (C2-C4)-Alkenyl, (C3-C6)-Cycloalkyl, OH, (C1-C4)-Alkoxy, CN, NO2, NH2, (C1-C4)-Alkylamino, (C1-C4)-Dialkylamino; wobei die Kohlenstoffketten oder -ringe unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen substituiert sind; wobei R3 und R7 nicht gleichzeitig Wasserstoff entsprechen; R8 H, (C1-C4)-Alkyl, (C3-C5)-Cycloalkyl, wobei die Kohlenstoffketten oder -ringe unsubstituiert oder mit 1 – 9 F-Atomen substituiert sind; sowie deren pharmazeutisch verträgliche Salze und Trifluoressigsäure-salze.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von Störungen des Atemantriebs.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von Atemstörungen, insbesondere Schlaf-bedingten Atemstörungen wie Schlafapnoen.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe des Schnarchens.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder zur Prophylaxe von akuten und chronischen Nierenerkrankungen, besonders des akuten Nierenversagens und des chronischen Nierenversagens.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von Störungen der Darmfunktion.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe des Bluthochdrucks, insbesondere der essentiellen Hypertonie.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von Erkrankungen des Zentralnervensystems, insbesondere von Erkrankungen, die durch ZNS-Übererregbarkeit resultieren, wie Epilepsie und zentral ausgelöste Krämpfe.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von Erkrankungen des Zentralnervensystems, insbesondere von Angstzuständen, Depressionen und Psychosen.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von ischämischen Zuständen des peripheren und zentralen Nervensystems und des Schlaganfalls.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von akuten und chronischen Schäden und Erkrankungen peripherer Organe und Gliedmaßen, die durch Ischämie- oder durch Reperfusionsereignisse verursacht werden.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Konservierung und Lagerung von Transplantaten für chirurgische Maßnahmen.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments für den Einsatz bei chirurgischen Operationen und Organtransplantationen.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung von Schockzuständen.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung der Zuckerkrankheit und diabetischer Spätschäden.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe der Atherosklerose.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von Störungen des Fettstoffwechsels.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung von Krankheiten, bei denen die Zellproliferation eine primäre oder sekundäre Ursache darstellt.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Prävention und Behandlung von Thrombosen.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von Störungen der Gallenfunktion.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe des Befalls durch Ektoparasiten.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von Erkrankungen infolge endothelialer Dysfunktion.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Gesunderhaltung und Lebensverlängerung.
- Verwendung einer Verbindung I und/oder deren pharmazeutisch verträgliche Salze nach Anspruch 12 zur Herstellung eines Medikaments zur Behandlung oder Prophylaxe von Protozoen-Erkrankungen, insbesondere der Malaria.
- Verfahren zur Herstellung von α-Aminoketalen der Formel (V) worin bedeuten: R1 und R2 unabhängig voneinander H, (C1-C6)-Alkyl-, (C2-C6)-Alkenyl, (C2-C6)-Alkinyl, (C3-C6)-Cycloalkyl, (C4-C6)-Cycloalkenyl, Phenyl, wobei Phenyl unsubstituiert oder unabhängig von einander mit bis zu zwei Resten aus der Gruppe mit bis zu zwei Resten aus der Gruppe F, Cl, Br, I, NR11R12, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert ist mit R11, R12 unabhängig voneinander (C1-C4)-Alkyl, Benzyl, 4-Methoxybenzyl; und wobei die Kohlenstoffketten unsubstituiert oder unabhängig voneinander mit 1 – 9 F-Atomen oder mit bis zu zwei Resten aus der Gruppe mit bis zu zwei Resten aus der Gruppe NR11R12, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert sind mit R11, R12 unabhängig voneinander (C1-C4)-Alkyl, Benzyl, 4-Methoxybenzyl; oder R1 und R2 zusammen mit den beiden Kohlenstoffatomen, an die sie gebunden sind, einen fünf- bis achtgliedrigen gesättigten oder eine Doppelbindungen enthaltenden Kohlenstoffring, wobei der Ring unsubstituiert oder unabhängig voneinander durch 1 – 12 F-Atome oder mit bis zu zwei Resten aus der Gruppe NR11R12, (C1-C4)-Alkyl, CN, CF3 oder (C1-C4)-Alkoxy substituiert ist mit R11, R12 unabhängig voneinander (C1-C4)-Alkyl, Benzyl, 4-Methoxybenzyl; E (C1-C4)-Alkyl oder beide Reste E ein cyclisches Ketal ausbilden, in dem E-E (C2-C4)-Alkylen ist. Hal Cl, Br, I dadurch gekennzeichnet, dass ein α-Halogenketon oder -aldehyd der Formel VI mit einem Azid unter Azid-Halogen-Austausch in das entsprechende α-Azidketon oder -aldehyd der Formel VII überführt wird das anschließend mit ein- oder zweiwertigen Alkoholen unter Ketalisierung oder Acetalisierung zum α-Azidketal oder -acetal der Formel VIII umgesetzt wird, welches dann zu Verbindungen der Formel V reduziert wird.
Priority Applications (18)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE10304374A DE10304374A1 (de) | 2003-02-04 | 2003-02-04 | Neue substituierte 2-Aminoimidazole, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| MXPA05007968A MXPA05007968A (es) | 2003-02-04 | 2004-01-20 | Nuevos 2-aminoimidazoles sustituidos, procedimiento para su preparacion, su uso como medicamento o ayuda al diagnostico, y medicamento que los contiene. |
| JP2006501561A JP4630269B2 (ja) | 2003-02-04 | 2004-01-20 | 新規な置換された2−アミノイミダゾール、その製造方法、その医薬または診断薬としての使用、および、その化合物を含有する医薬品 |
| CA002514028A CA2514028A1 (en) | 2003-02-04 | 2004-01-20 | Substituted 2-aminoimidazoles, method for the production thereof, their use as a medicament or as a diagnostic reagent, and medicament containing these compounds |
| AT04703371T ATE375982T1 (de) | 2003-02-04 | 2004-01-20 | Substituierte 2-aminoimidazole, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie diese enthaltendes medikament |
| DE502004005260T DE502004005260D1 (de) | 2003-02-04 | 2004-01-20 | Substituierte 2-aminoimidazole, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie diese enthaltendes medikament |
| EP07014956A EP1857445B1 (de) | 2003-02-04 | 2004-01-20 | Substituierte 2-Aminoimidazole, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| DE502004009771T DE502004009771D1 (de) | 2003-02-04 | 2004-01-20 | Substituierte 2-Aminoimidazole, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| EP04703371A EP1592669B1 (de) | 2003-02-04 | 2004-01-20 | Substituierte 2-aminoimidazole, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie diese enthaltendes medikament |
| AU2004208870A AU2004208870A1 (en) | 2003-02-04 | 2004-01-20 | Substituted 2-aminoimidazoles, method for the production thereof, their use as a medicament or as a diagnostic reagent, and medicament containing these compounds |
| PCT/EP2004/000394 WO2004069806A2 (de) | 2003-02-04 | 2004-01-20 | Substituierte 2-aminoimidazole, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie sie enthaltendes medikament |
| BR0407212-0A BRPI0407212A (pt) | 2003-02-04 | 2004-01-20 | 2-aminoimidazóis substituìdos, processos para a sua preparação, sua aplicação como medicamento ou diagnóstico bem como o medicamento contendo os mesmos |
| PE2004000108A PE20040943A1 (es) | 2003-02-04 | 2004-01-28 | 2-AMINOIMIDAZOLES SUSTITUIDOS COMO INHIBIDORES DEL INTERCAMBIADOR Na/H SUBTIPO 3 (NHE 3) |
| TW093102254A TW200508206A (en) | 2003-02-04 | 2004-02-02 | Novel substituted 2-aminoimidazoles, process for their preparation, their use as medicament or diagnostic aid, and medicament containing them |
| ARP040100314A AR049671A1 (es) | 2003-02-04 | 2004-02-02 | 2-aminoimidazoles sustituidos, procedimiento para su preparacion, su uso como medicamento o ayuda al diagnostico, y medicamento que los contiene |
| US10/771,185 US7442717B2 (en) | 2003-02-04 | 2004-02-03 | Substituted 2-aminoimidazoles, process for their preparation, their use as medicament or diagnostic aid |
| US12/172,380 US20080275098A1 (en) | 2003-02-04 | 2008-07-14 | Novel substituted 2-aminoimidazoles, process for their preparation, their use as medicament or diagnostic aid |
| JP2010196422A JP2011016825A (ja) | 2003-02-04 | 2010-09-02 | 新規な置換された2−アミノイミダゾール、その製造方法、その医薬または診断薬としての使用、および、その化合物を含有する医薬品 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE10304374A DE10304374A1 (de) | 2003-02-04 | 2003-02-04 | Neue substituierte 2-Aminoimidazole, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| DE10304374A1 true DE10304374A1 (de) | 2004-08-05 |
Family
ID=32667986
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE10304374A Withdrawn DE10304374A1 (de) | 2003-02-04 | 2003-02-04 | Neue substituierte 2-Aminoimidazole, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| DE502004005260T Expired - Lifetime DE502004005260D1 (de) | 2003-02-04 | 2004-01-20 | Substituierte 2-aminoimidazole, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie diese enthaltendes medikament |
| DE502004009771T Expired - Lifetime DE502004009771D1 (de) | 2003-02-04 | 2004-01-20 | Substituierte 2-Aminoimidazole, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE502004005260T Expired - Lifetime DE502004005260D1 (de) | 2003-02-04 | 2004-01-20 | Substituierte 2-aminoimidazole, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie diese enthaltendes medikament |
| DE502004009771T Expired - Lifetime DE502004009771D1 (de) | 2003-02-04 | 2004-01-20 | Substituierte 2-Aminoimidazole, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US7442717B2 (de) |
| EP (2) | EP1857445B1 (de) |
| JP (2) | JP4630269B2 (de) |
| AR (1) | AR049671A1 (de) |
| AT (1) | ATE375982T1 (de) |
| AU (1) | AU2004208870A1 (de) |
| BR (1) | BRPI0407212A (de) |
| CA (1) | CA2514028A1 (de) |
| DE (3) | DE10304374A1 (de) |
| MX (1) | MXPA05007968A (de) |
| PE (1) | PE20040943A1 (de) |
| TW (1) | TW200508206A (de) |
| WO (1) | WO2004069806A2 (de) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007083207A1 (en) * | 2006-01-19 | 2007-07-26 | Pfizer Limited | Substituted imidazoles and their use as pesticides |
| CN109422695A (zh) * | 2017-08-28 | 2019-03-05 | 扬子江药业集团有限公司 | 一种盐酸苯达莫司汀粗品的制备方法 |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050054705A1 (en) * | 2003-02-04 | 2005-03-10 | Aventis Pharma Deutschland Gmbh | N-substituted (benzoimidazol-2-yl) phenylamines, process for their preparation, their use as medicament or diagnostic aid, and medicament comprising them |
| WO2005107470A2 (en) * | 2004-04-29 | 2005-11-17 | University Of Florida Research Foundation, Inc. | Use of carbonic anhydrase inhibitors for insect control and malaria treatment |
| US20120088737A2 (en) * | 2009-10-02 | 2012-04-12 | Ajinomoto Co., Inc | Novel acyl guanidine derivatives |
| PL3173408T3 (pl) | 2014-07-25 | 2019-05-31 | Taisho Pharma Co Ltd | Związek fenylotetrahydroizochinolinowy podstawiony heteroarylem |
| CN118619883B (zh) * | 2024-05-24 | 2025-11-11 | 河北圣泰材料股份有限公司 | 一种4,5-二氰基-2-三氟甲基咪唑锂的制备方法 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4275072A (en) * | 1978-08-16 | 1981-06-23 | Farmos Group, Ltd. | 2,6-Dichlorophenyl-substituted amino-imidazole derivatives and use as hypertensive agents |
| EP0254259A2 (de) * | 1986-07-21 | 1988-01-27 | Otsuka Pharmaceutical Factory, Inc. | p-Aminophenol-Derivate |
| WO1990014338A1 (en) * | 1989-05-20 | 1990-11-29 | Fisons Plc | Anti-inflammatory 4-aminophenol derivatives |
| WO1995019968A1 (en) * | 1994-01-24 | 1995-07-27 | Allergan | Aromatic 2-amino-imidazole derivatives as alpha-2a adrenoceptor agonists |
| WO2001021160A2 (en) * | 1999-09-23 | 2001-03-29 | Axxima Pharmaceuticals Aktiengesellschaft | Carboxymide and aniline derivatives as selective inhibitors of pathogens |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3459763A (en) * | 1966-01-25 | 1969-08-05 | Geigy Chem Corp | Certain amino imidazole derivatives |
| FI792511A7 (fi) * | 1978-08-16 | 1981-01-01 | Farmos Oy | Menetelmä terapeuttisia ominaisuuksia omaavien kemiallisten yhdisteiden valmistamiseksi. |
| DE19633966A1 (de) * | 1996-08-22 | 1998-02-26 | Hoechst Ag | Phenylsubstituierte Alkenylcarbonsäure-guanidine, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| DE19945302A1 (de) | 1999-09-22 | 2001-03-29 | Merck Patent Gmbh | Biphenylderivate als NHE-3-Inhibitoren |
| DE19960204A1 (de) * | 1999-12-14 | 2001-06-28 | Aventis Pharma Gmbh | Substituierte Norlbornylamino-Derivate, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| DE10015248A1 (de) | 2000-03-28 | 2001-10-04 | Merck Patent Gmbh | Bisamidino-Verbindungen als NHE-3 Inhibitoren |
| DE10019062A1 (de) | 2000-04-18 | 2001-10-25 | Merck Patent Gmbh | 2-Guanidino-4-aryl-chinazoline als NHE-3 Inhibitoren |
| DE10043667A1 (de) | 2000-09-05 | 2002-03-14 | Merck Patent Gmbh | 2-Guanidino-4-aryl-chinazoline |
| WO2002030358A2 (en) * | 2000-10-11 | 2002-04-18 | Tularik Inc. | Modulation of ccr4 function |
| DE10060292A1 (de) * | 2000-12-05 | 2002-06-20 | Aventis Pharma Gmbh | Verwendung substituierter Benzimidazole zur Herstellung eines Medikaments zur Behandlung von Krankheiten, welche durch Inhibierung des Na+/H+-Austauschers beeinflusst werden können und sie enthaltendes Medikament |
| US20030187045A1 (en) * | 2001-12-21 | 2003-10-02 | Uwe Heinelt | Substituted imidazolidines, process for their preparation, and their use as a medicament or diagnostic |
| US7049333B2 (en) * | 2002-06-04 | 2006-05-23 | Sanofi-Aventis Deutschland Gmbh | Substituted thiophenes: compositions, processes of making, and uses in disease treatment and diagnosis |
-
2003
- 2003-02-04 DE DE10304374A patent/DE10304374A1/de not_active Withdrawn
-
2004
- 2004-01-20 AT AT04703371T patent/ATE375982T1/de not_active IP Right Cessation
- 2004-01-20 JP JP2006501561A patent/JP4630269B2/ja not_active Expired - Fee Related
- 2004-01-20 CA CA002514028A patent/CA2514028A1/en not_active Abandoned
- 2004-01-20 EP EP07014956A patent/EP1857445B1/de not_active Expired - Lifetime
- 2004-01-20 DE DE502004005260T patent/DE502004005260D1/de not_active Expired - Lifetime
- 2004-01-20 EP EP04703371A patent/EP1592669B1/de not_active Expired - Lifetime
- 2004-01-20 WO PCT/EP2004/000394 patent/WO2004069806A2/de not_active Ceased
- 2004-01-20 BR BR0407212-0A patent/BRPI0407212A/pt not_active IP Right Cessation
- 2004-01-20 MX MXPA05007968A patent/MXPA05007968A/es unknown
- 2004-01-20 AU AU2004208870A patent/AU2004208870A1/en not_active Abandoned
- 2004-01-20 DE DE502004009771T patent/DE502004009771D1/de not_active Expired - Lifetime
- 2004-01-28 PE PE2004000108A patent/PE20040943A1/es not_active Application Discontinuation
- 2004-02-02 TW TW093102254A patent/TW200508206A/zh unknown
- 2004-02-02 AR ARP040100314A patent/AR049671A1/es unknown
- 2004-02-03 US US10/771,185 patent/US7442717B2/en not_active Expired - Fee Related
-
2008
- 2008-07-14 US US12/172,380 patent/US20080275098A1/en not_active Abandoned
-
2010
- 2010-09-02 JP JP2010196422A patent/JP2011016825A/ja not_active Abandoned
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4275072A (en) * | 1978-08-16 | 1981-06-23 | Farmos Group, Ltd. | 2,6-Dichlorophenyl-substituted amino-imidazole derivatives and use as hypertensive agents |
| EP0254259A2 (de) * | 1986-07-21 | 1988-01-27 | Otsuka Pharmaceutical Factory, Inc. | p-Aminophenol-Derivate |
| WO1990014338A1 (en) * | 1989-05-20 | 1990-11-29 | Fisons Plc | Anti-inflammatory 4-aminophenol derivatives |
| WO1995019968A1 (en) * | 1994-01-24 | 1995-07-27 | Allergan | Aromatic 2-amino-imidazole derivatives as alpha-2a adrenoceptor agonists |
| WO2001021160A2 (en) * | 1999-09-23 | 2001-03-29 | Axxima Pharmaceuticals Aktiengesellschaft | Carboxymide and aniline derivatives as selective inhibitors of pathogens |
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007083207A1 (en) * | 2006-01-19 | 2007-07-26 | Pfizer Limited | Substituted imidazoles and their use as pesticides |
| US7544706B2 (en) | 2006-01-19 | 2009-06-09 | Pfizer Limited | Substituted imidazoles |
| US7547718B2 (en) | 2006-01-19 | 2009-06-16 | Pfizer Limited | Substituted imidazoles |
| US7592362B2 (en) | 2006-01-19 | 2009-09-22 | Pfizer Limited | Substituted imidazoles |
| US7825149B2 (en) | 2006-01-19 | 2010-11-02 | Pfizer Limited | Substituted imidazoles |
| EA015738B1 (ru) * | 2006-01-19 | 2011-10-31 | Пфайзер Лимитед | Замещенные имидазолы и их применение в качестве пестицидов |
| EP2423199A1 (de) * | 2006-01-19 | 2012-02-29 | Pfizer Limited | Substituierte Imidazole und ihre Verwendung als Pestizide |
| NO341141B1 (no) * | 2006-01-19 | 2017-08-28 | Zoetis Uk Ltd | Substituerte imidazoler og deres anvendelse som pesticider |
| CN109422695A (zh) * | 2017-08-28 | 2019-03-05 | 扬子江药业集团有限公司 | 一种盐酸苯达莫司汀粗品的制备方法 |
| CN109422695B (zh) * | 2017-08-28 | 2022-03-18 | 扬子江药业集团有限公司 | 一种盐酸苯达莫司汀粗品的制备方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| PE20040943A1 (es) | 2005-02-07 |
| WO2004069806A3 (de) | 2004-10-28 |
| WO2004069806A2 (de) | 2004-08-19 |
| CA2514028A1 (en) | 2004-08-19 |
| DE502004009771D1 (de) | 2009-08-27 |
| EP1592669B1 (de) | 2007-10-17 |
| US7442717B2 (en) | 2008-10-28 |
| BRPI0407212A (pt) | 2006-01-24 |
| MXPA05007968A (es) | 2005-09-20 |
| US20080275098A1 (en) | 2008-11-06 |
| EP1857445B1 (de) | 2009-07-15 |
| US20040259927A1 (en) | 2004-12-23 |
| AU2004208870A1 (en) | 2004-08-19 |
| EP1857445A3 (de) | 2007-12-19 |
| ATE375982T1 (de) | 2007-11-15 |
| JP4630269B2 (ja) | 2011-02-09 |
| JP2011016825A (ja) | 2011-01-27 |
| JP2006516576A (ja) | 2006-07-06 |
| DE502004005260D1 (de) | 2007-11-29 |
| TW200508206A (en) | 2005-03-01 |
| EP1857445A2 (de) | 2007-11-21 |
| EP1592669A2 (de) | 2005-11-09 |
| AR049671A1 (es) | 2006-08-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1341770B1 (de) | Substituierte 2-anilino-benzimidazole und ihre verwendung als nhe-inhibitoren | |
| US8067614B2 (en) | N-substituted (benzoimidazol-2-yl)phenylamines, processes for their preparation, their use as a medicament or diagnostic aid, and a medicament comprising them | |
| DE10046993A1 (de) | Substituierte Zimtsäureguanidide, Verfahren zur ihrer Herstellung, ihre Verwendung als Medikament sowie sie enthaltendes Medikament | |
| DE10226462A1 (de) | Fluorierte Cycloalkyl-derivatisierte Benzoylguanidine, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament, sowie sie enthaltendes Medikament | |
| EP1613600B1 (de) | Substituierte 4-phenyltetrahydroisochinoline, verfahren zu ihrer herstellung, ihre verwendung als medikament, sowie sie enthaltendes medikament | |
| EP1345902B1 (de) | Substituierte heterocyclo-norbornylamino-derivate, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie sie enthaltendes medikament | |
| US20080275098A1 (en) | Novel substituted 2-aminoimidazoles, process for their preparation, their use as medicament or diagnostic aid | |
| DE10224892A1 (de) | Substituierte Thiophene, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament | |
| DE4328352A1 (de) | Substituierte N,N'-Di-benzoylguanidine, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament | |
| EP1097140B1 (de) | Imidazolderivate mit biphenylsulfonylsubstitution, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie sie enthaltendes medikament | |
| EP1097141B1 (de) | Imidazolderivate mit biphenylsulfonylsubstitution, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum | |
| EP1592671B1 (de) | N-substituierte (benzoimidazol-2-yl)-phenyl-amine, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie sie enthaltendes medikament | |
| EP1461034B1 (de) | Substituierte imidazolidine, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie enthaltendes medikament | |
| EP1664058B1 (de) | Substituierte thienoimidazole, verfahren zu ihrer herstellung, ihre verwendung als medikament oder diagnostikum sowie sie enthaltende medikamente | |
| EP0895994A2 (de) | Sulfonamid-substituierte Pyranopyridine, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament | |
| DE4326005A1 (de) | Benzokondensierte 5-Ringheterocyclen, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament, ihre Verwendung als Diagnostikum, sowie sie enthaltendes Medikament |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| OM8 | Search report available as to paragraph 43 lit. 1 sentence 1 patent law | ||
| 8127 | New person/name/address of the applicant |
Owner name: SANOFI-AVENTIS DEUTSCHLAND GMBH, 65929 FRANKFURT, |
|
| 8130 | Withdrawal |