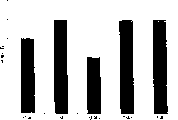CN1202127C - 癌症治疗中的免疫刺激剂细菌膜组分 - Google Patents
癌症治疗中的免疫刺激剂细菌膜组分 Download PDFInfo
- Publication number
- CN1202127C CN1202127C CNB008050503A CN00805050A CN1202127C CN 1202127 C CN1202127 C CN 1202127C CN B008050503 A CNB008050503 A CN B008050503A CN 00805050 A CN00805050 A CN 00805050A CN 1202127 C CN1202127 C CN 1202127C
- Authority
- CN
- China
- Prior art keywords
- precipitation
- purposes
- membrane component
- pharmaceutical composition
- gly
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/66—Microorganisms or materials therefrom
- A61K35/74—Bacteria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/164—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55516—Proteins; Peptides
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
本发明涉及革兰氏阴性细菌,尤其是肺炎克氏杆菌的膜组分在制备尤其用来治疗和预防癌症的免疫刺激剂型和/或能够诱导抗肿瘤免疫应答的药物组合物中的用途。本发明还包括制备所述膜组分和含有,尤其是与抗癌化合物联合的这些膜组分的药物组合物的方法。
Description
本发明涉及革兰氏阴性细菌,尤其是肺炎克氏杆菌(Klebsiellapneumoniae)膜组分在制备旨在尤其是用于治疗和预防癌症的免疫刺激剂型和/或能够诱导抗肿瘤免疫应答的药物组合物中的用途。本发明还包含制备所述膜组分,以及含有,尤其是与抗癌化合物联合的,这些膜组分的药物组合物的方法。
正常细胞转化成恶性细胞是许多可能自然发生的(例如突变或基因重排)或由化学、物理或病毒剂诱导的不同事件的结果。
肿瘤会被免疫活性细胞,尤其是淋巴细胞、树突细胞和巨噬细胞浸润。
肿瘤相关巨噬细胞(TAMs)起源于血液循环,并被细胞因子募集至肿瘤位置。在肿瘤位置,TAMs通过糖蛋白、糖和磷脂与肿瘤细胞结合并增殖(J.Natl.Cancer Inst.1998,90:1583)。在该处它们分泌许多促进其抗肿瘤活性的细胞因子。其中最重要的是TNF-α和IL-12。
TNF-α的抗肿瘤活性已在小鼠实验模型中得到阐明(Beyaert R.和Fiers W.,细胞因子(Cytokines),第24章,335-360,Academic Press,1998),并且已在人膀胱癌的治疗中进行过测试:单独地,TNF-α具有中等活性(Steinberg等,Ann.Oncol.,1992,3,741-745;欧洲泌尿学(Eur.Urol.)1992,22:112)。
由激活的巨噬细胞产生的IL-12通过促进产生IL-2和IFN-γ的Th1型CD4+T淋巴细胞的形成起到调节免疫应答的作用。IL-12对血管发生和肿瘤退化的抑制活性是公知的,并且看来与刺激产生IP-10(干扰素可诱导的蛋白10)和MIG(IFN-γ诱导的单核因子)的IFN-γ的诱导相联(J.Natl.Cancer Inst.,1998,90:1583)。
BCG(卡介苗)治疗被用于预防某些类型膀胱癌的复发。目前认为该作用机制是以细胞因子的产生为基础的:早期释放炎性细胞因子(TNF-α、IL-1、IL-6、IL-8),接着产生IL-2和IFN-γ(Th1应答),之后产生IL-4、IL-5和IL-10(Th2应答)。最后,达到伴随细胞毒性群体扩增的细胞激活阶段(Patard等,Progres en Urologie,1998,8,415-421)。
然而,由于有时所观察到的BCG治疗效果的代价是同样更高的发病率,所以BCG治疗并非仅具有优点。此外,BCG治疗存在禁忌征:活动性结核(但非原初(prior)结核)、免疫抑制(HIV、移植等)、对BCG的原初系统反应(肝炎、肺炎、BCG炎症(BCGitis))、类固醇治疗。而且,BCG治疗之后会出现抗性或复发。
肺炎克氏杆菌I145的膜组分被加入防止细菌来源的呼吸道感染的发生和复发的药物制剂组合物中,并且已经在人类中使用了20年。由于此原因,所以已有足够的时间来评价该产品的无毒性。以上列出的该组资料显示,目前对新的无毒性免疫刺激剂存在需求。这些免疫刺激剂将在某些类型癌症的治疗中具有很大的价值。
令人惊奇的是,本发明作者阐明,革兰氏阴性细菌尤其是肺炎克氏杆菌的膜组分(命名为FMKp),尤其是采用下文实施例中所述的方法获得的膜组分,具有期望的免疫刺激剂性质。
令人惊奇的是,发明人显示,FMKp或其主要成分之一,即称作P40的OmpA外膜蛋白(描述于专利申请WO 95/27787和WO 96/14415),不仅能够刺激人血液单核的细胞(mononucleated cell)的增殖,从而显示了其免疫刺激剂活性,而且能够诱导,尤其是通过单核细胞(monocyte)诱导,参与抗肿瘤免疫应答的细胞因子TNF-α和IL-12的产生。
因此,本发明的主题是革兰氏阴性细菌尤其是肺炎克氏杆菌的膜组分作为免疫刺激剂型化合物和/或能够诱导抗肿瘤免疫应答的化合物的用途,或在制备免疫刺激剂型和/或能够诱导抗肿瘤免疫应答的药物组合物中的用途,而且这与所选择的体内施用方式(经肠道的或不经肠道的途径)无关。
在本发明中,术语“免疫刺激剂型化合物”或“免疫刺激剂型药物组合物”是指能够增强非特异免疫应答的化合物或药物组合物。
在本发明中,词语“能够诱导抗肿瘤免疫应答的化合物”或“能够诱导抗肿瘤免疫应答的药物组合物”是指能够尤其是增强抗癌化合物的有效性或增强抗癌治疗例如通过放射治疗进行的治疗的有效性的化合物或药物组合物。
本发明还涉及本发明所要求保护的用途,其特征在于该膜组分含有至少两种不同细菌菌株的膜组分。
在本发明中,词语“细菌的膜组分”是指从所述细菌的培养物获得的并且其制备方法至少包含了如下步骤的任何纯化或部分纯化的膜组分或提取物,该步骤是:一个裂解培养后获得的该细菌的步骤,和一个从该裂解步骤后获得的总裂解物中分离含有所述细菌膜的组分,尤其是通过离心或过滤来进行分离的步骤。
在本发明中,当所述细菌是肺炎克氏杆菌时,词语“细菌的膜组分”还应理解为是指具有SEQ ID NO.2的氨基酸序列的P40蛋白,即肺炎克氏杆菌膜组分中的活性组分,或其片段。
根据本发明,这些膜组分可以根据本领域技术人员已知的方法制备,例如Haeuw J.F等(欧洲生物化学杂志(Eur.J.Biochem.)255,446-454,1998)所描述的方法。
根据一个具体实施方案,本发明涉及本发明所要求保护的用途,其特征在于该膜组分是通过包括以下步骤的方法制备的:
a)在允许所述细菌生长的培养基中对所述细菌进行培养,之后离心所述培养物;
b)如果适当的话,失活步骤a)获得的细菌沉淀中的分解酶,之后离心所获得的悬浮液;
c)通过在抽提溶液中对步骤a)或b)中获得的沉淀进行至少一个循环的洗涤,从该沉淀中抽提并除去非膜结合的蛋白质和核酸;
d)在存在蛋白水解酶的情况下消化步骤c)中获得的膜沉淀,之后离心;
e)在生理溶液和/或蒸馏水中对步骤d)中获得的沉淀进行至少一个循环的洗涤;和
f)超声处理步骤e)中获得的沉淀。
步骤b),对步骤a)获得的细菌沉淀中的分解酶的失活,可以通过任何已知的酶失活方法,例如尤其是通过将该重新悬浮的细菌沉淀加热至优选近100℃的温度,或通过加入这些酶的活性的抑制剂,来实现。
步骤c),从步骤a)或b)获得的沉淀中抽提并除去非膜结合的蛋白质和核酸,可以通过例如在抽提溶液中对该沉淀进行至少一个如下循环的洗涤来实现,即:加入高渗溶液(抽提溶液),优选摩尔浓度接近1M的盐水溶液,在足以达到期望效果的接触期之后,离心获得的悬浮液,并除去在所述离心后获得的上清液,可以将此洗涤循环重复几次。
步骤d),消化步骤c)中获得的膜沉淀,可以在存在蛋白水解酶例如胰蛋白酶、胰凝乳蛋白酶或任何已知的具有蛋白水解活性的酶的溶液时进行,其中反应条件、溶液的pH、反应温度和持续时间均优选调节至对于所选酶而言最佳的条件,之后进行离心,该消化循环可以采用相同的酶、相同的酶组合、或针对进行的每个消化循环而言采用不同的酶重复几次。
步骤e),洗涤步骤d)中获得的沉淀,是通过将该沉淀放入生理溶液或蒸馏水中,在足够的接触期后进行离心来实现的,可以将该洗涤循环重复几次。
最后步骤f),沉淀的超声处理,其目的在于尤其是破碎和匀浆步骤e)结束时获得的膜组分。该超声条件(持续时间和强度)将由本领域技术人员根据例如待处理的膜组分的量来确定。
根据另一个具体实施方案,本发明涉及本发明所要求保护的用途,其特征在于该膜组分是通过包含以下步骤的方法制备的:
a)在允许所述细菌生长的培养基中对所述细菌进行培养,之后,如果适当的话,进行离心;
b)冷冻步骤a)获得的该培养基或沉淀,之后融化并干燥细胞;
c)利用DNase从重新悬浮起来的步骤b)获得的该干燥细胞中除去核酸;
d)研磨步骤c)获得的细胞,然后澄清获得的悬浮液;
e)在酸性介质中沉淀步骤d)获得的悬浮液,并除去沉淀;
f)中和步骤e)获得的含有膜悬浮物的上清液,之后透析和浓缩该膜悬浮液;和
g)对步骤f)获得的浓缩膜悬浮液进行灭菌。
该方法步骤b)中的冷冻条件当然应由本领域技术人员根据待处理的沉淀的初始量来确定,优选对于1kg干燥细胞的等同物在4℃进行至少48个小时。
步骤c)中,核酸的去除通过例如向浓度等同于5%干燥细胞的细胞悬浮液中加入DNase至终浓度5mg/ml来实现。
对步骤c)获得的细胞的研磨可以利用本领域技术人员已知的用于研磨细胞的任何系统或装置,例如压机或优选例如在Manton Gaulinet loop中研磨30分钟来进行。
研磨后获得的悬浮液的澄清可以利用本领域技术人员已知的用于澄清细菌细胞研磨物的任何系统或装置,例如Sharpless系统来进行。
步骤e),在酸性介质中沉淀步骤d)获得的悬浮液,可以用例如乙酸来实现。该沉淀之后通过例如Sharpless类系统除去沉淀,并回收上清液。
步骤f)包括步骤:对在酸性介质中沉淀后获得的上清液进行中和、稀释、透析和浓缩。
最后,最后步骤包括通过例如于121℃加热约35分钟,对前面步骤获得的膜组分浓缩物灭菌。
本发明尤其涉及本发明所要求保护的用途,其特征在于该膜组分是具有SEQ ID NO.2序列的肺炎克氏杆菌P40蛋白,其片段,或序列表现出与SEQ ID NO.2序列有至少80%、优选90%、95%和99%的一致性百分数的同源蛋白质,其中所述片段或所述同源蛋白质能够诱导免疫刺激和/或抗肿瘤活性。
为了本发明的目的,术语两个核酸或氨基酸序列之间的“一致性百分数”、“一致性程度”或“一致性水平”是指在最佳比对后获得的待比较的两个序列之间一致的核苷酸或氨基酸残基的百分数,该百分数是纯粹的统计学结果,而且这两个序列之间的差异随机地分布在它们的全长范围内。常规地,两个核酸或氨基酸序列之间的序列比较是在以最佳方式比对这些序列之后通过比较它们来进行的,而为了鉴定和比较局部区域的序列相似性,所述比较是通过片段或“比较窗”来进行的。用于比较的序列最佳比对除了通过手工方式来进行外,还可以利用Smith和Waterman(1981)(Ad.App.Math.2:482)的局部同源性算法、Neddleman和Wunsch(1970)(分子生物学杂志(J.Mol.Biol.)48:443)的局部同源性算法、Pearson和Lipman(1988)(美国国家科学院院刊(Proc.Natl.Acad.Sci.USA)85:2444)的相似性搜索方法、或应用这些算法的计算机软件(GAP、BESTFIT、FASTA和TFASTA,Wisconsin遗传学软件包,Genetics Computer Group,575 Science Dr.,Madison,WI;或比较软件包BLAST N或BLAST P)来完成。
两个核酸或氨基酸序列之间的一致性百分数通过比较比较窗中最佳比对的这两个序列来确定,对于这两个序列之间的最佳比对而言,在所述比较窗中待比较的核酸或氨基酸序列区域相对于参考序列可以含有添加或缺失。该一致性百分数通过以下方式计算:确定这两个序列之间核苷酸或氨基酸残基一致的一致位置的数目,用该一致位置数目除以比较窗中位置的总数,然后将所获结果乘以100,即获得这两个序列之间的一致性百分数。
例如,可以采用在网址
http://www.ncbi.nlm.nih.gov/gorf/bls. html上可获得的BLAST程序,“BLAST 2序列”,和给出的默认参数(尤其是参数“开始空缺罚分”:5,和“延伸空缺罚分”:2;所选矩阵是例如由该程序提议的矩阵“BLOSUM 62”),待比较的两个序列之间的一致性百分数可以通过该程序直接计算获得。
词语“P40蛋白的片段”旨在尤其是指P40蛋白氨基酸序列中所包含的、能够增加非特异性免疫应答和/或能够诱导抗肿瘤免疫应答、并且含有至少5个氨基酸、优选至少10个氨基酸、或更优选至少15个氨基酸的任何氨基酸序列片段。
当然,所述P40蛋白或其片段,可以通过化学合成或以重组肽的形式获得。
目前,制备重组肽的方法是本领域技术人员所熟知的,因此在本发明说明书中不作详细描述。在可以用于产生这些重组肽的细胞中,当然应提及细菌细胞(Olins P.O.和Lee S.C.,1993,大肠杆菌中异源基因表达的最新进展(Recent advances in heterologous gene expression in E.coli),Curr.Op.Biotechnology 4:520-525),和酵母细胞(Buckholz R.G.,1993,用于异源基因产物表达的酵母系统(Yeast Systems for theExpression of Heterologous Gene Products),Curr.Op.Biotechnology4:538-542),以及动物细胞,尤其是哺乳动物细胞培养物(Edwards C.P.和Aruffo A.,1993,基于COS细胞的瞬时表达系统的当前应用(Currentapplications of COS cell based transient expression systems),Curr.Op.Biotechnology 4:558-563),和其中可以采用以例如杆状病毒作为工具的方法的昆虫细胞(Luckow V.A.,1993,用于人类基因产物表达的杆状病毒系统(Baculovirus systems for the expression of human geneproducts),Curr.Op.Biotechnology 4:564-572)。
本发明的主题还是本发明所要求保护的用途,其特征在于该药物组合物还含有以使得可以增加其稳定性和/或其免疫刺激剂活性和/或其诱导抗肿瘤免疫应答的能力的形式运载所述膜组分的药剂,这些形式例如水包油或油包水型乳剂的形式,脂质体、微球体或纳球体(nanosphere)类的颗粒形式、或使得所述膜组分能够以颗粒形式封装和呈递的任何类型结构的颗粒形式。
本发明还包括本发明所要求保护的用途,其特征在于该药物组合物还含有加强所述膜组分的免疫刺激剂活性和/或抗肿瘤免疫应答的药剂。
用于加强所述膜组分的免疫刺激剂活性和/或抗肿瘤免疫应答的所述药剂中,优选细胞因子和细胞化合物。
在细胞因子中,可以提及但不限于:IL-2、IL-12、IL-18、IFN-γ和IFN-α。
在细胞化合物中,尤其优选核酸、核糖体家族的化合物、或热休克蛋白质家族的蛋白质。
本发明还包括本发明所要求保护的用途,其特征在于该药物组合物还含有使得可以调节所述膜组分的免疫刺激剂活性和/或抗肿瘤应答的增强剂。
在使得可以调节所述膜组分的免疫刺激剂活性和/或抗肿瘤应答的所述增强剂中,优选激素和生长因子。
在激素中,可以提及但不限于β-hCG。
在生长因子中,可以提及但不限于:EGF、IGF-1、IGF-2、GM-CSF和G-CSF。
本发明的主题还是在制备旨在联合抗癌治疗,尤其是通过化学治疗(单一或综合化学治疗)和/或放射治疗进行的抗癌治疗,一起施用的药物组合物中的本发明所要求保护的用途。
根据本发明,该药物组合物制剂旨在通过肠道或肠道外途径,与抗癌治疗同时,分开或相隔一段时间施用。
本发明还包含在制备含有抗癌活性化合物与所述膜组分的药物组合物中的本发明所要求保护的用途。
许多具有抗癌活性的化合物由此可以与免疫刺激剂型和/或能够诱导抗肿瘤免疫应答的所述膜组分联合。
在这些化合物中,可以提及尤其是,但不限于蛋白酶抑制剂或具有抗血管生成活性的化合物,例如:
-TIMPs等蛋白酶抑制剂;
或下列具有抗血管生成活性的化合物:制管张素、endostatin、MCP-1、IP-10和PF-4,以及抗VEGF、抗血管生成素、抗aFGF和抗bFGF的抗体、反义序列或肽。
因此,本发明涉及本发明所要求保护的用途,其特征在于所述联合的抗癌治疗是包含了蛋白酶抑制剂或具有抗血管生成活性的化合物的化学治疗。
本发明的主题还是在制备旨在预防或治疗癌症,尤其是膀胱癌、前列腺癌、结肠癌、肝癌或恶性黑素瘤的药物组合物中的本发明所要求保护的用途。
另一方面,本发明涉及制备革兰氏阴性细菌,尤其是肺炎克氏杆菌的膜组分的方法,其特征在于它包括如下步骤:
a)在允许所述细菌生长的培养基中对所述细菌进行培养,然后离心所述培养物;
b)如果适当的话,失活步骤a)获得的细菌沉淀中的分解酶,之后离心获得的悬浮液;
c)通过在抽提溶液中对步骤a)或b)获得的沉淀进行至少一个循环的洗涤,从该沉淀中抽提并除去非膜结合的蛋白质和核酸;
d)在存在蛋白酶时消化步骤c)获得的膜沉淀,然后离心;
e)在生理溶液和/或蒸馏水中对步骤d)获得的沉淀进行至少一个循环的洗涤;和
f)超声处理步骤e)获得的沉淀。
本发明还包括制备革兰氏阴性细菌,尤其是肺炎克氏杆菌的膜组分的方法,其特征在于它包括如下步骤:
a)在允许所述细菌生长的培养基中对所述细菌进行培养,之后,如果适当的话,进行离心;
b)冷冻步骤a)获得的该培养基或沉淀,之后融化并干燥这些细胞;
c)利用DNase从重新悬浮起来的步骤b)获得的干燥细胞中除去核酸;
d)研磨步骤c)获得的细胞,然后澄清获得的悬浮液;
e)在酸性介质中沉淀步骤d)获得的悬浮液,并除去沉淀;
f)中和步骤e)获得的含有膜悬浮物的上清液,之后透析并浓缩该膜悬浮液;和
g)对步骤f)获得的浓缩膜悬浮液进行灭菌。
当然采用所述这些方法能够获得的膜组分形成了本发明的一部分。
采用所述方法能够获得的膜组分的蛋白聚糖(即FMKp的活性要素)的效价,当用半乳糖总含量和蛋白质总含量表示时,优选是:
-对于半乳糖:1.2g/l-3.4g/l;
-对于蛋白质:7.5g/l-14.9g/l。
更优选地,该效价为:
-对于半乳糖:1.8g/l-2.6g/l;
-对于蛋白质:9.3g/l-11.7g/l。
本发明还涉及含有采用本发明所要求保护的方法能够获得的膜组分的药物组合物。
本发明还包括含有革兰氏阴性细菌尤其是肺炎克氏杆菌的膜组分的药物组合物,其特征在于它与通过化学治疗和/或放射治疗进行的抗癌治疗相联合。
术语“膜组分”在本文中是指任何如上所定义的革兰氏阴性细菌的膜组分,包括那些采用本发明所要求保护的方法能够获得的膜组分,以及P40蛋白质或其片段。
优选地,本发明涉及本发明所要求保护的药物组合物,其特征在于它含有抗癌化合物,尤其是选自蛋白酶抑制剂或选自具有抗血管生成活性的化合物的抗癌化合物,作为同时、分开、或相隔一段时间施用的组合产品。
优选地,本发明所要求保护的所述药物组合物还可以含有药剂,例如载体、能够加强和/或调节以上所定义的所述膜组分的免疫刺激剂活性和/或抗肿瘤免疫应答的药剂。
以下的附图说明和实施例旨在举例说明本发明,而不是以任何方式限制其范围。
附图说明:
图1:在有FMKp存在时PBMC的增殖—剂量-依赖性研究
利用Ficoll-甲泛影钠溶液,从总的血液中分离获得单核的细胞(PBMC)。然后将该PBMC按10 000细胞/孔的比例在存在刺激剂时接种,总体积200μl。孵育72小时后,通过加入氚化胸苷客观评价增殖。结果表示为刺激指数=[PBMC+刺激物的cpm]/[无刺激物的PBMC的cpm(=RPMI培养基+10%SVF)]。
图2:在存在FMKp时PBMC的增殖—对几种供体的作用的重复性(FMKp为250μg/ml)。
图3:血液单核细胞产生的TNF-α
将该单核细胞培养在含有各种浓度产物的RPMI 1640培养基+10%SVF中。将这些细胞在孵育器中37℃于含有5%CO2的空气中进行孵育。培养条件:200 000个细胞/孔,孵育18个小时。孵育后,离心培养板,并等分上清液,保存在-80℃直到对它们进行分析。通过ELISA(酶联免疫吸附测定):Genzyme的Predicta试剂盒(检测阈值为3pg/ml),测定培养物上清液中存在的细胞因子浓度。
图4:血液单核细胞产生的(生物学上具有活性的)IL-12 p70
将该单核细胞培养在含有各种浓度产物的RPMI 1640培养基+10%SVF中。将这些细胞在孵育器中37℃于含有5%CO2的空气中进行孵育。培养条件:500 000个细胞/孔,孵育24个小时。孵育后,离心培养板,并等分上清液,保存在-80℃直到对它们进行分析。通过ELISA:Endogen抗体对(检测阈值为15pg/ml),测定培养物上清液中存在的细胞因子浓度。
实施例1:肺炎克氏杆菌膜组分(FMKp)的制备
方法1
优选在从离心沉淀中抽提肺炎克氏杆菌I145的膜之前增加一步:在任选地重新溶解之后,例如通过100℃加热沉淀,破坏沉淀中包含的细胞成分的分解酶。
从该离心沉淀中将膜实际提取出来优选通过以下方式来进行:在任选破坏分解酶后,用盐水溶液,例如1M氯化钠处理沉淀的细胞成分一或多次,之后优选以20,000g离心获得的悬浮液;从该离心获得的上清液含有蛋白质和核酸等非膜杂质,将之除去,而沉淀含有所述膜。
与含有这些杂质的盐溶液分离后,在有蛋白水解酶,优选胰蛋白酶和胰凝乳蛋白酶存在时,于pH 8的溶液中37℃消化该膜4小时。
消化后,通过超声匀浆该溶液。由此获得的产物构成称作FMKp的膜组分。
获得的上清再次在相同条件下,优选在140,000g离心。
制备膜结合的糖肽
通过40,000g离心20分钟,从离心获得的沉淀中制备该组分。将所述沉淀重新悬浮在生理盐水中,然后在煮沸的水浴上将该悬浮液加热至100℃10分钟,以失活分解酶。冷却后,20,000g离心该悬浮液30分钟。获得的沉淀用1M NaCl抽提两次,以除去蛋白质和核酸。通过20,000g离心30分钟回收该膜。
然后37℃在pH 8时用胰蛋白酶消化它们4小时,之后在相同条件下用胰凝乳蛋白酶消化。
然后通过2000g离心30分钟回收这些膜,用生理盐水,之后用蒸馏水洗涤,并通过超声15分钟进行破碎。
方法2
在+4℃融化最少48小时之后,将1kg肺炎克氏杆菌干燥细胞以5%干燥细胞的浓度重新悬浮起来。加入DNase至5mg/l。然后在MantonGaulin loop中研磨30分钟,接着在SHARPLES中以50l/h澄清,之后在pH=4.2+0.1下用乙酸沉淀30分钟。除去沉淀(SHARPLES,25l/h)并中和上清液,然后用渗透水(osmosed water)将其稀释至初体积的两倍。然后在PUF 100上以高达100Ωcm进行恒定体积透析,之后将由此获得的膜悬浮液(MS)浓缩至11l/kg干燥细胞。然后在+121℃35分钟灭菌该MS,并于+4℃保存6个星期。
FMKp的特性
根据定义,蛋白聚糖(即FMKp的活性要素)的效价为半乳糖和蛋白质的总量。
-半乳糖:平均2.2g/l
-蛋白质:平均10.5g/l。
实施例2:人血液PBMC的增殖
令人惊奇的是,获得的结果显示,FMKp引发了PBMC的增殖。该作用是剂量-依赖性的,并且在2.5mg/ml FMKp时达到最大值(图1)。而且,该作用是可重复的(图2)。
实施例3:从人血液纯化的单核细胞产生细胞因子
从预先由人类全血分离的单核的细胞(淋巴细胞、单核细胞、NK细胞等)中获得人单核细胞。单核细胞的制备是基于细胞上大量表达的CD14表面抗原。该分离是正向筛选。然后用异硫氰酸荧光素(FITC)偶联的CD13抗体标记,通过流式细胞仪评价该单核细胞的磁性分离效果:该细胞悬浮液含有94-97%的单核细胞。
令人惊奇的是,体外研究的结果说明,FMKp是一种诱导人类血液PBMC增殖,并直接作用于单核细胞的免疫刺激剂:使其产生TNF-α(图3)和IL-12 p70(图4)。值得注意的是,重组P40蛋白质(rP40),即肺炎克氏杆菌的OmpA,也能够刺激人类单核细胞产生TNF-α(图3)和IL-12 p70(图4)。
序列表
<110>PIERRE FABRE MEDICAMENT
<120>具有免疫刺激活性的细菌膜组分
在癌症治疗中的应用,制备它们
的方法和含有它们的药物组合物
<130>D17974
<140>FR 99 03154
<141>1999-03-15
<160>4
<170>PatentIn Vers.2.0
<210>1
<211>1035
<212>ADN
<213>肺炎克氏杆菌
<220>
<221>外显子
<222>(1)..(1032)
<220>
<221>内含子
<222>(1033)..(1035)
<220>
<221>CDS
<222>(1)..(1032)
<400>1
atg aaa gca att ttc gta ctg aat gcg gct ccg aaa gat aac acc tgg 48
Met Lys Ala Ile Phe Val Leu Asn Ala Ala Pro Lys Asp Asn Thr Trp
1 5 10 15
tat gca ggt ggt aaa ctg ggt tgg tcc cag tat cac gac acc ggt ttc 96
Tyr Ala Gly Gly Lys Leu Gly Trp Ser Gln Tyr His Asp Thr Gly Phe
20 25 30
tac ggt aac ggt ttc cag aac aac aac ggt ccg acc cgt aac gat cag 144
Tyr Gly Asn Gly Phe Gln Asn Asn Asn Gly Pro Thr Arg Asn Asp Gln
35 40 45
ctt ggt gct ggt gcg ttc ggt ggt tac cag gtt aac ccg tac ctc ggt 192
Leu Gly Ala Gly Ala Phe Gly Gly Tyr Gln Val Asn Pro Tyr Leu Gly
50 55 60
ttc gaa atg ggt tat gac tgg ctg ggc cgt atg gca tat aaa ggc agc 240
Phe Glu Met Gly Tyr Asp Trp Leu Gly Arg Met Ala Tyr Lys Gly Ser
65 70 75 80
gtt gac aac ggt gct ttc aaa gct cag ggc gtt cag ctg acc gct aaa 288
Val Asp Asn Gly Ala Phe Lys Ala Gln Gly Val Gln Leu Thr Ala Lys
85 90 95
ctg ggt tac ccg atc act gac gat ctg gac atc tac acc cgt ctg ggc 336
Leu Gly Tyr Pro Ile Thr Asp Asp Leu Asp Ile Tyr Thr Arg Leu Gly
100 105 110
ggc atg gtt tgg cgc gct gac tcc aaa ggc aac tac gct tct acc ggc 384
Gly Met Val Trp Arg Ala Asp Ser Lys Gly Asn Tyr Ala Ser Thr Gly
115 120 125
gtt tcc cgt agc gaa cac gac act ggc gtt tcc cca gta ttt gct ggc 432
Val Ser Arg Ser Glu His Asp Thr Gly Val Ser Pro Val Phe Ala Gly
130 135 140
ggc gta gag tgg gct gtt act cgt gac atc gct acc cgt ctg gaa tac 480
Gly Val Glu Trp Ala Val Thr Arg Asp Ile Ala Thr Arg Leu Glu Tyr
145 150 155 160
cag tgg gtt aac aac atc ggc gac gcg ggc act gtg ggt acc cgt cct 528
Gln Trp Val Asn Asn Ile Gly Asp Ala Gly Thr Val Gly Thr Arg Pro
165 170 175
gat aac ggc atg ctg agc ctg ggc gtt tcc tac cgc ttc ggt cag gaa 576
Asp Asn Gly Met Leu Ser Leu Gly Val Ser Tyr Arg Phe Gly Gln Glu
180 185 190
gat gct gca ccg gtt gtt gct ccg gct ccg gct ccg gct ccg gaa gtg 624
Asp Ala Ala Pro Val Val Ala Pro Ala Pro Ala Pro Ala Pro Glu Val
195 200 205
gct acc aag cac ttc acc ctg aag tct gac gtt ctg ttc aac ttc aac 672
Ala Thr Lys His Phe Thr Leu Lys Ser Asp Val Leu Phe Asn Phe Asn
210 215 220
aaa gct acc ctg aaa ccg gaa ggt cag cag gct ctg gat cag ctg tac 720
Lys Ala Thr Leu Lys Pro Glu Gly Gln Gln Ala Leu Asp Gln Leu Tyr
225 230 235 240
act cag ctg agc aac atg gat ccg aaa gac ggt tcc gct gtt gtt ctg 768
Thr Gln Leu Ser Asn Met Asp Pro Lys Asp Gly Ser Ala Val Val Leu
245 250 255
ggc tac acc gac cgc atc ggt tcc gaa gct tac aac cag cag ctg tct 816
Gly Tyr Thr Asp Arg Ile Gly Ser Glu Ala Tyr Asn Gln Gln Leu Ser
260 265 270
gag aaa cgt gct cag tcc gtt gtt gac tac ctg gtt gct aaa ggc atc 864
Glu Lys Arg Ala Gln Ser Val Val Asp Tyr Leu Val Ala Lys Gly Ile
275 280 285
ccg gct ggc aaa atc tcc gct cgc ggc atg ggt gaa tcc aac ccg gtt 912
Pro Ala Gly Lys Ile Ser Ala Arg Gly Met Gly Glu Ser Asn Pro Val
290 295 300
act ggc aac acc tgt gac aac gtg aaa gct cgc gct gcc ctg atc gat 960
Thr Gly Asn Thr Cys Asp Asn Val Lys Ala Arg Ala Ala Leu Ile Asp
305 310 315 320
tgc ctg gct ccg gat cgt cgt gta gag atc gaa gtt aaa ggc tac aaa 1008
Cys Leu Ala Pro Asp Arg Arg Val Glu Ile Glu Val Lys Gly Tyr Lys
325 330 335
gaa gtt gta act cag ccg gcg ggt taa 1035
Glu Val Val Thr Gln Pro Ala Gly
340
<210>2
<211>344
<212>PRT
<213>肺炎克氏杆菌
<400>2
Met Lys Ala Ile Phe Val Leu Asn Ala Ala Pro Lys Asp Asn Thr Trp
1 5 10 15
Tyr Ala Gly Gly Lys Leu Gly Trp Ser Gln Tyr His Asp Thr Gly Phe
20 25 30
Tyr Gly Asn Gly Phe Gln Asn Asn Asn Gly Pro Thr Arg Asn Asp Gln
35 40 45
Leu Gly Ala Gly Ala Phe Gly Gly Tyr Gln Val Asn Pro Tyr Leu Gly
50 55 60
Phe Glu Met Gly Tyr Asp Trp Leu Gly Arg Met Ala Tyr Lys Gly Ser
65 70 75 80
Val Asp Asn Gly Ala Phe Lys Ala Gln Gly Val Gln Leu Thr Ala Lys
85 90 95
Leu Gly Tyr Pro Ile Thr Asp Asp Leu Asp Ile Tyr Thr Arg Leu Gly
100 105 110
Gly Met Val Trp Arg Ala Asp Ser Lys Gly Asn Tyr Ala Ser Thr Gly
115 120 125
Val Ser Arg Ser Glu His Asp Thr Gly Val Ser Pro Val Phe Ala Gly
130 135 140
Gly Val Glu Trp Ala Val Thr Arg Asp Ile Ala Thr Arg Leu Glu Tyr
145 150 155 160
Gln Trp Val Asn Asn Ile Gly Asp Ala Gly Thr Val Gly Thr Arg Pro
165 170 175
Asp Asn Gly Met Leu Ser Leu Gly Val Ser Tyr Arg Phe Gly Gln Glu
180 185 190
Asp Ala Ala Pro Val Val Ala Pro Ala Pro Ala Pro Ala Pro Glu Val
195 200 205
Ala Thr Lys His Phe Thr Leu Lys Ser Asp Val Leu Phe Asn Phe Asn
210 215 220
Lys Ala Thr Leu Lys Pro Glu Gly Gln Gln Ala Leu Asp Gln Leu Tyr
225 230 235 240
Thr Gln Leu Ser Asn Met Asp Pro Lys Asp Gly Ser Ala Val Val Leu
245 250 255
Gly Tyr Thr Asp Arg Ile Gly Ser Glu Ala Tyr Asn Gln Gln Leu Ser
260 265 270
Glu Lys Arg Ala Gln Ser Val Val Asp Tyr Leu Val Ala Lys Gly Ile
275 280 285
Pro Ala Gly Lys Ile Ser Ala Arg Gly Met Gly Glu Ser Asn Pro Val
290 295 300
Thr Gly Asn Thr Cys Asp Asn Val Lys Ala Arg Ala Ala Leu Ile Asp
305 310 315 320
Cys Leu Ala Pro Asp Arg Arg Val Glu Ile Glu Val Lys Gly Tyr Lys
325 330 335
Glu Val Val Thr Gln Pro Ala Gly
340
Claims (20)
1.含有蛋白聚糖的肺炎克氏杆菌膜组分在制备免疫刺激剂型和能够诱导抗肿瘤免疫应答的药物组合物中的用途,其特征在于所述的膜组分是通过下述制备方法获得的,所述方法包含裂解培养后的肺炎克氏杆菌的步骤及从该裂解步骤后获得的总裂解物中分离含所述膜的组分的步骤。
2.根据权利要求1的用途,其特征在于该膜组分是采用包括以下步骤的方法制备的:
a)在允许所述细菌生长的培养基中对所述细菌进行培养,然后离心所述培养物;
b)失活步骤a)获得的细菌沉淀中的分解酶,之后离心获得的悬浮液;
c)通过在抽提溶液中对步骤a)或b)获得的沉淀进行至少一个循环的洗涤,从该沉淀中抽提并除去非膜结合蛋白质和核酸;
d)在存在蛋白酶时消化步骤c)获得的膜沉淀,然后离心;
e)在生理溶液和/或蒸馏水中对步骤d)获得的沉淀进行至少一个循环的洗涤;和
f)超声处理步骤e)获得的沉淀。
3.根据权利要求1的用途,其特征在于该膜组分是采用包括以下步骤的方法制备的:
a)在允许所述细菌生长的培养基中对所述细菌进行培养,之后进行离心;
b)冷冻步骤a)获得的该培养基或沉淀,之后融化并干燥这些细胞;
c)利用DNA酶从重新悬浮起来的步骤b)获得的干燥细胞中除去核酸;
d)研磨步骤c)获得的细胞,然后澄清获得的悬浮液;
e)在酸性介质中沉淀步骤d)获得的悬浮液,并除去沉淀;
f)中和步骤e)获得的含有膜悬浮物的上清液,之后进行透析并浓缩该膜悬浮液;和
g)对步骤f)获得的浓缩膜悬浮液进行灭菌。
4.根据权利要求1-3之一项的用途,其特征在于该药物组合物还含有以能够提高其稳定性和/或其免疫刺激剂活性和其诱导抗肿瘤免疫应答的能力的形式运载所述膜组分的药剂。
5.根据权利要求4的用途,其特征在于所述药剂是水包油或油包水乳剂类型。
6.根据权利要求4的用途,其特征在于所述药剂是使得所述膜组分能够以颗粒形式封装和呈递的脂质体、微球体或纳球体颗粒形式。
7.根据权利要求1的用途,其特征在于该药物组合物还含有用于加强所述膜组分的免疫刺激剂活性和抗肿瘤免疫应答的药剂。
8.根据权利要求7的用途,其特征在于用于加强所述膜组分的免疫刺激剂活性和抗肿瘤免疫应答的药剂是细胞因子。
9.根据权利要求7的用途,其特征在于用于加强所述膜组分的免疫刺激剂活性和抗肿瘤免疫应答的药剂是选自激素的调节剂。
10.根据权利要求7的用途,其特征在于用于加强所述膜组分的免疫刺激剂活性和抗肿瘤免疫应答的药剂是选自生长因子的调节剂。
11.根据权利要求7的用途,其特征在于用于加强所述膜组分的免疫刺激剂活性和抗肿瘤免疫应答的药剂是细胞化合物。
12.根据权利要求1的用途,所述药物组合物是与抗癌治疗联合施用的。
13.根据权利要求12的用途,其特征在于该抗癌治疗是化学治疗和/或放射治疗。
14.根据权利要求12的用途,所述药物组合物是与抗癌治疗同时、分开或相隔一段时间施用的。
15.根据权利要求14的用途,其特征在于该药物组合物通过肠道或肠道外途径施用。
16.根据权利要求12的用途,其特征在于所述联合的抗癌治疗是包含蛋白酶抑制剂或具有抗血管生成活性的化合物的化学治疗。
17.根据权利要求1的用途,所述药物组合物用于预防和/或治疗癌症。
18.含有能够采用下列膜组分制备方法获得的包含蛋白聚糖的肺炎克氏杆菌膜组分的药物组合物,所述方法包含下列步骤:
a)在允许所述细菌生长的培养基中对所述细菌进行培养,然后离心所述培养物;
b)失活步骤a)获得的细菌沉淀中的分解酶,之后离心获得的悬浮液;
c)通过在抽提溶液中对步骤a)或b)获得的沉淀进行至少一个循环的洗涤,从该沉淀中抽提并除去非膜结合蛋白质和核酸;
d)在存在蛋白酶时消化步骤c)获得的膜沉淀,然后离心;
e)在生理溶液和/或蒸馏水中对步骤d)获得的沉淀进行至少一个循环的洗涤;和
f)超声处理步骤e)获得的沉淀;
或所述方法包含下列步骤:
a)在允许所述细菌生长的培养基中对所述细菌进行培养,之后进行离心;
b)冷冻步骤a)获得的该培养基或沉淀,之后融化并干燥这些细胞;
c)利用DNA酶从重新悬浮起来的步骤b)获得的干燥细胞中除去核酸;
d)研磨步骤c)获得的细胞,然后澄清获得的悬浮液;
e)在酸性介质中沉淀步骤d)获得的悬浮液,并除去沉淀;
f)中和步骤e)获得的含有膜悬浮物的上清液,之后进行透析并浓缩该膜悬浮液;和
g)对步骤f)获得的浓缩膜悬浮液进行灭菌。
19.根据权利要18的药物组合物,其特征在于它还含有抗癌化合物,作为同时、分开或相隔一段时间使用的组合产品。
20.根据权利要求19的药物组合物,其特征在于所述抗癌化合物选自蛋白酶抑制剂或具有抗血管生成活性的化合物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR9903154A FR2790960B1 (fr) | 1999-03-15 | 1999-03-15 | Utilisation de fractions membranaires bacteriennes a activite immunostimulante dans le traitement de cancers, leurs procedes de preparation et les compositions pharmaceutiques les contenant |
| FR99/03154 | 1999-03-15 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1343125A CN1343125A (zh) | 2002-04-03 |
| CN1202127C true CN1202127C (zh) | 2005-05-18 |
Family
ID=9543185
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB008050503A Expired - Fee Related CN1202127C (zh) | 1999-03-15 | 2000-03-15 | 癌症治疗中的免疫刺激剂细菌膜组分 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US7033591B1 (zh) |
| EP (1) | EP1161250B9 (zh) |
| JP (1) | JP2002539170A (zh) |
| CN (1) | CN1202127C (zh) |
| AT (1) | ATE302014T1 (zh) |
| AU (1) | AU776350B2 (zh) |
| BR (1) | BR0009052A (zh) |
| CA (1) | CA2367211A1 (zh) |
| DE (1) | DE60022011T2 (zh) |
| DK (1) | DK1161250T3 (zh) |
| ES (1) | ES2246831T3 (zh) |
| FR (1) | FR2790960B1 (zh) |
| WO (1) | WO2000054790A1 (zh) |
| ZA (1) | ZA200107368B (zh) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2808445A1 (fr) * | 2000-05-04 | 2001-11-09 | Pf Medicament | Proteine omp associee a un lysat de cellules tumorales autologues et/ou heterologues |
| FR2809014A1 (fr) * | 2000-05-16 | 2001-11-23 | Pf Medicament | Utilisation d'une proteine ompa d'enterobacterie comme agent antimicrobien |
| GB2370838A (en) * | 2001-01-06 | 2002-07-10 | Benedikt Timmerman | Immunogenic complex |
| FR2822071B1 (fr) * | 2001-03-15 | 2005-07-01 | Pf Medicament | Utilisation d'une fraction membranaire de bacteries a gram negatif pour induire la maturation des cellules dendritiques |
| CN105899199A (zh) * | 2013-11-26 | 2016-08-24 | 硕腾服务有限责任公司 | 诱导免疫应答的组合物 |
| GB201713975D0 (en) * | 2017-08-31 | 2017-10-18 | Macrophage Pharma Ltd | Medical use |
| JP2022520999A (ja) * | 2019-02-22 | 2022-04-04 | エヴェロ バイオサイエンシズ,インコーポレーテッド | 細菌の膜調製物 |
| EP4190894A1 (en) | 2021-12-03 | 2023-06-07 | CiMaas B.V. | Method for the production of mature dendritic cells in vitro using a bacterial lysate |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2471785A1 (fr) * | 1979-12-21 | 1981-06-26 | Fabre Sa Pierre | Preparations immunostimulantes a base d'arn ribosomaux et procede de preparation des arn |
| FR2523154A1 (fr) * | 1982-03-09 | 1983-09-16 | Fabre Sa Pierre | Procede de preparation de proteoglycanes immunostimulants inducteurs d'interferon, proteoglycanes obtenus et medicaments les contenant |
| FR2596064B1 (fr) * | 1986-03-18 | 1990-02-02 | Pf Medicament | Procedes industriels de fabrication de vaccins ribosomaux et vaccins ribosomaux obtenus |
| AU603585B2 (en) * | 1986-05-07 | 1990-11-22 | Sloan-Kettering Institute For Cancer Research | Vaccine for stimulating or enhancing production of antibodies directed against GM2 |
| AU7477791A (en) * | 1990-03-02 | 1991-09-18 | Joaquin J. Jimenez | Method for treating cancer using combination chemotherapy and brm |
| US5242806A (en) * | 1990-05-07 | 1993-09-07 | Baxter Diagnostics Inc. | Method for conducting the cytotoxicity assays on tumor cells |
| US5776898A (en) * | 1991-05-14 | 1998-07-07 | Dana-Farber Cancer Institute | Method for treating a tumor with a chemotherapeutic agent |
| US5830686A (en) * | 1994-01-13 | 1998-11-03 | Calydon | Tissue-specific enhancer active in prostate |
| FR2726472B1 (fr) * | 1994-11-07 | 1997-01-31 | Pf Medicament | Proteine porteuse a effet adjuvant, complexe immunogene la contenant, leur procede de preparation, sequence nucleotidique et vaccin |
| US5633161A (en) * | 1995-03-29 | 1997-05-27 | Millennium Pharmaceuticals, Inc. | Murine gene fomy030 coding for tumor progression inhibitor |
| FR2785542B1 (fr) * | 1998-11-06 | 2001-02-09 | Pf Medicament | UTILISATION D'UNE PROTEINE OmpA D'ENTEROBACTERIE, POUR LE CIBLAGE SPECIFIQUE D'UNE SUBSTANCE BIOLOGIQUEMENT ACTIVE QUI LUI EST ASSOCIEE VERS LES CELLULES PRESENTATRICES D'ANTIGENES TELLES QUE LES CELLULES DENDRITIQUES HUMAINES |
-
1999
- 1999-03-15 FR FR9903154A patent/FR2790960B1/fr not_active Expired - Fee Related
-
2000
- 2000-03-15 WO PCT/FR2000/000623 patent/WO2000054790A1/fr active IP Right Grant
- 2000-03-15 DE DE60022011T patent/DE60022011T2/de not_active Expired - Lifetime
- 2000-03-15 CN CNB008050503A patent/CN1202127C/zh not_active Expired - Fee Related
- 2000-03-15 US US09/936,677 patent/US7033591B1/en not_active Expired - Fee Related
- 2000-03-15 AU AU32981/00A patent/AU776350B2/en not_active Ceased
- 2000-03-15 JP JP2000604865A patent/JP2002539170A/ja active Pending
- 2000-03-15 BR BR0009052-2A patent/BR0009052A/pt not_active Application Discontinuation
- 2000-03-15 AT AT00910947T patent/ATE302014T1/de not_active IP Right Cessation
- 2000-03-15 DK DK00910947T patent/DK1161250T3/da active
- 2000-03-15 CA CA002367211A patent/CA2367211A1/fr not_active Abandoned
- 2000-03-15 EP EP00910947A patent/EP1161250B9/fr not_active Expired - Lifetime
- 2000-03-15 ES ES00910947T patent/ES2246831T3/es not_active Expired - Lifetime
-
2001
- 2001-09-06 ZA ZA2001/07368A patent/ZA200107368B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| ES2246831T3 (es) | 2006-03-01 |
| AU776350B2 (en) | 2004-09-02 |
| BR0009052A (pt) | 2001-12-26 |
| AU3298100A (en) | 2000-10-04 |
| CN1343125A (zh) | 2002-04-03 |
| ATE302014T1 (de) | 2005-09-15 |
| DE60022011D1 (de) | 2005-09-22 |
| EP1161250B9 (fr) | 2006-07-05 |
| WO2000054790A1 (fr) | 2000-09-21 |
| US7033591B1 (en) | 2006-04-25 |
| EP1161250A1 (fr) | 2001-12-12 |
| ZA200107368B (en) | 2002-06-26 |
| DK1161250T3 (da) | 2005-12-12 |
| FR2790960B1 (fr) | 2002-10-31 |
| JP2002539170A (ja) | 2002-11-19 |
| FR2790960A1 (fr) | 2000-09-22 |
| EP1161250B1 (fr) | 2005-08-17 |
| CA2367211A1 (fr) | 2000-09-21 |
| DE60022011T2 (de) | 2006-06-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1227360C (zh) | Mage家族肿瘤相关抗原衍生物及其编码核酸序列 | |
| CN1805758A (zh) | 核酸和细胞疫苗的组分 | |
| CN1762490A (zh) | 基于癌抑制基因wt1的产物的癌抗原 | |
| CN1284884A (zh) | 疫苗 | |
| CN1909924A (zh) | 含有细菌鞭毛蛋白作为活性成分的粘膜疫苗佐剂 | |
| CN1318105A (zh) | 负调节Osteoprotegerin配体活性的方法 | |
| CN1265038A (zh) | 被称作胞外体的细胞囊泡,其制备方法及在免疫刺激中的用途 | |
| CN1639323A (zh) | T细胞来源囊泡的功能化及其在制备免疫原性药用组合物中的应用 | |
| CN1194000A (zh) | 增强保护性免疫应答的方法 | |
| CN1520311A (zh) | 含有基于癌抑制基因wt1的产物的癌抗原和阳离子脂质体的癌疫苗 | |
| CN1942205A (zh) | 可经粘膜和经皮给予的抗原药物媒介物、使用该媒介物的粘膜免疫的诱导方法、粘膜疫苗和dds | |
| CN1760209A (zh) | 人白细胞介素15与Fc融合蛋白 | |
| CN101080420A (zh) | 胸腺特异性蛋白质 | |
| CN1910284A (zh) | 由HLA-A2402-限制的Ep-CAM-特异的CTL识别的表位/肽及其应用 | |
| CN1202127C (zh) | 癌症治疗中的免疫刺激剂细菌膜组分 | |
| CN101048178A (zh) | 作为疫苗的重组分枝杆菌和生物活性剂的组合 | |
| CN1142186A (zh) | 用白介素-10激活外周血单核细胞的细胞溶解活性 | |
| CN1281748C (zh) | 为改善IL-12活性而突变的IL-12p40亚基基因及其作为DNA疫苗佐剂的用途 | |
| CN1871025A (zh) | 基于印记位点调节物兄弟(boris)的预防性癌症疫苗 | |
| CN1807452A (zh) | 幽门螺杆菌尿素酶B亚单位的Th表位肽、其编码DNA、疫苗及其应用 | |
| CN1948333A (zh) | 一种新的hPEBP4蛋白来源的HLA-A2限制性表位多肽及其应用 | |
| CN1718243A (zh) | 一类免疫佐剂及其在抗病毒疫苗或药物制备中的应用 | |
| CN101036784A (zh) | 一种乙型肝炎治疗性细胞毒性t细胞表位疫苗及其制备方法 | |
| CN1181890C (zh) | 肠细菌OmpA蛋白在制备特异导向抗原呈递细胞的药物中的应用 | |
| CN1639569A (zh) | 诱导免疫应答的方法和组合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C06 | Publication | ||
| PB01 | Publication | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20050518 Termination date: 20110315 |