用两种铝化合物生产阴离子粘土的方法
本发明涉及阴离子粘土的制备以及通过所述阴离子粘土的热处理制备Mg-Al固溶体。阴离子粘土的晶体结构由带正电荷的层组成,所述的层由金属氢氧化物的特定组合构成,层间有阴离子和水分子。水滑石是天然阴离子粘土的一个实例,其中,碳酸根是存在的主要阴离子。羟镁铝石是一种阴离子粘土,其中,羟基是存在的主要阴离子。
在水滑石类阴离子粘土中,水镁石类主层由八面体与中间层交替构成,其中分布水分子和阴离子,更特别地为碳酸根离子。所述中间层可能含有NO3 -、OH、Cl-、Br-、I-、SO4 2-、SiO3 2-、CrO4 2-、BO3 2-、MnO4 -、HGaO3 2-、HVO4 2-、ClO4 -、BO3 2-等阴离子;柱形(pillaring)阴离子如V10O28 6-和Mo7O24 6-;一元羧酸根,如醋酸根;二元羧酸根,如草酸根;烷基磺酸根,如十二烷基磺酸根。
应该注意使用各种术语来描述所述材料,所述材料在本发明中是指阴离子粘土。熟悉该技术的那些人交替使用水滑石类和层状双氢氧化物。在本专利申请中,我们称所述材料为阴离子型粘土,在该术语中包括水滑石类的和层状双氢氧化物的材料。
在许多以前的技术出版物中已经描述了阴离子粘土的制备。
近来,出版了阴离子粘土化学的两个主要综述,其中,总结了可以用于阴离子粘土合成的合成方法,F.Cavani等的“水滑石类阴离子粘土:制备、性能和用途,”“今日催化剂”,11(1991)ElsevierScience Publishers B.V.Amsterdam.
J P Besse等的“阴离子粘土:pillary chemistry,其合成和微气孔固体”(1992),2,108,编辑:M.I.Occelli,H.E.Robson,VanNostrand reinhold,N.Y.
在这些综述中,作者说明阴离子粘土的特性是在500℃的轻烧导致无序MgO状产物。所述无序MgO状产物区别于尖晶石(在重烧时产生)和阴离子粘土。在本专利申请中,我们把所述无序MgO状产物称为Mg-Al固溶体。此外,这些Mg-Al固溶体含有众所周知的记忆效应,从而使这样煅烧的材料暴露在水中时导致重新形成阴离子粘土结构。
对于阴离子粘土方面的工作,参考下列文章:
瑞士化学学报,25,106-137和555-569(1942)
美国陶瓷协会杂志,42,No.3,121(1959)
化学通报(日本),843(1973)
粘土和粘土矿物,23,369(1975)
粘土和粘土矿物,28,50(1980)
粘土和粘土矿物,34,507(1996)
材料化学和物理,14,569(1986)。
此外,在阴离子粘土的使用及其制备方法方面有大量的专利文献。
欧洲专利申请0 536 879描述了一种向粘土中引入与pH有关的阴离子。通过向含有硼酸根阴离子的碱性液中加入Al(NO3)3和Mg(NO3)2溶液制备所述粘土。然后把产物过滤、重复水洗并干燥一整夜。此外,使用Zn/Mg混合物。
在Miyata的题为“复合金属氢氧化物”的US3,796,792中,制备了一系列材料,向所述材料中引入了许多阳离子,包括Sc、La、Th、In等。在实施例中,制备了所述二价和三价阳离子的特定溶液并与碱混合产生共沉淀。把所的产物过滤、水洗、并在80℃干燥。实施例1是Mg和Al,实施例2是Mg和Bi。还给出了其它实施例,在每种情况下,在高pH值下沉淀所述阴离子粘土之前,用可溶盐制备溶液。
在Miyata的题为“复合金属氢氧化物”的US3,879,523中,也描述了大量制备实施例。然而,基础化学还是基于可溶盐的共沉淀,然后洗涤和干燥。重要的是强调洗涤是这种制备的必要部分,因为为了产生所述金属离子的共沉淀所需的碱性环境,需要一种碱性溶液并且这种碱性溶液由NaOH/Na2CO3溶液提供。例如,残余的钠对作为催化剂或氧化物载体的产物的性能可能具有明显的有害作用。
在US 3879525(Miyata)中,也描述了非常类似的过程。
在Miyata等人US4,351,814中,描述了一种制备纤维状水滑石的方法。这样的材料在结构上不同于正常的片状形貌。所述合成还涉及可溶盐。例如,制备MgCl2和CaCl2的混合物的水溶液并适当陈化。从这种溶液中,沉淀针状产物Mg2(OH)3Cl·4H2O。然后在蒸压釜中使一种单独的铝酸钠溶液与固体Mg2(OH)3Cl·4H2O反应,所得产物在过滤、水洗并干燥。
在Reichle的US4,458,026中,其中,描述了用作3-羟基丁醛缩聚反应催化剂的热处理阴离子粘土,还是利用镁和铝的硝酸盐溶液。向NaOH和Na2CO3的第二种溶液中加入这样的溶液。沉淀后,把所得浆料过滤并用蒸馏水洗两次,然后在125℃干燥。
在Misra的US4,656,156中,描述了以混合活性氧化铝与水滑石为基础的一种新型吸附剂的制备。通过使活性MgO(通过活化镁的化合物,如碳酸镁或氢氧化镁)与含有铝酸根、碳酸根和氢氧根离子的水溶液反应制备所述水滑石。作为一个实例,所述溶液从NaOH、Na2CO3和Al2O3制得。特别地,所述合成涉及使用工业Bayer母液作为Al源。所得产物在105℃干燥前洗涤并过滤。
在Misra的US4,904,457中,描述了一种通过使活性氧化镁与含有铝酸根、碳酸根和氢氧根离子的水溶液反应高产量地生产水滑石的方法。
在US4,656,156重复了所述方法。
在Kelkar等人的US5,507,980中,描述了一种制备包括合成水滑石类结合剂的新型催化剂、催化剂载体和吸附剂。典型的板状水滑石的合成涉及使假一水软铝石反应,向其中加入乙酸使所述假一水软铝石成为胶体。然后与氧化镁混合。更重要地,所述专利清楚说明所述发明使用一元有机羧酸,如蚁酸、丙酸、异丁酸。在所述专利中,给出了制备水滑石的传统方法。
在US5,439,861中,描述了一种制备基于水滑石的合成气体生产用催化剂的方法。所述制备方法还是基于可溶盐与碱反应的共沉淀,例如,通过向Na2CO3和NaOH溶液中加入RhCl3、Mg(NO3)2和Al(NO3)3溶液。
在Bhattacharyya的US5,399,537中,利用可溶性镁盐和铝盐的共沉淀制备基于水滑石的含镍催化剂。
在Bhattacharyya的US5,591,418中,通过煅烧一种阴离子粘土制备从气态混合物中除去硫的氧化物或氮的氧化物的催化剂,所述阴离子粘土通过Mg(NO3)2、Al(NO3)3和Ce(NO3)3的溶液的共沉淀制备。所得产物再过滤并用去离子水重复洗涤。
在US5,114,898/WO9110505中,Pinnavaia等人描述了用于从烟气中除去硫的氧化物的层状双氢氧化物吸附剂,其层状双氢氧化物通过使Al和Mg的硝酸盐或氯化物溶液与NaOH和Na2CO3溶液反应制备。在US5,079,203/WO9118670中,描述了用多氧阴离子插入层状双氢氧化物,基础粘土通过共沉淀技术制备。
在Alcoa的US5,578,286中,描述了一种羟镁铝石的制备方法。所述羟镁铝石可以与二元羧酸或多元羧酸阴离子接触形成水滑石类材料。在对比实施例1-3中,水菱镁石在CO2气氛中,大于30大气压的条件下与三水合铝接触。在这些实施例中没有获得水滑石。
在US5,514,316中,描述了一种用氧化镁和过渡型氧化铝制备羟镁铝石的方法。为了对比,用三水合铝与氧化镁结合。表明这种方法不能象过渡型氧化铝一样起作用。
US4,454,244和US4,843,168描述在阴离子粘土中使用柱形阴离子。
在van Broekhoven的US4,946,581和US4,952,382中,使用Mg(NO3)2和Al(NO3)3等可溶盐(引入或不引入稀土盐类)的共沉淀制备阴离子粘土作为催化剂成分和添加剂。描述了各种阴离子和二价和三价阳离子。
如上面的现有技术的描述所表明,有许多阴离子粘土的应用。
这些应用包括但不限制于:催化剂、吸附剂、钻井泥浆、催化剂载体和载体、添加剂和医药领域的应用。特别地,van Broekhoven描述了它们在除去SOx化学方面的应用。
由于这些材料的广泛的大规模工业应用,因此,需要利用代用的便宜的原料并且能以连续的方式进行的新方法来提供制造阴离子粘土的更低成本且环境相容的方法。特别地,从上述的现有技术,人们可以总结出,可以以下列方式改善所述制备方法:使用便宜的反应物源,更容易的反应物处理方法,因此不需要洗涤或过滤,消除了这些细颗粒物料伴随的过滤问题,避免了碱金属(对于某些催化剂应用,碱金属是特别不利的):在现有技术的制备中,使用有机酸使氧化铝胶体化。使用有机酸是昂贵的并且在所述合成方法中引入附加步骤,因此不是低成本的。此外,在干燥或煅烧通过现有技术方法制备的阴离子粘土过程中,遇到放出氮的氧化物、卤素、硫的氧化物等气体,产生环境污染问题。而且,没有一种现有技术中描述的制备方法提供了阴离子粘土的连续制备方法。
本发明包括一种使用便宜的原料,并利用这样的原料在一种非常适合于以连续的方式进行的简单方法中生产阴离子粘土的方法。所述方法涉及在室温或升高的温度下,在大气压或升高的压力下,在水中有或没有搅拌的条件下使混合物反应。这样的方法可以在标准工业设备中运行。更特别地,不需要洗涤或过滤,在反应产物中,较宽范围的Mg/Al比例都是可能的。
在根据本发明的方法中,在水基悬浮液中使一种铝源和一种镁源(如氧化镁或水镁石)反应,获得一种阴离子粘土。所述铝源包括两种含铝化合物,例如,三水合铝(如三水铝矿、拜三水铝石和诺三水铝石)及其热处理形式。所述反应在室温或升高的温度下,在大气压或升高的压力下进行,所述反应混合物导致一种阴离子粘土的直接形成,可以通过干燥从所述反应器中连续获得的浆料获得所述阴离子粘土。粉末X射线衍射谱图(PXRD)表明,所得产物可以与其它标准(间歇式)方法制造的阴离子粘土相比。所得产物的物理和化学性质也是可以与那些其它传统方法制备的阴离子粘土相比。本发明的总的方法是非常可行的,能使各种含阴离子粘土的组合物和阴离子粘土材料(例如含有碳酸根、氢氧根和其它阴离子)以经济的且环境友好的方式制备。
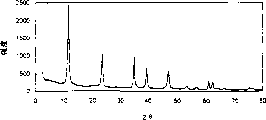
图1表示市售Mg-Al碳酸根阴离子粘土的PXRD谱图。
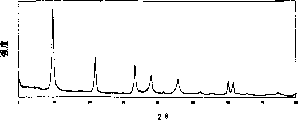
图2表示通过共沉淀制备的Mg-Al碳酸根阴离子粘土的PXRD谱图。
图3表示三水铝矿、无定形凝胶氧化铝和MgO制备的Mg-Al阴离子粘土的PXRD谱图。
图4表示用三水铝矿、热处理三水铝矿和MgO制备的Mg-Al阴离子粘土的PXRD谱图。
图5表示用三水铝矿、快速煅烧氧化铝和MgO制备的Mg-Al阴离子粘土的PXRD谱图。
图6表示用三水铝矿、Catapal A和MgO制备的Mg-Al阴离子粘土的PXRD谱图。
本发明涉及一种阴离子粘土的制备。特别地,它描述了一种阴离子粘土的制备方法,其中,在水基悬浮液中使一种铝源和一种镁源反应来获得一种阴离子粘土,所述铝源包括两种含铝化合物,其中,一种含铝化合物是三水合铝或其热处理形式。所述镁源可以由一种镁盐的溶液、一种固体含镁化合物或者两者的混合物组成。在所述Mg源与铝源之间的反应导致一种阴离子粘土的直接形成。所述反应在室温或更高的温度下进行。在高于100℃的温度下,所述反应优选在自发的条件下进行。在根据本发明的方法中,碳酸根、氢氧根或其它阴离子或其混合物(通过向所述反应器加入可溶盐在所述反应介质内提供或者在所述合成过程中从大气中吸收)引入到中间层区域中作为必要的平衡电荷的阴离子。
通过本方法制备阴离子粘土表现出通过传统的和以前提出的方法制备的阴离子粘土通常伴随的熟知的性质和特性(例如,化学分析、粉末X射线衍射谱图、FTIR、热分解特性、表面积、气孔体积和气孔尺寸分布)。
在加热时,阴离子粘土通常形成Mg-Al固溶体,在更高的温度下,形成尖晶石。在用作催化剂、吸附剂(例如催化裂解反应的SOx吸附剂)或催化剂载体时,根据本发明的阴离子粘土通常在制备过程中被加热,因此形成所述Mg-Al固溶体的形式。在FCC单元使用过程中,所述催化剂或吸附剂从阴离子粘土转变成Mg-Al固溶体。
所以,本发明还涉及一种方法,其中,在300-1200℃的温度下热处理根据本发明的方法制备的阴离子粘土,形成含有Mg-Al的固溶体和/或尖晶石。
根据本发明的阴离子粘土具有对应于下列通式的层状结构:
[Mgm 2+Aln 3+(OH)2m+2n](Xn/z z-)·bH2O
其中,m和n的值使得m/n=1-10,优选1-6,b值在0-10范围内,一般为2-6,通常约为4。X可以是CO3 2-、OH-或通常在阴离子粘土中间层中存在的任何其它阴离子。更优选地,m/n应该具有2-4的值,更特别地接近3。
由于本专利中提出的方法不要求产物的洗涤或过滤,因此,没有过滤废料或气体放出(例如酸的分解),使得本方法是特别环境友好的并且更适合于对工业运行日益严格的环境限制。所述产物可以直接喷雾干燥形成微球或者挤出形成成型体。
铝源
本发明包括使用两种含铝化合物,其中,一种含铝化合物是结晶态三水合铝(ATH)或其热处理形式。三水合铝的一个实例是三水铝矿(例如,由Reynolds Aluminium Company提供的TH-20或JM HuberMicral级)。BOC(矾土矿浓缩物)、拜三水铝石和诺三水铝石也是合适的三水合铝。BOC是最便宜的铝源。所述三水合铝优选具有小的颗粒尺寸。也可以使用热处理形式的三水铝矿。通过在100-800℃的温度下热处理铝的三水合物(三水铝矿)15分钟到24小时可以容易地获得热处理的(煅烧的)三水合铝。在任何情况下,获得煅烧的三水合铝的煅烧温度和时间应该足以使得表面积的增大可以测得,通过Bayer法生产的三水铝矿的表面积一般在30-50m2/g之间。应该注意,在本发明的概念内,快速煅烧氧化铝也被认为也是热处理形式的三水合铝,虽然一般认为它是非常特殊的氧化铝。快速煅烧氧化铝是通过在特定的工业设备中在800-1000℃处理三水合铝非常短的时间获得的,如在US4,051,072和US3,222,129中所述。在使用三水合铝时,加入其它含铝化合物,如铝的氧化物和氢氧化物(如溶胶、热处理的三水合铝,包括快速煅烧氧化铝、凝胶、假一水软铝石、一水软铝石)、铝盐,如硝酸铝、氯化铝、氯化铝水合物和铝酸钠作为第二种含铝化合物。所述其它含铝化合物可以是可溶于水或不溶于水的,可以加入到所述三水合铝中,或者以固体、溶液或悬浮液的形式单独加入到所述反应器中,在使用热处理的三水合铝时,也可以加入其它含铝化合物,例如,上述的那些含铝化合物,和三水合铝及其其它形式的热处理形式。所述其它铝源可以加入到所述热处理的三水合铝中,或者以固体、溶液或悬浮液的形式单独加入到所述反应器中。优选地,所述铝源以浆料的形式加入到所述反应器中,特别地,我们强调,不需要使用可形成胶体溶液的氧化铝源(三水铝矿石不能形成胶体溶液的),因此,不需要加入无机酸或有机酸来改变所述混合物的pH值。
镁源
可以使用的含Mg源包括MgO、Mg(OH)2、乙酸镁、甲酸镁、碱式醋酸镁、水菱镁石(Mg5(CO3)4(OH)2)、碳酸镁、碳酸氢镁、硝酸镁、氯化镁、白云石和海泡石。固体Mg源和可溶性Mg盐都是合适的。可以使用Mg源的组合。所述镁源可以以固体、溶液或优选以浆料形式加入到所述反应器中。所述镁源也可以在其加入到所述反应器之前与所述铝源混合。
条件
由于其简单性,这种方法特别适合于以连续的方式进行。为此,向反应器中供入铝源和镁源并使其在水基悬浮液中反应,来获得一种阴离子粘土。在间歇法的情况下,向所述反应器中加入所述铝源和镁源使其在水基悬浮液中反应来获得阴离子粘土。
在本发明的内容中,反应器被认为是在所述铝源和镁源之间发生反应的任何有限区域。所述反应器可以装有搅拌器、隔板等以保证反应物的均匀混合。所述反应可以在搅拌或不搅拌、室温或提高的温度、大气压或提高的压力下进行。通常,在大气压或高于大气压下使用0-100℃之间的温度。优选在50℃以上的温度而不是在室温进行所述过程,因为这产生比室温获得的阴离子粘土在x射线衍射谱图上具有更尖的峰的阴离子粘土。所述反应器可以通过任何热源加热,如窑炉、微波、红外源、加热套(电加热套或加热流体)、灯等。
所述反应器中的水基悬浮液可以通过向所述反应器中加入原料浆料(混合的或单独的)或者向铝源浆料中加入镁源或者相反地进行并把所得浆料加入到所述反应器中来获得。可能在较高温度下处理,例如所述的三水合铝浆料,然后向反应器中或者所述铝源浆料中加入Mg源本身,或者加入浆料或溶液形式的Mg源。给定可以获得的特定设备,可以水热法进行所述过程。这是特别有利的,因为获得更快更高的转化。不需要洗涤或过滤所述产物,因为在所述产物中没有使用其它制备方法时常常遇到的不必要的离子(如钠、铵、氯、硫酸根)。
在本发明的另一个实施方案中,所述方法以多步骤过程进行,例如,在第一个反应器中,在中温下热处理铝源和Mg源的浆料,然后在第二个反应器中水热处理。如果需要,可以向所述反应器加入预先形成的阴离子粘土。所述预先形成的粘土可以是从所述反应混合物中回收的阴离子粘土或者通过根据本发明的方法或任何其它方法单独制备的阴离子粘土。
如果需要,可以向所述反应器中加入有机或无机酸和碱(例如为了控制pH值)或者在所述镁源或铝源加入到所述反应器之前向其中加入有机或无机酸和碱。优选的pH值调节剂的实例是一种铵碱,因为在干燥时,没有有害的阳离子残留在所述阴离子粘土中。
如果需要,通过根据本发明的方法制备的阴离子粘土可以进行离子交换。在离子交换时,用其它阴离子取代所述中间层的平衡电荷的阴离子。所述其它阴离子是在阴离子粘土中通常存在的那些阴离子,包括柱形阴离子,如V10O28 -6、Mo7O24 6-、PW12O40 3-、B(OH)4 -、B4O5(OH)4 2-、HBO4 2-、HGaO3 2-、CrO4 2-。在US4774212中给出了合适的柱形阴离子的实例,为此,该专利引做参考。所述离子交换在浆料中形成的所述阴离子粘土的干燥之前或之后进行。
本发明的方法提供了制备具有宽范围Mg/Al比的产品的广泛的可行性。Mg∶Al比可以从0.1变化到10,优选地从1变化到6,更优选地从2变化到4,特别优选地接近3。
对于某些应用,希望有添加剂存在,包括金属和非金属,如稀土金属、Si、P、B、VI族、VIII族、碱土金属(例如Ca和Ba)和/或过渡金属(例如Mn、Fe、Ti、Zr、Cu、Ni、Zn、Mo、Sn)。所述金属和非金属可以容易地沉积在根据本发明的阴离子粘土或固溶体上,或者,它们可以加入到向所述反应器中加入的铝源或镁源中或者单独加入到反应器中。所述金属和非金属也可以加入到其中进行所述反应的水基悬浮液中。合适的金属或非金属源是氧化物、卤化物或任何其它盐类,如氯化物、硝酸盐等。在多步骤方法的情况下,可以在所述步骤的任一个中加入所述金属和非金属。它对于控制所述金属和非金属在所述阴离子粘土中的分布是特别有利的。
本发明通过下列实施例说明,但是这些实施例无论如何不能认为是限制性的。
实施例
基于现有技术状态的对比实施例
对比实施例1
从Reheis Chemical Company获得市售的Mg-Al碳酸根阴离子粘土的试样。图1表示其PXRD谱图。
|
D(A) |
7.80 |
3.89 |
2.59 |
|
I/I0 |
100 |
40 |
35 |
对比实施例2
本对比实施例说明共沉淀法,其中,向一种碱溶液中加入Mg和Al的盐溶液。(US3 979 523受让人Kyowa Chemical Industry,Japan)
在室温下,在强烈搅拌的条件下向含有0.05M Na2CO3的150ml的蒸馏水中滴加在100ml蒸馏水中含有0.04M Al(NO3)2·9H2O和0.08MMg(NO3)2·6H2O的溶液。Mg/Al比为2.0。通过加入3N NaOH把pH值保持在接近10,所得的浆料在室温下陈化一整夜。通过离心分离所述沉淀物,用热蒸馏水洗涤数次,然后在65℃干燥一整夜。
图2表示这种试样获得的PXRD谱图。结果为:
|
D(A) |
7.84 |
3.90 |
2.56 |
|
I/I0 |
100 |
40 |
20 |
热重分析表明有三个失重:在约100、250和450℃处,分别归因于失去物理吸附水、层间水和失去CO2以及晶格脱水。
对比实施例3
把实施例1中所得的产物在500℃煅烧12h。所述产物在45和63度2θ给出宽的X射线衍射线,类似于通过其它已经建立的方法制备的Mg∶Al比在2和5之间的煅烧阴离子粘土试样获得的那些X射线衍射线。
对比实施例4
把实施例2中所得的产物在500℃煅烧12h。所述产物在45和63度2θ给出宽的X射线衍射线,类似于通过其它已经建立的方法制备的Mg∶Al比在2和5之间的煅烧阴离子粘土试样获得的那些X射线衍射线。
对比实施例5
在室温下把0.15g的对比实施例3的产物加入到75ml的水中,并搅拌12h。把所述产物过滤、洗涤并在80℃干燥。PXRD谱图表明所述阴离子粘土结构已经重新形成,特征线在所述PXRD上的11.5、23.5和35°处。
对比实施例6
在室温下把0.15g的对比实施例4的产物加入水中,并搅拌12h。把所述产物过滤并在80℃干燥。PXRD谱图表明所述产物类似于对比实施例5的产物,证明所述阴离子粘土结构已经重新形成。
本发明的实施例
在氮气或不含二氧化碳的气氛下可以制备所述阴离子粘土,使得所述阴离子粘土主要含有氢氧根而不是主要为碳酸根作为平衡电荷的阴离子。也可能向所述反应器中送入二氧化碳,使得产生一种主要以碳酸根为平衡电荷的阴离子的阴离子粘土。
实施例7
把80∶20的三水铝矿和无定形凝胶氧化铝的混合物加入到水中的悬浮液形式的MgO中,并把所述混合物在85℃处理24小时。所述产物在110℃干燥(图3)。
实施例8
在400g去离子水中把16.27g三水铝矿和5.13g在400℃预先煅烧的三水铝矿试样制成浆料。向这种浆料中,加入在170g去离子水中的27.2g的MgO粉末的浆料并在混合器中混合10分钟。所述三水铝矿与煅烧的三水铝矿的重量比是70∶30,在所述浆料中的Mg∶Al比为2.3。通过加入氢氧化铵溶液把pH值调节到9.94。最后的浆料固相含量=7.0wt%。所述浆料在120℃陈化18小时,所得产物在110℃干燥。见如图4。
实施例9
在400g去离子水中把16.27g三水铝矿和5.13g在400℃预先煅烧的三水铝矿试样制成浆料。向这种浆料中,加入在170g去离子水中的27.2g的MgO粉末的浆料并在混合器中混合10分钟。所述三水铝矿与煅烧的三水铝矿的重量比是70∶30,在所述浆料中的Mg∶Al比为2.3。通过加入氢氧化铵溶液把pH值调节到9.94。最后的浆料固相含量=7.0wt%。在微波炉中在200psi(大约198℃)把所述浆料处理60分钟。所得产物在110℃干燥。
实施例10
在400g去离子水中把16.27g三水铝矿和5.75g快速煅烧三水铝矿CP-1.5的试样制成浆料。向这种浆料中,加入在170g去离子水中的27.2g的MgO粉末的浆料并在混合器中混合10分钟。所述三水铝矿与CP-1.5的重量比是70∶30,在所述浆料中的Mg∶Al比为2.3。通过加入氢氧化铵溶液把pH值调节到9.87。最后的浆料固相含量=7.0wt%。所述浆料在120℃陈化18小时,所得产物在110℃干燥。见如图5。
实施例11
在400g去离子水中把16.27g三水铝矿和5.75g快速煅烧三水铝矿CP-1.5的试样制成浆料。向这种浆料中,加入在170g去离子水中的27.2g的MgO粉末的浆料并在混合器中混合10分钟。所述三水铝矿与CP-1.5的重量比是70∶30,在所述浆料中的Mg∶Al比为2.3。通过加入氢氧化铵溶液把pH值调节到9.87。最后的浆料固相含量=7.0wt%。在微波炉中在200psi(大约198℃)把所述浆料处理60分钟。所得产物在110℃干燥。
实施例12
在400g去离子水中把16.27g三水铝矿和6.09g的Catapal A的试样制成浆料。向这种浆料中,加入在170g去离子水中的27.2g的MgO粉末的浆料并在混合器中混合10分钟。所述三水铝矿与Catapal的重量比是70∶30,在所述浆料中的Mg∶Al比为2.3。通过加入氢氧化铵溶液把pH值调节到9.96。最后的浆料固相含量=7.0wt%。所述浆料在120℃陈化18小时,所得产物在110℃干燥。见如图6。
实施例13
在400g去离子水中把16.27g三水铝矿和6.09g的Catapal A的试样制成浆料。向这种浆料中,加入在170g去离子水中的27.2g的MgO粉末的浆料并在混合器中混合10分钟。所述三水铝矿与Catapal的重量比是70∶30,在所述浆料中的Mg∶Al比为2.3。通过加入氢氧化铵溶液把pH值调节到9.96。最后的浆料固相含量=7.0wt%。在微波炉中在200psi(大约198℃)把所述浆料处理60分钟,所得产物在110℃干燥。