CN109689668B - 无加帽步骤的硫醇化寡核苷酸的合成 - Google Patents
无加帽步骤的硫醇化寡核苷酸的合成 Download PDFInfo
- Publication number
- CN109689668B CN109689668B CN201780051170.4A CN201780051170A CN109689668B CN 109689668 B CN109689668 B CN 109689668B CN 201780051170 A CN201780051170 A CN 201780051170A CN 109689668 B CN109689668 B CN 109689668B
- Authority
- CN
- China
- Prior art keywords
- formula
- compound
- agent
- steps
- oligonucleotide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/04—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with deoxyribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/02—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with ribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
- C12N2310/341—Gapmers, i.e. of the type ===---===
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Abstract
本发明在此描述了一种用于制备硫醇化寡核苷酸的合成方法,所述合成方法无需加帽步骤,因为硫化剂使未反应的5’‑OH基团加帽。
Description
相关应用
本申请根据美国法典第35篇第119条(e)款要求2016年6月24日提交的美国临时专利申请号62/354,433的权益,所述专利申请的全部内容特此以引用的方式并入。
序列表
本申请含有已以ASCII格式以电子方式提交且特此以引用的方式整体并入的序列表。创建于2017年6月20日的所述ASCII副本被命名为123429-00220_SL.txt并且大小为3,101个字节。
发明背景
寡核苷酸是可化学合成用于研究和医学目的短DNA或RNA寡聚体。通常通过逐步添加核苷酸残基以产生特定序列来制备寡核苷酸。硫醇化寡核苷酸的当前固相合成制造过程使用每个循环四个反应(即脱保护(例如,脱三苯甲基化)、偶联、硫化和加帽)的重复。设计加帽步骤以阻断在每个循环中未能与亚磷酰胺偶联的任何未反应的5'-羟基,因此失败序列不会进一步参与后续循环中的偶联反应来产生缺失失败偶联的核苷的杂质。加帽步骤通常使用乙酸酐与碱催化剂,如吡啶或N-甲基吗啉进行。
由于需要完成四个步骤中的每一个来将每个核苷酸添加至生长寡聚体,所以减少步骤的数量将减少每个核苷酸添加所需的时间的量以及减少完成寡核苷酸合成所需的试剂的量。因此,需要用于制备寡核苷酸的新的合成方法。
发明内容
本文中的本发明描述了一种使用每个循环三个反应(即脱三苯甲基化、偶联和硫化)而不是常规的每个循环四个反应的重复用于完全或部分硫醇化的寡核苷酸的固相合成制造方法。
通常,通过将连接至固体载体的生长寡聚体的最后一个核苷酸的游离5'-羟基与适当的亚磷酰胺偶联来将核苷酸添加至所述寡聚体链。偶联反应的低效将使一些5'-羟基在后续偶联反应中自由反应,从而产生缺失单个、但随机核苷酸的寡聚体的复杂混合物。因此,为了防止未反应的5'-羟基稍后反应,在硫化步骤之前或之后,经由使用加帽试剂如乙酸酐来使5'-羟基加帽。
出人意料地,本发明人开发了一种消除在硫化步骤之前或之后的加帽步骤的方法。特别地,与其用需要新引入至所述方法的试剂(例如乙酸酐)使未反应的5'-羟基加帽,本发明人出人意料地发现,在硫化步骤中产生的副产物可用于使未反应的5'-羟基加帽。可使这些副产物,或在某些情况下硫化剂本身(例如PADS)再循环穿过固体载体以使未能与亚磷酰胺偶联的5'-羟基加帽。未反应的5'羟基与硫化副产物反应,而无需单独的加帽步骤,并且在后续循环中不再可用于偶联。
对于完全硫醇化的寡核苷酸(即,一种仅包含硫代磷酸酯(–P=S)键的寡核苷酸),根本不需要加帽步骤,并且所述方法包括每个循环仅3个反应(脱保护、偶联和硫化)。
本文所述的方法还可用于制备部分硫醇化的寡核苷酸,所述寡核苷酸包含硫代磷酸酯(–P=S)键和磷酸二酯(-P=O)键。部分硫醇化的寡核苷酸常规地通过4-反应步骤循环制备,所述循环中的第三步骤是氧化或硫化,这取决于是需要–P=O键还是–P=S键。使用本文所述的方法可用于消除硫化步骤后的加帽步骤。然而,因为氧化步骤的副产物不能使未反应的5'-羟基加帽,所以在氧化步骤之后可能剩余残留量的未反应的5'-羟基。然而,对于包含少量–P=O键(例如4个或更少)的部分硫醇化的寡核苷酸,在此所述的方法甚至可在氧化步骤之后没有加帽步骤的情况下使用。对于包含更大量的–P=O键(例如5个或更多)的部分硫醇化的寡核苷酸,可使用本文所述的方法,但是可在每个氧化步骤后使用常规加帽步骤(例如用乙酸酐)。然而,在硫化步骤之后仍然不需要加帽步骤,无论存在多少–P=O键。
附图说明
图1是3-步寡核苷酸合成方法的图。
图2是常规4-步寡核苷酸合成方法的图。应注意,硫化步骤可在常规的每个循环4个反应的方法中在加帽步骤之前或之后进行。
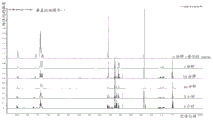
图3是通过使用PADS的4-反应-循环(上图);使用PADS的3-反应-循环(中图);使用苍耳烷氢化物的3-反应-循环(下图)的质谱比较纯度的色谱图。
图4和5是比较用PADS作为硫化剂通过4-反应-循环方法(下图)和3-反应-循环方法(上图)制备的BIIB078的RPIP HPLC色谱图。
图6和7是比较用PADS作为硫化剂通过4-反应-循环方法(下图)和3-反应-循环方法(上图)制备的BIIB078的质谱色谱图。
图8示出BuOH、P(OMe)3和PADS的反应混合物随时间推移的1H NMR光谱,其中用乙腈-d3中的3-甲基吡啶使PADS老化。
图9示出BuOH、P(OMe)3和PADS的反应混合物随时间推移的1H NMR光谱,其中用乙腈-d3中的N-甲基咪唑使PADS老化。
具体实施方式
本发明的第一实施方案是一种用于制备寡核苷酸的方法,所述方法包括:
a)使式(I)化合物:
b)用硫化剂使所述式(III)化合物硫化以形成式(IV)化合物:
以及由未反应的式(I)化合物形成式(V)化合物:
每个R1和R11独立地是核碱基,其中所述核碱基的NH2如果存在的话,受胺保护基团保护;
每个R2和R12独立地选自由以下组成的组:H、卤代和任选地被C1-6烷氧基取代的C1-6烷氧基;
R3是任选地包含接头的固体载体;
Y不存在、是核苷酸或是包含2个或更多个核苷酸的寡核苷酸;
每个R4独立地是H或与R2的烷氧基形成环;
每个R14独立地是H或与R12的烷氧基形成环;
R15是羟基保护基团;
R16是任选地被-CN取代的C1-6烷基;
R17a和R17b独立地是C1-6烷基;
RS是由所述硫化剂的副产物形成的羟基保护基团;
其中使所述硫化剂反应足够量的时间以使未反应的式(I)化合物基本上完全转化为所述式(V)化合物并使所述式(III)化合物转化为所述式(IV)化合物;
其中添加足够量的硫化剂以使未反应的式(I)化合物基本上完全转化为式(V)并使所述式(III)化合物转化为所述式(IV)化合物;并且
其中所述式(I)化合物、所述式(II)化合物、所述式(III)化合物、所述式(IV)化合物和所述式(V)化合物任选地呈药学上可接受的盐的形式。
如本文所用,“足够量的时间”可由本领域技术人员基于反应条件确定。例如,在第十三实施方案中提供的时间(即0至30分钟,例如0、5、10、15、20、25或30分钟)将是“足够量的时间”。
如本文所用,“基本上完全转化”可由本领域技术人员基于反应条件确定。特别地,基本上完全转化意味着将50%、60%、65%、70%、75%、80%、85%、90%、95%或100%未反应的式(I)化合物转化为式(V)化合物或式(III)化合物转化为式(IV)化合物。
在第一实施方案的一些方面,所述方法不包括步骤b之后的额外加帽步骤。具体地,任何未反应的式(I)、(VI)或(IX)化合物通过硫化步骤b的副产物加帽,而无需添加任何其他试剂来使任何未反应的式(I)、(VI)或(IX)化合物加帽。
在第一实施方案的特定方面,
R11是选自由以下组成的组:胞嘧啶、鸟嘌呤、腺嘌呤、胸腺嘧啶(或5-甲基尿嘧啶)、尿嘧啶、次黄嘌呤、黄嘌呤、7-甲基鸟嘌呤、5,6-二氢尿嘧啶、5-甲基胞嘧啶和5-羟甲基胞嘧啶,其中所述核碱基的NH2基团如果存在的话,受PhCO-、CH3CO-、iPrCO-、Me2N-CH=或Me2N-CMe=保护。
R12是选自由以下组成的组:H、卤代、C1-4烷氧基和C1-4烷氧基C1-4烷氧基;
每个R14独立地是H或与R12的烷氧基形成5或6元环;
R15是选自4,4'-二甲氧基三苯甲基、[双-(4-甲氧基苯基)苯基甲基](DMT)或三苯甲基(三苯基甲基,Tr)的羟基保护基团。
R16是被-CN取代的C1-4烷基;并且
R17a和R17b独立地是C1-4烷基。
在特定实施方案中,
在第一实施方案的具体方面,式(II)是选自以下结构式中的任一个:
其中DMTO是4,4'-二甲氧基三苯甲基保护的5'-羟基,并且R11是如针对第一实施方案所定义。
本发明的第二实施方案是一种如针对第一实施方案或其任何方面所描述的方法,所述方法还包括以下步骤:c)使所述式(IV)化合物脱保护以形成式(VI)化合物:
本发明的第三实施方案是一种如针对第二实施方案所描述的方法,所述方法还包括以下步骤:d)使所述式(VI)化合物与式(II)化合物反应以形成式(VII)化合物:
e)用氧化剂使所述式(VII)化合物氧化以形成式(VIII)化合物:
本发明的第四实施方案是一种如针对第三实施方案所描述的方法,所述方法还包括以下步骤:f)使所述式(VIII)化合物脱保护以形成式(IX)化合物:
本发明的第五实施方案是一种如针对第二实施方案和第四实施方案所描述的方法,其中以所述式(VI)化合物或所述式(IX)化合物开始,重复步骤a)、b)和c)n次并且重复步骤d)、e)和f)m次,其中步骤a)、b)和c)以及步骤d)、e)和f)的重复可相对于彼此以任何顺序发生,其中n是至少1或更多并且m是0、1、2、3或4;以形成式(X)或(XI)的寡核苷酸:
其药学上可接受的盐;或者形成寡核苷酸,其中步骤a、b和c或步骤d、e和f的每次重复产生一些未反应的式(VI)和(IX)化合物,所述未反应的式(VI)和(IX)化合物在所述硫化步骤后与过量的硫化剂或所述硫化剂的副产物反应以形成式(XII)或(XIII)化合物:
其中每个X独立地选自S或O,其限制条件是在所述式(X)、(XI)、(XII)和(XIII)化合物中,X仅4、3、2、1或0次为O。特别地,n是1至30、5至25或10至15,并且m是0、1、2、3或4。
以上针对第五实施方案描述的方法包括逐步添加核苷酸以形成所需的寡核苷酸。这些步骤中的每一个包括三个反应以将核苷酸添加至生长寡核苷酸中。在第一步骤(对应于步骤a和d)中,使核苷(如式(I)化合物)的5'端与核苷酸(如式(II)化合物)的3'端偶联。取决于这两个新键合的核苷酸之间的键联是硫代磷酸酯(即,P=S键,如在例如式(IV)中)还是磷酸二酯(即,P=O键,如在例如式(VIII)中),所述寡核苷酸分别被硫化(步骤b)或氧化(步骤e)。最后,使下一个5'-羟基脱保护(步骤c或f,并且例如式(VI)和(IX)),并重复所述过程以添加下一个核苷。如上所述,“一些未反应的式(VI)和(IX)化合物”是指即使偶联步骤a)或d)完成,一些式(VI)和(IX)化合物仍然未反应并可用于后续偶联反应,这将产生相对于所需寡核苷酸缺失寡核苷酸的寡核苷酸。由于相对于所需寡核苷酸仅缺失一个寡核苷酸(“N-1杂质”)的寡核苷酸可能难以与所需的寡核苷酸分离,因此需要未反应的5-OH羟基的加帽以防止形成N-1杂质。考虑“一些”任何量,例如,可剩余少于20%、15%、10%、5%、4%、3%、2%、1%或0.5%。
因此,这种方法允许合成具有任何数量的硫代磷酸酯键和至多四个磷酸二酯的寡核苷酸,而根本不需要任何加帽步骤,因为任何未反应的5'-羟基将与硫化剂本身或硫化剂的副产物反应,其中在两个核苷之间的键联中具有磷原子。这与常规合成形成对比,在常规合成中在偶联步骤之后进行加帽步骤以封闭任何未反应的5'OH。
本发明的第六实施方案是一种如针对第三实施方案所描述的方法,所述方法还包括以下步骤:g)使所述未反应的式(VI)化合物与加帽剂反应以形成式(XIV)化合物:
本发明的第七实施方案是一种如针对第六实施方案所描述的方法,所述方法还包括以下步骤:h)使所述式(VIII)化合物脱保护以形成所述式(XV)化合物:
本发明的第八实施方案是一种如针对第七实施方案所描述的方法,其中以所述式(VI)化合物或所述式(IX)化合物开始,重复步骤a)、b)和c)n次并且重复步骤d)、e)、g)和h)m次,其中步骤a)、b)和c)以及步骤d)、e)、g)和h)的重复可相对于彼此以任何顺序发生,其中n是至少1并且m是0或更大;以形成式(X)或(XVII)的寡核苷酸:
其药学上可接受的盐;或者形成寡核苷酸,其中步骤a、b和c或步骤d、e和f的每次重复产生一些未反应的式(VI)和(IX)化合物,所述未反应的式(VI)和(IX)化合物在所述硫化步骤后与过量的硫化剂或所述硫化剂的副产物反应以形成式XII或XIII化合物:
其中每个X独立地选自S或O。特别地,n是1至30、5至25或10至15,并且m是0至10、0至5或5至10。
以上针对第八实施方案描述的方法包括逐步添加核苷酸以形成所需的寡核苷酸。这些步骤各自包括三个反应来将含有硫代磷酸酯键联的核苷酸添加至生长寡核苷酸,和四个反应来将含有磷酸二酯键联的核苷酸添加至所述生长寡核苷酸。在第一步骤(对应于步骤a和d)中,使核苷(如式I化合物)的5'端与核苷酸(如式II化合物)的3'端偶联以使这两个核苷酸偶联(从而形成化合物,如式(III)和(VII)的那些化合物)。取决于这两个新键合的核苷酸之间的键联是硫代磷酸酯(即,P=S键)还是磷酸二酯(即,P=O键),所述寡核苷酸被硫化(步骤b,从而形成诸如式(IV)的那些的化合物)或被氧化(步骤e,从而形成诸如式(IV)或(VIII)的那些的化合物)。与以上针对第五实施方案所描述的方法不同,由于第八实施方案允许无限数量的磷酸二酯键联,因此必须在每个氧化步骤之后完成加帽步骤(步骤g)。然而,关于第五实施方案,在硫化步骤之后不需要加帽步骤。关于第五实施方案,使下一个5'-羟基脱保护(步骤c或h,并且例如,式(VI)和(IX)),并重复所述过程以添加下一个核苷。因此,这种方法允许合成具有任何数量的硫代磷酸酯键和磷酸二酯键的寡核苷酸,并且仅在包括氧化步骤的循环后需要加帽步骤。这与常规合成形成对比,在常规合成中在每个循环进行加帽步骤以封闭任何未反应的5'OH,甚至包括硫化步骤的那些。
在第一、第二、第三、第四、第五、第六、第七和第八实施方案的一些方面,式(I)、(II)、(III)、(IV)、(V)、(VI)、(VII)、(VIII)、(IX)、(X)、(XI)、(XII)、(XIII)、(XIV)或(XV)的化合物不是盐。
在第五或第八实施方案的特定方面,n是2至1000。特别地,n是2至500。特别地,n是2至50。特别地,n是2至25。
在第九实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七和第八实施方案或其任何方面中的任一项所描述,其中使连接至固体载体的接头裂解。
在第十实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八和第九实施方案或其任何方面中的任一项所描述,所述硫化剂是式A化合物:
在第十实施方案的特定方面,R1和R2均是甲基:
在第十一实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八和第九实施方案或其任何方面中的任一项所描述,所述硫化剂是式B化合物:
在第十二实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八和第九实施方案或其任何方面中的任一项所描述,所述硫化剂是3H-1,2-苯并二硫醇-3-酮1,1-二氧化物(贝卡格(Beaucage)试剂):
在第十三实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一和第十二实施方案或其任何方面中的任一项所描述,其中通过使所述硫化剂再循环0至30分钟,例如0、5、10、15、20、25或30分钟来使所述硫化剂反应。在一个实施方案中,使所述硫化剂再循环1至30分钟、1至20分钟、1至10分钟或1至5分钟。在另一个实施方案中,使所述硫化剂再循环1、2、3、4、5、6、7、8、9或10分钟。
在第十四实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二和第十三实施方案或其任何方面中的任一项所描述,其中使所述硫化剂再循环至少0-20次,例如1、2、5、10、15、20次。在一个实施方案中,使所述硫化剂再循环1-20次、1-10次或1-5次。
在第十五实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三和第十四实施方案或其任何方面中的任一项所描述,通过使相对于连接至固体载体的第一核苷的量3至6当量的硫化剂再循环来使所述硫化剂反应。
在第十六实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四和第十五实施方案或其任何方面中的任一项所描述,所述硫化试剂的浓度是0.02M至2.0M。在一些方面,将硫化剂溶解在吡啶、3-甲基吡啶、乙腈或其混合物中。在第十六实施方案的特定方面,所述硫化试剂的浓度是0.05M至0.5M。在特定方面,所述硫化试剂是溶解于吡啶中的以0.02M至0.1M,例如0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09或0.1M的浓度添加的3-(二甲基氨基-亚甲基)氨基)-3H-1,2,4-二噻唑(DDTT)。在特定方面,所述硫化试剂是以在乙腈(ACN)中0.01M至0.2M,例如0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.2M的浓度添加的3H-1,2-苯并二硫醇-3-酮1,1-二氧化物(贝卡格试剂)。在特定方面,所述硫化试剂是以在乙腈(ACN)/3-甲基吡啶中0.01M至0.2M,例如0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.2M的浓度添加的苯乙酰二硫化物(PADS)。在特定方面,所述硫化试剂是以在吡啶中0.01M至0.2M,例如0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.2M的浓度添加的3-氨基-1,2,4-二噻唑-5-硫酮(XH或ADTT)。
在某些实施方案中,将以上描述的硫化试剂(例如,苯乙酰二硫化物(PADS)或3-氨基-1,2,4-二噻唑-5-硫酮(XH))在其用于本发明的方法之前用碱处理(即,老化)。示例性碱包括但不限于N-甲基咪唑、吡啶和3-甲基吡啶。所述硫化试剂可用碱老化(即,用碱处理)1分钟至5天,例如5分钟至24小时、10分钟至12小时、30分钟至10小时、1小时至8小时、2小时至6小时或3小时至5个小时。在一个实施方案中,使所述硫化试剂老化4小时。在另一个实施方案中,在用于本发明的方法中之前,用3-甲基吡啶使所述硫化试剂PADS老化4小时。
在第十七实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五和第十六实施方案或其任何方面中的任一项所描述,所述核碱基是选自由以下组成的组:胞嘧啶、鸟嘌呤、腺嘌呤、胸腺嘧啶(或5-甲基尿嘧啶)、尿嘧啶、次黄嘌呤、黄嘌呤、7-甲基鸟嘌呤、5,6-二氢尿嘧啶、5-甲基胞嘧啶和5-羟甲基胞嘧啶,其中所述核碱基的NH2基团如果存在的话,受PhCO-、CH3CO-、iPrCO-、Me2N-CH=或Me2N-CMe=保护。在特定实施方案中,所述核碱基是选自由以下组成的组:胞嘧啶、鸟嘌呤、腺嘌呤、胸腺嘧啶(或5-甲基尿嘧啶)、尿嘧啶和5-甲基胞嘧啶,其中所述核碱基的NH2基团如果存在的话,受PhCO-、CH3CO-、iPrCO-、Me2N-CH=或Me2N-CMe=保护。
在第十八实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六和第十七实施方案或其任何方面中的任一项所描述,每个R2和R12独立地选自由以下组成的组:H、F和任选地被C1-4烷氧基取代的C1-4烷氧基;每个R4独立地是H或与R2的烷氧基形成环,其中所述环是任选地被1至3个C1-4烷基取代的5或6元环;R16是–CH2CH2CN;R17a和R17b独立地是C1-4烷基;并且每个R14独立地是H或与R12的烷氧基形成环,其中所述环是任选地被1至3个C1-4烷基取代的5或6元环。
在第十九实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六、第十七和第十八实施方案或其任何方面中的任一项所描述,每个R2和R12独立地选自H或任选地被C1-4烷氧基取代的C1-4烷氧基;R15是4,4'-二甲氧基三苯甲基;R16是–CH2CH2CN;R17a和R17b独立地是C1-6烷基;并且RS是–C(=N)(SH)-CN或-C(=O)CH2C6H5。
在第二十实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六、第十七、第十八和第十九实施方案或其任何方面中的任一项所描述,Y不存在。或者,Y是单个核苷酸。或者,Y是包含2至50个核苷酸,特别是2至40个核苷酸、2至30个核苷酸或2至25个核苷酸的寡核苷酸。
在第二十一实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六、第十七、第十八、第十九和第二十实施方案或其任何方面中的任一项所描述,所述式(X)或(XI)化合物是包含2至30个核苷酸的反义寡核苷酸。在特定方面,所述反义寡核苷酸仅包含修饰的RNA。或者,所述反义寡核苷酸包含DNA和修饰的RNA。特别地,所述反义寡核苷酸是缺口聚物(gapmer)。或者,所述反义寡核苷酸仅包含DNA。
在第二十二实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六、第十七、第十八、第十九、第二十和第二十一实施方案或其任何方面中的任一项所描述,所述反义寡核苷酸是具有以下序列(从5'至3')的硫代磷酸酯寡核苷酸:
TCACTTTCATAATGCTGG(SEQ ID NO:1),
其中所述寡核苷酸的每个核苷间键联是硫代磷酸酯键联,所述寡核苷酸的每个核苷是2'-O-甲氧基乙基(MOE)核苷,并且每个胞嘧啶是5-甲基胞嘧啶。SEQ ID NO:1也被称为BIIB058并且描述于WO2007/002390、WO2010/148249和US8,980,853中,其各自的教义以引用的方式并入本文。
在第二十三实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六、第十七、第十八、第十九、第二十和第二十一实施方案或其任何方面中的任一项所描述,所述反义寡核苷酸的序列是具有以下序列(从5'至3')的5-10-5MOE缺口聚物:
CAGGATACATTTCTACAGCT(SEQ ID NO:2),
其中核苷1-5和16-20中的每一个是2’-O-甲氧基乙基核糖修饰的核苷,并且核苷6-15中的每一个是2’-脱氧核苷,其中在核苷2至3、4至5、16至17和18至19之间的核苷间键联是磷酸二酯键联,并且在核苷1至2、3至4、5至6、6至7、7至8、8至9、9至10、10至11、11至12、12至13、13至14、14至15、15至16、17至18和19至20之间的核苷间键联是硫代磷酸酯键联,并且其中每个胞嘧啶是5’-甲基胞嘧啶。SEQ ID NO:2通过以下化学符号进行描述:mCes AeoGes Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te;其中,
A=腺嘌呤,
mC=5'-甲基胞嘧啶
G=鸟嘌呤,
T=胸腺嘧啶,
e=2'-O-甲氧基乙基核糖修饰的糖,
d=2'-脱氧核糖,
s=硫代磷酸酯核苷间键联,以及
o=磷酸二酯核苷间键联。
SEQ ID NO:2被称为BIIB067或ISIS 666853所述并且描述于WO2015153800中,其教义以引用的方式并入本文。
在第二十四实施方案中,所述方法如针对第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六、第十七、第十八、第十九、第二十和第二十一实施方案或其任何方面中的任一项所描述,所述反义寡核苷酸是具有以下序列(从5'至3')的4-8-6缺口聚物:
GCCCCTAGCGCGCGACUC(SEQ ID NO:8)
其中核苷1-4和13-18中的每一个是2’-O-甲氧基乙基核糖修饰的核苷,并且核苷5-12中的每一个是2’-脱氧核糖核苷酸,其中在核苷2至3、3至4、13至14、14至至15和15至16之间的核苷间键联是磷酸二酯键联,并且在核苷1至2、4至5、5至6、6至7、7至8、8至9、9至10、10至11、11至12、12至13、16至17和17至18之间的核苷间键联是硫代磷酸酯键联,其中每个胞嘧啶是5-甲基胞嘧啶,并且其中尿嘧啶是5-甲基尿嘧啶。SEQ ID NO:8通过以下化学符号进行描述:
5′-G Me C P=O Me C POO MeCMeCTAGMeCGMeCGMe C P=O G P=O A P=O Me C Me U Me C-3′
下划线=MoE核糖核苷酸
G=鸟嘌呤
MeC=5-甲基胞嘧啶
T=胸腺嘧啶
A=腺嘌呤
MeU=5-甲基尿嘧啶(也称为胸腺嘧啶)
P=O=磷酸二酯核苷间键联
任何其他核苷间键联是磷酸硫酯(phosphothioester)键联。
“胺保护基团”包括适用于保护胺基团NH2的任何基团,例如但不限于PhCO-、CH3CO-、iPrCO-和Me2N-CH=、Me2N-CMe=。所得到的由Me2N-CH=和Me2N-CMe=保护的氨基的结构是如下:
其他胺保护基团可在Greene,TW等人,Protective Groups in OrganicSynthesis,第4版,John Wiley and Sons(2007)中找到。
不希望受理论束缚,认为在偶联步骤中未能偶联的5'-羟基与硫化剂(例如像PADS)由硫化形成羟基衍生物,或者由苍耳烷氢化物形成N-氰基硫代甲亚胺酸酯,或由DDTT形成N,N-二甲基硫脲-N-硫代甲酸酯:
“羟基保护基团”包括适用于保护羟基OH的任何基团。这些保护基团和羟基保护基团的其他实例可在Greene,TW等人,Protective Groups in Organic Synthesis,第4版,John Wiley and Sons(2007)中找到。
在具体实施方案中,羟基保护基团由加帽剂(例如,在式(XIV)中RC)形成并且可以选自,例如,乙酰基(Ac);苯甲酰(Bz);苄基(Bn);β-甲氧基乙氧基甲基醚(MEM);甲氧基甲基醚(MOM);甲氧基三苯甲基[(4-甲氧基苯基)二苯基甲基,MMT);对甲氧基苄基醚(PMB);甲硫基甲基醚;新戊酰基(Piv);四氢吡喃基(THP);四氢呋喃(THF);甲硅烷基醚(包括但不限于三甲基甲硅烷基(TMS)、叔丁基二甲基甲硅烷基(TBDMS)、三异丙基甲硅烷基氧基甲基(TOM)和三异丙基甲硅烷基(TIPS)醚);甲基醚和乙氧基乙基醚(EE)。
或者,羟基保护基团封闭核苷或核苷酸的5'-羟基(例如,式(II)、(III)、(IV)、(VII)和(VIII)中的R15),并且在特定方面是选自4,4'-二甲氧基三苯甲基、[双-(4-甲氧基苯基)苯基甲基](DMT)或三苯甲基(三苯基甲基,Tr)的酸不稳定保护基团。
“核碱基”是指核苷的杂环碱基部分。核碱基可以是天然存在的或可以是修饰的。在某些实施方案中,核碱基可包含能够与另一核酸的核碱基氢键合的任何原子或原子团。特别地,所述核碱基是杂环碱基,通常是嘌呤和嘧啶。除了“未修饰的”或“天然的”核碱基如嘌呤核碱基腺嘌呤(A)和鸟嘌呤(G)以及嘧啶核碱基胸腺嘧啶(T)、胞嘧啶(C)和尿嘧啶(U)外,本领域技术人员已知的许多修饰的核碱基或核碱基模拟物适于并入通过本文所述的方法合成的化合物中。在某些实施方案中,修饰的核碱基是在结构上与亲本核碱基非常相似的核碱基,例如像7-脱氮嘌呤、5-甲基胞嘧啶或G型夹。在某些实施方案中,核碱基模拟物包括更复杂的结构,例如像三环吩噁嗪核碱基模拟物。用于制备上述修饰的核碱基的方法是本领域技术人员所熟知的。
“核苷”是指包含杂环碱基部分和糖部分的化合物。
“核苷酸”是指包含磷酸酯连接基团的核苷。
“寡核苷酸”是指包含多个连接的核苷的化合物。在某些实施方案中,所述多个核苷中的一或多个是修饰的。在某些实施方案中,寡核苷酸包含一个或多个核糖核苷(RNA)和/或脱氧核糖核苷(DNA)。
“核苷间键联”是指寡核苷酸的相邻核苷之间的共价键联。
“缺口聚物(Gapmer)”是指其中具有多个支持RNA酶H裂解的核苷的内部区域位于具有一个或多个核苷的外部区域之间的嵌合反义化合物,其中包含所述内部区域的核苷在化学上不同于包含外部区域的核苷。
如本文所用,术语“烷基”是指完全饱和的支链的或无支链的烃部分。优选地,烷基包含1至20个碳原子,更优选1至16个碳原子、1至10个碳原子、1至6个碳原子或1至4个碳原子。在一些实施方案中,烷基包括6至20个碳原子。烷基的代表性实例包括但不局限于:甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基、3-甲基己基、2,2-二甲基戊基、2,3-二甲基戊基、正庚基、正辛基、正壬基或正癸基。
术语“芳基”是指在环部分中具有6至14个碳原子的单环、双环或三环芳族烃基。在一个实施方案中,术语芳基是指具有6至10个碳原子的单环和双环芳族烃基。芳基的代表性实例包括苯基、萘基、芴基和蒽基。
术语“芳基”还指双环或三环基团,其中至少一个环是芳族的并且与一个或两个非芳族烃环稠合。非限制性实例包括四氢萘、二氢萘基和茚满基。
烷基或芳基的任选取代基在每次出现时独立地选自C1-6烷基、C2-6烯基、C2-6炔基、3至7元碳环基、3至7元杂环基、卤代、-CN、-C(O)Ra、-C(O)2Ra、-C(O)N(Ra)2、-ORa、-N(Ra)2、-N(Ra)C(O)Ra、-N(Ra)N(Ra)2、-NO2、-N(Ra)C(O)2Ra、-N(Ra)C(O)N(Ra)2、-N(Ra)S(O)2Ra、-SRa、-S(O)Ra、-S(O)2Ra、-S(O)N(Ra)2以及-S(O)2N(Ra)2;并且
Ra在每次出现时独立地选自H、C1-6烷基、3至6元单环碳环基和3至6元单环杂环基。
如本文所用,术语“碳环基”是指3-7个碳原子、3-6或5-7个碳原子的饱和或不饱和的单环或双环烃基。术语“碳环基”涵盖环烷基和芳族基团。术语“环烷基”是指3-7个碳原子、3-6个碳原子或5-7个碳原子的完全饱和的单环或双环烃基。示例性单环碳环基包括但不限于环丙基、环丁基、环戊基、环己基、环庚基、环丙烯基、环丁烯基、环戊烯基、环己烯基、环庚烯基、环丁二烯基、环戊二烯基、环己二烯基、环庚二烯基、苯基和环庚三烯基。示例性双环碳环基包括双环[2.1.1]己基、双环[2.2.1]庚基、双环[2.2.1]庚烯基、三环[2.2.1.02 ,6]庚烷基、6,6-二甲基双环[3.1.1]庚基或2,6,6-三甲基双环[3.1.1]庚基、螺[2.2]戊烷基和螺[3.3]庚烷基。
如本文所用,术语“桥环系统”是具有碳环基或杂环基环的环系统,其中所述环的两个不相邻原子通过选自C、N、O或S的一个或多个(优选一至三个)原子连接(桥联)。桥环系统可具有6-7个环成员。
如本文所用,术语“螺环系统”是具有两个环的环系统,所述环各自独立地选自碳环基或杂环基,其中两个环结构具有共同的一个环原子。螺环系统具有5至7个环成员。
如本文所用,术语“杂环基”是指饱和或不饱和的单环或双环(例如,桥环或螺环系统)环系统,所述环系统具有3至7个环成员或特别是3至6个环成员或5至7个环成员,所述环成员中的至少一个是杂原子,并且所述环成员中的至多4个(例如,1、2、3或4个)可以是杂原子,其中所述杂原子独立地选自O、S和N,并且其中C可被氧化(例如,C(O)),N可被氧化(例如,N(O))或季铵化,并且S可任选地被氧化成亚砜和砜。不饱和杂环包括杂芳基环。如本文所用,术语“杂芳基”是指具有1至4个独立地选自O、S和N的杂原子的芳族5或6元单环系统,并且其中N可被氧化(例如,N(O))或季铵化,并且S可任选地被氧化成亚砜和砜。在一个实施方案中,杂环基是3至7元饱和单环或3至6元饱和单环或5至7元饱和单环。在一个实施方案中,杂环基是3至7元单环或3至6元单环或5至7元单环。在另一个实施方案中,杂环基是6或7元双环。杂环基可连接在杂原子或碳原子处。杂环基的实例包括氮丙啶基、环氧乙烷基、硫杂环丙烷基、氧氮杂环丙烷基、二环氧乙烷基、氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、四氢呋喃基、硫杂环戊烷基、咪唑烷基、吡唑烷基、噁唑烷基、异噁唑烷基、噻唑烷基、异噻唑烷基、二氧戊环基、二硫戊环基、氧硫杂环戊基、哌啶基、四氢吡喃基、噻烷基、哌嗪基、吗啉基、硫代吗啉基、二氧杂环己烷基、二硫杂环己烷基、三氧杂环己烷基、三硫杂环己烷基、氮杂环庚烷基、氧杂环庚烷基、硫杂环庚烷基、二氢呋喃基、咪唑啉基、二氢吡喃基和杂芳基环,包括氮丙啶基、氧杂环丙稀基、硫杂环丙烯基、二吖丙啶基、氮杂环丁烯基、氧杂环丁烯基、硫杂环丁烯基、吡咯基、呋喃基、苯硫基(或噻吩基)、咪唑基、吡唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、呋咱基、噁二唑基、噻二唑基、二噻唑基、三唑基、四唑基、吡啶基、吡喃基、噻喃基、吡嗪基、嘧啶基、哒嗪基、噁嗪基、噻嗪基、二氧杂环己烯基、二硫杂环己烯基、氧硫杂环己烷基、三嗪基、四嗪基、氮杂卓基、氧杂卓基、硫杂卓基、二氮杂卓基以及硫氮杂卓基等。双环杂环系统的实例包括3-氮杂双环[3.1.0]己烷基、3-氮杂双环[3.1.1]庚烷基、2-氮杂螺[3.3]庚烷基、2-氧杂-6-氮杂螺[3.3]庚烷基以及5-氮杂螺[2.3]己烷基。
“卤素”或“卤代”可以是氟、氯、溴或碘。
实施例
实施例1寡核苷酸合成。
使用AKTA 100固相合成仪与Nittophase HL Unylinker(Kinovate,负载350μmol/g)作为固体载体,在0.72-2.2mmol规模上合成寡核苷酸。用于连接每个核苷的合成循环由三个反应步骤组成:脱三苯甲基化、偶联和硫化。脱三苯甲基化步骤用甲苯中的二氯乙酸(10%)作为试剂完成。通过使相应的亚磷酰胺(在乙腈中0.1-0.2M)和4,5-二氰基咪唑(在含有0.1M N-甲基咪唑的乙腈中1.0M)的溶液循环通过固体载体来进行偶联步骤。通过循环以下溶液中的任一种来完成硫化步骤:(a)乙腈/3-甲基吡啶(1:1,v/v)中的0.2M PADS;(b)吡啶中的0.2M 3-氨基-1,2,4-二噻唑-5-硫酮(XH);(c)乙腈中的0.2M 3H-1,2-苯并二硫醇-3-酮1,1-二氧化物(贝卡格试剂);或(d)吡啶中的0.1M 3-((二甲基氨基-亚甲基)氨基)-3H-1,2,4-二噻唑-3-硫酮(DDTT)。对于对照实验,合成由四个反应步骤组成:脱三苯甲基化、偶联和硫化以及加帽步骤。除硫化步骤后的加帽步骤外,所有步骤均以与上述相同的方式进行。用乙酸酐、吡啶和N-甲基咪唑于乙腈中的混合物进行加帽。在浓氢氧化铵中在升高的温度(50℃至60℃)下进行从载体裂解寡核苷酸和碱脱保护。合成反应参数总结在以下表1中。通过LC-MS分析寡核苷酸产物。
表1-方法方案
*CV:柱体积
**eq.:当量
通过以下方法制备的寡核苷酸:
1.BIIB 058(SEQ ID NO:1),一种18聚体硫代磷酸酯寡核苷酸,其中每个核糖寡核苷酸在2′位置包含甲氧基-乙基(MoE)。
2.BIIB 067(SEQ ID NO:2),一种5-10-5缺口聚物磷酸硫酯和磷酸二酯混合主链寡核苷酸。缺口聚物的中心嵌段是10个脱氧核糖核苷酸,所述中心嵌段由2′-MoE核糖核苷酸的嵌段侧接。
3.如下文表2中所示的硫代磷酸酯寡核苷酸A、B、C、D和E。
4.BIIB 078(SEQ ID NO:8),一种4-8-6缺口聚物磷酸硫酯和磷酸二酯混合主链寡核苷酸。缺口聚物的中心嵌段是8个脱氧核糖核苷酸,所述中心嵌段由2′-MoE核糖核苷酸的嵌段侧接。
5′-G Me C P=O MeCP=O Me C MeCTAGMeCGMeCGMe C P=O G P=OAP=O Me C Me U Me C-3′(SEQ ID
NO:8)
下划线:MoE核糖核苷酸
P=O:磷酸二酯
任何其他:磷酸硫酯
表2.硫代磷酸酯寡核苷酸A、B、C、D和E
结果
1.BIIB058
BIIB058使用本发明的方法(即,3-反应-循环)制备并与常规的每个循环过程4个反应进行比较。PADS和苍耳烷氢化物用作硫化剂。硫化反应以再循环模式进行5分钟。每种方法的结果在表3中示出。
表3.BIIB058粗产率和纯度比较
将用PADS作为硫化剂的4-反应-循环与3-反应-循环进行比较,BIIB058的产率和纯度在3-反应-循环中增加,并且未产生新的杂质。3-反应-循环中的苍耳烷氢化物与PADS表现类似。质谱色谱图的比较在图3中提供。
2.BIIB067
BIIB067使用本发明的方法(即,3-反应-循环)制备并与常规的每个循环过程4个反应进行比较,其中PADS用作硫化剂。硫化反应以再循环模式进行5分钟。与BIIB0058不同,BIIB067包含P=O键以及P=S键。因此,进行三种不同的反应:1)4反应-循环,2)3反应-循环,以及3)具有仅在氧化步骤后添加的加帽步骤的3反应-循环。因此,对于所述核苷酸,将包括氧化而不是硫化步骤,在氧化步骤之后不进行加帽步骤。每种方法的结果在表4中示出。
表4 BIIB 067粗产率和纯度比较
将4-反应-循环与氧化后无加帽反应的3-反应-循环进行比较,BIIB067的产率和纯度增加,并且未产生新的杂质。仅在氧化反应后包括加帽步骤未改进如通过3-反应-循环制备的BIIB067的总体纯度。因此,即使在包含P=O键的寡核苷酸情况下,也可使用无加帽的3-反应-循环。
3.寡核苷酸A、B、C、D和E
寡核苷酸A、B、C、D和E使用本发明的方法制备并与常规的每个循环过程4个反应进行比较。表5提供了用于合成的亚磷酰胺。所使用的硫化剂在表6中示出。
表5.用于合成的亚磷酰胺
表6.用于合成相应寡核苷酸的硫化试剂
如表7中所示,来自本发明方法的粗寡核苷酸的产率、UV纯度和MS杂质分布与如通过常规上文4-反应-循环方法制备的粗寡核苷酸相似。
表7.DMT-开启产物的光学产率(OD)和RPIP HPLC纯度
4.BIIB 078
BIIB078使用本发明的方法(即,3-反应-循环)制备并与常规的每个循环过程4个反应进行比较。PADS用作硫化剂。硫化反应以再循环模式进行3分钟。每种方法的结果在表8和图4-7中示出。
表8.BIIB 078粗产率和纯度比较
将用PADS作为硫化剂的4-反应-循环与3-反应-循环进行比较,BIIB078的产率和纯度在3-反应-循环中增加,并且未产生新的杂质。HPLC色谱图和质谱法色谱图的比较在图4-7中提供。
实施例2.PADS用于硫化和加帽的双重作用的NMR研究
在第一NMR实验中,使PADS在22℃下在乙腈-d3中的3-甲基吡啶中老化16小时(方案1)。在老化后,在溶液中添加n-BuOH,并且在不同的时间点取得NMR光谱。光谱显示PHCH2CO2Bu的形成非常缓慢。
在遵循与上文的相同程序的单独实验中,在添加BuOH后,向反应混合物中添加P(OMe)3并且在不同的时间点记录反应混合物的NMR光谱。
P(OMe)3具有与固相合成中的亚磷酸酯中间体类似的结构。光谱显示在约2分钟内P(OMe)3的硫化完成并且发生BuOH的酯化(加帽)(图8)。
这些实验结果表明,在硫化期间,产生了活性加帽试剂,并且所述加帽试剂使存在的醇加帽。
方案1.
以N-甲基咪唑作为碱重复相同的实验以使PADS老化并获得类似的结果(方案2)。不添加P(OMe)3,酯化反应非常缓慢,但在硫化反应后立即发生BuOH的酯化。这些结果再次表明,一旦发生硫化,就发生硫化和加帽(图9)。
方案2.PADS在NMI中的老化
Claims (44)
1.一种用于制备寡核苷酸的方法,所述方法包括:
a)使式(I)化合物:
b)用硫化剂使所述式(III)化合物硫化以形成式(IV)化合物:
以及由未反应的式(I)化合物形成式(V)化合物:
每个R1和R11独立地是核碱基,其中所述核碱基的NH2如果存在的话,受胺保护基团保护;
每个R2和R12独立地选自由以下组成的组:H、卤代和任选地被C1-6烷氧基取代的C1-6烷氧基;
R3是任选地包含接头的固体载体;
Y不存在、是核苷酸或是包含2个或更多个核苷酸的寡核苷酸;
每个R4独立地是H或与R2的烷氧基形成环;
每个R14独立地是H或与R12的烷氧基形成环;
R15是羟基保护基团;
R16是任选地被-CN取代的C1-6烷基;
R17a和R17b独立地是C1-6烷基;
其中(i)所述硫化剂是3-氨基-1,2,4-二噻唑-5-硫酮且RS是–C(SH)(=N)-CN;(ii)所述硫化剂是苯乙酰二硫化物且RS是-C(=O)CH2C6H5;(iii)所述硫化剂是3-(二甲基氨基-亚甲基)氨基)-3H-1,2,4-二噻唑且RS是-C(=S)NHC(=S)N=CHN(CH3)2;(iv)所述硫化剂是3H-1,2-苯并二硫醇-3-酮1,1-二氧化物且RS是并且
其中所述式(I)化合物、所述式(II)化合物、所述式(III)化合物、所述式(IV)化合物和所述式(V)化合物任选地呈药学上可接受的盐的形式;
其限制条件是不需要加帽步骤。
5.如权利要求4所述的方法,其中以所述式(VI)化合物或所述式(IX)化合物开始,重复步骤a)、b)和c)n次并且重复步骤d)、e)和f)m次,其中步骤a)、b)和c)以及步骤d)、e)和f)的重复可相对于彼此以任何顺序发生,其中n是至少1并且m是0、1、2、3或4;以形成式(X)或(XI)的寡核苷酸:
或其药学上可接受的盐;或者形成寡核苷酸,其中步骤a、b和c或步骤d、e和f的每次重复产生一些未反应的式(VI)或(IX)化合物,所述未反应的式(VI)或(IX)化合物在所述硫化步骤后与过量的硫化剂或所述硫化剂的所述副产物反应以形成式(XII)或(XIII)化合物:
其中每个X独立地选自S或O,其限制条件是在所述式(X)、(XI)、(XII)或(XIII)化合物中,X仅4、3、2、1或0次为O。
8.如权利要求7所述的方法,其中以所述式(VI)化合物或所述式(IX)化合物开始,重复步骤a)、b)和c)n次并且重复步骤d)、e)、g)和h)m次,其中步骤a)、b)和c)以及步骤d)、e)、g)和h)的重复可相对于彼此以任何顺序发生,其中n是至少1并且m是0或更大;以形成式(X)或(XVII)的寡核苷酸:
或其药学上可接受的盐;或者形成寡核苷酸,其中步骤a、b和c或步骤d、e和f的每次重复产生一些未反应的式(VI)或(IX)化合物,所述未反应的式(VI)或(IX)化合物在所述硫化步骤后与过量的硫化剂或所述硫化剂的所述副产物反应以形成式(XII)或(XIII)化合物:
9.如权利要求5或8所述的方法,其中n是2至1000。
10.如权利要求5或8所述的方法,其中n是2至500。
11.如权利要求5或8所述的方法,其中n是2至100。
12.如权利要求5或8所述的方法,其中n是2至50。
13.如权利要求5或8所述的方法,其中n是2至25。
14.如权利要求13所述的方法,其中使连接至所述固体载体的接头裂解。
15.如权利要求14所述的方法,其中所述硫化剂是3-氨基-1,2,4-二噻唑-5-硫酮,并且RS是–C(SH)(=N)-CN。
16.如权利要求14所述的方法,其中所述硫化剂是苯乙酰二硫化物,并且RS是-C(=O)CH2C6H5。
17.如权利要求14所述的方法,其中所述硫化剂是3-(二甲基氨基-亚甲基)氨基)-3H-1,2,4-二噻唑,并且RS是-C(=S)NHC(=S)N=CHN(CH3)2。
18.如权利要求14所述的方法,其中所述硫化剂是3H-1,2-苯并二硫醇-3-酮1,1-二氧化物。
20.如权利要求19所述的方法,其中通过使所述硫化剂再循环0至30分钟来使所述硫化剂反应。
21.如权利要求20所述的方法,其中使所述硫化剂再循环至少0-20次。
22.如权利要求20所述的方法,其中使所述硫化剂再循环1-20次、1-10次或1-5次。
23.如权利要求22所述的方法,其中如果第一核苷酸直接连接至所述固体载体,则通过使相对于所述接头或所述第一核苷酸3至6当量的硫化剂再循环来使所述硫化剂反应。
24.如权利要求23所述的方法,其中所述硫化试剂的浓度是0.02M至2.0M。
25.如权利要求24所述的方法,其中所述硫化试剂的浓度是0.05M至0.5M。
26.如权利要求25所述的方法,其中所述硫化试剂是以0.02M至0.1M的浓度添加的3-(二甲基氨基-亚甲基)氨基)-3H-1,2,4-二噻唑。
27.如权利要求26所述的方法,其中所述核碱基是选自由以下组成的组:胞嘧啶、鸟嘌呤、腺嘌呤、胸腺嘧啶、尿嘧啶、次黄嘌呤、黄嘌呤、7-甲基鸟嘌呤、5,6-二氢尿嘧啶、5-甲基胞嘧啶和5-羟甲基胞嘧啶,其中所述核碱基的所述NH2基团如果存在的话,受PhCO-、CH3CO-、iPrCO-、Me2N-CH=或Me2N-CMe=保护。
28.如权利要求27所述的方法,其中所述核碱基是选自由以下组成的组:胞嘧啶、鸟嘌呤、腺嘌呤、胸腺嘧啶、尿嘧啶和5-甲基胞嘧啶,其中所述核碱基的所述NH2基团如果存在的话,受PhCO-、CH3CO-、iPrCO-、Me2N-CH=或Me2N-CMe=保护。
29.如权利要求28所述的方法,其中
每个R2和R12独立地选自由以下组成的组:H、F和任选地被C1-4烷氧基取代的C1-4烷氧基;
每个R4独立地是H或与R2的烷氧基形成环,其中所述环是任选地被1至3个C1-4烷基取代的5或6元环;
R16是–CH2CH2CN;
R17a和R17b独立地是C1-4烷基;并且
每个R14独立地是H或与R12的烷氧基形成环,其中所述环是任选地被1至3个C1-4烷基取代的5或6元环。
30.如权利要求29所述的方法,其中每个R2和R12独立地选自H或任选地被C1-4烷氧基取代的C1-4烷氧基;
R15是4,4'-二甲氧基三苯甲基;
R16是–CH2CH2CN;
R17a和R17b独立地是C1-6烷基;并且
RS是–C(=N)(SH)-CN或-C(=O)CH2C6H5。
31.如权利要求30所述的方法,其中Y不存在。
32.如权利要求30所述的方法,其中Y是单个核苷酸。
33.如权利要求30所述的方法,其中Y是包含2至50个核苷酸的寡核苷酸。
34.如权利要求30所述的方法,其中Y是包含2至40个核苷酸的寡核苷酸。
35.如权利要求30所述的方法,其中Y是包含2至30个核苷酸的寡核苷酸。
36.如权利要求30所述的方法,其中Y是包含2至25个核苷酸的寡核苷酸。
37.如权利要求36所述的方法,其中式(X)化合物是包含2至30个核苷酸的反义寡核苷酸。
38.如权利要求37所述的方法,其中所述反义寡核苷酸仅包含修饰的RNA。
39.如权利要求37所述的方法,其中所述反义寡核苷酸包含DNA和修饰的RNA。
40.如权利要求37所述的方法,其中所述反义寡核苷酸是缺口聚物。
41.如权利要求37所述的方法,其中所述反义寡核苷酸仅包含DNA。
42.如权利要求37所述的方法,其中所述反义寡核苷酸的序列是SEQ ID NO:1。
43.如权利要求37所述的方法,其中所述反义寡核苷酸的序列是SEQ ID NO:2。
44.如权利要求37所述的方法,其中所述反义寡核苷酸的序列是SEQ ID NO:8。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662354433P | 2016-06-24 | 2016-06-24 | |
| US62/354,433 | 2016-06-24 | ||
| PCT/US2017/038643 WO2017223258A1 (en) | 2016-06-24 | 2017-06-22 | Synthesis of thiolated oligonucleotides without a capping step |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN109689668A CN109689668A (zh) | 2019-04-26 |
| CN109689668B true CN109689668B (zh) | 2023-02-17 |
Family
ID=59276874
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780051170.4A Active CN109689668B (zh) | 2016-06-24 | 2017-06-22 | 无加帽步骤的硫醇化寡核苷酸的合成 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US11142545B2 (zh) |
| EP (1) | EP3475292A1 (zh) |
| JP (1) | JP7235512B2 (zh) |
| KR (2) | KR20230133947A (zh) |
| CN (1) | CN109689668B (zh) |
| WO (1) | WO2017223258A1 (zh) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3652187B1 (en) | 2017-07-10 | 2021-09-15 | Geron Corporation | Improved process for preparing imetelstat |
| CN110468171B (zh) * | 2019-09-20 | 2021-10-29 | 凯莱英医药集团(天津)股份有限公司 | 核酸的合成方法 |
| IL295605A (en) | 2020-02-28 | 2022-10-01 | Ionis Pharmaceuticals Inc | Compounds and methods for modulating smn2 |
| CN114685572B (zh) * | 2022-06-02 | 2022-08-30 | 上海百力格生物技术有限公司 | 用于mgb核酸探针合成的氧化剂组合物及探针的合成方法 |
| WO2024061842A1 (en) | 2022-09-19 | 2024-03-28 | Bachem Holding Ag | Improved oligonucleotide synthesis |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6809195B1 (en) * | 2000-08-16 | 2004-10-26 | Isis Pharmaceuticals, Inc. | Process for the preparation of oligonucleotides |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6087491A (en) * | 1993-01-08 | 2000-07-11 | Hybridon, Inc. | Extremely high purity oligonucleotides and methods of synthesizing them using dimer blocks |
| US5614621A (en) * | 1993-07-29 | 1997-03-25 | Isis Pharmaceuticals, Inc. | Process for preparing oligonucleotides using silyl-containing diamino phosphorous reagents |
| EP1386925A1 (en) * | 2002-07-31 | 2004-02-04 | Girindus AG | Method for preparing oligonucleotides |
| ES2397113T3 (es) | 2005-06-23 | 2013-03-04 | Isis Pharmaceuticals, Inc. | Composiciones y procedimientos para modular el corte y empalme de SMN2 |
| TR201816256T4 (tr) | 2009-06-17 | 2018-11-21 | Biogen Ma Inc | Bir süjede smn2 uç birleştirmesinin modülasyonu için bileşimler ve yöntemler. |
| US8642755B2 (en) * | 2009-06-30 | 2014-02-04 | Agilent Technologies, Inc. | Use of thioacetic acid derivatives in the sulfurization of oligonucleotides with phenylacetyl disulfide |
| CA2858576A1 (en) * | 2011-12-06 | 2013-06-13 | Research Institute At Nationwide Children's Hospital | Non-ionic, low osmolar contrast agents for delivery of antisense oligonucleotides and treatment of disease |
| WO2015061246A1 (en) * | 2013-10-21 | 2015-04-30 | Isis Pharmaceuticals, Inc. | Method for solution phase detritylation of oligomeric compounds |
| CN106459972B (zh) | 2014-04-01 | 2020-05-08 | 比奥根Ma公司 | 用于调节sod-1表达的组合物 |
| BR112017018908A2 (pt) * | 2015-03-10 | 2018-04-17 | Aduro Biotech, Inc. | composições e métodos para ativar a sinalização dependente do "estimulador do gene de interferon |
| JOP20190218A1 (ar) * | 2017-03-22 | 2019-09-22 | Boehringer Ingelheim Int | مركبات ثنائية النيوكليوتيدات حلقية معدلة |
-
2017
- 2017-06-22 US US16/312,819 patent/US11142545B2/en active Active
- 2017-06-22 KR KR1020237031095A patent/KR20230133947A/ko not_active Application Discontinuation
- 2017-06-22 CN CN201780051170.4A patent/CN109689668B/zh active Active
- 2017-06-22 EP EP17735311.7A patent/EP3475292A1/en active Pending
- 2017-06-22 KR KR1020197001173A patent/KR20190020743A/ko active Application Filing
- 2017-06-22 JP JP2018567264A patent/JP7235512B2/ja active Active
- 2017-06-22 WO PCT/US2017/038643 patent/WO2017223258A1/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6809195B1 (en) * | 2000-08-16 | 2004-10-26 | Isis Pharmaceuticals, Inc. | Process for the preparation of oligonucleotides |
Non-Patent Citations (3)
| Title |
|---|
| Large-scale synthesis of oligonucleotide phosphorothioates using 3-amino-1,2,4-dithiazole-5-thione as an efficient sulfur-transfer reagent;TANG,ET AL;《ORGANIC PROCESS RESEARCH AND DEVELOPMENT》;20000101;第4卷(第3期);第194-198页 * |
| SULFURIZING REAGENT II AND ITS USE IN SYNTHESIZING OLIGONUCLEOTIDE PHOSPHOROTHIOATES;Marc M. Lemaître, ET AL;《The Glen Report》;20061231;第18卷(第1期);第1-6页 * |
| Synthesis of Antisense Oligonucleotides:Replacement of 3H-1,2-Benzodithiol-3-one 1,1-Dioxide(Beaucage Reagent) with Phenylacetyl Disulfide(PADS) As Efficient Sulfurization Reagent: From Bench to Bulk Manufacture of Active Pharmaceutical Ingredient;ZACHARIA S.CHERUUALLATH, ET AL;《ORGANIC PROCESS RESEARCH AND DEVELOPMENT》;20000501;第4卷(第3期);第199-204页 * |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20230133947A (ko) | 2023-09-19 |
| JP2019518778A (ja) | 2019-07-04 |
| JP7235512B2 (ja) | 2023-03-08 |
| WO2017223258A1 (en) | 2017-12-28 |
| KR20190020743A (ko) | 2019-03-04 |
| CN109689668A (zh) | 2019-04-26 |
| EP3475292A1 (en) | 2019-05-01 |
| US11142545B2 (en) | 2021-10-12 |
| US20190161513A1 (en) | 2019-05-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN109689668B (zh) | 无加帽步骤的硫醇化寡核苷酸的合成 | |
| JP4865544B2 (ja) | 立体規則性の高いリボヌクレオチド類縁体及びデオキシリボヌクレオチド類縁体の製造法 | |
| JP2023139036A (ja) | オリゴヌクレオチド組成物及びその使用方法 | |
| CA2561741C (en) | Processes and reagents for oligonucleotide synthesis and purification | |
| AU2009288632B2 (en) | RNA synthesis - phosphoramidites for synthetic RNA in the reverse direction, and application in convenient introduction of ligands, chromophores and modifications of synthetic RNA at the 3' - end | |
| JP2013520438A (ja) | 逆方向合成rnaのためのホスホルアミダイト | |
| US20110224424A1 (en) | Method for preparing oligonucleotides | |
| AU2010312751A1 (en) | Bridged artificial nucleoside and nucleotide | |
| JP2022531876A (ja) | オリゴヌクレオチドの収束液相合成 | |
| Páv et al. | Synthesis of oligoribonucleotides with phosphonate-modified linkages | |
| JP7085739B2 (ja) | 人工ヌクレオシド及び人工ヌクレオチド並びに人工オリゴヌクレオチド | |
| Sun et al. | Synthesis of 3'-thioribonucleosides and their incorporation into oligoribonucleotides via phosphoramidite chemistry. | |
| JP2000506849A (ja) | オリゴヌクレオチド類似体 | |
| Vasquez et al. | Evaluation of phosphorus and non-phosphorus neutral oligonucleotide backbones for enhancing therapeutic index of gapmer antisense oligonucleotides | |
| AU2022291626A1 (en) | Improved process for preparing imetelstat | |
| EP0983233A1 (en) | Reagent useful for synthesizing sulfurized oligonucleotide analogs | |
| WO2018162610A1 (en) | Novel phosphorylation reagents and uses thereof | |
| JP4709959B2 (ja) | ヌクレオシドホスホロアミダイト化合物 | |
| EP3154996A2 (en) | Protecting groups for "z nucleotide" and methods thereof | |
| WO2006095739A1 (ja) | リボヌクレオシドの2’水酸基の脱保護方法 | |
| EP4249495A1 (en) | Method for the purification of polynucleotides and analogues thereof | |
| CN116444589B (zh) | 新型GalNAc化合物及其硫代寡核苷酸缀合物和偶联方法 | |
| CN111801321A (zh) | 三环-dna核苷前体和其制备方法 | |
| US20100010069A1 (en) | Extended Length Borane Phosphonate Nucleic Acid Compounds |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |