CN108473931B - 困难样品类型的样品制备 - Google Patents
困难样品类型的样品制备 Download PDFInfo
- Publication number
- CN108473931B CN108473931B CN201680077342.0A CN201680077342A CN108473931B CN 108473931 B CN108473931 B CN 108473931B CN 201680077342 A CN201680077342 A CN 201680077342A CN 108473931 B CN108473931 B CN 108473931B
- Authority
- CN
- China
- Prior art keywords
- sample
- buffer
- collecting
- collected
- swab
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6806—Preparing nucleic acids for analysis, e.g. for polymerase chain reaction [PCR] assay
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1003—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1003—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor
- C12N15/1006—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor by means of a solid support carrier, e.g. particles, polymers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/686—Polymerase chain reaction [PCR]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/02—Devices for withdrawing samples
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/28—Preparing specimens for investigation including physical details of (bio-)chemical methods covered elsewhere, e.g. G01N33/50, C12Q
- G01N1/40—Concentrating samples
- G01N1/4077—Concentrating samples by other techniques involving separation of suspended solids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2521/00—Reaction characterised by the enzymatic activity
- C12Q2521/50—Other enzymatic activities
- C12Q2521/537—Protease
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2527/00—Reactions demanding special reaction conditions
- C12Q2527/153—Viscosity
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/02—Devices for withdrawing samples
- G01N2001/028—Sampling from a surface, swabbing, vaporising
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/28—Preparing specimens for investigation including physical details of (bio-)chemical methods covered elsewhere, e.g. G01N33/50, C12Q
- G01N1/40—Concentrating samples
- G01N1/4077—Concentrating samples by other techniques involving separation of suspended solids
- G01N2001/4088—Concentrating samples by other techniques involving separation of suspended solids filtration
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Analytical Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Physics & Mathematics (AREA)
- Biomedical Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Crystallography & Structural Chemistry (AREA)
- Plant Pathology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Sampling And Sample Adjustment (AREA)
Abstract
提供用于收集和处理困难样品类型的装置和方法。在本公开的一个方面,提供样品收集方法,所述方法包括使用拭子收集包含生物物质或环境物质的样品、将具有收集的样品的所述拭子置于样品缓冲液中和过滤所述样品。在各个说明性实施方案中,样品缓冲液可包含蛋白酶或洗涤剂,并且所述样品可使用植绒拭子收集并转移至所述样品缓冲液。
Description
优先权声明
本申请根据35 U.S.C.§ 119(e)要求2015年11月2日递交的美国临时申请序列号62/249592的权益,其整个内容通过参照结合于此。
背景
1. 技术领域
本公开的实施方案主要涉及用于从样品提取核酸的方法和装置。
2. 背景
在美国、加拿大和西欧,感染性疾病约占人类死亡率的7%,而在发展中地区,感染性疾病占人类死亡率的40%以上。感染性疾病导致多种临床表现。其中常见的明显表现为发热、肺炎、脑膜炎、腹泻和含血的腹泻。尽管身体表现提示某些病原体作为致病因子并消除其他病原体,但是仍然存在多种潜在的致病因子,并且明确的诊断通常需要实施多种测定。用于诊断病原体的传统微生物学技术可能需要数天或数周,通常延迟正确的治疗过程。
最近几年,聚合酶链式反应(PCR)已成为用于快速诊断感染因子的一个选项。PCR可为诊断感染性疾病的一种快速、灵敏和特异性的工具。使用PCR作为主要诊断手段的挑战为多种可能的致病生物体或病毒以及某些病理样本中存在的低水平的生物体或病毒。运行多组PCR测定通常不切实际,一种PCR测定用于每种可能的致病生物体或病毒,其大多数预计为阴性。当病原体核酸浓度低并需要大体积样品来收集足够的反应模板时,问题会加剧。在某些情况下,没有足够的样品来测定所有可能的致病因子。一种解决方案为运行“多重PCR”,其中在单个反应中同时测定样品的多种靶标。尽管多重PCR在一些系统中已被证明是有价值的,但是存在关于高水平多重反应的稳健性的缺陷以及清楚分析多种产物的困难。为了解决这些问题,随后可将测定分成多个二次PCR。在一次产物内嵌套二次反应增加稳健性。封闭系统比如FilmArray® (BioFire Diagnostics, LLC, Salt Lake City, UT)减少处理,从而减少污染风险。
样品制备通常为用于从较坚韧材料比如孢子和石蜡保存的样品释放核酸的苛刻提取和裂解条件与(特别是在较易于裂解并具有较长染色体的污染物中)可使核酸降解最小化的较温和裂解条件之间的平衡。期望能够从较坚韧材料提取核酸而不降解可能存在于样品中的其他核酸。
另外,某些样品类型可能难以处理。可能难以将固体、半固体或粘性样品引入到生物处理系统中。样品类型比如痰难以吸移(pipette)和测量,并且在样品处理之前通常需要预处理一段时间,说明性地用热或二硫苏糖醇进行预处理,以降低粘度和助于分解样品基质。除了痰之外,其他困难生物样品包括但不限于粘液、BAL和其他呼吸样品类型、粪便、组织、组织匀浆物、磨碎的组织、石蜡处理的福尔马林包埋组织、骨、骨匀浆物、焦痂、脓、滑液、淋巴结抽吸物和胃洗液。环境样品(说明性地为土壤、表面、粉末或食物)通常为固体或半固体,并且也可能存在挑战。此外,样品预处理期间的广泛处理可能导致交叉污染,可能耗时,并且通常稀释样品,通常导致灵敏度下降。
本发明解决与进一步测试之前制备样品相关的各种问题,所述测试例如用于从样品纯化核酸,用于生物分析。
发明概述
在本公开的一个方面提供一种样品收集方法,方法包括使用拭子收集包含生物物质或环境物质的样品,将具有收集的样品的拭子置于样品缓冲液中和过滤样品。在各个说明性实施方案中,样品缓冲液可包含蛋白酶或洗涤剂,并且所述样品可使用植绒拭子收集并转移至样品缓冲液。
另一方面提供一种样品收集方法,方法包括收集包含生物物质或环境物质的样品,并将样品置于样品缓冲液中,其中样品缓冲液包含按样品缓冲液的体积计至少10%的量的洗涤剂。说明性的实施方案可包括抽吸样品通过过滤器。
另一方面提供一种样品收集方法,方法包括通过使包含生物物质或环境物质的样品与相对样品基质优先收集和释放生物体的材料接触,并将具有收集的样品的材料置于样品缓冲液中来收集样品。说明性地,材料为亲水材料或吸附材料。在一个实施方案中,固定量的材料可重复地吸收和释放在4倍范围内的样品量。
本公开的另一方面提供一种插管式小瓶,所述插管式小瓶包括:瓶体,所述瓶体具有一端的顶面、相对端的底面及其间限定小瓶内部体积的外壁,顶面具有开口;插管,所述插管从底面延伸并具有第一末端、第二末端及其间限定插管体积的外表面,第一末端与小瓶内部体积处于流体连通;和设置在瓶体与插管之间的过滤器及提供在插管式小瓶中的添加剂。
本公开的仍然另一方面提供一种样品容器,所述样品容器包括配置成接收样品的开口、配置成容纳流体的主体、配置成使得流体能够离开的开口、被设置在主体与出口之间的过滤器及被提供用于处理样品的添加剂。说明性地,在样品容器中提供干燥的添加剂。说明性的添加剂包括蛋白酶、DNA酶、DNA酶抑制剂、RNA酶、RNA酶抑制剂和溶菌酶。
本公开的仍然另一方面提供一种将添加剂引入到系统中的方法,所述方法包括获得如以上描述的样品容器(所述样品容器容纳流体),将样品通过开口引入到流体中,抽吸流体通过过滤器并离开出口。
另一方面提供从直接血液样品扩增核酸的方法,所述方法包括将直接血液样品加入到样品缓冲液中,珠击(bead beating)样品缓冲液,从样品缓冲液提取核酸及扩增核酸。说明性地,这种方法可在封闭的样品容器中实施。在另一种说明性的方法中,步骤在没有离心、乙醇沉淀和DNA消化中的一个或多个的情况下实施。
本发明实施方案的另外特征和优点将在随后的描述中阐述,或者可通过实践这种实施方案来学习。这种实施方案的特征和优点可通过在附加权利要求中特别指出的仪器和组合来实现和获得。这些和其他特征从以下描述和附加权利要求将变得更加彻底地明显,或者可通过实践如下文阐述的这种实施方案来学习。
附图简述
为了描述可获得本发明以上列举的及其他优点和特征的方式,以上简要描述的本发明的更具体描述将通过参照附图中图解说明的其具体实施方案来呈现。应该理解,这些附图仅描绘本发明的典型实施方案,并且因此不被认为是对其范围的限制,本发明将通过使用附图以另外的特征和细节来描述和解释,其中:
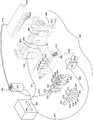
图1显示本发明一个实施方案的柔性袋。
图2为本发明示例性实施方案的用于与图1的袋一起使用的仪器(包括图1的袋)的分解透视图。
图3显示本发明示例性实施方案的图2仪器的局部剖视图,包括图2的气囊组件,图1的袋以虚线显示。
图4显示图2仪器的一个说明性实施方案中使用的电机。
图5显示本发明示例性实施方案的用于装载图1的袋的装载站(包括图1的袋)。
图6显示用于将样品装载到图1的袋中的样品小瓶。
图7显示本发明示例性实施方案的用于向图1的袋提供水合流体的水合小瓶。
图8显示本发明示例性实施方案的与图5类似,但是呈现不同的装载站配置和用于与装载站一起使用的小瓶的装载站。
图9显示本发明示例性实施方案的图8的样品小瓶的一部分以及样品小瓶如何锁入图8的装载站的样品小瓶座。
图10显示本发明示例性实施方案的图8的水合小瓶的一部分以及水合小瓶如何锁入图8的装载站的水合小瓶座。
详述
以下参照附图描述示例性实施方案。在不偏离本公开的精神和教导的情况下,许多不同的形式和实施方案是可能的,并且因此本公开不应解释为限于本文阐述的示例性实施方案。更确切地,提供这些示例性实施方案使得本公开透彻和完整,并将本公开的范围传达给本领域技术人员。在附图中,为了清楚起见,层和区域的大小和相对大小可能被夸大。在整个描述中,相同的标记数字涉及相同的元件。
除非另外定义,否则本文使用的所有术语(包括技术和科学术语)具有与本公开所属领域的普通技术人员通常理解的相同含义。应该进一步理解,术语(比如通常使用的词典中定义的那些)应解释为具有与其在本申请的上下文和相关领域中的含义一致的含义,并且不应以理想化或过于正式的含义来解释,除非本文明确地如此定义。在本文的本发明描述中使用的术语仅用于描述特定实施方案的目的,并且不旨在限制本发明。尽管与本文描述的那些类似或等同的一些方法和材料可用于本公开的实践,但是本文仅描述某些示例性的材料和方法。
本文提及的所有出版物、专利申请、专利或其他参考文献以其全部通过参照结合。在术语冲突的情况下,以本说明书为准。
本公开的各个方面,包括装置、系统、方法等,可参照一个或多个示例性实施方式来说明。本文使用的术语“示例性的”和“说明性的”意指“用作实例、例子或说明”,并且不一定解释为比本文公开的其他实施方式优选或有利。另外,提及本公开或发明的“实施方式”或“实施方案”包括具体提及其一个或多个实施方案,反之亦然,并且旨在提供说明性实例而不限制本发明的范围,后者由附加权利要求而不是由以下描述来表示。
应该注意,在本说明书和附加权利要求中使用的单数形式“一种”、“一个”和“该”包括复数指示物,除非内容另外明确地指明。因此,例如,提及“一个瓦片(tile)”包括一个、两个或多个瓦片。类似地,提及多个指示物应解释为包括单个指示物和/或多个指示物,除非内容和/或上下文另外明确指明。因此,提及“瓦片”不一定需要多个这种瓦片。反而应该意识到,独立于结合,本文考虑一个或多个瓦片。
在整个本申请中使用的词语“可以”和“可能”以容许的意义(即意指有可能)而不是强制性意义(即意指必须)使用。另外,术语“包括”,“具有”、“涉及”、“含有”、“特征在于”、其变体(例如“包括”、“具有”、“涉及”、“含有”等)以及包括权利要求在内的本文使用的类似术语应为包含性和/或开放式的,应具有与词语“包含”及其变体(例如“包含”和“包含”)相同的含义,并且说明性地不排除另外的、未列举的要素或方法步骤。
本文使用的方向和/或任意术语比如“顶部”、“底部”、“左”、“右”、“上”、“下”、“上”、“下”、“里”、“ 外”、“内部的”、“外部的”、“内部”、“外部”、“ 近端的”、“远端的”、“向前”、“反向”等可仅用于表示相对方向和/或取向,并且可能不旨在以其他方式限制包括说明书、发明和/或权利要求在内的本公开的范围。
应该理解,当元件称为被“耦合”、“连接”或“响应于”或“接通”另一个元件时,其可直接耦合、连接或响应于或接通其他元件,或者也可存在中间元件。相比之下,当元件被称为“直接耦合”、“直接连接”或“直接响应于”或“直接接通”另一个元件时,不存在中间元件。
本文参照作为示例性实施方案的理想化实施方案(和中间结构)的示意图的横截面图来描述本发明概念的示例性实施方案。因此,可预计由于例如制造技术和/或公差造成的图示形状的变化。因此,本发明概念的示例性实施方案不应解释为限于本文图解说明的区域的特定形状,而是包括例如由制造引起的形状偏差。因此,附图中图解说明的区域本质上为示意性的,并且其形状不旨在图解说明装置区域的实际形状,并且不旨在限制示例性实施方案的范围。
应该理解,尽管术语“第一”、“第二”等本文可用于描述各种元件,但是这些元件不应受这些术语的限制。这些术语仅用于区分一个元件与另一个元件。因此,在不背离本实施方案的教导的情况下,“第一”元件可被称为“第二”元件。
还应该理解,在不背离本公开范围的情况下,本文描述的各种实施方式可与所描述或公开的任何其他实施方式组合使用。因此,在不背离本公开范围的情况下,本公开某些实施方式的产品、构件、元件、装置、设备、系统、方法、过程、组合物和/或试剂盒可包括、掺入或者以其他方式包含本文公开的其他实施方式中描述的属性、特征、组件、构件、元件、步骤等(包括系统、方法、设备等)。因此,提及与一个实施方式相关的具体特征不应解释为仅限于所述实施方式内的应用。
本文使用的标题仅用于组织目的,并且不意在用于限制描述或权利要求的范围。为了便于理解,在可能的情况下使用相同的标记数字来指定附图中共有的相同元件。此外,在可能的情况下,在各附图中已经使用相同的元件编号。此外,特定元件的备选配置可各自包括附加于元件编号的单独字母。
术语“约”本文用于意指近似地、在所述区域内、大致地或大约。当术语“约”与数值范围结合使用时,其通过将边界延伸到所示数值的上下方来修饰该范围。通常,术语“约”本文用于修饰高于和低于所述值达5%方差的数值。当表示这种范围时,另一个实施方案包括从一个特定值和/或到另一个特定值。类似地,当数值表示为近似值时,通过使用先行词“约”,应该理解该特定值形成另一个实施方案。应该进一步理解,每个范围的端点对于另一个端点是显著的,并且独立于另一个端点。
本文使用的词语“或”意指特定列表中的任何一个成员,并且还包括该列表的成员的任何组合。
所谓的“样品”意指动物、来自动物的组织或器官、细胞(在受试者内、直接取自受试者、或者保持在培养物中或来自培养细胞系的细胞)、细胞裂解物(或裂解物组分)或细胞提取物;含有一种或多种源自细胞、细胞材料或病毒材料的分子(例如多肽或核酸)的溶液;或含有非天然存在的核酸的溶液,其如本文描述的那样进行测定。样品还可为可含有或不含宿主或病原体细胞、细胞组分或核酸的任何体液或排泄物(例如但不限于血液、尿液、粪便、唾液、眼泪、胆汁或脑脊液)。
本文所用的短语“核酸”指的是天然存在的或合成的寡核苷酸或多核苷酸,无论是DNA还是RNA还是DNA-RNA杂合体,单链还是双链的,有义还是反义的,其能够通过Watson-Crick碱基配对与互补核酸杂交。本发明的核酸还可包括核苷酸类似物(例如BrdU)和非磷酸二酯核苷间键(例如肽核酸(PNA)或硫代二酯键)。特别是,核酸可包括但不限于DNA、RNA、cDNA、gDNA、ssDNA、dsDNA或其任何组合。
所谓的“探针”、“引物”或“寡核苷酸”意指可与含有互补序列(“靶”)的第二核酸分子进行碱基配对的确定序列的单链核酸分子。生成的杂合体的稳定性取决于长度、GC含量和发生的碱基配对的程度。碱基配对的程度受参数比如探针与靶分子之间的互补程度以及杂交条件的严格程度的影响。杂交严格程度受参数比如温度、盐浓度和有机分子比如甲酰胺浓度的影响,并且通过本领域技术人员已知的方法确定。探针、引物和寡核苷酸可通过本领域技术人员熟知的方法放射性地、荧光性地或非放射性地进行可检测性标记。可使用dsDNA结合染料来检测dsDNA。应该理解,“引物”被具体配置为通过聚合酶延伸,而“探针”或“寡核苷酸”可或可不被如此配置。
所谓的“dsDNA结合染料”意指当与双链DNA结合时发出有差别的荧光超过与单链DNA结合时或在溶液中游离时,通常发出荧光更强的染料。当提及dsDNA结合染料时,应该理解本文可使用任何合适的染料,一些非限制性的说明性染料描述于通过参照结合于此的美国专利第7387887号中。其他信号产生物质可用于检测核酸扩增和解链,说明性地如本领域已知的酶、抗体等。
所谓的“特异性地杂交”意指探针、引物或寡核苷酸在高严格条件下识别并与基本互补的核酸(例如样品核酸)物理相互作用(即碱基配对),并且基本上不与其他核酸碱基配对。
所谓的“高严格条件”意指一般地在约解链温度(Tm)-5℃ (即低于探针Tm 5°)下发生。功能上,高严格条件用于鉴定具有至少80%序列同一性的核酸序列。
尽管PCR为本文实施例中使用的扩增方法,但是应该理解,使用引物的任何扩增方法可为合适的。这种合适的程序包括聚合酶链式反应(PCR)、链置换扩增(SDA)、基于核酸序列的扩增(NASBA)、级联滚环扩增(CRCA)、环介导的DNA等温扩增(LAMP)、等温和嵌合引物引发的核酸扩增(ICAN)、基于靶标的解旋酶依赖性扩增(HDA)、转录介导的扩增(TMA)等。因此,当使用术语PCR时,应该理解为包括其他备选的扩增方法。对于没有离散循环的扩增方法,可在循环或Cp下测量时使用反应时间,并且在本文描述的实施方案中加入另外的PCR循环时可增加另外的反应时间。应该理解,方案可能需要相应调整。
尽管本文的各种实例提及人类靶标和人类病原体,但是这些实例仅为说明性的。本文描述的方法、试剂盒和装置可用于检测和测序来自广泛的各种样品(包括人类、兽医、工业和环境样品)的广泛的核酸序列。
本文公开的各种实施方案使用自含式核酸分析袋来说明性地在单个封闭系统中测定样品中是否存在各种生物物质,说明性地为抗原和核酸序列。包括袋和与袋一起使用的仪器的这种系统在通过参照结合于此的美国专利第8394608和8895295号及美国专利申请第2014-0283945号中得到更详细地公开。然而,应该理解,这种袋仅为说明性的,并且本文讨论的核酸制备和扩增反应可在本领域已知的多种开放或封闭系统样品容器(包括96孔板、其他配置的板、阵列、转盘等)中的任何一种中,使用多种核酸纯化和扩增系统,如本领域已知的那样实施。当本文使用术语“样品孔”、“扩增孔”、“扩增容器”等时,这些术语意指包括如这些扩增系统中使用的孔、管和各种其他反应容器。在一个实施方案中,袋用于测定多种病原体。袋可说明性地在封闭系统中包括一个或多个用作样品孔的泡罩。说明性地,可在任选一次性的袋中实施各种步骤,包括核酸制备、一次大体积多重PCR、一次扩增产物的稀释和二次PCR,最后为任选的实时检测或扩增后分析比如解链-曲线分析。进一步地,应该理解,尽管可在本发明的袋中实施各种步骤,但是对于某些用途可以省略一个或多个步骤,并且可相应地改变袋配置。
图1显示可在各种实施方案中使用或者可为各种实施方案重新配置的说明性袋510。袋510与美国专利第8895295号的图15类似,相同的项目编号相同。配件590提供有入口通道515a至515l,其也用作试剂储存器或废物储存器。说明性地,试剂可在配件590中冷冻干燥并在使用之前再水合。具有其各自通道514、538、543、552、553、562和565的泡罩522、544、546、548、564和566类似于美国专利第8895295号的图15的相同编号的泡罩。图1的第二阶段反应区580与美国专利申请第8895295号类似,但是高密度阵列581的第二阶段孔582排列成稍微不同的图案。图1的高密度阵列581的更圆形图案消除角落里的孔并且可导致更均匀地填充第二阶段孔582。如所显示的那样,高密度阵列581提供有102个第二阶段孔582。袋510适合用于FilmArray®仪器(BioFire Diagnostics, LLC, Salt Lake City, UT)。然而,应该理解,袋的实施方案仅为说明性的。
尽管可使用其他容器,但是说明性地,袋510由两层柔性塑料膜或其他柔性材料比如聚酯、聚对苯二甲酸乙二醇酯(PET)、聚碳酸酯、聚丙烯、聚甲基丙烯酸甲酯及其混合物形成,其可通过本领域已知的任何方法制备,包括挤出、等离子体沉积和层压。也可使用具有层压铝的金属箔或塑料。本领域已知其他屏障材料,其可密封在一起以形成泡罩和通道。如果使用塑料膜,则可将这些层粘合在一起,说明性地通过热封。说明性地,材料具有低核酸结合能力。
对于采用荧光监测的实施方案,优选吸光度足够低且在工作波长下自动发荧光的塑料膜。这种材料可通过测试不同塑料、不同增塑剂和复合比率以及膜的不同厚度来鉴定。对于具有铝或其他层压箔的塑料,袋的待由荧光检测装置读取的部分可留置为没有箔。例如,如果在袋510的第二阶段反应区580的第二阶段孔582中监测到荧光,那么孔582处的一或两层将留置为没有箔。在PCR的实例中,由约0.0048英寸(0.1219 mm)厚的聚酯(Mylar,Dupont, Wilmington DE)和0.001-0.003英寸(0.025-0.076 mm)厚的聚丙烯膜组成的薄膜层压物性能良好。说明性地,袋510由能够传输大约80%-90%入射光的透明材料制成。
在说明性的实施方案中,通过在泡罩和通道上施加压力,说明性地为气动压力,使材料在泡罩之间移动。因此,在采用压力的实施方案中,袋材料说明性地足够柔性以使得压力能够具有期望的效果。术语“柔性的”本文用于描述袋材料的物理特征。术语“柔性的”本文定义为可易于通过本文使用的压力水平变形,而不会发生破裂、断裂、龟裂等。例如,薄塑料片比如SaranTM包装袋和Ziploc®袋以及薄金属箔比如铝箔都是柔性的。然而,甚至在采用气动压力的实施方案中,只有泡罩和通道的某些区域需要为柔性的。进一步地,只要泡罩和通道可易于变形,泡罩和通道的仅一侧需要为柔性的。袋510的其他区域可由刚性材料制成或者可用刚性材料加强。
说明性地,塑料膜用于袋510。可研磨或者以其他方式切割金属(说明性地铝)或其他合适材料的片材,以产生具有凸起表面图案的模具。当安装到气动压力机(说明性地为A-5302-PDS, Janesville Tool Inc., Milton WI)中,说明性地在195℃的操作温度下进行调节时,气动压力机像印刷机一样工作,仅在模具接触膜的地方熔化塑料膜的密封表面。当袋510形成时,各种组分(比如PCR引物(说明性地点样到膜上并干燥)、抗原结合基底、磁珠和硅酸锆珠)可被密封在各泡罩内。用于样品处理的试剂可在密封之前共同或分开地点样到膜上。在一个实施方案中,将核苷三磷酸(NTP)与聚合酶和引物分开点样到膜上,基本上消除聚合酶的活性,直到反应被含水样品水合。如果含水样品在水合之前已被加热,则这为真正的热启动PCR创造条件,并且减少或消除对昂贵的化学热启动组分的需要。
袋510可以与美国专利第8895295号中描述的类似方式使用。在一个说明性的实施方案中,将包含待测试样品(100 μl)和裂解缓冲液(200 μl)的300 μl混合物注入到入口通道515a附近的配件590中的注入口(未显示),并将样品混合物抽吸到入口通道515a中。水也被注入到与入口通道5151邻近的配件590的第二注入口(未显示)中,并经提供在配件590中的通道(未显示)分配,从而水合多达11种不同试剂, 其每一种先前以干燥形式提供在入口通道515b至515l处。这些试剂说明性地可包括冷冻干燥的PCR试剂、DNA提取试剂、洗涤溶液、免疫测定试剂或其他化学实体。说明性地,试剂用于核酸提取、第一阶段多重PCR、多重反应的稀释和第二阶段PCR试剂的制备以及对照反应。在图1中显示的实施方案中,所有需要注入的为一个注入口的样品溶液和另一个注入口的水。注入之后,两个注入口可以密封。关于袋510和配件590的各种配置的更多信息,参见已通过参照结合的美国专利第8895295号。
注入之后,样品经通道514从注入通道515a移到裂解泡罩522。裂解泡罩522提供有珠或颗粒534,比如陶瓷珠,并且配置成用于使用FilmArray®仪器内提供的旋转刀片或桨叶经撞击而涡旋。通过在裂解颗粒比如硅酸锆(ZS)珠534存在下摇动或涡旋样品进行珠磨为形成裂解物的有效方法。应该理解,本文使用的术语比如“裂解”、“裂解”和“裂解物”不限于破裂细胞,而且这种术语包括破坏非细胞颗粒比如病毒。
图4显示珠击电机819,其包括可安装在图2中显示的仪器800的支撑构件802的第一侧面811上的刀片821。刀片可延伸通过槽804以接触袋510。然而,应该理解,电机819可安装在仪器800的其他结构上。在一个说明性的实施方案中,电机819为安装在支撑构件802上的Mabuchi RC-280SA-2865 DC Motor (Chiba, Japan)。在一个说明性的实施方案中,电机转速为5000-25000 rpm,更具说明性地为10000-20000 rpm,并且仍然更具说明性地为约15000-18000 rpm。对于Mabuchi电机,已经发现7.2 V提供足够的rpm用于裂解。然而,应该理解,当刀片821撞击袋510时,实际速度可能稍慢。其他电压和速度可用于裂解,这取决于所使用的电机和桨叶。任选地,受控的小体积空气可被提供到邻近裂解泡罩522的气囊822中。已经发现,在一些实施方案中,用一个或多个小体积的空气部分地填充邻近气囊助于在裂解过程期间定位和支撑裂解泡罩。或者,可使用其他结构,说明性地为裂解泡罩522周围的刚性或顺应性垫圈或其他保持结构,以在裂解期间束缚袋510。还应该理解,电机819仅为说明性的,并且其他装置可用于研磨、摇动或涡旋样品。
一旦细胞已经充分裂解,则样品移动通过通道538、泡罩544和通道543到泡罩546,其中样品与核酸结合物质比如二氧化硅包覆的磁珠533混合。使得混合物温育适当的时间长度,说明性地为约10秒-10分钟。位于仪器内邻近泡罩546的可收回磁体捕获来自溶液的磁珠533,形成抵靠泡罩546的内表面的沉淀。然后将液体移出泡罩546并返回通过泡罩544和进入泡罩522中,泡罩522现用作废物容器。来自注入通道515c-515e中的一个或多个的一个或多个洗涤缓冲液经泡罩544和通道543提供至泡罩546。任选地,磁体收回并且通过经通道543从泡罩544和546来回移动珠来洗涤磁珠533。一旦磁珠533被洗涤,磁珠533通过磁体激活被重新捕获在泡罩546中,并且然后使洗涤溶液移到泡罩522。必要时可重复该过程,以从核酸结合磁珠533洗涤裂解缓冲液和样品碎片,说明性地包括3次或更多次洗涤,尽管对于本文公开的一些实施方案一次洗涤可能足够,并且任何数目的洗涤均处于本公开的范围内。
洗涤之后,储存在注入通道515f处的洗脱缓冲液移到泡罩548,并且收回磁体。溶液经通道552在泡罩546和548之间循环,破碎泡罩546中的磁珠533的沉淀并使得捕获的核酸能够从珠解离并进入溶液。磁体再次被激活,捕获泡罩546中的磁珠533,并使洗脱的核酸溶液移入泡罩548中。
来自注入通道515g的第一阶段PCR主混合物与泡罩548中的核酸样品混合。任选地,混合物通过迫使混合物经通道553在548和564之间来混合。在几个混合循环之后,溶液包含在泡罩564中,其中提供第一阶段PCR引物的沉淀,每个靶标至少有一组引物,并且实施第一阶段多重PCR。如果存在RNA靶标,则可在第一阶段多重PCR之前或同时实施RT步骤。在FilmArray®仪器的第一阶段多重PCR温度循环说明性地实施15-20个循环,尽管可期望其他水平的扩增,这取决于具体应用的需要。如本领域已知的那样,第一阶段PCR主混合物可为各种主混合物中的任何一种。在一个说明性的实例中,第一阶段PCR主混合物可为通过参照结合于此的US2015/0118715中公开的任何化学组成,用于每个循环需要20秒或者更少的PCR方案。
在第一阶段PCR已经进行期望的循环数之后,样品可被稀释,说明性地通过迫使大部分样品返回到泡罩548中,仅在泡罩564中留下小量样品,并加入来自注入通道515i的第二阶段PCR主混合物。或者,可使来自515i的稀释缓冲液移至泡罩566,然后通过在泡罩564和566之间来回移动流体而与泡罩564中扩增的样品混合。如果需要,可使用来自注入通道515j和515k的稀释缓冲液把稀释重复几次,或者可保留注入通道515k用于测序或用于其他PCR后分析,并且然后把来自注入通道515h的第二阶段PCR主混合物加入到部分或全部稀释的扩增样品。应该理解,稀释水平可通过改变稀释步骤的数目或者通过改变在与稀释缓冲液或包含用于扩增的组分(说明性地为聚合酶、dNTP和合适的缓冲液)的第二阶段PCR主混合物混合之前弃去的样品百分比来调整,尽管其他组分可能是合适的,特别是对于非PCR扩增方法。如果需要,样品和第二阶段PCR主混合物的这种混合物可在移到用于第二阶段扩增的第二阶段孔582之前,于泡罩564中预热。这种预热可避免在第二阶段PCR混合物中对热启动组分(抗体、化学品或其他)的需要。
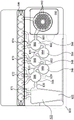
说明性的第二阶段PCR主混合物不完整,缺乏引物对,并且102个第二阶段孔582中的每一个预先装载有特异性PCR引物对。如果需要,第二阶段PCR主混合物可缺乏其他反应组分,并且这些组分也可预先装载在第二阶段孔582中。每个引物对可与第一阶段PCR引物对相似或相同,或者可嵌套在第一阶段引物对内。样品从泡罩564移到第二阶段孔582完成PCR反应混合物。一旦填充高密度阵列581,则单个第二阶段反应通过任何数目的手段密封在其各自第二阶段泡罩中,如本领域已知的那样。在已经通过参照结合的美国专利第8895295号中讨论了填充和密封高密度阵列581而没有交叉污染的说明性方式。说明性地,高密度阵列581的孔582中的各种反应同时进行热循环,说明性地用一个或多个珀尔帖(Peltier)装置进行热循环,但是用于热循环的其他手段为本领域已知的。
在某些实施方案中,第二阶段PCR主混合物含有dsDNA结合染料LCGreen® Plus(BioFire Diagnostics, LLC),以产生表示扩增的信号。然而,应该理解,该染料仅为说明性的,并且可使用其他信号,包括如本领域已知的荧光标记、放射性标记、化学发光标记、酶促标记等的其他dsDNA结合染料和探针。或者,阵列581的孔582可没有信号提供,结果通过随后的处理报告。
当使用气动压力来移动袋510内的材料时,在一个实施方案中可采用“气囊”。气囊组件810,其一部分显示在图2-3中,包括安置多个可膨胀气囊822、844、846、848、864和866的气囊板824,每个气囊可单个膨胀,说明性地通过压缩气体源。因为气囊组件810可经受压缩气体并被多次使用,所以气囊组件810可由比袋更坚韧或更厚的材料制成。或者,气囊822、844、846、848、864和866可由一系列用垫圈、密封件、阀门和活塞紧固在一起的板形成。其他排列也处于本发明的范围内。
二次PCR反应的成功取决于多重第一阶段反应产生的模板。一般地,PCR使用高纯度的DNA实施。方法比如苯酚提取或市售DNA提取试剂盒提供高纯度的DNA。通过袋510处理的样品可能需要进行调整以补偿不太纯的制备物。PCR可能被生物样品的组分所抑制,这是潜在的障碍。说明性地,热启动PCR、更高浓度的taq聚合酶、MgCl2浓度的调整、引物浓度的调整和加入佐剂(比如DMSO、TMSO或甘油)任选地可用于补偿较低的核酸纯度。尽管纯度问题更可能是第一阶段扩增的问题,但是应该理解,在第二阶段扩增中也可提供类似的调整。
当袋510被置于仪器800内时,气囊组件810被压靠在袋510的一个面上,使得如果特定气囊膨胀,则压力将迫使液体流出袋510中的相应泡罩。除了与袋510的许多泡罩对应的气囊之外,气囊组件810还可具有对应于袋510的各通道的另外的气动致动器,比如气囊或气动驱动活塞。图2-3显示对应于袋510的通道538、543、553和565的说明性的多个活塞或硬密封件838、843、852、853和865以及使回流至配件590最小化的密封件871、872、873、874。当被激活时,硬密封件838、843、852、853和865形成夹管阀以夹止并关闭相应的通道。为了将液体限制在袋510的特定泡罩内,硬密封件在通向泡罩和从泡罩引出的通道上被激活,使得致动器起夹管阀的作用以夹紧关闭通道。说明性地,为了将两个体积的液体在不同泡罩中混合,密封连接通道的夹管阀致动器被激活,并且泡罩上方的气动气囊交替加压,迫使液体来回通过连接泡罩的通道以在其中混合液体。夹管阀致动器可具有各种形状和大小,并且可配置成一次夹止多于一个通道。尽管本文讨论气动致动器,但是应该理解,可以考虑给袋提供压力的其他方式,包括各种机电致动器,比如线性步进电机、电机驱动凸轮、由气动、液压或电磁力驱动的刚性桨叶、滚筒、摇臂以及在某些情况下旋塞弹簧(cocked spring)。另外,除了施加垂直于通道轴线的压力之外,还有多种可逆或不可逆地关闭通道的方法。这些包括在通道上缠绕袋子、热封、滚动致动器以及密封在通道中的多种物理阀门,比如蝶阀和球阀。另外,小型珀耳帖装置或其他温度调节器可置于邻近通道并设置在足以使流体冷冻的温度下,从而有效地形成密封。而且,尽管图1的设计适用于特征为位于每个泡罩和通道上的致动器元件的自动化仪器,但是还可考虑致动器可保持静止,并且袋510可在一或两个维度上转换,使得少数致动器可用于几个处理站,包括样品破坏、核酸捕获、第一和第二阶段PCR以及袋510的其他应用,比如免疫测定和免疫PCR。作用于通道和泡罩的滚筒可证明在其中袋510在站之间平移的配置中特别有用。因此,尽管在目前公开的实施方案中使用气动致动器,但是当本文使用术语“气动致动器”时,应该理解可使用其他致动器和其他提供压力的方式,这取决于袋和仪器的配置。
其他现有技术的仪器教导在密封的柔性容器内的PCR。参见例如通过参照结合于此的美国专利第6645758和6780617号以及美国专利申请第2014/0038272号。然而,把细胞裂解包含在密封的PCR容器内可提高易用性和安全性,特别是如果待测试样品可能含有生物危害时。在本文图解说明的实施方案中,来自细胞裂解以及来自所有其他步骤的废物保留在密封袋内。然而,应该理解,袋内容物可被去除用于进一步测试。
图2显示可与袋510一起使用的说明性仪器800。仪器800包括支撑构件802,后者可形成壳体的壁或者安装在壳体内。仪器800还可包括任选地可相对于支撑构件802移动的第二支撑构件(未显示),以使得能够插入和抽出袋510。说明性地,一旦袋510已经插入仪器800中,盖可覆盖袋510。在另一个实施方案中,两个支撑构件可为固定的,袋510通过其他机械手段或通过气动压力被固定就位。
在说明性的实例中,加热器886和888安装在支撑构件802上。然而,应该理解,这种排列仅为说明性的,并且其他排列也是可能的。将形成气囊组件808的具有气囊822、844、846、848、864、866、硬密封件838、843、852、853、密封件871、872、873、874的气囊板810可说明性地安装在可移动支撑结构上,后者可朝向袋510移动,使得气动致动器被置于与袋510接触。当袋510插入仪器800并且可移动支撑构件朝向支撑构件802移动时,袋510的各泡罩处于邻近气囊组件810的各气囊和组件808的各密封件的位置,使得气动致动器的激活可迫使来自袋510的一个或多个泡罩的液体,或者可形成袋510的一个或多个通道的夹管阀。袋510的泡罩和通道与组件808的气囊和密封件之间的关系在图3中更详细地图解说明。
每个气动致动器经阀899连接到压缩空气源895。尽管图2中仅显示几个软管878,但是应该理解,每个气动配件经软管878连接到压缩气体源895。压缩气体源895可为压缩机,或者压缩气体源895可为压缩气体钢瓶,比如二氧化碳钢瓶。如果期望便携性,压缩气体钢瓶特别有用。压缩气体的其他来源处于本发明的范围内。
组件808说明性地安装在可移动支撑构件上,但是应该理解其他配置也是可能的。
仪器810的几个其他组件也连接到压缩气体源895。说明性地经软管878使用来自压缩气体源895的气体展开和收回安装在支撑构件802的第二侧面814上的磁体850,但是移动磁体850的其他方法为本领域已知的。磁体850位于支撑构件802的凹槽851中。应该理解,凹槽851可为穿过支撑构件802的通道,使得磁体850可接触袋510的泡罩546。然而,依支撑构件802的材料而定,应该理解,凹槽851不需一直延伸穿过支撑构件802,只要当磁体850展开时,磁体850足够接近以在泡罩546处提供足够的磁场,并且当磁体850收回时,磁体850不会显著影响存在于泡罩546中的任何磁珠533。当提及收回磁体850时,应该理解可使用电磁体,并且可通过控制通过电磁体的电流来激活和使电磁体失效。因此,尽管本说明书讨论了撤出或收回磁体,但是应该理解这些术语足够宽泛以结合其他撤回磁场的方式。应该理解,气动连接可为气动软管或气动空气歧管,因此减少需要的软管或阀的数目。
气动活塞阵列869的各个气动活塞868也经软管878连接到压缩气体源895。尽管仅显示两个软管878将气动活塞868连接到压缩气体源895,但是应该理解,每个气动活塞868连接到压缩气体源895。显示12个气动活塞868。
一对加热/冷却装置,说明性地为珀耳帖加热器,被安装在支撑件802的第二侧面814。第一阶段加热器886定位成加热和冷却用于第一阶段PCR的泡罩564的内容物。第二阶段加热器888定位成加热和冷却袋510的第二阶段泡罩582的用于第二阶段PCR的内容物。然而,应该理解,这些加热器也可用于其他加热目的,并且可包括适合特定应用的其他加热器。
当期望荧光检测时,可提供光学阵列890。如图2中显示的那样,光学阵列890包括光源898,说明性地为滤波后的LED光源、滤波后的白光或激光照明,以及摄像机896。摄像机896说明性地具有多个光电探测器,每个光电探测器对应于袋510中的第二阶段孔582。或者,摄像机896可拍摄含有所有第二阶段孔582的图像,并且图像可被分成对应于每个第二阶段孔582的单独区域。依配置而定,光学阵列890可为静止的,或者光学阵列890可置于附连到一个或多个电机的移动器上并且移动,以获得来自每个单个第二阶段孔582的信号。应该理解其他排列是可能的。
如所显示的那样,计算机894控制压缩空气源895的阀899,并且因此控制仪器800的所有气动装置。计算机894还控制加热器886和888以及光学阵列890。这些组件中的每一个电连接,说明性地经电缆891连接,但是其他物理或无线连接也处于本发明的范围内。应该理解,计算机894可安置在仪器800内或者可在仪器800的外部。进一步地,计算机894可包括控制一些或全部组件的内置电路板,并且还可包括外部计算机,比如台式或膝上型PC,以从光学阵列接收和显示数据。可提供说明性地为键盘接口的接口,其包括用于输入信息和变量比如温度、循环时间等的键。说明性地,还提供显示器892。例如,显示器892可为例如LED、LCD或其他这种显示器。
实施例
实施例1:高密度PCR
在一个实施例中,已知用于常见呼吸道病毒的标准市售免疫荧光测定可检测以下7种病毒:腺病毒、PIV1、PIV2、PIV3、RSV、甲型流感病毒和乙型流感病毒。说明性地,一个更完整的组将包括对包括以下的其他病毒的测定:冠状病毒、人偏肺病毒、鼻病毒和非HRV肠病毒。对于高度可变病毒比如腺病毒或HRV,期望使用多种引物来靶向病毒谱系的所有分支(说明性地分别为4个外部引物组和4个内部引物组)。对于其他病毒比如冠状病毒,存在4个不同谱系(229E、NL63、OC43、HKU1),其不会因季节而异,但是足够分歧,需要单独的引物组。FilmArray® Respiratory Panel (BioFire Diagnostics, LLC, Salt Lake City, UT)包括腺病毒、冠状病毒HKU1、冠状病毒NL63、冠状病毒229E、冠状病毒OC43、人偏肺病毒、人鼻病毒/肠病毒、甲型流感病毒、甲型流感病毒/H1、甲型流感病毒/H3、甲型流感病毒/H1-2009、乙型流感病毒、副流感病毒1型、副流感病毒2型、副流感病毒3型、副流感病毒4型和呼吸道合胞病毒。除了这些病毒之外,FilmArray® Respiratory Panel包括以下3种细菌:百日咳博代氏杆菌(Bordetella pertussis)、肺炎嗜衣原体(Chlamydophila pneumoniae)和肺炎支原体(Mycoplasma pneumonia)。高密度阵列581能够将这种组容纳在单个袋510中。其他组可用于FilmArray®,每个测定至少20种病原体。
实施例2:袋装载
图5显示装载站600。如所显示的那样,图1的袋510已经装载到装载站600的槽610中,使得只有袋510的配件590可见。如所显示的那样,装载站600提供有用于容纳样品小瓶650的样品小瓶座602和用于容纳水合小瓶670的水合小瓶座604。然而,应该理解,座和小瓶用于辅助工作流程并且仅为说明性的。其他配置及与其他袋和其他装置一起使用也处于本公开的范围内。
将样品吸移或者以其他方式装载到样品小瓶650中。如以下更详细讨论的那样,依工作流程而定,样品小瓶650可能已经含有用于接收生物样品的缓冲液或其他流体652,或者操作者可将适当缓冲液中的生物样品加入到样品小瓶650中。任选地,缓冲液可提供在单独的安瓿中,并分配适当量的缓冲液。类似地,水合小瓶670可预先装载有水、缓冲液或其他流体672,或者操作者可用这种流体装载水合小瓶670。
说明性的配件590包括说明性地在配件590的第二表面595附近形成的注入口541。如所显示的那样,注入口541位于样品注入开口563中,该注入开口563配置成通过配件590的第一表面594接收插管式转移容器,比如插管式注射器。在该说明性的配置中,注入口541被保护以防意外刺穿并且不会打开,直到将插管式转运容器置于样品注入开口563中。类似地,说明性的配件590包括说明性地在配件590的第二表面595附近形成的第二注入口588,并且位于水合流体注入开口583中,该注入开口583配置成类似于样品注入开口563。如该说明性实施方案中配置的那样,注入口541用于接收待测样的样品,该样品将被移到室592a或直接进入裂解泡罩522 (图1),并且第二注入口588配置成用于接收水合流体672 (显示在图7中),比如水或缓冲液,该水合流体672移到室592b至592l,用于随后移动通过入口通道515b至515l。应该理解,注入口541和588以及开口563和583的排列为说明性的,并且其他配置处于本公开的范围内。
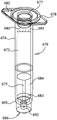
如图6中最佳显示的那样,说明性的样品小瓶650包括顶面662、瓶体654和插管655,其排列类似于许多插管式注射器。在该说明性的实施方案中,代替许多插管式注射器中存在的柱塞,样品小瓶650提供有盖658,用于延伸通过顶面662以密封瓶体654。说明性地,操作者将倾倒、吸移、插入拭子、挖去固体或半固体材料,或者以其他方式将流体和/或其他材料转移通过顶面662中的开口657并进入瓶体654中。
依待测试的样品类型而定,样品小瓶650可提供有过滤器646,过滤器646说明性地位于瓶体654的六边形底面666处或附近。如所显示的那样,过滤器646通过O形环644固定就位。然而,应该理解,过滤器646可通过粘合剂、通过焊接、通过压装到位或通过本领域已知的其他手段来固定就位。当插管655插入到样品注入开口653中并将样品抽吸到袋510中时,样品材料在被牵引通过过滤器646并进入插管655时被过滤。尽管过滤器材料的选择取决于样品类型和颗粒大小,但是适用于各种生物样品的过滤器包括Pall 100 µm AbsoluteUltipleat Polypropylene Melt Blown Media (聚丙烯熔喷介质)和Millipore 80 µmPolypropylene Net Filter (聚丙烯网过滤器)。大多数注射器过滤器设计成排除一定大小的生物体,从而从滤液中去除这些生物体。与这种预先存在的过滤器不同,这些说明性的过滤器基于其排除粪便、土壤、粉末等中存在的较大颗粒,同时使得直径为约60 μm或更小的靶生物体(例如细菌、病毒、原生动物和真菌生物体)能够通过过滤器的能力来选择。而且,说明性的过滤器材料为惰性的(即不结合生物体或核酸)并且相对抗堵塞。应该理解,选择这些说明性过滤器用于包含原生动物作为靶生物体(高达约60 μm)的样品。因为一些袋配置可能仅针对较小靶进行测试,所以可能期望具有较小孔径的过滤器,比如对于细菌和真菌具有1-10 μm孔径的过滤器,并且如果仅检测病毒颗粒,则孔径小于1 μm。当然,较大孔径的过滤器仍可用于过滤较小靶。这种过滤器对于具有大量颗粒物质的样品类型比如可能堵塞流体系统的土壤、粪便和粉末特别有用。进一步地,应该理解,孔径基于待过滤的材料选择,并且其他孔径处于本发明的范围内。
应该理解,可在瓶体654中提供用于样品制备的一种或多种干燥的组分。这种添加剂可包括缓冲剂、稳定剂、蛋白酶、DNA酶、DNA酶抑制剂、RNA、RNA酶抑制剂、溶菌酶,还原剂等。或者,这种组分可包括在样品缓冲液中,或者可在样品离开小瓶650用于进一步处理之后加入到下游。应该理解,这种添加剂的选择取决于样品类型和期望的进一步处理。助于降低粘度或助于溶解性以使得样品能够通过过滤器646的添加剂特别有用。
如所显示的那样,底盖664提供有六边形部分666,该六边形部分666配置成装入六边形样品小瓶座602。尽管在说明性实施方案中六边形部分666和样品小瓶座为六边形的,但是应该理解可使用其他形状,并且可提供六边形或者其他配合或互锁形状以辅助操作者移除底盖664。或者,操作者可通过其他手段移除底盖664,比如使用两只手从瓶体654拧下底盖664。底盖654可压装、装到或以其他方式盖到瓶体654上。
在说明性的实施方案中,底盖664提供有底座648,从而插管655的底端659延伸到底座648中。说明性地,插管655的底端659紧密地装入底座648内,使得底座648在插管655的开口底端659周围提供气密密封。任选地,在底盖664与瓶体654之间提供通风孔649。
现转向图7,水合小瓶670可与样品小瓶650类似地配置。然而,可期望用水合流体672预先装载水合小瓶670,并将水合流体672预先密封在水合小瓶670中,如图7中显示的那样。如图7中显示的那样,说明性的水合小瓶670包括顶面682、瓶体674和插管675,其排列类似于样品小瓶650。然而,说明性的水合小瓶670的盖678的舌部680已被压装到顶面682的开口677中,并且盖678可被密封到顶面682,从而防止水合小瓶670打开。这种排列仅为说明性的,并且应该理解,本文设想了在水合小瓶670内密封水合流体672的其他方式。说明性地,瓶体674和插管675可提供完全充满或基本上完全充满流体,使得处理或旋转水合小瓶670将不允许空气进入插管675。或者,一些空气685或其他气体可存在于瓶体674内,并且操作者可将水合体保持在直立位置以防止空气进入插管675。在仍然另一个备选实施方案中,空气685可在压力下提供,并且移除底盖684将导致水合流体被迫通过插管675。如所显示的那样,水合小瓶670未提供有过滤器,但是可视需要提供一个。
可提供底盖684,以保留可能从插管675滴落的任何流体以及防止插管675中的水合流体672的污染。擦拭器683可提供在底盖684中以从插管675的底部擦除多余的流体。擦拭器683的圆锥形状还可助于在随后的处理和处置期间将液滴保留在底盖684中。在说明性的实施方案中,底盖684提供有用于与六边形水合小瓶座604配合的六边形部分686,但是如以上讨论的那样,关于样品小瓶650其他形状也是可能的。水合小瓶670的六边形部分686和六边形水合小瓶座604可具有与样品小瓶650的六边形部分666和六边形样品小瓶座602不同的尺寸和/或不同的形状,使得仅有样品小瓶650易于装入样品小瓶座602和仅有水合小瓶670易于装入水合小瓶座604中,以减少操作者混淆样品小瓶650与水合小瓶670的机会,使得通过口541和588注入正确的流体。另外,样品小瓶650和注入开口563可部分或完全地以匹配的特定颜色(说明性地红色)提供,而水合小瓶670和注入开口583可部分或完全地以不同的匹配特定颜色(说明性地蓝色)提供,以在口541和588中提供正确的流体时提供给操作者视觉辅助。为了进一步使将错误的液体插入错误的注入开口的风险最小化,插管655的直径可不同于插管675的直径,并且样品注入开口563和水合流体注入开口583的直径可以类似地不同。其他配置处于本公开的范围内。
返回到图5,说明性地,为了装载袋510,操作者在装载站600上将样品小瓶650置于样品小瓶座602中和将水合小瓶670置于水合小瓶座604中。袋510也被置于槽610中。将样品以适合于样品类型的任何方式置于样品缓冲液652中,包括插入拭子630、吸移流体样品、将血液从患者直接滴入瓶体中,并伴随任选的涡旋或其他混合将固体或半固体样品比如粪便置于瓶体中,如本领域中的标准那样。依样品类型和期望的靶核酸而定,样品缓冲液可含有一种或多种添加剂或稳定剂,说明性地用于处理生物样品或环境样品,比如蛋白酶、DNA酶、DNA酶抑制剂、RNA酶、RNA酶抑制剂、溶菌酶等。另外或者备选地,这些添加剂可提供于袋510中。优选地,在涡旋或混合之前,操作者通过将盖658的舌部660置于通过开口657来关闭样品小瓶650。插入舌部660将瓶体654内含有的空气加压。说明性地,舌部660的体积等于或大于插管655的体积。说明性地,当移除底盖664时,底座648和插管655的底端659之间的气密密封被破坏,并且基本上所有空气都被挤出插管655。如果舌部660的体积大于插管655的体积,则这将助于确保最大量的空气从插管655中排出。被迫进入并可能通过插管655的流体量中的任何溢出可被捕获在底盖664中,并通过擦拭器663从插管655的底部移除。通过完全或基本上完全填充插管655,使装载袋时袋510中的气泡量最小化。一个或多个通风孔649可助于底盖664与水合小瓶650分离。
因为底盖664提供有六边形部分666,该六边形部分666配置成装入六边形样品小瓶座602,操作者可易于拧下底盖654,同时底盖啮合座602,从而暴露插管655。然后将插管655插入到样品注入开口563中并推入,打开注入口541。在有或没有来自瓶体的压力的情况下,袋590内的真空(或袋内相对于大气压力或袋外压力的减压)说明性地迫使样品通过过滤器(如果存在的话),可用于将样品抽吸到袋510中,说明性地抽吸到配件590中的室592a中,用于随后移入裂解室522。通过确保插管655基本上充满流体652,使从样品小瓶650移到袋510中的空气或其他气体的量最小化,从而最小化气泡的大小和数量。此外,当使用具有柱塞的现有技术注射器并且袋590内的真空抽吸流体时,柱塞沿注射器下拉,从而平衡注射器内的压力。在图5-6的实施方案中,因为每个瓶体顶部的开口被密封,当来自袋590内的真空从小瓶抽吸流体时,小瓶也将经受负压,并且可使样品脱气和从袋590抽出一些剩余的气泡。然后从样品注入开口563抽出插管655,并根据方案处置样品小瓶650和底盖664。由于瓶体654处于负压下,当插管655被抽出时,可能在注入口541附近已经收集的气泡可从袋510抽出,进一步减少袋中的气泡。
类似地,操作者从水合小瓶670拧下底盖684,从而暴露插管675。如果在压力下提供水合小瓶670的内容物,则当插管675与底座692分开时,少量水合流体可能泄漏到底盖684中。一个或多个通风孔693可助于底盖684与水合小瓶670分开。然后将插管675插入到水合注入开口583中并推入,打开注入口588。来自配件590内的真空可用于将水合流体抽吸到袋510中,说明性地抽吸到室592b-592l中,用于随后移入袋510的各泡罩中。将插管675从水合注入开口583移除,将袋510从装载站600移除并置于仪器800中,且开始运行。应该理解,瓶的移除仅为说明性的。如果仪器和小瓶的配置允许,则可将小瓶永久插入注入口,从而成为袋的封闭系统的一部分,并使来自样品的污染最小化。在这种实施方案中,可能不需要密封条。
在以上讨论的样品小瓶650的说明性实施方案中,舌部660的体积等于或大于插管655的体积。在其中袋510具有1 ml填充体积的一个示例性实施方案中,瓶体654可提供有1.5 ml样品流体652和样品流体上方1 ml体积的空气645。因此,空气为瓶体654体积的40%。然而,应该理解,可使用其他百分比的空气,包括10%、20%、30%、50%、60%、70%、80%及之间的量。当舌部660通过开口657插入时,样品流体上方的空气被压缩说明性地达约50%,但是在40-60%、30-70%、20-80%和10-90%范围内的压缩都是可能的。应该理解,空气和样品流体的体积选择取决于样品大小、插管直径、是否期望在运行流体反应之前移除小瓶以及一些其他因素。例如,不管流体系统的填充体积如何,挖去或擦拭的样品可能需要明显更大体积的样品流体。
说明性的瓶体654和674为圆柱形的。然而,因为这些说明性的小瓶不提供柱塞,因此应该理解,瓶体不需要具有圆形截面,并且任何主体形状均处于本发明的范围内。
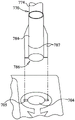
图8-10显示装载站600和小瓶650、670的备选实施方案,其中相同的编号表示相似的部件。如图8中显示的装载站700可类似于装载站600,具有样品小瓶座702和水合小瓶座704及用于接收袋510的槽710,类似于图1中显示的那些。然而,根据至少一个实施方案,装载站600与装载站700之间的座的形状和位置明显不同。例如,在至少一个实施方案中,与装载站600的座602、604相比较,座702和704更靠近袋510。由于该距离减小,装载袋510时发生滴落的机会较少。此外,如图9-10中最佳所见的那样,样品小瓶750的底盖764提供有4个相对短的翅片767,装在样品小瓶座702的4个匹配槽703内,并且水合小瓶770的底盖784提供有两个相对较长的翅片787,装在水合小瓶座704的两个匹配槽705内。这些翅片分别替换了小瓶650和670的六边形部分666和686。底盖764上的较大数目翅片767防止样品小瓶750被置于水合小瓶座704中,并且底盖784的较长翅片787防止水合小瓶770被置于样品小瓶座702中。然而,应该理解,使用不同大小和数目的翅片仅为说明性的,并且不同的键控系统处于本公开的范围内。如以上关于装载站600讨论的那样,装载站700的座702、704可用于辅助将底盖764、784从其各自瓶体754、774拧下,以辅助装载过程。
尽管样品小瓶650、750和水合小瓶670、770用于说明性实例中用于装载袋510,但是应该理解,这些装载瓶适合于装载本文公开的任何袋。它们也适合于装载其他流体或微流体装置,尤其是配置成使用真空或抽吸将液体抽吸到流体装置的流体装置。
实施例3:样品制备
在该说明性的实施方案中,使用来自下呼吸道感染(LRTI)的样品。然而,应该理解,本方法可适合于其他样品类型,包括但不限于难以处理的生物样品和环境样品类型,并且对于选择性结合收集材料并且然后释放的任何样品类型特别有用。LRTI为常见疾病,但是由于偏倚的诊断技术和抑制性样本特征,鉴定致病因子可能是困难的。目前用于病原体鉴定的“黄金标准”为细菌培养,其具有高度主观性,缺乏灵敏性,并且为一种不完全的筛选方法,因为培养仅能鉴定可培养的病原体,而不可培养的病原体未检测到。LRTI样本包括多种样本类型,比如支气管肺泡灌洗(BAL)、小型BAL、支气管冲洗液、痰和气管内抽吸物(ETA),所有这些样本都具有独特且通常具有挑战性的特征。痰和ETA样本可能难以操作,可能处理缓慢,并且可能对分子检测方法具有高度抑制性。另外,LRTI病原体包括革兰阳性和革兰阴性细菌、病毒和真菌生物体,通常需要多种样品处理方法。
痰为一种半固体样品基质,具有可变的粘度和颗粒。BAL可具有类似于清洁盐水的粘度或者可具有类似于痰的粘度,这两者都可能存在处理上的挑战。困难包括样本不可吸移、由于粘度变化引起的吸移体积不准确、气袋、拉回、残留物和袋注入或样品操作期间的起泡。由于粘度高,可能难以从样品基质分离病原体。另外,这种样品中存在的RNA酶活性可能影响RNA检测。对于这种样品类型,物理和化学裂解的组合可能是有效的。
痰样品可使用任何合适的手段获得,包括使患者吐痰到合适的收集容器中或诱导患者产生样本。大多数病原体检测方法使用可能难以用于痰或其他粘性样品的体积转移系统。一般地,样品进行预处理以液化样品用于随后的吸移。在一个说明性的实施方案中,拭子用于转移样品,减少或消除对预处理步骤的需要。尽管可使用移液管、其他拭子和其他转移装置来转移样品,但是使用植绒拭子提供一种简单且容易的方法来将样本引入到测试系统中,同时使样本操作问题最小化。一种合适的拭子为FLOQSwabs™ (Copan Diagnostics,Murrieta, CA)。这种说明性的植绒拭子为亲水性的,并且非常适合于收集病原体。对于说明性地具有3 cP或更高粘度的这种粘性样品或者固体或半固体样品,植绒拭子可相对固体材料优先地收集生物体。植绒拭子也可相对样品基质材料优先地释放生物体。相对样品基质优先地收集和释放生物体的其他材料可用于转移样品,并且应该理解,拭子形式仅为说明性的。
在一个说明性的实施方案中,拭子630可置于从患者收集的样品中,或者可置于环境样品中。拭子630然后可直接置于样品小瓶650中的样品缓冲液652中。依样品类型而定,样品缓冲液652可为任何缓冲液。如图6中显示的那样,如果需要,拭子630的尖端可被折断并且盖658可用于关闭瓶体654。瓶体654内的拭子尖端630的存在不应显著影响小瓶650的使用。小瓶650可说明性地通过倒置3次来摇动,或者说明性地更剧烈摇动10秒以从拭子630释放存在的任何病原体。或者,拭子630可在样品缓冲液652中打旋,并且然后可从小瓶650中取出拭子630。尽管不受理论的束缚,但是据信植绒拭子可相对样品基质优先地收集细胞、生物体和病毒,并且然后可保留一部分样品基质比如粘性痰材料,同时至少释放生物体和病毒。然而,应该理解,在各种实施方案中可使用其他拭子或转移装置。说明性地,可使用相对样品基质选择性地收集和释放期望的样品的任何转移材料来浓缩样品。这种材料包括拭子、刷子、海绵、过滤器、器具、环、纸或者选择性地结合和释放期望的样品并可在样品转移用于分析期间置于与样品接触的其他吸附材料。
因此,已经发现这种植绒拭子适合于收集和释放粘性样品比如LRTI样品中的病原体,并且植绒拭子提供相当均匀的收集体积。单个FLOQSwabs™拭子以相当可重复的方式收集约150-300 μl样品,包括较高粘度的样品类型,比如痰。可重复收集具有小样品体积范围(说明性地为2倍-4倍体积范围)的粘性样品的其他材料处于本发明的范围内。应该理解,样品体积范围为样品收集材料可重复收集的体积范围,使得说明性的2倍范围为150-300 μl和说明性的4倍范围为150-600 μl,但是包括其他2倍和4倍范围在内的其他范围处于本发明的范围内。说明性的实例包括其大小可收集50-150 μl以及300-1000 μl样品,并且可能收集5-10 ml的拭子,但是应该理解这些范围为说明性的,并且其他大小范围是可能的。尽管这种拭子可用于从患者收集样本,但是在一个说明性的实施方案中,使用拭子以可重复的方式收集样本,并将样品从合适的收集容器转移到另一个容器用于进一步处理。然而,应该理解,其他合适的收集和转移材料可与本文公开的各种实施方案一起使用,如本领域已知的那样。
本领域已知预处理困难样品一段时间。例如,痰可用二硫苏糖醇(DTT)处理和/或加热15分钟或更长时间,有时30分钟或更长时间。可使用样品缓冲液652,其可部分或完全液化痰样样本,说明性地没有这种预处理。本领域已知的缓冲液通常以按体积计10%或更少的量使用洗涤剂。本发明的说明性样品缓冲液652可含有10%或更多的洗涤剂,说明性地为12%、15%、18%、20%或更多的洗涤剂。合适的洗涤剂包括可使用非离子型、离子型和两性离子型洗涤剂。在一个说明性的实施方案中,可使用非离子型洗涤剂比如15% Triton-X。其他非限制性洗涤剂包括Tween-20、SDS和NP-40。已经发现,这种较高浓度的洗涤剂可在核酸提取之前减少或消除对预处理比如加热样品或DTT混合物预处理的需要。因此,可仅用5分钟或更少、2分钟或更少、1分钟或更少或者甚至没有保持时间来处理样品。然而,应该理解,对于一些样品类型预处理可为期望的。样品缓冲液652也可含有胍鎓化合物,比如盐酸胍。在一个说明性实例中,缓冲液为酸性的,说明性地具有约2-约6的pH。在某些样品制备方法中,说明性地当样品类型为血液或血液组分时,在样品缓冲液652中使用醇比如异丙醇。然而,其他样品缓冲液可为不含醇的。已经发现,在以10%或更多,说明性地15%的浓度采用洗涤剂的各种说明性的实施方案中,醇可从样品缓冲液652中省略。
如以上讨论的那样,样品小瓶650可提供有过滤器646。当插管655插入到样品注入开口653并且样品被抽吸到袋510中时,样品材料在其被牵引通过过滤器646并进入插管655时被过滤。这种过滤器646可被粘性样品比如痰堵塞。在一些实施方案中,样品小瓶650可提供有蛋白酶比如蛋白酶K,或者蛋白酶可以其他方式提供在样品小瓶650中或者可与样品缓冲液652一起加入。如果蛋白酶以干燥形式提供,则样品缓冲液652的引入使蛋白酶再水合,并且将样品引入到样品缓冲液652中使得蛋白酶能够开始分解样品中的蛋白质,甚至在样品被转移到袋510并到达裂解泡罩522之前。蛋白酶的作用可助于降低样品粘度,从而改善样品通过过滤器646的能力或改善其他下游处理步骤。因此,可用样品小瓶650中存在的蛋白酶将更多的病原体从样品中释放出来。然而,在一些使用蛋白酶的实施方案中,可期望将蛋白酶直接加入到样品缓冲液中或者稍后在该过程中加入蛋白酶,说明性地通过使蛋白酶在入口通道515b中干燥,而在其他实施方案中,蛋白酶可以省略。
应该理解,通过使用植绒拭子、更高的洗涤剂浓度、在蛋白酶存在下通过过滤器646过滤或其组合优先转移病原体可避免对加热或DTT预处理的需要,并可充分分解这种粘性样品。然后可将这种样品准备好用于随后的裂解步骤,随后进行PCR或其他测试。
尽管以上说明性描述关注于痰和其他LRTI样品类型,但是应该理解,以上方法和装置可与广泛的各种样品类型一起使用,特别是(但不限于)困难样品类型。除了痰、BAL和其他LRTI样品类型之外,其他困难生物样品包括但不限于粘液、粪便、组织、组织匀浆物、磨碎的组织、石蜡处理的福尔马林包埋组织、骨、骨匀浆物、焦痂、脓、滑液、淋巴结抽吸物和胃洗液。环境样品(说明性地为土壤、表面、粉末或食物)也可能存在挑战。使用植绒拭子或优先地收集和释放病原体的其他转移手段进行转移,允许相对一致地收集病原体,甚至是从难以准确地吸移或测量的样品。可使用部分或完全液化样品基质的样品缓冲液。通过过滤器抽吸样品,说明性地在存在较高浓度的洗涤剂或添加剂以助于样品制备的情况下,有助于分解样品基质以便以适合于进一步处理的形式提供样品。
实施例4:直接血液样品
在该实施方案中,直接血液样品用于宿主RNA分析。本文使用的“直接血液”意指尚未培养的血液样品。说明性的直接血液样品包括直接来自宿主生物体(说明性地为人)的全血、全血组分(例如血浆或血清)、收集在抗凝剂溶液(例如EDTA、枸橼酸盐)中的全血或收集在RNA稳定化溶液中的全血。应该理解,宿主对感染性、急性和/或慢性疾病的响应导致某些RNA分子(包括但不限于核糖体RNA、信使RNA (mRNA)、长非编码RNA或小干扰RNA)产生方面的变化。RNA产生的这种变化可用于表示宿主疾病的来源。直接血液样品中的RNA通常用自动或手动提取方法纯化,所述方法包括离心、洗涤、加入优化的缓冲液、蛋白质和核酸消化(经常伴随另外的洗涤)和洗脱。在许多现有技术方法中,这全部使用与终点分子诊断工具分开的设备来完成,并且通常需要90分钟或更长时间。然后将生成的纯化样品手动加入到终点分子诊断系统比如cDNA微阵列或qPCR仪器。纯化宿主RNA样品的过程通常需要大量时间、外部设备和样品操作,所有这些都可影响样品的完整性和质量。一种备选方法是将直接血液样品(说明性地以以上定义的任何形式)直接加入到样品缓冲液652中。说明性的样品缓冲液含有辅助核酸结合和回收,同时减少可降解RNA的蛋白质像RNA酶的离液剂(chaotropic agent)。说明性地,直接血液样品与样品缓冲液的比率在1:8-1:1的范围内,更具体地讲在1:5-1:1.67的范围内,但是应该理解其他比率也是可能的。如以上讨论的那样,该样品然后可直接装载到袋510中。如以上讨论的那样,宿主RNA在封闭系统内提取和纯化,说明性地在小瓶650中只有最小的混合或者没有任何另外的用户操作。这种样品制备可在没有任何或全部涉及离心、乙醇沉淀和DNA消化的步骤的情况下完成。因此,样品可仅用2分钟或更短的时间进行处理,并且不需要来自终点分子诊断工具的外部设备。
该应用的一个实例为检测响应流感感染的宿主RNA变化。将按照制造商说明书收集在RNA稳定化溶液中的100微升(100 µL)全血样品加入到样品缓冲液652中,说明性地为与FilmArray Respiratory Panel (BioFire Diagnostics, LLC)一起提供的样品缓冲液。说明性地,可使用300-900 μl或者样品缓冲液的2-5倍的样品体积。然后将该混合物注入到一次性袋510中。样品提取、纯化、逆转录和两个阶段的聚合酶链式反应导致测量相对于健康对照响应于病毒感染的显著上调的宿主RNA。样品纯化和qPCR分析的整个过程需要不到70分钟。
本申请的进一步实例为从收集在抗凝剂溶液(EDTA)中的全血中检测宿主RNA。将100微升(100 µL)的该全血样品加入到800 μL相同的样品缓冲液中。然后将该混合物注入到袋510中。样品提取、纯化、逆转录和两个阶段的聚合酶链式反应导致测量宿主RNA。样品纯化和qPCR分析的整个过程需要不到70分钟。
这些实例证实,可仅使用裂解(说明性地化学和/或机械裂解)和核酸纯化(说明性地通过与二氧化硅基底结合并洗脱,说明性地不超过5次洗涤或不超过3次洗涤,但是少至一次洗涤处于本发明的范围内),从直接血液样品提取核酸,说明性地为高拷贝数的核酸,包括但不限于各种RNA分子、细菌、病毒或其他微生物。这些核酸可不经离心或酶消化而被提取和制备,并且没有许多重复的洗涤步骤。同样如所证实的那样,这些提取的核酸适合作为随后扩增的模板。
本发明可以其他具体形式实施而不背离其精神或基本特征。所描述的实施方案在所有方面仅被认为是说明性的而非限制性的。因此,本发明的范围由附加的权利要求而不是由前述描述来表示。尽管为了说明本发明的目的而在本文和所附发明公开中包括了某些实施方案和细节,但是对本领域技术人员显而易见的是,本文公开的方法和设备可进行各种变化而不背离在附加权利要求中定义的本发明范围。在权利要求的等同含义和范围内的所有变化都将包括在其范围内。
Claims (35)
1.一种样品收集方法,所述方法包括:
收集包含生物物质或环境物质的样品以提供收集的样品,
将所述收集的样品与拭子接触,
将具有收集的样品的所述拭子置于样品缓冲液中,从而将至少一部分收集的样品转移到样品缓冲液中以提供包含收集的样品的样品缓冲液,和
过滤所述样品,
其中没有超过2分钟的预处理步骤,
其中收集步骤缺少拭子收集步骤,
其中收集步骤包括从支气管肺泡灌洗(BAL)、小型BAL、支气管冲洗液、气管内抽吸物(ETA)或痰获得样品,以提供所述收集的样品,和
其中所述样品缓冲液包含按所述样品缓冲液的体积计至少10%的量的洗涤剂。
2.权利要求1的样品收集方法,所述方法进一步包括使所述样品缓冲液中的所述样品与蛋白酶接触。
3.权利要求1的样品收集方法,其中所述拭子为植绒拭子。
4.权利要求1的样品收集方法,其中所述收集步骤包括在没有吸移的情况下从样品容器收集所述样品,并且所述拭子配置成吸收和释放在4倍体积范围内的样品量。
5.权利要求4的样品收集方法,其中所述拭子配置成吸收和释放在两倍体积范围内的来自所述生物物质或环境物质的样品。
6.权利要求4的样品收集方法,其中所述物质为粘度为3 cP或更高的物质。
7.权利要求6的样品收集方法,其中所述物质为痰。
8.权利要求1的样品收集方法,其中所述样品缓冲液包含按所述样品缓冲液的体积计至少12%的量的洗涤剂。
9.权利要求1的样品收集方法,其中所述样品缓冲液包含按所述样品缓冲液的体积计12%-18%范围内的量的洗涤剂。
10.权利要求1的样品收集方法,其中所述样品缓冲液包含按样品缓冲液的体积计15%的Triton-X。
11.权利要求1的样品收集方法,其中所述过滤步骤包括在存在蛋白酶的情况下抽吸所述样品通过过滤器。
12.权利要求1的样品收集方法,其中所述样品缓冲液含有醇。
13.权利要求1的样品收集方法,其中所述样品缓冲液不含醇。
14.权利要求1的样品收集方法,其中所述样品包含样品基质和病原体,其中所述拭子优先地保留所述样品基质,同时优先地将所述病原体释放到所述样品缓冲液中。
15.权利要求1的样品收集方法,其中没有预处理步骤的保持时间。
16.权利要求1的样品收集方法,其中所述样品为痰,并且所述痰在放置步骤之前未经热处理或未用DTT处理。
17.权利要求1的样品收集方法,其中所述样品缓冲液包含选自非离子型洗涤剂、离子型洗涤剂、两性离子型洗涤剂及其任何组合的洗涤剂。
18.权利要求1的样品收集方法,其中所述生物样品或环境样品为困难样品类型。
19.一种样品收集方法,所述方法包括:
收集包含生物物质或环境物质的样品以提供收集的样品,
将所述收集的样品与拭子接触,和
将所述拭子置于样品缓冲液中,从而将至少一部分收集的样品转移到样品缓冲液中以提供包含收集的样品的样品缓冲液,
其中所述样品缓冲液包含按所述样品缓冲液的体积计至少10%的量的洗涤剂,
其中收集步骤缺少拭子收集步骤,
其中收集步骤包括从支气管肺泡灌洗(BAL)、小型BAL、支气管冲洗液、气管内抽吸物(ETA)或痰获得样品,以提供所述收集的样品。
20.权利要求19的样品收集方法,所述方法进一步包括抽吸所述样品通过过滤器。
21.权利要求19的样品收集方法,所述方法进一步包括使所述样品缓冲液中的所述样品与蛋白酶接触。
22.权利要求19的样品收集方法,其中所述样品为血液或血液制品。
23.权利要求22的样品收集方法,其中所述样品缓冲液不含醇。
24.权利要求19的样品收集方法,其中所述收集的样品包含样品基质和至少一种病原体,并且所述方法进一步包括过滤所述收集的样品和过滤步骤使所述样品基质与至少一种所述病原体分开。
25.权利要求19的样品收集方法,其中所述收集的样品包含样品基质和至少一种病原体,并且所述方法进一步包括过滤所述收集的样品和所述过滤步骤在没有超过5分钟的预处理步骤的情况下使所述样品基质与所述至少一种病原体分开。
26.权利要求25的样品收集方法,其中所述样品为痰,并且所述痰在放置步骤之前未经热处理。
27.权利要求19的样品收集方法,其中所述缓冲液具有2-6的pH。
28.权利要求19的样品收集方法,其中所述收集步骤包括使含有所述样品的样品基质与相对样品基质优先收集和释放生物体的材料接触。
29.一种样品收集方法,所述方法包括:
收集包含生物物质或环境物质的样品以提供收集的样品,
使所述样品与相对样品基质优先收集和释放生物体的材料接触,和
将具有收集的样品的所述材料置于样品缓冲液中,从而将至少一部分收集的样品转移到样品缓冲液中以提供包含收集的样品的样品缓冲液,和
处理所述样品,其中在处理所述样品之前没有超过2分钟的预处理步骤,
其中收集步骤缺少拭子收集步骤,和
其中收集步骤包括从支气管肺泡灌洗(BAL)、小型BAL、支气管冲洗液、气管内抽吸物(ETA)或痰获得样品,以提供所述收集的样品,和
其中所述样品缓冲液包含按所述样品缓冲液的体积计至少10%的量的洗涤剂。
30.权利要求29的样品收集方法,其中所述材料为亲水材料。
31.权利要求30的样品收集方法,其中固定量的材料可重复地吸收和释放在4倍范围内的样品量。
32.权利要求31的样品收集方法,其中所述材料作为拭子提供。
33.权利要求31的样品收集方法,其中所述材料为吸附剂并且选自拭子、刷子、海绵、过滤器、器具、环和纸。
34.权利要求29的样品收集方法,所述方法进一步包括过滤所述样品。
35.权利要求29的样品收集方法,所述方法进一步包括使来自收集的样品的核酸经受扩增条件。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202210781180.6A CN115181781A (zh) | 2015-11-02 | 2016-11-01 | 困难样品类型的样品制备 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562249592P | 2015-11-02 | 2015-11-02 | |
| US62/249592 | 2015-11-02 | ||
| PCT/US2016/059928 WO2017079167A1 (en) | 2015-11-02 | 2016-11-01 | Sample preparation for difficult sample types |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202210781180.6A Division CN115181781A (zh) | 2015-11-02 | 2016-11-01 | 困难样品类型的样品制备 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN108473931A CN108473931A (zh) | 2018-08-31 |
| CN108473931B true CN108473931B (zh) | 2022-07-19 |
Family
ID=58635347
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202210781180.6A Pending CN115181781A (zh) | 2015-11-02 | 2016-11-01 | 困难样品类型的样品制备 |
| CN201680077342.0A Active CN108473931B (zh) | 2015-11-02 | 2016-11-01 | 困难样品类型的样品制备 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202210781180.6A Pending CN115181781A (zh) | 2015-11-02 | 2016-11-01 | 困难样品类型的样品制备 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US11175205B2 (zh) |
| EP (2) | EP3353278B1 (zh) |
| JP (3) | JP7126445B2 (zh) |
| KR (1) | KR20180080241A (zh) |
| CN (2) | CN115181781A (zh) |
| AU (1) | AU2016350734B2 (zh) |
| BR (1) | BR112018008331B1 (zh) |
| CA (1) | CA3003172A1 (zh) |
| CL (1) | CL2018001156A1 (zh) |
| ES (1) | ES2862224T3 (zh) |
| HK (1) | HK1252952A1 (zh) |
| SG (1) | SG11201802946WA (zh) |
| WO (1) | WO2017079167A1 (zh) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9522396B2 (en) | 2010-12-29 | 2016-12-20 | S.D. Sight Diagnostics Ltd. | Apparatus and method for automatic detection of pathogens |
| US20160296945A1 (en) | 2013-03-15 | 2016-10-13 | Ancera, Inc. | Systems and methods for active particle separation |
| WO2014145765A1 (en) | 2013-03-15 | 2014-09-18 | Ancera, Inc. | Systems and methods for bead-based assays in ferrofluids |
| WO2016210348A2 (en) | 2015-06-26 | 2016-12-29 | Ancera, Inc. | Background defocusing and clearing in ferrofluid-based capture assays |
| US9933445B1 (en) | 2016-05-16 | 2018-04-03 | Hound Labs, Inc. | System and method for target substance identification |
| EP3490694A4 (en) * | 2016-07-31 | 2020-04-15 | Ancera Corp. | MULTI-LAYER DISPOSABLE CARTRIDGE FOR FERROFLUID BASED ASSAYS AND METHOD OF USE |
| WO2018175411A1 (en) * | 2017-03-20 | 2018-09-27 | Nanocellect Biomedical, Inc. | Systems, apparatuses, and methods for cell sorting and flow cytometry |
| WO2018217929A1 (en) | 2017-05-24 | 2018-11-29 | Biofire Defense, Llc | Systems and methods for point of use evacuation of an array |
| US20200245899A1 (en) | 2019-01-31 | 2020-08-06 | Hound Labs, Inc. | Mechanical Breath Collection Device |
| US11977086B2 (en) | 2019-03-21 | 2024-05-07 | Hound Labs, Inc. | Biomarker detection from breath samples |
| CN110157702A (zh) * | 2019-05-24 | 2019-08-23 | 中国水产科学研究院南海水产研究所深圳试验基地 | 一种用于提取珊瑚rna样品的采集操作台 |
| US11933731B1 (en) | 2020-05-13 | 2024-03-19 | Hound Labs, Inc. | Systems and methods using Surface-Enhanced Raman Spectroscopy for detecting tetrahydrocannabinol |
| EP4158056A4 (en) * | 2020-05-29 | 2024-07-24 | Univ Rockefeller | METHOD AND SYSTEM FOR RNA ISOLATION FROM SMALL VOLUME SELF-COLLECTED SAMPLES |
| EP4168247A4 (en) * | 2020-06-18 | 2024-06-26 | NanoCellect Biomedical, Inc. | MICROFLUIDIC SYSTEMS AND METHODS FOR SORTING PARTICLES |
| CN111822282B (zh) * | 2020-07-24 | 2021-07-20 | 惠州法路源基因科技有限公司 | 一种取样拭子植绒设备 |
| US11806711B1 (en) | 2021-01-12 | 2023-11-07 | Hound Labs, Inc. | Systems, devices, and methods for fluidic processing of biological or chemical samples using flexible fluidic circuits |
| CN113136412A (zh) * | 2021-04-22 | 2021-07-20 | 浙江珂瑞康生物医疗科技有限公司 | 用于含可溶性蛋白生物医用材料的生物负载测定处理液 |
| WO2023144713A1 (en) * | 2022-01-25 | 2023-08-03 | S.D. Sight Diagnostics Ltd | Sample carrier for use with a bodily sample |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003016552A2 (en) * | 2001-08-20 | 2003-02-27 | Whatman, Inc. | Dna purification and recovery from high particulate and solids samples |
| WO2003070898A2 (en) * | 2002-02-19 | 2003-08-28 | Choicepoint Asset Company | Selective extraction of dna from groups of cells |
| JP2004245831A (ja) * | 2003-01-21 | 2004-09-02 | Denka Seiken Co Ltd | メンブレンアッセイ法 |
| CN103229053A (zh) * | 2010-07-27 | 2013-07-31 | 西北大学 | 过滤血浆的装置和方法 |
| CN103327906A (zh) * | 2011-01-05 | 2013-09-25 | 意大利科潘恩集团公司 | 用于实现用于收集和转移分子生物学样品之装置的方法 |
| CN104159559A (zh) * | 2011-11-10 | 2014-11-19 | 拜奥法尔诊断有限责任公司 | 装填管瓶 |
| CN104246505A (zh) * | 2012-04-05 | 2014-12-24 | 株式会社比尔生命 | 结核菌群的免疫学检测方法和试剂盒 |
| CN104321423A (zh) * | 2012-07-09 | 2015-01-28 | 拜奥卡蒂斯股份有限公司 | 一种用于过滤生物样品的方法 |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6645758B1 (en) | 1989-02-03 | 2003-11-11 | Johnson & Johnson Clinical Diagnostics, Inc. | Containment cuvette for PCR and method of use |
| US6780617B2 (en) | 2000-12-29 | 2004-08-24 | Chen & Chen, Llc | Sample processing device and method |
| US20040209331A1 (en) | 2001-07-16 | 2004-10-21 | Kirk Ririe | Thermal cycling system and method of use |
| US20040157219A1 (en) * | 2003-02-06 | 2004-08-12 | Jianrong Lou | Chemical treatment of biological samples for nucleic acid extraction and kits therefor |
| EP2402089A1 (en) * | 2003-07-31 | 2012-01-04 | Handylab, Inc. | Processing particle-containing samples |
| US7387887B2 (en) | 2004-04-20 | 2008-06-17 | University Of Utah Research Foundation | Nucleic acid melting analysis with saturation dyes |
| US8986614B2 (en) | 2010-02-23 | 2015-03-24 | Rheonix, Inc. | Self-contained biological assay apparatus, methods, and applications |
| EP3556868A1 (en) | 2005-05-09 | 2019-10-23 | BioFire Diagnostics, LLC | Self-contained biological analysis |
| US9481912B2 (en) | 2006-09-12 | 2016-11-01 | Longhorn Vaccines And Diagnostics, Llc | Compositions and methods for detecting and identifying nucleic acid sequences in biological samples |
| US8652782B2 (en) * | 2006-09-12 | 2014-02-18 | Longhorn Vaccines & Diagnostics, Llc | Compositions and methods for detecting, identifying and quantitating mycobacterial-specific nucleic acids |
| ES2809168T3 (es) | 2006-11-15 | 2021-03-03 | Biofire Diagnostics Llc | Análisis biológico autónomo de alta densidad |
| EP2326727B1 (en) * | 2008-08-15 | 2016-05-04 | Litmus Rapid-B LLC | Flow cytometry-based systems and methods for detecting microbes |
| NZ711257A (en) * | 2009-02-03 | 2017-05-26 | Netbio Inc | Nucleic acid purification |
| WO2012027302A2 (en) * | 2010-08-21 | 2012-03-01 | The Regents Of The University Of California | Systems and methods for detecting antibiotic resistance |
| WO2012050787A1 (en) | 2010-09-29 | 2012-04-19 | Ibis Biosciences, Inc. | Fungal nucleic acid extraction |
| US9808798B2 (en) * | 2012-04-20 | 2017-11-07 | California Institute Of Technology | Fluidic devices for biospecimen preservation |
| PL3539666T3 (pl) | 2012-05-24 | 2022-01-31 | University Of Utah Research Foundation | Urządzenie do ekstremalnej pcr |
| EP4067505A1 (en) * | 2013-03-15 | 2022-10-05 | Abbott Molecular Inc. | Compositions and methods for nucleic acid extraction |
| US10093918B2 (en) * | 2014-06-04 | 2018-10-09 | Lucigen Corporation | Sample collection and analysis devices |
-
2016
- 2016-11-01 SG SG11201802946WA patent/SG11201802946WA/en unknown
- 2016-11-01 CN CN202210781180.6A patent/CN115181781A/zh active Pending
- 2016-11-01 ES ES16862803T patent/ES2862224T3/es active Active
- 2016-11-01 US US15/340,612 patent/US11175205B2/en active Active
- 2016-11-01 AU AU2016350734A patent/AU2016350734B2/en active Active
- 2016-11-01 EP EP16862803.0A patent/EP3353278B1/en active Active
- 2016-11-01 BR BR112018008331-3A patent/BR112018008331B1/pt active IP Right Grant
- 2016-11-01 KR KR1020187013973A patent/KR20180080241A/ko not_active Application Discontinuation
- 2016-11-01 CA CA3003172A patent/CA3003172A1/en active Pending
- 2016-11-01 JP JP2018522661A patent/JP7126445B2/ja active Active
- 2016-11-01 EP EP20203395.7A patent/EP3789503B1/en active Active
- 2016-11-01 WO PCT/US2016/059928 patent/WO2017079167A1/en active Application Filing
- 2016-11-01 CN CN201680077342.0A patent/CN108473931B/zh active Active
-
2018
- 2018-04-30 CL CL2018001156A patent/CL2018001156A1/es unknown
- 2018-09-26 HK HK18112308.2A patent/HK1252952A1/zh unknown
-
2021
- 2021-10-01 JP JP2021162839A patent/JP2022008815A/ja active Pending
- 2021-10-19 US US17/504,903 patent/US20220034770A1/en active Pending
-
2023
- 2023-03-08 JP JP2023035914A patent/JP2023085281A/ja active Pending
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003016552A2 (en) * | 2001-08-20 | 2003-02-27 | Whatman, Inc. | Dna purification and recovery from high particulate and solids samples |
| WO2003070898A2 (en) * | 2002-02-19 | 2003-08-28 | Choicepoint Asset Company | Selective extraction of dna from groups of cells |
| JP2004245831A (ja) * | 2003-01-21 | 2004-09-02 | Denka Seiken Co Ltd | メンブレンアッセイ法 |
| CN103229053A (zh) * | 2010-07-27 | 2013-07-31 | 西北大学 | 过滤血浆的装置和方法 |
| CN103327906A (zh) * | 2011-01-05 | 2013-09-25 | 意大利科潘恩集团公司 | 用于实现用于收集和转移分子生物学样品之装置的方法 |
| CN104159559A (zh) * | 2011-11-10 | 2014-11-19 | 拜奥法尔诊断有限责任公司 | 装填管瓶 |
| CN104246505A (zh) * | 2012-04-05 | 2014-12-24 | 株式会社比尔生命 | 结核菌群的免疫学检测方法和试剂盒 |
| CN104321423A (zh) * | 2012-07-09 | 2015-01-28 | 拜奥卡蒂斯股份有限公司 | 一种用于过滤生物样品的方法 |
Non-Patent Citations (4)
| Title |
|---|
| Performance of the BD GeneOhm MRSA Achromopeptidase Assay for Real-Time PCR Detection of Methicillin-Resistant Staphylococcus aureus in Nasal Specimens;Parul A. Patel等;《JOURNAL OF CLINICAL MICROBIOLOGY》;20110420;第49卷(第6期);第2266–2268页 * |
| Simple Method for Combining Sputum and Nasal Samples for Virus Detection by Reverse Transcriptase PCR;Ann R. Falsey等;《Journal of Clinical Microbiology》;20120612;第50卷(第8期);第2835页 * |
| Swab Sample Transfer for Point-Of-Care Diagnostics: Characterization of Swab Types and Manual Agitation Methods;Nuttada Panpradist等;《PLOS ONE》;20140930;第9卷(第9期);e105786:第1-11页 * |
| The theological properties of saliva;S.S. Davis;《Rheol. Acta》;19710331;第10卷;第28-35页 * |
Also Published As
| Publication number | Publication date |
|---|---|
| US11175205B2 (en) | 2021-11-16 |
| CL2018001156A1 (es) | 2018-11-23 |
| JP2022008815A (ja) | 2022-01-14 |
| AU2016350734A1 (en) | 2018-06-14 |
| EP3353278A4 (en) | 2019-03-06 |
| CN115181781A (zh) | 2022-10-14 |
| JP2019502098A (ja) | 2019-01-24 |
| JP2023085281A (ja) | 2023-06-20 |
| CN108473931A (zh) | 2018-08-31 |
| EP3789503B1 (en) | 2024-04-10 |
| WO2017079167A1 (en) | 2017-05-11 |
| US20170122851A1 (en) | 2017-05-04 |
| EP3353278A1 (en) | 2018-08-01 |
| BR112018008331A2 (pt) | 2018-10-30 |
| SG11201802946WA (en) | 2018-05-30 |
| ES2862224T3 (es) | 2021-10-07 |
| US20220034770A1 (en) | 2022-02-03 |
| BR112018008331B1 (pt) | 2022-09-06 |
| EP3789503A1 (en) | 2021-03-10 |
| EP3789503C0 (en) | 2024-04-10 |
| HK1252952A1 (zh) | 2019-06-06 |
| KR20180080241A (ko) | 2018-07-11 |
| CA3003172A1 (en) | 2017-05-11 |
| AU2016350734B2 (en) | 2021-04-08 |
| EP3353278B1 (en) | 2021-03-10 |
| JP7126445B2 (ja) | 2022-08-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN108473931B (zh) | 困难样品类型的样品制备 | |
| US10464065B2 (en) | Nucleic acid purification | |
| US20240123452A1 (en) | Assay devices and methods of use thereof | |
| JP2013505010A (ja) | 簡易核酸増幅装置及び簡易核酸増幅装置の使用方法 | |
| AU2017235971A1 (en) | Nucleic Acid Purification | |
| CN113727841A (zh) | 用于反应容器的原位密封的设备、方法和系统 | |
| AU2013205155A1 (en) | Nucleic acid purification |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |