CN108064214B - 用于从碳氢化合物生产氢气和石墨碳的方法 - Google Patents
用于从碳氢化合物生产氢气和石墨碳的方法 Download PDFInfo
- Publication number
- CN108064214B CN108064214B CN201680019418.4A CN201680019418A CN108064214B CN 108064214 B CN108064214 B CN 108064214B CN 201680019418 A CN201680019418 A CN 201680019418A CN 108064214 B CN108064214 B CN 108064214B
- Authority
- CN
- China
- Prior art keywords
- reactor
- catalyst
- pressure
- gas
- hydrogen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J19/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J19/0006—Controlling or regulating processes
- B01J19/0013—Controlling the temperature of the process
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J19/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J19/24—Stationary reactors without moving elements inside
- B01J19/2445—Stationary reactors without moving elements inside placed in parallel
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J19/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J19/24—Stationary reactors without moving elements inside
- B01J19/245—Stationary reactors without moving elements inside placed in series
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/70—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper
- B01J23/74—Iron group metals
- B01J23/745—Iron
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J8/00—Chemical or physical processes in general, conducted in the presence of fluids and solid particles; Apparatus for such processes
- B01J8/0005—Catalytic processes under superatmospheric pressure
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J8/00—Chemical or physical processes in general, conducted in the presence of fluids and solid particles; Apparatus for such processes
- B01J8/18—Chemical or physical processes in general, conducted in the presence of fluids and solid particles; Apparatus for such processes with fluidised particles
- B01J8/24—Chemical or physical processes in general, conducted in the presence of fluids and solid particles; Apparatus for such processes with fluidised particles according to "fluidised-bed" technique
- B01J8/26—Chemical or physical processes in general, conducted in the presence of fluids and solid particles; Apparatus for such processes with fluidised particles according to "fluidised-bed" technique with two or more fluidised beds, e.g. reactor and regeneration installations
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B3/00—Hydrogen; Gaseous mixtures containing hydrogen; Separation of hydrogen from mixtures containing it; Purification of hydrogen
- C01B3/02—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen
- C01B3/22—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by decomposition of gaseous or liquid organic compounds
- C01B3/24—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by decomposition of gaseous or liquid organic compounds of hydrocarbons
- C01B3/26—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by decomposition of gaseous or liquid organic compounds of hydrocarbons using catalysts
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B3/00—Hydrogen; Gaseous mixtures containing hydrogen; Separation of hydrogen from mixtures containing it; Purification of hydrogen
- C01B3/02—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen
- C01B3/22—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by decomposition of gaseous or liquid organic compounds
- C01B3/24—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by decomposition of gaseous or liquid organic compounds of hydrocarbons
- C01B3/28—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by decomposition of gaseous or liquid organic compounds of hydrocarbons using moving solid particles
- C01B3/30—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by decomposition of gaseous or liquid organic compounds of hydrocarbons using moving solid particles using the fluidised bed technique
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B32/00—Carbon; Compounds thereof
- C01B32/20—Graphite
- C01B32/205—Preparation
-
- C—CHEMISTRY; METALLURGY
- C21—METALLURGY OF IRON
- C21B—MANUFACTURE OF IRON OR STEEL
- C21B15/00—Other processes for the manufacture of iron from iron compounds
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2203/00—Processes utilising sub- or super atmospheric pressure
- B01J2203/06—High pressure synthesis
- B01J2203/0605—Composition of the material to be processed
- B01J2203/061—Graphite
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2219/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
- B01J2219/00049—Controlling or regulating processes
- B01J2219/00162—Controlling or regulating processes controlling the pressure
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B2203/00—Integrated processes for the production of hydrogen or synthesis gas
- C01B2203/02—Processes for making hydrogen or synthesis gas
- C01B2203/0266—Processes for making hydrogen or synthesis gas containing a decomposition step
- C01B2203/0277—Processes for making hydrogen or synthesis gas containing a decomposition step containing a catalytic decomposition step
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B2203/00—Integrated processes for the production of hydrogen or synthesis gas
- C01B2203/06—Integration with other chemical processes
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B2203/00—Integrated processes for the production of hydrogen or synthesis gas
- C01B2203/10—Catalysts for performing the hydrogen forming reactions
- C01B2203/1041—Composition of the catalyst
- C01B2203/1047—Group VIII metal catalysts
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B2203/00—Integrated processes for the production of hydrogen or synthesis gas
- C01B2203/12—Feeding the process for making hydrogen or synthesis gas
- C01B2203/1205—Composition of the feed
- C01B2203/1211—Organic compounds or organic mixtures used in the process for making hydrogen or synthesis gas
- C01B2203/1235—Hydrocarbons
- C01B2203/1241—Natural gas or methane
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/30—Hydrogen technology
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Inorganic Chemistry (AREA)
- Combustion & Propulsion (AREA)
- Materials Engineering (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Geology (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Life Sciences & Earth Sciences (AREA)
- Manufacturing & Machinery (AREA)
- Metallurgy (AREA)
- Catalysts (AREA)
- Carbon And Carbon Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Hydrogen, Water And Hydrids (AREA)
- Manufacture And Refinement Of Metals (AREA)
Abstract
根据本发明,提供了一种用于从碳氢化合物气体生产氢气和石墨碳的方法,包括:在600℃和1000℃之间的温度下将催化剂与碳氢化合物气体接触,以将至少一部分碳氢化合物气体催化转化为氢气和石墨碳,其中催化剂是低级的氧化铁。还提供了用于富集含催化金属的矿石的方法,该方法包括在600℃和1000℃之间的温度下将含催化金属的矿石与碳氢化合物气体接触以形成碳涂覆的金属物质。
Description
技术领域
本发明涉及一种生产氢气和石墨碳的方法。
背景技术
氢气具有许多商业用途,例如内燃机燃料清洁的和环境友好的替代品。碳,或尤其是石墨,被认为是新兴绿色科技市场的关键材料。其已显示在能量储存、导电设备、催化剂载体、润滑添加剂和现代电子装置中是有用的。本专利中所提及的碳涉及碳的石墨形式,因此这些术语在全文中可互换使用。
然而,从化石燃料生产氢气的常规方法产生对环境有害的二氧化碳(天然气蒸汽重组和煤的气化)。
根据方程式(1),天然气可以催化裂化成氢气和固体碳两种,
CH4→C+2H2 (1)
在这种方法中,碳沉积到催化剂的表面上并产生氢气。目前已有众多已知的催化剂用于该方法,包括贵金属和碳基催化剂。
虽然上述过程是已知的,但是由于许多经济原因,它尚未被商业利用。这主要涉及初始供料中的潜在的催化剂成本,以及回收和再生催化剂的成本。虽然催化剂活性高,产物收率高,但这一领域的大多数研究人员都使用昂贵且复杂的载体催化剂,导致催化剂的流动成本也非常高。这些成本是商业化使用这种催化剂的重大障碍。迫切需要新的和改进的方法以及催化剂用于将碳氢化合物催化转化成稳定且具有商业价值的氢气和固体碳。
背景技术的前述讨论仅旨在便于理解本发明。应该理解,讨论不是确认或承认,所引用的任何材料都是在本申请优先权日之前的在澳大利亚公知常识的一部分。
发明内容
在最广泛的方面,本发明提供了一种用于从碳氢化合物气体中生产氢气和石墨碳的方法。特别地,本发明提供了用于使用低级催化剂将碳氢化合物气体催化转化为氢气和石墨碳的方法。
在整个说明书中,除非上下文另有要求,术语“低级”将被理解为隐含非合成材料。如本领域技术人员将理解的,合成材料通过前体材料的化学反应产生。除了本发明之外的,用于催化剂的标准合成技术是例如将纳米尺寸的催化元素浸渍在惰性载体上。虽然术语“低级”确实包括天然存在的材料,但不应理解为排除经过物理富集的材料,例如破碎和筛选或分类。
在整个说明书中,除非另有说明,所有压力以巴(标准)提供,0巴为大气压。
根据本发明,提供了一种用于从碳氢化合物气体生产氢气和石墨碳的方法,包括:
将催化剂与碳氢化合物气体在600℃和1000℃之间的温度下接触以将至少一部分碳氢化合物气体催化转化为氢气和石墨碳,
其中所述催化剂是低级氧化铁。
优选地,压力大于大气压。
在本发明的一种形式中,步骤为:
将催化剂与碳氢化合物气体在600℃和1000℃之间的温度下接触以将至少一部分碳氢化合物气体催化转化为氢气和石墨碳,
更具体地包括以下步骤:
将至少一部分氧化铁还原成铁;
分解碳氢化合物气体以产生氢气和碳化铁中间体;以及
在铁表面沉积石墨碳。
在本发明的一种形式中,将催化剂与碳氢化合物气体在600℃和1000℃之间的温度下接触的步骤在0巴至100巴的压力下进行。优选地,将催化剂与碳氢化合物气体在600℃和1000℃之间的温度下接触的步骤在0巴至50巴的压力下进行。更优选地,将催化剂与碳氢化合物气体在600℃和1000℃之间的温度下接触的步骤在0巴和20巴之间的压力下进行。更优选地,将催化剂与碳氢化合物气体在600℃和1000℃之间的温度下接触的步骤在2巴和10巴之间的压力下进行。
在本发明的一种形式中,步骤:
将催化剂与碳氢化合物气体在600℃和1000℃之间的温度下接触以将至少一部分碳氢化合物气体催化转化为氢气和石墨碳,
优选在700℃至950℃的温度下进行。
在本发明的第二种形式中,步骤:
将催化剂与碳氢化合物气体在600℃和1000℃之间的温度下接触以将至少一部分碳氢化合物气体催化转化为氢气和石墨碳,
优选在800℃至900℃的温度下进行。
在本发明的第三种形式中,步骤:
将催化剂与碳氢化合物气体接触以将至少一部分碳氢化合物气体催化转化为氢气和石墨碳,
优选在650℃至750℃的温度下进行。
本发明人已经发现,本发明的方法允许使用低级催化剂,同时仍然获得高转化率和产率。
不希望受理论束缚,本发明人认为铁矿石的使用是有利的,因为金属物质催化分解反应,并且矿石的矿物将催化元素暴露于碳氢化合物气体。本申请人认为,石墨层沉积在催化组分表面上的力足以将涂覆的催化剂颗粒与催化剂分离,暴露出其他的催化氧化铁。因此,催化剂是自我支撑的,并且在使用之前不需要大量的预处理。
在本发明的一种形式中,碳氢化合物气体是甲烷。优选地,碳氢化合物气体是天然气。
在本发明的一种形式中,将催化剂研磨至小于20毫米的粒度。优选地,将催化剂研磨至小于15mm的粒度。更优选地,将催化剂研磨至小于10mm的粒度。更优选地,将催化剂研磨至小于5mm的粒度。更优选地,将催化剂研磨至小于1mm的粒度。更优选地,将催化剂研磨至小于0.5mm的粒度。更优选地,将催化剂研磨至小于0.1mm的粒度。
在本发明的一种形式中,将催化剂与碳氢化合物气体在600℃和1000℃之间的温度下接触的步骤在加压反应器内进行。优选地,加压反应器选自静态,动态或流化床反应器。
在本发明的一种形式中,催化剂设置在反应器的基本水平的表面上并经受碳氢化合物气体的横向流动。
在本发明的第二种形式中,催化剂悬浮在流化床反应器中,碳氢化合物气体流过流化床。
在本发明的一种形式中,使催化剂与碳氢化合物气体接触的步骤在串联排列的多个加压反应器中进行。
在本发明的一种形式中,串联的反应器的布置允许气体从第一反应器流动到后续的反应器。优选地,串联中的每个后续反应器在比先前的反应器低的压力下操作,允许气体行进到较低压力的反应器。在串联布置中,任何未反应的碳氢化合物气体经过较低压力的后续反应器以接触额外的催化剂用于进一步加工和将碳氢化合物气体更完全地转化为氢气和石墨碳。
在本发明的替代形式中,串联的反应器布置允许催化剂从第一反应器流动到后续的反应器。优选地,串联中的每个后续的反应器在比先前的反应器高的压力下操作,允许催化剂行进到较高压力的反应器。在低压下,一些催化剂可能保持仅部分失活。在串联布置中,部分失活的催化剂经过更高压力的后续反应器,以与额外的碳氢化合物气体接触,用于进一步加工和生产更高纯度的石墨碳。申请人设想,随后的反应器可以设置在之前的反应器下方,使得催化剂在反应器之间的流动可以通过重力来辅助。申请人称之为级联式布置。
在本发明的一种形式中,串联使用两个加压反应器。
第一反应器压力处于15至25巴之间;
第二反应器压力处于0和1巴之间;
在本发明的替代形式中,串联使用三个加压反应器。如果串联使用三个加压反应器,
第一反应器压力处于15至25巴之间;
第二反应器压力处于5至10巴之间;且
第三反应器压力处于0至1巴之间。
在本发明的替代形式中,串联使用四个加压反应器。如果串联使用四个加压反应器,
第一反应器压力处于20至30巴之间;
第二反应器压力处于5至15巴之间;
第三反应器压力处于4至6巴之间;且
第四反应器压力处于0至1巴之间。
在本发明的替代形式中,串联使用五个加压反应器。如果串联使用五个加压反应器,
第一反应器压力处于25至35巴之间;
第二反应器压力处于10至20巴之间;
第三反应器压力处于5至10巴之间;
第四反应器压力处于4至6巴之间;且
第五反应器压力处于0至1巴之间。
碳氢化合物气体到氢气和石墨碳的转化的效用和经济的驱动力是反应的竞争动力学和热力学驱动力。如前所述,碳氢化合物气体分解,最终导致石墨碳沉淀在催化剂金属颗粒的表面上。沉淀一直持续,直到甲烷不能再渗入包封的石墨而到达催化剂。在动力学上,反应是由增加的反应压力驱动的,因为这更好地使甲烷扩散到包封活性催化剂表面的石墨结构中,得到更大的催化剂利用率。增加的催化剂利用率也导致更高纯度的石墨产品。竞争因素是反应的热力学优先指示在较低压力下进行反应。在更高的压力下,产品的气体体积增加(每摩尔甲烷进料产生2摩尔氢气),这导致对初始试剂而不是产品更有利的平衡位置。该平衡位置限制了可以转化为氢气的甲烷进料的%。这在本领域中被称为随着反应压力增加而减小的热力学平衡极限(TEL)。
通过提供串联的多个反应器,发明人已经发现可以通过改变每个后续的反应器的压力来控制反应的竞争动力学和热力学驱动力。这允许在较高压力下的高催化剂活性,也导致较低压力的反应器中的碳氢化合物气进料的高转化率。使用多个反应器串联的好处是允许使用提高的反应压力来提高使用的每单位催化剂的产物产率(催化剂利用率),同时保持高的甲烷转化效率(TEL)。
在本发明的一种形式中,其中串联使用多个反应器以允许气体在反应器之间流动,向每个反应器提供未反应的催化剂。在这种布置中,每个反应器在与碳氢化合物气体接触之前装载未反应的催化剂。一部分碳氢化合物气体在最高的压力的反应器中转化为氢气和石墨碳。第一反应器具有相关的TEL,导致碳氢化合物气体转化为氢气和碳。所得的碳氢化合物气体/氢气混合物转移到一个或多个连续的低压反应器。较低压力的反应器具有较高的相关TEL,使碳氢化合物气体进一步转化为氢气和碳。当在每个反应器中提供未反应的催化剂时,本申请人将这种布置称为平行气体多压反应器(平行气体MPR)。
在本发明的第二种形式中,其中串联使用多个反应器以允许反应器之间的催化剂流动,向每个反应器提供未反应的碳氢化合物气体。在这种布置中,碳氢化合物气体连续流过反应器。在最低压力的反应器中提供未反应的催化剂,其在甲烷的催化转化之后产生部分失活的催化剂。将部分失活的催化剂转移到串联的较高压力的下一个反应器中,以进一步催化转化甲烷。反应器的较高压力允许催化剂进一步失活。部分失活的催化剂的转移沿着压力增加的多个反应器重复。当在每个反应器中提供未反应的碳氢化合物气体时,本申请人将这种布置称为平行催化剂多压反应器(平行催化剂MPR)。
在本发明的第三种形式中,多个反应器以串联方式布置,其允许碳氢化合物气体和催化剂在相反方向上的反应器之间流动。在这种布置中,在最低压力的反应器中提供未反应的催化剂,并且在最高压力的反应器中提供未反应的碳氢化合物气体。催化剂在压力增加的反应室之间在与反应室之间的气流相反的方向转移。申请人称这种布置为逆流多压反应器(逆流MPR)。部分失活的催化剂在较高压力反应器中保持活性,并且所得石墨产物具有相应较高的纯度值(以质量%计)。
发明人已经发现,逆流MPR装置允许碳氢化合物气体的更完全转化和更高纯度的石墨碳产物。由于平行气体MPR中没有催化剂流动或并联催化剂MPR中没有气体流动,因此其设计比逆流MPR简单得多。
在本发明的一种形式中,该方法被配置为优先产生较高纯度的氢气或石墨碳。如本领域技术人员将理解的,氢气和石墨碳产物总是按照基本反应化学计量学所规定的质量基准按1:3(氢气与石墨碳)的比例不变。尽管如此,可以重点增加其中一种产品的纯度。
在本发明的一种形式中,其中该方法适于优先产生较高纯度的氢气,该方法包括:
在大气压下在800℃和900℃之间的温度下使催化剂与碳氢化合物气体接触,以将至少一部分碳氢化合物气体催化转化为氢气和石墨碳。
优选地,该方法在单个流化床反应器中进行。
如果优选更高纯度的氢气,则重点在于提高甲烷转化效率的条件。对于单级反应器中的较高纯度的氢气,这意味着通常较低的压力和更高的温度,因为其允许热力学方面的最高转化率。较高的转化率以较高的催化剂消耗量和较低纯度的石墨为代价,因为单位催化剂的产率较低。
在本发明的一种形式中,其中该方法适于优先生产较高纯度的石墨碳,该方法包括:
在650℃和950℃之间的温度下在2和100巴之间的压力下使催化剂与碳氢化合物气体接触,以将至少一部分碳氢化合物气体催化转化成氢气和石墨碳。
优选地,该方法在流化床反应器中进行。
如果优选更高纯度的石墨碳,则重点在于提高催化剂利用率的条件。石墨的质量是相对于非碳夹杂物的纯度和结晶度的函数。对于单级反应器中的较高纯度石墨碳,这意味着通常较大的温度范围和较高的压力,因为这允许催化剂的最高利用率。
根据本发明的另一方面,提供了一种用于富集含催化金属矿石的方法,所述方法包括在600℃和1000℃之间的温度下将含催化金属的矿石与碳氢化合物气体接触形成碳涂覆的金属物质。
优选地,压力大于大气压。
在本发明的一种形式中,碳涂覆的金属物质是石墨涂覆的金属物质。
在本发明的一种形式中,步骤:
在600℃和1000℃之间的温度下将含催化金属的矿石与碳氢化合物气体接触以形成碳涂覆的金属物质,
更具体地包括以下步骤:
将至少一部分含催化金属的矿石还原成催化金属物质;
分解碳氢化合物气体以产生氢气和催化金属碳化物中间体;以及
在催化金属表面沉积石墨碳。
不希望受理论束缚,本申请人认为,石墨层在催化组分的表面上的沉积力足以使涂覆的催化剂颗粒与剩余的矿石脉石分离。一旦涂覆的催化剂颗粒已经破裂,矿石内的其他催化组分暴露于碳氢化合物气体。
在本发明的一种形式中,含催化金属的矿石是铁矿石。
如前所述,铁矿石中的金属物质催化分解反应。地壳中大部分的铁是一种称为“条带状含铁构造(BIF)”的形式,其包括由非铁矿物层(通常为SiO2)分隔开的铁层。这种布置的好处是,气体可以一直进入铁层,因为它们永远不会被完全包裹在非铁物质中。此外,铁矿石的铁浓度相对较高。相比之下,其他矿石中的催化元素的浓度太低,且不分层,因此通常被非催化物质包裹,并且工艺气体不能接触它们进行反应。
在本发明的一种形式中,该方法在加压除尘反应器中进行。优选地,将含催化金属的矿石与碳氢化合物气体在加压除尘反应器内接触以产生纳米/微米尺寸的石墨涂覆的金属颗粒。有利的是,较大的(>1毫米)非催化脉石物质保持不变。由于这种尺寸差异,可以采用物理分离技术将石墨涂覆的金属颗粒与脉石分离出来。
在本发明的一种形式中,除尘反应器是流化床反应器。发明人已经发现,使用流化床反应器具有在富集过程中同时将纳米/微米尺寸的石墨涂覆的金属颗粒与更大的脉石物质分离的优点。较小尺寸的石墨涂覆的金属颗粒被夹带在工艺气流中并通过该气流从反应器中除去,而较大的脉石颗粒保留在反应器内。在本发明的一种形式中,通过允许颗粒沉降的气-固分离器从气流中除去较小的石墨涂覆的金属物质。可以通过定期排放,通过重力连续地从除尘反应器中移除脉石。
在本发明的一种形式中,步骤:
在600℃和1000℃之间的温度下将含催化金属的矿石与碳氢化合物气体接触以形成碳涂覆的金属物质,
优选在700℃至950℃的温度下进行。
在本发明的一种形式中,步骤:
在600℃和1000℃之间的温度下将含催化金属的矿石与碳氢化合物气体接触以形成碳涂覆的金属物质,
优选在800℃至900℃的温度下进行。
在本发明的一种形式中,步骤:
在600℃和1000℃之间的温度下将含催化金属的矿石与碳氢化合物气体接触以形成碳涂覆的金属物质,
优选在650℃至750℃的温度下进行。
在本发明的一种形式中,步骤:
在600℃和1000℃之间的温度下将含催化金属的矿石与碳氢化合物气体接触以形成碳涂覆的金属物质,
在0巴至100巴的压力下进行。
在本发明的一种形式中,步骤:
在600℃和1000℃之间的温度下将含催化金属的矿石与碳氢化合物气体接触以形成碳涂覆的金属物质,
在0巴至50巴的压力下进行。
在本发明的一种形式中,步骤:
在600℃和1000℃之间的温度下将含催化金属的矿石与碳氢化合物气体接触以形成碳涂覆的金属物质,
在0巴至20巴的压力下进行。
在本发明的一种形式中,步骤:
在600℃和1000℃之间的温度下将含催化金属的矿石与碳氢化合物气体接触以形成碳涂覆的金属物质,
在0巴至10巴的压力下进行。
在本发明的一种形式中,通过在700℃至900℃的温度下将石墨涂覆的金属物质与氢气接触,从石墨涂覆的金属物质中除去石墨。优选地,在700℃至900℃的温度下将石墨涂覆的金属物质与氢气接触的步骤在加压还原反应器中进行。
在本发明的一种形式中,从石墨涂覆的金属物质中除去石墨在加压还原反应器中在0巴至100巴的压力下进行。本发明人认为,更高的压力有利于石墨的去除。在本发明的优选形式中,从石墨涂覆的金属物质中除去石墨在加压还原反应器中在10巴至20巴的压力下进行。
在700℃至900℃的温度下将石墨涂覆的金属物质与氢气接触的步骤产生甲烷。在本发明的一种形式中,甲烷被再循环以产生氢气。更具体地说,回收甲烷的步骤包括,
在600℃和1000℃之间的温度下将低级铁矿石催化剂与甲烷接触以将至少一部分甲烷催化转化为氢气和石墨碳。
在本发明的一种形式中,在回收甲烷的步骤中产生的氢气用于在700℃至900℃的温度下将石墨涂覆的金属物质与氢气接触以从石墨涂覆的金属物质中除去石墨的步骤。
当富集铁矿石时,在还原反应中去除石墨得到以高纯度的形式的金属物质,通常为铁金属形式。
附图说明
在下面对几个非限制性实施例的描述中更全面地描述本发明的其它特征。该描述仅仅是为了举例说明本发明的目的。不应被理解为对上述发明的概括、公开或描述的限制。将参照附图进行描述,其中:
图1示出了根据本发明的逆流MPR的用于生产氢气和石墨的方法的示意图;
图2示出了根据本发明的平行气体MPR的用于生产氢气和石墨的方法的示意图;
图3示出了根据本发明的平行催化剂MPR的用于生产氢气和石墨的方法的示意图;
图4是根据第一个实施方式的用于含催化金属矿石富集的方法的示意图;
图5是分析级氧化铁和铁矿石催化剂样品的XRD图的图示;
图6是氧化铁催化剂反应后的的碳纯度(wt%)和碳产量(每克铁的碳克数-GC/GFe)的图示;
图7是三级级联逆流系统的示意图;
图8示出了用于测试使用静态固定床反应器的具有3个反应器串联的MPR系统的甲烷转化的实验条件的示意图;
图9是对于不同反应压力的赤铁矿催化剂的甲烷转化结果的图示;
图10是对于不同反应压力的赤铁矿催化剂的碳纯度(wt%)和碳产率(每克铁的碳克数-GC/GFe)的图示;
图11示意性地示出了逆流MPR系统的质量平衡计算的变量的示意图;
图12是逆流MPR和平行MPR的质量平衡计算结果的图示,示出了氢气产生速率为2000m3/h的平衡系统所需的催化剂质量流量。
具体实施方式
本领域技术人员将理解的是,除了具体描述的之外,本文描述的本发明易于变化和修改。本发明包括所有这些变化和修改。本发明还包括在说明书中单独地或整体地引用或指出的所有步骤、特征、制剂和化合物以及任何两个或多个步骤或特征的任何和所有组合。
本文中引用的每个文件、参考文献、专利申请或专利明确地通过引用其全部内容并入本文,这意味着读者阅读并将其认为是本文的一部分。本文中引用的文件、参考文献、专利申请或专利在本文中不再重复,仅仅是为了简明扼要。所引用的材料或材料中包含的信息不应被理解为公知常识。
通过引用并入本文的本文或本文中引用的任何文献中的任何产品的制造商的说明书、描述、产品规格和产品清单在此引入作为参考,并且可以用于本发明的实践中。
本发明不限于本文所述的任何具体实施方式的范围。这些实施方式仅用于示例的目的。功能上相同的产品、制剂和方法显然在本文所述的本发明的范围内。
本文描述的本发明可以包括一个或多个值的范围(例如,尺寸、浓度等)。一系列值将被理解为包括范围内的所有值,包括限定范围的值,以及与导致与限定该范围的边界的值紧邻的值相同或基本相同的结果的范围相邻的值。
在整个说明书中,除非上下文另有要求,单词“包括(comprise)”或如“包括(comprises)”或“包括(comprising)”的变体将被理解为隐含包含所述整数或整数组,但不排除任何其他整数或整数组。
本文使用的所选术语的其它定义可以在本发明的发明内容内找到并且在全文中适用。除非另有定义,本文使用的所有其它科学和技术术语具有与本发明所属领域的技术人员通常理解的相同的含义。
现在将参考以下非限制性描述和实施例来讨论本发明的特征。
在一般形式中,本发明涉及用于从碳氢化合物气体生产氢气和石墨碳的方法。特别地,本发明提供了一种使用低级含氧化铁的催化剂将碳氢化合物气体催化转化为氢气和石墨碳的方法。
碳氢化合物气体可以是包含轻质碳氢化合物的任何气流。碳氢化合物气体的说明性实施例包括但不限于天然气、煤层气、填埋气和沼气。碳氢化合物气体的组成可以显著变化,但它通常将包含一种或多种来自包含甲烷、乙烷、乙烯、丙烷和丁烷的轻质碳氢化合物。
在本发明的优选实施方式中,碳氢化合物气体是天然气。
从天然气生产氢气和石墨碳的方法包括:
在600℃和1000℃之间的温度下将催化剂与碳氢化合物气体接触,以将至少一部分碳氢化合物气体催化转化为氢气和石墨碳,其中催化剂是低级氧化铁。
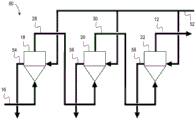
参考图1,描述了使用三个流化床反应器从碳氢化合物气体如天然气16产生氢气12和石墨碳14的逆流MPR工艺10。
在图1所示的实施方式中,该方法利用在不同压力下操作的三个反应器,18巴的高压反应器18,6巴的中压反应器20和1巴的低压反应器22。反应器的温度分别为850℃。反应器18、20和22串联布置,使得氢气和未反应的碳氢化合物天然气在相邻反应器之间转移,即从高压反应器18到中压反应器20以及从中压力反应器20到低压反应器22。
每个反应器22、20和18分别装载有低级的氧化铁催化剂,例如铁矿石24”,24'和24。其中24是新鲜的未反应的催化剂,而24',24”逐渐被更多地利用,具有更多的石墨碳附着和较少的整体催化活性残留。气流14仅含有痕量的完全消耗的催化剂,气流中绝大多数为石墨碳(在反应温度为850℃下为>90wt%)。
该反应所需的催化剂的量与所需的氢气的量、工艺条件和催化剂的类型有关。在3个反应器的条件下运行的2000m3/h氢气生产设备将需要大约14kg/h的铁。
天然气16被引导通过串联的反应器,从高压反应器18到中压反应器20和低压反应器22。每个反应器将天然气的一部分转化为氢气,每个连续的气流28、30、12包含较大比例的氢气。新鲜天然气16最初在850℃的温度和18巴的压力下与高压反应器18中的催化剂24”接触以将一部分天然气转化成氢气,因此相应的气流28是包含氢气和未反应的天然气的混合物。反应器还将一些石墨碳沉积到催化剂24”上,对气流14中的总石墨碳有贡献。
将气流28转移到中压反应器20中,在中压反应器20中,其在850℃的温度和6巴的压力下与催化剂24'接触,以将天然气转化成氢气和碳。中压反应器20的较低压力使气流28能够转化,从而对总氢气流12有贡献。该方法将石墨碳沉积到催化剂24'上,并因此对总的石墨碳流14有贡献。气流28中的一部分天然气保持未反应,并与产生的氢气混合以形成气流30。
将气流30转移到低压反应器22中,在低压反应器22中,其在850℃的温度和1巴(大气压)的压力下接触催化剂24。低压反应器22的较低压力使得反应的热力学平衡有利于反应的分解方向,从而允许第二气流30更多地转化成碳和氢气。该方法将石墨碳沉积在催化剂24上,并因此对总的石墨碳流14有贡献。该反应器还对总氢气气流12中的氢气有贡献,它们离开反应器以便使用或进一步处理。
理论经验计算要求反应器18、20、22分别具有54%、75%和94%的转化效率,并且相应地,气流28、30和12分别具有70wt%、86wt%和97wt%的氢气浓度。
氧化铁气流24、24'、24”和14中的石墨碳的比例分别为0%、91%、95%、98%。
在图1所示的实施方式中,当天然气16在高温下接触催化剂24以产生氢气12和碳14时,消耗催化剂24以形成部分失活的催化剂24'。部分失活的催化剂24'在反应器之间在天然气16气流逆流的方向转移。催化剂24被引入最低压力的反应器22中,随后被传递到较高压力的反应器中。因此,部分失活的催化剂24'将在高压反应器20中保持活性,并且所得石墨碳14具有相应较高的碳纯度值(质量百分比)。
在图2中,示出了平行气体MPR工艺50。平行气体MPR工艺50与逆流MPR工艺10具有共同特征,相似的数字表示相同的部分。
在图2所示的实施方案中,该方法利用在不同压力下操作的三个反应器,18巴的高压反应器18,6巴的中压反应器20和1巴的低压反应器22。反应器的温度分别为850℃。反应器18、20和22串联布置,使得未反应的碳氢化合物天然气可以在相邻反应器之间转移,即从高压反应器18到中压反应器20以及从中压力反应器20到低压反应器22。
每个反应器18、20和22分别装载有铁矿石催化剂52。与上面所示的逆流MPR工艺10相反,每个反应器22、20和18在与碳氢化合物气体接触之前都提供有未反应的催化剂52。
该反应所需的催化剂的量与所需的氢气的量、工艺条件和催化剂的类型有关。在3个反应器的条件下运行的2000m3/h氢气生产设备将需要大约27kg/h的铁。
天然气16被引导通过串联的反应器,从高压反应器18到中压反应器20和低压反应器22。每个反应器将天然气的一部分转化为氢气,每个连续的气流28、30、12包含较大比例的氢气。未反应的天然气16最初在850℃的温度和18巴的压力下与高压反应器18中的催化剂34接触以将一部分天然气转化成氢气,产生的气流28是氢气和未反应的天然气的混合物。石墨碳也沉积到催化剂34上,产生部分石墨气流54。
将气流28转移到中压反应器20中,在中压反应器20中,其在850℃的温度和6巴的压力下与催化剂52接触,以将天然气转化成氢气和碳。中压反应器20的较低压力使气流28能够进一步转化,从而对总氢气流12有贡献。该方法将碳沉积到催化剂52上,产生部分石墨流56。气流28中的一部分天然气保持未反应,并与产生的氢气混合以形成气流30。
将气流30转移到低压反应器22中,在低压反应器22中,其在850℃的温度和1巴(大气压)的压力下接触催化剂52。低压反应器22的较低压力使得反应的热力学平衡有利于反应的分解方向,从而允许第二气流30中的天然气转化成碳和氢气。该方法将碳沉积在催化剂52上,产生部分石墨流58。该反应器还对总氢气气流12中的氢气有贡献,它们离开反应器以便使用或进一步处理。
部分石墨流54、56和58包含未反应的铁矿石和石墨材料的混合物。给定每个反应器22、20和18的变化的压力,每个部分石墨流将具有不同的转化率。部分石墨流58将具有最高的铁杂质度,随后是部分石墨流56,然后是部分石墨流54。
从经验来看,反应器18、20、22分别具有54%、75%和94%的转化效率,并且相应地,气流28、30和12分别具有70wt%、86wt%和97wt%的氢气浓度。
在图3中,示出了平行催化剂MPR工艺60。平行MPR工艺60与逆流MPR工艺10具有共同特征,并且相似的数字表示相同的部分。
在图3所示的实施方式中,该方法利用在不同压力下操作的三个反应器,18巴的高压反应器18,6巴的中压反应器20和1巴的低压反应器22。反应器的温度分别为850℃。
每个反应器18、20和22分别装载有低级的含氧化铁的催化剂,例如铁矿石24”,24'和24。其中24是未反应的催化剂,而24',24”逐渐被更多地利用,具有更多的石墨碳附着和较少的整体催化活性残留。气流14仅含有痕量的完全消耗的催化剂,气流中绝大多数为石墨(在反应温度为850℃下为>90wt%)。
反应器18、20和22串联布置,使得催化剂24”,24'和24在相邻反应器之间转移,即从低压反应器22到中压反应器20以及从中压力反应器20到高压反应器18。
与上述所示的逆流MPR工艺10相反,未反应的天然气16提供给每个反应器22、20和18。
在图3所示的实施例中,当天然气16在高温下接触催化剂24以产生氢气12和碳14时,消耗催化剂24以形成部分失活的催化剂24'。部分失活的催化剂24',24”在反应器之间转移,将催化剂24引入最低压力的反应器22中,随后通过高压反应器20、18。因此,部分失活的催化剂24'将在高压反应器20中保持活性,并且所得碳14具有相应较高的碳纯度值(质量百分比)。
在850℃的温度和18巴的压力下在低压反应器22中天然气16与催化剂24接触以将一部分天然气16转化为氢气,以产生包含氢气和未反应的天然气的混合物的气流68。将石墨碳沉积在催化剂24上,以产生催化剂24',以对气流14中总碳有贡献。
在850℃的温度和18巴的压力下在中压反应器20中天然气16与催化剂24'接触以将一部分天然气16转化为氢气,以产生包含氢气和未反应的天然气的混合物的气流64。将石墨碳沉积在催化剂24'上,以产生催化剂24”,以对气流14中总碳有贡献。
在850℃的温度和18巴的压力下在高压反应器18中天然气16与催化剂24”接触以将一部分天然气16转化为氢气,以产生包含氢气和未反应的天然气的混合物的气流62。将石墨碳沉积在催化剂24”上,以产生催化石墨碳14。
参考图4,描述了用于富集含有催化金属的矿石如铁矿石102的方法100。
低级铁矿石102通过缓冲仓104并进入除尘反应器106。在除尘反应器106中,铁矿石102在850℃和10至20巴之间的压力下与碳氢化合物气体108接触以产生石墨涂覆的铁流110和包括较大(>1mm)脉石颗粒的废物流112。石墨涂覆的铁流110和废物流112之间的尺寸差异使两者分离。将石墨涂覆的铁流110通过气体/固体分离器114以将气流116与通过还原反应器120的固体流118分离。
在还原反应器120中,固体流118的石墨涂覆的铁颗粒在800℃至900℃的温度和10至20巴的压力下与氢气122接触,以除去碳涂覆,留下铁的浓缩流124。反应也形成甲烷气流126,其被再循环到该方法的其它部分。在图2所示的实施例中,甲烷气流126在800℃和900℃之间的温度下接触额外的铁矿石102,额外的铁矿石102通过氢气反应器127中的缓冲仓130,以产生氢气122和石墨粉末128。如图4所示,氢气122被转移回到还原反应器120中。
实施例
实施例1
使用铁矿石作为催化剂,通过甲烷的热催化分解经济地生产氢气和石墨。
实验细节
本发明提供一种能够使用低级氧化铁作为甲烷分解催化剂的方法。为了证明本发明的低级氧化铁催化剂的催化活性,将低级氧化铁样品与高级氧化铁样品进行比较。测试了两种类型的高级氧化铁:赤铁矿(99%,<5μm,西格玛-奥德里奇(Sigma-Aldrich))和磁铁矿(95%,<5μm,西格玛-奥德里奇);还有两个铁矿石样品:赤铁矿(皮尔巴拉(Pilbara)矿)和针铁矿(严迪(Yandi)矿)。将矿石样品研磨至<150μm,或未经处理。按原样的所有样品的组成数据,粒径分布和表面积如表1所示。
表1-氧化铁样品的组成、粒径和表面积数据。
将每个样品置于隔离的单级反应器中。反应器为垂直1/2"直径的不锈钢管(SS316世伟洛克公司),具有3/8"石英管内衬。石英管内衬通过限制与反应的甲烷气体接触减少不锈钢反应器壁的催化效应。将20g催化剂样品包含在“石英”室的3/8"试管内。
高级氧化铁催化剂样品,即分析级(赤铁矿和磁铁矿)和低级氧化铁催化剂样品(赤铁矿石和针铁矿石)的XRD图如图5所示。
每个样品在750-950℃的温度范围内反应,使用10sccm纯甲烷(UHP),反应压力在1-9巴(绝对值)之间。完全失活(约19小时)后,终止反应,样品用20sccm纯氮(UHP)冷却。称量所得的碳(和嵌入的催化剂颗粒),以确定使用的每克铁催化剂的总碳产量。
图6示出了在850℃和大气压力的反应条件下的这些实验的结果。结果表明,低级铁矿石样品与高级氧化物的表现几乎一样,碳产量为每克铁9.2至8.9克碳,碳纯度分别为90wt%至89wt%。这些值显示出与定量XRD得到的值密切相关,差异小于2wt%(在图6中表示为中空形状)。
如本领域技术人员将理解的,增加催化剂活性的常用方法是使其纯度非常高以增加反应面积。氧化铁催化剂,例如测试的高级氧化铁样品,必须是特别合成的纯度>99%的氧化铁。该实验的结果表明,本发明的具体工艺条件允许使用低级催化剂,而且仍然获得高转化率和产率。
实施例2
使用逆流MPR进行热催化甲烷分解。
逆流。
如图7的示意图所示,以级联布置建立三反应器逆流MPR。
使用静态(非连续)系统进行逆流MPR系统的实验评估。这是通过测试压力对甲烷转化效率和碳产量的影响来完成的。结果证实,压力的增加降低了甲烷转化率,提高了碳产量,反过来,较低的压力增加甲烷转化率也降低了总碳产量。
实验细节
反应压力对甲烷转化限的影响。
反应器设置包括具有不同设定的背压(12巴,4巴和大气压)和850度等温温度的三个独立的反应器阶段(3×1/2"OD 316SS世伟洛克公司,700mm长度)。替代将反应器串联连接,每个反应器分别独立进料和分析,以评估其各自的表现。将每个反应器的进料气体组成设置为模拟其串联操作,其中每个反应器在其理论上在反应压力下以最大可能的转化率操作(表2)。通过使用气相色谱监测来自每个反应器的流出物来确定每个阶段的表现。该过程的示意图示于图8中。使用过量的氧化铁来模拟该静态系统内的连续催化剂流动条件,以允许暂时观察到预期的稳态连续操作。
表2-MPR实验的工艺条件
从该实验获得的结果如图9所示,并且与理论期望有良好相关性并验证了该理论。所有的三个反应器阶段与期望的热力学平衡极限(如虚线所示)在超过20小时的期间内良好相关,之后反应终止。清楚的是,当使用MPR系统时,高的氢浓度不影响反应达到在热力学平衡极限下的转化的能力。
这些结果表明连续MPR系统可以在热力学平衡极限下维持稳定的转化,而不管氢的水平如何。
压力对产品产率的影响。
反应压力的影响使用20mg的催化剂以1巴的压力间隔进行测试,所有其它反应条件与前述实验相同(即850℃,20sccm甲烷,自动还原,19小时持续时间)。
结果表明反应压力和总碳产量之间存在正的线性关系。如图10所示,曲线图显示,在大气压力至9巴绝对压力范围内,每克铁的碳产量从9克增加至22克,相应碳纯度约为90-96%。
经验上催化剂流速计算
MPR系统的总体可行性取决于质量流量的平衡。这对于逆流MPR是特别重要的,因为催化剂质量流量与(1)反应器压力级数,(2)压力范围和(3)催化剂碳容量曲线的严格相互依赖性。进行经验的质量平衡计算,以确定实现平衡的可行性。
可以通过将碳沉积速率除以每个反应器的催化剂利用率来确定每个反应器内的催化剂流速;它们均受反应器压力范围的限制。
平行MPR
平行流MPR具有设计简单和确定级数和压力极限的限制更少的优点。
逆流MPR
逆流MPR布置的最大的限制是平衡所有反应器阶段之间的催化剂质量流,以便能够连续操作。每个阶段所需的催化剂流速取决于(1)反应器阶段数和(2)与压力相关的催化剂碳容量分布。这一平衡如图11所示。
该计算的目的是确定对于给定的催化剂碳容量分布和反应温度(假设等温条件)平衡所有阶段之间的催化剂流速的压力阶段的数量。
如果设定催化剂质量流速为使其在离开每个反应器阶段时完全失活,则每个阶段的催化剂利用率是反应器压力下的总催化剂利用率与相邻的较低压力反应器之间的差异。因此:
ΔCRn=Cn-Cn-1
其中“n”是反应器数量(n=1是最低压力反应器)。
通过每个反应器阶段的催化剂质量流量变为:
其中P、R和T分别为标准状况下的压力、气体常数和温度,
对于仅具有一个反应器(n=1)的反应器系统,不存在反应器(n-1)和(n+1)反应器阶段;因此可以简化为:
类似地,对于二级反应器,不存在反应器(n-1)和(n+2)反应器,并且对于三级反应器(n-1)和(n+3)反应器不存在。
催化剂质量流量平衡
为了使多级工艺连续,催化剂流速必须相等:
因此,对于二级反应器:
对于等温条件,可以简化为:
如果反应器“R1”在大气压力下运行并在TEL下运行,则ξR1是已知的,并且ξR2可以使用上述等式求解。该解决方案将解得反应器2所需的压力等于催化剂流速。
这可以类似地对较大数量的反应器进行:
三级反应器:
四级反应器:
然后可以将上述外推到其他的反应器阶段。
结果
使用压力高于9巴(abs)的线性外推值的经验结果如图12所示。这些结果表明,在所有情况下,逆流MPR将消耗比平行流少很多的催化剂。具有5个反应阶段的逆流工艺仅需要单级反应器所需的催化剂的19%,而相同级数的平行流则需要42%。然而,逆流工艺仅能够具有最多5个反应器级数,以使催化剂质量流量在所有阶段都是恒定的。相反,平行工艺阶段的数量是无限的;然而,可以看出,每个阶段的收率递减,总体上比逆流需要更多的催化剂。催化剂质量流量是基于假定的氢气输出流量为2000m3/h计算的。
实施例3
铁矿石的富集
实验细节
典型的低级铁矿石岩石由高级氧化铁和低级对应物的不同部分组成。这种类型的岩石被称为条带状含铁构造(BIF),制备6.69g BIF铁矿石样品,特性分析如表3所示。
表3-样品分析
将样品装入静态反应器床中,并在900℃和大气压力下与甲烷气体接触4小时。反应后,高级的氧化铁带已经破碎,而低级对应物在很大程度上不受影响。
不希望受理论束缚,本发明人认为,发生的第一个反应是将聚集氧化铁物质矿石还原成碳化铁,发射水蒸气,H2,CO2和痕量CO。持续的反应引起聚集碳化铁通过金属除尘(如前所述)和在不存在氧化物的体系中仅排出H2气体破碎。由于包封的石墨层,这种除尘导致铁物质分解成微米和纳米碎片。铁矿石的脉石(通常是高度稳定的含有SiO2和Al2O3的矿物质)不受这些工艺条件的影响,并保持完整和不变。因此,该工艺的产物具有更大的脉石聚集和石墨包裹的三价铁/碳化铁的微小颗粒。然后可以通过物理筛选利用铁物质和脉石之间的尺寸和密度差异来分离两者。
反应后的样品的组成数据和按尺寸的物理分离示于表4中。
表4-样品分析
分析表明,分离尺寸能够分离大部分铁物质,样品A对应于大部分铁。通过XRF分析确定组成数据,其需要预先将样品氧化,因此显示出所有铁物质为氧化物而不是铁素体。煅烧前的能量色散X射线光谱分析表明,铁物质为铁素体。从经验上来说,从铁组合物中除去这种氧化物,我们能够计算出该方法能够从原始总岩石组成约35wt%中提取约85wt%的铁。
可以设想,可以通过称为甲烷化的方法将石墨碳从石墨包裹的三价铁/碳化铁中除去。在该反应中,铁/碳颗粒在升高的温度下与氢气接触,通过以下反应2形成甲烷气体。
C+2H2→CH4 (2)
由于铁颗粒非常小并且该反应是放热的,所以铁颗粒聚集形成较大的纯铁颗粒。
可以设想,可以通过在800℃和20巴下将石墨包裹的三价铁/碳化铁与氢气接触,将石墨碳从石墨包裹的三价铁/碳化铁中除去。
本发明的富集方法与传统铁矿富集方法相比的优点在于,除了除去脉石之外,生成的氧化铁物质是还原的(除去氧留下三价铁)。这种还原铁是90-95wt%的铁,而高级的铁矿石通常是55-63wt%(理论最大值70%)。与铁矿石相比,还原铁是一种优质产品,因此价格更高。此外,由于不运输压载氧,还原铁产品潜在地具有较低的运输成本-节省30-40wt%和约50%的体积。工业中用于铁矿石的传统富集工艺包括碾磨、磁选、浮选、重力浓缩、增厚/过滤和集聚。
本领域技术人员将理解的是,除了具体描述的之外,本文描述的本发明易于变化和修改。本发明包括所有这些变化和修改。本发明还包括本说明书中提及或指出的所有步骤、特征、制剂和化合物,单独地或整体地以及任何和所有。
Claims (22)
1.一种用于从碳氢化合物气体生产氢气和石墨碳的方法,所述方法包括:
在600℃和1000℃之间的温度下将催化剂与气体接触以将至少一部分气体催化转化为氢气和石墨碳,
其中所述催化剂是天然存在的氧化铁;并且
其中所述碳氢化合物气体是甲烷、乙烷、乙烯、丙烷和/或丁烷。
2.根据权利要求1所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中所述方法在大于大气压的压力下进行。
3.根据权利要求1所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中所述方法在0巴至100巴的压力下进行。
4.根据前述权利要求中任一项所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中所述温度在700℃和950℃之间。
5.根据权利要求1所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中所述温度在800℃至900℃之间。
6.根据权利要求1至3中任一项所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中所述温度在650℃至750℃之间。
7.根据权利要求中1所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中所述碳氢化合物气体是甲烷。
8.根据权利要求1所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中使催化剂与所述气体接触的步骤在串联布置的多个加压反应器中进行。
9.根据权利要求8所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中所述反应器串联的布置允许气体从第一反应器流动到后续的反应器,并且串联中的每个后续的反应器在比之前的反应器在更低压力下运行,允许气体行进到较低压力的反应器。
10.根据权利要求9所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中每个反应器都提供有未反应的催化剂。
11.根据权利要求8所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中所述反应器串联的布置允许催化剂从第一反应器流动到后续的反应器,并且串联中的每个后续反应器在比之前的反应器更高的压力下运行,允许催化剂行进到较高压力的反应器。
12.根据权利要求11所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中向每个反应器提供未反应的气体。
13.根据权利要求8所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中所述反应器的串联布置允许气体和催化剂在反应器之间沿相反方向流动。
14.根据权利要求13所述的用于从碳氢化合物气体生产氢气和石墨碳的方法,其中在最低压力反应器中提供未反应的催化剂,并且在最高压力的反应器中提供未反应的气体,并且催化剂在压力增加的反应器之间以与在反应器之间流动的气体相反的方向转移。
15.一种富集含催化金属的矿石的方法,所述矿石包括催化金属和非催化脉石物质,该方法包括:在600℃和1000℃之间的温度下将含催化金属的矿石与气体接触以形成石墨涂覆的金属颗粒和未改变的非催化脉石物质,其中所述气体为碳氢化合物气体,并且所述碳氢化合物气体是甲烷、乙烷、乙烯、丙烷和/或丁烷;
将石墨涂覆的金属颗粒与未改变的非催化脉石物质分离;以及
通过在700℃至900℃的温度下将所述石墨涂覆的金属颗粒与氢气接触,以从所述石墨涂覆的金属颗粒中除去石墨从而得到催化金属。
16.根据权利要求15所述的方法,其中所述含催化金属的矿石是铁矿石。
17.根据权利要求15或16所述的方法,其中所述接触是在大于大气压的压力下进行的。
18.根据权利要求15或16所述的方法,其中所述接触是在0巴至100巴的压力下进行的。
19.根据权利要求15所述的方法,其中所述方法包括在700℃至950℃之间的温度下将含催化金属的矿石与气体接触以形成石墨涂覆的金属颗粒和未改变的非催化脉石物质。
20.根据权利要求15所述的方法,其中所述从石墨涂覆的金属颗粒中除去石墨在加压还原反应器中在0巴至100巴的压力下进行。
21.根据权利要求15所述的方法,其中在700℃至900℃的温度下将石墨涂覆的金属颗粒与氢气接触的步骤产生甲烷,所述甲烷是循环的以便产生氢气。
22.根据权利要求21所述的方法,其中在所述甲烷循环步骤中产生的氢气用于在700℃至900℃的温度下将石墨涂覆的金属颗粒与氢气接触以从石墨涂覆的金属颗粒中除去石墨。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AU2015901175 | 2015-03-31 | ||
| AU2015901175A AU2015901175A0 (en) | 2015-03-31 | Thermocatalytic methane decomposition | |
| PCT/AU2016/000115 WO2016154666A1 (en) | 2015-03-31 | 2016-03-31 | A process for producing hydrogen and graphitic carbon from hydrocarbons |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN108064214A CN108064214A (zh) | 2018-05-22 |
| CN108064214B true CN108064214B (zh) | 2021-08-06 |
Family
ID=57003724
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201680019418.4A Active CN108064214B (zh) | 2015-03-31 | 2016-03-31 | 用于从碳氢化合物生产氢气和石墨碳的方法 |
Country Status (18)
| Country | Link |
|---|---|
| US (2) | US11505458B2 (zh) |
| EP (1) | EP3277623A4 (zh) |
| JP (3) | JP7007256B2 (zh) |
| KR (2) | KR20230106169A (zh) |
| CN (1) | CN108064214B (zh) |
| AU (4) | AU2016240393B2 (zh) |
| BR (1) | BR112017021057B1 (zh) |
| CA (1) | CA2980471A1 (zh) |
| CL (1) | CL2017002468A1 (zh) |
| EA (1) | EA035857B1 (zh) |
| MX (1) | MX2017012559A (zh) |
| MY (1) | MY188748A (zh) |
| NZ (1) | NZ735781A (zh) |
| PH (1) | PH12017501770A1 (zh) |
| SA (1) | SA517390046B1 (zh) |
| SG (1) | SG11201707907SA (zh) |
| WO (1) | WO2016154666A1 (zh) |
| ZA (1) | ZA201706455B (zh) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN108064214B (zh) | 2015-03-31 | 2021-08-06 | 哈泽尔集团公司 | 用于从碳氢化合物生产氢气和石墨碳的方法 |
| KR102595258B1 (ko) | 2015-08-26 | 2023-10-27 | 헤이저 그룹 리미티드 | 흑연의 모폴로지(morphology)를 조절하는 방법 |
| WO2018170543A1 (en) * | 2017-03-20 | 2018-09-27 | Hazer Group Limited | System for the production of hydrogen and graphitic carbon |
| US20210114003A1 (en) | 2017-04-14 | 2021-04-22 | King Abdullah University Of Science And Technology | Treated iron ore catalysts for production of hydrogen and graphene |
| DE102018132661B4 (de) * | 2018-12-18 | 2020-10-01 | Thyssenkrupp Ag | Verfahren zur Kohlenwasserstoffpyrolyse mit räumlich getrennter Beheizungs- und Reaktionszone innerhalb des Reaktorraums |
| AT522315B1 (de) | 2019-03-28 | 2020-10-15 | Primetals Technologies Austria GmbH | Verfahren zur Herstellung von Wasserstoff und Kohlenstoff aus einem kohlenwasserstoffhaltigen Gas |
| US20210047180A1 (en) * | 2019-08-14 | 2021-02-18 | General Electric Company | Production system and method for generating hydrogen gas and carbon products |
| JP7413704B2 (ja) | 2019-10-08 | 2024-01-16 | 戸田工業株式会社 | 炭化水素の熱分解用触媒並びにそれを用いたカーボンナノチューブ及び水素製造方法 |
| US11685651B2 (en) | 2019-10-25 | 2023-06-27 | Mark Kevin Robertson | Catalytic decomposition of hydrocarbons for the production of hydrogen and carbon |
| CN110721691B (zh) * | 2019-11-12 | 2020-07-24 | 中南大学 | 一种cfan催化剂及其制备和在甲烷制氢中的应用 |
| US11401163B2 (en) | 2020-10-19 | 2022-08-02 | Xenophon Verykios | Catalytic materials for pyrolysis of methane and production of hydrogen and solid carbon with substantially zero atmospheric carbon emissions |
| KR102482738B1 (ko) * | 2020-11-23 | 2022-12-28 | 노용규 | 탄화수소 열분해 수소 생산 장치 및 이의 운용 방법 |
| KR102471954B1 (ko) * | 2020-11-23 | 2022-11-29 | 노용규 | 촉매 활성 저하를 해결한 탄화수소 열분해 수소 생산 장치 및 수소 생산 방법 |
| WO2022150639A1 (en) * | 2021-01-07 | 2022-07-14 | The Johns Hopkins University | Production of hydrogen from hydrocarbons |
| JP2023128516A (ja) * | 2022-03-03 | 2023-09-14 | 三菱重工業株式会社 | 触媒の製造方法及びこの触媒を使用した炭化水素の直接分解方法 |
| JP7482164B2 (ja) | 2022-03-11 | 2024-05-13 | 三菱重工業株式会社 | 炭化水素の直接分解方法 |
| US20240124301A1 (en) * | 2022-10-07 | 2024-04-18 | Sk Innovation Co., Ltd. | Process for producing hydrogen, carbon monoxide, and carbon from methane-containing feedstock |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2810657C2 (de) * | 1978-03-11 | 1980-01-24 | Hamburger Stahlwerke Gmbh, 2103 Hamburg | Verfahren zur Direktreduktion von Eisenerzen |
| US6048382A (en) | 1997-08-04 | 2000-04-11 | Bechtel Corporation | Method for direct reduction and upgrading of fine-grained refractory and earthy iron ores and slags |
| JP4758130B2 (ja) * | 2005-04-12 | 2011-08-24 | 国立大学法人北見工業大学 | ナノ炭素の製造方法およびナノ炭素製造用触媒反応装置 |
| JP4779446B2 (ja) | 2005-05-27 | 2011-09-28 | トヨタ自動車株式会社 | 触媒再生方法、水素生成装置および燃料電池システム |
| KR100743189B1 (ko) * | 2005-12-26 | 2007-07-27 | 주식회사 포스코 | 용철 제조 장치 및 제조 방법 |
| WO2008054541A2 (en) | 2006-05-19 | 2008-05-08 | Massachusetts Institute Of Technology | Nanostructure-reinforced composite articles and methods |
| KR100888247B1 (ko) * | 2007-08-02 | 2009-03-10 | 성균관대학교산학협력단 | 탄화수소의 카본 촉매분해에 의한 이산화탄소 배출없이 수소를 연속적으로 생산할 수 있는 유동층 반응기 및 이를 포함하는 반응 장치 |
| US20120258374A1 (en) * | 2009-09-10 | 2012-10-11 | The University Western Australia | Process for Producing Hydrogen from Hydrocarbons |
| JP2012158790A (ja) * | 2011-01-31 | 2012-08-23 | Nippon Steel Corp | マイクロ波を利用した製鉄原料の還元方法 |
| JP2013249496A (ja) * | 2012-05-30 | 2013-12-12 | Kobe Steel Ltd | 還元鉄とスラグの混合物の製造方法 |
| CN108064214B (zh) | 2015-03-31 | 2021-08-06 | 哈泽尔集团公司 | 用于从碳氢化合物生产氢气和石墨碳的方法 |
-
2016
- 2016-03-31 CN CN201680019418.4A patent/CN108064214B/zh active Active
- 2016-03-31 MX MX2017012559A patent/MX2017012559A/es unknown
- 2016-03-31 SG SG11201707907SA patent/SG11201707907SA/en unknown
- 2016-03-31 WO PCT/AU2016/000115 patent/WO2016154666A1/en active Application Filing
- 2016-03-31 US US15/563,430 patent/US11505458B2/en active Active
- 2016-03-31 EA EA201792048A patent/EA035857B1/ru unknown
- 2016-03-31 MY MYPI2017703581A patent/MY188748A/en unknown
- 2016-03-31 CA CA2980471A patent/CA2980471A1/en active Pending
- 2016-03-31 NZ NZ73578116A patent/NZ735781A/en unknown
- 2016-03-31 BR BR112017021057-6A patent/BR112017021057B1/pt active IP Right Grant
- 2016-03-31 KR KR1020237019348A patent/KR20230106169A/ko not_active Application Discontinuation
- 2016-03-31 AU AU2016240393A patent/AU2016240393B2/en active Active
- 2016-03-31 EP EP16771087.0A patent/EP3277623A4/en active Pending
- 2016-03-31 JP JP2018502293A patent/JP7007256B2/ja active Active
- 2016-03-31 KR KR1020177030318A patent/KR102571186B1/ko active IP Right Grant
-
2017
- 2017-09-26 PH PH12017501770A patent/PH12017501770A1/en unknown
- 2017-09-26 ZA ZA2017/06455A patent/ZA201706455B/en unknown
- 2017-09-28 SA SA517390046A patent/SA517390046B1/ar unknown
- 2017-09-29 CL CL2017002468A patent/CL2017002468A1/es unknown
-
2018
- 2018-11-19 AU AU2018101788A patent/AU2018101788B4/en not_active Expired
- 2018-11-19 AU AU2018267558A patent/AU2018267558A1/en not_active Abandoned
- 2018-11-19 AU AU2018101787A patent/AU2018101787B4/en not_active Expired
-
2021
- 2021-10-12 JP JP2021167526A patent/JP2022009048A/ja active Pending
-
2022
- 2022-11-22 US US17/992,855 patent/US20230227307A1/en not_active Abandoned
-
2023
- 2023-07-27 JP JP2023122178A patent/JP2023139231A/ja active Pending
Non-Patent Citations (1)
| Title |
|---|
| Cementite Formation in CH4–H2–Ar Gas Mixture and Cementite Stability;Jianqiang ZHANG et al.;《ISIJ International》;20011231;第41卷;摘要、第3.1节、第337页第2栏第2段、第228页第1栏最后一段 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN108064214B (zh) | 用于从碳氢化合物生产氢气和石墨碳的方法 | |
| US8709128B2 (en) | Process for production of direct reduced iron | |
| US20150078982A1 (en) | Methods and systems for capturing and sequestering carbon and for reducing the mass of carbon oxides in a waste gas stream | |
| WO2013158158A1 (en) | Methods for treating an offgas containing carbon oxides | |
| AU2015203898B2 (en) | A catalyst and a process for catalytic conversion of carbon dioxide-containing gas and hydrogen streams to hydrocarbons | |
| US11814289B2 (en) | Black powder catalyst for hydrogen production via steam reforming | |
| US9522386B2 (en) | Catalyst and a process for catalytic conversion of carbon dioxide-containing gas and hydrogen streams to hydrocarbons | |
| WO2018189723A1 (en) | Treated iron ore catalysts for production of hydrogen and graphene | |
| EP2945920B1 (en) | A catalyst and a process for catalytic conversion of carbon dioxide-containing gas and hydrogen streams to hydrocarbons | |
| EP3303217B1 (en) | Process for the synthesis of a reducing gaseous mixture starting from a hydrocarbon stream and carbon dioxide | |
| US7285257B2 (en) | Method of removing tar-forming gases from CVD/CVI furnace effluent | |
| CN103667567A (zh) | 中低阶煤气化制备还原气输送床冶炼新工艺和系统 | |
| CN1390265A (zh) | 氧化物的固态还原 | |
| WO2014187324A1 (zh) | 中低阶煤气化制备还原气流化床冶炼新方法及系统 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| CB02 | Change of applicant information | ||
| CB02 | Change of applicant information |
Address after: 9th Floor, 99 St. George's Avenue, Perth, Western Australia Applicant after: Hazel Group Corporation Address before: Western Australia, Australia Applicant before: Hazel Group Corporation |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant | ||
| CB03 | Change of inventor or designer information | ||
| CB03 | Change of inventor or designer information |
Inventor after: Andrew Cornejo Inventor after: Cai Huizhong Inventor before: Andrew Cornejo Inventor before: Cai Huitong |