CN107530049B - 支持成像的斑块切除设备 - Google Patents
支持成像的斑块切除设备 Download PDFInfo
- Publication number
- CN107530049B CN107530049B CN201680022621.7A CN201680022621A CN107530049B CN 107530049 B CN107530049 B CN 107530049B CN 201680022621 A CN201680022621 A CN 201680022621A CN 107530049 B CN107530049 B CN 107530049B
- Authority
- CN
- China
- Prior art keywords
- catheter body
- catheter
- cutting
- cutter
- imaging
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000003384 imaging method Methods 0.000 title claims abstract description 98
- 238000005520 cutting process Methods 0.000 claims abstract description 185
- 239000000463 material Substances 0.000 claims abstract description 91
- 238000000034 method Methods 0.000 claims description 34
- 238000012014 optical coherence tomography Methods 0.000 claims description 26
- 238000012545 processing Methods 0.000 claims description 26
- 238000002604 ultrasonography Methods 0.000 claims description 22
- 238000005259 measurement Methods 0.000 claims description 6
- 230000008569 process Effects 0.000 claims description 3
- 238000005452 bending Methods 0.000 description 54
- 210000001519 tissue Anatomy 0.000 description 33
- 210000004204 blood vessel Anatomy 0.000 description 27
- 210000001367 artery Anatomy 0.000 description 25
- 239000000306 component Substances 0.000 description 19
- 230000003287 optical effect Effects 0.000 description 19
- 208000007536 Thrombosis Diseases 0.000 description 18
- 238000002608 intravascular ultrasound Methods 0.000 description 16
- 210000003127 knee Anatomy 0.000 description 15
- 229910052751 metal Inorganic materials 0.000 description 14
- 239000002184 metal Substances 0.000 description 14
- 230000002792 vascular Effects 0.000 description 14
- 210000003090 iliac artery Anatomy 0.000 description 13
- 210000002414 leg Anatomy 0.000 description 13
- 201000001320 Atherosclerosis Diseases 0.000 description 12
- 239000002245 particle Substances 0.000 description 12
- 210000004369 blood Anatomy 0.000 description 11
- 239000008280 blood Substances 0.000 description 11
- 238000012512 characterization method Methods 0.000 description 9
- 239000012530 fluid Substances 0.000 description 9
- 239000000523 sample Substances 0.000 description 9
- 230000000712 assembly Effects 0.000 description 8
- 238000000429 assembly Methods 0.000 description 8
- 230000002093 peripheral effect Effects 0.000 description 8
- 210000003484 anatomy Anatomy 0.000 description 7
- 230000007246 mechanism Effects 0.000 description 7
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 6
- 238000001228 spectrum Methods 0.000 description 6
- 238000001514 detection method Methods 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 210000002465 tibial artery Anatomy 0.000 description 5
- 238000012285 ultrasound imaging Methods 0.000 description 5
- 239000002699 waste material Substances 0.000 description 5
- 239000010963 304 stainless steel Substances 0.000 description 4
- 229910000589 SAE 304 stainless steel Inorganic materials 0.000 description 4
- 230000009471 action Effects 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 230000003143 atherosclerotic effect Effects 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 238000009826 distribution Methods 0.000 description 4
- 238000002592 echocardiography Methods 0.000 description 4
- 210000001105 femoral artery Anatomy 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 210000003137 popliteal artery Anatomy 0.000 description 4
- 230000003595 spectral effect Effects 0.000 description 4
- 238000010183 spectrum analysis Methods 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- 210000003462 vein Anatomy 0.000 description 4
- 238000003466 welding Methods 0.000 description 4
- 208000027418 Wounds and injury Diseases 0.000 description 3
- 210000000702 aorta abdominal Anatomy 0.000 description 3
- 230000004323 axial length Effects 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 235000012000 cholesterol Nutrition 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 230000006835 compression Effects 0.000 description 3
- 238000007906 compression Methods 0.000 description 3
- 208000014674 injury Diseases 0.000 description 3
- 230000003447 ipsilateral effect Effects 0.000 description 3
- 238000003698 laser cutting Methods 0.000 description 3
- 239000007769 metal material Substances 0.000 description 3
- 238000010408 sweeping Methods 0.000 description 3
- 230000008733 trauma Effects 0.000 description 3
- 238000012800 visualization Methods 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- 206010053567 Coagulopathies Diseases 0.000 description 2
- 208000005189 Embolism Diseases 0.000 description 2
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 230000001070 adhesive effect Effects 0.000 description 2
- 238000002399 angioplasty Methods 0.000 description 2
- 230000000845 anti-microbial effect Effects 0.000 description 2
- 230000008321 arterial blood flow Effects 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000005540 biological transmission Effects 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 238000004891 communication Methods 0.000 description 2
- 210000004351 coronary vessel Anatomy 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 229960002897 heparin Drugs 0.000 description 2
- 229920000669 heparin Polymers 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 230000002452 interceptive effect Effects 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 238000003754 machining Methods 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 239000004810 polytetrafluoroethylene Substances 0.000 description 2
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 238000002310 reflectometry Methods 0.000 description 2
- 239000002002 slurry Substances 0.000 description 2
- 229910001220 stainless steel Inorganic materials 0.000 description 2
- 239000010935 stainless steel Substances 0.000 description 2
- CCEKAJIANROZEO-UHFFFAOYSA-N sulfluramid Chemical group CCNS(=O)(=O)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F CCEKAJIANROZEO-UHFFFAOYSA-N 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 208000037260 Atherosclerotic Plaque Diseases 0.000 description 1
- 238000012935 Averaging Methods 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 206010051055 Deep vein thrombosis Diseases 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 208000031481 Pathologic Constriction Diseases 0.000 description 1
- 239000004696 Poly ether ether ketone Substances 0.000 description 1
- 229920002614 Polyether block amide Polymers 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000004642 Polyimide Substances 0.000 description 1
- 208000010378 Pulmonary Embolism Diseases 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- NRTOMJZYCJJWKI-UHFFFAOYSA-N Titanium nitride Chemical compound [Ti]#N NRTOMJZYCJJWKI-UHFFFAOYSA-N 0.000 description 1
- 206010047249 Venous thrombosis Diseases 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 239000011358 absorbing material Substances 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 210000000709 aorta Anatomy 0.000 description 1
- JUPQTSLXMOCDHR-UHFFFAOYSA-N benzene-1,4-diol;bis(4-fluorophenyl)methanone Chemical compound OC1=CC=C(O)C=C1.C1=CC(F)=CC=C1C(=O)C1=CC=C(F)C=C1 JUPQTSLXMOCDHR-UHFFFAOYSA-N 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 239000012503 blood component Substances 0.000 description 1
- 230000036770 blood supply Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 210000004958 brain cell Anatomy 0.000 description 1
- 210000005013 brain tissue Anatomy 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 230000035602 clotting Effects 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 229940039231 contrast media Drugs 0.000 description 1
- 239000002872 contrast media Substances 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000002059 diagnostic imaging Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000004811 fluoropolymer Substances 0.000 description 1
- 229920002313 fluoropolymer Polymers 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 210000004013 groin Anatomy 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000005802 health problem Effects 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 238000005286 illumination Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 230000009826 neoplastic cell growth Effects 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 229910001000 nickel titanium Inorganic materials 0.000 description 1
- HLXZNVUGXRDIFK-UHFFFAOYSA-N nickel titanium Chemical compound [Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni] HLXZNVUGXRDIFK-UHFFFAOYSA-N 0.000 description 1
- 239000013307 optical fiber Substances 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 210000000277 pancreatic duct Anatomy 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920000052 poly(p-xylylene) Polymers 0.000 description 1
- 229920002530 polyetherether ketone Polymers 0.000 description 1
- -1 polyethylene Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920001721 polyimide Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 238000011176 pooling Methods 0.000 description 1
- 238000002203 pretreatment Methods 0.000 description 1
- 238000003672 processing method Methods 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 238000002601 radiography Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 231100000241 scar Toxicity 0.000 description 1
- 235000021391 short chain fatty acids Nutrition 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 230000002966 stenotic effect Effects 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 238000011477 surgical intervention Methods 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 230000001732 thrombotic effect Effects 0.000 description 1
- 230000009772 tissue formation Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- MTPVUVINMAGMJL-UHFFFAOYSA-N trimethyl(1,1,2,2,2-pentafluoroethyl)silane Chemical compound C[Si](C)(C)C(F)(F)C(F)(F)F MTPVUVINMAGMJL-UHFFFAOYSA-N 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 210000000626 ureter Anatomy 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/32—Surgical cutting instruments
- A61B17/3205—Excision instruments
- A61B17/3207—Atherectomy devices working by cutting or abrading; Similar devices specially adapted for non-vascular obstructions
- A61B17/320758—Atherectomy devices working by cutting or abrading; Similar devices specially adapted for non-vascular obstructions with a rotating cutting instrument, e.g. motor driven
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/12—Diagnosis using ultrasonic, sonic or infrasonic waves in body cavities or body tracts, e.g. by using catheters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/44—Constructional features of the ultrasonic, sonic or infrasonic diagnostic device
- A61B8/4483—Constructional features of the ultrasonic, sonic or infrasonic diagnostic device characterised by features of the ultrasound transducer
- A61B8/4488—Constructional features of the ultrasonic, sonic or infrasonic diagnostic device characterised by features of the ultrasound transducer the transducer being a phased array
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00681—Aspects not otherwise provided for
- A61B2017/00685—Archimedes screw
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/22—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for
- A61B2017/22038—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for with a guide wire
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/22—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for
- A61B2017/22038—Implements for squeezing-off ulcers or the like on the inside of inner organs of the body; Implements for scraping-out cavities of body organs, e.g. bones; Calculus removers; Calculus smashing apparatus; Apparatus for removing obstructions in blood vessels, not otherwise provided for with a guide wire
- A61B2017/22042—Details of the tip of the guide wire
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B90/00—Instruments, implements or accessories specially adapted for surgery or diagnosis and not covered by any of the groups A61B1/00 - A61B50/00, e.g. for luxation treatment or for protecting wound edges
- A61B90/06—Measuring instruments not otherwise provided for
- A61B2090/064—Measuring instruments not otherwise provided for for measuring force, pressure or mechanical tension
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B90/00—Instruments, implements or accessories specially adapted for surgery or diagnosis and not covered by any of the groups A61B1/00 - A61B50/00, e.g. for luxation treatment or for protecting wound edges
- A61B90/36—Image-producing devices or illumination devices not otherwise provided for
- A61B90/37—Surgical systems with images on a monitor during operation
- A61B2090/373—Surgical systems with images on a monitor during operation using light, e.g. by using optical scanners
- A61B2090/3735—Optical coherence tomography [OCT]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B90/00—Instruments, implements or accessories specially adapted for surgery or diagnosis and not covered by any of the groups A61B1/00 - A61B50/00, e.g. for luxation treatment or for protecting wound edges
- A61B90/36—Image-producing devices or illumination devices not otherwise provided for
- A61B90/37—Surgical systems with images on a monitor during operation
- A61B2090/378—Surgical systems with images on a monitor during operation using ultrasound
- A61B2090/3782—Surgical systems with images on a monitor during operation using ultrasound transmitter or receiver in catheter or minimal invasive instrument
- A61B2090/3784—Surgical systems with images on a monitor during operation using ultrasound transmitter or receiver in catheter or minimal invasive instrument both receiver and transmitter being in the instrument or receiver being also transmitter
Abstract
本发明涉及具有成像能力的用于切割和移除闭塞性物质的设备。根据某些方面,该设备包括导管主体(302)、可旋转轴和成像元件(311)。导管主体限定管腔并且包括限定开口的远侧壳体。可旋转轴设置在导管主体的管腔内。可旋转轴包括输送部件和切割元件,该切割元件至少部分地由远侧壳体围绕。成像元件(311)设置于导管主体的远侧壳体(314)上。
Description
技术领域
本申请涉及对闭塞的身体管腔的治疗,包括从血管移除闭塞性物质。
背景技术
血栓症是起因于血管内的血液凝块或血栓形成的医学病症。在腿部或下腹部的静脉中经常出现深静脉血栓,但是血栓也可出现在其它血管中。凝块通常是由于异常的长期静止所致的静脉内的血液淤积而形成的,例如,当个体在手术或经受变得虚弱的疾病之后卧床时。除血栓症之外,粥样硬化是起因于静脉中形成堵塞物的另一种医学病症。
粥样硬化起因于粥样硬化物质沿动脉壁的积累。粥样硬化沉积物可具有广泛变化的性质,其中一些沉积物相对柔软而另一些沉积物是纤维状的和/或钙化的。在后一种情况下,沉积物通常被称为斑块。通常,血栓形成和粥样硬化两者都存在于静脉中。例如,血栓出现在粥样硬化斑块的周围。
血栓形成和斑块积聚可导致中风或栓塞,这可造成严重的健康问题,包括死亡。当血液凝块或斑块阻挡动脉将血液供应至大脑而使大脑组织失去氧气时,发生中风。在没有氧气的情况下,脑细胞开始死亡。当血液凝块在身体各处游走并且将其自身卡在器官内时,发生栓塞。例如,肺栓塞是一种通向肺的血液供应的堵塞,这导致重度缺氧和心力衰竭。
对于一些堵塞物,手术介入可能是必需的,以从血管移除血栓、斑块或两者,比如当胆固醇或抗凝剂药物治疗不能减轻堵塞时。球囊血管成形术是常见的手术治疗,并且涉及将球囊放置在闭塞物内并使球囊膨胀以将靠着血管壁的斑块和其它凝块粉碎和/或移位。虽然通常是有效的,但是球囊血管成形术会不希望地拉伸动脉、撕裂血管壁,并且诱发瘢痕组织形成,这可导致产生动脉的再狭窄。斑块切除术是治疗闭塞的血管的另一形式,并且涉及使用血管内装置以从动脉壁机械地移除(例如,减量)堵塞物(例如斑块、血栓等)。虽然斑块切除装置能够在没有拉伸或撕裂的情况下移除凝块,但是存在一些缺点。斑块切除装置通常不能移除所产生的粉碎的斑块颗粒,并且这些颗粒的生成在操作期间显著地降低血管造影的可视化。
发明内容
本发明提供用于机械破碎和移除堵塞物(例如,斑块、血栓等)的装置和方法,该装置和方法同时允许对治疗部位和操作进行管腔内成像。本发明的具体优点包括闭塞物的类型和严重性的治疗前可视化、用于更完全和安全的分解的闭塞物机械破碎的实时管腔内评估,以及消除了多个装置的交换(例如,需要分离的成像导管)。本发明的装置很好地适于移除斑块和其它粥样硬化沉积物,但是也可用来治疗血栓症。
本发明的装置大体包括导管主体和设置在导管主体内的可旋转轴。可旋转轴包括联接至可旋转轴的切割构件和沿可旋转轴的长度的输送元件。导管主体的远侧端部包括壳体,该壳体限定远侧开口并且至少部分地围绕切割构件。成像元件设置于壳体上并且允许人们定位并且评估血管内的闭塞物、观察闭塞物的切割和移除以及在治疗后评估血管。为进行治疗,切割构件旋转以机械地破碎堵塞物,并且所形成的堵塞物颗粒经由输送部件被从血管驱入导管主体中。
设备的成像组件有利地在治疗期间提供管腔内引导。成像组件可以是前视成像元件、侧视成像元件或其组合。适合的成像组件包括超声成像组件和光学相干断层扫描成像组件。
除对两血管进行成像之外,所获得的图像数据可经受数据处理(例如,光谱分析),使得可表征堵塞物。用于表征图像数据中存在的对象的处理技术可包括例如确定闭塞物的密度、确定闭塞物的组成、确定一个或多个血管管腔的血液-组织边界。
一般来讲,本发明的设备包括一个切割元件,但是一些实施例包括多于一个的切割元件。切割元件可包括形成切割刀片的一个或多个槽。槽通常具有正前角。正前角可以是至少20度。在一些变化形式中,正前角的范围可从40度至80度。切割元件可还包括一个或多个压碎元件。压碎元件可具有负前角并且在形状上是大致矩形的。负前角的范围可从至少1度、5度、10度、15度、20度、25度、30度或更大。在切割元件被设计来割穿/切穿堵塞物的情况下,压碎元件被配置成给堵塞物提供钝力。设想到的是,其它正前角和负前角可用于切割元件和压碎元件。
本发明的设备包括与可旋转轴相关联的输送元件。输送元件用于从血管移除破碎的颗粒,由此使不希望释放至血流中的颗粒的量最小化。
根据某些实施例,输送元件是缠绕在可旋转轴周围的螺旋丝,类似于螺钉。当旋转时,输送元件沿导管主体的内管腔朝近侧驱动颗粒。颗粒可沉积在与导管主体相关联的存储器中。输送元件的横截面可以是圆形的或矩形的。矩形横截面增加输送元件与导管主体的内管腔表面之间接触,由此增加输送元件在导管主体内朝近侧驱动颗粒的能力。
附图说明
图1示出切成片段的动脉区段的解剖视图,以示出粥样硬化的不同程度。
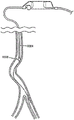
图2绘示出示出右腿的主要动脉和各动脉直径的典型变化形式的图解性解剖视图。
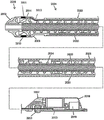
图3A绘示出如这里所述的斑块切除系统的例示性变化形式的透视图。
图3B示出图3A中所示的斑块切除系统的远侧部分的放大透视图。
图4A至图4D绘示出可在血管内布放斑块切除系统的例示性方法。
图5A绘示出这里所述的斑块切除系统的变化形式的分解透视图。
图5B绘示出图5A的斑块切除系统的组装后横截面侧视图。
图6A和图6B分别绘示出这里所述的代表性切割元件的变化形式的透视远侧视图和侧视图。
图6C是沿图6B中的线8C-8C作出的代表性切割元件的横截面图。
图6D是切入闭塞性物质中的如图6C中所示的代表性切割元件的横截面图。
图7绘示出包括第一切割元件和第二切割元件的切割器的变化形式的远侧透视图。
图8A至图8C绘示出根据某些实施例的切割元件的各视图。
图9A至图9B示出根据某些实施例的内部输送构件的横截面。
图10示出通过本文所述的斑块切除装置移除闭塞物。图11A绘示出这里所述的斑块切除系统的变化形式的透视图。
图11B是图11A中所示的斑块切除系统的远侧部分的放大透视图。
图11C和图11D绘示出可操纵如图11A中所示的斑块切除系统的不同方式。
图12A是这里所述的斑块切除系统的变化形式的分解透视图。
图12B绘示出图12A中所示的斑块切除系统的组装后横截面侧视图。
图13A是图12A和图12B的斑块切除系统的一部分的分解透视图。
图13B绘示出图13A中所绘示的部件的组装后透视图。
图13C和图13D绘示出可操纵图12A和图12B中所示的斑块切除系统的方式。
图14A至图14E和图14F(l)至图14F(5)绘示出以上关于图12A和图12B描述的斑块切除设备(2000)可在血管内主动地和被动地转向的方式。
图15A和图15B绘示出这里所述的斑块切除设备的变化形式。
图16示出用于与本文所述的斑块切除设备一起使用的系统。
具体实施方式
本发明提供用于移除血管内的闭塞物同时允许对操作进行实时成像的斑块切除装置。
在某些实施例中,本发明的装置和方法被设计成破碎并从身体管腔移除血液凝块(比如,栓子和血栓)、粥样硬化、斑块和其它闭塞性物质。身体管腔一般来讲是患病的身体管腔并且尤其是冠状动脉。身体管腔中的缺陷可以例如是重新凝块或支架内凝块。然而,该装置和方法也适于治疗身体管腔的狭窄和其它身体管腔(比如,输尿管、胆管、呼吸道、胰管、淋巴管等)中的其它增生性和赘生性病症。通常,由于包围和侵入身体管腔中的肿瘤将导致出现赘生性细胞的生长。这种物质的移除因而对于维持身体管腔的开放是有益的。本发明的装置和方法可收集管腔切除样本或物质。虽然其余的论述是针对抽出、成像和穿过冠状动脉中的粥样硬化或血栓形成的闭塞性物质,但应理解的是,本发明的系统、装置和方法可用于抽出和/或穿过各种身体管腔中的各种闭塞物、狭窄或增生性物质。
本发明的斑块切除装置尤其很好地适于粥样硬化的治疗。粥样硬化通常影响中动脉和大动脉,并且可在脂肪、胆固醇和其它物质累积在动脉壁上并且形成称为斑块/病变的肉质或硬的/钙化结构时发生。图1示出具有天然动脉壁(102)的正常的第一动脉区段(100)、具有在天然动脉壁(108)上形成的轻度粥样硬化和初期斑块(106)的第二动脉区段(104)和具有重度粥样硬化并且具有在天然动脉壁(114)上形成的晚期斑块(112)的第三动脉片段(110)的示例。当斑块形成在天然动脉壁内时,动脉会变窄并且变得缺少柔性,这会使血液更难以流过动脉。在周边动脉中,斑块通常不是局部的,而是可在长度上沿动脉的轴线延伸多达10mm或更多(在一些情况下高达400mm或更多)。
斑块切除术的临床挑战之一起因于指示进行斑块切除术的某些周边区域的天然解剖结构(例如,在腿部中)。因此,以下针对本发明的斑块切除装置的某些使用前景描述腿部的解剖结构。图2示出腿部(200)的主要动脉的解剖结构(为例示说明的目的示出了右腿)。还示出了腹主动脉(202)、左髂动脉(204)、右髂动脉(206)、髂内动脉(208)、髂外动脉(209)、股总动脉(210)、股浅动脉(212)、腘动脉(214)、胫腓大血管(216)、胫后动脉(218)、胫前动脉(220)和腓动脉(222)。腿部的周边动脉的直径通常沿着从膝盖以上至膝盖以下的动脉血液流动的方向从较大减少至较小。
腹主动脉(202)是身体中的最大动脉,并且其直径可介于从19mm至25mm(约0.75英寸至约1英寸)的范围内。腹主动脉在腿部的近侧区域与远侧区域之间相继地多次分支或分叉。每一后续分支或分叉可在从心脏至脚部的动脉血液流动的方向上减小动脉的直径,并且路径的曲折度通常增加。
第一分支在腹股沟处进入左髂总动脉(204)和右髂总动脉(206)中。在左腿中,左髂总动脉(204)分支成骼内动脉(208)和骼外动脉(209)。在股骨(224)的头部附近,髂外动脉(209)变成股总动脉(210)或“CPA”。CPA进一步连接至股浅动脉(212)或“SPA”。SPA连接至腘动脉(214),该腘动脉在膝盖的柔性区域后面延伸。在膝盖以上,SFA通常具有约5mm至7mm,或约0.2英寸至0.25英寸的直径。朝远侧穿行至膝盖以下(朝向脚部),腘动脉(214)可在直径上进一步减少至约4mm至4.5mm(0.157英寸至0.177英寸),并且随后进一步减少至约3.5mm(0.137英寸)。进一步朝远侧穿行,腘动脉(214)最终再次分支成胫前动脉(220)和胫腓大血管(216),导致在直径上进一步减少至约3.0mm至2.5mm(0.118英寸至0.098英寸)。进一步朝远侧穿行,胫腓大血管进一步再分成胫后动脉(218)和腓动脉(222),从而进一步使直径减少至约2.0mm(0.078英寸)。整体上,腿部的周边动脉的直径通常从约2mm(膝盖以下)变化至约7mm(膝盖以上)。
斑块切除装置通常通过同侧(即,相同侧)或对侧(即,相对侧)方案经由髂动脉引入到血管系统中,并且通常在荧光检查射线图像的引导下穿过CFA前进并且进入SFA中。当前,几乎所有的血管内斑块切除案例都是在SPA中进行的,然而,在大多数这些案例中,潜在地可治疗的粥样硬化存在于在膝盖以上和膝盖以下的多个层级的周边动脉上。因此,这里所述的装置和方法在到达这些潜在的斑块切除部位中是有帮助的。
图3A和图3B示出根据某些实施例的本发明的斑块切除系统。如图所示,斑块切除系统(300)可包括血管内斑块切除设备(302)和导丝(304),斑块切除设备(302)可在该导丝上布放。导丝(304)优选地是涂覆硅的或未涂覆的(裸露的),或以其它方式无PTFE涂层的。然而,应理解的是,在一些变化形式中,这里所述的斑块切除系统可包括具有PTFE涂层的导丝,或根本不包括导丝。在某些实施例中,导丝可以是感测导丝。例如,导丝可被配置成测量功能参数,如流量、压力、温度等。适合于在实践本发明的过程中使用的示例性功能测量装置包括Volcano Corporation的FloWire多普勒导丝和ComboWire XT导丝。
斑块切除设备(302)通常包括具有中心轴线的细长导管主体(306)。导管主体(306)可被确定尺寸并且被配置成从外部经皮进入部位在血管中在导丝(304)上前进。进入方案可以是同侧的或对侧的,并且直到目标区域。例如,图4A和图4B绘示出在斑块切除设备(302)的远侧部分使用同侧方案前进至胫前动脉(220)中的目标区域的情况下患者的解剖结构的视图。如图所示,斑块切除设备(302)可被引入右髂动脉(400)中的进入部位(400)中。相反地,图4C和图4D绘示出在斑块切除设备(302)的远侧部分在对侧方案中前进的情况下患者的解剖结构的视图。如图所示,斑块切除设备(302)的远侧部分可通过左髂动脉(204)中的进入部位(404)、跨过骼分叉前进,并且直到目标部位(在这些图中,目标部位被示为深动脉(406)的分支。为了从进入部位沿着血管内路径到达目标区域,导管主体(306)应具有用以允许导管主体(306)沿着导丝穿过弯曲且通常扭曲的血管内路径的物理和机械特性,如以下将更详细地描述的。
斑块切除设备(302)还可包括手柄(308),该手柄联接至导管主体(306)的近侧(即,最接近于护理人员)端部。手柄可被确定尺寸并且被配置成由护理人员在血管内路径外牢固地握持和操纵。手柄可从经皮进入部位附近的血管内路径之外进行操纵,这可允许护理人员使导管主体穿过血管内路径前进,当朝向腿部的远侧区域(膝盖以下并且朝向脚部)行进时,该血管内路径在腿部中通常变得更扭曲。图像引导(例如,CT、射线照相、斑块切除设备机载携带或以其它方式提供的现场可视化、或其它适合的引导模态、或其组合)可用于帮助斑块切除设备(302)前进或定位。导管主体(306)可前进以提供至目标区域的进入,在该目标区域处,脂肪、胆固醇和其它物质已聚集在动脉壁上而形成斑块或病变,该斑块或病变将通常也被称为11闭塞性物质。
斑块切除设备(302)可进一步包括在导管主体的远侧(例如,最远离手柄)端部处的切割器组件(310)。通常,切割器组件可用于切割和捕获闭塞性物质,并且借此从动脉移除闭塞性物质,这可为血液流动打开动脉。在一些变化形式中,切割器组件(310)可包括至少部分地容置在同心的切割器壳体(314)内的可旋转切割器(312)。切割器(312)能够在壳体内围绕导管主体的中心轴线旋转。在图3A和图3B中所示的变化形式中,切割器壳体(314)可在其最远侧端部处是开放的,使得切割器的最远侧端部可从开放的壳体(314)向远侧突出一距离。在这些变化形式的一些中,当切割器组件(310)被布放在闭塞性物质存在的目标区域中时,可以没有位于切割器组件前面(即,远侧)的斑块切除术的结构或部件,并且因此用以与斑块相互作用的斑块切除设备的第一区域是切割器组件。
切割器壳体(314)可包括位于其上或嵌置入其中的成像组件(311)。成像组件(311)可用于在利用切割器(312)粉碎之前、在粉碎期间,以及在粉碎之后获得闭塞物(粥样硬化、斑块、血栓或栓子)的实时图像,以观察操作的完成性或是否必需更多切割来完全地移除堵塞物或恢复适合的管腔开口。适合的成像组件包括光-声成像设备、血管内超声(IVUS)、前视血管内超声(FLIVUS)或光学相干断层扫描(OCT)。优选地,成像组件(311)是基于超声的成像组件。超声成像组件可以是包括多个换能器元件的相控阵组件。成像组件(311)可位于/嵌置在壳体(314)的一部分上。在某些实施例中,成像组件(311)围绕壳体(314)外接。在其它实施例中,成像组件(311)设置于导管主体(306)上、在壳体(314)的近侧。下文更详细地描述成像组件,如成像组件(311)。
图5A和图5B示出适于与这里描述的斑块切除系统一起使用的斑块切除设备(500)的分解图。如图所示,斑块切除设备(500)可包括手柄(502)、导管主体(504)和切割器组件(506),如以上针对图3A和图3B所描述的。如图5A和图5B中所示,切割器组件(506)可包括套箍(508)、切割器壳体(510)以及包括第一切割元件(512)和第二切割元件(514)的切割器。应理解的是,斑块切除设备(500)可包括任何适合的切割器组件,如以下更详细地描述的那些。壳体510可包括成像组件511。成像组件510连接至一个或多个信号线(513),该一个或多个信号线又连接至信号处理设备。信号线(513)将能量传输至成像组件511以发射成像信号(如超声或光学信号),并且将从成像组件接收到的后信号(后回波)传输至信号处理设备和成像控制台。信号线(513)可沿着导管主体(504)的内表面的边延伸至信号处理设备,或信号线(513)可并入导管主体(504)中。在某些实施例中,导管主体(504)可限定分离的管腔,信号线(513)可穿过该分离的管腔布设。
斑块切除设备(500)可包括马达(516),该马达在图5A和图5B中所示的实施例中可容置在手柄(502)的壳体部分(518)内。马达期望是电池供电的,通过使用可替换的电池、通过使用可充电的电池,或两者的组合。马达控制器期望能对所有操作状态提供一致的电力供应,包括空载到过量转矩和失速状态。可设置控制开关(520)(例如,滑动开关、按钮和/或电位计)以包括断开/接通功能,并且在一些情况下,包括各种其它控制功能中的一个或多个,如斜升和/或斜降,和/或可变速度。在一些变化形式中,马达可在6伏的标称电压下以约12,000RPM运转。操作参数可通过调整传动比来改变。
如图5A和图5B中所示,转矩轴(522)可将马达(502)连接至切割器。具体而言,马达(502)可使转矩轴(522)旋转,这继而可使切割器在切割器壳体(510)内围绕导管主体的中心轴线旋转。切割器组件(506)的切割器的旋转可使第一切割元件(512)和/或第二切割元件(514)切割闭塞性物质,并且将闭塞性物质输送至切割器壳体(510)中(也称为“减量(debulking)”的过程)。优选地,切割器组件(506)在没有使用任何真空抽吸的情况下从血液捕获切割下的闭塞性物质(但应理解的是,在一些变化形式中,真空抽吸可辅助切割下的闭塞性物质的输送)。
另外,斑块切除设备(500)可进一步包括在转矩轴(522)上的内部输送器(524)。当闭塞性物质被切割器输送至切割器壳体(510)中时,输送器(524)可沿导管主体进一步向后(朝近侧)输送切割下的闭塞性物质,以排放到患者身体外。如以上提到的,这种输送可在没有使用真空抽吸辅助的情况下发生。机械输送可补充远侧捕获。因为其不需要真空抽吸的辅助,所以机械输送可使切割器周围的动脉塌陷的风险以及相关联的穿孔风险最小化。另外,这种输送可使通过与切割器组件接触而已经被破坏的组织和血液成分的移除最大化。
在另外的实施例中,导管主体(504)、联接至该导管主体的壳体(510)和设置于壳体(510)上的成像组件(511)被配置成旋转。例如,这些部件可联接至旋转驱动轴以实现旋转。被配置成能够使导管主体和成像元件旋转的旋转驱动轴在本领域中是已知的。
这些部件的旋转可用于若干目的。例如,旋转可用作进一步使堵塞物分解的手段。在另一示例中,旋转可辅助将破碎的堵塞物颗粒移动至导管主体(504)中以便移除。另外,旋转可用于辅助对血管壁的管腔表面(例如,壁内空间内的管腔表面)进行成像。例如,成像元件(比如光学相干断层扫描和超声成像元件)捕获在成像元件的旋转期间获得的横截面成像数据。在一些实施例中,导管主体(504)和相关联元件的旋转逆着转矩轴(522)的旋转。这种逆向旋转可在移除破碎颗粒的过程中增加内部输送器(524)的有效性。
下文更详细地论述图3A、图3B、图5A和图5B中所示的系统的单独部件。
A.导管主体
1.尺寸
实际上,导管主体的任何片段(包括其携带的切割器组件)的外径可至少部分地由血管内路径和预定目标区域的解剖结构来决定。具体而言,可期望通过使切割器直径最大化来使切割器组件的切割有效性最大化,同时使血管刺穿或创伤的可能性最小化。另外,导管主体/切割器组件的外径还可至少部分地由所选择的导鞘或导引器的直径来决定,该导鞘或导引器可被放置在进入部位处以允许斑块切除设备引入至血管系统中。可期望选择一种导鞘或导引器,该导鞘或导引器被确定尺寸以在使用期间使疼痛、创伤和失血最小化,并且在移除之后利于进入切口的快速闭合,由此降低介入并发症的发生率。
如先前提到的,腿部的周边动脉的直径通常从膝盖以下区域中相对小的直径(2.0mm)变化至膝盖以上区域中相对大的直径(7.0mm)。为了经皮肤进入到周边动脉,临床医生通常使用尺寸介于5F(诊断)至7F(介入)的导鞘。
例如,从临床观点来看,假设7French的导鞘将是为进入膝盖以上的较大血管(4mm至7mm)而选择的最大尺寸,且允许在导管主体/切割器组件与导鞘之间有合理的间隙公差,则在一些情况下,用于通过这种导鞘引入的导管主体的外径可被选择成近似等于或小于约2.4mm。
从临床观点来看,假设5F的导鞘将是为进入膝盖以下的较小血管(2.5mm至3mm)而选择的最大尺寸,且允许在导管主体/切割器组件与导鞘之间有合理的间隙公差,则在一些情况下,用于通过这种导鞘引入的导管主体的外径可被选择成近似等于或小于约1.8mm。从临床观点来看,假设中等的6French的导鞘将是为进入膝盖附近的中等血管(3mm至4mm)而选择的最大尺寸,且允许在导管主体/切割器组件与导鞘之间有合理的间隙公差,则在一些情况下,用于通过这种导鞘引入的导管主体的外径可被选择成近似等于或小于约2.2mm。
可期望的是,切割器组件的外径最大化以使斑块切除组件的总切割面积最大化。当斑块切除设备的切割器组件是设备的最远侧部件时,切割器组件可通过切穿闭塞性物质来引路。然而,就导管主体而言,在导管主体的外径没有被最大化以匹配切割器组件的外径时,可产生功能和临床上的益处。相对于切割器组件减小导管主体的直径可使导管主体与血管壁之间的摩擦接触最小化。这可减小使导管主体穿过血管系统和闭塞性物质前进所需要的力,且可帮助避免导管主体抵靠血管中的组织结构拖曳或粘住血管中的组织结构,或以其它方式妨碍切割器组件穿过闭塞性物质前行。
例如,可期望的是,导管主体在切割器组件近侧的外径被确定尺寸成小于切割器组件的外径。在其它情况下,可期望的是,导管主体在切割器组件近侧的外径被确定尺寸成等于或小于切割器组件的外径。例如,在以上针对图5A和图5B所描述的斑块切除设备(500)的变化形式中,导管主体(504)可具有小于切割器组件(506)的外径的外径。
导管主体的直径减小也可容许在导鞘中、在导管主体周围注入射线照相造影剂。例如,用于通过7F的导引器系统引入的斑块切除设备可具有2.4mm的直径的切割器组件和具有2.2mm的直径的导管主体。在其它变化形式中,用于通过5F或6F的导引器系统引入的斑块切除设备可具有1.8mm的直径的切割器组件和具有1.6mm的直径的导管主体,或2.2mm的直径的切割器组件和直径1.6mm的直径导管主体。
2.导管特性
除了可在选择导管主体的外径中使用的解剖学和临床考虑之外,导管主体还期望具有某些物理和机械特性,比如以下紧接描述的那些,该物理和机械特性可增强导管主体的功能以支持和引导切割器组件通过血管内路径和闭塞性物质。
(i)柱刚度(推送性)
导管主体的一个潜在地期望的特性包括柱刚度。柱刚度以英寸/英尺-磅为单位,是导管主体承受轴向负荷或压力同时抵抗弯曲的能力。柱刚度可用常规方式来测量和表征,且在本文中可被称为“推送性”。一般来讲,较高的柱刚度是期望的,且可允许导管主体在没有屈曲的情况下将施加在手柄处的较高的轴向力(压缩)传递至切割器组件。
相应地,可期望的是,导管主体具有足以在没有屈曲的情况下在导丝上推动切割器组件的柱刚度。对于本文所述的导管主体而言,0.050英寸/磅或更大的柱刚度是期望的。
(ii)抗拉刚度(牵引性)
导管主体的另一个潜在地期望的特性包括抗拉刚度。抗拉刚度以英寸/英尺-磅为单位,是导管主体在被拉伸或牵引时在横截面开始显著收缩(称为“颈缩”)之前承受张力的能力。抗拉刚度可用常规方式来测量并表征,且在本文中可称被为“牵引性”。一般来将,高的抗拉刚度是期望的,且可允许导管主体在没有颈缩的情况下沿血管内路径朝近侧牵引(例如,为了撤回切割器组件)。对于本文所述的导管主体而言,0.050英寸/磅或更大的抗拉刚度是期望的。
(iii)抗扭刚度(扭转性)
导管主体的另一个潜在地期望的特性包括扭转刚度。
抗扭刚度以度/盎司-英寸为单位,是导管主体在没有扭转不足、过度扭转和/或变形的情况下传输旋转负载(转矩)的能力。抗扭刚度可用常规方式来测量并表征,且在本文中可被称为“扭转性”。抗扭刚度可控制导管主体将施加在其近侧端部(即,手柄)处的给定旋转量传递以在其远侧端部(即,切割器组件)获得可比的旋转量的能力。较高的抗扭刚度是期望的,以更好地允许沿着斑块切除设备的旋转传递(即,围绕导丝),且没有扭转或变形。对于本文所述的导管主体而言,在施加于近侧端部处的旋转与在远侧端部处观察到的旋转之间实现1:1关系的抗扭刚度是期望的。
(iv)抗弯刚度(循行性)
导管主体的另一个潜在地期望的特性包括抗弯刚度。
抗弯刚度以弯曲半径(按英寸表示)为单位,是导管轴在没有断裂或变形的情况下(即,没有过弯)响应于所施加的弯曲力而弯曲的能力。抗弯刚度是泛用的材料性能,可用常规方式来测量并表征,且在本文中可被称为“循行性”。
一般来讲,较低的抗弯刚度是期望的,以允许导管主体在导丝上绕血管系统中的急弯导航。对于本文所述的导管主体而言,在导管主体的中间长度处具有0.5英寸(弯曲半径)或更大的目标抗弯刚度是期望的。如果导管主体包括在其远侧端部处的主动偏转部件(如稍后更详细地描述),则对于本文所述的导管主体而言,在可偏转的远侧端部处1.0"(弯曲半径)的目标抗弯刚度是期望的。规定的最小弯曲半径也使得可在没有过弯的情况下卷绕导管主体以利于包装。
常规上,循行性被认为与推送性/牵引性和扭转性反向相关。也就是说,导管主体中较大的推送性、牵引性和/或扭转性可能导致导管主体的循行性减弱。然而,本文所述的导管主体可平衡给定导管主体的推送性、牵引性、扭转性和循行性。结果可能是导管主体是可循行的,且还拥有为了充分地可推送、可牵引和可扭转所必需的柱强度、抗拉强度和抗扭刚度,从而允许切割器组件的导航和推进。
给定导管主体的循行性(就其在导丝上可靠地导航的能力方面)主要受导管主体在其远侧端部处的物理和机械性能的影响。推送性、牵引性和扭转性主要受导管主体在其远侧端部的近侧的物理和机械性能的影响。也就是说,导管主体的不同区域的整体构造会给导管主体的总长度赋予特性,这可允许实现导管主体的整体推送性、牵引性、扭转性和循行性的优化。
3.导管主体的变化形式
一般来讲,导管主体的柱刚度、抗拉刚度、抗扭刚度和抗弯刚度可至少部分地由其构成材料、导管主体的尺寸(例如,内径、外径、壁厚等)以及比如图案的其它结构特征来确定。导管主体可由金属管(例如,304型不锈钢管等)制造。管的尺寸可至少部分地取决于斑块切除设备的预定用途。例如,在一些变化形式中,管的外径可能希望是约2.2mm,而在其它变化形式中,管的外径可以是约1.6mm。另外或替代地,管的壁厚可优选地是约0.288mm。另外或替代地,管的整体长度可优选地是约1437mm(约56.56英寸)。
具有以上刚刚描述的尺寸中的一些或全部的金属管可提供较高程度的的推送性、牵引性和扭转性,在给定导管主体的长度时,基线抗弯刚度会限制导管主体的循行性。
因此,在一些变化形式中,通过沿着导管主体长度的至少一部分形成多个切割图案区,可沿着导管主体的长度渐进地调节金属管的抗弯刚度。切割图案可用任何适合的方式(例如,经由激光切割)形成,且所述区可在导管主体的长度上带来期望的抗弯刚度分布。例如,切割图案区可用于从近侧端部到远侧端部以步进的方式渐进地减小抗弯刚度,以提供有利于在远侧端部处的循行性的最小抗弯刚度(在循行性更为期望时)。减小抗弯刚度的步进式方式可按照有助于维持整体的推送性、牵引性和扭转性的方式来构造。在某些实施例中,导管主体的一个或多个区包括螺旋形切割图案、螺纹形切割图案、螺线形切割图案或砌砖形切割图案。
具有任何切割图案的导管主体可以聚合物材料为衬里或护套,且还可经处理以产生亲水性、疏水性或药物结合(肝素、抗菌剂)的特性。
4.导管主体旋转
如以上所论述,导管主体504(以及壳体和成像组件)可被配置成用于旋转。在某些实施例中,导管主体504联接至驱动导管主体504的旋转的旋转驱动轴。在其它变化形式中,导管主体可联接至手柄上的柱,该柱被确定尺寸并且被配置成响应于控制旋钮的旋转而旋转。例如,以上针对图5A和图5B所描述的斑块切除设备(500)可包括旋转旋钮(526)。旋钮的旋转可将转矩施加至导管主体以选择性地旋转切割器组件。可设置分度机构以利用触觉和/或听觉反馈来提供步进式控制,使得护理人员在不使其眼睛离开射线照相图像或以其它方式提供的现场图像的情况下维持对切割器组件的旋转位置的知晓。
也可通过旋转手柄自身将转矩施加至导管主体。
切割器组件的选择性旋转可因此通过控制旋钮的操纵和手柄扭转的组合而精细地控制。
B.切割器组件
如以上提到的,斑块切除装置可包括切割器组件。切割器组件可包括套箍、切割器壳体以及包括至少一个切割器元件的切割器。在切割器组件包括套箍的变化形式中,切割器组件可通过套箍连接至导管主体的远侧端部。在某些实施例中,切割器组件还包括与切割器壳体相关联的成像组件。
1.切割器壳体
如先前提到的,切割器组件可包括壳体,切割器在该壳体中旋转。可期望的是使切割器组件(以及与切割器组件一起的切割器壳体)的外径最大化以使可由切割器组件切割的切割面积最大化。切割器组件的大小可根据预定的血管内路径和用于治疗的目标区域而受限制,以有助于降低切割器组件将切割或以其它方式破坏血管壁的可能性。
在本文所描述的变化形式的一些中,被确定尺寸以用于通过7French的导鞘引入的切割器组件可具有约2.4mm的外径(该外径在一些变化形式中可大于伴随的导管主体的外径,如上面更详细地描述的)。具有这种外径的切割器组件可例如被用于进入膝盖以上的较大血管(例如,介于约4mm与约7mm之间的血管)。在本文所描述的其它变化形式中,被确定尺寸以用于通过5或6French的导鞘引入的切割器组件可具有约1.8mm至约2.2mm的外径(该外径在一些变化形式中可大于伴随的导管主体的外径,如上面更详细地描述的)。具有这种外径的切割器组件可例如被用于进入膝盖处或以下的较小血管(例如,介于约2.5mm与约4mm之间的血管)。
壳体可以是或不是动态的(即,能够相对于导管主体旋转)。在壳体是动态的变化形式中,壳体可被配置成相较于切割器元件以相同速度或以不同速度旋转。另外,切割器壳体可被动态地驱动以相对于切割器在相同方向上或在相反方向上旋转。
壳体可包括一个或多个成像组件。成像组件可设置于壳体上或嵌置在壳体内。成像组件可覆盖壳体的一部分,并且优选地成像组件围绕壳体外接。成像组件连接至沿斑块切除术装置的长度延伸的一个或多个信号线。
切割器壳体的前边缘(其限定切割器突出穿过的远侧开口的周边)期望是修圆的,并且不存在锋利的远侧边缘。在这些变化形式中,修圆的远侧壳体可降低壳体的周边边缘在通过导鞘引入时挂在导鞘壁上的可能性。
另外,修圆的远侧边缘也可趋于掠过组织而没有抓取或挂在组织上,这可使得在前进期间由斑块切除设备所感受到的阻力最小化。应理解的是,在一些变化形式中,切割器壳体可具有锋利的或斜面的远侧边缘。在这些变化形式的一些中,切割器壳体可具有内斜面。在其它变化形式中,切割器壳体可具有外斜面。
在一些变化形式中,切割器的外径可小于切割器壳体的内径,以在两者之间产生需要的切割间隙。较大间隙可产生较大的切割体积,但是过大的间隙可容许组织绕过切割器进入切割器壳体。稍后将更详细地描述代表性的尺寸。在其它变化形式中,切割器的一部分的外径可大于或等于切割器壳体的直径。在这些变化形式中,切割器可切割较大直径的组织,这可降低切割器壳体在前进期间在切割的同时摩擦组织的可能性,由此利于装置的前进。
2.转矩轴
切割器通过转矩轴联接并且能够通过转矩轴旋转。转矩轴可继而通过手柄中的马达驱动。转矩轴可由任何适合的材料制成,优选是可与导管主体的推送性、牵引性、扭转性和循行性一致的一种或多种材料,如上文所述。例如,转矩轴可包括金属编织件和/或一个或多个金属线圈,以及转矩轴的嵌入到聚合物(例如,PEBAX、聚氨酯、聚乙烯、含氟聚合物、聚对二甲苯、聚酸亚胺、PEEK和/或PET)中的一个或多个部分。在一些变化形式中,转矩轴可由比如塑料的刚性材料制成,该刚性材料通过包括螺旋突起或沟槽而表现出柔性。
在一些变化形式(如以上针对图3A、图3B、图5A和图5B绘示的转矩轴)中,转矩轴可包括缠绕在中心管腔周围的柔性丝圈。
中心管腔可被确定尺寸以适应导丝穿过该中心管腔。柔性丝圈可优选地沿与转矩轴的预定旋转方向相同的方向缠绕,这可使线圈在遇到旋转的扭转阻力时打开(与施压相反,该施压可使转矩轴锁定至定位在中心管腔中的导丝上)。
一般来讲,转矩轴可在转矩轴的远侧端部处或附近联接至切割器组件的切割器,并且可在转矩轴的近侧端部处或附近附接至马达(例如,通过齿轮装置)。在一些变化形式(如图3A、图3B、图5A和图5B中所描述的斑块切除设备)中,切割器组件可包括可与转矩轴的中心管腔/导丝管腔连通的中心管腔。
3.切割元件的几何形状
如以上提到的,在一些变化形式中,切割器组件的切割器可包括多个切割元件。例如,在以上针对图5A和图5B描述的斑块切除设备(500)的变化形式中,切割器组件(506)可包括具有第一切割元件(512)和第二切割元件(514)的切割器。如图所示,第一切割元件(512)可定位在第二切割元件(514)的远侧。第一切割元件(512)可包括可至少部分地突出超过切割器壳体(510)的远侧端部的一个或多个切割边缘(528)。在一些变化形式中,第一切割元件(512)的至少一部分可具有大于或等于切割器壳体(510)的直径的直径。第二切割元件(514)可至少部分地容置在切割器壳体(510)内,并且可包括一个或多个切割边缘(530)。如图5B中所示,第二切割元件(514)的切割边缘(530)可被完全包围在切割器壳体(510)内。一般来讲,第一切割元件(512)和第二切割元件(514)可物理地联接在一起(例如,通过粘合剂或焊接)以便共同旋转。
转矩轴可联接至第二切割元件中的轴颈(532)。当第一切割元件(512)和第二切割元件(514)物理地联接在一起时,转矩轴可共同地旋转第一切割元件和第二切割元件两者。第二切割元件(514)上的近侧凸缘(534)可坐置在切割器壳体(510)中的浮雕出的近侧沟槽(536)内。浮雕出的近侧沟槽(536)可用作切割器壳体内的第一切割元件(512)和第二切割元件(514)的轴向保持器。
(i)第一切割元件
图6A至图6D绘示出适于与本文所描述的切割器组件一起使用的第一切割元件(800)的例示性变化形式。在一些变化形式中,第一切割元件(800)可由硬金属材料(例如,440C不锈钢)机械加工制成,并且可具有包括至少一个螺旋槽(802)(图中示为右旋,但应理解的是,至少一个螺旋槽(802)可具有左旋)的大体上半球形的构造。虽然图6A至图6D中示为具有两个螺旋槽(802),但是应理解的是,第一切割元件(800)可包括任何适合数目的螺旋槽(802)(例如,一个、两个、三个、四个或更多个螺旋槽)。每一切割槽可形成具有切割边缘(804)的切割刀片(803)。
第一切割元件可被机械加工以在所期望的半球形几何形状内形成螺旋槽(802)的结构。当相对于切割器壳体以延伸的、向远侧突出的关系支撑(例如,借助于与第二切割元件的连接,如以上更详细地描述的)时,半球形的、带槽的几何形状可被确定尺寸并且被配置成优化一个或多个切割刀片切穿和捕获闭塞性物质的能力,同时使一个或多个切割刀片抓住或挖入组织中、缠绕组织以及以其它方式使马达失速和过载的风险最小化。
每一槽的几何形状可被特意地成形以用于以上提到的目的,并且槽的几何形状可参照角的组合(或角的范围)来进行表征,包括前角、后角、槽角和螺旋角。另外,虽然图6A至图6D中示为具有半球形外轮廓,但是应理解的是,前切割元件可以是任何外轮廓,比如卵形外轮廓。
(a)前角
对于每一槽,前角(806)(在图6C中最好地示出)可限定为在(i)从切割刀片(810)的旋转轴线到刀片(803)的径向最远边缘(804)绘制的半径(808)与(ii)从那个刀片(803)的内面绘制的切线(810)之间测量的角。前角可描述切割边缘(804)相对于待切割物质的角。
在一些变化形式中,第一切割元件的每一槽可拥有正前角(即,切割刀片的内面从切割边缘向内或向后倾斜)。每一槽的正前角优选是大的,且在一些情况下可大于约20度。在这些变化形式的一些中,前角优选地大于约40度。在这些变化形式的一些中,前角可在约60度与80度之间(在本文中称为“高”前角)。在一些变化形式中,前角可在65度与75度之间。在一些变化形式中,前角可以是约70度。
一般来讲,具有正的高前角的装置可很好地适于切割具有较少钙的闭塞性物质,该闭塞性物质可具有纤维、肉质和/或橡胶状的一致性。橡胶状的一致性可致使常规的切割器偏离这些物质,从而致使常规装置失去循行性,但是高前角帮助切割器割进这个组织中,同时使切割器的偏转最小化。常规切割器的机械加工技术通常无法产生正的高前角切割器,并且这些切割器通常具有小前角(小于约15度)。另外,较大前角可降低切割器的结构完整性,这使切割器在使用期间可能碎裂或断裂。然而,本文所描述的切割器可允许实现高前角切割的益处,同时降低切割器故障的风险。
切割器的前角可根据待切割组织的性质加以修改。例如,用于切割具有较高钙含量的硬的、钙化的闭塞性物质的切割器组件可被配置成具有负前角(即,切割刀片的内面可向切割边缘外或前倾斜),这可很好地适于研磨或粉碎硬化的闭塞性物质。应理解的是,给定切割元件可被机械加工以包括具有正前角和负前角两者的切割刀片或以其它方式包括切割和研磨表面两者的组合。例如,在一些变化形式中,切割器可包括具有多个螺旋槽的第一切割元件,其中至少一个槽具有带有正前角的切割边缘并且至少一个槽具有带有负前角的切割边缘。在这些变化形式的一些中,具有带有正前角的切割边缘的螺旋槽可具有大于约20度(例如,大于约40度或约70°+/-10°)的正前角
在图6A至图6D中所示的第一切割元件(800)的变化形式中,具有大的正前角(例如,70°±10°)的槽的形成可产生具有放大的凹入内面的切割刀片。放大的凹入内面可限定能有效地割穿闭塞性物质(812)的槽形或勺形刀片,如图6D中所示。切割刀片的大的正(高)前角和所形成的放大的凹入内面可降低用于第一切割元件(800)的切割力和功率要求,并且可用切割刀片的每一次经过移除大体积的闭塞性物质。
(b)后角
对于每一槽,后角(814)可限定为在(i)从半径(808)自切割刀片(803)的最远径向边缘(804)绘制的切线(816)与(ii)沿刀片(803)的外面绘制的切线(818)之间测量的角。后角通常跨越切割边缘(804)与待切割的闭塞性物质(812)表面之间的间隙(如图6D中所示)。一般来讲,较小后角可在切割期间与组织表面形成更相切的界面,这可降低切割边缘在切割期间可能绊住或以其它方式挂在组织上的可能性。较大后角可提供更具攻击性的切割。
通常,后角优选地是小于或等于约10°的小角(例如,在约0°与约10°之间)。在这些变化形式的一些中,后角可以是约0°。在一些变化形式中,优选可具有约70度的前角和约0度的后角。在其它变化形式中,螺旋槽可具有约60度的前角和约10度的后角。具有小后角的槽的形成可产生可与闭塞性物质(812)实现攻击性接触的切割边缘(804),如图6D中所示。与大的正(高)前角一起,小后角可导致在切割器组件的远侧端部处高效地切割和捕获闭塞性物质,从而使残渣和栓塞最小化。
(c)槽角
对于每一槽,槽角(824)可以根据与前角和后角的关系而限定如下:
槽角=90°-(前角)-(后角)。
槽角的量值是切割边缘多厚和多锋利的指示。假设在优选实施例中前角可介于约60°与80°之间的范围内;后角可介于约0°与10°之间的范围内,槽角可介于约0°与约30°之间的范围内。最大化前角且最小化后角以实现高效切割状态可导致产生具有减小的槽角的切割器几何形状。因此,可期望的是,第一切割元件由硬金属材料加工成以包括尽可能锋利的切割边缘。在一些变化形式中,也可期望用具有低摩擦系数(优选地不大于0.5)的生物相容的高润滑材料涂覆切割刀片以帮助在使用期间保持切割刀片锋利。在这些变化形式中,可使用如氮化钛或类金刚石碳(DLC)的涂覆材料。
(d)螺旋角
在图6A至图6D中所示的第一切割元件(800)的变化形式中,第一切割元件(800)的每一槽(802)可包括螺旋切口。螺旋角(826)可被限定为在(i)切割刀片(803)的旋转轴线(828)和(ii)沿着切割刀片(803)的内面绘制的切线(830)之间的角。螺旋角的量值指示切割刀片将被切割的闭塞性物质沿着切割刀片朝近侧运送到壳体中的能力。
在一些变化形式中,第一切割元件(800)的每一槽(802)可具有介于约30°与60°之间的螺旋角(802)。低于30°的螺旋角可增加第一切割元件(800)会被闭塞性物质过载并且失速的可能性,而高于60°的螺旋角可降低第一切割元件(800)的切割效率。
图8A至图8C示出根据其它实施例的第一切割元件。如图8A至图8C中所示,该切割元件可包括一个或多个刀片1110、一个或多个钝的压碎元件1008,或两者。一个或多个刀片1110可被设计成具有以上论述的角度几何形状。刀片1110被设计成在切割元件旋转时切穿闭塞物。压碎元件1008被设计成将压碎性打击传递至闭塞物。也就是说,压碎元件1008被设计成将打击或突然撞击传递至闭塞物,从而进一步破碎除可以单独利用刀片1110之外的闭塞物。具体来说,压碎元件1008在破穿纤维性斑块和高度组织化的血栓中是有用的。压碎元件1008优选地是钝的并且在形状上是大致矩形的。在某些实施例中,压碎元件1008形成零前角或负前角(与刀片1110的正前角相反)。负前角的范围可从至少1度、5度、10度、15度、20度、25度、30度或更大。但是,压碎元件1008可包括其它形状,如球形、三角形、圆柱形、六边形等。虽然压碎元件的主体大体是钝的,但是压碎元件的边缘可以是锋利的,以便也辅助切穿闭塞物。一个或多个压碎元件1008可设置于刀片1110之间(如图8A至图8C中所示)。在某些实施例中,压碎元件1008由与切割元件的其余部分不同的材料形成。压碎元件1008在理想情况下由比如碳化钛的碳化金属形成。
(ii)第二切割元件
如以上提到的,切割器组件可包括第二切割元件。例如,在图5A和图5B中所示的斑块切除设备(500)的变化形式中,切割器组件(506)可包括第二切割元件(514)。在包括第二切割元件的变化形式中,第二切割元件可由硬金属材料(例如,17-4不锈钢)机械加工成包括螺旋切割槽。切割槽可被配置成具有与第一切割元件的槽相同的前角、后角、槽角和螺旋角。在一些变化形式中,除第二切割元件具有比第一切割元件更多的槽之外,第一切割元件和第二切割元件的上述几何形状可以是相同的。在这些变化形式的一些中,第二切割元件可具有第一切割元件的双倍数量的槽;也就是说,示出四个槽。
在一些变化形式中,第二切割元件被机械加工成包括配合在第一切割元件的中心轴颈内的中空杆。例如,在图5A和图5B中所示的斑块切除设备的变化形式中,第二切割元件(514)可包括杆(538),第一切割元件(512)可围绕该杆放置。例如,图9示出切割器组件(506)的透视图,其中第一切割元件(512)和第二切割元件(514)可在旋转对准的状态下连接在一起(例如,通过粘合剂或焊接)。在对准状态下,第二切割元件(514)的两个相对切割槽(540)可与第一切割元件(512)的两个相对切割槽(542)旋转地对准。它们的几何形状可在机械加工期间匹配,并且可用于通过第一切割元件切割闭塞性物质并将闭塞性物质朝近侧输送至壳体中,并且进一步将闭塞性物质更朝近侧输送而与第二切割元件的附加切割刀片接触。
(iii)两级切割动作
图7中所示的切割器组件(506)可提供两级切割动作。
一般来讲,第一切割元件(512)可切割闭塞性物质并且将物质输送至第二切割元件(514)。第二切割元件(514)可进一步将闭塞性物质切割或粉碎成更小的颗粒。在两个切割动作期间,闭塞性物质可连续地捕获在壳体内并且远离血管内目标部位朝近侧输送。当第一切割元件和第二切割元件旋转时,由槽形成的螺旋切割表面可切割血管中的闭塞性物质,并且可通过螺旋槽的动作将闭塞性物质从血管输送至壳体中,并且可在没有任何真空抽吸辅助的情况下这样做。
C.闭塞性物质的机械移除
如以上提到的,在这里所述的斑块切除设备的一些变化形式中,斑块切除设备包括内部输送构件。例如,图5A和图5B中所示的斑块切除设备(500)的变化形式可包括内部输送器(524)。在包括内部输送构件的变化形式中,内部输送构件可包括在与切割器组件的螺旋切割表面共同的方向上螺旋地缠绕在转矩轴周围的丝。内部输送机构件的横截面在形状上可以是大致圆形的或矩形的。图9A示出具有圆横截面的内部输送构件而图9B示出具有矩形横截面的内部输送构件。矩形横截面可增加输送器与导管主体的内表面之间的接触量,由此增加输送构件沿导管的长度移动堵塞物颗粒的能力。当切割器组件切割并且捕获闭塞性物质时(例如,当第一和/或第二切割元件的螺旋槽将被切割和捕获的闭塞性物质输送至输送构件时),输送构件可与转矩轴共同旋转以将其从切割器组件接收的被切割和捕获的闭塞性物质沿着导管主体进一步向后(朝近侧)输送至手柄中。例如,图10示出以上针对图5A和图5B描述的斑块切除设备(500)的变化形式通过该设备朝近侧输送和传送闭塞性物质(1700)。
由输送元件运回到手柄中的闭塞性物质可被传送至手柄内的排放通道中。与排放通道连通的传送推进器可联接至转矩轴以与转矩轴共同旋转,并且可用于将被切割、捕获和输送的闭塞性物质泵送至排放通道中。排放通道可包括外部联接器(例如,鲁尔连接器)以将排放通道联接至外部废物容器。被切割和捕获的闭塞性物质可被输送至废物容器中,并且可在不需要真空抽吸的情况下这样做。例如,如图10中所示,斑块切除设备(500)可包括传送推进器(544)、排放通道(546)和外部联接器(548),该外部联接器可连接至外部废物容器(1702),如刚刚所描述的。
在一些情况下,可期望沿导管主体输送生理盐水或另一种生物相容的流体以用于与切割器组件内的闭塞性物质混合。将流体与闭塞性物质混合可形成浆料,这可降低由斑块切除设备从血管切割、捕获并输送的物质的黏度。这可减小施加于切割器组件上的负荷并且利于将物质传送至废物容器。如图10中所示,斑块切除设备(500)可输送来自装置的远侧端部的流体(1704)。在一些变化形式中,流体(1704)可通过转矩轴(522)内的内部/导丝管腔输送。
可偏转的斑块切除系统和设备
在一些变化形式中,这里所描述的斑块切除系统可包括被配置成在其远侧端部处(例如,在切割器组件附近)选择性地动态偏转的斑块切除设备。例如,图11A至图11D示出包括手柄(1802)、导管主体(1804)和切割器组件(1806)的斑块切除设备(1800)的一个变化形式。这些元件可包括先前描述的特征中的任何特征。如将更详细地描述的,导管主体(1804)可被配置成在其远侧端部处(携带切割器组件(1806)的位置)相对于近侧导管主体(1804)的中心轴线动态地偏转,如图11C中所示。该偏转可在没有斑块切除设备的轴向前进的情况下发生。另外,斑块切除设备(1800)可被配置成在绕近侧导管主体(1804)的中心轴线偏转时旋转设备的远侧端部,以使切割器组件(1806)沿围绕中心轴线的弧(1808)扫掠,如图11D中所示。斑块切除设备(1800)的扫掠能力可允许切割器组件在比切割器组件的外径更大的区域中切割闭塞性物质,如以下将更详细地描述的。
斑块切除设备(1800)可以在包括导丝(1810)的斑块切除系统中使用,并且可从外部经皮进入部位引入血管中,如先前针对图4A至图4D所描述的。手柄(1802)可以按照先前所描述的方式确定尺寸并且被配置成由在血管内路径外的护理人员牢固地握持和操纵以使导管沿着血管内前进。图像引导(例如,CT、射线照相或引导机构,或其组合)可用来帮助护理人员的操纵。
图11A和图11B绘示出被配置成用于与这里所描述的斑块切除系统一起使用的斑块切除设备(2000)的变化形式。如图所示,斑块切除设备(2000)可包括手柄(2002)、导管组件(2004)和切割器组件(2006)。如图所示,切割器组件(2006)可包括套箍(2008)、切割器壳体(2010)、第一切割元件(2012)和第二切割元件(2014)。切割组件可具有如以上更详细地描述的任何元件或元件的组合。例如,切割器壳体(2010)、第一切割元件(2012)和第二切割元件(2014)可具有先前所描述的元件和尺寸中的任何元件和尺寸。在一些变化形式中,第一切割元件和第二切割元件可各自包括一个或多个螺旋切割槽,该一个或多个螺旋切割槽具有介于约60度与80度之间的前角、小于或等于10度(在这些变化形式的一些中,约0度)的前角、介于约30度与约0度之间的槽角以及介于约30与约60度之间的螺旋角。
图12A和图12B中还示出,斑块切除设备(2000)可进一步包括驱动马达(2016),在一些变化形式中该驱动马达可容纳在手柄(2002)的壳体(2018)中。还示出转矩轴(2020),该转矩轴可在转矩轴(2020)的近侧端部处通过齿轮装置联接至马达(2016),并且在转矩轴(2020)的远侧端部处联接至第二切割元件(2014)。转矩轴相对于切割组件旋转第一切割元件(2012)和第二切割元件(2014),如以上更详细地描述的。当切割器旋转时,它可切割闭塞性物质并将其输送至切割器壳体(2010)中,并且可在没有使用任何真空抽吸的情况下这样做。
切割器壳体(2010)可包括设置于其上或嵌置入其中的成像组件(2011)。成像组件(2011)可用来在用切割器(2012)粉碎之前、在粉碎期间和在粉碎之后获得闭塞物(粥样硬化、斑块、血栓或栓子)的实时图像,以观察操作的完成性或是否需要更多切割来完全地移除堵塞物或恢复适合的管腔开口。适合的成像组件包括光-声成像设备、血管内超声(IVUS)、前视血管内超声(FLIVUS)或光学相干断层扫描(OCT)。优选地,成像组件(2011)是基于超声的成像组件。超声成像组件可以是包括多个换能器元件的相控阵组件。成像组件(2011)可设置于/嵌置在壳体(2010)的一部分上。在某些实施例中,成像组件(2011)围绕壳体(314)外接。在其它实施例中,成像组件(2011)设置于导管组件(2032)上、在壳体(2010)的近侧。成像组件2011连接至一个或多个信号线(2013),该一个或多个信号线又连接至信号处理设备。信号线(2013)将能量传输至成像组件2011以发射成像信号(如超声或光学信号),并且将从成像组件接收的后信号(后回波)传输至信号处理设备和成像控制台。信号线(2011)可沿着导管组件(2036)的内表面的边延伸至信号处理设备,或信号线(2011)可并入导管组件(2036)中。在某些实施例中,导管组件(2036)可限定分离的管腔,信号线(2013)可通过该分离的管腔布设。
斑块切除设备(2000)可还进一步包括内部输送器(2024),该内部输送器可将闭塞性物质从切割器壳体(2010)沿着导管主体进一步向后(朝近侧)输送,以便排放至患者的身体外。在这些变化形式中,可不需要使用真空泵。
在下文中更详细地论述图11和图12中所示的系统的单独部件。
A.导管主体
1.概述
如先前提到的,斑块切除设备(2000)可包括导管组件(2004)。导管组件可具有任何适合的尺寸,如以上更详细地描述的。例如,在一些变化形式中,导管组件(2004)可具有小于或等于切割器组件(2006)的外径的外径。在这些变化形式的一些中,导管组件(2004)可具有小于切割器组件(2006)的外径的外径。在这些变化形式的一些中,切割器组件可具有2.4mm的外径,并且导管组件可具有2.2mm的外径。导管组件可被配置成平衡导管组件的柱刚度(推送性)、抗拉刚度(牵引性)、抗刚度(扭转性)和抗弯刚度(循行性),如以下更详细地描述的。
导管组件(2004)可包括外导管轴(2026)、内导管轴(2028)以及包括内扫掠管(2030)和外扫掠管(2032)的扫掠管组件。
2.外导管轴
外导管轴(2026)可以按照任何适合的方式形成。例如,外导管轴(2026)可由金属管(例如,304不锈钢管)形成。
外导管轴(2026)可具有任何适合的尺寸。例如,在一些变化形式中,可期望外导管轴(2026)由具有约2.2mm的外径、约0.288mm的壁厚和约1347mm(53.03英寸)的长度的管形成。
如先前所述,具有以上刚刚描述的尺寸中的一些或全部的金属管可提供高程度的推送性、牵引性和扭转性,在给定导管主体的长度时,基线抗弯刚度会限制导管主体的循行性。因此,在一些变化形式中,通过沿导管主体长度的至少一部分形成多个切割图案区,可沿着导管主体长度渐进地调整金属管的抗弯刚度。切割图案可用任何适合的方式(例如,经由激光切割)形成,且所述区可在导管主体的长度上带来期望的抗弯刚度分布。例如,切割图案区可用于从近侧端部至远侧端部以步进的方式渐进地减小抗弯刚度,以提供有利于在远侧端部处的循行性的最小抗弯刚度(在循行性更为期望时)。减小抗弯刚度的步进方式可按照有助于维持整体的推送性、牵引性和扭转性的方式来配置。
导管主体可具有任意数目的具有不同切割图案的区/区域(或在一些区中,完全不存在切割图案)。在某些实施例中,导管主体的一个或多个区包括螺旋形切割图案、螺纹形切割图案、螺线形切割图案或砌砖式切割图案。如以上提到的,外导管轴可用聚合物材料为衬里或护套,并且可被进一步处理以产生亲水性、疏水性或药物结合(肝素、抗菌剂)的特性。
3.扫掠管组件
如以上提到的,以上示于图12A和图12B中的导管组件(2004)可包括扫掠组件,该扫掠组件包括外扫掠管(2032)和内扫掠管(2030)。外扫掠管(2032)可在外扫掠管(2032)的近侧端部处连接至外导管轴(2026)的远侧端部(例如,经由联接器(2036)),并且可在外扫掠管(2032)的远侧端部处连接至切割器组件(2006)。
如以下将更详细地描述的,在外扫掠管(2032)内,内导管轴(2028)可联接至内扫掠管(2030)的近侧端部(例如经由内联接器(2038))。在远侧方向上滑动内导管轴(2028)可使内扫掠管(2030)优选地远离中心轴线弯曲,由此优选地朝向血管的侧壁偏转切割器组件。
(i)外扫掠管
外扫掠管(2032)可由金属管(例如,304不锈钢)形成。如以上提到的,外扫掠管(2032)可具有远侧扫掠部分(2034)和近侧柱部分(2036)。远侧扫掠部分(2034)和近侧柱部分(2036)可由单个管形成,或可单独地形成并且连接(例如,通过点焊)。远侧扫掠部分(2034)和近侧柱部分(2036)可具有任何适合的长度。在一些变化形式中,远侧扫掠部分(2034)可具有约0.450英寸的轴向长度,并且近侧柱部分(2036)可具有约0.400英寸的轴向长度。
在一些变化形式中,近侧柱部分(2036)可包括切割图案(如以上所描述的图案中的一个或多个)以降低近侧柱部分(2036)的抗弯刚度。在这些变化形式的一些中,近侧柱部分(2036)可包括具有约0.12英寸的节距的135°切割/45°未切割交错的砌砖式图案。这种双柱图案的高柔性可在外导管主体(2026)与外扫掠管(2032)的远侧扫掠部分(2034)之间提供柔性过渡。
相反地,远侧扫掠部分(2034)可被配置成在预定方向上赋予优选的弯曲性质。在一些变化形式中,远侧扫掠部分(2034)可包括闭合式互锁切口(其可被激光切割出)的图案。在图12A、图12B中所示的变化形式中,闭合式互锁切口(2038)可在围绕外扫掠管的大部分圆周(例如,350°)延伸的排中延伸,这可留下沿着远侧扫掠部分(2034)轴向地延伸的未切割材料形成的脊部(2040)(例如,约10°的未切割材料)。
在一些变化形式中,互锁切口(2038)可包括倒角式燕尾切口。
这些切口可提供从脊部(2040)延伸的多排材料。所述排(其均可具有0.25"的最大未切割长度)可通过约0.007英寸的倒角式燕尾切口(在67.4°)分离。互锁切口(2038)可具有任何数目的燕尾切口(例如,在每一排中沿着圆周的十二个燕尾切口)。在一些变化形式中,远侧扫掠部分(2034)可包括近侧未切割区域(邻近近侧柱部分(2036),其可在长度上为约0.01英寸)和远侧未切割区域(邻近切割器组件,其可在约0.025英寸至0.35英寸之间)。另外,在一些变化形式中,未切割材料形成的凸片(2042)可与脊部(2040)对准地延伸超过远侧端部,该凸片可形成外管对准键,如稍后将更详细地描述的。
如刚刚描述的闭合式互锁切口的激光形成图案可抵抗在除脊部(2040)的方向之外的任何方向上的弯曲。当施加弯曲力时,互锁切口打开以容许在脊部的方向上发生弯曲。可抵抗在任何其它方向上的弯曲力,因为互锁切口闭合以抵抗在这些方向上的弯曲。
(ii)内扫掠管
内扫掠管(2030)可由形成的金属管(例如,镍钛诺)制造。
内扫掠管(2030)可在外扫掠管(2032)内轴向地延伸并且可具有任何适合的尺寸。例如,在一些变化形式中,内扫掠管(2030)可具有约0.068英寸的外径和约0.058英寸的内径,并且可具有约0.700英寸±0.005英寸的总轴向长度。
在一些变化形式中,内扫掠管(2030)的基线抗弯刚度可以减小以在预定方向上赋予优选弯曲特性。在这些变化形式的一些中,可使用敞开式燕尾切口(2048)构成的图案产生优选弯曲。在图12A、图12B和图13A至图13D中所示的变化形式中,闭合的敞开式燕尾切口(2048)可围绕内扫掠管(2030)的大部分圆周(例如,350°)延伸,这可留下沿内扫掠管(2030)轴向地延伸的未切割材料(例如,约10°的未切口材料)形成的脊部(2050)。如图13A中所示,外扫掠管(2032)的脊部(2040)和内扫掠管(2030)的脊部(2050)可对准,使得脊部(2040)和脊部(2050)可定位在导管组件的相对侧上。
燕尾切口(2048)可具有任何适合的尺寸。例如,在一些变化形式中,燕尾切口(2048)各自沿内扫掠管(2030)的轴线延伸约0.55英寸,并且可包括任何数目的燕尾切口(2048)。在这些变化形式的一些中,内扫掠管(2030)可包括可沿脊部(2050)延伸约0.60"的八个燕尾切口。另外,在一些变化形式中,未切割材料形成的凸片(2052)可与脊部(2050)对准地延伸超过远侧端部,该凸片可形成内管对准键,如稍后将更详细地描述的。
如刚刚描述的敞开式切口的激光形成图案容许在敞开式切口的方向上远离脊部的优选弯曲,直到敞开式切口靠拢并且从远侧至近侧连续地干涉。当弯曲力施加至那里时,敞开式切口可容许弯曲,但当弯曲继续时,由于切口闭合和干涉而可以抵抗弯曲。预形成的弯曲半径可由此构建在内扫掠管中。
内扫掠管插入外扫掠管中,并且可使内对准凸片(2052)和外对准凸片(2042)配准(参见图13A和图13B)。旋转对准的内凸片(2052)和外凸片(2042)可配合至套箍(2008)上的对准键(2054)中(如图13B中所示)。这种配合可确保内扫掠管和外扫掠管能适当地对准,并且还可用于防止内扫掠管与外扫掠管之间的相对旋转。在一些变化形式中,内扫掠管和外扫掠管可固定至套箍的近侧端部(例如,通过焊接)。如以上提到的(并且如图13A中所示),当内凸片(2052)和外凸片(2042)旋转对准时,外扫掠管(2042)的脊部可与内扫掠管(2030)的敞开式切口(2048)轴向地对准(即,内扫掠管(2030)的脊部(2050)可与外扫掠管(2032)的脊部(2040)旋转地间隔180°)。
如图13A还示出,内扫掠管(2030)的近侧端部可包括与敞开式燕尾切口的图案成一角度(例如,约90°)面对的敞开式靴状区域(2054)。敞开式靴状区域(2054)可被确定尺寸并且被配置成接收内导管轴的远侧端部。内导管轴可将弯曲力施加至偏转组件,如稍后将更详细地描述的。
(iii)内导管轴
图12A和图12B中所示的斑块切除设备(2000)的内导管轴(2028)可以按照与先前描述的导管主体中的任何导管主体(例如,如以上所描述的导管主体)大体上相同的方式确定尺寸并且进行配置和制造。例如,内导管轴(2028)可由金属管(例如,304不锈钢管)形成,并且可具有适合于允许内导管轴(2028)配合在外导管轴内并且适应转矩轴和输送器元件在其中通过的尺寸。将描述代表性实施例。
这种材料和配置形成的管将提供基线柱刚度、抗拉刚度、抗扭刚度和抗弯刚度。在一些变化形式中,通过沿导管主体长度的至少一部分形成切割图案区,可沿导管主体长度渐进地调整金属管的抗弯刚度。切割图案可以按照任何适合的方式(例如,经由激光切割)形成,并且所述区可在导管主体的长度上赋予期望的抗弯刚度分布。例如,切割图案区可用于从近侧端部至远侧端部以步进的方式渐进地降低抗弯刚度,以提供有益于在远侧端部处的循行性的最小抗弯刚度(在循行性更为期望时)。降低抗弯刚度的步进方式可以按照有助于维持整体的推送性、牵引性和扭转性的方式进行配置。
在一些情况下,在内导管轴与外导管轴之间可存在间隙,使得冲洗流体可被输送至切割器组件,以便与切割器组件内的闭塞性物质混合。将流体与闭塞性物质混合可形成浆料,这可减小由斑块切除设备从血管切割、捕获并输送的物质的黏度,以减小施加于切割器组件上的负荷并且利于将物质传送至废物容器,如先前已描述的。增加的间隙可提供更大量的流体到达切割器组件,这继而可改善远离长的整个闭塞物的闭塞性物质的机械输送,由此降低切割器过载和失速的可能性。
(iv)偏转和扫掠机构
内导管轴的远侧端部可联接至内扫掠管,并且可控制导管组件的偏转。例如,在以上针对图12A、图12B、图13A和图13B所描述的斑块切除设备(2000)的变化形式中,内联接器(2038)可经由靴状区域(2054)将内导管轴(2028)连接至内扫掠管(2030)。一般来讲,内联接器(2038)可以以下述方式将内导管轴(2028)连接至靴状区域(2054),即,将轴向压缩或拉力传递至内扫掠管(2030),但是适应内导管轴(2028)与内扫掠管(2028)之间的相对旋转(即,当外导管轴被旋转以旋转内扫掠管及外扫掠管时,内导管轴不旋转)。
在内导管轴的直径减小以增加内导管轴与外导管轴之间的间隙尺寸(如先前所描述的,以适应更大的流体量)的情形中,联接套筒可被确定尺寸成在其联接至内扫掠套筒的敞开式靴处局部地逐步增加减小直径的内导管轴的远侧直径(即,当内导管轴缩小尺寸时,内扫掠管不需要缩小尺寸),但应理解的是,在一些情况下这些部件的直径可以是相同的。
内导管轴的近侧端部可联接至手柄(2002)上的控制旋钮(2056)。控制旋钮(2056)可轴向地(朝远侧)前进,以使内导管轴(2028)前进而抵靠内扫掠管(2030),以借此将沿内导管轴(2028)的压缩力(如由图13D中的箭头(2058)所示)施加至内扫掠管(2030)。通过套箍(2008)限制轴向前进,内扫掠管可响应于在敞开式切口区域的方向上所施加的压缩力而优选地偏转(如由图13D中的箭头(2060)所示)。同样地,控制旋钮可轴向地(朝近侧)缩回以减小压缩力并且将拉力施加至内扫掠管,以拉直可偏转组件,如图13C中所示。
如图13C和图13D中所示,在内扫掠管的脊部与外扫掠管的脊部相对对准的情况下,内扫掠管的优选弯曲性质(在敞开式切口的方向上)可与同心的外扫掠管的优选弯曲性质(在脊部的方向上,远离闭合式切口)统一。内扫掠管可响应于由内导管轴的轴向前进施加的弯曲力而渐进地弯曲,这可使内扫掠管的敞开式切口闭合并且首先在远侧端部处干涉,接着是沿着内扫掠管长度的近侧切口的闭合和干涉。当内扫掠管渐进地弯曲时,这可形成渐进的远侧至近侧的堆叠图案,直到内扫掠管上所有切口闭合和干涉以限定全弯曲半径(其在一些变化形式中可为约1°)。外扫掠管可与内扫掠管一致弯曲,这可打开远侧至近侧的堆叠图案中闭合的切口。内扫掠管和外扫掠管可在优选弯曲的方向上引导所施加的弯曲力,并且对于给定角单位的偏转而言可以需要较小的弯曲力。此外,内扫掠管的切口形成的相继的远侧至近侧的堆叠和外扫掠管的切口的打开可导致产生施加至切割器组件的均匀的柱刚度,而与偏转的程度无关。
当偏转时,导管组件可将并置力施加于切割器组件上,这可在切割器组件(在导管的端部处偏转)以期望的攻角(如图19B和图19C所示)接触闭塞性物质时,通过外导管组件抵靠相对血管壁的相对接触产生。内扫掠管和外扫掠管在优选弯曲期间的一致合作可增加并置力的量值,并且在导丝上前进期间可改善循行性并避免创伤。
在一些变化形式中,外导管轴可联接至手柄上的柱,该柱可被确定尺寸并且被配置成响应于控制旋钮(2056)的旋转而旋转。当控制旋钮(2056)轴向前进而将压缩力施加至内导管轴以偏转切割器组件时(如以上更详细地描述的),控制旋钮(2056)的旋转可将转矩施加至外导管轴以旋转切割器组件。切割器组件可在血管内沿弧扫掠,以清除大于切割器组件的外径的直径的闭塞性物质。也能通过旋转手柄自身将转矩施加至外导管轴。切割器组件的选择性旋转因此可通过控制旋钮的操纵和手柄扭转的组合而精细地控制。
可设置分度机构,以利用触觉和/或听觉反馈提供对偏转和/或扫掠的步进式控制,使得用户可维持对旋转的知晓。
(v)被动和主动转向
可循行、可偏转的导管组件的增强的优选弯曲性质可提供使斑块切除设备穿过扭曲的血管内解剖结构而主动地和被动地转向的能力。图14A至图14F(5)绘示出以上针对图12A和图12B所描述的斑块切除设备(2000)可在血管内主动地和被动地转向的方式。
主动转向可通过使内导管轴前进以弯曲远侧导管组件来实现,伴随着导管组件的旋转,从而在有或没有导丝的情况下使切割器组件指向通过血管内路径的优选方向和/或在并置的情况下使切割器组件朝向血管的侧壁指向,以切割和捕获闭塞性物质。例如,斑块切除设备(2000)的切割器组件(2006)可前进至血管(1902)中的闭塞性物质(1900)中,如图14A中所示。当在血管中处于适当位置时,导管组件(2004)可如图14B中所示偏转。偏转的导管组件(2004)被旋转以使切割器组件(2006)扫掠,如图14C和图14D中所示。这种扫掠可使切割器组件沿大于切割器组件的外径的弧移动。在一些变化形式中,切割器组件(2006)可在切割器组件的直径(如图14E中所示的Dl)的至少两倍的直径(如图14E中所示的D2)中切割。在其它变化形式中,切割器组件(2006)可在切割器组件的直径的至少三倍的直径(如图14E中所示的D3)中切割。在另外的其它变化形式中,切割器组件(2006)可在切割器组件的直径的至少四倍的直径(如图14E中所示的D4)中切割。
当切割器组件(2006)遇到血管内路径中的弯曲时,被动转向可在没有内导管轴前进的情况下实现(参见图14F-1)。一旦切割器组件靠近或接触弯曲,护理人员可将外导管主体(和因此偏转的导管组件)旋转至优选偏转方向背对弯曲的内半径的取向中(参见图14F-2和图14F-3)。在代表性实施例中,该取向可使套箍上的对准键(2054)背对弯曲的内半径(如图14F-3中可看出)。由于导管组件在处于该取向时的优选弯曲性质,在没有内导管轴的同时前进的情况下外导管轴的后续前进可施加足够的压缩力以导致导管组件在优选方向上(即,远离弯曲的内半径)偏转。导管主体上的压缩力的继续可使导管主体沿着被动偏转的导管组件远离弯曲的内半径并且进入弯曲自身中(参见图14F-3和图14F-4)。
通过在每一相继的弯曲处旋转导管主体(例如,通过旋转控制旋钮或通过手柄自身的旋转)以将导管组件的优选偏转定向成远离相应的内弯曲半径,并且在不需要通过内导管轴的操纵而主动地转向的情况下,可以以相同的被动方式实现在扭曲路径中相继弯曲的导航。
在一些变化形式中,导管组件(2004)可包括一个或多个射线照相标记以在射线照相引导期间、在没有使观察者的眼睛离开射线照相图像的情况下指示导管组件的优选弯曲方向的取向,向左、或向右、或朝向观察者、或远离观察者。
图15A和图15B绘示出这里所描述的斑块切除设备(1600)的另一个变化形式。如图所示,斑块切除设备(1600)可包括第一导管(1602)、第二导管(1604)和附接至第一导管(1602)的切割器组件(1605)。第一导管(1602)能够相对于第二导管(1604)移动,以使斑块切除设备(1600)的远侧部分在未偏转配置(如图15A中所示)与偏转配置(如图15B中所示)之间移动。在图15A和图15B中所示的斑块切除设备(1600)的变化形式中,第一导管(1602)能够在第二导管(1604)内移动,但应理解的是,在其它变化形式中第二导管(1604)可以是能够在第一导管(1602)内滑动。
一般来讲,第二导管(1604)的远侧部分(1606)可被成形以呈现如图15B中所示的偏转位置。具体而言,偏转的远侧部分(1606)可包括具有第一近侧曲线(1608)和第二远侧曲线(1610)的双曲线。如图所示,第一曲线(1608)可使远侧部分(1606)远离第二导管(1604)的近侧部分的纵向轴线(1612)弯曲,而第二曲线(1610)可使远侧部分(1606)在朝着纵向轴线(1612)的方向上弯曲。远侧部分(1606)的双曲线配置可允许第二曲线(1610)接触或以其它方式抵靠血管(1616)的壁(1614),如图15B中所示。另外,这可在切割期间使切割器组件(1605)朝向相对的血管壁(1618)成角度。在斑块切除设备(1600)如图15B中所示在导丝(1620)上前进时的情况下,导丝(1620)可接触相对的血管壁(1618)并且可帮助防止切割器组件(1605)直接接触和/或损伤血管壁(1618)。在一些情况下,远侧部分(1606)的双曲线配置可允许远侧部分(1606)在偏转时前进,同时最小化切割器组件(1605)可能挂在组织上并且反折的风险。
如以上提到的,第一导管(1602)可相对于第二导管(1604)移动以在偏转配置与未偏转配置之间移动斑块切除设备。具体而言,第一导管(1602)可包括远侧部分(1622)和近侧部分(未示出),其中远侧部分(1622)比近侧部分柔性更大。另外,第一导管(1602)的远侧部分(1622)可比第二导管(1604)的远侧部分(1606)柔性更大,而第一导管(1602)的近侧部分可比第二导管(1604)的远侧部分(1606)刚性更大。因此,第一导管(1602)可前进,使得第一导管(1602)的柔性的远侧部分(1622)延伸超过第二导管(1604)的远侧端部,这可使第一导管(1602)的近侧部分在第二导管(1604)的远侧部分(1606)内(或在第二导管(1604)定位在第一导管(1602)内的变化形式中在第二导管(1604)的远侧部分(1606)周围)。因为第一导管(1602)的近侧部分比第二导管(1604)的远侧部分刚性更大,所以这些导管区段的轴向对准可使第一导管(1602)的近侧部分拉直第二导管(1604)的远侧部分的曲线,由此将斑块切除设备(1600)放置在未偏转配置中,如图15A中所示。因为当处于未偏转配置中时第一导管(1602)的柔性的远侧部分延伸超过第二导管(1604)的远侧部分,所以它可用于在斑块切除设备(1600)通过血管系统的导航期间使切割器组件(1605)沿着导丝循行。另外,斑块切除设备(1600)可在切割时前进以沿导丝的路径切割(该路径在一些情况下可以是直线路径),如以下更详细地描述的。斑块切除设备(1600)随后可缩回并且偏转以切割穿过闭塞性物质(未示出)的更大路径,如以下所描述的。
为了将斑块切除设备移动至偏转配置,第一导管(1602)可缩回以将第一导管(1602)的柔性的远侧部分(1622)置于与第二导管(1604)的远侧部分(1606)轴向对准。因为第二导管(1604)的远侧部分(1606)比第一导管(1602)的远侧部分(1622)刚性更大,所以第二导管(1604)可使第一导管(1602)的柔性的远侧部分(1622)呈现以上针对图15B所描述的双曲线配置。
与斑块切除装置一起使用的成像组件
本发明的斑块切除系统包括被设置成用于闭塞物的引导切割和移除的成像组件(例如,311、511、2011)。成像组件可以是超声成像组件、声光成像组件、光学相干断层扫描成像组件或其组合。在进一步的实施例中,本发明的系统包括描述于W02014/109879中的聚焦声学计算机断层扫描术(FACT)。
成像组件可以是血管内超声(IVUS)成像组件。超声探针可以是旋转换能器或沿圆周定位的换能器阵列。导管的近侧端部附接至计算机化成像控制台。IVUS成像元件(即超声探针)包括利用超声能量(例如,20-50MHz的范围)对组织进行成像的换能器和收集返回的能量(回波)以产生血管内图像的图像收集器。成像换能器和成像收集器联接至信号线路,该信号线路沿导管的长度延伸并且联接至计算机化超声设备。
IVUS成像组件产生超声能量并且接收回波,其中从回波中产生血管的薄片段的实时超声图像。成像元件的成像换能器由在20-50MHz下产生声能量的压电部件构造。成像元件的图像收集器包括接收从血管系统反射的超声能量的分离的压电元件。
成像组件的替代性实施例可使用相同的压电部件来产生并且接收超声能量,例如,通过使用脉冲超声。也就是说,成像换能器和成像收集器是相同的。另一个替代性实施例可包括超声吸收材料和超声透镜以增加信噪比。
IVUS数据通常汇集在区段内,每个区段表示IVUS图像的一个角部分。因此,需要使用多个区段(或一组IVUS数据)来对血管对象的整个横截面进行成像。此外,多组IVUS数据通常是从血管对象内的多个位置采集的(例如,通过线性地移动换能器通过血管)。这些多组数据随后可被用来形成多个二维(2D)图像或一个三维(3D)图像。
IVUS成像组件和IVUS数据的处理在例如以下文献中进一步详细描述:Yock,美国专利No.4,794,931、No.5,000,185和No.5,313,949;Sieben等人,美国专利No.5,243,988和No.5,353,798;Crowley等人,美国专利No.4,951,677;Pomeranz,美国专利No.5,095,911;Griffith等人,美国专利No.4,841,977;Maroney等人,美国专利No.5,373,849;Born等人,美国专利No.5,176,141;Lancee等人,美国专利No.5,240,003;Lancee等人,美国专利No.5,375,602;Gardineer等人,美国专利No.5,373,845;Seward等人,梅奥诊所论文集71(7):629-635(1996);Packer等人,Cardiostim Conference 833(1994),"UltrasoundCardioscopy,"Eur.J.C.P.E.4(2):193(1994年6月);Eberle等人,美国专利No.5,453,575;Eberle等人,美国专利No.5,368,037;Eberle等人,美国专利No.5,183,048;Eberle等人,美国专利No.5,167,233;Eberle等人,美国专利No.4,917,097;Eberle等人,美国专利No.5,135,486,美国公开文件2009/0284332;美国公开文件2009/0195514 Al;美国公开文件2007/0232933;和美国公开文件2005/0249391以及与管腔内超声装置和模态有关的领域中公知的其它参考文献。
OCT是使用小型近红外光发射探针的医学成像方法。作为一种光学信号获取和处理方法,它从光学散射介质(例如,生物组织)内捕获微米分辨率的三维图像。最近,它也已经开始用于介入心脏病学中,以帮助诊断冠状动脉疾病。OCT允许应用干涉测量技术以例如从血管内观察,从而可视化生命个体中的血管的内皮(内壁)。
OCT系统和方法大体上描述在以下文献中:Castella等人,美国专利No.8,108,030;Milner等人,美国专利申请公开文件No.2011/0152771;Condit等人,美国专利申请公开文件No.2010/0220334;Castella等人,美国专利申请公开文件No.2009/0043191;Milner等人,美国专利申请公开文件No.2008/0291463;和Kemp,N.,美国专利申请公开文件No.2008/0180683,以上文献中的每一个的内容通过引用的方式整体地并入。
在OCT中,光源将光束输送至成像装置以对目标组织进行成像。光源可包括脉动光源或激光、连续波光源或激光、可调谐激光、宽频带光源或多个可调谐激光。在光源内是光学放大器和可调谐滤波器,该可调谐滤波器允许用户选择待放大的光的波长。在医学应用中常用的波长包括近红外光,例如在约800nm和约1700nm之间。
本发明的若干方面可从OCT系统获得成像数据,包括在时域或频(高清晰度)域中操作的OCT系统。时域OCT与频域OCT之间的基本差异在于,在时域OCT中,扫描机构是在图像获取期间根据时间进行扫描的可移动的少数件。然而,在频域OCT中,不存在移动部件,并且图像是根据频率或波长进行扫描的。
在时域OCT系统中,通过纵向地移动如参考反射镜的扫描机构来改变参考路径并且匹配因样本内的反射所致的多个光学路径来获得干涉光谱。给定反射率的信号随时间推移而进行取样,并且在具体距离处行进的光在检测器中产生干涉。扫描机构横跨样本侧向地(或旋转地)移动产生二维图像和三维图像。在频域OCT中,能够发射一定范围的光学频率的光源激发干涉仪,该干涉仪将从样本返回的光与来自同一源的参考光束组合,并且组合光的强度被记录为光学频率的函数以形成干涉光谱。干涉光谱的傅里叶变换提供沿样本内的深度的反射率分布。
频域OCT的若干方法在文献中描述。在有时也称为“光谱雷达”(Optics letters,第21卷,第14期(1996)1087-l089)的光谱域OCT(SD-OCT)中,光栅或棱镜或其它装置被用于将干涉仪的输出分散到其光学频率部件中。这些分离部件的强度使用光学检测器阵列进行测量,每一检测器接收光学频率或一小部分范围的光学频率。来自这些光学检测器的一组测量结果形成干涉光谱(Smith,L.M.和C.C.Dobson,Applied Optics 28:3339-3342),其中到散射器的距离由功率谱内的依赖波长的条纹间隔确定。SD-OCT已能通过分析光学检测器阵列的单个曝光量来确定沿照射轴线设置的多个散射器的距离和散射强度,使得在深度上不必进行扫描。
通常,光源同时发射宽范围的光学频率。
替代地,在扫掠源OCT中,通过使用具有可调光学频率的源(该源的光学频率扫掠过一定范围的光学频率,和在扫掠期间根据时间记录干涉光的强度来记录干涉光谱。扫掠源OCT的一个示例被描述于美国专利No.5,321,501中。
一般来讲,时域系统和频域系统可基于系统的光学布局在类型上进一步变化:公用射束路径系统和差分射束路径系统。公用射束路径系统通过单个光纤发送所有产生的光以生成参考信号和样本信号,而差分射束路径系统分裂产生的光,使得光的一部分指向样本而另一部分指向参考表面。公用射束路径系统描述于美国专利7,999,938;美国专利7,995,210;和美国专利7,787,127中,并且差分射束路径系统描述于美国专利7,783,337;美国专利6,134,003;和美国专利6,421,l64中,以上美国专利中的每一个的内容通过引用的方式整体地并入。
根据本发明的某些方面,来自本文所描述的斑块切除系统的成像组件的所获得的图像数据被处理,以表征血管内的生物物质和/或外来物质(即,闭塞物)。表征允许人们具体地确定血管内的闭塞物的类型(例如,斑块或凝块)和闭塞物的严重性,例如,闭塞物是钙化的、纤维的或软的。处理步骤可通过经由信号线可操作地连接至成像组件的图像处理计算机来执行。
现在参照图16,斑块切除系统10可联接至系统控制器600并且通过该系统控制器协调。系统控制器1600可控制成像的时序、持续时间和量。根据某些实施例,系统控制器1600可还控制转矩轴(和联接至该转矩轴的切割元件)的旋转,并且可还控制导管主体(和联接至该导管主体的成像组件和壳体)的旋转。如图17中所示,系统控制器1600另外与图像处理计算机1060连接。根据某些实施例,图像处理计算机1060的处理器1065执行组织/血液的表征,由此允许所观察和评估的图像是用于限定堵塞物的完全处理和分解的参数的基础。系统1000还包括显示器1620和用户接口,该用户接口允许用户例如外科医生与图像(包括组织表征)交互并且控制处理的参数。
如图16中所示,系统控制器1600连接至能够将图像合成为容易理解的图像的图像处理计算机1060。图像处理计算机1060还被配置成分析所收集的数据的光谱以确定组织特性,也称为虚拟组织学成像。如以下更详细地论述的,图像处理将展开反射声波或干扰红外波以产生距离和/或组织测量值,并且那些距离和组织测量值可用来产生图像,例如IVUS图像或OCT图像。流量检测和组织表征算法包括运动检测算法(如CHROMAFLO(IVUS流体流量显示软件;Volcano Corporation)、Q-流量、B-流量、Delta-Phase、多普勒、功率多普勒等)、时间算法、谐波信号处理,可被用于区分血液斑点与其它结构组织,并且因此增强其中在从血液向后散射的超声能量导致产生图像伪影的图像。
在某些实施例中,图像处理可另外包括光谱分析,即,检查在各种频率下返回的声信号的能量。光谱分析对于确定组织性质和外来对象的存在是有用的。斑块沉积物或新生内膜增生物例如将通常相较于没有这种斑块或新生内膜增生物的附近血管组织具有不同的光谱信号,从而允许在健康组织与患病组织之间进行区分。另外,如AV移植物的金属表面将具有不同的光谱信号。这种信号处理可另外包括时域中的返回超声信号的统计处理(例如,平均、过滤等)。光谱分析也可被用于确定组织管腔/血液的边界。
还可应用组织表征领域中已知的其它信号处理技术。通过在血管内的以上提到的特征之间进行区分,人们能够在不破坏周围血管组织的情况下小心地溶解堵塞物。
其它图像处理可利于使用所关注特征的图像或识别。例如,管腔的边界可被突出,或者血栓或斑块沉积物可以相较于图像的其它部分在视觉上不同的方式(例如,通过为血栓指定可辨别的色彩)显示。也可应用成像领域中已知的其它图象增强技术。在另一示例中,类似的技术可被用于在易患病斑块与其它斑块之间进行区分,或通过提供视觉指示符来增强所显示的图像以辅助用户在易患病斑块与其它斑块之间进行区分。如流动速率或压力的其它测量值可使用色彩映射或通过显示数字值来显示。在一些实施例中,管腔的开放的横截面区域用红色着色以表示血液通量。因此,通过使用虚拟组织学成像(光谱分析),本发明的方法允许人们在治疗前、治疗期间和治疗后评估堵塞物。
除以上公开的系统之外,使用虚拟组织学成像检测和表征斑块和生物组织的以下系统公开于以下专利中:2001年3月13日公告的名称为“血管斑块表征(VASCULAR PLAQUECHARACTERIZATION)”的美国专利No.6,200,268、2002年4月30日公告的名称为“使用主动轮廓方法和系统进行血管内超声分析(INTRAVASCULAR ULTRASONIC ANALYSIS USING ACTIVECONTOUR METHOD AND SYSTEM)”的美国专利No.6,381,350、2006年7月11日公告的名称为“表征血管组织的系统和方法(SYSTEM AND METHOD OF CHARACTERIZING VASCULARTISSUE)”的美国专利No.7,074,188、2007年2月13日公告的名称为“无创式组织表征系统和方法(NON-INVASIVE TISSUE CHARACTERIZATION SYSTEM AND METHOD)”的美国专利No.7,175,597、2007年5月8日公告的名称为“用于血管边界检测的系统和方法(SYSTEM ANDMETHOD FOR VASCULAR BORDER DETECTION)”的美国专利No.7,215,802、2008年4月15日公告的名称为“用于识别血管边界的系统和方法(SYSTEM AND METHOD FOR IDENTIFYING AVASCULAR BORDER)”的美国专利No.7,359,554,和2008年12月9日公告的名称为“用于血管边界检测的系统和方法(SYSTEM AND METHOD FOR VASCULAR BORDER DETECTION)”的美国专利No.7,463,759。
以引用方式并入
在本公开内容中已参考并引用了其它文档,比如专利、专利申请、专利公开文件、杂志、书籍、论文、网页内容。所有这些文档均出于各种目的以全文引用的方式并入本文中。
等同方案
根据本文档的全部内容,包括对本文引用的科学和专利文献的参考,除了本文示出和描述的那些实施例之外,本发明的诸多修改形式及其诸多进一步的实施例对本领域的技术人员来说将是明显的。本文的主题包含可适用于在其各种实施例及其等同方案中实现本发明的重要信息、示例和指导。
Claims (13)
1.一种用于切割和移除闭塞性物质的设备,所述设备包括:
导管主体,所述导管主体限定管腔并且包括限定开口的远侧部分;
可旋转轴,所述可旋转轴设置在所述导管主体的所述管腔内,其中所述可旋转轴包括输送部件;
切割元件,所述切割元件可操作地联接至所述可旋转轴并且被配置成通过旋转移除闭塞性物质,其中所述切割元件至少部分地由所述远侧部分围绕;
成像元件,所述成像元件设置于所述远侧部分上,其中所述远侧部分是壳体且所述成像元件围绕所述壳体外接;且
其中,所述导管主体被联接至旋转驱动轴,所述导管主体和所述壳体与所述成像元件一起由此被配置成旋转,其中所述可旋转轴和所述旋转驱动轴被配置成使得所述导管主体和所述壳体的旋转相对于所述可旋转轴的旋转处于相反的方向。
2.根据权利要求1所述的设备,其中,所述成像元件包括超声换能器。
3.根据权利要求1所述的设备,其中,所述成像元件被配置成用于提供用于光学相干断层扫描术(OCT)的测量结果。
4.根据权利要求2所述的设备,其中,所述超声换能器是相控阵换能器。
5.根据权利要求2所述的设备,其中,所述超声换能器被配置成在位于所述超声换能器的远侧的平面中成像。
6.根据权利要求书1至3中的任一项所述的设备,其中,所述设备进一步包括至少一个其它切割元件。
7.根据权利要求1至3中的任一项所述的设备,其中,所述切割元件包括至少两个螺旋槽。
8.根据权利要求1至3中的任一项所述的设备,其中,所述切割元件包括至少一个压碎元件。
9.根据权利要求8所述的设备,其中,所述压碎元件是大致矩形的,并且包括负前角。
10.根据权利要求1至3中的任一项所述的设备,其中,所述设备进一步包括排放元件,所述排放元件与所述导管主体可操作地相关联,所述排放元件被配置成接收由所述切割元件粉碎的闭塞性物质。
11.根据权利要求1至3中的任一项所述的设备,其中,所述输送部件包括缠绕在所述可旋转轴周围的螺旋丝。
12.一种提供成像能力的斑块切除系统,包括:
-根据权利要求1至11中的任一项所述的用于切割和移除闭塞性物质的设备;
-联接至所述设备的系统控制器;
-被配置成用于图像处理的处理计算机,
其中,由围绕壳体外接的成像元件提供的图像被通过所述处理计算机进行处理。
13.根据权利要求12所述的系统,其中,所述计算机被配置成处理由所述成像元件提供的所述图像,以便表征组织以区分易患病斑块。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562118585P | 2015-02-20 | 2015-02-20 | |
| US62/118,585 | 2015-02-20 | ||
| PCT/IB2016/050448 WO2016132241A1 (en) | 2015-02-20 | 2016-01-29 | Atherectomy apparatus with imaging |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN107530049A CN107530049A (zh) | 2018-01-02 |
| CN107530049B true CN107530049B (zh) | 2021-06-04 |
Family
ID=55299699
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201680022621.7A Active CN107530049B (zh) | 2015-02-20 | 2016-01-29 | 支持成像的斑块切除设备 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20160242808A1 (zh) |
| EP (1) | EP3258863B1 (zh) |
| JP (1) | JP6772161B2 (zh) |
| CN (1) | CN107530049B (zh) |
| WO (1) | WO2016132241A1 (zh) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11813485B2 (en) | 2020-01-28 | 2023-11-14 | The Regents Of The University Of Michigan | Systems and methods for histotripsy immunosensitization |
| US11813484B2 (en) | 2018-11-28 | 2023-11-14 | Histosonics, Inc. | Histotripsy systems and methods |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2948135T3 (es) | 2015-06-24 | 2023-08-31 | Univ Michigan Regents | Sistemas de terapia de histotripsia para el tratamiento del tejido cerebral |
| EP3508148B1 (en) * | 2016-08-30 | 2021-06-30 | Terumo Kabushiki Kaisha | Medical device |
| CN109715092B (zh) | 2016-09-16 | 2021-07-09 | 泰尔茂株式会社 | 医疗器械 |
| US20180311508A1 (en) * | 2017-03-02 | 2018-11-01 | Circuit Therapeutics, Inc. | System for optogenetic therapy |
| US10987131B2 (en) | 2017-05-25 | 2021-04-27 | Coopersurgical, Inc. | Tissue containment systems and related methods |
| JP7296945B2 (ja) * | 2018-03-28 | 2023-06-23 | テルモ株式会社 | 医療デバイス |
| US20210386451A1 (en) * | 2018-11-01 | 2021-12-16 | Koninklijke Philips N.V. | Atherectomy devices including pre-shaped and curved distal portions and methods |
| EP3908194A1 (en) * | 2019-01-07 | 2021-11-17 | Koninklijke Philips N.V. | Increased flexibility substrate for intraluminal ultrasound imaging assembly |
| JP2022517641A (ja) * | 2019-01-21 | 2022-03-09 | コーニンクレッカ フィリップス エヌ ヴェ | 血管内撮像能力を含む血管治療システム及び装置 |
| US20220211409A1 (en) * | 2019-05-17 | 2022-07-07 | Koninklijke Philips N.V. | Atherectomy devices including positive and negative rake angle cutting blades |
| CN114222536A (zh) * | 2019-06-18 | 2022-03-22 | 皇家飞利浦有限公司 | 包括多个远侧切割特征的斑块切除装置 |
| CN113017780B (zh) * | 2021-03-02 | 2022-03-08 | 哈尔滨医科大学 | 一种集成超声成像与腔内斑块旋切术的导管系统 |
| CN115429392A (zh) * | 2022-10-08 | 2022-12-06 | 福州大学 | 基于超声反馈的血管钙化组织识别及去除装置和使用方法 |
Family Cites Families (59)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5000185A (en) | 1986-02-28 | 1991-03-19 | Cardiovascular Imaging Systems, Inc. | Method for intravascular two-dimensional ultrasonography and recanalization |
| US4794931A (en) | 1986-02-28 | 1989-01-03 | Cardiovascular Imaging Systems, Inc. | Catheter apparatus, system and method for intravascular two-dimensional ultrasonography |
| US4841977A (en) | 1987-05-26 | 1989-06-27 | Inter Therapy, Inc. | Ultra-thin acoustic transducer and balloon catheter using same in imaging array subassembly |
| US4917097A (en) | 1987-10-27 | 1990-04-17 | Endosonics Corporation | Apparatus and method for imaging small cavities |
| US4951677A (en) | 1988-03-21 | 1990-08-28 | Prutech Research And Development Partnership Ii | Acoustic imaging catheter and the like |
| NL8902559A (nl) | 1989-10-16 | 1991-05-16 | Du Med Bv | Intra-luminale inrichting. |
| US5240003A (en) | 1989-10-16 | 1993-08-31 | Du-Med B.V. | Ultrasonic instrument with a micro motor having stator coils on a flexible circuit board |
| US5095911A (en) | 1990-05-18 | 1992-03-17 | Cardiovascular Imaging Systems, Inc. | Guidewire with imaging capability |
| US5135486A (en) | 1990-08-31 | 1992-08-04 | Endosonics Corporation | Self-venting balloon dilitation catheter |
| US5167233A (en) | 1991-01-07 | 1992-12-01 | Endosonics Corporation | Dilating and imaging apparatus |
| US5243988A (en) | 1991-03-13 | 1993-09-14 | Scimed Life Systems, Inc. | Intravascular imaging apparatus and methods for use and manufacture |
| US5353798A (en) | 1991-03-13 | 1994-10-11 | Scimed Life Systems, Incorporated | Intravascular imaging apparatus and methods for use and manufacture |
| US6111645A (en) | 1991-04-29 | 2000-08-29 | Massachusetts Institute Of Technology | Grating based phase control optical delay line |
| WO1992019930A1 (en) | 1991-04-29 | 1992-11-12 | Massachusetts Institute Of Technology | Method and apparatus for optical imaging and measurement |
| US6134003A (en) | 1991-04-29 | 2000-10-17 | Massachusetts Institute Of Technology | Method and apparatus for performing optical measurements using a fiber optic imaging guidewire, catheter or endoscope |
| US5183048A (en) | 1991-06-24 | 1993-02-02 | Endosonics Corporation | Method and apparatus for removing artifacts from an ultrasonically generated image of a small cavity |
| US5373845A (en) | 1992-05-22 | 1994-12-20 | Echo Cath, Ltd. | Apparatus and method for forward looking volume imaging |
| US5373849A (en) | 1993-01-19 | 1994-12-20 | Cardiovascular Imaging Systems, Inc. | Forward viewing imaging catheter |
| US5368037A (en) | 1993-02-01 | 1994-11-29 | Endosonics Corporation | Ultrasound catheter |
| US5453575A (en) | 1993-02-01 | 1995-09-26 | Endosonics Corporation | Apparatus and method for detecting blood flow in intravascular ultrasonic imaging |
| US6381350B1 (en) | 1999-07-02 | 2002-04-30 | The Cleveland Clinic Foundation | Intravascular ultrasonic analysis using active contour method and system |
| WO2001015609A1 (en) * | 1999-08-31 | 2001-03-08 | Fox Hollow Technologies | Atherectomy catheter with a rotating and telescoping cutter |
| US6200268B1 (en) | 1999-09-10 | 2001-03-13 | The Cleveland Clinic Foundation | Vascular plaque characterization |
| US7074188B2 (en) | 2002-08-26 | 2006-07-11 | The Cleveland Clinic Foundation | System and method of characterizing vascular tissue |
| US7359554B2 (en) | 2002-08-26 | 2008-04-15 | Cleveland Clinic Foundation | System and method for identifying a vascular border |
| WO2004034869A2 (en) * | 2002-10-18 | 2004-04-29 | Arieh Sher | Atherectomy system with imaging guidewire |
| US7175597B2 (en) | 2003-02-03 | 2007-02-13 | Cleveland Clinic Foundation | Non-invasive tissue characterization system and method |
| US6943881B2 (en) | 2003-06-04 | 2005-09-13 | Tomophase Corporation | Measurements of optical inhomogeneity and other properties in substances using propagation modes of light |
| EP3045136B1 (en) * | 2003-09-12 | 2021-02-24 | Vessix Vascular, Inc. | Selectable eccentric remodeling and/or ablation of atherosclerotic material |
| US7215802B2 (en) | 2004-03-04 | 2007-05-08 | The Cleveland Clinic Foundation | System and method for vascular border detection |
| US7397935B2 (en) | 2004-05-10 | 2008-07-08 | Mediguide Ltd. | Method for segmentation of IVUS image sequences |
| EP1825214A1 (en) | 2004-11-24 | 2007-08-29 | The General Hospital Corporation | Common-path interferometer for endoscopic oct |
| CA2602662A1 (en) * | 2005-03-30 | 2006-10-05 | Lumend, Inc. | Catheter systems for crossing total occlusions in vasculature |
| CA2605531C (en) * | 2005-05-12 | 2010-03-09 | Compumedics Medical Innovation Pty Ltd | Ultrasound diagnosis and treatment apparatus |
| EP1887946A2 (en) | 2005-06-06 | 2008-02-20 | The Board Of Regents, The University Of Texas System | Oct using spectrally resolved bandwidth |
| JP5600241B2 (ja) | 2005-10-13 | 2014-10-01 | ヴォルケイノウ・コーポレーション | コンポーネントベースのカテーテル・ラボラトリ血管内超音波システム |
| EP1948021A4 (en) | 2005-10-20 | 2009-12-02 | Univ Texas | ROTATING OPTICAL CATHETER TIP FOR OPTICAL COHERENCE TOMOGRAPHY |
| US8125648B2 (en) | 2006-06-05 | 2012-02-28 | Board Of Regents, The University Of Texas System | Polarization-sensitive spectral interferometry |
| US20090018566A1 (en) * | 2006-06-30 | 2009-01-15 | Artheromed, Inc. | Atherectomy devices, systems, and methods |
| US9314263B2 (en) * | 2006-06-30 | 2016-04-19 | Atheromed, Inc. | Atherectomy devices, systems, and methods |
| US8108030B2 (en) | 2006-10-20 | 2012-01-31 | Board Of Regents, The University Of Texas System | Method and apparatus to identify vulnerable plaques with thermal wave imaging of heated nanoparticles |
| US7929148B2 (en) | 2007-01-23 | 2011-04-19 | Volcano Corporation | Optical coherence tomography implementation apparatus and method of use |
| WO2009005779A1 (en) * | 2007-06-29 | 2009-01-08 | Atheromed, Inc. | Atherectomy devices, systems, and methods |
| US10219780B2 (en) | 2007-07-12 | 2019-03-05 | Volcano Corporation | OCT-IVUS catheter for concurrent luminal imaging |
| WO2009021179A1 (en) | 2007-08-09 | 2009-02-12 | Volcano Corporation | Controller user interface for a catheter lab intravascular ultrasound system |
| JP5608556B2 (ja) | 2007-08-10 | 2014-10-15 | ボード・オブ・リージエンツ,ザ・ユニバーシテイ・オブ・テキサス・システム | 前方結像型光干渉断層(oct)システムおよびプローブ |
| US7787127B2 (en) | 2007-10-15 | 2010-08-31 | Michael Galle | System and method to determine chromatic dispersion in short lengths of waveguides using a common path interferometer |
| US8784440B2 (en) * | 2008-02-25 | 2014-07-22 | Covidien Lp | Methods and devices for cutting tissue |
| WO2009140534A2 (en) | 2008-05-15 | 2009-11-19 | Silicon Valley Medical Instruments, Inc. | Ivus system with rotary capacitive coupling |
| CA2761774C (en) * | 2009-05-14 | 2014-09-16 | Tyco Healthcare Group Lp | Easily cleaned atherectomy catheters and methods of use |
| EP2506783B1 (en) * | 2009-12-02 | 2016-06-29 | Covidien LP | Methods and devices for cutting tissue |
| US9345510B2 (en) * | 2010-07-01 | 2016-05-24 | Avinger, Inc. | Atherectomy catheters with longitudinally displaceable drive shafts |
| BR112013011632A2 (pt) * | 2010-11-11 | 2016-08-09 | Covidien Lp | cateteres de citorredução flexíveis com imagiologia e métodos de uso e fabricação |
| CN103957825B (zh) * | 2011-10-13 | 2018-12-07 | 阿瑟罗迈德公司 | 粥样斑块切除装置、系统和方法 |
| EP2943127A4 (en) | 2013-01-08 | 2016-09-14 | Volcano Corp | PROCESS FOR FOCUSED ACOUSTIC COMPUTER TOMOGRAPHY (FACT) |
| US20140276059A1 (en) * | 2013-03-12 | 2014-09-18 | Volcano Corporation | Externally imaging a body structure within a patient |
| US20140276015A1 (en) * | 2013-03-14 | 2014-09-18 | Volcano Corporation | Devices and methods for imaging and crossing occluded vessels |
| EP3027126B1 (en) * | 2013-07-31 | 2019-10-23 | Atheromed, Inc. | Atherectomy devices |
| CN103462646B (zh) * | 2013-09-17 | 2014-12-10 | 浙江大学 | 一种集成血管内超声(ivus)影像和数字减影(dsa)影像的一体化离线处理系统 |
-
2016
- 2016-01-29 JP JP2017543368A patent/JP6772161B2/ja active Active
- 2016-01-29 WO PCT/IB2016/050448 patent/WO2016132241A1/en active Application Filing
- 2016-01-29 CN CN201680022621.7A patent/CN107530049B/zh active Active
- 2016-01-29 EP EP16702817.4A patent/EP3258863B1/en active Active
- 2016-02-19 US US15/048,042 patent/US20160242808A1/en active Pending
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11813484B2 (en) | 2018-11-28 | 2023-11-14 | Histosonics, Inc. | Histotripsy systems and methods |
| US11813485B2 (en) | 2020-01-28 | 2023-11-14 | The Regents Of The University Of Michigan | Systems and methods for histotripsy immunosensitization |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2016132241A1 (en) | 2016-08-25 |
| US20160242808A1 (en) | 2016-08-25 |
| EP3258863B1 (en) | 2020-09-16 |
| JP6772161B2 (ja) | 2020-10-21 |
| JP2018511361A (ja) | 2018-04-26 |
| EP3258863A1 (en) | 2017-12-27 |
| CN107530049A (zh) | 2018-01-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107530049B (zh) | 支持成像的斑块切除设备 | |
| EP2765930B1 (en) | Atherectomy apparatus | |
| US11819228B2 (en) | Methods and systems for treating a pulmonary embolism | |
| US9308016B2 (en) | Devices, systems, and methods for performing atherectomy including delivery of a bioactive material | |
| US9770258B2 (en) | Atherectomy devices | |
| US7771444B2 (en) | Methods and devices for removing material from a body lumen | |
| EP2164409B1 (en) | Atherectomy system | |
| CA2518497C (en) | Interventional catheters having differential cutting surfaces | |
| US20150297258A1 (en) | Atherectomy devices and methods | |
| US20140276684A1 (en) | Atherectomy methods using coregistered sets of data | |
| JP2017506933A (ja) | 血管アクセスを形成する装置及び方法 | |
| WO2014099905A1 (en) | Aspirating and removing biological material | |
| JP6069438B2 (ja) | 内視鏡超音波ガイド下胆道アクセスシステム | |
| US20140180316A1 (en) | Imaging and removing biological material |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| CB02 | Change of applicant information | ||
| CB02 | Change of applicant information |
Address after: Eindhoven, Netherlands Applicant after: Royal Philips Co.,Ltd. Applicant after: Philips image guided therapy Co. Address before: Eindhoven, Netherlands Applicant before: Royal Philips Co.,Ltd. Applicant before: VOLCANO Corp. |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant |