CN107024552B - 一种测定玉兰亚属植物中植物激素的方法 - Google Patents
一种测定玉兰亚属植物中植物激素的方法 Download PDFInfo
- Publication number
- CN107024552B CN107024552B CN201710194381.5A CN201710194381A CN107024552B CN 107024552 B CN107024552 B CN 107024552B CN 201710194381 A CN201710194381 A CN 201710194381A CN 107024552 B CN107024552 B CN 107024552B
- Authority
- CN
- China
- Prior art keywords
- magnolia
- plant hormones
- solution
- centrifugation
- standard
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 241000218378 Magnolia Species 0.000 title claims abstract description 79
- 238000000034 method Methods 0.000 title claims abstract description 61
- 239000003375 plant hormone Substances 0.000 title claims description 55
- 238000000605 extraction Methods 0.000 claims abstract description 36
- 241000196324 Embryophyta Species 0.000 claims abstract description 32
- 239000012086 standard solution Substances 0.000 claims abstract description 21
- 238000004128 high performance liquid chromatography Methods 0.000 claims abstract description 15
- 229930195732 phytohormone Natural products 0.000 claims abstract description 13
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 claims abstract description 11
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 claims abstract description 11
- 238000004458 analytical method Methods 0.000 claims abstract description 10
- 238000002360 preparation method Methods 0.000 claims abstract description 7
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 141
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims description 47
- 244000020518 Carthamus tinctorius Species 0.000 claims description 35
- 239000012071 phase Substances 0.000 claims description 33
- 235000003255 Carthamus tinctorius Nutrition 0.000 claims description 31
- 238000005119 centrifugation Methods 0.000 claims description 30
- 239000000243 solution Substances 0.000 claims description 28
- 229940088597 hormone Drugs 0.000 claims description 24
- 239000005556 hormone Substances 0.000 claims description 24
- 239000006228 supernatant Substances 0.000 claims description 24
- 239000000523 sample Substances 0.000 claims description 22
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 claims description 21
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 19
- 238000002386 leaching Methods 0.000 claims description 18
- 239000007788 liquid Substances 0.000 claims description 18
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 14
- 238000010828 elution Methods 0.000 claims description 13
- 241000287828 Gallus gallus Species 0.000 claims description 12
- 241000735598 Galbulimima belgraveana Species 0.000 claims description 11
- 238000002347 injection Methods 0.000 claims description 11
- 239000007924 injection Substances 0.000 claims description 11
- 230000014759 maintenance of location Effects 0.000 claims description 9
- 239000004570 mortar (masonry) Substances 0.000 claims description 9
- 239000000047 product Substances 0.000 claims description 9
- 239000011550 stock solution Substances 0.000 claims description 9
- 239000000284 extract Substances 0.000 claims description 8
- 238000012546 transfer Methods 0.000 claims description 8
- 238000001514 detection method Methods 0.000 claims description 7
- 239000012982 microporous membrane Substances 0.000 claims description 7
- 229910052757 nitrogen Inorganic materials 0.000 claims description 7
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 claims description 6
- 235000011114 ammonium hydroxide Nutrition 0.000 claims description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims description 5
- 239000008346 aqueous phase Substances 0.000 claims description 5
- 239000007864 aqueous solution Substances 0.000 claims description 5
- 239000000843 powder Substances 0.000 claims description 5
- 239000012141 concentrate Substances 0.000 claims description 4
- 238000001556 precipitation Methods 0.000 claims description 4
- 229910021642 ultra pure water Inorganic materials 0.000 claims description 4
- 239000012498 ultrapure water Substances 0.000 claims description 4
- 238000010812 external standard method Methods 0.000 claims description 3
- 238000002390 rotary evaporation Methods 0.000 claims description 3
- 239000012488 sample solution Substances 0.000 claims description 3
- 230000006837 decompression Effects 0.000 claims description 2
- 238000007654 immersion Methods 0.000 claims description 2
- 238000005406 washing Methods 0.000 claims description 2
- 239000002244 precipitate Substances 0.000 claims 1
- 238000005303 weighing Methods 0.000 claims 1
- 238000000227 grinding Methods 0.000 abstract description 9
- 238000011084 recovery Methods 0.000 abstract description 7
- UZKQTCBAMSWPJD-UQCOIBPSSA-N trans-Zeatin Natural products OCC(/C)=C\CNC1=NC=NC2=C1N=CN2 UZKQTCBAMSWPJD-UQCOIBPSSA-N 0.000 abstract description 5
- UZKQTCBAMSWPJD-FARCUNLSSA-N trans-zeatin Chemical compound OCC(/C)=C/CNC1=NC=NC2=C1N=CN2 UZKQTCBAMSWPJD-FARCUNLSSA-N 0.000 abstract description 5
- 229940023877 zeatin Drugs 0.000 abstract description 5
- 238000005259 measurement Methods 0.000 abstract description 3
- 238000000926 separation method Methods 0.000 abstract description 2
- JLIDBLDQVAYHNE-YKALOCIXSA-N (+)-Abscisic acid Chemical compound OC(=O)/C=C(/C)\C=C\[C@@]1(O)C(C)=CC(=O)CC1(C)C JLIDBLDQVAYHNE-YKALOCIXSA-N 0.000 description 44
- FCRACOPGPMPSHN-UHFFFAOYSA-N desoxyabscisic acid Natural products OC(=O)C=C(C)C=CC1C(C)=CC(=O)CC1(C)C FCRACOPGPMPSHN-UHFFFAOYSA-N 0.000 description 22
- 229960000583 acetic acid Drugs 0.000 description 13
- SEOVTRFCIGRIMH-UHFFFAOYSA-N indole-3-acetic acid Chemical compound C1=CC=C2C(CC(=O)O)=CNC2=C1 SEOVTRFCIGRIMH-UHFFFAOYSA-N 0.000 description 12
- 229930191978 Gibberellin Natural products 0.000 description 8
- IXORZMNAPKEEDV-UHFFFAOYSA-N gibberellic acid GA3 Natural products OC(=O)C1C2(C3)CC(=C)C3(O)CCC2C2(C=CC3O)C1C3(C)C(=O)O2 IXORZMNAPKEEDV-UHFFFAOYSA-N 0.000 description 8
- 239000003448 gibberellin Substances 0.000 description 8
- 239000001253 polyvinylpolypyrrolidone Substances 0.000 description 8
- JLIDBLDQVAYHNE-LXGGSRJLSA-N 2-cis-abscisic acid Chemical compound OC(=O)/C=C(/C)\C=C\C1(O)C(C)=CC(=O)CC1(C)C JLIDBLDQVAYHNE-LXGGSRJLSA-N 0.000 description 7
- 229930192334 Auxin Natural products 0.000 description 7
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 7
- 239000002363 auxin Substances 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- 238000004945 emulsification Methods 0.000 description 5
- 239000012535 impurity Substances 0.000 description 5
- 239000000049 pigment Substances 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 238000002203 pretreatment Methods 0.000 description 4
- 241000220324 Pyrus Species 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 239000003208 petroleum Substances 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- UWNADWZGEHDQAB-UHFFFAOYSA-N 2,5-dimethylhexane Chemical group CC(C)CCC(C)C UWNADWZGEHDQAB-UHFFFAOYSA-N 0.000 description 2
- 241000730180 Magnolia wufengensis Species 0.000 description 2
- 244000007021 Prunus avium Species 0.000 description 2
- 235000010401 Prunus avium Nutrition 0.000 description 2
- 235000014443 Pyrus communis Nutrition 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 238000003810 ethyl acetate extraction Methods 0.000 description 2
- 238000010829 isocratic elution Methods 0.000 description 2
- 238000004811 liquid chromatography Methods 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 240000002791 Brassica napus Species 0.000 description 1
- 235000004977 Brassica sinapistrum Nutrition 0.000 description 1
- 235000009917 Crataegus X brevipes Nutrition 0.000 description 1
- 235000013204 Crataegus X haemacarpa Nutrition 0.000 description 1
- 235000009685 Crataegus X maligna Nutrition 0.000 description 1
- 235000009444 Crataegus X rubrocarnea Nutrition 0.000 description 1
- 235000009486 Crataegus bullatus Nutrition 0.000 description 1
- 235000017181 Crataegus chrysocarpa Nutrition 0.000 description 1
- 235000009682 Crataegus limnophila Nutrition 0.000 description 1
- 235000004423 Crataegus monogyna Nutrition 0.000 description 1
- 240000000171 Crataegus monogyna Species 0.000 description 1
- 235000002313 Crataegus paludosa Nutrition 0.000 description 1
- 235000009840 Crataegus x incaedua Nutrition 0.000 description 1
- 235000008100 Ginkgo biloba Nutrition 0.000 description 1
- 244000194101 Ginkgo biloba Species 0.000 description 1
- 102000018997 Growth Hormone Human genes 0.000 description 1
- 108010051696 Growth Hormone Proteins 0.000 description 1
- 240000008415 Lactuca sativa Species 0.000 description 1
- 235000003228 Lactuca sativa Nutrition 0.000 description 1
- 241000218377 Magnoliaceae Species 0.000 description 1
- 244000018633 Prunus armeniaca Species 0.000 description 1
- 235000009827 Prunus armeniaca Nutrition 0.000 description 1
- 240000006079 Schisandra chinensis Species 0.000 description 1
- 235000008422 Schisandra chinensis Nutrition 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical class [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 238000009395 breeding Methods 0.000 description 1
- 230000001488 breeding effect Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 238000004042 decolorization Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 235000013399 edible fruits Nutrition 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 239000012362 glacial acetic acid Substances 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 238000007689 inspection Methods 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- GBMDVOWEEQVZKZ-UHFFFAOYSA-N methanol;hydrate Chemical group O.OC GBMDVOWEEQVZKZ-UHFFFAOYSA-N 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 235000021017 pears Nutrition 0.000 description 1
- 230000008121 plant development Effects 0.000 description 1
- 230000008635 plant growth Effects 0.000 description 1
- 239000005648 plant growth regulator Substances 0.000 description 1
- 238000004451 qualitative analysis Methods 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
- G01N30/04—Preparation or injection of sample to be analysed
- G01N30/06—Preparation
Landscapes
- Physics & Mathematics (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Peptides Or Proteins (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
本发明公开一种测定玉兰亚属植物中植物激素的方法,包括植物激素的提取步骤、标准溶液制备步骤、高效液相色谱分析步骤和标准溶液测定步骤,在植物激素的提取步骤中,使用低温研磨、低温避光浸提、PVPP萃取等方式,保证了玉米素的有效提取。本发明峰形更好,分离度高,无拖尾现象,重复性好,回收率高,准确可靠。
Description
技术领域
本发明属于生物化学领域,涉及植物激素的定性定量分析技术,具体涉及玉兰亚属植物中内源激素的测定方法,特别是玉兰亚属中红花玉兰和白玉兰中赤霉素(GA3)、生长素(IAA)、脱落酸(ABA)的测定方法。
背景技术
红花玉兰(Magnolia wufengensis L.Y.Ma et L.R.Wang)是2004年3月于湖北五峰发现的木兰科木兰属玉兰亚属新种,该玉兰花被片数为9(~11)片,内外全红且花色均匀的特征十分罕见。随后在该区域的调查中更是发现了玉兰花被片数为12、15、18、24等,甚至多达46片的野生类群,将与红花玉兰花色相近,花被片数目增多的类群正式命名为多瓣红花玉兰(Magnolia wufengensis var.multitepala L.Y.Ma et L.R.Wang)。随着红花玉兰新品种选育和繁殖工作的不断推进,红花玉兰苗木的产业化、商业化已成为必然趋势。植物内源激素如赤霉素(GA3)、生长素(IAA)、脱落酸(ABA)和玉米素(ZT)对植物的生长发育有重要的调节作用。了解掌握红花玉兰植物激素水平的变化规律是生产上通过施用植物生长调节剂改良观赏性状的理论基础。
植物激素在植物体内含量甚微,而且其在植物体内的组成复杂,相互共存的干扰组分多,对温度等条件敏感,因而对植物激素的测定比较困难。高效液相色谱(HPLC)是较理想的植物内源激素分析方法,植物激素的HPLC测定已在仁用杏花芽、甜樱桃、梨等果实,油菜、莴苣等籽粒上有所应用,对植物种子方面,主要集中在银杏、山楂、甜樱桃、五味子、早蜜梨和黄金梨等种子的激素含量测定上。目前,针对于玉兰亚属植物激素研究的报道较少,仍未建立起一种通用的植物激素测定方法。
在实现本发明过程中,发明人发现现有技术中至少存在如下问题:
1、不同种类植物内植物激素的高效液相色谱测定法中,其前处理方法、洗脱系统及检测系统差异十分明显,并不能直接借鉴其他植物的植物激素高效液相色谱测定法来测定玉兰亚属植物中植物激素特别是红花玉兰赤霉素(GA3)、生长素(IAA)和脱落酸(ABA)含量以及和白玉兰中赤霉素(GA3)、生长素(IAA)和脱落酸(ABA)含量。
2、红花玉兰幼嫩的植物组织,尤其是花芽在研磨过程中极易发生褐化,影响检查结果的准确性。
3、在前处理过程中,提取溶剂难以直接选择。在完成本发明的过程中,使用现有技术中的常规溶剂,会出现色素去除效果不理想的问题,萃取液乳化而不能分层的问题,待检测的植物激素离子化等问题,提取流程繁琐、提取效率低的问题。
4、待测样品组分复杂,极性很强,使用常规柱层析技术,色谱峰严重重叠,且有拖尾现象。
发明人在完成本发明的过程中,还发现玉兰亚属植物特别是红花玉兰和白玉兰中赤霉素(GA3)、生长素(IAA)、脱落酸(ABA)三种植物内源激素与玉米素(ZT)的前处理方法和柱层析方法,技术要求具有非常大的差异。本发明主要目的是检测玉兰亚属植物特别是红花玉兰和白玉兰中赤霉素(GA3)、生长素(IAA)、脱落酸(ABA)三种植物内源激素的含量。
发明内容
本发明所要解决的第一个技术问题是克服现有技术中缺少玉兰亚属植物中植物激素测定方法特别是红花玉兰中赤霉素(GA3)、生长素(IAA)、脱落酸(ABA)的测定方法以及白玉兰中赤霉素(GA3)、生长素(IAA)、脱落酸(ABA)的测定方法的问题。
本发明所要解决的第二个技术问题是克服玉兰亚属植物特别是红花玉兰或白玉兰前处理方法中出现色素去除效果不理想的问题、萃取液乳化而不能分层的问题、待检测的植物激素离子化中至少一个问题。
本发明所要解决的第三个技术问题是克服在液相色谱中,色谱峰严重重叠的问题。
发明人通过长期的探索和尝试,以及多次的实验和努力,不断的改革创新,为解决以上技术问题,本发明提供的技术方案是,提供一种测定玉兰亚属植物中植物激素的方法,包括植物激素的提取步骤、标准溶液制备步骤、高效液相色谱分析步骤和标准溶液测定步骤;
所述植物激素的提取步骤如下:
A)低温研磨植物组织样品至粉末,随后加入低温甲醇溶液,继续研磨成匀浆;
B)将所述匀浆转入第一离心管中,第一低温避光浸提;
C)第一离心,吸取第一上清液,在沉淀中加入低温甲醇溶液,第二低温避光浸提;
D)第二离心,吸取第二上清液,合并第一上清液和第二上清液至第一鸡心瓶;
E)向第一鸡心瓶中滴入氨水,35℃~40℃减压旋转蒸发至水相;
F)将前述水相完全转移至第二离心管,向第二离心管中加入PVPP,摇床振荡后第三离心;吸取第三上清液,并用HCl溶液调节pH至2.5~3.0,随后加入等体积乙酸乙酯萃取,重复操作本步骤1~3次;
G)合并萃取液至第二鸡心瓶,35℃~40℃减压浓缩至干;
H)用初始流动相溶解后过微孔滤膜,得到样品待测液,低温保存。
根据本发明测定玉兰亚属植物中植物激素的方法的一个进一步实施方式,所述高效液相色谱分析步骤中:
色谱条件为:
色谱柱:Agilent ZORBAX SB-C18;流动相A:甲醇,流动相B:0.1M乙酸水溶液;进样量:10μL;柱温:35℃;检测波长:254nm;
用外标法进行定量测定。
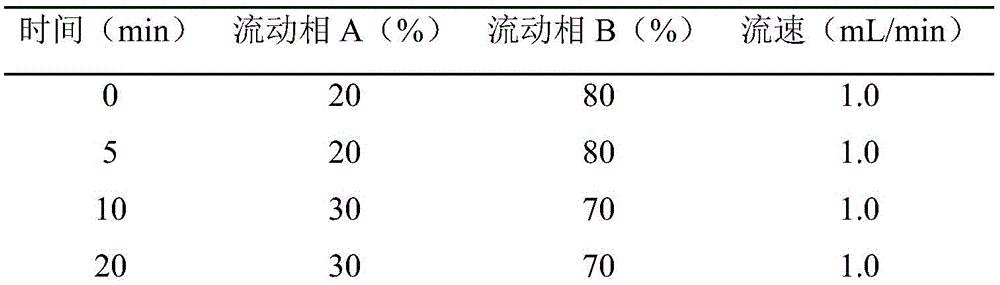
根据本发明测定玉兰亚属植物中植物激素的方法的一个进一步实施方式,所述高效液相色谱分析步骤中,采用梯度洗脱条件:0~5min,20%~20%A;5~10min,20%~30%A;10~20min,30%~30%A;20~23min,30%~40%A;23~40min,40%~40%A;40~45min,40%~20%A;流速:1mL/min。
根据本发明测定玉兰亚属植物中植物激素的方法的一个优选实施方式,所述玉兰亚属植物为红花玉兰或白玉兰;所述植物激素为GA3、IAA和ABA中的一种、两种或三种;所述植物组织为红花玉兰花芽、花被片或叶片,或白玉兰的花被片或叶片。
根据本发明测定玉兰亚属植物中植物激素的方法的一个进一步实施方式,所述标准溶液制备步骤具体是,准确称取GA3标准品0.0057g、IAA标准品0.0052g、ABA标准品0.0042g,分别用甲醇定容至10mL,配制成浓度分别为570mg/L、520mg/L、420mg/L的标准贮备液,密封后于-20℃低温避光保存;用移液器吸取一定量各激素的标准贮备液,稀释成相当于原浓度1/4、1/8、1/16、1/32、1/64、1/128、1/256、1/512、1/1024、1/2048的混合标准溶液,低温避光保存备用。
根据本发明测定玉兰亚属植物中植物激素的方法的一个进一步实施方式,所述标准溶液测定步骤具体是,将GA3、IAA、ABA的标准贮备液分别在确定的色谱条件下进样,记录每种激素的保留时间,从而定性;再将混合标准溶液在确定的色谱条件下重复进样3次,记录保留时间和峰面积,计算相对标准偏差;以各进样浓度为横坐标x,峰面积为纵坐标y,绘制标准工作曲线,计算回归方程及相关系数,从而定量。
根据本发明测定玉兰亚属植物中植物激素的方法的一个优选实施方式,所述低温研磨采用预冷的研钵,优选采用液氮预冷的研钵;所述低温甲醇溶液为预冷的甲醇溶液,优选为4℃预冷的甲醇溶液,更优选的是4℃预冷的体积分数为80%的甲醇溶液;所述甲醇溶液为体积分数为80%的甲醇溶液。
根据本发明测定玉兰亚属植物中植物激素的方法的一个进一步实施方式,所述第一低温避光浸提为1~4℃避光浸提15~21h。
优选地,所述第一低温避光浸提为4℃避光浸提15~21h。
根据本发明测定玉兰亚属植物中植物激素的方法的一个进一步实施方式,所述第二低温避光浸提为1~4℃避光浸提1~3h。
优选地,所述第二低温避光浸提为4℃避光浸提2h。
根据本发明测定玉兰亚属植物中植物激素的方法的一个进一步实施方式,所述第一离心为1~4℃、10000~14000r/min离心8~12min。
优选地,所述第一离心为4℃12000r/min离心10min。
根据本发明测定玉兰亚属植物中植物激素的方法的一个进一步实施方式,所述第二离心为1~4℃、10000~14000r/min离心8~12min。
优选地,所述第二离心为4℃12000r/min离心10min。
根据本发明测定玉兰亚属植物中植物激素的方法的一个进一步实施方式,所述第三离心为10000~14000r/min离心8~12min。
优选地,所述第三离心为12000r/min离心10min。
根据本发明测定玉兰亚属植物中植物激素的方法的一个进一步实施方式,所述摇床振荡为常温摇床振荡15~25min。
优选地,所述摇床振荡为常温摇床振荡20min。
根据本发明测定玉兰亚属植物中植物激素的方法的一个优选实施方式,所述HCl溶液为0.1M HCl溶液;所述初始流动相为20%甲醇,80%0.1M乙酸水溶液;所述微孔滤膜为0.45μm微孔滤膜;所述低温保存为4℃保存。
根据本发明测定玉兰亚属植物中植物激素的方法的一个优选实施方式,所述植物激素的提取步骤具体如下:
准确称取0.5000g红花玉兰植物组织样品放入预冷的研钵,加入液氮研磨成粉末后再加入8mL预冷的80%甲醇,研磨成匀浆,转入10mL第一离心管中置于4℃冰箱内第一低温避光浸提15~21h;4℃12000r/min第一离心10min,吸取第一上清液后在沉淀中加入4mL预冷的80%甲醇第二低温避光浸提2h;4℃12000r/min第二离心10min,吸取第二上清液,合并第一上清液和第二上清液至100mL第一鸡心瓶中;加入1滴氨水,35℃~40℃减压旋转蒸发至水相,将水相转移至10mL离心管中,并向第一鸡心瓶中加入2mL超纯水清洗,合并水相;称取0.1000g PVPP于离心管中,常温摇床振荡20min;12000r/min第三离心10min,吸取第三上清液并用0.1M HCl调节pH至2.5~3.0;加入等体积乙酸乙酯萃取,重复3次;合并酯相,倒入第二鸡心瓶中于35℃~40℃条件下减压浓缩至干;用0.5mL的初始流动相溶解后过0.45μm微孔滤膜得到样品待测液,置于4℃冰箱保存,用于测定GA3、IAA和ABA;所述初始流动相为20%甲醇,80%0.1M乙酸水溶液。
与现有技术相比,上述技术方案中的一个技术方案具有如下优点:
a)发明人在完成本发明过程中发现,红花玉兰幼嫩的植物组织,尤其是花芽在研磨过程中极易发生褐化。在研磨前使用低温的研钵,如用液氮将研钵预冷,研磨过程保证低温环境可以在一定程度上防止褐化。
b)本发明使用PVPP去除色素和酚类物质,一方面不会对乙酸乙酯萃取造成乳化的负面影响,另一方面,能够满足除杂要求,并且提取流程得以简化。
c)本发明采用梯度洗脱的方法,选择20%甲醇:80%0.1M乙酸(0.575%的乙酸溶液)作为初始流动相,峰形更好,分离度高,无拖尾现象。
d)洗脱系统梯度设计,整个程序运行过程中,出峰结束后基线恢复平稳,保证了自动进样的连续性和样品的等精度测量。
e)柱温的选择,可以保证GA3、IAA、ABA的分离度达到最佳。
f)流速过快会导致色谱峰重叠,流速过慢会出现“平头峰”,当流速为1.0mL/min时各激素的峰形最好。
g)本发明重复性好,回收率高,准确可靠。
附图说明
为了更清楚地说明本发明实施方式的技术方案,下面将对实施方式中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1是本发明实施例1中GA3、IAA和ABA标准品的液相色谱图。
图2是本发明实施例1中样品液相色谱图。
图3是本发明实施例1中样品加标准品液相色谱图。
图4是流动相为35%甲醇:65%水(水中含1.0%乙酸)的色谱图。
图中,1为GA3,2为IAA,3为ABA。
具体实施方式
为使本发明实施方式的目的、技术方案和优点更加清楚,下面将结合本发明实施方式中的附图,对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。因此,以下对在附图中提供的本发明的实施方式的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施方式。
实施例1
本实施例中,使用以下仪器和试剂。
仪器:美国Agilent 1260高效液相色谱仪,包括四元泵、自动进样器、柱温箱和紫外检测器;3-30K高速冷冻离心机(德国SIGMA);Hei-VAP旋转蒸发仪(德国Heidolph);PB-21酸度计(德国Sartorius);Quintix 224-1CN电子天平(德国Sartorius);移液器(德国Eppendorf);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司)。
试剂:聚乙烯聚吡咯烷酮(PVPP)(美国Sigma);甲醇(色谱纯,美国FischerScientific);冰醋酸、乙酸乙酯、氨水、盐酸(分析纯,北京化工厂);超纯水;GA3、IAA和ABA标准品(HPLC级,纯度≥98%,美国Sigma)。
本发明测定玉兰亚属植物中植物激素的方法,可以用于测定红花玉兰花芽、花被片或叶片中GA3、IAA和ABA含量,也可以用于测定白玉兰的花被片或叶片中GA3、IAA和ABA含量。在本实施例中,是以红花玉兰花芽作为提取对象。以下提及的红花玉兰植物组织样品,若无特殊说明,均指红花玉兰花芽。
本实施例测定玉兰亚属植物中植物激素的方法,包括植物激素的提取步骤、标准溶液制备步骤、高效液相色谱分析步骤和标准溶液测定步骤。
1、植物激素的提取步骤
准确称取0.5000g红花玉兰植物组织样品放入预冷的研钵,加入液氮研磨成粉末后再加入8mL预冷的80%甲醇,研磨成匀浆,转入10mL第一离心管中置于4℃冰箱内第一低温避光浸提15~21h。4℃12000r/min第一离心10min,吸取第一上清液后在沉淀中加入预冷的4mL 80%甲醇第二低温避光浸提2h。4℃12000r/min第二离心10min,吸取第二上清液,合并第一上清液和第二上清液至100mL第一鸡心瓶中。加入1滴氨水,35℃~40℃减压旋转蒸发至水相,此时溶液体积约减少2/3,将所述水相转移至10mL第二离心管中,并向第一鸡心瓶中加入2mL超纯水清洗,合并水相。称取0.1000g PVPP于第二离心管中,常温摇床振荡20min。12000r/min第三离心10min,吸取第三上清液并用0.1M HCl调节pH至2.5~3.0。加入等体积乙酸乙酯萃取,重复3次。合并酯相,倒入第二鸡心瓶中于35℃~40℃条件下减压浓缩至干。用0.5mL的初始流动相(20%甲醇,80%0.1M乙酸水溶液)溶解后过0.45μm微孔滤膜得到样品待测液,置于4℃冰箱保存,用于测定GA3、IAA和ABA。
上述第一、第二、第三仅具有区分对象的作用,不具有实际含义。本实施例中,植物激素的提取方法基于现有技术的基础上,做了大量的探索和研究,最终获得了改进的优化方案。发明人发现,在提取过程中,红花玉兰幼嫩的植物组织,尤其是花芽在研磨过程中极易发生褐化。在研磨前用液氮将研钵预冷,研磨过程保证低温环境可以一定程度上防止褐化。已知文献指出了80%甲醇粗提取后添加石油醚可大部分去除色素的干扰,但发明人在完成本发明过程中发现使用石油醚会对提取过程中乙酸乙酯的萃取产生影响,导致提取液出现乳化现象不能分层。有研究人员为了解决乳化现象,在提取植物激素样品前处理阶段添加等体积的5g/L的NaOH。但发明人发现强碱物质不仅会破坏植物激素还会导致提取液pH上升,使酸性的GA3、IAA、ABA离子化,因此会大幅降低提取效率。发明人通过进一步研究表明,加入一定饱和的NaCl溶液能够消除提取液的乳化现象,对激素影响较小。但是,通过试验发现石油醚的脱色效果十分有限,也使提取流程更加繁琐。最终,发明人筛选使用了PVPP去除色素和酚类物质,加入PVPP后,不会对乙酸乙酯萃取造成影响,并且能够满足除杂要求,简化提取流程。
需要说明的是,上述提及的现有方法都不是针对玉兰亚属植物特别是红花玉兰中植物激素的提取。而是其他植物中植物激素的提取方法。
2、标准溶液制备步骤
准确称取GA3标准品0.0057g,IAA标准品0.0052g,ABA标准品0.0042g分别用甲醇定容至10mL,配制成浓度分别为570mg/L、520mg/L、420mg/L的标准贮备液,密封后于-20℃低温避光保存。用移液器吸取一定量各激素的标准贮备液,稀释成相当于原浓度1/4、1/8、1/16、1/32、1/64、1/128、1/256、1/512、1/1024、1/2048的混合标准溶液,低温避光保存备用。
3、高效液相色谱分析步骤
色谱条件
色谱柱:Agilent ZORBAX SB-C18(4.6×150mm,5μm);流动相A:甲醇,流动相B:0.1M乙酸水溶液。
梯度洗脱条件:0~5min,20%~20%A;5~10min,20%~30%A;10~20min,30%~30%A;20~23min,30%~40%A;23~40min,40%~40%A;40~45min,40%~20%A;,运行时间48min。流速:1mL/min;进样量:10μL;柱温:35℃;检测波长:254nm。用外标法进行定量测定。
GA3、IAA和ABA的梯度洗脱时间表如下表所示:
本实施例采用二异丁基键合相Agilent ZORBAX SB-C18柱,能在低pH、高温条件下分析酸性、碱性和中性组分,具有峰形优异,柱寿命长的优点。
现有技术中,甲醇-水的流动相组成是目前常用的组合。发明人分别试验了35%甲醇:65%水,40%甲醇:60%水,45%:55%水,50%:50%水的等度洗脱效果,结果发现红花玉兰的样品组分极性很强,色谱峰严重重叠,且有拖尾的现象。不同的洗脱系统对洗脱效果有着非常明显的影响,图4示出了流动相为35%甲醇:65%水(水中含1.0%乙酸)的色谱图;色谱柱:Agilent ZORBAX SB-C18(4.6×150mm,5μm);流速:1mL/min;进样量:10μL;柱温:30℃;检测波长:254nm;色谱峰出现重叠和拖尾,样品中的3种待测激素不能有效分离。
有文献记载,甲醇与乙腈配合使用能够改善峰形,提高分离度。发明人在改进流动相组成试验中,采用20%甲醇:20%乙腈:60%水(其中含0.75%的乙酸)时仍不能使激素的色谱峰与杂质峰分离,结果说明红花玉兰样品组分复杂,极性很强,等度洗脱HPLC法不适用于其植物激素的检测。
最终,发明人选择了梯度洗脱法,最后通过对比实验选择20%甲醇:80%0.1M乙酸水溶液(0.575%的乙酸水溶液)作为初始流动相。减小有机相的比例能够增加洗脱强度,在梯度洗脱后期增加有机相的比例可使样品中剩余的极性组分被洗脱出来。检测GA3、IAA和ABA时,0~5min甲醇比例为20%,5~10min甲醇比例从20%增加到30%,影响GA3色谱峰的杂质在10min内出峰结束;从10~20min甲醇比例保持在30%,GA3和IAA出峰结束;从20~23min,甲醇比例从30%变化到40%;23~40min,甲醇比例保持在40%,包括ABA色谱峰在内的其余峰出峰结束;40~45min甲醇比例降至20%。整个程序运行48min,基线恢复平稳,保证了自动进样的连续性和样品的等精度测量。
在液相色谱中,提高柱温可以缩短出峰时间,提高灵敏度。试验中分别对比了25℃、30℃、35℃和40℃的色谱图,结果发现35℃柱温条件下,GA3、IAA、ABA的分离度最佳。
流动相速度增加可以缩短保留时间,使峰形变窄。试验对比了0.6mL/min、0.8mL/min、1.0mL/min和1.2mL/min这4种流速,结果发现流速过快会导致色谱峰重叠,流速过慢会出现“平头峰”,当流速为1.0mL/min时各激素的峰形最好。
4、标准溶液测定步骤
将各激素的标准贮备液分别在确定的色谱条件下进样,记录每种激素的保留时间,从而定性。将混合标准溶液在确定的色谱条件下重复进样3次,记录保留时间和峰面积,计算相对标准偏差。以各进样浓度为横坐标x,峰面积为纵坐标y,绘制标准工作曲线,计算回归方程及相关系数,从而定量。计算回归方程及相关系数如表1所示。将信噪比S/N=3时检测到的植物激素的最低浓度作为方法的检出限,结果如表1所示,各激素的浓度与峰面积之间有良好的线性关系,相关系数均大于0.9990。
表1 植物激素的标准工作曲线及检出限
样品的测定和加标回收率
称取0.5000g红花玉兰花芽,按照前述步骤进行提取和检测,在已测样品中添加一定量的已知浓度的标准溶液,重复进样5次,计算加标回收率。结果如表2所示,各激素的保留时间标准差均小于0.024,GA3、IAA和ABA的回收率分别为125.18%、109.72%和103.92%,相对标准偏差RSD均小于1.0%。表明本方法重复性好,回收率高,准确可靠。如图1所示,GA3、IAA和ABA标准品色谱图峰形尖锐,不受溶剂峰的干扰;如图2所示,各激素与杂质峰不重叠,分离度较好;如图3所示,样品加入标准品后,在相同的保留时间与样品中的激素叠加出峰。
表2 植物激素的加标回收率
*Mean±SD。
实施例2
将实施例1中红花玉兰植物组织即红花玉兰花芽分别用红花玉兰花被片、红花玉兰叶片、白玉兰花被片和白玉兰叶片替代,其他步骤相同,进行植物激素测定,重复进样3次。各植物组织的GA3、IAA、ABA含量如表3所示,红花玉兰花芽GA3含量最高,为125.31±0.43μg/g.FW;红花玉兰花被片样品为初开期的花被片,除ABA外,其余2种激素均低于处在盛开期的白玉兰花被片;红花玉兰叶片的采样时期为夏季,各项激素的含量均较高;白玉兰叶片采样时期为秋季,IAA含量最低,为0.84±0.04μg/g.FW。
表3 不同植物组织的激素含量
*Mean±SD。
结果表明,本方法同时适用于红花玉兰和白玉兰的植物激素测定,标准差较小,精确度高。本方法适用性广、实用性强,为红花玉兰生长发育规律的研究工作提供了技术支持。
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
Claims (14)
1.一种测定玉兰亚属植物中植物激素的方法,所述植物激素为GA3、IAA和ABA;其特征在于,包括植物激素的提取步骤、标准溶液制备步骤、高效液相色谱分析步骤和标准溶液测定步骤;
所述植物激素的提取步骤如下:
A)采用液氮预冷的研钵低温研磨植物组织样品至粉末,随后加入4℃预冷的甲醇溶液,继续研磨成匀浆;
B)将所述匀浆转入第一离心管中,第一低温避光浸提,1~4℃避光浸提15~21h;
C)第一离心,1~4℃、10000~14000r/min离心8~12min,吸取第一上清液,在沉淀中加入低温甲醇溶液,第二低温避光浸提1~4℃避光浸提1~3h;
D)第二离心,1~4℃、10000~14000r/min离心8~12min,吸取第二上清液,合并第一上清液和第二上清液至第一鸡心瓶;
E)向第一鸡心瓶中滴入氨水,35℃~40℃减压旋转蒸发至水相;
F)将前述水相完全转移至第二离心管,向第二离心管中加入PVPP,常温摇床振荡15~25min后第三离心,10000~14000r/min离心8~12min;吸取第三上清液,并用HCl溶液调节pH至2.5~3.0,随后加入等体积乙酸乙酯萃取,重复操作本步骤1~3次;
G)合并萃取液至第二鸡心瓶,35℃~40℃减压浓缩至干;
H)用初始流动相溶解后过微孔滤膜,得到样品待测液,低温保存,所述初始流动相为20%甲醇,80%0.1M乙酸水溶液;
所述高效液相色谱分析步骤中:
色谱条件为:
色谱柱:Agilent ZORBAX SB-C18;流动相A:甲醇,流动相B:0.1M乙酸水溶液;进样量:10μL;柱温:35℃;检测波长:254nm;
用外标法进行定量测定;
所述高效液相色谱分析步骤中,采用梯度洗脱,洗脱条件:0~5min,20%~20%A;5~10min,20%~30%A;10~20min,30%~30%A;20~23min,30%~40%A;23~40min,40%~40%A;40~45min,40%~20%A;流速:1mL/min。
2.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述玉兰亚属植物为红花玉兰或白玉兰;所述植物组织为红花玉兰花芽、花被片或叶片,或白玉兰的花被片或叶片。
3.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述标准溶液制备步骤具体是,准确称取GA3标准品0.0057g、IAA标准品0.0052g、ABA标准品0.0042g,分别用甲醇定容至10mL,配制成浓度分别为570mg/L、520mg/L、420mg/L的标准贮备液,密封后于-20℃低温避光保存;用移液器吸取一定量各激素的标准贮备液,稀释成相当于原浓度1/4、1/8、1/16、1/32、1/64、1/128、1/256、1/512、1/1024、1/2048的混合标准溶液,低温避光保存备用。
4.根据权利要求3所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述标准溶液测定步骤具体是,将GA3、IAA、ABA的标准贮备液分别在确定的色谱条件下进样,记录每种激素的保留时间,从而定性;再将混合标准溶液在确定的色谱条件下重复进样3次,记录保留时间和峰面积,计算相对标准偏差;以各进样浓度为横坐标x,峰面积为纵坐标y,绘制标准工作曲线,计算回归方程及相关系数,从而定量。
5.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述甲醇溶液为体积分数为80%的甲醇溶液。
6.据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述低温甲醇溶液是4℃预冷的体积分数为80%的甲醇溶液。
7.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述第一低温避光浸提4℃避光浸提15~21h。
8.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述第二低温避光浸提为4℃避光浸提2h。
9.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述第一离心为4℃12000r/min离心10min。
10.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述第二离心为4℃12000r/min离心10min。
11.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述第三离心为12000r/min离心10min。
12.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述摇床振荡为常温摇床振荡20min。
13.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述HCl溶液为0.1M HCl溶液;所述微孔滤膜为0.45μm微孔滤膜;所述低温保存为4℃保存。
14.根据权利要求1所述的测定玉兰亚属植物中植物激素的方法,其特征在于,所述植物激素的提取步骤具体如下:
准确称取0.5000g红花玉兰植物组织样品放入预冷的研钵,加入液氮研磨成粉末后再加入8mL预冷的80%甲醇,研磨成匀浆,转入10mL第一离心管中置于4℃冰箱内第一低温避光浸提15~21h;4℃12000r/min第一离心10min,吸取第一上清液后在沉淀中加入4mL 80%甲醇第二低温避光浸提2h;4℃12000r/min第二离心10min,吸取第二上清液,合并第一上清液和第二上清液至100mL第一鸡心瓶中;加入1滴氨水,35℃~40℃减压旋转蒸发至水相,将水相转移至10mL离心管中,并向第一鸡心瓶中加入2mL超纯水清洗,合并水相;称取0.1000gPVPP于离心管中,常温摇床振荡20min;12000r/min第三离心10min,吸取第三上清液并用0.1M HCl调节pH至2.5~3.0;加入等体积乙酸乙酯萃取,重复3次;合并酯相,倒入第二鸡心瓶中于35℃~40℃条件下减压浓缩至干;用0.5mL的初始流动相溶解后过0.45μm微孔滤膜得到样品待测液,置于4℃冰箱保存,用于测定GA3、IAA和ABA;所述初始流动相为20%甲醇,80%0.1M乙酸水溶液。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201710194381.5A CN107024552B (zh) | 2017-03-28 | 2017-03-28 | 一种测定玉兰亚属植物中植物激素的方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201710194381.5A CN107024552B (zh) | 2017-03-28 | 2017-03-28 | 一种测定玉兰亚属植物中植物激素的方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN107024552A CN107024552A (zh) | 2017-08-08 |
| CN107024552B true CN107024552B (zh) | 2020-03-06 |
Family
ID=59525480
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201710194381.5A Active CN107024552B (zh) | 2017-03-28 | 2017-03-28 | 一种测定玉兰亚属植物中植物激素的方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN107024552B (zh) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107796893B (zh) * | 2017-08-31 | 2019-06-04 | 四川农业大学 | 一种同时测定芍药种子中8种内源激素含量的hplc方法 |
| CN108414653A (zh) * | 2018-03-09 | 2018-08-17 | 福建省热带作物科学研究所 | 一种适用于草本植物内源激素测定的高效提取方法 |
| CN108535374A (zh) * | 2018-03-23 | 2018-09-14 | 山东农业大学 | 一种测定植物组织中生长素的方法 |
| CN108344824A (zh) * | 2018-03-27 | 2018-07-31 | 福建省热带作物科学研究所 | 一种适用于木本植物内源激素测定的高效提取方法 |
| CN110389178A (zh) * | 2018-04-18 | 2019-10-29 | 河北农业大学 | 一种利用高效液相色谱同时测定枣中4种内源激素的方法 |
| CN108445119B (zh) * | 2018-05-23 | 2020-12-04 | 漳州城市职业学院 | 一种适用于联合测定植物内源激素的色谱检测方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101762417A (zh) * | 2010-01-18 | 2010-06-30 | 福州大学 | 一种用于植物激素前处理的分散液液微萃取法 |
| CN104897843A (zh) * | 2015-06-24 | 2015-09-09 | 南京信息工程大学 | 一种茶树嫩芽内源激素含量的测定方法 |
| CN105974015A (zh) * | 2016-05-07 | 2016-09-28 | 中国热带农业科学院农产品加工研究所 | 一种蔬果中烯酰吗啉与赤霉素残留量测定的方法 |
-
2017
- 2017-03-28 CN CN201710194381.5A patent/CN107024552B/zh active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101762417A (zh) * | 2010-01-18 | 2010-06-30 | 福州大学 | 一种用于植物激素前处理的分散液液微萃取法 |
| CN104897843A (zh) * | 2015-06-24 | 2015-09-09 | 南京信息工程大学 | 一种茶树嫩芽内源激素含量的测定方法 |
| CN105974015A (zh) * | 2016-05-07 | 2016-09-28 | 中国热带农业科学院农产品加工研究所 | 一种蔬果中烯酰吗啉与赤霉素残留量测定的方法 |
Non-Patent Citations (5)
| Title |
|---|
| Changes of Endogenous of Level of ABB,IAA and GA-like Substances in Fruitlets of Parthenocarpic Persimmon;Kiyohide Kojima 等;《J.Japan.Soc.Hort.Sci》;19991231;第68卷(第2期);第242-247页 * |
| 濒危植物巴东木莲种子休眠与萌发特性的研究;陈发菊 等;《生物多样性》;20071231;第15卷(第5期);第492-499页 * |
| 芍药休眠芽发育进程内源激素变化研究;袁燕波 等;《浙江农业学报》;20140131;第26卷(第1期);第54-60页 * |
| 高效液相色谱法分离和测定小麦中的5种内源激素;张玉琼 等;《色谱》;20130831;第31卷(第8期);第800-803页 * |
| 高效液相色谱法测定玉米内源激素方法的改进研究;未晓巍 等;《玉米科学》;20131231;第21卷(第3期);第144-148页 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN107024552A (zh) | 2017-08-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107024552B (zh) | 一种测定玉兰亚属植物中植物激素的方法 | |
| Chai et al. | A rapid ultra performance liquid chromatography–tandem mass spectrometric method for the qualitative and quantitative analysis of ten compounds in Eucommia ulmodies Oliv. | |
| CN104897843B (zh) | 一种茶树嫩芽内源激素含量的测定方法 | |
| CN109884207A (zh) | 一种快速准确分析菜籽油中多酚含量的方法 | |
| CN102095822A (zh) | 一种测定烟用山楂酊中有机酸的方法 | |
| CN107290456B (zh) | 一种款冬花液相指纹图谱的构建方法和应用 | |
| CN112946137B (zh) | 一种蓝莓中花色苷的高效液相色谱检测方法 | |
| CN104374854B (zh) | 一种hplc波长切换技术同时测定诺尼果汁中多种酚酸含量的方法 | |
| CN106918667B (zh) | 一种加压微提取设备和加压微提取方法及其应用 | |
| CN111307966A (zh) | 一种灵芝孢子粉及其产品中三萜类成分的hplc测定方法 | |
| CN107271581A (zh) | 一种利用hplc高效测定柑橘果实中酚类化合物的方法 | |
| CN115184497B (zh) | 一种测定铁皮石斛中2,4-表芸苔素内酯含量的方法 | |
| CN115032318B (zh) | 一种检测3-(n-亚硝基甲氨基)丙腈含量的液相色谱分析方法 | |
| CN107064391B (zh) | 一种测定玉兰亚属植物中玉米素的方法 | |
| CN102590372A (zh) | 一种检测烤烟根系分泌物中酚酸种类和含量的方法 | |
| CN106990182B (zh) | 旋覆花配方颗粒的特征图谱建立和检测方法 | |
| CN101093216B (zh) | 烟用料液的气相色谱分析样品预处理方法 | |
| CN103207256B (zh) | 坛紫菜中红藻糖苷和异红藻糖苷含量的检测方法 | |
| Mooi et al. | Simultaneous detection and quantification of zeatin and kinetin in coconut water using ultra performance liquid chromatography coupled with a simple step solid phase extraction | |
| CN107670333B (zh) | 一种原油中烷基苯酚的分离方法 | |
| Xu et al. | Capillary liquid chromatographic analysis of fat-soluble vitamins and β-carotene in combination with in-tube solid-phase microextraction | |
| CN104215614A (zh) | 一种高效液相色谱-二极管阵列/荧光检测器串联检测芦荟苷a、b和芦荟大黄素的方法 | |
| CN103058859B (zh) | 一种香椿叶中没食子酸及其甲酯的同时制备及检测方法 | |
| CN104865334B (zh) | 一种检测叶面肥料中生长调节剂的方法 | |
| CN103529156B (zh) | 一种草莓中aba提取与测定的方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |