CN103845326A - 维格列汀与二甲双胍的复方组合物及其制备方法 - Google Patents
维格列汀与二甲双胍的复方组合物及其制备方法 Download PDFInfo
- Publication number
- CN103845326A CN103845326A CN201410110433.2A CN201410110433A CN103845326A CN 103845326 A CN103845326 A CN 103845326A CN 201410110433 A CN201410110433 A CN 201410110433A CN 103845326 A CN103845326 A CN 103845326A
- Authority
- CN
- China
- Prior art keywords
- metformin
- vildagliptin
- organic solvent
- granule
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Landscapes
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
Abstract
本发明属于药物制剂领域,本发明提供了一种维格列汀和二甲双胍的复方片剂组合物及其制备方法,该组合物含以干重计20~30%的在1%的水溶液的表观黏度为2~4mpas的粘合剂。所提供组合物在改善二甲双胍可压性的同时改善了维格列汀的可压性,粉体的可压性和流动性佳,所制备的复方片剂批间含量差异性小,片剂的脆碎度合格、溶出迅速,工艺可行性高。
Description
技术领域
本发明属于药物制剂领域,具体而言涉及一种含有维格列汀和二甲双胍的复方片剂组合物及其制备方法。
背景技术
糖尿病已经成为继心脑血管、恶性肿瘤之后严重危害人类健康的第三大疾病。根据病理学特点,糖尿病可分为Ⅰ型糖尿病和Ⅱ型糖尿病。Ⅱ型糖尿病为非胰岛素依赖型糖尿病,其严重威胁人类的健康。Ⅱ型糖尿病是以胰岛素抵抗为特征,表现为胰岛β细胞进行性衰竭,从而导致糖负荷后胰岛素分泌不足,以及损伤肠促胰岛素对糖的反应。长期的高血糖将导致严重的微血管和大血管并发症。有效的血糖控制可显著降低糖尿病并发症发病率和死亡率。在Ⅱ型糖尿病发病初期70 %~
80 %的患者需要口服降糖药物进行治疗,目前临床常用的口服抗糖药包括磺酰脲类、双胍类、噻唑烷二酮类等。
维格列汀(vildagliptin),其化学名称为:1-[[(3-羟基-1-金刚烷基)氨基]乙酰基]-2-氰基-(S)-四氢吡咯烷。分子式为C17H15N3O2,相对分子质量为303.4,结构式如下:
。
维格列汀是一种具有选择性、竞争性、可逆的二肽基肽酶Ⅳ(DPP-Ⅳ)抑制剂,其通过与DPP-Ⅳ结合形成DPP-Ⅳ复合物而抑制二肽基肽酶的活性,在提高胰高血糖素样多肽-1(GLP-1)浓度、促使胰岛β细胞产生胰岛素的同时,降低胰高血糖素浓度,从而降低血糖。维格列汀对体重无明显影响,其副作用仅限于低血糖和浮肿,与安慰剂的效用相差无几,但也存在单独服用维格列汀不能控制Ⅱ型糖尿病的情形。
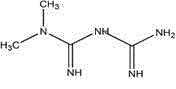
二甲双胍(Metformin),临床上常用其盐酸盐,即盐酸二甲双胍,其化学名称为1,1-二甲基双胍盐酸盐,相对分子质量为165.63,分子式为C4H11N5·HCl,结构式如下:
二甲双胍是双胍类的降血糖药物,是目前世界发达国家广泛使用的唯一口服类的抗高血糖药物,可改善Ⅱ型糖尿病患者对糖的耐受,降低基础及餐后血浆葡萄糖浓度。二甲双胍跟磺脲类药物的作用机制不同,在正常人及Ⅱ型糖尿病患者中不产生低血糖反应,也不产生高胰岛素血症。二甲双胍降血糖机制包括以下几点:(1)促进周围组织细胞对葡萄糖的利用;(2)抑制肝糖原异生作用,因此降低肝糖的输出;(3)抑制肠壁细胞摄取葡萄糖,与胰岛素作用不同,即本品无促使脂肪合成的作用,对正常人无明显降血糖作用,因此,一般不引起低血糖。二甲双胍可用于单纯饮食控制不满意的非胰岛素依赖型糖尿病患者,尤其是肥胖者,用本类药物不但有降血糖作用,还可能减轻体重的作用。但是双胍类降糖药不适用于体重较轻的患者服用,其最主要的副作用是导致乳酸性酸中毒。
EMEA于2007年11月14日批准诺华(Novarits)的维格列汀/盐酸二甲双胍复方片(Eucreas®)上市,治疗Ⅱ型糖尿病,用于治疗使用二甲双胍最大耐受剂量仍不能有效控制血糖的患者或目前已联合使用维格列汀(Galvus)与二甲双胍的患者。该复方片剂的剂量规格为维格列汀/盐酸二甲双胍50mg/850mg或50mg/1000mg。
专利申请CN1400908A公开了含有二肽基肽酶Ⅳ抑制剂和其他抗糖尿病药物的联合用药形式,能有效解决现有技术单独服用常用降糖药物或维格列汀不能有效控制Ⅱ型糖尿病的缺陷,同时具有有效控制血糖、协调保护内皮细胞功能、减少糖尿病并发症等效果,但并未具体公开相应的复方制剂及其制备方法。
诺华公司的专利申请CN101277688A公开了一种二甲双胍和维格列汀的配制物,其公开的复方片剂的优选制备方法为,先将二甲双胍和粘合剂熔融法制粒,然后与维格列汀及其他辅料混合后直接压片或制粒后压片。该申请提供的组合物及制备方法虽然可以一定程度的提高产品的可压性,但重复过程中发现存在工艺重现性差、损失量较大等缺陷。且采用熔融制粒需要使用可局部控温的双螺杆挤出机,由于国内生产设备匮乏,生产设备水平较低,因此采用熔融制粒法对现有复方制剂实现工业化生产存在一定的困难,成本也将更高。
北京润德康医药科技有限公司的专利申请CN101234105 A公开了一种含有二甲双胍和维格列汀的药用组合物及其制备方法。其中公开了一种二甲双胍和维格列汀的复方片剂,通过先将维格列汀与微晶纤维素混合,然后与二甲双胍混合,以50%乙醇溶液为溶剂湿法制粒,然后与其他辅料混合后压片。
北京奥萨医药研究中心有限公司的专利申请CN 101897697A公开了一种降糖药物组合物,包括复方二甲双胍和维格列汀片剂,其以乙醇为溶剂通过湿法制粒将两种主药组分混合后经一次制粒后压片得到。
上述后面两篇文献公开的复方片剂均先将二甲双胍与维格列汀及部分辅料进行固态混合,采用常见的湿法制粒工艺进行制粒后压片制得。二甲双胍和维格列汀的可压性均较差,且二甲双胍的剂量大,维格列汀的剂量小,两者也难以混合均匀,其主要采用湿法或熔融法工艺进行制粒,虽然可以一定程度上改善可压性,但仍存在可压性差和主药难以混合均匀的缺陷。
发明内容
本发明的目的在于提供一种维格列汀和二甲双胍的复方片剂组合物及其制备方法。
本发明所提供的维格列汀和二甲双胍复方组合物包括:活性成分维格列汀和二甲双胍、粘合剂;
其中所述维格列汀为维格列汀或其可药用盐;所述二甲双胍为二甲双胍或其可药用盐,优选为二甲双胍或盐酸二甲双胍。
其中所述维格列汀与二甲双胍的用量质量比为1:10~30,优选为1:15~20,最优选为1:17~20。
所述粘合剂优选在1%的水溶液的表观黏度为2~4mpas羟丙基纤维素或羟丙甲纤维素,更优选地,选自HPC-SSL或Pharmacoat
603,进一步优选HPC-SSL。
所述粘合剂的用量优选为组合物重量的20~30%,进一步优选为20~25%。
进一步地,所述组合物还包括润滑剂。
所述润滑剂优选为硬脂酸镁,其用量优选为组合物重量的0.1~5%,进一步优选0.5~1
%。润滑剂的加入可以防止压片物质粘冲,将片剂压制过程中的摩擦减少至最低,允许从冲模中移出片剂。
上述所述组合物还可以包括其他药学上可用的赋形剂,如填充剂、崩解剂或助流剂。
在获得适宜的上述组合物制备方法上,本发明面临如下挑战:
(1)二甲双胍的剂量大,维格列汀的剂量小,存在混合不均匀问题。
(2)二甲双胍为片状结晶物质,其物料的可压性极差,且剂量大,其对高负荷的药物进行湿法制粒生产是比较难以执行的,且滚压法对于可压性差的物料是不可接受的,直接压片法通常用于低剂量药物的片剂的制备,因此本复方片剂的制备存在难点。
(3)维格列汀是一种本身不可压制、可压性差、且具有吸湿性的物质,其对水敏感,遇水会发生一定程度上的降解。为了克服这个问题,有专利对维格列汀采用直接压片的方式进行片剂的制备,其拥有良好的各项性质,但药物负荷仅25%。
制粒的方式通常包括湿法制粒、干法制粒、熔融制粒、喷干制粒等。其中由于设备的匮乏,熔融制粒在生产中应用较少,而喷干制粒由于产量小、效率低,该工艺也不是生产的首选。常用优选的制粒手段包括湿法制粒和干法制粒。
实验过程中发明人发现,对于本发明提供的组合物,采用湿法或干法制粒先将二甲双胍和粘合剂进行制粒,然后与维格列汀及其他赋形剂混合后直接压片,可改善药物的可压性。其中粘合剂的性质和用量对可压性有相当程度的影响,诺华公司的专利申请CN101277688A的实施例中优选以羟丙甲纤维素(Klucel EXF)为粘合剂,用量基本在7.5%~10%,在发明人对其公开组方和方法的研究和重复过程中发现,其粉末的可压性虽有一定程度的改善,但所制备的颗粒较松散含细粉较多,流动性不够好,制备的颗粒也存在较大的混合不均匀、片含量差异问题。在本发明的研究过程中发现,通过组方中粘合剂和辅料的变化,以及制备方法改变,可以明显进一步改善二甲双胍和维格列汀粉体的可压性,制备得到批间差异性小的复方片剂,片剂的脆碎度合格,工艺可行性高。
本发明提供了一种制备所述维格列汀与二甲双胍的复方组合物的方法,为湿法制粒的方式,包括:将二甲双胍与粘合剂混合均匀后,采用有机溶剂进行制粒,将所制备的颗粒干燥,然后与维格列汀和润滑剂混合均匀,压片。
所述有机溶剂优选为醇类溶剂,所述醇类溶剂优选为乙醇或叔丁醇;其用量是技术人员根据制粒需要可以调整的,优选地,每克二甲双胍加入有机溶剂5~20ml,进一步优选地为5~10ml。
本发明提供了一种所述组合物的制备方法的优选实施方案,通过如下工艺来制备:
(1)二甲双胍和粘合剂粉碎过筛后混合均匀,加适量有机溶剂制软材,用30目筛制粒;
(2)将步骤(1)制得的颗粒干燥,将烘干的颗粒过筛后与维格列汀、润滑剂混合均匀;
(3)采用单冲压片机压片。
本发明提供了另一种制备所述维格列汀与二甲双胍的复方组合物的方法,为干法制粒的方式,包括:将二甲双胍与粘合剂混合均匀后,加入50%处方量的润滑剂,采用压大片法压成大块,后粉碎成一定粒度的颗粒后,与维格列汀、余量润滑剂混合均匀,压片。
本发明提供了一种所述组合物的制备方法的优选实施方案,通过如下工艺来制备:
(1)二甲双胍、粘合剂和50%处方量的润滑剂,粉碎过筛后混合均匀,压成大片;
(2)将大片粉碎、过筛、整粒;
(3)将步骤(2)所得颗粒与维格列汀、余量润滑剂混合均匀;
(4)采用单冲压片机压片。
本发明还提供了一种优选的制备所述复方组合物的方法,包括如下步骤:
(1)将二甲双胍和粘合剂溶解于有机溶剂中,旋蒸除去有机溶剂,得到固体团块;
(2)将所得的固体团块干燥,将干燥后的物料研磨粉碎,得到二甲双胍颗粒;
(3)将得到的二甲双胍颗粒与维格列汀、及润滑剂等辅料混合均匀,压片。
其中,所述有机溶剂优选为醇类溶剂或其与水的混合溶剂,所述醇类溶剂优选为乙醇或叔丁醇,所述有机溶剂优选为90%的乙醇溶液;所述有机溶剂的用量优选为每克二甲双胍加入有机溶剂为100~200ml,进一步优选地,为150~200ml。
该方法进一步提升了二甲双胍的可压性,并促进其与粘合剂的均匀混合,是本发明中优选采用的方法之一。
本发明还提供了另一种优选的制备所述复方组合物的方法,包括:
(1)将二甲双胍和粘合剂粉碎过筛,混合均匀得混合物;
(2)将维格列汀溶解于有机溶剂中,再与(1)中的混合物混合均匀,制软材,30目筛制粒;
(3)将步骤(2)制得颗粒干燥、整粒,然后与润滑剂混合均匀,压片。
其中,所述有机溶剂优选为醇类溶剂,所述醇类溶剂优选为乙醇或叔丁醇;所述有机溶剂的用量优选为每克二甲双胍加入有机溶剂5~20ml,进一步优选为5~10m。
本发明还提供了另一种优选的制备所述复方组合物的方法,包括:
(1)将二甲双胍和粘合剂粉碎过筛,混合均匀得混合物;
(2)将维格列汀溶解于有机溶剂中,再将(1)中的混合物加入维格列汀溶液,混合均匀,旋蒸除去有机溶剂,得到固体团块;
(3)将所得的固体团块干燥,将干燥后的物料研磨粉碎,过30目筛得含维格列汀与二甲双胍的颗粒;
(4)将得到的含维格列汀和二甲双胍的颗粒与润滑剂等辅料混合均匀,压片。
其中,所述有机溶剂优选为醇类溶剂或其与水的混合溶剂,所述醇类溶剂优选为乙醇或叔丁醇,所述有机溶剂优选为90%的乙醇溶液;所述有机溶剂的用量优选为每克二甲双胍加入有机溶剂100~200ml,进一步优选地,为150~200ml 。
由于复方中维格列汀和二甲双胍两种活性药物的剂量相差较大,容易造成混合不均匀问题。该方法较好地改善了混合不均匀的问题。
本发明制备的片剂优选采用20mm×10mm的异形冲压片,所制备的片剂:
——片剂片面光滑;
——片剂硬度为短径在150~200N之间,长径硬度在100~200N之间;
——片剂的脆碎度低于0.5%;
——片剂的厚度在5~8mm之间;
——片剂溶出度测定:至少70~90%的二甲双胍在30min内溶出;至少70~90%的维格列汀在30min内溶出。优选至少90%的二甲双胍在30min内溶出;至少90%的维格列汀在30min内溶出。
所述溶出按照中国药典2010版第二法进行测定,条件如下:
溶出介质:0.1M HCl溶液900mL;温度:37±0.5 ℃;转速:50rpm。
在本发明通过组方中粘合剂和辅料的选择,以及制备方法的改进和优选,可以明显进一步改善二甲双胍和维格列汀粉体的可压性,制备得到批间差异性小的复方片剂,片剂的脆碎度合格,工艺可行性高,很好地改善了粉体的可压性和流动性、以及药物含量混合不均匀的问题。本发明提供的维格列汀和二甲双胍复方制剂产品含量差异性更小、溶出更快,更加适合临床应用。
附图说明
图1为:实施例1、2、3、4、5和对照例1、2制得片剂中维格列汀的溶出曲线;
图2为:实施例1、2、3、4、5和对照例1、2制得片剂中盐酸二甲双胍的溶出曲线。
具体实施方式
下面通过具体的实施例来说明本发明,在以下的实施例中,未详细描述的各种过程与方法是本领域中公知的常规方法。应该正确理解的是:本发明的实施例是为了说明本发明而做出,而不是对本发明的限制,所以在本发明的方法前提下对本发明的简单改造也属于本发明的范围。
实施例 1 湿法制粒
表1 实施例1处方汇总
* 在加工过程中除去。
具体工艺:将二甲双胍针状结晶研磨,过100目筛备用;将羟丙基纤维素过60目筛备用。将二甲双胍与羟丙基纤维素过60目筛10次,混合均匀,加入适量的乙醇进行软材的制备,后采用30目筛进行制粒。将制备好的颗粒放于烘箱中于60℃干燥。将烘干的颗粒过36目筛整粒。将整粒后的颗粒与处方量的维格列汀、硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150N。
实施例 2干法制粒
表2 实施例2处方汇总
* 在加工过程中除去。
具体工艺:将二甲双胍针状结晶研磨,过100目筛备用;将羟丙基纤维素过60目筛备用。将二甲双胍与羟丙基纤维素、50 %处方量的硬脂酸镁过60目筛10次,混合均匀。将混合好的物料采用20 mm
× 10 mm的异形冲压片,后将所压制的片剂采用研钵粉碎到一定粒度。将所粉碎的颗粒过30目筛,保证干法制粒的粒径不超过560μm(30 目筛)。将整粒后的颗粒与处方量的维格列汀、硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150N。
实施例
3
表3 实施例3处方汇总
* 在加工过程中除去。
具体工艺:将处方量的二甲双胍和羟丙基纤维素溶解于90%的乙醇溶液中,将该溶液于60℃、40rpm的转速采用旋蒸除去溶剂。将得到的固体刮出后于60℃烘干。将干燥好的物料采用研钵粉碎到一定粒度。将所粉碎的颗粒过30目筛,保证颗粒的粒径不超过560μm(30 目筛)。将整粒后的颗粒与处方量的维格列汀、硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150N。
实施例
4
表4 实施例4处方汇总
* 在加工过程中除去
具体工艺:将二甲双胍针状结晶研磨,过100目筛备用;将羟丙基纤维素过60目筛备用。将二甲双胍与羟丙基纤维素过60目筛10次,混合均匀;将处方量的维格列汀溶解于少量的纯乙醇中,将含维格列汀的纯乙醇加入到混合物中进行软材的制备,后采用30目筛进行制粒。将制备好的颗粒放于烘箱中于60℃干燥。将烘干的颗粒过36目筛整粒。将整粒后的颗粒与处方量的硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150N。
实施例
5
表5实施例5处方汇总
* 在加工过程中除去。
具体工艺:将二甲双胍针状结晶研磨,过100目筛备用;将羟丙基纤维素过60目筛备用。将二甲双胍与羟丙基纤维素过60目筛10次,混合均匀;将处方量的维格列汀溶解于90%的乙醇溶液中,在将二甲双胍与羟丙基纤维素的混合物加入该溶液中,搅拌混合均匀,将该溶液于60℃、40rpm的转速采用旋蒸除去溶剂。将得到的固体刮出后于60℃烘干。将干燥好的物料采用研钵粉碎到一定粒度。将所粉碎的颗粒过30目筛,保证颗粒的粒径不超过560μm(30 目筛)。将整粒后的颗粒与处方量的硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150N。
实施例
6
表6实施例6处方汇总
* 在加工过程中除去
具体工艺:将处方量的二甲双胍和羟丙基纤维素溶解于90%的乙醇溶液中,将该溶液于60℃、40rpm的转速采用旋蒸除去溶剂。将得到的固体刮出后于60℃烘干。将干燥好的物料采用研钵粉碎到一定粒度。将所粉碎的颗粒过30目筛,保证颗粒的粒径不超过560μm(30 目筛)。将整粒后的颗粒与处方量的维格列汀、低取代羟丙基纤维素、硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150N。
实施例
7
表7实施例7处方汇总
* 在加工过程中除去
具体工艺:将处方量的二甲双胍和羟丙基纤维素溶解于90%的乙醇溶液中,将该溶液于60℃、40rpm的转速采用旋蒸除去溶剂。将得到的固体刮出后于60℃烘干。将干燥好的物料采用研钵粉碎到一定粒度。将所粉碎的颗粒过30目筛,保证颗粒的粒径不超过560μm(30 目筛)。将整粒后的颗粒与处方量的维格列汀、硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150N。
对照例 1湿法制粒
表8 对照例1处方汇总
* 在加工过程中除去。
具体工艺:将二甲双胍针状结晶研磨,过100目筛备用;将羟丙基纤维素过60目筛备用。将二甲双胍与羟丙基纤维素过60目筛10次,混合均匀,加入适量的乙醇进行软材的制备,后采用30目筛进行制粒。将制备好的颗粒放于烘箱中于60℃干燥。将烘干的颗粒过36目筛整粒。将整粒后的颗粒与处方量的维格列汀、硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150 N。
对照例 2湿法制粒
表9 对照例2处方汇总
* 在加工过程中除去
具体工艺:将二甲双胍针状结晶研磨,过100目筛备用;将羟丙基纤维素过60目筛备用。将二甲双胍与羟丙基纤维素过60目筛10次,混合均匀,加入适量的乙醇进行软材的制备,后采用30目筛进行制粒。将制备好的颗粒放于烘箱中于60℃干燥。将烘干的颗粒过36目筛整粒。将整粒后的颗粒与处方量的维格列汀、硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150 N。
对照例 3湿法制粒
对照例3处方汇总
* 在加工过程中除去
具体工艺:将处方量的二甲双胍和羟丙基纤维素溶解于90%的乙醇溶液中,将该溶液于60℃、40rpm的转速采用旋蒸除去溶剂。将得到的固体刮出后于60℃烘干。将干燥好的物料采用研钵粉碎到一定粒度。将所粉碎的颗粒过30目筛,保证颗粒的粒径不超过560μm(30 目筛)。将整粒后的颗粒与处方量的维格列汀、硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150N。
对照例 4湿法制粒
对照例4处方汇总
* 在加工过程中除去
具体工艺:将二甲双胍针状结晶研磨,过100目筛备用;将羟丙基纤维素过60目筛备用。将二甲双胍与羟丙基纤维素过60目筛10次,混合均匀;将处方量的维格列汀溶解于90%的乙醇溶液中,在将二甲双胍与羟丙基纤维素的混合物加入该溶液中,搅拌混合均匀,将该溶液于60℃、40rpm的转速采用旋蒸除去溶剂。将得到的固体刮出后于60℃烘干。将干燥好的物料采用研钵粉碎到一定粒度。将所粉碎的颗粒过30目筛,保证颗粒的粒径不超过560μm(30 目筛)。将整粒后的颗粒与处方量的硬脂酸镁混合15min,混合均匀。根据处方量,称取混合后的物料,采用20mm×10mm的异形冲进行压片,保持短径硬度在150N。
实验例
(
1
)粉体学性质
考察实施例1~5和对照例1、2中最终压片操作之前粉末的粉体学性质,结果如表10所示:
表10 实施例1~5和对照例1、2的粉体学性质
| 实施例 | 松密度(g/mL) | 紧密度(g/mL) | 卡尔指数(%) | 休止角(︒) |
| 实施例1 | 0.483 | 0.653 | 26.02 | 35.8 |
| 实施例2 | 0.453 | 0.675 | 32.88 | 38.5 |
| 实施例3 | 0.493 | 0.658 | 25.08 | 33.5 |
| 实施例4 | 0.480 | 0.665 | 27.82 | 35.3 |
| 实施例5 | 0.486 | 0.652 | 25.46 | 32.5 |
| 对照例1 | 0.497 | 0.700 | 29.00 | 41.8 |
| 对照例2 | 0.441 | 0.691 | 36.18 | 43.6 |
卡尔指数反映粉末的可压性和填充性能,休止角反应粉末的流动性。卡尔指数大的粉末可压性好,但流动性差;卡尔指数小的粉末填充性和流动性好,但可压性差。休止角越小流动性越好。一般情况下,当卡氏指数介于15~30%时,粉末的流动性和可压性均能达到旋转式压片机粉末直接压片的要求。从上表中可以看出,相对于对照例1而言,实施例1、3、4和5的粉末更加适合制备片剂,粉体的流动性较优,而实施例2流动性相对而言稍差,但其可压性较好;对照例2的流动性及可压性均较差。
根据粉体学性质的考察,相对于对照例,实施例1、3、4和5的粉末更适合用于制备片剂,且实施例3和5为其中的最优选。
(
2
)粉体含量均匀性测定
按以上处方工艺,将二甲双胍与粘合剂混合均匀后进行制粒,对所制备的颗粒进行粉体含量均匀性的测定,测定方法如下:根据不同的处方,混合相同时间,制粒后称取3份相同重量的粉体颗粒,加入相同量的水分,超声10 min后用0.45μm微孔滤膜滤,取续滤液1mL至10mL容量瓶中,定容后进样20μL,记录色谱峰面积,由测定结果代入标准曲线求得所称取的粉体颗粒中二甲双胍的含量。
表11实施例1~5和对照例1、2的粉体含量均匀性结果
| 实施例 | 过筛混合次数 | RSD(%) |
| 实施例1 | 10 | 1.8 |
| 实施例2 | 10 | 2.5 |
| 实施例3 | 0 | 0.2 |
| 实施例4 | 10 | 2.1 |
| 实施例5 | 0 | 0.3 |
| 对照例1 | 10 | 3.4 |
| 对照例2 | 10 | 5.2 |
从上表可以看出,对照例1由于粘合剂粘度较大,制粒较难,存在较大颗粒与较多细粉差别,因此粉体含量均匀性不佳;实施例1、2、4和对照例2经过10次过筛后,粉体含量均匀度良好,而实施例3和5不需要经过多次混合即可达到混合均匀度较优的效果。
(
3
)溶出度测定
根据中国药典2010版溶出度测定法(附录XC第二法),以pH 1.2 的HCl溶液900mL为溶剂,温度为37± 0.5℃,转速为50r/min,在0、5、10、15、30、45、60 min分别取溶液10mL,用0.45μm微孔滤膜滤过,取续滤液,并即时在容器中补充pH 1.2 HCl溶液10mL。取续滤液进样20μL,记录色谱峰面积,由测定结果代入标准曲线求得个时间点维格列汀的溶出量,经校正后即得累积溶出度。取续滤液1mL至10mL容量瓶中,定容后进样20μL,记录色谱峰面积,由测定结果代入标准曲线求得个时间点二甲双胍的溶出量,经校正后即得累积溶出度。药物累计释放百分率按如下公式计算:
其中Ci为药物浓度(μg·mL-1);为释放介质体积(mL);为补液体积(mL);W为样品重量(mg);F为制剂中药物的百分含量(%)。
表12 实施例1~5和对照例的片剂中维格列汀的溶出度实验结果
| 取样时(min) | 实施例1 | 实施例2 | 实施例3 | 实施例4 | 实施例5 | 对照例1 | 对照例2 | 对照例3 | 对照例4 |
| 5 | 24.50 | 28.23 | 27.98 | 23.98 | 28.62 | 18.41 | 18.68 | 21.21 | 8.66 |
| 10 | 45.59 | 46.67 | 50.65 | 46.32 | 52.13 | 35.45 | 36.82 | 40.38 | 16.92 |
| 15 | 63.45 | 62.07 | 67.08 | 64.55 | 68.53 | 55.47 | 57.55 | 56.43 | 25.85 |
| 30 | 91.58 | 88.78 | 99.12 | 92.04 | 99.04 | 84.21 | 84.86 | 83.14 | 52.69 |
| 45 | 101.54 | 101.55 | 100.87 | 101.84 | 100.76 | 98.52 | 98.69 | 97.87 | 78.87 |
| 60 | 101.99 | 101.98 | 101.21 | 102.54 | 100.24 | 100.04 | 100.58 | 100.03 | 100.05 |
表13 实施例1~5和对照例的片剂中二甲双胍的溶出度实验结果
| 取样时(min) | 实施例1 | 实施例2 | 实施例3 | 实施例4 | 实施例5 | 对照例1 | 对照例2 | 对照例3 | 对照例4 |
| 5 | 24.98 | 26.82 | 28.01 | 23.99 | 29.39 | 19.54 | 19.93 | 23.01 | 9.08 |
| 10 | 44.66 | 47.38 | 50.56 | 45.06 | 53.02 | 36.41 | 38.66 | 41.18 | 17.88 |
| 15 | 61.17 | 65.48 | 72.04 | 60.45 | 76.44 | 55.69 | 58.45 | 58.14 | 29.06 |
| 30 | 90.66 | 93.75 | 98.89 | 91.25 | 99.25 | 87.14 | 89.20 | 93.41 | 54.07 |
| 45 | 99.94 | 101.07 | 100.01 | 99.55 | 100.51 | 95.25 | 96.35 | 99.98 | 80.28 |
| 60 | 101.67 | 102.84 | 101.83 | 100.05 | 101.05 | 100.21 | 100.07 | 100.02 | 100.11 |
根据溶出的测定结果可知,实施例1~5的产品溶出更加迅速,其中实施例3和5明显相对更优。
Claims (9)
1.一种维格列汀与二甲双胍的复方组合物,其包含:
(1)维格列汀或其可药用盐;
(2)二甲双胍或其可药用盐;
(3)粘合剂;所述粘合剂是在1%的水溶液的表观黏度为2~4mpas羟丙基纤维素或羟丙甲纤维素,其用量是组合物重量的20~30%。
2.如权利要求1所述的复方组合物,其特征在于,所述复方组合物中维格列汀与二甲双胍的质量比为1:10~30,优选为1:15~20,进一步优选为1:17~20。
3.如权利要求1所述的复方组合物,其特征在于,所述粘合剂的用量是组合物重量的20~25%,所述粘合剂为HPC-SSL或Pharmacoat 603,优选HPC-SSL。
4.如权利要求1所述的复方组合物,其特征在于,其中还包括润滑剂,所述润滑剂的重量为组合物重量的0.1~5%,优选为0.5~1 %。
5.权利要求1~4任一项所述的复方组合物的制备方法,其特征在于,制备工艺如下:
(1)二甲双胍和粘合剂粉碎过筛后混合均匀,加适量有机溶剂制软材,用30目筛制粒;
(2)将步骤(1)制得的颗粒干燥,将烘干的颗粒过筛后与维格列汀、润滑剂混合均匀;
(3)采用单冲压片机压片;
所述有机溶剂为醇类溶剂,优选为叔丁醇或乙醇;其用量优选为每克二甲双胍加入有机溶剂5~20ml,进一步优选地为5~10ml。
6.权利要求1~4任一项所述的复方组合物的制备方法,其特征在于,制备工艺如下:
(1)二甲双胍、粘合剂和50%处方量的润滑剂,粉碎过筛后混合均匀,压成大片;
(2)将大片粉碎、过筛、整粒;
(3)将步骤(2)所得颗粒与维格列汀、余量润滑剂混合均匀;
(4)采用单冲压片机压片。
7.权利要求1~4任一项所述的复方组合物的制备方法,其特征在于,制备工艺如下:
(1)将二甲双胍和粘合剂溶解于有机溶剂中,旋蒸除去有机溶剂,得到固体团块;
(2)将所得的固体团块干燥,将干燥后的物料研磨粉碎到一定粒度,得到二甲双胍颗粒;
(3)将得到的二甲双胍颗粒与维格列汀、及润滑剂等辅料混合均匀,压片;
所述有机溶剂为醇类溶剂或其与水的混合溶剂,所述醇类溶剂优选为乙醇或叔丁醇,所述有机溶剂优选为90%的乙醇溶液;所述有机溶剂的用量优选为每克二甲双胍加入有机溶剂为100~200ml,进一步优选地,为150~200ml。
8.权利要求1~4任一项所述的复方组合物的制备方法,其特征在于,制备工艺如下:
(1)将二甲双胍和粘合剂粉碎过筛,混合均匀得混合物;
(2)将维格列汀溶解于有机溶剂中,再与(1)中的混合物混合均匀,制软材,30目筛制粒;
(3)将步骤(2)制得颗粒干燥、整粒,然后与润滑剂混合均匀,压片;
所述有机溶剂为醇类溶剂,优选为乙醇或叔丁醇;所述有机溶剂的用量优选为每克二甲双胍加入有机溶剂5~20ml,进一步优选为5~10m。
9.权利要求1~4任一项所述的复方组合物的制备方法,其特征在于,制备工艺如下:
(1)将二甲双胍和粘合剂粉碎过筛,混合均匀得混合物;
(2)将维格列汀溶解于有机溶剂中,再将(1)中的混合物加入维格列汀溶液,混合均匀,旋蒸除去有机溶剂,得到固体团块;
(3)将所得的固体团块干燥,将干燥后的物料研磨粉碎到一定粒度,过30目筛得含维格列汀与二甲双胍的颗粒;
(4)将得到的含维格列汀和二甲双胍的颗粒与润滑剂等辅料混合均匀,压片;
所述有机溶剂为醇类溶剂或其与水的混合溶剂,所述醇类溶剂优选为乙醇或叔丁醇,所述有机溶剂优选为90%的乙醇溶液;所述有机溶剂的用量优选为每克二甲双胍加入有机溶剂100~200ml,进一步优选地,为150~200ml。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201410110433.2A CN103845326B (zh) | 2014-03-24 | 2014-03-24 | 维格列汀与二甲双胍的复方组合物及其制备方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201410110433.2A CN103845326B (zh) | 2014-03-24 | 2014-03-24 | 维格列汀与二甲双胍的复方组合物及其制备方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN103845326A true CN103845326A (zh) | 2014-06-11 |
| CN103845326B CN103845326B (zh) | 2017-07-07 |
Family
ID=50853731
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201410110433.2A Expired - Fee Related CN103845326B (zh) | 2014-03-24 | 2014-03-24 | 维格列汀与二甲双胍的复方组合物及其制备方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN103845326B (zh) |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104288144A (zh) * | 2014-10-22 | 2015-01-21 | 上海麦步医药科技有限公司 | 含有维格列汀、盐酸二甲双胍复方制剂的制备方法 |
| CN105769796A (zh) * | 2016-05-04 | 2016-07-20 | 杭州百诚医药科技股份有限公司 | 一种含有维格列汀和盐酸二甲双胍的药物制剂及其制备方法 |
| CN106265641A (zh) * | 2016-08-12 | 2017-01-04 | 齐鲁制药有限公司 | 一种含有维格列汀和二甲双胍的药物组合物及其制备方法 |
| CN106421794A (zh) * | 2016-09-27 | 2017-02-22 | 黑龙江珍宝岛药业股份有限公司 | 一种用于治疗ⅱ型糖尿病的药物组合物及其制备方法 |
| CN106551927A (zh) * | 2015-09-30 | 2017-04-05 | 深圳翰宇药业股份有限公司 | 包含维格列汀和盐酸二甲双胍的药物组合物及其制备方法 |
| CN106580960A (zh) * | 2015-10-19 | 2017-04-26 | 南京优科制药有限公司 | 一种维格列汀和盐酸二甲双胍复方制剂的制备方法 |
| CN107536831A (zh) * | 2016-06-29 | 2018-01-05 | 深圳翰宇药业股份有限公司 | 一种含维格列汀与二甲双胍的组合物及制备方法 |
| CN113143929A (zh) * | 2021-04-15 | 2021-07-23 | 浙江诺得药业有限公司 | 一种西格列汀复方制剂的制备方法 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101181264A (zh) * | 2007-11-27 | 2008-05-21 | 北京润德康医药技术有限公司 | 一种以盐酸二甲双胍和维格列汀为活性成分的药用组合物及其制备方法、用途 |
| CN101208085A (zh) * | 2005-06-10 | 2008-06-25 | 诺瓦提斯公司 | 1-[(3-羟基-金刚烷基-1-基氨基)-乙酰基]-吡咯烷基-2(s)-腈的调释制剂 |
| CN101234105A (zh) * | 2008-01-09 | 2008-08-06 | 北京润德康医药技术有限公司 | 一种含有二甲双胍和维格列汀的药用组合物及其制备方法 |
| CN101277688A (zh) * | 2005-09-29 | 2008-10-01 | 诺瓦提斯公司 | 包含甲福明和维达列汀的配制物 |
| CN101897696A (zh) * | 2009-05-27 | 2010-12-01 | 北京奥萨医药研究中心有限公司 | 降糖药物组合物及其用途 |
| CN103285398A (zh) * | 2013-06-28 | 2013-09-11 | 青岛黄海制药有限责任公司 | 含有dpp-ⅳ抑制剂和第二种糖尿病药物的复方制剂及其制备方法 |
-
2014
- 2014-03-24 CN CN201410110433.2A patent/CN103845326B/zh not_active Expired - Fee Related
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101208085A (zh) * | 2005-06-10 | 2008-06-25 | 诺瓦提斯公司 | 1-[(3-羟基-金刚烷基-1-基氨基)-乙酰基]-吡咯烷基-2(s)-腈的调释制剂 |
| CN101277688A (zh) * | 2005-09-29 | 2008-10-01 | 诺瓦提斯公司 | 包含甲福明和维达列汀的配制物 |
| CN101181264A (zh) * | 2007-11-27 | 2008-05-21 | 北京润德康医药技术有限公司 | 一种以盐酸二甲双胍和维格列汀为活性成分的药用组合物及其制备方法、用途 |
| CN101234105A (zh) * | 2008-01-09 | 2008-08-06 | 北京润德康医药技术有限公司 | 一种含有二甲双胍和维格列汀的药用组合物及其制备方法 |
| CN101897696A (zh) * | 2009-05-27 | 2010-12-01 | 北京奥萨医药研究中心有限公司 | 降糖药物组合物及其用途 |
| CN103285398A (zh) * | 2013-06-28 | 2013-09-11 | 青岛黄海制药有限责任公司 | 含有dpp-ⅳ抑制剂和第二种糖尿病药物的复方制剂及其制备方法 |
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104288144A (zh) * | 2014-10-22 | 2015-01-21 | 上海麦步医药科技有限公司 | 含有维格列汀、盐酸二甲双胍复方制剂的制备方法 |
| CN106551927A (zh) * | 2015-09-30 | 2017-04-05 | 深圳翰宇药业股份有限公司 | 包含维格列汀和盐酸二甲双胍的药物组合物及其制备方法 |
| CN106580960A (zh) * | 2015-10-19 | 2017-04-26 | 南京优科制药有限公司 | 一种维格列汀和盐酸二甲双胍复方制剂的制备方法 |
| CN105769796A (zh) * | 2016-05-04 | 2016-07-20 | 杭州百诚医药科技股份有限公司 | 一种含有维格列汀和盐酸二甲双胍的药物制剂及其制备方法 |
| CN105769796B (zh) * | 2016-05-04 | 2019-06-04 | 杭州百诚医药科技股份有限公司 | 一种含有维格列汀和盐酸二甲双胍的药物制剂及其制备方法 |
| CN107536831A (zh) * | 2016-06-29 | 2018-01-05 | 深圳翰宇药业股份有限公司 | 一种含维格列汀与二甲双胍的组合物及制备方法 |
| CN106265641A (zh) * | 2016-08-12 | 2017-01-04 | 齐鲁制药有限公司 | 一种含有维格列汀和二甲双胍的药物组合物及其制备方法 |
| CN106265641B (zh) * | 2016-08-12 | 2019-07-30 | 齐鲁制药有限公司 | 一种含有维格列汀和二甲双胍的药物组合物及其制备方法 |
| CN106421794A (zh) * | 2016-09-27 | 2017-02-22 | 黑龙江珍宝岛药业股份有限公司 | 一种用于治疗ⅱ型糖尿病的药物组合物及其制备方法 |
| CN113143929A (zh) * | 2021-04-15 | 2021-07-23 | 浙江诺得药业有限公司 | 一种西格列汀复方制剂的制备方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN103845326B (zh) | 2017-07-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103845326A (zh) | 维格列汀与二甲双胍的复方组合物及其制备方法 | |
| CN103301084B (zh) | 一种盐酸小檗碱片及其制备方法 | |
| CN101574323B (zh) | 一种米格列醇微囊片剂及其制备方法 | |
| CN106924208A (zh) | 一种复方达格列净二甲双胍缓释片及其制备方法 | |
| CN103479592B (zh) | 一种盐酸二甲双胍缓释片及其制备方法 | |
| CN105582008A (zh) | 一种含有维格列汀和二甲双胍的组合物及其制备方法 | |
| CN105233300B (zh) | 一种稳定的维格列汀组合物及其制备方法 | |
| CN106265641A (zh) | 一种含有维格列汀和二甲双胍的药物组合物及其制备方法 | |
| CN101181264A (zh) | 一种以盐酸二甲双胍和维格列汀为活性成分的药用组合物及其制备方法、用途 | |
| CN105496966A (zh) | 一种恩格列净固体分散体的药物组合物及其制备方法 | |
| JP2019516706A (ja) | ダパグリフロジンの新規な結晶形並びにその製造方法および用途 | |
| CN104586795A (zh) | 一种卡格列净片及其制备方法 | |
| CN103251593B (zh) | 瑞格列奈二甲双胍组合物 | |
| CN103251594B (zh) | 瑞格列奈二甲双胍的片剂 | |
| CN106924237A (zh) | 一种含有恩格列净和盐酸二甲双胍的药物组合物 | |
| CN103505466B (zh) | 含有盐酸二甲双胍与格列美脲的固体复方制剂及其制备方法和用途 | |
| CN105663131B (zh) | 一种瑞格列奈二甲双胍片药物组合物及其制备方法 | |
| CN103735544A (zh) | 一种维达列汀/盐酸二甲双胍复方制剂的制备工艺 | |
| CN109528706A (zh) | 一种用于治疗糖尿病的药物组合物及其制备方法和用途 | |
| CN1235576C (zh) | 阿魏酸钠的缓释剂型及其制备方法 | |
| CN103705515A (zh) | 含有瑞格列奈和盐酸二甲双胍的药物组合物的制备方法 | |
| CN115671061A (zh) | 一种利格列汀片及其制备方法 | |
| CN103070829A (zh) | 一种包含普拉克索及其可药用盐的活性成分的药物组合物及其制备方法 | |
| CN104224783A (zh) | 一种含瑞格列奈二甲双胍的药物组合物及其制备方法 | |
| CN106580962B (zh) | 二甲双胍与维格列汀复方片剂及其制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant | ||
| CP01 | Change in the name or title of a patent holder | ||
| CP01 | Change in the name or title of a patent holder |
Address after: 211112 Jiangsu Province, Nanjing City, Jiangning Science Park Road No. 699 Patentee after: JIANGSU AOSAIKANG PHARMACEUTICAL Co.,Ltd. Address before: 211112 Jiangsu Province, Nanjing City, Jiangning Science Park Road No. 699 Patentee before: JIANGSU AOSAIKANG PHARMACEUTICAL Co.,Ltd. |
|
| CF01 | Termination of patent right due to non-payment of annual fee | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20170707 |