CN103269709A - Sanfilippo综合症类型B的治疗 - Google Patents
Sanfilippo综合症类型B的治疗 Download PDFInfo
- Publication number
- CN103269709A CN103269709A CN2011800407953A CN201180040795A CN103269709A CN 103269709 A CN103269709 A CN 103269709A CN 2011800407953 A CN2011800407953 A CN 2011800407953A CN 201180040795 A CN201180040795 A CN 201180040795A CN 103269709 A CN103269709 A CN 103269709A
- Authority
- CN
- China
- Prior art keywords
- naglu
- protein
- described method
- brain
- sheath
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0085—Brain, e.g. brain implants; Spinal cord
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/47—Hydrolases (3) acting on glycosyl compounds (3.2), e.g. cellulases, lactases
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/465—Hydrolases (3) acting on ester bonds (3.1), e.g. lipases, ribonucleases
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/19—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles lyophilised, i.e. freeze-dried, solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y301/00—Hydrolases acting on ester bonds (3.1)
- C12Y301/06—Sulfuric ester hydrolases (3.1.6)
- C12Y301/06013—Iduronate-2-sulfatase (3.1.6.13)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
Abstract
除了其它的以外,本发明提供了治疗Sanfilippo综合症类型B(Sanfilippo B)的方法和组合物,通过例如鞘内(IT)施用Naglu蛋白质。合适的Naglu蛋白质可以是重组的、基因活化的或者天然的蛋白质。在一些实施方案中,合适的Naglu蛋白质是重组的Naglu蛋白质。在一些实施方案中,重组的Naglu蛋白质是融合蛋白质,其含有Naglu域和溶酶体靶向部分。在一些实施方案中,所述靶向域是IGF-II部分。
Description
相关申请的交叉引用
本申请要求美国临时申请序列号61/358,857(2010年06月25日提交)、61/360,786(2010年7月1日提交)、61/387,862(2010年9月29日提交)、61/435,710(2011年1月24日提交)、61/442,115(2011年2月11日提交)、61/476,210(2011年4月15日提交)、和61/495,268(2011年6月9日提交)的优先权;其中每个的整体通过参考的方式并入本文。
与该申请相关的美国申请:名称为“治疗试剂的CNS递送;”于同日提交;“乙酰肝素N-硫酸酯酶CNS递送的方法和组合物,”于同日提交;“艾杜糖醛酸-2-硫酸酯酶的CNS递送的方法和组合物,”于同日提交;“β-半乳糖脑苷脂酶CNS递送的方法和组合物,”于同日提交;“芳基硫酸酯酶A的CNS递送的方法和组合物,”于同日提交;其中每个的整体通过参考的方式并入本文。
背景技术
酶替代治疗(ERT)涉及全身施用天然或者重组来源的蛋白质和/或酶至受试者。批准的疗法通常是通过静脉向受试者施用,并且对于治疗潜在的酶缺乏症的躯体症状有效。由于所述静脉施用的蛋白质和/或酶在进入所述中枢神经系统(CNS)的细胞和组织内的有限分布,具有CNS病因学的所述疾病的治疗尤其具有挑战性,因为所述静脉施用的蛋白质和/或酶没有充分穿过血-脑屏障(BBB)。
所述血-脑屏障(BBB)是由内皮细胞构成的体系,其功能是保护所述中枢神经系统(CNS)使免于遭受在所述血流中的有害物质,例如细菌、大分子(例如蛋白质)和其它亲水性分子,通过限制这种物质穿过所述BBB的扩散并进入所述潜在的脑脊髓液(CSF)和CNS。
有几种绕过所述BBB的方式,以增强治疗试剂的脑递送,包括直接的颅内注射、所述BBB的短暂通透性、以及修饰活性剂以改变组织分布。治疗试剂完全绕过所述血管直接注射进入脑组织,但是主要有患并发症(传染、组织损伤、免疫应答)的风险,所述并发症由颅内注射、以及所述活性剂从所述施用位点的轻度扩散所引起。到目前为止,蛋白质直接施用进所述脑物质中不能实现显著的治疗效果,因为扩散障碍和可以被施用的治疗体积有限。对流协助扩散已经通过放置在所述脑实质中的导管研究,使用缓慢的、长期的输液(Bobo,等,Proc.Natl.Acad.Sci.U.S.A91,2076-2080(1994);Nguyen,等J.Neurosurg.98,584-590(2003)),但是没有使用这种方法进行长期治疗的批准疗法。另外,大脑内导管的放置是非常侵入性的,并且作为临床替代不太理想。
鞘内(IT)注射,或者施用蛋白质到所述脑脊髓液(CSF),也已经被尝试,但是没有产生成功的治疗。在这种治疗方法中的主要的挑战是所述活性剂倾向于非常紧密地绑定在脑室室管膜衬里,其阻止了随后的扩散。目前,通过直接施用到所述CSF以治疗脑遗传性疾病,还没有批准的产品。
事实上,很多人都认为在大脑表面扩散的障碍、以及缺乏有效和便捷的递送方式,极大地妨碍了在大脑中任何疾病达到足够的治疗效果。
Sanfilippo综合症、或者黏多糖贮积症III(MPS III)是一种罕见的遗传性疾病,其特征在于涉及粘多糖(GAG)降解的酶的缺乏。在缺乏所述酶的情况下,部分降解的GAG分子不能从身体清除,并且在多种组织的溶酶体中累积,导致进行性广泛的身体功能障碍(Neufeld and Muenzer,2001)。
已经识别MPSIII的四种不同形式,称为MPS IIIA、B、C、和D。每种代表了参与硫酸乙酰肝素降解的四种酶之一的缺乏。所有形式包括不同程度的所述相同临床症状,包括粗面部特征、肝脾大、角膜混浊和骨骼畸形。更加显著地,然而,是认知能力的严重和进行性丧失,其不仅与硫酸乙酰肝素在神经元中的积累相关,而且与随后由初级GAG积累导致的神经节糖苷脂GM2、GM3和GD2升高(Walkley1998)相关。
黏多糖贮积症类型IIIB(MPS IIIB;Sanfilippo B疾病)是常染色体隐性遗传病,其特征在于所述酶α-N-乙酰-氨基葡萄糖苷酶的缺乏。在缺乏所述酶的情况下,GAG硫酸乙酰肝素在神经元和胶质细胞中累积,而在所述脑外累积减少。到目前为止,还没有成功地以任何方式治疗Sanfilippo B疾病导致的CNS症状。
因此,仍然非常需要有效地将治疗试剂递送到所述脑。更具体地讲,非常需要更有效地递送治疗试剂到所述中枢神经系统,用于治疗SanfilippoB疾病。
发明概述
本发明提供了有效治疗Sanfilippo B疾病的组合物和方法。部分上,本发明基于所述发现的基础上:即鞘内施用α-N-乙酰氨基(Naglu)蛋白质(例如,Naglu-IGFII融合蛋白质)至动物疾病模型,出乎意料地对于治疗Sanfilippo B疾病的多种症状(例如,改善、抑制、或者延缓其发生)有效,包括大量GAG在多种脑组织中积累。
在本发明之前,据报道,重组制备的Naglu蛋白质缺乏甘露糖-6-磷酸盐(M6P),其对于溶酶体靶向通常是必需的。因此,对于Sanfilippo B疾病的酶替代治疗提供了独特的挑战,由于在所述CNS中的主要表现和M6P残基的缺乏。如下文所描述的,本发明人已经证明,鞘内注射Naglu-IGFII曾意外地导致GAG积累在所述脑中减少,溶酶体储存在脑组织中的逆转,以及Naglu-IGFII渗透进入所述脑实质。在不希望受任何特定理论约束的情况下,这也是考虑到的,溶酶体靶向部分(例如IGF-II部分)可以克服甘露糖-6-磷酸盐(M6P)的缺乏,导致在所述靶组织中,M6P-非依赖的溶酶体定位。这些结果表明,IT施用的Naglu-蛋白质,例如Naglu-IGFII融合蛋白质,可以用来有效治疗Sanfilippo B疾病。因此,本发明在SanfilippoB酶替代治疗方面提供了显著突破。
尽管在下文所述实施例中描述了IT施用,这也是考虑到的,根据本发明的Naglu融合蛋白质直接递送至所述CNS,或者通过多种技术和途径,包括但不限于,脑实质内的、大脑内的、脑室内的(ICV)、鞘内的(例如,IT-腰椎、IT-小脑延髓池)施用,以及其它直接或间接注射入所述CNS技术和/或CSF的技术和途径。
在一个方面中,本发明提供了治疗Sanfilippo综合症类型B(San B)疾病的方法,所述方法包括步骤:向需要治疗的受试者鞘内施用α-N-乙酰氨基(Naglu)蛋白质。如本文所使用的,合适的Naglu蛋白质可以是合成的、重组的、基因活化的或者天然的蛋白质。
在一些实施方案中,合适的Naglu蛋白质是重组的Naglu蛋白质。在一些实施方案中,所述重组的Naglu蛋白质是融合蛋白质,所述融合蛋白质包括Naglu结构域和溶酶体靶向部分。在某些实施方案中,所述Naglu结构域包括与SEQ ID NO:1(成熟人类Naglu蛋白质)至少70%(例如,至少75%、80%、85%、90%、95%、或者98%)一致的氨基酸序列。在一些实施方案中,所述Naglu结构域包括与SEQ ID NO:1(成熟人类Naglu蛋白质)至少95%地一致的氨基酸序列。在一些实施方案中,所述Naglu结构域包括与SEQ ID NO:1(成熟人类Naglu蛋白质)一致的氨基酸序列。
在一些实施方案中,所述溶酶体靶向部分为IGF-II部分。在某些实施方案中,所述IGF-II部分包括与成熟人类IGF-II(SEQ ID NO:3)至少70%(例如,至少75%、80%、85%、90%、95%、或者98%)一致的氨基酸序列。在某些实施方案中,所述IGF-II部分包括与成熟人类IGF-II(SEQ IDNO:3)至少80%地一致的氨基酸序列。在某些实施方案中,所述IGF-II部分包括与成熟人类IGF-II(SEQ ID NO:2)至少90%一致的氨基酸序列。在一些实施方案中,所述IGF-II部分包括氨基酸序列,并且所述氨基酸序列包含成熟人类IGF-II(SEQ ID NO:3)的残基8-67。
在一些实施方案中,所述融合蛋白质进一步包括在所述Naglu结构域与所述溶酶体靶向部分之间的连接体。在某些实施方案中,所述连接体包括一条或多条GGGGGAAAAGGGG(SEQ ID NO:4)的氨基酸序列。在某些实施方案中,GGGGGAAAAGGGG(SEQ ID NO:4)的氨基酸序列以串联重复的方式存在。
在一些实施方案中,所述连接体进一步包括一个或多个GAP序列。在某些实施方案中,所述连接体包括氨基酸序列GAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAP(SEQ ID NO:5)。
在一些实施方案中,所述溶酶体靶向部分直接融合或者通过连接体与所述Naglu结构域的C-末端融合。在一些实施方案中,所述溶酶体靶向部分直接融合或者通过连接体与所述Naglu结构域的N-末端融合。
在一些实施方案中,所述重组的蛋白质从人类细胞制备。在一些实施方案中,所述重组的蛋白质从CHO细胞制备。
在一些实施方案中,所述鞘内施用导致在一种或多种脑靶组织中递送所述Naglu蛋白质。在某些实施方案中,所述一种或多种脑靶组织选自:灰质,白质,脑室周围区域,软膜蛛网膜,脑膜,新皮质,小脑,大脑皮层的深部组织,分子层,尾状核/豆状核区域,中脑,脑桥或者延髓的深部区域,及其组合。
在一些实施方案中,所述Naglu蛋白质被递送至神经元、胶质细胞、血管周细胞和/或脑膜细胞。在一些实施方案中,所述Naglu蛋白质被进一步递送至在所述脊髓中的神经元。
在一些实施方案中,所述鞘内施用进一步导致所述Naglu蛋白质在外周靶组织中的全身递送。在某些实施方案中,所述外周靶组织选自:肝脏、肾脏、脾脏、和/或心脏。
在一些实施方案中,所述鞘内施用导致在脑靶组织、脊髓神经元和/或外周靶组织中的溶酶体定位。
在一些实施方案中,所述鞘内施用导致溶酶体储存(例如,累积的酶底物)在所述脑靶组织、脊髓神经元和/或外周靶组织中减少。某些实施方案中,所述溶酶体储存通过LAMP-1染色测定。在一些实施方案中,所述溶酶体储存与对照相比,以至少20%、40%、50%、60%、80%、90%、1-倍、1.5-倍或者2-倍地减少。
在一些实施方案中,所述鞘内施用导致在神经元中液泡化减少。在某些实施方案中,所述神经元包括浦肯野细胞。
在一些实施方案中,所述鞘内施用导致Naglu酶活性在所述脑靶组织、脊髓神经元和/或外周靶组织中增加。在某些实施方案中,所述Naglu酶活性与对照相比,以至少1-倍、2-倍、3-倍、4-倍、5-倍、6-倍、7-倍、8-倍、9-倍或者10-倍地增加(例如,在所述受试者中的所述预处理内源性酶活性)。在某些实施方案中,所述增加的Naglu酶活性为至少大约10nmol/hr/mg,20nmol/hr/mg,40nmol/hr/mg,50nmol/hr/mg,60nmol/hr/mg,70nmol/hr/mg,80nmol/hr/mg,90nmol/hr/mg,100nmol/hr/mg,150nmol/hr/mg,200nmol/hr/mg,250nmol/hr/mg,300nmol/hr/mg,350nmol/hr/mg,400nmol/hr/mg,450nmol/hr/mg,500nmol/hr/mg,550nmol/hr/mg或者600nmol/hr/mg。如本文所使用的,nmol/hr/mg定义了所述酶的特异性活性,其度量每mg酶每小时水解的nmol底物。
在一些实施方案中,所述Naglu酶活性在所述腰椎区域中增加。在某些实施方案中,在所述腰椎区域中,所述增加的Naglu酶活性为至少大约500nmol/hr/mg,600nmol/hr/mg,700nmol/hr/mg,800nmol/hr/mg,900nmol/hr/mg,1000nmol/hr/mg,1500nmol/hr/mg,2000nmol/hr/mg,3000nmol/hr/mg,4000nmol/hr/mg,5000nmol/hr/mg,6000nmol/hr/mg,7000nmol/hr/mg,8000nmol/hr/mg,9000nmol/hr/mg或者10,000nmol/hr/mg。
在一些实施方案中,所述鞘内施用Sanfilippo B综合症的至少一种症状或特征在强度、严重程度或者频率方面减少,或者延缓发生。在一些实施方案中,San B疾病的至少一种症状或特征为听力损失、语言发展迟缓、运动技能缺陷、活动过度、智力迟钝、攻击性和/或睡眠障碍。
在一些实施方案中,所述鞘内施用的发生每两个星期一次。在一些实施方案中,所述鞘内施用的发生每月一次。在一些实施方案中,所述鞘内施用的发生每两个月一次。在一些实施方案中,所述鞘内施用被用于连同静脉施用。在一些实施方案中,所述静脉施用频率没有比每隔一周更频繁。在一些实施方案中,所述静脉施用没有比每两个星期一次更频繁。在一些实施方案中,所述静脉施用没有比每月一次更频繁。在一些实施方案中,所述静脉施用没有比每两个月一次更频繁。在某些实施方案中,所述静脉施用比每月一次施用更频繁,例如每周两次、每周一次、每隔一周一次或者每月两次。
在一些实施方案中,静脉和鞘内施用在同一天进行。在一些实施方案中,所述静脉和鞘内施用不在彼此的一定时间内执行,例如不执行:在至少2天以内,在至少3天以内,在至少4天以内,在至少5天以内,在至少6天以内,在至少7天以内,或者在至少一周以内。在一些实施方案中,静脉和鞘内施用按照交替的时间表执行,例如每周一次、每隔一周、每月两次或者每月一次交替施用。在一些实施方案中,鞘内施用替代在施用时间表上的静脉施用,例如在每周一次、每隔一周、每月两次或者每月一次的静脉施用时间表上,在该时间表中的每第三次或第四次或第五次施用可以用鞘内施用代替静脉施用。
在一些实施方案中,静脉和鞘内施用是连续地执行的,例如首先执行静脉施用(例如,每周一次、每隔一周、每月两次或者每月一次给药为期两周、一个月、二个月、三个月、四个月、五个月、六个月或者一年或者更久),然后鞘内施用(例如每周一次、每隔一周、每月两次或者每月一次给药为期多于两周、一个月、二个月、三个月、四个月、五个月、六个月或者一年或者更久)。在一些实施方案中,首先执行鞘内施用(例如,每周一次、每隔一周、每月两次、每月一次、每两个月一次、每隔三个月一次,给药为期两周、一个月、二个月、三个月、四个月、五个月、六个月或者一年或者更久),然后静脉施用(例如每周一次、每隔一周、每月两次或者每月一次,给药为期多于两周、一个月、二个月、三个月、四个月、五个月、六个月或者一年或者更久)。
在一些实施方案中,所述鞘内施用在缺乏静脉施用时使用。
在一些实施方案中,所述鞘内施用在缺乏并发免疫抑制疗法时使用。
在一些实施方案中,所述Naglu融合蛋白质以大于大约20mg/ml浓度施用。
在另一个方面中,本发明提供了治疗性融合蛋白质,所述治疗性融合蛋白质包含Naglu结构域;溶酶体靶向部分,并且其中,一旦施用,所述治疗性融合蛋白质被靶向溶酶体并且在活体内治疗性地活化。
在一些实施方案中,所述Naglu结构域包括与SEQ ID NO:1(成熟人类Naglu蛋白质)至少70%(例如,至少75%、80%、85%、90%、95%,或者98%)的氨基酸序列。在一些实施方案中,所述Naglu结构域包括与SEQ IDNO:1(成熟人类Naglu蛋白质)一致的氨基酸序列。在一些实施方案中,所述溶酶体靶向部分为IGF-II部分。在一些实施方案中,所述IGF-II部分包括与成熟人类IGF-II(SEQ ID NO:3)至少70%(例如,至少75%、80%、85%、90%、95%,或者98%)一致的氨基酸序列。在一些实施方案中,所述IGF-II部分包括氨基酸序列,并且所述氨基酸序列包含成熟人类IGF-II(SEQ ID NO:3)的残基8-67。
在一些实施方案中,所述融合蛋白质进一步包括在所述Naglu结构域与所述溶酶体靶向部分之间的连接体。在一些实施方案中,所述连接体包括氨基酸序列
GAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAP(SEQ ID NO:5)。
在一些实施方案中,所述溶酶体靶向部分直接融合或者通过连接体与所述Naglu结构域的C-末端融合。在一些实施方案中,
在又一实施方案中,本发明提供了治疗性融合蛋白质,所述治疗性融合蛋白质包含与SEQ ID NO:6(所述全长Naglu-IGF-II融合蛋白质)至少70%(例如,至少75%、80%、85%、90%、95%,或者98%)一致的氨基酸序列,其中,一旦施用,所述治疗性融合蛋白质被靶向溶酶体,并且在活体内治疗性地活化。
如在这个申请中使用的,所述术语“大约”和“约”是等价使用的。在本申请中使用的任何具有或不具有大约/约的数字,其意思是打算覆盖被在相关技术领域的普通技术人员所意识到的任何正常波动。
本发明的其它特征、目标和优点在下面的详细描述中是显而易见的。应该理解,尽管详细地描述,为了表明本发明的实施方案,仅仅是以解说的方式给出,而不是加以限制。现有技术的技术人员从所述详细的描述中,显而易见地得到在本发明范围以内的多种变化和修改。
附图简述
所述附图仅仅是解释的目的,而不是为了限制。
图1图解了示例性的rhNaglu、Naglu-IGFII、Naglu-TAT和Naglu Kif,以及验证性概念研究(POC)的结果。(no.of aa/theori mw-氨基酸数目和理论分子重量).
图2图解了示例性的PerT-Naglu和Naglu-ApoE。制备这两种修饰的rhNaglu,以检测经过所述BBB的运输酶。
图3A图解了示例性的IGFII分子,其显示氨基酸序列8-67(绿色的),作为与IGF II受体(图来自对Hashimoto1995,20的修改)的结合序列。图3B图解了示例性的M6P/IGF II受体和它的15个结构域。结构域3和9(绿色的)结合甘露糖-6-磷酸盐,而结构域5结合甘露糖-6-磷酸盐双酯。结构域11(黄色的)结合IGFII(图来自对Bohnsack2009,22的修改)。
图4图解了示例性的Naglu-IGFII克隆47dz2-15的波产量。所述Naglu-IGFII的平均产量为0.5pcd(统计图,每天,每百万细胞,每图)。GH,生长收获;H1至H8,收获1-8。
图5图解了从在图2-5中波产量收获的示例性Western blot分析。通过培养基的体积,将泳道归一化。
图6图解了在与PNGase F去糖基化之前和之后,Naglu-IGFII示例性的Western blot分析。在PNGase F消化之前消失的带是糖基化时,溶酶体蛋白质主要的外观。在PNGase F消化期间,所述蛋白质带变得清晰和密集,这是与均一的多肽链一致的外观。对于抗-人Naglu和抗-IGFII抗体的分析,证实了,只有Naglu-IGFII的完整分子被克隆47dz2-15表达。“-“,表示在PNGaseF消化之前收获的材料。“+”,表示在PNGase F消化之后收获的材料。
图7图解了Naglu-IGFII示例性的纯化方案,并且SDS-PAGE凝胶说明了来自条件培养基的Naglu-IGFII逐步纯化。
图8图解了示例性的Naglu-Kif蛋白质结晶体。
图9图解了Naglu作为漫画模型,示例性的结晶体机构。三个结构域以结构域I、结构域II和结构域III表示。多糖以棍棒显示。接触反应的残基是E316和E446。
图10图解了Naglu示例性的三聚体结构。所述3个分子的活性位点被标记。
图11图解了来自正常人类的示例性原代成纤维细胞,其用于rhNaglu和Naglu-IGFII的细胞内化研究。rhNaglu的细胞吸收是最小程度的,而Naglu-IGFII的细胞吸收更加显著。Naglu-IGFII内化的饱和曲线表明了受体介导的吸收。这种吸收被IGFII抑制,但不被甘露糖-6-磷酸盐抑制。
图12描述示例性的共聚焦显微镜研究,其使用Sanfilippo B患者的成纤维细胞(GM01426)。观察到:Naglu-IGFII的广泛内在化,以及Naglu-IGFII与Lamp-1的共定位。
图13为示例性的图解,其显示了在野生类型(WT)、Naglu-/-(KO)和杂合体Naglu+/-(Het)小鼠中的Naglu活性。Naglu的总缺陷在SanfilippoB小鼠的脑、肝脏、肾脏和脾脏中观察到。
图14描述了小鼠脑的顶面观和侧视图,表明了组织学分析脑池内(IC)注射位点和剖切平面。中间的照片,小鼠脑的横向切片视图,以1x级数。方框的区域表明在所述底部的显微照片中,所述范围为4x显微图像。底部的照片,4x图像的组织学切片。方框A表明了所述范围为40x显微图像,在图15和图16中。
图15描述了在IC注射后的7天,在Sanfilippo B小鼠中示例性的免疫组织化学,40x。rhNaglu和Naglu-IGFII(在神经元中以及在胶质细胞中)都表现广泛的细胞吸收,并且所述分布和细胞吸收模式在所述两个蛋白质之间非常相似。(抗-人Naglu单克隆抗体)。
图16描述了大脑皮层的示例性LAMP-1免疫染色,在40x。与所述野生类型小鼠的脑相比,在所述媒介物处理的Sanfilippo B小鼠脑中溶酶体储存增加是明显的,如所述增加的LAMP-1免疫染色阳性斑点所演示的。rhNalgu和Naglu-IGFII处理的Sanfilippo B小鼠的脑都表现酶体储存的减少,这与wt小鼠非常相似。
图17A图解了在IT-施用Naglu的Naglu-缺陷型小鼠的白质组织中,细胞液泡化普遍地减少(相对于被施用媒介物的所述相同Naglu-缺陷型小鼠)。图17B图解了在鞘内施用Naglu的Naglu-缺陷型小鼠的白质组织中,溶酶体相关膜蛋白1(LAMP1)免疫染色显著减少(相对于被施用媒介物的所述相同Naglu-缺陷型小鼠)。
图18从数量上图解并比较了在被施用Naglu的Naglu-缺陷型小鼠(相对于被施用媒介物的所述野生类型、以及Naglu-缺陷型小鼠)的大脑皮层、尾状核和豆状核(CP)、丘脑(TH)、小脑(CBL)和白质(WM)中测量的LAMP浓度。在鞘内施用所述三剂量的Naglu后,在7天的过程中,在被分析的每个脑组织区域的所述LAMP-阳性区域进一步地减少(图18A)(相对于2剂量的Naglu在2周的过程中(图18B))。
图19图解了示例性正中矢状位解剖图,其中人类CNS在该图中作为参考使用,以表明在wt插管的大鼠中的注射位点。蓝色箭头表面IT注射在所述脊髓,并且红色箭头表明所述大脑皮层区域中的大约解剖学定位,其中组织从免疫组织化学采集。
图20图解了在IT注射后,在所述脑中示例性的Naglu活性。在Naglu-TAT和Naglu-IGFII注射的wt大鼠的脑中,Naglu活性显著较高。
图21描述了在IT注射后24小时,(rhNaglu、Naglu-TAT、Naglu-IGFII、Naglu-kif和PerT-Naglu处理的wt插管的大鼠)的大脑皮层的示例性Naglu免疫染色,20x。Naglu-IGFII是表现出良好地广泛分布至所述脑实质中的唯一蛋白质。被细胞吸收进入神经元和胶质细胞中,这在Naglu-IGFII处理大鼠中也是显著的。另一方面,在rhNaglu、Naglu-TAT、Naglu kif和PerT-Naglu处理组中,所述蛋白质保留在所述脑膜(M)中。
图22描述了来自图21的选定切片的示例性高能量放大。上面的面板,在所述rhNaglu处理的wt插管的大鼠中,rhNaglu仅仅保持在所述脑膜(M),在所述脑的软组织中没有发现阳性染色。下面的面板,在Naglu-IGFII处理的wt插管的大鼠中,观察到良好地广泛分布进入所述脑实质,并且在神经元和胶质细胞中观察到细胞吸收。
图23图解了,在IT注射后的24小时,在所述脑和肝脏中的示例性Naglu活性。在所述三个组之间,在所述脑中的Naglu活性没有表现出显著的差异,在所述肝脏中对于Naglu活性,所述相同是真实的。这个结果暗示,在所述脑和肝脏中,Naglu活性被大程度地检测到,由于末次注射法发生在处死前的24小时。这还是不清楚的,在这点时,由于在肝脏中有显著较高Naglu活性的原因(与所述脑相比)。在IT注射后彻底的药代动力学研究可能有助于解释所述差异。
图24图解了在IT注射Naglu-IGFII后,在所述脑和肝脏中的示例性总GAG水平。在媒介物处理的Sanfilippo B鼠中的总GAG表现出进行性增加,这反映了由于随Sanfilippo B小鼠年龄增长的累积效应。GAG在所述脑中统计学显著性降低,这在3x注射组中观察到(p<0.05)。在2x和3x注射组中,也观察到GAG在肝脏中统计学显著性地降低(p<0.05)。GAG水平在肝脏中(相对于在脑中)更快和更剧烈的变化,是在其它溶酶体贮积症小鼠模型,例如亨特综合症(内部通信),中已经被观察到的现象。
图25描述了在IT注射后,在Sanfilippo B小鼠的脑中,Naglu的示例性生物分布。Naglu免疫荧光染色显示了在所述脑的脑膜(M)和软组织上的Naglu-IGFII蛋白质。在所述2x和3x注射组中,观察到细胞吸收。G:胶质细胞。
图26为示例性的图解,其显示了所述小鼠脑的冠状面。方框表示LAMP-1免疫染色的照片拍摄的部位。为了演示蛋白质分布和功效的程度,选择大脑皮层和皮层下组织(例如尾状核、丘脑和白质)进行LAMP1免疫染色。
图27描述了大脑皮层的LAMP1免疫染色,40x。与野生类型小鼠的脑相比,在所述媒介物处理treated Sanfilippo B小鼠的脑中,观察到溶酶体贮积增加,正如观察到LAMP1免疫染色阳性斑点的增加。在Naglu-IGFII IT注射后,溶酶体贮积的减少是显著的:2x注射处理的Sanfilippo B小鼠脑的阳性斑点的大小减少,并且3x注射处理的SanfilippoB小鼠脑的阳性斑点的大小和数量减少。
图28为描述了示例性的尾状核、皮层下核LAMP-1免疫染色(40x)。与在大脑皮层中看到的相似,在所述媒介物处理的Sanfilippo B小鼠的脑中,观察到溶酶体贮积增加,正如观察到的LAMP1免疫染色阳性斑点的增加。在Naglu-IGFII IT注射后,溶酶体储存减少是显著的:2x注射处理的Sanfilippo B小鼠脑的阳性斑点的大小减少,并且3x注射处理的Sanfilippo B小鼠脑的阳性斑点的大小和数量减少。
图29描述了示例性的所述丘脑、间脑核的LAMP-1免疫染色(40x)。在Naglu-IGFII IT注射后,溶酶体贮积的减少是显著的:2x注射处理的Sanfilippo B小鼠脑的阳性斑点的大小减少,并且3x注射处理的Sanfilippo B小鼠脑的阳性斑点的大小和数量减少。
图30描述了示例性的白质LAMP-1免疫染色(40x)。神经元轴纤维的径向磁迹将白质从存在于图26-29的灰质区分开。尽管如此,可以在媒介物处理的Sanfilippo B小鼠脑中观察到,溶酶体贮积增加的模式与所述野生小鼠相同。在Naglu-IGFII IT注射后,溶酶体贮积减少是显著的:在所述2x和3x注射处理的Sanfilippo B小鼠脑中,阳性斑点的大小减少,数量减少。
图31描述了示例性的小脑皮层的LAMP-1免疫染色。在小脑皮质中观察到溶酶体储存较少的效应与所述脑的其它区域相似。所述小脑皮层的形态是明显的:密集定位的颗粒神经元、细胞减少的分子层、以及(在所述颗粒神经元和所述分子层之间的)单层的Purkinje神经元。Purkinje神经元通过大细胞质识别,并且临时性树突突出进入所述分子层。
图32图解了示例性的在所述脑、脊髓和肝脏中的Naglu染色。在所述脑和脊髓中,注射的Naglu在脑膜(M)中检测到(仅通过IHC),并且在其它区域没有检测到Naglu阳性染色。在所述肝脏中,窦状腺细胞(S)是Naglu阳性,并且在肝脏中没有发现Naglu吸收(H)。
图33图解了示例性的所述肝脏和脊髓的LAMP免疫染色和H&E染色。与所述媒介物动物相比,在Naglu处理的整个肝脏和脊髓中,LAMP染色都减少。H&E染色显示,在肝脏中,在处理组中的细胞液泡化明显减少(与媒介物处理动物相比)。
图34A和B为示例性的图解,其显示了所述脑的H&E染色,表明所述脑的形态改善,在为期3个月的6次每隔一周的IT注射Naglu后。在所述处理的脑中,在所有被检测区域中的所述细胞液泡化(箭头)比媒介物组减少。
图35A和B示例性地图解了在多个脑区域中的LAMP免疫染色,在为期3个月6次IT Naglu注射后。与所述媒介物处理组相比,Naglu IT施用至Sanfilippo B小鼠,导致溶酶体活性在所有被检测区域中减少,通过LAMP免疫染色显示。这种减少的特征为:LAMP阳性细胞数目减少,较小的细胞体积,以及较轻的染色。在所述小脑和脑干(其定位在靠近所述脊髓的脑尾状核部分)中,(与其他脑区域相比)发现显著的减少。在所述深部脑区域(包括所述白质、海马和丘脑)中,发现明显的减少。
图36A和B是示例性地图解在为期3个月的6次IT Naglu注射后,在多个脑区域中的Iba IHC,其揭示了小胶质细胞的活化。与媒介物处理相比,在所述Naglu处理组中,阳性细胞数目和染色强度没有观察到减少。尽管如此,阳性小胶质细胞的细胞形态随着在所有被检测脑区域中细胞大小的减少而改变(与在所述媒介物组中大的和液泡化相比)(插入)。
图37A和B是示例性的图解,其显示了在为期3个月的6次IT Naglu注射后,在多个脑区域中的GFAP IHC,其揭示了星形胶质细胞的活化。与媒介物处理相比,在所述小脑和脑干中,GFAP阳性染色减少,并且在其它被检测区域中轻微地减少。
图38描述了示例性的鞘内药物递送设备(IDDD)。
图39描述了示例性的低调鞘内植入入口系统。
图40描述了示例性的鞘内药物递送设备(IDDD)。
图41描述了示例性的鞘内药物递送设备(IDDD),其允许在家施用以进行CNS酶替代治疗(ERT)。
图42图解和示例了具有固定机构鞘内药物递送设备(IDDD)的图形。
图43A描述了在患者体内IDDD可能被放置的示例性定位;图43B描绘了鞘内药物递送设备(IDDD)的多种组件;并且图43C描述了在IT-腰椎注射的患者体内的示例性插入位置。
术语解释
为了使本发明更容易被理解,某些术语在下文首先被定义。下面的术语和其它术语的其它定义在整个说明书提出。
约或者大约:如本文使用的,所述术语“约”或者“大约,”如应用于一个或多个感兴趣的值,其是指与规定的参考值相似的值。在某些实施方案中,所述术语“约”或者“大约”是指某范围的值,其落入所述规定的参考值在任意方向上(大于或小于)的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、或更小以内,除非另有说明或以其他方式明显从上下文得出(除非其中该数字将超过100%的可能值)。
转佳:如本文使用的,所述术语“转佳”意思是状态的预防、减轻或者缓减,或者受试者状态的改善。转佳包括,但是不要求病情(例如,SanfilippoB综合症)的痊愈或彻底的预防。在一些实施方案中,转佳包括相关蛋白质的水平或其活性(例如,Naglu)的增加,所述相关蛋白质在相关疾病组织中缺乏。
生物活性:如本文使用的,所述短语“生物活性”是指在生物系统中具有活性的任何实际的特性,并且特别地在生物体中。例如,当将试剂施用到生物体中,所述试剂对生物体具有生物效应,这被认为是生物活性。在特别的实施方案中,当蛋白质或多肽是生物活性的,该部分的蛋白或多肽将享有至少所述蛋白或多肽的一种生物活性,这通常被称为“生物活性”部分。
阳离子依赖型甘露糖-6-磷酸受体(CI-MPR):如本文使用的,所述术语“阳离子依赖型甘露糖-6-磷酸受体(CI-MPR)”是指细胞受体,所述细胞受体在高尔基体中,在酸水解酶前体上结合甘露糖-6-磷酸(M6P)标签,并被注定运输到所述溶酶体。除了甘露糖-6-磷酸,所述CI-MPR也结合其他蛋白质,包括IGF-II。所述CI-MPR也被称为“M6P/IGF-II受体”、“CI-MPR/IGF-II受体”、“IGF-II受体”或者“IGF2受体”。这些术语和其省略语在本文中互换使用。
并发免疫抑制疗法:如本文使用的,所述术语“并发免疫抑制疗法”包括作为预处理、预调节或者与治疗方法平行的任意免疫抑制疗法。
稀释剂:如本文使用的,所述术语“稀释剂”是指药学上可接受的(例如对施用到人类是安全的和非毒性的)稀释物质,其对于重组制剂的制备是有效的。示例性的稀释剂包括无菌水、注射用制菌水(BWFI)、pH缓冲溶液(例如磷酸盐-缓冲盐水)、无菌生理盐水、林格式溶液或者右旋糖溶液。
剂型:如本文使用的,所述术语“剂型”和“单位剂型”是指待治疗患者的治疗蛋白质的物理上分离的单位。每个单位含有预定量的经计算产生预期治疗效果的活性材料。可以理解,尽管如此,所述组合物的总剂量可以被由主治医生根据合理的医学判断决定。
酶替代治疗(ERT):如本文使用的,所述术语“酶替代治疗(ERT)”是指任意的治疗策略,其可以通过所述丢失的酶以纠正酶缺乏。在一些实施方案中,所述丢失的酶通过鞘内施用提供。在一些实施方案中,所述丢失的酶通过注入到血流中提供。一旦施用,酶被细胞吸收,并运输到所述溶酶体,在所述溶酶体中所述酶发挥清除由于酶缺乏而累积在所述溶酶体中的材料。通常,为了使溶酶体酶替代治疗有效,所述治疗酶被递送到在靶组织合适的细胞中的溶酶体(在所述组织中所述贮积缺陷是明显的)。
改善、增加、或者减少:如本文使用的,所述术语“改善”、“增加”或者“减少”或语法等价表达,包括相对于基线测量的值,例如在开始本文所描述的处理之前在相同个体中的测量,或者在缺乏本文所描述的处理的对照个体(或者多个对照个体)中的测量。“对照个体”是这样的个体:其受到与所述正被治疗的个体相同形式的溶酶体贮积症(例如Sanfilippo B综合症)的折磨,并且其与所述治疗个体年龄相同(以确保在所述正被治疗的个体和所述对照个体之间所述疾病所处的阶段是可比性的)。
个体、受试者、患者:如本文使用的,所述术语“受试者”、“个体”或者“患者”是指人类或者非人类的哺乳动物受试者。所述正被治疗的个体(也称为“患者”或者“受试者”)是患有疾病(例如Sanfilippo B综合症)的个体(胎儿、婴儿、儿童、青少年、成人)。
鞘内施用:如本文使用的,所述术语“鞘内施用”或者“鞘内注射”是指注射进入所述脊椎管(在所述脊髓周围的鞘内空间)。多种技术可以使用,包括但不限于,侧脑室注射(通过钻孔或小脑延髓池或腰椎穿刺或诸如此类)。在一些实施方案中,根据本发明的“鞘内施用”或“鞘内递送”是指IT施用或者递送(通过腰部或腰区),即腰椎IT施用或者递送。如本文使用的,所述术语“腰区”或“腰部”是指在所述第三和第四腰椎(下背部)骨之间的区域,更包含所述脊椎的L2-S1区域。
连接体:如本文使用的,所述术语“连接体”是指,在融合蛋白中,不同于在天然蛋白质中在特定位点出现的氨基酸序列,并且通常设计成柔性的或插入到在两个蛋白质部分之间的结构中(例如α-螺旋)。连接体也被称为间隔区。
溶酶体酶:如本文使用的,所述术语“溶酶体酶”是指任意的酶,其能够在哺乳动物溶酶体中累积的材料,或者能使一种或多种溶酶体贮积症症状得到拯救或转佳。适合于本发明的溶酶体酶包括野生类型的或者修饰的溶酶体酶,并能使用重组和合成的方法制备,或者从天然来源中纯化。
溶酶体酶缺乏:如本文使用的,“溶酶体酶缺乏”是指一组遗传性疾病,其由于至少一种酶的缺乏所导致,所述酶是在溶酶体中将大分子(例如酶底物)裂解成肽、氨基酸、单糖、核酸和脂肪酸所需要的。结果,患有溶酶体酶缺乏症的个体在多种组织(例如CNS、肝脏、脾脏、肠、血管壁和其它器官)中具有累积的材料。
溶酶体贮积症:如本文使用的,所述术语“溶酶体贮积症”是指导致一种或多种溶酶体酶缺乏的任意疾病,所述溶酶体酶是代谢天然大分子所需要的。这些疾病通常导致在溶酶体中未降解分子的累积,导致贮藏粒(术语也称为储存囊泡)数量的增加。这些疾病和多种实施例在下文详细地被描述。
多肽:如本文使用的,“多肽”,一般而言,是指由至少两个氨基酸彼此通过肽键连接成的一串。在一些实施方案中,多肽包括至少3-5个氨基酸,其中每个通过至少一个肽键的方式与其余的连接。那些在本领域的普通技术人员会意识到有时多肽包括“非天然”氨基酸或者任选的、其它仍然能合并到多肽链中的其它实体。
替代酶:如本文使用的,所述术语“替代酶”是指任意的酶,其能发挥作用以替代至少部分的所述(在待治疗的疾病中)缺乏或丢失的酶。在一些实施方案中,所述术语“替代酶”是指任意的酶,其能发挥作用以替代至少部分的所述(在待治疗的溶酶体贮积症中)缺乏或丢失的溶酶体酶。在一些实施方案中,替代酶能减少在哺乳动物溶酶体中累积的材料,或者其能拯救或改善一种或多种溶酶体贮积症症状。适合于本发明的替代酶包括野生类型或者修饰的溶酶体酶,并且能使用重组和合成的方法制备或者从天然来源中纯化。替代酶可以是重组的、合成的、基因活化的或者天然的酶。
可溶性:如本文使用的,所述术语“可溶性”是指治疗试剂形成均匀的溶液的能力。在一些实施方案中,所述治疗试剂在所述溶液中的可溶性(其在所述溶液中被施用,并且通过它运输到作用的靶向位点(例如所述脑的所述细胞和组织))是足够的,以允许递送治疗有效量的治疗世界至作用的靶向位点。几种因素可以影响所述治疗试剂的可溶性。例如,可能影响蛋白质可溶性的相关因素包括离子强度、氨基酸序列和存在其它共溶试剂或者盐(例如钙盐)。在一些实施方案中,所述药物组合物被配制,使得所述钙盐从这种组合物中排除。在一些实施方案中,依照本发明的所述试剂是在对应的组合物中可溶性的。可以理解,当等渗溶液通常对于肠胃外施用药物是优选的,使用等渗溶液可能限制一些治疗世界充分的溶解性,特别是某些蛋白质和/或酶。已经表明,轻微高渗溶液(例如高达175mM氯化钠,在5mM磷酸钠中,pH7.0)和含糖溶液(例如高达2%蔗糖,在5mM磷酸钠中,pH7.0)在猴中具有良好的耐受性。例如,最常见的批准的CNS推注制剂组合物是生理盐水(在水中150mM NaCl)。
稳定性:如本文使用的,所述术语“稳定的”是指所述治疗试剂在较长期间保持其治疗效果(例如所有的或者大部分的其预期生物活性和/或理化完整性)的能力。所述治疗试剂的稳定性,以及所述药物组合物保持这种治疗试剂的稳定性的能力,可以在延长的时间周期内进行评估(例如至少1、3、6、12、18、24、30、36月或更久)。通常,本文描述的药物组合物已经被配制,可以使得其能稳定、或者作为选择减慢或阻止与之相配制的一种或多种治疗试剂(例如重组蛋白质)的所述降解。在配制的情况下,稳定的制剂是一种,在这种制剂中所述治疗试剂在储存和在加工过程中(例如冷冻/融化,机械混合和冻干),基本保持其物理的和/或化学完整性和生物活性。对于蛋白质稳定性,其可以通过形成高分子量(HMW)聚集物酶活性损失、肽片段形成和电荷转移性能进行测量。
受试者:如本文使用的,所述术语“受试者”意思是任意的哺乳动物,包括人类。在本发明的某些实施方案中,所述受试者是成年人、青少年或者婴儿。本发明也考虑了所述药物组合物的施用、和/或子宫内治疗方法的性能。
基本的同源性:本文使用的所述短语“基本的同源性”是指,在氨基酸或核酸序列之间的比较。如本领域的普通技术人员的理解,两条序列通常会被认为“基本同源”,如果它们在对应的位点含有同源的残基。同源的残基可以是相同的残基。可选择的,同源的残基也可以是不相同的残基,其具有合适的相似结构和/或功能特性。例如,如本领域的普通技术人员所已知的,某些氨基酸通常被分类为“疏水的”或者“亲水的”氨基酸,和/或具有“极性”或“非极性|”侧链。一个氨基酸取代另一个相同类型的氨基酸,通常被认为是“|同源”取代。
众所周知在本领域技术中,氨基酸或者核酸序列可以使用多种算法比较,包括商业计算机程序,例如核酸序列的BLASTN,氨基酸序列的BLASTP、间隙BLAST(gapped BLAST)和PSI-BLAST。示例性的这种程序在这些文献中进行了描述:Altschul,等,Basic local alignment searchtool,J. Mol.Biol.,215(3):403-410,1990;Altschul,等,MethodsinEnzymology;Altschul,等,″Gapped BLAST and PSI-BLAST:a newgeneration of protein database search programs″,Nucleic Acids Res.25:3389-3402,1997;Baxevanis,et al.,Bioinformatics:APractical Guide tothe Analysis of Genes and Proteins,Wiley,1998;and Misener,等,(eds.),Bioinformatics Methods and Protocols/Methods in Molecular Biology,Vol.132),Humana Press,1999.除了识别同源序列,上述提及的所述程序通常提供同源性程度的指示。在一些实施方案中,两个序列被认为基本同源,如果他们相应残基的至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多在相关延伸的残基之间是同源的。在一些实施方案中,所述相关延伸是完全的序列。在一些实施方案中,所述相关延伸是至少10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500或更多残基。
基本一致性:本文使用的所述短语“基本一致性”是指在氨基酸或者核酸序列之间的比较。如本领域的普通技术人员所理解的,两条序列通常会被认为是“基本一致的”,如果它们在相应的位点含有一致的残基。众所周知在本领域技术中,氨基酸或者核酸序列可以使用多种算法中的任意一个进行比较,包括在商业计算机中的程序,例如核酸序列的BLASTN,以及氨基酸序列的BLASTP、间隙BLAST(gapped BLAST)和PSI-BLAST。示例性的这种程序在下述的文献中进行了描述:Altschul,等,Basic localalignment search tool,J.Mol.Biol.,215(3):403-410,1990;Altschul,等,Methods in Enzymology;Altschul等,Nucleic Acids Res.25:3389-3402,1997;Baxevanis etal.,Bioinformatics:APractical Guide to the Analysis of Genesand Proteins,Wiley,1998;and Misener,等,(eds.),Bioinformatics Methodsand Protocols(Methods in Molecular Biology,Vol.132),Humana Press,1999.除了识别这些一致的序列,上文所提及的所述程序通常提供了一致性程度的指示。在一些实施方案中,所述序列被认为是基本一致的,如果他们相应残基的至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多在相关延伸的残基之间是一致的。在一些实施方案中,所述相关延伸是完全的序列。在一些实施方案中,所述相关延伸是至少10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475、500或更多残基。
合成的CSF:如本文使用的,所述术语“合成的CSF”是指具有与脑脊髓液一致的pH、电解质组成、葡萄糖含量和渗透压的溶液。合成的CSF也被称为人工CSF。在一些实施方案中,合成的CSF是Elliott’s B溶液。
适合于CNS递送:如本文使用的,所述短语“适合于CNS递送”或者“适合于鞘内递送”是指本发明的所述药物组合物,通常是指这些组合物的稳定性、耐受性和可溶性性能,以及这些组合物递送有效量的含于其中的治疗试剂至递送靶向位点(例如所述CSF或者所述脑)的能力。
靶组织:如本文使用的,所述术语“靶组织”是指受到待治疗的所述溶酶体贮积症影响的任意组织,或者在其中所述缺乏的溶酶体酶正常表达。在一些实施方案中,靶组织包括这些组织,在其中具有可检测的或者异常高量的酶底物(例如储存在所述组织的所述细胞溶酶体中),在患有或者易患有溶酶体贮积症的患者中。在一些实施方案中,靶组织包括这些组织:其表现疾病相关病理、症状或特征。在一些实施方案中,靶组织包括这些组织:在其中所述缺乏的溶酶体酶以升高的水平正常表达。如本文使用的,靶组织可以是脑部靶组织、脊髓靶组织和/或周边靶组织。示例性的靶组织在下文详细描述。
治疗部分:如本文使用的,所述术语“治疗部分”是指部分的分子,其为所述分子提供治疗效果。在一些实施方案中,治疗部分是具有治疗活性的多肽。例如,根据本发明的治疗部分可以是适合于天然Naglu蛋白质的多肽。在一些实施方案中,根据本发明的治疗部分可以是多肽,所述多肽能拯救与Naglu缺陷症并发的一种或多种表现型。在一些实施方案中,根据本发明的治疗部分可以治疗在Sanfilippo B综合症患者中的一种或者多种症状。
治疗有效量:如本文使用的,所述术语“治疗有效量”是指治疗性蛋白质(例如,Naglu)的量,其给予所述治疗的受试者治疗效果,以合理的效益/风险比率(适合于任意的医疗)。所述治疗效果可以是客观的(例如通过某种测试或者标记物测量)或主观的(例如受试者给出的效果的指示或感觉)。特别地,所述“治疗有效量”是指某种量的治疗蛋白质或者组合物有效治疗、改善或者阻止预期的病或者病情,或者表现可检测的治疗或者预防效果(例如通过改善疾病相关症状、阻止或者延缓所述疾病的发生、和/或减少所述疾病的严重程度或频率)。在给药方案上的治疗有效量通常施用,可以包括多种单位剂量。对任何特定治疗蛋白质,治疗有效量(和/或在有效给药方案内的合适的单位剂量)会有所不同,例如,根据施用途径、以及其它药物试剂。而且,任何特定患者的所述特定的治疗有效量(和/或单位剂量)可以根据多种因素改变,包括被治疗的疾病和所述疾病的严重程度;所采用的特定药物试剂的活性;所采用的特定组合物;所述患者的年龄、体重、一般健康、性别和饮食;施用时间;施用途径;和/或所采用的特定融合蛋白的排泄和代谢;所述治疗持续的时间;以及在医药领域已知的类似因素。
可容忍的:如本文使用的,所述术语“可容忍的”和“耐受性”是指本发明的药物组合物在所述受试者(所述的这些受试者是指被施用组合物的受试者)中不引发有害反应的能力,或者可选择地在所述受试者(所述的这些受试者是指被施用组合物的受试者)中不引发严重的有害反应的能力。在一些实施方案中,本发明所述药物组合物可以被所述受试者(所述受试者是指被施用组合物的受试者)良好地容忍。
治疗:如本文使用的,所述术语“治疗”(也称为“处理”或“治疗”)是指任意施用的治疗性蛋白质(例如溶酶体酶),其部分地或者完全地缓解、改善、减轻、已知或者延缓发生,减少严重程度和/或减少(特定疾病、紊乱和/或病情(例如,Sanfilippo B综合症)的一种或多种症状或特征的发生率。这种治疗可以是这样的受试者(其不表现相关的疾病、紊乱和/或病情的体征),和/或这样的受试者(其仅仅表现相关的疾病、紊乱和/或病情的早期体征)。可选择地或者额外地这种治疗可以是这样的受试者,其表现所述相关的疾病、紊乱和/或病情的一种或多种已建立的体征。
发明详述
除了其它的以外,本发明提供方法和组合物,治疗Sanfilippo综合症类型B(Sanfilippo B),通过例如鞘内的(IT)施用Naglu蛋白质。合适的Naglu蛋白质可以是重组的、基因活化的或者天然的蛋白质。在一些实施方案中,合适的Naglu蛋白质是重组的Naglu蛋白质。在一些实施方案中,重组的Naglu蛋白质是融合蛋白质,所述融合蛋白质含有Naglu结构域和溶酶体靶向部分。在一些实施方案中,所述溶酶体靶向域是IGF-II部分。
本发明的多个发明在下面的章节详细地描述。所述章节的使用不是打算限制本发明。每章节可以应用于本发明的任意方面。在这份申请中,使用“或者”意思是“和/或”,除非另有声明。
治疗性融合蛋白质
根据本发明,适合于治疗Sanfilippo B疾病的治疗性融合蛋白质可以包括Naglu结构域(也称为治疗部分)和溶酶体靶向部分。
Naglu结构域
根据本发明的合适Naglu结构域可以是任意的分子或者分子的部分,其适合于天然发生的Naglu蛋白质活性,或者拯救与Naglu-缺陷症并发的一种或多种表现型或者症状。在一些实施方案中,适合于本发明的治疗部分是这样的多肽:所述多肽具有N-末端和C-末端以及与成熟人类Naglu蛋白质基本相似或者一致的氨基酸序列。
通常地,人类Naglu作为前体分子制备并加工成成熟形式。这种加工通常通过除去所述23个氨基酸信号肽而发生(由于所述蛋白质进入内质网)。通常地,所述前体形式也称为全长前体或者全长Naglu蛋白质,其含有743个氨基酸。所述N-末端的23氨基酸被断裂,因为所述前体蛋白质进入所述内质网,从而产生成熟形式。因此,这也是考虑到的,所述N-末端的23氨基酸通常对于Naglu蛋白质活性是不必需的。所述成熟形式(SEQ ID NO:1),和典型野生型或天然发生的人类Naglu蛋白质的全长前体(SEQ ID NO:2)的氨基酸序列,在表1中示出。
表1:人类Naglu
因此,在一些实施方案中,适合于本发明的治疗部分是成熟人类Naglu蛋白质(SEQ ID NO:1)。在一些实施方案中,合适的治疗部分可以是同源物或者成熟人类Naglu蛋白质的类似物。例如,成熟人类Naglu蛋白质的同源物或者类似物可以是修饰的成熟人类Naglu蛋白质,其含有一个或者多个氨基酸替换、删除、和/或插入,与野生型或天然发生的Naglu蛋白质(例如,SEQ ID NO:1)相比,同时保留基本的Naglu蛋白质活性。因此,在一些实施方案中,适合于本发明的治疗部分与成熟人类Naglu蛋白质(SEQID NO:1)基本同源。在一些实施方案中,适合于本发明的治疗部分具有与SEQ ID NO:1至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或者更多同源的氨基酸序列。在一些实施方案中,适合于本发明的治疗部分与成熟人类Naglu蛋白质(SEQ ID NO:1)基本一致。在一些实施方案中,适合于本发明的治疗部分具有与SEQ ID NO:1至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或者更多地一致的氨基酸序列。在一些实施方案中,适合于本发明的治疗部分含有成熟人类Naglu蛋白质的片段或者部分。
可选择地,适合于本发明的治疗部分是全长Naglu蛋白质。在一些实施方案中,合适的治疗部分可以是全长人类Naglu蛋白质的同源物或者类似物。例如,全长人类Naglu蛋白质的同源物或者类似物可以是修饰的全长人类Naglu蛋白质,其含有一个或者多个氨基酸替换、删除、和/或插入,与野生型或天然发生的全长Naglu蛋白质(例如SEQ ID NO:2)相比,同时保留基本的Naglu蛋白质活性。因此,在一些实施方案中,适合于本发明的治疗部分全长与人类Naglu蛋白质(SEQ ID NO:2)基本同源。在一些实施方案中,适合于本发明的治疗部分具有与SEQ ID NO:2至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或者更多地同源的氨基酸序列。在一些实施方案中,适合于本发明的治疗部分与SEQ ID NO:2基本一致。在一些实施方案中,适合于本发明的治疗部分具有与SEQ ID NO:2至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或者更多地一致的氨基酸序列。在一些实施方案中,适合于本发明的治疗部分含有全长人类Naglu蛋白质的片段或者部分。如本文所使用的,全长Naglu蛋白质通常地含有信号肽序列。
在一些实施方案中,治疗性蛋白质包括靶向部分(例如,溶酶体靶序列)和/或穿膜肽。在一些实施方案中,定向序列和/或穿膜肽是治疗部分的内在部分(例如,通过化学键,通过融合蛋白质)。在一些实施方案中,定向序列含有甘露糖-6-磷酸盐部分。在一些实施方案中,定向序列含有IGF-I部分。在一些实施方案中,定向序列含有IGF-II部分。
溶酶体靶向域
在一些实施方案中,治疗性的结构域(即,Naglu结构域)被修饰,以促进溶酶体靶向。例如,合适Naglu结构域可以融合进溶酶体靶向部分,其可以使所述Naglu结构域(以甘露糖-6-磷酸盐非依赖型的方式)靶向至溶酶体。合适的溶酶体靶向域可以来源于肽,包括但不限于,IGF-II、IGF-I、Kif、ApoE、TAT、RAP、和p97肽。在某些实施方案中,溶酶体靶向部分是蛋白质、肽、或者其它以甘露糖-6-磷酸盐非依赖型方式结合CI-MPR的部分(其也称为IGF-II受体)。
在一些实施方案中,溶酶体靶向部分来源于人类胰岛素样生长因子II(IGF-II)。在一些实施方案中,GILT标签是野生型或天然发生的成熟人类IGF-II(SEQ ID NO:3)。
成熟人类IGF-II(SEQ ID NO:3)
AYRPSETLCGGELVDTLQFVCGDRGFYFSRPASRVSRRSRGIVEECCFRSCDLALLETYCATPAKSE
在一些实施方案中,溶酶体靶向部分是修饰的成熟人类IGF-II,其含有氨基酸替换、插入或者删除。在一些实施方案中,GILT标签具有与成熟人类IGF-II(SEQ ID NO:3)序列至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或者99%地一致的序列。在一些实施方案中,溶酶体靶向部分是成熟人类IGF-II的片段。在特定的实施方案中,溶酶体靶向部分含有成熟人类IGF-II(SEQ ID NO:3)的氨基酸8-67。在一些实施方案中,溶酶体靶向部分含有N-末端的、C-末端的或者内部的删除。例如,溶酶体靶向部分含有成熟人类IGF-II(SEQ ID NO:3)N-末端(例如,Δ2-7)删除的氨基酸。在一些实施方案中,溶酶体靶向部分是修饰的人类IGF-II肽,其对于其它受体(例如IGF-I受体)结合亲和力减弱(与所述天然发生的人类IGF-II相比)。
在现有技术中,多种附加的溶酶体靶向部分是已知的,并且可以用来实现本发明。例如,某些基于溶酶体靶向部分的肽在美国专利号7,396,811,7,560,424和7,629,309;美国申请公开号2003-0082176,2004-0006008,2003-0072761,20040005309,2005-0281805,2005-0244400和国际公开WO03/032913,WO03/032727,WO02/087510,WO03/102583,WO2005/078077,WO/2009/137721中描述,所述整个公开文本通过参考的方式并入本文。
连接体或者间隔区
溶酶体靶向部分可以融合至编码溶酶体酶的肽N-末端或者C-末端,或者内部插入。所述溶酶体靶向部分可以直接融合至所述溶酶体多肽,或者通过连接体或间隔区与所述溶酶体多肽分离。氨基酸连接体或者间隔区通常设计成柔性的或在两个蛋白质部分之间插入结构(例如α-螺旋)。连接体或者间隔区可以是相对短的,例如序列GGGGGAAAAGGGG(SEQID NO:4),GAP(SEQ ID NO:5),GGGGGP(SEQ ID NO:6),或者可以是较长的,例如,长度10-50个(例如,10-20,10-25,10-30,10-35,10-40,10-45,10-50)氨基酸。在一些实施方案中,多种短的连接体序列可以以串联重复形式存在。例如,合适的连接体可以含有以串联重复形式存在的GGGGGAAAAGGGG(SEQ ID NO:4)氨基酸序列。在一些实施方案中,例如连接体可以进一步含有一个或多个GAP序列,即序列框GGGGGAAAAGGGG(SEQ ID NO:4)。例如,合适的连接体可以含有氨基酸序列
GAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAP(SEQ ID NO:5)。
在一些实施方案中,合适的连接体或者间隔区可以含有与序列SEQ IDNO:5至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、或者99%地一致的序列。
在一些实施方案中,适合本发明的治疗性蛋白质可以含有M6P残基。在一些实施方案中,适合本发明的治疗性蛋白质可以含有二磷酸化低聚糖,其具有与所述CI-MPR结合的较高亲和力。在一些实施方案中,合适的酶含有至多约每个酶平均为约至少20%二磷酸化低聚糖。在一些实施方案中,合适的酶可以含有每个酶约10%、15%、18%、20%、25%、30%、35%、40%、45%、50%、55%、60%二磷酸化低聚糖。同时这种二磷酸化低聚糖可以天然地存在于酶上,应该注意,可以修饰所述酶以拥有这种低聚糖。例如,合适的替代酶可以被某些酶修饰,这些酶能催化N-乙酰氨基葡萄糖-L-磷酸盐从UDP-GlcNAc转移至溶酶体酶上α-1,2-连接的甘露糖的6′位点。制备和使用这种酶的方法和组合物的描述参见,例如Canfield et al.的美国专利号6,537,785,以及美国专利号6,534,300,,每个都通过参考的方式并入本文。
在一些实施方案中,适合本发明的治疗性蛋白质是低糖基化的。如本文所使用的,“低糖基化的”是指蛋白质或者酶,其中正常存在于天然发生酶上的一个或多个碳水化合物结构(例如M6P残基)被删除、去除、修饰或者遮蔽。低糖基化的溶酶体酶可以在宿主(例如细菌或者酵母)中制备,所述宿主没有使蛋白质糖基化,例如传统哺乳动物细胞s(例如中国仓鼠卵巢(CHO)细胞)。例如,有所述宿主细胞制备的蛋白质可能缺乏末端甘露糖、岩藻糖、和/或N-乙酰氨基葡萄糖残基,其被所述甘露糖受体识别,或者完全未糖基化的。在一些实施方案中,低糖基化的溶酶体酶可以在哺乳动物细胞中或者其他宿主中制备,但是被化学或者酶催化地处理,以去除一个或多个碳水化合物残基(例如一个或者多个M6P残基),或者以修饰或遮蔽一个或者多个碳水化合物残基。这种化学地或者酶催化处理的酶也被称为脱糖基化的溶酶体酶。在一些实施方案中,一个或者多个糖基化位点通过编码溶酶体酶的核苷酸变异而被去除,从而降低所述酶的糖基化(当在哺乳动物细胞或者其它糖基化蛋白质的细胞中合成时)。在一些实施方案中,溶酶体酶可以使用分泌信号肽(例如IGF-II信号肽)制备,使得所述糖基化水平减少和/或修饰。低糖基化或者脱糖基化溶酶体酶实施例在美国专利号7,629,309和美国公开号20090041741以及20040248262中描述,其所有的公开都通过参考的方式并入本文。
蛋白质生产
适合于本发明的治疗性蛋白质可以在任何的哺乳动物细胞中或者易于细胞培养(和表达多肽)的细胞类型中制备,例如人类胚胎肾脏(HEK)293、中国仓鼠卵巢(CHO)、猴肾脏(COS)、HT1080、C10、HeLa、幼仓鼠肾脏(BHK)、3T3、C127、CV-1、HaK、NS/O、和L-929细胞。特定的非限定性实施例包括但不限于:BALB/c小鼠骨髓瘤系(NSO/1,ECACC No:85110503);人类成视网膜细胞(PER.C6(CruCell,Leiden,荷兰));SV40转化的猴肾脏CV1系(COS-7,ATCC CRL1651);人类胚胎肾脏系(293或293细胞,亚克隆用于在混悬培养基中生长,Graham et al.,J. Gen Virol.,36:59(1977));幼仓鼠肾脏细胞(BHK,ATCC CCL10);中国仓鼠卵巢细胞+/-DHFR(CHO,Urlaub and Chasin,Proc.Natl.Acad.Sci.USA,77:4216(1980));小鼠塞特利细胞(TM4,Mather,Biol.Reprod.,23:243-251(1980));猴肾脏细胞(CV1ATCC CCL70);非洲绿猴肾脏细胞(VERO-76,ATCCCRL-1587);人类颈部癌细胞(HeLa,ATCC CCL2);犬肾脏细胞(MDCK,ATCC CCL34);布法罗大鼠肝脏细胞(BRL3A,ATCC CRL1442);人类肺脏细胞(W138,ATCC CCL75);人类肝脏细胞(Hep G2,HB8065);小鼠乳房肿瘤(MMT060562,ATCC CCL51);TRI细胞(Mather et al.,Annals N.Y.Acad.Sci.,383:44-68(1982));MRC5细胞;FS4细胞;以及人类肝细胞肿瘤系(Hep G2)。在一些实施方案中,酶在CHO细胞中制备。在一些实施方案中,酶在源自CHO细胞中制备,例如内涵体酸化作用-缺陷症细胞系(例如,源自END3互补组的CHO-K1)。
酶也可以在多种非哺乳动物宿主细胞中表达,例如昆虫(例如,Sf-9、Sf-21、Hi5),植物(例如,Leguminosa、谷类、或者烟草),酵母(例如,S.cerivisae,P.pastoris),原核生物(例如,E.Coli,B.subtilis和其它Bacillusspp.,Pseudomonas spp.,Streptomyces spp),或者真菌。
在一些实施方案中,显示了转基因非人类在他们的乳汁中产生溶酶体酶。这种转基因非人类哺乳动物可以包括:兔、山羊、绵羊、猪或牛科。参见美国专利号6,118,045和7,351,410,其每个整体通过参考的方式并入本文。
鞘内递送
根据本发明,治疗性蛋白质(即,替代酶),含有Naglu结构域被递送至所述CNS。多种技术和途径可以被用于CNS递送,包括但不限于,脑实质内的、大脑内的、脑室内的(ICV)、鞘内的(例如,IT-腰椎、IT-小脑延髓池)施用,以及其它直接或间接注射入所述CNS技术和/或CSF的技术和途径。
在一些实施方案中,通过施用进入有需要治疗的受试者的所述脑脊髓液(CSF),递送替代酶至所述CNS。在一些实施方案中,使用鞘内施用递送预期的替代酶进入所述CSF。如本文所使用的,鞘内施用(也称为鞘内注射)是指注射进入所述脊髓管(在所述脊髓周围的鞘内空间)。可以使用多种技术,包括但不限于,通过钻孔或者小脑延髓池(或者腰椎穿刺等等)的侧脑室注射。示例性方法的描述见于Lazorthes et al.Advances in DrugDelivery Systems and Applications in Neurosurgery,143-192和Omaya et al.,Cancer Drug Delivery,1:169-179,其内容通过参考的方式并入本文。
根据本发明,可以在所述脊髓管周围的任意区域注射酶。在一些实施方案中,将酶注射进入所述腰椎区域或者所述小脑延髓池,或者脑室内地注射进入脑室空间。如本文所使用的,所述术语”腰椎部位”或者“腰椎区域”是指在所述第三和第四腰椎(下背部)骨之间的区域,更包含所述脊椎的L2-S1区域。通常地,通过腰椎部位或腰椎区域的鞘内注射也称为“腰椎IT递送”或者“腰椎IT施用”。所述术语“小脑延髓池”是指在所述小脑周围和下方的空间(经由在所述头骨和所述脊椎顶部之间的开口)。通常地,通过小脑延髓池的鞘内注射也称为“小脑延髓池递送”。所述术语“脑室”是指在所述脑中的空腔,其与所述脊髓的中央管是连续的。通常地,经由所述脑室空腔的注射是指脑室内的(intravetricular Cerebral,ICV)递送。
在一些实施方案中,根据本发明的“鞘内施用”或者“鞘内递送”是指腰椎IT施用或者递送,例如,在所述第三和第四腰椎骨(下背部)之间递送,更包含所述脊椎的L2-S1区域。这也是考虑到的,腰部IT施用或者递送区别于在所述小脑延髓池递送,因为根据本发明的腰部IT施用或者递送提供了更好和更有效地递送至远端脊椎管,而此外,小脑延髓池递送通常地不能良好地递送至远端脊髓管。
用于IT递送的稳定制剂
在一些实施方案中,预期的酶在用于鞘内递送的稳定制剂中递送。本发明的某些实施方案是基于,至少部分地是基于这个发现:此处公开的多种制剂促进一种或多种治疗试剂(例如酶)有效递送和分布至靶组织(所述CNS的细胞和/或细胞器)。此外,本文公开的制剂能增溶高浓度的治疗试剂(例如蛋白质或者酶),并适合于这种治疗试剂递送至受试者的所述CNS(为了治疗具有CNS组分和/或病因的疾病)。本文描述的所述组合物进一步的特征是:当施用到有需要其的受试者的所述CNS(鞘内施用)时,改善其稳定性和改善其耐受性。
在本发明之前,传统的无缓冲等渗盐水和Elliott’s B溶液(其是人工CSF)通常地用于鞘内递送。所述CSF组合物相对于Elliott’s B溶液的比较描述包含在下面的表2中。如表2所示,Elliott’s B溶液的所述浓度密切地与所述CSF相似。Elliott’s B溶液,尽管如此,含有非常低的缓冲液浓度,并且因此可能不能为稳定治疗试剂(例如蛋白质)的需要提供充分的缓冲能力,特别是在一段较长的时间(例如在储存条件下)。而且,Elliott’s B溶液含有某些盐,这些盐可能与所述制剂(所述制剂打算用于递送某些治疗试剂,特别是蛋白质或者酶)不相容。例如,存在于Elliott’s B溶液中的钙盐能够调节蛋白沉淀,并且因此减少了所述制剂的稳定性。
表2
因此,在一些实施方案中,适合于根据本发明的鞘内递送的制剂不是合成的或者人工的CSF。
在一些实施方案中,鞘内递送的制剂已经配制,使得它们能够稳定化,或者可选择地减缓或者阻止配制在其中的一种或多种治疗试剂(例如重组蛋白质)的降解。如本文使用的,所述术语“稳定的”是指所述治疗试剂(例如重组酶)在一段较长的时间内维持其治疗效果(例如它的预期的生物活性和/或理化完整性的全部或者大部分)的能力。治疗试剂的所述稳定性,和所述药物组合物维持这种治疗世界稳定性的能力,可以在一段较长的时间内(例如优选至少1、3、6、12、18、24、30、36月或者更多)进行评估。就制剂而言,稳定的制剂是这样的:其中的所述治疗试剂在储存和加工(例如冷冻/解冻、机械混合和冷冻干燥)过程中基本上保持其物理和/或化学完整性和生物活性。对于蛋白质稳定性,它可以通过形成高分子重量(HMW)聚集体,酶活性损失、肽片段的形成和电荷性能的变化进行量度。
治疗试剂的稳定性是特别重要的。所述治疗试剂的稳定性可以进一步评估,相对于所述治疗试剂在较长一段时间内的生物活性或理化完整性。例如,在给定时间点的稳定性可以与较早时间点(例如在配制的第0天)进行比较,或者与未配制的治疗试剂进行比较,并且这种比较结果以百分数表示。优选的,本发明的药物组合物使所述治疗试剂的生物活性或者理化完整性在一端较长的时间(例如在至少大约6-12个月、在室温或者加速储存条件下)内维持至少100%、至少99%、至少98%、至少97%至少95%、至少90%、至少85%、至少80%、至少75%、至少70%、至少65%、至少60%、至少55%或至少50%。
在一些实施方案中,治疗试剂(例如预期的酶)在本发明的制剂中是可溶的。所述术语“可溶性”(如其所提及的本发明的治疗试剂)是指这种治疗试剂形成均匀的溶液的能力。优选地,所述治疗试剂在所述溶液(在其中所述治疗试剂被施用,并且通过所述溶液所述治疗试剂被运送到作用的靶位点)中的可溶性是足够地以允许递送治疗有效量的所述治疗试剂至作用的靶位点。几种因素可以影响所述治疗试剂的可溶性。例如,可能影响蛋白质可溶性的相关因素,包括离子强度、氨基酸序列和存在其它共溶试剂或离子(例如钙盐)。在一些实施方案中,所述药物组合物被配制成使得所述钙盐从所述组合物排除。
因此,适合于鞘内施用的制剂可以含有多种浓度的感兴趣的治疗试剂(例如酶)。在一些实施方案中,合适的制剂可以含有感兴趣的蛋白质,其浓度高达大约300mg/ml(例如高达大约250mg/ml、高达200mg/ml、高达150mg/ml、高达100mg/ml、高达90mg/ml、高达80mg/ml、高达70mg/ml、高达60mg/ml、高达50mg/ml、高达40mg/ml、高达30mg/ml、高达25mg/ml、高达20mg/ml、高达10mg/m1)。在一些实施方案中,合适的制剂可以含有感兴趣的蛋白质或酶,其浓度范围在大约0-300mg/ml之间(例如大约1-250mg/ml、大约1-200mg/ml、大约1-150mg/ml、大约1-100mg/ml、大约10-100mg/ml、大约10-80mg/ml、大约10-70mg/ml、大约1-60mg/ml、大约1-50mg/ml、大约10-150mg/ml、大约1-30mg/ml)。在一些实施方案中,适合于鞘内递送的制剂可以含有感兴趣的蛋白质,其浓度为约1mg/ml、3mg/ml、5mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、50mg/ml、75mg/ml、100mg/ml、150mg/ml、200mg/ml、250mg/ml或者300mg/ml。
在一些实施方案中,使用等渗溶液。在一些实施方案中,已经表明:轻度高渗溶液(例如高达300mM(例如高达250mM、200mM、175mM、150mM、125mM)氯化钠,在5mM磷酸钠中,pH7.0)和含糖溶液(例如高达3%(例如高达2.4%、2.0%、1.5%、1.0%)蔗糖,在5mM磷酸钠中,pH7.0)在猴中可以被良好地容忍。在一些实施方案中,合适的CNS推注制剂组合物是生理盐水(例如在水中的150mM NaCl)。
许多治疗试剂,特别是本发明的蛋白质和酶,要求可控制的pH和特定的赋形剂,以维持他们在本发明的药物组合物中的的可溶性和稳定性。下面的表3区别了被认为对维持本发明所述蛋白质治疗试剂的可溶性和稳定性重要的某些示例性方面。、
表3
所述药物组合物的pH是能够改变治疗试剂(例如酶或者蛋白质)在水性药物组合物中的可溶性的额外因素。在一些实施方案中,本发明的药物组合物含有一种或多种缓冲。在一些实施方案中,根据本发明的组合物含有缓冲剂的量,足够以维持所述组合物的最适pH在大约4.0-8.0之间、在大约5.0-7.5之间、在大约5.5-7.0之间、在大约6.0-7.0之间和在大约6.0-7.5之间。在其它实施方案中,所述缓冲剂包括高达大约50mM(例如,高达大约45mM、40mM、35mM、30mM、25mM、20mM、15mM、10mM、5mM)的磷酸钠。合适的缓冲剂包括,例如醋酸盐、琥珀酸盐、柠檬酸盐、磷酸盐、其它有机酸和三(羟甲基)氨基甲烷(“Tris”)。合适的缓冲剂浓度可以是从大约1mM至大约100mM、或者从大约3mM至大约20mM,根据例如所述缓冲剂和所述制剂的期望等渗性。在一些实施方案中,合适的缓冲剂存在的浓度约l mM、5mM、10mM、15mM、20mM、25mM、30mM、35mM、40mM、45mM、50mM、55mM、60mM、65mM、70mM、75mM、80mM、85mM、90mM、95mM、或者100mM。
在一些实施方案中,制剂含有保持所述制剂等渗的等渗剂。如与IT递送相关使用的,“等渗的”意思是所述感兴趣制剂与人类CSF具有基本相同的渗透压。等渗的制剂通常具有的渗透压,从大约240mOsm/kg至大约350mOsm/kg。等渗性可以被测量,例如,使用蒸汽压力或者凝固点类型渗透计。示例性的等渗剂包括,但不限于甘氨酸、山梨糖、甘露醇、氯化钠和精氨酸。在一些实施方案中,合适的等渗剂可以存在于制剂中,以浓度从大约0.01-5%(例如0.05、0.1、0.15、0.2、0.3、0.4、0.5、0.75、1.0、1.25、1.5、2.0、2.5、3.0、4.0或5.0%),按重量计。
在一些实施方案中,制剂可以含有保护所述蛋白的稳定剂。通常地,合适的稳定剂是非还原糖(例如蔗糖、棉子塘、海藻糖),或者氨基酸(例如甘氨酸、精氨酸和蛋氨酸)。稳定剂在制剂中的量通常是使得所述制剂等渗。尽管如此,高渗的制剂也可以是合适的。另外,所述稳定剂的量必须不能太低,使得所述治疗试剂发生降解/聚集的量不可接受。在所述制剂中示例性的稳定剂浓度范围从大约1mM至大约400mM(例如从大约30mM至大约300mM,以及从大约50mM至大约100mM),或者,从0.1%至15%(例如从1%至10%,从5%至15%,从5%至10%),以重量计。在一些实施方案中,所述稳定剂和所述治疗试剂的质量的比率是大约1∶1。在其它实施方案中,所述稳定剂和所述治疗试剂的质量的比率可以是大约0.1∶1、0.2∶1、0.25∶1、0.4∶1、0.5∶1、1∶1、2∶1、2.6∶1、3∶1、4∶1、5∶1、10;1或者20∶1。在一些实施方案中,适合冷冻干燥的稳定剂也是冻干保护剂。
本发明的所述药物组合物、制剂和相关的方法对于递送(例如鞘内的、脑室内的、脑池内的)多种治疗试剂至受试者的所述CNS、以及治疗所述相关的疾病是有用的。本发明的药物组合物特别地对于递送蛋白质和酶至患有溶酶体贮积症的受试者有用。
在一些实施方案中,理想的是,添加表面活性剂至制剂。示例性的表面活性剂包括非离子表面活性剂,例如聚山梨醇酯(例如聚山梨醇酯20或者80);泊洛沙姆(例如洛沙姆188);Triton;十二烷基硫酸钠(SDS);月桂基硫酸钠;sodium octyl glycoside;十二烷基-,十四烷基-,linoleyl-,或者硬脂基-磺基甜菜碱;十二烷基-,十四烷基-,linoleyl-或者硬脂基-肌氨酸;linoleyl-,十四烷基-,或者鲸蜡基-甜菜碱;lauroamidopropyl-,cocamidopropyl-,linoleamidopropyl-,myristamidopropyl-,palmidopropyl-,或者异硬脂酰丙基-甜菜碱(例如lauroamidopropyl);myristarnidopropyl-,palmidopropyl-,或者异硬脂酰丙基-二甲胺;甲基椰油酰基钠-,或者disodiummethyl ofeyl-taurate;以及MONAQUATTM系列(Mona Industries,Inc.,Paterson,N.J.),聚乙二醇,聚丙二醇,以及乙烯和丙二醇的共聚物(例如Pluronics,PF68等)。通常地,所述添加的表面活性剂的量是使得所述蛋白质聚集减少,并且使颗粒或冒泡最小化。例如,存在于制剂中的表面活性剂可以是从大约0.001-0.5%(例如大约0.005-0.05%,或者0.005-0.01%)。特别的,存在于制剂中的表面活性剂浓度可以是约0.005%、0.01%、0.02%、0.1%、0.2%、0.3%、0.4%、或者0.5%等。
在一些实施方案中,合适的制剂可以进一步地包括一种或多种填充剂,特别地,用于冻干制剂的。“填充剂”是这样的复合物,其为所述冻干混合物增加质量,并且有助于所述冻干块状物的物理结构。例如,填充剂可以改善冻干块状物的外貌(例如基本均匀的冻干块状物)。合适的填充剂包括,但不限于,氯化钠、乳糖、甘露醇、甘氨酸、蔗糖、海藻糖、羟乙基淀粉。填充剂示例性的浓度是从大约1%至大约10%(例如1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%、5.5%、6.0%、6.5%、7.0%、7.5%、8.0%、8.5%、9.0%、9.5%和10.0%)。
根据本发明的制剂可以基于这些进行评估:产品质量分析、再生时间(如果冻干)、再生质量(如果冻干)、高分子量、湿度、和玻璃转化温度。通常地,蛋白质质量和产品分析包括产品降解率分析,使用的方法包括但不限于,体积排阻HPLC(SE-HPLC)、阳离子交换-HPLC(CEX-HPLC)、X-射线衍射(XRD)、调制式差示扫描量热法(mDSC)、反相HPLC(RP-HPLC)、多角度激光光散射(MALS)、荧光、紫外吸收、浊度测定法、毛细管电泳(CE)、SDS-PAGE、以及其组合。在一些实施方案中,根据本发明的产品的评估可以包括评估外貌的步骤(无论液体或者块状物的外貌)。
通常,制剂(冻干的或者水性的)可以用于在室温下在长时间的储存。储存温度通常的范围可以从0℃至45℃(例如4℃、20℃、25℃、45℃等)。制剂可以在数月至数年的时间段储存。储存时间通常是24月、12月、6月、4.5月、3月、2月或者1月。制剂可以直接在用于施用、消除转移步骤的所述容器中储存。
制剂可以直接在冻干容器中储存(如果冻干),所述冻干容器可以起重组器皿、消除转移步骤的作用。可选择的,冻干产品制剂可以估量成更小的储存增量。储存应该通常避免导致所述蛋白质降解的事件,包括但不限于暴露在阳光、紫外辐射、其它电磁辐射形式、过热或过冷、快速热冲击和机械冲击。
在一些实施方案中,根据本发明的制剂是以液体或者水性的形式。在一些实施方案中,根据本发明的制剂是冻干的。这种冻干的制剂可以在施用到受试者之前,通过添加以一种或多种稀释剂至其中进行再生。合适的稀释剂包括但不限于无菌水、注射用制菌水和无菌生理盐水。优选的,在再生过程中,所述治疗试剂(含在其中的)是稳定的、可溶的,并且表面光在施用到受试者过程中是具有耐受性的。
本发明的药物组合物的特征在于具有耐受性。如本文使用的,所述术语“可容忍的”和“耐受性”是指本发明的药物组合物在所述受试者(这种组合物施用至所述受试者)中不引起有害反应的能力,或者可选择地在所述受试者(这种组合物施用至所述受试者)中不引起严重有害反应的能力。在一些实施方案中,被这种组合物施用至的所述受试者可以良好地容忍本发明的药物组合物。
鞘内递送的设备
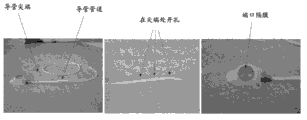
根据本发明鞘内递送可以使用多种设备。在一些实施方案中,鞘内施用的设备含有:流体进入端口(例如可注射的端口);空心体(例如导管),所述空心体具有与所述流体进入端口液体连通的第一流体孔口以及配置插入到脊髓中的第二流体孔口;和固定机构,所述固定机构用于固定在所述脊髓中的空心体的插入。如在图42中示出的非限定性实施例,合适的固定机构含有固定在所述空心体表面的一个或多个球形门柄、以及可调节覆盖所述一个或多个球形门柄的缝合环,所述缝合环用于阻止所述空心体(例如导管)从所述脊髓滑出。在多个实施方案中,所述流体进入端口包括贮液囊。在一些实施方案中,所述流体进入端口包括机械泵(例如灌流泵)。在一些实施方案中,植入的导管连接到贮液囊(例如用于推注递送),或者灌流泵。所述流体进入端口可以是植入的或者外置的。
在一些实施方案中,鞘内施用可以通过腰椎穿刺(缓慢推注)或通过端口-导管递送系统(例如注射或者推注)进行。在一些实施方案中,所述导管插入到所述腰椎之间的薄层,所述前端被拧到预期水平的鞘空间(通常L3-L4)(图43A-C)。
相对于静脉施用,适合鞘内施用的单剂量体积通常地小的。通常地,根据本发明的鞘内递送维持了所述CSF的组合物与所述受试者颅内压力之间的平衡。在一些实施方案中,对于相应的去除了CSF的受试者,鞘内递送没有进行。在一些实施方案中,合适的单剂量体积可以例如小于大约10ml、8ml、6ml、5ml、4ml、3ml、2ml、1.5ml、1ml、或者0.5ml。在一些实施方案中,合适的单剂量体积可以是大约0.5-5ml、0.5-4ml、0.5-3ml、0.5-2ml、0.5-1ml、1-3ml、1-5ml、1.5-3ml、1-4ml、或者0.5-1.5ml。在一些实施方案中,根据本发明的鞘内递送涉及首先去除预期量的CSF的步骤。在一些实施方案中,在IT施用之前,小于大约10ml(例如小于大约9ml、8ml、7ml、6ml、5ml、4ml、3ml、2ml、1ml)的CSF首先被去除。在这些情况下,合适的单剂量体积可以是例如多于大约3ml、4ml、5ml、6ml、7ml、8ml、9ml、10ml、15ml、或者20ml。
可以使用多种其它设备影响治疗组合物的鞘内施用。例如,含有预期酶的制剂的给予可以使用Ommaya贮液囊,所述Ommaya贮液囊通常用于脑膜癌扩散药物的鞘内施用(Lancet2:983-84,1963)。更具体地说,在这种方法中,脑室管通过在所述前角形成的孔中插入,并且连接到安装在所述头皮下的Ommaya贮液囊;并且所述Ommaya贮液囊是皮下穿刺,使其鞘内递送所述特定被替代的酶(所述酶被注射到所述贮液囊中)。治疗组合物或者制剂鞘内施用到个体的其它设备的描述可以参见:美国专利号6,217,552,其通过参考的方式并入本文。可选择地,所述药物可以鞘内施用,例如,可以单一注射,或者持续注射。应该理解,所述剂量治疗可以以单一剂量施用或者多种剂量的形式。
对于注射,本发明的制剂可以以液体溶液配制。另外,所述酶可以以固体形式配制,并且在使用之前重溶或者立即悬浮。冻干形式也包括在内。所述注射,例如以所述酶的推注注射或者持续注射(例如使用灌流泵)的形式。
在本发明的一个实施方案中,所述酶通过侧脑室注射至所述受试者的脑中。所述注射,可以例如通过在所述受试者的头骨中钻孔。在另一实施方案中,所述酶和/或其它药物制剂通过外科插入分流至所述受试者的脑室中。例如,所述注射可以在侧脑室(其更大)进行。在一些实施方案中,也可以注射进入所述第三和第四较小脑室。
在又一个实施方案中,在本发明中使用的所述药物组合物通过注射施用至受试者所述小脑延髓池、或腰椎区域。
在本发明的又一实施方案中,所述药学可接受的制剂提供了持久的递送至受试者(例如:在本发明中使用的所述酶或者其它药物组合物的“缓慢释放”),在所述药学可接受的制剂被施用到所述受试者后,维持至少一周、两周、三周、四周或更长时间段。
如本文使用的,所述术语“持久的递送”是指本发明的药物制剂在施用以后,在体内,在一段时间内持续递送,优选至少几天、一周或数周。所述组合物的持久递送可以被证明,例如所述酶在一段时间内的持久治疗效果(例如所述酶的持久递送可以通过在所述受试者中贮藏粒量的持续减少所证明)。可选择地,所述酶的持久递送可以被证明:通过检测在一定时间内,在体内存在的所述酶。
递送至靶组织
如上文所讨论的,本发明的一种令人惊讶的和重要的特征是:所述治疗试剂,特别的,使用本发明施用的替代酶(例如Naglu融合蛋白质)能有效地、广泛地分散在所述脑表面,并渗透多层脑区域(包括深部脑区域)。另外,本发明的方法和组合有效地递送替代酶(例如Naglu融合蛋白质)至脊髓的多种组织、神经元或细胞,包括腰区,所述腰区难以通过存在的CNS递送方法(例如ICV注射)靶向定位。而且,本发明的发明方法和组合物递送充分的量的替代酶(例如Naglu融合蛋白质)至血流、多种外周器官和组织中。
因此,在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至受试者的中枢神经系统。在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至脑、脊髓、和/或外周器官的一种或多种靶组织。如本文使用的,所述术语“靶组织”是指受到待治疗的溶酶体贮积症的影响的任意组织,或者所述缺乏的溶酶体酶正常表达的任意组织。在一些实施方案中,靶组织包括这些组织:在所述组织中具有可检测的或者异常高的量的酶底物,例如储存在所述组织的细胞溶酶体中(在患有或已患有溶酶体贮积症的患者中)。在一些实施方案中,靶组织包括表现具有疾病相关病理、症状或特征的这些组织。在一些实施方案中,靶组织包括这些组织:在所述组织中所述缺乏的溶酶体酶以升高的水平正常表达。如本文使用的,靶组织可以是脑靶组织、脊髓靶组织和/或外周靶组织。示例性的靶组织在下文详细描述。
脑靶组织
一般而言,所述脑可以被分成不同的区域、层和组织。例如,脑膜组织是覆盖所述中枢神经系统(包括所述脑)的膜系统。所述脑膜含有三层,包括硬脑膜、蛛网膜和软脑膜。一般而言,所述脑膜和脑脊髓液的主要功能是保护所述中枢神经系统。在一些实施方案中,根据本发明的治疗性蛋白质被递送至一层或多层所述脑膜。
所述脑具有三个主要的细分区,包括大脑、小脑和脑干。所述大脑半球位于大部分其它脑结构上方,并且被皮层覆盖。在所述大脑下面是脑干,所述脑干看起来像连接在所述大脑上的柄。在所述脑的后部,所述大脑以下和所述脑干后面,是小脑。
间脑(其位于所述脑中线附近,并且在所述中脑上方)含有丘脑、后丘脑、下丘脑、上丘脑、腹侧丘脑和前顶盖。中脑(也称为中脑)含有顶盖、大脑脚盖、脑室中脑水管、大脑脚、红核、和颅神经III核。中脑与视觉、听觉、运动控制、睡眠/唤醒、警觉和温度调节相关。
中枢神经系统组织的区域(包括脑)的特征,可以基于所述组织的深度划分。例如,CNS(例如脑)组织的特征可以描述成表面或者浅部组织、中层深度组织和/或深部组织。
根据本发明,治疗性蛋白质(例如替代酶)可以递送到与在受试者中待治疗的特定疾病相关的任意合适的脑靶组织。在一些实施方案中,根据本发明的治疗性蛋白质(例如替代酶)被递送至表面或浅部的脑靶组织。在一些实施方案中,根据本发明的治疗性蛋白质被递送至中层深度脑靶组织。在一些实施方案中,根据本发明的治疗性蛋白质被递送至深部脑靶组织。在一些实施方案中,根据本发明的治疗性蛋白质被递送至表面或浅部脑靶组织、中层深度脑靶组织、和/或深部脑靶组织的组合。在一些实施方案中,根据本发明的治疗性蛋白质被递送至深部脑组织,其在脑的外部表面以下(或内部)至少4mm、5mm、6mm、7mm、8mm、9mm、10mm或更多。
在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至大脑的一个或多个表面或者浅部组织。在一些实施方案中,所述靶向的大脑表面或者浅部组织位于距所述大脑表面4mm以内。在一些实施方案中,所述靶向的大脑表面或浅部组织选自:软脑膜组织、大脑皮质带状组织、海马、Virchow Robin空间、VR空间内的血管、海马、在脑下表面上的部分下丘脑、视神经和神经束、嗅球和突起物、以及其组合。
在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至大脑的一个或多个深部组织。在一些实施方案中,所述靶向的大脑表面或浅部组织位于在所述脑表面以下(或内部)4mm(例如5mm、6mm、7mm、8mm、9mm、或者10mm)。在一些实施方案中,大脑的靶向深部组织包括大脑皮质丝带。在一些实施方案中,大脑的靶向深部组织包括间脑(例如下丘脑、丘脑、腹侧丘脑、底丘脑等)、后脑、豆状核、基底神经节、尾状核、豆状核、杏仁核、苍白球及其组合的一种或多种组织。
在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至一种或多种的小脑组织。在某些实施方案中,所述靶向的一种多种小脑组织选自:分子层组织、浦肯野(氏)细胞层组织、颗粒细胞层组织、小脑脚、及其组合。在一些实施方案中,治疗试剂(例如酶)被递送至一种或多种小脑组织,包括但不限于浦肯野(氏)细胞层组织、颗粒细胞层组织、小脑深部白质组织(例如相对于颗粒细胞层的深部)、和小脑深部核组织。
在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至一种或多种脑干组织。在一些实施方案中,所述靶向的一种或多种脑干组织包括脑干白质组织和/或脑干核组织。
在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至多种脑组织,包括但不限于灰质、白质、脑室周围区域、软膜蛛网膜、脑膜、新皮质、小脑、大脑皮层中的深部组织、分子层、尾状核/豆状核区域、中脑、脑桥或者延髓的深部区域及其组合。
在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至在脑中的多种细胞,包括但不限于神经元、胶质细胞、血管周细胞和/或脑膜细胞。在一些实施方案中,治疗性蛋白质被递送至深部白质的少突胶质细胞。
脊髓
一般而言,脊髓的区域或者组织可以根据组织深度的特点区分。例如,脊髓组织可以区分为表面或者浅部组织、中层深度组织、和/或深部组织。
在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至脊髓的一种多种表面或者浅部组织。在一些实施方案中,靶向的脊髓的表面或浅部组织位于距离所述脊髓表面4mm以内。在一些实施方案中,靶向的脊髓的表面或浅部组织含有软脑膜和/或束状的白质。
在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至所述脊髓的一种或多种组织。在一些实施方案中,脊髓的靶向深部组织位于距所述脊髓表面内部4mm。在一些实施方案中,脊髓的靶向深部组织含有脊髓灰质和/或室管膜细胞。
在一些实施方案中,替代酶(例如Naglu融合蛋白质)被递送至脊髓的神经元。
外周靶组织
如本文使用的,外周器官或组织是指那些不是所述中枢神经系统(CNS)组成部分的任意器官或组织。外周靶组织可以包括,但不限于血液系统、肝脏、肾脏、心脏、内皮、骨髓和骨髓来源的细胞、脾脏、肺脏、淋巴结、骨、软骨、卵巢和睾丸。在一些实施方案中,根据本发明的替代酶(例如Naglu融合蛋白质)被递送至一种或多种外周靶组织。
生物分布和生物药效率
在多种实施方案中,一旦递送至所述靶组织,替代酶(例如Naglu融合蛋白质)被定位到细胞内。例如,替代酶(例如Naglu融合蛋白质)可以定位至靶细胞(例如神经元,例如浦肯野细胞)的外显子、轴突、溶酶体、线粒体或者液泡。例如,在一些实施方案中,鞘内施用的酶展示易位动态,使得所述酶在所述血管周空间以内移动(例如通过脉动辅助对流机制)。此外,与将所述施用蛋白质或者酶与神经丝结合有关的活性轴突运输机制可能有助于或者促进鞘内施用蛋白质或者酶分布进入所述中枢神经系统的深部组织。
在一些实施方案中,根据本发明递送的替代酶(例如Naglu融合蛋白质)可在多种本文描述的靶组织中,实现治疗(或临床)的效果水平(或活性)。如本文使用的,治疗(或临床)的效果水平(或活性)是这样的水平,其能在靶组织中提供足够的治疗效果。所述治疗效果可以是客观的(即通过某种测试或标记物进行可以测量的)或者主观的(即受试者给出的指示或者感觉的效果)。例如,治疗(或临床)的效果水平(或活性)可以是这样的酶水平或者活性:其可以足够地减缓与在所述靶组织中的疾病相关的症状(例如GAG储存)。
在一些实施方案中,根据本发明递送的替代酶(例如Naglu融合蛋白质)可以实现的酶水平或者活性是:相对于在靶组织中的溶酶体酶的正常水平或者活性的至少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%。在一些实施方案中,根据本发明递送的替代酶(例如Naglu融合蛋白质)可以实现的酶水平或者活性是:相对于对照(例如没有进行所述治疗时的内源水平或者活性),以至少1-倍、2-倍、3-倍、4-倍、5-倍、6-倍、7-倍、8-倍、9-倍或者10-倍地增加。在一些实施方案中,根据本发明递送的替代酶(例如Naglu融合蛋白质)可以达到增加的酶水平或者活性是:在靶组织中,至少约10nmol/hr/mg、20nmol/hr/mg、40nmol/hr/mg、50nmol/hr/mg、60nmol/hr/mg、70nmol/hr/mg、80nmol/hr/mg、90nmol/hr/mg、100nmol/hr/mg、150nmol/hr/mg、200nmol/hr/mg、250nmol/hr/mg、300nmol/hr/mg、350nmol/hr/mg、400nmol/hr/mg、450nmol/hr/mg、500nmol/hr/mg、550nmol/hr/mg或者600nmol/hr/mg。
在一些实施方案中,根据本发明发明的方法对于靶向腰区特别有用。在一些实施方案中,根据本发明递送的替代酶(例如Naglu融合蛋白质)可以达到的增加的酶水平或者活性是:在所述腰区中,至少约500nmol/hr/mg、600nmol/hr/mg、700nmol/hr/mg、800nmol/hr/mg、900nmol/hr/mg、1000nmol/hr/mg、1500nmol/hr/mg、2000nmol/hr/mg、3000nmol/hr/mg、4000nmol/hr/mg、5000nmol/hr/mg、6000nmol/hr/mg、7000nmol/hr/mg、8000nmol/hr/mg、9000nmol/hr/mg、或者10,000nmol/hr/mg。
一般而言,根据本发明递送的治疗试剂(例如替代酶)在CSF以及脑、脊髓和外周器官的靶组织中具有充分长的半衰期。在一些实施方案中,根据本发明递送的替代酶(例如Naglu融合蛋白质)可以具有的半衰期:至少约30分钟、45分钟、60分钟、90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、12小时、16小时、18小时、20小时、25小时、30小时、35小时、40小时、多达3天、多达7天、多达14天、多达21天或者多达一月。在一些实施方案中,在一些实施方案中,根据本发明递送的替代酶(例如Naglu融合蛋白质)可以在CSF或者血流中持有可检测的水平或者活性,在施用的12小时、24小时、30小时、36小时、42小时、48小时、54小时、60小时、66小时、72小时、78小时、84小时、90小时、96小时、102小时、或一周后。可检测的水平或者活性可以使用本领域已知的方法测定。
在某些实施方案中,根据本发明递送的替代酶(例如Naglu融合蛋白质)达到的浓度是:在施用后(在鞘内施用所述药物组合物至所述受试者后的例如1周、3天、48小时、36小时、24小时、18小时、12小时、8小时、6小时、4小时、3小时、2小时、1小时、30分钟或更少)的所述受试者的所述CNS组织和细胞中,至少30μg/ml。在某些实施方案中,根据本发明递送的替代酶(例如Naglu融合蛋白质)在施用至受试者(例如在鞘内施用这种组合物至所述受试者1周、3天、48小时、36小时、24小时、18小时、12小时、8小时、6小时、4小时、3小时、2小时、1小时、30分钟或更少时间之后)后,在所述受试者的靶组织或细胞中(例如脑组织或神经元),达到的浓度为:至少20μg/ml、至少15μg/ml、至少10μg/ml、至少7.5μg/ml、至少5μg/ml、至少2.5μg/ml、至少1.0μg/ml或者至少0.5μg/ml。
Sanfilippo综合症通过鞘内施用的治疗
Sanfilippo综合症、或者黏多糖贮积症III(MPS III)是一种罕见的遗传性疾病,其特征在于涉及粘多糖(GAG)降解的酶的缺乏。在缺乏所述酶的情况下,部分降解的GAG分子不能从身体清除,并且在多种组织的溶酶体中累积,导致进行性广泛的身体功能障碍(Neufeld and Muenzer,2001)。
已经识别MPSIII的四种不同形式,称为MPS IIIA、B、C、和D。每种代表了参与硫酸乙酰肝素降解的四种酶之一的缺乏。所有形式包括不同程度的所述相同相同临床症状,包括粗面部特征、肝脾大、角膜混浊和骨骼畸形。更加显著地,然而,是认知能力的严重和进行性丧失,其不仅与硫酸乙酰肝素在神经元中的积累相关,而且与随后由初级GAG积累导致的神经节糖苷脂GM2、GM3和GD2升高(Walkley1998)相关。
黏多糖贮积症类型IIIB(MPS IIIB;Sanfilippo B疾病)是常染色体隐性遗传病,其特征在于所述酶α-N-乙酰-氨基葡萄糖苷酶(Naglu)的缺乏。在缺乏所述酶的情况下,GAG硫酸乙酰肝素在神经元和胶质细胞中累积,而在所述脑外累积减少。
所述疾病定义的临床特征是中枢神经系统(CNS)衰退,其导致主要发育标志事件的损失或者未能实现。所述进行性的认知能力下降在痴呆和过早死亡中到达高潮。所述疾病通常地表现在幼童中,并且受影响的个体的寿命通常不超过十几岁晚期或二十岁初期。
本发明的组合物和方法用于有效治疗患有或易患有SanB的个体。所述术语,如本文所使用的“处理”或者“治疗”是指所述疾病并发的一种或多种症状的转佳,预防或者延缓所述疾病一种或多种症状的发病,和/或减轻所述疾病一种或多种症状的严重程度或者频率。
在一些实施方案中,治疗是指:在SanB患者中,使神经学损伤的严重程度和/或发生率部分地或者完全地缓解、转佳、减轻、抑制、延缓发生、降低。如本文使用的,所述术语“神经学损伤”包括:与中枢神经系统(例如脑和脊髓)损伤并发的多种症状。神经学损伤的症状包括:例如发育迟缓、进行性的认知障碍、听力损失、言语发展障碍、运动技能缺陷、活动过度、攻击性和/或睡眠障碍等等。
因此,在一些实施方案中,治疗是指溶酶体储存(例如GAG)在多种组织中的降低。在一些实施方案中,治疗是指在脑靶组织、脊髓神经元、和/或外周靶组织中,溶酶体贮积的减少。在某些实施方案中,溶酶体贮积相对于对照,以大约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或更多地减少。在一些实施方案中,溶酶体贮积相对于对照,以至少1-倍、2-倍、3-倍、4-倍、5-倍、6-倍、7-倍、8-倍、9-倍或10-倍地减少。在一些实施方案中,溶酶体储存通过LAMP-1染色测定。
在一些实施方案中,治疗是在神经元(例如含有浦肯野细胞的神经元)中液泡化的减少。在某些实施方案中,在神经元中的液泡化相对于对照,以大约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或更多地减少。在一些实施方案中,液泡化相对于对照,以至少1-倍、2-倍、3-倍、4-倍、5-倍、6-倍、7-倍、8-倍、9-倍或者10-倍地减少。
在一些实施方案中,治疗是指在多种组织中Naglu酶活性增加。在一些实施方案中,治疗是指Naglu酶活性在脑靶组织、脊髓神经元和/或外周靶组织中增加。在一些实施方案中,Naglu酶活性与对照相比,以约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、200%、300%、400%、500%、600%、700%、800%、900%1000%或者更多地增加。在一些实施方案中,Naglu酶活性与对照相比,以至少1-倍、2-倍、3-倍、4-倍、5-倍、6-倍、7-倍、8-倍、9-倍或者10-倍地增加。在一些实施方案中,增加的Naglu酶活性为至少大约10nmol/hr/mg,20nmol/hr/mg,40nmol/hr/mg,50nmol/hr/mg,60nmol/hr/mg,70nmol/hr/mg,80nmol/hr/mg,90nmol/hr/mg,100nmol/hr/mg,150nmol/hr/mg,200nmol/hr/mg,250nmol/hr/mg,300nmol/hr/mg,350nmol/hr/mg,400nmol/hr/mg,450nmol/hr/mg,500nmol/hr/mg,550nmol/hr/mg,600nmol/hr/mg或者更多。在一些实施方案中,Naglu酶活性在所述腰椎区域中增加。在一些实施方案中,在所述腰椎区域中,增加的Naglu酶活性为至少大约2000nmol/hr/mg,3000nmol/hr/mg,4000nmol/hr/mg,5000nmol/hr/mg,6000nmol/hr/mg,7000nmol/hr/mg,8000nmol/hr/mg,9000nmol/hr/mg,10,000nmol/hr/mg,或者更多。
在某些实施方案中,根据本发明的治疗导致与所述溶酶体贮积症并发的一种或多种病理学或生物学标记物的存在(或者可选择地,累积)的降低(例如大约5%、10%、15%、20%、25%、30%、40%、50%、55%、60%、65%、70%、75%、80%、90%、95%、97.5%、99%或更多降低)或者完全消除。这种降低或者消除可以特别地明显,在所述CNS的细胞和组织(例如神经元和少突胶质细胞)中。例如,在一些实施方案中,在施用本发明的药物组合物至受试者后,在所述受试者的所述CNS细胞和组织中(例如,在所述大脑皮层、小脑、尾状核和豆状核、白质和/或丘脑中),表现或实现了生物标记物溶酶体相关膜蛋白1(LAMP1)累积的降低。LAMP1是在溶酶体膜中高度表达的糖蛋白,并且它在许多患有溶酶体贮积症的患者中升高(Meikle,等Clin Chem.(1997)43:1325-1335.)。在患有溶酶体贮积症的患者中,LAMP1的存在或者缺乏(例如由LAMP染色测定的),从而为溶酶体贮积症的诊断或者监测提供了有用的溶酶体活性指示和标记物。
因此,本发明的一些实施方案,关于以下的方法:降低或者消除与疾病(例如溶酶体贮积症)并发的一种或多种病理学或生物学标记物的存在(或累积)。相似地,本发明的一些实施方案,关于以下的方法:增加与溶酶体贮积症并发的一种或多种病理学或生物学标记物(例如,LAMP1)的降解(或降解率)。
在一些实施方案中,治疗是指认知能力丧失的进展减少。在某些实施方案中,认知能力丧失的进展相对于对照,以大约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或者更多地减少。在一些实施方案中,治疗是指发展迟缓的减少。在某些实施方案中,发育迟缓相对于对照,以大约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或者更多地减少。
在一些实施方案中,治疗涉及增加的存活率(例如存活时间)。例如,治疗能导致患者预期寿命的增加。在一些实施方案中,根据本发明的治疗导致患者预期寿命增加,相对于患有类似疾病而没有治疗的一个或多个个体对照的平均预期寿命,以多于大约5%、大约10%、大约15%、大约20%、大约25%、大约30%、大约35%、大约40%、大约45%、大约50%、大约55%、大约60%、大约65%、大约70%、大约75%、大约80%、大约85%、大约90%、大约95%、大约100%、大约105%、大约110%、大约115%、大约120%、大约125%、大约130%、大约135%、大约140%、大约145%、大约150%、大约155%、大约160%、大约165%、大约170%、大约175%、大约180%、大约185%、大约190%、大约195%、大约200%或更多地增加。在一些实施方案中,根据本发明的治疗导致患者预期寿命增加,相对于患有类似疾病而没有治疗的一个或多个个体对照的平均预期寿命,以多于大约6月、大约7月、大约8月、大约9月、大约10月、大约11月、大约12月、大约2月、大约3月、大约4月、大约5月、大约6月、大约7月、大约8月、大约9月、大约10年或者更多地增加。在一些实施方案中,根据本发明的治疗导致患者的长期存活。如本文使用的,所述术语“长期存活”是指存活时间或者预期寿命长于大约40年、45年、50年、55年、60年、或更长时间。
所述术语“改善”、“增加”或“减少”如本文使用的,表示指示相对于对照的值。在一些实施方案中,合适的对照是基线测量,例如在启动本文描述的治疗之前的相同个体内的测量,或者在缺乏本文描述的治疗的对照个体(或多个对照个体)内的测量。“对照个体”是受SanB折磨的个体,并且其处于与正被治疗的个体相同的年龄和/或者性别(以确保被治疗的所述疾病的阶段和所述对照个体具有可比性)。
正被治疗的所述个体(也称为“患者”或“受试者”)是这样的个体(胎儿、婴儿、儿童、青少年或成年人类):其患有SanB或者具有发展为SanB的潜力。所述个体具有残留的内源性Naglu表达和/或活性、或者不可测量的活性。例如,患有SanB的所述个体可以具有的Naglu表达水平,比正常Naglu表达水平,低大约30-50%、低大约25-30%、低大约20-25%、低大约15-20%、低大约10-15%、低大约5-10%、低大约0.1-5%。
在一些实施方案中,所述个体是最近被诊断患有所述疾病的个体。通常地,早期治疗(在诊断后尽可能早地开始治疗)对于使疾病的影响最小化以及使治疗的益处最大化是重要的。
免疫耐受性
通常,鞘内施用根据本发明的替代酶(例如Naglu融合蛋白质)在所述受试者中不导致严重的不良反应。如本文使用的,严重的不良反应包括但不限于,基本免疫应答、毒性或者死亡。如本文使用的,所述术语“基本免疫应答”是指严重的免疫应答,例如适应性T-细胞免疫应答。
因此,在许多实施方案中,根据本发明发明的方法不涉及并发免疫抑制疗法(例如在与所述方法平行进行的作为预处理/预调节使用的许多免疫抑制剂治疗)。在一些实施方案中,根据本发明发明的方法不包括在所述被治疗的受试者中的免疫耐受诱导。在一些实施方案中,根据本发明发明的方法不涉及使用T-细胞免疫抑制剂进行的预处理或预调节。
在一些实施方案中,治疗试剂的鞘内施用可以发动针对这些试剂的免疫应答。因此,在一些实施方案中,它对于使得接受所述替代酶的所述受试者容忍所述酶替代疗法有用。免疫耐受性可以使用多种现有技术的方法诱导。例如,可以使用的方法:最初30-60天方案的T-细胞免疫抑制剂,例如环孢霉素A(CsA)和抗增殖剂(例如硫唑嘌呤(Aza)),并结合每周鞘内注射低剂量的预期替代酶。
对本领域技术人员已知的任何免疫抑制剂疗法,可以与本发明的组合疗法一起采用。这种免疫抑制剂包括但不限于:环孢霉素、FK506、纳巴霉素、CTLA4-Ig、和抗TNF试剂(例如依那西普)(参见例如Moder,2000,Ann.Allergy Asthma Immunol.84,280-284;Nevins,2000,Curr.Opin.Pediatr.12,146-150;Kurlberg et al.,2000,Scand.J.Immunol.51,224-230;Ideguchi etal.,2000,Neuroscience95,217-226;Potteret al.,1999,Ann.N.Y.Acad.Sci.875,159-174;Slavik et al.,1999,Immunol.Res.19,1-24;Gaziev et al.,1999,Bone Marrow Transplant.25,689-696;Henry,1999,Clin.Transplant.13,209-220;Gummert et al.,1999,J.Am.Soc.Nephrol.10,1366-1380;Qi et al.,2000,Transplantation69,1275-1283)。所述抗IL2受体(.α.-亚单位)抗体赛尼哌(例如Zenapax.TM.),其被表明在移植患者中有效,也能作为免疫抑制剂使用(参见例如Wiseman et al.,1999,Drugs58,1029-1042;Beniaminovitz et al.,2000,N.Engl J.Med.342,613-619;Ponticelli et al.,1999,Drugs R.D.1,55-60;Berard et al.,1999,Pharmacotherapy19,1127-1137;Eckhoff et al.,2000,Transplantation69,1867-1872;Ekberg et al.,2000,Transpl.Int.13,151-159)。其它免疫抑制剂包括但不限于:抗-CD2(Branco et al.,1999,Transplantation68,1588-1596;Przepiorka et al.,1998,Blood92,4066-4071),抗-CD4(Marinova-Mutafchieva et al.,2000,ArthritisRheum.43,638-644;Fishwild et al.,1999,Clin.Immunol.92,138-152),和抗-CD40配体(Hong et al.,2000,Semin.Nephrol.20,108-125;Chirmule et al.,2000,J.Virol.74,3345-3352;Ito et al.,2000,J.Immunol.164,1230-1235)。
施用
本发明的方法考虑到:单一以及多个治疗有效量的本文所描述的替代酶(例如Naglu融合蛋白质)的施用。替代酶(例如Naglu融合蛋白质)可以根据所述受试者的病情(例如溶酶体贮积症)的特性、严重程度和范围,以有规律的间隔施用。在一些实施方案中,治疗有效量的本发明替代酶(例如Naglu融合蛋白质)可以周期性地鞘内施用,以有规律的间隔(例如一年一次、6个月一次、每五个月一次、每三个月一次、两月一次(每两个月一次)、每月一次(每月一次)、两周一次(每两周一次)、每周一次)。
在一些实施方案中,鞘内施用可以连同其它施用途径使用(例如静脉内的、皮下地、肌肉内的、肠胃外地、经皮肤地、或者经黏膜地(或者口服地或经鼻地))。在一些实施方案中,这些施用途径(例如静脉施用)执行的频率不多于两周一次、每月一次、每两个月一次、每三个月一次、每四个月一次、每五个月一次、每六个月一次、每年一次施用。
如本文使用的,所述术语“治疗有效量”很大程度上,是基于在所述本发明药物组合物中的治疗试剂的总量决定的。通常的,治疗有效量对于所述受试者足够能实现有意义的好处(例如治疗、调整、治愈、阻止和/或改善所述潜在的疾病或病情)。例如,治疗有效量可以是足够实现预期治疗和/或预防性效果的量,并且这种量足够调节溶酶体受体或者他们的活性,从而治疗这种溶酶体贮积症或者其症状(例如在施用本发明组合物至受试者后,使“斑马小体”或者细胞液泡化的存在或者发生率减少或者消除。通常,治疗试剂(例如溶酶体酶)的量(施用至需要其的受试者)将根据所述受试者的特性变化。这种特性包括:所述受试者的病情、疾病严重程度、健康状况、年龄、性别和体重。一个本领域技术人员将根据这些和其它相关因素,容易地决定合适的剂量。另外,客观的和主观的分析都可以任选地采用,以识别最优剂量范围。
治疗有效量通常施用的剂量方案,包括多个单位剂量。对特定的治疗性蛋白质,治疗有效量(和/或在有效给药方案内的合适的单位剂量)可能会变化,例如根据结合其它药物试剂的施用途径。而且,对于特定患者的特定治疗有效量(和/或单位剂量)可以根据多种因素改变,包括正被治疗的疾病和所述疾病的严重程度、所采用的特定药物试剂的活性;所采用的特定组合物;所述受试者的年龄、体重、健康状况、性别和饮食;所采用的特定融合蛋白的施用时间、施用途径和/或排泄率或代谢率;所述治疗的持续时间;以及在医药领域已知的类似因素。
在一些实施方案中,所述治疗有效剂量的范围:从大约0.005mg/kg脑重量至500mg/kg脑重量,例如,从大约0.005mg/kg脑重量至400mg/kg脑重量,从大约0.005mg/kg脑重量至300mg/kg脑重量,从大约0.005mg/kg脑重量至200mg/kg脑重量,从大约0.005mg/kg脑重量至100mg/kg脑重量,从大约0.005mg/kg脑重量至90mg/kg脑重量,从大约0.005mg/kg脑重量至80mg/kg脑重量,从大约0.005mg/kg脑重量至70mg/kg脑重量,从大约0.005mg/kg脑重量至60mg/kg脑重量,从大约0.005mg/kg脑重量至50mg/kg脑重量,从大约0.005mg/kg脑重量至40mg/kg脑重量,从大约0.005mg/kg脑重量至30mg/kg脑重量,从大约0.005mg/kg脑重量至25mg/kg脑重量,从大约0.005mg/kg脑重量至20mg/kg脑重量,从大约0.005mg/kg脑重量至15mg/kg脑重量,从大约0.005mg/kg脑重量至10mg/kg脑重量。
在一些实施方案中,所述治疗有效剂量是:大于约0.1mg/kg脑重量,大于约0.5mg/kg脑重量,大于约1.0mg/kg脑重量,大于约3mg/kg脑重量,大于约5mg/kg脑重量,大于约10mg/kg脑重量,大于约15mg/kg脑重量,大于约20mg/kg脑重量,大于约30mg/kg脑重量,大于约40mg/kg脑重量,大于约50mg/kg脑重量,大于约60mg/kg脑重量,大于约70mg/kg脑重量,大于约80mg/kg脑重量,大于约90mg/kg脑重量,大于约100mg/kg脑重量,大于约150mg/kg脑重量,大于约200mg/kg脑重量,大于约250mg/kg脑重量,大于约300mg/kg脑重量,大于约350mg/kg脑重量,大于约400mg/kg脑重量,大于约450mg/kg脑重量,大于约500mg/kg脑重量。
在一些实施方案中,所述治疗有效剂量也可以通过mg/kg体重定义。作为本领域技术人员,将理解:所述脑重量和体重是相关的。DekabanAS.“Changes in brain weights during the span of human life:relation of brainweights to body heights and body weights,”Ann Neurol1978;4:345-56。因此,在一些实施方案中,所述剂量可以根据在表4中所示的进行转化。
表4
在一些实施方案中,所述治疗有效剂量可以通过mg/15cc的CSF定义。作为本领域技术人员,将理解:根据脑重量和体重,将治疗有效量转化成mg/15cc的CSF。例如,在成年人类中的CSF的体积为约150mL(Johanson CE,et al.“Multiplicity of cerebrospinal fluid functions:Newchallenges in health and disease,”cerebrospinal fluid Res.2008May14;5∶10).。因此,单剂量注射0.1mg至50mg蛋白质至成年人,在成年人中将会是约0.01mg/15cc的CSF(0.1mg)至5.0mg/15cc的CSF(50mg)剂量。
进一步可以理解,对于任意特定的受试者,随着时间的过去,根据所述个体需要和施用并监督(所述酶替代治疗的施用)的人员的专业判断,应该调整特定剂量方案,并且本文提出的给药范围仅仅是示例性的,并不打算限制本发明要求的范围或实践。
试剂盒
本发明进一步提供了试剂盒或者含有本发明所述制剂的其它制品,并提供了其再生(如果冻干)和/或使用的指导。试剂盒或其它制造业制品可以包括容器、IDDD、导管和其它对于鞘内施用和相关手术有用的制品、设备或装置。合适的容器包括,例如瓶子、小药瓶、注射器(例如载药注射器)、安瓿、药筒、贮液囊、或(装有冻干粉和稀释剂的)二室注射器给药系统(lyo-ject)。所述容器可以用多种材料(例如玻璃或者塑料)形成。在一些实施方案中,容器是载药注射器。合适的载药注射器包括,但不限于,具有烘干的硅树脂涂层的硼硅酸盐玻璃注射器、喷涂硅树脂的硼硅酸盐、或者无硅树脂的塑料树脂注射器。
通常地,所述容器可以容纳制剂,并在其上具有标签,或者与之相关地,所述容器可以指示再生和/或施用的指导。例如,所述标签可以指示:再生所述制剂至上文所描述的蛋白质浓度。所述标签可以进一步指示:所述制剂是有用的,或者打算用于(例如)IT施用。在一些实施方案中,容器可以含有单剂量的稳定制剂,所述制剂含有替代酶(例如Naglu融合蛋白质)。在多种实施方案中,单剂量的所述稳定的制剂以小于大约15ml、10ml、5.0ml、4.0ml、3.5ml、3.0ml、2.5ml、2.0ml、1.5ml、1.0ml、或者0.5ml的体积存在。可选择地,持有所述制剂的容器可以是多用途的小药瓶,其允许重复施用(例如2-6次施用)所述制剂。试剂盒或者制品可以进一步包括第二容器,所述第二容器包括合适的稀释剂(例如BWFI、生理盐水、缓冲的生理盐水)。在将所述稀释剂和所述制剂混合后,在所述再生的制剂中的所述最终蛋白质浓度通常可以是:至少1mg/ml(例如至少5mg/ml、至少10mg/ml、至少25mg/ml、至少50mg/ml、至少75mg/ml、至少100mg/ml)。试剂盒或者制品可以进一步包括其它(从商业和用户的角度看)理想的材料,其包括其它缓冲剂、稀释剂、过滤器、针头、IDDD、导管、注射器和具有使用指南的包装说明书。
通过参考以下的实施例,本发明将更充分地被理解。但是这些用于解释的实施例不限制本发明的范围。所有文献引用通过参考的方式并入本文。
实施例
实施例1:rhNaglu和Naglu融合蛋白质的表达
这个实施例演示了,开发重组人Naglu蛋白质,其预期用于通过鞘内注射直接施用进入Sanfilippo B患者的所述中枢神经系统。
Sanfilippo类型B(Sanfilippo B)是一种常染色体隐性遗传病,其是由于α-N-乙酰-氨基葡萄糖苷酶(Naglu)的缺乏所导致。Naglu是在所述肝磷脂硫酸盐降解途径中,从低聚糖的非还原端去除α-N-乙酰基葡糖胺的酶。编码Naglu的人基因具有6个外显子,其在染色体17q21.1上跨越了8.2kb的长度。人类Naglu作为743个氨基酸的前体在细胞中合成,其含有信号肽。所述Naglu的全长氨基酸序列在下文表5中提供。
表5
MEAVAVAAAVGVLLLAGAGGAAGDEAREAAAVRALVARLLGPGPAADFSVSVERALAAKPGLDTYSLGGGGAARVRVRGSTGVAAAAGLHRYLRDFCGCHVAWSGSQLRLPRPLPAVPGELTEATPNRYRYYQNVCTQSYSFVWWDWARWEREIDWMALNGINLALAWSGQEAIWQRVYLALGLTQAEINEFFTGPAFLAWGRMGNLHTWDGPLPPSWHIKQLYLQHRVLDQMRSFGMTPVLPAFAGHVPEAVTRVFPQVNVTKMGSWGHFNCSYSCSFLLAPEDPIFPIIGSLFLRELIKEFGTDHIYGADTFNEMQPPSSEPSYLAAATTAVYEAMTAVDTEAVWLLQGWLFQHQPQFWGPAQIRAVLGAVPRGRLLVLDLFAESQPVYTRTASFQGQPFIWCMLHNFGGNHGLFGALEAVNGGPEAARLFPNSTMVGTGMAPEGISQNEVVYSLMAELGWRKDPVPDLAAWVTSFAARRYGVSHPDAGAAWRLLLRSVYNCSGEACRGHNRSPLVRRPSLQMNTSIWYNRSDVFEAWRLLLTSAPSLATSPAFRYDLLDLTRQAVQELVSLYYEEARSAYLSKELASLLRAGGVLAYELLPALDEVLASDSRFLLGSWLEQARAAAVSEAEADFYEQNSRYQLTLWGPEGNILDYANKQLAGLVANYYTPR WRLFLEALVDSVAQGIPFQQHQFDKNVFQLEQAFVLSKQRYPSQPRGDTVDLAKKIFLKYYPRWVAGSW(SEQ ID NO:1)
当所述蛋白质进入所述内质网,所述23个氨基酸的信号肽被除去。最终产生的成熟Naglu蛋白质被分拣到溶酶体,在其中肝磷脂硫酸盐的酶降解发生或者分泌至胞外空间。成熟重组人Naglu的分子重量为:没有糖基化是80.2kDa,具有添加糖基化的重量大约93.4kDa。所述成熟Naglu蛋白质序列,其中氨基酸残基1-23被切除,并且在下文表6中提供。
表6
DEAREAAAVRALVARLLGPGPAADFSVSVERALAAKPGLDTYSLGGGGAARVRVRGSTGVAAAAGLHRYLRDFCGCHVAWSGSQLRLPRPLPAVPGELTEATPNRYRYYQNVCTQSYSFVWWDWARWEREIDWMALNGINLALAWSGQEAIWQRVYLALGLTQAEINEFFTGPAFLAWGRMGNLHTWDGPLPPSWHIKQLYLQHRVLDQMRSFGMTPVLPAFAGHVPEAVTRVFPQVNVTKMGSWGHFNCSYSCSFLLAPEDPIFPIIGSLFLRELIKEFGTDHIYGADTFNEMQPPSSEPSYLAAATTAVYEAMTAVDTEAVWLLQGWLFQHQPQFWGPAQIRAVLGAVPRGRLLVLDLFAESQPVYTRTASFQGQPFIWCMLHNFGGNHGLFGALEAVNGGPEAARLFPNSTMVGTGMAPEGISQNEVVYSLMAELGWRKDPVPDLAAWVTSFAARRYGVSHPDAGAAWRLLLRSVYNCSGEACRGHNRSPLVRRPSLQMNTSIWYNRSDVFEAWRLLLTSAPSLATSPAFRYDLLDLTRQAVQELVSLYYEEARSAYLSKELASLLRAGGVLAYELLPALDEVLASDSRFLLGSWLEQAR AAAVSEAEADFYEQNSRYQLTLWGPEGNILDYANKQLAGLVANYYTPRWRLFLEALVDSVAQGIPFQQHQFDKNVFQLEQAFVLSKQRYPSQPRGDTVDLAKKIFLKYYPRWVAGSW(SEQ ID NO:2)
为了形成重组人Naglu(rhNaglu),将所述人Naglu cDNA插入至表达载体,并转移至HT1080细胞系中。使用Naglu酶活性分析,以筛选高表达HT1080克隆。由Naglu表达HT1080细胞形成的分泌蛋白质为人Naglu的成熟形式。由HT1080细胞制备的所述重组人Naglu是糖基化的。所述rhNaglu朝向合成底物(4-MU-N-乙酰α-D-氨基葡糖苷)完全活化。
在重组Naglu与从天然来源分离的之间的最显著差异,例如,泌尿器的、胎盘的和肝脏Naglu,是甘露糖-6-磷酸盐多糖(M6P)的缺乏。几个研究者已经在CHO和HEK293细胞来源rhNaglu的研究中报道,在重组Naglu中缺乏M6P。也发现,HT1080表达的rhNaglu失去了M6P多糖。在重组Naglu中缺乏M6P的机制是未知的。本发明人已经开发了几种融合蛋白质和多糖的改进,企图克服在重组Naglu中细胞递送对于M6P的依赖(图1-3)。
Naglu-TAT
来自HIV,Naglu和蛋白质转导结构域的融合蛋白质命名为Naglu-TAT。设计和制备Naglu-TAT,并纯化。已经显示,TAT肽促进通过细胞膜进入所述细胞质的蛋白质转导。先前已经表明,所述TAT与所述溶酶体酶β-葡糖醛酸糖苷酶(GUS-TAT)的融合,导致在IV注射进MPSVII小鼠后,在所述肾脏中(比GUS)溶酶体储存更大的减少(Grubb JH et al.,Rejuvenation Research13:2,2010)。独立的实验表明,在Sanfilippo B患者成纤维细胞中Naglu-TAT的细胞吸收改善(与rhNaglu相比)(数据未示出)。但是,活体内生物分布研究表明,在IT注射过程中,Naglu-TAT显示与的相似的生物分布,并且仅仅稍微的改善了细胞吸收。在这项研究汇总,大部分蛋白质保留在所述脑膜中,非常有限地渗透到所述脑的软组织。这个结果表明,TAT多肽介导的递送不呢充分地替代受体介导的Naglu细胞吸收。
Naglu Kif
推荐Naglu-Kif并且制备和纯化。Naglu-Kif通过使用改进的细胞培养过程制备,并添加Kifunensine至所述培养基中。Kifunensine的添加改变了rhNaglu的糖基化途径,增强了高甘露糖多糖的生产,并且抑制了复杂碳水化合物的增加。Kifunensine抑制高尔基α-甘露糖苷酶I活性,并且因此抑制所述高甘露糖多糖的去除,导致抑制复杂多糖的耦合。结果,Naglu-Kif主要含有高甘露糖多糖。使用(源自细胞系的)巨噬细胞的细胞吸收证实了:Naglu-Kif的甘露糖依赖型吸收。但是,活体内实验表明,在鞘内注射进入所述野生类型插管大鼠的脑脊液的过程中,Naglu-Kif在分布至所述脑软组织方面,未能显示超过rhNaglu的改善。因此得出结论,甘露糖受体介导的Naglu-Kif吸收不能促进rhNaglu在所述CNS的递送。
Naglu-ApoE
ApoE(Apo脂蛋白E)的受体结合结构域融合到Naglu的C-末端,利用所述低密度脂蛋白受体(LDLR),以进行Naglu的细胞吸收。所述方法是基于支持LDLR存在于所述BBB的研究(Begley DJ et al.,CurrentPharmaceutical Design,2008,14,1566-1580。初步的小鼠活体内研究表明,Naglu-ApoE静脉施用至Sanfilippo B小鼠不运入脑中。
rhNaglu的IV施用
进行活体内实验,以研究在转运通过所述BBB中的rhNaglu和Naglu-IGFII。所述研究表明,在Sanfilippo B小鼠中,rhNaglu和Naglu-IGFII的IV施用不导致在所述脑中发现任何酶,并且没有发现组织病理学改善(在治疗小鼠中)。
Naglu-IGFII
通过将所述胰岛素样生长因子II序列(氨基酸8至67,8-67IGFII)融合至所述Naglu序列,构建Naglu-IGFII。与所述全长IGFII分子相比,据报道,8-67IGFII与所述M6P/IGF II受体结合,具有高于其2-10倍的亲和力;而当与所述IGF I受体结合减少30倍(Hashimoto R,JBC1995270(30):18013-18018)。
所述Naglu-IGFII分子含有连接体序列,其插入在Naglu和8-67IGFII之间。该连接体序列由三个串联重复的“GGGGGAAAAGGGG”、两个“GAP”序列(每端侧翼)、以及1个“GAP”序列(在每两个重复之间)。所述载体的实际序列在下文表7中提供:
表7:连接体序列
Naglu-GAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAP-IGFII(SEQ ID NO:3)
为了形成重组Naglu-IGFII融合子,将所述cDNA插入进表达载体pXD671,并转染至人类成纤维细胞系。所述重组的Naglu-IGFII融合蛋白质的蛋白质序列在下文表8中提供:
表8:重组Naglu-IGFII融合蛋白质的蛋白质序列
DEAREAAAVRALVARLLGPGPAADFSVSVERALAAKPGLDTYSLGGGGAARVRVRGSTGVAAAAGLHRYLRDFCGCHVAWSGSQLRLPRPLPAVPGELTEATPNRYRYYQNVCTQSYSFVWWDWARWEREIDWMALNGINLALAWSGQEAIWQRVYLALGLTQAEINEFFTGPAFLAWGRMGNLHTWDGPLPPSWHIKQLYLQHRVLDQMRSFGMTPVLPAFAGHVPEAVTRVFPQVNVTKMGSWGHFNCSYSCSFLLAPEDPIFPIIGSLFLRELIKEFGTDHIYGADTFNEMQPPSSEPSYLAAATTAVYEAMTAVDTEAVWLLQGWLFQHQPQFWGPAQIRAVLGAVPRGRLLVLDLFAESQPVYTRTASFQGQPFIWCMLHNFGGNHGLFGALEAVNGGPEAARLFPNSTMVGTGMAPEGISQNEVVYSLMAELGWRKDPVPDLAAWVTSFAARRYGVSHPDAGAAWRLLLRSVYNCSGEACRGHNRSPLVRRPSLQMNTSIWYNRSDVFEAWRLLLTSAPSLATSPAFRYDLLDLTRQAVQELVSLYYEEARSAYLSKELASLLRAGGVLAYELLPALDEVLASDSRFLLGSWLEQARAAAVSEAEADFYEQNSRYQLTLWGPEGNILDYANKQLAGLVANYYTPRWRLFLEALVDSVAQGIPFQQHQFDKNVFQLEQAFVLSKQRYPSQPRGDTVDLAKKIFLKYYPRWVAGSWGAPGGGGGAAAAAGGGGGGAPGGGGGAAAAAGGGGGGAPGGGGGAAAAAGGGGGGAPLCGGELVDTLQFVCGDRGFYFSRPASRVSRRSRGIVEECCFRSCDLALLETYCATPAKSE(SEQ ID NO:4)
使用Naglu酶活性分析,以筛选高表达HTl080克隆。为了进一步增加Naglu-IGFII的表达,所述选定的细胞系被再次转染(用额外的携带所述相同转录单位的质粒)。在所述单一转染和双重转染的细胞系中,所述分泌Naglu-IGFII都含有全长成熟Naglu序列和全长8-67IGFII。所述Naglu-IGFII融合蛋白质显示有倾向于相同合成底物(4-MU-N-乙酰α-D-氨基葡糖苷)的酶活性。图4-6描绘了示例性的波产量,使用所述双重转染的Naglu-IGFII细胞系运行。这种Naglu-IGFII细胞系的所述波产量在图4中,达到0.5pcd(统计图每天每百万细胞每图)的Naglu-IGFII。
rhNaglu和Naglu-IGFII的纯化
相似的纯化过程被应用于rhNaglu、Naglu-IGFII、Naglu-ApoE和NagluKif。改进的纯化过程应用于Naglu-TAT。rhNaglu和Naglu-IGFII蛋白质的纯化在下文概述。
为了纯化rhNaglu和Naglu-IGFII,采用了三步加工过程(图7)。首先,使用超-过滤设备(UF)浓缩所述条件培养基。所述浓缩培养基然后被应用于丁基琼脂糖凝胶层析柱(Butyl),并且随后应用于Q琼脂糖色谱柱(Q)。所述纯化的蛋白质被缓冲剂更换成PBS(11.9mM磷酸钠,2.7mM磷酸钠,137mM氯化钠,pH7.4)的制剂,用于储存。所述纯化的rhNaglu和Naglu-IGFII分别具有纯度99%和95%,其通过反相高压液相色谱法评估(数据未示出)。
rhNaglu和Naglu-IGFII的生物化学性质
所有的Naglu变异型、rhNaglu、Naglu-TAT、Naglu-IGFII、Naglu-Kif和Naglu-ApoE表现倾向于所述合成底物(4-甲基伞形-N-乙酰-a-D-氨基葡糖苷)的相似生物活性。所有的变异型对于磷酸糖基化为阴性,通过多糖分析(通过高效阴离子色谱交换)和单糖分析测定。
下面的章节概述了rhNaglu和Naglu-IGFII的生物化学性质(表9)。如在表9中所见的,rhNaglu和Naglu-IGFII的生物化学比较表明了在所述两种蛋白质之间的相似酶活性和稳定性。通过差异扫描热量法测量最适pH:对于rhNaglu为pH5-pH6.5,以及对于Naglu-IGFII为pH6至pH6.5。该结果与溶酶体水解酶的需要一致,在所述溶酶体酸性环境中表现出最佳稳定性。
表9:rh Naglu和Naglu-IGFII的生物化学比较
此外,成功浓缩Naglu-IGFII至多至26mg/ml,通过Bradford蛋白质分析测定(在4℃储藏至多3个月以后没有聚集或者丧失活性的迹象)。对于Naglu-IGFII制剂,也测试了含有5mM磷酸钠(pH6.5,150mM氯化钠,0.005%聚山梨醇酯20)的制剂(例如IT施用)。在所述PBS制剂和所述IT制剂之间,观察到相似的稳定性和可溶性(数据未示出)。
Naglu的结晶体结构
在rhNaglu开发中的一个突破是通过PEPR测定了Naglu的结晶体结构。该成功为Naglu提供了深入的结构,并且有助于预测蛋白质稳定性和制剂需求。这也是考虑到的:Sanfilippo B患者突变体Naglu3D结构的排列将提供药物开发的细节和工具。
从rhNaglu蛋白质获得所述结晶体(图8),所述rhNaglu蛋白质从用甘露糖苷酶-I抑制剂(Kifunensine)处理的培养基中纯化得到。Naglu Kif含有与rhNaglu一致的蛋白质序列,但是不同于糖基化模式。获得的NagluKif结晶体在pH=7.5上生长,并且Naglu Kif的结构在2.4分辨率(通过X-射线结晶学)溶解。Naglu结构(图9)被识别为具有三种不同的结构域:N-末端结构域(结构域-I,氨基酸24-126),然后是(α/β)8桶状结构域(含有催化的谷氨酸盐)(结构域-II,氨基酸127-467),以及所有螺旋C-末端结构域(结构域-III,氨基酸468-743)。对于另一糖苷水解酶家族-89蛋白质,cpGH89(细菌同源的Naglu)观察到相似的结构域(Ficko-Blean E, et al.,PNAS May6,2008vol.105no.186560-6565)。所述活性位点是在结构域II和III之间的裂口处,并且所述催化残基被确定为在结构域II上E316和E446。
在所述结晶体结构(图10)中可以见到紧密包装的对称三聚体排列Naglu分子,其与从超高速离心法分析(AUC)和体积排阻色谱分析(与多角度激光光散射(SEC-MALS)试验联机)观察到的天然协议状态(nativeassociation state)一致。在结构域II中的疏水相互作用和氢键维持了所述蛋白质的三聚体构象。H227出现,与附加分子R297在三聚体化的过程中形成堆垛相互作用。此外,E302与K301相互作用,形成分子间氢键。
Naglu具有6个潜在的N-糖基化位点(N261、N272、N435、N503、N526和N532),并且所有个位点在所述晶体结构中是糖基化的。对于与N272和N435每个连接的两个NAG分子,以及与N261、N503、N526和N532每个连接的一个NAG分子,在所述电子密度图谱(在分辨率)中观察到清晰的电子密度。由于溶解暴露的糖部分的柔性性质,所述多糖结构的剩余物在电子密度图谱中不能清晰可见。
Naglu的结构信息有助于Naglu的稳定性分析和分子水平特征分析。在Naglu中有8个半胱氨酸,其中4个形成二硫键(Cys273-Cys277和Cys504-Cys509).另外4个,C97、C99、C136和C405,作为还原的半胱氨酸出现(在所述结晶体结构中),即使在所述纯化和结晶化过程中没有使用还原剂。C97和C99彼此接近,并且部分暴露于表面。但是,C136和C405被埋入,并且根据该结构不可能形成分子间二硫键。
可以设想,根据目前可以获得的结构信息,Sanfilippo B患者突变体图谱解释了这种疾病的未来药物开发潜力(例如小分子伴侣分子的理论设计)。来自所述文献(Yogalingam2001)报道的San B突变体在所述结晶体结构图谱中绘制。几簇的突变体可能与结构或者功能区域相关,例如活性位点,在结构域-III中含有三个糖基化位点的环、以及在所述三个结构域之间的接口处(图10)。另外,几簇的突变体可以在N-末端的结构域-I和C-末端螺旋束状结构域-III中看到。这些突变残基的大多数是氢键和其它非共价相互作用的组成部分,并且其参与Naglu的结构稳定性。
实施例2:rhNaglu和Naglu-IGFII的体外研究
使用两种的Sanfilippo B患者成纤维细胞,GM02391(P359L)和GM01426(E153K),以及一种正常人类成纤维细胞系,研究了每种Naglu变异型的细胞吸收机制。由于在所述细胞系上M6P受体表达,传统上研究者使用成纤维细胞研究溶酶体酶的细胞吸收。
通过使成纤维细胞与rhNaglu或者Naglu-IGFII在37℃孵育4小时,进行细胞吸收研究。在孵育后,洗涤和裂解细胞,并测量Naglu在裂解液中的酶活性。rhNaglu与成纤维细胞的孵育导致在细胞内几乎没有可检测的酶量。相反,Naglu-IGFII与成纤维细胞的孵育导致酶在细胞内的显著水平(图11)。内在化的Naglu-IGFII的量达到饱和,同样用于孵育的酶的量增加。所述剂量依赖性的饱和吸收对于受体介导的细胞吸收,是典型的发现。而且,Naglu-IGFII的内在化不受外源M6P的抑制,但是被外源IGFII完全抑制(图11)。这个结果表明了:Naglu-IGFII内在化进入成纤维细胞,依赖于M6P/IGFII受体,以糖基化独立的方式。
进行实验,以研究rhNaglu和Naglu-IGFII至溶酶体的运输。使用Sanfilippo B患者成纤维细胞(GM01426)进行该研究。rhNaglu和Naglu-IGFII检测,通过在将使所述蛋白质与所述细胞初始孵育后,用抗-人Naglu多克隆抗体染色检查。使用LAMP-1(溶酶体相关膜蛋白1)的免疫荧光染色,以检测溶酶体。rhNaglu和Naglu-IGFII,与溶酶体的共定位,通过共聚焦显微镜可视化(图12)。
在所述蛋白质与所述细胞孵育4小时后,观察到Naglu-IGFII的广泛内在化,证明了Naglu-IGFII与溶酶体的共定位。相反地,rhNaglu未能在相同时间框架内的内在化,并且没有观察到与溶酶体的共定位。这个结果进一步为以下提供了证据:Naglu-IGFII被内在化进入细胞,并被运输到正确的细胞房室(溶酶体)。在Sanfilippo B患者成纤维细胞中,测定内在化的Naglu-IGFII的半衰期为1.5天(未显示数据)。
实施例3:在小鼠模型中的体内研究
野生类型(wt)插管的大鼠
除了Sanfilippo B小鼠模型,使用所述wt插管的大鼠(一种无缺陷的动物模型),以进行在体内的分子筛选。所述wt插管的大鼠具有外科植入的插管(在所述脊髓的上腰部和下胸部区域),并且通过所述插管,35ul的单剂量注射至所述CSF。使用该动物模型评估分子筛选的标准是Naglu活性检测、以及所述脑和脊髓的免疫组织化学。
Sanfilippo综合症B小鼠模型
Sanfilippo B的小鼠模型(Naglu-/-小鼠,Sanfilippo B小鼠)由E.Neufeld和其同事形成(Li HH,et al.,PNAS96(25):14505-14510;1999)。所述小鼠的Naglu基因的外显子6被插入的选择性标记物(新霉素抗性基因)打断。最终的同型结合子Naglu-/-小鼠是完全Naglu缺乏的(图13),并且在肝脏和肾脏中具有总的GAG累积。尽管Naglu的总缺陷,但是这些小鼠通常健康并具有8-12个月的寿命。其它溶酶体酶的表达变化发生在约5个月龄,这些变化包括:β-半乳糖苷酶、α-葡萄糖苷酶、β-葡萄糖醛酸酶和β-氨基己糖苷酶在肝脏和脑中的补偿性增加,α-L-艾杜糖苷酸酶在肝脏但不在脑中的提高,以及唾液酸苷酶在肝脏和脑中的降低。死亡通常由于尿滞留和尿传染而发生。已经在文献中广泛研究了所述Sanfilippo B小鼠模型,以描述Sanfilippo B病理学变化。已经报道了Naglu-/-小鼠的CNS病理相关的表现型,在4.5月龄为低活性,但是已经观察到在其它年龄段为极度活跃。
在Naglu-/-小鼠中的神经病理变化被描述为在神经元、巨噬细胞和内皮细胞中的液泡和内含体,其通过EM(电子显微镜)观察。这些病理变化通常在33天龄开始,并且随动物变老而进行性地恶化。通过组织病理学分析,也证明了活化的星形胶质细胞细胞和小胶质细胞。B两种神经节苷酯的生物化学分析(GM2和GM3)表明:5倍和9倍增加所述脑。(由于GM2和GM3不是Naglu的直接底物,并且在ERT后短时间内证明其显著减少是挑战性的,所以他们没有用作POC的生物标记物)。
通过测量Naglu酶活性和GAG水平进行了生物化学分析,通过抗-人Naglu抗体、抗-LAMP-l抗体、抗-Iba-l抗体和抗-GFAP抗体免疫组织化学进行了组织学分析。本研究使用的抗-人Naglu抗体为小鼠单克隆抗体,其不与在wt小鼠中的内源性鼠科Naglu或者Sanfilippo B小鼠的变异Naglu结合。LAMP-1免疫染色使用抗体结合溶酶体膜蛋白质,溶酶体相关膜蛋白-1。Iba-1染色使用的抗体结合离子钙-结合接头蛋白质,其对于小胶质细胞和巨噬细胞是特异性的。GFAP染色使用的抗体与胶质纤维酸性蛋白结合,其对于星形胶质细胞是特异性的。
通过颅内的(IC)注射进入Sanfilippo B小鼠,进行活体内生物活性筛选
这项研究的目的是评估Naglu酶在体内的生物活性。在这项研究中,通过IC注射施用蛋白质进入所述Sanfilippo B小鼠的脑中。本研究的Sanfilippo B小鼠的年龄接近匹配在8周龄。所述IC注射途径提供了最好的案例方案,以评估所述分子的功效。Naglu蛋白质的评估,通过其被吸收进入神经元细胞和减少溶酶体贮积的能力进行。施用免疫组织化学评估生物分布。并且溶酶体贮积被表征为使用LAMP-l免疫染色的阳性染色数量和体积。
通过经过所述Sanfilippo B小鼠的头骨直接注射进右大脑皮层,进行IC注射。将2微升或者35μg的Naglu蛋白质注射进入每只动物。所述动物的牺牲发生在注射后的7天。在初步研究中,牺牲的时间是预先确定的,其中动物牺牲发生在注射后的3、7和14天。从所述初步研究,已经确定:注射后7天对于免疫组织化学研究是最合适的时间。脑切片被横向切断(图14),并进行Naglu和Lamp-1免疫染色。通过使用抗-人Naglu抗体的免疫组织化学,证明:细胞吸收进入所述神经元和胶质细胞(在rhNaglu和Naglu-IGFII处理的Sanfilippo B小鼠中)(图14-16)。在rhNaglu和Naglu-IGFII处理的Sanfilippo B小鼠之间,观察到关于所述细胞吸收没有显著差异。另外地,(rhNaglu和Naglu-IGFII处理的小鼠两者都)脑组织的LAMP-1免疫染色表明:溶酶体贮积的降低。溶酶体贮积降低的水平(在rhNaglu和Naglu-IGFII处理组中,两者都)与正常wt小鼠水平几乎相同。
也观察到在IC注射后溶酶体贮积的降低(在Naglu-TAT、Naglu-Kif和PerT-Naglu测试的Sanfilippo B小鼠中)(未显示数据)。这项研究表明:所有Naglu的所述变异性的体内生物活性。
在单独的研究中,Naglu-缺陷小鼠被IT施用媒介物,或者可选的一周、两周或者三周剂量的重组Naglu-IgF-II融合蛋白构建体(Naglu)(在PBS中)。未处理野生-类型组的小鼠作为未处理野生-类型对照,并且施用没有Naglu的媒介物。小鼠在最终注射后的24小时后牺牲,接着制备组织进行免疫组织化学(IHC)和组织病理学分析。
在IT-施用所述重组Naglu后,Naglu分布至所述Naglu-缺陷的小鼠是明显的。如在图17A中图解的,IT-施用所述重组Naglu至Naglu-缺陷的小鼠,导致细胞液泡在所述白质组织中的普遍减少,与被IT-使用媒介物的Naglu-缺陷的小鼠相比。相似地,并且如在图17B中所图解的,形态计量分析揭示了:在所述处理小鼠中所述白质组织中LAMP1免疫染色的显著减少(相对于所述未处理Naglu-缺陷小鼠),从而反映了在疾病病理中的改善。
如在图18A-B中所示的,在被评估的每个区域的脑组织中(所述皮层,尾状核和豆状核(CP)、丘脑(TH)、小脑(CBL)和白质(WM)),在所述Naglu-处理小鼠中所述LAMP-阳性区域减少(相对于所述未处理Naglu-缺陷对照小鼠),并且接近于野生-类型小鼠的所述LAMP-阳性区域。特别显著的是,在被分析脑组织的每个区域中,在所述IT-施用两个或3个剂量(图18B)后,LAMP-阳性区域进一步减少,相对于单一剂量的(图18A)Naglu。
这些结果确证了:IT-施用的Naglu能改变溶酶体贮积症(例如在Naglu-缺陷小鼠模型中的Sanfilippo综合症类型B)的进展,进一步确证了IT-施用酶(例如Naglu)治疗溶酶体贮积症(例如Sanfilippo综合症类型B)并发的CNS表现的能力。
通过鞘内(IT)注射进入wt插管的大鼠,进行分子筛选
这项研究直接模拟药物施用的端口-介导方法。通过IT注射进入wt插管的大鼠,施用Naglu蛋白质,以测定其进入所述脑实质的生物分布。
在这些动物中的所述插管放置在脊髓的上腰椎和下胸椎部分(图19)。通过所述插管(由于可溶性限制,Naglu Kif仅被注射38.5ug,其少于其余Naglu的10倍),动物被注射5gl或者385μg的rhNaglu、Naglu-TAT、Naglu-IGFII和PerT-Naglu。牺牲发生在注射后的4小时或者2小时。
收集脑和脊髓组织,并通过Naglu活性分析测量。在所述处理动物的脑中,Naglu-TAT和Naglu-IGFII处理的动物表现更高的活性,与所述rhNaglu和其它Naglu变异型处理的动物(图20)相比。作为总趋势,对于所有处理的动物,在脊髓中所述Naglu活性显著高于在脑中(未显示数据)。这种现象可能表明:在接近所述IT注射位点,蛋白质被吸收更多。
免疫组织化学分析表明:在IT注射后的24小时,Naglu-IGFII处理组的生物分布在脑中比其它Naglu变异型处理组更加广泛(图21和22)。在所述rhNaglu处理动物中,仅在所述脑的脑膜中观察到所述蛋白质。在所述脊髓切片中,IHC表明:一些细胞吸收rhNaglu(在灰质神经元中),但是其与在脊髓神经元中的Naglu-IGFII吸收相比,程度较小(未显示数据)。
在Naglu-TAT IT注射组中,即使最高的Naglu活性在脑组中观察到(通过生物化学分析),但是IHC未能表明:任意的Naglu-TAT渗透进入所述脑的软组织,除了保留在所述脑膜上。除了Naglu-IGFII,所有的或其它的Naglu变异型未能显示越过脑膜的生物分布,这有力证明了Naglu细胞吸收依赖于M6P/IGFII受体(在脑中),在IT注射后。这个研究指出:Naglu-IGFII是主要的分子,用于Sanfilippo B的药物开发。
实施例4:使用Naglu-IGFII的验证性概念研究
实验设计
设计验证性概念研究,以表明(在Sanfilippo B小鼠中)在IT注射Naglu-IGFII后的生物分布和溶酶体贮积症逆转。对于这项研究,三组的Sanfilippo B小鼠(在8周龄),用IT注射Naglu-IGFII处理。每个IT注射剂含有10ul体积或者260ug的Naglu-IGFII。有三个处理组:1x注射,2x注射和3x注射组。对于所述1x注射组,单一剂量的蛋白在第0天施用。动物在注射后24小时牺牲。对于2x注射组,两次IT注射在第0天和第7天施用,并且动物在所述末次注射后的24小时牺牲。对于所述3x注射组,IT注射在第0天、第7天和第14天施用,并且动物在末次注射后的24小时牺牲。所述三组的媒介物处理小鼠也被包括在内。对于所述媒介物对照组,Sanfilippo B小鼠被注射媒介物(以与所述处理组相同的时间间隔),并且以与所述处理组相同的方式牺牲。
生物化学和组织学两者都被应用,以评估本研究的结果。所述生物化学分析包括Naglu活性分析(以测量酶在所述组织中的量),以及总GAG分析(以测量溶酶体贮积的减少)。对生物化学分析,肝脏和脑是所述受试的组织(图23和图24)。所述组织学分析包括H&E染色,以进行形态学评估(未显示数据),以及用抗-人Naglu抗体、LAMP、Iba和GFAP(数据未显示Iba和GFAP染色)进行的免疫组织学染色。
本研究使用的抗-人Naglu抗体是小鼠单克隆抗体,其不结合在wt小鼠中内源的鼠科Naglu或者在Sanfilippo B小鼠中变异的Naglu。LAMP-1免疫染色使用抗体与溶酶体相关膜蛋白结合。Iba-l染色使用抗体与离子钙结合接头蛋白质结合,其对于小胶质细胞和巨噬细胞是特异性的。GFAP染色使用抗体与胶质纤维酸性蛋白结合,其对于星形胶质细胞是特异性的。
Naglu免疫荧光的代表性微观图片在图25中示出。图26描绘了所述脑的代表性切片示意图。即使Naglu-IGFII被检测进入更接近脑膜的大脑皮层,但是其没有在皮层下区域(例如尾状核、丘脑和白质)发现(未显示数据)。由于所述相同皮层下区域LAMP-1、Iba-1和GFAP的免疫染色确实表明了溶酶体贮积的逆转,可认为,Naglu在所述深部脑区域的阴性免疫染色可能是由于Naglu免疫荧光的敏感性。
Lamp-1免疫染色的代表性微观图片在图27-31中示出。为了证明蛋白质分布和功效的程度,选择大脑皮层和皮层下区域(尾状核、丘脑和白质,以及小脑皮层),以进行免疫组织学分析。来自Iba-1和GFAP免疫染色(未显示数据)的结果表明:在LAMP-1免疫染色中所见到的是小胶质细胞和星形胶质细胞变化的组合影响,已报道这两种细胞类型在Sanfilippo B小鼠模型中受影响(Li2002,Ohmi2002),除了神经元以外。由于技术限制,LAMP-1免疫染色不能显示在神经元中的溶酶体贮积。为了更好地观察在神经元中的溶酶体累积,例如液泡和包涵体,通常利用电子显微镜(EM不包括在目前的研究中)。
将被理解的是,细胞类型的识别限制于神经元和胶质细胞。所述神经元通常地被识别,通过相对大和苍白的核(其中包含一个或多个致密染色的核仁)、以及经常可检测的细胞质。所述胶质细胞通常被识别,通过小而致密的核、以及不显眼的细胞质。在所述不同类型的胶质细胞之间的区分(例如星形胶质细胞、小胶质细胞、室管膜细胞和少突胶质细胞)通常的,通过用细胞类型特异性标记物染色进行。
在所述大脑皮层、尾状核、丘脑、白质和小脑中,在IT注射Naglu-IGFII后,除了溶酶体贮积的减少(通过所述LAMP-1免疫染色表现),Iba-1免疫染色表明了在小胶质细胞(microgial cell)中细胞体积和突起数目的减少,并且GFAP免疫染色表明了在星形胶质细胞中细胞大小和突起的长度/数目的减少(未显示数据)。而且,通过来自与免疫组织化学检测相同区域的脑组织H&E染色(苏木精和曙红),进行的组织病理学分析表明:在胶质细胞中的液泡在3x IT注射Naglu-IGFII后减少。所有上文提及的结果也意味着Naglu-IGFII注射的剂量相关影响。
Sanfilippo B小鼠在IT注射Naglu-IGFII后的生物化学分析,检测了在脑和肝脏中的Naglu活性。所述Naglu-IGFII的功效通过总GAG在脑和肝脏中的减少证明。免疫组织化学表明了Naglu-IGFII在脑实质中的生物分布。LAMP-1、Iba-1、GFAP的免疫染色和组织病理学分析(通过H&E染色)表现了溶酶体贮积的减少,所述体积和突起的减少(由小胶质细胞和星形胶质细胞)不仅仅在所述脑的大脑皮质区域,而且在所述脑的皮层下区域、白质和小脑皮层。
结论
此外,已经表明,所述融合蛋白,Naglu-IGFII,表现了在体外对底物的酶活性,所述底物具有与Naglu天然底物相似的结构。在体外的细胞吸收研究表明,所述分子被所述M6P/IGFII受体吸收(以独立于M6P糖基化的方式/)。内在化的Naglu-IGFII被显示与溶酶体共定位。Naglu-IGFII被显示:在IC注射进入所述Sanfilippo B小鼠后,减少在体内的溶酶体贮积。与rhNaglu和其它Naglu融合体和修饰体相比,在IT注射后,在渗透进入所述wt插管的大鼠脑实质方面,Naglu-IGFII超过了它们。最终,IT注射的Naglu-IGFII融合子入Sanfilippo B小鼠表明了越过所述脑膜良好地广泛分布,并且观察到溶酶体贮积在所述大脑皮层中以及所述皮层下区域中逆转。总之,这些数据表明Naglu-IGFII是治疗Sanfilippo B疾病的候选药物。
实施例5:NAGLU-IGFII的毒性、药代动力学(pk)和组织生物分布研究在小鼠中的验证性概念研究
Naglu(-/-)小鼠的三组(n=3)注射10uL含260ug Naglu-IGFII(作为单一推注IT腰椎注射)。所述260ug剂量解释为520mg/kg脑重量剂量(小鼠脑=0.0005kg)。一个组在第0天注射,并在注射后24小时牺牲。-个第二组在第0天和第7天注射,并且在末次注射后24小时牺牲。所述第三组在第0、7和14天组合注射,并在末次注射后24小时牺牲。每个Naglu-IGFII-给药组搭配媒介物对照组,以控制年龄/疾病严重程度。
在所述脑和肝脏中的Naglu酶活性,对于所述三个Naglu-IGFII-给药组是相似的。将rhNaglu酶活性在所述肝脏中与脑进行比较,在所述肝脏中发现超过10-倍的rhNaglu酶活性。这也是被考虑到的:因为在脑和肝脏中rhNAGLU酶活性水平是可比的,在1-、3-以及6-个月的给药后,在鼠和青少年猴子的所述关键毒性研究中,其中给予Naglu(-/-)小鼠的所述一些部分的rhNaglu剂量可能不是IT递送至肝脏,而是全身地递送。虽然如此,在所述脑中的总GAG水平显示了在3IT注射后的统计-显著性减少(p<0.05)。在所述肝脏中看到总GAG水平减少的剂量相关趋势,这在接受2或者3次剂量的所述组中是统计-显著性的(p<0.05)。
在IT注射后Naglu-IGFII的生物分布,很好地观察到其越过脑膜进入所述脑的软组织,但是深部皮下层区域对于抗-Naglu抗体免疫染色阴性。仅在所述给予2或者3次剂量的所述组中,观察到溶酶体活性的减少(通过溶酶体相关膜蛋白(LAMP)免疫染色)。溶酶体活性减少的区域包括大脑皮层和(尾状核、丘脑和白质的)深部皮层下区域。因此,在Naglu-IGFII-给药的动物中,多种免疫染色参数的减少意味着:尽管缺乏抗-NAGLU免疫染色,NAGLU的治疗水平可能存在。减毒的炎症反应,由星形胶质细胞的胶质纤维酸性蛋白(GFAP)免疫染色的减少,以及小胶质细胞/巨噬细胞的离子钙结合接头分子(Iba)染色的减少所证明(仅在接受2或者3次剂量的所述组中)。分析区域包括大脑皮层和(尾状核、丘脑和白质的)深部皮层下区域。
在鼠中研究
选择所述S-D作为啮齿物种,以从毒物学上评估IT-施用Naglu-IGFII。作为结果,16只鼠(每个性别8只)被给药重组Naglu-IGFII,在最大可行剂量(MFD)、以及1/4和1/2的所述MFD(分别为低的-和中间的-剂量水平),每4天共8剂量。
进行在鼠中的单剂量PK/生物分布研究,以分别测定CSF和血清浓度、或者组织分布(在IT施用至雄性和雌性动物中)。
设计毒理学研究,以评估Naglu-IGFII的IT-L施用的毒理学、以及安全药理学(神经病学的、呼吸系统的和心血管安全性的)的观点,包括在雄性和雌性动物中。在这些研究中的毒物学评估包括临床观察、体重、采食量、临床病理、合适的安全药理学评估(身体检查或者心电描记法)、总体组织和微观评估。收集有限数量的CSF和血清样本,并进行Naglu-IGFII分析,并作为所述测试制品的抗体。Naglu-IGFII组织分布和亚细胞定位的定量,分别通过酶活性分析和免疫组织化学。另外,选定的研究包括恢复期,以评估任何指出的显著毒物学发现的可逆性、或者潜在延迟外观。
在猴子中的研究
选择食蟹猴以作为非啮齿动物物种,以从毒物学角度评估IT施用Naglu-IGFII,由于它们与人类遗传学和解剖学的相似性,因此被认为是人类最相关的物种。假定Sanfilippo B临床试验的所述预计患者人口为儿科的,在青少年食蟹猴中进行慢性6-个月毒理学研究,特征为进行鞘内药物递送设备(IDDD)施用Naglu-IGFII。青少年食蟹猴在研究起始通常小于1年的年龄(约7-9个月龄),并且在研究起始称重在900至1,500之间。从1-个月重复剂量青少年食蟹猴研究获得的数据指导了所述剂量水平的选择、以及所述6-个月青少年食蟹猴研究的设计。所述重复剂量毒理学研究被设计,以模拟在1至6个月的时间段内,所述预期的临床途径(IT-L推注)和施用频率(每隔一周,EOW)。
如上文所描述的,设计毒理学研究,以评估IT-L施用Naglu-IGFII,从毒理学和安全药理学角度(神经学的、呼吸系统的和心血管安全性的),包括在雄性和雌性动物中。在这些研究中的毒物学评估包括临床观察、体重、采食量、临床病理、合适的安全性药理学评估(通过身体检查或心电描记法)、总组织和微观评估。收集有限数量的CSF和血清样本,并进行Naglu-IGFII分析,以及作为对所述测试制品的抗体。Naglu-IGFII组织分布和亚细胞定位,分别通过酶活性分析和免疫组织化学定量。另外,选定的研究包括恢复期,以评估任何指出的显著毒物学发现的可逆性或者潜在延迟外观。
实施例6.Naglu-IGFII的EOW鞘内施用
设计这个实施例,测定在所述Naglu-/-小鼠模型中,IT-腰部给药EOW,持续6次注射(3个月的研究)的可行性。这个给药方案与每周给药相比,更加地临床相关。
根据下述的实验设计,研究8周年老的Naglu-/-雄性和雌性小鼠:
表10:Naglu-IGFII的EOW IT递送的实验设计
生理学研究,包括进行:在肝脏、脑和血清中的Naglu活性分析,在血清中的抗-Naglu抗体分析,以及在肝脏和脑的BCA分析。组织学研究,包括进行:对脑、脊髓和肝脏的Naglu IHC,以及对脑和脊髓的Lamp染色。
收集脑、脊髓和肝脏,并固定在10%NBF中。制备5μm石蜡切片,以进行组织学染色。使用Naglu的免疫组织化学(IHC)染色,以检测所述注射蛋白质的细胞吸收。使用H&E染色,以观察形态学变化。LAMP(一种溶酶体活性和疾病状态的指示),GFAP和Iba-1(激活星形胶质细胞和小胶质细胞的两种CNS病理学标记物),被用于评估组织病理学的改善。
脑、脊髓和肝脏的媒介物和Naglu-IGFII处理小鼠的Naglu免疫染色表明,在所述脑和脊髓中,注射的Naglu在脑膜(M)中仅通过IHC检测到,并且在任何其它区域没有检测到Naglu阳性染色(图32)。在所述肝脏中窦状腺细胞为Naglu阳性,并且在肝细胞(H)中没有发现Naglu吸收。
媒介物和Naglu-IGFII处理小鼠的肝脏和脊髓的LAMP免疫染色和H&E染色表明,与所述媒介物动物相比,LAMP染色在Naglu处理的整个肝脏和脊髓中都减少。H&E染色显示,在肝脏中,在处理组中的细胞液泡形成显著减少(与媒介物处理动物相比)(图33和图34)。
媒介物和Naglu-IGFII处理小鼠的H&E染色表明,在6次每隔一周,IT注射Naglu-IGFII,持续3个月后,在所述脑中形态改善。在所述处理的脑中,在所有检验区域,所述细胞液泡形成(箭头)减少(与所述媒介物组相比)(图35)。
在6次IT Naglu注射,持续3个月后,在多个脑区域的LAMP IHC表明,与所述媒介物处理组相比,Naglu IT施用至SFB小鼠,导致溶酶体活性在所有检测区域减少(通过LAMP免疫染色显示)(图35)。这种减少的特征在于,LAMP阳性细胞数量减少,较小的细胞体积和较轻的染色。与其他脑区域相比,在所述脑和脑干中发现显著的较少,其定位于(靠近脊髓)脑的尾状核部分。在所述深部区域(包括白质、海马和丘脑)也发现明显的减少。
在6次IT Naglu注射,持续3个月后,多个脑区域的Iba IHC揭示了小胶质细胞的活化(图36)。与媒介物处理组相比,在Naglu处理组中观察到:阳性细胞的数量和染色强度没有减少。尽管如此,在所有检测的脑区域中,阳性小胶质细胞的细胞形态随细胞大小的减少而改变,与在所述媒介物组中大的和液泡化的相比(插入物)。
在6次IT Naglu注射,持续3个月后,在多个脑区域中的GFAP IHC揭示了星形胶质细胞的活化(图37)。与所述媒介物处理组相比,GFAP阳性染色在所述小脑和脑干中减少,并且在其它检验区域轻微减少。
关于细胞吸收,这些数据表明,在所述脑和脊髓中,仅在6次每隔一周Naglu IGFII IT注射持续3个月以后,在脑膜细胞中检测到Naglu。在所述脑和脊髓的其它区域,Naglu通过IHC检测不到。在所述肝脏中,在窦状腺细胞中发现Naglu的阳性染色。
在所述脑和脊髓中,在6次每隔一周的Naglu-IGFII,持续3个月以后,在整个所述脑和脊髓中可见到组织病理学改善,尽管注射的Naglu通过IHC检测不到。H&E染色表明了在所有检测脑区域中细胞液泡化的减少。LAMP染色在整个处理脊髓和在所有被评估脑区域(包括白质、海马和作为深部脑区域的丘脑)中减少,并且(在Naglu-IGFII处理组中)在所述小脑和脑干中显著减少。星形胶质细胞GFAP染色减少的染色模式,与LAMP染色一致,但没有如LAMP一样剧烈地减少。Iba-1染色显示了,在所有检测脑区域中,小胶质细胞的细胞体积减小。在所述肝脏中,H&E染色表明了,细胞液泡化减少,并且LAMP染色显著减少(在所述Naglu处理组中)。
实施例7:Sanfilippo B患者的治疗
通过例如IT递送的直接CNS施用,可以被用来有效地治疗Sanfilippo综合症类型B(Sanfilippo B)患者。这个实施例解释了:设计了多剂量递增研究以评估多达3剂量水平,每隔一周(EOW),持续40周的Naglu-IGFII和/或rhNaglu施用的安全性(通过鞘内药物递送设备(IDDD)至SanfilippoB综合症的患者)。适合于人类治疗的多种示例性鞘内药物递送设备在图38-41中进行了描述。
将招募多达20例患者:
队列1:5例患者(最低剂量)
队列2:5例患者(中剂量)
队列3:5例患者(最高剂量)
5例患者被随机分配至没有治疗组。
为本研究选取的患者是根据一下标准的内容:
在San A患者中测定了:通过IT注射施用Naglu(40周)的递增剂量的安全性。此外,评估了:Naglu-IGFII和/或rhNaglu对认知功能的临床活性、以及在血清中单一和重复剂量药代动力学、以及在脑脊髓液(CSF)中的浓度。
虽然本文描述的某复合物、组合物和方法已经根据某实施方案进行特定的描述,但是所述实施例仅用于解释本发明的复合物,并且不用于限制必须与其相同。
所述冠词“a”和“an”,如本文在说明书中和权利要求书中使用的,除非清楚地表明与之相反,应该被理解为包括其复数形式。在某组的一个或多个成员之间包括“或者”的权利要求或者描述,被认为:如果一个、一个或多个、或所有组成员存在、被采用或者以其它方式与给定的产品或过程相关,那么就是符合的;除非从上下文中表示相反或者其它方式明显地指出。本发明包括这样的实施方案:其中所述组的只有一个成员存在、或者被采用、或者以其它方式与给定的产品或过程相关。本发明也包括这样的实施方案:其中多个、或者整个组成员存在、或者被采用、或者以其他方式与给定的产品或过程相关。而且,应该理解,本发明包括来自一条或多条所列出的权利要求所有的变型、组合、以及置换,其中一种或多种限制、元素、条款、描述性术语等,其根据所述相同权利基础(或者相关、任意其它权利要求)被引入到另一权利要求,除非其它方式指出或者除非其对于本领域技术人员将明显地出现矛盾或者不一致。当元素以列表形式呈现(例如在Markush基团中或者类似的形式)时,应该理解,所述元素的每个亚组也是包括在内地被公开,并且任何元素可以从所述组删除。应该理解,一般而言,当本发明、或者本发明的某些方面,被指出包括特定的元素、特征等,那么本发明或者本发明的方面的某些实施方案、或者基本含有这些元素、特征等。为了简化这些实施方案,本文没有在每个案例中具体提出这么多的单词。应该理解,本发明的任意实施方案或者方面可以被清楚地从所述权利要求排出,无论所述具体的排除是否在本说明书中叙述。本文所引用的所述公开文本、网址和其它参考材料,为了描述本发明的背景、以及提供关于其实践的其它细节;都通过参考的方式引入本文。
Claims (57)
1.治疗Sanfilippo综合症类型B(San B)疾病的方法,包括步骤:
向有需要治疗的受试者鞘内施用重组的α-N-乙酰氨基(Naglu)蛋白质。
2.权利要求1所述的方法,其中所述重组的Naglu蛋白质为融合蛋白质,其包括Naglu结构域和溶酶体靶向部分。
3.权利要求2所述的方法,其中所述Naglu结构域包括与SEQ ID NO:1(成熟人类Naglu蛋白质)至少80%地一致的氨基酸序列。
4.权利要求2所述的方法,其中所述Naglu结构域包括与SEQ ID NO:1(成熟人类Naglu蛋白质)至少95%地一致的氨基酸序列。
5.权利要求2所述的方法,其中所述Naglu结构域包括与SEQ ID NO:1(成熟人类Naglu蛋白质)一致的氨基酸序列。
6.权利要求2-5任意一项所述的方法,其中所述溶酶体靶向部分为IGF-II部分。
7.权利要求6所述的方法,其中所述IGF-II部分包括与成熟人类IGF-II(SEQ ID NO:3)至少70%地一致的氨基酸序列。
8.权利要求6所述的方法,其中所述IGF-II部分包括与成熟人类IGF-II(SEQ ID NO:3)至少80%地一致的氨基酸序列。
9.权利要求6所述的方法,其中所述IGF-II部分包括与成熟人类IGF-II(SEQ ID NO:3)至少90%地一致的氨基酸序列。
10.权利要求6所述的方法,其中所述IGF-II部分包括氨基酸序列,并且所述氨基酸序列包含成熟人类IGF-II(SEQ ID NO:3)的残基8-67。
11.权利要求2-10任意一项所述的方法,其中所述融合蛋白质进一步包括在所述Naglu结构域与所述溶酶体靶向部分之间的连接体。
12.权利要求11所述的方法,其中所述连接体包括一条或多条GGGGGAAAAGGGG(SEQ ID NO:4)的氨基酸序列。
13.权利要求12所述的方法,其中GGGGGAAAAGGGG(SEQ IDNO:4)的氨基酸序列以串联重复的方式存在。
14.权利要求13所述的方法,其中所述连接体进一步包括一个或多个GAP序列。
15.权利要求14所述的方法,其中所述连接体包括氨基酸序列
GAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAP(SEQ ID NO:5)。
16.权利要求2-15任意一项所述的方法,其中所述溶酶体靶向部分直接融合或者通过连接体与所述Naglu结构域的C-末端融合。
17.权利要求2-15任意一项所述的方法,其中所述溶酶体靶向部分直接融合或者通过连接体与所述Naglu结构域的N-末端融合。
18.前述权利要求中任意一项所述的方法,其中所述重组的蛋白质从人类细胞制备。
19.前述权利要求中任意一项所述的方法,其中所述重组的蛋白质从CHO细胞制备。
20.前述权利要求中任意一项所述的方法,其中所述鞘内施用导致在一种或多种脑靶组织中递送所述Naglu蛋白质。
21.权利要求20所述的方法,其中所述一种或多种脑靶组织选自:灰质、白质、脑室周围区域、软膜蛛网膜、脑膜、新皮质、小脑、大脑皮层的深部组织、分子层、尾状核/豆状核区域、中脑、脑桥或者延髓的深部区域、及其组合。
22.权利要求20或者21所述的方法,其中所述Naglu蛋白质被递送至神经元、胶质细胞、血管周细胞和/或脑膜细胞。
23.前述权利要求中任意一项所述的方法,其中所述Naglu蛋白质被进一步递送至在所述脊髓中的神经元。
24.前述权利要求中任意一项所述的方法,其中所述鞘内施用进一步导致所述Naglu蛋白质在外周靶组织中的全身递送。
25.权利要求24所述的方法,其中所述外周靶组织选自:肝脏、肾脏、和/或心脏。
26.前述权利要求中任意一项所述的方法,其中所述鞘内施用导致在脑靶组织、脊髓神经元和/或外周靶组织中的溶酶体定位。
27.前述权利要求中任意一项所述的方法,其中所述鞘内施用导致在脑靶组织、脊髓神经元和/或外周靶组织中溶酶体储存减少。
28.权利要求27所述的方法,其中所述溶酶体储存通过LAMP-1染色测定。
29.权利要求28所述的方法,其中所述溶酶体储存与对照相比,以至少20%、40%、50%、60%、80%、90%、1-倍、1.5-倍,或者2-倍地减少。
30.前述权利要求中任意一项所述的方法,其中所述鞘内施用导致在神经元中液泡化减少。
31.权利要求30所述的方法,其中所述神经元包括浦肯野细胞。
32.前述权利要求中任意一项所述的方法,其中所述鞘内施用导致Naglu酶活性在所述脑靶组织、脊髓神经元和/或外周靶组织中增加。
33.权利要求32所述的方法,其中所述Naglu酶活性与对照相比,以至少1-倍、2-倍、3-倍、4-倍、5-倍、6-倍、7-倍、8-倍、9-倍或者10-倍地增加。
34.权利要求32或者33所述的方法,其中所述增加的HNS酶活性为至少大约10nmol/hr/mg,20nmol/hr/mg,40nmol/hr/mg,50nmol/hr/mg,60nmol/hr/mg,70nmol/hr/mg,80nmol/hr/mg,90nmol/hr/mg,100nmol/hr/mg,150nmol/hr/mg,200nmol/hr/mg,250nmol/hr/mg,300nmol/hr/mg,350nmol/hr/mg,400nmol/hr/mg,450nmol/hr/mg,500nmol/hr/mg,550nmol/hr/mg或者600nmol/hr/mg。
35.权利要求32所述的方法,其中所述Naglu酶活性在所述腰椎区域中增加。
36.权利要求35所述的方法,其中在所述腰椎区域中所述增加的Naglu酶活性为至少大约500nmol/hr/mg,600nmol/hr/mg,700nmol/hr/mg,800nmol/hr/mg,900nmol/hr/mg,1000nmol/hr/mg,1500nmol/hr/mg,2000nmol/hr/mg,3000nmol/hr/mg,4000nmol/hr/mg,5000nmol/hr/mg,6000nmol/hr/mg,7000nmol/hr/mg,8000nmol/hr/mg,9000nmol/hr/mg,或者10,000nmol/hr/mg。
37.前述权利要求中任意一项所述的方法,其中所述鞘内施用Sanfilippo B综合症的至少一种症状或特征在强度、严重程度或者频率方面减少,或者延缓发生。
38.权利要求37所述的方法,其中San B疾病的至少一种症状或特征为听力损失、语言发展迟缓、运动技能缺陷、活动过度、智力迟钝、攻击性和/或睡眠障碍。
39.前述权利要求中任意一项所述的方法,其中所述鞘内施用的发生每两个星期一次。
40.前述权利要求中任意一项所述的方法,其中所述鞘内施用的发生每月一次。
41.前述权利要求中任意一项所述的方法,其中所述鞘内施用的发生每两个月一次。
42.前述权利要求中任意一项所述的方法,其中所述鞘内施用被用于连同静脉施用。
43.权利要求42所述的方法,其中所述静脉施用没有比每月一次更频繁。
44.权利要求42所述的方法,其中所述静脉施用没有比每两个月一次更频繁。
45.前述权利要求中任意一项所述的方法,其中所述鞘内施用在缺乏静脉施用时使用。
46.前述权利要求中任意一项所述的方法,其中所述鞘内施用在缺乏并发免疫抑制疗法时使用。
47.前述权利要求中任意一项所述的方法,其中所述Naglu融合蛋白质以大于大约20mg/ml浓度施用。
48.治疗性融合蛋白质,包括:
Naglu结构域;
溶酶体靶向部分,并且
其中,一旦施用,所述治疗性融合蛋白质被靶向溶酶体并且在活体内治疗性地活化。
49.权利要求48所述的治疗性融合蛋白质,其中所述Naglu结构域包括与SEQ ID NO:1(成熟人类Naglu蛋白质)至少80%地一致的氨基酸序列。
50.权利要求48所述的治疗性融合蛋白质,其中所述Naglu结构域包括与SEQ ID NO:1(成熟人类Naglu蛋白质)一致的氨基酸序列。
51.权利要求48-50任意一项所述的治疗性融合蛋白质,其中所述溶酶体靶向部分为IGF-II部分。
52.权利要求51所述的治疗性融合蛋白质,其中所述IGF-II部分包括与成熟人类IGF-II(SEQ ID NO:2)至少70%地一致的氨基酸序列。
53.权利要求51所述的治疗性融合蛋白质,其中所述IGF-II部分包括氨基酸序列,并且所述氨基酸序列含有成熟人类IGF-II(SEQ ID NO:2)的残基8-67。
54.权利要求48-53任意一项所述的治疗性融合蛋白质,其中所述融合蛋白质进一步包括在所述Naglu结构域与所述溶酶体靶向部分之间的连接体。
55.权利要求54所述的治疗性融合蛋白质,其中所述连接体包括氨基酸序列
GAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAPGGGGGAAAAGGGGGAP(SEQ ID NO:4)。
56.权利要求54或者55所述的治疗性融合蛋白质,其中所述溶酶体靶向部分直接融合或者通过连接体与所述Naglu结构域的C-末端融合。
57.治疗性融合蛋白质,包括与SEQ ID NO:5(所述全长Naglu-IGF-II融合蛋白质)至少80%地一致的氨基酸序列,其中,一旦施用,所述治疗性融合蛋白质被靶向溶酶体,并且在活体内治疗性地活化。
Applications Claiming Priority (15)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US35885710P | 2010-06-25 | 2010-06-25 | |
| US61/358,857 | 2010-06-25 | ||
| US36078610P | 2010-07-01 | 2010-07-01 | |
| US61/360,786 | 2010-07-01 | ||
| US38786210P | 2010-09-29 | 2010-09-29 | |
| US61/387,862 | 2010-09-29 | ||
| US201161435710P | 2011-01-24 | 2011-01-24 | |
| US61/435,710 | 2011-01-24 | ||
| US201161442115P | 2011-02-11 | 2011-02-11 | |
| US61/442,115 | 2011-02-11 | ||
| US201161476210P | 2011-04-15 | 2011-04-15 | |
| US61/476,210 | 2011-04-15 | ||
| US201161495268P | 2011-06-09 | 2011-06-09 | |
| US61/495,268 | 2011-06-09 | ||
| PCT/US2011/041928 WO2011163652A2 (en) | 2010-06-25 | 2011-06-25 | Treatment of sanfilippo syndrome type b |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN103269709A true CN103269709A (zh) | 2013-08-28 |
Family
ID=46888842
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2011800407953A Pending CN103269709A (zh) | 2010-06-25 | 2011-06-25 | Sanfilippo综合症类型B的治疗 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20110318327A1 (zh) |
| EP (1) | EP2585105B1 (zh) |
| JP (1) | JP6063380B2 (zh) |
| KR (1) | KR20130043166A (zh) |
| CN (1) | CN103269709A (zh) |
| AU (2) | AU2011270672B2 (zh) |
| CA (1) | CA2805449A1 (zh) |
| ES (1) | ES2643015T3 (zh) |
| MX (1) | MX2013000324A (zh) |
| NZ (2) | NZ702801A (zh) |
| WO (1) | WO2011163652A2 (zh) |
Families Citing this family (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8497246B2 (en) | 2006-08-18 | 2013-07-30 | Armagen Technologies, Inc. | Methods for diagnosing and treating CNS disorders by trans-blood-brain barrier delivery of protein compositions |
| EP2182980A4 (en) | 2007-07-27 | 2012-04-18 | Armagen Technologies Inc | METHOD AND COMPOSITIONS FOR INCREASED ALPHA IDURONIDASE ACTIVITY IN THE CNS |
| ES2629853T3 (es) * | 2008-05-07 | 2017-08-16 | Biomarin Pharmaceutical Inc. | Péptidos de dirección lisosómica y usos de los mismos |
| HUE044865T2 (hu) | 2009-10-09 | 2019-11-28 | Armagen Inc | Eljárások és készítmények a központi idegrendszerben iduronát-2-szulfatáz-aktivitás növelésére |
| WO2011163647A2 (en) | 2010-06-25 | 2011-12-29 | Shire Human Genetic Therapies, Inc. | Methods and compositions for cns delivery of heparan n-sulfatase |
| NZ605865A (en) | 2010-06-25 | 2015-07-31 | Shire Human Genetic Therapies | Cns delivery of therapeutic agents |
| NZ702800A (en) | 2010-06-25 | 2017-03-31 | Shire Human Genetic Therapies | Methods and compositions for cns delivery of heparan n-sulfatase |
| DK2585104T3 (da) | 2010-06-25 | 2019-10-14 | Shire Human Genetic Therapies | Fremgangsmåder og sammensætninger tilcns-levering af arylsulfatase a |
| EP2975134A3 (en) * | 2010-07-22 | 2016-02-24 | Shire Human Genetic Therapies, Inc. | Crystal structure of human alpha-n-acetylglucosaminidase |
| CN103764162B (zh) * | 2011-03-04 | 2017-03-08 | 夏尔人类遗传治疗公司 | 用于多肽组成物的肽连接物及其使用方法 |
| US8580922B2 (en) | 2011-03-04 | 2013-11-12 | Shire Human Genetic Therapies, Inc. | Peptide linkers for polypeptide compositions and methods for using same |
| WO2013055888A2 (en) * | 2011-10-12 | 2013-04-18 | Synageva Biopharma Corp. | Recombinant human naglu protein and uses thereof |
| EP2785378B1 (en) | 2011-12-02 | 2020-05-13 | Armagen, Inc. | Methods and compositions for increasing arylsulfatase a activity in the cns |
| WO2013096899A2 (en) | 2011-12-23 | 2013-06-27 | Shire Human Genetic Therapies, Inc. | Stable formulations for cns delivery of arylsulfatase a |
| KR101380740B1 (ko) * | 2012-06-29 | 2014-04-11 | 쉐어 휴먼 제네텍 세러피스, 인코포레이티드 | 이듀로네이트-2-설파타제의 정제 |
| TWI711632B (zh) | 2012-11-27 | 2020-12-01 | 美商拜奧馬林製藥公司 | 靶向治療性溶小體酶融合蛋白及其用途 |
| FR3011468B1 (fr) * | 2013-10-04 | 2015-12-04 | Inventiva | Utilisation de l'odiparcil dans le traitement d'une mucopolysaccharidose |
| EP3160494B1 (en) * | 2014-06-25 | 2019-11-20 | Shire Human Genetic Therapies, Inc. | Generation of mannose-6-phosphate containing recombinant alpha-n-acetyl glucosaminidase |
| MA40460A (fr) | 2014-08-11 | 2016-02-18 | Shire Human Genetic Therapies | Ciblage lysosomial et utilisation correspondante |
| MX2017001898A (es) | 2014-08-11 | 2017-04-11 | Shire Human Genetic Therapies | Peptidos que contienen manosa-6-fosfato fusionados a enzimas lisosomales. |
| JP2017531632A (ja) | 2014-09-29 | 2017-10-26 | アレクシオン ファーマシューティカルズ, インコーポレイテッド | ムコ多糖症iiib型(mpsiiib)を治療する方法 |
| WO2016065319A1 (en) * | 2014-10-24 | 2016-04-28 | Shire Human Genetic Therapies, Inc. | Lysosomal targeting of enzymes, and uses thereof |
| MA41022A (fr) | 2014-11-24 | 2017-10-03 | Shire Human Genetic Therapies | Ciblage lysosomial et utilisations correspondantes |
| US10538589B2 (en) * | 2015-01-14 | 2020-01-21 | Armagen Inc. | Methods and compositions for increasing N-acetylglucosaminidase (NAGLU) activity in the CNS using a fusion antibody comprising an anti-human insulin receptor antibody and NAGLU |
| AU2017222620B2 (en) | 2016-02-24 | 2022-06-16 | Biomarin Pharmaceutical Inc. | Targeted therapeutic lysosomal enzyme fusion proteins, associated formulations and uses thereof |
| EP3811962A4 (en) | 2018-06-25 | 2022-03-16 | JCR Pharmaceuticals Co., Ltd. | PROTEIN AQUEOUS LIQUID FORMULATION |
| IL300887A (en) * | 2020-08-28 | 2023-04-01 | Japan Chem Res | α–N–ACETYLGLUCOSAMINIDASE MUTATION |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050048047A1 (en) * | 2003-08-29 | 2005-03-03 | Kakkis Emil D. | Delivery of therapeutic compounds to the brain and other tissues |
| US20080299640A1 (en) * | 2004-02-10 | 2008-12-04 | Zystor Therapeutics, Inc. | Acid alpha-glucosidase and fragments thereof |
| WO2009137721A2 (en) * | 2008-05-07 | 2009-11-12 | Zystor Therapeutics, Inc. | Lysosomal targeting peptides and uses thereof |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6118045A (en) | 1995-08-02 | 2000-09-12 | Pharming B.V. | Lysosomal proteins produced in the milk of transgenic animals |
| PT1137762E (pt) | 1998-12-07 | 2009-01-14 | Genzyme Corp | Tratamento da doença de pompe |
| US6217552B1 (en) | 1999-03-01 | 2001-04-17 | Coaxia, Inc. | Medical device for selective intrathecal spinal cooling in aortic surgery and spinal trauma |
| US6537785B1 (en) | 1999-09-14 | 2003-03-25 | Genzyme Glycobiology Research Institute, Inc. | Methods of treating lysosomal storage diseases |
| US20040005309A1 (en) | 2002-05-29 | 2004-01-08 | Symbiontics, Inc. | Targeted therapeutic proteins |
| US7560424B2 (en) | 2001-04-30 | 2009-07-14 | Zystor Therapeutics, Inc. | Targeted therapeutic proteins |
| US7629309B2 (en) | 2002-05-29 | 2009-12-08 | Zystor Therapeutics, Inc. | Targeted therapeutic proteins |
| ATE384736T1 (de) | 2001-04-30 | 2008-02-15 | Zystor Therapeutics Inc | Subzelluläres targeting von therapeutischen proteinen |
| US20030072761A1 (en) | 2001-10-16 | 2003-04-17 | Lebowitz Jonathan | Methods and compositions for targeting proteins across the blood brain barrier |
| JP2005506340A (ja) * | 2001-10-16 | 2005-03-03 | シムバイオンティクス インコーポレイテッド | 血液脳関門をわたる過小グリコシル化タンパク質の標的化のための方法および組成物 |
| EP1514106A4 (en) | 2002-05-29 | 2007-05-09 | Zystor Therapeutics Inc | TARGETED THERAPEUTIC PROTEINS |
| ES2371913T3 (es) | 2003-01-22 | 2012-01-11 | Duke University | Constructos mejorados para expresar polipéptidos lisosomales. |
| AU2004253471B2 (en) * | 2003-06-20 | 2010-05-13 | Raptor Pharmaceutical Inc. | Delivery of therapeutic compounds to the brain and other tissues |
| GB0611463D0 (en) * | 2006-06-09 | 2006-07-19 | Novartis Ag | Organic compounds |
| WO2008109677A2 (en) | 2007-03-06 | 2008-09-12 | Saint Louis University | Modified enzyme and treatment method |
| WO2011163647A2 (en) * | 2010-06-25 | 2011-12-29 | Shire Human Genetic Therapies, Inc. | Methods and compositions for cns delivery of heparan n-sulfatase |
-
2011
- 2011-06-25 CA CA2805449A patent/CA2805449A1/en not_active Abandoned
- 2011-06-25 ES ES11799039.0T patent/ES2643015T3/es active Active
- 2011-06-25 NZ NZ702801A patent/NZ702801A/en not_active IP Right Cessation
- 2011-06-25 KR KR1020137001751A patent/KR20130043166A/ko not_active Application Discontinuation
- 2011-06-25 US US13/168,969 patent/US20110318327A1/en not_active Abandoned
- 2011-06-25 NZ NZ605871A patent/NZ605871A/en not_active IP Right Cessation
- 2011-06-25 JP JP2013516847A patent/JP6063380B2/ja not_active Expired - Fee Related
- 2011-06-25 AU AU2011270672A patent/AU2011270672B2/en not_active Ceased
- 2011-06-25 EP EP11799039.0A patent/EP2585105B1/en active Active
- 2011-06-25 CN CN2011800407953A patent/CN103269709A/zh active Pending
- 2011-06-25 MX MX2013000324A patent/MX2013000324A/es unknown
- 2011-06-25 WO PCT/US2011/041928 patent/WO2011163652A2/en active Application Filing
-
2017
- 2017-04-10 AU AU2017202344A patent/AU2017202344A1/en not_active Abandoned
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050048047A1 (en) * | 2003-08-29 | 2005-03-03 | Kakkis Emil D. | Delivery of therapeutic compounds to the brain and other tissues |
| US20080299640A1 (en) * | 2004-02-10 | 2008-12-04 | Zystor Therapeutics, Inc. | Acid alpha-glucosidase and fragments thereof |
| WO2009137721A2 (en) * | 2008-05-07 | 2009-11-12 | Zystor Therapeutics, Inc. | Lysosomal targeting peptides and uses thereof |
Non-Patent Citations (3)
| Title |
|---|
| HASHIMOTO R等: "N-terminal deletion mutants of insulin-like growth factor-II (IGF-II) show Thr7 and Leu8 important for binding to insulin and IGF-I receptors and Leu8 critical for all IGF-II functions", 《J BIOL CHEM.》, vol. 270, no. 30, 31 December 1995 (1995-12-31) * |
| MANGAS,M.等: "NM_000263", 《GENBANK》, 5 March 2010 (2010-03-05) * |
| TIPPIN BRIGETTE L.等: "Insulin-like Growth Factor-2 Peptide Fusion Enables Uptake and Lysosomal Delivery of N-Acetylglucosaminidase to Mucopolysaccharidosis IIIB Fibroblasts", 《 MPS SCIENTIFIC PROGRAM:PLENARY PAPERS》, 12 June 2010 (2010-06-12), pages 100, XP009177964 * |
Also Published As
| Publication number | Publication date |
|---|---|
| ES2643015T3 (es) | 2017-11-21 |
| CA2805449A1 (en) | 2011-12-29 |
| EP2585105B1 (en) | 2017-08-09 |
| AU2011270672B2 (en) | 2017-01-12 |
| WO2011163652A2 (en) | 2011-12-29 |
| US20110318327A1 (en) | 2011-12-29 |
| EP2585105A2 (en) | 2013-05-01 |
| JP2013542913A (ja) | 2013-11-28 |
| MX2013000324A (es) | 2013-02-01 |
| AU2011270672A1 (en) | 2013-02-14 |
| KR20130043166A (ko) | 2013-04-29 |
| JP6063380B2 (ja) | 2017-01-18 |
| NZ702801A (en) | 2016-08-26 |
| EP2585105A4 (en) | 2014-07-09 |
| NZ605871A (en) | 2015-02-27 |
| WO2011163652A3 (en) | 2013-07-11 |
| AU2017202344A1 (en) | 2017-04-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103269709A (zh) | Sanfilippo综合症类型B的治疗 | |
| US11065307B2 (en) | Therapeutic fusion protein comprising an alpha-n-acetylglucosaminidase and a lysosomal targeting moiety | |
| AU2019204051B2 (en) | Methods and compositions for cns delivery of arylsulfatase a | |
| CN103260637B (zh) | 乙酰肝素n-硫酸酯酶cns递送的方法和组合物 | |
| CN103179980A (zh) | 艾杜糖醛酸-2-硫酸酯酶的cns递送的方法和组合物 | |
| US20220133863A1 (en) | Treatment of sanfilippo syndrome type b |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20130828 |