BR112016014870B1 - formulação de selante líquido compreendendo monômeros de fibrina e um peptídeo de gprp, seu método de fabricação, recipiente e kit - Google Patents
formulação de selante líquido compreendendo monômeros de fibrina e um peptídeo de gprp, seu método de fabricação, recipiente e kit Download PDFInfo
- Publication number
- BR112016014870B1 BR112016014870B1 BR112016014870-3A BR112016014870A BR112016014870B1 BR 112016014870 B1 BR112016014870 B1 BR 112016014870B1 BR 112016014870 A BR112016014870 A BR 112016014870A BR 112016014870 B1 BR112016014870 B1 BR 112016014870B1
- Authority
- BR
- Brazil
- Prior art keywords
- formulation
- peptide
- fibrin
- gprp
- fact
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L24/00—Surgical adhesives or cements; Adhesives for colostomy devices
- A61L24/04—Surgical adhesives or cements; Adhesives for colostomy devices containing macromolecular materials
- A61L24/10—Polypeptides; Proteins
- A61L24/106—Fibrin; Fibrinogen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L24/00—Surgical adhesives or cements; Adhesives for colostomy devices
- A61L24/001—Use of materials characterised by their function or physical properties
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L24/00—Surgical adhesives or cements; Adhesives for colostomy devices
- A61L24/001—Use of materials characterised by their function or physical properties
- A61L24/0015—Medicaments; Biocides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L24/00—Surgical adhesives or cements; Adhesives for colostomy devices
- A61L24/04—Surgical adhesives or cements; Adhesives for colostomy devices containing macromolecular materials
- A61L24/10—Polypeptides; Proteins
- A61L24/108—Specific proteins or polypeptides not covered by groups A61L24/102 - A61L24/106
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/20—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices containing or releasing organic materials
- A61L2300/25—Peptides having up to 20 amino acids in a defined sequence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/20—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices containing or releasing organic materials
- A61L2300/252—Polypeptides, proteins, e.g. glycoproteins, lipoproteins, cytokines
- A61L2300/254—Enzymes, proenzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/418—Agents promoting blood coagulation, blood-clotting agents, embolising agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/432—Inhibitors, antagonists
- A61L2300/434—Inhibitors, antagonists of enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2400/00—Materials characterised by their function or physical properties
- A61L2400/06—Flowable or injectable implant compositions
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Surgery (AREA)
- Epidemiology (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Diabetes (AREA)
- Organic Chemistry (AREA)
- Hematology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Materials For Medical Uses (AREA)
- Peptides Or Proteins (AREA)
- Medical Preparation Storing Or Oral Administration Devices (AREA)
- Medicinal Preparation (AREA)
Abstract
COLA DE FIBRINA DE UM ÚNICO COMPONENTE QUE COMPREENDE UM INIBIDOR DE POLIMERIZAÇÃO. A presente invenção refere-se a formulações de selante líquido estáveis que compreendem monômeros de fibrina e um agente de bloqueio de polimerização de fibrina reversível, métodos de preparo e uso das formulações.
Description
[001] O presente pedido contém uma listagem de sequências que é submetida juntamente com este pedido em formato ASCII por meio de EFS-Web e está aqui incorporada a título de referência, em sua totalidade. A dita cópia ASCII, criada em 22 de dezembro de 2013, tem o nome de "sequencelisting" e um tamanho de 8 quilobytes.
[002] O presente documento fornece uma formulação de selante líquido de um único componente, métodos para sua preparação e métodos para uso da mesma, como, entre outros, inter alia, hemóstase, vedação, cura e/ou cirurgia. Em particular, é revelada no presente documento uma formulação de selante líquido que compreende monô- meros de fibrina e um peptídeo de GPRP. As formulações apresentam estabilidade e vida útil prolongada e são úteis no bloqueio, na neutralização, na diluição de e/ou na remoção do peptídeo.
[003] Selantes de fibrina, conhecidos também como cola de fibri- na, vêm sendo usados na prática clínica por décadas (consulte, por exemplo, Tabélé, et al. J Pharm Pharmaceut Sci 2012, 15:124 a 140; Dickneite, G et al. Thrombosis Res 2003, 112:73 a 82). Frequentemente, os selantes de fibrina consistem em dois componentes líquidos, um componente que compreende fibrinogênio e um componente que compreende trombina, que são armazenados congelados devido a sua instabilidade inerente. Às vezes, os produtos selantes de fibrina consistem em dois componentes secados por congelamento, que exigem reconstituição imediatamente antes do uso e aplicação por meio de uma seringa conjunta ou outro dispositivo de aplicação de cilindro du plo. As formulações secadas por congelamento são tipicamente estáveis, mas o componente fibrinogênio é difícil de ser reconstituído. Mediante a mistura das soluções de dois componentes, a trombina cliva o fibrinogênio, permitindo, assim, que o último gere polímeros de fibrina.
[004] Um coágulo de selante de fibrina é formado por meio de reações enzimáticas que envolvem o fibrinogênio, a trombina e o Fator XIII. O fibrinogênio é a proteína precursora da matriz de coagulação sanguínea. O mesmo tem um peso molecular de ~ 340.000 Dáltons e consiste em 3 pares de cadeias de polipeptídeo não idênticas, Aα, Bβ e Y, ligadas por ligações dissulfeto. O fibrinogênio tem uma estrutura trinodular: dois domínios globulares terminais D idênticos e um domí-nio globular E central conectados por a-hélices supernovelados. A trombina converte o fibrinogênio em monômeros de fibrina por meio de ação enzimática a uma taxa determinada pela concentração de trom- bina.
[005] O Fator XIII, uma enzima do sistema de coagulação sanguíneo, tipicamente presente na formulação de cola, quando ativado por trombina e na presença de cálcio, reticula e estabiliza o coágulo de fibrina. Esse processo ignora a maioria das etapas da coagulação normal, e imita sua última fase. Alguns fabricantes adicionam agentes antiproteolíticos à formulação da cola de fibrina (por exemplo, conforme descrito em WO93/05822) ou especificamente removem o plasmi- nogênio para interromper ou retardar a fibrinólise (por exemplo, conforme descrito nas patentes US n°s 5.792.835 e 7.125.569).
[006] Os antecedentes da invenção incluem Laudano e Doolittle (PNAS 75(7):3.085 a 9) e as patentes US n°s 5.219.328, 5.318.524; 8.367.802; 5.750.657; 6.262.236; 6.268.483; 6.500.427; 5.723.579; 5.478.810; 5.607.858; 6.908.899 e 8.513.380.
[007] A preparação de um selante de fibrina antes do uso é de- morada e pouco prática. Os selantes comercializados consistem em dois componentes, um componente que compreende fibrinogênio e um componente que compreende trombina, que são tipicamente fornecidos como pós secos ou como líquidos congelados separados. O processo de reconstituição dos pós é demorado devido à solubilidade limitada do componente fibrinogênio e, com frequência, exige aquecimento. Uma vez reconstituídos ou descongelados, os componentes são transferidos para duas seringas separadas para uso imediato. São conhecidos selantes de um único componente cujo manuseio é pouco prático e/ou têm uma curta vida útil.
[008] São aqui fornecidas formulações de selante estáveis de um único componente que compreendem monômeros de fibrina e um pep- tídeo de GPRP ou outro agente de bloqueio de polimerização de fibri- na reversível, métodos de fabricação e métodos de uso, que superam as desvantagens das formulações de produtos selantes conhecidas, dos métodos de fabricação e/ou dos métodos de uso conhecidos.
[009] Um agente de bloqueio de polimerização de fibrina reversível pode ser um agente com tamanho menor que cerca de um (1) kD. Em algumas modalidades, o agente é uma pequena molécula e/ou um peptídeo isolado, um derivado ou sal do mesmo, que tem a capacidade de se ligar de modo reversível a um monômero de fibrina e evitar ou retardar a polimerização de fibrina. Em algumas modalidades, o agente de bloqueio de polimerização de fibrina reversível compreende uma molécula química pequena ou um peptídeo isolado. O agente de bloqueio de polimerização de fibrina reversível pode ser um agente de ligação de pouca afinidade com monômeros de fibrina e que não tem efeitos permanentes sobre a polimerização de fibrina. Portanto, tipica-mente, uma diluição e/ou uma troca de pequena molécula irá iniciar a polimerização. O agente de bloqueio na presente invenção não atua por redução do pH para um pH ácido.
[0010] Em um aspecto, é fornecida uma formulação de selante líquido que compreende monômeros de fibrina em uma concentração de 1 a 13%, (p/v); e um peptídeo de GPRP e/ou outro agente de bloqueio de polimerização de fibrina reversível; sendo que o agente de bloqueio e/ou o peptídeo de GPRP está(estão)presente(s) em uma quantidade que é maior que cerca de 100 ou maior que cerca de 340 vezes o excesso molar em relação aos monômeros de fibrina; e sendo que a formulação líquida é estável por ao menos 14 dias a uma temperatura ambiente selecionada do grupo que consiste em cerca de 20, 21, 22, 23, 24 e 25°C.
[0011] Em uma modalidade, a formulação líquida é estável por até 90 dias a uma temperatura ambiente selecionada do grupo que consiste em cerca de 20, 21, 22, 23, 24 e 25°C.
[0012] Em uma modalidade, a formulação líquida é estável por um período de tempo na faixa de 14 dias e até 90 dias a uma temperatura ambiente selecionada do grupo que consiste em cerca de 20, 21, 22, 23, 24 e 25°C.
[0013] Em uma modalidade, o peptídeo de GPRP está presente em uma quantidade maior que cerca de 100 a cerca de 460 ou maior que 100 a cerca de 340, ou cerca de 340 a cerca de 460 vezes o excesso molar em relação aos monômeros de fibrina.
[0014] O termo "monômeros de fibrina" como usado aqui inclui monômeros, dímeros e oligômeros de fibrina que têm várias unidades de fibrina de modo que a fibrina é mantida em forma solúvel em uma solução líquida aquosa a uma temperatura ambiente selecionada do grupo que consiste em cerca de 20, 21, 22, 23, 24 e 25°C.
[0015] Em uma modalidade, um oligômero contém até 10 unidades de fibrina.
[0016] O termo "polímero de fibrina" como usado aqui inclui uma pluralidade de unidades de fibrina que têm inúmeras unidades de fibri- na que limitam a solubilidade da fibrina em uma solução líquida aquosa a uma temperatura ambiente selecionada do grupo que consiste em cerca de 20, 21, 22, 23, 24 e 25°C.
[0017] Em uma modalidade, um polímero contém mais de 10 unidades de fibrina.
[0018] "Uma temperatura ambiente" é a temperatura no ambiente circundante da formulação de fibrina.
[0019] Em uma modalidade, a formulação é estável por um período mais longo de tempo quando mantida a uma temperatura mais baixa, por exemplo, 2 a 8°C ou congelada. Após o desco ngelamento, a formulação pode ser transferida para um local que tem uma temperatura ambiente de cerca de 20 a 25°C e permanece estável por ao menos 14 dias naquela temperatura. A formulação pode também ser estável a temperaturas que não aquelas especificamente reveladas acima.
[0020] Em várias modalidades, os monômeros de fibrina estão presentes em uma concentração de 1 a 4% (p/v) ou 3,5 a 13% (p/v).
[0021] Em algumas modalidades, a formulação compreende adicionalmente um veículo farmaceuticamente aceitável.
[0022] O termo "veículo farmaceuticamente aceitável" refere-se a qualquer diluente ou um carreador que é adequado para uso em seres humanos ou outros animais.
[0023] Em algumas modalidades, a formulação é substancialmente isenta de trombina adicionada. "Substancialmente isenta" refere-se a menos que cerca de (1) IU de trombina por mililitro (U/ml) de formulação.
[0024] Em algumas modalidades, o peptídeo de GPRP inclui um peptídeo, um derivado ou sal do mesmo que compreende a sequência de aminoácidos de tetrapeptídeo Gly-Pro-Arg-Pro.
[0025] Em algumas modalidades, o peptídeo de GPRP é um tetra- peptídeo que tem a sequência de aminoácidos apresentada na SEQ ID NO: 1, ou um derivado ou sal do mesmo.
[0026] Em algumas modalidades, o peptídeo de GPRP é um tetra- peptídeo que consiste em uma sequência de aminoácidos apresentada na SEQ ID NO: 1, ou um derivado ou sal do mesmo.
[0027] Em várias modalidades, o termo "peptídeo de GPRP" inclui um peptídeo selecionado a partir do grupo de peptídeos que têm uma sequência de aminoácidos selecionada dentre a SEQ ID NO:1 à SEQ ID NO:42 (SEQ ID NO:1; SEQ ID NO:2; SEQ ID NO:3; SEQ ID NO:4; SEQ ID NO:5; SEQ ID NO:6; SEQ ID NO:7; SEQ ID NO:8; SEQ ID NO:9; SEQ ID NO:10; SEQ ID NO:11; SEQ ID NO:12; SEQ ID NO:13; SEQ ID NO:14; SEQ ID NO:15; SEQ ID NO:16; SEQ ID NO:17; SEQ ID NO:18; SEQ ID NO:19; SEQ ID NO:20; SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:23; SEQ ID NO:24; SEQ ID NO:25; SEQ ID NO:26; SEQ ID NO:27; SEQ ID NO:28; SEQ ID NO:29; SEQ ID NO:30; SEQ ID NO:31; SEQ ID NO:32; SEQ ID NO:33; SEQ ID NO:34; SEQ ID NO:35; SEQ ID NO:36; SEQ ID NO:37; SEQ ID NO:38; SEQ ID NO:39; SEQ ID NO:40; SEQ ID NO:41; e SEQ ID NO:42;) ou derivado ou sal do mesmo.
[0028] Em várias modalidades, o peptídeo de GPRP é selecionado a partir do grupo de peptídeos que têm uma sequência de aminoáci- dos selecionada dentre a SEQ ID NO:1 à SEQ ID NO:42 ou derivado ou sal do mesmo.
[0029] Em várias modalidades, o peptídeo de GPRP é selecionado a partir do grupo de peptídeos que consistem uma sequência de ami- noácidos selecionada dentre SEQ ID NO:1 a SEQ ID NO:42 ou derivado ou sal do mesmo.
[0030] Em algumas modalidades, o peptídeo de GPRP é uma amida de peptídeo de GPRP.
[0031] Em algumas modalidades, a formulação compreende adici- onalmente Fator XIII ativado por trombina. A formulação pode incluir, também, um quelante de cálcio. O quelante de cálcio pode ser um íon de citrato, íon de oxalato, EDTA, EGTA ou uma combinação de tais quelantes de cálcio. Em várias modalidades, o quelante de cálcio é um íon de citrato fornecido, por exemplo, como citrato de sódio. O citrato de sódio pode estar presente na formulação em uma concentração de cerca de 1 mM a cerca de 50 mM. A formulação pode incluir EDTA e/ou EGTA, por exemplo, cerca de 0,1 a cerca de 2,5 mM de EDTA e/ou EGTA.
[0032] Em algumas modalidades, a formulação tem um pH neutro, por exemplo, pH de cerca de 6 a 8, ou um pH de cerca de 6,5 a 7,5 ou um pH de cerca de 6,7 a 7,2.
[0033] Em algumas modalidades, a formulação contém um tampão. Tipicamente, um tampão é um ingrediente que evita mudanças radicais no pH. Em uma modalidade, o tampão é selecionado do grupo que consiste em citrato de sódio, oxalato de sódio, acetato de sódio, glicina, arginina e combinações dos mesmos.
[0034] A formulação pode ser usada em hemóstase, na cura, na vedação e/ou na cirurgia, por exemplo, na vedação de tecido, na cura de ferimentos, na cura da dura máter na substituição de sutura ou anastomose.
[0035] Em um outro aspecto, é aqui fornecido um recipiente contendo uma formulação de selante líquido conforme aqui revelado. Em algumas modalidades, o recipiente é uma ampola, um frasco ou uma seringa precarregada que compreende a formulação. Em algumas modalidades, a formulação ou os componentes individuais da formulação são liofilizados. É aqui fornecido um recipiente contendo uma formulação liofilizada que, mediante a reconstituição, fornece uma formulação de selante líquido conforme aqui revelado.
[0036] Em um outro aspecto, é aqui fornecido um kit, que inclui um recipiente que compreende uma formulação de selante líquido conforme aqui revelado e, opcionalmente, um dispositivo de troca de pequena molécula ou um dispositivo de remoção de G (e, opcionalmente, instruções para uso).
[0037] Um dispositivo de troca de pequena molécula pode ser qualquer módulo contendo uma resina pré-equilibrada com uma pequena molécula permissiva para polimerização de fibrina. As pequenas moléculas na formulação são trocadas pela dita pequena molécula permissiva para polimerização.
[0038] Tipicamente, a troca de pequena molécula é a substituição de ao menos uma pequena molécula por ao menos outra pequena molécula. A resina na coluna é pré-equilibrada com uma ou mais pequenas moléculas que são desejadas na formulação final e/ou moléculas finais que permitem a polimerização de fibrina. As microesferas de resina são tipicamente porosas, sendo que os poros estão na faixa de pesos moleculares dessas moléculas que devem ser substituídas.
[0039] Em uma modalidade, uma formulação líquida que compreende os monômeros de fibrina e o peptídeo de GPRP atravessa uma coluna que é preenchida com a resina porosa. Os monômeros de fibri- na na formulação serão muito grandes para entrar nos poros da resina e rapidamente atravessam a coluna. Sem se ater ao mecanismo, uma pequena molécula, por exemplo, o peptídeo de GPRP na solução, irá percorrer uma trajetória mais tortuosa, visto que as moléculas pequenas têm a capacidade de entrar e sair novamente dos poros da resina, reduzindo, dessa forma, em grandes proporções, sua taxa de migração através da resina. Sem se ater a nenhuma teoria, as pequenas moléculas com as quais a resina foi pré-equilibrada, têm uma vantagem significativa e, portanto, saem da resina junto com as proteínas (por exemplo, monômeros de fibrina). Dessa forma, o tampão, sais e outras pequenas moléculas, são trocados nessa etapa.
[0040] Em uma modalidade, antes e/ou durante a aplicação da formulação, o GPRP é diluído em relação aos monômeros de fibrina e está a uma razão igual a ou menor que 100 como na razão de 1 a 60, por exemplo, 3, 4, 11, 11.3, 17, 22,7, 23, 34, 45, 56,7 ou 57.
[0041] Em uma outra modalidade, a formulação ou componentes individuais da formulação no kit são liofilizados. Consequentemente, o kit compreende um recipiente que compreende os monômeros de fi- brina como um pó ou um líquido, um recipiente que compreende o peptídeo de GPRP como um pó ou um líquido e, opcionalmente, um recipiente que compreende um líquido de reconstituição como água, um tampão de acetato ou um tampão de glicina, ou tampão de argini- na a um pH neutro ou um tampão de citrato a um pH neutro. Em uma modalidade, os monômeros de fibrina secos e o pó de peptídeo de GPRP são fornecidos no mesmo recipiente.
[0042] A formulação no recipiente ou no kit pode compreender adicionalmente um veículo farmaceuticamente aceitável.
[0043] Em ainda um outro aspecto, é fornecido um método de preparo de um selante em uma superfície que compreende: a) fornecer uma formulação de selante líquido conforme aqui revelado; e b) aplicar a formulação à superfície sob condições que facilitam a polimerização de fibrina na superfície.
[0044] Em algumas modalidades, a superfície é um órgão/tecido em sangramento ou sem sangramento de um indivíduo. Um indivíduo inclui mamíferos, incluindo seres humanos e pode ser um paciente humano. Em algumas modalidades, o paciente humano é um paciente de cirurgia.
[0045] Uma "superfície" é uma posição ou local em que é desejado formar o selante ou a cola. A superfície depende do uso do selante. O selante pode ser usado, por exemplo, em hemóstase, na fixação de tecido, na fixação de enxerto, na cura de ferimentos e na anastomose. As formulações, os métodos e os kits aqui revelados podem ser usados interna e externamente, para fixação de enxerto de tecido e de órgão, para vedar um ferimento cirúrgico, na cirurgia vascular incluindo fornecer hemóstase e para anastomose como anastomose arterial, gastrointestinal e traqueal.
[0046] A superfície pode ser uma superfície externa da pele que pode ser vista a olho nu e uma superfície de uma parte de corpo interna que é uma parte da anatomia interna de um organismo. Superfícies externas incluem, sem limitação, a pele da face, garganta, escalpo, tórax, costas, orelhas, pescoço, mão, cotovelo, quadril, joelho e outros sítios de pele. Exemplos de partes de corpo internas incluem, sem limitação, cavidade corporal ou abertura anatômica que são expostas ao ambiente externo e aos órgãos internos como as narinas; os lábios; as orelhas; a área genital, incluindo o útero, a vagina e os ovários; os pulmões; o ânus; o baço; o fígado; e o músculo cardíaco. A superfície pode ser um sítio com sangramento ou sem sangramento. A superfície pode também ser uma superfície de trabalho.
[0047] Em algumas modalidades, as condições compreendem remover, bloquear, neutralizar e/ou diluir o peptídeo de GPRP. O peptí- deo de GPRP pode ser removido ou diluído mediante a aplicação da formulação diretamente sobre a superfície. Alternativamente, o peptí- deo de GPRP pode ser removido ou diluído mediante a passagem da formulação através de um dispositivo de troca de pequena molécula. Além disso, o mesmo pode ser removido ou diluído mediante a passagem da formulação através de um dispositivo de exclusão por tamanho e/ou baseado em afinidade ou durante a aplicação à superfície. Outras opções de remoção ou de diluição incluem a adição de porções químicas complementares de GPRP ao dispositivo. Porções químicas complementares no dispositivo seriam essencialmente um método de afinidade.
[0048] Alternativa ou adicionalmente, o GPRP na formulação poderia ser neutralizado e/ou bloqueado mediante a adição de um peptí- deo, por exemplo, uma porção química complementar de um peptídeo de GPRP ou um anticorpo que tem a capacidade de deslocar o GPRP ligado à fibrina.
[0049] Em ainda um aspecto adicional é fornecido um método de cura, de vedação e/ou de redução de perda de sangue em um indivíduo em necessidade, que compreende aplicar ao indivíduo uma quantidade terapeuticamente eficaz de uma formulação de selante líquido aqui revelada. A formulação é aplicada ao indivíduo sob condições que facilitam a polimerização de fibrina. Em algumas modalidades, as condições compreendem remover, bloquear, neutralizar e/ou diluir o pep- tídeo de GPRP.
[0050] O termo "uma quantidade terapeuticamente eficaz" refere- se à dose exigida para evitar, melhorar e/ou tratar uma doença, um distúrbio ou uma condição. A dose eficaz pode ser mudada dependendo da idade e do peso do indivíduo, da doença ou da condição e sua severidade e de outros fatores que podem ser reconhecidos pelo versado na técnica.
[0051] Em um outro aspecto, é fornecida uma formulação de selante líquido conforme aqui revelado para uso na cura, na vedação, na redução da perda de sangue e/ou na cirurgia.
[0052] Em ainda um outro aspecto, é aqui fornecido um método de fabricação de uma formulação de selante líquido conforme aqui revelado que compreende: a) fornecer um componente que compreende monômeros de fibrina; b) fornecer um peptídeo de GPRP ou outro agente de bloqueio de polimerização de fibrina reversível, um derivado ou sal do mesmo; c) misturar a) e b) a fim de obter a formulação de selante líquido que compreende o GPRP em uma quantidade que é maior que 100 ou maior que ao menos 340 vezes o excesso molar em relação aos monômeros de fibrina e uma concentração de monômero de fibri- na de 1 a 13% (p/v).
[0053] Em certa modalidade, a razão é de cerca de 100 a cerca de 460 ou maior que 100 a cerca de 340, ou cerca de 340 a cerca de 460 vezes o excesso molar em relação aos monômeros de fibrina.
[0054] O termo "misturar " significa misturar os componentes em qualquer ordem, qualquer combinação e/ou subcombinação.
[0055] É fornecida adicionalmente uma formulação de selante líquido obtenível por meio do método.
[0056] Os monômeros de fibrina podem ser obtidos mediante o contato de uma solução que compreende fibrinogênio aquosa com trombina sob condições que permitem a clivagem de fibrinogênio em fibrina. Em tal modalidade, a preparação de monômeros de fibrina é sob condições que a polimerização da fibrina é inibida, por exemplo, na presença de GPRP ou outro agente de bloqueio de polimerização de fibrina reversível. Em uma modalidade, a fibrina é obtida a partir do fibrinogênio sob condições que inibem a polimerização (por exemplo, mediante a redução da temperatura) e o peptídeo de GPRP é adicio-nado posteriormente.
[0057] A trombina pode ser livre na solução ou imobilizada em mi- croesferas.
[0058] Se a trombina é imobilizada em microesferas, por exemplo, as microesferas sob a forma de lote ou em uma coluna e o componente de fibrinogênio atravessa/entra em contato com as microesferas, a formulação/componente resultante pode compreender quantidades residuais de trombina. Em algumas modalidades, a formulação é subs- tancialmente isenta de trombina, por exemplo, tem menos que cerca de (1) IU/ml de trombina.
[0059] Em algumas modalidades, a formulação/componente inclui Fator XIII ativado por trombina.
[0060] Alternativamente, os monômeros de fibrina nas formulações podem ser obtidos por meio do contato de uma solução que compreende fibrinogênio aquosa com uma enzima tipo trombina sob condições que permitem a clivagem de fibrinogênio em fibrina. Exemplos de tal enzima são enzimas de veneno de cobra que clivam fibrinopeptídeo A (FpA) como Batroxobina. Em tal modalidade, a preparação de mo- nômeros de fibrina é sob condições que a polimerização da fibrina é inibida, por exemplo, na presença de GPRP ou outro agente de bloqueio de polimerização de fibrina reversível.
[0061] Em algumas modalidades, o componente/formulação de monômero de fibrina inclui adicionalmente um quelante de cálcio.
[0062] Em algumas modalidades, o método de fabricação inclui uma etapa de secagem para fornecer uma formulação seca.
[0063] Os peptídeos de GPRP e/ou o componente que compreende monômeros fibrina podem estar sob forma em pó e/ou líquida.
[0064] É adicionalmente fornecida uma formulação de selante fabricada com o uso do método aqui fornecido.
[0065] O fibrinogênio pode ser preparado a partir de composição sanguínea inicial. A composição de sangue pode consistir em sangue integral ou frações sanguíneas, isto é, um produto do sangue integral, como plasma. O fibrinogênio pode ser autólogo, humano inclusive, obtido a partir de plasma acumulado, ou de uma fonte não humana. Também é possível que o fibrinogênio seja preparado por meio de métodos recombinantes ou pode ser quimicamente modificado.
[0066] Em uma modalidade da invenção, a solução de fibrinogênio é composta por um componente biologicamente ativo (BAC) que é uma solução de proteínas derivadas de plasma sanguíneo que pode adicionalmente compreender agentes antifibrinolíticos como ácido tra- nexâmico e/ou estabilizantes como arginina, lisina, seus sais farma- ceuticamente aceitáveis, ou misturas dos mesmos. O BAC pode ser derivado de crioprecipitado, em particular, crioprecipitado concentrado.
[0067] O termo "crioprecipitado" refere-se a um componente sanguíneo que é obtido a partir de plasma congelado preparado a partir de sangue integral. Um crioprecipitado pode ser obtido quando o plasma congelado é descongelado a frio, tipicamente a uma temperatura de 0 a 4°C, resultando na formação de um preci pitado que contém fibrinogênio e Fator XIII. O precipitado pode ser coletado, por exemplo, por meio de centrifugação e dissolvido em um tampão adequado como um tampão contendo 120 mM de cloreto de sódio, 1 mM de cloreto de cálcio, 10 mM de citrato trissódico, 120 mM de glicina, 95 mM de clori- drato de arginina. A solução de BAC pode compreender fatores adicionais como, por exemplo, fator VIII, fibronectina, fator de von Willebrand (vWF), vitronectina, etc., por exemplo, conforme descrito nos documentos US 6.121.232 e WO9833533. A composição de BAC pode compreender estabilizantes como ácido tranexâmico e cloridrato de arginina. A quantidade de ácido tranexâmico na solução de CBA pode ser de cerca de 80 a cerca de 110 mg/ml.
[0068] Em uma outra modalidade, a concentração de plasminogê- nio e plasmina na composição do CBA é reduzida para ser igual a ou menor que 15 μg/ml, como por exemplo 5 μg/ml ou menos de plasmi- nogênio, por exemplo, com o uso de um método conforme descrito nos documentos US 7.125.569, EP 1.390.485 e WO02095019. Em uma outra modalidade da invenção, quando a concentração de plasmino- gênio e de plasmídeo na composição de BAC é reduzida, a composição não contém ácido tranexâmico ou aprotinina.
[0069] A solução de fibrinogênio pode ser o componente BAC2 (de EVICEL®) ou qualquer outra solução contendo fibrinogênio, como fi- brinogênio recombinante purificado ou crioprecipitado produzido de plasma humano.
[0070] Em uma modalidade, a formulação é uma diluição completamente dissolvida, por exemplo, uma solução cujo soluto e o solvente constituem apenas uma fase, por exemplo, uma fase líquida.
[0071] Esses e outros aspectos e modalidades da invenção ficarão evidentes na referência à seguinte descrição detalhada da invenção e figuras.
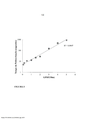
[0072] A Figura 1 é um gráfico que mostra o efeito da concentração de peptídeo de GPRP sobre o tempo de polimerização de fibrina em uma concentração fixa de fibrina.
[0073] A Figura 2A mostra uma formulação líquida que compreende peptídeo de GPRP e fibrina.
[0074] A Figura 2B mostra que a polimerização de fibrina ocorreu após a remoção do peptídeo de GPRP. Nessa modalidade, o peptídeo de GPRP foi removido submetendo a formulação a um dispositivo de troca de pequena molécula.
[0075] A presente revelação se baseia, em parte, na constatação de uma formulação de selante estável que inclui monômeros de fibrina e um peptídeo de GPRP em uma certa concentração.
[0076] São aqui fornecidas formulações de selante líquido que compreendem monômeros de fibrina e um peptídeo de GPRP em uma certa razão molar, que superam as deficiências das formulações de selante atualmente disponíveis. São adicionalmente aqui fornecidos métodos de fabricação e métodos de uso das formulações.
[0077] É aqui fornecida uma formulação de selante líquido que compreende a) monômeros de fibrina; e b) um peptídeo de GPRP ou outro agente de bloqueio de polimerização de fibrina reversível. Os monômeros de fibrina estão presentes em uma concentração de cerca de 1% a cerca de 13% (em peso por volume (p/v)). Em uma modalidade, o peptídeo de GPRP tem a sequência de aminoácidos Gly-Pro- Arg-Pro (GPRP; SEQ ID NO:1), um derivado ou sal do mesmo e está presente em uma quantidade que é maior que 100 vezes o excesso molar em relação aos monômeros de fibrina, maior que ou igual a cerca de 340 vezes o excesso molar ou cerca de 340 a cerca de 460 vezes o excesso molar em relação aos monômeros de fibrina.
[0078] Em uma outra modalidade, o peptídeo de GPRP compreende a sequência de aminoácidos Gly-Pro-Arg-Pro (SEQ ID NO: 1) ou Gly-Pro-Arg-Val (SEQ ID NO: 23).
[0079] Em várias modalidades, o peptídeo de GPRP é selecionado a partir do grupo de peptídeos que têm uma sequência de aminoáci- dos selecionada dentre a SEQ ID NO:2 à SEQ ID NO:42.
[0080] A estabilidade pode ser determinada por observação de polimerização espontânea ou coagulação mínima ou a ausência das mesmas na formulação, por exemplo, a formulação não mostra ou não tem polimerização ou coagulação espontânea na presença de peptí- deo de GPRP por até 14 dias, e retém seu nível de atividade de coagulação mediante a remoção, a diluição, o bloqueio e/ou a neutralização de GPRP em um excesso molar igual a ou menor que 100. O nível de atividade de coagulação ou capacidade de a formulação formar um selante pode ser determinado in vitro e/ou in vivo com o uso de métodos de coagulação conhecidos na técnica. A estabilidade pode também ser determinada mediante a medição e a observação da presença mínima ou ausência de polímeros de fibrina ou coágulo de fibrina na formulação líquida pronta para uso.
[0081] Em uso, o efeito de GPRP pode ser reduzido, por exemplo, por diluição para uma concentração de acordo com um uso previsto. Para hemóstase, será vantajoso obter tempos de coagulação que sejam menores que um minuto. Em uma modalidade, a concentração de GPRP na formulação é diluída em um excesso molar igual a ou menor que 100 vezes ou um excesso molar igual a ou menor que 34 vezes.
[0082] Para fixação de enxerto, será vantajoso obter tempos de coagulação que tenham aproximadamente 15 minutos. Em uma modalidade, a concentração de GPRP na formulação é diluída em um excesso molar igual a ou menor que 100 vezes ou um excesso molar igual a ou menor que 56 vezes.
[0083] Os termos "estável" e "estabilidade", com referência à formulação de selante líquido, significam a ausência de polimerização de fibrina/coagulação de fibrina na formulação antes de sua aplicação a uma superfície. As formulações aqui reveladas são estáveis a uma temperatura ambiente conforme definido acima por ao menos 14 (quatorze) dias.
[0084] A coagulação ou a polimerização de fibrina pode ser medida, por exemplo, mediante a medição do comprimento de migração em uma superfície inclinada (ou modelo de teste de queda) ou por meio de qualquer outro método conhecido na técnica. A polimerização completa pode ser avaliada por meio de cessação de fluxo da formulação líquida, por exemplo, mediante inversão. A polimerização rápida pode ser medida com o uso de um coagulômetro analisador de coagulação Stat4 Stago Diagnostics ou similar.
[0085] Para armazenamento a longo prazo, por exemplo, 1 ano ou mais a 2 a 8°C, a formulação que compreende os monô meros de fibri- na e o peptídeo de GPRP pode ser dividida em alíquotas em frascos estéreis, ampolas ou outros recipientes, que são, então, vedados. Em uma modalidade, é usada uma vedação que permite a remoção da formulação com uma seringa através da vedação. O recipiente pode ser identificado de acordo com a prática padrão na área farmacêutica ou de dispositivos médicos.
[0086] Em uso, a formulação de selante líquido pode ser aplicada diretamente do recipiente, pode ser atravessada por um dispositivo de troca de pequena molécula, ou através de um dispositivo de remoção de GPRP (por exemplo, um dispositivo de afinidade que tem uma porção química complementar para GPRP); embora o método de uso seja determinado pelo usuário (por exemplo, um médico como um praticante da medicina como um clínico, um enfermeiro, um médico), isto é, de acordo com as necessidades do paciente individual e da severidade do sangramento ou da condição.
[0087] Como usado aqui, os artigos indefinidos "um" e "uma" significam "ao menos um" ou "um ou mais", a menos que o contexto claramente determine de outro modo.
[0088] Como usado aqui, os termos "compreendendo", "incluindo", "tendo" e variações gramaticais dos mesmos devem ser considerados como especificando as características, etapas ou componentes estabelecidos, mas sem excluir a adição de uma ou mais características, etapas, componentes ou grupos adicionais dos mesmos.
[0089] Quando um valor numérico é precedido do termo "ao redor de", o termo "ao redor de" tem por objetivo indicar +/-10%.
[0090] Como usado aqui, o termo "peptídeo" é amplamente usado para significar um composto isolado de cerca de 4 a cerca de 50 ami- noácidos consecutivos ou análogos dos aminoácidos. Incluídos na definição de peptídeo estão, por exemplo, peptídeos contendo um ou mais análogos de um aminoácido (incluindo, por exemplo, aminoáci- dos sintéticos, peptoides, etc.), peptídeos com ligações substituídas, sais de peptídeo, assim como outras modificações conhecidas na técnica, tanto de ocorrência natural quanto de ocorrência não natural (por exemplo, sintética). Dessa forma, os peptídeos sintéticos, peptídeos ramificados ciclizados e similares, são incluídos dentro da definição.
[0091] O termo "peptídeos" inclui também derivados das sequências de aminoácidos da invenção tendo uma ou mais substituições, adição e/ou deleção, incluindo um ou mais aminoácidos de ocorrência não natural. De preferência, os derivados apresentam ao menos cerca de 50% de identidade com qualquer sequência de referência, de preferência ao menos cerca de 70% de identidade, com mais preferência pelo menos 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% ou 100% de identidade de sequência com qualquer sequência de referência aqui descrita. Os derivados de peptídeo podem incluir modificações na sequência nativa, como deleções, adições e substituições (em geral, de natureza conservadora), desde que o peptídeo mantenha a atividade desejada, por exemplo, de inibir de modo reversível a polimerização de fibrina.
[0092] Essas modificações podem ser deliberadas, como através da mutagênese sítio-dirigida, ou podem ser acidentais, como através da síntese ou mutações de hospedeiros que produzem proteínas ou erros devido à amplificação por PCR. É também abrangido aqui os sais farmaceuticamente aceitáveis de peptídeos e os derivados desses sais.
[0093] Inibidor reversível refere-se a uma baixa afinidade do inibidor (por exemplo, peptídeo de GPRP) com o monômero de fibrina e que não tem efeitos permanentes sobre a polimerização de fibrina ou a coagulação de fibrina. Portanto, tipicamente, a diluição, a remoção e/ou a troca de pequena molécula irá remover o efeito inibidor.
[0094] O termo "inibidor de polimerização reversível" é intercambi- ável no presente documento com o termo "agente de bloqueio de po- limerização de fibrina reversível".
[0095] O termo "peptídeo de GPRP" significa um peptídeo de quatro ou mais sequência de aminoácidos consecutivos apresentada em SEQ ID NO: 1, especificamente a sequência Gly-Pro-Arg-Pro. Um pep- tídeo de GPRP pode compreender um tetrâmero (GPRP, SEQ ID NO: 1), um derivado ou análogo do mesmo. Um peptídeo de GPRP pode ter 4 a 12 resíduos de aminoácido de comprimento, ou 4 a 8, de preferência, 4, 5, 6, 7 ou 8 aminoácidos de comprimento.
[0096] Sem se ater a nenhuma teoria, um peptídeo de GPRP tem a capacidade de se ligar a um monômero de fibrina, bloqueando, assim a associação e a polimerização de monômeros de fibrina. O peptí- deo de GPRP pode compreender, por exemplo, uma amida de peptí- deo de GPRP (amida em terminal C) revelada nas patentes US n°s 5.478.810 e 5.607.858, incorporada por referência, que tem a Fórmula GPRP-X-N(R1R2), em que G é o aminoácido glicina, P é o aminoácido L-prolina, R é o aminoácido L-arginina, X é um aminoácido proteinó- geno que não prolina ou um dipeptídeo incluindo prolina, N é nitrogênio e R1 e R2 são idênticos ou diferentes e são hidrogênio ou uma cadeia de alquila inferior que tem até 4 átomos de carbono. Outros pep- tídeos de GPRP incluem peptídeos denominados "peptídeos de nó de fibrina" revelados nas patentes US n° 8.513.380 com o um peptídeo que tem sequência de aminoácidos GPRP (SEQ ID NO:1), GPRV (SEQ ID NO:2), ou GHRP (SEQ ID NO:3). O peptídeo de GPRP pode ter a sequência de aminoácidos GPRPX (SEQ ID NO:32), GPRVX (SEQ ID NO:33), GPRPXX (SEQ ID NO:34), GPRVXX (SEQ ID NO:35), GPRPXXX (SEQ ID NO:36), GPRVXXX (SEQ ID NO:37), GPRPXXXX (SEQ ID NO:38), ou GPRVXXXX (SEQ ID NO:39), ou GPRXXX (SEQ ID NO:40), em que X é qualquer aminoácido.
[0097] O peptídeo pode também ter um aminoácido C-terminal, como, por exemplo, cisteína ou lisina, que permite reações químicas subsequentes com outros agentes para produzir conjugados C- terminais. Portanto, em algumas modalidades, o aminoácido C- terminal do peptídeo é uma cisteína. Portanto, em algumas modalidades, o aminoácido C-terminal do peptídeo é uma lisina. Por exemplo, o peptídeo de GPRP pode ter a sequência de aminoácidos GPRPAAC (SEQ ID NO: 25), GPRPFPAC (SEQ ID NO: 26), GPRPPERC (SEQ ID NO: 27), GPRVVERC (SEQ ID NO: 28), GPRVVAAC (SEQ ID NO: 29) ou GPSPAAC (SEQ ID NO: 30).
[0098] Qualquer uma das sequências de peptídeo apresentadas nas SEQ ID NOS: 1 a 42 pode ser uma amida de peptídeo, por exemplo, conforme revelado nas patentes citadas acima.
[0099] As sequências de aminoácidos e peptídeos são comumente abreviadas como mostrado abaixo, na Tabela A. TABELA A: Abreviação, nome sistemático e fórmulas dos amino- ácidos comuns
[00100] Em uma modalidade, uma sequência análoga de aminoáci- dos é usada sendo que ao menos um aminoácido no peptídeo isolado é substituído por um aminoácido análogo ou biossimilar (substituição conservativa), conforme conhecido na técnica. Os aminoácidos podem estar na forma L, D, ou seus derivados [por exemplo, pseudoaminoá- cido, aminoácido funcionalizado (por exemplo, aminoácido fluora- do...etc.), beta aminoácido, gama aminoácido...etc.].
[00101] Um versado na técnica reconhecerá que os peptídeos aqui revelados podem ser sintetizados como derivados dos peptídeos, incluindo "miméticos de peptídeo". Um peptídeo mimético é uma molécula que não é de natureza completamente peptídica, mas ainda as- sim imita a atividade biológica do peptídeo no qual é estruturalmente baseado. Esses peptídeos miméticos incluem moléculas similares a peptídeo contendo aminoácidos de ocorrência não natural. Um peptí- deo mimético pode incluir um ou mais análogos de aminoácidos e pode ser uma molécula similar a um peptídeo que contém, por exemplo, um isóstero ligado à amida, como uma modificação retroinversa; ligação amida reduzida; ligação metilenotioéter ou metilenossulfóxido; ligação metileno éter; ligação etileno; ligação tioamida; ligação transole- fina ou fluoroolefina; anel 1,5-tetrazol dissubstituído; ligação de imida; ligação cetometileno ou fluorocetometileno ou outro isóstero de amida. Os termos incluem também moléculas que compreendem um ou mais resíduos de glicina N-substituídos (um "peptoide") e outros aminoáci- dos ou peptídeos sintéticos. (Consulte, por exemplo, as patentes US n°s 5.831.005; 5.877.278; e 5.977.301; Nguyen et al. (2000) Chem Biol. 7(7):463 a 473; e Simon et al. (1992) Proc. Natl. Acad. Sci. USA 89(20):9.367 a 9371 para descrição de peptoides). Um versado na técnica entende que esses e outros miméticos de peptídeo estão incluídos dentro do significado do termo "peptídeo mimético", conforme aqui usado.
[00102] A sequência de aminoácidos de um peptídeo é escrita de acordo com a notação convencional, com um grupo amino (NH2) na terminação N aparecendo do lado esquerdo da sequência e um grupo carboxila (COOH) na terminação C aparecendo do lado direito da mesma.
[00103] Os peptídeos aqui descritos podem formar um sal fisiologi- camente aceitável pela reação de formação de sal convencional. Esses sais podem incluir sais com ácidos inorgânicos, como ácido clorídrico, ácido sulfúrico e ácido fosfórico; sais com ácidos orgânicos, como ácido lático, ácido tartárico, ácido maleico, ácido fumárico, ácido oxálico, ácido málico, ácido cítrico, ácido oleico e ácido palmítico; sais com hidróxidos e carbonatos de metais alcalinos e metais alcalinos terrosos, como sódio, potássio, cálcio e alumínio; e sais com aminas, como trietilamina, benzilamina, dietanolamina, t-butilamina, diciclo- hexilamina e arginina.
[00104] Ambas as ligações dissulfeto intra e entre cadeias podem ser formadas e as formas de peptídeo resultantes da formação dessas ligações dissulfeto são abrangidas pela presente invenção.
[00105] Em uma modalidade, os peptídeos aqui revelados são sintetizados quimicamente. Em outras modalidades, os peptídeos aqui revelados são produzidos in vivo ou ex vivo através da expressão de DNA recombinante em células hospedeiras procarióticas ou eucarióti- cas.
[00106] Em algumas modalidades, os peptídeos de GPRP ligam de modo reversível a região de C-terminal da fibrina e a cadeia de fibrino- gênio. Deve ficar entendido que uma interação preferencial não exige necessariamente interação entre os resíduos de aminoácidos específicos e/ou motivos de cada peptídeo.
[00107] O termo "substancialmente isento de trombina" ou "isento de trombina" refere-se a um componente ou uma formulação que não tem mais que cerca de 1 (uma) unidade de trombina por mililitro (ml) de formulação.
[00108] O termo "uma quantidade eficaz" refere-se à quantidade de um componente ou uma formulação aqui revelada exigida para formar um selante, por exemplo, para cobrir uma superfície lesionada, para reduzir o sangramento, para aumentar a cura, para melhorar uma condição desejada, etc.
[00109] Os carreadores, solventes, diluentes, excipientes e veículos "farmaceuticamente aceitáveis" ou "farmacologicamente aceitáveis", em geral, referem-se a diluentes, cargas ou materiais encapsulados inertes, sólidos ou líquidos não tóxicos que não reagem com os ingre- dientes ativos da composição aqui revelada. Excipientes aceitáveis incluem, mas não se limitam a, solução salina; ácido acético ou acetato; e íons de cloreto de sódio; manitol; albumina; ou uma combinação dos mesmos.
[00110] Os peptídeos aqui revelados são sintetizados de acordo com os métodos conhecidos na técnica, que incluem, mas não se limitam a, métodos sintéticos (por exemplo, sintetização química do peptí- deo a partir de aminoácidos individuais) e recombinantes (por exemplo, sintetização do DNA que codifica o peptídeo e uso o DNA para produzir o peptídeo recombinante).
[00111] Síntese química do peptídeo: um peptídeo aqui revelado e o DNA codificando o peptídeo podem ser quimicamente sintetizados por métodos conhecidos na arte. Os métodos adequados para sintetizar o peptídeo são descritos por Stuart e Young (1984), "Solid Phase Peptide Synthesis", Solid Phase Peptide Synthesis, Methods Enzymol., Segunda edição, Pierce Chemical Company, 289, Academic Press, Inc., NY, EUA (1997). Por exemplo, um método de síntese de fase sólida ou um método de síntese de fase líquida pode ser usado. A síntese de fase sólida é em geral realizada por grupos amino protetores com grupos protetores adequados. Por exemplo, Boc (terc- butoxicarbonila) ou Fmoc (9-fluorenilmetiloxicarbonila) ou uma combinação dos mesmos podem ser usados. Em um exemplo, um peptídeo aqui revelado é sintetizado pelas seguintes etapas: 1) um resíduo de aminoácidos correspondendo ao C-terminal do peptídeo a ser produzido é ligado a um material de fase sólida insolúvel a um solvente da reação através de um grupo COOH do aminoácido ou esse material de fase sólida é adquirido; 2) na direção N-terminal do peptídeo, um ami- noácido correspondente ou fragmento de peptídeo é ligado por condensação ao aminoácido da etapa 1) depois de proteger outros grupos funcionais, como um grupo a-amino do aminoácido ou fragmento de peptídeo correspondente que não seja um grupo a-COOH; 3) um grupo de proteção de um grupo amino formando uma ligação peptídica de modo que um grupo a-amino é removido do aminoácido ligado ou fragmento de peptídeo; 4) as etapas 2) e 3) são repetidas para alongar uma cadeia peptídica para formar uma cadeia peptídica correspondendo ao peptídeo desejado; 5) separar a cadeia peptídica produzida do material de fase sólida e remover os grupos protetores dos grupos funcionais protegidos; e 6) purificar o peptídeo para obter, assim, o peptídeo desejado.
[00112] Os materiais de fase sólida, assim como os solventes e agentes condensantes, são bem conhecidos na técnica.
[00113] Síntese química e expressão do DNA: O DNA que codifica um peptídeo aqui revelado pode ser replicado e usado para expressar o peptídeo recombinante após a inserção em uma ampla variedade de células hospedeiras em uma ampla variedade de vetores de clonagem e de expressão. O hospedeiro pode ser procariote ou eucariote. O DNA pode ser quimicamente sintetizado. Métodos adequados para sintetizar DNA e vetores de clonagem (por exemplo, para usar em células de mamífero, inseto, vegetais, bacterianas, fagos e levedura) estão disponíveis. O peptídeo recombinante, que pode ser expressado sob a forma de uma proteína de fusão, é purificado pelos métodos conhecidos na arte.
[00114] Embora os exemplos a seguir demonstrem determinadas modalidades da invenção, os mesmos não devem ser interpretados como limitantes do escopo da invenção, mas, preferivelmente, como fatores contribuintes para uma completa descrição da invenção. EXEMPLOS EXEMPLO 1: EFEITO DA CONCENTRAÇÃO DE PEPTÍDEO DE GPRP SOBRE O TEMPO DE POLIMERIZAÇÃO DE FIBRINA.
[00115] Para avaliar o efeito da presença de um peptídeo e de sua concentração sobre a taxa de polimerização de monômeros de fibrina, uma mistura de peptídeo de GPRP:monômeros de fibrina foi incubada e o tempo até a coagulação se formar foi medido.
[00116] Foi preparada uma mistura de peptídeo de GPRP:monômeros de fibrina da seguinte forma:
[00117] i. peptídeo de GPRP (Gly-Pro-Arg-Pro; fabricado de modo personalizado por Sigma; o peptídeo foi fornecido sob forma liofilizada (250 mg) e dissolvida em 100 mM de citrato de sódio di-hidrato; pH=7, criando 1 M de GPRP) foi adicionado a uma solução de fibrinogênio (solução de BAC2 como no Selante de Fibrina EVICEL®). A concentração final de peptídeo na solução é mostrada na Tabela 1 abaixo. A concentração final de fibrinogênio usada foi 1%, 1,5%, 3%, 3,5%. Uma solução de BAC2 [componente de fibrinogênio de EVICEL®] contendo 7% de fibrinogênio passível de coagulação foi diluída em 20 mM de tampão de acetato de sódio (NaAcetate), pH 7,0, para obter as concentrações finais listadas.
[00118] Para formar fibrina, trombina (como no Selante de Fibrina EVICEL®) foi adicionada à solução de fibrinogênio em uma concentração final de 10 IU/ml ou 100 IU/ml e, então, o tempo até a coagulação foi registrado. A coagulação foi avaliada por cessação de fluxo durante a inversão do tubo.
[00119] A Tabela 1 fornece um esboço do tempo de coagulação por concentrações finais de fibrina e de peptídeo.
[00120] A concentração de monômero de fibrina foi estimada como sendo igual à concentração de fibrinogênio. TABELA 1: tempo de coagulação como uma função de concentra- ção de fibrina e peptídeo.
[00121] Em geral, visto que a concentração de peptídeo de GPRP foi reduzida, os monômeros de fibrina polimerizaram progressivamente em uma taxa mais rápida. Por exemplo, a 1% de fibrina e 0,1 mM de GPRP (razão molar de ~3,4:1 entre GPRP:fibrina), um coágulo de fi- brina se formou imediatamente; a 1% de fibrina e 1 mM de GPRP (razão molar de ~34:1), um coágulo se formou em menos que 5 minutos. A 1% de fibrina e 5 mM de GPRP (~170:1), a solução era estável como um líquido por 4 horas, e a 1% de fibrina e 10 mM de GPRP (~340:1), a solução era estável como um líquido por aproximadamente 7 a 8 dias, mas não polimerizou para formar um sólido após isso. RESULTADOS DE EXPERIMENTOS A LONGO PRAZO:
[00122] A uma concentração de fibrina de 1,5% e 20 mM de GPRP (~453:1), ou a 3,5% de fibrina e 40 mM de GPRP (~389:1), a solução era estável e não formou um coágulo mesmo após 2 semanas à temperatura ambiente.
[00123] Esses experimentos mostram que uma razão molar de 340:1 (GPRP:fibrina) vantajosamente resultou na estabilização da solução líquida por cerca de 7 a 8 dias.
[00124] Resultados similares foram observados com as duas concentrações de trombina usadas.
[00125] Sem se ater a nenhuma teoria, esse resultado indica que a maior parte ou a totalidade do fibrinogênio foi clivada pela trombina e as diferenças no tempo de coagulação estavam relacionadas às concentrações de GPRP em relação à fibrina.
[00126] A relação entre tempo de polimerização e a razão molar entre GPRP:fibrina é também mostrada na Figura 1.
[00127] Nesse experimento, uma concentração de fibrina fixa (3%) e quantidades crescentes de GPRP (0,1 mM, 0,2 mM, 0,5 mM, 1 mM, 1,5 mM, 2 mM, 3 mM, 4 mM e 5 mM) foram usadas para atrasar a po- limerização. Todas essas (tendo uma razão de no máximo 57:1) estão abaixo da razão mínima exigida para estabilização a longo prazo de monômeros de fibrina. A solução de GPRP:fibrina foi preparada conforme descrito acima (mediante a adição de um peptídeo de GPRP em uma solução de fibrinogênio e a adição de trombina à mistura de GPRP:fibrinogênio). Posteriormente, o tempo até coagulação foi registrado conforme acima.
[00128] A Figura 1 mostra que há correlação logarítmica entre a taxa de polimerização de fibrina e a razão molar entre peptídeo de GPRP e fibrina.
[00129] Isso indica que a taxa de formação de um coágulo de fibri- na pode ser controlada mediante o ajuste da concentração do peptí- deo de GPRP na solução e que a diluição do peptídeo de GPRP mesmo em uma pequena quantidade afetaria a taxa de polimerização de fibrina.
[00130] Ademais, a correlação definida permite, em algumas modalidades, o controle da taxa de polimerização por meio do controle da concentração final de peptídeo de GPRP após a aplicação (por exemplo, através de um dispositivo de troca de pequena molécula). EXEMPLO 2: FORMAÇÃO DE COÁGULO DE FIBRINA DE UMA SOLUÇÃO QUE COMPREENDE FIBRINA E GPRP COM O USO DE UM DISPOSITIVO DE TROCA DE PEQUENA MOLÉCULA.
[00131] O seguinte exemplo deseja mostrar que a iniciação e/ou a aceleração de formação de um coágulo de fibrina pode ser obtida mediante o uso de um dispositivo de troca de pequena molécula para diluir ou remover o peptídeo de GPRP da solução.
[00132] Uma mistura contendo uma concentração de fibrina de aproximadamente 3,8% e uma concentração de peptídeo de GPRP de 41 mM de peptídeo de GPRP (razão molar de ~366:1) foi preparada conforme descrito acima (mediante a adição de um peptídeo de GPRP em uma solução de 3,8% de fibrinogênio e a adição de trombina para clivar o fibrinogênio em fibrina). Constatou-se que essa razão molar era suficiente para manter a formulação estável.
[00133] Um dispositivo de troca de pequena molécula comercial (GE PD-10 colunas giratórias; Código de produto: 17-0851-01, GE Healthcare) foi usado de acordo com o protocolo de rotação padrão fornecido com o dispositivo, para remover/diluir o peptídeo de GPRP da formulação de GPRP:monômero de fibrina. O dispositivo de troca foi pré-equilibrado com um tampão que incluía 20 mM de acetato de sódio, pH 7,0; 25 mM de cloreto de cálcio. 2,5 ml de solução foram submetidos ao procedimento de troca de tampão e a formação do coágulo de fibrina foi avaliada mediante a inversão do tubo contendo a mistura de tampão trocado.
[00134] A formulação de pequena molécula trocada coagulou-se rapidamente (Figura 2B), enquanto que a solução que não foi submetida ao procedimento de troca de tampão permaneceu sob forma líquida (Figura 2A).
[00135] Embora várias modalidades tenham sido descritas aqui, muitas modificações e variações daquelas modalidades podem ser implantadas. Além disso, quando os materiais são apresentados para determinados componentes, outros materiais podem ser usados. A descrição mencionada anteriormente e as reivindicações seguintes são destinadas a abranger todas essas modificações e variações.
[00136] Qualquer patente, publicação ou outro material de revelação, no todo ou em parte, que seja tido como incorporado a título de referência à presente invenção, é incorporado à presente invenção apenas até o ponto em que os materiais incorporados não entrem em conflito com definições, declarações ou outros materiais de revelação existentes apresentados nesta revelação. Desse modo, e na medida em que for necessário, a revelação como explicitamente aqui apresentada substitui qualquer material conflitante incorporado à presente invenção a título de referência.
[00137] A citação ou identificação de qualquer referência nesse pedido não deve ser interpretada como uma confissão de que tal refe- rência está disponível como técnica anterior à invenção.
[00138] Os títulos das seções são aqui usados para facilitar a compreensão do relatório descritivo e não devem ser entendidos como necessariamente limitantes.
Claims (19)
1. Formulação de selante líquido compreendendo monômeros de fibrina e um peptídeo GPRP, caracterizada pelo fato de que: (i) os ditos monômeros estão presentes em uma concentração de 1 a 13% (p/v); (ii) o peptídeo GPRP está presente na formulação em uma quantidade que é maior que 100 vezes o excesso molar em relação aos monômeros de fibrina; e (iii) a formulação líquida é estável por pelo menos 14 dias a uma temperatura ambiente selecionada do grupo que consiste em 20, 21, 22, 23, 24 e 25°C, em que o peptídeo GPRP é um peptídeo selecionado do grupo de peptídeos com uma sequência de aminoácidos selecionada de SEQ ID NO: 1 a SEQ ID NO: 42.
2. Formulação, de acordo com a reivindicação 1, caracterizada pelo fato de que o peptídeo GPRP está presente em uma quantidade maior que 340 vezes o excesso molar em relação aos monômeros de fibrina.
3. Formulação, de acordo com a reivindicação 1, caracterizada pelo fato de que o peptídeo GPRP está presente em uma quantidade de 340 a 460 vezes o excesso molar em relação aos monômeros de fibrina.
4. Formulação, de acordo com qualquer uma das reivindicações 1 a 3, caracterizada pelo fato de que é substancialmente isenta de trombina adicionada.
5. Formulação, de acordo com qualquer uma das reivindicações 1 a 4, caracterizada pelo fato de que compreende adicionalmente Fator XIII ativado por trombina.
6. Formulação, de acordo com qualquer uma das reivindicações 1 a 4, caracterizada pelo fato de que compreende adicionalmente um quelante de cálcio.
7. Formulação, de acordo com a reivindicação 6, caracterizada pelo fato de que o quelante de cálcio é um íon de citrato.
8. Formulação, de acordo com a reivindicação 7, caracterizada pelo fato de que o íon de citrato é fornecido por citrato de sódio.
9. Formulação, de acordo com a reivindicação 8, caracterizada pelo fato de que compreende de 1 mM a 50 mM de citrato de sódio.
10. Formulação, de acordo com qualquer uma das reivindicações 1 a 9, caracterizada pelo fato de que tem um pH neutro.
11. Formulação, de acordo com qualquer uma das reivindicações 1 a 10, caracterizada pelo fato de que é para uso em hemóstase, vedação, cura e/ou em cirurgia.
12. Recipiente, caracterizado pelo fato de que compreende a formulação como definida em qualquer uma das reivindicações 1 a 10.
13. Kit, caracterizado pelo fato de que compreende o recipiente como definido na reivindicação 12, e, opcionalmente, instruções para uso.
14. Método para fabricação de uma formulação de selante líquido que compreende monômeros de fibrina em uma concentração de 1 a 13% (p/v) e um peptídeo GPRP em que o peptídeo GPRP está presente na formulação em uma quantidade que é maior que 100 vezes o excesso molar em relação aos monômeros de fibrina; e sendo que a formulação líquida é estável por pelo menos 14 dias a uma temperatura ambiente selecionada do grupo que consiste em 20, 21, 22, 23, 24 e 25°C, em que o peptídeo GPRP é um peptídeo selecionado do grupo de peptídeos com uma sequência de aminoácidos selecionada de SEQ ID NO: 1 a SEQ ID NO: 42, caracterizado pelo fato de que compreende as etapas de: a) fornecer um componente que compreende monômeros de fibrina; b) fornecer um peptídeo GPRP, um derivado ou sal do mesmo; e c) misturar a) e b) a fim de obter a formulação de selante líquido.
15. Método, de acordo com a reivindicação 14, caracterizado pelo fato de que os monômeros de fibrina fornecidos são obtidos mediante o contato de uma solução aquosa de fibrinogênio com trombina ou uma enzima tipo trombina sob condições que permitem a clivagem do fibrinogênio.
16. Método, de acordo com a reivindicação 14 ou 15, caracterizado pelo fato de que o componente de monômero de fibrina compreende Fator XIII ativado por trombina.
17. Método, de acordo com a reivindicação 14 ou 15, caracterizado pelo fato de que o componente de monômero de fibrina compreende um quelante de cálcio.
18. Formulação, caracterizada pelo fato de que é obtenível por meio do método como definido em qualquer uma das reivindicações 14 a 17.
19. Formulação, de acordo com qualquer uma das reivindicações 1 a 9, caracterizada pelo fato de que é para uso em um método de cura, vedação e/ou redução de perda sanguínea em um indivíduo em necessidade.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361920646P | 2013-12-24 | 2013-12-24 | |
| IL230151 | 2013-12-24 | ||
| IL230151A IL230151A0 (en) | 2013-12-24 | 2013-12-24 | One-component fibrin glue containing a polymerization inhibitor |
| US61/920,646 | 2013-12-24 | ||
| PCT/IL2014/000063 WO2015097688A1 (en) | 2013-12-24 | 2014-12-04 | One component fibrin glue comprising a polymerization inhibitor |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112016014870A2 BR112016014870A2 (pt) | 2017-09-19 |
| BR112016014870B1 true BR112016014870B1 (pt) | 2021-02-02 |
Family
ID=51691232
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112016014870-3A BR112016014870B1 (pt) | 2013-12-24 | 2014-12-04 | formulação de selante líquido compreendendo monômeros de fibrina e um peptídeo de gprp, seu método de fabricação, recipiente e kit |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US9814799B2 (pt) |
| EP (1) | EP3086818B1 (pt) |
| JP (1) | JP6588019B2 (pt) |
| CN (1) | CN105899242B (pt) |
| AU (1) | AU2014372152A1 (pt) |
| BR (1) | BR112016014870B1 (pt) |
| CA (1) | CA2934420A1 (pt) |
| ES (1) | ES2702657T3 (pt) |
| HK (1) | HK1231418A1 (pt) |
| IL (2) | IL230151A0 (pt) |
| WO (1) | WO2015097688A1 (pt) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL230151A0 (en) | 2013-12-24 | 2014-09-30 | Omrix Biopharmaceuticals Ltd | One-component fibrin glue containing a polymerization inhibitor |
| IL231792A0 (en) | 2014-03-27 | 2014-08-31 | Omrix Biopharmaceuticals Ltd | Device and method for the preparation and administration of one-component fibrin glue |
| EP3648804A1 (en) * | 2017-07-07 | 2020-05-13 | Vivostat A/S | A tissue sealant for use in the formation of an anastomosis in the gastrointestinal tract |
| CN110669126B (zh) * | 2019-10-23 | 2022-08-16 | 广州领晟医疗科技有限公司 | 多肽gpr5及其促进肝细胞增殖和抑制肝细胞凋亡的用途 |
| CN111499687A (zh) * | 2020-03-13 | 2020-08-07 | 宁波市第一医院 | 1-磷酸鞘氨醇受体3激动剂及其制备方法和应用 |
| CN113929736B (zh) * | 2020-06-29 | 2024-01-26 | 首都医科大学 | Gly-Pro-Arg-Pro-氧乙氨羰基华法林,其合成,活性和应用 |
| CN113929739B (zh) * | 2020-06-29 | 2023-07-28 | 首都医科大学 | Gly-Pro-Arg-Pro-NH乙氧羰华法林,其合成,活性和应用 |
| CN113929742A (zh) * | 2020-06-29 | 2022-01-14 | 首都医科大学 | 华法林-4-O-乙酰-Gly-Pro-Arg-Pro-AA2及其合成,活性和应用 |
| CN113929741A (zh) * | 2020-06-29 | 2022-01-14 | 首都医科大学 | 华法林-4-O-乙酰-Gly-Pro-Arg-Pro-AA1及其合成、活性和应用 |
| WO2022137002A1 (en) | 2020-12-21 | 2022-06-30 | Ethicon, Inc. | Bleeding detection method |
| CN113967286B (zh) * | 2021-11-03 | 2022-10-21 | 吉林大学 | 一种短肽干粉粘合剂在缺损硬膜的封堵与修复中的应用 |
Family Cites Families (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AT366916B (de) | 1980-04-02 | 1982-05-25 | Immuno Ag | Vorrichtung zur applikation eines gewebeklebstoffes auf basis von menschlichen oder tierischenproteinen |
| US4627879A (en) | 1984-09-07 | 1986-12-09 | The Trustees Of Columbia University In The City Of New York | Fibrin adhesive prepared as a concentrate from single donor fresh frozen plasma |
| DE3622642A1 (de) | 1986-07-05 | 1988-01-14 | Behringwerke Ag | Einkomponenten-gewebekleber sowie verfahren zu seiner herstellung |
| US4978336A (en) | 1987-09-29 | 1990-12-18 | Hemaedics, Inc. | Biological syringe system |
| US4874368A (en) | 1988-07-25 | 1989-10-17 | Micromedics, Inc. | Fibrin glue delivery system |
| DE3843126C3 (de) | 1988-12-22 | 1994-10-06 | Octapharma Ag | Verfahren zur Herstellung eines hochreinen Thrombinkonzentrates |
| US5104375A (en) | 1989-10-16 | 1992-04-14 | Johnson & Johnson Medical, Inc. | Locking holder for a pair of syringes and method of use |
| US5219328A (en) | 1990-01-03 | 1993-06-15 | Cryolife, Inc. | Fibrin sealant delivery method |
| US5318524A (en) | 1990-01-03 | 1994-06-07 | Cryolife, Inc. | Fibrin sealant delivery kit |
| DE4014655A1 (de) | 1990-05-08 | 1991-11-14 | Behringwerke Ag | Peptidamide, verfahren zu deren herstellung und diese enthaltende mittel als fibrin/thrombin-gerinnungsinhibitoren |
| US5792835A (en) | 1991-09-05 | 1998-08-11 | Baxter International Inc. | Method of preparing a topical fibrinogen complex |
| SK294292A3 (en) | 1991-09-27 | 1994-06-08 | Octapharma Ag | Tissue adhesive and method of its production |
| US5831005A (en) | 1992-09-24 | 1998-11-03 | Chiron Corporation | Synthesis of N-substituted oligomers |
| US5877278A (en) | 1992-09-24 | 1999-03-02 | Chiron Corporation | Synthesis of N-substituted oligomers |
| CN1091315A (zh) * | 1992-10-08 | 1994-08-31 | E·R·斯奎布父子公司 | 血纤维蛋白封闭剂组合物及其使用方法 |
| US5723579A (en) | 1996-02-02 | 1998-03-03 | Bayer Corporation | Fibrinogen binding peptides |
| EP0885020A1 (en) | 1996-02-20 | 1998-12-23 | Cohesion Corporation | Tissue sealant compositions and methods of use thereof |
| DE19636622C1 (de) | 1996-09-10 | 1998-06-10 | Omrix Biopharm Sa | Auftragvorrichtung zum Auftragen eines Mehrkomponenten-Gewebeklebstoffs und Halterung für eine solche Auftragvorrichtung |
| US5844087A (en) | 1996-11-05 | 1998-12-01 | Bayer Corporation | Method and device for delivering fibrin glue |
| ATE357946T1 (de) * | 1996-11-15 | 2007-04-15 | Bristol Myers Squibb Co | Vorrichtung zur anwendung einer mischung von zwei oder mehreren flüssigen komponenten zur bildung eines biomaterials |
| US6613020B1 (en) | 1996-12-06 | 2003-09-02 | Bristol-Myers Squibb Company | Method of applying a mixture of two liquid components as well as a device for carrying out the method |
| FR2757770B1 (fr) * | 1996-12-30 | 1999-02-26 | Inoteb | Procede de preparation d'une colle biologique capable de coaguler par simple addition d'ions calcium |
| EP0856317A1 (en) | 1997-01-31 | 1998-08-05 | Omrix Biopharmaceuticals S.A. | A stabilized mixture comprising fibrinogen |
| US6783514B2 (en) | 1997-01-31 | 2004-08-31 | United States Surgical Corporation | Fibrin sealant applicator |
| US6121232A (en) | 1997-01-31 | 2000-09-19 | Omrix Biopharmaceuticals Sa | Stabilized mixture comprising fibrinogen |
| GB9711927D0 (en) | 1997-06-09 | 1997-08-06 | Bristol Myers Squibb Co | Compositions useful as fibrin sealants |
| SK288005B6 (sk) | 2001-05-21 | 2012-10-02 | Omrix Biopharmaceuticals S. A. | In vitro method for specifically removing or isolating plasminogen or plasmin and support used in this method |
| US6908899B2 (en) | 2001-08-17 | 2005-06-21 | U.S. Dept. Of Veterans Affairs | Pro-inflammatory fibrinopeptide |
| CN1606447A (zh) * | 2001-10-03 | 2005-04-13 | 克里斯托弗·J·伍尔弗顿 | 保存稳定的纤维蛋白原溶液 |
| DE10261126A1 (de) | 2002-08-13 | 2004-03-04 | Aventis Behring Gmbh | Lagerungsstabile, flüssige Fibrinogen-Formulierung |
| US7208087B2 (en) | 2005-02-15 | 2007-04-24 | Bio-Rad Laboratories, Inc. | Dual-chamber chromatographic cartridge |
| DE602005013301D1 (de) | 2005-11-22 | 2009-04-23 | Omrix Biopharm Sa | Applikatorvorrichtung zum aufbringen einer mehrkomponenten-flüssigkeit |
| FR2894831B1 (fr) | 2005-12-16 | 2008-02-15 | Lab Francais Du Fractionnement | Colle biologique exempte de thrombine et son utilisation comme medicament. |
| GB0623607D0 (en) * | 2006-11-27 | 2007-01-03 | Haemostatix Ltd | Tissue adhesive |
| FR2909180B1 (fr) * | 2006-11-29 | 2009-02-20 | Diagnostica Stago Soc Par Acti | Methode de mesure fonctionnelle de l'activite de la thrombomoduline plasmatique. |
| AU2009324297B2 (en) * | 2008-12-11 | 2013-12-05 | Baxter Healthcare S.A. | Preparations based on fibrinogen and sulfated polysaccharides |
| US8367802B2 (en) | 2009-06-18 | 2013-02-05 | Biomedica Management Corporation | Method to produce fibrin monomer in acid media for use as tissue sealant |
| US8513380B2 (en) | 2009-07-09 | 2013-08-20 | Georgia Tech Research Corporation | Peptides for binding fibrinogen and fibrin |
| IL230150A0 (en) | 2013-12-24 | 2014-09-30 | Omrix Biopharmaceuticals Ltd | One-component fibrin glue containing zymogens |
| IL230151A0 (en) | 2013-12-24 | 2014-09-30 | Omrix Biopharmaceuticals Ltd | One-component fibrin glue containing a polymerization inhibitor |
| IL231792A0 (en) | 2014-03-27 | 2014-08-31 | Omrix Biopharmaceuticals Ltd | Device and method for the preparation and administration of one-component fibrin glue |
-
2013
- 2013-12-24 IL IL230151A patent/IL230151A0/en unknown
-
2014
- 2014-12-04 WO PCT/IL2014/000063 patent/WO2015097688A1/en active Application Filing
- 2014-12-04 CN CN201480071021.0A patent/CN105899242B/zh not_active Expired - Fee Related
- 2014-12-04 US US14/560,329 patent/US9814799B2/en active Active
- 2014-12-04 CA CA2934420A patent/CA2934420A1/en not_active Abandoned
- 2014-12-04 ES ES14831093T patent/ES2702657T3/es active Active
- 2014-12-04 JP JP2016542749A patent/JP6588019B2/ja active Active
- 2014-12-04 BR BR112016014870-3A patent/BR112016014870B1/pt not_active IP Right Cessation
- 2014-12-04 AU AU2014372152A patent/AU2014372152A1/en not_active Abandoned
- 2014-12-04 EP EP14831093.1A patent/EP3086818B1/en active Active
-
2016
- 2016-06-13 IL IL246174A patent/IL246174B/en active IP Right Grant
-
2017
- 2017-03-23 US US15/467,191 patent/US10357589B2/en active Active
- 2017-04-11 HK HK17103702.4A patent/HK1231418A1/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| IL246174A0 (en) | 2016-07-31 |
| ES2702657T3 (es) | 2019-03-04 |
| CN105899242B (zh) | 2020-01-14 |
| IL246174B (en) | 2020-08-31 |
| AU2014372152A1 (en) | 2016-06-30 |
| EP3086818B1 (en) | 2018-10-31 |
| WO2015097688A1 (en) | 2015-07-02 |
| CA2934420A1 (en) | 2015-07-02 |
| IL230151A0 (en) | 2014-09-30 |
| HK1231418A1 (zh) | 2017-12-22 |
| CN105899242A (zh) | 2016-08-24 |
| JP6588019B2 (ja) | 2019-10-09 |
| US9814799B2 (en) | 2017-11-14 |
| BR112016014870A2 (pt) | 2017-09-19 |
| JP2017502045A (ja) | 2017-01-19 |
| WO2015097688A8 (en) | 2016-09-15 |
| EP3086818A1 (en) | 2016-11-02 |
| US20150174289A1 (en) | 2015-06-25 |
| US10357589B2 (en) | 2019-07-23 |
| US20180000982A1 (en) | 2018-01-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| BR112016014870B1 (pt) | formulação de selante líquido compreendendo monômeros de fibrina e um peptídeo de gprp, seu método de fabricação, recipiente e kit | |
| US4650678A (en) | Readily dissolvable lyophilized fibrinogen formulation | |
| JP7146712B2 (ja) | チモーゲンを含む一成分フィブリン糊 | |
| KR101082769B1 (ko) | 저장 안정성의 액상 피브리노겐 제형 | |
| US20060148698A1 (en) | Storage-stable fibrinogen solutions | |
| AU2008230476B2 (en) | Solid fibrinogen preparation | |
| CN112402587A (zh) | 使用纯化的两亲性多肽组合物的外科手术方法 | |
| KR101127127B1 (ko) | 고농도 피브리노겐 용액의 제조 방법 및 이를 이용한 피브린 실란트 제품의 제조방법 | |
| US20070014780A1 (en) | Storage-stable human fibrinogen solutions | |
| JP3867931B2 (ja) | 液状フィブリノゲン製剤 | |
| US20030091559A1 (en) | Storage-stable human fibrinogen solutions | |
| JP4733283B2 (ja) | 液状フィブリノゲン製剤 | |
| CZ20001909A3 (cs) | Použití tranexamové kyseliny pro výrobu prostředku lidského fibrinogenu a lidský fíbrinogenový prostředek |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B06A | Patent application procedure suspended [chapter 6.1 patent gazette] | ||
| B06A | Patent application procedure suspended [chapter 6.1 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B09X | Republication of the decision to grant [chapter 9.1.3 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 04/12/2014, OBSERVADAS AS CONDICOES LEGAIS. |
|
| B21F | Lapse acc. art. 78, item iv - on non-payment of the annual fees in time |
Free format text: REFERENTE A 8A ANUIDADE. |
|
| B24J | Lapse because of non-payment of annual fees (definitively: art 78 iv lpi, resolution 113/2013 art. 12) |
Free format text: EM VIRTUDE DA EXTINCAO PUBLICADA NA RPI 2699 DE 27-09-2022 E CONSIDERANDO AUSENCIA DE MANIFESTACAO DENTRO DOS PRAZOS LEGAIS, INFORMO QUE CABE SER MANTIDA A EXTINCAO DA PATENTE E SEUS CERTIFICADOS, CONFORME O DISPOSTO NO ARTIGO 12, DA RESOLUCAO 113/2013. |