BR112015016817B1 - métodos para derivar um sacarídeo, para conjugar um derivado de sacarídeo e para incitar uma resposta imune em um mamífero, derivado de sacarídeo, conjugado de um derivado de sacarídeo, composição farmacêutica, e, uso de um conjugado ou composição farmacêutica - Google Patents
métodos para derivar um sacarídeo, para conjugar um derivado de sacarídeo e para incitar uma resposta imune em um mamífero, derivado de sacarídeo, conjugado de um derivado de sacarídeo, composição farmacêutica, e, uso de um conjugado ou composição farmacêutica Download PDFInfo
- Publication number
- BR112015016817B1 BR112015016817B1 BR112015016817-5A BR112015016817A BR112015016817B1 BR 112015016817 B1 BR112015016817 B1 BR 112015016817B1 BR 112015016817 A BR112015016817 A BR 112015016817A BR 112015016817 B1 BR112015016817 B1 BR 112015016817B1
- Authority
- BR
- Brazil
- Prior art keywords
- saccharide
- conjugate
- group
- azide
- spacer
- Prior art date
Links
- 0 C[C@]([C@]1O*CC1*)O Chemical compound C[C@]([C@]1O*CC1*)O 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/55—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound the modifying agent being also a pharmacologically or therapeutically active agent, i.e. the entire conjugate being a codrug, i.e. a dimer, oligomer or polymer of pharmacologically or therapeutically active compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/09—Lactobacillales, e.g. aerococcus, enterococcus, lactobacillus, lactococcus, streptococcus
- A61K39/092—Streptococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/646—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the entire peptide or protein drug conjugate elicits an immune response, e.g. conjugate vaccines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/006—Heteroglycans, i.e. polysaccharides having more than one sugar residue in the main chain in either alternating or less regular sequence; Gellans; Succinoglycans; Arabinogalactans; Tragacanth or gum tragacanth or traganth from Astragalus; Gum Karaya from Sterculia urens; Gum Ghatti from Anogeissus latifolia; Derivatives thereof
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Polymers & Plastics (AREA)
- Biochemistry (AREA)
- Virology (AREA)
- Materials Engineering (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Saccharide Compounds (AREA)
- Polysaccharides And Polysaccharide Derivatives (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
MÉTODOS PARA DERIVAR UM SACARÍDEO, PARA CONJUGAR UM DERIVADO DE SACARÍDEO E PARA INCITAR UMA RESPOSTA IMUNE EM UM MAMÍFERO, DERIVADO DE SACARÍDEO, CONJUGADO DE UM DERIVADO DE SACARÍDEO, E, COMPOSIÇÃO FARMACÊUTICA A invenção fornece novos derivados de sacarídeo, conjugados, e métodos para fabricar os derivados e conjugados.
Description
[001] Esta invenção está no campo de derivados de sacarídeo, conjugados incluindo sacarídeos e métodos para produzir os derivados de sacarídeo e conjugados. Os conjugados são úteis para imunização.
[002] Os sacarídeos capsulares de bactérias foram usados durantemuitos anos em vacinas contra bactérias capsuladas. Visto que os sacarídeos são antígenos independentes T, entretanto, eles são insuficientemente imunogênicos. A conjugação a um carreador pode converter os antígenos independentes T em antígenos dependentes T, realçando deste modo as respostas de memória e permitindo que a imunidade protetiva se desenvolva.
[003] Embora os procedimentos clássicos para a conjugação(aminação redutiva, formação de ligação de amida, etc.) contem com a reação aleatória do polissacarídeo para as aminas da proteína carreadora, novos métodos de conjugação que possibilitam a instalação específica de sítio de um ligando em uma proteína estão emergindo [1]. A conjugação específica de sítio, além de fornecer biomoléculas mais homogêneas como candidatos a vacina, ajudariam a preservar a imunogenicidade da proteína.
[004] O método da química clickfoi descrito como um método paraa formação de substâncias complexas pela união de subunidades pequenas juntas em uma maneira modular [2, 3]. Várias formas de reação da química clicksão conhecidas na técnica, tais como a reação catalisada pelo cobre de cicloadição 1,3-dipolar de Huisgen [4], que é frequentemente aludida como a “reação click”.Outras alternativas incluem reações de cicloadição tais como as reações de substituição nucleofilica de Diels-Alder (especialmente para anéis forçados pequenos como epóxi e compostos de aziridina), formação da química da carbonila de compostos de ureia e reações envolvendo ligações duplas de carbono-carbono, tais como alcinos em reações tiol-inas.
[005] A reação de cicloadição de Huisgen de azida-alcino usa um catalisador de cobre na presença de um agente redutor para catalisar a reação de um grupo alcino terminal ligado a uma primeira molécula. Na presença de uma segunda molécula compreendendo uma porção de azida, a azida reage com o alcino ativado para formar um 1,2,3-triazol 1,4-di-substituído. A reação catalisada por cobre ocorre na temperatura ambiente e é suficientemente específica para que a purificação do produto de reação frequentemente não seja requerida [5], Os grupos funcionais de azida e alcino são amplamente inertes para as biomoléculas em meio aquoso, permitindo que a reação ocorra em soluções complexas. O triazol formado é quimicamente estável e não é submetido à clivagem enzimática, tomando o produto da química click altamente estável em sistemas biológicos. Entretanto, o catalisador de cobre é tóxico para as células vivas, impedindo aplicações biológicas.
[006] Uma reação clickisenta de cobre foi proposta [6], que usa tensão de anel (em um anel de ciclo-octino) no lugar do catalisador de cobre para promover uma reação de cicloadição de [3 + 2] azida-alcino. A estrutura de anel fechada induz uma deformação substancial no ângulo de ligação do acetileno, que é altamente reativo com grupos azida para formar um triazol.
[007] É um objetivo da presente invenção fornecer outros métodos e melhorados para derivar sacarídeos. É um outro objetivo da presente invenção fornecer outros métodos e melhorados para conjugar sacarídeos a várias porções, tais como proteínas carreadoras. Também é um objetivo da invenção fornecer um método de conjugação que produza conjugados com estruturas mais uniformes. Também é um objetivo da invenção fornecer conjugados com propriedades imunogênicas melhoradas.
[008] Os inventores desenvolveram novos processos para derivar sacarídeos e para a conjugação de tais derivados de sacarídeo a outras porções. Os inventores também produziram novos derivados de sacarídeo e conjugados que têm propriedades melhoradas em relação aos derivados de sacarídeo e conjugados conhecidos na técnica. Em particular, os conjugados da invenção podem ter propriedades imunológicas melhoradas.
[009] Em um aspecto, a invenção fornece um método para derivar um sacarídeo compreendendo ligar um grupo cicloalcino de oito membros ao sacarídeo. A invenção também fornece um derivado de sacarídeo compreendendo um grupo cicloalcino de oito membros. O derivado de sacarídeo compreendendo um grupo cicloalcino de oito membros pode ser obtido ou obtenível pelo método para derivar um sacarídeo.
[0010] Em um outro aspecto, a invenção fornece um método para conjugar um derivado de sacarídeo a uma porção contendo azida, compreendendo reagir o grupo cicloalcino de oito membros com a azida para formar uma ligação de triazol. A invenção também fornece um conjugado de um derivado de sacarídeo e uma porção contendo azida, em que o conjugado tem a fórmula R-S-T, em que R compreende um resíduo do derivado de sacarídeo, S é um grupo triazol fundido a um grupo cicloalquila de oito membros e T compreende um resíduo da porção contendo a porção azida.
[0011] O conjugado pode ser obtido ou obtenível pelo método para conjugar um derivado de sacarídeo a uma porção contendo azida da invenção.
[0012] A presente invenção também se refere às composições farmacêuticas compreendendo um conjugado da invenção em combinação com um carreador farmaceuticamente aceitável.
[0013] A presente invenção refere-se ainda a métodos para incitar uma resposta imune em um mamífero, compreendendo administrar um conjugado ou composição farmacêutica da invenção ao mamífero.
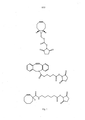
[0014] A Figura 1 apresenta três compostos contendo ciclo-octina.
[0015] A Figura 2 apresenta um esquema de reação geral para a ligação de um grupo ciclo-octina a um sacarídeo de GBS do serotipo II.
[0016] A Figura 3 apresenta a estrutura de sacarídeo de GBS serotipo V com grupo ciclo-octina ligado (I).
[0017] A Figura 4 apresenta a estrutura de sacarídeo de GBS do serotipo II com grupo ciclo-octina ligado (II).
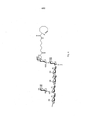
[0018] A Figura 5 apresenta um esquema de reação geral para a conjugação de derivado de sacarídeo (II) a uma proteína carreadora GBS80 por intermédio de um resíduo de tirosina.
[0019] A Figura 6 apresenta os resultados da caracterização de SDS- PAGE para o conjugado A (1 = MW, 2 = GBS8O-Y-N3, 3 = GBS80-Y- N3/PSV depois da purificação).
[0020] A Figura 7 apresenta os resultados da caracterização de SDS- PAGE para 0 conjugado B (1 = MW, 2 = GBS8O-Y-N3, 3 = GBS80-Y- N3/PSII depois da purificação).
[0021] A Figura 8 apresenta os resultados da caracterização de SDS- PAGE para 0 conjugado C (1 = MW, 2 = GBS67-Y-N3, 3 = GBS67-Y- N3/PSII depois da purificação, 4 = GBS67-Y-N3/PSII depois da purificação).
[0022] A Figura 9 apresenta os resultados da caracterização de SDS- PAGE para 0 conjugado D (1 = MW, 2 = GBS67-Y-N3, 3 = GBS67-Y- N3/PSII depois da purificação, 4 = GBS67-Y-N3/PSII depois da purificação).
[0023] A Figura 10 apresenta a estrutura de sacarídeo MenY com grupo ciclo-octina ligado (III).
[0024] A Figura 11 apresenta os resultados da caracterização de SDS- PAGE para 0 conjugado E (1 = MW, 2 = CRM197-Y-N3, 3 = CRM197-Y- Ns/MenY).
[0025] A Figura 12 apresenta resultados de imunoensaio de ELISA para a determinação de títulos de IgG contra antígenos de sacarídeo de GBS serotipo II (para a dose de carboidrato de 1,0 pg).
[0026] A Figura 13 apresenta resultados do imunoensaio de ELISA para a determinação de títulos de IgG contra antígenos de sacarídeo de GBS do serotipo II (para dose de carboidrato de 0,5 pg).
[0027] A Figura 14 apresenta resultados de imunoensaio de ELISA para a determinação de títulos de IgG contra antígenos de sacarídeo de GBS do serotipo II (para a dose de proteína de 1,0 pg).
[0028] A Figura 15 apresenta resultados do ensaio de opsonofagocitose usando cepas GBS.
[0029] A Figura 16 apresenta resposta imune de vários antígenos contra sacarídeo de GBS serotipo II.
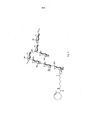
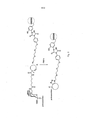
[0030] A Figura 17 apresenta resposta imune de vários antígenos contra GBS 80.
[0031] A Figura 18 apresenta a estrutura de uma construção preparada por intermédio da conjugação seletiva de tirosina de um dímero MenY a CRM197.
[0032] A invenção envolve métodos para derivar um sacarídeo e métodos de conjugar um derivado de sacarídeo a uma porção contendo azida. A invenção também envolve novos derivados de sacarídeo e conjugados. Os traços destes métodos, derivados de sacarídeo e conjugados são descritos em detalhes abaixo.
[0033] A invenção está fundamentada nos novos derivados de sacarídeo e métodos de produzir tais derivados de sacarídeo.
[0034] O sacarídeo usado nos métodos da invenção podem ser qualquer sacarídeo, particularmente um sacarídeo de um organismo patogênico. Os sacarídeos exemplares para o uso nos métodos da invenção são descritos abaixo. Em particular, o sacarídeo pode ser um sacarídeo bacteriano, por exemplo, um sacarídeo capsular bacteriano.
[0035] Os sacarídeos podem ser usados na forma de oligossacarídeos. Estes são convenientemente formados pela fragmentação de polissacarídeo purificado (por exemplo, pela hidrólise), que habitualmente será seguida pela purificação dos fragmentos do tamanho desejado. Os sacarídeos podem ser purificados a partir de fontes naturais. Como uma alternativa para purificação, os sacarídeos podem ser obtidos pela síntese total ou parcial.Sacarídeos capsulares de S', agalactiae
[0036] Os sacarídeos capsulares bacterianos preferidos incluem aqueles de Streptococcus agalactiae (“GBS”). O sacarídeo capsular é covalentemente ligado à cadeia principal de peptidoglicano de GBS, e é distinto do antígeno do grupo B, que é um outro sacarídeo que é ligado à cadeia principal de peptidoglicano.
[0037] GBS é uma causa principal de infecções bacterianas severas nos primeiros 3 meses de vida entre os recém-nascidos e de morbidez entre as mães [7], GBS também é uma causa importante de morbidez e mortalidade entre adultos não grávidos, particularmente entre pessoas idosas e adultos com condições médicas subjacentes. Todas as cepas de GBS possuem um polissacarídeo capsular (CPS) na sua superfície, que é um fator de virulência principal. Dez serotipos do CPS diferentes foram caracterizados (Ia, lb, II, III, IV, V, VI, VII, VIII e IX), dos quais cinco (Ia, lb, II, III, V) são responsáveis pela maioria das doenças neonatais na América do Norte e Europa. As vacinas conjugadas monovalentes foram preparadas contra os serotipos Ia, Ib, II, III, IV, V, VI, VII ,VIII e a eficácia demonstrada em modelos de animal 3. Recentemente, foi demonstrado que as proteínas da fímbria de GBS, além de serem estruturas importantes na adesão e invasão bacterianas, parecem ser mais conservadas do que aquelas de outras bactérias Gram-positivas [8],
[0038] Os sacarídeos capsulares de GBS são quimicamente relacionados, mas são antigenicamente muito diferentes. Todos os sacarídeos capsulares de GBS compartilham os seguintes núcleos de trissacarídeo:β-D-GI c/?N Ac( 1 —>3)β-D-Gal/2( 1 -^4)β-D-Gl cp
[0039] Os vários serotipos de GBS diferem pelo modo em que este núcleo é modificado.
[0040] As doenças relacionadas com GBS surgem primariamente dos serotipos Ia, lb, II, III, IV, V, VI, VII, e VIII, com mais de 85% sendo causadas pelos cinco serotipos: Ia, lb, III & V. A invenção pode usar um sacarídeo de qualquer serotipo, em particular dos serotipos Ia, lb, II, III & V.
[0041] Os sacarídeos usados nos métodos da invenção podem estar na sua forma nativa, ou podem ter sido modificados. Por exemplo, o sacarídeo pode ser mais curto do que o sacarídeo capsular nativo, ou pode ser quimicamente modificado. Em particular, o sacarídeo capsular do serotipo V usado na invenção pode ser modificado como descrito nas refs. 9 e 10. Por exemplo, um sacarídeo capsular do serotipo V que foi substancialmente desialilado. O sacarídeo capsular do serotipo V de GBS desialilado pode ser preparado tratando-se o sacarídeo capsular do serotipo V de GBS purificado sob condições brandamente ácidas (por exemplo, ácido sulfúrico 0,1 M a 80°C por 60 minutos) ou pelo tratamento com neuraminidase, como descrito na referência 9. O sacarídeo usado de acordo com a invenção pode ser um polissacarídeo capsular substancialmente de tamanho natural, como encontrado na natureza, ou pode ser mais curto do que o comprimento natural. Os polissacarídeos de tamanho natural podem ser despolimerizados para dar fragmentos mais curtos para o uso com a invenção por exemplo, pela hidrólise em ácido brando, pelo aquecimento, pela cromatografia de classificação por tamanho, etc. Em particular, os sacarídeos capsulares dos serotipos II e/ou III usados na invenção podem ser despolimerizados como descrito nas refs. 11 e 12.
[0042] O sacarídeo pode ser quimicamente modificado em relação ao sacarídeo capsular como encontrado na natureza. Por exemplo, o sacarídeo pode ser des-O-acetilado (parcial ou totalmente), des-N-acetilado (parcial ou totalmente), N-propionado (parcial ou totalmente), etc. A desacetilação pode ocorrer antes, durante ou depois da conjugação, mas preferivelmente ocorre antes da conjugação. Dependendo do sacarídeo particular, a desacetilação pode afetar ou não a imunogenicidade. A relevância da O-acetilação sobre os sacarídeos de GBS em vários serotipos é debatida na referência 13, e em algumas modalidades a O-acetilação dos resíduos do ácido siálico nas posições 7, 8 e/ou 9 é retida antes, durante e depois da conjugação por exemplo, pela proteção/desproteção, pela reacetilação, etc. Entretanto, tipicamente o sacarídeo de GBS usado na presente invenção substancialmente não tem nenhuma O-acetilação de resíduos do ácido siálico nas posições 7, 8 e/ou 9. Em particular, quando o sacarídeo de GBS foi purificado pela extração com base como descrito abaixo, depois a O-acetilação é tipicamente perdida, o efeito da desacetilação, etc. pode ser avaliado pelos ensaios de rotina.
[0043] Os sacarídeos capsulares podem ser purificados pelas técnicas conhecidas, como descrito em 14. Um processo típico envolve a extração com base, centrifugação, filtração, tratamento com RNase/DNase, tratamento com protease, concentração, cromatografia de exclusão de tamanho, ultrafiltração, cromatografia de troca de ânion, e outra ultrafiltração. O tratamento de células de GBS com a enzima mutanolisina, que cliva a parede de célula bacteriana para liberar os componentes da parede celular, também é útil.
[0044] Como uma alternativa, o processo de purificação descrito na referência 15 pode ser usado. Isto envolve a extração com base, tratamento com etanol/CaCfi, precipitação com CTAB, e ressolubilização. Um outro processo alternativo é descrito na referência 16.
[0045] O sacarídeo pode ser um sacarídeo capsular bacteriano. Os sacarídeos capsulares bacterianos exemplares incluem aqueles de N. meningitidis.Com base no polissacarídeo capsular do organismo, vários serogrupos de N. meningitidisforam identificados, incluindo A, B, C, H, I, K, L, 29E, W135, X, Y & Z. O sacarídeo na invenção pode ser de qualquer um destes serogrupos. Tipicamente, o sacarídeo é de um dos seguintes serogrupos meningocócicos: A, C, W135 e Y.
[0046] Os sacarídeos capsulares no geral serão usados na fonna de oligossacarídeos. Estes são convenientemente formados pela fragmentação de polissacarídeo capsular purificado (por exemplo, pela hidrólise), que habitualmente será seguido pela purificação dos fragmentos do tamanho desejado.
[0047] A fragmentação de polissacarídeos é tipicamente realizada para dar um grau final médio de polimerização (DP) no oligossacarídeo de menos do que 30 (por exemplo, entre 10 e 20, preferivelmente em tomo de 10 para o serogrupo A; entre 15 e 25 para os serogrupos W135 e Y, preferivelmente em torno de 15 a 20; entre 12 e 22 para o serogrupo C; etc.), o DP pode ser convenientemente medido pela cromatografia de troca iônica ou pelos ensaios colorimétricos [17],
[0048] Se a hidrólise é realizada, o hidrolisado no geral seráclassificado por tamanho de modo a remover oligossacarídeos de comprimento curto [18], Isto pode ser obtido de vários modos, tais como ultrafiltração seguida pela cromatografia de troca iônica. Os oligossacarídeos com um grau de polimerização de menos do que ou igual a cerca de 6 são preferivelmente removidos para o serogrupo A, e aqueles menores do que em tomo de 4 são preferivelmente removidos para os serogrupos W135 e Y.
[0049] A hidrólise química de sacarídeos no geral envolve o tratamento com ácido ou base sob condições que são padrão na técnica. As condições para a despolimerização de sacarídeos capsulares nos seus monossacarídeos constituintes são conhecidas na técnica. Um método de despolimerização envolve o uso de peróxido de hidrogênio [19], O peróxido de hidrogênio é adicionado a um sacarídeo (por exemplo, para dar uma concentração de H2O2 final de 1%), e a mistura é depois incubada (por exemplo, em torno de 55°C) até que uma redução desejada no comprimento da cadeia tenha sido obtida. A redução com 0 tempo pode ser seguida pela remoção das amostras da mistura e depois medição do tamanho molecular (médio) de sacarídeo na amostra. A despolimerização pode ser depois interrompida pelo resfriamento rápido uma vez que um tamanho de cadeia desejado tenha sido atingido
[0050] As técnicas para preparar polissacarídeos capsulares de meningococos têm sido conhecidas por muitos anos, e tipicamente envolvem um processo compreendendo as etapas de precipitação de polissacarídeo (por exemplo, usando um detergente catiônico), fracionamento com etanol, extração com fenol frio (para remover proteína) e ultracentrifugação (para remover LPS) [por exemplo, ver a ref. 20],
[0051] Um processo mais preferido [21] envolve a precipitação de polissacarídeo seguida pela solubilização do polissacarídeo precipitado usando um álcool inferior. A precipitação pode ser obtida usando um detergente catiônico tal como sais de tetrabutilamônio e cetiltrimetilamônio (por exemplo, os sais de brometo), ou brometo de hexadimetrina e sais de miristiltrimetilamônio. O brometo de cetiltrimetilamônio (‘CTAB’) é particularmente preferido [22], A solubilização do material precipitado pode ser obtida usando um álcool inferior tal como metanol, propan-l-ol, propan-2- ol, butan-l-ol, butan-2-ol, 2-metil-propan-l-ol, 2-metil-propan-2-ol, dióis, etc., mas 0 etanol é particularmente adequado para a solubilização de complexos de CTAB-polissacarídeo. O etanol pode ser adicionado ao polissacarídeo precipitado para dar uma concentração de etanol final (com base no teor total de etanol e água) dentre 50% e 95%.
[0052] Depois da ressolubilização, o polissacarídeo pode ser tratado ainda para remover contaminantes. Isto é particularmente importante em situações onde contaminação mesmo menor não é aceitável (por exemplo, para a produção de vacina humana). Isto tipicamente envolverá uma ou mais etapas de filtração por exemplo, filtração profunda, filtração através de carbono ativado pode ser usado, filtração de tamanho e/ou ultrafiltração.
[0053] Uma vez filtrado para remover contaminantes, o polissacarídeo pode ser precipitado para outro tratamento e/ou processamento. Isto pode ser convenientemente obtido pela troca de cátions (por exemplo, pela adição de sais de cálcio ou sódio).
[0054] Métodos adicionais e alternativos para a purificação de sacarídeos meningocócicos são descritos nas referências 19 & 23.
[0055] Como uma alternativa para a purificação, os sacarídeos capsulares da presente invenção podem ser obtidos pela síntese total ou parcial por exemplo, a síntese de Hib é descrita na ref. 24, e a síntese de MenA na ref. 25.
[0056] O sacarídeo pode ser quimicamente modificado por exemplo, o mesmo pode ser O-acetilado ou des-O-acetilado. Qualquer uma de tal des- O-acetilação ou hiperacetilação pode ser em posições específicas no sacarídeo. Por exemplo, a maioria das cepas do serogrupo C têm grupos O- acetila na posição C-7 e/ou C-8 dos resíduos do ácido siálico, mas cerca de 15% dos isolados clínicos carecem destes grupos O-acetila [26, 27], A acetilação não parece afetar a eficácia protetiva (por exemplo, diferente do produto Menjugate®, o produto NeisVac-C® usa um sacarídeo des-O- acetilado, mas ambas as vacinas são eficazes). O sacarídeo do serogrupo W135 é um polímero de unidades dissacarídicas de ácido siálico-galactose. O sacarídeo do serogrupo Y é similar ao sacarídeo do serogrupo W135, exceto que a unidade de repetição de dissacarídeo inclui glicose ao invés de galactose. Igual aos sacarídeos do serogrupo C, os sacarídeos de MenW135 e MenY têm O-acetilação variável, mas nas posições 7 e 9 do ácido siálico [28],
[0057] O método pode incluir um antígeno de sacarídeo capsular do serogrupo A. O sacarídeo pode ser purificado e conjugado no mesmo modo como para os serogrupos C, W135 e Y (ver acima), embora o mesmo seja estruturalmente diferente - ao passo que as cápsulas dos serogrupos C, W135 e Y são fundamentadas em tomo do ácido siálico (ácido 7V-acetil- neuramínico, NeuAc), a cápsula do serogrupo A está fundamentada na N- acetil-manosamina, que é o precursor natural do ácido siálico. O sacarídeo do serogrupo A é particularmente susceptível à hidrólise, e a sua instabilidade em meios aquosos significa que (a) a imunogenicidade de vacinas líquidas contra o serogrupo A diminui com o tempo, e (b) o controle de qualidade é mais difícil, devido à liberação de produtos da hidrólise de sacarídeo dentro da vacina.
[0058] O sacarídeo capsular MenA nativo é um homopolímero de N- acetil-D-manosamina-1-fosfato ligado em (αW6), com O-acetilação parcial em C3 e C4. A ligação glicosídica principal é uma ligação 1-6 fosfodiéster envolvendo o grupo de hemiacetal de Cl e o grupo alcoólico de C6 da D- manosamina. O comprimento de cadeia médio é de 93 monômeros. A mesma tem a seguinte fórmula:
[0059] Um antígeno de sacarídeo modificado foi preparado que retém a atividade imunogênica do sacarídeo do serogrupo A nativo, mas que é muito mais estável em água. Os grupos hidroxila ligados nos carbonos 3 e 4 das unidades de monossacarídeo são substituídos por um grupo de bloqueio [refs. 29 e 30],
[0060] O número de unidades de monossacarídeo tendo grupos de bloqueio no lugar das hidroxilas pode variar. Por exemplo, todas ou substancialmente todas as unidades de monossacarídeo podem ter grupos de bloqueio. Altemativamente, pelo menos 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% ou 90% das unidades de monossacarídeo podem ter grupos de bloqueio. Pelo menos 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 ou 30 unidades de monossacarídeo podem ter grupos de bloqueio.
[0061] Do mesmo modo, o número de grupos de bloqueio em uma unidade de monossacarídeo pode variar. Por exemplo, o número de grupos de bloqueio em qualquer unidade de monossacarídeo particular pode ser 1 ou 2.
[0062] Os grupos de bloqueio para substituir grupos hidroxila podem ser diretamente acessíveis por intermédio de uma reação de derivatização do grupo hidroxila, isto é, pela substituição do átomo de hidrogênio do grupo hidroxila com um outro grupo. Os derivados adequados de grupos hidroxila que atuam como grupos de bloqueio são, por exemplo, carbamatos, sulfonatos, carbonatos, ésteres, éteres (por exemplo, éteres silílicos ou éteres alquílicos) e acetais. Alguns exemplos específicos de tais grupos de bloqueio são alila, Aloc, benzila, BOM, t-butila, tritila, TBS, TBDPS, TES, TMS, TIPS, PMB, MEM, MOM, MTM, THP, etc. Outros grupos de bloqueio que não são diretamente acessíveis e que completamente substituem o grupo hidroxila incluem alquila C1-12, alquila C3-12, arila C5-12, arila C5-12 alquila C1-6, NR'R2(R1 e R2 são definidos no parágrafo que segue), H, F, Cl, Br, CO2H, CO2(alquila Ci-6), CN, CF3, CC13, etc.
[0063] Os grupos de bloqueio típicos são da fórmula: -O-X-Y ou - OR3em que: X é C(O), S(O) ou SO2; Y é alquila C1.12, alcóxi C1.12, cicloalquila C3-12, arila C5-12 ou arila C5-12 alquila Ci_6, cada um dos quais pode ser opcionalmente substituído com 1, 2 ou 3 grupos independentemente selecionados de F, Cl, Br, CO2H, CO2(alquila CI-Ó), CN, CF3 ou CCfi; ou Y é NR2R2; R1 e R2 são independentemente selecionados de H, alquila C1.12, cicloalquila C3-12, arila C5-12, arila C5-12 alquila Ci.6; ou R1 e R2 podem ser unidos para formar um grupo heterocíclico C3-12 saturado; R3 é alquila C1-12 ou cicloalquila C3-12, cada um dos quais pode ser opcionalmente substituído com 1, 2 ou 3 grupos independentemente selecionados de F, Cl, Br, CO2(alquila Ci-6), CN, CF3 ou CC13; ou R3 é arila C5-12 ou arila C5-12 alquila Ci.6, cada um dos quais pode ser opcionalmente substituído com 1, 2, 3, 4 ou 5 grupos selecionados de F, Cl, Br, CO2H, CChCalquila CI-Ó), CN, CF3 ou CC13. Quando R3 é alquila C1-12 ou cicloalquila C3-12, 0 mesmo é tipicamente substituído com 1,2 ou 3 grupos como definidos acima. Quando R e R sao unidos para formar um grupo heterocíclico C3-12 saturado, e intencionado que R1 e R2 juntos com 0 átomo de nitrogênio formem um grupo heterocíclico saturado contendo qualquer numero de átomos de carbono entre 3 e 12 (por exemplo, C3, C4, C5, C6, C7, C8, C9, Cio, Cu, C12). O grupo heterocíclico pode conter 1 ou 2 heteroátomos (tais como N, O ou S) outros que não o átomo de nitrogênio. Os exemplos de grupos heterocíclicos C3-12 saturados são pirrolidinila, piperidinila, morfolinila, piperazinila, imidazolidinila, azetidinila e aziridinila.
[0064] Os grupos de bloqueio -O-X-Y e -OR3podem ser preparados a partir dos grupos -OH pelos procedimentos de derivatização padrão, tais como a reação do grupo hidroxila com um haleto de acila, haleto de alquila, haleto de sulfonila, etc. Consequentemente, 0 átomo de oxigênio em -O-X-Y é habitualmente 0 átomo de oxigênio do grupo hidroxila, enquanto que 0 grupo -X-Y em -O-X-Y habitualmente substitui 0 átomo de hidrogênio do grupo hidroxila.
[0065] Altemativamente, os grupos de bloqueio podem ser acessíveis por intermédio de uma reação de substituição, tal como uma substituição do tipo de Mitsonobu. Estes e outros métodos de preparar grupos de bloqueio a partir de grupos hidroxila são bem conhecidos.
[0066] Os grupos de bloqueio específicos para 0 uso na invenção são - OC(O)CF3 [31] e um grupo carbamato OC(O)NR1R2, onde R1 e R2 são independentemente selecionados de alquila C1-6. Tipicamente, R1 e R2 são ambos metila, isto é, 0 grupo de bloqueio é -OC(O)NMe2. Os grupos de bloqueio de carbamato têm um efeito estabilizante sobre a ligação glicosídica e podem ser preparados sob condições brandas.
[0067] Um grupo de bloqueio particularmente preferido é -OC(O)CH3 [30], A proporção das posições 4 e/ou 3 no sacarídeo do serogrupo A de Neisseria meningitidismodificado que têm este grupo de bloqueio pode variar. Por exemplo, a proporção das posições 4 que têm grupos de bloqueio pode ser de cerca de 0%, pelo menos 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% ou de cerca de 100%, com pelo menos 80% e cerca de 100% sendo preferidos. Similarmente, a proporção das posições 3 que têm grupos de bloqueio pode ser de cerca de 0%, pelo menos 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% ou de cerca de 100%, com pelo menos 80% e cerca de 100% sendo preferidos. Tipicamente, a proporção das posições 4 e 3 que têm grupos de bloqueio está em tomo da mesma em cada posição. Em outras palavras, a razão das posições 4 que têm grupos de bloqueio para as posições 3 que têm grupos de bloqueio está em torno de 1:1. Entretanto, em algumas modalidades, a proporção das posições 4 que têm grupos de bloqueio pode variar em relação à proporção das posições 3 que têm grupos de bloqueio. Por exemplo, a razão das posições 4 que têm grupos de bloqueio para as posições 3 que têm grupos de bloqueio pode ser de 1:20, 1:19, 1:18, 1:17, 1:16, 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3 ou 1:2. Similarmente, a razão das posições 3 que têm grupos de bloqueio para as posições 4 que têm grupos de bloqueio pode ser de 1:20, 1:19, 1:18, 1:17, 1:16, 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5,1:4, 1:3 ou 1:2.
[0068] Os sacarídeos MenA modificados típicos contêm n unidades de monossacarídeo, onde pelo menos /?% das unidades de monossacarídeo não têm grupos -OH em ambas das posições 3 e 4. O valor de h é 24 ou mais (por exemplo, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 98, 99 ou 100) e é habitualmente 50 ou mais. Os grupos -OH ausentes são grupos de bloqueio como definidos acima.
[0069] Outros sacarídeos de MenA modificados típicos compreendem unidades de monossacarídeo, em que pelo menos 5 das unidades de monossacarídeo não têm -OH na posição 3 e não têm -OH na posição 4. O valor de 5 é de pelo menos 1 (por exemplo, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90). Os grupos-OH ausentes são grupos de bloqueio como definidos acima.
[0070] Os Sacarídeos de MenA modificados adequados para o uso com a invenção têm a fórmula: em quen é um número inteiro de 1 a 100 (particularmente um número inteiro de 5 a 25, habitualmente de 15 a 25);cada grupo Z é independentemente selecionado de OH ou um grupo de bloqueio como definido acima; ecada grupo Q é independentemente selecionado de OH ou um grupo de bloqueio como definido acima;Y é selecionado de OH ou um grupo de bloqueio como definido acima;E é H ou um grupo de proteção de nitrogênio;e em que mais do que cerca de 7% (por exemplo, 8%, 9%, 10% ou mais) dos Q grupos são grupos de bloqueio. Em algumas modalidades, o grupo hidroxila ligado no carbono 1 na fórmula (A) é substituído por um grupo de bloqueio como definido acima. Em algumas modalidades, E na fórmula (B) é o ponto de ligação ao grupo ciclo-octina.
[0071] Cada um dos grupos n+2 Z podem ser os mesmos ou diferentes um do outro. Do mesmo modo, cada um dos grupos n+2 Q podem ser os mesmos ou diferentes um do outro. Todos os grupos Z podem ser OH. Alternativamente, pelo menos 10%, 20, 30%, 40%, 50% ou 60% dos grupos Z podem ser OAc. Tipicamente, cerca de 70% dos grupos Z são OAc, com o resto dos grupos Z sendo OH ou grupos de bloqueio como definidos acima. Pelo menos cerca de 7% dos grupos Q são grupos de bloqueio. Tipicamente, pelo menos 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% ou ainda 100% dos grupos Q são grupos de bloqueio.* Glicanos
[0072] O sacarídeo pode ser um glicano. Os glicanos são polissacarídeos contendo glicose encontrados inter alia nas paredes celulares fúngicas. Os a-glicanos incluem uma ou mais ligações α entre as subunidades de glicose, ao passo que os β-glicanos incluem uma ou mais ligações β entre as subunidades de glicose. O glicano usado de acordo com a invenção inclui ligações β, e pode conter apenas ligações β (isto é, nenhuma ligação a).
[0073] O glicano pode compreender uma ou mais ligações β-1,3 e/ou uma ou mais ligações β-1,6. O mesmo também pode compreender uma ou mais ligações β-1,2 e/ou ligações β-1,4, mas normalmente as suas únicas ligações β serão ligações β-1,3 e /ou ligações β-1,6.
[0074] O glicano pode ser ramificado ou linear.
[0075] Os β-glicanos de tamanho natural nativos são insolúveis e têm um peso molecular na faixa de megadalton. E preferido usar glicanos solúveis nos conjugados da invenção. A solubilização pode ser obtida pela fragmentação de glicanos insolúveis longos. Isto pode ser obtido pela hidrólise ou, mais convenientemente, pela digestão com uma glicanase (por exemplo, com uma β-l,3-glicanase ou uma β-l,6-glicanase). Como uma alternativa, glicanos curtos podem ser preparados sinteticamente pela união de blocos de ligação de monossacarídeo.
[0076] Os glicanos de peso molecular baixo são preferidos, particularmente aqueles com um peso molecular de menos do que 100 kDa (por exemplo, menos do que 80, 70, 60, 50, 40, 30, 25, 20, ou 15 kDa). Também é possível usar oligossacarídeos por exemplo, contendo 60 ou menos (por exemplo, 59, 58, 57, 56, 55, 54, 53, 52, 51, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4) unidades de glicose de monossacarídeo. Dentro desta faixa, oligossacarídeos com entre 10 e 50 ou entre 20 e 40 unidades de monossacarídeo são preferidos.
[0077] O glicano pode ser um glicano fúngico. Um ‘glicano fúngico’ no geral será obtido a partir de um fungo, mas, onde uma estrutura de 0 glicano particular é encontrada tanto em fungos quanto em não fungos (por exemplo, em bactérias, plantas inferiores ou algas) então o organismo não fúngico pode ser usado como uma fonte alternativa. Assim o glicano pode ser derivado da parede celular de um Candida,tal como C. albicans,ou de Coccidioides immitis, Trichophyton verrucosum, Blastomyces dermatidis, Cryptococcus neoformans, Histoplasma capsulatum, Saccharomyces cerevisiae, Paracoccidioides brasiliensis, owPyihiumn insidiosum.
[0078] Existem várias fontes de β-glicanos fúngicos. Por exemplo, β- glicanos puros são comercialmente disponíveis por exemplo, pustulan (Calbiochem) é um β-l,6-glicano purificado a partir de Umbilicaria papullosa.Os β-glicanos podem ser purificados das paredes celulares fúngicas em vários modos. A referência 32, por exemplo, descreve um procedimento de duas etapas para preparar um extrato de β-glicano solúvel em água a partir de Candida,isento de manana da parede celular, envolvendo a oxidação de NaClO e extração de DMSO. O produto resultante (‘β-D- glicano solúvel de Candida'’ou ‘CSBG’) é principalmente composto de um β- 1,3-glicano linear com uma porção de β-l,6-glicano linear. Similarmente, a referência 33 descreve a produção de GG-zym a partir de C.albicans. Tais glicanos de C. albicans,incluem (a) β-l,6-glicanos com cadeias laterais de β- 1,3-glicano e um grau médio de polimerização de cerca de 30, e (b) β-1,3- glicanos com cadeias laterais de β-l,6-glicano e um grau médio de polimerização de cerca de 4.
[0079] Em algumas modalidades da invenção, o glicano é um β-1,3 glicano com alguma ramificação de β-1,6, como observado por exemplo, nas laminarinas. As laminarinas são encontradas nas algas marrons e algas marinhas. As razões β(l-3):β(l-6) das laminarinas variam entre fontes diferentes por exemplo, a mesma é tão baixa quanto 3:2 na laminarina de Eisenia biciclis, mas tão alta quanto 7:1 na laminarina de Laminaria digititata [34], Assim o glicano usado com a invenção pode ter uma razão β( 1 -3):β(l-6) entre 1,5:1 e 7,5:1 por exemplo, de cerca de 2:1, 3:1, 4:1, 5:1, 6:1 ou 7:1. Opcionalmente, o glicano pode ter uma subunidade de manitol terminal, por exemplo, um resíduo de manitol ligado em 1,1-a [35], O glicano também pode compreender subunidades de mano se.
[0080] Em outras modalidades, o glicano tem exclusiva ou principalmente ligações β-1,3, como observado em curdlan. Estes glicanos podem evocar melhor proteção do que os glicanos compreendendo outras ligações, particularmente glicanos compreendendo ligações β-1,3 e uma melhor proporção de ligações β-1,6. Assim o glicano pode ser fabricado unicamente de resíduos de glicose ligados em β-1,3 (por exemplo, β-D- glicopiranoses lineares exclusivamente com ligações 1,3). Opcionalmente, embora, o glicano possa incluir resíduos de monossacarídeo que não são resíduos de glicose ligados em β-1,3 por exemplo, o mesmo pode incluir resíduos de glicose ligados em β-1,6. A razão de resíduos de glicose ligados em β-1,3 para estes outros resíduos deve ser de pelo menos 8:1 (por exemplo, ^9:1, > 10:1, > 11:1, > 12:1, > 13:1, > 14:1, > 15:1, > 16:1, > 17:1, > 18:1, > 19:1, > 20:1, > 25:1, > 30:1, > 35:1, > 40:1, > 45:1, > 50:1, > 75:1, > 100:1, etc.) e/ou existem uma ou mais (por exemplo, > 1, > 2, > 3, > 4, > 5, > 6, > 7, > 8, > 9, > 10, > 11, > 12, etc.) sequências de pelo menos cinco (por exemplo, > 5, > 6, > 7, > 8, > 9, > 10, > 11, > 12, > 13, > 14, > 15, > 16, > 17, > 18, > 19, > 20, > 30, > 40, > 50, > 60, etc.) resíduos não terminais adjacentes ligados a outros resíduos apenas pelas ligações β-1,3. Por “não terminal” é intencionado que o resíduo não esteja presente em uma extremidade livre do glicano. Em algumas modalidades, os resíduos não terminais adjacentes pode não incluir nenhum dos resíduos nos quais o grupo ciclo-octina é ligado. A presença de cinco resíduos não terminais adjacentes ligados a outros resíduos apenas pelas ligações β-1,3 pode fornecer uma resposta de anticorpo protetiva, por exemplo, contra C. albicans.
[0081] Em outras modalidades, um conjugado pode incluir dois glicanos diferentes por exemplo, um primeiro glicano tendo uma razão β(l- 3):β(l-6) dentre 1,5:1 e 7,5:1, e um segundo glicano tendo exclusiva ou principalmente ligações β-1,3. Por exemplo um conjugado pode incluir tanto um glicano de laminarina quanto um glicano de curdlan.
[0082] Onde um β-glicano inclui tanto ligações β-1,3 quanto β-1,6 em uma razão e/ou sequência então este glicano pode ser encontrado na natureza (por exemplo, uma laminarina), ou pode ser fabricado artificialmente. Por exemplo, o mesmo pode ser fabricado pela síntese química, no todo ou em parte. Os métodos para a síntese química de β-l,3/β-l,6 glicanos são conhecidos, por exemplo das referências 36, [i], [ii], [iii], [iv], [v], [vi], [vii], [viii], [ix] e -46. β-glicano incluindo tanto a ligação β-1,3 quanto a β-1,6 em uma razão desejada também pode ser fabricado partindo de um glicano disponível e tratando-o com uma β-l,6-glicanase (também conhecida como glicano endo-l,6-β-glicosidase, 1,6-β-D-glicano glicano-hidrolase, etc.; EC 3.2.1.75) ou uma β-l,3-glicanase (tal como uma exo-l,3-glicanase (EC 3.2.1.58) ou uma endo-l,3-glicanase (EC 3.2.1.39) até uma razão e/ou sequência desejadas sejam atingidas.
[0083] Quando um glicano contendo glicose unicamente ligada em β- 1,3 é desejada então o tratamento de β-l,6-glicanase pode ser seguido até a conclusão, visto que a β-l,6-glicanase eventualmente produzirá β-1,3 glicano puro. Mais convenientemente, entretanto, um β-l,3-glicano puro pode ser usado. Estes podem ser sinteticamente fabricados, pela síntese química e/ou enzimática por exemplo, usando uma (1—>3)-β-D-glicano sintase, das quais várias são conhecidas de muitos organismos (incluindo bactérias, leveduras, plantas e fungos). Os métodos para a síntese química de β-1,3 glicanos são conhecidos, por exemplo das referências 47, [x], [xi] e -50. Como uma alternativa útil para a síntese, um β-l,3-glicano natural pode ser usado, tal como um curdlan (β-1,3-glicano linear de uma Agrobacteriumpreviamente conhecida como Alcaligenes faecalis var. myxogenes; comercialmente disponível por exemplo, da Sigma-Aldrich catálogo C7821) ou paramilon (β- 1,3-glicano da Euglena). Os organismos que produzem altos níveis de β-1,3- glicanos são conhecidos na técnica por exemplo, a Agrobacteriumdas refs. 51 & 52, ou a Euglena gracilisda ref. 53.
[0084] Laminarina e curdlan são tipicamente encontrados na natureza como polímeros de alto peso molecular, por exemplo, com um peso molecular de pelo menos 100 kDa. Eles são frequentemente insolúveis em meios aquosos. Nas suas formas naturais, portanto, eles não são bem adequados para imunização. Assim a invenção pode usar um glicano mais curto por exemplo, aqueles contendo 60 ou menos unidades de glicose de monossacarídeo (por exemplo, 59, 58, 57, 56, 55, 54, 53, 52, 51, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4). Um glicano tendo vários resíduos de glicose na faixa de 2 a 60 pode ser usado por exemplo, entre 10 e 50 ou entre 20 e 40 unidades de glicose. Um glicano com 25 a 30 resíduos de glicose é particularmente útil. Os glicanos adequados podem ser formados por exemplo, pela hidrólise ácida de um glicano natural, ou pela digestão enzimática por exemplo, com uma glicanase, tal como uma β-1,3- glicanase. Um glicano com 11 a 19, por exemplo, 13 a 19 e particularmente 15 ou 17, unidades de glicose de monossacarídeo também é útil. Em particular, os glicanos com as seguintes estruturas (A) ou (B) são especificamente considerados para o uso na presente invenção:em que n+2 está na faixa de 2 a 60, por exemplo, entre 10 e 50 ou entre 2 e 40. Preferivelmente, n+2 está na faixa de 25 a 30 ou 6 a 19, por exemplo, 6 ou 13 a 17. Os inventores descobriram que n+2 = 6 é adequado. n+2 = 15 também pode ser adequadoem que n está na faixa de 0 a 9, por exemplo, entre 1 e 7 ou entre 2 e 6. Preferivelmente, n está na faixa de 3 a 4 ou 1 a 3. Os inventores descobriram que n = 2 é adequado.
[0085] Em algumas modalidades, o glicano é uma espécie molecular única. Nestas modalidades, todas as moléculas de glicano são idênticas em termos de sequência. Consequentemente, todas das moléculas de glicano são idênticas em termos de suas propriedades estruturais, incluindo peso molecular, etc. Tipicamente, esta forma de glicano é obtida pela síntese química, por exemplo, usando os métodos descritos acima. Por exemplo, a referência 48 descreve a síntese de uma única espécie ligada a β-1,3. Alternativamente, em outras modalidades, o glicano pode ser obtido a partir de um glicano natural, por exemplo, um glicano de L. digitata, Agrobacterium ou Euglena como descrito acima, com o glicano sendo purificado até que a espécie molecular única requerida seja obtida. Os glicanos naturais que foram purificados deste modo são comercialmente disponíveis. Um glicano que é uma espécie molecular única pode ser identificada medindo-se a polidispersividade (Mw/Mn) da amostra de glicano. Este parâmetro pode ser convenientemente medido pela SEC-MALLS, por exemplo como descrito na referência 54. Os glicanos adequados para o uso nesta modalidade da invenção têm uma polidispersividade de cerca de 1, por exemplo, 1,01 ou menos.
[0086] A solubilidade dos glicanos naturais, tais como curdlan, pode ser aumentada pela introdução de grupos iônicos (por exemplo, pela sulfatação, particularmente em 0-6 no curdlan). Tais modificações podem ser usadas com a invenção, mas são idealmente evitadas visto que elas podem alterar a antigenicidade do glicano.
[0087] Quando o sacarídeo é um glicano, o mesmo é tipicamente uma laminarina.
[0088] Como debatido acima, o sacarídeo também pode ser um sacarídeo capsular bacteriano. Outros sacarídeos capsulares bacterianos exemplares incluem aqueles de S', pneumoniae.Quando o sacarídeo é um dos sacarídeos capsulares de S', pneumoniae,o mesmo é tipicamente de um dos seguintes serotipos pneumocócicos: 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F e 33F, preferivelmente de 1, 5, 6B, 14, 19F e 23F. Os polissacarídeos capsulares de S. pneumoniae compreendem unidades de repetição de oligossacarídeo que podem conter até 8 resíduos de açúcar. As unidades de oligossacarídeo para os principais serotipos de S. pneumoniaesão descritos nas refs 55 e 56.
[0089] Outros sacarídeos capsulares bacterianos exemplares incluem aqueles de S', aureus,particularmente os polissacarídeos capsulares de S. aureustipo 5 e tipo 8. As estruturas dos polissacarídeos capsulares tipo 5 e tipo 8 foram descritas nas referências 57 e 58 como:Tipo 54)-β-D-ManNAcA(3OAc)-(l 4)-α-L-FucNAc(l 3)-β- D-FucNAc-(lTipo 83)-β-D-ManNAcA(4OAc)-(l 3)-a-L-FucNAc(l 3)-β- D-FucNAc-(l
[0090] Dados recentes da espectroscopia de RMN [59] tem levado a uma revisão destas estruturas para:Tipo 54)-β-D-ManNAcA-( 1 4)-α-L-FucNAc(3OAc)-(l 3)-β-D-FucNAc-(lTipo 83)-β-D-ManNAcA(4OAc)-(l 3)-α-L-FucNAc(l 3)-a- D-FucNAc(l
[0091] O polissacarídeo pode ser quimicamente modificado emrelação ao polissacarídeo capsular como encontrado na natureza.
[0092] Por exemplo, o polissacarídeo pode ser des-O-acetilado(parcial ou totalmente), des-N-acetilado (parcial ou totalmente), N- propionado (parcial ou totalmente), etc. A desacetilação pode ocorrer antes, durante ou depois da conjugação, mas tipicamente ocorre antes da conjugação. O efeito de desacetilação, etc. pode ser avaliado pelos ensaios de rotina. Por exemplo, a relevância da O-acetilação sobre os polissacarídeos capsulares tipo 5 ou tipo 8 de S. aureusé debatida na referência 60. Os polissacarídeos nativos são os ditos neste documento ter 75% de O-acetilação. Estes polissacarídeos induziram anticorpos tanto para a cadeia principal do polissacarídeo quanto para os grupos O-acetila. Os polissacarídeos com 0% de O-acetilação ainda evocaram anticorpos para a cadeia principal de polissacarídeo. Ambos os tipos de anticorpo foram opsônicos contra as cepas de S'. aureusque variaram no seu conteúdo de O-acetila. Consequentemente, os polissacarídeos capsulares tipo 5 ou tipo 8 usados na presente invenção podem ter entre 0 e 100% de O-acetilação.
[0093] O grau de O-acetilação do polissacarídeo pode ser determinado por qualquer método conhecido na técnica, por exemplo, pela RMN de próton (por exemplo, como descrito nas referências 61, 62, 63 ou 64). Um outro método é descrito na referência 65. Métodos similares podem ser usados para determinar o grau de N-acetilação do polissacarídeo. Os grupos O-acetila podem ser removidos pela hidrólise, por exemplo peto tratamento com uma base tal como hidrazina anidra [66] ou NaOH [60], Métodos similares podem ser usados para remover grupos N-acetila. Para manter altos níveis de O-acetilação nos polissacarídeos capsulares tipo 5 e/ou 8, tratamentos que levam à hidrólise dos grupos O-acetila são minimizados, por exemplo, tratamentos em extremos de pH.
[0094] Os polissacarídeos capsulares podem ser purificados pelas técnicas conhecidas, como descrito nas referências aqui. Um processo típico envolve a inativação de fenol-etanol de células de S. aureus,centrifugação, tratamento com lisoestafina, tratamento com RNase/DNase, centrifugação, diálise, tratamento com protease, outra diálise, filtração, precipitação com etanol/CaCfi, diálise, secagem por congelamento, cromatografia de troca de ânion, diálise, secagem por congelamento, cromatografia de exclusão de tamanho, diálise e secagem por congelamento [67], Um processo alternativo envolve a autoclavagem de células de S. aureus,ultrafiltração do sobrenadante contendo polissacarídeo, concentração, liofilização, tratamento com metaperiodato de sódio para remover o ácido teicoico, outra ultrafiltração, diafiltração, cromatografia líquida de exclusão de tamanho de alto desempenho, diálise e secagem por congelamento [68],
[0095] A invenção não é limitada aos polissacarídeos purificados a partir de fontes naturais, entretanto, e os polissacarídeos podem ser obtidos por outros métodos, tais como síntese total ou parcial.* Outros sacarídeos capsulares bacterianos
[0096] Outros sacarídeos capsulares bacterianos exemplares incluem aqueles de Haemophilus influenzaeTipo b, Salmonella enterica Typhi Vi e Clostridium difficile.Carboidrato de S. pyogenes (Streptococcus Grupo A ou GAS)
[0097] A invenção também pode usar sacarídeos bacterianos não capsulares. Um dos sacarídeos bacterianos não capsulares exemplares é o carboidrato de S', pyogenes GAS (também conhecido como o polissacarídeo da parede celular de GAS, ou GASP). Este sacarídeo caracteriza uma estrutura ramificada com uma cadeia principal de L-ramnopiranose (Rha/?) consistindo de ligações alfa-(1^2) e alfa-(l—>3) alternadas e resíduos de D- N-acetilglicosamina (GlcpNAc) conectados em beta-(l—>3) aos anéis de ramnose alternados ([69]).
[0098] O carboidrato GAS no geral estará na sua forma nativa, mas pode ter sido modificado. Por exemplo, o sacarídeo pode ser mais curto do que o carboidrato de GAS nativo, ou pode ser quimicamente modificado.
[0099] Assim o sacarídeo usado de acordo com a invenção pode ser um carboidrato de GAS substancialmente de tamanho natural, como encontrado na natureza, ou o mesmo pode ser mais curto do que o comprimento natural. Os polissacarídeos de tamanho natural podem ser despolimerizados para dar fragmentos mais curtos para o uso com a invenção por exemplo, pela hidrólise em ácido brando, pelo aquecimento, pela cromatografia de classificação por tamanho, etc. Um fragmento curto embora corresponda à unidade de terminal no carboidrato de GAS foi proposto para o uso em uma vacina [70], Consequentemente, fragmentos curtos são considerados na presente invenção. Entretanto, é preferido usar sacarídeos substancialmente de tamanho natural. O carboidrato de GAS tipicamente tem um peso molecular de cerca de 10, em particular cerca de 7,5 a 8,5 kDa. As massas moleculares podem ser medidas pela HPLC, por exemplo SEC-HPLC usando uma coluna TSK Gel G3000SW (Sigma) em relação a padrões de pululano, tais como aqueles disponíveis da Polymer Standard Service [71],
[00100] O sacarídeo pode ser quimicamente modificado em relação ao carboidrato de GAS como encontrado na natureza. Por exemplo, o sacarídeo pode ser des-N-acetilado (parcial ou totalmente), N-propionado (parcial ou totalmente), etc. o efeito da desacetilação, etc., por exemplo sobre a imunogenicidade, pode ser avaliado pelos ensaios de rotina.
[00101] A presente invenção refere-se em parte a um método para derivar um sacarídeo compreendendo ligar um grupo cicloalcino de oito membros ao sacarídeo.
[00102] O grupo cicloalcino de oito membros é ligado ao sacarídeo por uma ligação covalente. Tipicamente, o grupo cicloalcino de oito membros é ligado por intermédio de um espaçador. O grupo cicloalcino de oito membros tipicamente está em um terminal do espaçador. O outro terminal do espaçador tem um grupo funcional para a ligação ao sacarídeo. A natureza do grupo funcional dependerá do sacarídeo, em particular no grupo ou grupos disponíveis no sacarídeo para ligação. A ligação do grupo cicloalcino de oito membros pode ser realizada usando qualquer método adequado dependendo da natureza do sacarídeo e, quando um espaçador é usado, o grupo funcional no espaçador.
[00103] Por exemplo, se o sacarídeo contém uma amina, o espaçador pode incluir qualquer grupo funcional que permita a ligação a uma amina (por exemplo, um éster succinimidílico). Similarmente, se o sacarídeo contém um aldeído, o espaçador pode incluir qualquer grupo funcional que possibilite a ligação a um aldeído (por exemplo, uma amina).
[00104] Em algumas modalidades, o grupo cicloalcino de oito membros inclui um ou mais átomos de nitrogênio, tais como 1, 2 ou 3 átomos de nitrogênio. Em algumas modalidades, o grupo cicloalcino de oito membros é fundido a um ou mais outros sistemas de anel, tais como ciclopropano ou benzeno. Em uma modalidade preferida, o grupo cicloalcino de oito membros é fundido a um grupo ciclopropano. Em uma outra modalidade preferida, o grupo cicloalcino de oito membros é fundido a dois grupos benzeno. Nas modalidades mais preferidas, o grupo cicloalcino de oito membros é um grupo ciclo-octina.
[00105] Em uma modalidade, a ligação é realizada usando um composto tendo a fórmula X1-L-X2, onde Xi é 0 grupo cicloalcino de oito membros e X2-L é 0 espaçador. Nestas modalidades, X2 pode ser qualquer grupo que possa reagir com um grupo funcional no sacarídeo, e L é uma porção de ligação no espaçador.
[00106] Em algumas modalidades preferidas, X2 é N-oxissuccinimida. Este grupo é adequado para a ligação a uma amina em um sacarídeo. Em outras modalidades, X2 pode ser um grupo amina, que seja adequado para a ligação a um aldeído em um sacarídeo. L pode ser um alquila de cadeia reta com 1 a 10 átomos de carbono (por exemplo, Ci, C2, C3, C4, C5, CÓ, C7, Cs, C9, Cio) por exemplo, -(CH2)4- ou -(CEE)3-. L tipicamente tem fórmula -L - L2-L1-, em que L1 é carbonila, L2 é um alquila de cadeia reta com 1 a 10 átomos de carbono (por exemplo, Ci, C2, C3, C4, C5, CÓ, C7, Cs, C9, Cw) por exemplo, -(CH2)4- ou -(CH2)5- ou L2 é ausente, e L3 é -NHC(O)-, carbonila ou -O(CH3)-.
[00107] Em uma modalidade preferida, L1 é carbonila, L2 é -(CEEjs- e L3 é -NHC(O)-. Em uma outra modalidade preferida, L1 é carbonila, L é - (CH2)4- e L3 é carbonila. Em uma outra modalidade preferida, L é carbonila, L2 é ausente e L3 é -O(CH3)-.
[00114] A derivatização do sacarídeo pode ser requerido introduzir grupos funcionais tais como aminas e aldeídos. Em algumas modalidades, a ligação do grupo cicloalcino de oito membros ao sacarídeo é precedida pela oxidação do sacarídeo de modo a introduzir um grupo aldeído dentro de pelo menos um resíduo de sacarídeo no sacarídeo. Esta etapa pode envolver a introdução de mais do que um grupo aldeído dentro do sacarídeo.
[00115] Por exemplo, os sacarídeos capsulares de GBS não incluem um grupo aldeído na sua forma natural, e assim é tipicamente gerado antes da ligação do grupo ciclo-octina pela oxidação (por exemplo, oxidação com periodato) de uma porção (por exemplo, entre 5 e 40%, particularmente entre 10 e 30%, preferivelmente de cerca de 20%) dos resíduos de ácido siálico do sacarídeo [72], Altemativamente, se o método usa um sacarídeo capsular do serotipo V que é desialilado, então um grupo aldeído pode ser gerado neste sacarídeo antes da ligação do grupo cicloalcino de oito membros pela oxidação (por exemplo, oxidação com periodato) de uma porção (por exemplo, entre 5 e 40%, particularmente entre 10 e 30%, preferivelmente de cerca de 20%) dos resíduos de galactose do sacarídeo [10],
[00116] As reações típicas para produzir aldeídos incluem o uso de sais de periodato, e particularmente meta-periodatos (por exemplo, meta-periodato de sódio ou potássio por exemplo, NalCf), para oxidar grupos hidroxila [73], A pessoa habilitada seria capaz de identificar condições adequadas para a oxidação.
[00117] A oxidação do sacarídeo pode ser seguida por uma etapa de aminação redutiva, por exemplo se é desejável fornecer uma amina no sacarídeo para a ligação a um espaçador.
[00118] A aminação redutiva é uma técnica padrão na química orgânica. Em uma modalidade, um grupo aldeído no resíduo de sacarídeo reage com um grupo amina no espaçador. Isto pode ser convenientemente obtido combinando-se o polissacarídeo com o espaçador na presença de um agente redutor apropriado (por exemplo, cianoboroidretos, tais como cianoboroidreto de sódio NaBEECN; borano-piridina; triacetoxiboroidreto de sódio; resina de troca de boroidreto, etc.). Em uma outra modalidade, um grupo aldeído é convertido em um grupo amina pela aminação redutiva para fornecer um grupo amina para a ligação do espaçador. A aminação redutiva envolve amónia ou uma amina primária (NEER). Isto pode ser convenientemente obtido usando-se um sal de amónio (por exemplo, cloreto de amónio) em combinação com um agente redutor apropriado (por exemplo, como listado acima). A pessoa habilitada seria capaz de identificar as condições adequadas para a aminação redutiva. Por exemplo, os inventores descobriram que o tratamento de polissacarídeo a 10 mg/ml com proteína carreadora em uma razão de polissacarídeo:proteína de 4:1 (p/p) e NaBEECN em uma razão de polissacarídeo:NaBH3CN de 2:1 é adequado.
[00119] Quando um espaçador é usado, o derivado de sacarídeo compreenderá uma porção espaçadora. A porção espaçadora pode incluir átomos tais como carbono, hidrogênio, oxigênio e/ou nitrogênio. Os espaçadores que compreendem carbono e hidrogênio são típicos, e os espaçadores que compreendem ainda oxigênio e/ou nitrogênio também são tipicamente usados. Os espaçadores que incluem átomos de nitrogênio podem incluir um átomo de carbono ligado a um átomo de nitrogênio, que por sua vez é ligado a um segundo átomo de carbono (-C-N-C-). Os espaçadores que incluem um átomo de oxigênio tipicamente incluem o mesmo como parte de um grupo carbonila. As porções espaçadoras com um peso molecular dentre 30 e 500 Da são típicos. Os espaçadores contendo dois grupos carbonila também são típicos.
[00120] Uma porção espaçadora útil pode ser -NH-C(O)-(CH2)n-NH- C(O)-, em que n é 1, 2, 3, 4, 5, 6, 7, 8, 9 ou 10. O valor de n é tipicamente 5. O terminal -NH- neste espaçador é habitualmente ligado a um átomo de carbono da porção de polissacarídeo. O terminal -C(O)- neste espaçador é habitualmente ligado ao grupo ciclo-octina. Uma porção espaçadora preferida pode ser convenientemente introduzida por um processo envolvendo: aminação redutiva do aldeído no resíduo de sacarídeo oxidado; reação do grupo-NIU resultante com um espaçador bifuncional que é um diéster (por exemplo, um éster dissuccinimidila) de um ácido dioico (por exemplo, de ácido adípico, HOOC-(CH2)4-COOH); e aminação redutiva do produto ([74]).
[00121] Outras químicas que podem ser usadas para ligar um espaçador a um grupo -NH2 no sacarídeo, incluem:- acriloilação (por exemplo, pela reação com cloreto de acriloíla), seguida pela adição do tipo de Michael a cada um do ε-NIU ou a um -SH [75], A porção espaçadora resultante é -NH-C(O)-(CH2)2- (Propionamida).- reação com um haleto de haloacila, seguida pela reação com 0 ε-NH2 ou a um -SH [76], A porção espaçadora é -NH-C(O)-CH2-,
[00122] O método para derivar um sacarídeo de acordo com a invenção pode dar 0 sacarídeo como descrito abaixo.
[00123] A invenção fornece um derivado de sacarídeo compreendendo um grupo cicloalcino de oito membros. O derivado de sacarídeo pode incluir qualquer sacarídeo e, onde apropriado, espaçador, como esboçado acima. A invenção também fornece um derivado de sacarídeo obtido ou obtenível pelo método esboçado acima. O derivado de sacarídeo não é um sacarídeo que ocorre naturalmente.
[00124] Os derivados de sacarídeo incluem um sacarídeo capsular de Streptococcus agalactiae (“GBS”). Em modalidades particularmente preferidas, o sacarídeo é um sacarídeo capsular de Streptococcus agalactiae (“GBS”) serotipo II ou V. Em uma modalidade, o derivado de sacarídeo é um derivado de GBS tendo a seguinte estrutura:
[00125] Em uma outra modalidade, o derivado de sacarídeo é umderivado de GBS tendo a seguinte estrutura:
[00126] A invenção refere-se em parte a um método para conjugar um derivado de sacarídeo como definido acima a uma porção contendo azida, compreendendo reagir o grupo cicloalcino de oito membros com a azida para formar uma ligação de triazol. Em algumas modalidades, o derivado de sacarídeo usado no método de conjugação é produzido de acordo com os métodos descritos acima. Em particular, o derivado de sacarídeo pode ser produzido pela ligação de um grupo cicloalcino de oito membros ao sacarídeo. O método de conjugação é tipicamente realizado na ausência de um catalisador metálico, tal como um catalisador de cobre.
[00127] Os inventores descobriram que um método de conjugação adequado envolve misturar a proteína (tipicamente em uma concentração de 5 mg/ml) em solução salina tamponada com fosfato (PBS), com sacarídeo (tipicamente solubilizado em água em uma concentração de cerca de 25 a 30 mg/ml). Tipicamente, a mistura de proteína e sacarídeo será agitada por cerca de 6 a 12 horas na temperatura ambiente.
[00128] O método para conjugar um derivado de sacarídeo a uma porção contendo azida ocorre por intermédio de uma reação de [3+2] cicloadição. Esta reação é facilitada pela tensão de anel no cicloalcino de oito membros, que promove a reação de cicloadição de azida-alcino na ausência de um catalisador de cobre. Os inventores descobriram que este método de conjugação é particularmente eficiente, e é capaz de produzir conjugados em quantidades superiores às que foram obteníveis usando os métodos de conjugação clássicos. Os métodos gerais para a conjugação usando uma reação de cicloadição [3+2] são conhecidos na técnica e são descritos na referência 77.
[00129] O método para conjugar um derivado de sacarídeo a uma porção contendo azida pode dar um conjugado como descrito abaixo.
[00130] Tipicamente, a porção contendo azida é uma molécula carreadora, tal como uma proteína. A porção contendo azida pode ser fabricada de acordo com métodos conhecidos na técnica, por exemplo os métodos descritos na referência 78.
[00131] As proteínas carreadoras úteis incluem toxinas bacterianas ou toxoides, tais como toxoide da difteria ou toxoide do tétano. Fragmentos de toxinas ou toxoides também podem ser usados por exemplo, fragmento C de toxoide do tétano [79], Por exemplo, o mutante CRM197 da toxina da difteria [80-xii 82] é um útil com a invenção. Outras proteínas carreadoras adequadas incluem a proteína da membrana externa da N. meningitidis[83], peptídeos sintéticos [84,85], proteínas de choque térmico [86,87], proteínas da coqueluche [88,89], citocinas [90], linfocinas [90], hormônios [90], fatores de crescimento [90], albumina sérica humana (preferivelmente recombinante), proteínas artificiais compreendendo epítopos de célula T CD4+ humana múltipla de vários antígenos derivados de patógeno [91] tais como NI9 [92], proteína D de H. influenzae[93,94], proteína de superfície pneumocócica PspA [95], pneumolisina [96],proteínas de captação de ferro [97], toxina A ou B de C. difficile[98], exoproteína A de Pseudomonas aeruginosa recombinante (rEPA) [99], uma proteína GBS [100], etc. Em modalidades preferidas, a proteína carreadora é uma proteína de GBS, tal como GBS67 e GBS80 [101],
[00132] Tipicamente, a porção contendo azida inclui um espaçador. A azida está tipicamente presente como um grupo terminal na porção contendo azida, tal que a mesma esteja disponível para tomar parte nas reações de conjugação como aqui descritas.
[00133] Os espaçadores são usados para ligar um grupo azida à porção. Os métodos para ligar um espaçador a uma molécula carreadora, tal como uma proteína, são conhecidos na técnica (ver por exemplo, a referência 78).
[00134] O espaçador pode ser um alquila de cadeia reta com 1 a 10 átomos de carbono (por exemplo, Ci, C2, C3, C4, C5, CÓ, C7, Cs, C9, Cw) por exemplo, -(CEEjzi- ou -(CEfíjs-. Em algumas modalidades preferidas, 0 espaçador tem a fórmula -[(CH2)2O]n-, onde n é 1, 2, 3, 4, 5, 6, 7, 8, 9 ou 10. Adequadamente, n é 3.
[00135] Quando um espaçador é usado, a porção contendo azida compreenderá uma porção espaçadora. A porção espaçadora pode incluir átomos tais como carbono, hidrogênio, oxigênio e/ou nitrogênio. Os espaçadores que compreendem carbono e hidrogênio são típicos, e espaçadores que compreendem ainda oxigênio e/ou nitrogênio também são tipicamente usado. Os espaçadores que incluem átomos de nitrogênio podem incluir um átomo de carbono ligado a um átomo de nitrogênio, que por sua vez é ligado a um segundo átomo de carbono (-C-N-C-). Os espaçadores que incluem um átomo de oxigênio tipicamente incluem o mesmo como parte de um grupo carbonila. As porções espaçadoras com um peso molecular dentre 30 e 500 Da são típicos. Os espaçadores contendo dois grupos carbonila também são típicos. Uma porção espaçadora particularmente útil inclui -[(CH2)2O]n-, onde n é 1, 2, 3, 4, 5, 6, 7, 8, 9 ou 10. Adequadamente, n é 3.
[00136] Em modalidades preferidas, a porção contendo azida contém um ou mais aminoácidos derivatizados, tais como um ou mais resíduos de tirosina derivatizados. Os métodos adequados para derivar resíduos de tirosina são descritos na PCT/US2012/045549. Em modalidades preferidas, a porção contendo azida é uma proteína carreadora em que a azida é ligada à proteína por intermédio de um espaçador. A porção contendo azida pode ser uma proteína carreadora em que a azida é ligada a um resíduo de tirosina derivatizado na proteína por intermédio de um espaçador. Os inventores descobriram que ligar a azida a uma proteína carreadora por intermédio de um resíduo de tirosina na proteína é particularmente preferido. Em algumas modalidades, a porção contendo azida é uma proteína carreadora contendo pelo menos um resíduo de tirosina derivatizado tendo a seguinte estrutura, em que a azida é ligada por intermédio da 3H-l,2,4-triazol-3,5(4H)-diona:u
[00137] Por exemplo, a porção contendo azida pode ser uma proteína carreadora contendo pelo menos um resíduo de tirosina derivatizado tendo a seguinte estrutura:
[00138] A invenção também fornece porções contendo azida como aqui descritas.
[00139] A invenção refere-se em parte a um conjugado de um derivado de sacarídeo como definido acima e uma porção contendo azida como definido acima, em que o conjugado tem a fórmula R-S-T, em que R compreende um resíduo do derivado de sacarídeo, S é um grupo triazol fundido a um grupo cicloalquila de oito membros e T compreende um resíduo da porção contendo azida.
[00140] Em algumas modalidades, o grupo cicloalquila de oito membros inclui um ou mais átomos de nitrogênio, tais como 1, 2 ou 3 átomos de nitrogênio. Em algumas modalidades, o grupo cicloalquila de oito membros é fundido a um ou mais outros sistemas de anel além do grupo triazol, tais como ciclopropano ou benzeno. Em uma modalidade preferida, o grupo cicloalcino de oito membros é fundido a um grupo ciclopropano além do grupo triazol. Em uma outra modalidade preferida, o grupo cicloalcino de oito membros é fundido a dois grupos benzeno além do grupo triazol.
[00144] A porção é tipicamente uma molécula carreadora, tal como uma proteína. As proteínas carreadoras adequadas são descritas acima. O conjugado pode incluir um espaçador no resíduo do derivado de sacarídeo entre o sacarídeo e S. Por exemplo, o espaçador pode ser um espaçador como descrito acima para o derivado de sacarídeo. Além disso, ou alternativamente, o conjugado pode incluir um espaçador no resíduo da porção contendo azida entre a porção e S. Por exemplo, o espaçador pode ser um espaçador como descrito acima para a porção contendo azida. Tipicamente, o conjugado incluirá um espaçador no resíduo do derivado de sacarídeo entre o sacarídeo e S e um espaçador no resíduo da porção contendo azida entre a porção e S.
[00145] Em uma modalidade particularmente preferida, o conjugado inclui o sacarídeo de GBS serotipo V conjugado à proteína GBS80. Em uma outra modalidade particularmente preferida, o conjugado inclui sacarídeo de GBS serotipo II conjugado à proteína GBS80. Em uma outra modalidade particularmente preferida, o conjugado inclui sacarídeo de GBS serotipo V conjugado à proteína GBS67. Em uma outra modalidade particularmente preferida, o conjugado inclui sacarídeo de GBS serotipo II conjugado à proteína GBS 67.
[00147] O conjugado pode ser obtido ou obtenível pelo método para conjugar um derivado de sacarídeo a uma porção contendo azida como descrita acima.
[00148] Em algumas modalidades, os conjugados podem ter proteína carreadora em excesso (p/p) ou sacarídeo em excesso (p/p) por exemplo, na faixa de razão de 1:5 a 5:1. O conjugado pode incluir quantidades pequenas de proteína carreadora livre (isto é, não conjugada). Quando uma dada proteína carreadora está presente tanto na forma livre quanto na conjugada em uma composição da invenção, a forma não conjugada preferivelmente não é maior do que 5% da quantidade total da proteína carreadora na composição como um todo, e mais preferivelmente presente em menos do que 2% (em peso). Quando o conjugado é compreendido dentro de uma composição farmacêutica da invenção, a composição também pode compreender proteína carreadora livre como imunógeno [102], Depois da conjugação, antígenos livres e conjugados podem ser separados. Existem muitos métodos adequados por exemplo, cromatografia hidrofóbica, ultrafiltração tangencial, diafiltração, etc. [ver também as refs. 103, 104, etc.].
[00149] Da mesma forma que fornecendo conjugados individuais como descritos acima, a invenção fornece uma composição compreendendo um conjugado da invenção e um ou mais outros antígenos. A composição é tipicamente uma composição imunogênica.
[00150] As composições da invenção podem compreender ainda um ou mais outros antígenos, incluindo antígenos bacterianos, virais ou parasíticos adicionais. Estes podem ser selecionados dos seguintes: um antígeno de proteína de N. meningitidisserogrupo B, tal como aqueles nas refs. 105 a 111, com a proteína ‘287’ (ver abaixo) e derivados (por exemplo, ‘ΔG287’) sendo particularmente preferidos.uma preparação de vesícula de membrana externa (OMV) de N. meningitidisserogrupo B, tal como aquela descrita nas refs. 112, 113, 114, 115, etc.um antígeno de sacarídeo de N. meningitidisserogrupo A, C, W135 e/ou Y, tal como o oligossacarídeo descrito na ref. 116 do serogrupo C ou os oligossacarídeos da ref. 117.um antígeno de sacarídeo de Streptococcus pneumoniae[por exemplo, refs. 118 xiii 120; capítulos 22 & 23 da ref. 127],um antígeno do vírus da hepatite A, tal como o vírus inativado [por exemplo, 121, 122; capítulo 15 da ref. 127].um antígeno do vírus da hepatite B, tal como os antígenos de superfície e/ou núcleo [por exemplo, 122, 123; capítulo 16 da ref. 127],um antígeno do vírus da hepatite C [por exemplo, 124],um antígeno de Bordetella pertussis,tal como a holotoxina da coqueluche (PT) e hemaglutinina filamentosa (FHA) de B. pertussis,opcionalmente também em combinação com pertactina e/ou aglutinógenos 2 e 3 [por exemplo, refs. 125 & 126; capítulos 21 da ref. 127],um antígeno da difteria, tal como um toxoide da difteria [por exemplo, capítulo 13 da ref. 127],um antígeno do tétano, tal como um toxoide do tétano [por exemplo, capítulo 27 da ref. 127],um antígeno de sacarídeo de Haemophilus influenzaeB [por exemplo, capítulo 14 da ref. 127] um antígeno de N. gonorrhoeae [por exemplo, 105, 106, 107],um antígeno de Chlamydia pneumoniae[por exemplo, 128, 129, 130, 131, 132, 133, 134],um antígeno de Chlamydia trachomatis[por exemplo, 135], um antígeno de Porphyromonas gingivalis [por exemplo, 136], antígeno(s) da poliomielite [por exemplo, 137, 138; capítulo 24 da ref. 127] tal(is) como IPV.antígeno(s) da raiva [por exemplo, 139] tal (is) como o vírus inativado liofílizado [por exemplo, 140, RabAvert®].antígenos do sarampo, caxumba e/ou rubéola [por exemplo, capítulos 19, 20 e 26 da ref. 127],antígeno(s) da influenza [por exemplo, capítulos 17 & 18 da ref. 127], tal(is) como as proteínas de superfície da hemaglutinina e/ou neuraminidase.um antígeno de Moraxella catarrhalis [por exemplo, 141], um antígeno de Streptococcus pyogenes(estreptococos do grupo A) [por exemplo, 142, 143, 144],um antígeno de Streptococcus agalactiae (estreptococos do grupo B) [por exemplo, 145-xiv 147],um antígeno de 5. epidermidis [por exemplo, sacarídeo do tipo I, II e/ou III obtenível a partir das cepas ATCC-31432, SE-360 e SE-10 como descrito nas refs. 148, 149 e 150.
[00151] Onde um sacarídeo ou antígeno de carboidrato é usado, o mesmo é preferivelmente conjugado a um carreador de modo a realçar a imunogenicidade. A conjugação de antígenos de sacarídeo da H. influenzaeB, meningocócico e pneumocócico é bem conhecida.
[00152] Os antígenos da proteína tóxica pode ser destoxificada onde necessário (por exemplo, destoxificação da toxina da coqueluche pelos meios químicos e/ou genéticos [126]).
[00153] Onde um antígeno da difteria é incluído na composição é preferido também incluir antígeno do tétano e antígenos da coqueluche. Similarmente, onde um antígeno do tétano é incluído é preferido também incluir antígenos da difteria e coqueluche. Similarmente, onde um antígeno da coqueluche é incluído é preferido também incluir os antígenos da difteria e tétano.
[00154] Os antígenos podem ser absorvidos em um sal de alumínio. Onde existe mais do que um conjugado em uma composição, nem todos os conjugados precisam ser absorvidos.
[00155] Os antígenos na composição tipicamente estarão presentes em uma concentração de pelo menos 1 pg/ml cada um. No geral, a concentração de qualquer antígeno dado será suficiente para evocar uma resposta imune contra este antígeno.
[00156] Como uma alternativa ao uso de antígenos de proteínas na composição da invenção, o ácido nucleico que codifica o antígeno pode ser usado [por exemplo, refs. 151 a, xv, xvi, xvii, xviii, xix, xx, xxi, 159], Os componentes de proteína das composições da invenção podem assim ser substituídos pelo ácido nucleico (preferivelmente DNA por exemplo, na forma de um plasmídeo) que codifica a proteína. Em termos práticos, pode haver um limite superior ao número de antígenos incluídos nas composições da invenção. O número de antígenos em uma composição da invenção pode ser menor do que 20, menor do que 19, menor do que 18, menor do que 17, menor do que 16, menor do que 15, menor do que 14, menor do que 13, menor do que 12, menor do que 11, menor do que 10, menor do que 9, menor do que 8, menor do que 7, menor do que 6, menor do que 5, menor do que 4, ou menor do que 3. O número de antígenos em uma composição da invenção pode ser menor do que 6, menor do que 5, ou menor do que 4.
[00157] A invenção fornece processos para preparar composições farmacêuticas, compreendendo as etapas de misturar conjugado da invenção com um carreador farmaceuticamente aceitável. Os ‘carreadores farmaceuticamente aceitáveis’ típicos incluem qualquer carreador que por si só não induz a produção de anticorpos nocivos para o indivíduo que receber a composição. Os carreadores adequados são tipicamente macromoléculas grandes, lentamente metabolizadas tais como proteínas, sacarídeos, ácidos polilácticos, ácidos poliglicólicos, aminoácidos poliméricos, copolímeros de aminoácido, lactose, e agregados lipídicos (tais como gotículas de óleo ou lipossomas). Tais carreadores são bem conhecidos por aqueles de habilidade comum na técnica. As vacinas também podem conter diluentes, tais como água, solução salina, glicerol, etc. Adicionalmente, substâncias auxiliares tais como agentes umectantes ou emulsificantes, substâncias tamponantes de pH, e os semelhantes, podem estar presentes. Solução salina fisiológica estéril isenta de pirógeno, tamponada com fosfato é um carreador típico. Um debate completo de excipientes farmaceuticamente aceitáveis está disponível na referência 160.
[00158] As composições da invenção podem estar na forma aquosa (isto é, soluções ou suspensões) ou em uma forma seca (por exemplo, liofilizada). Se uma vacina seca é usada então a mesma será reconstituída em um meio líquido antes da injeção. A liofilização de vacinas conjugadas é conhecida na técnica por exemplo, o produto Menjugate® é apresentado na forma liofilizada, ao passo que NeisVac-C® e Meningitec® são apresentados na forma aquosa. Para estabilizar os conjugados durante a liofilização, pode ser típico incluir um álcool de açúcar (por exemplo, manitol) ou um dissacarídeo (por exemplo, sacarose ou trealose) por exemplo, entre 1 mg/ml e 30 mg/ml (por exemplo, em tomo de 25 mg/ml) na composição.
[00159] As composições farmacêuticas podem ser embaladas em frascos ou em seringas. As seringas podem ser fornecidas com ou sem agulhas. Uma seringa incluirá uma dose única da composição, ao passo que um frasco pode incluir uma dose única ou doses múltiplas.
[00160] As composições aquosas de sacarídeos da invenção são adequadas para reconstituir outras vacinas a partir de uma forma liofilizada. Onde uma composição da invenção deva ser usada para tal reconstituição extemporânea, a invenção fornece um processo para reconstituir uma tal vacina liofilizada, compreendendo a etapa de misturar o material liofilizado com uma composição aquosa da invenção. O material reconstituído pode ser usado para injeção.
[00161] As composições da invenção podem ser embaladas na forma de dose unitária ou na forma de dose múltipla. Para as formas de dose múltipla, frascos são preferidos às seringas preenchidas. Os volumes de dosagem eficazes podem ser rotineiramente estabelecidos, mas uma dose humana típica da composição tem um volume de 0,5 ml por exemplo, para a injeção intramuscular.
[00162] O pH da composição é tipicamente entre 6 e 8, por exemplo, cerca de 7. pH estável pode ser mantido pelo uso de um tampão. Se uma composição compreende um sal de hidróxido de alumínio, é típico usar um tampão de histidina [161], A composição pode ser estéril e/ou isenta de pirógeno. As composições da invenção podem ser isotônicas com respeito aos seres humanos.
[00163] As composições da invenção são imunogênicas, e são mais preferivelmente composições de vacina. As vacinas de acordo com a invenção podem ser profiláticas (isto é, prevenir a infecção) ou terapêutica (isto é, tratar a infecção), mas tipicamente será profilática. As composições imunogênicas usadas como vacinas compreendem uma quantidade imunologicamente eficaz de antígeno(s), assim como quaisquer outros componentes, como necessários. Por ‘quantidade imunologicamente eficaz’, é intencionado que a administração desta quantidade a um indivíduo, em uma dose única ou como parte de uma série, é eficaz para o tratamento ou prevenção. Esta quantidade varia dependendo da condição de saúde ou física do indivíduo a ser tratado, idade, do grupo taxonômico do indivíduo a ser tratado (por exemplo, primata não humano, primata, etc.), da capacidade do sistema imune do indivíduo para a síntese de anticorpos, do grau de proteção desejado, da formulação da vacina, da avaliação do médico da situação médica, e outros fatores relevantes. É esperado que a quantidade caia em uma faixa relativamente ampla que pode ser determinada através de testes de rotina.
[00164] Dentro de cada dose, a quantidade de um antígeno de sacarídeo individual no geral será entre 1 e 50 pg (medida como massa de sacarídeo) por exemplo, de cerca de 1 pg, cerca de 2,5 pg, cerca de 4 pg, cerca de 5 pg, ou cerca de 10 pg.
[00165] As composições da invenção podem ser preparadas em várias formas. Por exemplo, as composições podem ser preparadas como injetáveis, como soluções ou suspensões líquidas. A composição pode ser preparada para a administração pulmonar por exemplo, como um inalador, usando um pó fino ou uma pulverização. A composição pode ser preparada como um supositório ou pessário. A composição pode ser preparada para a administração nasal, aural ou ocular por exemplo, como pulverização, gotas, gel ou pó [por exemplo, refs 162 & 163], Sucesso com a administração nasal de sacarídeos pneumocócicos [164, 165], sacarídeos Hib [166], sacarídeos MenC [167], e misturas de sacarídeos conjugados Hib e MenC [168] foi relatado.
[00166] As composições da invenção podem incluir um antimicrobiano, particularmente quando embalado no formato de dose múltipla.
[00167] As composições da invenção podem compreender detergente por exemplo, um Tween (polissorbato), tal como Tween 80. Os detergentes estão no geral presentes em níveis baixos por exemplo, < 0,01%.
[00168] As composições da invenção podem incluir sais de sódio (por exemplo, cloreto de sódio) para dar tonicidade. Uma concentração de 10 ± 2 mg/ml de NaCl é típica.
[00169] As composições da invenção no geral incluirão um tampão. Um tampão de fosfato é típico.
[00170] As composições da invenção no geral serão administradas em conjunção com outros agentes imunorreguladores. Em particular, as composições habitualmente incluirão um ou mais adjuvantes. Tais adjuvantes incluem, mas não são limitados a:
[00171] As composições contendo mineral adequadas para o uso como adjuvantes na invenção incluem sais minerais, tais como sais de alumínio e sais de cálcio. A invenção inclui sais minerais tais como hidróxidos (por exemplo, óxi-hidróxidos), fosfatos (por exemplo, hidroxifosfatos, ortofosfatos), sulfatos, etc. [por exemplo, capítulos 8 & 9 da ref. 169], ou misturas de compostos minerais diferentes (por exemplo, uma mistura de um adjuvante de fosfato e um de hidróxido, opcionalmente com um excesso do fosfato), com os compostos tomando qualquer forma adequada (por exemplo, gel, cristalina, amorfa, etc.), e com absorção para o(s) sal(is) sendo típica. As composições contendo mineral também podem ser formuladas como uma partícula de sal metálico [170],
[00172] Os sais de alumínio podem ser incluídos nas vacinas da invenção tal que a dose de Al3+ esteja entre 0,2 e 1,0 mg por dose.
[00173] Um adjuvante de fosfato de alumínio típico é hidroxifosfato de alumínio amorfo com razão molar de PO4/AI entre 0,84 e 0,92, incluído a 0,6 mg de Al3+/ml. A absorção com uma dose baixa de fosfato de alumínio pode ser usada por exemplo, entre 50 e 100 pg de Al3+ por conjugado por dose. Onde um alumínio fosfato é usado e é desejado não absorver um antígeno para 0 adjuvante, isto é favorecido pela inclusão de ions fosfato livres na solução (por exemplo, pelo uso de um tampão de fosfato).
[00174] As composições de emulsão oleosa adequadas para o uso como adjuvantes na invenção incluem emulsões de esqualeno-água, tal como MF59 (5% de Esqualeno, 0,5% de Tween 80, e 0,5% de Span 85, formulada em partículas submícron usando um microfluidizador) [Capítulo 10 da ref. 169; também refs. 171-xxii 173], MF59 é usado como o adjuvante na vacina de subunidade trivalente do vírus da gripe FLUAD®.
[00175] Os adjuvantes particularmente úteis para o uso nas composições são emulsões de óleo em água submícron. As emulsões de óleo em água submícron preferidas para o uso aqui são emulsões de esqualeno/ água opcionalmente contendo quantidades variáveis de MTP-PE, tais como uma emulsão de óleo em água submícron contendo de 4 a 5% p/v de esqualeno, de 0,25 a 1,0% p/v de Tween 80 (monooleato de polioxietilenossorbitano), e/ou de 0,25 a 1,0% de Span 85 (trioleato de sorbitano), e, opcionalmente, N-acetilmuramil-L-alanil-D-isogluataminil-L- alanina-2-(r-2’-dipalmitoil-s77-glicero-3-hidroxifosfoorilóxi)-etilamina (MTP-PE). As emulsões de óleo em água submícron, os métodos de fabricar as mesmas e agentes imunoestimuladores, tais como peptídeos de muramila, para o uso nas composições, são descritos em detalhes nas referências 171 & 174-175.
[00176] Adjuvante de Freund completo (CFA) e adjuvante de Freund incompleto (IFA) também podem ser usados como adjuvantes na invenção.
[00177] As formulações de saponina também podem ser usadas como adjuvantes na invenção. As saponinas são um grupo heterólogo de glicosídeos de esterol e glicosídeos triterpenoides que são encontrados na casca, folhas, hastes, raízes e mesmo nas flores de uma ampla faixa de espécies de planta. As saponinas isoladas da casca da árvore Quillaia saponariaMolina foi amplamente estudada como adjuvantes. A saponina também pode ser comercialmente obtida a partir da Smilax ornata (salsaparrilha), Gypsophilla paniculata (véu de noivas), e Saponaria officianalis (raiz sabão). As formulações adjuvantes de saponina incluem formulações purificadas, tais como QS21, assim como formulações lipídicas, tais como ISCOMs.
[00178] As composições de saponina foram purificadas usando HPLC e RP-HPLC. As frações purificadas específicas usando estas técnicas foram identificadas, incluindo QS7, QS17, QS18, QS21, QH-A, QH-B e QH-C. Preferivelmente, a saponina é QS21. Um método de produção de QS21 é descrito na ref 176. As formulações de saponina também podem compreender um esterol, tal como colesterol [177],
[00179] As combinações de saponinas e colesteróis podem ser usadas para formar partículas únicas chamadas de complexos de imunoestimulação (ISCOMs) [capítulo 23 da ref. 169], ISCOMs tipicamente também incluem um fosfolipídeo tal como fosfatidiletanolamina ou fosfatidilcolina. Qualquer saponina conhecida pode ser usada em ISCOMs. Preferivelmente, o ISCOM inclui um ou mais de QuilA, QHA e QHC. Os ISCOMs são descritos ainda nas refs. 177-xxiii-179. Opcionalmente, os ISCOMS podem ser destituídos de detergente(s) adicional(is) [180],
[00180] Uma revisão do desenvolvimento de adjuvantes com base em saponina pode ser encontrada nas refs. 181 & 182.
[00181] Virossomas e partículas iguais a vírus (VLPs) também podem ser usados como adjuvantes na invenção. Estas estruturas no geral contêm uma ou mais proteínas de um vírus opcionalmente combinado ou formulado com um fosfolipídeo. Eles são no geral não patogênicos, não replicativos e no geral não contêm nenhum dos genomas virais nativos. As proteínas virais podem ser recombinantemente produzidas ou isoladas dos vírus inteiros. Estas proteínas virais adequadas para o uso em virossomas ou VLPs incluem proteínas derivadas do vírus da influenza (tais como HA ou NA), vírus da Hepatite B (tal como proteínas de núcleo e capsídicas), vírus da Hepatite E, vírus do sarampo, vírus Sindbis, Rotavirus, vírus da Doença da Febre Aftosa, Retrovirus, vírus Norwalk, vírus do papiloma humano, HIV, fagos de RNA, fago QB (tal como proteínas de revestimento), fago GA, fago fr, fago AP205, e Ty (tal como proteína pl de retrotransposon Ty). VLPs são debatidos ainda nas refs. 183-xxiv, xxv, xxvi, xxvii 188. Virossomas são debatidos ainda, por exemplo, na ref. 189.
[00182] Os adjuvantes adequados para o uso na invenção incluem derivados bacterianos ou microbianos tais como derivados não tóxicos de lipossacarídeo enterobacteriano (LPS), derivados de Lipídeo A, oligonucleotídeos imunoestimulatórios e toxinas de ribosilação de ADP e derivados destoxificados dos mesmos.
[00183] Os derivados não tóxicos de LPS incluem monofosforil lipídeo A (MPL) e MPL 3-O-desacilado (3dMPL). 3dMPL é uma mistura de monofosforil lipídeo A 3 des-O-acilado com 4, 5 ou 6 cadeias aciladas. Uma forma de “partícula pequena” preferida de monofosforil lipídeo A 3 des-O- acilado é descrita na ref. 190. Tais “partículas pequenas” de 3dMPL são pequenas o bastante para serem filtradas estéreis através de uma membrana de 0,22 pm [190], Outros derivados de LPS não tóxicos incluem imitações de monofosforil lipídeo A, tais como derivados de aminoalquil glicosaminida fosfato por exemplo, RC-529 [191,192],
[00184] Os derivados de Lipídeo A incluem derivados de lipídeo A de Escherichia coli tais como OM-174. OM-174 é descrito por exemplo nas refs. 193 & 194.
[00185] Os oligonucleotídeos imunoestimuladores adequados para o uso como adjuvantes na invenção incluem sequências de nucleotídeo contendo um motivo de CpG (uma sequência de dinucleotídeo contendo uma citosina desmetilada ligada por uma ligação de fosfato a uma guanosina). Os RNAs de filamento duplo e oligonucleotídeos contendo sequências palindrômicas ou poli(dG) também foram mostradas ser imunoestimuladoras.
[00186] Os CpG’s podem incluir modificações/análogos de nucleotídeo tais como modificações de fosforotioato e podem ser de filamento duplo ou de filamento único. As referências 195, 196 e 197 descrevem substituições análogas possíveis por exemplo, a substituição de guanosina com 2’-desóxi-7-desazaguanosina. O efeito adjuvante de oligonucleotídeos de CpG é debatido ainda nas refs. 198- xxviii, xxix, xxx, xxxi 203.
[00187] A sequência de CpG pode ser direcionada a TLR9, tal como o motivo GTCGTT ou TTCGTT [204], A sequência CpG pode ser específica para induzir uma resposta imune Thl, tal como um CpG-A ODN, ou pode ser mais específica para induzir uma resposta de célula B, uma tal CpG-B ODN. CpG-A e CpG-B ODNs são debatidos nas refs. 205- xxxii 207. Preferivelmente, a CpG é uma CpG-A ODN.
[00188] Preferivelmente, o oligonucleotídeo CpG é construído de modo que a extremidade 5’ seja acessível para o reconhecimento de receptor. Opcionalmente, duas sequências de oligonucleotídeo CpG podem ser ligadas nas suas extremidades 3’ para formar “imunômeros” (por exemplo, refs. 204 & 208- xxxiii 210).
[00189] As toxinas de ribosilação de ADP bacteriana e seus derivados destoxifícados podem ser usados como adjuvantes na invenção. Preferivelmente, a proteína é derivada da E. coli (enterotoxina instável ao calor da E. coli “LT”), cólera (“CT”), ou coqueluche (“PT”). O uso de toxinas de ribosilação de ADP destoxificadas como adjuvantes mucósicos é descrito na ref. 211 e como adjuvantes parenterais na ref. 212. A toxina ou toxoide está preferivelmente na forma de uma holotoxina, compreendendo as subunidades tanto A quanto B. Preferivelmente, a subunidade A contém uma mutação de destoxifícação; preferivelmente a subunidade B não é mutada. Preferivelmente, o adjuvante é um mutante LT destoxificado tal como LT- K63, LT-R72 e LT-G192. O uso de toxinas de ribosilação de ADP e seus derivados destoxificados, particularmente LT-K63 e LT-R72, como adjuvantes pode ser encontrado nas refs. 213-, xxxiv, xxxv, xxxvi, xxxvii, xxxviii, xxxix e 220. A referência numérica para as substituições de aminoácido está preferivelmente fundamentada nos alinhamentos das subunidades A e B das toxinas de ribosilação de ADP apresentadas na ref 221, aqui especificamente incorporadas por referência na sua totalidade.
[00190] Imunomoduladores humanos adequados para o uso como adjuvantes na invenção incluem citocinas, tais como interleucinas (por exemplo, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 [222], etc.) [223], interferons (por exemplo, interferon-y), fator estimulador de colônia de macrófago, e fator de necrose de tumor.
[00191] Bioadesivos e mucoadesivos também podem ser usados como adjuvantes na invenção. Os bioadesivos adequados incluem microesferas de ácido hialurônico esterificado [224] ou mucoadesivos tais como derivados reticulados do poli(ácido acrílico), álcool polivinílico, polivinilpirrolidona, polissacarídeos e carboximetilcelulose. Quitosano e seus derivados também podem ser usados como adjuvantes na invenção [225],
[00192] Micropartículas também podem ser usadas como adjuvantes na invenção. As micropartículas (isto é, uma partícula de -100 nm a -150 pm no diâmetro, mais preferivelmente -200 nm a -30 pm no diâmetro, e o mais preferivelmente de -500 nm a -10 pm no diâmetro) formadas a partir de materiais que são biodegradáveis e não tóxicos (por exemplo, um poli(ácido a-hidróxi), um ácido poli-hidroxibutírico, um poliortoéster, um polianidrido, uma policaprolactona, etc.), com poli(lactídeo-co-glicolídeo) são preferidos, opcionalmente tratados para ter uma superfície negativamente carregada (por exemplo, com SDS) ou uma superfície positivamente carregada (por exemplo, com um detergente catiônico, tal como CTAB).Lipossomas (Capítulos 13 & 14 da ref.)
[00193] Os exemplos de formulações de lipossoma adequadas para o uso como adjuvantes são descritos nas refs. 226- xl 228.Formulações de éter de polioxietileno e éster de polioxietileno
[00194] Os adjuvantes adequados para o uso na invenção incluem éteres de polioxietileno e ésteres de polioxietileno [229], Tais formulações incluem ainda tensoativos de éster de polioxietileno sorbitano em combinação com um octoxinol [230] assim como éteres alquílicos de polioxietileno ou tensoativos de éster em combinação com pelo menos um tensoativo não iônico adicional tal como um octoxinol [231], Os éteres de polioxietileno preferidos são selecionados dos seguintes grupos: éter polioxietileno-9- laurílico (lauret 9), éter polioxietileno-9-esteorílico, éter polioxietileno-8- esteorílico, éter polioxietileno-4-laurílico, éter polioxietileno-35-laurílico, e éter polioxietileno-2 3 -1 aurílico.
[00195] As formulações de PCPP são descritas, por exemplo, nas refs. 232 e 233.
[00196] Os exemplos de peptídeos de muramila adequados para o uso como adjuvantes na invenção incluem N-acetil-muramil-L-treonil-D- isoglutamina (thr-MDP), N-acetil-normuramil-L-alanil-D-isoglutamina (nor- MDP), e N-acetilmuramil-L-alanil-D-isoglutaminil-L-alanina-2-(r-2’- dipalmitoil-sw-glicero-3-hidroxifosforilóxi)-etilaminaMTP-PE).
[00197] Os exemplos de compostos de imidazoquinolona adequados para o uso como adjuvantes na invenção incluem Imiquamod e seus homólogos (por exemplo. “Resiquimod 3M”), descrito ainda nas refs. 234 e 235.
[00198] Os exemplos de compostos de tiossemicarbazona, assim como métodos de formulação, fabricação, e triagem para os compostos todos adequados para o uso como adjuvantes na invenção incluem aqueles descritos in ref 236. As tiossemicarbazonas são particularmente eficazes na estimulação das células mononucleares do sangue periférico humano para a produção de citocinas, tais como TNF-a.
[00199] Os exemplos de compostos de triptantrina, assim como métodos de formulação, fabricação, e triagem para os compostos todos adequados para o uso como adjuvantes na invenção incluem aqueles descritos na ref. 237. Os compostos de triptantrina são particularmente eficazes na estimulação de células mononucleares do sangue periférico humano para a produção de citocinas, tais como TNF-a.
[00200] A invenção também pode compreender combinações de aspectos de um ou mais dos adjuvantes identificados acima. Por exemplo, as seguintes combinações podem ser usadas como composições adjuvantes na invenção: (1) uma saponina e uma emulsão de óleo em água [238]; (2) uma saponina (por exemplo, QS21) + um derivado não tóxico de LPS (por exemplo, 3dMPL) [239]; (3) uma saponina (por exemplo, QS21) + um derivado não tóxico de LPS (por exemplo, 3dMPL) + um colesterol; (4) uma saponina (por exemplo, QS21) + 3dMPL + IL-12 (opcionalmente + um esterol) [240]; (5) combinações de 3dMPL com, por exemplo, QS21 e/ou emulsões de óleo em água [241]; (6) SAF, contendo 10% de esqualano, 0,4% de Tween 80®, 5% de plurônico-polímero de bloco LI21, e thr-MDP, microfluidizado em uma emulsão submícron ou turbilhonado para gerar uma emulsão de tamanho de partícula maior. (7) sistema de adjuvante Ribi® (RAS), (Ribi Immunochem) contendo 2% de esqualeno, 0,2% de Tween 80, e um ou mais componentes de parede de célula bacteriana do grupo consistindo de monofosforilipídeo A (MPL), dimicolato de trealose (TDM), e esqueleto de parede celular (CWS), preferivelmente MPL + CWS (Detox®); e (8) um ou mais sais minerais (tais como um sal de alumínio) + um derivado não tóxico de LPS (tal como 3dMPL).
[00201] Outras substâncias que atuam como agentes imunoestimuladores são descritos no capítulo 7 da ref. 169.
[00202] O uso de adjuvantes de sal de alumínio é particularmente útil, e antígenos são no geral absorvidos em tais sais. Os conjugados Menjugate® e NeisVac® usam um adjuvante de hidróxido, ao passo que Meningitec® usa um adjuvante de fosfato. E possível nas composições da invenção absorver alguns antígenos em um hidróxido de alumínio, mas ter outros antígenos em associação com um fosfato de alumínio. Tipicamente, entretanto, apenas um único sal é usado, por exemplo, um hidróxido ou um fosfato, mas não ambos. Nem todos os conjugados precisam ser absorvidos, isto é, um pouco ou todo pode estar livre em solução.
[00203] A invenção também fornece um método para incitar uma resposta imune em um mamífero, compreendendo administrar uma composição farmacêutica da invenção ao mamífero. A resposta imune é preferivelmente protetiva e preferivelmente envolve anticorpos. O método pode incitar uma resposta mais reforçada.
[00204] O mamífero é preferivelmente um ser humano. Onde a vacina é para uso profilático, o ser humano é preferivelmente uma criança (por exemplo, um bebê ou criança jovem) ou um adolescente; onde a vacina é para uso terapêutico, o ser humano é preferivelmente um adulto. Uma vacina intencionada para crianças também pode ser administrada aos adultos por exemplo, para avaliara a segurança, dosagem, imunogenicidade, etc. Uma classe preferida de seres humanos para o tratamento são pacientes em risco de infecção nosocomial, particularmente aqueles com doença renal em estágio terminal e/ou em hemodiálise. Outros pacientes em risco de infecção nosocomial também são preferidos, por exemplo, pacientes imunodefícientes ou aqueles que passaram por cirurgia, especialmente cirurgia cardíaca, ou trauma. Uma outra classe preferida de seres humanos para o tratamento são pacientes em risco de bacteremia.
[00205] A invenção também fornece uma composição da invenção para o uso como um medicamento. O medicamento é preferivelmente capaz de incitar uma resposta imune em um mamífero (isto é, o mesmo é uma composição imunogênica) e é mais preferivelmente uma vacina.
[00206] A invenção também fornece o uso de um conjugado da invenção na fabricação de um medicamento para incitar uma resposta imune em um mamífero.
[00207] Estes usos e métodos são preferivelmente para a prevenção e/ou tratamento de uma doença causada pela 5. agalactiae por exemplo, septicemia ou bacteremia neonatais, pneumonia neonatal, meningite neonatal, endometrite, osteomielite, artrite séptica, etc.
[00208] O indivíduo no qual a doença é prevenida pode não ser o mesmo como o indivíduo que recebe o conjugado da invenção. Por exemplo, um conjugado pode ser administrado a uma mulher (antes ou durante a gravidez) de modo a proteger o rebento (chamada de ‘imunização maternal’ [242- xli 244]).
[00209] Um modo de checar a eficácia do tratamento terapêutico envolve monitorar a infecção por GBS depois da administração da composição da invenção. Um modo de checar a eficácia do tratamento profilático envolve monitorar as respostas imunes contra os antígenos de GBS depois da administração da composição.
[00210] A composições preferidas da invenção podem conferir um título de anticorpo em um paciente que seja superior ao critério para a seroproteção para cada componente antigênico para uma porcentagem aceitável de indivíduos humanos. Os antígenos com um título de anticorpo associado acima do qual um hospedeiro é considerado estar seroconvertido contra o antígeno são bem conhecidos, e tais títulos são publicados pelas organizações tais como WHO. Preferivelmente mais do que 80% de uma amostra estatisticamente signifícante de indivíduos são seroconvertidos, mais preferivelmente mais do que 90%, ainda mais preferivelmente mais do que 93% e o mais preferivelmente de 96 a 100%.
[00211] As composições da invenção no geral serão administradas diretamente a um paciente. A liberação direta pode ser realizada pela injeção parenteral (por exemplo, subcutânea, intraperitoneal, intravenosa, intramuscularmente, ou ao espaço intersticial de um tecido), ou pela administração retal, oral, vaginal, tópica, transdérmica, intranasal, ocular, auricular, pulmonar ou outra mucosa. A administração intramuscular à coxa ou ao braço é preferido. A injeção pode ser por intermédio de uma agulha (por exemplo, uma agulha hipodérmica), mas injeção isenta de agulha pode ser altemativamente usada. Uma dose intramuscular típica é de 0,5 ml.
[00212] A invenção pode ser usada para evocar imunidade sistêmica e/ou da mucosa.
[00213] O tratamento de dosagem pode ser um programa de dose única ou um programa de dose múltipla. As doses múltiplas podem ser usadas em um programa de imunização primária e/ou em um programa de imunização de reforço. Um programa de dose primária pode ser seguido por um programa de dose de reforço. O intervalo de tempo adequado entre as doses de pré- ativação (por exemplo, entre 4 e 16 semanas), e entre a pré-ativação e reforço, pode ser rotineiramente determinado.
[00214] A prática da presente invenção utilizará, a menos que de outro modo indicado, métodos convencionais da química, bioquímica, biologia molecular, imunologia e farmacologia, dentro da habilidade da técnica. Tais técnicas são totalmente explicadas na literatura (por exemplo, refs. 245- xlii xlii xliii xliv xlv xlvi xlvii 252, etc.).
[00215] O termo “compreendendo” abrange “incluindo” assim como “consistindo” por exemplo, uma composição “compreendendo” X pode consistir exclusivamente de X ou pode incluir alguma coisa mais por exemplo, X + Y. Em algumas implementações, o termo “compreendendo” se refere à inclusão do agente ativo indicado, tal como os polipeptídeos citados, assim como a inclusão de outros agentes ativos, e carreadores, excipientes, emolientes, estabilizadores, etc. farmaceuticamente aceitáveis, como são conhecidos na indústria farmacêutica. Em algumas implementações, o termo “consistindo essencialmente de” se refere a uma composição, cujo único ingrediente ativo é o(s) ingrediente(s) ativo(s) indicado(s), entretanto, outros compostos podem ser incluídos que são para estabilizar, preservar, etc. a formulação, mas não estão envolvidos diretamente no efeito terapêutico do ingrediente ativo indicado. O uso da frase transicional “consistindo essencial?’ significa que o escopo de uma reivindicação deve ser interpretado para abranger os materiais ou etapas especificados citados nas reivindicações, e aqueles que não afetam materialmente a(s) característica(s) básica(s) e nova(s) da invenção reivindicada. Ver, In re Herz, 537 F, 2d 549, 551-52, 190 USPQ 461, 463 (CCPA 1976); ver também MPEP § 2111.03. Assim, o termo “consistindo essencialmente de” quando usado em uma reivindicação desta invenção não é intencionado a ser interpretado ser equivalente a “compreendendo”.
[00216] O termo “cerca de” em relação a um valor numérico x significa, por exemplo, x +J0%.
[00217] A palavra “substancialmente” não exclui “completamente” por exemplo, uma composição que é “substancialmente isenta” de Y pode ser completamente isenta de Y. Onde necessário, a palavra “substancialmente” pode ser omitida da definição da invenção.
[00218] Onde a invenção fornece um processo envolvendo etapas sequenciais múltiplas, a invenção também pode fornecer um processo envolvendo menos do que o número total de etapas. As etapas diferentes podem ser realizadas em tempos muito diferentes por pessoas diferentes em lugares diferentes (por exemplo, em países diferentes).
[00219] Serpa avaliado que os anéis de açúcar podem existir na forma aberta e fechada e que, embora as formas fechadas sejam aqui mostradas nas fórmulas estruturais, as formas abertas também são abrangidas pela invenção. Similarmente, será avaliado que os açúcares podem existir nas formas de piranose e furanose e que, embora as fonnas de piranose sejam aqui mostradas nas fórmulas estruturais, as fonnas de furanose também são abrangidas. As formas anoméricas diferentes de açúcares também são abrangidas.
[00220] Os sacarídeos de GBS serotipos II e V foram reagidos com NaIO4 para efetuar a oxidação de resíduos do ácido siálico para grnpos aldeído. O grau de oxidação das porções de sialila foi controlado variando-se a quantidade de NaIO4 usada. A aminação redutiva dos aldeídos forneceu grupos amina para a inserção de espaçadores diferentes, facilitando a ligação do grupo ciclo-octina aos sacarídeos. Vários compostos contendo ciclo-octina foram testados para estabelecer o tamanho ideal para o espaçador, como mostrado na Figura 1.
[00221] As reações foram monitoradas pela espectroscopia de RMN e as recuperações de carboidrato foram quantificadas usando a determinação colorimétrica do ácido siálico. A Figura 2 apresenta um esquema de reação geral para a ligação de um grupo ciclo-octina a um sacarídeo de GBS serotipo II.
[00222] Usando este método, dois derivados de sacarídeo foram produzidos, como mostrado na Figura 3 (sacarídeo de GBS serotipo V com grupo ciclo-octina ligado (I)) e Figura 4 (sacarídeo de GBS serotipo II com grupo ciclo-octina ligado (II)).
[00223] A quantidade de cada reagente usado na síntese do sacarídeode GBS serotipo V com grupo ciclo-octina ligado (I) foi como segue:
[00224] A quantidade de cada reagente usado na síntese de sacarídeode GBS serotipo II com grupo ciclo-octina ligado (II) foi como segue:
[00225] Um outro derivado de sacarídeo foi produzido como mostrado na Figura 10 (sacarídeo MenY com grupo ciclo-octina ligado (III)).
[00226] Os derivados de sacarídeo também foram sintetizados usando os outros dois sistemas de cicloalcino mostrados na Figura 1.
[00227] Espaçadores que possibilitam a conjugação da proteína (GBS60 ou GBS67) foram instalados pela reação do tipo de Mannich loco dirigida na tirosina usando os procedimentos descritos na PCT/US2012/045549, produzindo a proteína carreadora ligada a um grupo azida terminal. A proteína carreadora-azida foi reagida com o sacarídeo-ciclo- octina para efetuar uma reação de cicloadição de azida-alcino, produzindo o conjugado de proteína carreadora-sacarídeo. A Figura 5 apresenta um esquema de reação geral para a conjugação de derivado de sacarídeo (II) a uma proteína carreadora GBS80 por intermédio de um resíduo de tirosina.
[00228] Oito conjugados contendo proteína GBS diferentes foram sintetizados, como segue (onde “Y” indica a ligação à proteína carreadora GBS80 ou GBS67 por intermédio de um resíduo de tirosina e “N?” indica a ligação de triazol):A. GBS80-Y-N3-sacarídeo de GBS serotipo VB. GBS80-Y-N3-sacarídeo de GBS serotipo II C. GBS67-Y-N3-sacarídeo de GBS serotipo II D. GBS67-Y-N3-sacarídeo de GBS serotipo V
[00229] A conjugação foi realizada em uma razão de sacarídeo:proteína de 6:1 (p/p) para os conjugados A-B e a uma razão de sacarídeo:proteína de 4:1 (p/p) para os conjugados C-D. A adição de proteína (em PBS) a uma concentração de 5 mg/ml ao sacarídeo seguida pela agitação na temperatura ambiente por 6 a 12 horas produziu os conjugados. Os conjugados foram purificados usando uma coluna de hidroxiapatita para remover a proteína livre (com um tampão de fase móvel de 2 mM de NaPi, pH 7,2 seguido por um tampão de fase móvel de 400 mM de NaPi, pH 7,2) e sacarídeo livre (com um tampão de fase móvel de 2 mM de NaPi, 550 mM de NaCl, pH 7,2 seguido por um tampão de fase móvel de 10 mM de NaPi, pH 7,2 seguido por um tampão de fase móvel de 35 mM de NaPi, pH 7,2 seguido por um tampão de fase móvel de 400 mM de NaPi, pH 7,2).
[00230] A SDS-PAGE (3 a 8%) foi usada para confirmar a formação dos conjugados. Os resultados da caracterização de SDS-PAGE para cada um dos conjugados A-D são mostrados nas Figuras 6 a 9, respectivamente.
[00231] A análise de HPAEC-PAD foi usada para determinar o teor desacarídeo dos conjugados. Os conjugados tiveram as seguintes propriedades:
[00232] Um conjugado contendo proteína CRM197 também foi sintetizado. Em particular, o derivado de sacarídeo (III) foi conjugado àproteína CRM197, como segue:E. CRM197-Y-N3-sacarídeo MenY
[00233] A conjugação foi realizada usando 60 equivalentes de derivadode sacarídeo (2,1 mg) e 1,5 mg de proteína. A SDS-PAGE foi usada paraconfirmar a formação do conjugado. Os resultados da caracterização de SDS-PAGE para o conjugado E são mostrados na Figura 11.C. Estudos de Imunização usando os conjugados
[00234] A imunogenicidade de vários antígenos foi testada emcamundongos como esboçado abaixo.Modelo de inoculação usando a cepa tipo V
[00235] Grupos de oito camundongos CD1 foram imunizados pelainjeção intraperitoneal com uma dose de 1,0 pg de sacarídeo em um volumede injeção de 200 pl com AlumOH como adjuvante. As injeções foramrealizadas em 1, 21 e 35 dias, com sangrias realizadas em 1, 35 e 49 dias. Asimunizações foram realizadas em grupos de oito camundongos com osseguintes antígenos: (i) PBS, (ii) CRM197-sacarídeo GBS serotipo V, (iii)TT-sacarídeo GBS serotipo V, (iv) GBS80-sacarídeo GBS serotipo V e (v)GBS80-Y-N3-sacarídeo GBS serotipo V (conjugado A). Os conjugados (i) a(iv) foram preparados usando as metodologias da conjugação clássica (porexemplo, como descrito na referência [253]), ao passo que o conjugado (v) foipreparado usando a química click.Os neonatos foram inoculados com ascepas tipo V. Os resultados são mostrados abaixo:Modelo de inoculação usando a cepa tipo II
[00236] Grupos de oito camundongos CD1 foram imunizados pela injeção intraperitoneal com uma dose de 1,0 pg de sacarídeo em um volume de injeção de 200 pl com AlumOH como adjuvante. As injeções foram realizadas em 1, 21 e 35 dias, com sangria realizada em 1, 35 e 49 dias. As imunizações foram realizadas em grupos de oito camundongos com os seguintes antígenos: (i) PBS, (ii) CRM197-sacarídeo de GBS serotipo II, (iii) TT-sacarídeo de GBS serotipo II, (iv) GBS80-sacarídeo de GBS serotipo II e (v) GBS80-Y-N3-sacarídeo de GBS serotipo II (conjugado B). Os conjugados (i) a (iv) foram preparados usando as metodologias de conjugação clássicas, ao passo que o conjugado (v) foi preparado usando a química click.Os neonatos foram inoculados com as cepas tipo II. Os resultados são mostrados abaixo:
[00237] Estes resultados mostram que níveis mais altos de proteção foram obtidos com GBS80-Y-N3-sacarídeo de GBS serotipo II B do que com os conjugados de CRM197 e GBS80 obtidos usando os métodos de conjugação clássicos.Imunoensaio de ELISA para a determinação de títulos IgG contra antígenos de sacarídeo GBS serotipo II
[00238] Os títulos de IgG contra sacarídeo de GBS serotipo II nos soros de animais imunizados foram medidos como segue. As placas de microtítulo foram revestidas com antígenos (por exemplo, GBS8O-Y-N3- sacarídeo de GBS serotipo II B) e as placas foram incubadas durante a noite na temperatura ambiente e depois lavadas três vezes em tampão de lavagem (0,05% de Tween 20 em PBS). Depois de dispensar 250 pl de PBS, 2% de BSA, 0,05% de Tween 20 por reservatório, as placas foram incubadas 90 minutos a 37 °C e depois aspiradas para remover a solução pós-revestimento. Os soros de teste foram diluídos 1:400 em PBS, 2% de BSA, 0,05% de Tween 20. O soro padrão foi preparado pela reunião de soros hiperimunes e diluições iniciais de reuniões padrão foram escolhidas para se obter uma densidade óptica (OD) de cerca de 2.000 a 405 nm. As placas foram incubadas por 1 hora a 37 °C e depois lavadas com tampão de lavagem e 100 pL de IgG Anticamundongo Conjugada à Fosfatase Alcalina 1:1000 em tampão de diluição foram dispensados em cada reservatório. As placas foram incubadas 90 minutos a 37 °C e depois lavadas com tampão de lavagem. 100 pL de uma solução de p-NitroFenilFosfato (p-NPP) 4,0 mg/ml em tampão de substrato foram dispensados em cada reservatório. As placas foram incubadas 30 minutos na temperatura ambiente e depois 100 pL de uma solução em EDTA 7% (p/v) de sal de dissódio mais NaoHPCf 3,5% pH 8,0, foram adicionados a cada reservatório para interromper a reação enzimática. A densidade óptica (OD) a 405 nm foi medida. Os títulos totais de IgG contra antígeno de sacarídeo de GBS serotipo II foram calculados usando-se o Método de Ensaio de Linha de Referência e os resultados foram expressados como Unidades Arbitrárias de ELISA/ml (EU/ml). Para cada um dos três antígenos, o título de IgG sérico padrão foi arbitrariamente designado a um valor de 1,0 EU/ml. O título de IgG de cada soro foi estimado pela interpolação das ODs obtidas com a curva de titulação (tendência e inclinação) da reunião padrão.
[00239] Os resultados são demonstrados na Figura 12 (por 1,0 pg de dose de carboidrato), Figura 13 (para 0,5 pg de dose de carboidrato) e Figura 14 (para 1,0 pg de dose de proteína). A 1,0 pg de dose de carboidratos títulos de IgG de GBS80-Y-N3-sacarídeo de GBS serotipo II B não são estatisticamente diferentes dos conjugados CRM197 e GBS80 obtidos usando os métodos de conjugação clássicos. A 0,5 pg de dose de carboidrato os títulos de IgG de GBS80-Y-N3-sacarídeo de GBS serotipo II B não são estatisticamente diferentes de todos os novos conjugados e controle.Ensaio de Opsonofagocitose
[00240] O ensaio de opsonofagocitose foi realizado usando as cepas de GBS como células alvo e a linhagem de célula HL-60 (ATCC; CCL-240), diferenciada em células iguais a granulócito, pela adição de 100 rnM de N,Ndimetilformamida (Sigma) ao meio de crescimento por 4 dias. As célulasbacterianas semiexponenciais foram incubadas a 37 °C por 1 h na presença decélulas fagocíticas, 10% de complemento de coelho bebê (Cedarlane), eantissoros de camundongo inativados por calor. Os controles negativosconsistiram de reações com soros pré-imunes, ou sem HL-60, ou comcomplemento inativado por calor. A quantidade de morte opsonofagocítica foideterminada subtraindo-se o log do número de colônias que sobrevivem aoensaio de 1 h do log do número de CFU no ponto de tempo zero. Osresultados dos experimentos são mostrados na Figura 15 e abaixo:
[00241] Os títulos OPKA e IgG de GBS80-Y-N3-sacarídeo de GBS serotipo II B são estatisticamente comparáveis aos conjugados com CRM197 e GBS80 obtidos usando os métodos de conjugação clássicos. Os títulos de OPKA e IgG apresentam boa correlação com a % de sobrevivência no modelo animal de inoculação.Imunogenicidade de conjugados preparados em razões de sacarídeo:proteína diferentes
[00242] A resposta imune foi avaliada contra sacarídeo de GBS serotipo II (com 1,0 pg de dose de proteína) com conjugados tendo razões de sacarídeo:proteína diferentes. Os resultados são mostrados na Figura 16 eabaixo:
[00243] A resposta imune também foi avaliada contra GBS80 (com 1,0 pg de dose de proteína) com conjugados tendo razões de sacarídeo:proteína diferentes. Os resultados são mostrados na Figura 17 e abaixo:Avaliação da presença de anticorpos antiligador
[00244] Uma construção foi preparada por intermédio da conjugação seletiva de tirosina de um dímero MenY à CRM197 (Figura 18). Níveis baixos de anticorpos direcionados para o ligador foram encontrados.
[00245] Será entendido que a invenção foi descrita apenas por via de exemplo e modificações podem ser feitas embora permaneçam dentro do escopo e espírito da invenção.
[00246] A invenção inclui as seguintes modalidades numeradas:1. Um método para derivar um sacarídeo compreendendo ligar um grupo cicloalcino de oito membros ao sacarídeo.2. O método da modalidade 1, em que o grupo cicloalcino de oito membros é fundido a um grupo ciclopropano.3. O método da modalidade 1, em que o grupo cicloalcino de oito membros é fundido a dois grupos benzeno.4. O método da modalidade 1, em que o grupo cicloalcino de oito membros é um grupo ciclo-octina.5. O método de qualquer modalidade anterior, em que o sacarídeo é um sacarídeo capsular.6. O método de qualquer modalidade anterior, em que o sacarídeo é um sacarídeo de GBS capsular.7. O método de qualquer modalidade anterior, em que o sacarídeo é um sacarídeo de GBS dos serotipos Ia, lb, II, III ou V.8. O método de qualquer modalidade anterior, em que o sacarídeo é um sacarídeo de GBS dos serotipos II ou V.9. O método de qualquer modalidade anterior, em que o grupo cicloalcino de oito membros é ligado ao sacarídeo por intermédio de um espaçador.10. O método da modalidade 9, em que o grupo cicloalcino de oito membros está em um terminal do espaçador.11. O método da modalidade 10, em que o outro terminal do espaçador tem um grupo funcional para a ligação ao sacarídeo.12. O método da modalidade 11, em que a ligação é realizada usando um composto tendo a fórmula X1-L-X2, onde Xi é 0 grupo cicloalcino de oito membros e X2-L é 0 espaçador em que X2 é qualquer grupo que pode reagir com um grupo funcional no sacarídeo e L é uma porção ligadora no espaçador.13. O método da modalidade 12, em que X2 é N- oxissuccinimida.14. O método das modalidades 12 ou 13, em que L tem a fórmula -L3-!?-!?-, em que L1 é carbonila, L2 é um alquila de cadeia reta com 1 a 10 átomos de carbono ou L2 é ausente, e L3 é -NHC(O)-, carbonila ou - O(CH3)-.15. O método de qualquer uma das modalidades de 12 a 14, em que 0 composto tendo a fórmula X1-L-X2 é:16. O método de qualquer uma das modalidades de 12 a 14, em que o composto tendo a fórmula X1-L-X2 é:17. O método de qualquer uma das modalidades de 12 a 14, em que 0 composto tendo a fórmula X1-L-X2 é:18. Um derivado de sacarídeo compreendendo um grupo cicloalcino de oito membros.19. O derivado de sacarídeo da modalidade 18, em que 0 grupo cicloalcino de oito membros é um grupo ciclo-octina.20. O derivado de sacarídeo de acordo com a modalidade 18, obtenível pelo método de qualquer uma das modalidades de 1 a 17.21. Um método para conjugar um derivado de sacarídeo como definido em qualquer uma das modalidades de 18 a 20 a uma porção contendo azida, compreendendo reagir 0 grupo cicloalcino de oito membros com a azida para formar uma ligação de triazol.22. O método da modalidade 21, em que o derivado de sacarídeo é produzido de acordo com 0 método de qualquer uma das modalidades de 1 a 17.23. O método da modalidade 21 ou modalidade 22, em que o método é realizado na ausência de um catalisador metálico.24. O método de qualquer uma das modalidades de 21 a 23, em que a conjugação ocorre por intermédio de uma reação de cicloadição [3+2].25. O método de qualquer uma das modalidades de 21 a 25, em que a porção contendo azida é uma molécula carreadora.26. O método da modalidade 25, em que a molécula carreadora é uma proteína.27. O método da modalidade 26, em que a proteína é uma proteína de GBS.28. O método da modalidade 27, em que a proteína de GBS é GBS67 ou GBS80.29. O método de qualquer uma das modalidades de 21 a 28, em que a porção contendo azida inclui um espaçador.30. O método da modalidade 29, em que a porção contendo azida é uma proteína carreadora contendo pelo menos um resíduo de tirosina derivatizado tendo a seguinte estrutura, em que a azida é ligada por intermédio da 3H-l,2,4-triazol-3,5(4H)-diona:31. O método de qualquer uma das modalidades de 21 a 30, em que a azida está presente como um grupo terminal na porção contendo azida.32. O método da modalidade 31, em que a porção contendo azida é uma proteína carreadora contendo pelo menos um resíduo de tirosinaderivatizado tendo a seguinte estrutura:33. Um conjugado de um derivado de sacarídeo como definidoem qualquer uma das modalidades de 18 a 20 e uma porção contendo azida, em que o conjugado tem a fórmula R-S-T, em que R compreende um resíduo do derivado de sacarídeo, S é um grupo triazol fundido a um grupo cicloalquila de oito membros e T compreende um resíduo da porção contendo azida.34. O conjugado da modalidade 33, em que o conjugado inclui um espaçador no resíduo do derivado de sacarídeo entre o sacarídeo e S.35. O conjugado da modalidade 34, em que o espaçador tem afórmula -NH-C(O)-(CH2)n-NH-C(O)-, onde n é 1, 2, 3, 4, 5, 6, 7, 8, 9 ou 10.36. O conjugado da modalidade 35, em que n é 5.37. O conjugado de qualquer uma das modalidades de 33 a 36,em que o conjugado inclui um espaçador no resíduo da porção contendo azida entre a porção e S.38. O conjugado da modalidade 37, em que o espaçador tem a fórmula -[(CfUjiOjn-, onde n é 1, 2, 3, 4, 5, 6, 7, 8, 9 ou 10.39. O conjugado da modalidade 38, em que n é 3.40. O conjugado de qualquer uma das modalidades de 33 a 39,em que o conjugado inclui um espaçador no resíduo do derivado de sacarídeo entre o sacarídeo e S e um espaçador no resíduo da porção contendo azida entre a porção e S.41. 0 conjugado de qualquer uma das modalidades de 33 a 40, em que R-S-T é:42. O conjugado de qualquer uma das modalidades de 33 a 40, em que R-S-T é:R R43. O conjugado de qualquer uma das modalidades de 33 a 40, em que R-S-T é:T44. O conjugado de qualquer uma das modalidades de 33 a 43, obtenível pelo método de qualquer uma das modalidades de 21 a 32.45. Uma composição farmacêutica compreendendo um conjugado da invenção em combinação com um carreador farmaceuticamente aceitável.46. Um método para incitar uma resposta imune em um mamífero, compreendendo administrar um conjugado ou composição farmacêutica de acordo com qualquer uma das modalidades de 33 a 43 ao mamífero.
[001] Peptide Science (2010), 94(1), 95. [002] Kolb et al., (2004) Angew Chem Int Ed 40, 3004 [003] Evans (2007) Aust J Chem 60, 384. [004] Tomoe et al. (2002) J Organic Chem 67, 3057 [005] Rostovstev et al., (2002) Angew Chem Int Ed 4f 2596 [006] Agard et al., (2004) JAm Chem Soc 126, 15046 [007] Pure Appl. Chem.<1984), 56, 893. [008] Nature Reviews(2006) 4, 509. [009] W02006/050341 [0010] Guttormsen et al. (2008) Proc Natl Acad Sci USA. 105(15):5903-8. Epub 2008 Mar 31. [0011] WO96/40795 [0012] Michon et al. (2006) Clin Vaccine Immunol. 2006 Aug; 13(8): 936-43. [0013] Lewis et al. QM^PNAS USA 101:11123-8. [0014] Wessels et al. (1989) Infect Immun 57:1089-94. [0015] W02006/082527. [0016] W02009/081276. [0017] Ravenscroft et al. (1999) Vaccine 17:2802-2816. [0018] Costantino et al. (1999) Vaccine 17:1251-1263. [0019] WO02/058737. [0020] Frash (1990) p. 123-145 of Advances inBiotechnological Processes vol. 13 (eds. Mizrahi & Van Wezel) [0021] W003/007985. [0022] Inzana (1987) Infect. Immun. 55:1573-1579. [0023] W0200/5103230 [0024] Kandil et al. (1997) Glycoconj J 14:13-17. [0025] Berkin et al. (2002) Chemistry 8:4424-4433. [0026] Glode et al. (1979) J Infect Dis 139:52-56 [0027] WO94/05325; Patente US 5,425,946. [0028] W02005/033148. [0029] W003/080678. [0030] W02008/084411 [0031] Nilsson & Svensson (1979) Carbohydrate Research 69: 292-296) [0032] Tokunaka et al. (1999) Carbohydr Res 316:161- 172. [0033] W003/097091 [0034] Pang et al. (2005) Biosci Biotechnol Biochem 69:553-8. [0035] Read et al. (1996) Carbohydr Res. 281:187-201. [0036] Takeo and Tei (1986) Carbohydr Res. 145:293-306 [0037] Tanaka et al. (2003) Tetrahedron Letters 44:3053- 3057 [0038] Ning et al. (2002) Tetrahedron Letters 43:5545- 5549 [0039] Geurtsen e[ ai (1999) Journal of Organic Chemistry 64 (21):7828-7835 [0040] Wu et al. (2003) Carbohydr Res. 338:2203-12 [0041] Nicolaou et al. (1997) J. Am. Chem. Soc. 119:449- 450 [0042] Yamada et ai (1999) Tetrahedron Letters 40:4581- 4584 [0043] Yamago et al. (2001) Org. Lett. 24:3867-3870 [0044] Yuguo et Q[ (2004) Tetrahedron 60: 6345-6351 [0045] Amaya et ai (2001) Tetrahedron Letters 42:9191- 9194 [0046] Mei et al. (2005) Carbohydr Res. 340:2345-2351 [0047] Takeo et al. (1993) Carbohydr Res. 245:81-96 [0048] Jamois et al. (2005) Glycobiology 15(4):393-407 [0049] Lefeber et al. (2001) Chem. Eur. J. 7(20):4411-4421 [0050] Huang et al. (2005) Carbohydr Res. 340:603-608 [0051] Patente US 5508191. [0052] MiKyoung et al. (2003) Biochemical Engineering Journal, 16:163-8. [0053] Barsanti et al. (2001) J Appl Phycol 13:59-65 [0054] Bardotti et al. (2008) Vaccine 26:2284-96 [0055] Jones (2005) An. Acad. Bras. Cienc, 77(2) 293-324 [0056] Jones (2005) J Pharm Biomed Anal 38 840-850 [0057] Moreau et al. (1990) Carbohydrate Res. 339(5):285-91 [0058] Fournier et al. (1984) Infect. Immun. 45(1):87-93. [0059] Jones (2005) Carbohydrate Res. 340(6):1097-106. [0060] Fattom et al. (1998) Infect Immun. 66(10):4588-92 [0061] Lemercinier and Jones (1996) Carbohydrate Res 296:83-96. [0062] Jones and Lemercinier (2002) J Pharm Biomed Anal. 30(4): 1233-47. [0063] WO05/033148 [0064] WO 00/56357 [0065] Hestrin (1949) J. Biol. Chem. 180:249-261 [0066] Konadu et al. (1994) Infect. Immun. 62:5048-5054 [0067] Fattom et al. (1990) Infect Immun. 58(7):2367-74 [0068] Gilbert et al. (1994) J. Microb. Meth. 20:39-46. [0069] Mei et al. (2005) Carbohydr Res. 340:2345-2351Takeo et al. (1993) Carbohydr Res. 245:81-96Jamois etal. (2005) Glycobiology 15(4):393-407Lefeber et al. (2001) Chem. Eur. J. 7(20):4411-4421Huang et al. (2005) Carbohydr Res. 340:603-608Patente US 5508191.MiKyoiing et al. (2003) Biochemical EngineeringBarsanti et al. (2001) J Appl Phycol 13:59-65.Bardotti et al. (2008) Vaccine 26:2284-96Jones (2005) An. Acad. Bras. Cienc, 77(2) 293-324.Jones (2005) J Pharm Biomed Anal 38 840-850.Moreau et al. (1990) Carbohydrate Res.Fournier et al. (1984) Infect. Immun. 45(l):87-93.Jones (2005) Carbohydrate Res. 340(6): 1097-106.Fattometal. (1998) InfectImmun. 66(10):4588-92Lemercinier and Jones (1996) Carbohydrate Res.Jones and Lemercinier (2002) J Pharm BiomedW005/033148WO 00/56357Hestrin(T949) J. Biol. Chem. 180:249-261.Konadu etal. (1994)Infect. Immun. 62:5048-5054.Fattometal. (1990)InfectImmun. 58(7):2367-74Gilbert et al. (1994) J. Microb. Meth. 20:39-46.Kreis et al. (1995) Int J Biol Macromol. 17(3- 4): 117-30. [0070] Hõõg etα/.(2002) Carbohydr Res. 337(21-23):2023- 36 [0071] www.polymer.de [0072] Patente US 4356170. [0073] Patentes US 4.356.170 e 4.663.160 [0074] Patente US 4711779. [0075] WO00/10599. [0076] Patente US 4,057,685. [0077] WO2012/075361. [0078] Wan et al. (2006) J Org Chem, 71, 8244 [0079] W02005/000346 [0080] Anonymous (Jan 2002) Research Disclosure, 453077. [0081] Anderson (1983) Infect Immun 39(l):233-238. [0082] Anderson et al. (1985) J Clin Invest 76(l):52-59. [0083] EP-A-0372501. [0084] EP-A-0378881. [0085] EP-A-0427347. [0086] WO93/17712 [0087] W094/03208. [0088] WO98/58668. [0089] EP-A-0471177. [0090] WO91/01146 [0091] Falugieit//. (2001) Eur J Immunol 31:3816-24. [0092] Baraldo et al. (2004) Infect Immun 72:4884-87. [0093] EP-A-0594610. [0094] WO00/56360. [0095] W002/091998. [0096] Kuo et al. (1995) Infect Immun 63:2706-13. [0097] WOO 1/72337 [0098] WOOO/61761. [0099] WOOO/33882. [00100] W02004/041157. [00101] WO 2012/035519 [00102] WO96/40242. [00103] Lei et al. (2000) Dev Biol (Basel) 103:259-264. [00104] WOOO/38711 [00105] WO99/24578. [00106] WO99/36544. [00107] WO99/57280. [00108] WO00/22430. [00109] Tettelin et al. (2000) Science, 287, 1809. [00110] WO96/29412. [00111] Pizza et al. (2000) Science, 287, 1816. [00112] WOOl/52885. [00113] Bjune et al. (1991) Lancet, 338, 1093. [00114] Fukasawa et al. (1999) Vaccine, 17, 2951. [00115] Rosenqvist et al. (1998) Dev. Biol. Stand., 92, 323. [00116] Costantino et al. (1992) Vaccine, 10,691. [00117] W003/007985. [00118] Watson (2000) Pediatr. Infect. Dis. J., 19,331. [00119] Rubin (2000) Pediatr. Clin. North. Am., 47y 269. [00120] Jedrzejas (2001) Microbiol. Mol. Biol. Rev., 65, 187. [00121] Bell (2000) Pediatr. Infect. Dis. J., 19, 1187 100122/ Iwarson (1995) APMIS, 103, 321. [00123] Gerlich et al. (1990) Vaccine, 8, S63-68 & 79-80. [00124] Hsu et al. (1999) Clin. Liver. Dis. ,3,901. [00125] Gustafsson et al. (1996) N. Engl. J. Med., 334, 349. [00126] Rappuoli et al. (1991) TIBTECH, 9, 232. [00127] Vaccines (2004) eds. Plotkin & Orenstein. ISBN 0- 7216-9688-0. [00128] W002/02606. [00129] Kalman et al. (1999) Nature Genetics 21:385-389. [00130] Read et al. (2000) Nucleic Acids Res 28:1397-406. [00131] Shirai et al. (2000) J. Infect. Dis. 181 (Suppl 3):S524-S527. [00132] WO99/27105. [00133] WOOO/27994. [00134] WOOO/37494. [00135] WO99/28475. [00136] Ross et al. (2001) Vaccine, 19, 4135. [00137] Sutter et al. (2000) Pediatr. Clin. North. Am., 47 287. [00138] Zimmerman & Spann (1999) Am. Fam. Physician. 59, 113-118, 125-126. [00139] Dreesen (1997) Vaccine, 15 Suppl, S2. [00140] MMWR Morb. Mortal. Wkly. Rep. (1998), V7, 12 19. [00141] McMichael (2000) Vaccine, 19 Suppl 1, S101. [00142] WO02/34771. [00143] Dale (1999) Infect. Dis. Clin. North. Am., 13, 222 viii. [00144] Ferretti et al. (2001) PNAS USA, 98, 4658. [00145] W003/093306. [00146] W02004/018646. [00147] W02004/041157. [00148] Ichiman and Yoshida (1981) J. Appl. Bacterial., 51, 229. [00149] US4197290 [00150] Ichiman et al. (1991) J. Appl. Bacterial., 71, 176. [00151] Robinson & Torres (1997) Seminars in Immunology, 9, 271. [00152] Donnelly et al. (1997) Annu. Rev. Immunol., 15, 617. [00153] Scott-Taylor & Dalgleish (2000) Expert. Opin. Investig. Drugs, 9, 471. [00154] Apostolopoulos & Piebanski (2000) Curr. Opin.Mol. Ther.,2, 441. [00155] Ilan (1999) Curr. Opin. Mol. Ther., 1, 116. [00156] Dubensky et al. (2000) Mol. Med., 6, 723. [00157] Robinson & Pertmer (2000) Adv. Virus Res., 55, 1. [00158] Donnelly et al. (2000) Am. J. Respir. Crit. Care Med., 162, S190. [00159] Davis (1999) Mt. Sinai J. Med., 66, 84. [00160] Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th edition. [00161] W003/009869. [00162] Almeida & Alpar (1996) J. Drug Targeting, 3, 455. [00163] Agarwal & Mishra (1999) Indian J. Exp. Biol., 37, 6. [00164] WOOO/53221. [00165] Jakobsen et al. (2002) Infect. Immun., 70, 1443. [00166] Bergquist et al. (1998) APMIS, 106, 800. [00167] Baudner et al. (2002) Infect. Immun., 70, 4785. [00168] Ugozzoli et al. (2002) J. Infect. Dis., 186, 1358. [00169] Vaccine Design (1995) Powell & Newman, Plenum. [00170] WO00/23105. [00171] WO90/14837. [00172] Podda (2001) Vaccine, 19, 2673. [00173] Frey et al. (2003) Vaccine, 21, 4234. [00174] Patente US 6,299,884. [00175] Patente US 6,451,325. [00176] Patente US 5,057,540. [00177] WO96/33739. [00178] EP-A-0109942. [00179] WO96/11711. [00180] WO00/07621. [00181] Barr et al. (1998) Advanced Drug Delivery Reviews,32, 247. [00182] Sjolanderet et al. (1998) Advanced Drug Delivery Reviews, 32, 321. [00183] Niikura et al. (2002) Virology, 293, 273. [00184] Lenz et al. (2001) J. Immunol., 166, 5346. [00185] Pinto et al. (2003) J. Infect. Dis., 188, 327. [00186] Gerber et al. (2001) Virol., 75, 4752. [00187] W003/024480. [00188] W003/024481. [00189] Gluck et al. (2002) Vaccine, 20, B10. [00190] EP-A-0689454. [00191] Johnson et al. (1999) Bioorg. Med. Chem. Lett., 9,2273. [00192] Evans et al. (2003) Expert Rev. Vaccines, 2, 219. [00193] Meraldi et al. (2003) Vaccine, 21, 2485. [00194] Pajak et al. (2003) Vaccine, 21, 836. [00195] Kandimalla et al. (2003) Nucleic Acids Research, 37,2393. [00196] WO02/26757. [00197] WO99/62923. [00198] Krieg (2003) Nature Medicine, 9, 831. [00199] McCluskie et al. (2002) FEMS Immunology and Medical Microbiology, 32, 179. [00200] W098/40100. [00201] Patente US 6,207,646. [00202] Patente US 6,239,116. [00203] Patente US 6,429,199. [00204] Kandimalla et al. (2003) Biochemical Society Transactions, 31, 654. [00205] Blackwell et al. (2003) J. Immunol., 170, 4061. [00206] Krieg (2002) Trends Immunol., 23, 64. [00207] WOOl/95935. [00208] Kandimalla et al. (2003) BBRC, 306, 948. [00209] Bhagat et al. (2003) BBRC, 300, 853. [00210] WO03/035836. [00211] WO95/17211. [00212] WO98/42375. [00213] Beignon et al. (2002) Infect. Immun., 70, 3012. [00214] Pizza et al. (2001) Vaccine, 19, 2534. [00215] Pizza et al. (2000) Int. J. Med. Microbiol., 290, 455. [00216] Scharton-Kersten et al. (2000) Infect. Immun., 68, 5306. [00217] Ryan et al. (1999) Infect. Immun., 67, 6270. [00218] Partidos et al. (1999) Immunol. Lett., 67, 209 [00219] Peppoloni et al. (2003) Expert. Rev. Vaccines, 2, 285. [00220] Pine et al. (2002) J. Control. Release., 85, 263. [00221] Domenighini et al. (1995) Mol. Microbiol., 15, 1165. [00222] WO99/40936. [00223] WO99/44636. [00224] Singh et al. (2001) J. Cont. Release., 70, 267. [00225] WO99/27960. [00226] Patente US 6,090,406. [00227] Patente US 5,916,588. [00228] EP-A-0626169. [00229] WO99/52549. [00230] WOO 1/21207. [00231] WOO 1/21152. [00232] Andrianov et al. (1998) Biomaterials, 19, 109. [00233] Payne et al. (1998) Adv. Drug Delivery Review, 31, 185. [00234] Stanley (2002) Clin. Exp. Dermatol., 27, 571. [00235] Jones (2003) Curr. Opin. Investig. Drugs, 4, 214. [00236] W004/60308. [00237] WO04/64759. [00238] WO99/11241. [00239] W094/00153. [00240] WO98/57659. [00241] Pedidos de patente europeus 0835318, 0735898 e 0761231. [00242] Glezen & Alpers (1999) Clin. Infect. Dis. 28:219-224 [00243] Madoff et al. (1994) J Clin Invest 94:286-92. [00244] Paoletti et al. (1994) Infect Immun 62:3236-43. [00245] Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th edition. [00246] Colowick & Kaplan, Methods In Enzymology, Academic Press, Inc. [00247] Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and C.C. Blackwell, eds, 1986, Blackwell Scientific Publications). [00248] Sambrook et al. (2001) Molecular Cloning: A Laboratory Manual, 3rd edition (Cold Spring Harbor Laboratory Press). [00249] Handbook of Surface and Colloidal Chemistry (Birdi, K.S. ed., CRC Press, 1997). [00250] Ausubel et al. (eds) (2002) Short protocols in molecular biology, 5th edition (Current Protocols). [00251] Molecular Biology Techniques: An Intensive Laboratory Course, (Ream et al., eds., 1998, Academic Press) [00252] PCR (Introduction to Biotechniques Series'), 2nd ed.(Newton & Graham eds., 1997, Springer Verlag) [00253] WO2012/035519
Claims (19)
1. Método para derivar um sacarídeo, caracterizadopelo fato de que o método compreende ligar um grupo cicloalcino de oito membros ao sacarídeo, em que o sacarídeo é um sacarídeo capsular.
2. Método de acordo com a reivindicação 1, caracterizadopelo fato de que o sacarídeo é um sacarídeo de GBS capsular.
3. Método de acordo com a reivindicação 1 ou 2, caracterizado pelo fato de que o grupo cicloalcino de oito membros é:fundido a um grupo ciclopropano;fundido a dois grupos benzeno; ouum grupo ciclo-octina.
4. Método de acordo com qualquer uma das reivindicações precedentes, caracterizadopelo fato de que o grupo cicloalcino de oito membros é ligado ao sacarídeo por intermédio de um espaçador.
6. Derivado de sacarídeo compreendendo um grupo cicloalcino de oito membros, caracterizadopelo fato de que o grupo cicloalcino de oito membros é um grupo ciclo-octina e o derivado de sacarídeo é obtenível pelo método como definido em qualquer uma das reivindicações de 1 a 5.
7. Método para conjugar um derivado de sacarídeo como definido na reivindicação 6 a uma porção contendo azida, caracterizadopelo fato de que o método compreende reagir o grupo cicloalcino de oito membros com a azida para formar uma ligação de triazol, em que a porção contendo azida é uma proteína.
8. Método de acordo com a reivindicação 7, caracterizadopelo fato de que a conjugação ocorre por intermédio de uma reação de cicloadição [3+2].
9. Método de acordo com a reivindicação 7 ou 8, caracterizado pelo fato de que a porção contendo azida inclui um espaçador.
11. Conjugado de um derivado de sacarídeo como definido na reivindicação 6 e uma porção contendo azida, caracterizado pelo fato de que o conjugado tem a fórmula R-S-T, R compreende um resíduo do derivado de sacarídeo, S é um grupo triazol fundido a um grupo cicloalquila de oito membros e T compreende um resíduo da porção contendo azida.
12. Conjugado de acordo com a reivindicação 11, caracterizado pelo fato de que o conjugado inclui um espaçador no resíduo do derivado de sacarídeo entre o sacarídeo e S, e em que o espaçador tem a fórmula -NH-C(O)-(CH2)n-NH-C(O)-, onde n é 1, 2, 3, 4, 5, 6, 7, 8, 9 ou 10.
13. Conjugado de acordo a reivindicação 11 ou 12, caracterizado pelo fato de que o conjugado inclui um espaçador no resíduo da porção contendo azida entre a porção e S, e em que o espaçador tem a fórmula -[(CH2)2O]n-, onde n é 1, 2, 3, 4, 5, 6, 7, 8, 9 ou 10.
14. Conjugado de acordo com qualquer uma das reivindicações de 11 a 13, caracterizado pelo fato de que o conjugado inclui um espaçador no resíduo do derivado de sacarídeo entre o sacarídeo e S e um espaçador no resíduo da porção contendo azida entre a porção e S.
15. Conjugado de acordo com a reivindicação 14, caracterizado pelo fato de que é obtenível pelo método como definido em qualquer uma das reivindicações de 7 a 10.
16. Composição farmacêutica, caracterizada pelo fato de que a composição compreende um conjugado como definido em qualquer uma das reivindicações de 11 a 14 em combinação com um carreador farmaceuticamente aceitável.
17. Método para incitar uma resposta imune em um mamífero, caracterizadopelo fato de que o método compreende administrar ao mamífero um conjugado obtenível ou obtido pelo método como definido em qualquer uma das reivindicações de 1 a 10 ou um conjugado ou composição farmacêutica como definidos em qualquer uma das reivindicações 11 a 16.
18. Uso de um conjugado obtenível ou obtido pelo método como definido em qualquer uma das reivindicações de 1 a 10 ou um conjugado ou composição farmacêutica como definidos em qualquer uma das reivindicações 11 a 16 na manufatura de um medicamento, caracterizadopelo fato de que o uso é como um medicamento.
19. Uso de um conjugado obtenível ou obtido pelo método como definido em qualquer uma das reivindicações de 1 a 10 ou de um conjugado ou composição farmacêutica como definidos em qualquer uma das reivindicações de 11 a 16, caracterizadopelo fato de que é na manufatura de um medicamento para incitar uma resposta imune em um mamífero.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB1300707.5 | 2013-01-15 | ||
| GBGB1300707.5A GB201300707D0 (en) | 2013-01-15 | 2013-01-15 | Compounds and processes |
| PCT/EP2014/050483 WO2014111344A1 (en) | 2013-01-15 | 2014-01-13 | Cycloalkyne derivatized saccharides |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| BR112015016817A2 BR112015016817A2 (pt) | 2017-07-11 |
| BR112015016817A8 BR112015016817A8 (pt) | 2019-10-29 |
| BR112015016817B1 true BR112015016817B1 (pt) | 2020-11-10 |
Family
ID=47758014
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112015016817-5A BR112015016817B1 (pt) | 2013-01-15 | 2014-01-13 | métodos para derivar um sacarídeo, para conjugar um derivado de sacarídeo e para incitar uma resposta imune em um mamífero, derivado de sacarídeo, conjugado de um derivado de sacarídeo, composição farmacêutica, e, uso de um conjugado ou composição farmacêutica |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US11135300B2 (pt) |
| EP (1) | EP2945641B1 (pt) |
| JP (3) | JP6719209B2 (pt) |
| CN (1) | CN105377282B (pt) |
| BR (1) | BR112015016817B1 (pt) |
| CA (1) | CA2897348C (pt) |
| CY (1) | CY1122822T1 (pt) |
| DK (1) | DK2945641T3 (pt) |
| ES (1) | ES2774729T3 (pt) |
| GB (1) | GB201300707D0 (pt) |
| HR (1) | HRP20200351T1 (pt) |
| LT (1) | LT2945641T (pt) |
| PL (1) | PL2945641T3 (pt) |
| PT (1) | PT2945641T (pt) |
| SI (1) | SI2945641T1 (pt) |
| WO (1) | WO2014111344A1 (pt) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB201300707D0 (en) * | 2013-01-15 | 2013-02-27 | Novartis Ag | Compounds and processes |
| CN108697741B (zh) * | 2016-03-04 | 2023-04-14 | 悠绿那股份有限公司 | 抗病毒剂及抗病毒用食品 |
| US11951165B2 (en) | 2016-12-30 | 2024-04-09 | Vaxcyte, Inc. | Conjugated vaccine carrier proteins |
| JP7186166B2 (ja) | 2016-12-30 | 2022-12-08 | バックスサイト・インコーポレイテッド | 非天然アミノ酸とのポリペプチド抗原接合体 |
| JP7295571B2 (ja) * | 2018-02-05 | 2023-06-21 | 国立大学法人 宮崎大学 | 細胞標識剤及び細胞標識キット |
| CA3103227A1 (en) | 2018-06-14 | 2019-12-19 | Mochida Pharmaceutical Co., Ltd. | Novel crosslinked alginic acid |
| WO2020010016A1 (en) | 2018-07-04 | 2020-01-09 | Sutrovax, Inc. | Self-adjuvanted immunogenic conjugates |
| TW202304503A (zh) * | 2021-05-28 | 2023-02-01 | 美商輝瑞大藥廠 | 包含結合之莢膜醣抗原的免疫原組合物及其用途 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1490409B1 (en) * | 2002-03-26 | 2008-12-31 | Novartis Vaccines and Diagnostics S.r.l. | Modified saccharides having improved stability in water |
| JP2008518953A (ja) * | 2004-11-01 | 2008-06-05 | ザ ブリガム アンド ウィメンズ ホスピタル インコーポレイテッド | 連鎖球菌修飾多糖類およびそれらの使用法 |
| GB0502095D0 (en) * | 2005-02-01 | 2005-03-09 | Chiron Srl | Conjugation of streptococcal capsular saccharides |
| CN101925366B (zh) * | 2007-11-21 | 2015-02-04 | 乔治亚大学研究基金公司 | 炔烃以及炔烃与1,3-偶极-官能化合物反应的方法 |
| ITVI20090234A1 (it) * | 2009-09-25 | 2011-03-26 | Termotecniche Fraccaro S R L Off | Dispositivo per il riscaldamento di ambienti ad alta efficienza energetica, nonche' sistema riscaldante comprendente tale dispositivo |
| EP2515914A4 (en) | 2009-12-23 | 2013-09-11 | Scripps Research Inst | BIOCONJUGATION OF TYROSINE BY EYE REACTIONS IN AQUEOUS MEDIA |
| EP2563753B9 (en) * | 2010-04-27 | 2016-07-06 | SynAffix B.V. | Fused cyclooctyne compounds and their use in metal-free click reactions |
| WO2012017701A1 (ja) * | 2010-08-05 | 2012-02-09 | 株式会社ミュージックゲート | いびき防止マスク |
| GB201101665D0 (en) | 2011-01-31 | 2011-03-16 | Novartis Ag | Immunogenic compositions |
| EP2621905B1 (en) | 2010-09-27 | 2017-04-12 | University Of Georgia Research Foundation, Inc. | Methods including latent 1,3-dipole-functional compounds and materials prepared thereby |
| US20120208722A1 (en) | 2010-10-19 | 2012-08-16 | Richard Dluhy | Surface enhanced raman spectroscopy platforms and methods |
| DK2721045T3 (en) | 2011-06-20 | 2017-07-24 | Radiomedix Inc | COMPOSITIONS, METHODS OF SYNTHESIS AND USE OF CARBOHYDRATE TARGETED AGENTS |
| CN104136606A (zh) * | 2011-12-01 | 2014-11-05 | 安吉奥开米公司 | 靶向的艾杜糖-2-硫酸酯酶化合物 |
| GB201300707D0 (en) * | 2013-01-15 | 2013-02-27 | Novartis Ag | Compounds and processes |
-
2013
- 2013-01-15 GB GBGB1300707.5A patent/GB201300707D0/en not_active Ceased
-
2014
- 2014-01-13 SI SI201431496T patent/SI2945641T1/sl unknown
- 2014-01-13 PL PL14700602T patent/PL2945641T3/pl unknown
- 2014-01-13 JP JP2015552077A patent/JP6719209B2/ja active Active
- 2014-01-13 US US14/760,916 patent/US11135300B2/en active Active
- 2014-01-13 CN CN201480012960.8A patent/CN105377282B/zh active Active
- 2014-01-13 PT PT147006027T patent/PT2945641T/pt unknown
- 2014-01-13 BR BR112015016817-5A patent/BR112015016817B1/pt active IP Right Grant
- 2014-01-13 WO PCT/EP2014/050483 patent/WO2014111344A1/en active Application Filing
- 2014-01-13 EP EP14700602.7A patent/EP2945641B1/en active Active
- 2014-01-13 CA CA2897348A patent/CA2897348C/en active Active
- 2014-01-13 ES ES14700602T patent/ES2774729T3/es active Active
- 2014-01-13 LT LTEP14700602.7T patent/LT2945641T/lt unknown
- 2014-01-13 DK DK14700602.7T patent/DK2945641T3/da active
-
2018
- 2018-12-28 JP JP2018246761A patent/JP2019073528A/ja not_active Withdrawn
-
2020
- 2020-03-02 HR HRP20200351TT patent/HRP20200351T1/hr unknown
- 2020-03-13 CY CY20201100223T patent/CY1122822T1/el unknown
- 2020-03-23 JP JP2020050828A patent/JP7036854B2/ja active Active
-
2021
- 2021-05-14 US US17/320,482 patent/US20210268116A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| PT2945641T (pt) | 2020-03-26 |
| JP7036854B2 (ja) | 2022-03-15 |
| CN105377282A (zh) | 2016-03-02 |
| ES2774729T3 (es) | 2020-07-22 |
| BR112015016817A8 (pt) | 2019-10-29 |
| EP2945641B1 (en) | 2020-01-01 |
| WO2014111344A1 (en) | 2014-07-24 |
| SI2945641T1 (sl) | 2020-03-31 |
| US11135300B2 (en) | 2021-10-05 |
| EP2945641A1 (en) | 2015-11-25 |
| CA2897348C (en) | 2022-09-27 |
| JP2020114839A (ja) | 2020-07-30 |
| JP2016506905A (ja) | 2016-03-07 |
| BR112015016817A2 (pt) | 2017-07-11 |
| DK2945641T3 (da) | 2020-03-09 |
| JP2019073528A (ja) | 2019-05-16 |
| US20210268116A1 (en) | 2021-09-02 |
| HRP20200351T1 (hr) | 2020-06-12 |
| CN105377282B (zh) | 2020-07-17 |
| US20160166704A1 (en) | 2016-06-16 |
| LT2945641T (lt) | 2020-02-25 |
| CY1122822T1 (el) | 2021-05-05 |
| GB201300707D0 (en) | 2013-02-27 |
| CA2897348A1 (en) | 2014-07-24 |
| JP6719209B2 (ja) | 2020-07-08 |
| PL2945641T3 (pl) | 2020-06-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10188719B2 (en) | Conjugation of Streptococcal capsular saccharides | |
| US20210268116A1 (en) | Cycloalkyne Derivatized Saccharides | |
| CA2564366C (en) | Combined meningococcal conjugates with common carrier protein | |
| ES2379792T3 (es) | Sacáridos capsulares meningocócicos hipo-e hiper-acetilados | |
| US20180104324A1 (en) | Immunogenic composition | |
| ES2812523T3 (es) | Conjugación de polisacáridos capsulares de Staphylococcus aureus de tipo 5 y de tipo 8 | |
| MX2007008537A (es) | Vacunacion conjugado meningococico. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] | ||
| B15K | Others concerning applications: alteration of classification |
Ipc: A61K 38/00 (2006.01), C08B 37/00 (2006.01), A61K 4 |
|
| B07E | Notification of approval relating to section 229 industrial property law [chapter 7.5 patent gazette] |
Free format text: NOTIFICACAO DE ANUENCIA RELACIONADA COM O ART 229 DA LPI |
|
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 13/01/2014, OBSERVADAS AS CONDICOES LEGAIS. |