WO2019082874A1 - ダイレクトリプログラミングによる肝幹細胞又は肝前駆細胞の製造方法 - Google Patents
ダイレクトリプログラミングによる肝幹細胞又は肝前駆細胞の製造方法Info
- Publication number
- WO2019082874A1 WO2019082874A1 PCT/JP2018/039295 JP2018039295W WO2019082874A1 WO 2019082874 A1 WO2019082874 A1 WO 2019082874A1 JP 2018039295 W JP2018039295 W JP 2018039295W WO 2019082874 A1 WO2019082874 A1 WO 2019082874A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- cells
- hiheppc
- hepatic
- combination
- myc
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/067—Hepatocytes
- C12N5/0672—Stem cells; Progenitor cells; Precursor cells; Oval cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/10—Growth factors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/60—Transcription factors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/60—Transcription factors
- C12N2501/606—Transcription factors c-Myc
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2506/00—Differentiation of animal cells from one lineage to another; Differentiation of pluripotent cells
- C12N2506/11—Differentiation of animal cells from one lineage to another; Differentiation of pluripotent cells from blood or immune system cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2506/00—Differentiation of animal cells from one lineage to another; Differentiation of pluripotent cells
- C12N2506/28—Differentiation of animal cells from one lineage to another; Differentiation of pluripotent cells from vascular endothelial cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/13011—Gammaretrovirus, e.g. murine leukeamia virus
- C12N2740/13041—Use of virus, viral particle or viral elements as a vector
- C12N2740/13043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
Definitions
- the present invention relates to a method for producing hepatic stem cells or hepatic progenitor cells by introducing a predetermined reprogramming factor into vascular endothelial cells and the like.
- Non-Patent Document 1 JP-A-2015-527084.
- Hnf1 ⁇ and Foxa3 are introduced into mouse embryonic fibroblasts, they are reprogrammed in liver stem cells (Non-Patent Document 1), and by expressing FOXA3, HNF1A and HNF4A, from human fibroblasts to mature hepatocytes.
- Non-patent document 2 Method of reprogramming (Non-patent document 2), Method of producing human induced hepatocytes by over-expressing HNF1A, HNF4A and HNF6 together with maturation factors ATF5, PROX1 and CEBPA (Non-patent document 3) are known.
- hepatocytes induced by the conventional method have poor proliferation ability and can not differentiate into biliary epithelial cells.
- the present inventors succeeded in obtaining hepatic stem / hepatic progenitor cells by a combination of predetermined genes and completed the present invention.
- the present invention is as follows.
- a method for inducing liver stem cells or hepatic progenitor cells from non-hepatic stem cells or non-hepatic progenitor cells which comprises introducing the following combination into non-hepatic stem cells or non-hepatic progenitor cells: (A) combination of HNF1, HNF6 and FOXA, (B) combination of HNF1, HNF6 and FOXA genes, (C) A combination of HNF1, MYC and FOXA, or (d) a combination of HNF1, MYC and FOXA genes.
- non-hepatic stem cells or non-hepatic progenitor cells are vascular endothelial cells or blood-derived cells.
- the vascular endothelial cell is derived from umbilical vein, peripheral blood or umbilical cord blood.
- the blood-derived cells are peripheral blood T cells or cord blood T cells.
- (11) (a) inducing hepatic stem cells or hepatic progenitor cells by the method according to (1), and (b) differentiating the induced hepatic stem cells or hepatic progenitor cells into hepatic cells or biliary epithelial cells , A method of producing hepatocytes or biliary epithelial cells.
- non-hepatic stem / non-hepatic progenitor cells such as vascular endothelial cells can be directly converted to hepatic stem / hepatic progenitor cells.
- the induced hepatic stem / hepatic progenitor cells have long-term proliferative ability and can differentiate into hepatocytes and biliary epithelial cells. Furthermore, vascular endothelial cells can be induced to hepatic stem / hepatic progenitor cells not only in fetal cells but also in adult peripheral blood. Therefore, liver function test and drug screening using peripheral blood-derived liver stem / liver precursor cells are also possible.
- hiHepPC human induced hepatic progenitor cell
- hiHepPC human induced hepatic progenitor cell
- FIG. 5 shows differentiation of hiHepPC into biliary epithelial cell-like cells.
- FIG. 5 shows the analysis result of proliferation ability and differentiation ability by clone analysis of HUVEC origin hiHepPC.
- FIG. 6 shows hiHepPC induction from human peripheral blood-derived endothelial cells (HPBEC). It is a figure which shows the analysis result of proliferation ability and differentiation ability by clonal analysis of HPBEC origin 4F-hiHepPC. It is a figure which shows the analysis result when FOXA3 which is one of the hiHepPC inducers is substituted to FOXA1 and FOXA2.
- FIG. 6 shows hiHepPC induction from human peripheral blood-derived T cells (HPBTC). It is a figure showing an outline of the present invention.
- the present invention relates to non-hepatic stem / non-hepatic progenitor cells, a combination of HNF1A, HNF6 and FOXA reprogramming factors, a combination of genes encoding the factor, a combination of HNF1A, MYC and FOXA reprogramming factors, or the factor
- the present invention relates to a method for inducing non-hepatic stem / non-hepatic progenitor cells to hepatic stem / hepatic progenitor cells, which comprises introducing a combination of genes encoding.
- the present invention is characterized in that non-hepatic stem / non-hepatic precursor cells are induced to the hepatic stem / hepatic precursor cells from which they originate, rather than to the already differentiated cells, and the combination of the above reprogramming factors is used. Use.
- Non-hepatic stem / non-hepatic precursor cells mean cells other than the target hepatic stem / hepatic precursor cells.
- non-hepatic stem / non-hepatic precursor cells for example, fibroblasts, endothelial cells, blood cells, cord blood cells, bone marrow cells, keratinocytes, hepatocytes, biliary epithelial cells, myofibroblasts, neural cells, epithelial cells, etc. Can be mentioned.
- vascular endothelial cells or blood-derived cells can be used.
- Vascular endothelial cells include those derived from umbilical vein, peripheral blood or cord blood, and blood-derived cells include peripheral blood cells or cord blood cells (for example, peripheral blood T cells or cord blood T cells).
- the non-hepatic stem / non-hepatic precursor cells used in the present invention are, for example, cells derived from mammals such as mice, rats, rabbits, cats, dogs, monkeys and humans. In one embodiment of the present invention, the non-hepatic stem / non-hepatic precursor cells used are cells of human origin.
- Reprogramming Factors is the process of changing the differentiation state of a cell to a different differentiation state or an undifferentiated state from the cell.
- the non-hepatic stem / non-hepatic progenitor cells are induced to hepatic stem / hepatic progenitor cells.
- non-hepatic stem / non-hepatic progenitor cells can be induced to hepatic stem / hepatic progenitor cells without passing through pluripotent stem cells.
- the factors used for such reprogramming are the following combinations: (A) combination of HNF1, HNF6 and FOXA, (B) combination of HNF1, HNF6 and FOXA genes, (C) A combination of HNF1, MYC and FOXA, or (d) a combination of HNF1, MYC and FOXA genes.
- HNF1 Hepatocyte Nuclear Factor 1
- HNF6 Hepatocyte Nuclear Factor 6
- HNF1A Hepatocyte Nuclear Factor 1
- HNF6B Hepatocyte Nuclear Factor 6
- FOXA is a hepatocyte nuclear factor (transcription factor) that is required for the earliest process of liver tissue formation and includes FOXA1, FOXA2, FOXA3. These FOXA transcription factors are considered to have functional complementarity with each other because they have 90% or more homology at the amino acid level in the common forkhead / wingedhelix domain.
- NF1A, HNF6 and FOXA3 ⁇ NF1A, L-MYC and FOXA3 ⁇ NF1A, HNF6, FOXA3 and L-MYC
- the genes encoding reprogramming factors may be linked to one vector for all of the gene sets to be introduced, or may be linked to separate vectors for each gene. It is also possible to link some genes to one vector and link the remaining genes to another vector.
- expression vectors examples include plasmids, bacteriophages, and virus vectors derived from retrovirus, vaccinia virus, adenovirus, lentivirus, adeno-associated virus, Sendai virus and the like.
- the method for introducing the expression vector into non-hepatic stem / non-hepatic precursor cells is not particularly limited, and there may be mentioned a method of infecting cells with an expression vector containing a gene encoding each reprogramming factor, For example, the lipofection method, the electroporation method, the calcium phosphate method and the like can be adopted.
- the dose of the vector for infecting cells with a viral vector can be appropriately adjusted.
- HNF1A, HNF6 and FOXA3 ⁇ HNF1A, L-MYC and FOXA3 ⁇ HNF1A, HNF6, FOXA3 and L-MYC The above factors can be produced by genetic engineering (for example, "Molecular Cloning, A Laboratory Manual (4th edition)” (see Cold Spring Harbor Laboratory Press (2012)), and the obtained polypeptide is introduced into cells. The introduction may be carried out by linking to a membrane permeable peptide or the like and introducing into cells, a method of introducing into cells using cationic lipids, etc. Intracellular transfer reagents are also commercially available ( PULSin (PPU), Prote-IN (HYG), BioPORTER Protein Delivery Reagent (GTS), etc.).
- FIG. 1A A schematic diagram of a hiHepPC induction experiment is shown in FIG. 1A.
- a retroviral vector (gene expression vector) was introduced into a commercially available human umbilical vein endothelial cell (HUVEC) by retroviral infection. Meanwhile, HUVECs were cultured in medium (HUVEC medium) in which Medium 200 and Fibrous serum-free cell culture medium were mixed at 1: 1.
- HUVEC empty vector (mock), combination of HNF4A and FOXA3 (H4A / F3), combination of HNF4A with FOXA3, HNF1A, HNF6 (H4A / F3 / H1A / H6), combination of HNF4A with FOXA3, HNF1A (H4A / F3 / H1A), HNF4A and FOXA3, combination of HNF6 (H4A / F3 / H6), combination of HNF4A and HNF1A, HNF6 (H4A / H1A / H6), HNF4A and HNF1A, HNF6, ATF5, PROX1, CEBPA combination (H4A / H1A / H6 + APC), combination of FOXA3 with HNF1A, HNF6 (F3 / H1A / H6), and ALBUMIN (ALB) immunostaining and ALB positive every 1st to 6th passages (P) The number of cells was count
- ALB is a marker expressed in hepatic progenitor cells and hepatocytes
- E-CAD is a marker for epithelial cells. From the immunostaining of ALB and E-CAD, the phase contrast picture of cells (Phase), and the graph of the proportion of ALB positive cells, hepatic progenitor cell-like cells having proliferation ability when F3 / H1A / H6 is introduced Is found to be induced.
- PH in the graph represents parental HUVEC
- PN represents passage number.
- Two independent experiments are performed, and the results are shown by the blue and red lines on the graph.
- Cellular DNA was stained with DAPI (blue). Scale bar: 50 ⁇ m.
- transduced the gene set of F3 / H1A / H6 into HUVEC, and induced hiHepPC was performed independently 3 times.
- FIG. 1C The results are shown in FIG. 1C. The number of cells grown in 16 passages of hiHepPC (hiHepPC-1, hiHepPC-2, hiHepPC-3) obtained in each experiment is shown. While hiHepPC continues to proliferate, HUVEC ceases to proliferate during passage. Furthermore, the results of chromosomal analysis of hiHepPC at the 12th passage are shown in FIG. 1D. Twenty cells were analyzed, but all of them had normal chromosome numbers.
- FIG. 1B The results are shown in FIG.
- panel A ALB immunostaining was performed every 1st to 6th passages (P), and in P6, immunostaining of E-CAD and imaging of phase-contrast photographs (phase) were also performed. Cellular DNA was stained with DAPI (blue). Scale bar: 50 ⁇ m.
- Panel B measures the number of ALB-positive cells at each of the first to sixth passages after introducing the F3 / H1A / H6 + L-MYC combination into HUVEC, and graphs the percentage of ALB-positive cells. Show. PH in the graph represents parental HUVEC, and PN represents passage number (passage number). Two independent experiments are performed, and the results are shown by the blue and red lines on the graph. The combination F3 / H1A / H6 + L-MYC induces ALB positive cells earlier than the combination F3 / H1A / H6 (see FIG. 1B).
- human fibroblasts were successfully differentiated into hepatocyte-like cells and biliary epithelial cell-like cells.
- human umbilical cord blood T cells were successfully differentiated into hepatocyte-like cells and biliary epithelial cell-like cells.
Abstract
非肝幹細胞又は非肝前駆細胞に、以下の組合せを導入することを特徴とする、非肝幹細胞又は非肝前駆細胞から肝幹細胞又は肝前駆細胞への誘導方法: (a)HNF1、HNF6及びFOXAの組合せ、 (b)HNF1遺伝子、HNF6遺伝子及びFOXA遺伝子の組合せ、 (c)HNF1、MYC及びFOXAの組合せ、又は (d)HNF1遺伝子、MYC遺伝子及びFOXA遺伝子の組合せ。
Description
本発明は、血管内皮細胞等に所定のリプログラミング因子を導入することにより、肝幹細胞又は肝前駆細胞を製造する方法に関する。
ある種の遺伝子セットをヒト線維芽細胞に導入することにより肝細胞を作製する技術は、既に知られている。例えば、リプログラミング因子としてCEBPA、HNF4A、FOXA3、GATA4、HNF1Aなどを用いて、非肝細胞から誘導肝細胞を作製する方法が知られている(特許文献1:特表2015-527084号公報)。
また、マウス胚性線維芽細胞にHnf1β及びFoxa3を導入すると肝幹細胞にリプログラミングされること(非特許文献1)、FOXA3、HNF1A及びHNF4Aを発現させることにより、ヒト線維芽細胞から成熟肝細胞にリプログラミングする方法(非特許文献2)、HNF1A、HNF4A及びHNF6を、成熟因子であるATF5、PROX1及びCEBPAとともに過剰発現することにより、ヒト誘導肝細胞を作製する方法(非特許文献3)などが知られている。
しかしながら、従来法で誘導された肝細胞は増殖能に乏しく、また胆管上皮細胞にも分化できない。
また、マウス胚性線維芽細胞にHnf1β及びFoxa3を導入すると肝幹細胞にリプログラミングされること(非特許文献1)、FOXA3、HNF1A及びHNF4Aを発現させることにより、ヒト線維芽細胞から成熟肝細胞にリプログラミングする方法(非特許文献2)、HNF1A、HNF4A及びHNF6を、成熟因子であるATF5、PROX1及びCEBPAとともに過剰発現することにより、ヒト誘導肝細胞を作製する方法(非特許文献3)などが知られている。
しかしながら、従来法で誘導された肝細胞は増殖能に乏しく、また胆管上皮細胞にも分化できない。
Bing Yu et al., Cell Stem Cell 13, 1-13, September 5, 2013
Pengyu Huang et al., Cell Stem Cell 14, 1-15, March 6, 2014
Yuanyuan Du et al., Cell Stem Cell 14, 1-10, March 6, 2014
増殖能を有し、かつ胆管上皮細胞に分化することができる肝幹細胞又は肝前駆細胞(以下、肝幹/肝前駆細胞という)を得ることができれば、当該細胞を培養することにより、目的の肝細胞や胆管上皮細胞を必要なだけ調達することができる。そこで、肝幹/肝前駆細胞を製造する方法の開発が望まれていた。
本発明者は、上記課題を解決するために鋭意検討を行った結果、所定遺伝子の組合せにより肝幹/肝前駆細胞を得ることに成功し、本発明を完成するに至った。
すなわち、本発明は以下の通りである。
(1)非肝幹細胞又は非肝前駆細胞に、以下の組合せを導入することを特徴とする、非肝幹細胞又は非肝前駆細胞から肝幹細胞又は肝前駆細胞への誘導方法:
(a)HNF1、HNF6及びFOXAの組合せ、
(b)HNF1遺伝子、HNF6遺伝子及びFOXA遺伝子の組合せ、
(c)HNF1、MYC及びFOXAの組合せ、又は
(d)HNF1遺伝子、MYC遺伝子及びFOXA遺伝子の組合せ。
(2)(1)に記載の方法によって肝幹細胞又は肝前駆細胞を誘導する工程を含む、肝幹細胞又は肝前駆細胞の製造方法。
(3)HNF1がHNF1Aである、(1)又は(2)に記載の方法。
(4)FOXAがFOXA3である、(1)~(3)のいずれか1項に記載の方法。
(5)組合せが(a)又は(b)であって、さらに、MYC又はMYC遺伝子を導入する、(1)~(4)のいずれか1項に記載の方法。
(6)MYCがL-MYCである、(1)~(5)のいずれか1項に記載の方法。
(7)非肝幹細胞又は非肝前駆細胞が、血管内皮細胞又は血液由来細胞である、(1)~(6)のいずれか1項に記載の方法。
(8)血管内皮細胞が臍帯静脈、末梢血又は臍帯血由来のものである(7)に記載の方法。
(9)血液由来細胞が末梢血T細胞又は臍帯血T細胞である(7)に記載の方法。
(10)(2)~(9)のいずれか1項に記載の方法により製造された、肝幹細胞又は肝前駆細胞。
(11)(a)(1)に記載の方法によって肝幹細胞又は肝前駆細胞を誘導する工程、及び
(b)誘導した肝幹細胞又は肝前駆細胞を肝細胞又は胆管上皮細胞に分化させる工程
を含む、肝細胞又は胆管上皮細胞の製造方法。
(1)非肝幹細胞又は非肝前駆細胞に、以下の組合せを導入することを特徴とする、非肝幹細胞又は非肝前駆細胞から肝幹細胞又は肝前駆細胞への誘導方法:
(a)HNF1、HNF6及びFOXAの組合せ、
(b)HNF1遺伝子、HNF6遺伝子及びFOXA遺伝子の組合せ、
(c)HNF1、MYC及びFOXAの組合せ、又は
(d)HNF1遺伝子、MYC遺伝子及びFOXA遺伝子の組合せ。
(2)(1)に記載の方法によって肝幹細胞又は肝前駆細胞を誘導する工程を含む、肝幹細胞又は肝前駆細胞の製造方法。
(3)HNF1がHNF1Aである、(1)又は(2)に記載の方法。
(4)FOXAがFOXA3である、(1)~(3)のいずれか1項に記載の方法。
(5)組合せが(a)又は(b)であって、さらに、MYC又はMYC遺伝子を導入する、(1)~(4)のいずれか1項に記載の方法。
(6)MYCがL-MYCである、(1)~(5)のいずれか1項に記載の方法。
(7)非肝幹細胞又は非肝前駆細胞が、血管内皮細胞又は血液由来細胞である、(1)~(6)のいずれか1項に記載の方法。
(8)血管内皮細胞が臍帯静脈、末梢血又は臍帯血由来のものである(7)に記載の方法。
(9)血液由来細胞が末梢血T細胞又は臍帯血T細胞である(7)に記載の方法。
(10)(2)~(9)のいずれか1項に記載の方法により製造された、肝幹細胞又は肝前駆細胞。
(11)(a)(1)に記載の方法によって肝幹細胞又は肝前駆細胞を誘導する工程、及び
(b)誘導した肝幹細胞又は肝前駆細胞を肝細胞又は胆管上皮細胞に分化させる工程
を含む、肝細胞又は胆管上皮細胞の製造方法。
本発明により、肝幹細胞及び肝前駆細胞以外の細胞、すなわち非肝幹細胞又は非肝前駆細胞(以下、「非肝幹/非肝前駆細胞」という)から、肝幹/肝前駆細胞への誘導方法(リプログラミング方法)、及び肝幹/肝前駆細胞の製造方法が提供される。本発明によれば、血管内皮細胞等の非肝幹/非肝前駆細胞から肝幹/肝前駆細胞に直接転換させることができる。誘導された肝幹/肝前駆細胞は、長期増殖能を有し、肝細胞や胆管上皮細胞に分化することが可能である。さらに、血管内皮細胞は胎児性のものだけでなく、成人末梢血中のものでも肝幹/肝前駆細胞に誘導することができる。従って、末梢血由来肝幹/肝前駆細胞を用いた肝機能検査や薬剤スクリーニングも可能になる。
本発明は、非肝幹/非肝前駆細胞に、HNF1A、HNF6及びFOXAのリプログラミング因子の組合せ、当該因子をコードする遺伝子の組合せ、HNF1A、MYC及びFOXAのリプログラミング因子の組合せ、又は当該因子をコードする遺伝子の組合せを導入することを特徴とする、非肝幹/非肝前駆細胞から肝幹/肝前駆細胞への誘導方法に関する。本発明は、既に分化した細胞に誘導するのではなく、非肝幹/非肝前駆細胞から、その起源となる肝幹/肝前駆細胞に誘導させることを特徴とし、上記リプログラミング因子の組合せを用いる。
1.非肝幹/非肝前駆細胞
本発明において、使用の対象となる非肝幹/非肝前駆細胞は、目的とする肝幹/肝前駆細胞以外の細胞を意味する。非肝幹/非肝前駆細胞としては、例えば線維芽細胞、内皮細胞、血液細胞、臍帯血細胞、骨髄細胞、ケラチノサイト、肝細胞、胆管上皮細胞、筋線維芽細胞、神経系細胞、上皮系細胞などが挙げられる。本発明においては、例えば血管内皮細胞又は血液由来細胞を使用することができる。血管内皮細胞としては、臍帯静脈、末梢血又は臍帯血由来のものが挙げられ、血液由来細胞としては、末梢血細胞又は臍帯血細胞(例えば末梢血T細胞又は臍帯血T細胞)が挙げられる。本発明において用いられる非肝幹/非肝前駆細胞は、例えば、マウス、ラット、ウサギ、ネコ、イヌ、サル、ヒトなどの哺乳動物由来の細胞である。本発明の一つの態様において、用いられる非肝幹/非肝前駆細胞はヒト由来の細胞である。
本発明において、使用の対象となる非肝幹/非肝前駆細胞は、目的とする肝幹/肝前駆細胞以外の細胞を意味する。非肝幹/非肝前駆細胞としては、例えば線維芽細胞、内皮細胞、血液細胞、臍帯血細胞、骨髄細胞、ケラチノサイト、肝細胞、胆管上皮細胞、筋線維芽細胞、神経系細胞、上皮系細胞などが挙げられる。本発明においては、例えば血管内皮細胞又は血液由来細胞を使用することができる。血管内皮細胞としては、臍帯静脈、末梢血又は臍帯血由来のものが挙げられ、血液由来細胞としては、末梢血細胞又は臍帯血細胞(例えば末梢血T細胞又は臍帯血T細胞)が挙げられる。本発明において用いられる非肝幹/非肝前駆細胞は、例えば、マウス、ラット、ウサギ、ネコ、イヌ、サル、ヒトなどの哺乳動物由来の細胞である。本発明の一つの態様において、用いられる非肝幹/非肝前駆細胞はヒト由来の細胞である。
2.リプログラミング因子
「リプログラミング」とは、細胞の分化状態を当該細胞とは異なる分化状態又は未分化状態に変更するプロセスである。本発明においては、上記非肝幹/非肝前駆細胞を、肝幹/肝前駆細胞に誘導する。本発明では、多能性幹細胞を経由せずに非肝幹/非肝前駆細胞から肝幹/肝前駆細胞に誘導させることができる。このようなリプログラミングに用いる因子(リプログラミング因子)は、以下の組合せである:
(a)HNF1、HNF6及びFOXAの組合せ、
(b)HNF1遺伝子、HNF6遺伝子及びFOXA遺伝子の組合せ、
(c)HNF1、MYC及びFOXAの組合せ、又は
(d)HNF1遺伝子、MYC遺伝子及びFOXA遺伝子の組合せ。
「リプログラミング」とは、細胞の分化状態を当該細胞とは異なる分化状態又は未分化状態に変更するプロセスである。本発明においては、上記非肝幹/非肝前駆細胞を、肝幹/肝前駆細胞に誘導する。本発明では、多能性幹細胞を経由せずに非肝幹/非肝前駆細胞から肝幹/肝前駆細胞に誘導させることができる。このようなリプログラミングに用いる因子(リプログラミング因子)は、以下の組合せである:
(a)HNF1、HNF6及びFOXAの組合せ、
(b)HNF1遺伝子、HNF6遺伝子及びFOXA遺伝子の組合せ、
(c)HNF1、MYC及びFOXAの組合せ、又は
(d)HNF1遺伝子、MYC遺伝子及びFOXA遺伝子の組合せ。
HNF1(Hepatocyte Nuclear Factor 1)は、ホメオドメインを持つタンパク質であり、HNF1A及びHNF1Bの2種類のアイソフォームがある。
HNF6(Hepatocyte Nuclear Factor 6)は、ヒトの組織発生に関わるホメオドメイン型転写因子であり、膵臓や肝臓など多様な組織の発生を制御するとともに、種々の肝遺伝子の発現制御を行う。
HNF6(Hepatocyte Nuclear Factor 6)は、ヒトの組織発生に関わるホメオドメイン型転写因子であり、膵臓や肝臓など多様な組織の発生を制御するとともに、種々の肝遺伝子の発現制御を行う。
FOXAは、肝組織形成の最も初期の過程に必要とされる肝細胞核因子(転写因子)であり、FOXA1、FOXA2、FOXA3が含まれる。これらのFOXA転写因子は、共通するforkhead/wingedhelixドメインにおいてアミノ酸レベルで90%以上のホモロジーを持つことから、互いに機能相補性を有すると考えられる。
また、本発明においては、上記リプログラミング因子の組合せが(a)又は(b)である場合に、さらにL-MYCを組み合わせることができる。
MYCファミリー遺伝子は、核内DNAに結合して働く転写因子として知られており、ヒトでは、c-MYC、L-MYC及びN-MYCがある。本発明では、これらのいずれも使用することができる。
MYCファミリー遺伝子は、核内DNAに結合して働く転写因子として知られており、ヒトでは、c-MYC、L-MYC及びN-MYCがある。本発明では、これらのいずれも使用することができる。
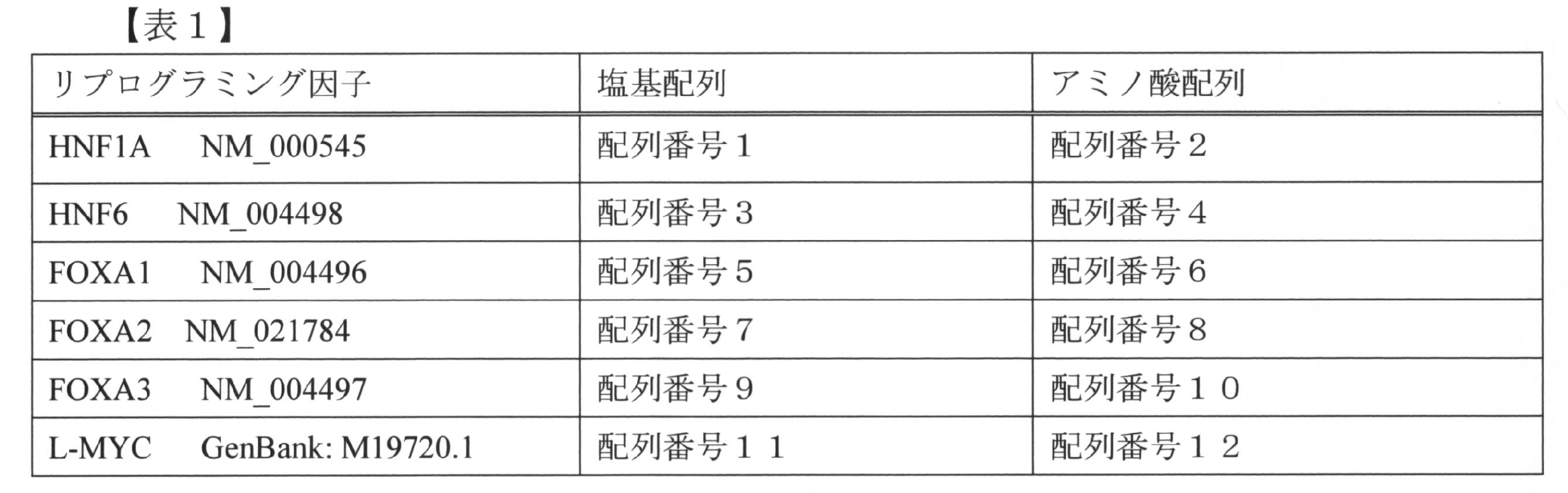
上記リプログラミング因子のアミノ酸配列、及びこれらの因子をコードする遺伝子の塩基配列を表1に示す。
これらの因子をコードする遺伝子の一部は、「Molecular Cloning, A Laboratory Manual (4th edition)」(Cold Spring Harbor Laboratory Press (2012))等を参照してクローニングすることができ、あるいは、addgene等から入手することも可能である。
本明細書において、HNF1Aをコードする遺伝子を「HNF1A遺伝子」、HNF6をコードする遺伝子を「HNF6遺伝子」という。他の因子をコードする遺伝子についても、上記と同様に表示する。
本明細書において、HNF1Aをコードする遺伝子を「HNF1A遺伝子」、HNF6をコードする遺伝子を「HNF6遺伝子」という。他の因子をコードする遺伝子についても、上記と同様に表示する。
本発明の一態様では、例えば以下の組合せのリプログラミング因子、又はこれらの因子をコードする遺伝子のセットを使用することができる。
・NF1A、HNF6及びFOXA3
・NF1A、L-MYC及びFOXA3
・NF1A、HNF6、FOXA3及びL-MYC
・NF1A、HNF6及びFOXA3
・NF1A、L-MYC及びFOXA3
・NF1A、HNF6、FOXA3及びL-MYC
本発明において使用されるリプログラミング因子(遺伝子又はタンパク質)は、表1に示す配列番号で表される塩基配列及びアミノ酸配列に限らず、以下に示す変異型も、本発明におけるリプログラミング因子の機能を有する限り含めることができる。
(a) 表1に示されるアミノ酸配列において、1個又は数個(例えば10個以下、5個以下、4個以下、3個以下又は2個)のアミノ酸が、欠失、置換又は付加されたアミノ酸配列からなり、かつ、それぞれのリプログラミング因子が有する本発明におけるリプログラミング因子としての機能を有するタンパク質
(b) 表1に示されるアミノ酸配列に対して80%以上、85%以上、90%以上、95%以上、98%以上、又は99%以上の相同性を有するアミノ酸配列からなり、かつ、それぞれのリプログラミング因子が有する本発明におけるリプログラミング因子としての機能を有するタンパク質
(c) 上記(a)のタンパク質をコードする核酸
(d) 上記(b)のタンパク質をコードする核酸
(e) 表1に示される塩基配列に相補的な塩基配列からなる核酸とストリンジェントな条件下でハイブリダイズし、かつ、それぞれのリプログラミング因子が有する本発明におけるリプログラミング因子としての機能を有するタンパク質をコードする核酸
(a) 表1に示されるアミノ酸配列において、1個又は数個(例えば10個以下、5個以下、4個以下、3個以下又は2個)のアミノ酸が、欠失、置換又は付加されたアミノ酸配列からなり、かつ、それぞれのリプログラミング因子が有する本発明におけるリプログラミング因子としての機能を有するタンパク質
(b) 表1に示されるアミノ酸配列に対して80%以上、85%以上、90%以上、95%以上、98%以上、又は99%以上の相同性を有するアミノ酸配列からなり、かつ、それぞれのリプログラミング因子が有する本発明におけるリプログラミング因子としての機能を有するタンパク質
(c) 上記(a)のタンパク質をコードする核酸
(d) 上記(b)のタンパク質をコードする核酸
(e) 表1に示される塩基配列に相補的な塩基配列からなる核酸とストリンジェントな条件下でハイブリダイズし、かつ、それぞれのリプログラミング因子が有する本発明におけるリプログラミング因子としての機能を有するタンパク質をコードする核酸
本発明において、「ストリンジェントな条件」とは、例えば、5×SSC、5×デンハルト溶液、0.5%SDS、50%ホルムアミド、50℃の条件である。これらの条件において、温度を上げるほど高い相同性を有するDNA及び/又はRNAが効率的に得られることが期待できる。ただし、ハイブリダイゼーションのストリンジェンシーに影響する要素としては温度、DNA及び/又はRNAの濃度、DNA及び/又はRNAの長さ、イオン強度、時間、塩濃度等の複数の要素が考えられ、当業者であればこれらの要素を適宜選択することで同様のストリンジェンシーを実現することが可能である。
3.細胞へのリプログラミング因子の導入
宿主細胞である非肝幹/非肝前駆細胞にリプログラミング因子を導入するために、リプログラミング因子をコードする遺伝子を同一の又は異なるベクターに組み込んだ組換えベクターを構築してもよい。本発明において、ベクターは、挿入セグメントの複製をもたらすために挿入され得るレプリコンを使用することができる。ベクターは、1つ以上の発現制御配列を作動可能に連結させた発現ベクターとしてもよく、リプログラミング因子以外の他のDNA配列の転写及び/又は翻訳を制御するDNAを含めることができる。発現制御配列の例としては、プロモーター、エンハンサー、転写終結領域等が挙げられる。
宿主細胞である非肝幹/非肝前駆細胞にリプログラミング因子を導入するために、リプログラミング因子をコードする遺伝子を同一の又は異なるベクターに組み込んだ組換えベクターを構築してもよい。本発明において、ベクターは、挿入セグメントの複製をもたらすために挿入され得るレプリコンを使用することができる。ベクターは、1つ以上の発現制御配列を作動可能に連結させた発現ベクターとしてもよく、リプログラミング因子以外の他のDNA配列の転写及び/又は翻訳を制御するDNAを含めることができる。発現制御配列の例としては、プロモーター、エンハンサー、転写終結領域等が挙げられる。
本発明においては、リプログラミング因子をコードする遺伝子は、導入する遺伝子セットの全てを1つのベクターに連結してもよく、1つの遺伝子ごとに別々のベクターに連結してもよい。また、1つのベクターに一部の遺伝子を連結し、他のベクターに残りの遺伝子を連結することも可能である。
本発明において使用可能な発現ベクターとしては、プラスミド、バクテリオファージのほか、レトロウイルス、ワクシニアウイルス、アデノウイルス、レンチウイルス、アデノ随伴ウイルス、センダイウイルス等に由来するウイルスベクターなどが挙げられる。発現ベクターを非肝幹/非肝前駆細胞に導入する方法は特に限定はされず、それぞれのリプログラミング因子をコードする遺伝子を含む発現ベクターを細胞に感染させる方法が挙げられるが、これ以外にも、例えば、リポフェクション法、エレクトロポレーション法、リン酸カルシウム法などを採用することができる。ウイルスベクターを細胞に感染させるときのベクターの用量は適宜調製することができる。
本発明の非肝幹/非肝前駆細胞から肝幹/肝前駆細胞への誘導方法は、in vitroで行ってもよく、in vivoで行ってもよい。in vitroで行う場合、発現ベクターを非肝幹/非肝前駆細胞に導入して形質転換体を得た後は、所定期間培養してもよい。培養は、動物細胞の培養に用いられる培地を用いて行い、その後必要により継代を繰り返すことにより、肝幹/肝前駆細胞にリプログラミングすることができる。
in vivoで行う場合は、発現ベクターを既知の導入手法を用いて、例えば動物の皮膚組織や血管内、腹腔内から非肝幹/非肝前駆細胞に導入し、形質転換体を得てもよい。その後、動物組織中、又は動物組織より回収した細胞中において、肝幹/肝前駆細胞にリプログラミングした細胞を確認することができる。
得られた細胞が肝幹/肝前駆細胞にリプログラミングされたか否かは、これらの細胞に発現するマーカーにより確認することができる。マーカーとしては、例えばアルブミン、α-フェトプロテイン、E-カドヘリンなどが挙げられる。
また、本発明においては、下記因子のポリペプチドを直接細胞に導入することも可能である。
・HNF1A、HNF6及びFOXA3
・HNF1A、L-MYC及びFOXA3
・HNF1A、HNF6、FOXA3及びL-MYC
上記因子は、遺伝子工学的に製造することができ(例えば「Molecular Cloning, A Laboratory Manual (4th edition)」(Cold Spring Harbor Laboratory Press (2012)を参照)、得られたポリペプチドの細胞内への導入は、膜透過性ペプチド等に連結して細胞内に導入する方法、陽イオン性脂質を用いて細胞内に導入する方法などを採用することができ、細胞内導入試薬も市販されている(PULSin(PPU 社) 、Prote-IN(HYG 社)、BioPORTER Protein Delivery Reagent(GTS 社)等)。
in vivoで行う場合は、発現ベクターを既知の導入手法を用いて、例えば動物の皮膚組織や血管内、腹腔内から非肝幹/非肝前駆細胞に導入し、形質転換体を得てもよい。その後、動物組織中、又は動物組織より回収した細胞中において、肝幹/肝前駆細胞にリプログラミングした細胞を確認することができる。
得られた細胞が肝幹/肝前駆細胞にリプログラミングされたか否かは、これらの細胞に発現するマーカーにより確認することができる。マーカーとしては、例えばアルブミン、α-フェトプロテイン、E-カドヘリンなどが挙げられる。
また、本発明においては、下記因子のポリペプチドを直接細胞に導入することも可能である。
・HNF1A、HNF6及びFOXA3
・HNF1A、L-MYC及びFOXA3
・HNF1A、HNF6、FOXA3及びL-MYC
上記因子は、遺伝子工学的に製造することができ(例えば「Molecular Cloning, A Laboratory Manual (4th edition)」(Cold Spring Harbor Laboratory Press (2012)を参照)、得られたポリペプチドの細胞内への導入は、膜透過性ペプチド等に連結して細胞内に導入する方法、陽イオン性脂質を用いて細胞内に導入する方法などを採用することができ、細胞内導入試薬も市販されている(PULSin(PPU 社) 、Prote-IN(HYG 社)、BioPORTER Protein Delivery Reagent(GTS 社)等)。
実施例
以下、実施例により本発明をさらに具体的に説明する。但し、本発明の範囲はこれらの実施例により限定されるものではない。
以下、実施例により本発明をさらに具体的に説明する。但し、本発明の範囲はこれらの実施例により限定されるものではない。
(1)ヒト誘導肝前駆細胞(human induced hepatic progenitor cell: hiHepPC)を誘導する特定因子の同定
hiHepPC誘導実験の概略図を図1Aに示す。
市販のヒト臍帯静脈内皮細胞(human umbilical vein endothelial cell: HUVEC)に対し、レトロウイルス感染によりレトロウイルスベクター(遺伝子発現ベクター)を導入した。その間、HUVECはMedium 200とFibrolife serum-free cell culture mediumを1:1で混合した培地(HUVEC medium)で培養した。ウイルス感染後、2日間Hepato-medium(DMEMとF12の1:1混合培地に4%ウシ胎児血清、1 μg/ml インスリン、10-7M デキサメタゾン、10 mM ニコチンアミド、2 mM L-グルタミン、50 μM β-メルカプトエタノール、ペニシリン/ストレプトマイシンを添加したもの)に20% Fibrolife 血清フリー細胞培養培地、20 ng/ml HGF、1 μM A83-01、2 μM SB43852、5 μM Y27632を添加した培地(Hepato-medium (plus))で培養し、その後はHepato-medium (plus)にて細胞の継代を行いながら、随時解析を行った。
hiHepPC誘導実験の概略図を図1Aに示す。
市販のヒト臍帯静脈内皮細胞(human umbilical vein endothelial cell: HUVEC)に対し、レトロウイルス感染によりレトロウイルスベクター(遺伝子発現ベクター)を導入した。その間、HUVECはMedium 200とFibrolife serum-free cell culture mediumを1:1で混合した培地(HUVEC medium)で培養した。ウイルス感染後、2日間Hepato-medium(DMEMとF12の1:1混合培地に4%ウシ胎児血清、1 μg/ml インスリン、10-7M デキサメタゾン、10 mM ニコチンアミド、2 mM L-グルタミン、50 μM β-メルカプトエタノール、ペニシリン/ストレプトマイシンを添加したもの)に20% Fibrolife 血清フリー細胞培養培地、20 ng/ml HGF、1 μM A83-01、2 μM SB43852、5 μM Y27632を添加した培地(Hepato-medium (plus))で培養し、その後はHepato-medium (plus)にて細胞の継代を行いながら、随時解析を行った。
HUVECに対し、空ベクター(mock)、HNF4AとFOXA3の組み合わせ(H4A/F3)、HNF4AとFOXA3、HNF1A、HNF6の組み合わせ(H4A/F3/H1A/H6)、HNF4AとFOXA3、HNF1Aの組み合わせ(H4A/F3/H1A)、HNF4AとFOXA3、HNF6の組み合わせ(H4A/F3/H6)、HNF4AとHNF1A、HNF6の組み合わせ(H4A/H1A/H6)、HNF4AとHNF1A、HNF6、ATF5、PROX1、CEBPAの組み合わせ(H4A/H1A/H6+APC)、FOXA3とHNF1A、HNF6の組み合わせ(F3/H1A/H6)のそれぞれを導入し、1~6回目の継代(P)ごとにALBUMIN(ALB)の免疫染色とALB陽性細胞数の計測を行った。また、P6においてはE-CADHERIN(E-CAD)の免疫染色も行った。
結果を図1Bに示す。
ALBは肝前駆細胞や肝細胞で発現するマーカーであり、E-CADは上皮細胞のマーカーである。ALB及びE-CADの免疫染色、細胞の位相差写真(Phase)、並びにALB陽性細胞の割合のグラフから、F3/H1A/H6を導入した場合において、増殖能をもった肝前駆細胞様の細胞が誘導されることがわかる。
ALBは肝前駆細胞や肝細胞で発現するマーカーであり、E-CADは上皮細胞のマーカーである。ALB及びE-CADの免疫染色、細胞の位相差写真(Phase)、並びにALB陽性細胞の割合のグラフから、F3/H1A/H6を導入した場合において、増殖能をもった肝前駆細胞様の細胞が誘導されることがわかる。
図1Bにおいて、グラフ中のPHはparental HUVECを、PNはpassage number(継代数)を表す。独立した2回の実験を行い、それぞれの結果をグラフ上の青線と赤線で示す。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
また、F3/H1A/H6の遺伝子セットをHUVECに導入してhiHepPC を誘導する実験を3回独立して行った。
また、F3/H1A/H6の遺伝子セットをHUVECに導入してhiHepPC を誘導する実験を3回独立して行った。
結果を図1Cに示す。それぞれの実験で得たhiHepPC(hiHepPC-1、hiHepPC-2、hiHepPC-3)が16回の継代の中で増殖した細胞数を表す。hiHepPCは増殖を続けるが、HUVECは継代途中で増殖を停止する。
さらに、12回目の継代時におけるhiHepPCの染色体解析を行った結果を図1Dに示す。20個の細胞を解析したが、それらすべてにおいて染色体数は正常であった。
さらに、12回目の継代時におけるhiHepPCの染色体解析を行った結果を図1Dに示す。20個の細胞を解析したが、それらすべてにおいて染色体数は正常であった。
(2)hiHepPCから肝細胞様細胞への分化
HUVEC由来hiHepPCについて、継代(P)1~6回目のそれぞれでALBとα-フェトプロテイン(AFP)の共免疫染色を行い、ALB陽性細胞中のAFP陽性率を算出した。
HUVEC由来hiHepPCについて、継代(P)1~6回目のそれぞれでALBとα-フェトプロテイン(AFP)の共免疫染色を行い、ALB陽性細胞中のAFP陽性率を算出した。
結果を図2に示す。
パネルAにおいて、hiHepPC誘導の初期過程では、肝前駆細胞の特徴であるALB及びAFP共陽性細胞の割合が多いが、継代を重ねることで肝細胞の特徴であるALB単独陽性細胞の割合が増加する。この結果から、HUVECはまずhiHepPCに変化し、その後hiHepPCから肝細胞様細胞が分化してくると考えられる。グラフは、独立した3回の実験で作製したhiHepPCの解析で得たデータの平均値±標準偏差(n=3)を表す。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
パネルAにおいて、hiHepPC誘導の初期過程では、肝前駆細胞の特徴であるALB及びAFP共陽性細胞の割合が多いが、継代を重ねることで肝細胞の特徴であるALB単独陽性細胞の割合が増加する。この結果から、HUVECはまずhiHepPCに変化し、その後hiHepPCから肝細胞様細胞が分化してくると考えられる。グラフは、独立した3回の実験で作製したhiHepPCの解析で得たデータの平均値±標準偏差(n=3)を表す。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
また、パネルBに関し、HUVEC由来hiHepPCから分化した肝細胞様細胞は、ALBだけでなく、肝細胞マーカーであるAATやASGPR1、CYP3A4も発現している。一方、HUVECは血管内皮細胞マーカーのCD31を発現するが、肝細胞マーカーの発現はすべて陰性である。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
(3)hiHepPCから分化した肝細胞様細胞の機能解析と遺伝子発現解析
hiHepPCから分化した肝細胞様細胞の機能解析と遺伝子発現解析結果を図3に示す。
パネルAでは、HUVEC由来hiHepPCから分化した肝細胞様細胞は、肝細胞と同様にグリコーゲンの蓄積、脂質合成、及びインドシアニングリーン(ICG)の取込みと放出を行うことができることが示される。スケールバー:50μm。
hiHepPCから分化した肝細胞様細胞の機能解析と遺伝子発現解析結果を図3に示す。
パネルAでは、HUVEC由来hiHepPCから分化した肝細胞様細胞は、肝細胞と同様にグリコーゲンの蓄積、脂質合成、及びインドシアニングリーン(ICG)の取込みと放出を行うことができることが示される。スケールバー:50μm。
パネルBは、HUVEC由来hiHepPCから分化した肝細胞様細胞が、アルブミンの分泌、尿素合成、及びシトクロムP450活性能を有することを示す。独立した3回の実験で作製したhiHepPC(hiHepPC-1、hiHepPC-2、hiHepPC-3)を解析に用いた。ヒト肝がん由来細胞株であるHepG2をポジティブコントロールとした。グラフは、平均値±標準偏差(n=3)を表す。
パネルCは、HUVEC由来hiHepPCから分化した肝細胞様細胞が、肝細胞毒性を有する薬剤(acetaminofen、amiodarone、dicrofenac)に反応し、細胞死を起こすことを示す。独立した3回の実験で作製したhiHepPC(hiHepPC-1、hiHepPC-2、hiHepPC-3)を解析に用いた。グラフは、平均値±標準偏差(n=3)を表す。*P < 0.05、**P < 0.01
パネルDは、3つのHUVEC(HUVEC-1、HUVEC-2、HUVEC-3)と3つのhiHepPC(hiHepPC-1、hiHepPC-2、hiHepPC-3)の遺伝子発現をmRNA-seqによって解析した結果を示す。公共データからヒト肝細胞の遺伝子発現プロファイルを取得し、このプロファイルについて、HUVEC及びhiHepPCのデータと合わせて解析を行った。上段のヒートマップはクラスタリング解析結果を示しており、hiHepPCはヒト肝細胞の遺伝子発現パターンに近いがHUVECとは大きく異なることが示されている。また、下段のヒートマップでは、脂肪酸代謝やコレステロール代謝、グルコース代謝、及び薬物又は異物代謝に関連する遺伝子の発現パターンが示されており、hiHepPCから分化した肝細胞様細胞が様々な肝機能遺伝子を発現していることがわかる。
(4)hiHepPCの移植による肝臓組織の再構築
まず、3週令の免疫不全マウス(NSGマウス)が7週令になるまで、レトロルシンを週に1回、計5回投与した。続いて、最後のレトロルシン投与から1週間後、当該マウスに四塩化炭素(CCl4)を1回投与し、肝障害を誘導した。そして、その次の日に1 x 107個のHUVEC由来hiHepPCを脾臓から門脈経由で肝臓に移植した。移植後2ヶ月が経った後、肝臓と血清の解析を行った。
まず、3週令の免疫不全マウス(NSGマウス)が7週令になるまで、レトロルシンを週に1回、計5回投与した。続いて、最後のレトロルシン投与から1週間後、当該マウスに四塩化炭素(CCl4)を1回投与し、肝障害を誘導した。そして、その次の日に1 x 107個のHUVEC由来hiHepPCを脾臓から門脈経由で肝臓に移植した。移植後2ヶ月が経った後、肝臓と血清の解析を行った。
結果を図4に示す。
パネルAは、hiHepPC移植実験の概略図を示す。
パネルBは、hiHepPC移植後のマウス血清中に存在するヒトアルブミン濃度を示し、また、hiHepPCを移植した5匹のマウスについて、それらの解析結果を示す。ネガティブコントロールとして、移植なしのNSGマウスの血清、並びにHUVECを移植したNSGマウスの血清の解析結果を示す。TPはtransplantationを表す。グラフは、平均値±標準偏差(n=2)を表す。
パネルAは、hiHepPC移植実験の概略図を示す。
パネルBは、hiHepPC移植後のマウス血清中に存在するヒトアルブミン濃度を示し、また、hiHepPCを移植した5匹のマウスについて、それらの解析結果を示す。ネガティブコントロールとして、移植なしのNSGマウスの血清、並びにHUVECを移植したNSGマウスの血清の解析結果を示す。TPはtransplantationを表す。グラフは、平均値±標準偏差(n=2)を表す。
パネルCは、HUVEC又はhiHepPCを移植したマウスの肝臓組織をヒトAATに対する抗体で免疫染色した結果である。hiHepPCを移植したマウス肝臓では、hiHepPC由来肝細胞様細胞による肝臓組織の再構築が観察される。TPはtransplantationを表す。細胞のDNAはDAPI(青色)で染色した。スケールバー:100μm。
(5)hiHepPCから胆管上皮細胞様細胞への分化
図5は、hiHepPCから胆管上皮細胞様細胞への分化を示す。
パネルAは、HUVEC及びHUVEC由来hiHepPCをマトリゲル内で1週間三次元培養すると、hiHepPCのみが上皮管腔構造をもった球状組織(スフェロイド)を形成することを示す。これらスフェロイドは継代(P)することも可能である。スケールバー:100μm。
図5は、hiHepPCから胆管上皮細胞様細胞への分化を示す。
パネルAは、HUVEC及びHUVEC由来hiHepPCをマトリゲル内で1週間三次元培養すると、hiHepPCのみが上皮管腔構造をもった球状組織(スフェロイド)を形成することを示す。これらスフェロイドは継代(P)することも可能である。スケールバー:100μm。
パネルBは、HUVEC由来hiHepPCから形成されたスフェロイドが、極性(E-CAD、EZRIN、ZO-1、Phalloidinの局所的発現パターン)を有し、胆管上皮細胞マーカー(CK19、SOX9、HNF1B、CFTR、EpCAM、α-TUBULIN)を発現する上皮細胞によって形成されていることを示す。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
パネルCは、HUVEC由来hiHepPCから形成されたスフェロイドが、胆管と同様に蛍光色素(ローダミン)を取り込むことを示す。Verapamil添加によって取り込みが阻害されることから、この取り込みはトランスポーターを介することがわかる。スケールバー:50μm。
パネルDは、HUVEC由来hiHepPCから形成されたスフェロイドの電顕写真を示す。内腔側に微絨毛を有し、細胞間はタイトジャンクション(図中の矢頭)によって結合している。スケールバー:10μm(左図)、500nm(右図)。
(6)HUVEC由来hiHepPCのクローン解析による増殖能と分化能の解析
独立した3回の実験で作製したhiHepPC(hiHepPC-1、hiHepPC-2、hiHepPC-3)のそれぞれについて、フローサイトメトリー(FACS)によるクローンソーティングを行い、96ウェル培養プレートの各ウェルに1つずつ細胞を播種し、1細胞培養を行った。その後、1細胞(hiHepPCクローン)から増殖した細胞について解析を行った。
独立した3回の実験で作製したhiHepPC(hiHepPC-1、hiHepPC-2、hiHepPC-3)のそれぞれについて、フローサイトメトリー(FACS)によるクローンソーティングを行い、96ウェル培養プレートの各ウェルに1つずつ細胞を播種し、1細胞培養を行った。その後、1細胞(hiHepPCクローン)から増殖した細胞について解析を行った。
この解析手法を図6Aに、解析結果を図6B~Dに示す。
パネルBでは、hiHepPC-1、hiHepPC-2及びhiHepPC-3のそれぞれについて、1細胞培養の結果形成されるコロニーの割合(それぞれ570ウェル当たり)、及び、その後増殖を続けるクローンの割合(それぞれ570ウェル当たり)を左図、右図のそれぞれのグラフで示す。
パネルBでは、hiHepPC-1、hiHepPC-2及びhiHepPC-3のそれぞれについて、1細胞培養の結果形成されるコロニーの割合(それぞれ570ウェル当たり)、及び、その後増殖を続けるクローンの割合(それぞれ570ウェル当たり)を左図、右図のそれぞれのグラフで示す。
パネルCは、増殖したhiHepPCクローンについて、細胞の位相差像(Phase)並びにALB及びE-CADの共免疫染色像を示す。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。パネルDは、増殖したhiHepPCクローンをマトリゲル内で三次元培養すると胆管上皮細胞様細胞に分化し、上皮管腔構造をもったスフェロイドを形成することを示す。スケールバー:50μm。
(7)L-MYCの追加によるhiHepPCの誘導時間の短縮
HUVECに対し、FOXA3、HNF1A及びHNF6に加え、L-MYCも同時に導入し、解析を行った。
HUVECに対し、FOXA3、HNF1A及びHNF6に加え、L-MYCも同時に導入し、解析を行った。
結果を図7に示す。
パネルAでは、1~6回目の継代(P)ごとにALBの免疫染色を行い、P6においてはE-CADの免疫染色と位相差写真(Phase)の撮影も行った。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
パネルBは、HUVECにF3/H1A/H6+L-MYCの組み合わせを導入後、1~6回目の継代ごとにALB陽性細胞数の計測を行い、ALB陽性細胞の割合をグラフ化した結果を示す。グラフ中のPHはparental HUVECを、PNはpassage number(継代数)を表す。独立した2回の実験を行い、それぞれの結果をグラフ上の青線と赤線で示す。F3/H1A/H6+L-MYCの組み合わせでは、F3/H1A/H6の組み合わせ(図1B参照)よりも早くALB陽性細胞が誘導される。
パネルAでは、1~6回目の継代(P)ごとにALBの免疫染色を行い、P6においてはE-CADの免疫染色と位相差写真(Phase)の撮影も行った。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
パネルBは、HUVECにF3/H1A/H6+L-MYCの組み合わせを導入後、1~6回目の継代ごとにALB陽性細胞数の計測を行い、ALB陽性細胞の割合をグラフ化した結果を示す。グラフ中のPHはparental HUVECを、PNはpassage number(継代数)を表す。独立した2回の実験を行い、それぞれの結果をグラフ上の青線と赤線で示す。F3/H1A/H6+L-MYCの組み合わせでは、F3/H1A/H6の組み合わせ(図1B参照)よりも早くALB陽性細胞が誘導される。
(8)ヒト末梢血由来血管内皮細胞(human peripheral blood-derived endothelial cell: HPBEC)からのhiHepPC誘導
HPBECからhiHepPCを誘導する実験の概略図を図8Aに示す。まず、健常人ボランティアから採取した末梢血から単核細胞を分離し、HPBEC medium(EGMTM-2MV BulletKitTM Mediumに20%ウシ胎児血清を添加したもの)で培養してHPBECを得た。次に、HPBECに対し、レトロウイルス感染によりF3/H1A/H6の組み合わせ(3F)又はF3/H1A/H6+L-MYCの組み合わせ(4F)を導入した。ウイルス感染後、HPBEC mediumとHepato-medium (plus)との1:1混合培地で2日間培養した。続いてHepato-medium (plus)にて43日間そのまま培養し、その後は細胞の継代を行いながら、随時解析を行った。
HPBECからhiHepPCを誘導する実験の概略図を図8Aに示す。まず、健常人ボランティアから採取した末梢血から単核細胞を分離し、HPBEC medium(EGMTM-2MV BulletKitTM Mediumに20%ウシ胎児血清を添加したもの)で培養してHPBECを得た。次に、HPBECに対し、レトロウイルス感染によりF3/H1A/H6の組み合わせ(3F)又はF3/H1A/H6+L-MYCの組み合わせ(4F)を導入した。ウイルス感染後、HPBEC mediumとHepato-medium (plus)との1:1混合培地で2日間培養した。続いてHepato-medium (plus)にて43日間そのまま培養し、その後は細胞の継代を行いながら、随時解析を行った。
結果を図8B~Eに示す。
パネルBは、ウイルス感染を行っていないHPBEC、及び3F又は4Fを導入したHPBEC(ウイルス感染後45日目)の位相差像(Phase)、並びにALB免疫染色像を示す(注:それぞれの写真は同一視野ではない)。点線で囲われている細胞群が誘導したhiHepPC(3F又は4Fで誘導したhiHepPCを、それぞれ3F-hiHepPC、4F-hiHepPCと表記する)である。右のグラフは、ウイルス感染を行っていないHPBEC、及び3F又は4Fを導入したHPBEC(ウイルス感染後45日目と継代(P)3回目)で観察されるALB陽性細胞の割合を示す。健常人2名の末梢血を使って独立した実験を行い、それぞれの結果をグラフ上の青バーと赤バーで示した。スケールバー:100μm。
パネルBは、ウイルス感染を行っていないHPBEC、及び3F又は4Fを導入したHPBEC(ウイルス感染後45日目)の位相差像(Phase)、並びにALB免疫染色像を示す(注:それぞれの写真は同一視野ではない)。点線で囲われている細胞群が誘導したhiHepPC(3F又は4Fで誘導したhiHepPCを、それぞれ3F-hiHepPC、4F-hiHepPCと表記する)である。右のグラフは、ウイルス感染を行っていないHPBEC、及び3F又は4Fを導入したHPBEC(ウイルス感染後45日目と継代(P)3回目)で観察されるALB陽性細胞の割合を示す。健常人2名の末梢血を使って独立した実験を行い、それぞれの結果をグラフ上の青バーと赤バーで示した。スケールバー:100μm。
パネルCでは、HPBEC から誘導した3F-hiHepPCと4F-hiHepPCは共に一部の細胞がAFP陽性であるが、3F-hiHepPCと4F-hiHepPCから分化した肝細胞様細胞は、ALBだけでなく、肝細胞マーカーであるAAT、ASGPR1及びCYP3A4を発現していることが示される。また、3F-hiHepPCと4F-hiHepPCから分化した肝細胞様細胞は、肝細胞と同様にグリコーゲンの蓄積や脂質合成、インドシアニングリーン(ICG)の取込みと放出を行うことができる。さらに、3F-hiHepPCと4F-hiHepPCをマトリゲル内で三次元培養すると胆管上皮細胞様細胞に分化し、上皮管腔構造をもったスフェロイドを形成する。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
パネルDでは、3F-hiHepPCと4F-hiHepPCから分化した肝細胞様細胞が、アルブミンの分泌、尿素合成及びシトクロムP450活性能を有することが示される。健常人2名の末梢血を使って作製した3F-hiHepPC(3F-hiHepPC-1、3F-hiHepPC-2)と4F-hiHepPC(4F-hiHepPC-1、4F-hiHepPC-2)を解析に用いた。ヒト肝がん由来細胞株であるHepG2をポジティブコントロールとした。グラフは、平均値±標準偏差(n=3)を表す。
パネルEは、3F-hiHepPCと4F-hiHepPCから分化した肝細胞様細胞が、肝細胞毒性を有する薬剤(acetaminofen、amiodarone、dicrofenac)に反応し、細胞死を起こすことを示す。健常人2名の末梢血を使って作製した3F-hiHepPC(3F-hiHepPC-1、3F-hiHepPC-2)と4FhiHepPC(4F-hiHepPC-1、4F-hiHepPC-2)を解析に用いた。グラフは、平均値±標準偏差(n=3)を表す。*P < 0.05、**P < 0.01
(9)HPBEC由来4F-hiHepPCのクローン解析による増殖能と分化能の解析
細胞のクローン解析手法及び結果を図9に示す。
パネルAにおいて、点線で囲われたHPBEC由来4F-hiHepPCのコロニーをピックアップし、細胞を分散させた上で96ウェル培養プレートの各ウェルに1つずつ細胞を播種し、1細胞培養を行った。その後、1細胞(4F-hiHepPCクローン)から増殖した細胞について解析を行った。スケールバー:100μm。
細胞のクローン解析手法及び結果を図9に示す。
パネルAにおいて、点線で囲われたHPBEC由来4F-hiHepPCのコロニーをピックアップし、細胞を分散させた上で96ウェル培養プレートの各ウェルに1つずつ細胞を播種し、1細胞培養を行った。その後、1細胞(4F-hiHepPCクローン)から増殖した細胞について解析を行った。スケールバー:100μm。
パネルBは、左から、96ウェル培養プレートの1ウェルに播種した1細胞(4F-hiHepPCクローン)の位相差像(Phase)、1細胞から増殖した細胞の位相差像(Phase)、増殖した細胞のALB及びE-CAD共免疫染色像、増殖した細胞から分化した胆管上皮細胞様細胞が三次元培養下で形成する上皮管腔構造をもったスフェロイドを示す。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
(10)FOXA1及びFOXA2を用いた実験
図10は、hiHepPC誘導因子の1つであるFOXA3が、FOXA1やFOXA2に置き換えることができることを示す。
パネルAでは、FOXA1、HNF1A及びHNF6の組み合わせでHUVECから誘導したhiHepPC (FOXA1)、並びにFOXA2、HNF1A及びHNF6の組み合わせでHUVECから誘導したhiHepPC (FOXA2)が、どちらもFOXA3、HNF1A及びHNF6の組み合わせで誘導したhiHepPCと同様に上皮細胞形態を有し、血管内皮細胞マーカーであるCD31は発現せず、一部の細胞はAFP陽性であることが示される。一方で、hiHepPC (FOXA1)とhiHepPC (FOXA2)から分化した肝細胞様細胞は、ALBだけでなく、肝細胞マーカーであるAAT、ASGPR1及びCYP3A4を発現している。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
図10は、hiHepPC誘導因子の1つであるFOXA3が、FOXA1やFOXA2に置き換えることができることを示す。
パネルAでは、FOXA1、HNF1A及びHNF6の組み合わせでHUVECから誘導したhiHepPC (FOXA1)、並びにFOXA2、HNF1A及びHNF6の組み合わせでHUVECから誘導したhiHepPC (FOXA2)が、どちらもFOXA3、HNF1A及びHNF6の組み合わせで誘導したhiHepPCと同様に上皮細胞形態を有し、血管内皮細胞マーカーであるCD31は発現せず、一部の細胞はAFP陽性であることが示される。一方で、hiHepPC (FOXA1)とhiHepPC (FOXA2)から分化した肝細胞様細胞は、ALBだけでなく、肝細胞マーカーであるAAT、ASGPR1及びCYP3A4を発現している。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
パネルBでは、HUVEC 由来のhiHepPC (FOXA1)とhiHepPC (FOXA2)から分化した肝細胞様細胞が、肝細胞と同様にグリコーゲンの蓄積、脂質合成、並びにインドシアニングリーン(ICG)の取込み及び放出を行うことができることを示す。さらに、hiHepPC (FOXA1)とhiHepPC (FOXA2)をマトリゲル内で三次元培養すると胆管上皮細胞様細胞に分化し、上皮管腔構造をもったスフェロイドを形成する。スケールバー:50μm。
(11)ヒト末梢血由来T細胞(human peripheral blood-derived T cell: HPBTC)からのhiHepPC誘導
ヒト末梢血から単核細胞を分離後、T細胞培地(HPBEC mediumとFibrolife serum-free cell culture mediumの1:1混合培地に10 ng/ml rIL-2、0.05 pl/cell Dynabeads HumanT-Activator CD3/CD28を添加したもの)で培養し、T細胞の増殖を促進させた。
ヒト末梢血から単核細胞を分離後、T細胞培地(HPBEC mediumとFibrolife serum-free cell culture mediumの1:1混合培地に10 ng/ml rIL-2、0.05 pl/cell Dynabeads HumanT-Activator CD3/CD28を添加したもの)で培養し、T細胞の増殖を促進させた。
結果を図11に示す。
パネルAの写真は、hiHepPC誘導前のHPBTC位相差像(Phase)を示す。スケールバー:50μm。
パネルBは、HPBTCにF3/H1A/H6の組み合わせ(3F)、又はF3/H1A/H6+L-MYCの組み合わせ(4F)を導入して作製した3F-hiHepPC及び4F-hiHepPCの位相差像(Phase)、並びにALB及びE-CAD共免疫染色像である。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
パネルAの写真は、hiHepPC誘導前のHPBTC位相差像(Phase)を示す。スケールバー:50μm。
パネルBは、HPBTCにF3/H1A/H6の組み合わせ(3F)、又はF3/H1A/H6+L-MYCの組み合わせ(4F)を導入して作製した3F-hiHepPC及び4F-hiHepPCの位相差像(Phase)、並びにALB及びE-CAD共免疫染色像である。細胞のDNAはDAPI(青色)で染色した。スケールバー:50μm。
以上の実施例により、HUVEC、HPBEC又はHPBTCに、FOXA3、HNF1A及びHNF6の組み合わせ(必要に応じてL-MYCを追加)を導入することにより、増殖能を有し、肝細胞様細胞と胆管上皮細胞様細胞に分化できるhiHepPCを誘導(ダイレクトリプログラミング)できることが明らかとなった。本実施例のまとめを図12に示す。
同様にして、ヒト線維芽細胞を肝細胞様細胞と胆管上皮細胞様細胞に分化させることに成功した。また、同様にして、ヒト臍帯血T細胞を肝細胞様細胞と胆管上皮細胞様細胞に分化させることに成功した。
さらに、ヒト臍帯血T細胞に、FOXA3、HNF1A及びL-MYCの組み合わせを導入することにより、ヒト臍帯血T細胞を肝細胞様細胞と胆管上皮細胞様細胞に分化させることに成功した。
配列番号12:XaaはSer又はThrを表す(存在位置:362)。
Claims (11)
- 非肝幹細胞又は非肝前駆細胞に、以下の組合せを導入することを特徴とする、非肝幹細胞又は非肝前駆細胞から肝幹細胞又は肝前駆細胞への誘導方法:
(a)HNF1、HNF6及びFOXAの組合せ、
(b)HNF1遺伝子、HNF6遺伝子及びFOXA遺伝子の組合せ、
(c)HNF1、MYC及びFOXAの組合せ、又は
(d)HNF1遺伝子、MYC遺伝子及びFOXA遺伝子の組合せ。 - 請求項1に記載の方法によって肝幹細胞又は肝前駆細胞を誘導する工程を含む、肝幹細胞又は肝前駆細胞の製造方法。
- HNF1がHNF1Aである、請求項1又は2に記載の方法。
- FOXAがFOXA3である、請求項1~3のいずれか1項に記載の方法。
- 組合せが(a)又は(b)であって、さらに、MYC又はMYC遺伝子を導入する、請求項1~4のいずれか1項に記載の方法。
- MYCがL-MYCである、請求項1~5のいずれか1項に記載の方法。
- 非肝幹細胞又は非肝前駆細胞が、血管内皮細胞又は血液由来細胞である、請求項1~6のいずれか1項に記載の方法。
- 血管内皮細胞が臍帯静脈、末梢血又は臍帯血由来のものである請求項7に記載の方法。
- 血液由来細胞が末梢血T細胞又は臍帯血T細胞である請求項7に記載の方法。
- 請求項2~9のいずれか1項に記載の方法により製造された、肝幹細胞又は肝前駆細胞。
- (a)請求項1に記載の方法によって肝幹細胞又は肝前駆細胞を誘導する工程、及び
(b)誘導した肝幹細胞又は肝前駆細胞を肝細胞又は胆管上皮細胞に分化させる工程
を含む、肝細胞又は胆管上皮細胞の製造方法。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019551148A JP7307478B2 (ja) | 2017-10-23 | 2018-10-23 | ダイレクトリプログラミングによる肝幹細胞又は肝前駆細胞の製造方法 |
| US16/757,817 US20210189347A1 (en) | 2017-10-23 | 2018-10-23 | Method for producing liver stem cells or liver progenitor cells by direct reprogramming |
| EP18870975.2A EP3702449A4 (en) | 2017-10-23 | 2018-10-23 | METHOD FOR PRODUCING LIVER STEM CELLS OR LIVER ANALYZER CELLS BY DIRECT REPROGRAMMING |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017204432 | 2017-10-23 | ||
| JP2017-204432 | 2017-10-23 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2019082874A1 true WO2019082874A1 (ja) | 2019-05-02 |
Family
ID=66246576
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2018/039295 WO2019082874A1 (ja) | 2017-10-23 | 2018-10-23 | ダイレクトリプログラミングによる肝幹細胞又は肝前駆細胞の製造方法 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20210189347A1 (ja) |
| EP (1) | EP3702449A4 (ja) |
| JP (1) | JP7307478B2 (ja) |
| WO (1) | WO2019082874A1 (ja) |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011052504A1 (ja) * | 2009-10-28 | 2011-05-05 | 財団法人ヒューマンサイエンス振興財団 | 幹細胞から肝細胞への分化誘導方法 |
| JP2015527084A (ja) | 2012-09-07 | 2015-09-17 | ジェネンテック, インコーポレイテッド | 誘導肝細胞を作製するための方法及び組成物 |
| JP2016010379A (ja) * | 2014-06-30 | 2016-01-21 | 国立研究開発法人医薬基盤・健康・栄養研究所 | 薬物評価用細胞及び薬物評価方法 |
| JP2017511150A (ja) * | 2014-02-12 | 2017-04-20 | 北昊干細胞与再生医学研究院有限公司BeiHao Stem Cell and Regenerative Medicine Translational Research Institute | 非肝細胞を肝細胞にリプログラミングするためのキットおよび方法 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013189521A1 (en) * | 2012-06-19 | 2013-12-27 | Waclawczyk Simon | Method of generating cells of hepatocyte phenotype |
-
2018
- 2018-10-23 US US16/757,817 patent/US20210189347A1/en active Pending
- 2018-10-23 JP JP2019551148A patent/JP7307478B2/ja active Active
- 2018-10-23 EP EP18870975.2A patent/EP3702449A4/en active Pending
- 2018-10-23 WO PCT/JP2018/039295 patent/WO2019082874A1/ja unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011052504A1 (ja) * | 2009-10-28 | 2011-05-05 | 財団法人ヒューマンサイエンス振興財団 | 幹細胞から肝細胞への分化誘導方法 |
| JP2015527084A (ja) | 2012-09-07 | 2015-09-17 | ジェネンテック, インコーポレイテッド | 誘導肝細胞を作製するための方法及び組成物 |
| JP2017511150A (ja) * | 2014-02-12 | 2017-04-20 | 北昊干細胞与再生医学研究院有限公司BeiHao Stem Cell and Regenerative Medicine Translational Research Institute | 非肝細胞を肝細胞にリプログラミングするためのキットおよび方法 |
| JP2016010379A (ja) * | 2014-06-30 | 2016-01-21 | 国立研究開発法人医薬基盤・健康・栄養研究所 | 薬物評価用細胞及び薬物評価方法 |
Non-Patent Citations (10)
| Title |
|---|
| "Molecular Cloning, A Laboratory Manual", 2012, COLD SPRING HARBOR LABORATORY PRESS |
| BING YU ET AL., CELL STEM CELL, vol. 13, 5 September 2013 (2013-09-05), pages 1 - 13 |
| DING, YI ET AL.: "Overexpression of transcription factor Foxa2 and Hnfla induced rat bone mesenchymal stem cells into hepatocytes", CYTOTECHNOLOGY, vol. 68, 2016, pages 2037 - 2047, XP036055365, DOI: 10.1007/s10616-016-9944-7 * |
| MIURA, SHIZUKA ET AL.: "Generation of Mouse and Human Organoid-Forming Intestinal Progenitor Cells by Direct Lineage Reprogramming", CELL STEM CELL, vol. 21, 5 October 2017 (2017-10-05), pages 456 - 471, XP085208263 * |
| NAKAGAWA, MASATO ET AL.: "Promotion of direct reprogramming by transformation-deficient Myc", PROC. NATL. ACAD. SCI. USA, vol. 107, no. 32, 2010, pages 14152 - 14157, XP008151220, DOI: 10.1073/pnas.1009374107 * |
| PENGYU HUANG ET AL., CELL STEM CELL, vol. 14, 6 March 2014 (2014-03-06), pages 1 - 10 |
| See also references of EP3702449A4 |
| SUZUKI, ATSUSHI: "Direct induction technology of hepatocytes for medical application", EXPERIMENTAL MEDICINE, vol. 33, no. 2, 2015, pages 72 - 79, XP009520815, ISSN: 0288-5514 * |
| WANG, MINJUN ET AL.: "Regulation of transcriptional factor during liver development", SHENGMING DE HUAXUE = CHEMISTRY OF LIFE, vol. 31, no. 3, 2011, pages 395 - 400, XP009520812, DOI: 10.13488/j.smhx.2011.03.018 * |
| YU , BING ET AL.: "Reprogramming Fibroblasts into Bipotential Hepatic Stem Cells by Defined Factors", CELL STEM CELL, vol. 13, 2013, pages 328 - 340, XP055194339, DOI: 10.1016/j.stem.2013.06.017 * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3702449A4 (en) | 2021-07-28 |
| JPWO2019082874A1 (ja) | 2020-09-17 |
| US20210189347A1 (en) | 2021-06-24 |
| JP7307478B2 (ja) | 2023-07-12 |
| EP3702449A1 (en) | 2020-09-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Verfaillie et al. | Unexpected potential of adult stem cells | |
| Bossolasco et al. | Neuro-glial differentiation of human bone marrow stem cells in vitro | |
| Marcus et al. | Fetal stem cells from extra‐embryonic tissues: do not discard | |
| Li et al. | Hepatoblast-like progenitor cells derived from embryonic stem cells can repopulate livers of mice | |
| Sun et al. | Retinal stem/progenitor properties of iris pigment epithelial cells | |
| US20190161734A1 (en) | Derivation of hepatic stem cells and mature liver cell types and uses thereof | |
| US11920160B2 (en) | Pancreatic insulin-producing beta-cell lines derived from human pluripotent stem cells | |
| JP2005523328A (ja) | 胎盤由来の幹細胞及びその使用 | |
| WO2011102532A1 (ja) | 誘導肝細胞 | |
| JP2009225661A (ja) | 胚性幹細胞のインスリン分泌細胞への分化誘導方法、該方法により誘導されるインスリン分泌細胞およびその用途 | |
| JPWO2007010858A1 (ja) | 骨格筋組織由来の単一細胞よりクローン化した多能性幹細胞 | |
| Dimomeletis et al. | Assessment of human MAPCs for stem cell transplantation and cardiac regeneration after myocardial infarction in SCID mice | |
| JP2015109833A (ja) | 線維芽細胞から血管内皮細胞を製造する方法 | |
| Cheng et al. | Conversion of human adipose-derived stem cells into functional and expandable endothelial-like cells for cell-based therapies | |
| WO2018144725A1 (en) | Engineering blood vessel cells for transplantation | |
| Raju et al. | The road to regenerative liver therapies: the triumphs, trials and tribulations | |
| JP6095272B2 (ja) | 上皮系体性幹細胞の製造方法 | |
| JPWO2005024004A1 (ja) | 間葉系幹細胞の肝細胞への分化方法及び人工ヒト肝臓細胞 | |
| JP7307478B2 (ja) | ダイレクトリプログラミングによる肝幹細胞又は肝前駆細胞の製造方法 | |
| JP2018113962A (ja) | 高分化度の多能性幹細胞由来細胞の製造方法 | |
| KR101587231B1 (ko) | 체세포에서 간세포로의 직접교차분화 촉진용 조성물 및 방법 | |
| JP2005095138A (ja) | 多分化能を有する細胞の分化誘導方法 | |
| KR20200045984A (ko) | 소포체 스트레스 완화제를 이용한 생체 외 배양 간세포 제조방법 및 이를 통해 마련된 생체 외 배양 간세포 | |
| WO2014038652A1 (ja) | 膵臓由来体性幹細胞の製造方法 | |
| KR20200045983A (ko) | 소포체 스트레스 완화제를 이용한 생체 외 배양 간세포 제조방법 및 이를 통해 마련된 생체 외 배양 간세포 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 18870975 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2019551148 Country of ref document: JP Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 2018870975 Country of ref document: EP Effective date: 20200525 |