WO2014069875A2 - 아세트아미노펜의 신규한 제조방법 - Google Patents
아세트아미노펜의 신규한 제조방법 Download PDFInfo
- Publication number
- WO2014069875A2 WO2014069875A2 PCT/KR2013/009680 KR2013009680W WO2014069875A2 WO 2014069875 A2 WO2014069875 A2 WO 2014069875A2 KR 2013009680 W KR2013009680 W KR 2013009680W WO 2014069875 A2 WO2014069875 A2 WO 2014069875A2
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- compound
- acetaminophen
- formula
- group
- metal catalyst
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C231/00—Preparation of carboxylic acid amides
- C07C231/22—Separation; Purification; Stabilisation; Use of additives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C231/00—Preparation of carboxylic acid amides
- C07C231/14—Preparation of carboxylic acid amides by formation of carboxamide groups together with reactions not involving the carboxamide groups
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/02—Catalysts comprising hydrides, coordination complexes or organic compounds containing organic compounds or metal hydrides
- B01J31/12—Catalysts comprising hydrides, coordination complexes or organic compounds containing organic compounds or metal hydrides containing organo-metallic compounds or metal hydrides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/18—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes containing nitrogen, phosphorus, arsenic or antimony as complexing atoms, e.g. in pyridine ligands, or in resonance therewith, e.g. in isocyanide ligands C=N-R or as complexed central atoms
- B01J31/1805—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes containing nitrogen, phosphorus, arsenic or antimony as complexing atoms, e.g. in pyridine ligands, or in resonance therewith, e.g. in isocyanide ligands C=N-R or as complexed central atoms the ligands containing nitrogen
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/24—Phosphines, i.e. phosphorus bonded to only carbon atoms, or to both carbon and hydrogen atoms, including e.g. sp2-hybridised phosphorus compounds such as phosphabenzene, phosphole or anionic phospholide ligands
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C231/00—Preparation of carboxylic acid amides
- C07C231/12—Preparation of carboxylic acid amides by reactions not involving the formation of carboxamide groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/01—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C233/16—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms
- C07C233/24—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by a carbon atom of a six-membered aromatic ring
- C07C233/25—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by a carbon atom of a six-membered aromatic ring having the carbon atom of the carboxamide group bound to a hydrogen atom or to a carbon atom of an acyclic saturated carbon skeleton
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/10—Complexes comprising metals of Group I (IA or IB) as the central metal
- B01J2531/16—Copper
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/80—Complexes comprising metals of Group VIII as the central metal
- B01J2531/82—Metals of the platinum group
- B01J2531/824—Palladium
Definitions
- the present invention relates to a novel process for preparing acetaminophen. More specifically, the present invention relates to a method for preparing acetaminophen which can realize high yield and excellent isomer selectivity while simplifying the synthesis process, and is environmentally friendly and has high economic feasibility.
- Acetaminophen is a nonsteroidal anti-inflammatory drug and is widely known to have analgesic, anti-inflammatory and antipyretic effects as a mechanism for inhibiting the synthesis of prostaglandin.
- a general method for preparing such acetaminophen there is a method of using benzene chloride and phenol as starting materials.
- banzen chloride is reacted with a mixed acid of strong acid nitric acid and sulfuric acid to proceed with nitrification reaction to produce nitrobenzene benzene as an intermediate.
- nitrification reaction a complex of regioisomers in which nitro functional groups are introduced at ortho-, meta- and para- positions of the benzene ring is produced.
- the para-nitrochloride benzene is separated from the mixture thus produced, and para-nitrophenol is synthesized through the hydroxylation reaction.
- the nitro functional group of the produced para-nitrophenol is reduced to obtain para-aminophenol, and the resulting amino functional group is acetylated to synthesize acetaminophen.
- nitro reaction is carried out by reacting with a mixed acid of nitric acid and sulfuric acid in order to introduce an amide functional group at the para-phenyl position of the phenol.
- Nitrophenols containing positional isomers are synthesized through the nitrification reaction, where only para-isomers are separated and reduced to obtain para-aminophenol, which is then acetylated to synthesize acetaminophen.
- previously known methods for preparing acetaminophen had to undergo several stages of reaction in order to introduce amino or hydroxy groups into the benzene ring.
- the introduction of nitro functional groups into the benzene ring involves the use of strong acids in manufacturing processes that are not harmful to the human body or environmentally friendly, and additional equipment or process steps are required to recover or dispose of the strong acids used and disposed of.
- nitro functional groups are introduced at least one at ortho-, meta- and para- positions to generate various positional isomers.
- a separation process for separating only the desired para-isomers had to be introduced.
- the present invention is to provide a method for preparing acetaminophen which can realize high yield and excellent isomer selectivity while simplifying the synthesis process and having eco-friendly and high economic efficiency.
- the present invention is selected from the group consisting of a copper compound and a palladium compound
- X 1 and X 2 are each independently a halogen, an alkoxy group having 1 to 4 carbon atoms, nitro (-N02), diazonium salt, sulfonate, phosphate, Tosylate, or Triflate, and in Formula 2, X 3 is an unsubstituted functional group in reaction with acetamide in X 1 and X 2 .
- X 1 and X 2 are each preferably halogen and more preferably iodine (I) in order to obtain acetaminophen with high isomeric selectivity and excellent reaction yield.
- I iodine
- acetaminophen for analgesic, anti-inflammatory, and antipyretic action, which is widely used all over the world, and acetylbenzene compounds in which specific functional groups are substituted in the presence of the metal catalyst.
- acetaminophen can be synthesized by sequentially reacting with amide and water, and completed the invention.
- acetaminophen can be provided with high yield and excellent isomer selectivity, while simplifying the synthesis process.
- organic solvents such as strong acids
- a first metal catalyst comprising at least one compound selected from the group consisting of a copper compound and a palladium compound
- the compound of formula 2 by reacting acetamide with a compound of formula 1 Forming; And reacting the compound of Chemical Formula 2 with water in the presence of a base and a second metal catalyst including a copper compound.
- a method for preparing acetaminophen may be provided.
- X 1 and X 2 are each independently halogen, alkoxy group having 1 to 4 carbon atoms, nitro (-N0 2 diazonium salt), sulfonate, phosphate, tosyl It is selected from the group consisting of Tosylate, and Triflate, and in Formula 2, X 3 is an unsubstituted functional group in reaction with acetamide of X 1 and X 2 .
- the method for preparing acetaminophen using a compound of Formula 1 as a starting material, introducing a functional group at a para- (ar—) position in a conventional production method
- the step of separating the positional isomers of ortho- (riAi? ”), Meta-Oseia ⁇ , and para- ra) generated from the nitrification reaction may be omitted.
- the method for preparing acetaminophen is X in the para- (para-) position of the compound of Formula 1. 1 , X 2 leaving group and the metal catalyst, due to the combined effect of the high isomer selectivity compared to the conventional manufacturing method, acetaminophen can be obtained with excellent reaction yield.
- One of X 1 and X 2 may be acetamide to form Formula 2 in the ara form. That is, accordingly, in the method for preparing acetaminophen, the acetaminophen that is finally synthesized by forming the compound of Formula 2 as an intermediate in the presence of a metal catalyst can be almost obtained only in para form.
- Copper compounds included in the first metal catalyst or the second metal catalyst are copper halides, copper acetate (Cu (0Ac) 2 ), copper cyanide (CuCN), copper triflate (Cu (OTf) 2 ), copper triflate benzene Composite ((CuOTf) 2 Benzene), copper sulfate (CuS0 4 ), or a combination thereof.
- copper halide copper chloride, copper bromide or copper iodide.
- the palladium compound may be palladium acetate (Pd (0Ac) 2 ), trisdibenzylideneacetonedipalladium (Pd 2 (dba) 3 ), or a combination thereof.
- the amount of the first metal catalyst used in the step of forming the compound of Chemical Formula 2 may be appropriately adjusted according to the amount of the semicoupling added.
- the metal catalyst may be used in an amount of 0.1 to 10 niol3 ⁇ 4, preferably 1 to 4 mo 1% of the total reactants.
- the first metal catalyst may further include an organic ligand compound.
- the organic ligand compound may form a complex with the metal catalyst, and may increase the selectivity of isomers of acetaminophen prepared with the activity of the catalyst by donating electrons to the metal catalyst.
- the free ligand may be appropriately adjusted depending on the specific components or properties of the metal catalyst used. Specifically, an amine compound, an amino acid, an organophosphorus compound, or a combination of two or more thereof may be used as the organic ligand compound.
- the added organic ligand compound shows a difference in catalyst activity and yield depending on the type of metal catalyst.
- a metal catalyst containing a copper compound it is highly preferable to add an amine compound or an amino acid as the organic ligand compound. It is preferable to obtain a yield, and it is more preferable to add a diamine.
- an organic or phosphorus compound when reacting in the presence of a metal catalyst containing a palladium compound, it is preferable to add an organic or phosphorus compound.
- ⁇ -based compound examples include ethylenediamine (et hy 1 ened i am i ne), A ⁇ V'-dimethylethylenediamine (C-dimethylethylenediamine, DMEDA), ⁇ , ⁇ , ⁇ ', ⁇ ' -Tetramethylethylenediamine (, ⁇ , ⁇ ', N'-tetramethyl ethyl ened i amine), cyclohexanediamine, ⁇ , ⁇ -dimethylcyclonucleic acid diamine -dimethyol lohexanediamine, 1,10-phenanthroline, or a combination of two or more thereof.
- the amino acid include glycine, proline, dimethylglycine 0V, A iimethylglycine, or a combination of two or more thereof
- the organophosphorus compound may be hydrogen or A hydrocarbon-substituted compound, specifically hydrogen, an alkyl group having 1 to 20 carbon atoms, having 2 to 20 carbon atoms An alkenyl group, an alkynyl group having 2 to 20 carbon atoms, a cycloalkylene group having 4 to 20 carbon atoms, an aryl group having 6 to 20 carbon atoms, or an aliphatic hetero group having 5 to 30 carbon atoms including nitrogen, oxygen, or sulfur Ring groups or aromatic hetero ring groups.
- organophosphorus compounds include 2- (Dicylcohexylphosphino) biphenyl, 2- (di-tert-butylphosphino) biphenyI, ⁇ , Xantphos, or a combination of two or more thereof.
- the molar ratio of the first metal catalyst and the organic ligand compound is 1: 1 to
- 1:20 preferably 1: 1 to 1:10, more preferably 1: 1 to 1: 5.
- the degree of catalytic activity may be insignificant, and when the molar ratio of the organic ligand compound is greater than 1:20, the purification process may be difficult.
- Forming the compound of Formula 2 may be carried out in the presence of an organic solvent.
- organic solvent that can be used include benzene, toluene, alkylbenzene, dimethyl sulfoxide (DMS0), dimethylformamide (DMF), tetrahydrofuran (THF), dioxane, and ethyl acetate (EA ), Or a combination thereof.
- the forming of the compound of Chemical Formula 2 may further include adding a base.
- a base is added in the step of reacting the compound of Formula 1 with acetamide in the presence of the metal catalyst, the compound of Formula 2 which is an intermediate by effectively mediating the reaction between the compound of Formula 1, acetamide and the first metal catalyst It is possible to more efficiently enable the formation of, thereby reducing the overall reaction time while improving the efficiency of the manufacturing process and the selectivity of the final reaction result.
- the type of the base that can be used in the step of forming the compound of Formula 2 is not particularly limited, and specific examples thereof include powdered or granular potassium triphosphate (K 3 P0 4 ) and potassium carbonate (K 2 C0 3 ), Carbonate (Cs 2 CO 3 ), potassium fluoride (KF), sodium fluoride (NaF), cesium fluoride (CsF), tetrabutylammonium fluoride (TBAF), or a combination thereof. have.
- Forming the compound of Formula 2 may be made at 25 to 200 ° C, preferably 60 to 150 ° C, more preferably 70 to 130 ° C. When the reaction temperature is less than 25 ° C.
- reaction yield may be greatly reduced or the amount of acetaminophen produced may be insignificant, and if the reaction temperature is more than 200 ° C unnecessary unwanted reaction Excessive or stereoisomer selectivity of the final composite may be significantly lowered.
- the compound of formula (2) obtained by reacting the compound of formula (1) with acetamide in the presence of the first metal catalyst described above is reacted with water in the presence of a base and a second metal catalyst containing a copper compound to the X 1 and
- the unsubstituted functional group in X 2 may be substituted with a hydroxyl group.
- Water reflecting the compound of Formula 2 may be distilled water, ultrapure water or deionized water as well as general water.
- bases that can be used in this reaction step are not particularly limited, but specifically, powdered or particulate tribasic potassium phosphate (K 3 P0 4 ), potassium carbonate (K 2 C0 3 ), cesium carbonate (Cs 2 C3 ⁇ 4) , Potassium fluoride (KF), sodium fluoride (NaF), cesium fluoride (CsF), tetrabutylammonium fluoride (TBAF), or a combination of two or more thereof can be used.
- K 3 P0 4 powdered or particulate tribasic potassium phosphate
- K 2 C0 3 potassium carbonate
- Cs 2 C3 ⁇ 4 cesium carbonate
- KF potassium fluoride
- NaF sodium fluoride
- CsF cesium fluoride
- TBAF tetrabutylammonium fluoride
- the copper compound is copper halide, copper acetate (Cu (0Ac) 2 ), copper cyanide (CuCN), triflate copper (Cu (0Tf) 2 ), triflate copper benzene complex ((CuOTf) 2 Benzene), copper sulfate 4 ), or a combination thereof, and specific examples of copper halides include copper chloride, copper bromide, and copper iodide. Preference is given to using copper halides for high yields.
- the second metal catalyst may further include an organic ligand compound.
- the organic ligand compound may form a complex with the metal catalyst, and may increase the selectivity of isomers of acetaminophen prepared with the activity of the catalyst by donating electrons to the metal catalyst.
- the free ligand may be appropriately adjusted depending on the specific components or properties of the metal catalyst used.
- the amount of the second metal catalyst used in the step of reacting the compound of Formula 2 with water may be appropriately adjusted according to the amount of reactant to be introduced.
- the second metal catalyst may be 5 to 15 of the total reaction product. mol%, preferably 8 to 13 mol% may be used.
- the molar ratio of the metal catalyst and the organic ligand compound may be 1: 1 to 1:20, preferably 1: 1 to 1:10, and more preferably 1: 1 to 1: 5.
- the molar ratio of the catalyst and the organic ligand compound is less than 1: 1, the degree of catalytic activity may be insignificant, and when the molar ratio of the organic ligand compound is greater than 1:20, the purification process may be somewhat difficult.
- the organic ligand compound include an amine compound, an amino acid, or a combination thereof.
- the amine compound may be ethylenediamine (ethyl enedi amine), ⁇ , ⁇ - dimethyl ethylenediamine ( ⁇ , N'-dimethyl ethyl enedi amine, DMEDA), ⁇ , ⁇ , ⁇ ', ⁇ -tetramethyl Ethylenediamine ⁇ !! ⁇ ! ⁇ ), cyclohexanediamine, ⁇ , ⁇ '-dimethylcyclohexanediamine (N, N'-dimethylcyclohexanediamine), 1,10 Phenanthroline (l, 10-phenanthroline), or a combination of two or more thereof.
- amino acid examples include glycine, proline, dimethylglycine, or a combination of two or more thereof.
- the step of reacting the compound of Formula 2 with water may proceed in the presence of a predetermined solvent.
- a mixture of a water-soluble solvent and an organic solvent or a water-soluble solvent alone may be used as the solvent.
- Preferred examples of the solvent are DMS0 Or a mixture of an aqueous solvent containing an organic solvent of DMF and water, or water.
- the step of reacting the compound of Formula 2 with an aqueous solution is preferably performed in an aqueous solvent.
- Preferred examples of the water-soluble solvent include water.
- the reaction of the compound of Formula 2 and water may be performed at 25 to 200 ° C., preferably at 100 to 200 ° C., more preferably at 130 to 200 ° C.
- the reaction temperature is less than 25 ° C, the reactions are not sufficiently reacted so that the reaction yield is greatly reduced or the amount of acetaminophen produced is insignificant.
- the reaction temperature is more than 2C C, unnecessary side reactions are excessively excessive. May occur or the stereoisomer selectivity of the final composite may be significantly lowered.
- the reaction container can be used without limitation as long as it can be commonly used in the synthesis of the compound, and the size, form and type of the reaction can be appropriately adjusted in consideration of reaction conditions, the amount of reaction and the amount of the product.
- a glass round bottom flask, a reaction vessel capable of injecting inert gas or removing air, or a reaction vessel capable of withstanding high pressure, such as a pressure tube may be used.
- an economical and efficient method for preparing acetaminophen which can exhibit excellent isomer selectivity and can omit the separation process of positional isomers, and more specifically, it is environmentally friendly and excellent because no strong acid is used in the manufacturing process.
- a novel process for preparing acetaminophen can be provided which yields the final product in reaction yield.
- N-acetyl-paraiodoaniline (1 mmol), CsF (2 ⁇ ol), CuKO.l mmol) and DMEDA (0.5 ⁇ ol) synthesized in the above pressure tube were mixed with distilled water (3 ⁇ 40, 4 mL). ), Inert gas was injected and stirred, and the reaction temperature was raised to 160 ° C or 180 ° C and reacted for 24 hours.
- Example 1 except for using the para- dichlorobenzene (1 mmol, formula 2-3) in place of the para- diiodoben point Kl ⁇ ol) In the same manner, N-Acetyani p-chroloani Hne and Acetaminophen were prepared.
- acetaminophen can be synthesized with high isomer selectivity and high reaction yield by using para-dihalogenated benzene as a starting material and using a specific metal catalyst as an intermediate of N-acetylpypara-halogenated aniline. there was.
- the synthesis process can be simplified by introducing a nitro group at the para position of the benzene ring, or by omitting the reduction of the nitro group, and a strong acid required for the step of replacing the nitro group. Since the use of organic solvents can be suppressed, acetaminophen can be produced in an eco-friendly and economic manner.
- acetaminophen can be produced in a high yield (Example 1) of 60% or more through the manufacturing process of acetaminophen, which is simpler, more economical, and environmentally friendly than the existing process.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Inorganic Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
본 발명은 아세트아미노펜의 신규한 제조방법에 관한 것으로서, 보다 상세하게는 금속촉매의 존재하에 특정 작용기가 치환된 벤젠 화합물을 아세트아마이드와 반응시키는 단계; 및 금속촉매와 염기의 존재하에, 상기 생성물과 수용액을 반응시켜 아세트아미노펜을 제조하는 단계;를 포함하는 아세트아미노펜의 제조방법에 관한 것이다. 특히, 제조 공정에서 강산을 사용하지 않아 친환경적이고, 위치 이성질체의 분리 공정을 생략하고 높은 반응수율로 아세트아미노펜을 제조할 수 있어 효율적, 경제적인 아세트아미노펜의 제조방법에 관한 것이다.
Description
【명세서】
【발명의 명칭】
아세트아미노펜의 신규한 제조방법
【기술분야】
본 발명은 아세트아미노펜의 신규한 제조방법에 관한 것이다. 보다 구체적으로는, 합성 과정을 단순화 하면서도 높은 수율과 우수한 이성질체 선택성을 구현할 수 있으며 친환경적이고 높은 경제성을 갖는 아세트아미노펜의 제조 방법에 관한 것이다.
【발명의 배경이 되는 기술】
아세트아미노펜은 비스테로이드성 항염증약으로서, 프로스타글란딘 (prostaglandin)의 합성을 억제하는 메커니즘으로 진통, 항염증, 해열 작용을 하는 것으로 알려져 널리 사용되고 있다.
이러한 아세트아미노펜을 제조하는 일반적인 방법으로는 염화벤젠과 페놀을 출발물질로 하는 방법이 있다. 염화벤젠을 출발물질로 하는 방법에서는, 염화밴젠을 강산인 질산과 황산의 흔합산과 반응시켜 나이트로화 반웅을 진행하고 중간 물질인 나이트로염화벤젠을 생성한다. 이때, 나이트로화 반웅 과정에서 벤젠 고리의 오쏘 -(ortho-), 메타 -(metaᅳ), 그리고 파라 -(para-)위치에 나이트로 작용기가 도입된 위치이성질체들의 흔합물이 생성된다. 이렇게 생성된 흔합물로부터 파라-나이트로염화벤젠을 분리하고, 하이드록시화 반응을 통하여 파라-나이트로페놀을 합성한다. 생성된 파라-나이트로페놀의 나이트로 작용기를 환원하여 파라- 아미노페놀을 얻고, 생성된 아미노작용기를 아세틸화반웅 시켜 아세트아미노펜을 합성한다.
벤젠 고리에 하이드록시가 이미 도입되어 있는 페놀을 출발 물질로 하는 방법에서는, 페놀의 파라ᅳ위치에 아미드 작용기를 도입시키기 위하여 질산과 황산의 흔합산과 반웅시켜 나이트로화 반웅을 진행한다. 상기 나이트로화 반웅을 통하여 위치 이성질체들을 포함한 나이트로 페놀을 합성되며, 여기에서 파라 -이성질체만 분리하고 환원시켜 파라-아미노페놀을 얻고, 이를 아세틸화반웅시켜 아세트아미노펜을 합성한다.
그러나, 이전에 알려진 아세트아미노펜의 제조 방법들은 벤젠 고리에 아미노기나 히드록시기를 도입하기 위하여 여러 단계의 반응을 거쳐야 하였다. 특히 벤젠 고리에 나이트로 작용기를 도입하는 과정에서 강산을 사용하여 인체에 유해하거나 친환경적이지 않은 제조 공정이 포함되었고, 사용하고 폐기되는 강산을 회수하거나 처리하기 위하여 추가적인 장치나 공정 단계가 요구되었다.
또한, 벤젠 고리의 나이트로화 반웅에서는 나이트로 작용기가 오쏘- (ortho-), 메타 -(meta -), 그리고 파라 -(para-) 위치에 1 이상 도입되어 다양한 위치 이성질체가 생성되기 때문에, 이들 중 원하는 파라- 이성질체만을 분리해 내는 분리 공정이 반드시 도입하여야 하는 제한이 있었다. 그리고, 이와 같이 파라 -이성질체만 분리하는 공정에 의한다고 하여도 최종 제품의 합성 수율이나 선택도를 높이는 데에도 일정한 한계가 있었다.
이에 따라, 합성 과정을 단순화 하면서도 높은 수율과 우수한 이성질체 선택성을 가지고 아세트아미노펜을 합성해낼 수 있으면서도, 최근 높아져가는 환경 규제와 인체에 대한 제조 공정의 유해성 문제를 모두 층족할 수 있는 친환경적인 제조 공정 설계가 가능한 아세트아미노펜의 제조 방법에 대한 개발이 요구되고 있다.
【발명의 내용】
【해결하고자 하는 과제】
본 발명은 합성 과정을 단순화 하면서도 높은 수율과 우수한 이성질체 선택성을 구현할 수 있으며 친환경적이고 높은 경제성을 갖는 아세트아미노펜의 제조 방법을 제공하는 것이다.
【과제의 해결 수단】
본 발명은, 구리 화합물 및 팔라듐 화합물로 이루어진 군에서 선택된
1 종 이상의 화합물을 포함하는 제 1 금속 촉매의 존재하에, 하기 화학식 1의 화합물과 아세트아마이드를 반웅시켜 하기 화학식 2의 화합물을 형성하는 단계; 및 구리 화합물을 포함하는 제 2 금속 촉매와 염기의 존재 하에, 상기 형성된 화학식 2 의 화합물을 물과 반웅시키는 단계;를 포함하는 아세트아미노펜의 제조 방법을 제공한다.
[화학식 1]
상기 화학식 1 에서, X1 및 X2는 각각 독립적으로 할로겐, 탄소수 1 내지 4 의 알콕시기, 나이트로 (-N02), 디아조늄 염 (Diazonium salt), 술포네이트 (Sulfonate), 포스페이트 (Phosphate), 토실레이트 (Tosylate), 또는 트리풀레이트 (Triflate)이고, 상기 화학식 2 에서, X3는 상기 X1 및 X2 중 상기 아세트아마이드와의 반웅에서 치환되지 않은 작용기이다. 상기 X1 및 X2 는 높은 이성질체 선택성과, 우수한 반응 수율로 아세트아미노펜을 수득하기 위하여 각각 할로겐인 것이 바람직하고, 요오드 (I)인 것이 더욱 바람직하다. 이하 발명의 구체적인 구현예에 따른 아세트아미노펜의 제조방법에 관하여 보다 상세하게 설명하기로 한다.
본 발명자들은, 전세계적으로 널리 사용되는 진통, 항염증, 해열 작용을 하는 아세트아미노펜의 친환경적, 효율적, 경제적인 제조방법에 대하여 연구하여, 상기 금속 촉매의 존재 하에 특정 작용기가 치환된 벤젠 화합물을 아세트아마이드 및 물과 순차적으로 반웅시킴으로서 아세트아미노펜을 합성할 수 있다는 점을 실험을 통하여 확인하고 발명을 완성하였다.
이러한 제조 방법에 따르면 합성 과정을 보다 단순화 하면서도 높은 수율과 우수한 이성질체 선택성으로 아세트아미노펜을 제공할 수 있고,
강산 등의 유기 용매의 사용을 최소화하여 친환경적이고 인체에 유해하지 않은 공정을 설계할 수 있고, 밴젠 고리에 하이드톡시기나 아미노기를 도입하기 위하여 다양한 화합물과 복잡한 공정을 거치지 않기 때문에 공정 설계 비용과 최종 제품의 생산 비용을 절감할 수 있다.
발명의 일 구현 예에 따르면, 구리 화합물 및 팔라듐 화합물로 이루어진 군에서 선택된 1 종 이상의 화합물올 포함하는 제 1 금속 촉매의 존재하에, 하기 화학식 1 의 화합물과 아세트아마이드를 반응시켜 하기 화학식 2의 화합물을 형성하는 단계; 및 구리 화합물을 포함하는 제 2 금속 촉매와 염기의 존재 하에, 상기 형성된 화학식 2 의 화합물을 물과 반웅시키는 단계;를 포함하는 아세트아미노펜의 제조 방법이 제공될 수 있다.
상기 화학식 1 에서, X1 및 X2는 각각 독립적으로 할로겐, 탄소수 1 내지 4 의 알콕시기, 나이트로 (-N02 디아조늄 염 (Diazonium salt), 술포네이트 (Sulfonate), 포스페이트 (Phosphate) , 토실레이트 (Tosylate), 및 트리플레이트 (Trif late)으로 이루어진 군에서 선택되고, 상기 화학식 2 에서, X3 는 상기 X1 및 X2 중 상기 아세트아마이드와의 반웅에서 치환되지 않은 작용기이다.
상기 아세트아미노펜의 제조방법에서는 화학식 1 의 화합물을 출발 물질로 하여, 기존의 제조방법에서 파라 -( ar— )위치에 작용기를 도입하기
위하여 수행된, 나이트로화 반웅에서 생성된 오쏘- ( riAi?"), 메타 -Oseia一), 및 파라— ra— )의 위치 이성질체를 분리하는 공정이 생략 될 수 있다. 또한, 상기 나이트로화 반응에서 첨가한 질산과 황산 같은 강산을 사용하지 않아 경제적, 효율적이며, 친환경적인 제조방법이다. 이에 더하여, 상기 아세트아미노펜의 제조방법은 화학식 1 의 화합물의 파라 -(para-)위치에 존재하는 X1, X2 의 이탈기와, 금속촉매의 복합적인 영향으로 기존 제조방법에 비해 높은 이성질체 선택성을 나타내며, 우수한 반응 수율로 아세트아미노펜을 수득 할 수 있다.
보다 상세하게는, 상기 구리 화합물 및 팔라듐 화합물로 이루어진 군에서 선택된 1 종 이상의 화합물을 포함하는 제 1 금속 촉매의 존재 하에 상기 화학식 1의 화합물을 아세트아마이드와 반웅시키면, 상기 화학식 1의
X1 및 X2 중 하나가 아세트아마이드화 되어 파라 ( ara) 형태의 화학식 2 가 형성될 수 있다. 즉, 이에 따라, 상기 아세트아미노펜의 제조 방법에서는 금속 촉매의 존재 하에 화학식 2 의 화합물을 중간체로 형성함으로서 최종 합성되는 아세트아미노펜이 거의 대부분 파라 (para) 형태로만 얻어질 수 있다.
상기 제 1금속 촉매 또는 제 2금속 촉매에 포함되는 구리 화합물은 할로겐화 구리, 구리 아세테이트 (Cu(0Ac)2), 시안화구리 (CuCN), 트리플레이트구리 (Cu(OTf)2), 트리플레이트구리벤젠복합물 ((CuOTf)2Benzene), 황산구리 (CuS04), 또는 이들의 흔합물일 수 있다. 상기 아세트아미노펜의 제조 방법의 수율을 향상시키기 위해서는 상기 구리 화합물로 할로겐화 구리를 사용하는 것이 바람직하며, 상기 할로겐화 구리의 구체적인 예로는 염화구리, 브롬화구리 또는 요오드화구리를 들 수 있다.
또, 상기 팔라듐 화합물은 팔라듐 아세테이트 (Pd(0Ac)2), 트리스다이벤질리데아세톤다이팔라듐 (Pd2(dba)3), 또는 이들의 흔합물일 수 있다.
상기 화학식 2 의 화합물을 형성하는 단계에 있어서 사용되는 제 1 금속촉매의 양은 투입되는 반웅물의 양에 따라 적절히 조절될 수
있으며, 예를 들어 상기 금속촉매는 전체 반응물 중 0.1 내지 10 niol¾, 바람직하게는 1 내지 4 mo 1%사용될 수 있다.
상기 제 1 금속 촉매는 유기 리간드 화합물을 더 포함 할 수 있다. 상기 유기 리간드 화합물은 상기 금속 촉매와 착체를 형성할 수 있으며, 상기 금속 촉매에 전자를 공여하여 촉매의 활성과 함께 제조되는 아세트아미노펜의 이성질체의 선택성을 보다 높일 수 있다.
상기 유리 리간드는 사용되는 금속 촉매의 구체적인 성분이나 특성에 따라서 적절히 조절될 수 있다. 구체적으로, 상기 유기 리간드 화합물로 아민계 화합물, 아미노산, 유기 인계 화합물 또는 이들의 2 종 이상의 흔합물을 사용할 수 있다.
상기 첨가하는 유기 리간드 화합물은 금속촉매의 종류에 따라 촉매 활성도와 수율에 차이를 보이는데, 구리 화합물을 포함하는 금속촉매의 존재하에 반응시키는 경우, 유기 리간드 화합물로 아민계 화합물 또는 아미노산을 첨가하는 것이 높은 수율을 얻을 수 있어 바람직하며, 다이아민을 첨가하는 것이 더욱 바람직하다. 또한, 팔라듐 화합물을 포함하는 금속촉매의 존재 하에 반응시키는 경우, 유기, 인계화합물 첨가하는 것이 바람직하다.
Λ 아민계 화합물의 구체적인 예로는 에틸렌다이아민 ( e t hy 1 ened i am i ne ), A^V'-다이메틸에틸렌다이아민 (씨 - dimethylethylenedi amine, DMEDA) , Ν,Ν,Ν',Ν'- 테트라메틸에틸렌다이아민 ( , Ν, Ν', N'-t etramethyl ethyl ened i amine), 사이클로핵산다이아민 (cyclohexanediamine), Ν,Μ - 다이메틸사이클로핵산다이아민
-d i me t hy 1 eye lohexanedi amine) , 1,10- 페난트롤린 (1,10-phenanthroline), 또는 이들의 2종 이상의 흔합물을 들 수 있다.
상기 아미노산의 구체적인 예로는 글라이신 (glycine), 프를린 (proline), 씨다이메틸글라이신 0V,A iimethylglycine), 또는 이들의 2 종 이상의 흔합물을 들 수 있고, 상기 유기 인계 화합물은 인원자에 수소 또는 탄화수소가 치환된 화합물을 의미하며, 구체적으로 중심 인 원자에 수소, 탄소수 1 내지 20 의 알킬기, 탄소수 2 내지 20 의
알케닐기, 탄소수 2 내지 20 의 알키닐기 (alkynyl), 탄소수 4 내지 20 의 사이클로 알킬렌기, 탄수소 6 내지 20 의 아릴기 (aryl) 또는 질소, 산소 또는 황을 포함하는 탄소수 5 내지 30의 지방족 헤테로 고리기 또는 방향족 해테로 고리기를 포함할 수 있다. 그리고, 이러한 유기 인계 화합물의 바람직한 예로는 2-(Dicylcohexylphosphino)biphenyl, 2-(di-tert- butylphosphino)biphenyI , ΒΙΝΑΡ, 잔트포스 (Xantphos) 또는 이들의 2 종 이상의 흔합물을 들 수 있다.
상기 제 1 금속촉매와 유기 리간드 화합물의 몰 비율은 1:1 내지
1:20 일 수 있고, 바람직하게는 1:1 내지 1:10, 더욱 바람직하게는 1:1 내지 1:5 일 수 있다. 촉매와 유기 리간드 화합물의 몰 비율이 1:1 미만인 경우, 촉매활성 정도가 미미할 수 있고, 1:20 을 초과하는 경우 정제 공정이 어려울 수 있다.
상기 화학식 2 의 화합물을 형성하는 단계는 유기 용매의 존재 하에 진행 될 수 있다. 상기 사용 가능한 유기 용매의 구체적인 예로는 벤젠, 를루엔, 알킬벤젠, 다이메틸설폭사이드 (DMS0), 다이메틸포름아미드 (DMF), 테트라하이드로 퓨란 (THF), 다이옥센 (Dioxane), 에틸아세테이트 (EA), 또는 이들의 흔합물을 들 수 있다.
한편, 상기 화학식 2 의 화합물을 형성하는 단계는 염기를 첨가하는 단계를 더 포함할 수 있다. 상기 금속 촉매의 존재 하에, 화학식 1 의 화합물과 아세트아마이드를 반웅시키는 단계에서 염기가 첨가됨에 따라서, 화학식 1 의 화합물, 아세트아마이드 및 제 1 금속촉매 사이의 반응을 효과적으로 매개하여 중간체인 화학식 2 의 화합물의 형성을 보다 효율적으로 가능하게 할 수 있으며, 이에 따라 전체 반웅시간은 즐어들면서도 제조 과정의 효율 및 최종 반웅 결과물의 선택성은 향상될 수 있다.
상기 화학식 2의 화합물을 형성하는 단계에서 사용될 수 있는 염기의 종류는 크게 한정되는 것은 아니며, 이의 구체적인 예로는 분말형 또는 입자형의 제삼인산칼륨 (K3P04), 탄산칼륨 (K2C03), 탄산세슴 (Cs2C03), 플루오르화 칼륨 (KF), 플루오르화 나트륨 (NaF), 플루오르화 세슘 (CsF), 테트라부틸암모니움플루오라이드 (TBAF), 또는 이들의 흔합물을 들 수 있다.
상기 화학식 2 의 화합물을 형성하는 단계는 25 내지 200 °C에서 이루어질 수 있고, 바람직하게는 60 내지 150 °C , 보다 바람직하게는 70 내지 130 °C에서 이루어 질 수 있다. 상기 반응 온도가 25 °C 미만인 경우에는 상기 반웅물들이 층분히 반응하지 못하여 반응 수율이 크게 저하되거나 생성되는 아세트아미노펜의 양이 미미할 수 있으며, 상기 반웅 온도가 200 °C 초과인 경우에는 불필요한 부반옹이 과도하게 일어나거나 최종 합성물의 입체 이성질체 선택성이 크게 저하될 수 있다.
한편, 상술한 제 1 금속 촉매의 존재하에 화학식 1 의 화합물과 아세트아마이드를 반응시켜 얻어진 화학식 2 의 화합물은, 구리화합물을 포함하는 제 2 금속 촉매와 염기의 존재 하에 물과 반웅함으로서 상기 X1 및 X2중 치환되지 않은 작용기가 하이드록시기로 치환될 수 있다.
상기 화학식 2 의 화합물과 반옹하는 물은 일반적인 물 뿐만 아니라 증류수, 초정수 또는 탈이온수 일 수 있다.
이러한 반웅 단계에서 사용 가능한 염기의 예는 크게 제한되는 것은 아니나, 구체적으로 분말형 또는 입자형의 제삼인산칼륨 (K3P04), 탄산칼륨 (K2C03), 탄산세슘 (Cs2C¾), 플루오르화 칼륨 (KF), 플루오르화 나트륨 (NaF), 플루오르화 세슘 (CsF), 테트라부틸암모니움플루오라이드 (TBAF), 또는 이들의 2 종 이상의 흔합물을 사용할 수 있다.
상기 구리 화합물은 할로겐화 구리, 구리 아세테이트 (Cu(0Ac)2), 시안화구리 (CuCN), 트리플레이트구리 (Cu(0Tf)2), 트리플레이트구리벤젠복합물 ((CuOTf)2Benzene), 황산구리 (CuS04), 또는 이들의 흔합물일 수 있는데, 할로겐화 구리의 구체적인 예로는 염화구리, 브름화구리, 요오드화구리를 들 수 있다. 높은 수율을 위해 할로겐화 구리를 사용하는 것이 바람직하다.
상기 제 2 금속 촉매는 유기 리간드 화합물을 더 포함 할 수 있다. 상기 유기 리간드 화합물은 상기 금속 촉매와 착체를 형성할 수 있으며, 상기 금속 촉매에 전자를 공여하여 촉매의 활성과 함께 제조되는 아세트아미노펜의 이성질체의 선택성을 보다 높일 수 있다.
상기 유리 리간드는 사용되는 금속 촉매의 구체적인 성분이나 특성에 따라서 적절히 조절될 수 있다. 상기 구리 화합물을 포함하는 제 2 금속 촉매의 경우, 유기 리간드로서 아민계 화합물 또는 아미노산을 사용하는 것이 바람직하고, 보다 바람직하게는 다이 아민 화합물을 사용하는 것이 바람직하다.
상기 화학식 2 의 화합물과 물을 반웅시키는 단계에 있어서 사용되는 제 2 금속촉매의 양은 투입되는 반응물의 양에 따라 적절히 조절될 수 있으며, 예를 들어 상기 제 2 금속촉매는 전체 반웅물 중 5 내지 15 mol%, 바람직하게는 8 내지 13 mol%사용될 수 있다.
상기 금속촉매와 유기 리간드 화합물의 몰 비율은 1:1 내지 1:20 일 수 있고, 바람직하게는 1:1 내지 1:10, 더욱 바람직하게는 1:1 내지 1:5 일 수 있다. 촉매와 유기 리간드 화합물의 몰 비율이 1:1 보다 미만인 경우, 촉매활성 정도가 미미할 수 있고, 1:20 을 초과하는 경우 정제과정이 다소 어려울 수 있다.
상기 유기 리간드 화합물의 구체적인 예로는 아민계 화합물, 아미노산, 또는 이들의 흔합물을 들 수 있다. 상기 아민계 화합물은 구체적으로 에틸렌다이아민 (ethyl enedi amine), Ν,Ν- 다이메틸에틸렌다이아민 (Ν , N '-dimethyl ethyl enedi amine, DMEDA), Ν,Ν,Ν',Ν - 테트라메틸에틸렌다이아민^ ,!니^—^ ^ ^^! ^^ ^), 사이클로핵산다이아민 (cyclohexanediamine), Ν,Ν' - 다이메틸사이클로핵산다이아민 (N,N'-dimethylcyclohexanediamine), 1,10- 페난트롤린 (l,10-phenanthroline), 또는 이들의 2 종 이상의 흔합물 일 수 있다.
또한 상기 아미노산의 구체적인 예로는 글라이신 (glycine), 프를린 (proline), , 다이메틸글라이신 (씨 dimethylglycine), 또는 이들의 2종 이상의 흔합물을 들 수 있다.
또한, 상기 화학식 2 의 화합물과 물을 반응시키는 단계는 소정의 용매의 존재 하에 진행 될 수 있다. 상기 화학식 2 의 화합물과 물을 반웅시키는 단계에서는, 수용성 용매 및 유기 용매의 흔합물 또는 수용성 용매 단독을 용매로 사용할 수 있다. 상기 용매의 바람직한 예로는 DMS0
또는 DMF의 유기용매와 물을 포함하는 수용성 용매의 흔합물, 또는 물을 들 수 있다. 다만, 최종 합성되는 아세트아미노펜에 대한 반응 수율과 이성질체 선택성 등을 향상시키고 유기용매를 분리해 내는 공정을 생략하기 위하여, 상기 화학식 2 의 화합물과 수용액을 반응시키는 단계는 수용성 용매 내에서 이루어지는 것이 바람직하며, 상기 수용성 용매의 바람직한 예로는 물을 들 수 있다.
상기 화학식 2 의 화합물과 물을 반웅시키는 단계는 25 내지 200 °C에서 이루어질 수 있고, 바람직하게는 100 내지 200 °C, 보다 바람직하게는 130 내지 200 °C에서 이루어 질 수 있다. 상기 반웅 은도가 25 °C 미만인 경우에는 상기 반응물들이 층분히 반웅하지 못하여 반웅 수율이 크게 저하되거나 생성되는 아세트아미노펜의 양이 미미할 수 있으며, 상기 반웅 온도가 2C C 초과인 경우에는 불필요한 부반응이 과도하게 일어나거나 최종 합성물의 입체 이성질체 선택성이 크게 저하될 수 있다. 반웅 용기로는 화합물의 합성 등에 통상적으로 사용될 수 있는 것이면 별 다른 제한 없이 사용 가능하고, 반웅 조건, 반웅물의 양 및 생성물의 양 등을 감안하여 반웅기의 크기, 형태 및 종류를 적절히 조절할 수 있다. 바람직하게는 유리 둥근바닥 플라스크, 비활성 기체를 주입하거나 공기의 제거가 용이한 반웅기, 또는 압력관 (pressure tube)과 같이 고압을 견딜 수 있는 반웅기를 사용할 수 있다.
【발명의 효과】
본 발명에 따르면, 우수한 이성질체 선택성을 나타내어 위치 이성질체의 분리공정을 생략할 수 있는 경제적이고 효율적인 아세트아미노펜의 제조 방법이 제공될 수 있고, 보다 구체적으로는 제조 공정 상 강산을 사용하지 아니하여 친환경적이면서도 우수한 반웅 수율로 최종 생성물을 얻을 수 있는 아세트아미노펜의 신규한 제조 방법이 제공될 수 있다.
【발명을 실시하기 위한 구체적인 내용】
발명을 하기의 실시 예에서 보다 상세하게 설명한다. 단, 하기의 실시 예는 본 발명을 예시하는 것일 뿐, 본 발명의 내용이 하기의 실시 예에 의하여 한정되는 것은 아니다.
실시예 : Acetaminophen의 제조
[실시예 1]
1. N-Acetyl-p-iodoani 1 ine의 제조:
반웅기에 파라ᅳ다이아이오도벤젠 (1 mmol)과, 아세트아마이드 (1.5 麵 ol), CsF (1.5 mmol), Cul(0.02 mmol), DMEDA(0.2 誦 ol)를 THF (4 mL)에 넣고, 비활성 기체를 주입하며 교반시키고, 반웅 온도를 75 °C로 올려 24 시간 동안 반웅 시켰다. 반응 온도를 실은으로 내리고, 에틸아세테이트 20 mL 를 넣고, 포화 NH4C1 수용액 (20 mL) 또는 증류수 (20 mL)로 유기층을 씻어준 뒤, MgS04 또는 NaS04를 투입하고 침전물을 필터로 제거하고 잔여 유기층을 감압농축기를 통해 모든 유기용매를 제거하였다. 농축된 물질올 컬럼크로마토그래피로 정제하여 원하는 생성물을 76%의 수율로 얻었다. 이때, 수율은 (얻어진 합성물의 몰수 /출발물질의 몰수) *100으로 계산하였다. 화학식 2-1 : ¾ NMR (DMS0) δ 10.03 (s, 1H), 7.61 (d, 2H, J = 8.4), 7.42 (d, 2H, / = 8), 2.03 (s, 3H)
압력관에 상기 합성된 화학식 2-1 의 N-아세틸-파라아이오도아닐린 (1 mmol)과, CsF(2 醒 ol), CuKO.l mmol), DMEDA(0.5 讓 ol)를 증류수 (¾0, 4 mL)에 넣고, 비활성 기체를 주입하며 교반시키고, 반응 온도를 160 °C 또는 180 °C로 올려 24시간 동안 반응 시켰다.
상기 반웅이 완료된 시점에서, 상기 압력관의 온도를 실온으로 내리고 에틸아세테이트 20 mL 를 넣고, 포화 NH4C1 수용액 (20 mL) 또는 증류수 (20 mL)로 유기층을 씻어준 뒤, MgS04 또는 NaS04 를 투입하고 침전물을 필터로 제거하고 잔여 유기층을 감압농축기를 통해 모든
유기용매를 제거하였다. 농축된 물질을 컬럼크로마토그래피로 정제하여 원하는 생성물을 63%의 수율로 얻었다. 이때, 수율은 (얻어진 합성물의 몰수 /출발물질의 몰수) *100으로 계산하였다.
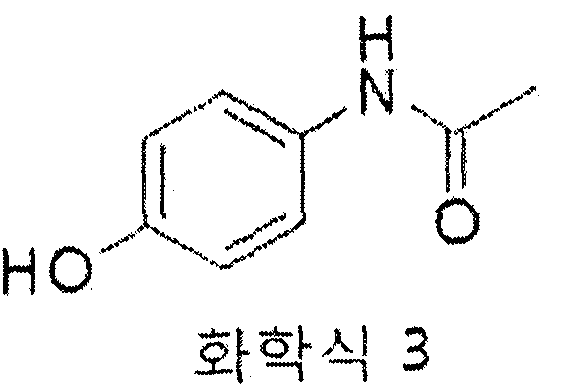
화학식 3: ¾ NMR (DMS0) δ 9.65 (s, 1H), 9.14 (s, 1H), 7.33 (d, 2H, J = 9.6), 6.67 (d, 2H, J = 8.4), 2.00 (s, 3H)
13C NMR (DMSO) δ 167.4, 153.0, 130.9, 120.7, 114.9, 23.6
[실시예 2]
상기 파라 -다이아이오도벤젠 (1 睡 01) 대신에 상기 파라- 다이브로모벤젠 (1 mniol , 화학식 2-2)을 사용한 점을 제외하고 실시예 1 과 동일한 방법으로 N-Acetyl-p-bromoani 1 ine 및 Acetaminophen 을 제조하였다.
[실시예 3]
상기 파라—다이아이오도벤점 Kl 隱 ol) 대신에 상기 파라- 다이클로로벤젠 (1 mmol , 화학식 2-3)을 사용한 점을 제외하고 실시예 1 과
동일한 방법으로 N-Acety卜 p-chroloani Hne 및 Acetaminophen 을 제조하였다
辆식 2-3 화학식 2-3: ¾ NMR (DMS0) δ 10.06 (s, 1H), 7.60 (d, 2H, J = 8.8), 7.34 (d, 2H, J = 8.8), 2.04 (s, 3H) 상기 실시예에서는 파라ᅳ다이할로겐화 벤젠을 출발 물질로 하고 특정의 금속 촉매를 사용하여, N-아세틸ᅳ파라-할로겐화 아닐린을 중간체로 하여 높은 이성질체 선택도 및 높은 반웅 수율로서 아세트아미노펜을 합성할 수 있었다.
또한, 상기 실시예에서는, 벤젠 고리의 파라 위치에 나이트로기를 도입하는 단계나, 나이트로기를 환원 단계 등을 생략하여 합성과정을 단순화 할 수 있었고, 상기 나이트로기를 치환하는 공정에 필요한 강산 등의 유기용매의 사용을 억제할 수 있어 친환경적, 경제적으로 아세트아미노펜을 제조할 수 있었다.
이에 더하여, 실시예에서는 기존의 공정에 비해 단순하며 , 경제적 , 친환경적인 상기 아세트아미노펜의 제조 공정을 통해, 60% 이상의 높은 수율 (실시예 1)로 아세트아미노펜을 생성할 수 있는 점이 확인되었다.
Claims
[화학식 1]
상기 화학식 1 에서, X1 및 X2는 각각 독립적으로 할로겐, 탄소수 1 내지 4 의 알콕시기, 나이트로 (-N02), 디아조늄 염 (Diazonium salt), 술포네이트 (Sulfonate), 포스페이트 (Phosphate), 토실레이트 (Tosylate), 및 트리플레이트 (Triilate)으로 이루어진 군에서 선택되고,
상기 화학식 2 에서, X3는 상기 X1 및 X2중 상기 아세트아마이드와의 반웅에서 치환되지 않은 작용기이다.
【청구항 2】
제 1항에 있어서,
상기 제 1금속 촉매 또는 제 2금속 촉매에 포함되는 구리 화합물은 할로겐화구리, 구리 아세테이트 (Cu(0Ac)2), 시안화구리 (CuCN),
트리플레이트구리 (Cu(0Tf)2), 트리플레이트구리벤젠복합물 ((CuOTf)2
Benzene), 및 황산구리 (CuS04)로 이루어진 군에서 선택된 1 종 이상을 포함하는 아세트아미노펜의 제조방법 .
【청구항 3】
제 1항에 있어서,
상기 팔라듐 화합물은 팔라듐 아세테이트 (Pd(0Ac)2), 및 트리스다이벤질리데아세톤다이팔라듐 (Pd2(dba)3)으로 이루어진 군에서 선택된 1종이상을 포함하는 아세트아미노펜의 제조방법 .
【청구항 4】
제 1항에 있어서,
상기 제 1 금속 촉매는 유기 리간드 화합물을 더 포함하는 아세트아미노펜의 제조방법 .
【청구항 5】
제 4항에 있어서 ,
상기 제 1 금속 촉매와 유기 리간드 화합물의 몰 비율은 1:1 내지
1:20인 아세트아미노펜의 제조방법 .
【청구항 6】
제 4항에 있어서,
상기 유기 리간드 화합물은 아민계 화합물, 아미노산 및 유기 인계 화합물로 이루어진 군에서 선택된 1 종 이상의 화합물을 포함하는 아세트아미노펜의 제조방법.
【청구항 7】
제 6항에 있어서,
상기 아민계 화합물은 에틸렌다이아민 (ethylenediamine), Ν,Ν'- 다이메틸에틸렌다이아민 ( , V'-dimethyletliylene(iiamine, DMEDA) , Ν,Ν,Ν',Ν'- 테트라메틸에틸렌다이아민 (^ iV',vV :etramethylethylenediamirie), 사이클로핵산다이아민 (cyclohexanediamine), Ν,Ν'ᅳ 다이메틸사이클로핵산다이아민 GV,yV'-dimethylcyclohexanediamine), 및 1,10-페난트를린 (1,10-phenanthroline)으로 이루어진 군에서 선택된 1 종 이상의 화합물을 포함하는 아세트아미노펜의 제조방법 .
【청구항 8]
제 6항에 있어서,
상기 아미노산은 글라이신 (glycine), 프를린 (proline), 및 Ν,Ν一 다이메틸글라이신 (씨 dimethylglycine)으로 이루어진 군에서 1 종 이상의 화합물을 포함하는 아세트아미노펜의 쎄조방법.
【청구항 9】
제 6항에 있어서,
상기 유기 인계화합물은 2- ( D i cy 1 cohexy 1 phosph i no ) b i pheny 1 , 2-(di- tert-butylphosphino)biphenyl, BINAP, 및 잔트포스 (Xantphos)으로 이루어진 군에서 선택된 1 종 이상의 화합물을 포함하는 아세트아미노펜의 제조 방법 .
【청구항 10】
제 1항에 있어서,
상기 화학식 2 의 화합물을 형성하는 단계는 유기 용매 내에서 이루어지는 아세트아미노펜의 제조방법.
【청구항 11】
제 10항에 있어서,
상기 용매는 벤젠, 를루엔, 알킬벤젠, 다이메틸설폭사이드 (DMS0), 다이메틸포름아미드 (DMF), 테트라하이드로 퓨란 (THF), 다이옥센 (Dioxane), 및 에틸아세테이트 (EA)로 이루어진 군에서 선택된 1 종 이상의 화합물을 포함하는 아세트아미노펜의 제조방법 .
【청구항 12]
제 1항에 있어서,
상기 화학식 2 의 화합물을 형성하는 단계는 염기를 첨가하는 단계를 더 포함하는 아세트아미노펜의 제조 방법 .
【청구항 13】
제 12항에 있어서,
상기 염기는 제삼인산칼륨 (K3P04), 탄산칼륨 ( C03), 탄산세슘 (Cs2C03), 플루오르화 칼륨 (KF), 플루오르화 나트륨 (NaF), 플루오르화 세슘 (CsF), 및
테트라부틸암모니움플루오라이드 (TBAF)으로 이루어진 군에서 선택된 1 종 이상의 화합물을 포함하는 아세트아미노펜의 제조 방법 .
【청구항 14】
제 1항에 있어서,
상기 화학식 2 의 화합물을 형성하는 단계는 25 내지 200 °C에서 이루어지는 아세트아미노펜의 제조 방법.
【청구항 15】
제 1항에 있어서,
상기 형성된 화학식 2 의 화합물을 물과 반웅시키는 단계에서 사용되는 염기는 제삼인산칼륨 (K3PO4), 탄산칼륨 (κ2ω3), 탄산세슴 (cs2co3), 플루오르화 칼륨 (KF), 플루오르화 나트륨 (NaF), 플루오르화 세슴 (CsF), 및 테트라부틸암모니움폴루오라이드 (TBAF)으로 이루어진 군에서 선택된 1 종 이상을 포함하는 아세트아미노펜의 제조방법 .
【청구항 16】
제 1항에 있어서,
상기 제 2 금속 촉매는 유기 리간드 화합물을 더 포함하는 아세트아미노펜의 제조방법. .
【청구항 17]
제 16항에 있어서,
상기 제 2 금속 촉매와 유기 리간드 화합물의 몰 비율은 1:1 내지
1:20인 아세트아미노펜의 제조방법 .
【청구항 18】
제 1항에 있어서,
상기 화학식 2 의 화합물과 물을 반웅시키는 단계는, 수용성 용매 내에서 이루어지는 아세트아미노펜의 제조방법.
【청구항 19]
제 1항에 있어서,
상기 화학식 2 의 화합물과 물을 반응시키는 단계는 25 내지 200 °C에서 이루어지는 아세트아미노펜의 제조 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR10-2012-0120664 | 2012-10-29 | ||
| KR1020120120664A KR101974850B1 (ko) | 2012-10-29 | 2012-10-29 | 아세트아미노펜의 신규한 제조방법 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| WO2014069875A2 true WO2014069875A2 (ko) | 2014-05-08 |
| WO2014069875A3 WO2014069875A3 (ko) | 2015-04-30 |
Family
ID=50628216
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/KR2013/009680 WO2014069875A2 (ko) | 2012-10-29 | 2013-10-29 | 아세트아미노펜의 신규한 제조방법 |
Country Status (2)
| Country | Link |
|---|---|
| KR (1) | KR101974850B1 (ko) |
| WO (1) | WO2014069875A2 (ko) |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2998450A (en) * | 1958-05-19 | 1961-08-29 | Warner Lambert Pharmaceutical | Process of preparing nu-acetyl-p-amino phenol |
| US3917695A (en) * | 1973-02-20 | 1975-11-04 | Mallinckrodt Inc | Preparation of N-acetyl-p-aminophenol |
| US4565890A (en) * | 1983-10-27 | 1986-01-21 | Mallinckrodt, Inc. | Process for the preparation of N-acetyl-P-aminophenol |
| US4670589A (en) * | 1982-11-04 | 1987-06-02 | Monsanto Company | Preparation of N-acetyl-p-aminophenol |
| KR100355532B1 (ko) * | 1999-10-27 | 2002-10-09 | 서울대학교 공과대학 교육연구재단 | 수소가 치환된 다공질 결정성 규산 알루미늄 촉매를 이용하여 아세트아미노펜을 합성하는 방법 |
| US7173152B2 (en) * | 2004-08-19 | 2007-02-06 | The Texas A&M University System | One-pot reductive acetamidation of aryl nitro compounds |
-
2012
- 2012-10-29 KR KR1020120120664A patent/KR101974850B1/ko active IP Right Grant
-
2013
- 2013-10-29 WO PCT/KR2013/009680 patent/WO2014069875A2/ko active Application Filing
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2998450A (en) * | 1958-05-19 | 1961-08-29 | Warner Lambert Pharmaceutical | Process of preparing nu-acetyl-p-amino phenol |
| US3917695A (en) * | 1973-02-20 | 1975-11-04 | Mallinckrodt Inc | Preparation of N-acetyl-p-aminophenol |
| US4670589A (en) * | 1982-11-04 | 1987-06-02 | Monsanto Company | Preparation of N-acetyl-p-aminophenol |
| US4565890A (en) * | 1983-10-27 | 1986-01-21 | Mallinckrodt, Inc. | Process for the preparation of N-acetyl-P-aminophenol |
| KR100355532B1 (ko) * | 1999-10-27 | 2002-10-09 | 서울대학교 공과대학 교육연구재단 | 수소가 치환된 다공질 결정성 규산 알루미늄 촉매를 이용하여 아세트아미노펜을 합성하는 방법 |
| US7173152B2 (en) * | 2004-08-19 | 2007-02-06 | The Texas A&M University System | One-pot reductive acetamidation of aryl nitro compounds |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2014069875A3 (ko) | 2015-04-30 |
| KR101974850B1 (ko) | 2019-05-03 |
| KR20140054767A (ko) | 2014-05-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5107267B2 (ja) | 置換ビフェニルの製造法 | |
| JP5138386B2 (ja) | 置換ビフェニル類の製造方法 | |
| TWI434839B (zh) | 製備2-胺基-5-氰基苯甲酸衍生物之方法 | |
| US20110003999A1 (en) | Process for Preparing Substituted Biphenylanilides | |
| JP5971656B2 (ja) | シクロポリアリーレン化合物及びそれらの製造方法 | |
| CN111712500A (zh) | 制备西他列汀的新的有效方法 | |
| JP5623389B2 (ja) | 置換ビフェニルアニリド類を調製する方法 | |
| JP2016525526A (ja) | ハロゲン化されたビフェニルアニリドおよびビフェニルアニリンの改善された製造方法 | |
| CN108779105A (zh) | Buchwald-Hartwig芳基化方法用于制备叔芳族胺 | |
| JP6104241B2 (ja) | トリヨード造影剤の製造 | |
| CN110437125B (zh) | 一种Tezacaftor中间体II的制备方法 | |
| WO2014069875A2 (ko) | 아세트아미노펜의 신규한 제조방법 | |
| BRPI0616596B1 (pt) | processo para a preparação de anilinas | |
| JP2003522744A (ja) | 多環式芳香族化合物の製造方法 | |
| TWI663145B (zh) | 芳香胺的單芳基化 | |
| KR101182615B1 (ko) | 광학 활성 2,2'-비페놀 유도체 및 그 제조 방법 | |
| JP2014169273A (ja) | 環式芳香族化合物の製造方法 | |
| CN104672180A (zh) | 一种[(1s)-3-甲基-1-[[(2r)-2-甲基环氧乙基]羰基]丁基]氨基甲酸叔丁酯的手性制备方法 | |
| KR20120128097A (ko) | 18f-표지 pet 방사성의약품의 전구체 및 그 제조방법 | |
| JP6532737B2 (ja) | ヘテロアセン化合物の製造方法 | |
| WO2013047162A1 (ja) | クロロアルキルスルホニルクロリドの製造方法 | |
| KR101605427B1 (ko) | 아세트아미노펜의 단일단계 제조공정 | |
| JPH0586000A (ja) | 2−アミノ−4−フルオロ安息香酸の製造方法 | |
| EP2937355B1 (en) | Phosphorus compound and transition metal complex of the same | |
| JP4571740B2 (ja) | 1,6−ジシアノヘキサンの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 13851085 Country of ref document: EP Kind code of ref document: A2 |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 13851085 Country of ref document: EP Kind code of ref document: A2 |