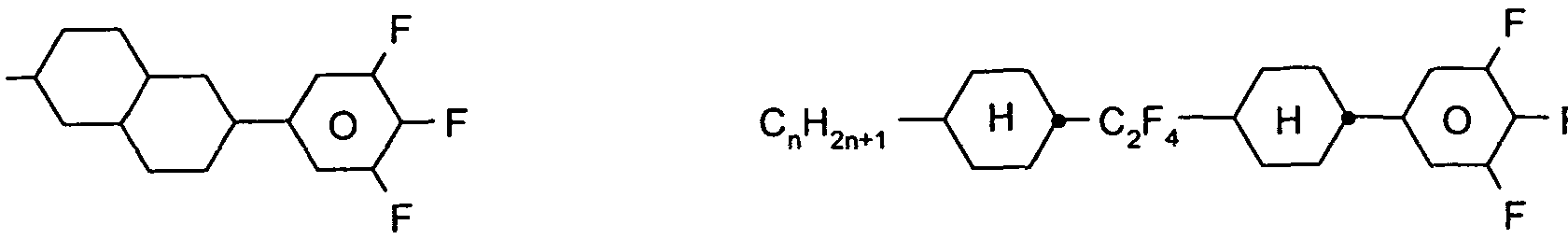Flüssigkristallines Medium
Die vorliegende Erfindung betrifft ein flüssigkristallines Medium (FK- Medium), dessen Verwendung für elektrooptische Zwecke und dieses Medium enthaltende FK-Anzeigen.
Flüssigkristalle werden vor allem als Dielektrika in Anzeigevorrichtungen verwendet, da die optischen Eigenschaften solcher Substanzen durch eine angelegte Spannung beeinflusst werden können. Elektrooptische Vorrich- tungen auf der Basis von Flüssigkristallen sind dem Fachmann bestens bekannt und können auf verschiedenen Effekten beruhen. Derartige Vorrichtungen sind beispielsweise Zellen mit dynamischer Streuung, DAP- Zellen (Deformation aufgerichteter Phasen), Gast/Wirt -Zellen, TN-Zellen mit verdrillt nematischer ("twisted nematic") Struktur, STN-Zellen ("super-twisted nematic"), SBE-Zellen ("superbirefringence effect") und OMI-Zellen ("optical mode interference"). Die gebräuchlichsten Anzeigevorrichtungen beruhen auf dem Schadt-Helfrich-Effekt und besitzen eine verdrillt nematische Struktur. Die Flüssigkristallmaterialien müssen eine gute chemische und thermische Stabilität und eine gute Stabilität gegenüber elektrischen Feldern und elektromagnetischer Strahlung besitzen. Ferner sollten die Flüssigkristallmaterialien niedere Viskosität aufweisen und in den Zellen kurze Ansprechzeiten, tiefe Schwellenspannungen und einen hohen Kontrast ergeben.
Wetterhin sollten sie bei üblichen Betriebstemperaturen, d.h. in einem möglichst breiten Bereich unterhalb und oberhalb Raumtemperatur eine geeignete Mesophase besitzen, beispielsweise für die oben genannten Zellen eine nematische oder cholesterische Mesophase. Da Flüssigkristalle in der Regel als Mischungen mehrerer Komponenten zur Anwendung gelangen, ist es wichtig, dass die Komponenten untereinander gut mischbar sind. Weitere Eigenschaften, wie die elektrische Leitfähigkeit, die
dielektrische Anisotropie und die optische Anisotropie, müssen je nach Zellentyp und Anwendungsgebiet unterschiedlichen Anforderungen genügen. Beispielsweise sollten Materialien für Zellen mit verdrillt
nematischer Struktur eine positive dielektrische Anisotropie und eine geringe elektrische Leitfähigkeit aufweisen.
Beispielsweise sind für Matrix-Flüssigkristallanzeigen mit integrierten nicht- linearen Elementen zur Schaltung einzelner Bildpunkte (MFK-Anzeigen)
Medien mit großer positiver dielektrischer Anisotropie, breiten nematischen Phasen, relativ niedriger Doppelbrechung, sehr hohem spezifischen Widerstand, guter UV- und Temperaturstabilität und geringem Dampfdruck erwünscht.
Derartige Matrix-Flüssigkristallanzeigen sind bekannt. Als nichtlineare Elemente zur individuellen Schaltung der einzelnen Bildpunkte können beispielsweise aktive Elemente (d.h. Transistoren) verwendet werden. Man spricht dann von einer "aktiven Matrix", wobei man zwei Typen
unterscheiden kann: . MOS (Metal Oxide Semiconductor) oder andere Dioden auf Silizium- Wafer als Substrat. 2. Dünnfilm-Transistoren (TFT) auf einer Glasplatte als Substrat.
Die Verwendung von einkristallinem Silizium als Substratmaterial beschränkt die Displaygröße, da auch die modulartige Zusammensetzung verschiedener Teildisplays an den Stößen zu Problemen führt.
Bei dem aussichtsreicheren Typ 2, welcher bevorzugt ist, wird als elektro- optischer Effekt üblicherweise der TN-Effekt verwendet. Man unterscheidet zwei Technologien: TFT's aus Verbindungshalbleitern wie z.B. CdSe oder TFT's auf der Basis von polykristallinem oder amorphem Silizium. An letzterer Technologie wird weltweit mit großer Intensität gearbeitet.
Die TFT-Matrix ist auf der Innenseite der einen Glasplatte der Anzeige aufgebracht, während die andere Glasplatte auf der Innenseite die transparente Gegenelektrode trägt. Im Vergleich zu der Größe der Bildpunkt- Elektrode ist der TFT sehr klein und stört das Bild praktisch nicht. Diese Technologie kann auch für voll farbtaugliche Bilddarstellungen erweitert
werden, wobei ein Mosaik von roten, grünen und blauen Filtern derart angeordnet ist, dass je ein Filterelement einem schaltbaren Bildelement gegenüber liegt. Die TFT-Anzeigen arbeiten üblicherweise als TN-Zellen mit gekreuzten Polarisatoren in Transmission und sind von hinten beleuchtet.
Der Begriff MFK-Anzeigen umfasst hier jedes Matrix-Display mit integrierten nichtlinearen Elementen, d.h. neben der aktiven Matrix auch Anzeigen mit passiven Elementen wie Varistoren oder Dioden (MIM = Metall-Isolator- Metall).
Derartige MFK-Anzeigen eignen sich insbesondere für TV-Anwendungen (z.B. Taschenfernseher) oder für hochinformative Displays für Rechner- anwendungen (Laptop) und im Automobil- oder Flugzeugbau. Neben Problemen hinsichtlich der Winkelabhängigkeit des Kontrastes und der Schaltzeiten resultieren bei MFK-Anzeigen Schwierigkeiten bedingt durch nicht ausreichend hohen spezifischen Widerstand der Flüssigkristallmischungen [TOGASHI, S., SEKIGUCHI, K., TANABE, H., YAMAMOTO, E., SORIMACHI, K., TAJIMA, E., WATANABE, H., SHIMIZU, H., Proc.
Eurodisplay 84, Sept. 984: A 210-288 Matrix LCD Controlled by Double Stage Diode Rings, p. 141 ff, Paris; STROMER, M., Proc. Eurodisplay 84, Sept. 1984: Design of Thin Film Transistors for Matrix Adressing of Tele- vision Liquid Crystal Displays, p. 145 ff, Paris]. Mit abnehmendem Wider- stand verschlechtert sich der Kontrast einer MFK-Anzeige und es kann das Problem der "after image elimination" auftreten. Da der spezifische Widerstand der Flüssigkristallmischung durch Wechselwirkung mit den inneren Oberflächen der Anzeige im allgemeinen über die Lebenszeit einer MFK- Anzeige abnimmt, ist ein hoher (Anfangs)-Widerstand sehr wichtig, um akzeptable Standzeiten zu erhalten. Insbesondere bei low-volt-Mischungen war es bisher nicht möglich, sehr hohe spezifische Widerstände zu realisieren. Weiterhin ist es wichtig, dass der spezifische Widerstand eine möglichst geringe Zunahme bei steigender Temperatur sowie nach Temperatur- und/oder UV-Belastung zeigt. Besonders nachteilig sind auch die Tieftemperatureigenschaften der Mischungen aus dem Stand der Technik. Gefordert wird, dass auch bei tiefen Temperaturen keine Kristallisation
und/oder smektische Phasen auftreten und die Temperaturabhängigkeit der Viskosität möglichst gering ist. Die MFK-Anzeigen aus dem Stand der Technik genügen somit nicht den heutigen Anforderungen.
Neben Flüssigkristallanzeigen, die eine Hintergrundbeleuchtung verwenden, also transmissiv und gegebenenfalls transflektiv betrieben werden, sind besonders auch reflektive Flüssigkristallanzeigen interessant. Diese reflektiven Flüssigkristallanzeigen benutzen das Umgebungslicht zur Informationsdarstellung. Somit verbrauchen sie wesentlich weniger Energie als hintergrundbeleuchtete Flüssigkristallanzeigen mit entsprechender Größe und Auflösung. Da der TN-Effekt durch einen sehr guten Kontrast gekennzeichnet ist, sind derartige reflektive Anzeigen auch bei hellen Umgebungsverhältnissen noch gut abzulesen. Dies ist bereits von einfachen reflektiven TN-Anzeigen, wie sie in z. B. Armbanduhren und Taschenrechnern verwendet werden, bekannt. Jedoch ist das Prinzip auch auf hochwertige, höher auflösende Aktiv-Matrix angesteuerte Anzeigen wie z. B. TFT- Displays anwendbar. Hier ist wie bereits bei den allgemeinen üblichen transmissiven TFT-TN-Anzeigen die Verwendung von Flüssigkristallen mit niedriger Doppelbrechung (Δη) nötig, um eine geringe optische Verzögerung (d■ Δη) zu erreichen. Diese geringe optische Verzögerung führt zu einer meist akzeptablen geringen Blickwinkelabhängigkeit des Kontrastes (vgl. DE 30 22 818). Bei reflektiven Anzeigen ist die Verwendung von
Flüssigkristallen mit kleiner Doppelbrechung noch wichtiger als bei transmissiven Anzeigen, da bei reflektiven Anzeigen die effektive
Schichtdicke, die das Licht durchquert, ungefähr doppelt so groß ist wie bei transmissiven Anzeigen mit derselben Schichtdicke.
Zur Realisierung von 3D-Effekten mittels Shutterbrillen werden
insbesondere schnell schaltende Mischungen mit niedrigen
Rotationsviskositäten und einer entsprechend hohen optischen Anisotropie (Δη) eingesetzt. Elektrooptische Linsensyteme, mit denen eine 2
dimensionale Darstellung eines Displays in eine 3 dimensionale
autostereoskopische Darstellung geschaltet werden kann, können unter Verwendung von Mischungen mit hoher optischer Anisotropie (Δη) realisiert werden.
Es besteht somit immer noch ein großer Bedarf nach MFK-Anzeigen mit sehr hohem spezifischen Widerstand bei gleichzeitig großem Arbeitstemperaturbereich, kurzen Schaltzeiten auch bei tiefen Temperaturen und niedriger Schwellenspannung, die diese Nachteile nicht oder nur in geringerem Maße zeigen.
Bei TN-(Schadt-Helfrich)-Zellen sind Medien erwünscht, die folgende Vorteile in den Zellen ermöglichen: - erweiterter nematischer Phasenbereich (insbesondere zu tiefen
Temperaturen)
Schaltbarkeit bei extrem tiefen Temperaturen (out-door-use,
Automobil, Avionik) erhöhte Beständigkeit gegenüber UV-Strahlung (längere Lebensdauer) kleine Schwellenspannung. Mit den aus dem Stand der Technik zur Verfügung stehenden Medien ist es nicht möglich, diese Vorteile unter gleichzeitigem Erhalt der übrigen
Parameter zu realisieren.
Bei höher verdrillten Zellen (STN) sind Medien erwünscht, die eine höhere Multiplexierbarkeit und/oder kleinere Schwellenspannungen und/oder breitere nematische Phasenbereiche (insbesondere bei tiefen Temperaturen) ermöglichen. Hierzu ist eine weitere Ausdehnung des zur Verfügung stehenden Parameterraumes (Klärpunkt, Übergang smektisch-nematisch bzw. Schmelzpunkt, Viskosität, dielektrische Größen, elastische Größen) dringend erwünscht.
Insbesondere bei FK-Anzeigen für TV- und Video-Anwendungen (z. B. LCD- TV, Monitore, PDAs, Notebooks, Spielkonsolen) ist eine deutliche
Verringerung der Schaltzeiten gewünscht. Dies erfordert FK-Mischungen mit niedrigen Rotationsviskositäten und hohen dielektrischen Anisotropien.
Gleichzeitig sollten die FK-Medien hohe Klärpunkte, vorzugsweise > 80 °C, aufweisen.
Der Erfindung liegt die Aufgabe zugrunde, Medien insbesondere für der- artige MFK-, FFS-, IPS-, TN-, positive VA- oder STN-Anzeigen
bereitzustellen, die die oben angegebenen Nachteile nicht oder nur in geringerem Maße zeigen, und vorzugsweise schnelle Schaltzeiten und niedrige Rotationsviskositäten bei gleichzeitig hohem Klärpunkt, sowie eine hohe dielektrische Anisotropie und eine niedrige Schwellenspannung aufweisen.
Es wurde nun gefunden, dass diese Aufgabe gelöst werden kann, wenn man FK-Medien enthaltend eine oder mehrere Verbindungen der Formel IA und eine oder mehrere Verbindungen der Formel IB verwendet. Die Verbin- düngen der Formeln IA und IB führen zu LC-Mischungen mit den oben angegebenen gewünschten Eigenschaften.
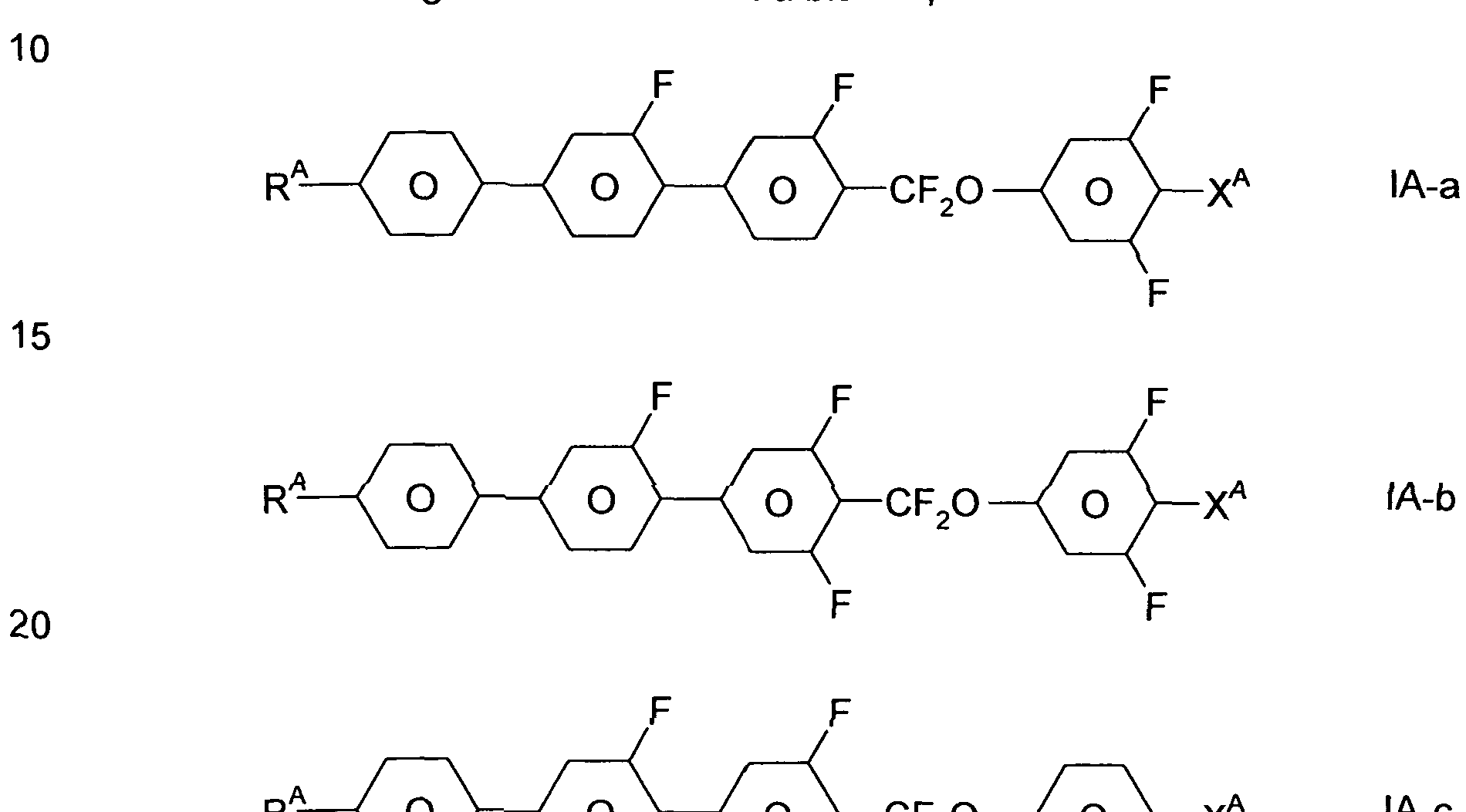
Gegenstand der Erfindung ist ein flüssigkristallines Medium, dadurch gekennzeichnet, dass es eine oder mehrere Verbindungen der Formel IA
und eine oder mehrere Verbindungen der Formel IB
und RB jeweils unabhängig voneinander einen halogenierten oder
unsubstituierten Alkyl- oder Alkoxyrest mit 1 bis 15 C-Atomen, wobei in diesen Resten auch eine oder mehrere CH2-Gruppen jeweils unabhängig voneinander durch -C=C-, -CF2O-,
-CH=CH-, . — " , -O-, -CO-O- oder -O-CO- so ersetzt sein können, dass O-Atome nicht direkt miteinander verknüpft sind,
XA
und XB jeweils unabhängig voneinander F, Cl, CN, SF5, SCN, NCS,
halogenierter Alkylrest, halogenierter Alkenylrest, halogenierter Alkoxyrest oder halogenierter Alkenyloxyrest mit jeweils bis zu 6 C- Atomen, und
Y "13 jeweils unabhängig voneinander H oder F bedeuten, enthält.
Überraschenderweise wurde gefunden, dass Mischungen enthaltend die Verbindungen der Formeln IA und IB eine hohe dielektrische Anisotropie Δε und gleichzeitig ein vorteilhaftes Verhältnis Rotationsviskosität γι /Klärpunkt aufweisen. Sie sind daher zur Realisierung von Flüssigkristallmischungen mit niedrigem γι und sehr hohem Klärpunkt besonders geeignet. Darüber hinaus zeigen die Verbindungen der Formeln IA und IB eine gute Löslichkeit in FK-Medien. Erfindungsgemäße FK-Medien enthaltend Verbindungen der Formeln IA und IB besitzen eine niedrige Rotationsviskosität, schnelle Schaltzeiten, einen hohen Klärpunkt, eine sehr hohe positive dielektrische Anisotropie, eine relativ hohe Doppelbrechung und einen breiten
nematischen Phasenbereich. Sie sind deshalb besonders gut für mobile Telefone, TV- und Video-Anwendungen geeignet.
Die Verbindungen der Formeln IA und IB besitzen einen breiten
Anwendungsbereich. In Abhängigkeit von der Auswahl der Substituenten können sie als Basismaterialien dienen, aus denen flüssigkristalline Medien zum überwiegenden Teil zusammengesetzt sind; es können aber auch den
Verbindungen der Formeln IA und IB flüssigkristalline Basismaterialien aus anderen Verbindungsklassen zugesetzt werden, um beispielsweise die dielektrische und/oder optische Anisotropie eines solchen Dielektrikums zu beeinflussen und/oder um dessen Schwellenspannung und/oder dessen Viskosität zu optimieren.
Die Verbindungen der Formeln IA und IB sind in reinem Zustand farblos und bilden flüssigkristalline Mesophasen in einem für die elektrooptische Verwendung günstig gelegenen Temperaturbereich. Chemisch, thermisch und gegen Licht sind sie stabil.
Die Verbindungen der Formeln IA und IB werden nach an sich bekannten Methoden dargestellt, wie sie in der Literatur (z.B. in den Standardwerken wie Houben-Weyl, Methoden der Organischen Chemie, Georg-Thieme- Verlag, Stuttgart) beschrieben sind, und zwar unter Reaktionsbedingungen, die für die genannten Umsetzungen bekannt und geeignet sind. Dabei kann man auch von an sich bekannten, hier nicht näher erwähnten Varianten Gebrauch machen. Die Verbindungen der Formeln IA und IB sind beispielsweise bekannt aus der WO 2004/048501 A und EP 0 786 445.
Falls in den oben- und untenstehenden Formeln RA und RB einen Alkylrest und/oder einen Alkoxyrest bedeutet, so kann dieser geradkettig oder verzweigt sein. Vorzugsweise ist er geradkettig, hat 2, 3, 4, 5, 6 oder 7 C- Atome und bedeutet demnach bevorzugt Ethyl, Propyl, Butyl, Pentyl, Hexyl, Heptyl, Ethoxy, Propoxy, Butoxy, Pentoxy, Hexoxyoder Heptoxy, ferner Methyl, Octyl, Nonyl, Decyl, Undecyl, Dodecyl, Tridecyl, Tetradecyl,
Pentadecyl, Methoxy, Octoxy, Nonoxy, Decoxy, Undecoxy, Dodecoxy, Tridecoxy oder Tetradedoxy. RA und RB bedeuten jeweils vorzugsweise geradkettiges Alkyl mit 2-6 C-Atomen.
Oxaalkyl bedeutet vorzugsweise geradkettiges 2-Oxapropyl (= Methoxy- methyl), 2-(= Ethoxymethyl) oder 3-Oxabutyl (= 2-Methoxyethyl), 2-, 3- oder 4-pxapentyl, 2-, 3-, 4- oder 5-Oxahexyl, 2-, 3-, 4-, 5- oder 6-Oxaheptyl, 2-,
3-, 4-, 5-, 6-, oder 7-Oxaoctyl, 2-, 3-, 4-, 5-, 6-, 7- oder 8-Oxanonyl, 2-, 3-, 4-, 5-, 6-, 7-, 8- oder 9-Oxadexyl.
Falls RA und RB einen Alkylrest bedeutet, in dem eine CI-fe-Gruppe durch - CH=CH- ersetzt ist, so kann dieser geradkettig oder verzweigt sein.
Vorzugsweise ist er geradkettig und hat 2 bis 10 C-Atome. Er bedeutet demnach besonders Vinyl, Prop-1-, oder Prop-2-enyl, But-1-, 2- oder But-3- enyl, Pent-1-, 2-, 3- oder Pent-4-enyl, Hex-1-, 2-, 3-, 4- oder Hex-5-enyl, Hept-1-, 2-, 3-, 4-, 5- oder Hept-6-enyl, Oct-1-, 2-, 3-, 4-, 5-, 6- oder
Oct-7-enyl, Non-1-, 2-, 3-, 4-, 5-, 6-, 7- oder Νοη-8-enyl, Dec-1-, 2-, 3-, 4-, 5- , 6-, 7-, 8- oder Dec-9-enyl.
Falls RA und RB einen mindestens einfach durch Halogen substituierten Alkyl- oder Alkenylrest bedeutet, so ist dieser Rest vorzugsweise geradkettig und Halogen ist vorzugsweise F oder Cl. Bei Mehrfachsubstitution ist Halogen vorzugsweise F. Die resultierenden Reste schließen auch perfluorierte Reste ein. Bei Einfachsubstitution kann der Fluor- oder
Chlorsubstituent in beliebiger Position sein, vorzugsweise jedoch in ω- Position.
In den oben- und untenstehenden Formeln ist XA und/oder XB vorzugsweise F, Cl oder ein- oder mehrfach fluorierter Alkyl- oder Alkoxyrest mit 1 , 2 oder 3 C-Atomen oder ein- oder mehrfach fluorierter Alkenylrest mit 2 oder 3 C- Atomen bedeutet. XA und/oder XB ist besonders bevorzugt F, Cl, CF3, CHF2, OCF3) OCHF2, OCFHCF3, OCFHCHF2) OCFHCHF2> OCF2CH3, OCF2CHF2, OCF2CHF2, OCF2CF2CHF2, OCF2CF2CHF2, OCFHCF2CF3, OCFHCF2CHF2, OCF2CF2CF3, OCF2CF2CCIF2, OCCIFCF2CF3, OCH=CF2 oder CH=CF2) ganz besonders bevorzugt F oder OCF3, ferner CF3, OCF=CF2, OCHF2 und OCH=CF2.
Besonders bevorzugt sind Verbindungen der Formeln IA und IB, worin XA und/oder XB F oder OCF3, vorzugsweise F, bedeutet. Bevorzugte
Verbindungen der Formel IA sind solche, worin Y1 F bedeutet, solche worin Y2 F bedeutet, solche worin Y3 H bedeutet, solche worin Y4 H und Y5 F bedeutet, sowie solche, worin Y6 und Y7 jeweils H bedeuten. Bevorzugte Verbindungen der Formel IB sind solche, worin Y8 F bedeutet, worin Y9 F
bedeutet, solche worin Y10 F bedeutet, solche worin Y1 F bedeutet, sowie solche, worin Y12 und Y13 jeweils H bedeuten.
Besonders bevorzugte Verbindungen der Formel IA sind ausgewählt folgenden Unterformeln,
RA— < o o o >-CF2O-< o VxA IA"d
R
A— 0 >— < O >— O V-CF-O- O x
A IA"
e
worin
RA und XA die in Anspruch 1 angegebenen Bedeutungen haben. Vorzugsweise bedeutet geradkettiges Alkyl mit 1 bis 6 C-Atomen, insbesondere Ethyl und Propyl, ferner Alkenyl mit 2 bis 6 C-Atomen.
Ganz besonders bevorzugt ist die Verbindung der Unterformel lA-b.
Besonders bevorzugte Verbindungen der Formel IB sind ausgewählt den folgenden Unterformeln,
RB und XB die in Anspruch 1 angegebenen Bedeutungen haben.
Vorzugsweise bedeutet RB geradkettiges Alkyl mit 1 bis 6 C-Atomen, insbesondere Propyl, Butyl und Pentyl, ferner Alkenyl mit 2 bis 6 C-Atomen.
Ganz besonders bevorzugt ist die Verbindung der Unterformel IB-c.
Weitere bevorzugte Ausführungsformen sind im Folgenden angegeben:
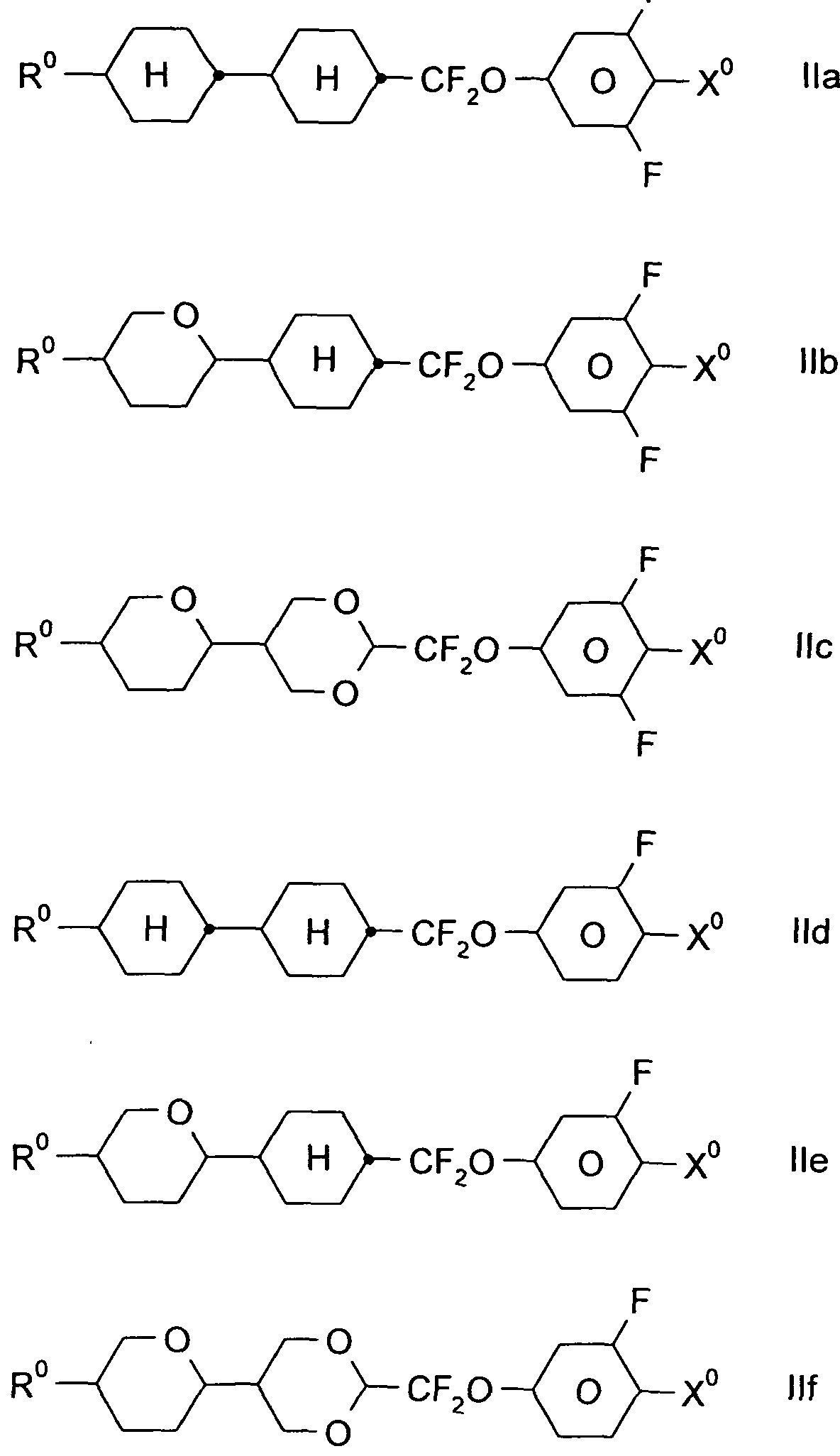
Das Medium enthält zusätzlich eine oder mehrere Verbindungen der Formel II und/oder III
II
worin einen halogenierten oder unsubstituierten Alkyl- oder
Alkoxyrest mit 1 bis 15 C-Atomen, wobei in diesen Resten auch eine oder mehrere CH2-Gruppen jeweils unabhängig voneinander durch -C=C-, -CF2O-, -CH=CH,
-O- - ^(X^ . -CO-O- oder -O-CO- so ersetzt sein können, dass O-Atome nicht direkt miteinander verknüpft sind,
F, Cl, CN, SF5> SCN, NCS, halogenierter Alkylrest, halogenierter Alkenylrest, halogenierter Alkoxyrest oder halogenierter Alkenyloxyrest mit bis zu 6 C-Atomen, und jeweils unabhängig voneinander H oder F
Die Verbindungen der Formel II sind vorzugsweise ausgewählt aus den folgenden Formeln,
worin R° und X° die oben angegebenen Bedeutungen haben.
Vorzugsweise bedeutet R° Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F. Besonders bevorzugt sind Verbindungen der Formel IIa und IIb, insbesondere Verbindungen der Formeln IIa und IIb, worin X F bedeutet.
Die Verbindungen der Formel III sind vorzugsweise ausgewählt aus den folgenden Formeln,
worin R° und X° die oben angegebenen Bedeutungen haben.
Vorzugsweise bedeutet R° Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F. Besonders bevorzugt sind Verbindungen der Formeln lila und llle, insbesondere Verbindungen der Formel lila;
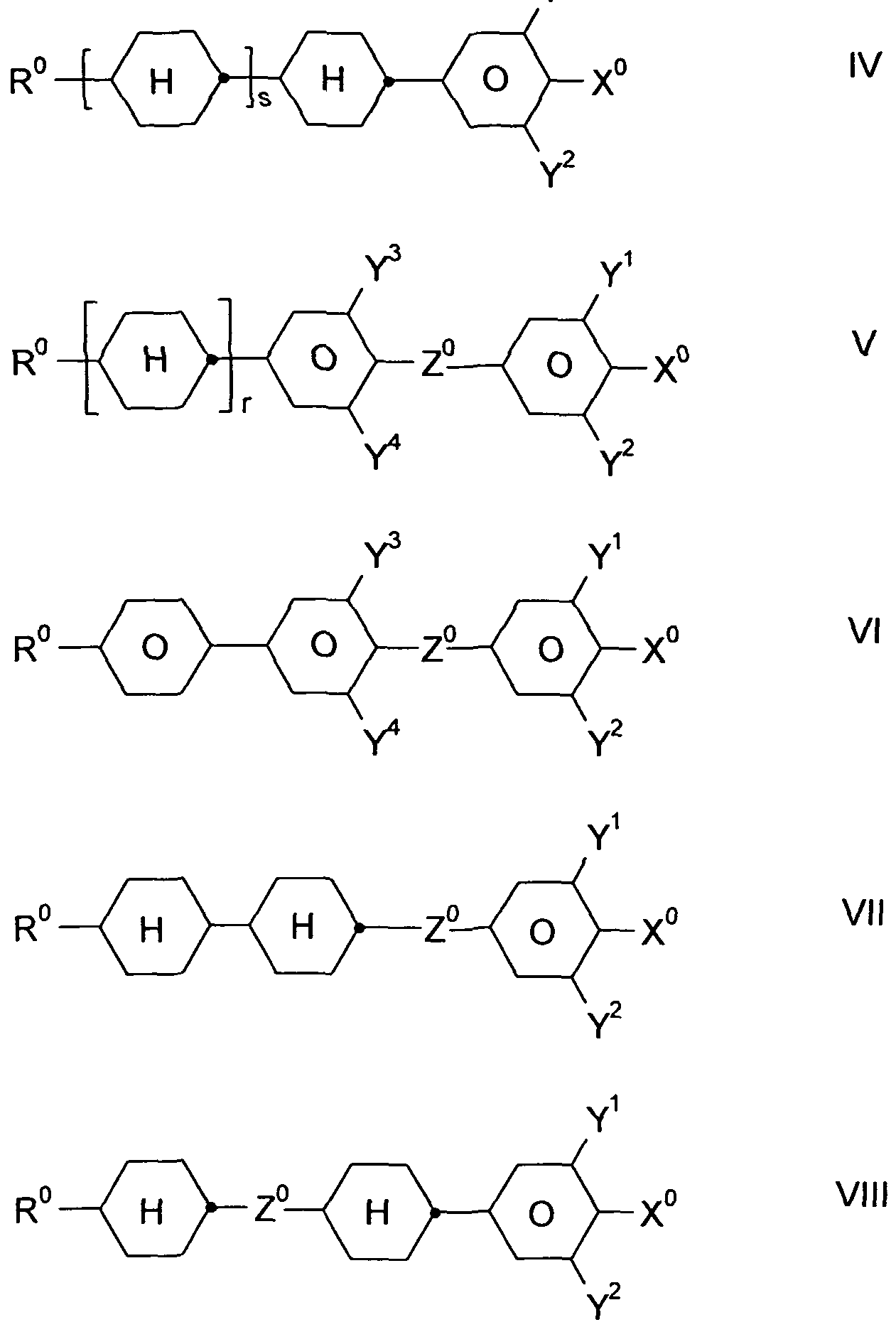
R°, X° und Y1" die oben angegebenen Bedeutungen besitzen, und Z° -C2H4-. -(CH2)4-, -CH=CH-, -CF=CF-, -C2F4-, -CH2CF2-,
-CF2CH2-, -CH20-, -OCH2-, -COO- oder -OCF2-, in Formel V und VI auch eine Einfachbindung, in Formel V und VIII auch -CF20-, r 0 oder 1 , und s 0 oder 1 bedeuten;
Die Verbindungen der Formel IV sind vorzugsweise ausgewählt aus folgenden Formeln,
worin R° und X° die oben angegebenen Bedeutungen haben.
Vorzugsweise bedeutet R° Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F oder OCF3, ferner OCF=CF2 und Cl;
Die Verbindungen der Formel V sind vorzugsweise ausgewählt aus den folgenden Formeln,
F
worin R° und X° die oben angegebenen Bedeutungen haben.
Vorzugsweise bedeutet R° Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F und OCF3, ferner OCHF2l CF3, OCF=CF2 und OCH=CF2;
Die Verbindungen der Formel VI sind vorzugsweise ausgewählt aus den folgenden Formeln,
worin R° und X° die oben angegebenen Bedeutungen haben.
Vorzugsweise bedeutet R° Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F, ferner OCF
3l CF
3, CF=CF
2, OCHF
2 und OCH=CF
2;
Die Verbindungen der Formel VII sind vorzugsweise ausgewählt aus den folgenden Formeln,
worin R° und X° die oben angegebenen Bedeutungen haben.
Vorzugsweise bedeutet R° Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F, femer OCF3, OCHF2 und OCH=CF2.
Das Medium enthält zusätzlich eine oder mehrere Verbindungen ausgewählt aus den folgenden Formeln,
worin X° die oben angegebenen Bedeutungen besitzen, und L H oder F,
"Alkyl" C1-6-Alkyl,
R' C1-6-Alkyl, Ci-e-Alkoxy oder C2-6-Alkenyl, und
"Alkenyl" und "Alkenyl*" jeweils unabhängig voneinander C2-6-Alkenyl bedeuten.
Die Verbindungen der Formeln IX-XM sind vorzugsweise ausgewählt aus folgenden Formeln,
worin "Alkyl" die oben angegebene Bedeutung hat;
Insbesondere bevorzugt sind die Verbindungen der Formeln XIa, IXb, IXc, Xa, Xb, XIa und Xlla. In den Formeln IXb und IX bedeutet "Alkyl" unabhängig voneinander vorzugsweise n-C3H7, n-C4H9 oder n-CsHn, insbesondere n-C3H7.
Das Medium enthält zusätzlich eine oder mehrere Verbindungen ausgewählt aus den folgenden Formeln,
XIII
worin L
1 und L
2 die oben angegebenen Bedeutungen haben, und R
1 und R
2 jeweils unabhängig voneinander n-Alkyl, Alkoxy, Oxaalkyl, Fluoralkyl oder Alkenyl mit jeweils bis zu 6 C-Atomen bedeuten, und vorzugsweise jeweils unabhängig voneinander Alkyl mit 1 bis 6 C- Atomen bedeuten; In der Verbindung der Formel XIII bedeutet vorzugsweise mindestens einer der Reste R
1 und R
2 Alkenyl mit 2 bis 6 C-Atomen.
Das Medium enthält eine oder mehrere Verbindungen der Formel XIII, worin mindestens einer der Reste R1 und R2 Alkenyl mit 2 bis 6 C- Atomen bedeutet, vorzugsweise solche ausgewählt aus folgenden Formeln,
Xllla
Xlllb
Xlllc
Xllld
worin "Alkyl" die oben angegebene Bedeutung hat;
Das Medium enthält eine oder mehrere Verbindungen der folgenden Formeln,
worin R°, X° und Y
1"4 die in Formel I angegebenen Bedeutungen besitzen, und
Die Verbindungen der Formeln XV und XVI sind vorzugsweise ausgewählt aus den folgenden Formeln,
worin R° und X° die oben angegebenen Bedeutungen haben.
Vorzugsweise bedeutet R° Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F, ferner OCF3. Besonders bevorzugte Verbindungen der Formeln XV und XVa-XVf sind solche, worin Y F und Y2 H oder F, vorzugsweise F, bedeutet. Besonders bevorzugt enthält die
erfindungsgemäße Mischung mindestens eine Verbindung der Formel XVf.
Das Medium enthält eine oder mehrere Verbindungen der
Formel XVII,
R O O O V R2 XVII
1 2
worin R und R die oben angegebenen Bedeutungen besitzen, und vorzugsweise jeweils unabhängig voneinander Alkyl mit 1 bis 6 C- Atomen bedeuten. L bedeutet H oder F.
Besonders bevorzugte Verbindungen der Formel XVII sind solche der Unterformeln,
alkenyl— O O O V- alkyl XVI l-d
alkenyl— O O O )— alkenyl* XVI l-e
XVI l-f
worin alkyl und alkyl
* jeweils unabhängig voneinander geradkettiger
Alkylrest mit 1-6 C-Atomen, insbesondere Ethyl, Propyl und Pentyl,
alkenyl
und alkenyl* jeweils unabhängig voneinander geradkettiger
Alkenylrest mit 2-6 C-Atomen, insbesondere
CH
3CH=CHC
2H4, CH
2=CH und CH
3CH=CH, bedeuten.
Besonders bevorzugt sind die Verbindungen der Formeln XVII-b und XVI l-c. Ganz besonders bevorzugt sind die Verbindungen der Formeln
Das Medium enthält eine oder mehrere Verbindungen der folgenden Formeln,
worin R
1 und R
2 die oben angegebenen Bedeutungen besitzen, und vorzugsweise jeweils unabhängig voneinander Alkyl mit 1 bis 6 C- Atomen bedeuten. L bedeutet H oder F;
Das Medium enthält zusätzlich eine oder mehrere Verbindungen ausgewählt aus den folgenden Formeln,
worin R° und X jeweils unabhängig voneinander eine der oben angegebenen Bedeutungen haben und Y
1"4 jeweils unabhängig voneinander H oder F bedeuten. X° ist vorzugsweise F, Cl, CF
3) OCF
3 oder OCHF
2. R° bedeutet vorzugsweise Alkyl, Alkoxy, Oxaalkyl, Fluoralkyl oder Alkenyl mit jeweils bis zu 6 C-Atomen.
Besonders bevorzugt erhält die erfindungsgemäße Mischung eine oder mehrere Verbindungen der Formel XXIV-a,
XXIV-a
worin R° die oben angegebene Bedeutungen hat. Vorzugsweise bedeutet R° geradkettiges Alkyl, insbesondere Ethyl, n-Propyl, n-Butyl und n-Pentyl, und ganz besonders bevorzugt n-Propyl. Die
Verbindung(en) der Formel XXIV, insbesondere der Formel XXIV-a werden vorzugsweise in Mengen von 0,5-20 Gew.%, besonders bevorzugt 1-15 Gew.% in den erfindungsgemäßen Mischungen eingesetzt.
Das Medium enthält zusätzlich eine oder mehrere Verbindungen aus der F
worin R°, X° und Y
"6 die in Formel I angegebene Bedeutung besitzen, s 0 oder 1 , und
bedeuten.
In der Formel XXIV kann X° auch ein Alkylrest mit 1-6 C-Atomen oder ein Alkoxyrest mit 1-6 C-Atomen bedeuten. Vorzugsweise ist der Alkyl- oder Alkoxyrest geradkettig.
Vorzugsweise bedeutet R° Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F;
Die Verbindungen der Formel XXIV sind vorzugsweise ausgewählt aus den folgenden Formeln,
)_χ° XXIVh
worin R°, X° und Y1 die oben angegebenen Bedeutungen haben. Vorzugsweise bedeutet R° Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F und Y1 ist vorzugsweise F; F,
F
R° ist geradkettiges Alkyl oder Alkenyl mit 2 bis 6 C-Atomen;
Das Medium enthält eine oder mehrere Verbindungen der folgenden Formeln
worin R
1 und X° die oben angegebenen Bedeutungen besitzen. R
1 bedeutet vorzugsweise Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F oder Cl. In der Formel XXV bedeutet X° ganz
besonders bevorzugt Cl.
Das Medium enthält eine oder mehrere Verbindungen der folgenden Formeln,
R— ( H >-< O -X° XXVII
II
worin R
1 und X° die oben angegebene Bedeutung besitzen. R
1 bedeutet vorzugsweise Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F; Insbesondere bevorzugt enthält das erfindungsgemäße Medium eine
oder mehrere Verbindungen der Formel XXIX, worin X° vorzugsweise F bedeutet. Die Verbindung(en) der Formeln XXVII - XXIX werden vorzugsweise in Mengen von 1-20 Gew.%, besonders bevorzugt 1-15 Gew.% in den erfindungsgemäßen Mischungen eingesetzt. Besonders bevorzugte Mischungen enthalten mindestens eine Verbindung der Formel XXIX.
Das Medium enthält eine oder mehrere Verbindungen der folgenden Pyrimidin- oder Pyridin-Verbindungen der Formeln,
worin R
1 und X° die oben angegebene Bedeutung besitzen. R
1 bedeutet vorzugsweise Alkyl mit 1 bis 6 C-Atomen. X° bedeutet vorzugsweise F; Insbesondere bevorzugt enthält das erfindungsgemäße Medium eine oder mehrere Verbindungen der Formel M- , worin X° vorzugsweise F bedeutet. Die Verbindung(en) der FormelnM-1 - M-3 werden vorzugsweise in Mengen von 1-20 Gew.%, besonders bevorzugt 1- 5 Gew.% in den erfindungsgemäßen Mischungen eingesetzt.
Nachfolgend werden weitere bevorzugte Ausführungsformen angegeben:
Das Medium enthält zwei oder mehr Verbindungen der Formel IA, insbesondere der Formel lA-b;
Das Medium enthält 2-30 Gew.%, bevorzugt 3-20 Gew.%, besonders bevorzugt 3- 5 Gew.%, an Verbindungen der Formel IA;
Das Medium enthält neben den Verbindungen der Formeln IA und IB weitere Verbindungen ausgewählt aus der Gruppe der Verbindungen der Formeln II, III, IX-XIII, XVII und XVIII;
Der Anteil an Verbindungen der Formeln II, III, IX-XIII, XVII und XVIII im Gesamtgemisch beträgt 40 bis 95 Gew.%;
Das Medium enthält 10-50 Gew.%, besonders bevorzugt 12-40 Gew.% an Verbindungen der Formel II und/oder III;
Das Medium enthält 20-70 Gew.%, besonders bevorzugt 25-65 Gew.% an Verbindungen der Formeln IX-XIII;
Das Medium enthält 4-30 Gew.%, besonders bevorzugt 5-20 Gew.% an Verbindungen der Formel XVII;
Das Medium enthält 1-20 Gew.%, besonders bevorzugt 2-15 Gew.% an Verbindungen der Formel XVIII.
Das Medium enthält mindestens zwei Verbindungen der Formeln
- Das Medium enthält mindestens zwei Verbindungen der Formeln
- Das Medium enthält mindestens zwei Verbindungen der Formel IA und mindestens zwei Verbindungen der Formel IB;
- Das Medium enthält mindestens eine Verbindung der Formel IA und mindestens eine Verbindung der Formel IB und mindestens eine
Verbindung der Formel lila.
- Das Medium enthält mindestens zwei Verbindungen der Formel IA und mindestens zwei Verbindungen der Formel IB und mindestens eine Verbindung der Formel lila.
- Das Medium enthält > 25 Gew.%, vorzugsweise > 30 Gew.%, einer oder mehrerer Verbindungen der Formel IA und einer oder mehrerer
Verbindungen der Formel IB;
- Das Medium enthält > 20 Gew.%, vorzugsweise > 24 Gew.%, vorzugsweise 25-60 Gew.%, an Verbindungen der Formel IXb, insbesondere die Verbindung der Formel IXb-1,
- Das Medium enthält mindestens eine Verbindung der Formel IXb-1 und mindestens eine Verbindung der Formel IXc-1.
Das Medium enthält mindestens eine Verbindung der Formel DPGU-n-F.
Das Medium enthält mindestens eine Verbindung der Formel CDUQU-n-F.
Das Medium enthält mindestens eine Verbindung der Formel CPU-n-OXF.
Das Medium enthält mindestens eine Verbindung der Formel PPGU-n-F.
Das Medium enthält mindestens eine Verbindung der Formel PGP-n-m, vorzugsweise zwei oder drei Verbindungen.
Das Medium enthält mindestens eine Verbindung der Formel PGP-2-2V mit der Struktur
F
Es wurde gefunden, dass > 20 Gew.%, vorzugsweise > 25 Gew.% an Verbindungen der Formel IA und IB im Gemisch mit üblichen
Flüssigkristallmaterialien, insbesondere jedoch mit einer oder mehreren Verbindungen der Formeln II bis XXVIII zu einer beträchtlichen Erhöhung der Lichtstabilität und zu niedrigen Werten für die Doppelbrechung führt, wobei gleichzeitig breite nematische Phasen mit tiefen Übergangstemperaturen smektisch-nematisch beobachtet werden, wodurch die
Lagerstabilität verbessert wird. Gleichzeitig zeigen die Mischungen sehr niedrige Schwellenspannungen und sehr gute Werte für die VHR bei UV- Belastung und sehr hohe Klärpunkte.
Der Ausdruck "Alkyl" bzw. "Alkyl*" umfasst in dieser Anmeldung
geradkettige und verzweigte Alkylgruppen mit 1-6 Kohlenstoffatomen, insbesondere die geradkettigen Gruppen Methyl, Ethyl, Propyl, Butyl, Pentyl und Hexyl. Gruppen mit 2-5 Kohlenstoffatomen sind im allgemeinen bevorzugt.
Der Ausdruck "Alkenyl" bzw. "Alkenyl*" umfasst geradkettige und verzweigte Alkenylgruppen mit 2-6 Kohlenstoffatomen, insbesondere die geradkettigen Gruppen. Bevorzugte Alkenylgruppen sind Qj-Cr-I E-Alkenyl, C4-C6-3E-
Alkenyl, insbesondere C2-C6-1 E-Alkenyl. Beispiele besonders bevorzugter Alkenylgruppen sind Vinyl, 1 E-Propenyl, 1 E-Butenyl, 1 E-Pentenyl, 1 E- Hexenyl, 3-Butenyl, 3E-Pentenyl, 3E-Hexenyl, 4-Pentenyl, 4Z-Hexenyl, 4E-Hexenyl und 5-Hexenyl. Gruppen mit bis zu 5 Kohlenstoffatomen sind im allgemeinen bevorzugt, insbesondere CH2=CH, CH3CH=CH.
Der Ausdruck "Fluoralkyl" umfasst vorzugsweise geradkettige Gruppen mit endständigem Fluor, d.h. Fluormethyl, 2-Fluorethyl, 3-Fluorpropyl, 4-Fluor- butyl, 5-Fluorpentyl, 6-Fluorhexyl und 7-Fluorheptyl. Andere Positionen des Fluors sind jedoch nicht ausgeschlossen.
Der Ausdruck "Oxaalkyl" bzw. "Alkoxy" umfasst vorzugsweise geradkettige Reste der Formel CnH2n+i-O-(CH2)m, worin n und m jeweils unabhängig voneinander 1 bis 6 bedeuten, m kann auch 0 bedeuten. Vorzugsweise ist n = 1 und m 1 -6 oder m = 0 und n = 1-3.
Durch geeignete Wahl der Bedeutungen von R° und X° können die
Ansprechzeiten, die Schwellenspannung, die Steilheit der Transmissionskennlinien etc. in gewünschter Weise modifiziert werden. Beispielsweise führen 1 E-Alkenylreste, 3E-Alkenylreste, 2E-Alkenyloxyreste und
dergleichen in der Regel zu kürzeren Ansprechzeiten, verbesserten nematischen Tendenzen und einem höheren Verhältnis der elastischen Konstanten k33 (bend) und kn (splay) im Vergleich zu Alkyl- bzw.
Alkoxyresten. 4-Alkenylreste, 3-Alkenylreste und dergleichen ergeben im allgemeinen tiefere Schwellenspannungen und kleinere Werte von k33/kn im Vergleich zu Alkyl- und Alkoxyresten. Die erfindungsgemäßen Mischungen zeichnen sich insbesondere durch hohe Δε-Werte aus und besitzen somit deutlich schnellere Schaltzeilen als die Mischungen aus dem Stand der Technik. Das optimale Mengenverhältnis der Verbindungen der oben genannten Formeln hängt weitgehend von den gewünschten Eigenschaften, von der Wahl der Komponenten der oben genannten Formeln und der Wahl weiterer gegebenenfalls vorhandener Komponenten ab. Geeignete Mengenverhältnisse innerhalb des oben angegebenen Bereichs können von Fall zu Fall leicht ermittelt werden.
Die Gesamtmenge an Verbindungen der oben genannten Formeln in den erfindungsgemäßen Gemischen ist nicht kritisch. Die Gemische können daher eine oder mehrere weitere Komponenten enthalten zwecks
Optimierung verschiedener Eigenschaften. Der beobachtete Effekt auf die gewünschte Verbesserung der Eigenschaften der Mischung ist jedoch in der Regel umso größer je höher die Gesamtkonzentration an Verbindungen der oben genannten Formeln ist.
In einer besonders bevorzugten Ausführungsform enthalten die erfindungsgemäßen Medien Verbindungen der Formel II bis VIII (vorzugsweise II, III, IV und V, insbesondere IIa und lila), worin X° F, OCF3, OCHF2) OCH=CF2, OCF=CF2 oder OCF2-CF2H bedeutet. Eine günstige
synergistische Wirkung mit den Verbindungen der Formeln IA und IB führt zu besonders vorteilhaften Eigenschaften. Insbesondere Mischungen
enthaltend Verbindungen der Formeln IA und IB, IIa und lila zeichnen sich durch ihre niedrige Schwellenspannung aus.
Die einzelnen Verbindungen der oben genannten Formeln und deren Unterformeln, die in den erfindungsgemäßen Medien verwendet werden können, sind entweder bekannt, oder sie können analog zu den bekannten Verbindungen hergestellt werden.
Gegenstand der Erfindung sind auch elektrooptische Anzeigen, wie z. B. STN- oder MFK-Anzeigen mit zwei planparallelen Trägerplatten, die mit einer Umrandung eine Zelle bilden, integrierten nicht-linearen Elementen zur Schaltung einzelner Bildpunkte auf den Trägerplatten und einer in der Zelle befindlichen nematischen Flüssigkristallmischung mit positiver dielektrischer Anisotropie und hohem spezifischem Widerstand), die derartige Medien enthalten sowie die Verwendung dieser Medien für elektrooptische Zwecke.
Die erfindungsgemäßen Flüssigkristallmischungen ermöglichen eine bedeutende Erweiterung des zur Verfügung stehenden Parameterraumes. Die erzielbaren Kombinationen aus Klärpunkt, Viskosität bei tiefer
Temperatur, thermischer und UV-Stabilität und hoher optischer Anisotropie übertreffen bei weitem bisherige Materialien aus dem Stand der Technik.
Die erfindungsgemäßen Mischungen sind insbesondere für mobile
Anwendungen und TFT-Anwendungen, wie z. B. Mobiltelefone und PDAs geeignet. Weiterhin können die erfindungsgemäßen Mischungen in FFS-, VA-IPS, OCB- und IPS-Anzeigen Anwendung finden.
Die erfindungsgemäßen Flüssigkristallmischungen ermöglichen es, bei Beibehaltung der nematischen Phase bis -20 °C und bevorzugt bis -30 °C, besonders bevorzugt bis -40 °C, und des Klärpunkts > 75 °C, vorzugsweise > 80 °C, gleichzeitig Rotationsviskositäten von < 1 10 mPa-s, besonders bevorzugt < 100 mPa-s zu erreichen, wodurch hervorragende MFK- Anzeigen mit schnellen Schaltzeiten erzielt werden können. Die
Rotationsviskositäten sind bei 20 °C bestimmt.
Die dielektrische Anisotropie der erfindungsgemäßen Flüssigkristallmischungen Δε ist bei 20 °C vorzugsweise > +8, besonders bevorzugt > +10, insbesondere bevorzugt > 12. Die Mischungen sind außerdem durch kleine Operationsspannungen gekennzeichnet. Die Schwellenspannung der erfindungsgemäßen Flüssigkristallmischungen ist vorzugsweise s 2.0 V. Die Doppelbrechung An der erfindungsgemäßen Flüssigkristallmischungen ist bei 20 °C vorzugsweise > 0,09, besonders bevorzugt > 0,10.
Der nematische Phasenbereich der erfindungsgemäßen Flüssigkristall- mischungen ist vorzugsweise mindestens 90° , insbesondere mindestens 100° breit. Vorzugsweise erstreckt sich dieser Bereich mindestens von -25° bis +70°C.
Es versteht sich, dass durch geeignete Wahl der Komponenten der erfmdungsgemäßen Mischungen auch höhere Klärpunkte (z.B. oberhalb 100 °C) bei höheren Schwellenspannungen oder niedrigere Klärpunkte bei niedrigeren Schwellenspannungen unter Erhalt der anderen vorteilhaften Eigenschaften realisiert werden können. Ebenso können bei entsprechend wenig erhöhten Viskositäten Mischungen mit größerem Δε und somit geringen Schwellen erhalten werden. Die erfindungsgemäßen MFK-
Anzeigen arbeiten vorzugsweise im ersten Transmissionsminimum nach Gooch und Tarry [C.H. Gooch und H.A. Tarry, Electron. Lett. 10, 2-4, 1974; C.H. Gooch und H.A. Tarry, Appl. Phys., Vol. 8, 1575-1584, 1975], wobei hier neben besonders günstigen elektrooptischen Eigenschaften, wie z.B. hohe Steilheit der Kennlinie und geringe Wnkelabhängigkeit des Kontrastes (DE-PS 30 22 818) bei gleicher Schwellenspannung wie in einer analogen Anzeige im zweiten Minimum, eine kleinere dielektrische Anisotropie ausreichend ist. Hierdurch lassen sich unter Verwendung der
erfindungsgemäßen Mischungen im ersten Minimum deutlich höhere spezifische Widerstände verwirklichen als bei Mischungen mit Cyan- verbindungen. Der Fachmann kann durch geeignete Wahl der einzelnen Komponenten und deren Gewichtsanteiten mit einfachen Routinemethoden die für eine vorgegebene Schichtdicke der MFK-Anzeige erforderliche Doppelbrechung einstellen.
Messungen des "Vortage Holding-ratio" (HR) [S. Matsumoto et al., Liquid Crystals 5, 1320 (1989); K. Niwa et al., Proc. SID Conference, San Francisco, June 1984, p. 304 (1984); G. Weber et al., Liquid Crystals 5, 1381 (1989)] haben ergeben, dass erfindungsgemäße Mischungen enthaltend
Verbindungen der Formel IA und IB eine deutlich geringere Abnahme des HR unter UV-Belastung aufweisen als analoge Mischungen enthaltend anstelle den Verbindun en der Formel IA und IB Cyanophenylcyclohexane der Formel
oder Ester der Formel
Die Lichtstabilität und UV-Stabilität der erfindungsgemäßen Mischungen ist erheblich besser, d.h. sie zeigen eine deutlich kleinere Abnahme des HR unter Licht- bzw. UV-Belastung.
Der Aufbau der erfindungsgemäßen MFK-Anzeige aus Polarisatoren,
Elektrodengrundplatten und Elektroden mit Oberflächenbehandlung
entspricht der für derartige Anzeigen üblichen Bauweise. Dabei ist der
Begriff der üblichen Bauweise hier weit gefasst und umfasst auch alle
Abwandlungen und Modifikationen der MFK-Anzeige, insbesondere auch Matrix-Anzeigeelemente auf Basis poly-Si TFT oder MIM.
Ein wesentlicher Unterschied der erfindungsgemäßen Anzeigen zu den bisher üblichen auf der Basis der verdrillten nematischen Zelle besteht jedoch in der Wahl der Flüssigkristallparameter der Flüssigkristallschicht. Die Herstellung der erfindungsgemäß verwendbaren Flüssigkristallmischungen erfolgt in an sich üblicher Weise, beispielsweise indem man eine oder mehrere Verbindungen der Formeln IA und IB mit einer oder mehreren Verbindungen der Formeln ll-XXVIII oder mit weiteren
flüssigkristallinen Verbindungen und/oder Additiven mischt. In der Regel wird die gewünschte Menge der in geringerer Menge verwendeten
Komponenten in der den Hauptbestandteil ausmachenden Komponenten gelöst, zweckmäßig bei erhöhter Temperatur. Es ist auch möglich Lösungen der Komponenten in einem organischen Lösungsmittel, z.B. in Aceton, Chloroform oder Methanol, zu mischen und das Lösungsmittel nach
Durchmischung wieder zu entfernen, beispielsweise durch Destillation.
Die Dielektrika können auch weitere, dem Fachmann bekannte und in der Literatur beschriebene Zusätze, wie z. B. UV-Stabilisatoren wie Tinuvin®, z.B. Tinuvin® 770, der Fa. Ciba Chemicals, Antioxidantien, z.B. TEMPOL, Mikropartikel, Radikalfänger, Nanopartikel, etc. enthalten. Beispielsweise können 0-15 % pleochroitische Farbstoffe oder chirale Dotierstoffe zugesetzt werden. Geeignete Stabilisatoren und Dotierstoffe werden nachfolgend in den Tabellen C und D genannt.
Den erfindungsgemäßen Mischungen können weiterhin polymerisierbare Verbindungen, sogenannte reaktive Mesogene (RMs), beispielsweise wie in U.S. 6,861 ,107 offenbart, in Konzentrationen von bevorzugt 0,12 - 5
Gew.%, besonders bevorzugt 0,2 - 2 % bezogen auf die Mischung, zugesetzt werden. Optional können diese Mischungen auch einen Initiator enthalten, wie beispielsweise in der U.S 6,781 ,665 beschrieben. Der Initiator, z.B. lrganox- 076 der Fa. Ciba, wird vorzugsweise der Mischung enthaltend polymerisierbare Verbindungen in Mengen von 0-1 % zugesetzt. Derartige Mischungen können für sogenannte Polymer Stabilized (PS) Modes, bei denen eine Polymerisierung der reaktiven Mesogene in der flüssigkristallinen Mischung erfolgen soll, verwendet werden, z.B. für PS- IPS-, PS-FFS, PS-TN, PS-VA-IPS. Voraussetzung hierfür ist, dass die Flüssigkristallmischung selbst keine polymerisierbaren Komponenten enthält.
In einer bevorzugten Ausführungsform der Erfindung sind die
polymerisierbaren Verbindungen ausgewählt aus den Verbindungen der Formel M
RMa-AM1-(ZM1-AM2)m1-R b M worin die einzelnen Reste folgende Bedeutung haben:
R a und RMb jeweils unabhängig voneinander P, P-Sp-, H, Halogen, SF5,
NO2, eine Alkyl-, Alkenyl- oder Alkinylgruppe, wobei bevorzugt mindestens einer der Reste RMa und RMb eine Gruppe P oder P-Sp- bedeutet oder enthält,
P eine polymerisierbare Gruppe,
Sp eine Abstandsgruppe oder eine Einfachbindung,
A 1 und AM2 jeweils unabhängig voneinander eine aromatische,
heteroaromatische, alicyclische oder heterocyclische Gruppe, vorzugsweise mit 4 bis 25 Ringatomen, bevorzugt C-Atomen, welche auch anellierte Ringe umfasst oder enthalten kann, und die optional ein- oder mehrfach durch L substitutiert sein kann,
L P, P-Sp-, OH, CH2OH, F, Cl, Br, I, -CN, -NO2, -NCO, -NCS,
-OCN, -SCN, -C(=O)N(Rx)2, -C(=O)Y1, -C(=O)Rx, -N(RX)2, optional substituiertes Silyl, optional substituiertes Aryl mit 6 bis 20 C Atomen, oder geradkettiges oder verzweigtes Alkyl, Alkoxy, Alkylcarbonyl, Alkoxycarbonyl, Alkylcarbonlyoxy oder Alkoxycarbonyloxy mit 1 bis 25 C-Atomen, worin auch ein oder mehrere H-Atome durch F, Cl, P oder P-Sp- ersetzt sein können, bevorzugt P, P-Sp-, H, OH, CH2OH, Halogen, SF5, NO2) eine Alkyl-, Alkenyl- oder Alkinylgruppe,
Y1 Halogen,
Z 1 -O-, -S-, -CO-, -CO-O-, -OCO-, -O-CO-O-, -OCH2-, -CH2O-,
-SCH2-, -CH2S-, -CF2O-, -OCF2-, -CF2S-, -SCF2-, -(CH2)n1-, -CF2CH2-, -CH2CF2-, -(CF2)n1-, -CH=CH-, -CF=CF-, -C=C-, -CH=CH-, -COO-, -OCO-CH=CH-, CR°R00 oder eine
Einfachbindung,
R° und R00 jeweils unabhängig voneinander H oder Alkyl mit 1 bis 12 C- Atomen,
R P, P-Sp-, H, Halogen, geradkettiges, verzweigtes oder
cyclisches Alkyl mit 1 bis 25 C-Atomen, worin auch eine oder mehrere nicht benachbarte CH2-Gruppen durch -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind,
und worin auch ein oder mehrere H-Atome durch F, Cl, P oder P-Sp- ersetzt sein können, eine optional substituierte Aryl- oder Aryloxygruppe mit 6 bis 40 C-Atomen, oder eine optional substituierte Heteroaryl- oder Heteroaryloxygruppe mit 2 bis 40 C-Atomen, m1 0, 1 , 2, 3 oder 4, und n1 1 , 2, 3 oder 4, wobei mindestens einer, bevorzugt einer, zwei oder drei, besonders bevorzugt einer oder zwei, aus der Gruppe RMa, RMb und der vorhandenen Substituenten L eine Gruppe P oder P-Sp- bedeutet oder mindestens eine Gruppe P oder P-Sp- enthält.
Besonders bevorzugte Verbindungen der Formel M sind solche, worin
RMa und RMb jeweils unabhängig voneinander P, P-Sp-, H, F, Cl, Br, I, -CN, - N02, -NCO, -NCS, -OCN, -SCN, SF5 oder geradkettiges oder verzweigtes Alkyl mit 1 bis 25 C-Atomen, worin auch eine oder mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander durch -C(R°)=C(R00)-, -C=C-, -N(R00)-, -O-, -S-, - CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl, Br, I,
CN, P oder P-Sp- ersetzt sein können, wobei bevorzugt mindestens einer der Reste RMa und RMb eine Gruppe P oder P-Sp- bedeutet oder enthält, AM1 und AM2 jeweils unabhängig voneinander 1 ,4-Phenylen, Naphthalin-1 ,4- diyl, Naphthalin-2,6-diyl, Phenanthren-2,7-diyl, Anthracen-2,7- diyl, Fluoren-2,7-diyl, Cumarin, Flavon, wobei in diesen
Gruppen auch eine oder mehrere CH-Gruppen durch N ersetzt sein können, Cyclohexan-1 ,4-diyl, worin auch eine oder mehrere nicht-benachbarte CH2-Gruppen durch O und/oder S ersetzt sein können, 1 ,4-Cyclohexenylen, Bicyclo[1.1.1]pentan-
1 ,3-diyl, ßicyclo[2.2.2]octan-1 ,4-diyl, Spiro[3.3]heptan-2,6-diyl, Piperidin-1 ,4-diyl, Decahydronaphthalin-2,6-diyl, 1 ,2,3,4- Tetrahydronaphthalin-2,6-diyl, lndan-2,5-diyl oder Octahydro- 4,7-methano-indan-2,5-diyl, wobei alle diese Gruppen unsubstituiert oder durch L ein- oder mehrfach substituiert sein können,
L P, P-Sp-, OH, CH2OH, F, Cl, Br, I, -CN, -NO2, -NCO, -NCS, -
OCN, -SCN, -C(=O)N(Rx)2, -C(=0)Y1, -C(=0)Rx, -N(RX)2, optional substituiertes Silyl, optional substituiertes Aryl mit 6 bis 20 C Atomen, oder geradkettiges oder verzweigtes Alkyl, Alkoxy, Alkylcarbonyl, Alkoxycarbonyl, Alkylcarbonlyoxy oder Alkoxycarbonyloxy mit 1 bis 25 C-Atomen, worin auch ein oder mehrere H-Atome durch F, Cl, P oder P-Sp- ersetzt sein können,
P eine polymerisierbare Gruppe,
Y1 Halogen,
Rx P, P-Sp-, H, Halogen, geradkettiges, verzweigtes oder
cyclisches Alkyl mit 1 bis 25 C-Atomen, worin auch eine oder mehrere nicht benachbarte CH2-Gruppen durch -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl, P oder P-Sp- ersetzt sein können, eine optional substituierte Aryl- oder Aryloxygruppe mit 6 bis 40 C-Atomen, oder eine optional substituierte Heteroaryl- oder Heteroaryloxygruppe mit 2 bis 40 C-Atomen, bedeuten.
Ganz besonders bevorzugt sind Verbindungen der Formel M, worin einer von RMa und RMb oder beide P oder P-Sp- bedeuten.
Geeignete und bevorzugte RMs für die Verwendung in erfindungs-gemäßen flüssigkristallinen Medien und PS-Mode-Anzeigen, sind beispielsweise ausgewählt aus den folgenden Formeln:
worin die einzelnen Reste folgende Bedeutung besitzen:
P1 und P2 jeweils unabhängig voneinander eine polymerisierbare
Gruppe, vorzugsweise mit einer der vor- und nachstehend für P angegebenen Bedeutungen, besonders bevorzugt eine Acrylat-, Methacrylat-, Fluoracrylat-, Oxetan-, Vinyloxy- oder Epoxygruppe,
Sp1 und Sp2 jeweils unabhängig voneinander eine Einfachbindung oder eine
Abstandsgruppe, vorzugsweise mit einer der vor- und nachstehend für Sp angegebenen Bedeutungen, und besonders bevorzugt -(CH2)Pi-, -(CH2)PrO-, -(CH2)p1-CO-0- oder -(CH2)pi-0-CO-0- bedeuten, worin p1 eine ganze Zahl von 1 bis 12 ist, und wobei in den letztgenannten Gruppen die Verknüpfung zur benachbarten Ring über das O-Atom erfolgt, wobei einer der Reste P1-Sp1- und P2-Sp2- auch Raa bedeuten kann,
Raa H, F, Cl, CN oder geradkettiges oder verzweigtes Alkyl mit 1 bis 25 C-Atomen, worin auch eine oder mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander durch C(R°)=C(R00)-, -C=C-, -N(R0)-, -O-, -S-, -CO-, -CO-O-, - O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S- Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl, CN oder P -Sp1- ersetzt sein können, besonders bevorzugt geradkettiges oder verzweigtes, optional ein- oder mehrfach fluoriertes, Alkyl, Alkoxy, Alkenyl, Alkinyl, Alkylcarbonyl, Alkoxycarbonyl, oder Alkylcarbonyloxy mit 1 bis 12 C-Atomen (wobei die Alkenyl- und Alkinylreste mindestens zwei und die verzweigten Reste mindestens drei C-Atome aufweisen),
R°, R00 jeweils unabhängig voneinander und bei jedem Auftreten
gleich oder verschieden H oder Alkyl mit 1 bis 12 C-Atomen,
Ry und Rz jeweils unabhängig voneinander H, F, CH3 oder CF3,
Z 1 -O-, -CO-, -C(RyR2)-,oder -CF2CF2-.
Z 2 und Zm jeweils unabhängig voneinander -CO-O-, -O-CO-, -CH2O-,
-OCH2-, -CF2O-, -OCF2-, oder -(CH2)n-, wobei n 2, 3 oder 4 ist,
L bei jedem Auftreten gleich oder verschieden F, Cl, CN, oder geradkettiges oder verzweigtes, optional ein- oder mehrfach fluoriertes, Alkyl, Alkoxy, Alkenyl, Alkinyl, Alkylcarbonyl, Alkoxycarbonyl, oder Alkylcarbonyloxy mit 1 bis 12 C-Atomen vorzugsweise F,
L' und L" jeweils unabhängig voneinander H, F oder Cl, r 0, 1 , 2, 3 oder 4, s 0, 1 , 2 oder 3,
t 0, 1 oder 2, und x O oder l .
Geeignete polymerisierbare Verbindungen sind beispielsweise in Tabelle E gelistet.
Bevorzugt enthalten die flüssigkristallinen Medien gemäß der vorliegenden Anmeldung insgesamt 0,01 bis 10 %, bevorzugt 0,2 bis 4,0 %, besonders bevorzugt 0,2 bis 2,0 %, an polymerisierbaren Verbindungen.
Insbesondere bevorzugt sind die polymerisierbaren Verbindungen der Formel M.
Gegenstand der vorliegenden Erfindung ist somit auch die Verwendung der erfindungsgemäßen Mischungen in elektrooptischen Anzeigen sowie der Einsatz der erfindungsgemäßen Mischungen in Shutter-Brillen,
insbesondere für 3D-Anwendungen, und in TN-, PS-TN-, STN-, TN-TFT-, OCB-, IPS-, PS-IPS-, FFS-, PS-FFS- und PS-VA-I PS-Anzeigen.
In der vorliegenden Anmeldung und in den folgenden Beispielen sind die Strukturen der Flüssigkristallverbindungen durch Acronyme angegeben, wobei die Transformation in chemische Formeln gemäß Tabelle A erfolgt. Alle Reste C
nH2n+i und C
mH
2m+i sind geradkettige Alkylreste mit n bzw. m C- Atomen; n, m und k sind ganze Zahlen und bedeuten vorzugsweise 0, 1 , 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 oder 12. Die Codierung gemäß Tabelle B versteht sich von selbst. In Tabelle A ist nur das Acronym für den Grundkörper angegeben. Im Einzelfall folgt getrennt von Acronym für den Grundkörper mit einem Strick ein Code für die Substituenten R , R
2*, L
r und L
2*:
Code für R , R R
2* L L
2 R
2*, L , L
2*, L
3*
nO.m OC
nH2n+1 C
mH2m+1 H H
nOF OCnH2n+1 F H H
Bevorzugte Mischungskomponenten finden sich in den Tabellen A und B.
Tabelle A
BCH CBC
55
Tabelle B
In den nachfolgenden Formeln bedeuten n und m jeweils unabhängig voneinander 0, 1 , 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 oder 12, insbesondere 2, 3, 5, ferner 0, 4, 6.
F
APUQU-n-F
PGP-n-m CGU-n-F
CDUQU-n-F
CDU-n-F
cNH2N+1 ~ H y-< o CNH2N+1— ( H ( O )- COO— ( O
CGG-n-F CPZG-n-OT
CC-nV-Vm
CCP-Vn-m CCG-V-F
CLUQU-n-F
CCQG-n-F CQU-n-F
CUQU-n-F
CCCQU-n-F
CGUQU-n-F
CPGU-n-OT
GPQU-n-F MPP-n-F
GGP-n-F PGIGI-n-F
PGU-n-OXF CPU-n-OXF
Besonders bevorzugt sind flüssigkristalline Mischungen, die neben den Verbindungen der Formeln IA und IB mindestens ein, zwei, drei, vier oder mehr Verbindungen aus der Tabelle B enthalten.
Tabelle C
In der Tabelle C werden mögliche Dotierstoffe angegeben, die in der Regel den erfindungsgemäßen Mischungen zugesetzt werden. Vorzugsweise enthalten die Mischungen 0-10 Gew.%, insbesondere 0,01-5 Gew.% und besonders bevorzugt 0,01-3 Gew.% an Dotierstoffen.
R/S-4011 R/S-5011
R/S-1011
Tabelle D
Stabilisatoren, die beispielsweise den erfindungsgemäßen Mischungen in Mengen von 0-10 Gew.% zugesetzt werden können, werden nachfolgend genannt.
n = 1 , 2, 3, 4, 5, 6 oder 7
n = 1, 2, 3, 4, 5, 6 oder 7
66
Tabelle E
Polymerisierbare Verbindungen, die beispielsweise den erfindungsgemäßen Mischungen in Mengen von 0,01 - 1 Gew.% zugesetzt werden können, werden nachfolgend genannt. Gegebenenfalls muss für die
Polymerisation noch ein Initiator zugesetzt werden, vorzugsweise in Mengen von 0 - 1 %.
RM-18
RM-22
R -27
74
Die folgenden Mischungsbeispiele sollen die Erfindung erläutern, ohne sie zu begrenzen.
Vor- und nachstehend bedeuten Prozentangaben Gewichtsprozent. Alle Temperaturen sind in Grad Celsius angegeben. Fp. bedeutet Schmelzpunkt, Kp. = Klärpunkt. Ferner bedeuten K = kristalliner Zustand, N = nematische Phase, S = smektische Phase und I = isotrope Phase. Die Angaben zwischen diesen Symbolen stellen die Übergangstemperaturen dar. Weiterhin bedeutet
An die optische Anisotropie bei 589 nm und 20 °C, γι die Rotationsviskosität (mPa-s) bei 20 °C,
Δε die dielektrische Anisotropie bei 20 °C und 1 kHz (Δε = ε(| - εχ, wobei ε|| die Dielektrizitätskonstante parallel zu den Moleküllängsachsen und ει die Dielektrizitätskonstante senkrecht dazu bedeutet),
V10 die Spannung (V) für 10 % Transmission (Blickrichtung senkrecht zur Plattenoberfläche), (Schwellenspannung), bestimmt in einer TN Zelle (90 Grad Verdrillung) im 1. Minimum (d.h. bei einem dAn-Wert von 0,5 pm) bei 20 °C,
V0 die kapazitiv bestimmte Freedericksschwellenspannung in einer antiparallel geriebenen Zelle bei 20 °C.
Alle physikalischen Eigenschaften werden nach "Merck Liquid
Crystals, Physical Properties of Liquid Crystals" Status Nov. 1997, Merck KGaA, Deutschland bestimmt und gelten für eine Temperatur von 20 °C, sofern nicht explizit anders angegeben.
Beispiele
Beispiel M1
CC-3-V 28,0 % Klärpunkt [°C]:
CC-3-V1 5,5 % Δη [589 nm, 20 °C]
CCP-V2-1 5,0 % Δε [1 kHz, 20 °C]:
CCP-30CF3 7,0 % γι [mPa-s, 20 °C]:
CCP-5OCF3 5,0 % Vo M:
ACQU-3-F 2,5 %
CCQU-3-F 8,0 %
CCQU-5-F 6,0 %
CCGU-3-F 4,0 %
PUQU-3-F 7,5 %
APUQU-2-F 5,0 %
APUQU-3-F 7,0 %
PGUQU-3-F 2,0 %
PGUQU-4-F 5,0 %
PGUQU-5-F 2,5 %
Beispiel M2
CC-3-V 24,5 % Klärpunkt [°C]: 95
CC-3-V1 7,0 % Δη [589 nm, 20 °C]: 0,0996
CCP-V2-1 6,0 % Δε [1 kHz, 20 °C]: 1 1 ,0
CCP-V-1 8,0 % γι [mPa-s, 20 °C]: 98
CCP-3OCF3 7,0 % Vo M: 1 ,21
CCP-5OCF3 5,0 %
CCQU-3-F 8,0 %
CCQU-5-F 6,0 %
PUQU-3-F 7,0 %
APUQU-2-F 5,0 %
APUQU-3-F 8,0 %
PGUQU-3-F 1 ,5 %
PGUQU-4-F 7,0 %
Beispiel 3
CC-3-V 32,0 % Klärpunkt [°C]: 75,9
CC-3-V1 9,0 % Δη [589 nm, 20 °C]: 0,1258
CCP-V-1 5,0 % Δε [1 kHz, 20 °C]: 16,5
PGP-2-2V 3,0 % γι [mPa-s, 20 °C]: 87
PGU-2-F 4,0 % Vo M: 0,90
PGU-3-F 3,5 %
PUQU-3-F 6,5 %
APUQU-2-F 5,0 %
APUQU-3-F 12,0 %
PGUQU-3-F 5,0 %
PGUQU-4-F 7,0 %
PGUQU-5-F 8,0 %
Beispiel M4
CC-3-V 27,0 % Klärpunkt [°C]: 74,8
CC-3-V1 9,0 % Δη [589 nm, 20 °C]: 0,1255
CCP-V-1 8,5 % Δε [1 kHz, 20 °C]: 18,6
PGU-2-F 4,5 % γι [mPa s, 20 °C]: 95
PGU-3-F 3,0 % V0 [V]: 0,83
PUQU-3-F 11 ,0 %
APUQU-2-F 5,0 %
APUQU-3-F 12,0 %
PGUQU-3-F 5,0 %
PGUQU-4-F 7,0 %
PGUQU-5-F 8,0 %
Beispiel M5
CC-3-V 30,0 % Klärpunkt [°C]: 94,5
CC-3-V1 8,0 % Δη [589 nm, 20 °C]: 0,0990
CCP-V2-1 4,0 % Δε [1 kHz, 20 °C]: 11 ,0
CCP-V-1 8,0 % γι [mPa-s, 20 °C]: 92
CCP-30CF3 7,0 % LTS [Bulk, -25 °C]: > 1000 h
CCQU-3-F 4,0 % Vo M: 1 ,22
PUQU-3-F 5,0 %
APUQU-2-F 5,0 %
APUQU-3-F 2,0 %
PGUQU-3-F 2,0 %
PGUQU-4-F 5,0 %
PGUQU-5-F 5,0 %
CDUQU-3-F 10,0 %
ECCP-31 5,0 %
Beispiel M6
CC-3-V 37,0 % Klärpunkt [°C]: 80,0
CCP-V-1 5,0 % Δη [589 nm, 20 °C]: 0,1287
PGU-2-F 3,0 % Δε [1 kHz, 20 °C]: 17,3
PGU-3-F 8,0 % γι [mPa-s, 20 °C]: 99
BCH-3F.F.F 8,0 % LTS [Bulk, -25 °C]: > 1000 h
APUQU-2-F 7,0 % Vi0 [V]: 1 ,05
APUQU-3-F 8,0 %
PGUQU-3-F 4,0 %
PGUQU-4-F 6,0 %
PGUQU-5-F 6,0 %
DPGU-4-F 8,0 %
Beispiel M7
APUQU-2-F 5,0 % Klärpunkt [°C]: 74,5
APUQU-3-F 6,0 % Δη [589 nm, 20 °C]: 0,1345
BCH-3F.F.F 2,0 % Δε [1 kHz, 20 °C]: 13,8
CC-3-V 31,5 %
CC-3-V1 5,0 %
CCP-3-3 1 ,0 %
CCP-V-1 3,0 %
CPU-3-OXF 5,0 %
PGP-2-2V 10,5 %
PGU-2-F 6,0 %
PGUQU-3-F 7,0 %
PGUQU-4-F 3,0 %
PGUQU-5-F 3,0 %
PPGU-3-F 1 ,0 %
PUQU-3-F 11 ,0 %
Beispiel M8
CC-3-V 22,0 % Klärpunkt [°C]: 79,5
CCP-1 F.F.F 3,0 % Δη [589 nm, 20 °C]: 0,1294
CCP-2F.F.F 9,0 % Δε [1 kHz, 20 °C]: 20,2
CCP-3F.F.F 9,0 % γι [mPa-s, 20 °C]: 129
CPU-3-OXF 12,0 % LTS [Bulk, -25 °C]: > 1000 h
PGU-2-F 3,0 % Vio [V]: 1 ,05
PGU-3-F 6,0 %
APUQU-2-F 7,0 %
APUQU-3-F 7,0 %
PGUQU-3-F 4,0 %
PGUQU-4-F 5,0 %
PGUQU-5-F 6,0 %
DPGU-4-F 7,0 %
Beispiel M9
CC-3-V 37,0 % Klärpunkt [°C]: 77,5
PUQU-3-F 14,0 % Δη [589 nm, 20 °C]: 0,1372
APUQU-2-F 4,0 % Δε [1 kHz, 20 °C]: 12,8
APUQU-3-F 5,0 % γι [mPa-s, 20 °C]: 82
PGP-1-2V 6,0 % LTS [Bulk, -25 °C]: > 1000 h
PGP-2-2V 6,0 % V10M: 1,24
PGP-3-2V 6,0 %
CCP-V2-1 5,0 %
PGUQU-3-F 7,0 %
PGUQU-4-F 5,0 %
PGUQU-5-F 5,0 %
Beispiel M10
APUQU-2-F 6,0 % Klärpunkt [°C]: 75,0
APUQU-3-F 12,0 % Δη [589 nm, 20 °C]: 0,1268
PGUQU-3-F 8,0 % Δε [1 kHz, 20 °C]: 14,4
PGUQU-4-F 0,0 % γι [mPa s, 20 °C]: 78
PGUQU-5-F 8,0 % V0 [V]: 0,99
PGP-2-2V 5,0 %
CC-3-V 42,0 %
CC-3-V1 3,0 %
PP-1-2V1 6,0 %
Beispiel 11
APUQU-2-F 10,0 % Klärpunkt [°C]: 76,5
APUQU-3-F 10,0 % Δη [589 nm, 20 °C]: 0,1183
PGUQU-3-F 8,0 % Δε [1 kHz, 20 °C]: 14,0
PGUQU-4-F 8,0 % V0 [V]: 0,95
PGUQU-5-F 8,0 %
CC-3-V 50,0 %
PGP-2-2V 6,0 %
Beispiel M12
CC-3-V 33,0 % Klärpunkt [°C]: 93,5
CC-3-V1 12,0 % Δη [589 nm, 20 °C]: 0,1086 CCP-V2-1 6,0 % Δε [1 kHz, 20 °C]: 13,7
CCP-30CF3 6,0 % γι [mPa-s, 20 °C]: 92
CCQU-3-F 4,0 % V0 [V]: 1 ,09
APUQU-2-F 10,0 %
APUQU-3-F 10,0 %
PGUQU-3-F 5,0 %
PGUQU-4-F 8,0 %
DPGU-4-F 6,0 %
Beispiel M13
CC-3-V 32,0 % Klärpunkt [°C]: 96,0
CC-3-V1 12,0 % Δη [589 nm, 20 °C]: 0,1092
CCP-V2-1 9,0 % Δε [1 kHz, 20 °CJ: 15,0
CCGU-3-F 4,0 % γι [mPa s, 20 °C]: 108
APUQU-2-F 9,0 % V0 [V]: 1 ,03
APUQU-3-F 9,0 %
PGUQU-3-F 6,0 %
PGUQU-4-F 6,0 %
PGUQU-5-F 4,0 %
CDUQU-3-F 9,0 %
Beispiel M14
CC-3-V 31 ,0 % Klärpunkt [°C]: 96,0
CC-3-V1 12,0 % Δη [589 nm, 20 °C]: 0,1087
CCP-V2-1 5,0 % Δε [1 kHz, 20 °C]: 15,2
CCGU-3-F 3,0 % γι [mPa s, 20 °C]: 106
CCQU-3-F 11 ,0 % V0 [V]: 1 ,03
APUQU-2-F 10,0 %
APUQU-3-F 10,0 %
PGUQU-3-F 5,0 %
PGUQU-4-F 6,0 %
DPGU-4-F 7,0 %