WO2004067498A2 - Derives d’ arylalkylcarbamates, leur preparation et leur application en therapeutique - Google Patents
Derives d’ arylalkylcarbamates, leur preparation et leur application en therapeutique Download PDFInfo
- Publication number
- WO2004067498A2 WO2004067498A2 PCT/FR2004/000139 FR2004000139W WO2004067498A2 WO 2004067498 A2 WO2004067498 A2 WO 2004067498A2 FR 2004000139 W FR2004000139 W FR 2004000139W WO 2004067498 A2 WO2004067498 A2 WO 2004067498A2
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- group
- alkyl
- cycloalkyl
- alkylene
- optionally substituted
- Prior art date
Links
- IOJXXVMUZXWYLP-UHFFFAOYSA-N CNC(COC(NCCc(cc1)ccc1Oc(cc1)ccc1Cl)=O)=O Chemical compound CNC(COC(NCCc(cc1)ccc1Oc(cc1)ccc1Cl)=O)=O IOJXXVMUZXWYLP-UHFFFAOYSA-N 0.000 description 1
- YXXOGXAMRJXRRF-UHFFFAOYSA-N CNC(COC(NCCc1cccc(Oc2ccccc2)c1)=O)=O Chemical compound CNC(COC(NCCc1cccc(Oc2ccccc2)c1)=O)=O YXXOGXAMRJXRRF-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/10—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/10—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C271/12—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/27—Esters, e.g. nitroglycerine, selenocyanates of carbamic or thiocarbamic acids, meprobamate, carbachol, neostigmine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/08—Drugs for disorders of the alimentary tract or the digestive system for nausea, cinetosis or vertigo; Antiemetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/14—Prodigestives, e.g. acids, enzymes, appetite stimulants, antidyspeptics, tonics, antiflatulents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/02—Non-specific cardiovascular stimulants, e.g. drugs for syncope, antihypotensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C269/00—Preparation of derivatives of carbamic acid, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C269/06—Preparation of derivatives of carbamic acid, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups by reactions not involving the formation of carbamate groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/10—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C271/14—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms to carbon atoms of hydrocarbon radicals substituted by halogen atoms or by nitro or nitroso groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/10—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C271/16—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms to carbon atoms of hydrocarbon radicals substituted by singly-bound oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/10—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C271/18—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms to carbon atoms of hydrocarbon radicals substituted by doubly-bound oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/10—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C271/20—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms to carbon atoms of hydrocarbon radicals substituted by nitrogen atoms not being part of nitro or nitroso groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/36—Radicals substituted by singly-bound nitrogen atoms
- C07D213/40—Acylated substituent nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/12—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D217/00—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems
- C07D217/12—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems with radicals, substituted by hetero atoms, attached to carbon atoms of the nitrogen-containing ring
- C07D217/18—Aralkyl radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/02—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings
- C07D241/10—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D241/12—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D261/00—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings
- C07D261/02—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings
- C07D261/06—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members
- C07D261/08—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D285/00—Heterocyclic compounds containing rings having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by groups C07D275/00 - C07D283/00
- C07D285/01—Five-membered rings
- C07D285/02—Thiadiazoles; Hydrogenated thiadiazoles
- C07D285/04—Thiadiazoles; Hydrogenated thiadiazoles not condensed with other rings
- C07D285/06—1,2,3-Thiadiazoles; Hydrogenated 1,2,3-thiadiazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/91—Dibenzofurans; Hydrogenated dibenzofurans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/06—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to the ring carbon atoms
- C07D333/14—Radicals substituted by singly bound hetero atoms other than halogen
- C07D333/20—Radicals substituted by singly bound hetero atoms other than halogen by nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/50—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D333/52—Benzo[b]thiophenes; Hydrogenated benzo[b]thiophenes
- C07D333/54—Benzo[b]thiophenes; Hydrogenated benzo[b]thiophenes with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to carbon atoms of the hetero ring
- C07D333/58—Radicals substituted by nitrogen atoms
Definitions
- Arylalkylcarbamate derivatives their preparation and their therapeutic use
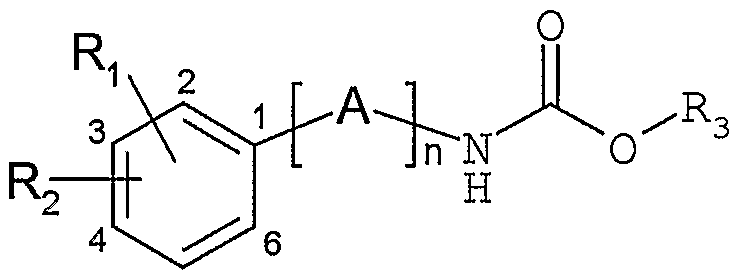
- the subject of the invention is arylalkylcarbamate derivatives, their preparation and their therapeutic use.
- n represents an integer ranging from 1 to 7;
- A is chosen from one or more groups X, Y and / or Z;
- X represents a C ⁇ _ 2 -alkylene group optionally substituted by one or more C ⁇ _ ⁇ 2 -alkyl, C 3 _ - cycloalkyl or C3_ -cycloalkyl-C ⁇ _6-alkylene groups;
- Y represents either a C 2 -alkenylene group optionally substituted by one or more C ⁇ - ⁇ 2 alkyl, C 3 - - cycloalkyl or C 3 _ 7 -cycloalkyl-C ⁇ - 6 -alkylene groups; either a group
- Z represents a C 3 _ 7 -cycloalkyl group, of formula:
- Ri represents a hydrogen or halogen atom or a hydroxy, cyano, nitro, C ⁇ - 4 -alkyle, C ⁇ - 4 -alkoxy, C 1 - 4 - thioalkyle, C ⁇ -4-fluoroalkyle, C ⁇ _ 4 -fluoroalkoxy group, C ⁇ - -fluoro- 4 thioalkyl;
- R 2 represents a hydrogen or halogen atom or a cyano, nitro, hydroxy, C ⁇ - 4 -alkyl, C ⁇ - 4 -alkoxy group, C ⁇ -4-thioalkyle, C ⁇ - 4 -fluoroalkyle, C ⁇ - 4 -fluoroalkoxy, C ⁇ -4-fluorothioalkyle, or a group chosen among in particular a phenyl, naphthalenyl, biphenyl, phenylethylenyl, naphthylethylenyl, pyridinyl, pyrimidinyl, pyrazinyl, pyridazinyl , indanyl, indenyl, quinolinyl, isoquinolinyl, quinazolinyl, quinoxalinyl, phthalazinyl, cinnolinyl, thienyl, furanyl, pyrrolyl, imidazolyl,
- R ⁇ and R independently of one another represent a C ⁇ - 3 -alkyl group, a phenyl
- R 3 represents a group of general formula CHR 4 CONHR 5 wherein R 4 represents a hydrogen atom or a group C ⁇ _ 3 -alkyl and R 5 represents a hydrogen atom or a C1 group 3 - alkyl, C 3 - 5 -cycloalkyle, C 3 _ -cycloalkyle-C ⁇ - 6 -alkylène.
- R 4 represents a hydrogen atom or a group C ⁇ _ 3 -alkyl
- R 5 represents a hydrogen atom or a C1 group 3 - alkyl, C 3 - 5 -cycloalkyle, C 3 _ -cycloalkyle-C ⁇ - 6 -alkylène.
- the compounds of general formula (I) can therefore comprise several groups A which are identical or different from one another.
- n represents an integer ranging from 1 to 7;
- A is chosen from one or more groups X, Y and / or Z;
- X represents a C ⁇ - 2 -alkylene group optionally substituted by one or more C ⁇ _ ⁇ 2 -alkyl, C 3 - 7 - cycloalkyl or C3 - cycloalkyl-C ⁇ -6-alkylene groups;
- Y represents either a C 2 -alkenylene group optionally substituted by one or more C ⁇ - ⁇ 2 alkyl, C 3 - cycloalkyl or C 3 --cycloalkyl-C ⁇ -6-alkylene groups; or a C 2 -alkynylene group;
- Z represents a C3 - cycloalkyl group, of formula:
- m represents an integer ranging from 1 to 5; p and q represent whole numbers and are defined such that p + q is a number ranging from 1 to 5;
- Ri represents a hydrogen or halogen atom or a hydroxy, cyano, nitro, C ⁇ - 4 -alkyle, C ⁇ - 4 -alkoxy, C 1 - 4 - thioalkyle, C ⁇ - 4 -fluoroalkyle, C ⁇ - 4 -fluoroalkoxy group , C ⁇ -4-fluorothioalkyl;
- R 2 represents a hydrogen atom, a halogen atom or a cyano, nitro, hydroxy, C ⁇ - 4 -alkyl, C ⁇ -4-alkoxy group,
- C ⁇ - 4 -fluorothioalkyle or a group chosen from in particular a phenyl, naphthalenyl, biphenyl, phényléthylényle, naphtylethylènyle, pyridinyl, pyrimidinyl, pyrazinyl, pyridazinyl, triazinyl, indanyl, indenyl, quinolinyl, isoquinolinyl, quinazolinyl, quinoxalinyl, phthalazinyl, cinnolinyl, thienyl, furanyl, pyrrolyl, imidazolyl, pyrazolyl, oxazolyl, thiazolyl, isoxazolyl, isothiazolyl, thiadiazolyl, oxadiazolyl, triazolyl, phénylimidazolyle, benzothienyl, benzo
- R4 represents a hydrogen atom or a C ⁇ - 3 -alkyl group and R5 represents a hydrogen atom or a C ⁇ _ 3 - alkyl group, C 3 _5-cycloalkyl, C3 - cycloalkyle-C ⁇ -6-alkylene; provided that if Ri and R 2 represent a hydrogen atom and A is a group X, X being methylene, then n is different from 1.
- a second family of preferred compounds consists of the compounds for which: - when n is equal to 1:
- A is chosen from one or more groups X, Y and / or Z;
- X represents a C ⁇ - 2 -alkylene group optionally substituted by one or more C ⁇ _ ⁇ 2 -alkyl, C 3 _ 7 - cycloalkyl or C 3 - 7 -cycloalkyl-C ⁇ -6-alkylene groups;
- Y represents either a C 2 -alkenylene group optionally substituted by one or more C ⁇ - ⁇ 2 alkyl, C 3 - 7 - cycloalkyl or C 3 --cycloalkyl-C ⁇ -6-alkylene groups; or a C 2 -alkynylene group;
- Z represents a C 3 - 7 -cycloalkyl group, of formula:
- Ri represents a hydrogen or halogen atom or a hydroxy, cyano, nitro, C ⁇ - 4 -alkyle, C ⁇ - 4 -alkoxy, C 1 - 4 - thioalkyle, C ⁇ - 4 -fluoroalkyle, C ⁇ - 4 -fluoroalkoxy group , C ⁇ _-fluorothioalkyl;
- R 2 represents a halogen atom or a cyano, nitro, hydroxy, C ⁇ - 4 -alkyl, C ⁇ - 4 -alkoxy group,
- C ⁇ - 4 -fluorothioalkyle or a group chosen from in particular a phenyl, naphthalenyl, biphenyl, phenylethylenyl, naphthylethylenyl, pyridinyl, pyrimidinyl, pyrazinyl, pyridazinyl, triazinyl, indanyl, indenyl, quinolinyl, isoquinolinyl, quininolinyl, quinazinyl) , furanyl, pyrrolyl, imidazolyl, pyrazolyl, oxazolyl, thiazolyl, isoxazolyl, isothiazolyl, thiadiazolyl, oxadiazolyl, triazolyl, phenylimidazolyl, benzothienyl, benzofuranyl, dibenzofuranyl, benzimidazylyl, benzotriazy
- R 4 represents a hydrogen atom or a C ⁇ - 3 -alkyl group and R 5 represents a hydrogen atom or a C1-3- alkyl group, C 3 - 5 -cycloalkyle, C 3 --cycloalkyle-C ⁇ - 6 -alkylene; - when n represents an integer ranging from 2 to 7:
- A is chosen from one or more groups X, Y and / or Z;
- X represents a C ⁇ _ 2 -alkylene group optionally substituted by one or more C ⁇ _ ⁇ 2 -alkyl, C 3 - cycloalkyl or C 3 - 7 -cycloalkyl-C ⁇ _ 6 -alkylene groups;
- Y represents either a C 2 -alkenylene group optionally substituted by one or more C1- 1 2 alkyl, C 3 - 7 - cycloalkyl or C 3 - 7 -cycloalkyl-C ⁇ - 6 -alkylene groups; or a C 2 -alkynylene group;
- Z represents a C 3 - 7 -cycloalkyl group, of formula:
- Ri represents a hydrogen or halogen atom or a hydroxy, cyano, nitro, C ⁇ - 4 -alkyle, C ⁇ - 4 -alkoxy, C 1 - 4 - thioalkyle, C ⁇ - 4 -fluoroalkyle, C ⁇ _ 4 -fluoroalkoxy group, C ⁇ _4-fluorothioalkyle;
- R 2 represents a hydrogen or halogen atom or a cyano, nitro or hydroxy group, C ⁇ - alkyl, C ⁇ - 4 -alkoxy, C ⁇ -4-thioalkyle, C ⁇ - 4 -fluoroalkyle, C ⁇ - 4 -fluoroalkoxy, C ⁇ -4-fluorothioalkyle, or a group chosen from in particular a phenyl, naphthalenyl, biphenyl, phenylethylenylated, naphthylethylenyl, pyridinyl,
- R 3 represents a group of general formula CHR4CONHR5 in which
- R4 represents a hydrogen atom or a C ⁇ - 3 -alkyl group and R5 represents a hydrogen atom or a C ⁇ - 3 - alkyl group, C 3 - 5 -cycloalkyle, C 3 --cycloalkyle-C ⁇ -6-alkylene .
- n represents an integer from 1 to 5; and / or A is chosen from one or more groups X and / or Z; X represents a C ⁇ - 2 -alkylene group, more particularly methylene, optionally substituted by one or more C ⁇ - 3 -alkyl groups, more particularly methyl; Z represents a C 3 --cycloalkyl group, of formula:
- m represents an integer ranging from 1 to 5, more particularly equal to 1; p and q represent whole numbers and are defined such that p + q is a number ranging from 1 to 5, more particularly equal to 4; and / or R 1 represents a hydrogen or a halogen, more particularly a chlorine or a fluorine, or a C 1 - 4 - alkoxy group, more particularly a methoxy; and / or R 2 represents a hydrogen or halogen atom, more particularly a chlorine, a bromine or a fluorine, or a hydroxy group, C ⁇ - alkyl, more particularly methyl, C ⁇ - 4 -alkoxy, more particularly methoxy , C 1 - 4 - fluoroalkyle, more particularly trifluoromethyl, Ci- 4 -fluoroalkoxy, more particularly trifluoromethoxy, or a group chosen from a phenyl, naphthalenyl, biphenyl, phenylethylenyl,
- R ⁇ and R represent, independently of one another, a C ⁇ - 3 -alkyl group, more particularly methyl; and or
- R 3 represents a group of general formula CHR 4 CONHR 5 in which
- R 4 represents a hydrogen atom or a C ⁇ _ 3 -alkyl group and R 5 represents a hydrogen atom or a C ⁇ _ 3 - alkyl group, more particularly methyl, ethyl, C 3 - 5 - cycloalkyl, more particularly cyclopropyl, C 3 - 7 - cycloalkyle-C ⁇ -6-alkylene, more particularly cyclopropylmethyl.
- n represents an integer from 1 to 5; and / or A represents a C ⁇ _ 2 -alkylene group, more particularly methylene; and or
- R1 represents hydrogen or halogen, more particularly chlorine or fluorine
- / or R 2 represents a group chosen from phenyl, naphthalenyl, phenyloxy, benzyloxy, pyridinyl, quinolinyl, isoquinolinyl, phenylimidazole or pyrrolopyridinyl, and optionally substituted by one or more substituents chosen from a halogen atom, more particularly a chlorine or a fluorine, a cyano, C ⁇ - 4 -alkyl group, more particularly methyl, C 1 - 4 - alkoxy, more particularly methoxy, C ⁇ _ 3 -fluoroalkyle, more particularly trifluoromethyl, C ⁇ - 3 -fluoroalkoxy, more particularly trifluoromethoxy; and / or R 3 represents a group of general formula CHR 4 CONHR in which
- R4 represents a hydrogen and R5 represents a hydrogen atom or a C ⁇ _ 3 -alkyl group, more particularly methyl, ethyl, C 3 - 5 -cycloalkyle, more particularly cyclopropyl, C 3 - 7 -cycloalkyle-C ⁇ -6- alkylene, more particularly cyclopropylmethyl.
- n has an integer of 5 to 7;
- A represents a C ⁇ -2-alkylene group, more particularly methylene;
- Ri and R 2 independently of one another a hydrogen or halogen atom or a cyano, hydroxy, C ⁇ - 4 -alkyl, C ⁇ - 4 -alkoxy, C ⁇ - 4 fluoroalkyl, C 1 - 4 - fluoroalkoxy; and or
- R 3 represents a group of general formula CHR 4 CONHR 5 in which R4 represents a hydrogen and R5 represents a hydrogen atom or a C ⁇ - 3 -alkyl group, more particularly methyl, ethyl, C 3 _ 5 -cycloalkyl, more particularly cyclopropyl, C3-7-cycloalkyle-C ⁇ _6- alkylene, more particularly cyclopropylmethyl.
- a subject of the invention is also, among the compounds of general formula (I), compounds corresponding to the general formula (I '):
- n represents an integer between 1 and 6;
- A is chosen from one or more groups X, Y and / or Z;
- X represents a C ⁇ - 2 -alkylene group optionally substituted by one or more C ⁇ - ⁇ 2 -alkyl, C 3 - 7 - cycloalkyl or C 3 _ 7 -cycloalkyl-C ⁇ - 6 -alkylene groups;
- Y represents a C 2 -alkenylene group optionally substituted by one or more C1-12 alkyl, C3-.7-cycloalkyl or C 3 --cycloalkyl-C ⁇ - 6 -alkylene groups;
- Z represents a C 3 _ 7 -cycloalkyl group, of formula:
- Ri represents a hydrogen or halogen atom or a hydroxy, cyano, nitro, C ⁇ - 3 -alkyle, C ⁇ - 3 -alkoxy, C1- 3 - thioalkyle, C ⁇ _ 3 -fluoroalkyle, C ⁇ _ 3 -fluoroalkoxy, C ⁇ - group 3 -fluorothioalkyl;
- R 2 represents a hydrogen, halogen atom or a cyano, nitro, hydroxy, C ⁇ - 3 -alkyl, C ⁇ - 3 -alkoxy group,
- C ⁇ - 3 -fluorothioalkyle or a group chosen from a phenyl, naphthalenyl, biphenyl, phenylethylenyl, naphthylethylenyl, pyridinyl, pyrimidinyl, pyrazinyl, pyridazinyl, triazinyl, indanyl, indenyl, quinolinyl, isoquinolinyl, quinazolinyl, quinoxalinyl, phthalazinyl, cinnolinyl, thienyl, furanyl, pyrrolyl, imidazolyl, pyrazolyl, oxazolyl, thiazolyl, isoxazolyl, isothiazolyl, thiadiazolyl, oxadiazolyl, triazolyl, benzothienyl, benzofuranyl, dibenzofuranyl, benzimidazoly
- R ⁇ and R 7 independently of one another represent a C ⁇ - 3 -alkyl group, a phenyl
- R 3 represents a group of general formula CHR 4 CONHR 5 in which R 4 represents a hydrogen atom or a C ⁇ - 3 -alkyl group and R5 represents a hydrogen atom or a C ⁇ - 3 - alkyl, C 3 - group 5 -cycloalkyle, C3 - cycloalkyle-C ⁇ _6-alkylene.
- the compounds of general formula (I) may contain one or more asymmetric carbons. They can exist in the form of enantiomers or diastereoisomers. These enantiomers and diastereoisomers, as well as their mixtures, including racemic mixtures, are part of the invention.
- the compounds of formula (I) may exist 'in the form of bases or of addition salts with acids. Such addition salts form part of the invention.
- salts are advantageously prepared with pharmaceutically acceptable acids, but the salts of other acids useful, for example, for the purification or isolation of the compounds of formula (I) also form part of the invention.
- the compounds of general formula (I) can be in the form of hydrates or solvates, namely in the form of associations or combinations with one or more molecules of water or with a solvent. Such hydrates and solvates are also part of the invention.
- a carbon chain can have from t to z carbon atoms, for example C ⁇ _ 3 a carbon chain which can have from 1 to 3 carbon atoms; alkyl, a saturated, linear or branched aliphatic group; for example a C ⁇ _ 3 -alkyle group represents a carbon chain of 1 to 3 carbon atoms, linear or branched, more particularly methyl, ethyl, propyl, 1-methylethyl; alkylene, a divalent saturated, linear or branched alkyl group, for example a C ⁇ - 3 -alkylene group represents a divalent carbon chain of 1 to 3 carbon atoms, linear or branched, more particularly methylene, ethylene, 1-methylethylene, propylene ; cycloalkyl, a cyclic alkyl group, for example a C 3 -5-cycloalkyl group represents a cyclic carbon group of 3 to 5 carbon atoms,
- the compounds of the invention can be prepared according to various methods, illustrated by the diagrams which follow.
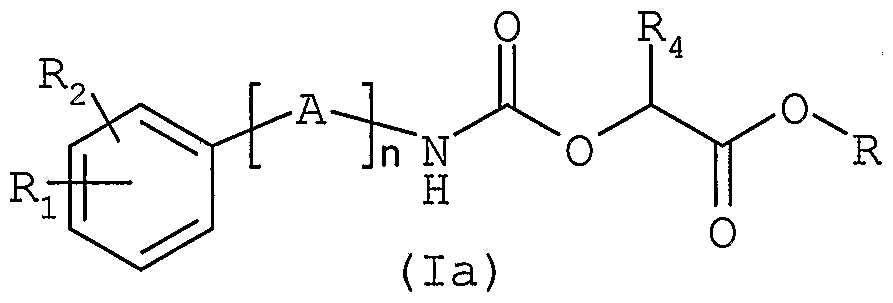
- a first method (scheme 1) consists in reacting an amine of general formula (II), in which Ri, R 2 , n and A are as defined above, with a carbonate of general formula (III), in which U represents a hydrogen atom or a nitro group and R 3 is as defined above, in a solvent such as toluene or dichloroethane, at a temperature between 0 and 80 ° C.
- the carbonates of general formula (III) can be prepared according to any method described in the literature, for example by reaction of an alcohol of general formula HO 3 with phenyl or 4-nitrophenyl chloroformate, in the presence of a base such than triethylamine or diisopropylethylamine.
- Another method for obtaining the compounds of general formula (I) consists in reacting an amine of general formula (II), as defined above, with a carbonate of general formula (Illa) in which V represents a hydrogen atom or a nitro group, R 4 is as defined above and R represents a methyl or ethyl group.
- the carbamate ester of general formula (la) thus obtained is then transformed into compound of general formula
- R5NH2 where R 5 is as defined above.
- the aminolysis reaction can be carried out in a solvent such as methanol or a mixture of solvents such as methanol and tetrahydrofuran.
- the carbonates of general formula (IIIa) can be prepared in a similar manner to the carbonates of formula (III).
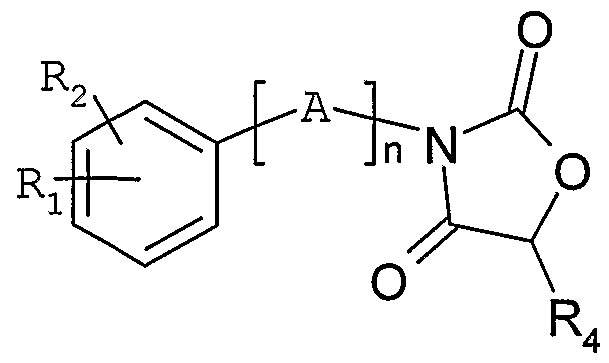
- a variant preparation (scheme 3) of the compounds of general formula (I) consists in reacting a derivative of general formula (Ha) in which Ri, R 2 , n and A are as defined above and W represents a hydroxy, mesylate, tosylate group, or a chlorine, bromine or iodine atom, with an oxazolidine-dione of general structure
- the reaction can be carried out according to the conditions of Mitsunobu (Synthesis 1981, 1-28), for example, by the action of the diethyl or diisopropyl azodicarboxylate in the presence of triphenylphosphine.
- the reaction can be carried out in the presence of a base such as 1, 1, 3, 3-tetramethylguanidine, sodium hydride or sodium tert-butoxide in a solvent such as tetrahydrofuran, acetonitrile or dimethylformamide at a temperature between 0 ° C and 80 ° C.
- a base such as 1, 1, 3, 3-tetramethylguanidine, sodium hydride or sodium tert-butoxide
- a solvent such as tetrahydrofuran, acetonitrile or dimethylformamide
- R 2 represents an aryl or heteroaryl type group in a compound of formula (I), (la), (II), (Ha) or (V)
- the introduction of R 2 onto the phenyl ring can be carried out by reaction of a derivative of a compound of general formula (I), (la), (II), (Ha) or (V), the phenyl ring of which carries a chlorine, bromine, iodine atom or a triflate group in the position where it is desired to introduce R 2 , with a boronic acid derivative of aryl or heteroaryl according to the reaction conditions of Suzuki (Chem. Rev. (1995), 95, 2457-2483) , or with a trialkylstannous derivative of aryl or heteroaryl according to the reaction conditions of Stille (Angew. Chem. (1986), 25, 508-524).
- R2 represents an aryloxy or imidazolyl, pyrrolopyridinyl or indolyl group in a compound of formula (I), (la), (II), (Ha) or (V)
- the introduction of R 2 on the phenyl ring can be carried out by an O-arylation or N-arylation reaction depending on the conditions Buchwald's reaction (Angew. Chem. (2003), 42, 5400-5449).
- n, A, Ri and R4 are as defined in general formula (I) and in which R 2 represents a hydrogen, bromine, iodine or fluorine atom, or cyano, nitro, hydroxy, C ⁇ - 4 -alkyl, C ⁇ - 4 alkoxy, C ⁇ -4-thioalkyl, C ⁇ - 4 fluoroalkyl, C ⁇ - 4 -fluoroalkoxy, C ⁇ - -fluorothioalkyle 4, or a group selected from phenyl, naphthalenyl, biphenyl, phenylethylenyl, naphthylethylenyl, pyridinyl, pyrimidinyl, pyrazinyl, pyridazinyl, triazinyl, indanyl, indenyl, quinolinyl, isoquinolinyl, quinazolinyl, quinoxalinyl, phthala
- NHCOR 6 COR6, O Re, SOXRç, -O- (C ⁇ - 3 -alkylene) -0-, 4-piperazinyl optionally substituted by C ⁇ - 3 -alkyl or by benzyl; and R ⁇ and R represent, independently of one another, a C ⁇ -3-alkyl group, a phenyl; are new and are also part of the invention. They are useful as synthesis intermediates for the preparation of the compounds of general formula (I).
- N-methyl-2-hydroxyacetamide To 0.1 g (0.97 mmol) of N-methyl-2-hydroxyacetamide is added dropwise and at room temperature a solution of 0.196 g (0.97 mmol) of 4-nitrophenyl chloroformate in 3 ml of methylene chloride and 0.166 ml (0.97 mmol) of W ⁇ N-diisopropylethylamine. The mixture is stirred at room temperature for 45 min, then a solution of 0.195 g (1.067 mmol) of 4-phenylbenzylamine in 3 ml of methylene chloride and 0.166 ml (0.97 mmol) is added dropwise and at room temperature of N, N-diisopropylethylamine.
- the mixture is stirred at room temperature for 1 h. Washing is carried out with a saturated aqueous solution of ammonium chloride, with a 10% aqueous solution of sodium carbonate and with a saturated aqueous solution of sodium chloride. The phases are separated and the organic phase is dried over sodium sulfate. Filtered, the filtrate is concentrated under reduced pressure and the residue is purified by chromatography on silica gel with ethyl acetate.
- the filtrate is concentrated under reduced pressure, the residue is taken up with dichloromethane and a 5% aqueous sodium hydroxide solution (10 ml).
- the aqueous phase is separated and then extracted 2 times with dichloromethane.
- the organic phases are combined and washed successively with an aqueous solution of hydrochloric acid (IN), then a saturated aqueous solution of sodium hydrogencarbonate and a saturated aqueous solution of sodium chloride.
- the organic phase is dried over sodium sulfate and the filtrate is concentrated under reduced pressure.
- the residue thus obtained is purified by chromatography on silica gel, eluting with a 20/80 mixture of ethyl acetate and cyclohexane.
- the salts are separated by filtration on celite, then the filtrate is concentrated under reduced pressure.
- the residue is taken up with ethyl acetate and water.
- the organic phase is separated and washed with a saturated aqueous solution of sodium chloride.
- the filtrate is concentrated under reduced pressure, and the residue is purified by chromatography on silica gel, eluting with dichloromethane.
- Example 4 (Compound No. 192) 2- (3 '-chloro-4' -fluoro-1, 2- (methylamino) -2-oxoethyl-ethylcarbamate
- step 2.2. The method described in Example 2 (step 2.2.) Is used. From 0.820 g (2.6 mmol) of 2- (4-bromophenyl) - 2- (methylamino) -2-oxoethyl ethylcarbamate obtained in step 4.1, of 0.4 g (2.86 mmol) of 3-chloro-4-fluorophenylboronic acid, 2.86 ml (5.72 mmol) of an aqueous solution of sodium carbonate (2 M), 3 ml of ethanol and 0.15 g (0 , 13 mmol) of pallet tetrakis (triphenylphosphine), 0.42 g of pure product is obtained in the form of a white solid, after chromatography on silica gel, eluting with a 95/5 mixture of dichloromethane and methanol, followed by recrystallization from ethyl acetate.
- LC-MS: M + H 365 PF (° C):
- the mixture is allowed to return to ambient temperature and the residue is taken up in dichloromethane and water.
- the aqueous phase is separated and extracted twice with dichloromethane, the combined organic phases are washed with a saturated aqueous solution of sodium chloride and dried over sodium sulfate. After evaporation of the solvent, the residue obtained is purified by chromatography on silica gel, eluting with a 10/90 mixture of ethyl acetate and cyclohexane.
- the mixture is left to return to ambient temperature, filtered on paper and then the filtrate is treated with 0.9 ml of water and 0.9 ml of a 15% aqueous sodium hydroxide solution and then 2.7 ml of water. .
- the mixture is left stirring at room temperature for 1 hour. It is taken up in ethyl acetate, the aqueous phase is separated and extracted three times. times with ethyl acetate, the combined organic phases are washed with a saturated aqueous sodium chloride solution, dried over sodium sulfate and the filtrate is concentrated under reduced pressure.
- the residue obtained is purified by chromatography on silica gel, eluting with a 97/3 / 0.3 mixture of dichloromethane, methanol and 28% ammonia.
- the salt formed is separated and the filtrate is concentrated under reduced pressure.
- Example 2 The procedure is as in Example 2 (step 2.2.). From 0.33 g (0.9 mmol) of (((2- (3, 4 '-difluoro-1, l--biphenyl-4-yl) ethyl) amino) carbonyl) ethyl oxyacetate, prepared in step 6.5., and 1.35 ml (2.7 mmol) of a solution of methylamine (2M) in tetrahydrofuran, 0.210 g of pure product is obtained in the form of a white solid, after recrystallization from ethyl acetate.
- 2M methylamine
- Example 7 (Compound No. 145) 1- (4 '-fluoro-1, l -biphenyl-4-yl) 2-amino-2-oxoethyl cyclopropylmethyl carbamate
- the aqueous phase is washed with 3 times 25 ml of ether.
- the aqueous phase is made alkaline with 10 ml of 36% aqueous sodium hydroxide and extracted with 3 times 50 ml of dichloromethane.
- the extracts are washed with a saturated aqueous sodium chloride solution, dried over sodium sulfate and the filtrate is concentrated under reduced pressure. 0.67 g of product is obtained in the form of an orange-brown oil used as it is in the following step.
- Example 11 (Compound No. 171) 2- (3 '-cyano-1, 2- (methylenino-4-yl) ethylcarbamate 2- (methylamino) -2-oxoethyl
- Example 13 (Compound No. 224) 2- [4-1J-pyrrolo [2, 3-b] pyridin-1-yl) phenyl] 2-amino-2-oxoethyl ethylcarbamate
- Table 1 illustrates the chemical structures and physical properties of some compounds according to the invention.
- Table 1 illustrates the chemical structures and physical properties of some compounds according to the invention. In this table :
- - i-propyl, n-butyl and t-butyl respectively represent isopropyl, linear butyl and tert-butyl groups.
- the compounds of the invention have been the subject of pharmacological tests making it possible to determine their inhibitory effect on the enzyme FAAH (Fatty Acid amido Hydrolase).
- the inhibitory activity was demonstrated in a radioenzy atic test based on the measurement of the hydrolysis product (ethanolamine [1- 3 H]) of the ananda ide [ethanolamine 1- 3 H] by FAAH (Life Sciences (1995), 56, 1999-2005 and Journal of Pharmacology and Experimental Therapeutics (1997), 283 r 729-734).
- mouse brains minus the cerebellum
- the membrane homogenates are prepared externally by homogenization of the tissues with Polytron in a 10 mM Tris-HC1 buffer (pH 8.0) containing 150 mM NaCl and 1 mM EDTA.
- the enzymatic reaction is then carried out in 70 ⁇ l of buffer containing bovine serum albumin without fatty acids (1 mg / ml).
- the compounds tested at different concentrations are successively added, anandamide [ethanolamine 1 - 3 H] (specific activity of 15-20 Ci / mmol) diluted to 10 ⁇ M with cold anandamide and the branch preparation (400 ⁇ g frozen tissue per test).
- the enzymatic reaction is stopped by adding 140 ⁇ L of chloroform / ethanol (2: 1). The mixture is stirred for 10 minutes and then centrifuged for 15 minutes at 3500 g. An aliquot (30 ⁇ L) of the aqueous phase containing ethanolamine [ 1–3 H] is counted by liquid scintillation.
- the most active compounds of the invention have IC 50 (concentration inhibiting by 50% the enzymatic activity controlling FAAH) of between 0.001 and 1 ⁇ M.
- Table 2 below presents the IC 50 values of some compounds according to the invention.
- the compounds according to the invention have an inhibitory activity on the FAAH enzyme.
- the in vivo activity of the compounds of the invention was evaluated in an analgesia test.
- PBQ phenylbenzoquinone, 2 mg / kg in a 0.9% sodium chloride solution containing 5% ethanol
- the test compounds are administered orally in suspension in 0.5% Tween 80, 60 minutes or 120 minutes before the administration of PBQ.
- Tween 80 60 minutes or 120 minutes before the administration of PBQ.
- the most powerful compounds of the invention reduce from 35 to 70% the number of stretches induced by PBQ, in a range of doses between 1 and 30 mg / kg.
- Table 3 presents the results of the analgesia test for a few compounds according to the invention.
- the enzyme FAAH [Chemistry and Physics of Lipids, (2000), 108, 107-121) catalyzes the hydrolysis of endogenous derivatives of amides and esters of different fatty acids such as N-arachidonoylethanolamine (anandamide), N-palmitoyl-ethanola ine, N-oleoylethanolamine, oleamide or 2-arachidonoylglycerol. These derivatives exercise different pharmacological activities by interacting, among others, with the cannabinoid and vanilloid receptors.
- the compounds of the invention block this degradation pathway and increase the tissue level of these compounds. endogenous substances. As such, they can be used in the prevention and treatment of pathologies in which endogenous cannabinoids and / or any other substrates metabolized by the FAAH enzyme are involved. Examples include the following diseases and conditions:
- the invention also relates to medicaments which comprise a compound of formula (I), or a salt, or alternatively a hydrate or a pharmaceutically acceptable solvate of the compound of formula (I). These drugs find their use in therapy, in particular in the treatment of the pathologies mentioned above.
- the present invention relates to pharmaceutical compositions containing, as active principle, at least one compound according to the invention.
- These pharmaceutical compositions contain an effective dose of a compound according to the invention, or a salt, or a hydrate, or a pharmaceutically acceptable solvate of said compound, and optionally one or more pharmaceutically acceptable excipients.
- Said excipients are chosen according to the pharmaceutical form and the desired mode of administration, from the usual excipients which are known to those skilled in the art.
- compositions of the present invention for oral, sublingual, subcutaneous, intramuscular, intravenous, topical, local, intrathecal, intranasal, transdermal, pulmonary, ocular or rectal administration the active principle of formula (I) above, or its salt, solvate or optional hydrate, can be administered in unit administration form, in admixture with conventional pharmaceutical excipients, to animals and humans for the prophylaxis or treatment of the above disorders or diseases above.
- Suitable unit administration forms include oral forms such as tablets, soft or hard capsules, powders, granules, chewing gum and oral solutions or suspensions, sublingual, buccal administration forms, intratracheal, intraocular, intranasal, inhalation, forms of subcutaneous, intramuscular or intravenous administration and forms of rectal or vaginal administration.
- oral forms such as tablets, soft or hard capsules, powders, granules, chewing gum and oral solutions or suspensions
- sublingual, buccal administration forms intratracheal, intraocular, intranasal, inhalation, forms of subcutaneous, intramuscular or intravenous administration and forms of rectal or vaginal administration.
- the compounds according to the invention can be used in creams, ointments or lotions.
- a unit form of administration of a compound according to the invention in tablet form can comprise the following components: Compound according to the invention 50.0 g Mannitol 223.75 mg
- Said unit forms are dosed to allow daily administration of 0.01 to 20 mg of active principle per kg of body weight, depending on the dosage form.
- the appropriate dosage for each patient is determined by the doctor according to the method of administration, the weight and the response of said patient.
- the invention according to another of its aspects, also relates to a method of treatment of the pathologies indicated above which comprises the administration of an effective dose of a compound according to the invention, of one of its pharmaceutically acceptable salts, a solvate or a hydrate of said compound.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Immunology (AREA)
- Rheumatology (AREA)
- Urology & Nephrology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Physical Education & Sports Medicine (AREA)
- Pain & Pain Management (AREA)
- Pulmonology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Otolaryngology (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Ophthalmology & Optometry (AREA)
- Diabetes (AREA)
- Virology (AREA)
- Anesthesiology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Nutrition Science (AREA)
Abstract
Description
Claims
Priority Applications (21)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AT04704251T ATE465990T1 (de) | 2003-01-23 | 2004-01-22 | Arylalkylcarbamatderivate, verfahren zur ihrer herstellung und deren therapeutischen anwendungen |
| SI200431464T SI1590321T1 (sl) | 2003-01-23 | 2004-01-22 | Arilalkilkarbamatni derivati, njihova priprava in njihova terapevtska uporaba |
| NZ541148A NZ541148A (en) | 2003-01-23 | 2004-01-22 | Aryl alkyl carbamate derivatives production and use thereof in therapy |
| CA002511941A CA2511941A1 (fr) | 2003-01-23 | 2004-01-22 | Derives d' arylalkylcarbamates, leur preparation et leur application en therapeutique |
| AU2004207657A AU2004207657B2 (en) | 2003-01-23 | 2004-01-22 | Aryl alkyl carbamate derivatives production and use thereof in therapy |
| YUP-2005/0562A RS20050562A (en) | 2003-01-23 | 2004-01-22 | Aryl alkyl carbamate derivatives production and use thereof in therapy |
| EA200500979A EA008801B1 (ru) | 2003-01-23 | 2004-01-22 | Получение арилалкилкарбаматных производных и их применение в терапии |
| BR0406901-3A BRPI0406901A (pt) | 2003-01-23 | 2004-01-22 | Derivados de arilalquilcarbamatos, a respectiva preparação e a respectiva aplicação em terapêutica |
| MXPA05007848A MXPA05007848A (es) | 2003-01-23 | 2004-01-22 | Derivados de arilalquilcarbamatos, su preparacion y su aplicacion en terapeutica. |
| DE602004026826T DE602004026826D1 (de) | 2003-01-23 | 2004-01-22 | Arylalkylcarbamatderivate, verfahren zur ihrer herstellung und deren therapeutischen anwendungen |
| MEP-213/08A MEP21308A (en) | 2003-01-23 | 2004-01-22 | Ryl alkyl carbamate derivatives production and use thereof in therapy |
| EP04704251A EP1590321B1 (fr) | 2003-01-23 | 2004-01-22 | Derives d' arylalkylcarbamates, leur preparation et leur application en therapeutique |
| JP2006502114A JP4617292B2 (ja) | 2003-01-23 | 2004-01-22 | アリールアルキルカルバメート誘導体の製造およびそれらの治療用途 |
| DK04704251.0T DK1590321T3 (da) | 2003-01-23 | 2004-01-22 | Arylalkylcarbamat-derivater, fremstilling og terapeutisk anvendelse deraf |
| IS7916A IS7916A (is) | 2003-01-23 | 2005-06-27 | Arýl alkýl karbamat afleiður framleiðslu og notkun þeirra í meðferð |
| IL169444A IL169444A (en) | 2003-01-23 | 2005-06-28 | Arylalkyl carbamate derivatives, process for preparing said derivatives, pharmaceutical compositions and use thereof |
| TNP2005000172A TNSN05172A1 (fr) | 2003-01-23 | 2005-06-30 | Derives d'arylalkylcarbamates, leur preparation et leur application en therapeutique |
| HR20050631A HRP20050631A2 (en) | 2003-01-23 | 2005-07-11 | Aryl alkyl carbamate derivatives production and use thereof in therapy |
| US11/186,242 US7632850B2 (en) | 2003-01-23 | 2005-07-21 | Arylalkylcarbamate derivatives and production thereof |
| NO20053593A NO20053593L (no) | 2003-01-23 | 2005-07-22 | Arylalkylkarbamat-derivater, fremgangsmate og anvendelse derav i terapi |
| HK06105197.4A HK1085193A1 (en) | 2003-01-23 | 2006-05-02 | Aryl alkyl carbamate derivatives production and use thereof in therapy |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR0300704A FR2850377B1 (fr) | 2003-01-23 | 2003-01-23 | Derives d'arylalkylcarbamates, leur preparation et leur application en therapeutique |
| FR03/00704 | 2003-01-23 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US11/186,242 Continuation US7632850B2 (en) | 2003-01-23 | 2005-07-21 | Arylalkylcarbamate derivatives and production thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| WO2004067498A2 true WO2004067498A2 (fr) | 2004-08-12 |
| WO2004067498A3 WO2004067498A3 (fr) | 2004-11-04 |
Family
ID=32669151
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/FR2004/000139 WO2004067498A2 (fr) | 2003-01-23 | 2004-01-22 | Derives d’ arylalkylcarbamates, leur preparation et leur application en therapeutique |
Country Status (34)
| Country | Link |
|---|---|
| US (1) | US7632850B2 (fr) |
| EP (1) | EP1590321B1 (fr) |
| JP (1) | JP4617292B2 (fr) |
| KR (1) | KR20050104352A (fr) |
| CN (2) | CN101058564B (fr) |
| AR (1) | AR042746A1 (fr) |
| AT (1) | ATE465990T1 (fr) |
| AU (1) | AU2004207657B2 (fr) |
| BR (1) | BRPI0406901A (fr) |
| CA (1) | CA2511941A1 (fr) |
| CY (1) | CY1110216T1 (fr) |
| DE (1) | DE602004026826D1 (fr) |
| DK (1) | DK1590321T3 (fr) |
| EA (1) | EA008801B1 (fr) |
| ES (1) | ES2344454T3 (fr) |
| FR (1) | FR2850377B1 (fr) |
| HK (1) | HK1085193A1 (fr) |
| HR (1) | HRP20050631A2 (fr) |
| IL (1) | IL169444A (fr) |
| IS (1) | IS7916A (fr) |
| MA (1) | MA27609A1 (fr) |
| ME (1) | MEP21308A (fr) |
| MX (1) | MXPA05007848A (fr) |
| NO (1) | NO20053593L (fr) |
| NZ (1) | NZ541148A (fr) |
| PL (1) | PL378022A1 (fr) |
| PT (1) | PT1590321E (fr) |
| RS (1) | RS20050562A (fr) |
| SI (1) | SI1590321T1 (fr) |
| TN (1) | TNSN05172A1 (fr) |
| TW (1) | TWI330628B (fr) |
| UA (1) | UA86013C2 (fr) |
| WO (1) | WO2004067498A2 (fr) |
| ZA (1) | ZA200505351B (fr) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005077898A1 (fr) * | 2004-01-16 | 2005-08-25 | Sanofi-Aventis | Derives de type aryloxyalkylcarbamates, leur preparation et leur application en therapeutique |
| FR2866885A1 (fr) * | 2004-02-26 | 2005-09-02 | Sanofi Synthelabo | Derives de piperidinylalkylcarbamates, leur prepation et leur application en therapeutique |
| WO2005090347A1 (fr) * | 2004-02-26 | 2005-09-29 | Sanofi-Aventis | Derives d’aryl- et d’heteroaryl-piperidinecarboxylates, leur preparation et leur application comme inhibiteurs de l'enzyme faah |
| WO2005090292A1 (fr) * | 2004-02-26 | 2005-09-29 | Sanofi-Aventis | Derives d’heteroaryl-alkylcarbamates, leur preparation et leur application comme inhibiteurs de l’enzyme faah |
| WO2006074025A1 (fr) * | 2004-12-30 | 2006-07-13 | Janssen Pharmaceutica N.V. | Urees piperazinyle et piperidinyle en tant que modulateurs de l’amide hydrolase d’acides gras |
| US8940745B2 (en) | 2010-05-03 | 2015-01-27 | Janssen Pharmaceutica Nv | Modulators of fatty acid amide hydrolase |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2864080B1 (fr) * | 2003-12-23 | 2006-02-03 | Sanofi Synthelabo | Derives de 1-piperazine-et-1-homopiperazine-carboxylates, leur preparation et leur application en therapeutique |
| DE102004039326A1 (de) * | 2004-08-12 | 2006-02-16 | Abbott Gmbh & Co. Kg | Neue medizinische Verwendungen und Verfahren |
| US20070155707A1 (en) * | 2005-12-29 | 2007-07-05 | Kadmus Pharmaceuticals, Inc. | Ionizable inhibitors of fatty acid amide hydrolase |
| WO2008030752A2 (fr) * | 2006-09-07 | 2008-03-13 | N.V. Organon | Procédés de détermination des doses efficaces des inhibiteurs de l'amide d'acide gras-hydrolase in vivo |
| WO2008042892A2 (fr) * | 2006-10-02 | 2008-04-10 | N.V. Organon | Procédé de traitement de troubles du métabolisme énergétique en empêchant l'activité d'un amide hydrolase d'acide gras |
| US20080119549A1 (en) * | 2006-11-20 | 2008-05-22 | N.V. Organon | Metabolically-stabilized inhibitors of fatty acid amide hydrolase |
| WO2009009041A2 (fr) * | 2007-07-06 | 2009-01-15 | Kinex Pharmaceuticals, Llc | Compositions et procédés permettant de moduler une cascade de kinases |
| TW200948805A (en) * | 2008-03-07 | 2009-12-01 | Sigma Tau Ind Farmaceuti | Enol carbamate derivatives as modulators of fatty acid amide hydrolase |
| CN101538245B (zh) * | 2008-03-18 | 2011-02-16 | 中国科学院上海药物研究所 | 一类哒嗪酮类化合物及其制备方法和制备药物的用途 |
| US9187413B2 (en) | 2010-07-28 | 2015-11-17 | The Regents Of The University Of California | Peripherally restricted FAAH inhibitors |
| JP6092870B2 (ja) | 2011-08-19 | 2017-03-08 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | メタ置換ビフェニル末梢に限局されたfaah阻害剤 |
| SI2890680T1 (en) | 2012-08-30 | 2018-08-31 | Athenex, Inc. Conventus Building | N- (3-FLUOROBENZYL) -2- (5- (4-MORFOLINOPHENYL) PIRIDIN-2-IL) ACETAMIDE AS PROTEIN TIROZINE KINASE PROTECTORS |
| ES2908240T3 (es) | 2014-04-07 | 2022-04-28 | Univ California | Inhibidores de la enzima amida hidrolasa de ácidos grasos (FAAH) con biodisponibilidad oral mejorada y su uso como medicamentos |
| CA3120152A1 (fr) * | 2018-11-20 | 2020-05-28 | Bayer Aktiengesellschaft | Antagonistes de recepteur alpha 2-adrenergiques de sous-type c (alpha-2c) pour le traitement de l'apnee du sommeil |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6462054B1 (en) * | 2000-03-27 | 2002-10-08 | The Scripps Research Institute | Inhibitors of fatty acid amide hydrolase |
| WO2002087569A1 (fr) * | 2001-04-27 | 2002-11-07 | Bristol-Myers Squibb Company | Le bisarylimidazolyle, inhibiteur de l'hydrolase des amides d'acides gras |
| WO2003065989A2 (fr) * | 2002-02-08 | 2003-08-14 | Bristol-Myers Squibb Company | (oxime)carbamoyl, inhibiteurs de l'hydrolase des amides d'acides gras |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2909467A (en) * | 1958-07-09 | 1959-10-20 | Us Vitamin Pharm Corp | 3-(d-alpha-methylphenethyl)-5-methyl-1, 3-oxazolidine-2, 4-dione |
| NL265085A (fr) * | 1960-05-24 | |||
| US3742022A (en) * | 1967-05-08 | 1973-06-26 | A Verbiscar | Carbamate esters of physiologically active ph enenthylamines |
| DE3003653A1 (de) * | 1980-02-01 | 1981-08-06 | Hoechst Ag, 6000 Frankfurt | Verfahren zur herstellung von n-substituierten oxazolindionen-(2,4) |
| JP2616989B2 (ja) * | 1989-04-03 | 1997-06-04 | 株式会社トクヤマ | 2,4―オキサゾリジンジオン化合物 |
| EP0545478A1 (fr) * | 1991-12-03 | 1993-06-09 | MERCK SHARP & DOHME LTD. | Composés hétérocycliques comme tachykinine antagonistes |
| GB9210744D0 (en) * | 1992-05-20 | 1992-07-08 | Pfizer Ltd | Antiviral peptides |
-
2003
- 2003-01-23 FR FR0300704A patent/FR2850377B1/fr not_active Expired - Fee Related
-
2004
- 2004-01-20 TW TW093101679A patent/TWI330628B/zh not_active IP Right Cessation
- 2004-01-22 ES ES04704251T patent/ES2344454T3/es not_active Expired - Lifetime
- 2004-01-22 EA EA200500979A patent/EA008801B1/ru not_active IP Right Cessation
- 2004-01-22 MX MXPA05007848A patent/MXPA05007848A/es active IP Right Grant
- 2004-01-22 AT AT04704251T patent/ATE465990T1/de active
- 2004-01-22 UA UAA200508210A patent/UA86013C2/ru unknown
- 2004-01-22 ZA ZA200505351A patent/ZA200505351B/en unknown
- 2004-01-22 BR BR0406901-3A patent/BRPI0406901A/pt not_active IP Right Cessation
- 2004-01-22 ME MEP-213/08A patent/MEP21308A/xx unknown
- 2004-01-22 AU AU2004207657A patent/AU2004207657B2/en not_active Ceased
- 2004-01-22 CA CA002511941A patent/CA2511941A1/fr not_active Abandoned
- 2004-01-22 DK DK04704251.0T patent/DK1590321T3/da active
- 2004-01-22 SI SI200431464T patent/SI1590321T1/sl unknown
- 2004-01-22 JP JP2006502114A patent/JP4617292B2/ja not_active Expired - Fee Related
- 2004-01-22 NZ NZ541148A patent/NZ541148A/en not_active IP Right Cessation
- 2004-01-22 AR ARP040100170A patent/AR042746A1/es unknown
- 2004-01-22 KR KR1020057013551A patent/KR20050104352A/ko active IP Right Grant
- 2004-01-22 PT PT04704251T patent/PT1590321E/pt unknown
- 2004-01-22 EP EP04704251A patent/EP1590321B1/fr not_active Expired - Lifetime
- 2004-01-22 WO PCT/FR2004/000139 patent/WO2004067498A2/fr active Application Filing
- 2004-01-22 PL PL378022A patent/PL378022A1/pl not_active Application Discontinuation
- 2004-01-22 DE DE602004026826T patent/DE602004026826D1/de not_active Expired - Lifetime
- 2004-01-22 CN CN2007100840856A patent/CN101058564B/zh not_active Expired - Fee Related
- 2004-01-22 RS YUP-2005/0562A patent/RS20050562A/sr unknown
- 2004-01-22 CN CNB2004800027704A patent/CN100506788C/zh not_active Expired - Fee Related
-
2005
- 2005-06-27 IS IS7916A patent/IS7916A/is unknown
- 2005-06-28 IL IL169444A patent/IL169444A/en not_active IP Right Cessation
- 2005-06-30 TN TNP2005000172A patent/TNSN05172A1/fr unknown
- 2005-07-11 HR HR20050631A patent/HRP20050631A2/xx not_active Application Discontinuation
- 2005-07-12 MA MA28384A patent/MA27609A1/fr unknown
- 2005-07-21 US US11/186,242 patent/US7632850B2/en not_active Expired - Fee Related
- 2005-07-22 NO NO20053593A patent/NO20053593L/no not_active Application Discontinuation
-
2006
- 2006-05-02 HK HK06105197.4A patent/HK1085193A1/xx not_active IP Right Cessation
-
2010
- 2010-07-20 CY CY20101100676T patent/CY1110216T1/el unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6462054B1 (en) * | 2000-03-27 | 2002-10-08 | The Scripps Research Institute | Inhibitors of fatty acid amide hydrolase |
| WO2002087569A1 (fr) * | 2001-04-27 | 2002-11-07 | Bristol-Myers Squibb Company | Le bisarylimidazolyle, inhibiteur de l'hydrolase des amides d'acides gras |
| WO2003065989A2 (fr) * | 2002-02-08 | 2003-08-14 | Bristol-Myers Squibb Company | (oxime)carbamoyl, inhibiteurs de l'hydrolase des amides d'acides gras |
Non-Patent Citations (3)
| Title |
|---|
| CHEMICAL ABSTRACTS, vol. 73, no. 3, 20 juillet 1970 (1970-07-20), Columbus, Ohio, US; abstract no.: 14748u, DOVLATYAN, V. V. ET AL.: "Synthesis of pesticides." page 358 colonne 1 XP002257138 & ARM. KHIM. ZH., vol. 23, no. 2, 1970, pages 173-179, * |
| GIORGIO TARZIA ET AL.: "Design, synthesis, and structure-activity relationships of alkylcarbamic acid aryl esters, a new class of Fatty Acid Amide Hydrolase inhibitors" JOURNAL OF MEDICINAL CHEMISTRY., vol. 46, no. 12, 2003, pages 2352-2360, XP002257137 AMERICAN CHEMICAL SOCIETY. WASHINGTON., US ISSN: 0022-2623 * |
| See also references of EP1590321A2 * |
Cited By (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7439257B2 (en) | 2004-01-16 | 2008-10-21 | Sanofi-Aventis | Aryloxyalkylcarbamate-type derivatives, preparation method thereof and use of same in therapeutics |
| US8026258B2 (en) | 2004-01-16 | 2011-09-27 | Sanofi-Aventis | Aryloxyalkylcarbamate-type derivatives, preparation method thereof and use of same in therapeutics |
| WO2005077898A1 (fr) * | 2004-01-16 | 2005-08-25 | Sanofi-Aventis | Derives de type aryloxyalkylcarbamates, leur preparation et leur application en therapeutique |
| US7674805B2 (en) | 2004-01-16 | 2010-03-09 | Sanofi-Aventis | Aryloxyalkylcarbamate-type derivatives, preparation method thereof and use of same in therapeutics |
| EP2251324A1 (fr) * | 2004-02-26 | 2010-11-17 | Sanofi-Aventis | Dérivés d'heteroaryl-alkylcarbamates, leur preparation et leur application comme inhibiteurs de l'enzyme faah |
| US7781590B2 (en) | 2004-02-26 | 2010-08-24 | Sanofi-Aventis | Piperidinylalkylcarbamate derivatives, methods for their preparation and the therapeutic use thereof as fatty acid amido hydrolase enzyme inhibitors |
| WO2005089759A1 (fr) * | 2004-02-26 | 2005-09-29 | Sanofi-Aventis | Derives de piperidinylalkylcarbamates, leur preparation et leur application comme inhibiteurs de l’enzyme faah |
| FR2866885A1 (fr) * | 2004-02-26 | 2005-09-02 | Sanofi Synthelabo | Derives de piperidinylalkylcarbamates, leur prepation et leur application en therapeutique |
| WO2005090347A1 (fr) * | 2004-02-26 | 2005-09-29 | Sanofi-Aventis | Derives d’aryl- et d’heteroaryl-piperidinecarboxylates, leur preparation et leur application comme inhibiteurs de l'enzyme faah |
| US7645757B2 (en) | 2004-02-26 | 2010-01-12 | Sanofi-Aventis | Derivatives of heteroaryl-alkylcarbamates, methods for their preparation and use thereof as fatty acid amido hydrolase enzyme inhibitors |
| WO2005090292A1 (fr) * | 2004-02-26 | 2005-09-29 | Sanofi-Aventis | Derives d’heteroaryl-alkylcarbamates, leur preparation et leur application comme inhibiteurs de l’enzyme faah |
| EA012589B1 (ru) * | 2004-12-30 | 2009-10-30 | Янссен Фармацевтика Н.В. | Производные фениламида 4-(бензил)пиперазин-1-карбоновой кислоты и родственные соединения в качестве модуляторов амида жирной кислоты гидролазы для лечения страхов, боли и других состояний |
| WO2006074025A1 (fr) * | 2004-12-30 | 2006-07-13 | Janssen Pharmaceutica N.V. | Urees piperazinyle et piperidinyle en tant que modulateurs de l’amide hydrolase d’acides gras |
| US7598249B2 (en) | 2004-12-30 | 2009-10-06 | Janssen Pharmaceutica N.V. | Piperazinyl and piperidinyl ureas as modulators of fatty acid amide hydrolase |
| US8530476B2 (en) | 2004-12-30 | 2013-09-10 | Janssen Pharmaceutica Nv | Piperazinyl and piperidinyl ureas as modulators of fatty acid amide hydrolase |
| US9169224B2 (en) | 2004-12-30 | 2015-10-27 | Janssen Pharmaceutica Nv | Piperazinyl and piperidinyl ureas as modulators of fatty acid amide hydrolase |
| US8940745B2 (en) | 2010-05-03 | 2015-01-27 | Janssen Pharmaceutica Nv | Modulators of fatty acid amide hydrolase |
| US9688664B2 (en) | 2010-05-03 | 2017-06-27 | Janssen Pharmaceutica Nv | Modulators of fatty acid amide hydrolase |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1720848B1 (fr) | Derives de alkylpiperazine- et alkylhomopiperazine- carboxylates, leur preparation et leur application en tant qu'inhibiteurs de l'enzyme faah | |
| EP1720872B1 (fr) | Derives d'aryl- et d'heteroaryl-piperidinecarboxylates, leur preparation et leur application comme inhibiteurs de l'enzyme faah | |
| EP1708994B1 (fr) | Derives de type aryloxyalkylcarbamates, leur preparation et leur application en therapeutique | |
| EP1537096B1 (fr) | Derives de dioxane-2-alkylcarbamates, leur preparation et leur application en therapeutique | |
| EP1590321A2 (fr) | DERIVES D’ ARYLALKYLCARBAMATES, LEUR PREPARATION ET LEUR APPLICATION EN THERAPEUTIQUE | |
| EP1633735A1 (fr) | Derives de piperidinyl- et piperazinyl-alkylcarbamates, leurs procedes de preparation et leur application en therapeutique | |
| WO2005089759A1 (fr) | Derives de piperidinylalkylcarbamates, leur preparation et leur application comme inhibiteurs de l’enzyme faah | |
| WO2005070910A2 (fr) | Derives de 1 -piperazine- et 1-homopiperazine-carboxylates, leur preparation et leur application en tant qu’ inhibiteurs de l’enzyme faah | |
| FR2945531A1 (fr) | Derives de 7-aza-spiro°3,5!nonane-7-carboxylates, leur preparation et leur application en therapeutique | |
| FR2885364A1 (fr) | Derives d'alkyl-, alkenyl-et alkynylcarbamates, leur preparation et leur application en therapeutique | |
| EP1673337B1 (fr) | Dérivés d'arylalkylcarbamates, leur préparation et leur application en thérapeutique | |
| EP1720829B1 (fr) | Derives d' heteroaryl-alkylcarbamates, leur preparation et leur application comme inhibiteurs de l'enzyme faah |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: P-2005/0562 Country of ref document: YU |
|
| AK | Designated states |
Kind code of ref document: A2 Designated state(s): AE AG AL AM AT AU AZ BA BB BG BR BW BY BZ CA CH CN CO CR CU CZ DE DK DM DZ EC EE EG ES FI GB GD GE GH GM HR HU ID IL IN IS JP KE KG KP KR KZ LC LK LR LS LT LU LV MA MD MG MK MN MW MX MZ NA NI NO NZ OM PG PH PL PT RO RU SC SD SE SG SK SL SY TJ TM TN TR TT TZ UA UG US UZ VC VN YU ZA ZM ZW |
|
| AL | Designated countries for regional patents |
Kind code of ref document: A2 Designated state(s): BW GH GM KE LS MW MZ SD SL SZ TZ UG ZM ZW AM AZ BY KG KZ MD RU TJ TM AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HU IE IT LU MC NL PT RO SE SI SK TR BF BJ CF CG CI CM GA GN GQ GW ML MR NE SN TD TG |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application | ||
| WWE | Wipo information: entry into national phase |
Ref document number: 2004704251 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: DZP2005000229 Country of ref document: DZ |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2511941 Country of ref document: CA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 169444 Country of ref document: IL Ref document number: 1257/KOLNP/2005 Country of ref document: IN |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2005/05351 Country of ref document: ZA Ref document number: 200505351 Country of ref document: ZA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 541148 Country of ref document: NZ |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2004207657 Country of ref document: AU Ref document number: P20050631A Country of ref document: HR |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 200500979 Country of ref document: EA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 05071362 Country of ref document: CO |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 11186242 Country of ref document: US Ref document number: 1200501039 Country of ref document: VN |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2006502114 Country of ref document: JP Ref document number: 1020057013551 Country of ref document: KR Ref document number: PA/a/2005/007848 Country of ref document: MX Ref document number: 378022 Country of ref document: PL |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 20048027704 Country of ref document: CN |
|
| ENP | Entry into the national phase |
Ref document number: 2004207657 Country of ref document: AU Date of ref document: 20040122 Kind code of ref document: A |
|
| WWP | Wipo information: published in national office |
Ref document number: 2004207657 Country of ref document: AU |
|
| WWP | Wipo information: published in national office |
Ref document number: 1020057013551 Country of ref document: KR Ref document number: 2004704251 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 1-2005-501297 Country of ref document: PH |
|
| ENP | Entry into the national phase |
Ref document number: PI0406901 Country of ref document: BR |
|
| WWP | Wipo information: published in national office |
Ref document number: 11186242 Country of ref document: US |