WO2003004465A2 - Fungizide triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel - Google Patents
Fungizide triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel Download PDFInfo
- Publication number
- WO2003004465A2 WO2003004465A2 PCT/EP2002/007340 EP0207340W WO03004465A2 WO 2003004465 A2 WO2003004465 A2 WO 2003004465A2 EP 0207340 W EP0207340 W EP 0207340W WO 03004465 A2 WO03004465 A2 WO 03004465A2
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- alkyl
- formula
- compounds
- alkenyl
- halogen
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/90—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having two or more relevant hetero rings, condensed among themselves or with a common carbocyclic ring system
Definitions
- Fungicidal triazolopyrimidines processes for their preparation and their use in combating harmful fungi and compositions containing them
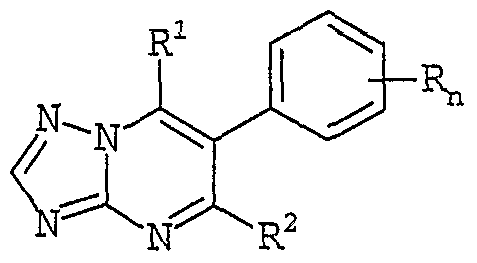
- the present invention relates to triazolopyrimidines of the formula I,
- n is 0 or an integer from 1 to 5;
- R halogen, cyano, hydroxy, cyanato (OCN), Ci-Ca-alkyl, C 2 -C 10 alkenyl, C -C 10 alkynyl, -C-C 6 haloalkyl, C 2 -C 10 haloalkenyl, Ci-C ⁇ alkoxy, C 2 ⁇ -C ⁇ o A lkenyloxy, C 2 ⁇ C ⁇ o ⁇ alkynyl - oxy, Ci-Cg haloalkoxy, C 3 -C 6 cycloalkyl, C 3 -CG-cycloalkanes -alkenyl, C 3 - Cg-cycloalkoxy, Ci-C 8 alkoxycarbonyl, C 2 -Cj .
- R 1 Cx-C o-alkyl, C 2 -C ⁇ 0 alkenyl, C 2 -C ⁇ 0 alkynyl, C 3 -C ⁇ 2 cycloalkyl, C 3 -C ⁇ o cycloalkenyl, phenyl, naphthyl, or a five- to ten-membered saturated, partially unsaturated or aromatic heterocycle which contains one to four hetero atoms selected from the group ⁇ 0, N or S,
- R and / or Rl can be partially or completely halogenated or substituted by one to four identical or different groups R a :
- R a halogen, cyano, nitro, hydroxy, -C ⁇ Cg-alkyl, Ci-Cg-halogenoalkyl, Ci-C ß -alkylcarbonyl, C 3 -C 6 cycloalkyl, C ⁇ ⁇ Cg-alkoxy, Ci-Cg -Haloalkoxy, Ci-Cg-alkoxycarbonyl, Ci-Cg-alkylthio, Ci-Cg-alkylamino, di-Ci-Cg-alkylamino, C 2 ⁇ Cg-alkenyl, C 2 -C 6 -alkenyloxy, C 3 -C 6 -alkynyloxy, C 3 ⁇ Cg-cycloal- kyl, Ci-Cs-alkoximino, C 2 -C 0 alkenyloximino, C2 ⁇ C ⁇ o-alkynyloximino, aryl-Ci-Cs-alkyloximin
- these aliphatic, alicyclic or aromatic groups in turn can be partially or completely halogenated or can carry one to three groups R b :
- R b halogen, cyano, nitro, hydroxy, mercapto, amino, carboxyl, aminocarbonyl, aminothiocarbonyl, alkyl, haloalkyl, alkenyl, alkenyloxy, alkynyloxy, alkoxy,
- R 2 C ⁇ -C 4 alkyl, C -C 4 alkenyl or C 2 -C 4 -alkynyl, the 4 -alkoxycarbonyl can be stituiert sub- by halogen, cyano, nitro, C ⁇ -C 2 alkoxy or C ⁇ -C ,
- the invention also relates to processes for the preparation of these compounds, compositions containing them and their use in combating harmful fungi.
- EP-A 71 792, EP-A 550 113 WO-A 94/20501, EP-A 834 513, WO-A 98/46608 and WO-A 99/41255 are 5-Chlortriazolopyrimidine known for controlling harmful fungi.
- the compounds of the formula I differ from those from the abovementioned publications in the combination of the 5-alkyl radical with groups bonded via carbon in the 7-position.
- the compounds of the formula I have an increased activity against harmful fungi compared to the known compounds.
- the compounds I can be obtained in various ways; it is advantageous to start from 5-aminotriazole of the formula II, which is condensed with dicarbonyl compounds of the formula III.
- This reaction usually takes place at temperatures from 80 ° C. to 250 ° C., preferably 120 ° C. to 180 ° C., without solvent or in an inert organic solvent in the presence of a base [cf. EP-A 770 615] or in the presence of acetic acid among those from Adv. Het. Chem. Vol. 57, pp. 81ff. (1993) known conditions.
- Suitable solvents are aliphatic hydrocarbons, aromatic hydrocarbons such as toluene, o-, m- and p-xylene, halogenated hydrocarbons, ethers, nitriles, ketones, alcohols, and also N-methylpyrrolidone, dimethyl sulfoxide, dirnethyl formamide and dimethylacetamide.
- the reaction is particularly preferably carried out without solvent or in chlorobenzene, xylene, dimethyl sulfoxide, N-methylpyrrolidone. Mixtures of the solvents mentioned can also be used.
- Bases generally include inorganic compounds such as alkali metal and alkaline earth metal hydroxides, alkali metal and alkaline earth metal oxides, alkali metal and alkaline earth metal hydrides, alkali metal metal amides, alkali metal and alkaline earth metal carbonates and alkali metal bicarbonates, organometallic compounds, in particular alkali metal alkyls, alkyl magnesium halides and alkali metal and alkaline earth metal alcoholates and dimethoxymagnesium, and also organic bases, for example tertiary amines such as trimethylamine, tri-methylamine, triethylamine, triethylamine, triethylamine , N-methylmorpholine, pyridine, substituted pyridines such as collidine, lutidine and 4-dimethylaminopyridine and bicyclic amines. Tertiary amines such as tri-isopropylethylamine, tributylamine, N-methylmorpholine or
- the bases are generally used in catalytic amounts, but they can also be used in equimolar amounts, in excess or, if appropriate, as a solvent.
- the starting materials are generally reacted with one another in equimolar amounts. It may be advantageous for the yield to use the base and the diketone III in an excess based on II.
- X represents halogen, in particular chlorine or
- R and R 1 have the meaning defined for formula I and R A represents hydrogen or -CC 3 alkyl, which may be substituted by halogen, cyano, nitro or -C 2 -alko y.
- R A is hydrogen or methyl, in particular hydrogen.
- the starting materials V are known in the literature [J. At the. Chem. Soc, Vol. 64, 2714 (1942); J. Org. Chem., Vol. 39, 2172 (1974); Helv. Chi. Acta, Vol. 61, 1565 (1978)] or can be prepared according to the literature cited.
- the decarboxylation is usually carried out at from 20 ° C. to 180 ° C., preferably from 50 ° C. to 120 ° C., in an inert solvent, optionally in the presence of an acid.
- Suitable acids are hydrochloric acid, sulfuric acid, phosphoric acid, formic acid, acetic acid, p-toluenesulfonic acid.
- Suitable solvents are water, aliphatic hydrocarbons such as pentane, hexane, cyclohexane and petroleum ether, aromatic hydrocarbons such as toluene, o-, m- and p-xylene, halogenated hydrocarbons such as methylene chloride, chloroform and chlorobenzene, ethers such as diethyl ether, diisopropyl ether, tert.
- Compounds of the formula I can also be obtained by coupling 5-halotriazolopyrimidines of the formula IV with organometallic reagents of the formula VII.
- the reaction takes place using transition metal catalysis, such as Ni or Pd catalysis.
- M stands for a metal ion of valence Y, such as B, Zn or Sn.
- This reaction can be carried out, for example, analogously to the following methods: J. Chem. Soc. Perkin Trans. 1, 1187 (1994), ibid. 1, 2345 (1996); WO-A 99/41255; Aust. J. Chem., Vol. 43, 733 (1990); J. Org. Chem., Vol. 43, 358 (1978); J. Chem. Soc. Chem. Commun. 866 (1979); Tetrahedron Lett., Vol. 34, 8267 (1993); ibid., vol. 33, 413 (1992).
- reaction mixtures are worked up in a conventional manner, e.g. by mixing with water, separation of the phases and, if necessary, chromatographic purification of the crude products.
- the intermediate and end products fall partly in the form of colorless or slightly brownish, viscous oils, which are freed from volatile components or purified under reduced pressure and at a moderately elevated temperature. If the intermediate and end products are obtained as solids, they can also be purified by recrystallization or digesting.
- isomer mixtures are obtained during the synthesis, however, a separation is generally not absolutely necessary, since the individual isomers can partially convert into one another during preparation for use or during use (e.g. under the action of light, acid or base). Corresponding conversions can also take place after use, for example in the treatment of plants in the treated plant or in the harmful fungus or animal pest to be controlled.
- Halogen fluorine, chlorine, bromine and iodine
- Alkyl saturated, straight-chain or branched hydrocarbon radicals with 1 to 4, 6, 8 or 10 carbon atoms, for example Ci-Cg-alkyl such as methyl, ethyl, propyl, 1-methylethyl, butyl, 1-methyl-propyl, 2 -Methylpropyl, 1, 1-dirnethylethyl, pentyl, 1-methylbutyl, 2-methylbutyl, 3-methylbutyl, 2, 2-dimethylpropyl, 1-ethylpropyl, hexyl, 1, 1-dimethylpropyl, 1, 2-dimethylpropyl, 1-methylpentyl, 2-methylpentyl, 3-methylpentyl, 4-methylpentyl, 1, 1-dimethylbutyl, 1, 2-dimethylbutyl, 1, 3- Dimethylbutyl, 2,2-dimethylbutyl, 2, 3-dimethylbutyl, 3, 3-dimethylbutyl, 1-ethylbutyl, 2-ethyl
- Haloalkyl straight-chain or branched alkyl groups with 1 to 10 carbon atoms (as mentioned above), in which case the hydrogen atoms in these groups can be partially or completely replaced by halogen atoms as mentioned above, for example C -C 2 -haloalkyl such as chloromethyl, bromomethyl, dichloromethyl, trichloromethyl , Fluoromethyl, difluoromethyl, trifluoromethyl, chlorofluoromethyl, dichlorofluoromethyl, chlorodifluoromethyl, l7chloroethyl, 1-bromoethyl, 1-fluoroethyl, 2-fluoroethyl, 2,2-di-fluoroethyl, 2, 2, 2-trifluoroethyl, 2-chloro-2-fluoroethyl , 2-chloro-2,2-difluoroethyl, 2, 2-dichloro-2-fluoroethyl, 2, 2, 2-trichlor
- Alkenyl unsaturated, straight-chain or branched hydrocarbon radicals with 2 to 4, 6, 8 or 10 carbon atoms and a double bond in any position, for example C 2 ⁇ Cg-alkenyl such as ethenyl, 1-propenyl, 2-propenyl, 1-methylethenyl, 1-butenyl, 2-butenyl, 3-butenyl, 1-methyl-1-propenyl, 2-methyl-1-propenyl, 1-methyl-2-propenyl, 2-methyl-2-propenyl, 1-pentenyl, 2- Pentenyl, 3-pentenyl, 4-pentenyl, 1-methyl-1-butenyl, 2-methyl-1-butenyl, 3-methyl-1-butenyl, 1-methyl-2-butenyl, 2-methyl-2-butenyl, 3-methyl-2-butenyl, l-methyl-3-butenyl, 2-methyl-3-butenyl, 3-methyl-3-butenyl, 1, l-dimethyl-2-propen
- Alkynyl straight-chain or branched hydrocarbon groups with 2 to 4, 6, 8 or 10 carbon atoms and a triple bond in any position, for example C 2 -C 6 -alkynyl such as
- Ethynyl 1-propynyl, 2-propynyl, 1-butynyl, 2-butynyl, 3-butynyl, 1-methyl-2-propynyl, 1-pentynyl, 2-pentynyl, 3-pentynyl, 4-pentynyl, l-methyl- 2-butynyl, l-methyl-3-butynyl, 2-methyl-3-butynyl, 3-methyl-l-butynyl, 1, l-dimethyl-2-propynyl, l-ethyl-2-propynyl, 1-hexynyl, 2-hexynyl, 3-hexynyl, 4-hexynyl, 5-hexynyl, l-methyl-2-pentynyl, l-methyl-3-pentynyl, l-methyl-4-pentynyl, 2-methyl-3-pentynyl, 2- Methyl-4
- Cycloalkyl mono- or bicyclic, saturated hydrocarbon groups with 3 to 6, 8, 10 or 12 carbon ring members, for example C_ 3 -C 8 cycloalkyl such as cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cycloheptyl and cyclooctyl, or C 7 - C 2 bicycloalkyl;
- Aryl a mono- to trinuclear aromatic ring system containing 6 to 14 carbon ring members, e.g. Phenyl, naphthyl and A thracenyl;
- Nitrogen atoms and / or an oxygen or sulfur atom or one or two oxygen and / or sulfur atoms for example 2-tetrahydrofuranyl, 3-tetrahydrofuranyl, 2-tetrahydrothienyl, 3-tetrahydrothienyl, 2-pyrrolidinyl, 3-pyrrolidinyl, 3-isoxazo - Lidinyl, 4-isoxazolidinyl, 5-isoxazolidinyl, 3-isothiazolidinyl, 4-isothiazolidinyl, 5-isothiazolidinyl, 3-pyrazolidinyl, 4-pyrazolidinyl, 5-pyrazolidinyl, 2-0xazolidinyl, 4-0xazolidinyl, 5-oxazolidinyl , 2-thiazolidinyl, 4-thiazolidinyl, 5-thiazolidinyl, 2-imidazolidinyl, 4-imidazolidinyl, 1, 2, 4-oxadiazolidin-3
- 5-membered heteroaryl containing one to four nitrogen atoms or one to three nitrogen atoms and one sulfur or oxygen atom
- 5-ring heteroaryl groups which, in addition to carbon atoms, contain one to four nitrogen atoms or one to three nitrogen atoms and one sulfur or oxygen atom as ring members may contain, e.g.
- 5-ring heteroaryl groups which, in addition to carbon atoms, contain one to four nitrogen atoms or one to three nitrogen atoms and one sulfur or oxygen atom can contain as ring members, and in which two neighboring Carbon ring members or a nitrogen and an adjacent carbon ring member can be bridged by a buta-1, 3-diene-1, 4-diyl group;
- - 6-membered heteroaryl containing one to three or one to four nitrogen atoms 6-ring heteroaryl groups which, in addition to carbon atoms, can contain one to three or one to four nitrogen atoms as ring members, for example 2-pyridinyl, 3-py ridinyl, 4-pyridinyl, 3-pyridazinyl, 4-pyridazinyl, 2-pyrimidinyl, 4-pyrimidinyl, 5-pyrimidinyl, 2-pyrazinyl
- Alkylene divalent unbranched chains from 3 to 5 CH 2 groups, for example CH 2 , CH 2 CH 2 , CH 2 CH 2 CH 2 , CH 2 CH 2 CH 2 CH and CH 2 CH 2 CHCH 2 CH 2 ;
- Oxyalkylene divalent unbranched chains of 2 to 4 CH 2 groups, one valence being attached to the skeleton via an oxygen atom, for example OCH 2 CH 2 , OCH 2 CH 2 CH 2 and OCH2CH 2 CH2CH 2 ;
- Oxyalkyleneoxy divalent unbranched chains of 1 to 3 CH 2 groups, where both valences are bound to the skeleton via an oxygen atom, for example OCH 2 0, OCH 2 CH 2 0 and OCH 2 CH 2 CH 2 0.
- the scope of the present invention includes the (R) and (S) isomers and the racemates of compounds of the formula I which have chiral centers.
- R 1 is C 3 -Cs-alkyl, C 3 -Cs-alkenyl, C 3 -C 8 -alkynyl, C 3 -Cg-cycloalkyl or C 5 -Cg-cycloalkenyl.
- R 1 is Ci-Cg-alkyl or Ci-Cg-haloalkyl.
- R 1 is C 2 -C 0 -alkenyl or C 2 -C 0 -alkynyl.
- R 1 represents a 5- or 6-membered saturated or aromatic heterocycle.
- R 1 is C 3 -C 6 cycloalkyl, which can be substituted by C -C 4 alkyl.
- R is halogen, cyano, Ci-Cg-alkyl, C 2 -Cg-alkenyl, C 2 -Cg-alkynyl, Ci-Cg-alkoxy, Ci-Cg-alkoxycarbonyl, Ci Cg alkoximino, C 2 -C 6 alkenyloximino or C 2 -Cg alkynyloximno.
- R b is halogen, cyano, Ci-Cg-alkyl, C 2 -Cg-alkenyl, C 2 -Cg-alkynyl or -C ⁇ Cg-alkoxy.
- compounds I are also preferred in which a substituent R is in the 2 position and n is an integer from 1 to 4, in particular 1 to 3.
- n is 2 or 3 and a substituent R is in the 2-position.
- R is fluorine, chlorine, bromine, cyano, Ci-Cg-alkyl, C-Cg-alkoxy, Ci-Cg-alkoxycarbonyl, Ci-Cg-alkylcarbonyl, C ⁇ -Cg-alkoximino -C-Cg-alkyl, Ci-Cg-alkenyloximino-Ci-Cg-alkyl or C ⁇ -Cg-alkynyloximino-C ⁇ -Cg-alkyl is.
- R n is 2-chloro, 2-fluorine, 2,6-difluoro, 2-methoxy, 2-trifluoromethyl, 2-trifluoromethyl, 6-chloro, 2-chloro, 6-fluorine, 2, 4, 6-trifluoro, 2, 6-difluoro, 4-methoxy or pentafluoro.
- R n is 2-chloro, 6-fluorine, 2, 6-difluoro, 4-methoxy or 2, 6-trifluoro.
- compounds IA are particularly preferred in which n, R and R 1 have the meanings as in formula I:
- the compounds I are suitable as fungicides. They are characterized by excellent activity against a broad spectrum of phytopathogenic fungi, in particular from the class of the Ascomycetes, Deuteromyceben, Phycomycetes and Basidiomycetes. Some of them are systemically effective and can be used in plant protection as leaf and soil fungicides.
- Botryfcis cinerea (gray mold) on strawberries, vegetables, ornamental plants and vines, • Cercospora arachidicola on peanuts,
- Erysiphe graminis (powdery mildew) on cereals, Fusarium and Verfcicillium species on various plants, • Helminthosporium species on cereals,
- the compounds I are also suitable for combating harmful fungi such as Paecilomyces variotii in the protection of materials (e.g. wood, paper, dispersions for painting, fibers or fabrics) and in the protection of stored products.
- harmful fungi such as Paecilomyces variotii in the protection of materials (e.g. wood, paper, dispersions for painting, fibers or fabrics) and in the protection of stored products.
- the compounds I are used by treating the fungi or the plants, seeds, materials or the soil to be protected against fungal attack with a fungicidally active amount of the active compound. Fabrics treated. The application can take place both before and after the infection of the materials, plants or seeds by the fungi.
- the fungicidal compositions generally contain between 0.1 and 95, preferably between 0.5 and 90% by weight of active ingredient.
- the application rates in crop protection are between 0.01 and 2.0 kg of active ingredient per hectare.
- active ingredient 0.001 to 0.1 g, preferably 0.01 to 0.05 g, per kg of seed are generally required.
- the amount of active ingredient applied depends on the type of application and the desired effect. Usual application rates in material protection are, for example, 0.001 g to 2 kg, preferably 0.005 g to 1 kg of active ingredient per cubic meter of treated material.
- the compounds I can be converted into the usual formulations, e.g. Solutions, emulsions, suspensions, dusts, powders, pastes and granules.
- the form of application depends on the respective purpose; in any case, it should ensure a fine and uniform distribution of the compound according to the invention.
- the formulations are prepared in known manner, eg forward by extending the active compound with solvents and / or carriers, if desired using emulsifiers ⁇ and dispersants, where, in the case of water as a diluent other organic solvents can be used as auxiliary solvents.
- auxiliaries solvents such as aromatics (e.g. xylene), chlorinated aromatics (e.g. chlorobenzenes), paraffins (e.g. petroleum fractions), alcohols (e.g. methanol, butanol), ketones (e.g. cyclohexanone), amines (e.g.
- Carriers such as natural stone powder (eg kaolins, clays, talc, chalk) and synthetic stone powder (eg highly disperse silica, silicates); Emulsifiers such as non-ionic and anionic emulsifiers (eg polyoxyethylene fatty alcohol ethers, alkyl sulfonates and aryl sulfonates) and dispersants such as lignin sulfite liquors and methyl cellulose.
- Carriers such as natural stone powder (eg kaolins, clays, talc, chalk) and synthetic stone powder (eg highly disperse silica, silicates)
- Emulsifiers such as non-ionic and anionic emulsifiers (eg polyoxyethylene fatty alcohol ethers, alkyl sulfonates and aryl sulfonates) and dispersants such as lignin sulfite liquors and methyl cellulose.
- solvents e.g. Di ethylformamide, dimethyl sulfoxide, N-methylpyrrolidone, water.
- Powders, materials for broadcasting and dusts can be prepared by mixing or grinding the active substances together with a solid carrier.
- Granules for example coated, impregnated and Homogengranula ⁇ te, of the active compounds can be prepared by binding to solid carriers.
- Solid carriers are, for example, mineral earths, such as silica gel, silicas, silicates, talc, kaolin, Attaclay, limestone, lime, chalk, bolus, loess, clay, dolomite, diatomaceous earth, calcium and magnesium sulfate, magnesium oxide, ground plastics, fertilizers such as ammonium sulfate , Ammonium phosphate, ammonium nitrate, ureas and herbal products, such as
- Cereal flour, tree bark, wood and nutshell flour, cellulose powder and other solid carriers generally contain between 0.01 and 95% by weight, preferably between 0.1 and 90% by weight, of the active ingredient.
- the active ingredients are used in a purity of 90% to 100%, preferably 95% to 100% (according to the NMR spectrum).
- V. 80 parts by weight of a compound according to the invention are mixed with 3 parts by weight of the sodium salt of diisobutylnaphthalene-alpha-sulfonic acid, 10 parts by weight of the sodium salt of a lignosulfonic acid from a sulfite waste liquor and 7 parts by weight of powdered silica gel well mixed and ground in a hammer mill (active ingredient content 80% by weight).
- VI. 90 parts by weight of a compound according to the invention are mixed with 10 parts by weight of N-methyl- ⁇ -pyrrolidone and a solution is obtained which is suitable for use in the form of tiny drops (active substance content 90% by weight).
- 20 parts by weight of a compound according to the invention are dissolved in a mixture which consists of 40 parts by weight of cyclohexanone, 30 parts by weight.
- Pouring the solution into 100,000 parts by weight of water and finely distributing it therein gives an aqueous dispersion which comprises 0.02% by weight of the active ingredient.
- VIII.20 parts by weight of a compound according to the invention are pulverized with 3 parts by weight of the sodium salt of diisobutylnaphthalene- ⁇ -sulfonic acid, 17 parts by weight of the sodium salt of a lignin sulfonic acid from a sulfite waste liquor and 60 parts by weight. deformed silica gel well mixed and ground in a hammer mill. By finely distributing the mixture in 20,000 parts by weight of water, a spray liquor is obtained which contains 0.1% by weight of the active ingredient.
- the active ingredients as such in the form of their formulations or the use forms prepared therefrom, e.g. in the form of directly sprayable solutions, powders, suspensions or dispersions, emulsions, oil dispersions, pastes, dusts, sprinkling agents, granules by spraying, atomizing, dusting, scattering or pouring.
- the application forms depend entirely on the purposes; in any case, they should ensure the finest possible distribution of the active compounds according to the invention.
- Aqueous formulations may be prepared from emulsion concentrates, pastes or wettable powders (spray powders, oil dispersions) by ⁇ To set are prepared from water. To prepare emulsions, pastes or oil dispersions, the substances as such or dissolved in an oil or solvent can be homogenized in water by means of wetting agents, adhesives, dispersants or emulsifiers. However, it is also possible to prepare concentrates composed of an active substance, wetting agents, adhesives, dispersants or emulsifiers and possibly solvents or oil, which are suitable for dilution with water.
- the active substance concentrations in the ready-to-use preparations can be varied over a wide range. In general, they are between 0.0001 and 10%, preferably between 0.01 and 1%.
- the active ingredients can also be used with great success in the ultra-low-volume process (ULV), it being possible to apply formulations with more than 95% by weight of active ingredient or even the active ingredient without additives.
- UUV ultra-low-volume process
- Oils of various types, herbicides, fungicides, other pesticides, bactericides can be added to the active compounds, if appropriate also only immediately before use (tank mix). These agents can be added to the agents according to the invention in a weight ratio of 1:10 to 10: 1.
- the agents according to the invention can also be present in the use form as fungicides together with other active ingredients which, e.g. with herbicides, insecticides, growth regulators, fungicides or even with fertilizers. Mixing the compounds I or the compositions containing them in the use form as fungicides with other fungicides results in an enlargement of the fungicidal activity spectrum in many cases.
- Sulfur, dithiocarbate and their derivatives such as ferridimethyldithiocarbamate, zinc dimethyldithiocarbamate, zinc ethylene bisdithiocarbamate, manganese ethylene bisdithiocarbamate, manganese-zinc ethylenediamine bis-dithiocarbate, tetramethyl zinc ammonia (ethylenedi-nulfide ide, n-ethylenediuron disulfide ide, bis-dithiocarbamate), ammonia complex of zinc (N, N '-propylene-bis-dithiocarbamate), zinc (N, N'-propylene-bis-dithiocarbamate), N, N' -polypropylene-bis- (thiocarbamoyl) disulfide id;
- Nitroderivate such as dinitro- (1-methylheptyl) phenylcrotonate, 2-sec-butyl-4,6-dinitrophenyl-3,3-dimethylacrylate, 2-sec-butyl-4, 6-dinitrophenyl-isopropyl carbonate, 5- Nitro-isophthalic acid-di-isopropyl ester; Heterocyclic substances, such as 2-heptadecyl-2-imidazoline acetate, 2-chloro-N- (4'-chloro-biphenyl-2-yl) -nicotina id, 2,4-di-chloro-6- ( o-chloroanilino) -s-triazine, 0, O-diethyl-phthalimidophosphonothioate, 5-amino-l- [bis- (dimethyla ino) -phosphinyl] -3-phenyl-l, 2,4-triazole, 2,3-
- Phenylpyrroles such as 4- (2, 2-difluoro-1,3-benzodioxol-4-yl) pyrrole-3-carbonitrile, cinnamic acid amides such as 3- (4-chlorophenyl) -3- (3,4-dimethoxyphe nyl) acrylic morpholide, 3- (4-fluorophenyl) -3- (3,4-dimethoxyphenyl) acrylic morpholide, As well as various fungicides, such as dodecylguanidine acetate,
- the residue was mixed with a little kieselguhr and stirred with a mixture of dilute hydrochloric acid and ethyl acetate.
- the acetonitrile wash phase was also stirred with dilute hydrochloric acid / ethyl acetate.
- the combined ethyl acetate phases were dried and concentrated.
- the residue crystallized and was digested with diisopropyl ether. 1.4 g (38%) of the title compound were obtained as a colorless solid.
- the active ingredients were separated or together as a 10% emulsion in a mixture of 70% by weight cyclohexanone, 20% by weight Nekanil® LN (Lutensol® AP6, wetting agent with emulsifying and dispersing action based on ethoxylated alkylphenols) and 10% by weight .-% Wettol® EM (non-ionic emulsifier based on ethoxylated castor oil) prepared and diluted with water according to the desired concentration.
- Nekanil® LN Litensol® AP6, wetting agent with emulsifying and dispersing action based on ethoxylated alkylphenols
- .-% Wettol® EM non-ionic emulsifier based on ethoxylated castor oil
- Leaves of potted plants of the "large meat tomato St. Pierre" were sprayed to runoff point with an aqueous suspension which had been prepared from a stock solution of 10% active ingredient, 63% cyclohexanone and 27% emulsifier. The following day, the leaves were infected with an aqueous suspension of zoospores from Al ternaria solani in 2% biomalt solution with a density of 0.17 x 10 5 spores / ml. The plants were then placed in a steam-saturated chamber at temperatures between 20 and 22 ° C. After 5 days, the blight on the untreated but infected control plants had developed so strongly that the infestation could be determined visually in%.
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Dentistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Plant Pathology (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Pest Control & Pesticides (AREA)
- Agronomy & Crop Science (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
Claims
Priority Applications (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CA002452625A CA2452625A1 (en) | 2001-07-05 | 2002-07-03 | Fungicidal triazolopyrimidines, method for the production thereof and use thereof in controlling noxious fungi and agents containing said compounds |
| PL02367776A PL367776A1 (en) | 2001-07-05 | 2002-07-03 | Fungicidal triazolopyrimidines, method for the production thereof and use thereof in controlling noxious fungi and agents containing said compounds |
| HU0400385A HUP0400385A3 (en) | 2001-07-05 | 2002-07-03 | Fungicidal triazolopyrimidines, method for the production thereof and use thereof in controlling noxious fungi and compositions containing them |
| EA200400107A EA007164B1 (ru) | 2001-07-05 | 2002-07-03 | Фунгицидные триазолопиримидины, способ их получения и их применение для борьбы с фитопатогенными грибами, а также содержащие их средства |
| MXPA04000045A MXPA04000045A (es) | 2001-07-05 | 2002-07-03 | Triazolopirimidinas funguicidas, procedimientos para su obtencion y el uso de las mismas para controlar hongos nocivos, asi como productos que las contienen. |
| EP02758297A EP1406903B1 (de) | 2001-07-05 | 2002-07-03 | Fungizide triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| DE50209496T DE50209496D1 (de) | 2001-07-05 | 2002-07-03 | Fungizide triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| BR0210858-5A BR0210858A (pt) | 2001-07-05 | 2002-07-03 | Composto, processo para preparar o mesmo, composição adequada para o combate de fungos danosos, uso dos compostos, e, método para combater fungos danosos |
| JP2003510633A JP2004533485A (ja) | 2001-07-05 | 2002-07-03 | 殺真菌性のトリアゾロピリミジン、その製造方法及び有害真菌を抑制するためのその使用、ならびにこれらの化合物を含む組成物 |
| NZ530822A NZ530822A (en) | 2001-07-05 | 2002-07-03 | Fungicidal triazolopyrimidines, method for the production thereof and use thereof in controlling noxious fungi and agents containing said compounds |
| KR1020047000089A KR100619216B1 (ko) | 2001-07-05 | 2002-07-03 | 살진균성 트리아졸로피리미딘, 이의 제조방법 및 유해진균 방제를 위한 이의 용도 및 상기 화합물을 포함하는조성물 |
| IL15960402A IL159604A0 (en) | 2001-07-05 | 2002-07-03 | Fungicidal triazolopyrimidines, method for the production thereof and use thereof in controlling noxious fungi and agents containing said compounds |
| US10/482,216 US7300908B2 (en) | 2001-07-05 | 2002-07-03 | Fungicidal triazolopyrimidines, method for the production thereof and use thereof in controlling noxious fungi and agents containing said compounds |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE10132059.0 | 2001-07-05 | ||
| DE10132059 | 2001-07-05 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| WO2003004465A2 true WO2003004465A2 (de) | 2003-01-16 |
| WO2003004465A3 WO2003004465A3 (de) | 2003-05-08 |
Family
ID=7690356
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP2002/007340 WO2003004465A2 (de) | 2001-07-05 | 2002-07-03 | Fungizide triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
Country Status (19)
| Country | Link |
|---|---|
| US (1) | US7300908B2 (de) |
| EP (3) | EP1406903B1 (de) |
| JP (1) | JP2004533485A (de) |
| KR (1) | KR100619216B1 (de) |
| CN (1) | CN1284782C (de) |
| AR (1) | AR036128A1 (de) |
| AT (1) | ATE353901T1 (de) |
| BR (1) | BR0210858A (de) |
| CA (1) | CA2452625A1 (de) |
| DE (1) | DE50209496D1 (de) |
| EA (1) | EA007164B1 (de) |
| ES (1) | ES2281535T3 (de) |
| HU (1) | HUP0400385A3 (de) |
| IL (1) | IL159604A0 (de) |
| MX (1) | MXPA04000045A (de) |
| NZ (1) | NZ530822A (de) |
| PL (1) | PL367776A1 (de) |
| WO (1) | WO2003004465A2 (de) |
| ZA (1) | ZA200400914B (de) |
Cited By (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004055018A1 (de) * | 2002-12-17 | 2004-07-01 | Basf Aktiengesellschaft | Fungizide triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| WO2004087705A1 (de) * | 2003-03-31 | 2004-10-14 | Basf Aktiengesellschaft | 7-alkenylamino-triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| WO2005058907A1 (de) * | 2003-12-18 | 2005-06-30 | Basf Aktiengesellschaft | 6-(2-halogenphenyl)-triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| WO2005121146A2 (de) * | 2004-06-09 | 2005-12-22 | Basf Aktiengesellschaft | 1, 2, 4-TRIAZOLO[1,5a]PYRIMIDINE UND DEREN VERWENDUNG ZUR BEKÄMPFUNG VON PFLANZEN-PATHOGENEN PILZEN |
| WO2006000592A1 (de) | 2004-06-28 | 2006-01-05 | Basf Aktiengesellschaft | Verwendung von ethergruppen enthaltenden polymeren als lösungsvermittler |
| WO2006034848A1 (de) * | 2004-09-28 | 2006-04-06 | Basf Aktiengesellschaft | 7-AMINOMETHYL-1,2,4-TRIAZOLO[1,5-a]PYRIMIDIN-VERBINDUNGEN UND IHRE VERWENDUNG ZUR BEKÄMPFUNG VON SCHADPILZEN |
| WO2007116011A2 (de) * | 2006-04-10 | 2007-10-18 | Basf Se | Substituierte triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| WO2008084027A1 (de) * | 2007-01-08 | 2008-07-17 | Basf Se | Verwendung von azolopyrimidinen zur bekämpfung von pflanzenpathogenen schadpilzen |
| WO2010092088A2 (de) | 2009-02-10 | 2010-08-19 | Basf Se | Verwendung von hydrophobin als spreitmittel |
| EP2305033A1 (de) | 2005-06-20 | 2011-04-06 | Basf Se | Kristalline Modifikationen des Pyraclostrobins |
| EP2308460A1 (de) | 2005-02-21 | 2011-04-13 | Basf Se | Wirkstoffzusammensetzung die wenigstens ein stickstoffatomhaltiges, hyperverzweigtes Polymer enthält |
| WO2011095449A1 (de) | 2010-02-05 | 2011-08-11 | Basf Se | Verfahren zur solubilisierung von hydrophoben wirkstoffen in wässrigem medium |
| WO2012127009A1 (en) | 2011-03-23 | 2012-09-27 | Basf Se | Compositions containing polymeric, ionic compounds comprising imidazolium groups |
| EP2514310A1 (de) | 2005-09-13 | 2012-10-24 | ISAGRO S.p.A. | Verfahren zum Schutz vor Phytopathogenen mit Kiralaxyl, entsprechende Verwendung und Mittel hierzu |
| EP2676680A1 (de) | 2007-09-13 | 2013-12-25 | Basf Se | Verwendung von Hydrophobin-Polipeptiden als Penetrationsverstärker |
| EP3050919A1 (de) | 2015-01-29 | 2016-08-03 | Basf Se | Lignocellulosehaltige materialen enthaltend mischungen mit salzen von n-substituierten carbamidsäuren |
| WO2023111297A1 (en) | 2021-12-17 | 2023-06-22 | Basf Se | Lactones for enhancing the activity of antimicrobial agents |
| WO2023111296A1 (en) | 2021-12-17 | 2023-06-22 | Basf Se | Composition comprising an antimicrobial agent and a carboxamide |
| EP4289273A1 (de) | 2022-06-07 | 2023-12-13 | Basf Se | Zusammensetzung, die ein antimikrobielles mittel und ein n-cyclohexyldiazeniumdioxysalz umfasst |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI0519045A2 (pt) * | 2004-12-17 | 2008-12-23 | Basf Ag | compostos, uso de um composto, agente para combater fungos fitopatogÊnicos, combinaÇço, processo para combater fungos fitopatogÊnicos, semente, e, processo para preparar um composto |
| KR100790109B1 (ko) | 2006-11-09 | 2008-01-02 | 삼성전자주식회사 | 푸쉬 로드 및 그를 구비하는 슬라이딩형 휴대용 단말기 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0834513A2 (de) * | 1996-10-07 | 1998-04-08 | American Cyanamid Company | Pentafluorophenylazolopyrimidine |
| WO1999041255A1 (en) * | 1998-02-11 | 1999-08-19 | American Cyanamid Company | Fungicidal 7-alkyl-triazolopyrimidines |
| EP1048649A1 (de) * | 1997-12-26 | 2000-11-02 | Nissin Food Products Co., Ltd. | 5-arylpyrrol-derivate |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2388579A (en) * | 1944-02-29 | 1945-11-06 | Univ Minnesota | Process of making heterocyclic compounds |
| BE472445A (de) * | 1946-04-11 | |||
| FR2490586A1 (fr) | 1980-09-24 | 1982-03-26 | Aerospatiale | Profil de pale pour voilure tournante d'aeronef |
| DE3130633A1 (de) | 1981-08-01 | 1983-02-17 | Basf Ag, 6700 Ludwigshafen | 7-amino-azolo(1,5-a)pyrimidine und diese enthaltende fungizide |
| TW224044B (de) | 1991-12-30 | 1994-05-21 | Shell Internat Res Schappej B V | |
| AU5813394A (en) * | 1992-12-23 | 1994-07-19 | Byk Gulden Lomberg Chemische Fabrik Gmbh | Anellated uracil derivates |
| IL108747A (en) | 1993-03-04 | 1999-03-12 | Shell Int Research | Mushroom-killing preparations containing a history of 6 metamorphoses of 5 - 7 Dihalo - 1, 2 - 4 Triazlo [A-1,5] Pyrimidine Certain such new compounds and their preparation |
| RU2147584C1 (ru) | 1995-10-27 | 2000-04-20 | Американ Цианамид Компани | Способ получения дигалоидазолопиримидинов и способ получения дигидроксиазолопиримидинов |
| TW460476B (en) | 1997-04-14 | 2001-10-21 | American Cyanamid Co | Fungicidal trifluoromethylalkylamino-triazolopyrimidines |
| US6057456A (en) * | 1997-10-16 | 2000-05-02 | Yale University | Transition metal-catalyzed process for preparing alpha-arylated carbonyl-containing compounds |
-
2002
- 2002-07-03 JP JP2003510633A patent/JP2004533485A/ja not_active Withdrawn
- 2002-07-03 WO PCT/EP2002/007340 patent/WO2003004465A2/de active IP Right Grant
- 2002-07-03 HU HU0400385A patent/HUP0400385A3/hu unknown
- 2002-07-03 AT AT02758297T patent/ATE353901T1/de not_active IP Right Cessation
- 2002-07-03 EA EA200400107A patent/EA007164B1/ru not_active IP Right Cessation
- 2002-07-03 DE DE50209496T patent/DE50209496D1/de not_active Expired - Fee Related
- 2002-07-03 EP EP02758297A patent/EP1406903B1/de not_active Expired - Lifetime
- 2002-07-03 ES ES02758297T patent/ES2281535T3/es not_active Expired - Lifetime
- 2002-07-03 NZ NZ530822A patent/NZ530822A/en unknown
- 2002-07-03 US US10/482,216 patent/US7300908B2/en not_active Expired - Fee Related
- 2002-07-03 CA CA002452625A patent/CA2452625A1/en not_active Abandoned
- 2002-07-03 PL PL02367776A patent/PL367776A1/xx not_active Application Discontinuation
- 2002-07-03 MX MXPA04000045A patent/MXPA04000045A/es not_active Application Discontinuation
- 2002-07-03 EP EP05018655A patent/EP1634863A1/de not_active Withdrawn
- 2002-07-03 CN CNB028158946A patent/CN1284782C/zh not_active Expired - Fee Related
- 2002-07-03 IL IL15960402A patent/IL159604A0/xx unknown
- 2002-07-03 BR BR0210858-5A patent/BR0210858A/pt not_active IP Right Cessation
- 2002-07-03 EP EP05018654A patent/EP1616870A1/de not_active Withdrawn
- 2002-07-03 KR KR1020047000089A patent/KR100619216B1/ko not_active IP Right Cessation
- 2002-07-04 AR ARP020102513A patent/AR036128A1/es unknown
-
2004
- 2004-02-04 ZA ZA200400914A patent/ZA200400914B/en unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0834513A2 (de) * | 1996-10-07 | 1998-04-08 | American Cyanamid Company | Pentafluorophenylazolopyrimidine |
| EP1048649A1 (de) * | 1997-12-26 | 2000-11-02 | Nissin Food Products Co., Ltd. | 5-arylpyrrol-derivate |
| WO1999041255A1 (en) * | 1998-02-11 | 1999-08-19 | American Cyanamid Company | Fungicidal 7-alkyl-triazolopyrimidines |
Non-Patent Citations (1)
| Title |
|---|
| C.W. CHOPPEE; J. CYMERMAN CRAIG; R. E. LACK: "Acetylenic Compounds related to Stilben. Part III. Acetylenic Alcohols derived from alpha-Alkyldeoxyanisoins, and the alpha-Alkyl-beta-ethynylstilbenes" J. CHEM. SCO., 1961, Seiten 1311-1321, XP009004205 * |
Cited By (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004055018A1 (de) * | 2002-12-17 | 2004-07-01 | Basf Aktiengesellschaft | Fungizide triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| WO2004087705A1 (de) * | 2003-03-31 | 2004-10-14 | Basf Aktiengesellschaft | 7-alkenylamino-triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| WO2005058907A1 (de) * | 2003-12-18 | 2005-06-30 | Basf Aktiengesellschaft | 6-(2-halogenphenyl)-triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| WO2005121146A2 (de) * | 2004-06-09 | 2005-12-22 | Basf Aktiengesellschaft | 1, 2, 4-TRIAZOLO[1,5a]PYRIMIDINE UND DEREN VERWENDUNG ZUR BEKÄMPFUNG VON PFLANZEN-PATHOGENEN PILZEN |
| WO2005121146A3 (de) * | 2004-06-09 | 2006-02-16 | Basf Ag | 1, 2, 4-TRIAZOLO[1,5a]PYRIMIDINE UND DEREN VERWENDUNG ZUR BEKÄMPFUNG VON PFLANZEN-PATHOGENEN PILZEN |
| WO2006000592A1 (de) | 2004-06-28 | 2006-01-05 | Basf Aktiengesellschaft | Verwendung von ethergruppen enthaltenden polymeren als lösungsvermittler |
| WO2006034848A1 (de) * | 2004-09-28 | 2006-04-06 | Basf Aktiengesellschaft | 7-AMINOMETHYL-1,2,4-TRIAZOLO[1,5-a]PYRIMIDIN-VERBINDUNGEN UND IHRE VERWENDUNG ZUR BEKÄMPFUNG VON SCHADPILZEN |
| EP2308460A1 (de) | 2005-02-21 | 2011-04-13 | Basf Se | Wirkstoffzusammensetzung die wenigstens ein stickstoffatomhaltiges, hyperverzweigtes Polymer enthält |
| EP2305033A1 (de) | 2005-06-20 | 2011-04-06 | Basf Se | Kristalline Modifikationen des Pyraclostrobins |
| EP2514310A1 (de) | 2005-09-13 | 2012-10-24 | ISAGRO S.p.A. | Verfahren zum Schutz vor Phytopathogenen mit Kiralaxyl, entsprechende Verwendung und Mittel hierzu |
| EP2514311A1 (de) | 2005-09-13 | 2012-10-24 | ISAGRO S.p.A. | Verfahren zum Schutz vor Phytopathogenen mit Kiralaxyl, entsprechende Verwendung und Mittel hierzu |
| WO2007116011A3 (de) * | 2006-04-10 | 2007-12-21 | Basf Ag | Substituierte triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| WO2007116011A2 (de) * | 2006-04-10 | 2007-10-18 | Basf Se | Substituierte triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel |
| WO2008084027A1 (de) * | 2007-01-08 | 2008-07-17 | Basf Se | Verwendung von azolopyrimidinen zur bekämpfung von pflanzenpathogenen schadpilzen |
| EP2676680A1 (de) | 2007-09-13 | 2013-12-25 | Basf Se | Verwendung von Hydrophobin-Polipeptiden als Penetrationsverstärker |
| WO2010092088A2 (de) | 2009-02-10 | 2010-08-19 | Basf Se | Verwendung von hydrophobin als spreitmittel |
| WO2011095449A1 (de) | 2010-02-05 | 2011-08-11 | Basf Se | Verfahren zur solubilisierung von hydrophoben wirkstoffen in wässrigem medium |
| WO2012127009A1 (en) | 2011-03-23 | 2012-09-27 | Basf Se | Compositions containing polymeric, ionic compounds comprising imidazolium groups |
| EP3378313A1 (de) | 2011-03-23 | 2018-09-26 | Basf Se | Zusammensetzungen mit polymeren, ionischen verbindungen mit imidazoliumgruppen |
| EP3050919A1 (de) | 2015-01-29 | 2016-08-03 | Basf Se | Lignocellulosehaltige materialen enthaltend mischungen mit salzen von n-substituierten carbamidsäuren |
| WO2023111297A1 (en) | 2021-12-17 | 2023-06-22 | Basf Se | Lactones for enhancing the activity of antimicrobial agents |
| WO2023111296A1 (en) | 2021-12-17 | 2023-06-22 | Basf Se | Composition comprising an antimicrobial agent and a carboxamide |
| EP4289273A1 (de) | 2022-06-07 | 2023-12-13 | Basf Se | Zusammensetzung, die ein antimikrobielles mittel und ein n-cyclohexyldiazeniumdioxysalz umfasst |
Also Published As
| Publication number | Publication date |
|---|---|
| HUP0400385A2 (hu) | 2004-12-28 |
| JP2004533485A (ja) | 2004-11-04 |
| AR036128A1 (es) | 2004-08-11 |
| EA007164B1 (ru) | 2006-08-25 |
| US20050090665A1 (en) | 2005-04-28 |
| IL159604A0 (en) | 2004-06-01 |
| KR20040010835A (ko) | 2004-01-31 |
| PL367776A1 (en) | 2005-03-07 |
| ZA200400914B (en) | 2005-02-04 |
| US7300908B2 (en) | 2007-11-27 |
| DE50209496D1 (de) | 2007-03-29 |
| HUP0400385A3 (en) | 2005-11-28 |
| MXPA04000045A (es) | 2004-05-21 |
| BR0210858A (pt) | 2004-06-29 |
| ATE353901T1 (de) | 2007-03-15 |
| KR100619216B1 (ko) | 2006-09-08 |
| EP1616870A1 (de) | 2006-01-18 |
| NZ530822A (en) | 2004-08-27 |
| EA200400107A1 (ru) | 2004-06-24 |
| ES2281535T3 (es) | 2007-10-01 |
| EP1406903A2 (de) | 2004-04-14 |
| WO2003004465A3 (de) | 2003-05-08 |
| CN1284782C (zh) | 2006-11-15 |
| CN1541218A (zh) | 2004-10-27 |
| EP1634863A1 (de) | 2006-03-15 |
| CA2452625A1 (en) | 2003-01-16 |
| EP1406903B1 (de) | 2007-02-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1343785A2 (de) | Verwendung von substituierten imidazoazinen, neue imidazoazine, verfahren zu deren herstellung, sowie sie enthaltende mittel | |
| EP1414302B1 (de) | 7-aminotriazolopyrimidine zur bekämpfung von schadpilzen | |
| WO2002074753A2 (de) | 5-phenylpyrimidine, verfahren und zwischenprodukte zu ihrer herstellung und ihre verwendung zur bekaempfung von schadpilzen | |
| WO2003004465A2 (de) | Fungizide triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel | |
| WO2003043993A1 (de) | 5-phenylpyrimidine, verfahren zu ihrer herstellung, sie enthaltende mittel und ihre verwendung | |
| EP0824533A1 (de) | PYRAZOLO- 1,5a]-PYRIMIDINE, VERFAHREN ZU IHRER HERSTELLUNG UND IHRE VERWENDUNG | |
| EP1164126A1 (de) | Salicylsäurehydrazid-Derivate, Verfahren und Zwischenprodukte zu ihrer Herstellung, sie enthaltende Mittel und ihre Verwendung zur Bekämpfung von Schadpilzen | |
| EP1490372B1 (de) | Fungizide triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen sowie sie enthaltende mittel | |
| EP1504009B1 (de) | Fungizide triazolopyrimidine, verfahren zu ihrer herstellung und ihre verwendung zur bek mpfung von schadpilzen sowie sie ent haltende mittel | |
| WO2003070721A1 (de) | 2-(2-pyridyl)-5-phenyl-6-aminopyrimidine, verfahren und zwischenprodukte zu ihrer herstellung und ihre verwendung zur bekämpfung von schadpilzen | |
| EP1172355A1 (de) | Salicylsäure-Derivate, Verfahren zu ihrer Herstellung, sie enthaltende Mittel sowie ihre Verwendung zur Bekämpfung von Schadpilzen | |
| WO2000020399A2 (de) | Verwendung von substituierten 5-hydroxypyrazolen, neue 5-hydroxypyrazole, verfahren zu deren herstellung, sowie sie enthaltende mittel | |
| DE10257394A1 (de) | 2-Substituierte Triazolopyrimidine, Verfahren zu ihrer Herstellung und ihre Verwendung zur Bekämpfung von Schadpilzen sowie sie enthaltende Mittel | |
| EP1758906A2 (de) | 1, 2, 4-triazolo[1,5a]pyrimidine und deren verwendung zur bekämpfung von pflanzen-pathogenen pilzen | |
| DE4234012A1 (de) | Neue Anilinderivate und diese enthaltende Pflanzenschutzmittel |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| AK | Designated states |
Kind code of ref document: A2 Designated state(s): AE AG AL AM AT AU AZ BA BB BG BR BY BZ CA CH CN CO CR CU CZ DE DK DM DZ EC EE ES FI GB GD GE GH GM HR HU ID IL IN IS JP KE KG KP KR KZ LC LK LR LS LT LU LV MA MD MG MK MN MW MX MZ NO NZ OM PH PL PT RO RU SD SE SG SI SK SL TJ TM TN TR TT TZ UA UG US UZ VN YU ZA ZM ZW |
|
| AL | Designated countries for regional patents |
Kind code of ref document: A2 Designated state(s): GH GM KE LS MW MZ SD SL SZ TZ UG ZM ZW AM AZ BY KG KZ MD RU TJ TM AT BE BG CH CY CZ DE DK EE ES FI FR GB GR IE IT LU MC NL PT SE SK TR BF BJ CF CG CI CM GA GN GQ GW ML MR NE SN TD TG |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application | ||
| DFPE | Request for preliminary examination filed prior to expiration of 19th month from priority date (pct application filed before 20040101) | ||
| WWE | Wipo information: entry into national phase |
Ref document number: 2002758297 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 159604 Country of ref document: IL |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2452625 Country of ref document: CA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2003510633 Country of ref document: JP Ref document number: 1020047000089 Country of ref document: KR |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2002325289 Country of ref document: AU |
|
| WWE | Wipo information: entry into national phase |
Ref document number: PA/a/2004/000045 Country of ref document: MX |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 530822 Country of ref document: NZ |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 200400107 Country of ref document: EA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2004/00914 Country of ref document: ZA Ref document number: 200400914 Country of ref document: ZA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 235/CHENP/2004 Country of ref document: IN |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 20028158946 Country of ref document: CN |
|
| WWP | Wipo information: published in national office |
Ref document number: 2002758297 Country of ref document: EP |
|
| REG | Reference to national code |
Ref country code: DE Ref legal event code: 8642 |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 10482216 Country of ref document: US |
|
| WWP | Wipo information: published in national office |
Ref document number: 530822 Country of ref document: NZ |
|
| WWG | Wipo information: grant in national office |
Ref document number: 530822 Country of ref document: NZ |
|
| WWG | Wipo information: grant in national office |
Ref document number: 2002758297 Country of ref document: EP |