WO1992013866A1 - Derivate von disaccharidalkoholen, verfahren zu ihrer herstellung und ihre verwendung - Google Patents
Derivate von disaccharidalkoholen, verfahren zu ihrer herstellung und ihre verwendung Download PDFInfo
- Publication number
- WO1992013866A1 WO1992013866A1 PCT/EP1992/000235 EP9200235W WO9213866A1 WO 1992013866 A1 WO1992013866 A1 WO 1992013866A1 EP 9200235 W EP9200235 W EP 9200235W WO 9213866 A1 WO9213866 A1 WO 9213866A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- weight
- hydrogen
- isomalt
- derivatives
- mixtures
- Prior art date
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q5/00—Preparations for care of the hair
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/30—Cosmetics or similar toiletry preparations characterised by the composition containing organic compounds
- A61K8/60—Sugars; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/30—Cosmetics or similar toiletry preparations characterised by the composition containing organic compounds
- A61K8/60—Sugars; Derivatives thereof
- A61K8/608—Derivatives containing from 2 to 10 oxyalkylene groups
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H15/00—Compounds containing hydrocarbon or substituted hydrocarbon radicals directly attached to hetero atoms of saccharide radicals
- C07H15/02—Acyclic radicals, not substituted by cyclic structures
- C07H15/04—Acyclic radicals, not substituted by cyclic structures attached to an oxygen atom of the saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H15/00—Compounds containing hydrocarbon or substituted hydrocarbon radicals directly attached to hetero atoms of saccharide radicals
- C07H15/02—Acyclic radicals, not substituted by cyclic structures
- C07H15/04—Acyclic radicals, not substituted by cyclic structures attached to an oxygen atom of the saccharide radical
- C07H15/06—Acyclic radicals, not substituted by cyclic structures attached to an oxygen atom of the saccharide radical being a hydroxyalkyl group esterified by a fatty acid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H15/00—Compounds containing hydrocarbon or substituted hydrocarbon radicals directly attached to hetero atoms of saccharide radicals
- C07H15/02—Acyclic radicals, not substituted by cyclic structures
- C07H15/04—Acyclic radicals, not substituted by cyclic structures attached to an oxygen atom of the saccharide radical
- C07H15/08—Polyoxyalkylene derivatives
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D1/00—Detergent compositions based essentially on surface-active compounds; Use of these compounds as a detergent
- C11D1/66—Non-ionic compounds
- C11D1/662—Carbohydrates or derivatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
- A61Q19/10—Washing or bathing preparations
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q5/00—Preparations for care of the hair
- A61Q5/02—Preparations for cleaning the hair
Definitions
- the present invention relates to derivatives of disaccharide alcohols, namely fatty acid esters and alkoxylation products of ⁇ -D-glucopyranosyl-1, 6-mannitol, hereinafter referred to as GPM, and of ⁇ -D-glucopyranosyl-1,6-sorbitol, hereinafter Called GPS, and mixtures of these two disaccharide alcohols.
- GPM fatty acid esters and alkoxylation products of ⁇ -D-glucopyranosyl-1, 6-mannitol
- Called GPS ⁇ -D-glucopyranosyl-1,6-sorbitol
- Mono- and disaccharides such as glucose and sucrose
- sucrose esters have been used as valuable mild and biodegradable additives in cosmetics and in the food industry for some years.
- the reducing disaccharide isomaltulose (palatinose '') is obtained from sucrose in an industrial process using an enzymatic transglucosidation.
- the hydrogenation of isomaltulose in aqueous neutral solution with hydrogen over a nickel catalyst provides the known sweetener isomalt (palatinite ⁇ ') as an approximately equimolar mixture of the two isomers GPM and GPS.
- isomalt is also used below for any other mixture of these two isomers in the range from 5 to 95% by weight GPM or 95 to 5% by weight GPS.
- DE-OS 34 30 944 describes the production of saccharose esters from fatty acids, sugar and catalytic amounts of a lipolytic enzyme.
- the disadvantages of this process are that very high amounts of enzyme of 10 to 200% by weight, based on sugar, are used, and the reaction products only have to be cleaned and worked up with the toxic solvents chloroform and tetrahydrofuran after a reaction time of 72 hours.
- a solvent-free transesterification process has recently become known from DE-AS 24 12 374.
- the reaction is carried out with melted sucrose, fatty acid triglycerides and K, CO (5 to 10% by weight) at 125 to 130 ° C.
- isomalt has a similarly high molecular weight (344) and a similar number of OH groups (9) as sucrose (molecular weight 342, 8-OH groups), but this process can hardly be transferred to isomalt, since the products obtained become very dark after a short reaction time, and the overall yield of mono- and diesters is well below 30%.
- This process provides a complex reaction mixture that contains an increasing number of unreacted starting products.
- JP-A 59-60439 describes a monoester mixture of palatinit * '(isomalt) for dental care.
- a palatinit'-lauric acid monoester mixture with an average degree of esterification of 1.2 and a monoester content of 80% is described, which was prepared in the usual way by esterification with acid chloride.
- the technical problem of the present invention is first of all to provide configuratively characterized mono- and diesters of isomalt and alkoxylated and multiply esterified derivatives by means of a process for the solvent-free production of new mono- and diesters and alkoxylation products of isomalt and their mixtures.
- the process should be simple to carry out and should therefore be particularly suitable for use on an industrial scale, and at the same time avoid the problems of the prior art which arise from the use of toxic solvents. It should preferably enable selective esterification on primary OH groups of the isomalt.
- X is hydrogen or an acyl residue of a saturated or unsaturated fatty acid having 8 to 20 carbon atoms or the residue (-CH 2_-C
- R 3 means, where R 3 represents hydrogen or a methyl group, and n is in the range from 1 to 20, R .. and R_ are the same or different and can have the same meaning as X, but may not both be hydrogen at the same time X is hydrogen, and mixtures of these derivatives.
- the derivatives according to the invention are prepared by adding .alpha.-D-glucopyranosyl-1,6-mannitol or .alpha.-D-glucopyranosyl-1,6-sorbitol or a mixture thereof either in an aqueous alkaline solution at elevated temperature Ethylene oxide or propylene oxide are reacted or reacted without solvent in the presence of alkaline catalysts at elevated temperatures with saturated or unsaturated fatty acids having 8 to 20 carbon atoms and optionally also subsequently reacted with ethylene oxide or propylene oxide.
- the derivatives according to the invention or their mixtures are alkoxylated with 2 to 150 moles of ethylene oxide or propylene oxide.
- Alkaline or alkaline earth oxide, hydroxide, carbonate, peroxide, or hydrogen can be used as the alkaline catalyst.
- carbonate or alcoholate can be used.
- the inorganic salts can be used as such or in combination with the alcoholates of sodium, potassium or lithium.
- the catalyst preferably consists of 0.01 to 10% by weight of these substances.
- Capric acid, lauric acid, myristic acid, palmitic acid, stearic acid, isostearic acid, coconut fatty acid, ricinoleic acid, oleic acid, linoleic acid and undecylenic acid are preferably used as fatty acids.
- fatty acid mixtures from natural fats can also be used.
- the esterification is preferably carried out at temperatures zwi ⁇ rule 90 and 180 ⁇ C at normal pressure or in vacuo von ⁇ .
- the isomalt is used as the alcohol component.
- the molar ratio of fatty acid to isomalt can be between 3: 1 and 1: 2.
- Only primary OH groups are preferably esterified, with not only monofatty acid esters but also, in particular, the difatty acid esters.
- the content of monofatty acid ester in the end product can be varied by adjusting the molar ratio of fatty acid to isomalt.
- 1 mol of fatty acid (lauric acid; 200.31 g) is used, for example Weighed out 1 mol of isomalt (average molar mass from GPS and GPM dihydrate; 362.33 g) and the esterification components were first intensively stirred in a homogenizer, screw reactor or with a high-speed stirrer at 70 ° C. for one hour. 0.01 to 10% by weight, but preferably 0.1 to 5% by weight, of the alkali metal catalyst are added to this homogeneous, lump-free paste. The reaction temperature is gradually increased to 120 to 140 ° C. and the mixture is esterified under reduced pressure for 2 to 6 hours.
- GPS and GPM (Fig. 3) are in a 1: 1 ratio.
- Signals of the primary C atoms of the open chain C. are 62.97 and 63.93 ppm, respectively.
- the primary carbon atoms on the pyridoside ring C gl coincide in the signal at 61.29 ppm.
- the further table shows the 13C assignment of the launic acid chain in [ppm] (D 2 0):
- the esterification products of other fatty acids (C, 0 to C_) according to the invention were worked up and analyzed in an analogous manner to the lauric acid batch.
- These test results clearly indicate that the mono- and diesters according to the invention of the isomalt are not only new, but primary OH groups (FIGS. 1 and 2) of the isomalt are preferably esterified in the process according to the invention. It is therefore isomalt-1-lauric acid monoester and isomalt-1,6'-lauric acid diester. It is also surprising that, in contrast to the known sucrose esters, the isomaltesters according to the invention have almost no tri and polyester or cracking products.
- the mono- and diesters of isomalt produced in high yields and with a high degree of purity are compounds which represent highly effective detergents, emulsifiers and valuable additives for numerous cosmetics, pharmaceuticals and foods. If desired, these raw materials are alkoxylated with 2 to 150 mol of ethylene oxide and / or propylene oxide in order to expand the application possibilities.
- FIG. 1 shows the structural formulas of the isomalt-1-lauric acid monoester.
- Figure 2 shows the structural formulas of isomalt-1,6'-lauric acid diesters.
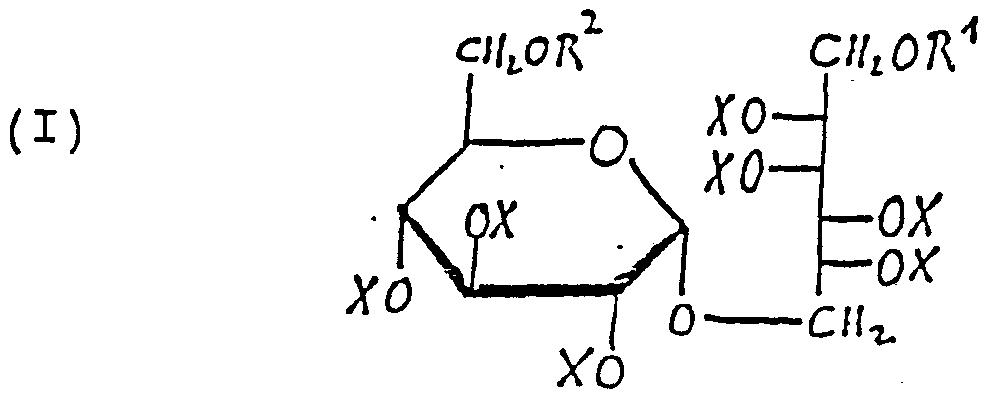
- FIG. 3 shows the two structural formulas of isomalt, namely ⁇ -D-glucopyranosyl-1, 6-mannitol (GPM) and ⁇ -D-glucopyranosyl-1, 6-sorbitol (GPS).
- the conversion based on isomalt was 79.78%.
- Table 2 shows the composition of the isomaltester from Examples 1 to 8.
- Viscosity 6000 to 6500 mPa-s
- Silicone oil 345 1.0% by weight
- Cocoamidopropyl betaine 15.0% by weight
- Cocoamidopropyl betaine 13.5% by weight
Abstract
Gegenstand der Erfindung sind Derivate von Disaccharidalkoholen der allgemeinen Formeln (I) und (II), worin X Wasserstoff oder einen Acylrest einer gesättigten oder ungesättigten Fettsäure mit 8 bis 20 Kohlenstoffatomen oder den Rest (III) bedeutet, wobei R3 Wasserstoff oder eine Methylgruppe darstellt, und n im Bereich 1 bis 20 liegt, R1 und R2 gleich oder verschieden sind und die gleiche Bedeutung haben können wie X, jedoch nicht beide gleichzeitig Wasserstoff sein dürfen wenn X gleich Wasserstoff ist, und Gemische dieser Derivate sowie ein Verfahren zu ihrer Herstellung und ihre Verwendung.
Description
Derivate von Disaccharidalkoholen,
Verfahren zu ihrer Herstellung und ihre Verwendung
Die vorliegende Erfindung betrifft Derivate von Disaccha¬ ridalkoholen, nämlich Fettsäureester und Alkoxylierungs- produkte von α-D-Glucopyranosyl-l,6-mannit, im folgenden GPM genannt, und von α-D-Glucopyranosyl-l,6-sorbit, im folgenden GPS genannt, und von Gemischen dieser beiden Disaccharidalkohole. Die annähernd äguimolare Mischung dieser Disaccharidalkohole ist als Süßungsmittel unter dem Namen Isomalt (Palatinit^ '), bekannt geworden. Die Erfindung betrifft weiterhin Verfahren zur Herstellung dieser neuen Derivate sowie ihre Verwendungen.
Mono- und Disaccharide, wie Gluσose bzw. Saccharose, wer¬ den als nachwachsende Rohstoffe zunehmend für die Her¬ stellung von zahlreichen Spezialprodukten eingesetzt. Seit einigen Jahren werden beispielsweise Saccharoseester als wertvolle milde und biologisch abbaubare Zusätze in der Kosmetik und in der Lebensmittelindustrie verwendet.
Aus Saccharose wird in einem großtechnischen Prozeß über eine enzymatische Transglucosidierung das reduzierende Disaccharid Isomaltulose (Palatinose' ') gewonnen. Die Hydrierung von Isomaltulose in wäßriger neutraler Lösung mit Wasserstoff am Nickel-Katalysator liefert das bekann¬ te Süßungsmittel Isomalt (Palatinit^ ') als annähernd äguimolare Mischung der beiden Isomeren GPM und GPS.
Zur Vereinfachung wird im folgenden auch für jede andere Mischung dieser beiden Isomeren im Bereich von 5 bis 95 Gew.—% GPM bzw. 95 bis 5 Gew.—% GPS die Bezeichnung Isomalt verwendet. Diese sind das Ausgangsmaterial für die neuen erfindungsgemäßen Derivate.
Es ist bekannt, daß die selektive Veresterung von Saccha¬ rose, bedingt durch die begrenzte thermische Stabilität und durch das Vorhandensein mehrerer gleichreaktiver Hydroxylgruppen, mit erheblichen Schwierigkeiten verbun¬ den ist. Bei den bisher bekannten Verfahren zur Herstel¬ lung von Mono- und Disaccharidestern wird die Umsetzung von Methylestern in Gegenwart von organischen basischen Katalysatoren in Dimethylformamid oder Dimethylsulfoxid als Lösungsmittel beschrieben. Ein großer Nachteil dieser Verfahren liegt darin, daß die toxischen Lösungsmittel DMF oder DMSO nach der Umesterung restlos aus dem Reak¬ tionsgemisch entfernt werden müssen (vergl. US-PS 3,251,829, US-PS 3,349,081 nd US-PS 890,206).
In der DE-OS 34 30 944 wird die Herstellung von Saccha¬ roseestern aus Fettsäuren, Zucker und katalytischen Men¬ gen eines lipolytischen Enzyms beschrieben. Die Nachteile dieses Verfahrens liegen darin, daß sehr hohe Enzymmengen von 10 bis 200 Gew.—%, bezogen auf Zucker, eingesetzt werden, und die Reaktionsprodukte erst nach 72 Stunden Reaktionszeit mit den toxischen Lösungsmitteln Chloroform und Tetrahydrofuran gereinigt und aufgearbeitet werden müssen.
Neuerdings ist aus der DE-AS 24 12 374 auch ein lösungs¬ mittelfreies Umesterungsverfahren bekannt geworden. Nach diesem Verfahren, wird die Umsetzung mit geschmolzener Saccharose, Fettsäuretriglyceriden und K,CO (5 bis 10 Gew.-%) bei 125 bis 130βC durchgeführt. Obwohl Isomalt
ein ähnlich hohes Molekulargewicht (344) und eine ähn¬ liche Anzahl von OH-Gruppen (9) besitzt wie Saccharose (Molekulargewicht 342, 8-OH-Gruppen) , läßt sich dieses Verfahren jedoch auf Isomalt kaum übertragen, da die er¬ haltenen Produkte nach kurzer Reaktionszeit sehr dunkel werden, und die Gesamtausbeute an Mono- und Diestern weit unter 30% liegt. Dieses Verfahren liefert dabei ein komplexes Reaktionsgemisch, das in erhöhtem Maße nicht reagierte Ausgangsprodukte enthält.
Die JP-A 59-60439 beschreibt ein Monoestergemisch aus Palatinit* ' (Isomalt) zur Zahnpflege. Es wird ein Palatinit '-Laurinsäuremonoestergemisch mit einem durch¬ schnittlichen Veresterungsgrad von 1,2 und einem Mono- estergehalt von 80% beschrieben, der in üblicher Weise durch Veresterung mit Säurechlorid hergestellt wurde.
Die chemische Zusammensetzung der Isomaltester sowie die Konfiguration dieser Produkte sind bisher im Stand der Technik nicht beschrieben worden. Diese Information ist jedoch sehr wichtig für die Ermittlung der Anwendungs¬ gebiete dieser Verbindungen. Es wurde gefunden, daß reine oder nahezu reine Monoiso altester, bedingt durch ihre hohen HLB-Werte, als ausgezeichnete Löslichkeitsver itt- ler für Parfümingredients, Aromastoffe für Getränke, Backwaren, Konfitüren, Speiseeis und Pharmawirkstoffe dienen können. Sie können ferner für die Herstellung von klaren Sha poos, Badepräparaten sowie als O/W Emulgatoren bei der Herstellung von Schokolade, Pudding, Desserts etc. verwendet werden. Im Gegensatz dazu können die Di- ester oder nahezu reine Diester des Iso alts als hervor¬ ragende milde Verdicker und W/o Emulgatoren für kosme¬ tische Präparate Verwendung finden.
Das technische Problem der vorliegenden Erfindung besteht zunächst in der Bereitstellung von konfigurativ charakte¬ risierten Mono- und Diestern des Isomalts sowie alkoxy- lierten und mehrfach veresterten Derivaten mittels eines Verfahrens zur lösungsmittelfreien Herstellung von neuen Mono- und Diestern sowie Alkoxylierungsprodukten des Isomalts nebst deren Gemischen. Das Verfahren soll in einfacher Weise durchführbar sein und sich somit beson¬ ders für die Anwendung im industriellen Maßstab eignen, gleichzeitig die durch die Verwendung toxischer Lösungs¬ mittel auftretenden Probleme des Standes der Technik ver¬ meiden. Vorzugsweise soll es eine selektive Veresterung an primären OH-Gruppen des Isomalts ermöglichen.
Das technische Problem wird erfindungsgemäß dadurch ge¬ löst, daß Derivate von Disaccharidalkoholen der allge¬ meinen Formeln I und II
bereitgestellt werden, worin X Wasserstoff oder ein Acyl- rest einer gesättigten oder ungesättigten Fettsäure mit 8 bis 20 Kohlenstoffatomen oder den Rest (-CH 2_-C|H-0)n-H
R3 bedeutet, wobei R3 Wasserstoff oder eine Methylgruppe darstellt, und n im Bereich 1 bis 20 liegt, R.. und R_ gleich oder verschieden sind und die gleiche Bedeutung haben können wie X, jedoch nicht beide gleichzeitig Was¬ serstoff sein dürfen wenn X gleich Wasserstoff ist, sowie Gemische dieser Derivate.
Die erfindungsgemäßen Derivate werden dadurch herge¬ stellt, daß α-D-Glucopyranosyl-l,6-mannit oder α-D- Glucopyranosyl-l,6-sorbit oder ein Gemisch derselben ent¬ weder in wäßrig alkalischer Lösung bei erhöhter Tempera¬ tur mit Ethylenoxid oder Propylenoxid umgesetzt werden oder ohne Lösungsmittel in Gegenwart alkalischer Kataly¬ satoren bei erhöhten Temperaturen mit gesättigten oder ungesättigten Fettsäuren mit 8 bis 20 Kohlenstoffatomen umgesetzt und gegebenenfalls anschließend auch noch mit Ethylenoxid oder Propylenoxid umgesetzt werden.
In einer besonderen Ausführungsform werden die erfin¬ dungsgemäßen Derivate oder deren Mischungen mit 2 bis 150 Mol Ethylenoxid bzw. Propylenoxid alkoxyliert.
In einer weiteren bevorzugten Ausführungsform werden die Mono- oder Diester der allgemeinen Formeln I und II (X = H) oder deren Mischungen mit Fettsäuren, Fettsäure¬ estern, -anhydriden oder -halogeniden zu Derivaten, die 3 bis 9 Estergruppen enthalten, umgesetzt.
Als alkalischer Katalysator können Alkali- oder Erd- alkalioxid, -hydroxid, -carbonat -peroxid, -hydrogen-
carbonat oder -alkoholat verwendet werden. Die anorga¬ nischen Salze können als solche oder auch in Kombination mit den Alkoholaten von Natrium, Kalium oder Lithium ver¬ wendet werden. Vorzugsweise besteht der Katalysator aus 0,01 bis 10 Gew.-% dieser Substanzen.
Als Fettsäuren werden bevorzugt Caprinsäure, Laurinsäure, Myristinsäure, Palmitinsäure, Stearinsäure, Isostearin¬ säure, Kokosfettsäure, Ricinolsäure, ölsäure, Linolsäure und Undecylensäure eingesetzt. Anstelle der reinen Fett¬ säuren können auch Fettsäuregemisehe aus natürlichen Fetten eingesetzt werden.
Die Veresterung wird vorzugsweise bei Temperaturen zwi¬ schen 90 und 180βC bei Normaldruck oder im Vakuum durch¬ geführt. Als Alkoholkomponente wird das Isomalt einge¬ setzt.
Ausgehend vom Stand der Technik, wonach die Veresterung der Disaccharide ausschließlich über die Umsetzung von Methylestern in Lösungsmitteln verläuft, ist es äußerst überraschend, daß bei einer direkten Umsetzung mittels eines basischen Katalysators wirksame, helle Produkte ohne Zersetzung oder Karamelisierung und mit erheblich höherem Anteil der gewünschten Mono- und Diester erhalten werden.
Es ist ferner überraschend, daß bei dem erfindungsgemäßen Verfahren bevorzugt nur die primären OH-Gruppen verestert werden, wobei neue Mono- und Diester des Isomalts oder deren Gemische als Hauptreaktionsprodukte entstehen.
Ein weiterer interessanter Aspekt der Erfindung liegt darin, daß sowohl das Isomalt als solches als auch die Mono- und Diester des Isomalts bzw. deren Gemische mit Ethylenoxid bzw. Propylenoxid alkoxyliert werden können, wobei neue nichtionogene Tenside und Emulgatoren für Haut- und Haarpflegemittel erhalten werden.
Im Stand der Technik war es seit langem üblich, die Um- esterungen von Fettsäuremethylestern mit Mono- und Di- sacchariden in Lösungsmitteln, wie z.B. Dimethylformamid, Dimethylsulfoxid oder N-Methylpyrrolidon, durchzuführen. Lediglich einige zuvor beschriebene Tendenzen existier¬ ten, um lösungsmittelfreie Umsetzungen zu entwickeln. Diese führten jedoch, wie eingangs dargestellt, nicht zur Entwicklung eines lösungsmittelfreien Herstellungsverfah¬ rens. Es ist ferner bekannt, daß die beschriebenen Ver¬ fahren in erheblichem Umfang nichtreagierte Ausgangsver¬ bindungen enthalten, die zusätzlich zu den Lösungsmitteln aus dem Reaktionsprodukt entfernt werden müssen. Dieser Aufwand beeinträchtigte die Wirtschaftlichkeit der bis¬ herigen Verfahren in erheblichem Maße.
Bei der erfindungsgemäßen Umsetzung von Fettsäuren mit Isomalt kann das molare Verhältnis von Fettsäure zu Isomalt zwischen 3 : 1 bis 1 : 2 liegen. Es werden dabei bevorzugt nur primäre OH-Gruppen verestert, wobei außer Monofettsaureestern vor allem auch die Difettsäureester entstehen. Der Gehalt von Monofettsäureester im Endpro¬ dukt kann durch Einstellen der molaren Verhältnisse von Fettsäure zu Isomalt variiert werden.
Für die Durchführung des erfindungsgemäßen Verfahrens werden z.B. 1 Mol Fettsäure (Laurinsäure; 200,31 g) mit
1 Mol Isomalt (gemittelte Molmasse aus GPS und GPM-Dihy- drat; 362,33 g) eingewogen und die Veresterungskomponen¬ ten zuerst in einem Homogenisator, Schneckenreaktor oder mit einem hochtourigen Rührer bei 70°C für eine Stunde intensiv gerührt. Zu dieser homogenen , klumpenfreien Paste werden 0,01 bis 10 Gew.-%, bevorzugt jedoch 0,1 bis 5 Gew.-%, des Alkalimetallkatalysators zugegeben. Die Reaktionstemperatur wird stufenweise auf 120 bis 140"C erhöht und es wird bei vermindertem Druck 2 bis 6 Stunden verestert. Nach Beendigung der Reaktion wurde das hell¬ braune pastöse Produkt gaschromatographisch analysiert und der Gehalt an Mono-, Di- und Triestern ermittelt. Um die genaue chemische Struktur der neuen Mono- und Diester des Isomalts zu ermitteln, wurde der obige .Ansatz aus der äquimolaren Umsetzung von Laurinsäure mit Isomalt wie folgt aufgearbeitet und NMR-spektroskopisch analysiert:
100 g des Estergemisches aus der Reaktion von Laurinsäure mit Isomalt wurden mit 100 g Methanol und 300 g Wasser 12 Stunden bei 50βC gerührt. Danach wurde die trübe Reak¬ tionsmischung 24 Stunden bei Raumtemperatur stehengelas¬ sen und anschließend abfiltriert. Der Rückstand, eine helle weiche Paste, wurde im Vakuum getrocknet und das Filtrat am Rotationsverdampfer von den Lösungsmitteln befreit. Die Zusammensetzung der beiden Pasten ist in folgender Tabelle aufgelistet:
100,00 100,00
Isomalt ergibt in 2[H]_-Pyr dιn bzw.D-0 gut aufgelöste und voll interpretierbare 13C-NMR-Spektren. Die Isomeren
GPS und GPM (Fig. 3) liegen im Verhältnis 1 : 1 vor. Die
Signale der primären C-Atome der offenen Kette C. liegen bei 62,97 bzw. 63,93 ppm. Die primären C-Atome am Pyrano- sidring Cgl fallen im Signal bei 61,29 ppm zusammen.
Die nach dem erfindungsgemäßen Verfahren durchgeführte
Veresterung an den primären Hydroxylgruppen des Isomalts führt zu einer signifikanten Verschiebung der NMR Signale
Die analytische HPLC-Trennung des Rückstandes zeigte ne¬ ben dem Monoester eine Anzahl steroisomerer Diester und Triester in sehr kleiner Menge. Mono- und Diester des Isomalts wurden präparativ getrennt (mobile Phase: Methanol/H20 = 10 : 1) .
Die Molekulargewichte der Mono- und Diester des Isomalts wurden mit Hilfe von CI-Massenspektren bestätigt.
Die folgende Tabelle zeigt die 13C-Zuordnung der primären
Isomalt-C-Atome in [ppm] ( 2[H]g-Pyrιdm) :
Die weitere Tabelle zeigt die 13C-Zuordnung der Launn- säurekette in [ppm] (D20) :
In analoger Weise wurden die erfindungsgemäßen Vereste- rungsprodukte anderer Fettsäuren (C,0 bis C_ ) in Ana¬ logie zu dem Laurinsaureansatz aufgearbeitet und analy¬ siert. Diese Untersuchungsergebnisse weisen eindeutig darauf hin, daß die erfindungsgemäßen Mono- und Diester
des Isomalts nicht nur neu sind, sondern bei dem erfin¬ dungsgemäßen Verfahren bevorzugt primäre OH-Gruppen (Fig. 1 und 2) des Isomalts verestert werden. Es handelt sich somit um Isomalt-1-laurinsäuremonoester und Isomalt-1,6'- laurinsäurediester. Es ist ferner überraschend, daß im Gegensatz zu den bekannten Saccharoseestern die erfin¬ dungsgemäßen Isomaltester nahezu keine Tri- und Polyester oder Krackprodukte aufweisen.
Die in hohen Ausbeuten und mit hohem Reinheitsgrad herge¬ stellten Mono- und Diester des Isomalts sind Verbindun¬ gen, die hochwirksame Detergentien, Emulgatoren und wert¬ volle Zusatzstoffe für zahlreiche Kosmetika, Pharmazeu- tika und Lebensmittel darstellen. Diese Rohstoffe werden gewunschtenfalls mit 2 bis 150 Mol Ethylenoxid und/oder Propylenoxid alkoxyliert, um die anwendungstechnischen Möglichkeiten zu erweitern.
Figur 1 zeigt die Strukturformeln der Isomalt-1-laurin- säuremonoester.
Figur 2 zeigt die Strukturformeln der Isomalt-1,6'- laurinsäurediester.
Figur 3 zeigt die beiden Strukturformeln des Isomalt, nämlich α-D-Glucopyranosyl-l,6-mannit (GPM) und α-D- Glucopyranosyl-l,6-sorbit (GPS).
Die folgenden Beispiele stellen besondere Ausführungs¬ formen der Erfindung dar.
BEISPIEL 1
200,31 g (1 Mol) Laurinsäure werden mit 362,33 g (1 Mol) Isomalt eingewogen und mit Hilfe eines Homogenisators, Schneckenreaktors oder eines hochtourigen Rührers bei 70°C eine Stunde intensiv gerührt. Die homogene, klumpen¬ freie Paste wird dann in einen 2-Liter-Dreihalskolben mit Rührer, Thermometer und Wasserabscheider überführt und mit 4,22 g Kaliumcarbonat versetzt. Anschließend wird das Reaktionsgemisch auf 120 bis 125 ' C erhitzt und bei ver¬ mindertem Druck 5 Stunden verestert. Das Vakuum wird so eingestellt, daß noch keine Laurinsäure aus dem Reak¬ tionsgemisch entfernt wird.
Die abgeschiedene Wassermenge betrug 17,2 g. Nach Beendi¬ gung der Reaktion erhielt man 536,35 g eines hellbraunen, pastösen Produktes. Dieses Estergemisch wurde dann mit 536 g Methanol und 1.6 g Wasser 12 Stunden bei 50°C ge¬ rührt, 24 Stunden bei Raumtemperatur stehengelassen und anschließend abfiltriert. Der Rückstand, eine helle wei¬ che Paste, wurde im Vakuum getrocknet und das Filtrat am Rotationsverdampfer von Lösungsmitteln befreit, wobei 83,84 g Reaktionsprodukt angereichert mit nicht umgesetz¬ tem Isomalt erhalten wurden.
Der Rückstand (440 g) enthielt:
55,19 % Iso altmonolaurinsäureester 33,00 % Isomal dilaurinsäureester
4,00 % Isomalttrilaurinsäureester
1,74 % Laurinsäure
0,84 % Isomalt
3,90 % nicht indentif. Komponente
1,33 % Wasser.
Das Produkt aus dem Filtrat (83,84 g) enthielt:
4,74 % Isomaltmonolaurinsäureester 11,52 % Laurinsäure 82,82 % Isomalt.
Der Umsatz bezogen auf Isomalt betrug 79,78 %.
BEISPIELE 2 bis 7
Die Reaktion wurde wie im Beispiel 1 durchgeführt. Die verwendete Fettsäure, das Molverhältnis, Reaktionstempe¬ ratur und -zeit sowie Menge des Katalysators und Konsi¬ stenz und Farbe des Produktes sind in der Tabelle 1 zu- sammgestellt.
BEISPIEL 8
Darstellung von Isomalt-nonadodecanoat
20 g (55.2 mmol) Isomalt oder eine entsprechende Menge an Mono- oder Diester in 200 ml wasserfreiem Pyridin werden unter Rühren innerhalb von 3 Stunden tropfenweise mit 131 ml (552 mmol) Laurinsäurechlorid versetzt.
Nach beendeter Zugabe wird 1 d bei Raumtemperatur weiter¬ gerührt. Die ausgefallenen Salze werden abgesaugt und mit wenig Pentan gewaschen. Die vereinigten F'ltrate werden bei ca. 60βC im Vakuum eingeengt. Der Rückstand wird mit Wasser (200 ml) und Pentan (300 ml) verrührt. Die Pentan¬ phase wird mit 5-%iger Salzsäure (200 ml) und nochmals mit Wasser (200 ml) extrahiert, mit wasserfreiem Natrium¬ sulfat getrocknet und filtriert.
Zur Entfärbung wird die Pentanphase über eine Schicht Aktivkohle/Kieselgel filtriert und anschließend bis zur Trockne eingeengt.
Ausbeute: 70 g (61 % der Theorie) eines schwach gelb ge¬ färbten fettartigen Produktes mit einem Schmelzbereich von 35 bis 39'C.
Dünnschichtchromatographisch (Kieselgel-60, Laufmittel: P Peennttaann :: EEtthheerr == 55 :: 11)) ssiinndd GGPPSS-- ((RRp = 0.57) und GPM- (R„ = 0.61)nonadodecanoat auftrennbar.
Die Struktur beider Produkte konnte nach separater Einzeldarstellung beider Komponenten durch H-NMR-Spek- troskopie (300 MHz, CDC1-) vollständig abgesichert wer¬ den.
Tabelle 2 zeigt die Zusammensetzung der Isomaltester aus den Beispielen 1 bis 8.
TABELLE 1
Beispiel Fettsäure Molverh. Reaktioπs- Reaktions- Katalysator Farbe/Konsistenz Nr. FS /Isomalt temp. zeit Gew. %
°C h
1 : 1,25 130 4,5 0,75 K2C03 weiß / fest
1:1 135 1,00 NaOC2H5 Creme weich/pastös
1:1 135 0,50 K20 weiß / fest
1:1 125-30 5,5 0,50 NaOCHß hell-/transparent 0,50 K20 braun
1:1 125 1,00 L1OCH3 Creme weich pastös
0,25 NaOCH3
TABELLE 2
Beispiel Monoester Diester Triester Fettsäure Isomalt nicht ident. H20 VZ SZ JZ
Komponente Nr. % % % % % % %
1 55,19 3,90
2 56,30 4,00 3 58,00 4,31 4 56,00 3,75 5 50,04 10,20 6 49,20 3,00 7 17,00
4,00 8 Isomaltnonadodecanoat
(VZ = Verseifungszahl; SZ =• Säurezahl; JZ = Jodzahl)
BEISPIEL 9
In einem Druckreaktor mit Produktkreislauf, Heizung, einer Zudosierung für Ethylenoxid, Druck- und Temperatur¬ messung wurden 1.000 g Isomalt und 10 g 45%-iger Kali¬ lauge zugegeben, sorgfältig mit Stickstoff gespült und anschließend bei einer Reaktionstemperatur von 165 bis 170"C mit 1.214 g Ethylenoxid versetzt. Die Reaktion war nach 3 Stunden beendet, inklusive einer Nachreaktionszeit von einer Stunde. Nach dem .Abkühlen auf ca. 30"C wurde mit Schwefelsäure neutralisiert. Es wurde ein bei 20βC klares, hellgelbes öl mit folgenden Kenndaten erhalten:
Hydroxylzahl: 630 bis 670 mg KOH/g
Säurezahl: 2
Viskosität: 6000 bis 6500 mPa-s
Wassergehalt: 0,05 %
BEISPIEL 10
Eine Mischung aus 1.000 g Isomalt und 10 g 45%-iger Kali¬ lauge wurde wie im Beispiel 9 mit 2.428 g Ethylenoxid umgesetzt. Gewonnen wird ein bei 20βC klares, gelbes öl mit folgenden Kenndaten:
Hydroxyzahl: 460 bis 480 mg KOH/g
Säurezahl: 2
Viskosität: 5000 bis 5500 Pa-s
Wassergehalt: 0,1 %.
BEISPIEL 11
Eine Mischung aus 1.000 g Mischester nach Beispiel 2 und 10 g 45%-iger Kalilauge wurde wie im Beispiel 9 mit 1.100 g Ethylenoxid bei 140"C umgesetzt. Das entstandene weiße, wachsartige Produkt hatte folgende Kenndaten:
Verseifungszahl: 45 bis 55
Säurezahl: < 1
Hydroxylzahl: 120 bis 130
Wassergehalt: 0,1 %.
In den nachfolgenden Beispielen werden einige typische Anwendungen der neuen Produkte beschrieben.
BEISPIEL 12
Baby Shampoo
Produkt nach Beispiel 1 2,0 Gew.-%
Produkt nach Beispiel 6 2,0 Gew.-%
Natriumlaurylethersulfat 35,0 Gew.-%
Coσoamidopropylbetain 7,0 Gew.-%
Natriumchlorid 2,0 Gew.-%
Konservierer 0,1 Gew.-%
Wasser 51,9 Gew.-%
100,0 Gew.-%
BEISPIEL 13
Haarkur
Produkt nach Beispiel 3 2,0 Gew.-%
Produkt nach Beispiel 6 2,0 Gew.-%
Cetylstearylalkohol 2,5 Gew.-%
Cetylstearylalkohol mit 20 Mol EO 0,5 Gew.-% Polyglykol-Polyamin Kondensationsharz 2,0 Gew.-%
Glycerin 3,0 Gew.-%
Konservierer 0,1 Gew.-%
Wasser 87,9 Gew.-%
100,0 Gew.-%
BEISPIEL 14
Körperlotion
Produkt nach Beispiel 3 2,5 Gew.-%
Produkt nach Beispiel 5 2,5 Gew.-%
Cetylstearylalkohol mit 20 Mol EO 2,0 Gew.-% Mono- und Diglyceride der Palmitin- und Stearinsäure 8,0 Gew.-%
Capril/Caprinsäuretriglycerid 4,0 Gew.-%
2-Octyldodecanol 8,0 Gew.-%
Konservierer 0,2 Gew.-%
Wasser 72,8 Gew.-%
100,0 Gew.-%
BEISPIEL 15
Feuchtigkeitsσreme
Produkt nach Beispiel 3 2,5 Gew.-%
Produkt nach Beispiel 11 2,5 Gew.-%
Cetylstearylalkohol mit 20 Mol EO 2,0 Gew.-% Mono- und Diglyceride der Palmitin- und Stearinsäure 8,0 Gew.-%
Capril/Caprinsäuretriglycerid 4,0 Gew.-%
2-Octyldodecanol 8,0 Gew.-%
Konservierer 0,2 Gew.-%
Wasser 72,8 Gew.-%
100,0 Gew.-%
BEISPIEL 16
Körperlotion
Produkt nach Beispiel 3 3,0 Gew.-%
Produkt nach Beispiel 2 2,0 Gew.-%
Cetylstearylalkohol 1,0 Gew.-%
Capryl-/Caprinsäuretriglycerid 5,0 Gew.-%
Siliconöl 345 1,0 Gew.-%
1,2-Propylenglykol 2,0 Gew.-%
Citronensäure 0,4 Gew.-%
Konservierer 0,1 Gew.-%
Wasser 85,5 Gew.-%
100,0 Gew.-%
BEISPIEL 17
Schaumbad
Produkt nach Beispiel 6 2,5 Gew.-%
Produkt nach Beispiel 7 2,0 Gew.-%
Natriumlaurylethersulfat 35,0 Gew.-%
Cocoa idopropylbetain 12,0 Gew.-%
Natriumchlorid 1,5 Gew.-%
Konservierer 0,1 Gew.-%
Wasser 46,9 Gew.-%
100,0 Gew.-%
BEISPIEL 18
Intim-Waschpflegemittel
Produkt nach Beispiel 3 5,0 Gew.-%
Natriumlaurylethersulfat 25,0 Gew.-%
Cocoamidopropylbetain 15,0 Gew.-%
1,2-Propylenglykol 2,0 Gew.-%
Natriumchlorid 0,5 Gew.-%
Konservierer 0,1 Gew.-%
Wasser 52,4 Gew.-%
100,0 Gew.-%
BEISPIEL 19
Intimpflege-Waschmittel
Produkt nach Beispiel 3 5,0 Gew.-%
Produkt nach Beispiel 9 3,0 Gew.-%
Natriumlaurylethersulfat 23,5 Gew.-%
Cocoamidopropylbetain 13,5 Gew.-%
1,2-Propylenglykol 2,0 Gew.-%
Natriumchlorid 0,5 Gew.-%
Konservierer 0,1 Gew.-%
Wasser 52,4 Gew.-%
100,0 Gew.-%
Claims
1. Derivate von Disaccharidalkoholen der allgemeinen Formeln I und II
worin X Wasserstoff oder einen Acylrest einer gesättigten oder ungesättigten Fettsäure mit 8 bis 20
Kohlenstoffatomen oder den Rest (-CH 2--C \H-0)n-H
bedeutet, wobei R_ Wasserstoff oder eine Methylgruppe darstellt, und n im Bereich 1 bis 20 liegt, R und R_ gleich oder verschieden sind und die gleiche Bedeutung haben können wie X, jedoch nicht beide gleichzeitig Wasserstoff sein dürfen wenn X gleich Wasserstoff ist, sowie deren Isomerengemische.
2. Verfahren zur Herstellung von Derivaten gemäß Anspruch 1, dadurch gekennzeichnet, daß α-D-Glucopyranosyl-1,6- mannit oder α-D-Glucopyranosyl-l,6-sorbit oder Ge¬ mische derselben a) entweder in wäßrig-alkalischer Lösung bei erhöhter Temperatur mit Ethylenoxid oder Propylenoxid umge¬ setzt oder b) ohne Lösungsmittel in Gegenwart alkalischer Kataly¬ satoren bei erhöhten Temperaturen mit gesättigten oder ungesättigten Fettsäuren mit 8 bis 20 Kohlen¬ stoffatomen umgesetzt und gegebenenfalls anschlie¬ ßend auch noch mit Ethylenoxid oder Propylenoxid umgesetzt werden.
3. Verfahren nach Anspruch 2, dadurch gekennzeichnet, daß mit 2 bis 150 Mol Ethylenoxid bzw. Propylenoxid alk- oxyliert wird.
4. Verfahren nach den Ansprüchen 2 und 3, dadurch gekenn¬ zeichnet, daß Mono- oder Diester gemäß den allgemeinen Formeln I und II (X = H) oder deren Mischungen mit Fettsäuren, Fettsäureestern, -anhydriden oder -halo- geniden zu Derivaten, die 3 bis 9 Estergruppen ent¬ halten, umgesetzt werden.
5. Verfahren nach den Ansprüchen 2 bis 4, dadurch gekenn¬ zeichnet, daß als alkalischer Katalysator ein Alkali¬ oder Erdalkalioxid, -hydroxid, -carbonat, -hydrogen- carbonat, -peroxid oder -alkoholat verwendet wird.
6. Verfahren nach den Ansprüchen 2 bis 5, dadurch gekenn¬ zeichnet, daß Mischungen verschiedener Fettsäuren aus natürlichen Fetten verwendet werden.
7. Verfahren nach den Ansprüchen 2 bis 6, dadurch gekenn¬ zeichnet, daß die Veresterung bevorzugt bei Tempera¬ turen zwischen 90βC und 180°C bei Normaldruck oder im Vakuum durchgeführt wird.
8. Verwendung der Verbindungen nach Anspruch 1 als Tenside, Emulgatoren, Feuchthaltemittel und Fett¬ ersatzstoffe in Haut- und Haarpflegemitteln, Phar a- zeutika und Lebensmitteln.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DEP4103681.6 | 1991-02-07 | ||
| DE19914103681 DE4103681C2 (de) | 1991-02-07 | 1991-02-07 | Derivate von Disaccharidalkoholen, Verfahren zu ihrer Herstellung und ihre Verwendung |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO1992013866A1 true WO1992013866A1 (de) | 1992-08-20 |
Family
ID=6424556
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP1992/000235 WO1992013866A1 (de) | 1991-02-07 | 1992-02-04 | Derivate von disaccharidalkoholen, verfahren zu ihrer herstellung und ihre verwendung |
Country Status (2)
| Country | Link |
|---|---|
| DE (1) | DE4103681C2 (de) |
| WO (1) | WO1992013866A1 (de) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0611024A2 (de) * | 1993-02-10 | 1994-08-17 | AUF ANALYTIK UMWELTTECHNIK FORSCHUNG GmbH | Grenzflächenchemisch aktive Verbindungen aus mikrobiellen Biomassen |
| WO1995009691A1 (de) * | 1993-10-05 | 1995-04-13 | Brigitte Olschewski | Grenzflächenchemisch aktive verbindungen aus nachwachsenden rohstoffen |
| WO1995019366A1 (de) * | 1994-01-17 | 1995-07-20 | Henkel Kommanditgesellschaft Auf Aktien | Pseudoceramide |
| EP0666302A1 (de) * | 1994-02-08 | 1995-08-09 | AUF ANALYTIK UMWELTTECHNIK FORSCHUNG GmbH | Wasserlösliche Tensidmischungen aus mikrobiellen Biomassen |
| WO1997008958A1 (de) * | 1995-09-02 | 1997-03-13 | Südzucker Aktiengesellschaft | Zuckerfreie dragierte produkte |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE19805918A1 (de) * | 1998-02-13 | 1999-08-19 | Beiersdorf Ag | Lipidreduzierte Zubereitungen |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2423278A1 (de) * | 1973-05-15 | 1974-12-05 | Amsterdam Chem Comb | Verfahren zur herstellung von carbonsaeureestern |
| GB2038182A (en) * | 1978-12-29 | 1980-07-23 | Lion Fat Oil Co Ltd | Oral composition |
| FR2499576A1 (fr) * | 1981-02-12 | 1982-08-13 | Hayashibara Biochem Lab | Cristaux anhydres de maltitol, hydrolysat d'amidon, hydrogene, cristallin, contenant ces cristaux, et procedes pour leur preparation et leur utilisation |
| GB2140452A (en) * | 1983-05-11 | 1984-11-28 | Lion Corp | Shampoo compositions |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BE593754A (de) * | 1959-08-12 | |||
| US3102114A (en) * | 1961-04-03 | 1963-08-27 | Komori Saburo | Polyoxyethylene derivatives of esters of sucrose with long-chain fatty acids |
| DE1270021B (de) * | 1963-03-21 | 1968-06-12 | Bayer Ag | Verfahren zur Abtrennung nicht-umgesetzter Zucker aus dem bei der Herstellung von Zuckerfettsaeureestern aus Fettsaeurealkylestern und ueberschuessigen Mengen an Zuckernin Dimethylformamid, Dimethylacetamid, Dialkylsulfoxyd oder Butyrolacton erhaltenenReaktionsgemisch |
| US3349081A (en) * | 1963-06-26 | 1967-10-24 | Ledoga Spa | Process for preparing sucrose esters of high molecular weight fatty acids |
| GB1082673A (en) * | 1964-06-10 | 1967-09-06 | Pfizer Ltd | Polyethers |
| GB1399053A (en) * | 1973-03-16 | 1975-06-25 | Tate & Lyle Ltd | Process for the production of surface active agents comprising sucrose esters |
| US4614718A (en) * | 1983-08-23 | 1986-09-30 | Dai-Ichio Kogyo Seiyaku Co., Ltd. | Synthesis of sugar or sugar-alcohol fatty acid esters |
-
1991
- 1991-02-07 DE DE19914103681 patent/DE4103681C2/de not_active Expired - Fee Related
-
1992
- 1992-02-04 WO PCT/EP1992/000235 patent/WO1992013866A1/de active Application Filing
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2423278A1 (de) * | 1973-05-15 | 1974-12-05 | Amsterdam Chem Comb | Verfahren zur herstellung von carbonsaeureestern |
| GB2038182A (en) * | 1978-12-29 | 1980-07-23 | Lion Fat Oil Co Ltd | Oral composition |
| FR2499576A1 (fr) * | 1981-02-12 | 1982-08-13 | Hayashibara Biochem Lab | Cristaux anhydres de maltitol, hydrolysat d'amidon, hydrogene, cristallin, contenant ces cristaux, et procedes pour leur preparation et leur utilisation |
| GB2140452A (en) * | 1983-05-11 | 1984-11-28 | Lion Corp | Shampoo compositions |
Non-Patent Citations (3)
| Title |
|---|
| CHEMICAL ABSTRACTS, vol. 104, no. 10, 10. M{rz 1986, Columbus, Ohio, US; abstract no. 74837, 'dentifrices containing palatinose fatty acid esters' Seite 378 ;Spalte 2 ; * |
| JOURNAL OF THE AMERICAN OIL CHEMISTS SOCIETY Bd. 52, Juli 1975, Seiten 256 - 258; F. SCHOLNICK ET AL.: 'Lactose-Derived Surfactants: Fatty Esters of Lactitol' * |
| JOURNAL OF THE AMERICAN OIL CHEMISTS SOCIETY Bd. 54, Oktober 1977, Seiten 430 - 432; F. SCHOLNICK ET AL.: 'Lactose Derived Surfactants (III): Fatty Esters of Oxyalkylated Lactitol' * |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0611024A2 (de) * | 1993-02-10 | 1994-08-17 | AUF ANALYTIK UMWELTTECHNIK FORSCHUNG GmbH | Grenzflächenchemisch aktive Verbindungen aus mikrobiellen Biomassen |
| EP0611024A3 (de) * | 1993-02-10 | 1995-03-15 | Auf Analytik Umwelttech Forsch | Grenzflächenchemisch aktive Verbindungen aus mikrobiellen Biomassen. |
| WO1995009691A1 (de) * | 1993-10-05 | 1995-04-13 | Brigitte Olschewski | Grenzflächenchemisch aktive verbindungen aus nachwachsenden rohstoffen |
| WO1995019366A1 (de) * | 1994-01-17 | 1995-07-20 | Henkel Kommanditgesellschaft Auf Aktien | Pseudoceramide |
| EP0666302A1 (de) * | 1994-02-08 | 1995-08-09 | AUF ANALYTIK UMWELTTECHNIK FORSCHUNG GmbH | Wasserlösliche Tensidmischungen aus mikrobiellen Biomassen |
| WO1997008958A1 (de) * | 1995-09-02 | 1997-03-13 | Südzucker Aktiengesellschaft | Zuckerfreie dragierte produkte |
| EP1013175A1 (de) * | 1995-09-02 | 2000-06-28 | Südzucker Aktiengesellschaft Mannheim/Ochsenfurt | Zuckerfreie dragierte Produkte |
Also Published As
| Publication number | Publication date |
|---|---|
| DE4103681C2 (de) | 1994-11-24 |
| DE4103681A1 (de) | 1992-08-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE19750526A1 (de) | Ascorbinsäurederivate enthaltende kosmetische und pharmazeutische Zubereitungen | |
| DE3729844A1 (de) | Verfahren zur herstellung von alkyloligoglycosiden | |
| EP0703962B1 (de) | Ultramilde tensidmischungen | |
| DE4435495C2 (de) | Pumpfähige wäßrige Tensidkonzentrate | |
| WO1992013866A1 (de) | Derivate von disaccharidalkoholen, verfahren zu ihrer herstellung und ihre verwendung | |
| EP1436306B1 (de) | Verfahren zur herstellung von tensidgemischen | |
| EP0268974B1 (de) | Verfahren zur Herstellung von Gemischen aus mono- und oligomeren Kohlenhydratestern, die so erhältlichen Kohlenhydratestergemische und ihre Verwendung | |
| EP0621283B1 (de) | Fettsäureester von Methylglucosid-Derivaten | |
| DE2734059C3 (de) | Verfahren zur Herstellung von teilweise neutralisierten Mischestern aus Milchsäure, Zitronensäure und partiellen Glycerinfettsäureestern | |
| EP0703963B1 (de) | Ultramilde tensidmischungen | |
| DE3619796A1 (de) | Verfahren zur herstellung von alkyloligoglycosiden | |
| EP3285732B1 (de) | Isosorbiddiester als perlglanzmittel und trübungsmittel | |
| EP1656337A1 (de) | Citronens ureester | |
| DE60023544T2 (de) | Zusammensetzungen enthaltend eine kombination von defi und modifizierten defi und verfahren zur herstellung | |
| DE4433070C1 (de) | Milde Detergensgemische | |
| DE2459221A1 (de) | Verfahren zur herstellung von 1-aethyl-2-(2'-methoxy-5'-sulfamoyl- benzamidomethyl)-pyrrolidin | |
| EP0843659B1 (de) | Polyhydroxyalkyl-amidaminoxide | |
| EP1589022B1 (de) | Verfahren zur Herstellung eines Gemischs enthaltend Fettalkohole und APG- ethercarboxylat | |
| DE3904247A1 (de) | N-polyhydroxy-n'-alkylharnstoffderivate, verfahren zu ihrer herstellung und verwendung derselben | |
| EP1572706B1 (de) | Verfahren zur herstellung von alkyl- und/oder alkenyloliglykosidcarbons ure-salzen | |
| DE4430851C1 (de) | Dicarbonsäureesterderivate mit einem Diacyloxypropylrest | |
| DE19622613C2 (de) | Kosmetische und/oder pharmazeutische Emulsionen | |
| WO1997019915A1 (de) | Sulfosuccinate von polyhydroxyamiden | |
| WO2000039137A2 (en) | Regiospecific synthesis of glucose-based surfactants | |
| Bogaert et al. | New coupling method without heavy metals for the synthesis of a new class of fatty acid methyl ester oligoglycoside ethers |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| AK | Designated states |
Kind code of ref document: A1 Designated state(s): JP US |
|
| AL | Designated countries for regional patents |
Kind code of ref document: A1 Designated state(s): AT BE CH DE DK ES FR GB GR IT LU MC NL SE |
|
| DFPE | Request for preliminary examination filed prior to expiration of 19th month from priority date (pct application filed before 20040101) | ||
| 122 | Ep: pct application non-entry in european phase |