RU2741007C1 - Способ получения эритрулозы из дигидроксиацетона и формальдегида - Google Patents
Способ получения эритрулозы из дигидроксиацетона и формальдегида Download PDFInfo
- Publication number
- RU2741007C1 RU2741007C1 RU2020113607A RU2020113607A RU2741007C1 RU 2741007 C1 RU2741007 C1 RU 2741007C1 RU 2020113607 A RU2020113607 A RU 2020113607A RU 2020113607 A RU2020113607 A RU 2020113607A RU 2741007 C1 RU2741007 C1 RU 2741007C1
- Authority
- RU
- Russia
- Prior art keywords
- erythrulose
- dihydroxyacetone
- formaldehyde
- yield
- conversion
- Prior art date
Links
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/06—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of zinc, cadmium or mercury
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/70—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper
- B01J23/74—Iron group metals
- B01J23/745—Iron
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/70—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper
- B01J23/74—Iron group metals
- B01J23/75—Cobalt
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H3/00—Compounds containing only hydrogen atoms and saccharide radicals having only carbon, hydrogen, and oxygen atoms
- C07H3/02—Monosaccharides
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Catalysts (AREA)
Abstract
Изобретение может быть использовано в химической промышленности и относится к способу получения эритрулозы. Предложен способ получения эритрулозы из дигидроксиацетона и формальдегида методом альдольной конденсации, характеризующийся тем, что процесс альдольной конденсации формальдегида и дигидроксиацетона проводят при нагревании до температуры не выше 80°С в водном растворе при рН 7,54-8,71, где pH регулируется количеством введенного гетерогенного катализатора, представляющего собой цеолитоподобный имидазолятный каркас ZIF, образованный катионами Zn(II), Co(II), Fe(II), Cd(II) и органическими линкерами, выбранными из имидазола, 2-метилимидазола, 2-этилимидазола и имидазол-2-карбоксиальдегида. Предложен новый эффективный способ получения эритрулозы. 4 з.п. ф-лы, 3 табл., 21 пр.
Description
Изобретение относится к синтезу природных моносахаридов, а именно, к синтезу эритрулозы (S-1,3,4-тригидрокси-2-бутанон, L-глицеро-2-тетрулоза) из несахароподобного сырья - дигидроксиацетона (ДГА) и формальдегида в присутствии цеолитоподобных имидазолятных каркасов. В природе эритрулоза встречается в спелых красных ягодах (например, малины), поэтому ее называют малиновым сахаром. Эритрулоза используется в косметических средствах для автозагара, чаще всего в комбинации с дигидроксиацетоном благодаря тому, что может вступать в реакцию с аминокислотой кератинсульфата наружного слоя кожи, придавая коже коричневый оттенок. Эритрулоза также используется как интермедиат для синтеза некоторых противоинфекционных препаратов.
Промышленно эритрулозу выделяют из натурального сырья (ягод малины) или получают биотехнологическим методом из молекул полисахаридов в присутствии бактерии Gluconobacter senedeus [T.K. Lindhorst, Essentials of carbohydrate chemistry and biochemistry - 1st. Wiley-VCH, 2007. ISBN 3-527-31528-4]. С применением бактерий и ферментов в качестве катализаторов возможно получение эритрулозы также из других органических соединений [US 2019136278, C12N 9/04, 09.05.2019; WO 0142483, C12P 19/02, 14.06.2001; DE 102008006101, C12P 19/02, 30.07.2009]. Например, описан синтез L-эритрулозы из эритрола ((2R,3S)-бутан-1,2,3,4-тетрол, мезоэритрит, эритриол, эритритол, E968)
в присутствии бактерий Acetobacter suboxydans (ATCC 621) в среде, содержащей пептон и дрожжевой экстракт, или дрожжевой экстракт и карбонат кальция [CN 103952334, C12N 1/20, 25.03.2014]. Недостатком этого способа является низкий выход 23% L-эритрулозы.
Показана возможность получения эритрулозы из смеси эритрола и глицерина в присутствии дрожжей Yarrowia lipolytica (W29 RIY210) [WO 2017194424, C12N 9/32, 16.11.2017]. В результате катаболизма эритрола (процесса метаболического распада) конверсия эритритола в эритрулозу может достигать 65% с производительностью по эритролу 0,59-1,05 г/(л·ч), а по эритрулозе – 0,20 г/(л·ч).
Общими недостатками биотехнологических методов является низкие скорости реакции, высокая стоимость исходных соединений, а также необходимость отделения продуктов от дрожжевой или бактериальной биомассы.
Из гидроксипирувата литиевой соли и гликолевого альдегида в присутствии биогибридного катализатора, состоящего из ферментов (транскетолазы), иммобилизованных на слоистые двойные гидроксиды Zn2Al-NO3 и Mg2Al-NO3, эритрулоза получается с выходом 56%
[K. Benaissi, V. Helaine, V. Prevot, C. Forano, L. Hecqueta, Efficient immobilization of yeast transketolase on layered double hydroxides and application for ketose synthesis, Adv. Synth. Catal., 353 (2011) 1497-1509].
Описаны примеры селективного синтеза эритрулозы из формальдегида в неводных растворителях, таких как ДМФА и ДМСО, в присутствии в качестве катализаторов органических соединений - 2-диметиламиноэтанола и тиамингидрохлорида [Y. Shigemasa, A. Okano, H. Saimoto, R. Nakashima, The favored Formation DL-glycero-tetrulose in the Formose reaction, Carbohydr. Res., 162 (1987) С1-С3]. Однако выход эритрулозы в их присутствии не превышает 23%.
Показано [A.L. Weber, The sugar model: Catalysis by amines and amino acid products, Origins of Life and Evolution of the Biosphere, 31 (2001) 71-86], что проведение реакции альдольной конденсации 30 мМ формальдегида и 20-30 мМ гликолевого альдегида в течение 5-6 дней при 50°С в присутствии 10 мМ аммиака или аминов (включая аминокислоты, например, аланин) и 200 мМ ацетата натрия (рН реакционной смеси 5.5) эритрулоза образуется в количестве 2.5-3%
Альдольная конденсация формальдегида и дигидроксиацетона также позволяет получать эритрулозу
В качестве катализаторов этой реакции предлагают использовать никельфосфатные цеолитоподобные структуры (VSB-5) [.V. Delidovich, M.N. Timofeeva, A. Yu. Orlov, V.N. Panchenko, Zubair Hasan, S.H. Jhung, O.P. Tarana, V.N. Parmon, Nickel phosphate molecular sieves VSB-5 as heterogeneous catalysts for synthesis of monosaccharides from formaldehyde and dihydroxyacetone, New J. Chem., 36 (2012) 2201-2204]. В присутствии 0,03 мас.% VSB-5 при 80°С за 2 ч реакции конверсия дигидроксиацетона составляет 39%, а выход эритрулозы - 49%.
Наиболее близким решением к предлагаемому изобретению является синтез эритрулозы из формальдегида и дигидроксиацетона в присутствии фосфатных катализаторов в нейтральных водных средах (pH 7,0-7,7) при 80°С [A.N. Simonov, L.G. Matvienko, O.P. Pestunova, V.N. Parmon, N.A. Komandrova, V.A. Denisenko and V.E. Vas'kovskii, Selective synthesis of erythrulose and 3-pentulose from formaldehyde and dihydroxyacetone catalyzed by phosphates in a neutral aqueous medium, Kinet. Catal., 48 (2007) 550-555]. В цитированной работе показана возможность применения как гомогенного, так и гетерогенного катализаторов (таблица 1). Альдольная конденсация формальдегида и дигидроксиацетона в растворе фосфатного буфера (Na2HPO4+KH2PO4), рН 7.3, позволяет получать эритрулозу за 0.75 ч с выходом 46%. Недостатком этого метода является проблема отделения фосфатов от продуктов реакции. В присутствии гетерогенных фосфатных катализаторов, таких как Сa3(PO4)2 и природный гидроксиапатит, эритрулоза также образуется с высоким выходом [A.N. Simonov, L.G. Matvienko, O.P. Pestunova, V.N. Parmon, N.A. Komandrova, V.A. Denisenko and V.E. Vas'kovskii, Selective synthesis of erythrulose and 3-pentulose from formaldehyde and dihydroxyacetone catalyzed by phosphates in a neutral aqueous medium, Kinet. Catal., 48 (2007) 550-555]. Стоит отметить, что рН раствора 7,3 достигается за счет частичного гидролиза и вымывания фосфатных солей. В присутствии этих катализаторов в количестве 1 мас.% при 40°С за 100 ч реакции выход эритрулузы составляет 45-50% при 70-85% конверсии ДГА (табл. 1).
Способы по прототипу обладают следующими недостатками:
- Необходимость проведения процесса в гомогенных условиях.
- Необходимость проведения процесса при высоких загрузках катализатора.
- Необходимость проведения процесса при длительных временах контакта.
- Значительное количество побочных продуктов.
Задачей изобретения является разработка каталитического способа получения эритрулозы из дигидроксиацетона и формальдегида в присутствии гетерогенных каталитических систем.
Поставленная задача решается тем, что процесс альдольной конденсации формальдегида и дигидроксиацетона проводят при температуре не выше 80°С, предпочтительно при 60°С, в водном растворе при рН 7,54-8,71, который регулируется количеством введенного катализатора, представляющего собой цеолитоподобный имидазолятный каркас (ZIF), образованный катионами Zn(II), Co(II), Fe(II), Cd(II) и органическими линкерами, такими как имидазол (Im), 2-метилимидазол (mIm), 2-этилимидазол (eIm) и имидазол-2-карбоксиальдегид (ica) (таблица 2), причем концентрацию катализатора берут в пределах 0,01-0,035 мас.%, предпочтительно 0.01 мас.%, процесс ведут в течение 0.5-5 ч, предпочтительно 0.5 ч.
Цеолитоподобный имидазолятный каркас (ZIF) может быть получен в соответствии с известными в литературе способами [Y.-R. Lee, M.-S. Jang, H.-Y. Cho, H.-J. Kwon, S. Kim, W.-S. Ahn, ZIF-8: A comparison of synthesis methods, Chem. Eng. J., 271 (2015) 276-280; B.N. Bhadra, P.W. Seo, N.A. Khan, S.H. Jhung, Hydrophobic cobalt-ethylimidazolate frameworks: phase-pure syntheses and possible application in cleaning of contaminated water, Inorg. Chem., 55 (2016) 11362-11371; J. Qian, F. Sun, L. Qin, Hydrothermal synthesis of zeolitic imidazolate framework-67 (ZIF-67) nanocrystals, Mater. Lett., 82 (2012) 220-223; W. Morris, C.J. Doonan, H. Furukawa, R. Banerjee, O.M. Yaghi, Crystals as molecules: Postsynthesis covalent functionalization of zeolitic imidazolate frameworks, J. Am. Chem. Soc., 130 (2008) 12626-12627].
Сущность изобретения иллюстрируется следующими примерами.
Пример 1. В стеклянный реактор объемом 250 мл, снабженный магнитной мешалкой и обратным холодильником, загружают 1,35 мл (7.5 М) раствора формальдегида, 45 мг (0,5 мМ) дигидроксиацетона, 100 мл воды, очищенной с помощью установки Milli-Q (Millipore, США), 35 мг (0.035 мас.%) катализатора ZIF-8 и смесь нагревают до 80°С. В этих условиях рН реакционного раствора составляет 8,36. Реакционную массу выдерживают при интенсивном перемешивании (1000 об/мин) в течение 0,5 ч. ZIF-8 получают из нитрата цинка и 2-метилимидазола по методике, описанной в работе [Y.-R. Lee, M.-S. Jang, H.-Y. Cho, H.-J. Kwon, S. Kim, W.-S. Ahn, ZIF-8: A comparison of synthesis methods, Chem. Eng. J., 271 (2015) 276-280]. Реакционный раствор анализируют методом высокоэффективной жидкостной хроматографии на хроматографе Shimadzu Prominence LC-20. Концентрацию формальдегида определяют спектрофотометрическим методом с предварительной дериватизацией хромотроповой кислотой. Конверсия дигидроксиацетона составляет 43%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 45, 24 и 3%, соответственно.
Пример 2. Аналогичен примеру 1, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 1 ч. Конверсия дигидроксиацетона составляет 60%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 38, 33 и 9%, соответственно.
Пример 3. Аналогичен примеру 1, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 5 ч. Конверсия дигидроксиацетона составляет 86%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 21, 27 и 46%, соответственно.
Пример 4. Аналогичен примеру 1, отличие состоит в том, что в реактор загружают 10 мг (0,01 мас.%) катализатора. В этих условиях рН реакционного раствора составляет 7,54. Конверсия дигидроксиацетона составляет 26%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 40, 22 и 0%, соответственно.
Пример 5. Аналогичен примеру 4, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 1 ч. Конверсия дигидроксиацетона составляет 31%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 41, 25 и 3%, соответственно.
Пример 6. Аналогичен примеру 4, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 2 ч. Конверсия дигидроксиацетона составляет 53%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 49, 27 и 5%, соответственно.
Пример 7. Аналогичен примеру 1, отличие состоит в том, что реакцию проводят при 65°С. В этих условиях рН реакционного раствора составляет 8,36. Конверсия дигидроксиацетона составляет 26%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 56, 23 и 0%, соответственно.
Пример 8. Аналогичен примеру 7, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 1 ч. Конверсия дигидроксиацетона составляет 42%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 54, 22 и 1%, соответственно.
Пример 9. Аналогичен примеру 6, отличие состоит в том, что реакцию проводят при 65°С. В этих условиях рН реакционного раствора составляет 7,54. Конверсия дигидроксиацетона составляет 22%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 52, 21 и 2%, соответственно
Пример 10. Аналогичен примеру 9, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 4 ч. Конверсия дигидроксиацетона составляет 38%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 49, 23 и 0%, соответственно
Пример 11. Аналогичен примеру 1, отличие состоит в том, что в качестве катализатора используют ZIF-14, полученный из нитрата цинка и 2-этилимидазола по методике, описанной в работе [B.N. Bhadra, P.W. Seo, N.A. Khan, S.H. Jhung, Hydrophobic cobalt-ethylimidazolate frameworks: phase-pure syntheses and possible application in cleaning of contaminated water, Inorg. Chem., 55 (2016) 11362-11371]. В этих условиях рН реакционного раствора составляет 8.60. Конверсия дигидроксиацетона составляет 50%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 38, 27 и 12%, соответственно.
Пример 12. Аналогичен примеру 11, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 1 ч. Конверсия дигидроксиацетона составляет 57%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 35, 31 и 14%, соответственно.
Пример 13. Аналогичен примеру 1, отличие состоит в том, что в качестве катализатора использовали ZIF-71, полученный из нитрата цинка и 2-этилимидазола по методике, описанной в работе [B.N. Bhadra, P.W. Seo, N.A. Khan, S.H. Jhung, Hydrophobic cobalt-ethylimidazolate frameworks: phase-pure syntheses and possible application in cleaning of contaminated water, Inorg. Chem., 55 (2016) 11362-11371]. В этих условиях рН реакционного раствора составляет 8.71. Конверсия дигидроксиацетона составляет 66%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 33, 28 и 14%, соответственно.
Пример 14. Аналогичен примеру 13, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 1 ч. Конверсия дигидроксиацетона составляет 74%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 30, 28 и 15%, соответственно.
Пример 15. Аналогичен примеру 13, отличие состоит в том, что в реактор загружают 10 мг (0,01 мас.%) катализатора и реакционную массу выдерживают при интенсивном перемешивании в течение 0,5 ч при 65°С. В этих условиях рН раствора составляет 7.54. Конверсия дигидроксиацетона составляет 15%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 60, 19 и 0%, соответственно.
Пример 16. Аналогичен примеру 15, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 1 ч. Конверсия дигидроксиацетона составляет 21%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 54, 22 и 0%, соответственно.
Пример 17. Аналогичен примеру 15, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 2 ч. Конверсия дигидроксиацетона составляет 26%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 50, 24 и 1%, соответственно.
Пример 18. Аналогичен примеру 2, отличие состоит в том, что в качестве катализатора использовали ZIF-67, полученный из нитрата кобальта и 2-метилимидазола по методике, описанной в работе [J. Qian, F. Sun, L. Qin, Hydrothermal synthesis of zeolitic imidazolate framework-67 (ZIF-67) nanocrystals, Mater. Lett., 82 (2012) 220-223]. В этих условиях рН реакционного раствора составляет 8.32. Конверсия дигидроксиацетона составляет 13%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 35, 23 и 2%, соответственно.
Пример 19. Аналогичен примеру 18, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 5 ч. Конверсия дигидроксиацетона составляет 21%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 28, 27 и 9%, соответственно.
Пример 20. Аналогичен примеру 2, отличие состоит в том, что в качестве катализатора использовали ZIF-90, полученный из нитрата кобальта и имидазол-2-карбоксиальдегида по методике, описанной в работе [W. Morris, C.J. Doonan, H. Furukawa, R. Banerjee, O.M. Yaghi, Crystals as molecules: Postsynthesis covalent functionalization of zeolitic imidazolate frameworks, J. Am. Chem. Soc., 130 (2008) 12626-12627]. В этих условиях рН реакционного раствора составляет 8,34. Конверсия дигидроксиацетона составляет 25%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 33, 31 и 8%, соответственно.
Пример 21. Аналогичен примеру 20, отличие состоит в том, что реакционную массу выдерживают при интенсивном перемешивании в течение 5 ч. Конверсия дигидроксиацетона составляет 36%, выход эритрулозы, пентоз (арабинозы и рибозы) и гексоз (фруктозы и глюкозы) - 25, 35 и 17%, соответственно.
Обобщенные данные по результатам проведения процесса по примерам 1-21 приведены в таблице 3. Конверсия ДГА рассчитана как выход продукта на количество прореагировавшего дигидроксиацетона.
Приведенные в таблице 3 результаты демонстрируют:
1. Влияние продолжительности процесса и температуры реакции на конверсию дигидроксиацетона и выход эритрулозы концентрации катализатора;
2. Возможность регулирования выхода эритрулозы изменением структуры цеолитоподобного имидазолятного каркаса, а также варьированием концентрации выбранного катализатора.
Таким образом, предлагаемый гетерогенный способ получения эритрулозы из ДГА и формальдегида в присутствии цеолитоподобных имидазолятных каркасов позволяет сделать процесс более технологичным, при этом сохраняется выход целевого продукта, что может быть использовано в промышленном применении.
Таблица 1 - Получение эритрулозы из формальдегида (0.1 моль/л) и ДГА (5 ммоль/л) в присутствии фосфатных каталитических систем [A.N. Simonov, L.G. Matvienko, O.P. Pestunova, V.N. Parmon, N.A. Komandrova, V.A. Denisenko and V.E. Vas'kovskii, Selective synthesis of erythrulose and 3-pentulose from formaldehyde and dihydroxyacetone catalyzed by phosphates in a neutral aqueous medium, Kinet. Catal., 48 (2007) 550-555].
| Катализатор | Т, °С | рН | Время, ч | Конверсия ДГА, % | Выход, % | |||
| Тип | Концентрация, мас.% | Эритрулоза | С5 | С6 | ||||
| Na2HPO4+KH2PO4 | 0.02M | 80 | 7.3 | 0.75 | 87 | 46 | 31 | 11 |
| Гидроксиапатит | 1.0 | 40 | 7.3 | 100 | 80-85 | 45-50 | 35-40 | н.д. |
| Ca3(PO4)2 | 1.0 | 40 | 7.3 | 100 | 70 | 45-50 | 35-40 | н.д. |
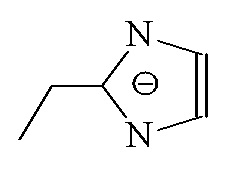
Таблица 2 - Структуры органических линкеров, используемых для синтеза ZIF
| Название | Обозначение | Структура |
| Имидазол | Im | |
| 2-Метилимидазол | mIm | |
| 2-Этилимидазол | eIm | |
| Имидазол-2-карбоксиальдегид | ica |
Таблица 3 - Примеры получения эритрулозы из формальдегида (0,1 моль/л ) и ДГА (5 ммоль/л) с использованием ZIF в качестве катализаторов.
| Пример | Катализатор | Условия | Конверсия ДГА, % | Выход, % | |||||||
| Концентрация катализатора, мас.% | Время, ч | Т, °С | рН | Гликолевый альдегид | Эритрулоза | Арабиноза | Рибоза | Фруктоза (Глюкоза) | |||
| 1 | ZIF-8 | 0.035 | 0.5 | 80 | 8.36 | 43 | 28 | 45 | 4 | 20 | 3 (0) |
| 2 | 0.035 | 1 | 80 | 8.36 | 60 | 20 | 38 | 6 | 27 | 9 (0) | |
| 3 | 0.035 | 5 | 80 | 8.36 | 86 | 6 | 21 | 7 | 20 | 41 (5) | |
| 4 | 0.010 | 0.5 | 80 | 7.54 | 26 | 38 | 40 | 1 | 21 | 0 (0) | |
| 5 | 0.010 | 1 | 80 | 7.54 | 31 | 31 | 41 | 5 | 20 | 3 (0) | |
| 6 | 0.010 | 2 | 80 | 7.54 | 53 | 19 | 49 | 5 | 22 | 5 (0) | |
| 7 | 0.035 | 0.5 | 65 | 8.36 | 26 | 21 | 56 | 5 | 18 | 0 (0) | |
| 8 | 0.035 | 1 | 65 | 8.36 | 42 | 23 | 54 | 2 | 20 | 1 (0) | |
| 9 | 0.010 | 2 | 65 | 7.54 | 22 | 25 | 52 | 2 | 19 | 2 (0) | |
| 10 | 0.010 | 4 | 65 | 7.54 | 38 | 28 | 49 | 2 | 21 | 0 (0) | |
| 11 | ZIF-14 | 0.035 | 0.5 | 80 | 8.60 | 50 | 23 | 38 | 6 | 21 | 12 (0) |
| 12 | 0.035 | 1 | 80 | 8.60 | 57 | 20 | 35 | 7 | 24 | 14 (0) | |
Таблица 3 - Примеры получения эритрулозы из формальдегида (0,1 моль/л) и ДГА (5 ммоль/л) с использованием в качестве катализаторов ZIF. (продолжение)
| Пример | Катализатор | Условия | Конверсия ДГА, % | Выход, % | |||||||
| Концентрация катализатора, мас.% | Время, ч | Т, °С | рН | Гликолевый альдегид | Эритрулоза | Арабиноза | Рибоза | Фруктоза (Глюкоза) | |||
| 13 | ZIF-71 | 0.035 | 0.5 | 80 | 8.71 | 66 | 25 | 33 | 6 | 22 | 8 (6) |
| 14 | 0.035 | 1 | 80 | 8.71 | 74 | 27 | 30 | 6 | 22 | 9 (6) | |
| 15 | 0.010 | 0.5 | 65 | 7.54 | 15 | 21 | 60 | 1 | 18 | 0 (0) | |
| 16 | 0.010 | 1 | 65 | 7.54 | 21 | 24 | 54 | 1 | 21 | 0 (0) | |
| 17 | 0.010 | 2 | 65 | 7.54 | 26 | 25 | 50 | 1 | 23 | 1 (0) | |
| 18 | ZIF-67 | 0.035 | 1 | 80 | 8.32 | 13 | 40 | 35 | 6 | 17 | 2 (0) |
| 19 | 0.035 | 5 | 80 | 8.32 | 21 | 36 | 28 | 7 | 20 | 5 (4) | |
| 20 | ZIF-90 | 0.035 | 1 | 80 | 8.34 | 25 | 28 | 33 | 6 | 25 | 4 (4) |
| 21 | 0.035 | 5 | 80 | 8.34 | 36 | 23 | 25 | 7 | 28 | 12 (5) | |
Claims (5)
1. Способ получения эритрулозы из дигидроксиацетона и формальдегида методом альдольной конденсации, характеризующийся тем, что процесс альдольной конденсации формальдегида и дигидроксиацетона проводят при нагревании до температуры не выше 80°С в водном растворе при рН 7,54-8,71, где pH регулируется количеством введенного гетерогенного катализатора, представляющего собой цеолитоподобный имидазолятный каркас ZIF, образованный катионами Zn(II), Co(II), Fe(II), Cd(II) и органическими линкерами, выбранными из имидазола, 2-метилимидазола, 2-этилимидазола и имидазол-2-карбоксиальдегида.
2. Способ по п. 1, отличающийся тем, что процесс альдольной конденсации формальдегида и дигидроксиацетона проводят при мольном избытке формальдегида по отношению к дигидроксиацетону, предпочтительно равном 20.
3. Способ по п. 1, отличающийся тем, что процесс альдольной конденсации формальдегида и дигидроксиацетона проводят при нагревании до температуры не выше 80°С, предпочтительно при 65°С.
4. Способ по п. 1, отличающийся тем, что концентрация цеолитоподобных имидазолятных каркасов ZIF в растворе не превышает 0,035 мас.% в расчете на вес реакционной массы.
5. Способ по п. 1, отличающийся тем, что время проведения процесса получения эритрулозы не превышает 2 ч, предпочтительно 0,5 ч.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2020113607A RU2741007C1 (ru) | 2020-04-16 | 2020-04-16 | Способ получения эритрулозы из дигидроксиацетона и формальдегида |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2020113607A RU2741007C1 (ru) | 2020-04-16 | 2020-04-16 | Способ получения эритрулозы из дигидроксиацетона и формальдегида |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2741007C1 true RU2741007C1 (ru) | 2021-01-22 |
Family
ID=74213315
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2020113607A RU2741007C1 (ru) | 2020-04-16 | 2020-04-16 | Способ получения эритрулозы из дигидроксиацетона и формальдегида |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2741007C1 (ru) |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2710598C2 (ru) * | 2014-06-19 | 2019-12-30 | Хальдор Топсеэ А/С | Конверсия с1-3 оксигенатных соединений до с4-оксигенатных соединений, опосредованная кристаллическим микропористым материалом |
-
2020
- 2020-04-16 RU RU2020113607A patent/RU2741007C1/ru active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2710598C2 (ru) * | 2014-06-19 | 2019-12-30 | Хальдор Топсеэ А/С | Конверсия с1-3 оксигенатных соединений до с4-оксигенатных соединений, опосредованная кристаллическим микропористым материалом |
Non-Patent Citations (4)
| Title |
|---|
| "Technology of catalysts" ed. I.P. Mukhlenova, Leningrad, "Chemistry", Leningrad branch, 1989, pp. 19-20. * |
| A.N. Simonov et al., Kinet. Catal., 2007, 48, стр. 550-555. * |
| V. V. Butova et al, Russian Chemical Reviews, 2016, 85 (3) 280-307. * |
| V. V. Butova et al, Russian Chemical Reviews, 2016, 85 (3) 280-307. "Технология катализаторов" под ред. И.П. Мухленова, Ленинград, "Химия", Ленинградское отделение, 1989, стр. 19-20. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2732326C2 (ru) | Способ получения фуран-2,5-дикарбоновой кислоты | |
| US9192926B2 (en) | Method for enhancing heterogeneous asymmetric selectivity and catalytic activity | |
| EP0232182B1 (en) | Process for producing bases | |
| US9045449B2 (en) | Method for the manufacture of furan compounds for renewable primary products | |
| CN104789620B (zh) | 一种葡萄糖苷抗坏血酸制备的方法 | |
| RU2741007C1 (ru) | Способ получения эритрулозы из дигидроксиацетона и формальдегида | |
| DE3823864A1 (de) | Enymatisches verfahren zur herstellung von optisch aktiven cyanhydrinen | |
| US6900361B2 (en) | Process for lactose conversion to polyols | |
| CA2801258A1 (en) | Process for manufacturing tagatose and glucose | |
| JP4355805B2 (ja) | α−ヒドロキシカルボン酸エステルの製造方法 | |
| KR19980080086A (ko) | D-글루쿠로노락톤의 제조 방법 | |
| US10138185B1 (en) | Method for preparation of mannitol from fructose using butanol as solvent | |
| EP0350908B1 (de) | Verfahren zur Herstellung von S-Cyanhydrinen | |
| US6300494B1 (en) | Process for the manufacture of D-erythrose | |
| DE60105657T2 (de) | Immobilisiertes Enzym und Verfahren zur Herstellung von optisch aktiven Cyanhydrinen | |
| CN104372035A (zh) | 合成高纯2-酮酸盐的方法 | |
| CN113735775B (zh) | 一种α-酮缬氨酸钙及其中间体的制备方法 | |
| WO2024106319A1 (ja) | セロビオースの製造方法 | |
| Waluga et al. | Adsorption of laminaribiose in an in-situ product recovery process | |
| JP2955590B2 (ja) | ラミナリオリゴ糖の製造方法 | |
| CN114214376B (zh) | 一种利用全细胞转化合成l-果糖的方法 | |
| CN112359028B (zh) | 一种托莫西汀中间体的生物合成方法及羰基还原酶 | |
| CN111647636B (zh) | 一种利用酵母全细胞催化合成胞二磷胆碱的方法 | |
| CN113735776B (zh) | 一种α-酮亮氨酸钙及其中间体的制备方法 | |
| CN115700146A (zh) | 一种光催化剂的制备方法及其应用 |