RU2727976C2 - Композитный материал для имплантатов - Google Patents
Композитный материал для имплантатов Download PDFInfo
- Publication number
- RU2727976C2 RU2727976C2 RU2017132258A RU2017132258A RU2727976C2 RU 2727976 C2 RU2727976 C2 RU 2727976C2 RU 2017132258 A RU2017132258 A RU 2017132258A RU 2017132258 A RU2017132258 A RU 2017132258A RU 2727976 C2 RU2727976 C2 RU 2727976C2
- Authority
- RU
- Russia
- Prior art keywords
- additives
- base material
- implant
- modulus
- elasticity
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/12—Mammary prostheses and implants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B6/00—Apparatus for radiation diagnosis, e.g. combined with radiation therapy equipment
- A61B6/50—Clinical applications
- A61B6/502—Clinical applications involving diagnosis of breast, i.e. mammography
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/18—Macromolecular materials obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/40—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material
- A61L27/42—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material having an inorganic matrix
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/40—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material
- A61L27/44—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material having a macromolecular matrix
- A61L27/446—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material having a macromolecular matrix with other specific inorganic fillers other than those covered by A61L27/443 or A61L27/46
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/40—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material
- A61L27/44—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material having a macromolecular matrix
- A61L27/48—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material having a macromolecular matrix with macromolecular fillers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2210/00—Particular material properties of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2210/0057—Particular material properties of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof stretchable
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2210/00—Particular material properties of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2210/0076—Particular material properties of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof multilayered, e.g. laminated structures
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0014—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis
- A61F2250/0025—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis differing in roughness
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0014—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis
- A61F2250/0036—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis differing in thickness
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0091—Additional features; Implant or prostheses properties not otherwise provided for transparent or translucent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0096—Markers and sensors for detecting a position or changes of a position of an implant, e.g. RF sensors, ultrasound markers
- A61F2250/0098—Markers and sensors for detecting a position or changes of a position of an implant, e.g. RF sensors, ultrasound markers radio-opaque, e.g. radio-opaque markers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/44—Radioisotopes, radionuclides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/04—Materials or treatment for tissue regeneration for mammary reconstruction
Abstract
Изобретение имеет отношение к протезному имплантату. Протезный имплантат подходит для имплантации в человеческое тело и содержит композитный материал. Композитный материал в свою очередь содержит основной материал и множество добавок. Основной материал содержит силиконовый гель. Добавки выбраны из рентгенопрозрачных добавок и/или гиперэхогенных добавок. При частоте 1 Гц модуль упругости указанного композитного материала больше модуля упругости указанного основного материала, и причем указанный модуль упругости больше модуля упругости указанного основного материала по меньшей мере на 20%. Добавки имеют среднеквадратичное значение шероховатости поверхности от 0,2 до 40 нм, а также имеют размер не более 500 мкм, где разница между их размерами составляет по меньшей мере 20%. Технический результат - улучшенные радиологические свойства, такие как улучшенная рентгенопрозрачность, и уменьшенные связанные визуальные помехи на ультразвуковых изображениях, отсутствие утечки свободных молекул из основного материала. 8 з.п. ф-лы, 7 ил.
Description
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится в целом к имплантируемым протезным устройствам и конкретно к имплантируемым протезным устройствам, характеризующимся основным материалом и добавочным материалом.
УРОВЕНЬ ТЕХНИКИ
В прошлом столетии пластическая и косметическая хирургия стала обычной практикой. Конкретно, пластическая хирургия груди была разработана для реконструкции женской груди, подвергшейся таким процедурам как мастэктомия. Косметическая хирургия груди также стала доступной для улучшения внешнего вида женской груди, например, путем вставки имплантата, увеличивающего размер груди, исправляющего асимметрию, изменяющего форму и устраняющего деформации. Материал, выбираемый для имплантата, должен иметь соответствующую упругость, эластичность и гибкость, что обеспечивает ему специфические ощущения при прикосновении. В целом желательно создать имплантат, обеспечивающий специфическую форму и имитирующий ощущения настоящей человеческой ткани на месте имплантата. Важно, чтобы имплантат сохранял свою форму и ощущения в течение длительного периода, устраняя необходимость в дополнительных хирургических вмешательствах.
Имплантаты известного уровня техники, используемые сегодня в имплантационной хирургии груди, например, содержат внешнюю оболочку, как правило изготовленную из вулканизированного силиконового каучука (эластомера), которая может быть одно- или многослойной, гладкой или текстурированной, с барьерными слоями или без них, или покрыта пенополиуретаном; и внутреннее содержимое, как правило состоящее из силиконового геля или физраствора. Существуют также двуполостные имплантаты, представляющие собой комбинации с силиконом и физраствором, такие как имплантат Becker от компании Mentor Corp.
Имплантаты известного уровня техники сталкиваются с рядомпроблемам, описанных более подробно ниже, в том числе: визуализация, например, маммограммы; утечки геля из имплантата; механические и химические проблемы. Визуализированные исследования проводятся на увеличенной груди по двум основным причинам: 1) для оценки тканей груди (например, на предмет повреждений); 2) для оценки грудных имплантатов на предмет осложнений например, важно иметь возможность четко определить целостность оболочки имплантата. При оценке тканей груди желательно, чтобы имплантаты не затемняли исследуемые ткани или не создавали помехи для выбранного метода визуализации. Кроме того, желательно иметь возможность четко определить целостность оболочки имплантата.
Для исследования груди применяют три основных метода визуализации:
- Ультразвуковая эхография;
- Маммография (рентген); и
- МРИ (магнитно-резонансное исследование).
Силиконовый гель, используемый в стандартных имплантатах, непрозрачен для рентгеновских лучей. Поэтому типичное изображение имплантата при маммографии будет белым без дополнительных деталей ткани перед имплантатом или за ним. Это показано на фигуре 3А, которая представляет собой маммограмму груди с имплантатом известного уровня техники. Как показано на маммограмме 300, имплантат 302 выглядит полностью белым (непрозрачным для рентгеновских лучей), не показывая деталей ткани перед ним или за ним. Ткань груди 304, не затемненная имплантатом, видна на маммограмме 300.
Соответственно, маммограммы у женщин с грудными имплантатами как правило выполняются дважды, один раз обычным образом как для груди без имплантатов, а потом снова в наклонном положении с имплантатом, сдвинутым назад насколько это возможно за рамки маммограммы (известно как метод смещения имплантата Эклунда). Как правило 30% ткани груди могут все равно быть закрыты имплантатом.
При использовании ультразвуковой эхографии силиконовый гель анэхогенен. Поскольку силиконовый гель имеет плотность, близкую к жидкости, скорость звука в имплантате немного меньше, но близка к скорости звука в воде (и в окружающих тканях), и поэтому ультразвуковая эхография обычно обнаруживает эхо или отражение оболочки с дополнительными артефактами реверберации от самого геля. Отражения от геля создают визуальные помехи на изображении, мешающие радиологу обнаружить аномалии.
Мягкие ткани имеют скорость звука 1540 м/с. Вода, имеющая скорость звука 1492 м/с, будет выглядеть темной, и чем более эхогенный материал, тем более светлым он будет выглядеть. Силикон имеет скорость звука приблизительно 997 м/с, и замедление звуковых волн в имплантате вызывает множество отражений и шумов.
Это показано на фигурах 5А и 5С, на которых представлены ультразвуковые изображения краев грудных имплантатов известного уровня техники на месте. Как показано на фигуре 5А, оболочка 502 имплантата известного уровня техники видна на ультразвуковом изображении 500, полученном с помощью 12 МГц ультразвукового зонда.
Верхняя часть изображения 500 представляет собой поверхность соприкосновения зонда с кожей. Далее представлена ткань 502, содержащая кожу, жировой слой, железы и другие ткани, а за ней оболочка силиконового имплантата 504. Гель 508 виден как черная зона. Отражения, видимые как визуальные помехи 506, вызванные имплантатом, видны также на изображении 500 в зоне, которая должна быть черной (гель 508). Видно, что помехи распространяются на 1,5 см в зону изображения 500. Помехи распространяются также над оболочкой, создавая облако, подобное снегу, над зоной ткани 502 на изображении, предназначенном для диагностики. Аналогичным образом фигура 5С показывает ультразвуковое изображение 520, полученное с помощью 17 МГц ультразвукового зонда, на котором видны как оболочка имплантата 522, так и визуальные помехи, вызванные имплантатом 524.
Если имплантат разорван, вытекший гель может мигрировать в другие зоны в теле. Однако, из-за анэхогенного характера геля и его высокого сходства с водой, свободный силиконовый гель может быть ошибочно принят за патологию, такую как киста.
Таким образом, известный уровень техники не предлагает и не предполагает материал для протезных имплантатов, который не затемняет исследуемые ткани или не создает помехи для выбранного метода визуализации. Кроме того, как показано, имплантаты известного уровня техники создают визуальные помехи, мешающие радиологу обнаружить аномалии. Наконец, было бы предпочтительно, чтобы в случае разрыва оболочки силиконовый материал оставался связанным, предотвращая миграцию в другие части тела, или чтобы силиконовый материал был легко идентифицируемым и отличимым тканей.
Дополнительная проблема имплантатов известного уровня техники заключается в утечке геля из неповрежденного имплантата. Утечка геля - это общий термин, описывающий явления, основанные на диффузии, когда растворитель (силиконовое масло), представляющий собой часть силиконового геля, диффундирует/протекает сквозь оболочку. Диффузия представляет собой явление, когда вещество течет из области с высокой концентрацией в область с низкой концентрацией благодаря наличию химическому потенциалу. Диффузионный поток градиенту концентрации с обратным знаком, а коэффициент пропорциональности представляет собой коэффициент диффузии. Поток идет из областей с высокой концентрацией в области с низкой концентрацией. Таким образом, уменьшение градиента концентрации снижает утечку геля.
Утечка силикона в ткани тела нежелательна, поскольку свободный силикон может вызвать реакцию на инородное тело, приводящую к образованию гранулем и кальцинозов в груди, которые могут быть ошибочно приняты при радиологических обследованиях за аномалии ткани груди. Свободный силикон также может легко мигрировать в лимфатическую систему и накапливаться в лимфатических узлах (обычно в подмышечных), приводя к их опухолям и лимфаденопатии. Утечка геля также считается одной из причин капсулярной контрактуры. Исследования на животных показали, что «Существует зависимое от дозы отношение между утечкой силиконового геля и эластичностью капсулы, которое независит от когезионности силикона» (Moyer HRI, Ghazi ВН, Losken A. Plast Reconstr Surg. 2012 Oct; 130(4):793-800).
Усилия по уменьшению утечек геля концентрировались на двух направлениях:
- Добавление и улучшение барьерных слоев в оболочках;
- Изменение состава растворителя, снижающее количество низкомолекулярного силикона, способного легко диффундировать сквозь эластомерную оболочку и его замена силиконом с высокой молекулярной массой.
Хотя эти усилия привели к созданию грудных имплантатов 4-го и 5-го поколения, в которых утечка геля несколько снижена, они не решили проблему полностью. Кроме того, эти решения имеют некоторую эффективность, только когда оболочка имплантата не повреждена. Когда оболочка имплантата нарушена из-за разрыва или разрушения, эти решения обеспечивают значительно меньшую эффективность, позволяя повышенным количествам растворителя мигрировать в тело. Таким образом, желательно усовершенствовать имплантаты, уменьшив утечку растворителя из неповрежденных, а также разорванных имплантатов.
Наконец, в последние годы было показано, что желательно использовать более когезивный гель по нескольким причинам:
- Более близкая имитация окружающей ткани груди, чтобы грудь ощущалась более естественной;
- Снижение утечки геля, как описано выше;
- Улучшение динамической механической поверхности соприкосновения с грудью, служащей каркасом, поддерживающим форму увеличенной груди;
- Предотвращение утечки и рассеивания геля в теле в случае разрыва или разрушения оболочки;
- Предотвращение разрыва геля во время вставки или использования в теле;
- Улучшение сохранения формы имплантата во время обычного использования. Это особенно важно для фасонных или анатомических имплантатов; и
- Предотвращение или уменьшение сморщивания. Часто имплантаты страдают от видимых складок и морщин (в особенности у женщин с тонким тканевым покровом).
Существующие силиконовые гели имеют разную степень когезивности. Когезивность силиконового геля может быть увеличена путем повышения степени перекрестного связывания, приводящего к образованию сетки с более высокой плотностью поперечных связей. Таким образом, среднее расстояние между двумя соседними поперечными связями сокращается.
Таким образом, увеличенное перекрестное связывание имеет преимущества, однако, чрезмерное повышение степени перекрестного связывания может приводить к разрывам геля даже без приложения внешних усилий из-за остаточных внутренних напряжений. Например, для такого геля как NUSIL Med 3-6300, указано отношение компонентов смеси 3:1 части А к части В. Часть А содержит катализатор, а часть В содержит средство для перекрестного связывания, и поэтому изменение отношения компонентов смеси приводит к различной плотности поперечных связей и различному связыванию. Однако, чрезмерное увеличение количества компонента для перекрестного связывания приводит к разрыву геля. В этом случае смешивание в соотношении 3:2 приводит к образованию высококогезивного геля, который разрывается и ломается без приложения каких-либо нагрузок.
Таким образом, по причинам, указанным выше, желателен более связанный гель, но простое усиление перекрестного связывания вызывает разломы геля, и поэтому необходим другой механизм увеличения когезивности геля.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение преодолевает недостатки существующего уровня техники, предлагая протезный имплантат, содержащий композитный материал имплантата, дополнительно содержащий основной материал и добавки. Термин «основной материал», используемый в данном документе, относится к полимерной сетке, дополнительно содержащей свободную молекулу, которая может представлять собой либо растворитель, либо свободную полимерную цепь. Таким образом, свободная молекула определяет, имеет полимерная сетка форму геля или эластомера. Композитный материал, описываемый в данном изобретении, в альтернативных вариантах может в данном документе называться материалом имплантата, композитным материалом имплантата или композитным материалом. Внедрение Добавление добавок в основной материал обеспечивает несколько улучшений:
Материал имплантата имеет улучшенные радиологические свойства, такие как улучшенная рентгенопрозрачность, и уменьшенные связанные визуальные помехи на ультразвуковых изображениях. Кроме того, композитный материал можно уникально идентифицировать с помощью методов визуализации и можно легко отличить от ткани или других материалов.
Явление утечки геля можно свести к утечке свободных молекул из основного материала. Материал имплантата уменьшает общее количество свободных молекул, что приводит к снижению градиента концентрации, а следовательно к сокращению утечки свободных молекул. Как описано выше, градиент концентрации представляет собой движущую силу утечки свободных молекул, а следовательно снижение концентрации свободных молекул сокращает утечку свободных молекул.
Кроме того, добавки, включенные в основной материал, ограничивают утечку свободных молекул на основе двух дополнительных механизмов. Первый механизм физический, согласно нему в некоторой точке композитный материал сжимается из-за потери свободных молекул основным материалом, добавки сдерживают дальнейшее сжатие благодаря своему физическому размеру и соприкосновению друг с другом. Второй механизм основан на большой совокупной площади поверхности добавок. Свободные молекулы в основном материале смачивают поверхность добавок благодаря поверхностным взаимодействиям и не стремятся к выходу (в отсутствии высыхания, десорбции или замены другой жидкостью, имеющей большее сродство к поверхности). В противоположность этому, имплантаты известного уровня техники не имеют таких ограничений и теоретически могут потерять весь свой растворитель путем диффузии.
Добавки в материале имплантата повышают плотность поперечных связей/связывание основного материала, таким образом укрепляя (армируя) основной материал, сохраняя его целостность. Материал имплантата с армированным основным материалом обеспечивает несколько преимуществ при использовании в грудных имплантатах:
- Более близкая имитация окружающей ткани груди, чтобы грудь ощущалась более естественной;
- Наличие у армированного имплантата желательного гладкого контура благодаря связанности и стабильной форме;
- Предотвращение или уменьшение сморщивания.
- Сокращение утечки растворителя из неповрежденного имплантата;
- Сохранение формы и контуров имплантата;
- Предотвращение разрыва во время имплантации или использования;
- Улучшение динамической механической поверхности соприкосновения с грудью, служащей каркасом, поддерживающим форму увеличенной груди;
- Предотвращение утечки и рассеивания основного материала в теле в случае разрыва или разрушения оболочки и уменьшение количества свободного растворителя, способного быть поглощенным телом в таких случаях.
Добавки внедряют в основной материал в качестве объемозамещающего элемента, создающего двухфазную систему с непрерывной фазой и дисперсной фазой или взаимно непрерывную систему. В качестве примера, 30% объема основного материала имплантата могут быть замещены добавками. Необязательно добавки могут составлять до 60% объема композитного материала. Необязательно добавки могут составлять до 90% объема композитного материала.
Материал имплантата пригоден для использования в имплантатах с оболочкой согласно по меньшей мере некоторым вариантам реализации данного изобретения, в которых имплантат имеет оболочку и материал имплантата так, что материал имплантата содержится внутри оболочки.
Кроме того, данное изобретение соответствует требованиям к имплантируемым протезам, таким как способность обеспечивать специфическую трехмерную форму и сохранять эту форму в течение многих лет, предпочтительно в течение всего срока жизни пациента, у которого установлен имплантат; наличие специфического ощущения, предпочтительно имитирующего ощущение человеческой или животной ткани, такое как ощущение настоящей груди; наличие биологической устойчивости так, чтобы он не разрушался при взаимодействии с человеческим или животным телом; наличие биологической совместимости так, чтобы имплантат не вредил здоровью пациента даже в экстремальных обстоятельствах: например, наполнитель (основной материал с добавками) должен быть нетоксичным в случае утечки из имплантата.
Согласно предпочтительным вариантам реализации данного изобретения, имплантат выполнен с возможностью использования в качестве грудного имплантата.
Согласно по меньшей мере некоторым вариантам реализации данного изобретения, материал имплантата содержит основной материал, такой как, например, силиконовый гель, и материал меньшей плотности. Плотность силиконового геля составляет ~1 г/см3, что соответствует порядку плотности других жидкостей, таких как вода и органические растворители. Следовательно, материал меньшей плотности имеет плотность меньше ~1 г/см3. Необязательно и предпочтительно материал меньшей плотности содержит газ.
В типовых вариантах реализации изобретения имплантат может быть выполнен в различных размерах, например, от 50 см3 до 1500 см3, или больше, или меньше. Необязательно имплантат может быть имплантирован не только в грудь, но и в другие области тела, например, для замены или увеличения яичек, грудных мышц, подбородка, щек, икр, ягодиц или других частей тела человека или животного, проявляя тактильные свойства, аналогичные естественной ткани.
Согласно предпочтительному варианту реализации данного изобретения, протезный имплантат, подходящий для имплантации в человеческое тело, содержит композитный материал, содержащий основной материал и множество добавок, причем добавки выбраны из рентгенопрозрачных добавок и/или гиперэхогенных добавок. Предпочтительно добавки выбраны из группы, состоящей из: добавок, содержащих по меньшей мере один из следующих материалов: стекло, керамика, металл, полимеры, полиметилметакрилат, полиакрилонитрил, полибутадиен, полиэфирэфиркетон, натуральный каучук, синтетический каучук, аморфный полимер или полукристаллический полимер; добавки могут иметь диаметр от 1 нм до 1 мм; добавки могут состоять из элементов трехмерной формы, таких как сферы, волокна, пластинки, хлопья, бесформенные элементы, кристаллы, полусферы, стержни, диски или комбинации этих форм или геометрически нарушенные варианты этих форм; добавки могут быть полостными, пористыми, монолитными; добавки могут содержать по меньшей мере 2 материала; добавки могут иметь среднеквадратичное значение шероховатости поверхности от 0,2 нм до 40 нм; добавки могут содержать газ; добавки могут содержать нерастворяющую жидкость; добавки могут содержать несиликоновый гель; добавки могут быть выполнены в виде микрополостей; и комбинаций указанного выше.
Необязательно основной материал содержит силиконовый гель. Необязательно имплантат содержит множество оболочек, в том числе по меньшей мере одну внутреннюю оболочку и по меньшей мере одну внешнюю оболочку; причем эта по меньшей мере одна внутренняя оболочка по меньшей мере частично окружена внешней оболочкой; причем внешняя оболочка заполнена основным материалом и множеством гиперэхогенных добавок, и причем внутренняя оболочка заполнена основным материалом и множеством рентгенопрозрачных добавок.
Согласно другому предпочтительному варианту реализации данного изобретения, композитный материал, подходящий для имплантации в человеческое тело, содержит основной материал и множество добавок, причем добавки выбраны из рентгенопрозрачных добавок и/или гиперэхогенных добавок. Предпочтительно добавки составляют до 60% объема композитного материала. Предпочтительно добавки составляют до 90% объема композитного материала. Необязательно основной материал представляет собой силиконовый гель.
Согласно другому предпочтительному варианту реализации данного изобретения, протезный имплантат, подходящий для имплантации в человеческое тело, содержит композитный материал, содержащий основной материал и множество добавок, причем добавки выбраны так, что концентрация растворителя в композитном материале составляет 5%-95% концентрации растворителя в основном материале.
Необязательно добавки снижают концентрацию растворителя в основном материале на 20%-80%. Необязательно добавки снижают концентрацию растворителя в основном материале на 40%-60%. Необязательно добавки снижают концентрацию растворителя в основном материале на до 50%.
Предпочтительно добавки выбраны из группы, состоящей из: добавок, содержащих по меньшей мере один из следующих материалов: стекло, керамика, металл, полимеры, полиметилметакрилат, полиакрилонитрил, полибутадиен, полиэфирэфиркетон, натуральный каучук, синтетический каучук, аморфный полимер или полукристаллический полимер; добавок, имеющих диаметр от 1 нм до 1 мм; добавок, состоящих из элементов трехмерной формы, таких как сферы, волокна, пластинки, хлопья, бесформенные элементы, кристаллы, полусферы, стержни, диски или комбинации этих форм или геометрически нарушенные варианты этих форм; полостных добавок; пористых добавок; монолитных добавок; добавок, содержащих по меньшей мере 2 материала; добавки со среднеквадратичным значением шероховатости поверхности от 0,2 нм до 40 нм; добавок, содержащих газ; добавок, содержащих нерастворяющую жидкость; добавок, содержащих несиликоновый гель; добавок, выполненных в виде микрополостей; и комбинаций указанного выше.
Необязательно основной материал содержит силиконовый гель. Необязательно имплантат содержит множество оболочек, в том числе по меньшей мере одну внутреннюю оболочку и по меньшей мере одну внешнюю оболочку; причем эта по меньшей мере одна внутренняя оболочка по меньшей мере частично окружена внешней оболочкой; причем внешняя оболочка заполнена основным материалом и добавками в более высокой концентрации ближе к внешней оболочке, и приэтом внутренняя оболочка заполнена основным материалом и добавками, концентрации которых возрастает с увеличением расстояния от внутренней оболочки.
Согласно другому предпочтительному варианту реализации данного изобретения, композитный материал, подходящий для имплантации в человеческое тело, содержит основной материал и множество добавок, причем добавки выбраны так, что концентрация растворителя в композитном материале составляет 5%-95% концентрации растворителя в основном материале. Предпочтительно добавки составляют до 60% объема композитного материала. Предпочтительно добавки составляют до 90% объема композитного материала. Необязательно основной материал представляет собой силиконовый гель.
Согласно другому предпочтительному варианту реализации данного изобретения, протезный имплантат, подходящий для имплантации в человеческое тело, содержит композитный материал, содержащий основной материал и множество армирующих добавок, причем добавки выбраны так, что модуль упругости композитного материала больше модуля упругости основного материала по меньшей мере на 20%. Предпочтительно модуль упругости больше на 100%-1000%. Предпочтительно модуль упругости больше на 100%-500%.
Предпочтительно добавки выбраны так, что связанность композитного материала возрастает при измерении с помощью пенетрометра, результат которого на 5%-99,5% меньше результата для основного материала, причем пенетрация измеряется через 5 секунд с помощью пенетрометра Lab-Line (Melrose, IL, USA) со стержнем массой 12 грамм и ножкой диаметром 1 дюйм (25,4 мм).
Предпочтительно добавки выбраны из группы, состоящей из: добавок, содержащих по меньшей мере один из следующих материалов: стекло, керамика, металл, полимеры, полиметилметакрилат, полиакрилонитрил, полибутадиен, полиэфирэфиркетон, натуральный каучук, синтетический каучук, аморфный полимер или полукристаллический полимер; добавок, имеющих диаметр от 1 нм до 1 мм; добавок, состоящих из элементов трехмерной формы, таких как сферы, волокна, пластинки, хлопья, бесформенные элементы, кристаллы, полусферы, стержни, диски или комбинации этих форм или геометрически нарушенные варианты этих форм; полостных добавок; пористых добавок; монолитных добавок; добавок, содержащих по меньшей мере 2 материала; добавок со среднеквадратичным значением шероховатости поверхности от 0,2 нм до 40 нм; добавок, содержащих газ; добавок, содержащих нерастворяющую жидкость; добавок, содержащих несиликоновый гель; добавок, выполненных в виде микрополостей; и комбинаций указанного выше. Необязательно основной материал представляет собой силиконовый гель.
Необязательно имплантат содержит множество оболочек, в том числе по меньшей мере одну внутреннюю оболочку и по меньшей мере одну внешнюю оболочку; причем эта по меньшей мере одна внутренняя оболочка по меньшей мере частично окружена внешней оболочкой; причем внешняя оболочка заполнена основным материалом и добавками в низкой концентрации, и причем внутренняя оболочка заполнена основным материалом и добавками в высокой концентрации.
Согласно другому предпочтительному варианту реализации данного изобретения, композитный материал, подходящий для имплантации в человеческое тело, содержит основной материал и множество добавок, причем добавки выбраны так, что при частоте 1 Гц модуль упругости композитного материала на 20%-5000% больше модуля упругости основного материала. Предпочтительно добавки выбраны так, что связанность композитного материала возрастает при измерении с помощью пенетрометра, результат которого на 5%-99,5% меньше результата для основного материала, причем пенетрация измеряется через 5 секунд с помощью пенетрометра Lab-Line (Melrose, IL, USA) со стержнем массой 12 грамм и ножкой диаметром 1 дюйм (25,4 мм). Предпочтительно добавки составляют до 60% объема композитного материала. Предпочтительно добавки составляют до 90% объема композитного материала. Необязательно основной материал представляет собой силиконовый гель.
Необязательно имплантат по любому из описанных выше вариантов реализации изобретения содержит множество оболочек, в том числе по меньшей мере одну внутреннюю оболочку и по меньшей мере одну внешнюю оболочку; причем эта по меньшей мере одна внутренняя оболочка по меньшей мере частично окружена внешней оболочкой; причем внешняя оболочка заполнена основным материалом и добавками в первой концентрации, и причем внутренняя оболочка заполнена основным материалом и добавками во второй концентрации. Предпочтительно первая концентрация ниже второй концентрации. В альтернативном варианте первая концентрация выше второй концентрации.
Необязательно имплантат содержит несколько зон или отсеков. Необязательно материал имплантата присутствует только в определенных зонах или отсеках имплантата. Необязательно имплантат содержит различные концентрации основного материала и/или добавок в различных зонах. Необязательно использована единственная добавка или в альтернативном варианте использованы несколько добавок. Необязательно различные концентрации основного материала обеспечиваются различными комбинациями добавок в различных зонах имплантата.
Если не определено другое, все технические и научные термины, используемые в данном документе, имеют обычное значение, понятное специалисту, имеющему обычную подготовку в области, к которой относится данное изобретение. Материалы, способы и примеры, представленные в данном документе, приведены только в качестве иллюстраций и не представляют собой ограничений.
Реализация способа и системы по данному изобретению подразумевает выполнение или совершение определенных избранных задач или этапов вручную, автоматически или комбинированным способом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Изобретение описано в данном документе только в виде примеров со ссылкой на прилагаемые графические материалы. С особой ссылкой на подробные графические материалы подчеркиваем, что детали показаны только для примера и только в целях иллюстративного обсуждения предпочтительных вариантов реализации данного изобретения и представления того, что считается наиболее полезным, легко понятного описания принципов и концептуальных аспектов изобретения. В этом отношении, не предпринимаются попытки показать структурные элементы изобретения более подробно, чем необходимо для понимания принципов изобретения, описание вместе с графическими материалами делает очевидным для специалистов, подготовленных в данной области, как некоторые формы изобретения могут быть реализованы на практике.
На графических материалах:
На ФИГ. 1 показан не имеющий ограничительного характера пример иллюстративного протезного имплантата согласно по меньшей мере некоторым вариантам реализации данного изобретения;
На ФИГ. 2 показан другой не имеющий ограничительного характера пример иллюстративного протезного имплантата согласно по меньшей мере некоторым вариантам реализации данного изобретения;
ФИГ. 3А и 3В показывают маммографические изображения груди с имплантатом известного уровня техники и груди с имплантатом по данному изобретению, соответственно;
ФИГ. 4А и 4В показывают маммографические изображения имплантата известного уровня техники и имплантата по данному изобретению, помещенных сверху помеченной локализационной таблички и индюшиной грудинки;
ФИГ. 5A-5D показывают ультразвуковые изображения груди с имплантатами известного уровня техники (5А, 5С) и имплантатами по данному изобретению (5В, 5D).
ФИГ. 6А и 6В представляют собой фотоснимки и график, показывающие сравнение диффузии геля имплантата известного уровня техники и композитного материала по данному изобретению; и
ФИГ. 7 представляет собой типовой реологический график, показывающий сравнение модуля упругости геля имплантата известного уровня техники и трех альтернативных композитных материалов по данному изобретению.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
В данном изобретении предложен композитный материал имплантата, содержащий основной материал, смешанный с добавками. Материал имплантата имеет улучшенные радиологические свойства, такие как улучшенная рентгенопрозрачность, и уменьшенные связанные визуальные помехи в ультразвуковой эхографии. Определение оболочки имплантата при визуализации с помощью ультразвука предпочтительно улучшено путем использования композитного материала, непосредственно прилегающего к гиперэхогенной оболочке. Поскольку эхо возникает из-за разницы скоростей звуковых волн, гиперэхогенность материала имплантата достигается путем максимального снижения скорости звука. Поэтому имплантат предпочтительно содержит добавки низкой плотности, такие как полостные добавки или добавки, содержащие газ. Предпочтительно добавки содержат частичный или полный вакуум, дополнительно усиливающий эхо, поскольку в нем меньше молекул, проводящих звук.
Материал по данному изобретению более рентгенопрозрачен чем чистый силиконовый гель, при наблюдении, например, на маммограмме, что улучшает видимость тканей перед имплантатом или за ним, а, следовательно, повышает диагностические возможности врача или радиолога. Материал предпочтительно содержит добавки, подходящие для радиологии, такие как рентгенопрозрачные добавки, например, элементы меньшей плотности, содержащие полости, поры или газ. Необязательно использованы материалы добавок, относительно прозрачные для рентгеновских лучей, полученных с настройками (напряжение и миллиамперы), обычно используемыми в визуализированых исследованиях. Не имеющий ограничительного характера пример напряжений на рентгеновской трубке, как правило используемых в маммографии, составляет 24 КВ - 32 КВ.
Не имеющий ограничительного характера пример рентгенопрозрачного материала, необязательно использованного в качестве добавки, представляет собой полиэфирэфиркетон (ПЭЭК), как у Kurtz SM, Devine JN. (ПЭЭК Biomaterials in Trauma, Orthopedic, and Spinal Implants. Biomaterials. 2007; 28(32):4845-4869. doi: 10.1016/j.biomaterials.2007.07.013.) «ПЭЭК сейчас находит широкое применение в качестве рентгенопрозрачной альтернативы металлическим биоматериалам в сообществе специалистов по позвоночнику».
Композитный материал по данному изобретению предпочтительно содержит добавки, такие, что в случае разрыва вытекающий композитный материал по данному изобретению легко идентифицируется с помощью технологий визуализации и отличается от физиологических отклонений, таких как кисты, внутрикапсульные или внекапсулярные, благодаря присутствию добавок.
Для основного материала, содержащего растворитель, добавки в материале имплантата уменьшают общее количество свободных молекул, что приводит к снижению перепада концентрации, а, следовательно, утечки свободных молекул. Как описано выше, градиент концентрации представляет собой движущую силу утечки свободных молекул, а следовательно снижение концентрации свободных молекул сокращает утечку геля. Предпочтительно добавки снижают концентрацию свободных молекул в основном материале на 5%-95%. Уменьшенную концентрацию свободных молекул измеряют, сравнивая концентрацию свободных молекул в основном материале без добавок и концентрацию свободных молекул в композитном материале. Не имеющий ограничительного характера пример улучшения показан на фотоснимках и графиках, представленных на фигурах 6А и 6В.
Кроме того, если существует утечка из имплантата, остающиеся добавки ограничивают общее количество жидкости, имеющей возможность вытечь, с помощью двух механизмов, описанных выше. В противоположность этому, имплантаты известного уровня техники не ограничены и теоретически могут потерять всю свою жидкость путем диффузии.
Добавки в материале имплантата повышают плотность поперечных связей/связывание основного материала, таким образом укрепляя основной материал, сохраняя его целостность. Предпочтительно выбираются добавки, улучшающие механические свойства, например, повышая динамический модуль упругости (С) на 20%-1000% или 5000% или более. Не имеющий ограничительного характера пример показан на графике, представленном на Фиг. 7. В альтернативном варианте повышение связанности измеряется с помощью пенетрационного теста, состоящего в помещении взвешенного стержня с пластиной на поверхность испытуемого материала и измерении глубины его погружения после определенного количества времени. Предпочтительно добавки повышают связанность, измеряемую с помощью пенетрационного теста, так, что проникновение в композитный материал на 5%-99,5% меньше чем в основной материал.
Эти и другие улучшения предпочтительно достигаются путем внедрения добавок в основной материал в качестве объемозамещающего элемента, создающего двухфазную систему с непрерывной фазой и дисперсной фазой, или взаимно непрерывную систему.
Материал имплантата предпочтительно содержится внутри оболочки, образуя протезный имплантат с оболочкой. Не имеющий ограничительного характера подходящего материала оболочки представляет собой силиконовый эластомер необязательно с материалом, таким как пенополиуретан, наложенным на оболочку. По меньшей мере оболочка, но предпочтительно все материалы имплантата биологически совместимы и безопасны для терапевтического и/или косметического использования внутри человеческого тела.
Описанный выше основной материал предпочтительно представляет собой силиконовый гель, известный в данной области техники, например, такой как полидиметилсилоксан и его производные. В альтернативном варианте основной материал представляет собой полиуретановую сетку. В альтернативном варианте основной материал представляет собой любой другой подходящий биологически совместимый основной материал или комбинацию основных материалов.
Необязательно основной материал выбирается так, чтобы он мог образовывать ковалентные связи с выбранной добавкой, которая может быть любой из добавок, описанных в данном документе.
Добавка или комбинация добавок предпочтительно выбирается на основании факторов, включающих биологическую совместимость, прочность, цену и другие факторы.
Добавка необязательно содержит один или более таких материалов как стекло, керамика, металл, полимеры, например, такие как ПММА (полиметилметакрилат), полиакрилонитрил, полибутадиен, полиэфирэфиркетон (ПЭЭК) (или любой другой натуральный или синтетический каучук или аналогичные материалы) или любой другой аморфный или полукристаллический полимер. Материалы могут необязательно определяться согласно их относительной гибкости. Например, для ПММА прочность при растяжении на пределе текучести предпочтительно составляет от 52 до 71 мегапаскалей, а модуль упругости при растяжении предпочтительно составляет от 2,2 до 3,1 гигапаскалей. В качестве дополнительного примера, для боросиликатного стекла (Pyrex®) с 80% диоксида кремния, 13% бора и солей прочность при растяжении на пределе текучести предпочтительно составляет от 35 до 100 мегапаскалей, а модуль упругости при растяжении составляет 64*10^3 мегапаскалей.
Необязательно добавка содержит каучук. Не имеющие ограничительного характера примеры подходящего каучука включают: этиленакрилатный каучук, полиэфируретан, бромоизобутиленизопрен, полибутадиен, хлороизобутиленизопрен, полихлоропрен, хлорсульфонированный полиэтилен, эпихлоргидрин, этиленпропилен, этиленпропилендиеновый мономер, полиэфируретан, перфторуглеродный каучук, фторсодержащий углеводород, фторсиликон, фторуглеродный каучук, гидрированный нитрилбутадиен, полиизопрен, изобутиленизопренбутил, акрилонитрилбутадиен, полиуретан, стиролбутадиен, стиролэтиленбутиленовый сополимер стирола, полисилоксан, винилметилсиликон, мономер акрилонитрилбутадиенкарбоксила, мономер стиролбутадиенкарбоксила, термопластичный сложный полиэфир-эфирный сополимер, блок-сополимер стиролбутадиена, блок-сополимер стиролбутадиенкарбоксила.
Добавка необязательно может быть любого подходящего размера. Каждая добавка необязательно имеет размер от 1 нм (нанометра) до 1 мм. Предпочтительно добавка не больше 500 микрон. Предпочтительно коэффициент упаковки добавок может быть увеличен с помощью полидисперсности размеров добавок. Предпочтительно добавки содержат частицы множества различных размеров необязательно с разницей между ними по меньшей мере 20%.
Добавка может необязательно содержать элементы любой трехмерной формы. Не имеющие ограничительного характера примеры форм добавок включают сферы, волокна, пластинки, хлопья, бесформенные элементы, кристаллы, полусферы, стержни, диски или комбинации этих форм или неправильные варианты этих форм. Каждая добавка может необязательно иметь внутренние или внешние структурные элементы или их комбинации, сохраняющие трехмерную форму добавки, включая ульевые элементы и т.п., но не ограничиваясь ими.
Добавки могут необязательно быть полостными или могут быть полностью монолитными. Полостные добавки предпочтительно содержат оболочку, имеющую диапазон толщины от монослоя атомов до 95% радиуса добавки. Полостные добавки могут необязательно быть заполнены газом. Необязательно добавки могут быть пористыми, имеющими отверстия или поры различной сложности внутри добавки, которые могут быть заполнены основным материалом или другим материалом. Пористые добавки предпочтительно содержат твердый компонент, имеющий диапазон толщины от монослоя атомов до 95% радиуса добавки.
Добавка может необязательно состоять из нескольких материалов. Эти материалы могут необязательно быть расположены в несколько слоев, причем следующие слои охватывают внутренние слои, или в альтернативном варианте могут быть расположены так, чтобы отдельные слои соприкасались с окружающим основным материалом. Добавки могут необязательно содержать множество слоев, собранных стопкой, плоской или искривленной; в последнем случае кривизна предпочтительно определяется согласно форме имплантата. Не имеющие ограничительного характера примеры материалов, которые можно комбинировать, включают стекло, керамику, металлы, пластики и каучуки. Например, стеклянные микросферы могут быть покрыты слоем каучука. Более предпочтительно использована смесь полимеров, например, смесь такого полимера как ПММА и каучукового материала, например, такого как полибутадиен.
Добавка необязательно имеет различную шероховатость поверхности. Необязательно среднеквадратичное значение шероховатости составляет от 0,2 нм до 40 нм.
Необязательно добавка представляет собой нерастворяющую жидкость, такую как масло, образующую пузыри внутри основного материала. Могут необязательно быть использованы нерастворяющие жидкости различной вязкости. Необязательно добавка представляет собой несиликоновый гель, такой как гидрогель.
Необязательно добавка представляет собой газ. Предпочтительно это инертный газ, такой как азот. Необязательно газ может содержать кислород или диоксид углерода. Необязательно газ образует микрополости, которые могут необязательно содержать жесткие материалы, в том числе стекло, керамику и т.п. Необязательно микрополости окружены жестким материалом, таким как жесткий пластик. Не имеющий ограничительного характера пример жесткого пластика представляет собой полиэфирэфиркетон (ПЭЭК).
Добавки необязательно вступают в различные поверхностные взаимодействия от инертных до взаимодействий с образованием химической связи с окружающим основным материалом. Необязательно добавки свободно плавают, то есть, не связаны с основным материалом и удерживаются основным материалом механически. Необязательно добавки связаны с основным материалом слабыми связями, такими как силы Ван-дер-Ваальса, водородные связи или ионные взаимодействия. Предпочтительно добавки связаны с основным материалом при помощи химических связей. Эти связи предпочтительно предотвращают разделение основного материала и добавок на две фазы.
Добавки предпочтительно имеют обработанную поверхность, позволяющую лучше связываться с окружающим основным материалом и предотвратить смещение или разделение на две фазы. Связывание добавок с основным материалом также заставляет основной материал окружать добавки; не желая ограничиваться единственной гипотезой, в случае разрыва или утечки ожидается, что основной материал будет продолжать покрывать добавки так, что тело подвергнется действию только основного материала.
Не имеющие ограничительного характера примеры средств обработки поверхности включают: связывающиеся с поверхностью цепи с большой молекулярной массой, такие как стеариновая кислота или любая другая длинная органическая цепь или полимерные щетки, гидрофобные или гидрофильные молекулы и другие подобные молекулы; создание заряженной поверхности, способствующей электростатическому притяжению, например, путем добавления полиэлектролита в силиконовый гель; повышение «шероховатости» или физической переменности поверхности добавок так, чтобы части поверхности выступали в основной материал, а следовательно могли взаимодействовать с основным материалом, или использование силанов с добавками, например, стеклом. Органофункциональная группа силана выбрана согласно типу подходящего взаимодействия между основным материалом и добавкой.
Предпочтительно один пограничный материал используется для поверхностной обработки добавок. Необязательно один или более одного связующего вещества используется в качестве средства обработки поверхности с последовательным добавлением связующих веществ сверху. Предпочтительно используются два связующих вещества. Необязательно могут использоваться до 20 связующих веществ. В большинстве случаев поверхностная обработка органофункциональными силанами, цирконатами, титанатами и другими связующими веществами приводит к полимерному поверхностному взаимодействию. Тип связующего вещества выбирается согласно химии поверхности добавки и химии основного материала.
Различные другие средства поверхностной обработки и способы их применения, представленные в заявке на патент США №13/520,356, поданной 3 июля 2012 года, включенной в данный документ посредством ссылки, как если бы она была полностью изложена в данном документе, которая находится в совместной собственности с данной заявкой, и которая имеет с ней по меньшей мере одного общего изобретателя, также могут необязательно быть использованы дополнительно или в качестве альтернативного варианта.
Необязательно добавки присутствуют в различных концентрациях в различных зонах имплантата. В качестве не имеющего ограничительного характера примера добавки, выполненные с возможностью использования в ультразвуковых исследованиях, могут иметь более высокую концентрацию в области, непосредственно прилегающей к оболочке, создавая сильное эхо, как описано выше. В качестве не имеющего ограничительного характера примера добавки, выполненные с возможностью использования в маммографии, могут иметь более высокую концентрацию во внутренних частях имплантата, чтобы достигнуть высокой степени рентгенопрозрачности имплантата.
В качестве дополнительного не имеющего ограничительного характера примера добавка может иметь более высокую концентрацию во внутренних частях имплантата, чтобы создать градиент диффузии, направленный внутрь. В качестве дополнительного не имеющего ограничительного характера примера добавки могут иметь более высокую концентрацию вблизи оболочки, чтобы служить в качестве барьера/буфера для диффузии.
В качестве дополнительного не имеющего ограничительного характера примера добавка может иметь более высокую концентрацию во внутренних частях имплантата, чтобы создать менее жесткий материал имплантата ближе к поверхности.
Необязательно добавки имеют такую же плотность как основной материал или в альтернативном варианте они имеют большую плотность. Предпочтительно добавки имеют меньшую плотность чем окружающий основной материал.
Предпочтительно добавки сочетают любые из перечисленных выше свойств, делая возможным целый ряд вариантов реализации данного изобретения, охватывающих добавки комбинированных и переменных размеров, форм, плотностей, материалов и структур с выбранным механизмом связывания с основным материалом.
Принципы и работу данного изобретения можно лучше понять со ссылкой на графические материалы и сопровождающее описание.
Сейчас обратимся к фигурам 1 и 2, показывающим не имеющие ограничительного характера типовые варианты реализации имплантатов согласно данному изобретению; Любые из описанных выше свойств материала оболочки, основного материала и добавок или их комбинации могут необязательно быть использованы в описанных ниже конструкциях.
Фигура 1 показывает не имеющий ограничительного характера пример иллюстративного протезного имплантата с оболочкой согласно по меньшей мере некоторым вариантам реализации данного изобретения;
Как показано, имплантируемый протез 100 содержит оболочку 110 с низкой проницаемостью, необязательно содержащую биологически совместимый силикон, полиуретан или другой материал, обычно используемый для имплантатов. Оболочка 110 может содержать единственный слой или несколько слоев, причем некоторые слои могут быть из одного материала, а другие из другого. Кроме того, оболочка 110 может быть гладкой или текстурированной с различными узорами. Оболочка 110 может иметь зоны с различной эластичностью. Оболочка 110 может иметь различную толщину в различных зонах. Необязательно материал оболочки 110 может представлять собой комбинацию нескольких материалов. Как правило оболочка 110 служит заграждением, предотвращающим вытекание части или всего содержимого протеза 100. Необязательно оболочка 110 может быть выполнена в различных формах, например, круглой, овальной, анатомической, специальной или другой. Оболочка 110 содержит основной материал 120 и по меньшей мере одну добавку 140. В этом не имеющем ограничительного характера примере оболочка 110 содержит множество добавок 140, которые могут необязательно иметь любые из свойств, описанных выше. Необязательно добавки распределены равномерно в основном материале 120. Необязательно добавки присутствуют в различных концентрациях в различных частях основного материала 120.
Сейчас обратимся к фигуре 2, показывающей частичный разрез другого не имеющего ограничительного характера примера иллюстративного протезного имплантата 200 с оболочкой согласно по меньшей мере некоторым вариантам реализации данного изобретения; В этом примере внешняя оболочка 202 содержит внешний композитный материал 204, а внутренняя оболочка 206 содержит внутренний композитный материал 208. Каждая из внешней оболочки 202 и внутренней оболочки 206 может необязательно быть изготовлена из силиконового эластомерного материала как описано в данном документе, необязательно с множеством слоев и также необязательно с барьерным слоем. Внешняя оболочка 202 может необязательно иметь любую из гладкой нетекстурированной поверхности, текстурированной поверхности или покрытой микропенополиуретаном поверхности. Было показано, что текстурирование поверхности снижает частоту и серьезность капсулярного сжатия. Внутренняя оболочка 206 предпочтительно гладкая, но может также необязательно быть текстурированной.
Внешний композитный материал 204 предпочтительно имеет добавки, выполненные с возможностью использования в ультразвуковых исследованиях, имеющие более высокую концентрацию, создающую сильное эхо, как описано выше. Внутренний композитный материал 208 предпочтительно имеет добавки, выполненные с возможностью использования в маммографии, с высокой степенью рентгенопрозрачности, как описано выше.
В альтернативном варианте внешний композитный материал 204 предпочтительно имеет добавки, имеющие более высокую концентрацию вблизи оболочки, служащие в качестве барьера/буфера для диффузии, как описано выше. Внутренний композитный материал 208 предпочтительно имеет большую концентрацию добавок по мере увеличения расстояния от внутренней оболочки 206, создающую градиент диффузии, направленный внутрь, как описано выше.
В альтернативном варианте внешний композитный материал 204 предпочтительно имеет меньшую концентрацию армирующих добавок, создающую менее жесткий материал имплантата ближе к поверхности. Внутренний композитный материал 208 предпочтительно имеет более высокую концентрацию добавок, а следовательно, большее армирование. В альтернативном варианте внутренний композитный материал 208 имеет более высокую концентрацию добавок по мере увеличения расстояния от внутренней оболочки 206.
Необязательно каждая из внешней оболочки 202 и внутренней оболочки 206 закрыта лоскутом, изготовленным из таких же силиконовых эластомеров, как соответствующая оболочка 202 и 206, и заклеена с помощью клейкого компонента небольшим силиконовым колпачком 210 на внутренней стороне заднего лоскута 212, используемым для наполнения имплантата композитным материалом. Необязательно внутренняя оболочка 206 расположена концентрично внутри внешней оболочки 202 и приклеена к ней у основания 214.
Различные другие расположения оболочки и/или других компонентов, представленные в заявке на патент США №20090299473, поданной 24 апреля 2006 года, включенной в данный документ посредством ссылки, как если бы она была полностью изложена в данном документе, которая находится в совместной собственности с данной заявкой, и которая имеет с ней по меньшей мере одного общего изобретателя, также могут необязательно быть использованы дополнительно или в качестве альтернативного варианта.
Сейчас обратимся к фигурам 3А и 3В, представляющим собой маммографические изображения груди с имплантатом известного уровня техники и груди с имплантатом по данному изобретению, соответственно. Как показано на маммограмме 300, имплантат 302 известного уровня техники выглядит полностью белым (непрозрачным для рентгеновских лучей), не показывая деталей ткани перед ним или за ним. Как показано на маммограмме 300, имплантат 302 выглядит полностью белым (непрозрачным для рентгеновских лучей), не показывая деталей ткани перед ним или за ним. Ткань груди 304, не затемненная имплантатом, видна на маммограмме 300.
В противоположность этому, на маммограмме 310 груди 314 с имплантатом 312 по данному изобретению ткань 316 груди видна сквозь имплантат 312 благодаря присутствию рентгенопрозрачных добавок, как описано выше.
Сейчас обратимся к фигурам 4А и 4В, представляющим собой маммографичские изображения грудных имплантатов сверху помеченной локализационной таблички и груди индейки. Фигура 4А показывает имплантат известного уровня техники, а фигура 4В показывает имплантат согласно данному изобретению. Обе маммограммы были выполнены с одинаковыми параметрами толщины и выдержки.
Как показано на фигуре 4А, на маммограмме 400 имплантат известного уровня техники 402 почти полностью затемняет локализационную табличку 404. В противоположность этому, на фигуре 4В на маммограмме 410, показывающей имплантат 412 по данному изобретению, видна надпись на локализационной табличке 414 сквозь имплантат 412. Это достигается благодаря рентгенопрозрачности добавок в имплантате 412, как описано выше.
Сейчас обратимся к фигурам 5А-5D, представляющим собой ультразвуковые изображения груди с имплантатами известного уровня техники (5А, 5С) и имплантатами по данному изобретению (5В, 5D). Как показано на фигуре 5А, оболочка 502 имплантата известного уровня техники видна на ультразвуковом изображении 500, полученном с помощью зонда 12 МГц. Верхняя часть изображения 500 представляет собой поверхность соприкосновения зонда с кожей. Далее представлена ткань 502, содержащая кожу, жир, железы и другие ткани, а за ней оболочка силиконового имплантата 504. Гель 508 виден как черная зона. Отражения, видимые как визуальные помехи 506, вызванные имплантатом, видны также на изображении 500 в зоне, которая должна быть черной (гель 508). Видно, что эти помехи распространяются на 1,5 см в зону изображения 500. Помехи распространяются также над оболочкой, создавая облако, подобное снегу, над зоной ткани 502 на изображении, предназначенном для диагностики.
В противоположность этому, полученное при 12 МГц ультразвуковое изображение 510 груди с имплантатом по данному изобретению показывает очень мало визуальных помех 516, а ткань 512, оболочка 514 и материал имплантата 518 не затемнены помехами, как на ультразвуковом изображении 500.
Аналогичным образом фигура 5С показывает ультразвуковое изображение 520, полученное с помощью зонда 17 МГц, на котором видны как оболочка имплантата 522, так и визуальные помехи, вызванные имплантатом 524. Эхогенные границы на поверхности раздела оболочки 522 кажутся толстыми, представляя радиологу оболочку более толстой чем она есть на самом деле. В противоположность этому, полученное при 17 МГц ультразвуковое изображение 530 груди с имплантатом по данному изобретению показывает намного меньше визуальных помех 534, а ткань 532, оболочка 534 и материал имплантата 538 не затемнены и не искажены помехами, как на ультразвуковом изображении 520.
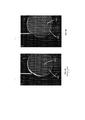
Сейчас обратимся к фигурам 6А-6В, представляющим собой фотоснимки и график, показывающие сравнение диффузии геля имплантата известного уровня техники и композитного материала по данному изобретению. Фигура 6А показывает таблицу 600 со следующими строками: строка прошедшего времени 602, строка геля известного уровня техники 604 и строка композитного материала имплантата 606. Каждая из строк 604 и 606 показывает серию фотоснимков образцов геля/композитного материала одинакового размера, помещенных на впитывающую бумагу 610. Гель 612 взят из имплантата известного уровня техники, а композитный материал 614 представляет собой композитный материал по данному изобретению, содержащий добавки, уменьшающие диффузию.
Столбец 622 показывает фотоснимки, полученные во время = 0, то есть: непосредственно после помещения геля/материала на место; столбец 623 показывает те же материалы, сфотографированные через 2 дня и 7,5 часов; столбец 624 показывает те же материалы, сфотографированные через 5 дней и 4 часа; столбец 625 показывает те же материалы, сфотографированные через 17 дней и 10 часов; столбец 626 показывает те же материалы, сфотографированные через 33 дня и 17 часов; и столбец 627 показывает те же материалы, сфотографированные через 82 дня и 19 часов.
Фигура 6В показывает график 650, представляющий графически отношение прошедшего времени 602 (в часах) и расчетной смоченной площади 652 (в мм) впитывающей бумаги 610, как показано на фотоснимках фигуры 6А.
Как показано в столбце 623, через 2 дня и 7,5 часов растворитель из геля известного уровня техники 612 диффундировал значительно больше растворителя из композитного материала 614 по данному изобретению. Разница очевидна из большего диаметра диффундировавшего растворителя 616 известного уровня техники по сравнению с диаметром диффундировавшего растворителя 618 по данному изобретению. Аналогичным образом, в столбцах 624-627 растворитель из геля известного уровня техники 612 диффундировал значительно больше растворителя из композитного материала 614 по данному изобретению. График 650 показывает большую диффузию растворителя геля известного уровня техники (строка 654) по сравнению с растворителем композитного материала по данному изобретению (строка 656).
Следует отметить, что впитывающая бумага 610 не сравнима с человеческим телом, поскольку растворитель (на бумаге) не удаляется, и поэтому скорость диффузии (на бумаге) на самом деле замедлена. В человеческом теле большая часть растворителя удалятся или рассеивается различными биологическими механизмами, и градиент диффузии остается высоким. Тем не менее, впитывающая бумага 610 иллюстрирует значительную разницу между материалом известного уровня техники и композитным материалом по данному изобретению.
Таким образом, в течение длительного времени существует значительное различие в общем количестве растворителя, способного выйти в тело. Композитный материал по данному изобретению имеет меньшую скорость диффузии и высвобождает значительно меньшее общее количество растворителя. Это потенциально может проявляться в виде меньшей вероятности лимфаденопатии, даже в случае разрыва.
Сейчас обратимся к фигуре 7, представляющей собой набор реологических графиков, показывающих сравнение модуля упругости геля имплантата известного уровня техники и трех альтернативных композитных материалов по данному изобретению. Реологическая характеристика представляет результаты измерения динамического модуля упругости (С) в виде функции скорости сдвига (частота, измеряемая в Гц или рад/с). График показывает реологические характеристики четырех различных материалов, причем 702 представляет собой реологический график геля имплантата известного уровня техники, а 704, 706 и 708 представляют собой реологические графики материалов имплантатов по данному изобретению, каждый из которых содержит различные добавки в различных концентрациях.
Как показано, материалы имплантатов по данному изобретению демонстрируют увеличенный модуль упругости по сравнению с гелем имплантата известного уровня техники (график 702), а композитный материал графика 708 показывает наибольшее увеличение модуля упругости.
Хотя изобретение описано относительно ограниченного количества вариантов реализации, следует понимать, что оптимальные отношения размеров частей изобретения, а также вариации размера, материала, геометрии, формы функций и способа действия, сборки и применения, считаются очевидно выраженными и понятными для специалиста, подготовленного в данной области техники, а все соотношения, эквивалентные показанным на графических материалах и описанным в спецификации, охватываются данным изобретением.
Таким образом, предыдущее описание считается только иллюстрацией принципов изобретения. Кроме того, поскольку многочисленные модификации и изменения легко придут на ум специалисту, подготовленному в данной области техники, описание не ограничивает изобретение точной показанной и описанной конструкцией и способом действия, и соответственно все подходящие модификации и эквиваленты могут считаться входящими в объем изобретения.
После описания конкретных предпочтительных вариантов реализации изобретения со ссылкой на прилагаемые графические материалы будет понятно, что данное изобретение не ограничено этими точными вариантами реализации изобретения, и что специалист, имеющий обычную подготовку в данной области техники, может внести в них различные изменения и модификации, не выходящие за рамки объема или идеи изобретения, определяемых приложенной формулой изобретения.
Дополнительные модификации также придут на ум лицам, подготовленным в данной области техники, и все они считаются соответствующими объему и идее изобретения, определенным приложенной формулой изобретения.
Хотя изобретение было описано относительно ограниченного количества вариантов реализации изобретения, будет понятно, что могут быть предложены многие изменения, модификации и варианты применения изобретения.
Claims (26)
1. Протезный имплантат, подходящий для имплантации в человеческое тело, содержащий композитный материал, который содержит основной материал и множество добавок, причем указанный основной материал содержит силиконовый гель, причем
a) указанные добавки выбраны из рентгенопрозрачных добавок и/или гиперэхогенных добавок;
b) указанные добавки выбраны так, что при частоте 1 Гц модуль упругости указанного композитного материала больше модуля упругости указанного основного материала, и причем указанный модуль упругости больше модуля упругости указанного основного материала по меньшей мере на 20%;
c) указанные добавки имеют среднеквадратичное значение шероховатости поверхности от 0,2 до 40 нм; и
d) указанные добавки имеют размер не более 500 мкм, где разница между их размерами составляет по меньшей мере 20%.
2. Имплантат по п. 1, отличающийся тем, что указанные добавки выбраны из группы, состоящей из:
a) добавок, содержащих по меньшей мере один из таких материалов как: стекло, керамика, металл, полимеры, ПММА, полиакрилонитрил, полибутадиен, ПЭЭК, натуральный каучук, синтетический каучук, аморфный полимер или полукристаллический полимер;
b) добавок, содержащих элементы трехмерной формы, в том числе сферы, волокна, пластинки, хлопья, бесформенные элементы, кристаллы, полусферы, стержни, диски или комбинации этих форм или неправильные варианты этих форм;
c) полостных добавок;
d) пористых добавок;
e) монолитных добавок;
f) добавок, содержащих по меньшей мере 2 материала;
g) добавок, содержащих газ;
h) добавок, содержащих нерастворяющую жидкость;
i) добавок, содержащих несиликоновый гель;
j) добавок, выполненных в виде микрополостей; и
k) комбинаций указанного выше.
3. Имплантат по п. 1, содержащий множество оболочек, в том числе по меньшей мере одну внутреннюю оболочку и по меньшей мере одну внешнюю оболочку, причем указанная по меньшей мере одна внутренняя оболочка по меньшей мере частично окружена указанной внешней оболочкой, причем указанная внешняя оболочка заполнена указанным основным материалом и множеством гиперэхогенных добавок, и причем указанная внутренняя оболочка заполнена указанным основным материалом и множеством рентгенопрозрачных добавок.
4. Имплантат по п. 1, отличающийся тем, что объемное содержание указанных добавок выбрано из группы, состоящей из следующего:
a) указанные добавки составляют до 60% объема композитного материала, и
b) указанные добавки составляют до 90% объема композитного материала.
5. Имплантат по любому из пп. 1-4, отличающийся тем, что указанный основной материал содержит растворитель, и указанные добавки выбраны для обеспечения большой совокупной площади поверхности так, что концентрация растворителя в указанном композитном материале составляет 5-95% концентрации растворителя в указанном основном материале.
6. Имплантат по любому из пп. 1-5, отличающийся тем, что указанные добавки выбраны так, что при частоте 1 Гц модуль упругости указанного композитного материала на 20-5000% больше модуля упругости указанного основного материала.
7. Имплантат по любому из пп. 1-6, отличающийся тем, что указанный модуль упругости на 100-1000% больше, чем модуль упругости указанного основного материала.
8. Имплантат по любому из пп. 1-7, отличающийся тем, что указанный модуль упругости на 100-500% больше, чем модуль упругости указанного основного материала.
9. Имплантат по любому из пп. 1-8, содержащий множество оболочек, в том числе по меньшей мере одну внутреннюю оболочку и по меньшей мере одну внешнюю оболочку, причем указанная по меньшей мере одна внутренняя оболочка по меньшей мере частично окружена указанной внешней оболочкой, причем указанная внешняя оболочка заполнена указанным основным материалом и добавками в низкой концентрации, и причем указанная внутренняя оболочка заполнена указанным основным материалом и добавками в высокой концентрации.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562132078P | 2015-03-12 | 2015-03-12 | |
| US201562132071P | 2015-03-12 | 2015-03-12 | |
| US62/132,078 | 2015-03-12 | ||
| US62/132,071 | 2015-03-12 | ||
| US201562153608P | 2015-04-28 | 2015-04-28 | |
| US62/153,608 | 2015-04-28 | ||
| PCT/IL2016/050277 WO2016142949A1 (en) | 2015-03-12 | 2016-03-13 | Composite implant material |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2017132258A RU2017132258A (ru) | 2019-04-12 |
| RU2017132258A3 RU2017132258A3 (ru) | 2019-08-23 |
| RU2727976C2 true RU2727976C2 (ru) | 2020-07-28 |
Family
ID=56880025
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017132258A RU2727976C2 (ru) | 2015-03-12 | 2016-03-13 | Композитный материал для имплантатов |
Country Status (15)
| Country | Link |
|---|---|
| US (2) | US10933165B2 (ru) |
| EP (1) | EP3267942B1 (ru) |
| JP (1) | JP6940917B2 (ru) |
| KR (1) | KR102612116B1 (ru) |
| CN (1) | CN107427357B (ru) |
| AU (1) | AU2016230679B2 (ru) |
| BR (1) | BR112017019431B1 (ru) |
| CA (1) | CA2979385A1 (ru) |
| CO (1) | CO2017010151A2 (ru) |
| CR (1) | CR20170466A (ru) |
| ES (1) | ES2922986T3 (ru) |
| IL (1) | IL254462B2 (ru) |
| MX (1) | MX2017011656A (ru) |
| RU (1) | RU2727976C2 (ru) |
| WO (1) | WO2016142949A1 (ru) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3367970B1 (en) * | 2015-10-30 | 2021-09-08 | Power-Cooper, Jeannette | Post-lumpectomy breast implant |
| US20180140410A1 (en) * | 2016-11-21 | 2018-05-24 | William A. Brennan | Cosmetic implant |
| CN111770739A (zh) * | 2018-02-18 | 2020-10-13 | G & G生物技术有限公司 | 具有增强的壳粘附性的植入物 |
| US11710234B2 (en) * | 2018-10-03 | 2023-07-25 | Establishment Labs S.A. | Systems and methods of monitoring medical implants |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997026025A1 (en) * | 1996-01-15 | 1997-07-24 | British Technology Group Limited | Compacted biomaterials |
| RU2197509C1 (ru) * | 2001-06-08 | 2003-01-27 | Институт элементоорганических соединений им. А.Н. Несмеянова | Полимерная композиция биомедицинского назначения |
| RU2233644C1 (ru) * | 2002-12-09 | 2004-08-10 | Федеральное государственное унитарное предприятие "Федеральный научно-практический центр медико-социальной экспертизы и реабилитации инвалидов" | Способ изготовления экзопротеза молочной железы |
| WO2006069677A2 (en) * | 2004-12-30 | 2006-07-06 | Cinvention Ag | Combination comprising an agent providing a signal, an implant material and a drug |
| US20090299473A1 (en) * | 2005-04-25 | 2009-12-03 | Jacky Govrin-Yehudian | Lightweight implantable prosthetic device |
| WO2011086537A2 (en) * | 2010-01-18 | 2011-07-21 | G & G Biotechnology Ltd | Lightweight breast implant material |
| WO2013070290A1 (en) * | 2011-11-09 | 2013-05-16 | Ideal Implant Incorporated | Breast implant with low coefficient of friction between internal shells in an aqueous fluid environment |
Family Cites Families (103)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2797201A (en) | 1953-05-11 | 1957-06-25 | Standard Oil Co | Process of producing hollow particles and resulting product |
| US2676892A (en) | 1953-11-13 | 1954-04-27 | Kanium Corp | Method for making unicellular spherulized clay particles and articles and composition thereof |
| NL232500A (ru) | 1957-10-22 | |||
| US3189662A (en) | 1961-01-23 | 1965-06-15 | Gen Electric | Organopolysiloxane-polycarbonate block copolymers |
| US3247158A (en) | 1962-02-07 | 1966-04-19 | Standard Oil Co | Filled plastisol compositions |
| US3230184A (en) | 1962-03-06 | 1966-01-18 | Standard Oil Co | Glass microsphere and fiber filled polyester resin composition |
| US3308491A (en) | 1965-12-22 | 1967-03-14 | Stryker Corp | Cushion structure |
| US3548420A (en) | 1967-03-06 | 1970-12-22 | Stryker Corp | Cushion structure |
| US3622437A (en) | 1969-05-09 | 1971-11-23 | Gen Dynamics Corp | Composite buoyancy material |
| US3683424A (en) | 1970-01-30 | 1972-08-15 | William J Pangman | Surgically implantable compound breast prosthesis |
| US3681787A (en) | 1971-03-26 | 1972-08-08 | Moxness Products Inc | Implantable breast prosthesis filled with gels of different densities |
| GB1373055A (en) | 1971-07-06 | 1974-11-06 | Gen Electric | Organosiloxane gel |
| US3811133A (en) | 1972-08-31 | 1974-05-21 | E Harris | Weighted prosthetic breast |
| US3986213A (en) | 1975-05-27 | 1976-10-19 | Medical Engineering Corporation | Gel filled medical devices |
| US4019209A (en) | 1976-04-22 | 1977-04-26 | Spenco Medical Corporation | Artificial breast form and method of forming |
| US4021589A (en) | 1976-04-28 | 1977-05-03 | Emerson & Cuming, Inc. | Buoyancy materials |
| US4470160A (en) | 1980-11-21 | 1984-09-11 | Cavon Joseph F | Cast gel implantable prosthesis |
| US4298998A (en) | 1980-12-08 | 1981-11-10 | Naficy Sadeque S | Breast prosthesis with biologically absorbable outer container |
| US4380569A (en) | 1981-08-03 | 1983-04-19 | Spenco Medical Corporation | Lightweight preformed stable gel structures and method of forming |
| US4773909A (en) | 1981-10-06 | 1988-09-27 | Memorial Hospital For Cancer And Allied Diseases | Multi-lumen high profile mammary implant |
| US4459145A (en) | 1982-09-30 | 1984-07-10 | The United States Of America As Represented By The United States Department Of Energy | Fabrication of glass microspheres with conducting surfaces |
| EP0125400B1 (de) | 1983-04-18 | 1987-07-01 | EBERL, Tertulin | Brustprothese |
| DE3440960A1 (de) | 1984-10-13 | 1986-04-24 | S + G Implants GmbH, 2400 Lübeck | Prothese als ersatzfuer eine amputierte brust |
| KR930004059B1 (ko) | 1984-12-28 | 1993-05-19 | 가부시끼가이샤 큐우빅 엔지니어링 | 완충재용 복합형 실리콘겔재 |
| US4650889A (en) | 1985-11-29 | 1987-03-17 | Dow Corning Corporation | Silane coupling agents |
| US4849456A (en) | 1986-10-30 | 1989-07-18 | Watercolour Bath Products, Inc. | Fillers for use in casting marble products and cast marble products formed therefrom |
| DE8701925U1 (ru) | 1987-02-09 | 1987-07-16 | Eberl, Tertulin, 8122 Penzberg, De | |
| US5282856A (en) | 1987-12-22 | 1994-02-01 | Ledergerber Walter J | Implantable prosthetic device |
| DE68904665T2 (de) | 1988-03-17 | 1993-09-02 | Kuraray Co | Haertbare harzzusammensetzung. |
| US5011494A (en) | 1988-09-16 | 1991-04-30 | Clemson University | Soft tissue implant with micron-scale surface texture to optimize anchorage |
| AU5154390A (en) * | 1989-02-15 | 1990-09-05 | Microtek Medical, Inc. | Biocompatible material and prosthesis |
| US5081997A (en) * | 1989-03-09 | 1992-01-21 | Vance Products Incorporated | Echogenic devices, material and method |
| US4992312A (en) | 1989-03-13 | 1991-02-12 | Dow Corning Wright Corporation | Methods of forming permeation-resistant, silicone elastomer-containing composite laminates and devices produced thereby |
| US5147398A (en) | 1990-05-04 | 1992-09-15 | Lynn Lawrence A | Multiple compartment breast prosthesis |
| US5723006A (en) | 1991-02-22 | 1998-03-03 | Ledergerber; Walter J. | Breast implant introducer |
| US5246454A (en) | 1991-07-22 | 1993-09-21 | Peterson Robert L | Encapsulated implant |
| US5171269A (en) | 1991-08-29 | 1992-12-15 | Medical Engineering Corporation | Mammary prosthesis |
| US5202362A (en) | 1991-09-09 | 1993-04-13 | Intech Specialties Co., Inc. | Syringeable ear plug molding putty composition |
| US5236454A (en) | 1991-11-04 | 1993-08-17 | Miller Archibald S | Stacked breast implant |
| US5258578A (en) | 1992-02-18 | 1993-11-02 | Minnesota Mining And Manufacturing Company | Closure end seal |
| US5358521A (en) | 1992-04-01 | 1994-10-25 | Fred Shane | Multiple-layer prosthesis implant with tissue tactility |
| AU4381793A (en) | 1992-05-20 | 1993-12-13 | Cytrx Corporation | Gel composition for implant prosthesis and method of use |
| US5534023A (en) | 1992-12-29 | 1996-07-09 | Henley; Julian L. | Fluid filled prosthesis excluding gas-filled beads |
| US5496367A (en) | 1993-01-13 | 1996-03-05 | Fisher; Jack | Breast implant with baffles |
| US5480430A (en) | 1993-06-04 | 1996-01-02 | Mcghan Medical Corporation | Shape-retaining shell for a fluid filled prosthesis |
| US5590430A (en) | 1993-10-15 | 1997-01-07 | Sereboff; Joel L. | Gel filled deformable cushion and composition contained therein |
| US5437824A (en) | 1993-12-23 | 1995-08-01 | Moghan Medical Corp. | Method of forming a molded silicone foam implant having open-celled interstices |
| US5549671A (en) | 1994-12-28 | 1996-08-27 | Mcghan Medical Corporation | Adjunctive filler material for fluid-filled prosthesis |
| US5741877A (en) | 1995-02-21 | 1998-04-21 | Tiffany; John S. | Silicone pseudogel |
| US5545217A (en) | 1995-04-20 | 1996-08-13 | C.M. Offray & Son, Inc. | Breast implant |
| EP0874604B1 (en) | 1995-11-29 | 2004-03-10 | Jack Fisher | Breast implant with baffles |
| US5776159A (en) | 1996-10-03 | 1998-07-07 | General Surgical Innovations, Inc. | Combination dissector and expander |
| US6146418A (en) | 1997-02-28 | 2000-11-14 | Berman; Mark | Body implant and method of implanting |
| US6271278B1 (en) | 1997-05-13 | 2001-08-07 | Purdue Research Foundation | Hydrogel composites and superporous hydrogel composites having fast swelling, high mechanical strength, and superabsorbent properties |
| US5902335A (en) | 1997-10-01 | 1999-05-11 | Capital Marketing Technologies, Inc. | Multiple section breast prosthesis |
| US6638308B2 (en) | 1997-10-10 | 2003-10-28 | John D. Corbitt, Jr. | Bioabsorbable breast implant |
| FR2770220B1 (fr) | 1997-10-29 | 2003-01-31 | Rhodia Chimie Sa | Composition silicone reticulable en gel adhesif et amortisseur avec microspheres |
| GB9815080D0 (en) | 1998-07-10 | 1998-09-09 | Dow Corning Sa | Compressible silicone composition |
| US6478656B1 (en) | 1998-12-01 | 2002-11-12 | Brava, Llc | Method and apparatus for expanding soft tissue with shape memory alloys |
| US6544287B1 (en) | 1998-12-11 | 2003-04-08 | Gerald W. Johnson | Solid filled implants |
| DE19935494C1 (de) | 1999-07-28 | 2000-12-14 | Amoena Med Orthopaedie Tech | Verfahren zur Herstellung von Brustprothesen |
| US6183514B1 (en) | 1999-08-16 | 2001-02-06 | Hilton Becker | Self positioning breast prosthesis |
| WO2001030272A1 (en) | 1999-10-22 | 2001-05-03 | Miller Archibald S | Breast implant |
| US6387981B1 (en) | 1999-10-28 | 2002-05-14 | 3M Innovative Properties Company | Radiopaque dental materials with nano-sized particles |
| CN2457979Y (zh) * | 1999-11-26 | 2001-11-07 | 广州市万和整形材料有限公司 | 一种人工乳房假体 |
| CN1179756C (zh) * | 1999-11-26 | 2004-12-15 | 广州市万和整形材料有限公司 | 水凝胶人工乳房假体的制作方法 |
| US6967221B2 (en) | 2000-06-29 | 2005-11-22 | Shin-Etsu Chemical Co., Ltd. | Hollow filler-containing silicone rubber and method of production |
| US6464726B1 (en) | 2000-07-13 | 2002-10-15 | Jenna Heljenek | Breast implant system and method of augmentation |
| US6786930B2 (en) | 2000-12-04 | 2004-09-07 | Spineco, Inc. | Molded surgical implant and method |
| DE20101174U1 (de) | 2001-01-23 | 2002-05-29 | Amoena Med Orthopaedie Tech | Brustprothese |
| US6835763B2 (en) | 2001-02-01 | 2004-12-28 | I-Tek, Inc. | Lightweight material for protective pads, cushions, supports or the like and method |
| US7575596B2 (en) | 2001-02-21 | 2009-08-18 | Amoena Medizin-Orthopädie-Technik GmbH | Two-layer external breast prosthesis with self-shaping feature and process for the manufacture thereof |
| JP2002296940A (ja) | 2001-03-29 | 2002-10-09 | Ge Toshiba Silicones Co Ltd | 熱定着ロール用シリコーンゴム組成物 |
| CN1273994C (zh) | 2001-04-06 | 2006-09-06 | 世界财产股份有限公司 | 导电性有机硅及其制造方法 |
| ES2190339B1 (es) | 2001-05-07 | 2004-11-01 | Ricardo Gonzalez De Vicente | Protesis para mama. |
| NL1019023C2 (nl) | 2001-09-24 | 2003-03-25 | Mentor Medical Systems B V | Inrichting en werkwijze voor het vervaardigen van een siliconen omhulsel voor een borstimplantaat. |
| US6755861B2 (en) | 2001-10-16 | 2004-06-29 | Granit Medical Innovation, Inc. | Device for providing a portion of an organism with a desired shape |
| US6857932B2 (en) | 2002-02-14 | 2005-02-22 | Bragel International, Inc. | Breast form encased with fabric laminated thermoplastic film |
| US6733893B2 (en) | 2002-08-02 | 2004-05-11 | Dow Corning Corporation | Coated silicone rubber article and method of preparing same |
| DE20215801U1 (de) | 2002-10-15 | 2003-01-16 | Thaemert Orthopaedische Hilfsmittel Gmbh & Co Kg | Brustprothese mit einer Haftschicht |
| US7736391B2 (en) | 2003-02-06 | 2010-06-15 | Tonaba Healthscience Ii, Llc | Cosmetic and reconstructive prostheses with a microencapsulated biologically compatible rupture indicator for sustained release and methods of detecting compromise of a prosthesis |
| US6802861B1 (en) | 2003-08-26 | 2004-10-12 | Rsh-Gs Trust | Structured breast implant |
| KR100543703B1 (ko) | 2003-09-08 | 2006-01-20 | 삼성전자주식회사 | 포인팅 장치 및 그 방법 |
| DE202004003278U1 (de) | 2004-03-03 | 2004-05-13 | Thämert Orthopädische Hilfsmittel GmbH & Co. KG | Brustprothese |
| US7090721B2 (en) | 2004-05-17 | 2006-08-15 | 3M Innovative Properties Company | Use of nanoparticles to adjust refractive index of dental compositions |
| DE202004011988U1 (de) | 2004-07-30 | 2005-12-08 | Amoena Medizin-Orthopädie-Technik GmbH | Brustprothese |
| US6932840B1 (en) | 2004-09-08 | 2005-08-23 | Absolute Breast Solutions | Implant device |
| GB2421440A (en) | 2004-12-21 | 2006-06-28 | Ishay Wahl | Breast implant with securing means |
| US20060224239A1 (en) | 2005-04-04 | 2006-10-05 | Tiahrt Leif K | Breast implant |
| US20060282164A1 (en) | 2005-06-08 | 2006-12-14 | Joann Seastrom | Implant shell and filler apparatus |
| US20070050027A1 (en) | 2005-08-24 | 2007-03-01 | Mcghan Donald K | Leak-proof breast implant |
| US7615074B2 (en) | 2005-08-25 | 2009-11-10 | Carvallo Edward | Method and apparatus for reconstructive surgery |
| AU2006306193B2 (en) | 2005-10-26 | 2013-07-04 | Allergan, Inc. | Variable cohesive gel form-stable breast implant |
| US20070293945A1 (en) | 2006-06-14 | 2007-12-20 | Johnny Snyder | Lightweight breast prosthesis |
| US7988106B2 (en) | 2007-02-23 | 2011-08-02 | Carnevali Jeffrey D | Adaptive mounting structure |
| EP3677222A1 (en) | 2007-07-27 | 2020-07-08 | Allergan, Inc. | All-barrier elastomeric gel-filled breast prosthesis |
| TWM342043U (en) | 2008-05-27 | 2008-10-11 | jun-kai Huang | Light-weight breast shaping device |
| BRPI0917988A2 (pt) * | 2008-08-13 | 2015-11-17 | Allergan Inc | revestimento suave de prótese preenchida com superfícies de fixação distintas |
| CA3054722A1 (en) * | 2010-07-08 | 2012-01-12 | Lifecell Corporation | Method for shaping tissue matrices |
| US8562679B2 (en) | 2010-09-16 | 2013-10-22 | American Breat Care, LP | Three layer breast prosthesis |
| WO2014093669A1 (en) | 2012-12-13 | 2014-06-19 | Allergan, Inc. | Device and method for making a variable surface breast implant |
| US9486309B2 (en) * | 2014-04-25 | 2016-11-08 | Allergan, Inc. | Lighter weight implant |
| KR101741795B1 (ko) | 2016-02-19 | 2017-05-30 | 오스템임플란트 주식회사 | 안정성이 우수한 실리콘 보형물 |
-
2016
- 2016-03-13 RU RU2017132258A patent/RU2727976C2/ru active
- 2016-03-13 AU AU2016230679A patent/AU2016230679B2/en active Active
- 2016-03-13 KR KR1020177026739A patent/KR102612116B1/ko active IP Right Grant
- 2016-03-13 CN CN201680015309.5A patent/CN107427357B/zh active Active
- 2016-03-13 WO PCT/IL2016/050277 patent/WO2016142949A1/en active Application Filing
- 2016-03-13 MX MX2017011656A patent/MX2017011656A/es unknown
- 2016-03-13 JP JP2017566230A patent/JP6940917B2/ja active Active
- 2016-03-13 EP EP16761210.0A patent/EP3267942B1/en active Active
- 2016-03-13 BR BR112017019431-7A patent/BR112017019431B1/pt active IP Right Grant
- 2016-03-13 CR CR20170466A patent/CR20170466A/es unknown
- 2016-03-13 CA CA2979385A patent/CA2979385A1/en active Pending
- 2016-03-13 ES ES16761210T patent/ES2922986T3/es active Active
-
2017
- 2017-09-12 IL IL254462A patent/IL254462B2/en unknown
- 2017-09-12 US US15/701,883 patent/US10933165B2/en active Active
- 2017-10-05 CO CONC2017/0010151A patent/CO2017010151A2/es unknown
-
2021
- 2021-01-21 US US17/153,925 patent/US20210244856A1/en active Pending
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997026025A1 (en) * | 1996-01-15 | 1997-07-24 | British Technology Group Limited | Compacted biomaterials |
| RU2197509C1 (ru) * | 2001-06-08 | 2003-01-27 | Институт элементоорганических соединений им. А.Н. Несмеянова | Полимерная композиция биомедицинского назначения |
| RU2233644C1 (ru) * | 2002-12-09 | 2004-08-10 | Федеральное государственное унитарное предприятие "Федеральный научно-практический центр медико-социальной экспертизы и реабилитации инвалидов" | Способ изготовления экзопротеза молочной железы |
| WO2006069677A2 (en) * | 2004-12-30 | 2006-07-06 | Cinvention Ag | Combination comprising an agent providing a signal, an implant material and a drug |
| US20090299473A1 (en) * | 2005-04-25 | 2009-12-03 | Jacky Govrin-Yehudian | Lightweight implantable prosthetic device |
| WO2011086537A2 (en) * | 2010-01-18 | 2011-07-21 | G & G Biotechnology Ltd | Lightweight breast implant material |
| WO2013070290A1 (en) * | 2011-11-09 | 2013-05-16 | Ideal Implant Incorporated | Breast implant with low coefficient of friction between internal shells in an aqueous fluid environment |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2979385A1 (en) | 2016-09-15 |
| RU2017132258A3 (ru) | 2019-08-23 |
| JP2018510043A (ja) | 2018-04-12 |
| RU2017132258A (ru) | 2019-04-12 |
| ES2922986T3 (es) | 2022-09-22 |
| EP3267942B1 (en) | 2022-05-04 |
| KR20170132167A (ko) | 2017-12-01 |
| JP6940917B2 (ja) | 2021-09-29 |
| WO2016142949A1 (en) | 2016-09-15 |
| BR112017019431B1 (pt) | 2022-11-08 |
| CN107427357A (zh) | 2017-12-01 |
| IL254462B (en) | 2022-10-01 |
| CR20170466A (es) | 2018-02-02 |
| KR102612116B1 (ko) | 2023-12-08 |
| EP3267942A4 (en) | 2018-10-31 |
| IL254462B2 (en) | 2023-02-01 |
| AU2016230679A1 (en) | 2017-09-21 |
| AU2016230679B2 (en) | 2020-04-30 |
| US20210244856A1 (en) | 2021-08-12 |
| BR112017019431A2 (pt) | 2018-04-24 |
| CO2017010151A2 (es) | 2018-03-20 |
| EP3267942A1 (en) | 2018-01-17 |
| US10933165B2 (en) | 2021-03-02 |
| MX2017011656A (es) | 2018-06-07 |
| IL254462A0 (en) | 2017-11-30 |
| CN107427357B (zh) | 2021-04-30 |
| US20180000991A1 (en) | 2018-01-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20210244856A1 (en) | Composite implant material | |
| US10213293B2 (en) | Lightweight breast implant material | |
| EP1592365B1 (en) | Solid implant | |
| US4795463A (en) | Labeled breast prosthesis and methods for detecting and predicting rupture of the prosthesis | |
| Young et al. | Breast implant research: where we have been, where we are, where we need to go | |
| Dunn et al. | Breast implant materials: sense and safety | |
| EP0177288A2 (en) | Labeled breast prosthesis and methods for detecting and predicting rupture of the prosthesis | |
| WO2003026537A1 (en) | Breast prosthesis filled with fibers | |
| Newman | Mammographic evaluation of the augmented breast | |
| Ravera | Diagnostic imaging of the breast in aesthetic breast surgery | |
| DeBruhl et al. | Imaging after breast implants | |
| Collis et al. | Breast implant controversy: an update |