RU2566818C2 - Способ получения (±)n-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида или его фармацевтически приемлемых солей и промежуточное соединение для его получения - Google Patents
Способ получения (±)n-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида или его фармацевтически приемлемых солей и промежуточное соединение для его получения Download PDFInfo
- Publication number
- RU2566818C2 RU2566818C2 RU2013150716/04A RU2013150716A RU2566818C2 RU 2566818 C2 RU2566818 C2 RU 2566818C2 RU 2013150716/04 A RU2013150716/04 A RU 2013150716/04A RU 2013150716 A RU2013150716 A RU 2013150716A RU 2566818 C2 RU2566818 C2 RU 2566818C2
- Authority
- RU
- Russia
- Prior art keywords
- fluorophenyl
- ethyl
- ethylpiperidin
- formula
- obtaining
- Prior art date
Links
- STSQHGMNQPXBLZ-UHFFFAOYSA-N CCN1CCC(CC(c(cc2)ccc2F)NC(c(cc2)ccc2[N+]([O-])=O)=O)CC1 Chemical compound CCN1CCC(CC(c(cc2)ccc2F)NC(c(cc2)ccc2[N+]([O-])=O)=O)CC1 STSQHGMNQPXBLZ-UHFFFAOYSA-N 0.000 description 1
Abstract
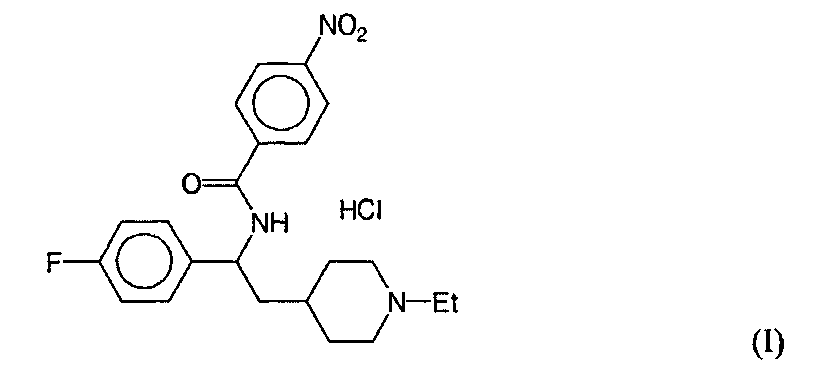
Изобретение относится к новому способу получения (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида, соответствующему структурной формуле (I), или его фармацевтически приемлемых солей. Преимущественно способ относится к гидрохлориду соединения формулы (I) (ниферидил гидрохлориду). Ниферидил гидрохлорид используется в качестве лекарственного средства для лечения мерцательной аритмии у людей. Согласно предлагаемому способу соединение формулы (I)
получают взаимодействием этилового эфира 4-фторбензойной кислоты с 4-пиколином в тетрагидрофуране в присутствии катализатора или конденсирующего средства, с получением 1-(4-фторфенил)-2-(4-пиридил)этанона. Предпочтительно использовать в качестве конденсирующего агента натрий бис(триметилсилил)амид в количестве 1-2 моля на моль 4-фторбензоата. Полученное соединение алкилируют этилгалогенидом с получением соответствующей пиридиниевой соли. Последнюю подвергают каталитическому восстановлению водородом в присутствии палладиевого или платинового катализатора с добавлением концентрированной соляной кислоты для получения 2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этанона формулы (II), который подвергают восстановительному аминированию с получением [2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)-этил]амина, с последующим взаимодействием последнего с хлорангидридом 4-нитробензойной кислоты с получением (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида формулы (I) в свободном виде или в виде его фармацевтически приемлемой соли. Соединение формулы (II) является новым промежуточным соединением. Способ позволяет упростить и удешевить процесс за счет сокращения количества стадий, а также повысить качество получаемого целевого продукта до 99,6% по данным ВЭЖХ. 3 н. и 2 з.п. ф-лы, 1 пр.
Description
Изобретение относится к способу синтеза биологически активного соединения (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида или его фармацевтически приемлемых солей, преимущественно его гидрохлориду (Ниферидил гидрохлорид). Ниферидил гидрохлорид используется в качестве лекарственного средства для лечения мерцательной аритмии у людей. Способ согласно настоящему изобретению позволяет упростить и удешевить процесс, за счет сокращения количества стадий синтеза, а также повысить качество целевого продукта.
Профилактика и лечение аритмий сердца является одним из самых актуальных направлений в разработке новых методов лечения в сердечно-сосудистой области, что связано с большим числом пациентов, страдающих аритмиями сердца, и высокими показателями смертности в этой группе больных. В настоящее время основное внимание исследователей привлечено к созданию антиаритмических препаратов III класса, основным эффектом которых является увеличение продолжительности потенциала действия клеток миокарда и проводящей системы сердца за счет замедления фазы реполяризации, что приводит к увеличению рефрактерных периодов. Показано, что это служит важным механизмом устранения аритмий типа кругового движения. Соединение - (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида гидрохлорид (I), получившее название ′′Нифередил гидрохлорид′′, было синтезировано и исследовано как средство, обладающее выраженной антифибрилляторной активностью при сравнительно низкой токсичности (Р.Г. Глушков и др., Хим. Фарм. Журнал, 2011, т.45, №2, с.3-12, а также Р.Г. Глушков и др. RU 2415128). Соединение соответствует структурной формуле:
Однако исследование, производство и возможное дальнейшее использование этого соединения в лечебной практике ограничиваются трудностью его синтеза. В патенте RU 2415128 описывается 11-ти стадийный метод синтеза (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида гидрохлорида (I) (Нифередила гидрохлорида) исходя из высокотоксичного и труднодоступного 4-фторфенилацетонитрила.
Известный способ осуществляют по следующей схеме:
Согласно известному способу получают 1-(4-фторфенил)-2-(4-пиридил)-пропионитрил (VI) взаимодействием 4-фторфенилацетонитрила (II) с гидрохлоридом 4-хлорметилпиридина (IV). Полученное соединение (VI) переводят в основание и конденсируют с натриевым производным этилового эфира 1-(4-фторфенил)-циануксусной кислоты (III), которое, в свою очередь, полученным из 4-фторфенилацетонитрила (II), этилата натрия и диэтил-карбоната в толуоле. Декарбоксилирование этилового эфира 1-(4-фторфенил)-1-циан-2-(4-пиридил)-пропионовой кислоты (V) проводят водным раствором гидроксида калия. Выход «пропионитрила» (VI) составляет 90%. Гидролизом «пропионитрила» (VI) получают «пропионамид» (VII), алкилирование которого приводит к образованию четвертичной соли (VIII). Четвертичную соль (VIII) получают из (VII) и бромистого этила в ацетонитриле с выходом 90-95%. Путем восстановления пиридинового кольца получают алкилзамещенный пиперидиновый цикл. Был изучен ряд катализаторов и растворителей, при этом лучшие результаты получены при гидрировании (VIII) над оксидом платины в метиловом спирте. Реакция заканчивается за 14-16 часов. Выход продукта - количественный.
После проведения гидрирования гидробромид 1-(4-фторфенил)-2-[4-(N-этилпиперидил)]-пропионамида (IX) перегруппировкой Гофмана превращают в «уретилан» (X) в присутствии метилгипобромида, который получали в процессе реакции из метилата натрия и брома. Выход на стадии составляет 85-90%. Затем «уретилан» (X) гидролизуют до «амина» (XI) в присутствии щелочи в водно-спиртовой среде. 1-(4-фторфенил)-1-амино-2-[4-(N-этилпиперидил)]-этан (XI) очищают перегонкой в вакууме и конденсируют с 4-нитробензоилхлоридом в ацетонитриле, получая конечный продукт (I). При этом чистота целевого соединения, полученного по указанному методу, не является удовлетворительной и пригодной для использования в качестве активного фармацевтического ингредиента, что видно из растянутой в 10°C точки плавления (218-227°C). Указанный в патенте RU 2415128 метод получения соединения (I) затруднителен для использования и масштабирования в промышленных количествах с выходом к фармацевтической субстанции надлежащего качества.
Задачей настоящего изобретения является упрощение и удешевление процесса синтеза, сокращение количества стадий синтеза (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида гидрохлорида (Нифередила гидрохлорида) и повышение качества целевого продукта.
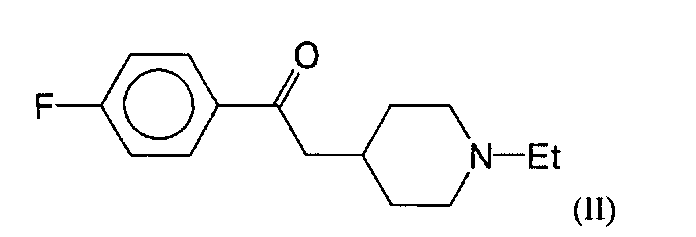
Поставленная цель достигается способом, согласно которому синтез (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида или его фармацевтически приемлемой соли, преимущественно гидрохлорида, осуществляют с использованием нового промежуточного соединения 2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этанона (II).
Согласно настоящему изобретению (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида гидрохлорид формулы (I) получают по схеме 1.
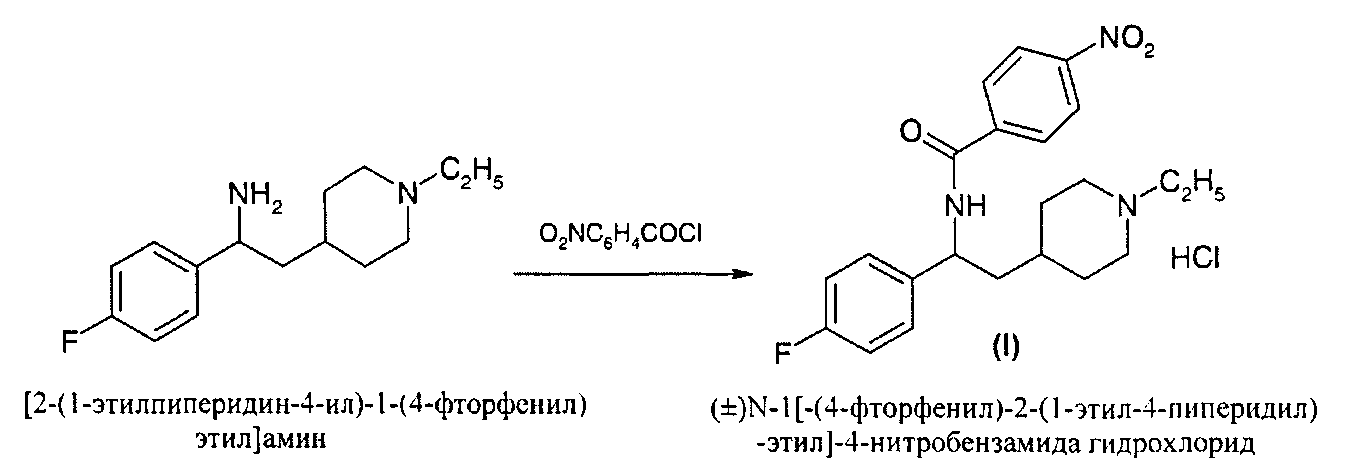
В качестве исходного соединения в представленном синтезе выбран коммерчески доступный, не токсичный этиловый эфир 4-фторбензойной кислоты, который на первой стадии подвергают реакции с 4-пиколином в присутствии платинового или палладиевого катализатора в тетрагидрофуране с получением 1-(4-фторфенил)-2-(4-пиридил)этанона. Последний алкилируют этилгалогенидом, например, бромистым этилом. Полученную пиридиниевую соль каталитически восстанавливают водородом при нормальном давлении в присутствии платинового или палладиевого катализатора, преимущественно платины на угле, с добавлением концентрированной соляной кислоты. При этом получают новый интермедиат 2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этанон формулы (II). 2-(1-Этилпиперидин-4-ил)-1-(4-фторфенил)этанон, который подвергают восстановительному аминированию с превращением кетогруппы в аминогруппу, с получением [2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)-этил]амина. При взаимодействии последнего с галоидангидридом, преимущественно хлорангидридом, 4-нитробензойной кислоты получают целевой (±)N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамид в виде фармацевтически приемлемой соли. При необходимости из полученной соли может быть получен (±)N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамид в виде свободного основания. Преимущественной солью является гидрохлорид соединения формулы (I).
В качестве фармацевтически приемлемой соли могут быть получены соли, выбранные из хлоргидрата, мезилата, ацетата, сульфата. Обработкой основанием соль может быть переведена в основание нифередила.
Более подробно процесс осуществляют следующим образом:
Первой стадией синтеза является получение 1-(4-фторфенил)-2-(4-пиридил)этанона путем конденсации 4-фторбензоата с 4-пиколином. Конденсирующим средством при этом предпочтительно является натрий бис(триметилсилил)амид, который используется в количестве 1-2 моля на моль 4-фторбензоата. Реакцию проводят в среде тетрагидрофурана. Синтез 1-этил-[2-(4-фторфенил)-2-оксоэтил]пиридиний галогенида на второй стадии осуществляют путем алкилирования 1-(4-фторфенил)-2-(4-пиридин)этанона этилгалогенидом, взятом в 2-8-кратном избытке. Преимущественно используют этилбромид. На следующей стадии синтеза проводят гидрирование водородом в присутствии платинового или палладиевого катализатора, например платины на угле, и получают 2-(этилпиперидин-4-ил)-1-(4-фторфенил)этанон. Последний затем подвергают восстановительному аминированию с получением [2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этил]амина. Заключительной стадией синтеза является конденсация [2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этил] амина с 4-нитробензоилгалогенидом, хлоридом в подходящем органическом растворителе, преимущественно в тетрагидрофуране, в результате чего образуется целевой свободный (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамид по формуле (I) или его фармацевтически приемлемая соль.
Схема 1
Hal представляет атом галогена, означает бром или йод. Получают (±)N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамида гидрохлориду по формуле (I).
Способ согласно изобретению является 5 стадийным, легко масштабируемым и позволяет получить (±)N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамида гидрохлорид (нифередила гидрохлорид) высокого качества с содержанием основного вещества не менее 99.6% по данным ВЭЖХ. Продукт такого качества пригоден для использования в качестве активного ингредиента для фармацевтического использования.
Изобретение также относится к новому соединению: 2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этанону, соответствующему формуле (II)
Соединение (II) является промежуточным продуктом для синтеза (±)N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамида в свободном виде или в виде фармацевтически приемлемых солей.
Исходные и промежуточные соединения для осуществления синтеза по схеме 1 являются соединениями, которые коммерчески доступны и не требуют специальных условий обращения и хранения.
Ниже показан пример получения соединения по формуле (I) по изобретению с использованием в качестве ключевого интермедиата соединения по формуле (II).
Пример.
Стадия 1. Получение 1-(4-фторфенил)-2-(4-пиридил)этанона
В трехгорлую круглодонную колбу вместимостью 2 л, снабженную термометром, капельной воронкой и трубкой для подачи аргона, загружают 26.9 г (0.16 мол) 4-фторбензоата и 180 мл тетрагидрофурана. Затем загружают 15.9 мл (14.9 г; 0.16 моль) 4-пиколина. Полученный раствор перемешивают на магнитной мешалке и при температуре 0°C в токе аргона медленно (-10 мин) приливают 258 мл 1М раствора NaHMDS (натрия гексаметилдисилазан) в тетрагидрофуране. Смесь перемешивают при этой температуре 0.5 ч и еще 2 ч при 20±3°C. Затем к образовавшейся суспензии приливают 415 мл гексана и через 5-10 мин осадок отфильтровывают с отсасыванием на воронке с пористым фильтром, промывают 50 мл гексана. Осадок переносят в стакан вместимостью 1 л, добавляют 1330 мл воды и перемешивают. Затем полученную суспензию экстрагируют этилацетатом (3 раза по 450 мл). Объединенный экстракт промывают водой и водным раствором NaCl. Этилацетатный раствор сушат сульфатом натрия 2-3 ч, фильтруют, сульфат натрия промывают на фильтре этилацетатом и упаривают на роторном испарителе досуха. Получают 26 г технического 1-(4-фторфенил)-2-(4-пиридил)этанона, который кристаллизуют из смеси гексан-этилацетат (49:1). Получают 20.64 г (60%) 1-(4-фторфенил)-2-(4-пиридин)этанона.
Т. пл. 92-94°C.
MS (m/z):215 (М+)
1H NMR (DMSO-d6):δ 8.65-8.5 (2Н, d, 2СН pyridine), 8.05 (2Н, dd, 2СН) 7.25-7.1 (4Н, m, 2СН и 2СН pyridine) и 4.4 (2Н, s, CH2CO) ppm
Элементный анализ C13H10FNO:
Вычислено, %: С, 72.55; Н, 4.68; N, 6.51
Найдено, %: С, 72.46; Н, 4.57; N, 6.67
Стадия 2. Получение 1-этил-[2-(4-фторфенил)-2-оксоэтил]пиридиний бромида
В одногорлую круглодонную колбу вносят 20.64 г (0,096 моль) 1-(4-фторфенил)-2-оксо-(4-пиридил)этанон, 190 мл нитрометана и 42 мл (0.576 моль) бромэтана и кипятят при перемешивании на магнитной мешалке 2 ч. Раствор охлаждают и упаривают на роторном испарителе при температуре 60°C в бане. К теплому остатку при перемешивании приливают 500 мл этилацетата и перемешивают при нагревании (45°C) 1 ч. Осадок отфильтровывают на воронке с пористым фильтром и промывают этилацетатом (2 раза по 20 мл). Сушат на воздухе. Получают 29.55 г (95%) 1-этил-[2-(4-фторфенил)-2-оксоэтил]пиридиний бромида и его используют на следующей стадии без очистки.
Т. пл. 156-158°C.
MS (m/z): 244 (М+)
1H NMR (DMSO-d6):δ 9.06 (2Н, d, 2СН piperidine), 8.17 (2Н, t, 2 СН), 8.03 (2Н, d, 2СН piperidine), 7.39 (2Н, t, 2СН), 4.87 (2Н, d, СН2СО), 4.61 (2Н, q,
) и 1.55 (3Н, t,
) ppm.
Элементный анализ C15H16BrFNO:
Вычислено, %: С, 55.40; Н, 4.96; N, 4.11
Найдено, %: С, 55.38; Н, 5.04; N, 4.22
Стадия 3. Получение 2-(этилпиперидин-4-ил)-1-(4-фторфенил)этанона формулы (II)
В круглодонную трехгорлую колбу вместимостью 0.5 л вносят 29.55 г (0.0912 моль) 1-(этил-[2-(4-фторфенил)2-оксоэтилпиридиний бромида, 190 мл этанола, 1.66 мл конц. соляной кислоты и затем при перемешивании осторожно прибавляют 2.95 г катализатора Pt/C 5%. Затем реакционную массу гидрируют при перемешивании на магнитной мешалке при комнатной температуре в течение 24 ч до прекращения поглощения водорода. Расход водорода на гидрирование ~7 л. Затем катализатор отфильтровывают и промывают 45 мл этанола. Этанол упаривают на роторном испарителе досуха. Получают масло (смесь гидробромида и гидрохлорида 2-(этилпиперидин-4-ил)-1-(4-фторфенил)этанона) (II), которое при охлаждении кристаллизуется. К остатку добавляют 550 мл воды, и полученный раствор подщелачивают 2N раствором NaOH (~55 мл) до рН 10 при перемешивании и охлаждении ледяной водой. Выпавший осадок отфильтровывают, промывают водой 3 раза. Осадок хорошо отжимают и сушат в эксикаторе над KОН до постоянного веса. Получают 18.17 г (80%) 2-(этилпиперидин-4-ил)-1-(4-фторфенил)этанона (II), который используют на следующей стадии без очистки.
Т. пл. 73-74°C.
MS (m/z):249 (М+)
1H NMR (DMSO-d6):δ 8.02 (2Н, t, 2СН), 7.33 (2Н, t, 2СН), 2.97 (2Н, d, СН2СО), 2.24 (2Н, q,
), 1.15-1.80 (11Н, m, piperidine) и 0.95 (3Н, t, СН2СН3) ppm.
Элементный анализ C15H20FNO:
Вычислено, %: С, 72.26; Н, 8.09; N, 5.62
Найдено, %: С, 72.33; Н, 8.16; N, 5.49
Стадия 4. Получение [2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этил]амина.
В круглодонную трехгорлую колбу вместимостью 1 л, снабженную обратным холодильником, вносят 18.17 г (0.073 моль) 2-(этилпиперидин-4-ил)-1-(4-фторфенил)этанона (II) и 295 мл метанола. К полученному раствору добавляют 64.85 г (0.84 моль) ацетата аммония и 17.39 г (0.28 моль) цианборгидрида натрия. Смесь кипятят при перемешивании на магнитной мешалке 6 ч. Оставляют на ночь при комнатной температуре. Реакционный раствор при перемешивании и охлаждении ледяной водой подкисляют 106 мл конц. соляной кислотой до рН 1. Образовавшийся осадок отфильтровывают и промывают метанолом. Маточный раствор упаривают на роторном испарителе до образования кашеобразной массы, которую растворяют в 600 мл воды и экстрагируют этилацетатом. Органический слой отделяют, водный слой подщелачивают до рН 9-10, прибавляя небольшими порциями твердый KОН (30.3 г) при перемешивании и охлаждении ледяной водой. Выделившееся масло экстрагируют этилацетатом (3 раза по 140 мл). Полученный этилацетатный экстракт промывают водным раствором соли и сушат сульфатом натрия. Упаривают растворитель и получают 12.77 г (70%) [2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этил]амина в виде густого масла, которое используют далее без дополнительной очистки.
ВЭЖХ содержание 98.8% основного вещества (Column Luna 5u С18(2); ACN /water-90:10; flow 0.4 ml/min; UV 254 nm; tR=4.68 min)
MS (m/z): 250 (M+)
1H NMR (DMSO-d6): δ 7.38 (2H, m, 2CH), 7.09 (2H, m, 2CH), 3.83 (1H, t,
), 2.74 (2H, br. s, CH2), 2.21 (2H, q,
), 1.05-1.7 (11H, m, piperidine) и 0.96 (3H, t,
) ppm
Стадия 5. Получение (±)N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамида гидрохлорида (I) (ниферидила гидрохлорид)
В трехгорлую круглодонную колбу вместимостью 0.5 л, снабженную обратным холодильником с хлоркальциевой трубкой, термометром и капельной воронкой, вносят 12.77 г (0.051 моль) [2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этил]амина и 130 мл тетрагидрофурана. К полученному раствору при перемешивании на магнитной мешалке при температуре 20°C начинают прикапывать раствор 10.42 г (0.056 моль) n-нитробензоилхлорида в 190 мл тетрагидрофурана, не допуская повышения температуры реакционной массы выше 40°C. Затем реакционную массу нагревают до 50±5°C и перемешивают при этой температуре 40 мин, после чего обогрев отключают и перемешивают при самопроизвольном охлаждении до комнатной температуры (~20°C) 1.5 ч. Осадок отфильтровывают на воронке, промывают тетрагидрофураном 3 раза по 40 мл, переносят в реакционную колбу и кипятят при перемешивании с 260 мл ацетона 10 мин. Осадок отфильтровывают горячим и промывают 40 мл ацетона. После высушивания получают 15.7 г (±)N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил-этил]-4-нитробензамида гидрохлорида (I), который дважды перекристаллизовывают из этилового спирта. Его сушат и получают 13 г (45%) целевого (±)N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил-этил]-4-нитробензамида гидрохлорида.
Т. пл. 229-231°C.
ВЭЖХ содержание основного вещества 99.6%. (Column Luna С18(2); ACN/water-90:10; flow 0.4 ml/min; UV 254 nm; tR=4.7 min)
MS (m/z): 399 (M+)
1H NMR (DMSO-d6):δ 10.08 (1H, br. s, N+H), 9.28 (1H, d, NHCO), 8.33 и 8.14 (4H, два d, C6H4NO2), 7.49 и 7.17 (4H, два м, C6H4F), 5.15 (1H, m,
), 3.41 (2Н, d, HeqCNCHeq), 2.99 (2Н, m,
), 2.80 (2Н, m, HaxCNCHax) и 2.00-1.50 (7Н, m, piperidine) и 1.19 (3Н, t, СН3) ppm.
Элементный анализ C22H27ClFN3O3:
Вычислено, %: С, 60.62; Н, 6.24; N, 9.64
Найдено, %: С, 60.53; Н, 6.11; N, 9.70.
Claims (5)
1. Способ получения (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида формулы
или его фармацевтически приемлемых солей, заключающийся в том, что этиловый эфир 4-фторбензойной кислоты подвергают реакции с 4-пиколином в тетрагидрофуране в присутствии катализатора или конденсирующего средства с получением 1-(4-фторфенил)-2-(4-пиридил)этанона, который алкилируют этилгалогенидом, и полученную пиридиниевую соль подвергают каталитическому восстановлению водородом в присутствии палладиевого или платинового катализатора с добавлением концентрированной соляной кислоты, для получения 2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этанона формулы
который подвергают восстановительному аминированию с получением [2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)-этил]амина, с последующим взаимодействием последнего с хлорангидридом 4-нитробензойной кислоты с получением (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида формулы (I) в свободном виде или в виде его фармацевтически приемлемой соли.
или его фармацевтически приемлемых солей, заключающийся в том, что этиловый эфир 4-фторбензойной кислоты подвергают реакции с 4-пиколином в тетрагидрофуране в присутствии катализатора или конденсирующего средства с получением 1-(4-фторфенил)-2-(4-пиридил)этанона, который алкилируют этилгалогенидом, и полученную пиридиниевую соль подвергают каталитическому восстановлению водородом в присутствии палладиевого или платинового катализатора с добавлением концентрированной соляной кислоты, для получения 2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)этанона формулы
который подвергают восстановительному аминированию с получением [2-(1-этилпиперидин-4-ил)-1-(4-фторфенил)-этил]амина, с последующим взаимодействием последнего с хлорангидридом 4-нитробензойной кислоты с получением (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида формулы (I) в свободном виде или в виде его фармацевтически приемлемой соли.
2. Способ по п.1, отличающийся тем, что получают гидрохлорид (±)N-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида формулы (I).
3. Способ по п.1, отличающийся тем, что в качестве конденсирующего средства используют натрий бис(триметилсилил)амид в количестве 1-2 моля на моль 4-фторбензоата.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2013150716/04A RU2566818C2 (ru) | 2013-11-15 | 2013-11-15 | Способ получения (±)n-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида или его фармацевтически приемлемых солей и промежуточное соединение для его получения |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2013150716/04A RU2566818C2 (ru) | 2013-11-15 | 2013-11-15 | Способ получения (±)n-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида или его фармацевтически приемлемых солей и промежуточное соединение для его получения |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2013150716A RU2013150716A (ru) | 2015-05-20 |
| RU2566818C2 true RU2566818C2 (ru) | 2015-10-27 |
Family
ID=53283867
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2013150716/04A RU2566818C2 (ru) | 2013-11-15 | 2013-11-15 | Способ получения (±)n-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида или его фармацевтически приемлемых солей и промежуточное соединение для его получения |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2566818C2 (ru) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU618039A3 (ru) * | 1972-07-21 | 1978-07-30 | Сьянс Юньон Э Ко Сосьете Франсэз Де Решерш Медикаль (Фирма) | Способ получени замещенных бензамидов или их гидрохлоридов |
| SU1833612A3 (ru) * | 1987-12-08 | 1996-02-27 | Центр по химии лекарственных средств | Гидрохлориды 1-фенил-1-(n-нитробензоиламино)-5-n-пиперидино)- или (n-диэтиламино)пентанов, проявляющие антиаритмическую и антифибрилляторную активность |
| RU2415128C2 (ru) * | 2009-05-07 | 2011-03-27 | Общество с ограниченной ответственностью "Центр по химии лекарственных средств" (ООО "ЦХЛС-ВНИХФИ") | Гидрохлорид n-1-[(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамид, проявляющий антиаритмическую и антифибрилляторную активность |
-
2013
- 2013-11-15 RU RU2013150716/04A patent/RU2566818C2/ru not_active IP Right Cessation
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU618039A3 (ru) * | 1972-07-21 | 1978-07-30 | Сьянс Юньон Э Ко Сосьете Франсэз Де Решерш Медикаль (Фирма) | Способ получени замещенных бензамидов или их гидрохлоридов |
| SU1833612A3 (ru) * | 1987-12-08 | 1996-02-27 | Центр по химии лекарственных средств | Гидрохлориды 1-фенил-1-(n-нитробензоиламино)-5-n-пиперидино)- или (n-диэтиламино)пентанов, проявляющие антиаритмическую и антифибрилляторную активность |
| RU2415128C2 (ru) * | 2009-05-07 | 2011-03-27 | Общество с ограниченной ответственностью "Центр по химии лекарственных средств" (ООО "ЦХЛС-ВНИХФИ") | Гидрохлорид n-1-[(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамид, проявляющий антиаритмическую и антифибрилляторную активность |
Non-Patent Citations (1)
| Title |
|---|
| GLUSHKOV, R. G et al., Experience in creating new drugs using traditional technologies. Pharmaceutical Chemistry Journal, 2011, 45(9), 517-521 (English) . GLUSHKOV, R. G et al., New group of class III antiarrhythmic drugs: piperid-4-ylethane. derivatives. Pharmaceutical Chemistry Journal, 2011, 45(2), 65-74 (English) * |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2013150716A (ru) | 2015-05-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3812748B2 (ja) | 4−ピペリドンのカルベン添加/アミノリシスによるスフェンタニル誘導体の製造方法 | |
| JP5276579B2 (ja) | イバブラジン及び薬学的に許容されうる酸とのその付加塩の合成のための新たな方法 | |
| EP1527048B1 (fr) | Derives de n-[phenyl(piperidin-2-yl)methyl]benzamide, leur preparation et leur application en therapeutique | |
| JPS5943459B2 (ja) | N−アルキルピペリジン誘導体 | |
| PL161379B1 (pl) | S p o só b wytwarzania kwasu 2-[2-[4-[/4-chlorofenylo/fenylom etylo]-1-piperazynylo] etoksy]octow ego i jego dichlorowodorku PL PL | |
| JP2008539218A (ja) | 新規のヒスタミンh3−受容体リガンドおよびそれらの治療的応用 | |
| US6605744B2 (en) | Production of 2-amin-2-[2-(2-(40-C2-20-alkyl-phenyl)ethyl]propane-1,3-diols | |
| JP3626191B2 (ja) | 心臓血管系に活性な2−アミノ−1,2,3,4−テトラヒドロナフタレン誘導体 | |
| WO2014101690A1 (zh) | 依泽替米贝手性中间体的制备方法 | |
| JPS6147838B2 (ru) | ||
| ES2286474T3 (es) | Derivados de 4-(finilpiperazinilmetil) benzamida y su uso para el tratamiento de dolor o transtornos gastrointestinales. | |
| RU2566818C2 (ru) | Способ получения (±)n-[1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил]-4-нитробензамида или его фармацевтически приемлемых солей и промежуточное соединение для его получения | |
| EP2358369A1 (en) | Process for the preparation of substantially optically pure repaglinide and precursors thereof | |
| JPWO2003002532A1 (ja) | 縮合環式基を有する環状ジアミン化合物 | |
| JPS59161377A (ja) | ピペリジンジオン誘導体、その製造方法及びそれを含む薬剤 | |
| JP2014139175A (ja) | 治療化合物 | |
| JP2004526797A (ja) | 2−[5−(4−フルオロフェニル)−3−ピリジルメチルアミノメチル]クロマンの製造方法 | |
| US9611217B2 (en) | Synthetic processes of carprofen | |
| FI83417B (fi) | Foerfarande foer framstaellning av farmakologiskt vaerdefulla fenylaettiksyraderivat. | |
| DE60021859T2 (de) | 1, 2, 3, 4-tetrahydro-1-naphthalenamin verbindungen zur therapeutsichen verwendung | |
| JP4014138B2 (ja) | 製造中間体 | |
| FI68830B (fi) | Dl- eller d-trans-8-fluor-5-(p-fluorfenyl)-2,3,4,4a,5,9b-heksahydro-1h-pyrido(4,3-b)indol som anvaends som mellanprodukt vid framstaellning av terapeutiskt anvaendbara 2-substituerade dl- och d-trans-8-fluor-5-(p-fluorfenyl)-2,3,4,4a,5,9b-heksahydro-1h-pyrido(4,3-b)indoler | |
| JP4263427B2 (ja) | ハロゲノ−4−ジヒドロキシメチルピリジン、その製造法及びそれを用いたハロゲノ−4−ピリジンカルバルデヒドの製造法 | |
| HU186190B (en) | New, improved process for preparing encainide | |
| JP2005525342A (ja) | 新規なトリシクロイミダゾリン誘導体、その製造方法およびその医薬としての使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| QB4A | Licence on use of patent |
Free format text: LICENCE Effective date: 20170505 |
|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20171116 |