RU2424805C2 - Стабильные фармацевтические композиции, включающие пиримидинсульфамид - Google Patents
Стабильные фармацевтические композиции, включающие пиримидинсульфамид Download PDFInfo
- Publication number
- RU2424805C2 RU2424805C2 RU2008113869/15A RU2008113869A RU2424805C2 RU 2424805 C2 RU2424805 C2 RU 2424805C2 RU 2008113869/15 A RU2008113869/15 A RU 2008113869/15A RU 2008113869 A RU2008113869 A RU 2008113869A RU 2424805 C2 RU2424805 C2 RU 2424805C2
- Authority
- RU
- Russia
- Prior art keywords
- pharmaceutical composition
- formula
- compound
- total weight
- tablets
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2059—Starch, including chemically or physically modified derivatives; Amylose; Amylopectin; Dextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2077—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/284—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone
- A61K9/2846—Poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/286—Polysaccharides, e.g. gums; Cyclodextrin
- A61K9/2866—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Pulmonology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Изобретение относится к фармацевтической области и касается композиции, обладающей антагонистической активностью в отношении эндотелиновых рецепторов, включающей:
а) соединение формулы I или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму,
b) наполнитель, состоящий из моногидрата лактозы с монокристаллической целлюлозой;
с) вещество, обеспечивающее распадаемость, состоящее из натриевой соли гликолята крахмала или комбинации натриевой соли гликолята крахмала и поливинилпирролидона;
d) поверхностно-активное вещество, состоящее из полисорбата, в общем количестве от 0,1 до 3 мас.% в пересчете на полную массу фармацевтической композиции и
е) смазывающее вещество, состоящее из стеарата магния.
Изобретение обеспечивает стабильную фармацевтическую композицию, обладающую благоприятным фармакокинетическим профилем. 2 н. и 4 з.п. ф-лы, 1 ил., 25 табл.
Description
Настоящее изобретение относится к стабильным фармацевтическим композициям, включающим [5-(4-бромфенил)-6-[2-(5-бромпиримидин-2-илокси)-этокси]-пиримидин-4-ил]-амид пропилсульфаминовой кислоты или его фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы, указанное соединение ниже в настоящем изобретении называется соединением формулы I. Соединение формулы I обладает следующей формулой:
Соединение формулы I является ингибитором эндотелинового рецептора и применимо в качестве антагониста эндотелиновых рецепторов. Соединение формулы I и его получение раскрыто в WO 02/053557.
В контексте настоящего изобретения любая ссылка на соединение формулы I также означает ссылку на фармацевтически приемлемые соли или сольваты, включая гидраты соединения формулы I, а также на его морфологические формы, если не указано иное и если это является подходящим или целесообразным.
Соединение формулы I, предлагаемое в настоящем изобретении, в настоящее время проходит клинические исследования, поэтому было необходимо разработать стабильную композицию. Поэтому настоящее изобретение относится к стабильным фармацевтическим композициям, включающим соединение [5-(4-бромфенил)-6-[2-(5-бромпиримидин-2-илокси)-этокси]-пиримидин-4-ил]-амид пропилсульфаминовой кислоты или его фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы.
Стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, включает:
а) соединение формулы I, обладающее приведенной ниже формулой, или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму,
b) наполнитель,
c) вещество, обеспечивающее распадаемость,
d) поверхностно-активное вещество,
e) смазывающее вещество.
В предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция находится в форме таблетки.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция находится в форме капсулы.
Стабильные фармацевтические композиции, предлагаемые в настоящем изобретении, предпочтительно таковы, что один или большее количество наполнителей выбраны из числа следующих: лактоза, кукурузный крахмал, предварительно желатинизированный крахмал, дигидрат гидрофосфата кальция (CaHPO4·2Н2О), микрокристаллическая целлюлоза, мальтодекстрин и маннит; одно или большее количество веществ, обеспечивающих распадаемость, выбрано из числа следующих: натриевая соль кроскармелозы, натриевая соль гликолята крахмала, кальциевая соль карбоксиметилцеллюлозы, натриевая соль карбоксиметилцеллюлозы, сшитый поливинилпирролидон, поливинилпирролидон, альгиновая кислота, альгинат натрия, предварительно желатинизированный крахмал, гуаровая камедь, глины и ионообменные смолы; поверхностно-активное вещество выбрано из числа следующих: лаурилсульфат натрия, полисорбаты, сополимеры этилена с оксипропиленом, полиоксиэтиленстеараты, диоктилсульфосукцинат натрия, полиоксиэтиленсорбитановые эфиры жирных кислот, полиоксиэтилен-С1-С4 алкиловые простые эфиры, сложные моноэфиры сахарозы и простые и сложные эфиры ланолина, и смазывающее вещество выбрано из числа следующих: стеарат магния, алюминия или кальция, стеариновая кислота, стеарилфумарат натрия, тальк, бензоат натрия, глицериловый моноэфир жирной кислоты, полиэтиленгликоль, гидрированное хлопковое масло, касторовое масло и сложные эфиры сахарозы.
Стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, предпочтительно может включать:
a) соединение формулы I по пункту 1 формулы изобретения или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму,
b) один или большее количество инертных наполнителей, выбранных из группы, включающей лактозу, кукурузный крахмал, предварительно желатинизированный крахмал, гидрофосфат кальция и микрокристаллическую целлюлозу,
c) поливинилпирролидон,
d) натриевую соль гликолята крахмала,
e) поверхностно-активное вещество и
f) смазывающее вещество.
Стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, более предпочтительно может включать:
a) соединение формулы I по пункту 1 формулы изобретения или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму в полном количестве, составляющем до 50 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 5 до 30% и более предпочтительно - от 10 до 20 мас.% в пересчете на полную массу фармацевтической композиции),
b) один или большее количество инертных наполнителей, выбранных из группы, включающей лактозу, кукурузный крахмал, предварительно желатинизированный крахмал, гидрофосфат кальция и микрокристаллическую целлюлозу в полном количестве, составляющем от 10 до 95 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 30 до 90%, предпочтительно - от 50 до 80% и более предпочтительно - от 60 до 75 мас.% в пересчете на полную массу фармацевтической композиции),
c) поливинилпирролидон в полном количестве, составляющем до 20 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,5 до 10%, предпочтительно - от 1 до 5% и более предпочтительно - от 2 до 4 мас.% в пересчете на полную массу фармацевтической композиции),
d) натриевую соль гликолята крахмала в полном количестве, составляющем до 30 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,5 до 20%, предпочтительно - от 1 до 10% и более предпочтительно - от 2 до 6 мас.% в пересчете на полную массу фармацевтической композиции),
e) поверхностно-активное вещество в полном количестве, составляющем до 7 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,01 до 5%, предпочтительно - от 0,05 до 1% и более предпочтительно - от 0,1 до 0,5 мас.% в пересчете на полную массу фармацевтической композиции), и
f) смазывающее вещество в полном количестве, составляющем до 10 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,05 до 5%, предпочтительно - от 0,1 до 2% и более предпочтительно - от 0,25 до 1,5 мас.% в пересчете на полную массу фармацевтической композиции).
Например, стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, может включать:
a) соединение формулы I по пункту 1 формулы изобретения или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму в полном количестве, составляющем до 50 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 1 до 50%, предпочтительно - от 5 до 30% и более предпочтительно - от 10 до 20 мас.% в пересчете на полную массу фармацевтической композиции),
b) лактозу или моногидрат лактозы в полном количестве, составляющем от 10 до 75 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 30 до 70%, предпочтительно - от 45 до 65% и более предпочтительно - от 52 до 60 мас.% в пересчете на полную массу фармацевтической композиции),
c) микрокристаллическую целлюлозу в полном количестве, составляющем от 0 до 20 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 1 до 10%, предпочтительно - от 2 до 8% и более предпочтительно - от 4 до 6 мас.% в пересчете на полную массу фармацевтической композиции),
d) поливинилпирролидон в полном количестве, составляющем до 20 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,5 до 10%, предпочтительно - от 1 до 5% и более предпочтительно - от 2 до 4 мас.% в пересчете на полную массу фармацевтической композиции),
e) натриевую соль гликолята крахмала в полном количестве, составляющем до 30 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,5 до 20%, предпочтительно - от 1 до 10% и более предпочтительно - от 2 до 6 мас.% в пересчете на полную массу фармацевтической композиции),
f) поверхностно-активное вещество в полном количестве, составляющем до 7 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,01 до 5%, предпочтительно - от 0,05 до 1% и более предпочтительно - от 0,1 до 0,5 мас.% в пересчете на полную массу фармацевтической композиции), и
g) смазывающее вещество в полном количестве, составляющем до 10 мас.% в пересчете на полную массу фармацевтической композиции (например, в количестве, составляющем от 0,05 до 5%, предпочтительно - от 0,1 до 2% и более предпочтительно - от 0,25 до 1,5 мас.% в пересчете на полную массу фармацевтической композиции).
Фармацевтическая композиция, предлагаемая в настоящем изобретении, предпочтительно может содержать:
a) соединение формулы I по пункту 1 формулы изобретения или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму,
b) лактозу или моногидрат лактозы,
c) микрокристаллическую целлюлозу,
d) поливинилпирролидон,
e) натриевую соль гликолята крахмала,
f) поверхностно-активное вещество и
g) смазывающее вещество.
В предпочтительном варианте осуществления композиций, указанном выше, поверхностно-активным веществом является полисорбат.
В другом предпочтительном варианте осуществления композиций, указанном выше, смазывающим веществом является стеарат магния.
Стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, также необязательно может содержать вещество, придающее скользкость. Поэтому настоящее изобретение также относится к стабильным фармацевтическим композициям, включающим:
а) соединение формулы I или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму,
b) наполнитель,
c) вещество, обеспечивающее распадаемость,
d) поверхностно-активное вещество,
e) вещество, придающее скользкость, и
f) смазывающее вещество.
Наполнители, предлагаемые в настоящем изобретении, включают, но не ограничиваются только ими, один или большее количество из следующих: лактоза, кукурузный крахмал, предварительно желатинизированный крахмал, дигидрат гидрофосфата кальция (СаНРО4·2Н2О), микрокристаллическая целлюлоза, мальтодекстрин и маннит. Предпочтительно используют лактозу с микрокристаллической целлюлозой, лактозу с кукурузным крахмалом, предварительно желатинизированный крахмал с микрокристаллической целлюлозой или дигидрат гидрофосфата кальция с микрокристаллической целлюлозой. Также предпочтительным является моногидрат лактозы (например, Pharmatose® 200 Mesh) с микрокристаллической целлюлозой (например, Avicel РН101).
Вещества, обеспечивающие распадаемость, предлагаемые в настоящем изобретении, включают, но не ограничиваются только ими, одно или большее количество из следующих: натриевая соль кроскармелозы, натриевая соль гликолята крахмала, кальциевая соль карбоксиметилцеллюлозы (СМС-Са), натриевая соль карбоксиметилцеллюлозы CMC-Na, сшитый поливинилпирролидон (например, Crospovidone (PVP XL; Polyplasdone, продающийся фирмой ISP company, или Kollidon® XL, продающийся фирмой BASF)), поливинилпирролидон (ПВП), альгиновая кислота, альгинат натрия, предварительно желатинизированный крахмал, гуаровая камедь, глины и ионообменные смолы. В качестве вещества, обеспечивающего распадаемость, предпочтительно используют натриевую соль гликолята крахмала или комбинацию натриевой соли гликолята крахмала и ПВП.
Поверхностно-активное вещество, предлагаемое в настоящем изобретении, включает, но не ограничивается только ими, одно или большее количество из следующих: лаурилсульфат натрия, полисорбаты (имеющиеся в продаже под названием Tween®), сополимеры этилена с оксипропиленом (Pluronic F65), полиоксиэтиленстеараты (MYRJ), диоктилсульфосукцинат натрия, полиоксиэтиленсорбитановые эфиры жирных кислот (продающиеся фирмой Nikko Chemicals), полиоксиэтилен-С1-С4алкиловые простые эфиры, сложные моноэфиры сахарозы и простые и сложные эфиры ланолина. В качестве поверхностно-активного вещества предпочтительно используют лаурилсульфат натрия.
Полисорбат, включаемый в композицию, предлагаемую в настоящем изобретении, обладает средней степенью полимеризации, составляющей от 20 до 100 мономерных звеньев (предпочтительно - примерно 80), и может, например, представлять собой полисорбат 80. Также предпочтительно, если полисорбат получен из растений.
Вещества, придающие скользкость, предлагаемые в настоящем изобретении, включают, но не ограничиваются только ими, одно или большее количество из следующих: диоксид кремния; коллоидный диоксид кремния, например безводный коллоидный диоксид кремния (например, Aerosil® 200), трисиликат магния, порошкообразная целлюлоза, крахмал и тальк. Предпочтительно используют коллоидный диоксид кремния.
Смазывающие вещества, предлагаемые в настоящем изобретении, включают, но не ограничиваются только ими, одно или большее количество из следующих: Mg-, Al- или Са-стеарат, стеариновая кислота, стеарилфумарат натрия, тальк, бензоат натрия, глицериловый моноэфир жирной кислоты, например, обладающий молекулярной массой, равной от 200 до 800 Да (например, глицерилмоностеарат (например, продающийся фирмой Danisco, UK)), глицерилдибегенат (например, CompritolAT0888™, Gattefossé France), глицерилпальмитостеариловый эфир (например, Precirol™, Gattefossé France), полиэтиленгликоль (ПЭГ, BASF), гидрированное хлопковое масло (Lubitab, Edward Mendell Со Inc.), касторовое масло (Cutina HR, Henkel) и сложные эфиры сахарозы (Surfhope SE, Mitsubishi-Kagaku Foods Co.). Предпочтительно используют стеарат магния.
Следует понимать, что любой данный инертный наполнитель может выполнять более одной функции, например выступать в качестве наполнителя, вещества, обеспечивающего распадаемость, поверхностно-активного вещества, вещества, придающего скользкость, и/или смазывающего вещества.
Стабильная фармацевтическая композиция, предлагаемая в настоящем изобретении, также необязательно может содержать (независимо от наличия вещества, придающего скользкость) винную кислоту.
В настоящем изобретении используется имеющаяся в продаже лактоза, предпочтительно - моногидрат лактозы (такой, как Pharmatose® 200М, выпускающийся фирмой DMV International) в настоящем изобретении.
В настоящем изобретении используется имеющийся в продаже кукурузный крахмал, предпочтительно - кукурузный крахмал, выпускающийся фирмой Roquette.
В настоящем изобретении используется имеющийся в продаже предварительно желатинизированный крахмал, предпочтительно - крахмал 1500 (выпускающийся фирмой Colorcon).
В настоящем изобретении используется имеющийся в продаже дигидрат гидрофосфата кальция, предпочтительно - дигидрат гидрофосфата кальция в неразмолотой форме, такой как выпускающийся фирмой Calipharm А или A-Tab.
В настоящем изобретении используется имеющаяся в продаже микрокристаллическая целлюлоза, предпочтительно - Avicel PH101, выпускающийся фирмой FMC international.
В настоящем изобретении используется имеющийся в продаже поливинилпирролидон (ПВП), предпочтительно - поливинилпирролидон, выпускающийся фирмой BASF.
В настоящем изобретении используется имеющаяся в продаже натриевая соль гликолята крахмала, предпочтительно - натриевая соль гликолята крахмала, выпускающаяся фирмой Roquette.
В настоящем изобретении используется имеющийся в продаже лаурилсульфат натрия, предпочтительно - лаурилсульфат натрия, выпускающийся фирмой Ellis & Everard.
В настоящем изобретении используется имеющийся в продаже Коллоидный диоксид кремния, предпочтительно - Aerosil, выпускающийся фирмой Degussa AG.
В настоящем изобретении используется имеющийся в продаже стеарат магния, предпочтительно - стеарат магния, выпускающийся фирмой Peter Greven.
Термин “С1-С4-алкил” по отдельности или в комбинации с другими группами означает обладающую линейной или разветвленной цепью алкильную группу, содержащую от 1 до 4 атомов углерода. Примерами обладающих линейной или разветвленной цепью С1-С4алкильных групп являются метил, этил, пропил, изопропил, бутил, втор-бутил, изобутил, трет-бутил.
Термин “примерно”, находящийся перед числовым значением “X”, в настоящей заявке указывает диапазон от X минус 10% от X до X плюс 10% от X и предпочтительно - диапазон от X минус 5% от X до X плюс 5% от X.
Выражение “фармацевтически приемлемые соли” включает соли с неорганическими кислотами и с органическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, уксусная кислота, малеиновая кислота, винная кислота, бензойная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п., которые нетоксичны для живых организмов, или в случае, когда соединение формулы (I) является кислотным по характеру, - с неорганическим основанием, таким как основание щелочного или щелочноземельного металла, например гидроксид натрия, гидроксид калия, гидроксид кальция и т.п.
В предпочтительном варианте осуществления настоящего изобретения фармацевтические композиции включают:
наполнитель, причем один или большее количество наполнителей выбраны из числа следующих: лактоза, кукурузный крахмал, предварительно желатинизированный крахмал, дигидрат гидрофосфата кальция (CaHPO4·2H2O) и микрокристаллическая целлюлоза, мальтодекстрин и маннит; вещество, обеспечивающее распадаемость, причем одно или большее количество веществ, обеспечивающих распадаемость, выбрано из числа следующих: натриевая соль кроскармелозы, натриевая соль гликолята крахмала, СМС-Са, CMC-Na, сшитый ПВП, ПВП, альгиновая кислота, альгинат натрия, предварительно желатинизированный крахмал, гуаровая камедь, глины и ионообменные смолы; поверхностно-активное вещество, которое выбрано из числа следующих: лаурилсульфат натрия, полисорбаты, сополимеры этилена с оксипропиленом, полиоксиэтиленстеараты и диоктилсульфосукцинат натрия, полиоксиэтиленсорбитановые эфиры жирных кислот, полиоксиэтилен-С1-С4-алкиловые простые эфиры, сложные моноэфиры сахарозы и простые и сложные эфиры ланолина; вещество, придающее скользкость, которое выбрано из числа следующих: диоксид кремния, безводный коллоидный диоксид кремния, трисиликат магния, порошкообразная целлюлоза, крахмал и тальк; смазывающее вещество, которое выбрано из числа следующих: Mg-, Al- или Са-стеарат, стеариновая кислота, стеарилфумарат натрия, тальк, бензоат натрия, глицериловый моноэфир жирной кислоты, полиэтиленгликоль, гидрированное хлопковое масло, касторовое масло и сложные эфиры сахарозы.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтические композиции включают:
a) смесь по меньшей мере одного или большего количества инертных наполнителей, выбранных из следующей группы, включающей лактозу, кукурузный крахмал, предварительно желатинизированный крахмал, гидрофосфат кальция и микрокристаллическую целлюлозу,
b) поливинилпирролидон,
c) натриевую соль гликолята крахмала,
d) лаурилсульфат натрия,
e) коллоидный диоксид кремния и
f) стеарат магния.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция включает:
a) смесь по меньшей мере одного или большего количества инертных наполнителей, выбранных из следующей группы, включающей лактозу, кукурузный крахмал, крахмал 1500, Calipharm А и Avicel РН101,
b) поливинилпирролидон,
c) натриевую соль гликолята крахмала,
d) лаурилсульфат натрия,
e) Aerosil и
f) стеарат магния.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтические композиции включают:
a) соединение формулы I или его фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы в полном количестве, составляющем до 50 мас.% в пересчете на полную массу фармацевтической композиции,
b) смесь по меньшей мере одного или большего количества наполнителей в полном количестве, составляющем 10-95 мас.% в пересчете на полную массу фармацевтической композиции,
c) поливинилпирролидон в полном количестве, составляющем до 20 мас.% в пересчете на полную массу фармацевтической композиции,
d) натриевую соль гликолята крахмала в полном количестве, составляющем до 30 мас.% в пересчете на полную массу фармацевтической композиции,
e) поверхностно-активное вещество в полном количестве, составляющем до 7 мас.% в пересчете на полную массу фармацевтической композиции,
f) вещество, придающее скользкость, в полном количестве, составляющем до 5 мас.% в пересчете на полную массу фармацевтической композиции, и
g) смазывающее вещество в полном количестве, составляющем до 10 мас.% в пересчете на полную массу фармацевтической композиции,
где полная масса фармацевтической композиции составляет 100%.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция включает:
a) соединение формулы I или его фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы в полном количестве, составляющем до 50 мас.% в пересчете на полную массу фармацевтической композиции,
b) смесь по меньшей мере одного или большего количества наполнителей в полном количестве, составляющем 30-85 мас.% в пересчете на полную массу фармацевтической композиции,
c) поливинилпирролидон в полном количестве, составляющем от 2 до 10 мас.% в пересчете на полную массу фармацевтической композиции,
d) натриевую соль гликолята крахмала в полном количестве, составляющем до 10 мас.% в пересчете на полную массу фармацевтической композиции,
f) поверхностно-активное вещество в полном количестве, составляющем до 3 мас.% в пересчете на полную массу фармацевтической композиции,
e) вещество, придающее скользкость, в полном количестве, составляющем до 2,5 мас.% в пересчете на полную массу фармацевтической композиции, и
g) смазывающее вещество в полном количестве, составляющем до 7 мас.% в пересчете на полную массу фармацевтической композиции,
где полная масса фармацевтической композиции составляет 100%.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтические композиции включают:
a) соединение формулы I или его фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы в полном количестве, составляющем до 50 мас.% в пересчете на полную массу фармацевтической композиции,
b) смесь по меньшей мере одного или большего количества наполнителей в полном количестве, составляющем 30-85 мас.% в пересчете на полную массу фармацевтической композиции,
c) поливинилпирролидон в полном количестве, составляющем от 2 до 5 мас.% в пересчете на полную массу фармацевтической композиции,
d) натриевую соль гликолята крахмала в полном количестве, составляющем до 5 мас.% в пересчете на полную массу фармацевтической композиции,
e) поверхностно-активное вещество в полном количестве, составляющем до 3 мас.% в пересчете на полную массу фармацевтической композиции,
f) вещество, придающее скользкость, в полном количестве, составляющем до 1 мас.% в пересчете на полную массу фармацевтической композиции, и
g) смазывающее вещество в полном количестве, составляющем до 3 мас.% в пересчете на полную массу фармацевтической композиции,
где полная масса фармацевтической композиции составляет 100%.
Фармацевтические композиции или фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы, предлагаемые в настоящем изобретении, можно использовать в качестве лекарственного средства.
Фармацевтические композиции или фармацевтически приемлемые соли, сольваты, гидраты или морфологические формы, предлагаемые в настоящем изобретении, можно использовать для приготовления лекарственного средства, предназначенного для лечения легочной артериальной гипертензии (ЛАГ).
Даются ссылки на обширную литературу по этим и другим фармацевтически приемлемым инертным наполнителям и методикам, указанным в настоящем изобретении, см., в частности, Handbook of Pharmaceutical Excipients, Third Edition, edited by Arthur H. Kibbe, American Pharmaceutical Association, Washington, USA and Pharmaceutical Press, London; и Lexikon der Hilfsstoffe für Pharmazie, Kosmetik und angrenzende Gebiete edited by H. P. Fiedler, 4th Edition, Edito Cantor, Aulendorf и более ранние издания.
В контексте настоящего изобретения количество соединения формулы I или его фармацевтически приемлемых солей, сольватов, гидратов или морфологических форм суммарно может составлять до 90 мас.% в пересчете на полную массу фармацевтической композиции. Предпочтительно, если количество соединения формулы I или его фармацевтически приемлемых солей, сольватов, гидратов или морфологических форм суммарно может составлять до 50 мас.% в пересчете на полную массу фармацевтической композиции. Более предпочтительно, если количество соединения формулы I или его фармацевтически приемлемых солей, сольватов, гидратов или морфологических форм составляет от 1 до 50%, предпочтительно - от 5 до 30% и более предпочтительно - от 10 до 20 мас.% в пересчете на полную массу фармацевтической композиции.
В контексте настоящего изобретения количество наполнителей может меняться в диапазоне от 10 до 95%, предпочтительно - от 30 до 85% и более предпочтительно - от 30 до 50 мас.% в пересчете на полную массу фармацевтической композиции.
Количество вещества, обеспечивающего распадаемость, может меняться от 1 до 20%, предпочтительно - от 2 до 10% (например, от 3 до 8%) и более предпочтительно - от 2 до 5 мас.% в пересчете на полную массу фармацевтической композиции. Например, композиция может содержать от 2 до 4 мас.% (например, 3%) вещества, обеспечивающего распадаемость, в пересчете на полную массу фармацевтической композиции.
Количество поверхностно-активного вещества может меняться от 0,01 до 7%, предпочтительно - от 0,1 до 3% и более предпочтительно - от 0,1 до 1 мас.% в пересчете на полную массу фармацевтической композиции.
Количество вещества, придающего скользкость, если оно содержится в композиции, может меняться в диапазоне от 0,1 до 5%, предпочтительно - от 0,1 до 2,5%, более предпочтительно - от 0,5 до 1,0 мас.% в пересчете на полную массу фармацевтической композиции.
Количество смазывающего вещества может меняться от 0,05 до 10%, предпочтительно - от 0,05 до 7%, наиболее предпочтительно - от 0,1 до 3,0% и еще более предпочтительно - от 0,1 до 1 мас.% в пересчете на полную массу фармацевтической композиции.
Количество винной кислоты, если она содержится в композиции, может меняться от 0,1 до 10%, предпочтительно - от 1 до 10% и наиболее предпочтительно - от 4 до 6 мас.% в пересчете на полную массу фармацевтической композиции.
Абсолютное количество каждого фармацевтически приемлемого инертного наполнителя и количество других фармацевтически приемлемых инертных наполнителей зависят от необходимых характеристик таблетки и могут быть выбраны с помощью стандартных экспериментов.
Полная масса фармацевтической композиции составляет 100%.
Фармацевтическая композиция, предлагаемая в настоящем изобретении, считается “стабильной”, если в течение некоторого периода времени сохраняется 70%, предпочтительно - 80% и наиболее предпочтительно - 95% от исходного содержания соединения формулы I или его фармацевтически приемлемой соли, сольвата, гидрата или морфологической формы.
Стабильность фармацевтической композиции можно исследовать обычным образом, например путем определения содержания соединения формулы I и продуктов его разложения, исследования растворения, хрупкости, времени распада, внешнего вида и/или микроскопического исследования, например, после хранения при 25°С и равной 60% относительной влажности и/или после хранения при 40°С и равной 75% относительной влажности в течение определенных периодов времени.
Пример методики исследования растворения приведен в экспериментальной части, расположенной после примеров.
Предпочтительно, чтобы твердые композиции, предлагаемые в настоящем изобретении, были стабильны в течение не менее 6 или 12 месяцев при хранении при температуре от 5 до 50°С. Более предпочтительно, чтобы они были стабильны в течение не менее 6 или 12 месяцев при хранении при температуре от 15 до 45°С. Наиболее предпочтительно, чтобы они были стабильны в течение не менее 6 или 12 месяцев при хранении при температуре от 25 до 40°С.
В более предпочтительном варианте осуществления фармацевтические композиции стабильны в течение периода времени, такого как 1 год, и предпочтительно - 2 года. Более предпочтительно, чтобы фармацевтические композиции были стабильны в течение 3 лет.
Содержание соединения формулы 1 и продуктов его разложения в капсулах и таблетках определяют с помощью ВЭЖХ (высокоэффективная жидкостная хроматография).
Фармацевтическую композицию можно приготовить в виде капсулы и таблетки. Например, партию массой 1625 г (6500 капсул) при дозе 1 мг можно приготовить следующим образом:
Материал гранул предварительно перемешивали в смесителе с большим сдвиговым усилием, например Diosna (резервуар объемом 6 л), в течение 5 мин. К материалу гранул при перемешивании прибавляли примерно 731-893 г воды со скоростью 65 г/мин и перемешивали до образования подходящих гранул. Материал гранул дополнительно перемешивали в течение 2 мин. Затем гранулы сушили в аппарате с псевдоожиженным слоем с подачей воздуха, обладающего температурой 60°С, пока потери при сушке гранул не достигали 6-9 мас./мас.%. После этого гранулы пропускали через мельницу, снабженную ситом с отверстиями размером 813 мкм. Все материалы, наносимые на гранулы, за исключением стеарата магния пропускали через сито с отверстиями размером 1000 мкм и перемешивали с гранулами в течение 25 мин при 25 оборотов/мин в смесителе с двухконусным корпусом Pharmatech объемом 10 л. Стеарат магния просеивали через сито с отверстиями размером 500 мкм и прибавляли к порошкообразной смеси, находящейся в смесителе, и перемешивали в течение еще 3 мин.
Затем порошок помещали в белые непрозрачные капсулы из твердого желатина размера 0.
В одном объекте настоящего изобретения перед прессованием на соприкасающиеся с материалом поверхности прессующего оборудования, например пуансоны и/или матрицы таблетирующей машины, можно распылить одно или большее количество смазывающих веществ.
Размер капсул может быть разным, например от размера 1 до размера 00.
В контексте настоящего изобретения также можно приготовить таблетки. Таблетки могут обладать разной формой и могут быть, например, круглыми, овальными, удлиненными, цилиндрическими, обладать формой клеверного листа или любой другой подходящей формой.
В одном варианте осуществления настоящего изобретения полученные таблетки обладают формой клеверного листа или круглой формой. Края таблеток могут быть скошенными или скругленными. В другом варианте осуществления таблетки обладают формой клеверного листа со скошенными краями. Таблетки, предлагаемые в настоящем изобретении, могут обладать насечкой или гравировкой.
Таблетка, предлагаемая в настоящем изобретении, также может обладать формой клеверного листа с крестообразной насечкой и скошенными краями. Она может обладать диаметром от 5 до 15 мм (например, диаметром от 5 до 8 мм, например, диаметром, равным 6 мм), предпочтительно - диаметром в диапазоне от 8 до 15 мм и более предпочтительно - диаметром в диапазоне от 9 до 11 мм. Ее толщина может находиться в диапазоне (до нанесения покрытия, если на таблетку наносят пленочное покрытие) от 2,5 до 4,5 мм, предпочтительно - от 2,9 до 3,9 мм.
Капсулы и таблетки, предлагаемые в настоящем изобретении, могут быть окрашены и/или маркированы, чтобы придать им индивидуальный внешний вид и сделать их быстро распознаваемыми. Использование красителей может служить для улучшения внешнего вида, а также для идентификации таблеток. Красители, пригодные для использования в фармацевтике, включают каротиноиды, оксиды железа и хлорофилл. Таблетки, предлагаемые в настоящем изобретении, можно маркировать с помощью штампованного кода.
Капсулы и таблетки, предлагаемые в настоящем изобретении, применимы для лечения ЛАГ и обладают хорошим фармакокинетическим профилем.
Методики, которые можно использовать, могут быть обычными или известными в данной области техники или основанными на таких методиках, например описанные в публикациях L. Lachman et al., The Theory and Practice of Industrial Pharmacy, 3rd Ed., 1986; H. Sucker et al., Pharmazeutische Technologie, Thieme, 1991; Hagers Handbuch der pharmazeutischen Praxis, 4th Ed. (Springer Verlag, 1971) и Remington's Pharmaceutical Sciences, 13th Ed., (Mack Publ., Co., 1970) или более поздних изданиях.
Способ приготовления фармацевтической композиции в форме капсул, предлагаемый в настоящем изобретении, можно осуществить в соответствии со следующей блок-схемой:
Стадию сушки предпочтительно проводить с помощью сушилки с псевдоожиженным слоем.
Если приготавливаемая фармацевтическая композиция представляет собой таблетки, то способ приготовления, предлагаемый в настоящем изобретении, можно осуществить в соответствии со следующей блок-схемой:
Можно осуществить два варианта этого способа, один включает мокрое гранулирование (т.е. способ, представленный на приведенной выше блок-схеме, в котором к материалу гранул прибавляют некоторое количество воды и указанную воду удаляют на стадии сушки), и второй включает прямое прессование (т.е. способ, представленный на приведенной выше блок-схеме, без стадии сушки, указанная стадия сушки является излишней, поскольку к материалу гранул не прибавляют воду).
В соответствии с предпочтительным вариантом способа на таблетки, приготовленные описанным выше способом, наносят защитное пленочное покрытие. Указанное защитное пленочное покрытие предотвращает непосредственное взаимодействие таблетки с влагой; оно также может облегчить нанесение маркировки на таблетку.
В контексте настоящего изобретения масса материала покрытия составляет от 2 до 8%, предпочтительно - от 3 до 7% и более предпочтительно - от 4 до 6 мас.% в пересчете на массу таблетки до нанесения покрытия.
Материал покрытия, образующий указанное защитное пленочное покрытие, включает полимер, обладающий низкой проницаемостью для паров воды (такой, как поливиниловый спирт (например, Opadry АМВ®) или диметиламиноэтилметакрилат (например, EUDRAGIT® Е РО)). Материал покрытия может дополнительно включать пластификатор (например, пропиленгликоль, триацетин, дибутилфталат или дибутилсебацинат), поверхностно-активное вещество (например, лаурилсульфат натрия или полисорбат, такой как Tween) и/или смазывающее вещество/вещество, придающее скользкость (например, стеариновая кислота, стеарат магния или кальция, или тальк). Кроме того, материал покрытия также может включать пигмент (например, оксид железа(II), оксид железа(III) или оксид титана) для придания таблетке окраски.
Приведенные ниже неограничивающие примеры иллюстрируют настоящее изобретение.
ПРИМЕРЫ
Фармацевтические композиции примеров 1-15 готовили способом, представленным на приведенной ниже блок-схеме:
Фармацевтические композиции примеров 16-33 готовили способом мокрого гранулирования, представленным на приведенной ниже блок-схеме:
Наконец, фармацевтические композиции примеров 34-35 готовили способом прямого прессования, представленным на приведенной ниже блок-схеме:
(Отметим, что на приведенных выше блок-схемах “оборотов/мин” означает количество оборотов в минуту.)
Для нанесения на таблетки покрытия из Opadry® АМВ использовали описанную ниже технологию (далее называющуюся “общая технология нанесения на таблетки покрытия из Opadry® АМВ”).
Раствор для нанесения на таблетки покрытия из Opadry® АМВ получали путем приготовления 20 мас./мас.% дисперсии Opadry® АМВ (мелкий белый порошок) в очищенной воде, проводимого в емкости из нержавеющей стали при комнатной температуре. В течение 45 мин до использования и во время нанесения покрытия дисперсию перемешивали в смесителе Heidolph, снабженном лопастью из нержавеющей стали. До внесения таблеток бак для нанесения покрытия приводили в равновесие при установленной температуре (60°С). В течение 10 мин до нанесения покрытия таблетки приводили в равновесие к баке для сушки. На стадиях нагревания, нанесения покрытия и сушки использовали одну и ту же температуру и поток воздуха.
Параметры, использованные при нанесении покрытия на таблетки, содержащие соединение формулы (I), были следующими:
| Бак для нанесения покрытия | Accelacota 24” с блоком Manesty Flowtab |
| Температура на входе | 60°С |
| Температура на выходе | 40°С |
| Скорость вращения барабана | 12-14 оборотов/мин |
| Скорость распыления | 10 г/мин с повышением до 15 г/мин после 60 мин распыления |
| Отверстие сопла для жидкости (мм) | 1,2 мм |
| Распылительное устройство | Manesty МК-2 |
| Давление распыляющего воздуха | 50 фунт-сила/дюйм |
| Давление воздуха, создаваемое вентилятором | 50 фунт-сила/дюйм |
| Масса таблеток без активного вещества, увеличивающих объем слоя таблеток (г) | 7000 |
| Масса таблеток с активным веществом (г) | 300 |
| Количество таблеток с активным веществом | 4300 |
| Полная масса слоя таблеток (г) | 7300 |
Скорость потока воздуха в баке для нанесения покрытия не измеряли до нанесения покрытия, но измеряли после этого, и она найдена равной примерно 250 м3/ч. Для завершения нанесения покрытия требовалось от 110 до 120 мин (нанесение покрытия прекращали после распыления 1460 г раствора). После нанесения покрытия таблетки сушили в баке в течение 10 мин.
Для нанесения на таблетки покрытия из EUDRAGIT® Е РО использовали описанную ниже технологию (далее называющуюся “общая технология нанесения на таблетки покрытия из EUDRAGIT® Е РО”).
Покрытие наносили в аппарате Lödige LHC 25. Для распыления использовали распылительное устройство Schlick 970/7-1 S75 с диаметром сопла, равным 1,2 мм. В качестве системы подачи распыляемой суспензии использовали перистальтический насос Verder CD 70 и силиконовую трубку с внутренним диаметром, равным 2 мм.
Суспензию для нанесения на таблетки покрытия из EUDRAGIT® Е РО готовили следующим образом. В емкость помещали воду, прибавляли необходимое количество лаурилсульфата натрия и смесь гомогенизировали в течение 5 мин с помощью ULTRA Turrax. Затем небольшими порциями прибавляли необходимое количество стеариновой кислоты и гомогенизировали в течение 5-10 мин. После гомогенизации небольшими порциями медленно прибавляли EUDRAGIT® Е РО и гомогенизировали в течение 30 мин. Затем с помощью ULTRA Turrax необходимое количество стеарата магния готовили в виде 15% суспензии в воде и гомогенизировали. Суспензию стеарата магния прибавляли к раствору EUDRAGIT® Е РО. Готовую суспензию для покрытия в течение всей процедуры нанесения покрытия непрерывно перемешивали обычным пропеллерным смесителем.
Пример 1:
Масса партии: 20 г
| Материалы | Содержание мас./мас.% |
| Соединение | 40,0 |
| формулы I | |
| Pharmatose DCL11 | 28,7 |
| Крахмал 1500 | 25,0 |
| Натриевая соль гликолята крахмала | 4,0 |
| Лаурилсульфат | 1,0 |
| натрия | |
| Коллоидный | 0,3 |
| диоксид кремния | |
| Стеарат магния | 1,0 |
| Всего | 100,0 |
Примеры 2 и 3:
Масса партии: 625 г
| Материалы | Пример 2 | Пример 3 |
| Соединение формулы I | 0,08 | 0,08 |
| Pharmatose DCL11 | 68,62 | - |
| Крахмал 1500 | - | 93,62 |
| Avicel PH101 | 25,00 | - |
| Натриевая соль гликолята крахмала | 4,00 | 4,00 |
| Лаурилсульфат натрия | 1,00 | 1,00 |
| Aerosil 200 | 0,30 | 0,30 |
| Стеарат магния | 1,00 | 1,00 |
| 100 | 100 | |
| Примеры 4-11: |
Пример 12:
| Соединение формулы I, капсулы 0,2 мг | |||||
| МАТЕРИАЛ | Назначение | Содержание в композиции (мас./мас.%) | Разовая доза (мг) | Типичное количество в партии (г) | |
| (ХИМИЧЕСКОЕ НАЗВАНИЕ) | |||||
| В гра- нуле |
Соединение формулы I | Активное вещество | 0,08 | 0,20 | 0,600 |
| Предварительно желатинизированный кукурузный крахмал, ЕФ/ФВ/НФ | Разбавитель | 73,62 | 184,05 | 552,15 | |
| Микрокристаллическая целлюлоза, ЕФ | Разбавитель/вещество, обеспечивающее распадаемость | 10,00 | 25,00 | 75,00 | |
| Натриевая соль гликолята крахмала, ЕФ | Вещество, обеспечивающее распадаемость | 2,00 | 5,00 | 15,00 | |
| Лаурилсульфат натрия, ЕФ/НФ | Поверхностно-активное вещество | 1,00 | 2,50 | 7,50 | |
| На гра- нуле |
Микрокристаллическая целлюлоза, ЕФ | Разбавитель/вещество, обеспечивающее распадаемость | 10,00 | 25,00 | 75,00 |
| Натриевая соль гликолята крахмала, ЕФ | Вещество, обеспечивающее распадаемость | 2,00 | 5,00 | 15,00 | |
| Коллоидный диоксид кремния, ЕФ/НФ | Вещество, придающее скользкость | 0,30 | 0,75 | 2,25 | |
| Стеарат магния, ЕФ/ФВ | Смазывающее вещество | 1,00 | 2,50 | 7,50 | |
| Всего | 100,000 | 250,00 | 750,00 | ||
| ЕФ - Европейская Фармакопея, ФВ - Фармакопея Великобритании, НФ - Национальный фармацевтический справочник (США) | |||||
Пример 13:
| Соединение формулы I, капсулы 1,0 мг | |||||
| Материал | Назначение | Содержание в композиции (мас./мас.%) | Разовая доза (мг) | Типичное количество в партии (г) | |
| (химическое название) | |||||
| В гра- нуле |
Соединение формулы I | Активное вещество | 0,40 | 1,00 | 3,000 |
| Предварительно желатинизированный кукурузный крахмал, ЕФ/ФВ/НФ | Разбавитель | 73,30 | 183,25 | 549,75 | |
| Микрокристаллическая целлюлоза, ЕФ | Разбавитель/вещество, обеспечивающее распадаемость | 10,00 | 25,00 | 75,00 | |
| Натриевая соль гликолята крахмала, ЕФ | Вещество, обеспечивающее распадаемость | 2,00 | 5,00 | 15,00 | |
| Лаурилсульфат натрия, ЕФ/НФ | Поверхностно-активное вещество | 1,00 | 2,50 | 7,50 | |
| На гра- нуле |
Микрокристаллическая целлюлоза, ЕФ | Разбавитель/вещество, обеспечивающее распадаемость | 10,00 | 25,00 | 75,00 |
| Натриевая соль гликолята крахмала, ЕФ | Вещество, обеспечивающее распадаемость | 2,00 | 5,00 | 15,00 | |
| Коллоидный диоксид кремния, ЕФ/НФ | Вещество, придающее скользкость | 0,30 | 0,75 | 2,25 | |
| Стеарат магния, ЕФ/ФВ | Смазывающее вещество | 1,00 | 2,50 | 7,50 | |
| Всего | 100,000 | 250,00 | 750,00 | ||
Пример 14:
Пример 15:
| Соединение формулы I, капсулы 100 мг | |||||
| Материал | Назначение | Содержание в композиции (мас./мас.%) | Разовая доза (мг) | Типичное количество в партии (г) | |
| (химическое название) | |||||
| Соединение формулы I | Активное вещество | 40,00 | 100,00 | 300,00 | |
| В гра- нуле |
Предварительно желатинизированный кукурузный крахмал, ЕФ/ФВ/НФ | Разбавитель | 33,70 | 84,25 | 252,75 |
| Микрокристаллическая целлюлоза, ЕФ | Разбавитель/вещество, обеспечивающее распадаемость | 10,00 | 25,00 | 75,00 | |
| Натриевая соль гликолята крахмала, ЕФ | Вещество, обеспечивающее распадаемость | 2,00 | 5,00 | 15,00 | |
| Лаурилсульфат натрия, ЕФ/НФ | Поверхностно-активное вещество | 1,00 | 2,50 | 7,50 | |
| На гра- нуле |
Микрокристаллическая целлюлоза, ЕФ | Разбавитель/вещество, обеспечивающее распадаемость | 10,00 | 25,00 | 75,00 |
| Натриевая соль гликолята крахмала, ЕФ | Вещество, обеспечивающее распадаемость | 2,00 | 5,00 | 15,00 | |
| Коллоидный диоксид кремния, ЕФ/НФ | Вещество, придающее скользкость | 0,30 | 0,75 | 2,25 | |
| Стеарат магния, ЕФ/ФВ | Смазывающее вещество | 1,00 | 2,50 | 7,50 | |
| Всего | 100,000 | 250,00 | 100,000 | ||
Примеры 16-20:
Масса партии: 1 кг
| Соединение формулы I, таблетки (70 мг) | |||
| МАТЕРИАЛ | Содержание в композиции (мас./мас.%) | Разовая доза (мг) | |
| (ХИМИЧЕСКОЕ НАЗВАНИЕ) | |||
| В гра- нуле |
Соединение формулы I | 14,29 | 10,00 |
| Pharmatose 200М | 56,51 | 39,56 | |
| Avicel PH101 | 5,00 | 3,50 | |
| Povidone K30 | 3,00 | 2,10 | |
| Натриевая соль гликолята крахмала | 2,00 | 1,40 | |
| Tween 80V | 0,20 | 0,14 | |
| Вода | Сколько требуется | Сколько требуется | |
| На гра- нуле |
Avicel PH101 | 17,50 | 12,25 |
| Натриевая соль гликолята крахмала | 2,00 | 1,40 | |
| Стеарат магния | 0,50 | 0,35 | |
| Всего | 100,00 | 70,00 | |
Для приготовления таблеток по 70 мг, состав которых приведен в представленной выше таблице, использовали следующие параметры:
| Пример № | Установка пресса | Средняя твердость (Кр) | Средняя толщина (мм) |
| 16 | 19 | 1,81 | 3,348 |
| 17 | 21 | 7,11 | 2,944 |
| 18 | 23 | 8,10 | 2,875 |
| 19 | 25 | 8,56 | 2,864 |
| 20 | 27 | 8,85 | 2,886 |
Примеры 21-25:
Масса партии: 1 кг
| Соединение формулы I, таблетки (70 мг) | |||
| МАТЕРИАЛ (ХИМИЧЕСКОЕ НАЗВАНИЕ) | Содержание в композиции (мас./мас.%) | Разовая доза (мг) | |
| В гра- нуле |
Соединение формулы I | 0,43 | 0,30 |
| Pharmatose 200М | 68,37 | 47,86 | |
| Avicel PH101 | 5,00 | 3,50 | |
| Povidone K30 | 4,00 | 2,80 | |
| Натриевая соль гликолята крахмала | 2,00 | 1,40 | |
| Tween 80V | 0,20 | 0,14 | |
| Вода | Сколько требуется | Сколько требуется | |
| На гра- нуле |
Avicel PH101 | 17,50 | 12,25 |
| Натриевая соль гликолята крахмала | 2,00 | 1,40 | |
| Стеарат магния | 0,50 | 0,35 | |
| Всего | 100,00 | 70,00 | |
Для приготовления таблеток по 70 мг, состав которых приведен в представленной выше таблице, использовали следующие параметры (твердость и толщину определяли до возможного нанесения покрытия):
| Пример № | Установка пресса | Средняя твердость (Кр) | Средняя толщина (мм) |
| 21 | 19 | 1,52 | 3,339 |
| 22 | 21 | 5,77 | 3,048 |
| 23 | 23 | 6,32 | 2,989 |
| 24 | 25 | 6,88 | 3,059 |
| 25 | 27 | 6,95 | 3,006 |
Примеры 26-30:
Масса партии: 1 кг
| Соединение формулы I, таблетки (70 мг) | |||
| МАТЕРИАЛ (ХИМИЧЕСКОЕ НАЗВАНИЕ) | Содержание в композиции (маc./мас.%) | Разовая доза (мг) | |
| В грануле | Соединение формулы I | 0,43 | 0,30 |
| Pharmatose 200М | 68,37 | 47,86 | |
| Avicel PH101 | 5,00 | 3,50 | |
| Povidone K30 | 3,00 | 2,10 | |
| Натриевая соль гликолята крахмала | 2,00 | 1,40 | |
| Tween 80V | 0,20 | 0,14 | |
| Вода | Сколько требуется | Сколько требуется | |
| На грануле | Avicel PHI01 | 17,50 | 12,25 |
| Натриевая соль гликолята крахмала | 2,00 | 1,40 | |
| Стеарат магния | 1,50 | 1,05 | |
| Всего | 100,00 | 70,00 | |
Для приготовления таблеток по 70 мг, состав которых приведен в представленной выше таблице, использовали следующие параметры (твердость и толщину определяли до возможного нанесения покрытия):
| Пример № | Установка пресса | Средняя твердость (Кр) | Средняя толщина (мм) |
| 26 | 19 | 2,23 | 2,774 |
| 27 | 20 | 2,53 | 2,734 |
| 28 | 21 | 2,88 | 2,713 |
| 29 | 22 | 3,30 | 2,699 |
| 30 | 23 | 3,51 | 2,657 |
Пример 31:
Масса партии: 500 г
Таблетки по 250 мг, содержащие 1 мг соединения формулы I, состава, указанного в приведенной ниже таблице, готовили с использованием параметров, аналогичных указанным в приведенных выше примерах 16-30:
| Соединение формулы I, таблетки (250 мг) | |||
| МАТЕРИАЛ (ХИМИЧЕСКОЕ НАЗВАНИЕ) | Содержание в композиции (мас./мас.%) | Разовая доза (мг) | |
| В грануле | Соединение формулы I | 0,40 | 1,00 |
| Крахмал 1500 | 74,60 | 186,50 | |
| Avicel PH101 | 10,00 | 25,00 | |
| Натриевая соль гликолята крахмала | 2,00 | 5,00 | |
| Вода | Сколько требуется | Сколько требуется | |
| На грануле | Avicel PH101 | 10,00 | 25,00 |
| Натриевая соль гликолята крахмала | 2,00 | 5,00 | |
| Стеарат магния | 1,00 | 2,50 | |
| Всего | 100,00 | 250,00 | |
Пример 32:
Масса партии: 500 г
Таблетки по 70 мг, содержащие 1 мг соединения формулы I, состава, указанного в приведенной ниже таблице, и обладающие средней твердостью, равной 4 Кр, готовили с использованием параметров, аналогичных указанным в приведенных выше примерах 16-30:
| Соединение формулы I, таблетки (70 мг) | |||
| МАТЕРИАЛ (ХИМИЧЕСКОЕ НАЗВАНИЕ) | Содержание в композиции (мае./мас.%) | Разовая доза (мг) | |
| В гра- нуле |
Соединение формулы I | 1,43 | 1,00 |
| 200М лактоза | 70,86 | 49,60 | |
| Кукурузный крахмал | 20,00 | 14,00 | |
| Povidone К30 | 3,00 | 2,10 | |
| Натриевая соль | 2,00 | 1,40 | |
| гликолята крахмала | |||
| Tween 80V | 0,14 | 0,10 | |
| Вода | Сколько требуется | Сколько требуется | |
| На гра- нуле |
Натриевая соль | 2,00 | 1,40 |
| гликолята крахмала | |||
| Стеарат магния | 0,57 | 0,40 | |
| Всего | 100,00 | 70,00 | |
Пример 33:
Масса партии: 500 г
Таблетки по 70 мг, содержащие 1 мг соединения формулы I, состава, указанного в приведенной ниже таблице, готовили с использованием параметров, аналогичных указанным в приведенных выше примерах 16-30:
| Соединение формулы I, таблетки (70 мг) | |||
| МАТЕРИАЛ (ХИМИЧЕСКОЕ НАЗВАНИЕ) | Содержание в композиции (мас./мас.%) | Разовая доза (мг) | |
| В грану- ле |
Соединение формулы I | 1,40 | 0,98 |
| 200М лактоза | 62,50 | 43,75 | |
| Avicel PH101 | 5,00 | 3,50 | |
| Povidone К30 | 3,00 | 2,10 | |
| Натриевая соль | 2,00 | 1,40 | |
| гликолята крахмала | |||
| Tween 80V | 0,10 | 0,07 | |
| Винная кислота | 6,00 | 4,20 | |
| Вода | Сколько требуется | Сколько требуется | |
| На грану- ле |
Avicel PH101 | 17,50 | 12,25 |
| Натриевая соль гликолята крахмала | 2,00 | 1,40 | |
| Стеарат магния | 0,50 | 0,35 | |
| Всего | 100,00 | 70,00 | |
Пример 34:
Масса партии: 500 г
| Материалы | Содержание в композиции (мас./мас.%) | Разовая доза (мг) |
| Соединение формулы I | 1,40 | 0,98 |
| Безводная лактоза | 71,60 | 50,12 |
| Avicel PH112 | 22,50 | 15,80 |
| Натриевая соль гликолята крахмала | 4,00 | 2,80 |
| Стеарат магния | 0,50 | 0,40 |
| Всего | 100,0 | 70,00 |
Пример 35:
Масса партии: 500 г
| Материалы | Содержание в композиции (мас./мас.%) | Разовая доза (мг) |
| Соединение формулы I | 1,40 | 0,98 |
| Маннит (SD200) | 71,60 | 50,12 |
| Avicel PH112 | 22,50 | 15,80 |
| Натриевая соль гликолята | 4,00 | 2,80 |
| крахмала | ||
| Стеарат магния | 0,50 | 0,40 |
| Всего | 100,0 | 70,00 |
Пример 36:
На таблетки по 70 мг, содержащие 10 мг соединения формулы I, изготовленные, как в приведенном выше примере 17, покрытие наносили по общей технологии нанесения на таблетки покрытия из Opadry® АМВ, указанной выше, с использованием приведенных ниже значений параметров (ПРИМЕЧАНИЕ: значения, приведенные для твердых веществ и раствора для нанесения покрытия, таковы, что обеспечивают нанесение покрытия на партию не обладающих покрытием таблеток массой 7300 г):
| Содержание покрытия, мас./мас.% в пересчете на массу таблетки | 4% |
| Масса твердых веществ, необходимая для нанесения покрытия (г) | 292 |
| Содержание раствора для нанесения покрытия, мас./мас.% | 20% |
| Масса раствора, необходимая для нанесения покрытия (г) | 1460 |
Пример 37:
На таблетки по 70 мг, содержащие 10 мг соединения формулы I, изготовленные, как в приведенном выше примере 17, покрытие наносили по общей технологии нанесения на таблетки покрытия из Opadry® АМВ, указанной выше, с использованием приведенных ниже значений параметров (ПРИМЕЧАНИЕ: значения, приведенные для твердых веществ и раствора для нанесения покрытия, таковы, что обеспечивают нанесение покрытия на партию не обладающих покрытием таблеток массой 7300 г):
| Содержание покрытия, мас./мас.% в пересчете на массу таблетки | 6% |
| Масса твердых веществ, необходимая для нанесения покрытия (г) | 438 |
| Содержание раствора для нанесения покрытия, мас./мас.% | 20% |
| Масса раствора, необходимая для нанесения покрытия (г) | 2190 |
Пример 38:
На таблетки по 70 мг, содержащие 10 мг соединения формулы I, изготовленные, как в приведенном выше примере 17 (обладающие диаметром 5 мм и толщиной 3,1 мм), покрытие наносили по общей технологии нанесения на таблетки покрытия из EUDRAGIT Е РО, указанной выше. Масса партии не обладающих покрытием таблеток составляла 500 г. Использовали следующие количества EUDRAGIT® Е РО, лаурилсульфата натрия, стеариновой кислоты, стеарата магния и воды:
| EUDRAGIT Е РО (г) | 26,3 |
| Лаурилсульфат натрия (г) | 2,6 |
| Стеариновая кислота (г) | 3,9 |
| Стеарат магния (г) | 9,2 |
| Вода | 238,4 |
Пример 39:
На таблетки по 70 мг, содержащие 0,3 мг соединения формулы I, изготовленные, как в приведенном выше примере 28 (обладающие диаметром 5 мм и толщиной 2,9 мм), покрытие наносили по общей технологии нанесения на таблетки покрытия из EUDRAGIT® Е РО, указанной выше. Масса партии не обладающих покрытием таблеток составляла 600 г. Использовали следующие количества EUDRAGIT® Е РО, лаурилсульфата натрия, стеариновой кислоты и стеарата магния:
| EUDRAGIT® Е РО (г) | 92,0 |
| Лаурилсульфат натрия (г) | 9,2 |
| Стеариновая кислота (г) | 13,8 |
| Стеарат магния (г) | 32,2 |
| Вода | 834,3 |
Экспериментальное исследование фармацевтических композиций, предлагаемых в настоящем изобретении:
Исследование растворения:
Оборудование
Для исследования растворения использовали следующее оборудование:
- Аппарат типа USP 2: установка для исследования растворения SOTАХ АТ7 или эквивалентная, 6 емкостей для растворения объемом 1000 мл и 6 лопастей.
- Система ВЭЖХ Agilent 1100 с блоком сбора данных (Chemstation Plus).
- Аналитические весы METTLER АХ 205 DR
- Milli-Q gradient А10 MILLIPORE, F1KN13093 H
Характеристики работы оборудования
Растворение изучали при следующих условиях:
- Прибор для исследования растворения:
| Температура: | 37,0±0,5°С |
| Скорость: | 50±2 оборотов/мин |
| Объем: | 900 мл |
| Растворяющая среда: | Буфер рН 6,8, содержащий 0,05% Tween 80 |
| Объем пробы: | 12 мл без пополнения среды |
| Моменты отбора проб: | 5, 10, 15, 30, 45, 60 мин |
- Параметры ВЭЖХ:
| Стационарная фаза: | ЕС 250/3 Nucleodur С18 3 мкм |
| (cat. No. 7600820,30) |
Колонка: 250 мм х 3,00 мм 3 мкм (Macherey-Nagel)
Подвижная фаза: Изократическая
Инжектируемый 10 мкл
объем:
Температура колонки: 25°С
Температура 25°С
устройства автоматического
отбора проб:
Скорость потока: 0,5 мл/мин
Давление: 149 бар
Рабочая длина волны
детектора: 260 нм
Длительность 10 мин
хроматографирования:
Подвижная фаза: Тщательно перемешать 850 мл ацетонитрила, 150 мл воды и 5 мл трифторуксусной кислоты. Перед использованием дегазировать.
Методика
10 л среды для растворения готовят следующим образом: 79,85 г NaH2PO4·2H2O, 69,55 г Na2HPO4 и 5 г Tween 80 разбавляют водой до полного объема, равного 10 л.
Эталонный стандартный раствор соединения формулы I готовят дважды. Один из эталонных стандартных растворов будет использоваться в качестве рабочего эталонного стандартного раствора, а второй эталонный стандартный раствор будет использоваться в качестве контрольного эталонного стандартного раствора. Эталонный стандартный раствор соединения формулы I готовят следующим образом.
55 мг соединения формулы I отвешивают в мерную колбу объемом 250 мл и прибавляют 4 мл ацетонитрила. Смесь обрабатывают ультразвуком в течение 5 мин. После полного растворения соединения формулы I прибавляют среду для растворения с доведением объема до 250 мл. 10,0 мл этого раствора пипеткой переносят в мерную колбу объемом 200 мл, прибавляют среду для растворения с доведением объема до 200 мл. В результате концентрация соединения формулы I в эталонном стандартном растворе составляет 11 мкг/мл.
Раствор, содержащий растворенный образец, готовят следующим образом.
В каждую емкость аппарата для исследования растворения помещают 900 мл среды для растворения. Среду для растворения в течение не менее 30 мин приводят в равновесие в ванне для растворения при 37°С±0,5°С. В каждую емкость помещают 10 мг таблетку соединения формулы I. Из каждой емкости через 5, 10, 15, 30, 45 и 60 мин отбирают 12 мл раствора образца. Среду не пополняют. Через фильтрующий шприц Gelman acrodisk, содержащий стекловолоконный фильтр с отверстиями размером 1 мкм, раствор образца сразу же фильтруют во флакон для ВЭЖХ и охлаждают до комнатной температуры.
При проведении анализа с помощью ВЭЖХ инжектирование выполняют в следующем порядке:
- один раз инжектируют среду для растворения;
- последовательно 6 раз инжектируют рабочий эталонный стандартный раствор;
- один раз инжектируют раствор каждого образца.
После инжектирования 6 образцов повторно инжектируют рабочий эталонный стандартный раствор, чтобы дрейф системы находился в установленных пределах (2,0%).
Должны выполняться следующие требования:
- Последовательно 6 раз инжектируют рабочий эталонный стандартный раствор. Выраженное в процентах ОКО (относительное стандартное отклонение) для коэффициентов чувствительности (т.е. концентрации эталонного раствора, деленной на площадь пика эталонного раствора) должно составлять ≤2,0%. Полное ОКО коэффициента чувствительности для соединения формулы I в рабочем эталонном стандартном растворе должно составлять ≤2,0%.
- Относительная разность среднего коэффициента чувствительности для 6 инжектирований рабочего эталонного стандартного раствора и среднего для 2 инжектирований контрольного эталонного стандартного раствора должна составлять ≤1,5%.
Результаты можно рассчитать по следующим формулам:
| № | Длительность отбора проб (мин) | |
| 1 | 5 | 0 |
| 2 | 10 | C1Vr |
| 3 | 15 | (C1+C2)Vr |
| 4 | 30 | (C1+C2+C3)Vr |
| 5 | 45 | (C1+C2+C3+C4)Vr |
| 6 | 60 | (C1+C2+C3+C4+C5)Vr |
| и т.п. |
где:
D(%) = растворенное соединение формулы I в пересчете на указанное на этикетке количество,
Cn = концентрация соединения формулы I в n-м инжектировании, в
мг/мл,
V = начальный объем среды для растворения, в мл=900,
Vr = объем среды для растворения, извлеченной при каждом инжектировании, в мл=12,
Vn = реальный объем среды для растворения, в мл, в n-м инжектировании,
Т = указанное на этикетке количество соединения формулы I в 1 таблетке=10 мг,
n = n-й отбор пробы,
Aspl = площадь пика соединения формулы I, полученного для раствора образца,
Astd = площадь пика соединения формулы I, полученного для рабочего эталонного стандартного раствора,
Cstd = концентрация в мг/мл соединения формулы I в рабочем эталонном стандартном растворе,
Wstd = масса соединения формулы I в рабочем эталонном стандартном растворе, в мг,
Pstd = активность эталонного вещества соединения формулы I, в %,
DFstd = коэффициент разбавления стандартного раствора, в мл=5000.
Результаты для фармацевтических композиций, предлагаемых в настоящем изобретении.
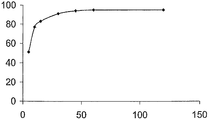
Композиции примеров 16-20 при исследовании по описанной методике обладают профилем растворения, приведенным на чертеже (на котором приведена зависимость растворения в процентах (ось Y) от времени в минутах (ось X)).
Claims (6)
1. Стабильная фармацевтическая композиция, обладающая антагонистической активностью в отношении эндотелиновых рецепторов, включающая:
а) соединение формулы I или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму
b) наполнитель, состоящий из моногидрата лактозы с монокристаллической целлюлозой;
c) вещество, обеспечивающее распадаемость, состоящее из натриевой соли гликолята крахмала или комбинации натриевой соли гликолята крахмала и поливинилпирролидона;
d) поверхностно-активное вещество, состоящее из полисорбата, в общем количестве от 0,1 до 3 мас.% в пересчете на полную массу фармацевтической композиции; и
e) смазывающее вещество, состоящее из стеарата магния.
а) соединение формулы I или его фармацевтически приемлемую соль, сольват, гидрат или морфологическую форму
b) наполнитель, состоящий из моногидрата лактозы с монокристаллической целлюлозой;
c) вещество, обеспечивающее распадаемость, состоящее из натриевой соли гликолята крахмала или комбинации натриевой соли гликолята крахмала и поливинилпирролидона;
d) поверхностно-активное вещество, состоящее из полисорбата, в общем количестве от 0,1 до 3 мас.% в пересчете на полную массу фармацевтической композиции; и
e) смазывающее вещество, состоящее из стеарата магния.
2. Стабильная фармацевтическая композиция по п.1, в которой полисорбат присутствует в общем количестве от 0,1 до 1 мас.% в пересчете на полную массу фармацевтической композиции.
3. Стабильная фармацевтическая композиция по п.1 или 2, в которой полисорбат представляет собой полисорбат 80.
4. Фармацевтическая композиция по одному из пп.1-3, которая находится в форме капсулы.
5. Фармацевтическая композиция по одному из пп.1-3, которая находится в форме таблетки.
6. Применение стабильной фармацевтической композиции по любому из пп.1-5 для приготовления лекарственного средства, предназначенного для лечения легочной артериальной гипертензии.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EPPTC/EP2005/009775 | 2005-09-12 | ||
| EP2005009775 | 2005-09-12 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008113869A RU2008113869A (ru) | 2009-10-20 |
| RU2424805C2 true RU2424805C2 (ru) | 2011-07-27 |
Family
ID=37865339
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008113869/15A RU2424805C2 (ru) | 2005-09-12 | 2006-09-11 | Стабильные фармацевтические композиции, включающие пиримидинсульфамид |
Country Status (24)
| Country | Link |
|---|---|
| US (6) | US20080233188A1 (ru) |
| EP (2) | EP2292209A3 (ru) |
| JP (2) | JP4955685B2 (ru) |
| KR (1) | KR101313395B1 (ru) |
| CN (1) | CN101262847B (ru) |
| AU (1) | AU2006290309B2 (ru) |
| BR (1) | BRPI0615898B8 (ru) |
| CA (1) | CA2621273C (ru) |
| CY (1) | CY1113395T1 (ru) |
| DK (1) | DK1928409T3 (ru) |
| ES (1) | ES2393117T3 (ru) |
| HK (1) | HK1121950A1 (ru) |
| HR (1) | HRP20120957T1 (ru) |
| IL (1) | IL190072A (ru) |
| MY (1) | MY151003A (ru) |
| NO (1) | NO341325B1 (ru) |
| NZ (1) | NZ567188A (ru) |
| PL (1) | PL1928409T3 (ru) |
| PT (1) | PT1928409E (ru) |
| RU (1) | RU2424805C2 (ru) |
| SI (1) | SI1928409T1 (ru) |
| TW (1) | TWI323661B (ru) |
| WO (1) | WO2007031933A2 (ru) |
| ZA (1) | ZA200802947B (ru) |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SI1928409T1 (sl) | 2005-09-12 | 2012-12-31 | Actelion Pharmaceuticals Ltd. | Stabilni farmacevtski sestavek, ki obsega pirimidin-sulfamid |
| AR062501A1 (es) | 2006-08-29 | 2008-11-12 | Actelion Pharmaceuticals Ltd | Composiciones terapeuticas |
| TWI399223B (zh) * | 2006-09-15 | 2013-06-21 | Daiichi Sankyo Co Ltd | 奧美沙坦酯及氨氯地平之固體劑型 |
| MX2010001837A (es) * | 2007-08-17 | 2010-03-10 | Actelion Pharmaceuticals Ltd | Derivados de 4-pirimidinasulfamida. |
| MX2010008994A (es) | 2008-02-20 | 2010-09-07 | Actelion Pharmaceuticals Ltd | Combinacion que comprende paclitaxel para el tratamiento del cancer de ovario. |
| SI3300729T1 (sl) | 2008-08-13 | 2020-02-28 | Actelion Pharmaceuticals Ltd. | Terapevtski sestavki, ki vsebujejo macitentan |
| CN102510719B (zh) | 2009-08-10 | 2015-07-22 | 得克萨斯大学体系董事会 | 用与细胞毒性化学治疗剂组合的内皮素受体抑制剂治疗脑转移 |
| WO2011074961A1 (en) | 2009-12-18 | 2011-06-23 | Frieslandcampina Nederland Holding B.V. | Co-processed tablet excipient composition its preparation and use |
| IT1403248B1 (it) * | 2010-11-12 | 2013-10-17 | Scharper Therapeutics Srl | Composizione per il trattamento di disfunzioni degli apparati fonatorio ed olfattorio |
| SG192600A1 (en) | 2011-02-04 | 2013-09-30 | Actelion Pharmaceuticals Ltd | Combinations comprising macitentan for the treatment of glioblastoma multiforme |
| DE14721256T1 (de) * | 2013-04-22 | 2017-03-16 | Sandoz Ag | Pharmazeutische zusammensetzungen mit kristallinem macitentan |
| US11857543B2 (en) | 2013-06-13 | 2024-01-02 | Akebia Therapeutics, Inc. | Compositions and methods for treating anemia |
| CN105693624B (zh) * | 2013-06-14 | 2018-05-18 | 杭州普晒医药科技有限公司 | 马西替坦晶体及其制备方法、其药物组合物和用途 |
| EP3169669A1 (en) * | 2014-07-15 | 2017-05-24 | OLON S.p.A. | Amorphous form and new crystalline forms of macitentan |
| NZ728089A (en) | 2014-07-25 | 2024-01-26 | Novartis Ag | Tablet formulation of 2-fluoro-n-methyl-4-[7-(quinolin-6-ylmethyl)imidazo[1,2-b][1,2,4]triazin-2-yl]benzamide |
| CN105388244B (zh) * | 2015-12-10 | 2017-03-08 | 合肥久诺医药科技有限公司 | 一种马西替坦有关物质的高效液相色谱分析方法 |
| WO2018153925A1 (en) | 2017-02-22 | 2018-08-30 | Amneal Pharmaceuticals Company Gmbh | Stable pharmaceutical compositions comprising macitentan |
| MX2021007455A (es) * | 2018-12-21 | 2021-08-05 | Actelion Pharmaceuticals Ltd | Composicion farmaceutica para el tratamiento de hipertension arterial pulmonar. |
| TW202042818A (zh) * | 2019-01-25 | 2020-12-01 | 瑞士商艾克泰聯製藥有限公司 | 用於治療慢性血栓性肺高血壓之醫藥組成物 |
| US20220249381A1 (en) * | 2019-07-05 | 2022-08-11 | TECNIMEDE - Sociedade Técnico-medicinal, SA | Compressed macitentan compositions, methods and uses thereof |
| TW202133851A (zh) | 2019-11-29 | 2021-09-16 | 瑞士商艾克泰聯製藥有限公司 | 治療肺動脈高血壓之方法 |
| WO2022238375A1 (en) | 2021-05-11 | 2022-11-17 | Actelion Pharmaceuticals Ltd | Methods of treating pulmonary hypertension |
| TW202317119A (zh) * | 2021-06-11 | 2023-05-01 | 瑞士商艾克泰聯製藥有限公司 | 用於口服投予之分散錠 |
| WO2023025672A1 (en) | 2021-08-25 | 2023-03-02 | Basf Se | Direct tableting auxiliary composition |
| WO2023038600A1 (en) * | 2021-09-07 | 2023-03-16 | Sanovel Ilac Sanayi Ve Ticaret Anonim Sirketi | A capsule formulation comprising macitentan |
| EP4154873A1 (en) | 2021-09-22 | 2023-03-29 | Sanovel Ilac Sanayi Ve Ticaret A.S. | The tablet comprising macitentan |
Family Cites Families (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5945098A (en) | 1990-02-01 | 1999-08-31 | Baxter International Inc. | Stable intravenously-administrable immune globulin preparation |
| JPH04103525A (ja) | 1990-08-22 | 1992-04-06 | Sanwa Kagaku Kenkyusho Co Ltd | 難水溶性薬物の持続性製剤化方法 |
| RU2086544C1 (ru) | 1991-06-13 | 1997-08-10 | Хоффманн-Ля Рош АГ | Бензолсульфонамидные производные пиримидина или их соли, фармацевтическая композиция для лечения заболеваний, связанных с активностью эндотелина |
| CA2124690C (en) | 1992-10-02 | 2007-09-11 | Thomas Osterberg | Composition comprising coagulation factor viii formulation, process for its preparation and use of a surfactant as stabilizer |
| US5811120A (en) | 1994-03-02 | 1998-09-22 | Eli Lilly And Company | Solid orally administerable raloxifene hydrochloride pharmaceutical formulation |
| TW442301B (en) | 1995-06-07 | 2001-06-23 | Sanofi Synthelabo | Pharmaceutical compositions containing irbesartan |
| TW414792B (en) | 1995-12-20 | 2000-12-11 | Yamanouchi Pharma Co Ltd | An arylethensulfonamide derivative having endothelin receptor antagonistic effect and its pharmaceutical composition |
| JPH103525A (ja) | 1996-06-14 | 1998-01-06 | Dainippon Printing Co Ltd | Icカード、命令コード格納方法及び命令コード実行方法 |
| CO5021171A1 (es) | 1997-12-08 | 2001-03-27 | Smithkline Beechman Corp | Sal de monoargininilo del acido(e)-3-(1-n-butil-5-(2-(2- carboxifenil)metoxi-4-clorofenil)-1h-pirazol-4-il)-2- ((5-metoxi-2,3-dihidrobenzofuran-5-il)metil)-prop-2-enoico |
| KR20010041609A (ko) | 1998-03-06 | 2001-05-25 | 유란드 인터내셔날 에스.피.아. | 속해성 정제 |
| US20010014352A1 (en) | 1998-05-27 | 2001-08-16 | Udit Batra | Compressed tablet formulation |
| US20040062803A1 (en) * | 1999-12-22 | 2004-04-01 | Hedden David B. | Sustained-release formulation of a cyclooxygenase-2 inhibitor |
| NZ519717A (en) * | 1999-12-31 | 2003-06-30 | Texas Biotechnology Corp | Sulfonamides and derivatives thereof that modulate the activity of endothelin |
| GB0001621D0 (en) | 2000-01-26 | 2000-03-15 | Astrazeneca Ab | Pharmaceutical compositions |
| JP2001335469A (ja) | 2000-05-26 | 2001-12-04 | Lion Corp | 固体製剤の製造方法 |
| HUP0301802A3 (en) | 2000-06-28 | 2009-04-28 | Teva Pharma | Process for producing carvedilol, crystalline carvedilol, process for producing it and pharmaceutical composition containing it |
| CA2430288C (en) | 2000-12-01 | 2009-03-10 | Kyowa Hakko Kogyo Co., Ltd. | A composition improved in the solubility or oral absorbability |
| AU2002239508B9 (en) | 2000-12-07 | 2005-09-08 | Gilead Palo Alto, Inc. | Substituted 1, 3, 5-triazines and pyrimidines as ABCA-1 elevating compounds against coronary artery disease or atherosclerosis |
| CN100432070C (zh) * | 2000-12-18 | 2008-11-12 | 埃科特莱茵药品有限公司 | 新颖的磺酰胺类化合物及其作为内皮素受体拮抗剂的应用 |
| FR2819720B1 (fr) | 2001-01-22 | 2004-03-12 | Fournier Lab Sa | Nouveaux comprimes de fenofibrate |
| JP3930290B2 (ja) | 2001-09-12 | 2007-06-13 | 富士フイルム株式会社 | 熱現像感光材料及びそれを用いた熱現像方法 |
| KR20030041577A (ko) | 2001-11-20 | 2003-05-27 | 디디에스텍주식회사 | 난용성 약물과 치환된 시클로덱스트린을 함유하는고체분산체 및 이를 함유하는 약제학적 조성물 |
| BR0306777A (pt) * | 2002-01-07 | 2005-04-26 | Pharmacia Corp | Tratamento de dor, inflamação e distúrbios relacionados à inflamação, com uma combinação de um inibidor seletivo de ciclooxigenase-2 e aspirina |
| EA008939B1 (ru) | 2002-02-11 | 2007-10-26 | Пфайзер Инк. | Производные никотинамида, полезные в качестве ингибиторов pde4 |
| MY135609A (en) | 2002-02-26 | 2008-05-30 | Astrazeneca Ab | Pharmaceutical formulation of iressa comprising a water-soluble cellulose derivative |
| GB0204771D0 (en) | 2002-02-28 | 2002-04-17 | Phoqus Ltd | Fast disintegrating tablets |
| US7625887B2 (en) | 2003-01-28 | 2009-12-01 | Takeda Pharmaceutical Company Limited | Receptor agonists |
| MXPA05009098A (es) | 2003-02-25 | 2005-11-17 | Lilly Co Eli | Clorhidrato de 1- (4-(2 -piperidiniletoxifenoxi) -2-(4-metansulfonilfenil) -6-hidroxinaftaleno cristalino no solvatado. |
| CA2549001A1 (en) | 2003-12-10 | 2005-06-30 | Activbiotics, Inc. | Rifamycin analogs and uses thereof |
| US7094081B1 (en) | 2005-03-24 | 2006-08-22 | Delphi Technologies, Inc. | Electrical connector assembly |
| SI1928409T1 (sl) | 2005-09-12 | 2012-12-31 | Actelion Pharmaceuticals Ltd. | Stabilni farmacevtski sestavek, ki obsega pirimidin-sulfamid |
| AR062501A1 (es) | 2006-08-29 | 2008-11-12 | Actelion Pharmaceuticals Ltd | Composiciones terapeuticas |
| MX2010008994A (es) | 2008-02-20 | 2010-09-07 | Actelion Pharmaceuticals Ltd | Combinacion que comprende paclitaxel para el tratamiento del cancer de ovario. |
| SI3300729T1 (sl) | 2008-08-13 | 2020-02-28 | Actelion Pharmaceuticals Ltd. | Terapevtski sestavki, ki vsebujejo macitentan |
| SG192600A1 (en) | 2011-02-04 | 2013-09-30 | Actelion Pharmaceuticals Ltd | Combinations comprising macitentan for the treatment of glioblastoma multiforme |
-
2006
- 2006-09-11 SI SI200631471T patent/SI1928409T1/sl unknown
- 2006-09-11 NZ NZ567188A patent/NZ567188A/en unknown
- 2006-09-11 JP JP2008529767A patent/JP4955685B2/ja active Active
- 2006-09-11 ES ES06809280T patent/ES2393117T3/es active Active
- 2006-09-11 RU RU2008113869/15A patent/RU2424805C2/ru active
- 2006-09-11 BR BRPI0615898A patent/BRPI0615898B8/pt active IP Right Grant
- 2006-09-11 PL PL06809280T patent/PL1928409T3/pl unknown
- 2006-09-11 CN CN2006800333751A patent/CN101262847B/zh active Active
- 2006-09-11 CA CA2621273A patent/CA2621273C/en active Active
- 2006-09-11 DK DK06809280.8T patent/DK1928409T3/da active
- 2006-09-11 AU AU2006290309A patent/AU2006290309B2/en active Active
- 2006-09-11 US US12/066,448 patent/US20080233188A1/en not_active Abandoned
- 2006-09-11 PT PT06809280T patent/PT1928409E/pt unknown
- 2006-09-11 WO PCT/IB2006/053210 patent/WO2007031933A2/en active Application Filing
- 2006-09-11 MY MYPI20080524 patent/MY151003A/en unknown
- 2006-09-11 EP EP10009910A patent/EP2292209A3/en not_active Withdrawn
- 2006-09-11 EP EP06809280A patent/EP1928409B1/en active Active
- 2006-09-11 KR KR1020087008450A patent/KR101313395B1/ko active IP Right Review Request
- 2006-09-12 TW TW095133695A patent/TWI323661B/zh active
-
2008
- 2008-03-11 IL IL190072A patent/IL190072A/en active IP Right Grant
- 2008-04-03 ZA ZA200802947A patent/ZA200802947B/xx unknown
- 2008-04-09 NO NO20081724A patent/NO341325B1/no unknown
-
2009
- 2009-02-18 US US12/388,142 patent/US8367685B2/en active Active
- 2009-03-09 HK HK09102261.9A patent/HK1121950A1/xx not_active IP Right Cessation
- 2009-05-01 JP JP2009112258A patent/JP5054061B2/ja active Active
-
2012
- 2012-11-21 CY CY20121101126T patent/CY1113395T1/el unknown
- 2012-11-23 HR HRP20120957TT patent/HRP20120957T1/hr unknown
-
2013
- 2013-01-08 US US13/736,699 patent/US9265762B2/en active Active
-
2016
- 2016-01-20 US US15/002,255 patent/US10117870B2/en active Active
-
2018
- 2018-02-20 US US15/900,586 patent/US10946015B2/en active Active
-
2020
- 2020-12-09 US US17/116,983 patent/US11648249B2/en active Active
Non-Patent Citations (2)
| Title |
|---|
| ГФ СССР 11 изд., вып.2. Общие методы анализа. Лекарственное растительное сырье. - М.: Медицина, 1990, с.159. * |
| ЧУЕШОВ В.И. и др. Промышленная технология лекарств. Т.2. - Харьков: Издательство НФАУ, МТК-Книга, 2002, с.330-334. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2424805C2 (ru) | Стабильные фармацевтические композиции, включающие пиримидинсульфамид | |
| US11103467B2 (en) | Method for treating depression | |
| EP3572074B1 (en) | Stabilized formulations of molindone | |
| CN105431140B (zh) | 含有缓释二甲双胍和速释HMG-CoA还原酶抑制剂的复合制剂 | |
| KR20030076634A (ko) | 의약 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| TK4A | Correction to the publication in the bulletin (patent) |
Free format text: AMENDMENT TO CHAPTER -FG4A- IN JOURNAL: 21-2011 FOR TAG: (57) |
|
| RZ4A | Other changes in the information about an invention | ||
| TK4A | Correction to the publication in the bulletin (patent) |
Free format text: AMENDMENT TO CHAPTER -RZ4A- IN JOURNAL: 26-2016 |