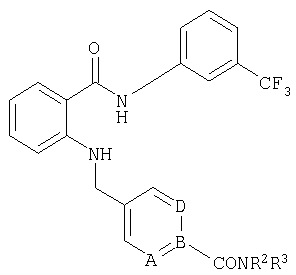
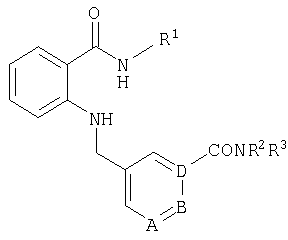
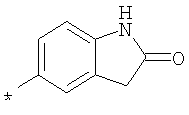
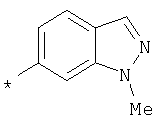
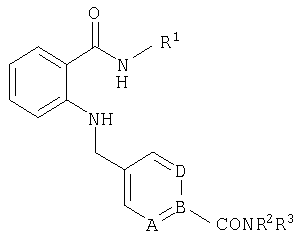
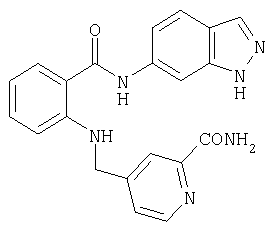
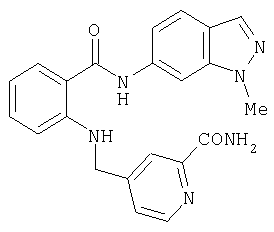
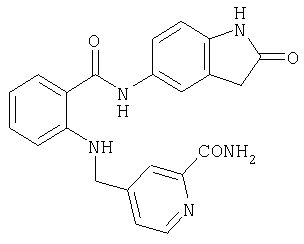
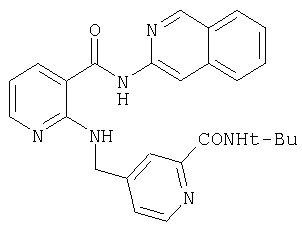
RU2299208C2 - Антраниламидпиридинамиды избирательного действия в качестве ингибиторов vegfr-2 и vegfr-3 - Google Patents
Антраниламидпиридинамиды избирательного действия в качестве ингибиторов vegfr-2 и vegfr-3 Download PDFInfo
- Publication number
- RU2299208C2 RU2299208C2 RU2003134148/04A RU2003134148A RU2299208C2 RU 2299208 C2 RU2299208 C2 RU 2299208C2 RU 2003134148/04 A RU2003134148/04 A RU 2003134148/04A RU 2003134148 A RU2003134148 A RU 2003134148A RU 2299208 C2 RU2299208 C2 RU 2299208C2
- Authority
- RU
- Russia
- Prior art keywords
- alkyl
- group
- ring
- nitrogen atom
- nitrogen
- Prior art date
Links
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 title claims abstract description 10
- 108010053100 Vascular Endothelial Growth Factor Receptor-3 Proteins 0.000 title claims abstract description 4
- 150000001408 amides Chemical class 0.000 title abstract description 27
- 239000003112 inhibitor Substances 0.000 title abstract description 9
- 230000000694 effects Effects 0.000 title abstract description 5
- 102000016549 Vascular Endothelial Growth Factor Receptor-2 Human genes 0.000 title 1
- 102000016663 Vascular Endothelial Growth Factor Receptor-3 Human genes 0.000 title 1
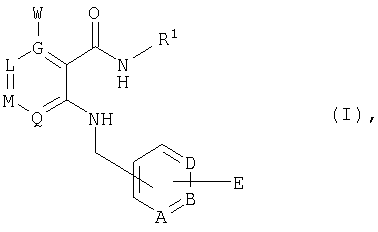
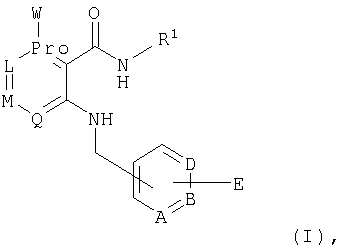
- -1 hydroxy- Chemical group 0.000 claims abstract description 94
- 229910052757 nitrogen Inorganic materials 0.000 claims abstract description 88
- 239000001257 hydrogen Substances 0.000 claims abstract description 83
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 83
- 125000004433 nitrogen atom Chemical group N* 0.000 claims abstract description 74
- 150000001875 compounds Chemical class 0.000 claims abstract description 69
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 47
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims abstract description 46
- 125000003118 aryl group Chemical group 0.000 claims abstract description 43
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 38
- 229910052799 carbon Inorganic materials 0.000 claims abstract description 27
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims abstract description 20
- 150000003839 salts Chemical class 0.000 claims abstract description 20
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims abstract description 19
- 229910052717 sulfur Inorganic materials 0.000 claims abstract description 19
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 17
- 239000001301 oxygen Substances 0.000 claims abstract description 16
- 125000006413 ring segment Chemical group 0.000 claims abstract description 16
- 125000005842 heteroatom Chemical group 0.000 claims abstract description 15
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims abstract description 14
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims abstract description 14
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 14
- 125000004093 cyano group Chemical group *C#N 0.000 claims abstract description 14
- 239000011593 sulfur Substances 0.000 claims abstract description 14
- 150000001721 carbon Chemical group 0.000 claims abstract description 12
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims abstract description 11
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 claims abstract description 11
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims abstract description 11
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims abstract description 11
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 claims abstract description 10
- 125000004434 sulfur atom Chemical group 0.000 claims abstract description 10
- 125000004430 oxygen atom Chemical group O* 0.000 claims abstract description 9
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 claims abstract description 5
- BJHCYTJNPVGSBZ-YXSASFKJSA-N 1-[4-[6-amino-5-[(Z)-methoxyiminomethyl]pyrimidin-4-yl]oxy-2-chlorophenyl]-3-ethylurea Chemical compound CCNC(=O)Nc1ccc(Oc2ncnc(N)c2\C=N/OC)cc1Cl BJHCYTJNPVGSBZ-YXSASFKJSA-N 0.000 claims abstract description 5
- 239000000126 substance Substances 0.000 claims abstract description 5
- 102100033179 Vascular endothelial growth factor receptor 3 Human genes 0.000 claims abstract description 3
- 125000005843 halogen group Chemical group 0.000 claims abstract 18
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims abstract 8
- 238000002360 preparation method Methods 0.000 claims description 53
- 229910052736 halogen Inorganic materials 0.000 claims description 48
- 239000000203 mixture Substances 0.000 claims description 36
- 150000002367 halogens Chemical class 0.000 claims description 34
- 150000002431 hydrogen Chemical group 0.000 claims description 33
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 22
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 20
- 201000010099 disease Diseases 0.000 claims description 19
- 239000003814 drug Substances 0.000 claims description 17
- SNOOUWRIMMFWNE-UHFFFAOYSA-M sodium;6-[(3,4,5-trimethoxybenzoyl)amino]hexanoate Chemical compound [Na+].COC1=CC(C(=O)NCCCCCC([O-])=O)=CC(OC)=C1OC SNOOUWRIMMFWNE-UHFFFAOYSA-M 0.000 claims description 14
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 claims description 13
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims description 10
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 10
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 claims description 8
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 8
- 229940079593 drug Drugs 0.000 claims description 8
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 claims description 8
- 230000035755 proliferation Effects 0.000 claims description 6
- 125000004076 pyridyl group Chemical group 0.000 claims description 6
- 208000037803 restenosis Diseases 0.000 claims description 6
- 208000003120 Angiofibroma Diseases 0.000 claims description 5
- 206010003210 Arteriosclerosis Diseases 0.000 claims description 5
- 206010063209 Chronic allograft nephropathy Diseases 0.000 claims description 5
- 208000007342 Diabetic Nephropathies Diseases 0.000 claims description 5
- 206010012689 Diabetic retinopathy Diseases 0.000 claims description 5
- 201000009273 Endometriosis Diseases 0.000 claims description 5
- 208000010412 Glaucoma Diseases 0.000 claims description 5
- 201000004681 Psoriasis Diseases 0.000 claims description 5
- 206010052779 Transplant rejections Diseases 0.000 claims description 5
- 208000011775 arteriosclerosis disease Diseases 0.000 claims description 5
- 206010003246 arthritis Diseases 0.000 claims description 5
- 208000019425 cirrhosis of liver Diseases 0.000 claims description 5
- 208000033679 diabetic kidney disease Diseases 0.000 claims description 5
- 208000030533 eye disease Diseases 0.000 claims description 5
- 230000003176 fibrotic effect Effects 0.000 claims description 5
- 201000011066 hemangioma Diseases 0.000 claims description 5
- 208000017169 kidney disease Diseases 0.000 claims description 5
- 201000003142 neovascular glaucoma Diseases 0.000 claims description 5
- 210000000944 nerve tissue Anatomy 0.000 claims description 5
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 5
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims description 5
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 5
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 claims description 4
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 claims description 4
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 claims description 4
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 claims description 4
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 claims description 4
- 230000003211 malignant effect Effects 0.000 claims description 4
- 201000009925 nephrosclerosis Diseases 0.000 claims description 4
- 229930192474 thiophene Natural products 0.000 claims description 4
- 208000011231 Crohn disease Diseases 0.000 claims description 3
- 206010012442 Dermatitis contact Diseases 0.000 claims description 3
- 206010016654 Fibrosis Diseases 0.000 claims description 3
- 208000017604 Hodgkin disease Diseases 0.000 claims description 3
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 3
- 208000007766 Kaposi sarcoma Diseases 0.000 claims description 3
- 230000007882 cirrhosis Effects 0.000 claims description 3
- 208000010247 contact dermatitis Diseases 0.000 claims description 3
- 230000002401 inhibitory effect Effects 0.000 claims description 3
- 208000032839 leukemia Diseases 0.000 claims description 3
- 210000003584 mesangial cell Anatomy 0.000 claims description 3
- 125000001544 thienyl group Chemical group 0.000 claims description 3
- 230000029663 wound healing Effects 0.000 claims description 3
- 206010053648 Vascular occlusion Diseases 0.000 claims description 2
- 239000002671 adjuvant Substances 0.000 claims description 2
- 229960003444 immunosuppressant agent Drugs 0.000 claims description 2
- 239000003018 immunosuppressive agent Substances 0.000 claims description 2
- 208000021331 vascular occlusion disease Diseases 0.000 claims description 2
- 230000001737 promoting effect Effects 0.000 claims 1
- 230000000451 tissue damage Effects 0.000 claims 1
- 231100000827 tissue damage Toxicity 0.000 claims 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 abstract description 9
- 230000015572 biosynthetic process Effects 0.000 abstract description 8
- 238000003786 synthesis reaction Methods 0.000 abstract description 8
- 239000003795 chemical substances by application Substances 0.000 abstract description 3
- 230000004071 biological effect Effects 0.000 abstract description 2
- 230000007721 medicinal effect Effects 0.000 abstract 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 104
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 69
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 69
- 238000000034 method Methods 0.000 description 67
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 52
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 48
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 47
- 235000019439 ethyl acetate Nutrition 0.000 description 35
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 34
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 32
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 28
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 27
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 24
- 238000004949 mass spectrometry Methods 0.000 description 24
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 23
- 239000000243 solution Substances 0.000 description 22
- 239000000741 silica gel Substances 0.000 description 21
- 229910002027 silica gel Inorganic materials 0.000 description 21
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 19
- 239000003480 eluent Substances 0.000 description 19
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Natural products CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 18
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 18
- 239000002904 solvent Substances 0.000 description 15
- 238000003756 stirring Methods 0.000 description 15
- 239000012074 organic phase Substances 0.000 description 14
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 13
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 12
- 239000011347 resin Substances 0.000 description 12
- 229920005989 resin Polymers 0.000 description 12
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 11
- 125000000217 alkyl group Chemical group 0.000 description 11
- 238000006243 chemical reaction Methods 0.000 description 11
- 238000010828 elution Methods 0.000 description 10
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 9
- 230000033115 angiogenesis Effects 0.000 description 9
- 238000002844 melting Methods 0.000 description 9
- 230000008018 melting Effects 0.000 description 9
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 9
- 235000017557 sodium bicarbonate Nutrition 0.000 description 9
- 239000007787 solid Substances 0.000 description 9
- 238000005160 1H NMR spectroscopy Methods 0.000 description 8
- 229960000583 acetic acid Drugs 0.000 description 8
- 239000002253 acid Substances 0.000 description 8
- 230000005764 inhibitory process Effects 0.000 description 8
- 229910052763 palladium Inorganic materials 0.000 description 8
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 8
- ASFAFOSQXBRFMV-LJQANCHMSA-N 3-n-(2-benzyl-1,3-dihydroxypropan-2-yl)-1-n-[(1r)-1-(4-fluorophenyl)ethyl]-5-[methyl(methylsulfonyl)amino]benzene-1,3-dicarboxamide Chemical compound N([C@H](C)C=1C=CC(F)=CC=1)C(=O)C(C=1)=CC(N(C)S(C)(=O)=O)=CC=1C(=O)NC(CO)(CO)CC1=CC=CC=C1 ASFAFOSQXBRFMV-LJQANCHMSA-N 0.000 description 7
- 102000002004 Cytochrome P-450 Enzyme System Human genes 0.000 description 7
- 108010015742 Cytochrome P-450 Enzyme System Proteins 0.000 description 7
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 7
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 7
- SIOXPEMLGUPBBT-UHFFFAOYSA-N Picolinic acid Natural products OC(=O)C1=CC=CC=N1 SIOXPEMLGUPBBT-UHFFFAOYSA-N 0.000 description 7
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 7
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 7
- 239000012298 atmosphere Substances 0.000 description 7
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 7
- 230000002085 persistent effect Effects 0.000 description 7
- 239000011550 stock solution Substances 0.000 description 7
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 6
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 6
- 150000001412 amines Chemical class 0.000 description 6
- 239000012300 argon atmosphere Substances 0.000 description 6
- 125000002102 aryl alkyloxo group Chemical group 0.000 description 6
- 238000009835 boiling Methods 0.000 description 6
- 238000001816 cooling Methods 0.000 description 6
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 6
- 229910052740 iodine Inorganic materials 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 5
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 5
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 5
- 108010029485 Protein Isoforms Proteins 0.000 description 5
- 102000001708 Protein Isoforms Human genes 0.000 description 5
- 108091008605 VEGF receptors Proteins 0.000 description 5
- 239000008346 aqueous phase Substances 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- 239000012362 glacial acetic acid Substances 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- JLTRXTDYQLMHGR-UHFFFAOYSA-N trimethylaluminium Chemical group C[Al](C)C JLTRXTDYQLMHGR-UHFFFAOYSA-N 0.000 description 5
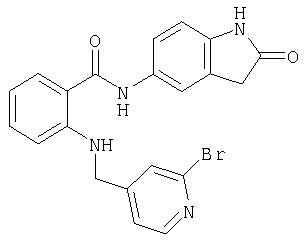
- UFQULLMHZGLQOQ-UHFFFAOYSA-N 2-[(6-bromopyridin-3-yl)methylamino]-n-isoquinolin-3-ylbenzamide Chemical compound C1=NC(Br)=CC=C1CNC1=CC=CC=C1C(=O)NC1=CC2=CC=CC=C2C=N1 UFQULLMHZGLQOQ-UHFFFAOYSA-N 0.000 description 4
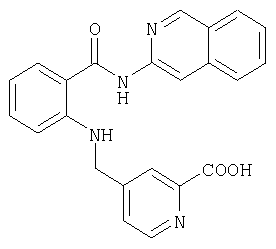
- ICBWRCJYESEONQ-UHFFFAOYSA-N 5-[[2-(isoquinolin-3-ylcarbamoyl)anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=NC(C(=O)O)=CC=C1CNC1=CC=CC=C1C(=O)NC1=CC2=CC=CC=C2C=N1 ICBWRCJYESEONQ-UHFFFAOYSA-N 0.000 description 4
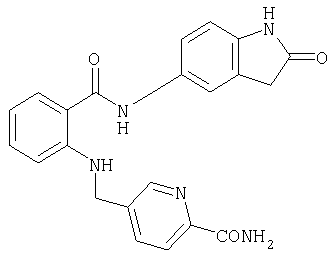
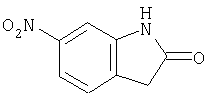
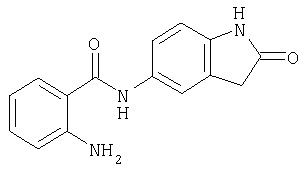
- JQCGHRDKVZPCRO-UHFFFAOYSA-N 5-nitro-1,3-dihydroindol-2-one Chemical compound [O-][N+](=O)C1=CC=C2NC(=O)CC2=C1 JQCGHRDKVZPCRO-UHFFFAOYSA-N 0.000 description 4
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 206010018364 Glomerulonephritis Diseases 0.000 description 4
- 206010028980 Neoplasm Diseases 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- 108010053096 Vascular Endothelial Growth Factor Receptor-1 Proteins 0.000 description 4
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 description 4
- 229910002091 carbon monoxide Inorganic materials 0.000 description 4
- 150000001733 carboxylic acid esters Chemical class 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 229910052801 chlorine Inorganic materials 0.000 description 4
- 150000002148 esters Chemical group 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- RBGYINCBTMEZKS-UHFFFAOYSA-N methyl 2-[(2-bromopyridin-4-yl)methylamino]benzoate Chemical compound COC(=O)C1=CC=CC=C1NCC1=CC=NC(Br)=C1 RBGYINCBTMEZKS-UHFFFAOYSA-N 0.000 description 4
- MYGAJZBZLONIBZ-UHFFFAOYSA-N methyl 2-chloropyridine-3-carboxylate Chemical compound COC(=O)C1=CC=CN=C1Cl MYGAJZBZLONIBZ-UHFFFAOYSA-N 0.000 description 4
- 239000003921 oil Substances 0.000 description 4
- 235000019198 oils Nutrition 0.000 description 4
- 230000003647 oxidation Effects 0.000 description 4
- 238000007254 oxidation reaction Methods 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- 230000026731 phosphorylation Effects 0.000 description 4
- 238000006366 phosphorylation reaction Methods 0.000 description 4
- 229910000027 potassium carbonate Inorganic materials 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 239000000377 silicon dioxide Substances 0.000 description 4
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 4
- ONDSBJMLAHVLMI-UHFFFAOYSA-N trimethylsilyldiazomethane Chemical compound C[Si](C)(C)[CH-][N+]#N ONDSBJMLAHVLMI-UHFFFAOYSA-N 0.000 description 4
- IQNUGAFIKDRYRP-UHFFFAOYSA-N (2-bromopyridin-4-yl)methanol Chemical compound OCC1=CC=NC(Br)=C1 IQNUGAFIKDRYRP-UHFFFAOYSA-N 0.000 description 3
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 3
- TYBHOVGTFNYLMH-UHFFFAOYSA-N 2-[(2-bromopyridin-4-yl)methylamino]benzoic acid Chemical compound OC(=O)C1=CC=CC=C1NCC1=CC=NC(Br)=C1 TYBHOVGTFNYLMH-UHFFFAOYSA-N 0.000 description 3
- VQINEUOBBUQFOD-UHFFFAOYSA-N 2-[(3-bromopyridin-4-yl)methylamino]-n-isoquinolin-3-ylbenzamide Chemical compound BrC1=CN=CC=C1CNC1=CC=CC=C1C(=O)NC1=CC2=CC=CC=C2C=N1 VQINEUOBBUQFOD-UHFFFAOYSA-N 0.000 description 3
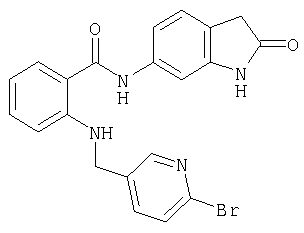
- WNLPDAAPKOSKLN-UHFFFAOYSA-N 2-[(6-cyanopyridin-3-yl)methylamino]-n-(2-oxo-1,3-dihydroindol-5-yl)benzamide Chemical compound C=1C=C2NC(=O)CC2=CC=1NC(=O)C1=CC=CC=C1NCC1=CC=C(C#N)N=C1 WNLPDAAPKOSKLN-UHFFFAOYSA-N 0.000 description 3
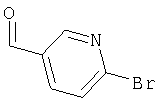
- RTWLIQFKXMWEJY-UHFFFAOYSA-N 2-bromopyridine-4-carbaldehyde Chemical compound BrC1=CC(C=O)=CC=N1 RTWLIQFKXMWEJY-UHFFFAOYSA-N 0.000 description 3
- MDXIZXUTXSSPJR-UHFFFAOYSA-N 2-chloro-n-isoquinolin-3-ylpyridine-3-carboxamide Chemical compound ClC1=NC=CC=C1C(=O)NC1=CC2=CC=CC=C2C=N1 MDXIZXUTXSSPJR-UHFFFAOYSA-N 0.000 description 3
- APTDYFKGJMMECD-UHFFFAOYSA-N 2-nitro-n-(2-oxo-1,3-dihydroindol-5-yl)benzamide Chemical compound [O-][N+](=O)C1=CC=CC=C1C(=O)NC1=CC=C(NC(=O)C2)C2=C1 APTDYFKGJMMECD-UHFFFAOYSA-N 0.000 description 3
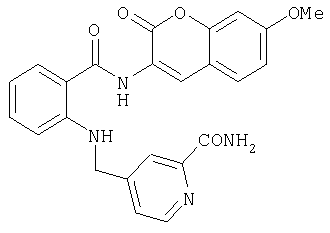
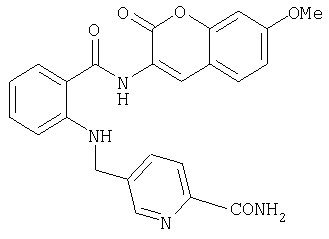
- WDHGEMGLHPFINN-UHFFFAOYSA-N 3-amino-7-methoxychromen-2-one Chemical compound C1=C(N)C(=O)OC2=CC(OC)=CC=C21 WDHGEMGLHPFINN-UHFFFAOYSA-N 0.000 description 3
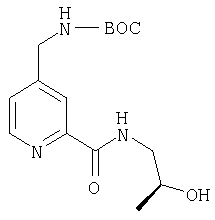
- BSNYTBOSHJFWQM-UHFFFAOYSA-N 4-[[(2-methylpropan-2-yl)oxycarbonylamino]methyl]pyridine-2-carboxylic acid Chemical compound CC(C)(C)OC(=O)NCC1=CC=NC(C(O)=O)=C1 BSNYTBOSHJFWQM-UHFFFAOYSA-N 0.000 description 3
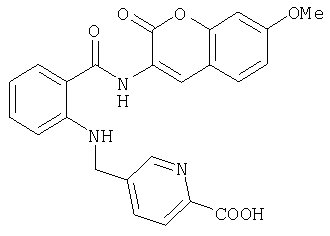
- XDKYVYWSYZKNNI-UHFFFAOYSA-N 5-[[2-[(7-methoxy-2-oxochromen-3-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound O=C1OC2=CC(OC)=CC=C2C=C1NC(=O)C1=CC=CC=C1NCC1=CC=C(C(O)=O)N=C1 XDKYVYWSYZKNNI-UHFFFAOYSA-N 0.000 description 3
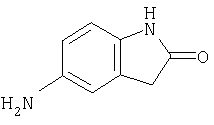
- JPUYXUBUJJDJNL-UHFFFAOYSA-N 5-amino-1,3-dihydroindol-2-one Chemical compound NC1=CC=C2NC(=O)CC2=C1 JPUYXUBUJJDJNL-UHFFFAOYSA-N 0.000 description 3
- UHOWQPKSOYGVKZ-UHFFFAOYSA-N 7-methoxy-3-nitrochromen-2-one Chemical compound C1=C([N+]([O-])=O)C(=O)OC2=CC(OC)=CC=C21 UHOWQPKSOYGVKZ-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
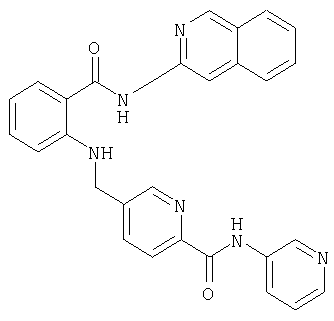
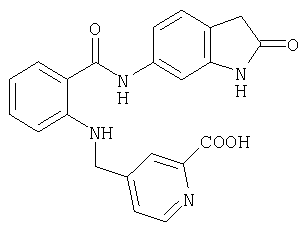
- PLLNJDJCRISLAA-UHFFFAOYSA-N C1=CC=C2C=NC(=CC2=C1)N(CC3=CC(=NC=C3)C(=O)O)C4=CC=CC=C4C(=O)O Chemical compound C1=CC=C2C=NC(=CC2=C1)N(CC3=CC(=NC=C3)C(=O)O)C4=CC=CC=C4C(=O)O PLLNJDJCRISLAA-UHFFFAOYSA-N 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- 108010044467 Isoenzymes Proteins 0.000 description 3
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 3
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 239000000010 aprotic solvent Substances 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 150000001555 benzenes Chemical class 0.000 description 3
- 210000004204 blood vessel Anatomy 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 244000309464 bull Species 0.000 description 3
- 230000006315 carbonylation Effects 0.000 description 3
- 238000005810 carbonylation reaction Methods 0.000 description 3
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 3
- 150000001735 carboxylic acids Chemical class 0.000 description 3
- 210000004027 cell Anatomy 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 3
- 238000003818 flash chromatography Methods 0.000 description 3
- VYCKDIRCVDCQAE-UHFFFAOYSA-N isoquinolin-3-amine Chemical compound C1=CC=C2C=NC(N)=CC2=C1 VYCKDIRCVDCQAE-UHFFFAOYSA-N 0.000 description 3
- 125000004551 isoquinolin-3-yl group Chemical group C1=NC(=CC2=CC=CC=C12)* 0.000 description 3
- 230000035168 lymphangiogenesis Effects 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
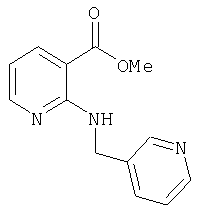
- PLOCZDFHZOYHLI-UHFFFAOYSA-N methyl 2-(pyridin-4-ylmethylamino)pyridine-3-carboxylate Chemical compound COC(=O)C1=CC=CN=C1NCC1=CC=NC=C1 PLOCZDFHZOYHLI-UHFFFAOYSA-N 0.000 description 3
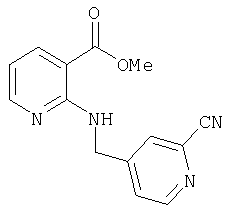
- KGBLFOGNASQAJK-UHFFFAOYSA-N methyl 2-[(2-cyanopyridin-4-yl)methylamino]benzoate Chemical compound COC(=O)C1=CC=CC=C1NCC1=CC=NC(C#N)=C1 KGBLFOGNASQAJK-UHFFFAOYSA-N 0.000 description 3
- QJLHLTMTLOSSGW-UHFFFAOYSA-N methyl 2-[(2-cyanopyridin-4-yl)methylamino]pyridine-3-carboxylate Chemical compound COC(=O)C1=CC=CN=C1NCC1=CC=NC(C#N)=C1 QJLHLTMTLOSSGW-UHFFFAOYSA-N 0.000 description 3
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 3
- 239000007800 oxidant agent Substances 0.000 description 3
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 3
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 3
- 239000002798 polar solvent Substances 0.000 description 3
- 239000012286 potassium permanganate Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 150000003462 sulfoxides Chemical class 0.000 description 3
- XTHPWXDJESJLNJ-UHFFFAOYSA-N sulfurochloridic acid Chemical class OS(Cl)(=O)=O XTHPWXDJESJLNJ-UHFFFAOYSA-N 0.000 description 3
- CFTCZCNBBMZUQF-UHFFFAOYSA-N tert-butyl n-[[2-(2-hydroxypropylcarbamoyl)pyridin-4-yl]methyl]carbamate Chemical compound CC(O)CNC(=O)C1=CC(CNC(=O)OC(C)(C)C)=CC=N1 CFTCZCNBBMZUQF-UHFFFAOYSA-N 0.000 description 3
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 3
- 238000003828 vacuum filtration Methods 0.000 description 3
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 2
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- WZUODJNEIXSNEU-UHFFFAOYSA-N 2-Hydroxy-4-methoxybenzaldehyde Chemical compound COC1=CC=C(C=O)C(O)=C1 WZUODJNEIXSNEU-UHFFFAOYSA-N 0.000 description 2
- OSCSTFAICYKXCV-UHFFFAOYSA-N 2-[(2-bromopyridin-4-yl)methylamino]-n-(2-methylindazol-6-yl)benzamide Chemical compound C=1C2=NN(C)C=C2C=CC=1NC(=O)C1=CC=CC=C1NCC1=CC=NC(Br)=C1 OSCSTFAICYKXCV-UHFFFAOYSA-N 0.000 description 2
- QQXNKEAUFHNFIX-UHFFFAOYSA-N 2-[(2-cyanopyridin-4-yl)methylamino]-n-(7-methoxy-3-methylquinolin-2-yl)benzamide Chemical compound N=1C2=CC(OC)=CC=C2C=C(C)C=1NC(=O)C1=CC=CC=C1NCC1=CC=NC(C#N)=C1 QQXNKEAUFHNFIX-UHFFFAOYSA-N 0.000 description 2
- RISJVVNYVPITNN-UHFFFAOYSA-N 2-[(2-cyanopyridin-4-yl)methylamino]-n-isoquinolin-3-ylbenzamide Chemical compound C=1C2=CC=CC=C2C=NC=1NC(=O)C1=CC=CC=C1NCC1=CC=NC(C#N)=C1 RISJVVNYVPITNN-UHFFFAOYSA-N 0.000 description 2
- IKEULLMSDKJYPP-UHFFFAOYSA-N 2-[(2-cyanopyridin-4-yl)methylamino]-n-isoquinolin-3-ylpyridine-3-carboxamide Chemical compound C=1C2=CC=CC=C2C=NC=1NC(=O)C1=CC=CN=C1NCC1=CC=NC(C#N)=C1 IKEULLMSDKJYPP-UHFFFAOYSA-N 0.000 description 2
- RAKIUTFZQGIDOB-UHFFFAOYSA-N 2-amino-n-isoquinolin-3-ylbenzamide Chemical compound NC1=CC=CC=C1C(=O)NC1=CC2=CC=CC=C2C=N1 RAKIUTFZQGIDOB-UHFFFAOYSA-N 0.000 description 2
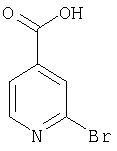
- YBTKGKVQEXAYEM-UHFFFAOYSA-N 2-bromopyridine-4-carboxylic acid Chemical compound OC(=O)C1=CC=NC(Br)=C1 YBTKGKVQEXAYEM-UHFFFAOYSA-N 0.000 description 2
- BWWHTIHDQBHTHP-UHFFFAOYSA-N 2-nitrobenzoyl chloride Chemical compound [O-][N+](=O)C1=CC=CC=C1C(Cl)=O BWWHTIHDQBHTHP-UHFFFAOYSA-N 0.000 description 2
- CUYKNJBYIJFRCU-UHFFFAOYSA-N 3-aminopyridine Chemical compound NC1=CC=CN=C1 CUYKNJBYIJFRCU-UHFFFAOYSA-N 0.000 description 2
- NOBDKWLIAQKADB-UHFFFAOYSA-N 3-bromopyridine-4-carbaldehyde Chemical compound BrC1=CN=CC=C1C=O NOBDKWLIAQKADB-UHFFFAOYSA-N 0.000 description 2
- GRZDSPFFPDFKFS-UHFFFAOYSA-N 4-[[2-(isoquinolin-3-ylcarbamoyl)anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=NC(C(=O)O)=CC(CNC=2C(=CC=CC=2)C(=O)NC=2N=CC3=CC=CC=C3C=2)=C1 GRZDSPFFPDFKFS-UHFFFAOYSA-N 0.000 description 2
- JZYICEHJSWQJNJ-UHFFFAOYSA-N 4-[[2-[(2-oxo-1,3-dihydroindol-5-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=NC(C(=O)O)=CC(CNC=2C(=CC=CC=2)C(=O)NC=2C=C3CC(=O)NC3=CC=2)=C1 JZYICEHJSWQJNJ-UHFFFAOYSA-N 0.000 description 2
- WDKCMIRQZVIWRI-UHFFFAOYSA-N 4-[[2-[(2-oxo-1,3-dihydroindol-6-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=NC(C(=O)O)=CC(CNC=2C(=CC=CC=2)C(=O)NC=2C=C3NC(=O)CC3=CC=2)=C1 WDKCMIRQZVIWRI-UHFFFAOYSA-N 0.000 description 2
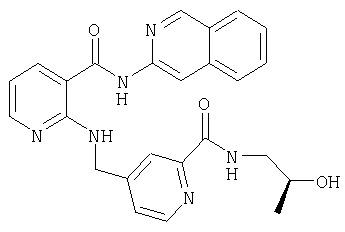
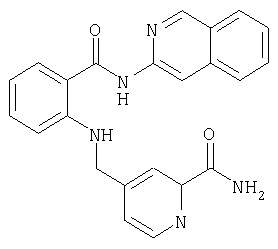
- QNPLNVROXNLQAU-UHFFFAOYSA-N 5-[[2-(isoquinolin-3-ylcarbamoyl)anilino]methyl]pyridine-2-carboxamide Chemical compound C1=NC(C(=O)N)=CC=C1CNC1=CC=CC=C1C(=O)NC1=CC2=CC=CC=C2C=N1 QNPLNVROXNLQAU-UHFFFAOYSA-N 0.000 description 2
- QDAZVRQTOOCZEW-UHFFFAOYSA-N 5-[[2-[(2-oxo-1,3-dihydroindol-5-yl)carbamoyl]anilino]methyl]pyridine-2-carboxamide Chemical compound C1=NC(C(=O)N)=CC=C1CNC1=CC=CC=C1C(=O)NC1=CC=C(NC(=O)C2)C2=C1 QDAZVRQTOOCZEW-UHFFFAOYSA-N 0.000 description 2
- KXNKLKRZKXQNNF-UHFFFAOYSA-N 5-[[2-[(2-oxo-1,3-dihydroindol-6-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=NC(C(=O)O)=CC=C1CNC1=CC=CC=C1C(=O)NC1=CC=C(CC(=O)N2)C2=C1 KXNKLKRZKXQNNF-UHFFFAOYSA-N 0.000 description 2
- VVKQSAFJJJEDHM-UHFFFAOYSA-N 5-[[2-[(7-methoxy-3-methylquinolin-2-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound N=1C2=CC(OC)=CC=C2C=C(C)C=1NC(=O)C1=CC=CC=C1NCC1=CC=C(C(O)=O)N=C1 VVKQSAFJJJEDHM-UHFFFAOYSA-N 0.000 description 2
- OCOCBVKMMMIDLI-UHFFFAOYSA-N 6-amino-1,3-dihydroindol-2-one Chemical compound NC1=CC=C2CC(=O)NC2=C1 OCOCBVKMMMIDLI-UHFFFAOYSA-N 0.000 description 2
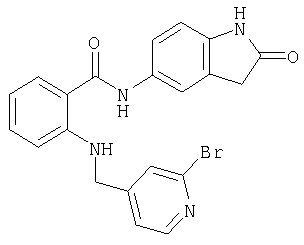
- PVUKGNBRJFTFNJ-UHFFFAOYSA-N 6-bromopyridine-3-carbaldehyde Chemical compound BrC1=CC=C(C=O)C=N1 PVUKGNBRJFTFNJ-UHFFFAOYSA-N 0.000 description 2
- WYCVARGVMCGNMC-UHFFFAOYSA-N 6-nitro-1,3-dihydroindol-2-one Chemical compound [O-][N+](=O)C1=CC=C2CC(=O)NC2=C1 WYCVARGVMCGNMC-UHFFFAOYSA-N 0.000 description 2
- 206010003445 Ascites Diseases 0.000 description 2
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 description 2
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- 206010030113 Oedema Diseases 0.000 description 2
- 206010038563 Reocclusion Diseases 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 2
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 125000003545 alkoxy group Chemical group 0.000 description 2
- 150000001350 alkyl halides Chemical class 0.000 description 2
- 150000001351 alkyl iodides Chemical class 0.000 description 2
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 2
- 150000008052 alkyl sulfonates Chemical class 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- HVLDUPWEZFVUJB-UHFFFAOYSA-N benzyl 4-[[2-(isoquinolin-3-ylcarbamoyl)anilino]methyl]pyridine-2-carboxylate Chemical compound C1=NC(=CC2=CC=CC=C12)NC(C1=C(C=CC=C1)NCC1=CC(=NC=C1)C(=O)OCC1=CC=CC=C1)=O HVLDUPWEZFVUJB-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- GPAYUJZHTULNBE-UHFFFAOYSA-N diphenylphosphine Chemical compound C=1C=CC=CC=1PC1=CC=CC=C1 GPAYUJZHTULNBE-UHFFFAOYSA-N 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 239000008298 dragée Substances 0.000 description 2
- YFXCNIVBAVFOBX-UHFFFAOYSA-N ethenylboronic acid Chemical class OB(O)C=C YFXCNIVBAVFOBX-UHFFFAOYSA-N 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- KTWOOEGAPBSYNW-UHFFFAOYSA-N ferrocene Chemical compound [Fe+2].C=1C=C[CH-]C=1.C=1C=C[CH-]C=1 KTWOOEGAPBSYNW-UHFFFAOYSA-N 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- WQYVRQLZKVEZGA-UHFFFAOYSA-N hypochlorite Chemical compound Cl[O-] WQYVRQLZKVEZGA-UHFFFAOYSA-N 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 239000013067 intermediate product Substances 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 2
- HTANURMJHZJJSO-UHFFFAOYSA-N methyl 2-(2,4-dinitrophenyl)acetate Chemical compound COC(=O)CC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O HTANURMJHZJJSO-UHFFFAOYSA-N 0.000 description 2
- VAMXMNNIEUEQDV-UHFFFAOYSA-N methyl anthranilate Chemical compound COC(=O)C1=CC=CC=C1N VAMXMNNIEUEQDV-UHFFFAOYSA-N 0.000 description 2
- LCEDQNDDFOCWGG-UHFFFAOYSA-N morpholine-4-carbaldehyde Chemical compound O=CN1CCOCC1 LCEDQNDDFOCWGG-UHFFFAOYSA-N 0.000 description 2
- GBLPFRZXYUVPPX-UHFFFAOYSA-N n-(7-methoxy-2-oxochromen-3-yl)-2-nitrobenzamide Chemical compound O=C1OC2=CC(OC)=CC=C2C=C1NC(=O)C1=CC=CC=C1[N+]([O-])=O GBLPFRZXYUVPPX-UHFFFAOYSA-N 0.000 description 2
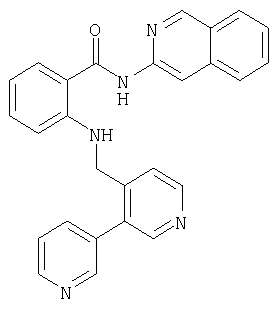
- CABBUUSMSNUGDL-UHFFFAOYSA-N n-isoquinolin-3-yl-2-[(3-pyridin-3-ylpyridin-4-yl)methylamino]benzamide Chemical compound C=1C2=CC=CC=C2C=NC=1NC(=O)C1=CC=CC=C1NCC1=CC=NC=C1C1=CC=CN=C1 CABBUUSMSNUGDL-UHFFFAOYSA-N 0.000 description 2
- AOBONTSDRGSRPD-UHFFFAOYSA-N n-isoquinolin-3-yl-2-[(3-thiophen-3-ylpyridin-4-yl)methylamino]benzamide Chemical compound C=1C2=CC=CC=C2C=NC=1NC(=O)C1=CC=CC=C1NCC1=CC=NC=C1C=1C=CSC=1 AOBONTSDRGSRPD-UHFFFAOYSA-N 0.000 description 2
- 150000002825 nitriles Chemical class 0.000 description 2
- 150000007530 organic bases Chemical class 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- WGYKZJWCGVVSQN-UHFFFAOYSA-N propylamine Chemical compound CCCN WGYKZJWCGVVSQN-UHFFFAOYSA-N 0.000 description 2
- FSYKKLYZXJSNPZ-UHFFFAOYSA-N sarcosine Chemical compound C[NH2+]CC([O-])=O FSYKKLYZXJSNPZ-UHFFFAOYSA-N 0.000 description 2
- 239000012047 saturated solution Substances 0.000 description 2
- 230000037390 scarring Effects 0.000 description 2
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 2
- 229910052938 sodium sulfate Inorganic materials 0.000 description 2
- 235000011152 sodium sulphate Nutrition 0.000 description 2
- 238000000967 suction filtration Methods 0.000 description 2
- 150000003457 sulfones Chemical class 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- 150000003567 thiocyanates Chemical class 0.000 description 2
- 150000003568 thioethers Chemical class 0.000 description 2
- LEIMLDGFXIOXMT-UHFFFAOYSA-N trimethylsilyl cyanide Chemical compound C[Si](C)(C)C#N LEIMLDGFXIOXMT-UHFFFAOYSA-N 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- 230000008728 vascular permeability Effects 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- GTLDTDOJJJZVBW-UHFFFAOYSA-N zinc cyanide Chemical compound [Zn+2].N#[C-].N#[C-] GTLDTDOJJJZVBW-UHFFFAOYSA-N 0.000 description 2
- OFASYGONGSPXPQ-UHFFFAOYSA-N (2-methylpropan-2-yl)oxy hypochlorite Chemical compound CC(C)(C)OOCl OFASYGONGSPXPQ-UHFFFAOYSA-N 0.000 description 1
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- CUGDYSSBTWBKII-LXGUWJNJSA-N (2r,3r,4r,5s)-6-(dimethylamino)hexane-1,2,3,4,5-pentol Chemical compound CN(C)C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO CUGDYSSBTWBKII-LXGUWJNJSA-N 0.000 description 1
- IKXCHOUDIPZROZ-LXGUWJNJSA-N (2r,3r,4r,5s)-6-(ethylamino)hexane-1,2,3,4,5-pentol Chemical compound CCNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO IKXCHOUDIPZROZ-LXGUWJNJSA-N 0.000 description 1
- HXKKHQJGJAFBHI-VKHMYHEASA-N (2s)-1-aminopropan-2-ol Chemical compound C[C@H](O)CN HXKKHQJGJAFBHI-VKHMYHEASA-N 0.000 description 1
- 125000006710 (C2-C12) alkenyl group Chemical group 0.000 description 1
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 description 1
- CRPTXKKKIGGDBX-UHFFFAOYSA-N (z)-but-2-ene Chemical group [CH2]C=CC CRPTXKKKIGGDBX-UHFFFAOYSA-N 0.000 description 1
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- HXKKHQJGJAFBHI-UHFFFAOYSA-N 1-aminopropan-2-ol Chemical compound CC(O)CN HXKKHQJGJAFBHI-UHFFFAOYSA-N 0.000 description 1
- ZGCHLAJIRWDGFE-UHFFFAOYSA-N 1-aminopropane-1,1-diol Chemical compound CCC(N)(O)O ZGCHLAJIRWDGFE-UHFFFAOYSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- ZYBZYDVRLQSWGG-UHFFFAOYSA-N 2,2-dimethyloct-7-enoic acid Chemical compound OC(=O)C(C)(C)CCCCC=C ZYBZYDVRLQSWGG-UHFFFAOYSA-N 0.000 description 1
- KCNISYPADDTFDO-UHFFFAOYSA-N 2,4-dinitrophenylacetic acid Chemical compound OC(=O)CC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O KCNISYPADDTFDO-UHFFFAOYSA-N 0.000 description 1
- PXBFMLJZNCDSMP-UHFFFAOYSA-N 2-Aminobenzamide Chemical class NC(=O)C1=CC=CC=C1N PXBFMLJZNCDSMP-UHFFFAOYSA-N 0.000 description 1
- YFTBCWMMWHINDF-UHFFFAOYSA-N 2-[(2-bromopyridin-4-yl)methylamino]-n-(1h-indazol-5-yl)benzamide Chemical compound C1=NC(Br)=CC(CNC=2C(=CC=CC=2)C(=O)NC=2C=C3C=NNC3=CC=2)=C1 YFTBCWMMWHINDF-UHFFFAOYSA-N 0.000 description 1
- CZOLDQLIAKPLNN-UHFFFAOYSA-N 2-[(2-bromopyridin-4-yl)methylamino]-n-[3-(trifluoromethyl)phenyl]benzamide Chemical compound FC(F)(F)C1=CC=CC(NC(=O)C=2C(=CC=CC=2)NCC=2C=C(Br)N=CC=2)=C1 CZOLDQLIAKPLNN-UHFFFAOYSA-N 0.000 description 1
- KPSQEMJSAOWXGW-UHFFFAOYSA-N 2-[(2-bromopyridin-4-yl)methylamino]-n-isoquinolin-3-ylbenzamide Chemical compound C1=NC(Br)=CC(CNC=2C(=CC=CC=2)C(=O)NC=2N=CC3=CC=CC=C3C=2)=C1 KPSQEMJSAOWXGW-UHFFFAOYSA-N 0.000 description 1
- RZGYHFZTRXJGPY-UHFFFAOYSA-N 2-[(2-cyanopyridin-3-yl)methylamino]-n-isoquinolin-3-ylpyridine-3-carboxamide Chemical compound C=1C2=CC=CC=C2C=NC=1NC(=O)C1=CC=CN=C1NCC1=CC=CN=C1C#N RZGYHFZTRXJGPY-UHFFFAOYSA-N 0.000 description 1
- LSLLZZGSRBIVLL-UHFFFAOYSA-N 2-[(6-cyanopyridin-3-yl)methylamino]-n-isoquinolin-3-ylpyridine-3-carboxamide Chemical compound C=1C2=CC=CC=C2C=NC=1NC(=O)C1=CC=CN=C1NCC1=CC=C(C#N)N=C1 LSLLZZGSRBIVLL-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 1
- CKNGDBNIVUIJSL-UHFFFAOYSA-N 2-amino-n-(2-oxoindol-5-yl)benzamide Chemical compound NC1=CC=CC=C1C(=O)NC1=CC2=CC(=O)N=C2C=C1 CKNGDBNIVUIJSL-UHFFFAOYSA-N 0.000 description 1
- OOSDJJXZFYBLNM-UHFFFAOYSA-N 2-amino-n-(2-oxoindol-6-yl)benzamide Chemical compound NC1=CC=CC=C1C(=O)NC1=CC2=NC(=O)C=C2C=C1 OOSDJJXZFYBLNM-UHFFFAOYSA-N 0.000 description 1
- HMPCPXVHEFSMPU-UHFFFAOYSA-N 2-aminobenzamide;pyridine-2-carboxamide Chemical class NC(=O)C1=CC=CC=N1.NC(=O)C1=CC=CC=C1N HMPCPXVHEFSMPU-UHFFFAOYSA-N 0.000 description 1
- LSZMVESSGLHDJE-UHFFFAOYSA-N 2-bromo-4-methylpyridine Chemical compound CC1=CC=NC(Br)=C1 LSZMVESSGLHDJE-UHFFFAOYSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- RXTRRIFWCJEMEL-UHFFFAOYSA-N 2-chloropyridine-3-carbonyl chloride Chemical compound ClC(=O)C1=CC=CN=C1Cl RXTRRIFWCJEMEL-UHFFFAOYSA-N 0.000 description 1
- IBRSSZOHCGUTHI-UHFFFAOYSA-N 2-chloropyridine-3-carboxylic acid Chemical compound OC(=O)C1=CC=CN=C1Cl IBRSSZOHCGUTHI-UHFFFAOYSA-N 0.000 description 1
- MHCWLERQNFATHZ-UHFFFAOYSA-N 2-methylindazol-6-amine Chemical compound C1=CC(N)=CC2=NN(C)C=C21 MHCWLERQNFATHZ-UHFFFAOYSA-N 0.000 description 1
- YOETUEMZNOLGDB-UHFFFAOYSA-N 2-methylpropyl carbonochloridate Chemical compound CC(C)COC(Cl)=O YOETUEMZNOLGDB-UHFFFAOYSA-N 0.000 description 1
- KSYBRTXOXKWUIR-UHFFFAOYSA-N 2-nitrobutanoic acid Chemical compound CCC(C(O)=O)[N+]([O-])=O KSYBRTXOXKWUIR-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- JMTMSDXUXJISAY-UHFFFAOYSA-N 2H-benzotriazol-4-ol Chemical compound OC1=CC=CC2=C1N=NN2 JMTMSDXUXJISAY-UHFFFAOYSA-N 0.000 description 1
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 1
- IUFOZBQMZPRDSW-UHFFFAOYSA-N 4-(aminomethyl)pyridine-2-carboxylic acid Chemical compound NCC1=CC=NC(C(O)=O)=C1 IUFOZBQMZPRDSW-UHFFFAOYSA-N 0.000 description 1
- BHZXYQSTHREJOC-UHFFFAOYSA-N 4-[[2-(1h-indazol-5-ylcarbamoyl)anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=NC(C(=O)O)=CC(CNC=2C(=CC=CC=2)C(=O)NC=2C=C3C=NNC3=CC=2)=C1 BHZXYQSTHREJOC-UHFFFAOYSA-N 0.000 description 1
- AEXJHQZIAWWIRA-UHFFFAOYSA-N 4-[[2-(1h-indazol-6-ylcarbamoyl)anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=NC(C(=O)O)=CC(CNC=2C(=CC=CC=2)C(=O)NC=2C=C3NN=CC3=CC=2)=C1 AEXJHQZIAWWIRA-UHFFFAOYSA-N 0.000 description 1
- KSUVAIBWQQRJHK-UHFFFAOYSA-N 4-[[2-(isoquinolin-3-ylcarbamoyl)anilino]methyl]pyridine-2-carboxamide Chemical compound C1=NC(C(=O)N)=CC(CNC=2C(=CC=CC=2)C(=O)NC=2N=CC3=CC=CC=C3C=2)=C1 KSUVAIBWQQRJHK-UHFFFAOYSA-N 0.000 description 1
- NWUIQHHMNFQTKZ-UHFFFAOYSA-N 4-[[2-[(1-methylindazol-6-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=C2N(C)N=CC2=CC=C1NC(=O)C1=CC=CC=C1NCC1=CC=NC(C(O)=O)=C1 NWUIQHHMNFQTKZ-UHFFFAOYSA-N 0.000 description 1
- VNZMYLMUJVNDAQ-UHFFFAOYSA-N 4-[[2-[(2-methylindazol-6-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound C=1C2=NN(C)C=C2C=CC=1NC(=O)C1=CC=CC=C1NCC1=CC=NC(C(O)=O)=C1 VNZMYLMUJVNDAQ-UHFFFAOYSA-N 0.000 description 1
- VKTMGZHDQKVTTQ-UHFFFAOYSA-N 4-[[2-[(7-methoxy-2-oxochromen-3-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound O=C1OC2=CC(OC)=CC=C2C=C1NC(=O)C1=CC=CC=C1NCC1=CC=NC(C(O)=O)=C1 VKTMGZHDQKVTTQ-UHFFFAOYSA-N 0.000 description 1
- KBZXPQMOFVISEC-UHFFFAOYSA-N 4-[[2-[(7-methoxy-3-methylquinolin-2-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound N=1C2=CC(OC)=CC=C2C=C(C)C=1NC(=O)C1=CC=CC=C1NCC1=CC=NC(C(O)=O)=C1 KBZXPQMOFVISEC-UHFFFAOYSA-N 0.000 description 1
- QSZMMOPFJOOYRX-UHFFFAOYSA-N 4-[[2-[[3-(trifluoromethyl)phenyl]carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=NC(C(=O)O)=CC(CNC=2C(=CC=CC=2)C(=O)NC=2C=C(C=CC=2)C(F)(F)F)=C1 QSZMMOPFJOOYRX-UHFFFAOYSA-N 0.000 description 1
- WIFPJDJJFUSIFP-UHFFFAOYSA-N 4-aminobutane-1,2,3-triol Chemical compound NCC(O)C(O)CO WIFPJDJJFUSIFP-UHFFFAOYSA-N 0.000 description 1
- ZUHFXWNBESIGKU-UHFFFAOYSA-N 5-[[2-[(1-methylindazol-6-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=C2N(C)N=CC2=CC=C1NC(=O)C1=CC=CC=C1NCC1=CC=C(C(O)=O)N=C1 ZUHFXWNBESIGKU-UHFFFAOYSA-N 0.000 description 1
- LVLOUVGRTKZVNW-UHFFFAOYSA-N 5-[[2-[(2-methylindazol-6-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound C=1C2=NN(C)C=C2C=CC=1NC(=O)C1=CC=CC=C1NCC1=CC=C(C(O)=O)N=C1 LVLOUVGRTKZVNW-UHFFFAOYSA-N 0.000 description 1
- BOODHVNMGNKBAO-UHFFFAOYSA-N 5-[[2-[(2-oxo-1,3-dihydroindol-5-yl)carbamoyl]anilino]methyl]pyridine-2-carboxylic acid Chemical compound C1=NC(C(=O)O)=CC=C1CNC1=CC=CC=C1C(=O)NC1=CC=C(NC(=O)C2)C2=C1 BOODHVNMGNKBAO-UHFFFAOYSA-N 0.000 description 1
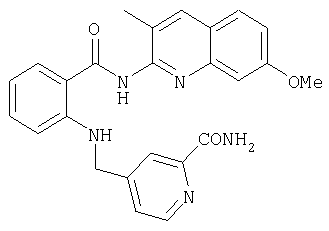
- WBLHMNLNMGJYDE-UHFFFAOYSA-N 7-methoxy-3-methylquinolin-2-amine Chemical compound C1=C(C)C(N)=NC2=CC(OC)=CC=C21 WBLHMNLNMGJYDE-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- KESKVVPNMUCTAJ-UHFFFAOYSA-N COc(cc1)cc(OC2=O)c1C=C2NC(c(cccc1)c1NCc(cc1)cnc1C#N)=O Chemical compound COc(cc1)cc(OC2=O)c1C=C2NC(c(cccc1)c1NCc(cc1)cnc1C#N)=O KESKVVPNMUCTAJ-UHFFFAOYSA-N 0.000 description 1
- HJLPKSBZERKXAE-UHFFFAOYSA-N C[n](c1c2)ncc1ccc2NC(c(cccc1)c1NCc1cc(C(N)=O)ncc1)=O Chemical compound C[n](c1c2)ncc1ccc2NC(c(cccc1)c1NCc1cc(C(N)=O)ncc1)=O HJLPKSBZERKXAE-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 102000008144 Cytochrome P-450 CYP1A2 Human genes 0.000 description 1
- 108010074922 Cytochrome P-450 CYP1A2 Proteins 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- SNRUBQQJIBEYMU-UHFFFAOYSA-N Dodecane Natural products CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 238000007341 Heck reaction Methods 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 229910010082 LiAlH Inorganic materials 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 229910021380 Manganese Chloride Inorganic materials 0.000 description 1
- GLFNIEUTAYBVOC-UHFFFAOYSA-L Manganese chloride Chemical compound Cl[Mn]Cl GLFNIEUTAYBVOC-UHFFFAOYSA-L 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- BVAMFJKHQJHVGD-UHFFFAOYSA-N NC1=CC=CC(C(N(C2=CC3=CC=CC=C3C=N2)O)=O)=C1CC1=CC=NC=C1 Chemical compound NC1=CC=CC(C(N(C2=CC3=CC=CC=C3C=N2)O)=O)=C1CC1=CC=NC=C1 BVAMFJKHQJHVGD-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- OCAJNLYUYALWHU-UHFFFAOYSA-N O=C(c(cccc1)c1NCc1ccc(C(Nc2cccnc2)=O)nc1)Nc1cc(cccc2)c2cn1 Chemical compound O=C(c(cccc1)c1NCc1ccc(C(Nc2cccnc2)=O)nc1)Nc1cc(cccc2)c2cn1 OCAJNLYUYALWHU-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000034038 Pathologic Neovascularization Diseases 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 108010077895 Sarcosine Proteins 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 239000005708 Sodium hypochlorite Substances 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 238000006619 Stille reaction Methods 0.000 description 1
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-M Thiocyanate anion Chemical compound [S-]C#N ZMZDMBWJUHKJPS-UHFFFAOYSA-M 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- UZUJTDNAOMFXKY-UHFFFAOYSA-H [dimethylamino(triazolo[4,5-b]pyridin-3-yloxy)methylidene]-dimethylazanium hexafluoride Chemical compound [F-].[F-].[F-].[F-].[F-].[F-].N1(N=NC2=C1N=CC=C2)OC(=[N+](C)C)N(C)C.N2(N=NC1=C2N=CC=C1)OC(=[N+](C)C)N(C)C.N1(N=NC2=C1N=CC=C2)OC(=[N+](C)C)N(C)C.N2(N=NC1=C2N=CC=C1)OC(=[N+](C)C)N(C)C.N1(N=NC2=C1N=CC=C2)OC(=[N+](C)C)N(C)C.N2(N=NC1=C2N=CC=C1)OC(=[N+](C)C)N(C)C UZUJTDNAOMFXKY-UHFFFAOYSA-H 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 150000008065 acid anhydrides Chemical class 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 150000001336 alkenes Chemical group 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 150000001345 alkine derivatives Chemical class 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 238000010640 amide synthesis reaction Methods 0.000 description 1
- 210000003050 axon Anatomy 0.000 description 1
- 150000001540 azides Chemical class 0.000 description 1
- 125000004931 azocinyl group Chemical group N1=C(C=CC=CC=C1)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- 239000003613 bile acid Substances 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 238000006664 bond formation reaction Methods 0.000 description 1
- ODWXUNBKCRECNW-UHFFFAOYSA-M bromocopper(1+) Chemical compound Br[Cu+] ODWXUNBKCRECNW-UHFFFAOYSA-M 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 125000005510 but-1-en-2-yl group Chemical group 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- CREMABGTGYGIQB-UHFFFAOYSA-N carbon carbon Chemical compound C.C CREMABGTGYGIQB-UHFFFAOYSA-N 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- XMPZTFVPEKAKFH-UHFFFAOYSA-P ceric ammonium nitrate Chemical compound [NH4+].[NH4+].[Ce+4].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O XMPZTFVPEKAKFH-UHFFFAOYSA-P 0.000 description 1
- FZFAMSAMCHXGEF-UHFFFAOYSA-N chloro formate Chemical compound ClOC=O FZFAMSAMCHXGEF-UHFFFAOYSA-N 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- ORTQZVOHEJQUHG-UHFFFAOYSA-L copper(II) chloride Chemical compound Cl[Cu]Cl ORTQZVOHEJQUHG-UHFFFAOYSA-L 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000006880 cross-coupling reaction Methods 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000004090 cyclononenyl group Chemical group C1(=CCCCCCCC1)* 0.000 description 1
- 125000006547 cyclononyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- BGRWYRAHAFMIBJ-UHFFFAOYSA-N diisopropylcarbodiimide Natural products CC(C)NC(=O)NC(C)C BGRWYRAHAFMIBJ-UHFFFAOYSA-N 0.000 description 1
- FFHWGQQFANVOHV-UHFFFAOYSA-N dimethyldioxirane Chemical compound CC1(C)OO1 FFHWGQQFANVOHV-UHFFFAOYSA-N 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 229960001484 edetic acid Drugs 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 210000004696 endometrium Anatomy 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 229940031098 ethanolamine Drugs 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- WBJINCZRORDGAQ-UHFFFAOYSA-N formic acid ethyl ester Natural products CCOC=O WBJINCZRORDGAQ-UHFFFAOYSA-N 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 229960002442 glucosamine Drugs 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 208000000509 infertility Diseases 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 231100000535 infertility Toxicity 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- UBJFKNSINUCEAL-UHFFFAOYSA-N lithium;2-methylpropane Chemical compound [Li+].C[C-](C)C UBJFKNSINUCEAL-UHFFFAOYSA-N 0.000 description 1
- WGOPGODQLGJZGL-UHFFFAOYSA-N lithium;butane Chemical compound [Li+].CC[CH-]C WGOPGODQLGJZGL-UHFFFAOYSA-N 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- FRIJBUGBVQZNTB-UHFFFAOYSA-M magnesium;ethane;bromide Chemical compound [Mg+2].[Br-].[CH2-]C FRIJBUGBVQZNTB-UHFFFAOYSA-M 0.000 description 1
- 239000011565 manganese chloride Substances 0.000 description 1
- 235000002867 manganese chloride Nutrition 0.000 description 1
- 229940099607 manganese chloride Drugs 0.000 description 1
- NUJOXMJBOLGQSY-UHFFFAOYSA-N manganese dioxide Inorganic materials O=[Mn]=O NUJOXMJBOLGQSY-UHFFFAOYSA-N 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 238000006263 metalation reaction Methods 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 1
- HPIAPTPBJJTJJG-UHFFFAOYSA-N methyl 2,2-dinitro-2-phenylacetate Chemical compound COC(=O)C([N+]([O-])=O)([N+]([O-])=O)C1=CC=CC=C1 HPIAPTPBJJTJJG-UHFFFAOYSA-N 0.000 description 1
- YRLBSRJCKUXAHK-UHFFFAOYSA-N methyl 2-(pyridin-3-ylmethylamino)pyridine-3-carboxylate Chemical compound COC(=O)C1=CC=CN=C1NCC1=CC=CN=C1 YRLBSRJCKUXAHK-UHFFFAOYSA-N 0.000 description 1
- KOHRQQUUYPVTMI-UHFFFAOYSA-N methyl 2-[(2-cyanopyridin-3-yl)methylamino]pyridine-3-carboxylate Chemical compound COC(=O)C1=CC=CN=C1NCC1=CC=CN=C1C#N KOHRQQUUYPVTMI-UHFFFAOYSA-N 0.000 description 1
- MMRQPDXZCKOBRB-UHFFFAOYSA-N methyl 2-[(6-cyanopyridin-3-yl)methylamino]pyridine-3-carboxylate Chemical compound COC(=O)C1=CC=CN=C1NCC1=CC=C(C#N)N=C1 MMRQPDXZCKOBRB-UHFFFAOYSA-N 0.000 description 1
- UIHNMNIIIMELDJ-UHFFFAOYSA-N methyl 2-[[2-(tert-butylcarbamoyl)pyridin-4-yl]methylamino]pyridine-3-carboxylate Chemical compound COC(=O)C1=CC=CN=C1NCC1=CC=NC(C(=O)NC(C)(C)C)=C1 UIHNMNIIIMELDJ-UHFFFAOYSA-N 0.000 description 1
- IDDZUMXKCUWECH-UHFFFAOYSA-N methyl 4-[2-(isoquinolin-3-ylcarbamoyl)-n-methylanilino]pyridine-2-carboxylate Chemical compound C1=NC(C(=O)OC)=CC(N(C)C=2C(=CC=CC=2)C(=O)NC=2N=CC3=CC=CC=C3C=2)=C1 IDDZUMXKCUWECH-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- DVSDBMFJEQPWNO-UHFFFAOYSA-N methyllithium Chemical compound C[Li] DVSDBMFJEQPWNO-UHFFFAOYSA-N 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 125000000896 monocarboxylic acid group Chemical group 0.000 description 1
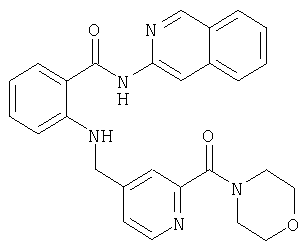
- GFHUPLRXSDERGZ-UHFFFAOYSA-N n-isoquinolin-3-yl-2-[[2-(morpholine-4-carbonyl)pyridin-4-yl]methylamino]benzamide Chemical compound C=1C2=CC=CC=C2C=NC=1NC(=O)C1=CC=CC=C1NCC(C=1)=CC=NC=1C(=O)N1CCOCC1 GFHUPLRXSDERGZ-UHFFFAOYSA-N 0.000 description 1
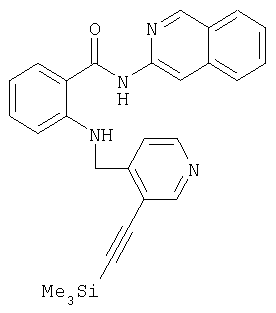
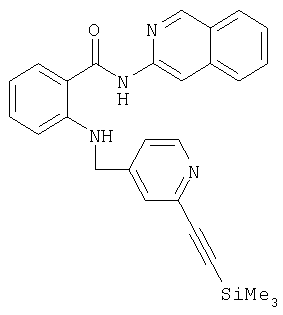
- TZCSSTGYJJEENB-UHFFFAOYSA-N n-isoquinolin-3-yl-2-[[3-(2-trimethylsilylethynyl)pyridin-4-yl]methylamino]benzamide Chemical compound C[Si](C)(C)C#CC1=CN=CC=C1CNC1=CC=CC=C1C(=O)NC1=CC2=CC=CC=C2C=N1 TZCSSTGYJJEENB-UHFFFAOYSA-N 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 210000000118 neural pathway Anatomy 0.000 description 1
- 230000010004 neural pathway Effects 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 125000002560 nitrile group Chemical group 0.000 description 1
- 150000002828 nitro derivatives Chemical class 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000003585 oxepinyl group Chemical group 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 1
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- AQSJGOWTSHOLKH-UHFFFAOYSA-N phosphite(3-) Chemical class [O-]P([O-])[O-] AQSJGOWTSHOLKH-UHFFFAOYSA-N 0.000 description 1
- 229940080469 phosphocellulose Drugs 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- CYQAYERJWZKYML-UHFFFAOYSA-N phosphorus pentasulfide Chemical compound S1P(S2)(=S)SP3(=S)SP1(=S)SP2(=S)S3 CYQAYERJWZKYML-UHFFFAOYSA-N 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- 239000003880 polar aprotic solvent Substances 0.000 description 1
- 229920001515 polyalkylene glycol Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- NTTOTNSKUYCDAV-UHFFFAOYSA-N potassium hydride Chemical compound [KH] NTTOTNSKUYCDAV-UHFFFAOYSA-N 0.000 description 1
- 229910000105 potassium hydride Inorganic materials 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- ZNNZYHKDIALBAK-UHFFFAOYSA-M potassium thiocyanate Chemical compound [K+].[S-]C#N ZNNZYHKDIALBAK-UHFFFAOYSA-M 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 239000003586 protic polar solvent Substances 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- UBQKCCHYAOITMY-UHFFFAOYSA-N pyridin-2-ol Chemical class OC1=CC=CC=N1 UBQKCCHYAOITMY-UHFFFAOYSA-N 0.000 description 1
- ABMYEXAYWZJVOV-UHFFFAOYSA-N pyridin-3-ylboronic acid Chemical compound OB(O)C1=CC=CN=C1 ABMYEXAYWZJVOV-UHFFFAOYSA-N 0.000 description 1
- TXQWFIVRZNOPCK-UHFFFAOYSA-N pyridin-4-ylmethanamine Chemical compound NCC1=CC=NC=C1 TXQWFIVRZNOPCK-UHFFFAOYSA-N 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 239000010948 rhodium Substances 0.000 description 1
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 229940043230 sarcosine Drugs 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 229960001153 serine Drugs 0.000 description 1
- WRIKHQLVHPKCJU-UHFFFAOYSA-N sodium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([Na])[Si](C)(C)C WRIKHQLVHPKCJU-UHFFFAOYSA-N 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- UKLNMMHNWFDKNT-UHFFFAOYSA-M sodium chlorite Chemical compound [Na+].[O-]Cl=O UKLNMMHNWFDKNT-UHFFFAOYSA-M 0.000 description 1
- 229960002218 sodium chlorite Drugs 0.000 description 1
- SUKJFIGYRHOWBL-UHFFFAOYSA-N sodium hypochlorite Chemical compound [Na+].Cl[O-] SUKJFIGYRHOWBL-UHFFFAOYSA-N 0.000 description 1
- CMZUMMUJMWNLFH-UHFFFAOYSA-N sodium metavanadate Chemical compound [Na+].[O-][V](=O)=O CMZUMMUJMWNLFH-UHFFFAOYSA-N 0.000 description 1
- 229960001922 sodium perborate Drugs 0.000 description 1
- 229910000693 sodium vanadium oxide Inorganic materials 0.000 description 1
- YKLJGMBLPUQQOI-UHFFFAOYSA-M sodium;oxidooxy(oxo)borane Chemical compound [Na+].[O-]OB=O YKLJGMBLPUQQOI-UHFFFAOYSA-M 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000012089 stop solution Substances 0.000 description 1
- NVBFHJWHLNUMCV-UHFFFAOYSA-N sulfamide Chemical class NS(N)(=O)=O NVBFHJWHLNUMCV-UHFFFAOYSA-N 0.000 description 1
- 125000001174 sulfone group Chemical group 0.000 description 1
- 150000003460 sulfonic acids Chemical class 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- RVMVGHFPBFHBTD-UHFFFAOYSA-N tert-butyl n-[(2-cyanopyridin-4-yl)methyl]carbamate Chemical compound CC(C)(C)OC(=O)NCC1=CC=NC(C#N)=C1 RVMVGHFPBFHBTD-UHFFFAOYSA-N 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000004001 thioalkyl group Chemical group 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 208000037816 tissue injury Diseases 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003624 transition metals Chemical class 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- CWMFRHBXRUITQE-UHFFFAOYSA-N trimethylsilylacetylene Chemical group C[Si](C)(C)C#C CWMFRHBXRUITQE-UHFFFAOYSA-N 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 125000002948 undecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Landscapes
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Настоящее изобретение относится к антраниламидпиридинамидам избирательного действия в качестве ингибиторов VEGFR-2 и VEGFR-3. Описываются соединения общей формулы I
в которой А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце, Е представляет собой арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий 5 или 6 кольцевых атомов и вместо углерода содержащий в кольце идентичные либо разные гетероатомы, выбранные из атомов азота или серы, или представляет собой группу -COOR8, -CONR2R3 или G представляет собой атом азота или группу -С-Х, L представляет собой атом азота или группу -С-Х, М представляет собой атом азота или группу -С-Х, Q представляет собой атом азота или группу -С-Х, при этом в кольце расположен максимум один атом азота, Х представляет собой водород, W представляет собой водород или галоген, R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, C1-С6алкилом или группой =O арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий от 3 до 16 кольцевых атомов и вместо углерода содержащий в кольце один или более идентичных либо разных гетероатомов, таких как кислород, азот или сера, который может быть моно-, би- или трициклическим и дополнительно может быть сконденсирован с бензольным ядром, R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, C1-С6алкилом, фенилом, гидрокси-C1-С6алкилом, гало-C1-С6алкилом либо группой -NR6R7, -OR5, C1-С6алкил-OR5 C1-С6алкил, C3-С6циклоалкил, C3-С6циклоалкенил арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий от 3 до 6 кольцевых атомов и вместо углерода содержащий в кольце один или более гетероатомов, таких как азот или сера, или R2 и R3 вместе с атомом азота образуют С3-С8кольцо, которое необязательно может содержать еще один атом азота или кислорода, либо может содержать группу -N(R10), R5 представляет собой водород, R6 и R7 независимо друг от друга представляют собой водород или C1-С6алкил, R8 представляет собой водород или необязательно одно- либо многозамещенный галогеном C1-С6алкил или бензил, R9 представляет собой водород или три-C1-С6алкилсилил, R10 представляет собой водород или C1-С6алкил, а также их изомеры, энантиомеры и соли. Также описывается лекарственное средство на основе соединений формулы I. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 2 н. и 6 з.п. ф-лы, 2 табл.
Description
Настоящее изобретение относится к антраниламидпиридинамидам избирательного действия в качестве ингибиторов VEGFR-2 и VEGFR-3, к их получению и применению в качестве лекарственных средств для лечения заболеваний, обусловленных персистирующим ангиогенезом.
Персистирующий ангиогенез (развитие кровеносных сосудов) может являться причиной различных заболеваний, таких как псориаз, артрит, например ревматоидный артрит, гемангиома, эндометриоз, ангиофиброма, глазные болезни, например диабетическая ретинопатия, неоваскулярная глаукома, заболевания почек, например гломерулонефрит, диабетическая нефропатия, злокачественный нефросклероз, тромбомикроангиопатия, отторжение трансплантата и гломерулопатия, фиброзные заболевания, например цирроз печени, заболевания, связанные с пролиферацией мезангиальных клеток, и артериосклероз, или может привести к прогрессированию этих заболеваний.
Персистирующий ангиогенез индуцируется фактором VEGF (васкулярный эндотелиальный фактор роста) через его рецептор. Для проявления фактором VEGF этого действия необходимо, чтобы VEGF связывался с рецептором и инициировал фосфорилирование тирозина.
Прямое или косвенное ингибирование VEGF-рецептора может использоваться для лечения подобных заболеваний и другого индуцируемого VEGF патологического ангиогенеза, а также расстройств, связанных с нарушением проницаемости сосудов, таких как васкуляризация опухолей. Так, например, известно, что с помощью растворимых рецепторов и антител к VEGF удается подавить рост опухолей.
Из заявки WO 00/27819 известны амиды антраниловой кислоты, которые применяются в качестве лекарственных средств для лечения псориаза, артрита, такого как ревматоидный артрит, гемангиомы, ангиофибромы, глазных болезней, таких как диабетическая ретинопатия, неоваскулярная глаукома, заболеваний почек, таких как гломерулонефрит, диабетическая нефропатия, злокачественный нефросклероз, тромбомикроангиопатия, отторжение трансплантата и гломерулопатия, фиброзных заболеваний, таких как цирроз печени, заболеваний, связанных с пролиферацией мезангиальных клеток, артериосклероза, повреждений нервной ткани, а также для ингибирования повторной окклюзии сосудов после лечения с использованием баллонных катетеров, при протезировании сосудов или после применения механических приспособлений, таких как стенты, для сохранения просвета (проходимости) сосудов.
Интенсивный ангиогенез является предпосылкой избыточного роста (разрастания) внематочного эндометрия при эндометриозе. Благодаря этому подавление ангиогенеза можно использовать также для терапии данной формы болезни, обусловливающей болезненные состояния и приводящей часто к бесплодию.
Известные соединения хотя, как правило, и эффективные при вышеназванных показаниях, тем не менее эта их эффективность сопровождается токсичностью и ухудшает переносимость медикамента. С учетом этого остается актуальной потребность, с одной стороны, в более эффективных, а с другой стороны, токсикологически более безвредных соединений, которые к тому же должны отличаться лучшей переносимостью.
При создании изобретения было установлено, что указанные выше недостатки удается устранить благодаря соединениям общей формулы I
в которой
А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце,
Е представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, C1-С6алкилом, C1-С6алкоксигруппой, гало-C1-С6алкилом либо группой -OR5, -SR4, -SOR4 или -SO2R4 арил либо гетарил, или представляет собой группу -COOR8, -CONR2R3, -SR4, -SOR4, -SO2R4, -SCN, -PO(OR12)(OR13), -CH-CH-COR9 или -C≡C-R9,
G представляет собой атом азота или группу -С-Х,
L представляет собой атом азота или группу -С-Х,
М представляет собой атом азота или группу -С-Х,
Q представляет собой атом азота или группу -С-Х,
при этом в кольце расположен максимум один атом азота,
Х представляет собой водород, галоген или незамещенный либо необязательно одно- или многозамещенный галогеном C1-С6алкил, C1-С6алкилоксигруппу или C1-С6-карбоксиалкил,
R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, аралкилоксигруппой, C1-С6алкилом и/или группой -NR2R3 разветвленный либо неразветвленный C1-С12алкил или C2-С12алкенил, или представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, C1-С6алкилом и/или группой -NR2R3 C3-С10циклоалкил либо C3-С10пиклоалкенил, или представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, гидроксигруппой, C1-С6алкилоксигруппой, C2-С6алкенилом, арил-C1-С6-алкилоксигруппой, аралкилоксигруппой, C1-С6алкилом, гало-C1-С6-алкилом либо группой =О, -SO2R4, -OR5, -R5 или -PO(OR12)(OR13) арил либо гетарил,
R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, C1-С6алкилом, фенилом, гидрокси-C1-С6алкилом, гало-C1-С6алкилом либо группой -NR6R7, -OR5, C1-С6алкил-ОР3, -SR4, -SOR4 или -SO2R4 C1-С6алкил, C3-С6циклоалкил, C3-С6циклоалкенил, арил либо гетарил или
R2 и R3 вместе с атомом азота образуют C3-С8кольцо, которое необязательно может содержать еще один атом азота, серы либо кислорода или может содержать группу -N(R10) и которое необязательно может быть идентично либо различно одно- или многозамещенным галогеном, цианогруппой, C1-С6алкилом, гало-C1-С6алкилом, арилом либо группой -OR5, -SR4, -SOR4 или -SO2R4,
R4 представляет собой гидроксигруппу, C1-С6алкил, арил, гетароарил или группу -NR2R3,
R5 представляет собой водород, C1-С12алкил, гало-C1-С6алкил, C3-С6циклоалкил либо гало-C3-С6циклоалкил или представляет собой C1-С12алкил, который может быть одно- либо многократно разорван кислородом, или
представляет собой группу -(CH2)2NR2R3, -CH2CN либо -CH2CF3,
R6 и R7 независимо друг от друга представляют собой водород или C1-С6алкил или
R6 и R7 вместе образуют 5-7-членное кольцо, которое может содержать атом кислорода либо серы или группу -N(R10)-,
R8 представляет собой водород или необязательно одно- либо многозамещенный галогеном C1-С6алкил, C1-С6алкоксигруппу, бензил, арил или гетарил,
R9 представляет собой водород, C1-С6алкил, три-C1-С6алкилсилил, арил, гетарил или группу -COR11,
R10 представляет собой водород, C1-С6алкил или арил,
R11 представляет собой водород, C1-С6алкил или группу -NR2R3, и
R12 и R13 независимо друг от друга представляют собой водород или C1-С6алкил, а также благодаря их изомерам, энантиомерам и солям.
Предлагаемые в изобретении соединения препятствуют фосфорилированию тирозина, соответственно подавляют персистирующий ангиогенез и тем самым останавливают рост и распространение опухолей, причем в первую очередь они отличаются меньшей степенью ингибирования изоформ цитохрома Р 450 (2С9 и 2С19).
Многие лекарственные средства расщепляются под действием этих изоформ. При ингибировании данных изоформ повышается уровень содержания указанных лекарственных средств в плазме, что может привести к нежелательным побочным эффектам.
Под алкилом имеется в виду соответственно прямоцепочечный либо разветвленный алкильный остаток, такой, например, как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, пентил, изопентил или гексил, гептил, октил, нонил, децил, ундецил и додецил.
Под алкоксигруппой имеется в виду соответственно прямоцепочечная либо разветвленная алкоксигруппа, такая, например, как метилокси, этилокси, пропилокси, изопропилокси, бутилокси, изобутилокси, втор-бутилокси, пентилокси, изопентилокси, гексилокси, гептилокси, октилокси, нонилокси, децилокси, ундецилокси или додецилокси.
Под циклоалкилом имеются в виду моноциклические алкильные кольца, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил или циклодецил, а также бициклические или трициклические кольца, такие, например, как адамантанил.
Под циклоалкенилом имеются в виду соответственно циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, циклононенил или циклодеценил, причем присоединение может происходить как по двойной, так и по простым (одинарным) связям.
Под галогеном имеется в виду соответственно фтор, хлор, бром или иод.
Под алкенилом имеется в виду соответственно прямоцепочечный либо разветвленный алкенильный остаток, содержащий 2-6, предпочтительно 2-4, С-атомов. В качестве примеров можно назвать следующие алкенильные остатки: винил, пропен-1-ил, пропен-2-ил, бут-1-ен-1-ил, бут-1-ен-2-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, 2-метилпроп-2-ен-1-ил, 2-метилпроп-1-ен-1-ил, бут-1-ен-3-ил, бут-3-ен-1-ил и аллил.
Арильный остаток содержит соответственно 6-12 атомов углерода, и в качестве примеров можно назвать нафтил, бифенил и прежде всего фенил.
Гетероарильный остаток включает от 3 до 16 кольцевых атомов и вместо углерода может содержать в кольце один или более идентичных либо разных гетероатомов, таких как кислород, азот или сера, и может быть моно-, би- или трициклическим и дополнительно может быть соответственно сконденсирован с бензольным ядром.
В качестве примеров можно назвать тиенил, фуранил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, тиазолил, тиадиазолил и др. и их бензопроизводные, такие, например, как бензофуранил, бензотиенил, бензоксазолил, бензимидазолил, индазолил, индолил, изоиндолил и др., или пиридил, пиридазинил, пиримидинил, пиразинил, триазинил и др. и их бензопроизводные, такие, например, как хинолил, изохинолил и др., или азоцинил, индолизинил, пуринил и др. и их бензопроизводные, или циннолинил, фталазинил, хиназолинил, хиноксалинил, нафтиридинил, птеридинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксазинил, ксантенил, оксепинил и др.
Арильный и гетероарильный остаток может быть соответственно идентично либо различно одно-, дву- или тризамещенным гидроксигруппой, галогеном, С1-С4алкоксигруппой, С1-С4алкилом или С1-С4алкилом, одно- либо многозамещенным в свою очередь галогеном.
При наличии кислотной функциональной группы в качестве солей пригодны физиологически совместимые соли органических и неорганических оснований, такие, например, как обладающие хорошей растворимостью соли щелочных и щелочноземельных металлов, а также N-метилглюкамин, диметилглюкамин, этилглюкамин, лизин, 1,6-гексадиамин, этаноламин, глюкозамин, саркозин, серинол, трисгидроксиметиламинометан, аминопропандиол, основание Совака (Sovak) и 1-амино-2,3,4-бутантриол.
При наличии же основной функциональной группы пригодными являются физиологически совместимые соли таких органических и неорганических кислот, как соляная кислота, серная кислота, фосфорная кислота, лимонная кислота, винная кислота, фумаровая кислота и др.
Предлагаемые в изобретении соединения общей формулы I могут быть представлены также в таутомерных формах и включают Е- либо Z-изомеры или, при наличии хирального центра, также рацематы и энантиомеры.
В качестве особенно эффективных зарекомендовали себя такие соединения общей формулы I, в которой
А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце,
Е представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, C1-С6алкилом, C1-С6алкоксигруппой, гало-C1-С6алкилом либо группой -OR5, -SR4, -SOR4 или -SO2R4 арил либо гетарил, или представляет собой группу -COOR8, -CONR2R3, -SR4, -SOR4, -SO2R4, -SCN, -PO(OR12)(OR13), -CH=CH-COR9 или -C≡C-R9,
G представляет собой атом азота или группу -С-Х,
L представляет собой атом азота или группу -С-Х,
М представляет собой атом азота или группу -С-Х,
Q представляет собой атом азота или группу -С-Х,
при этом в кольце расположен максимум один атом азота,
Х представляет собой водород, галоген или незамещенный либо необязательно одно- или многозамещенный галогеном C1-С6алкил, C1-С6алкилоксигруппу или C1-С6-карбоксиалкил,
R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, гидроксигруппой, C1-С6алкилоксигруппой, C2-С6алкенилом, арил-C1-С6алкилоксигруппой, аралкилоксигруппой, C1-С6алкилом, гало-C1-С6алкилом либо группой =O, -SO2R4, -OR5, -R5 или -PO(OR12)(OR13) арил либо гетарил,
R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, C1-С6алкилом, фенилом, гидрокси-C1-С6алкилом, гало-C1-С6алкилом либо группой -NR6R7, -OR5, C1-С6алкил-OR5, -SR4, -SOR4 или -SO2R4 C1-С6алкил, C3-С6циклоалкил, C3-С6циклоалкенил, арил либо гетарил или
R2 и R3 вместе с атомом азота образуют C3-С8кольцо, которое необязательно может содержать еще один атом азота, серы либо кислорода или может содержать группу -N(R10) и которое необязательно может быть идентично либо различно одно- или многозамещенным галогеном, цианогруппой, C1-С6алкилом, гало-C1-С6алкилом, арилом либо группой -OR5, -SR4, -SOR4 или -SO2R4,
R4 представляет собой гидроксигруппу, C1-С6алкил, арил, гетароарил или группу -NR2R3,
R5 представляет собой водород, C1-С12алкил, гало-C1-С6алкил, C3-С6циклоалкил либо гало-C3-С6циклоалкил или представляет собой C1-С12алкил, который может быть одно- либо многократно разорван кислородом, или
представляет собой группу -(CH2)2NR2R3, -CH2CN либо -CH2CF3,
R6 и R7 независимо друг от друга представляют собой водород или C1-С6алкил или
R6 и R7 вместе образуют 5-7-членное кольцо, которое может содержать атом кислорода либо серы или группу -N(R10)-,
R8 представляет собой водород или необязательно одно- либо многозамещенный галогеном C1-С6алкил, C1-С6алкоксигруппу, бензил, арил или гетарил,
R9 представляет собой водород, C1-С6алкил, три-C1-С6алкилсилил, арил, гетарил или группу -COR11,
R10 представляет собой водород, C1-С6алкил или арил,
R11 представляет собой водород, C1-С6алкил или группу -NR2R3 и
R12 и R13 независимо друг от друга представляют собой водород или C1-С6алкил, а также их изомеры, энантиомеры и соли.
К особенно эффективным относятся далее такие соединения общей формулы I, в которой
А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце,
Е представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, C1-С6алкилом, C1-С6алкоксигруппой, гало-C1-С6алкилом либо группой -OR5, -SR4, -SOR4 или -SO2R4 арил либо гетарил, или представляет собой группу -COOR8, -CONR2R3, -SR4, -SOR4, -SO2R4, -SCN, -PO(OR12)(OR13), -CH=CH-COR9 или -C≡C-R9,
G представляет собой атом азота или группу -С-Х,
L представляет собой атом азота или группу -С-Х,
М представляет собой атом азота или группу -С-Х,
Q представляет собой атом азота или группу -С-Х,
при этом в кольце расположен максимум один атом азота,
Х представляет собой водород или галоген,
R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, аралкилоксигруппой, C1-С6алкилом, гало-C1-С6алкилом либо группой -SO2R4, -OR5, -R5 или -PO(OR12)(OR13) арил либо гетарил,
R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, C1-С6алкилом, фенилом, гидрокси-C1-С6алкилом, гало-C1-С6алкилом либо группой -NR6R7, -OR5, C1-С6алкил-OR3, -SR4, -SOR4 или -SO2R4 C1-С6алкил, C3-С6циклоалкил, C3-С6циклоалкенил, арил либо гетарил или
R2 и R3 вместе с атомом азота образуют C3-С8кольцо, которое необязательно может содержать еще один атом азота, серы либо кислорода или может содержать группу -N(R10) и которое необязательно может быть идентично либо различно одно- или многозамещенным галогеном, цианогруппой, C1-С6алкилом, гало-C1-С6алкилом, арилом либо группой -OR5, -SR4, -SOR4 или -SO2R4,
R4 представляет собой гидроксигруппу или группу -NR2R3,
R5 представляет собой водород, C1-С12алкил или C1-С12алкил, который может быть одно- либо многократно разорван кислородом, или представляет собой группу -(CH2)2NR2R3, -CH2CN либо -СН2CF3,
R6 и R7 независимо друг от друга представляют собой водород или C1-С6алкил или
R6 и R7 вместе образуют 5-7-членное кольцо, которое может содержать атом кислорода либо серы или группу -N(R10)-,
R8 представляет собой водород или необязательно одно- либо многозамещенный галогеном C1-С6алкил, C1-С6алкоксигруппу, бензил, арил или гетарил,
R9 представляет собой водород, C1-С6алкил, три-C1-С6алкилсилил, арил, гетарил или группу -COR11,
R10 представляет собой водород, C1-С6алкил или арил,
R11 представляет собой водород, C1-С6алкил или группу -NR2R3 и
R12 и R13 независимо друг от друга представляют собой водород или C1-С6алкил, а также их изомеры, энантиомеры и соли.
Эффективными свойствами обладают также соединения общей формулы I, в которой
А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце,
Е представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, C1-С6алкилом, C1-С6алкоксигруппой, гало-C1-С6алкилом либо группой -OR5, -SR4, -SOR4 или -SO2R4 гетарил, или представляет собой группу -COOR8, -CONR2R3, -SR4, -SOR4, -SO2R4, -SCN, -PO(OR12)(OR13), -CH=CH-COR9 или -C≡C-R9,
G представляет собой группу -С-Х,
L представляет собой группу -С-Х,
М представляет собой группу -С-Х,
Q представляет собой атом азота или группу -С-Х,
Х представляет собой водород или галоген,
R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, аралкилоксигруппой, C1-С6алкилом, гало-C1-С6алкилом либо группой -SO2R4, -OR5, -R5 или -PO(OR12)(OR13) фенил, тиофен, фуран, оксазол, тиазол, имидазол, пиразол, пиридин, пиримидин, триазин, хинолин, изохинолин или замещен по группе
в которой Т обозначает водород, C1-С6алкил или C1-С6алкоксигруппу,
R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, C1-С6алкилом, фенилом, гидрокси-C1-С6алкилом, гало-C1-С6алкилом либо группой -NR6R7, -OR5, C1-С6алкил-OR5, -SR4, -SOR4 или -SO2R4 C1-С6алкил, C3-С6циклоалкил, C3-С6циклоалкенил, арил либо гетарил или
R2 и R3 вместе с атомом азота образуют C3-С8кольцо, которое необязательно может содержать еще один атом азота, серы либо кислорода или может содержать группу -N(R10) и которое необязательно может быть идентично либо различно одно- или многозамещенным галогеном, цианогруппой, C1-С6алкилом, гало-C1-С6алкилом, арилом либо группой -OR5, -SR4, -SOR4 или -SO2R4,
R4 представляет собой гидроксигруппу или группу -NR2R3,
R5 представляет собой водород, C1-С12алкил, гало-C1-С6алкил, C3-С6циклоалкил либо гало-C3-С6циклоалкил или представляет собой C1-С12алкил, который может быть одно- либо многократно разорван кислородом, или представляет собой группу -(CH2)2NR2R3, -CH2CN либо -СН2CF3,
R6 и R7 независимо друг от друга представляют собой водород или C1-С6алкил или
R6 и R7 вместе образуют 5-7-членное кольцо, которое может содержать атом кислорода либо серы или группу -N(R10)-,
R8 представляет собой водород или необязательно одно- либо многозамещенный галогеном C1-С6алкил, C1-С6алкоксигруппу, бензил, арил или гетарил,
R9 представляет собой водород, C1-С6алкил или три-C1-С6алкилсилил и
R12 и R13 независимо друг от друга представляют собой водород или C1-С6алкил, а также их изомеры, энантиомеры и соли.
Исключительными по своей эффективности свойствами отличаются такие соединения общей формулы I, в которой
А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце,
Е представляет собой тиенил, пиридил либо группу -COOR8, -CONR2R3 или -C≡C-R9
G представляет собой группу -С-Х,
L представляет собой группу -С-Х,
М представляет собой группу -С-Х,
Q представляет собой атом азота или группу -С-Х,
Х представляет собой водород или галоген,
R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, аралкилоксигруппой, C1-С6алкилом, гало-C1-С6алкилом либо группой -SO2R4, -OR5, -R5 или -PO(OR12)(OR13) фенил, тиофен, фуран, оксазол, тиазол, имидазол, пиразол, пиридин, пиримидин, триазин, хинолин, изохинолин или замещен по группе
в которой Т обозначает водород, C1-С6алкил или C1-С6алкоксигруппу,
R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, C1-С6алкилом, фенилом либо группой -NR6R7, -OR5 или C1-С6алкил-OR5 C1-С6алкил, C3-С6циклоалкил, фенил либо пиридил или
R2 и R3 вместе с атомом азота образуют C3-С8кольцо, которое необязательно может содержать еще один атом азота либо кислорода и которое необязательно может быть идентично либо различно одно- или многозамещенным C1-С6алкилом,
R4 представляет собой гидроксигруппу или группу -NR2R3,
R5, R6 и R7 независимо друг от друга представляют собой водород или C1-С6алкил или
R6 и R7 вместе образуют 5-7-членное кольцо, которое может содержать атом кислорода или серы,
R8 представляет собой водород, C1-С6алкил или бензил,
R9 представляет собой водород, C1-С6алкил или три-C1-С6алкилсилил и
R12 и R13 независимо друг от друга представляют собой водород или C1-С6алкил, а также их изомеры и соли.
Предлагаемые в изобретении соединения, равно как и их физиологически совместимые соли препятствуют фосфорилированию тирозина, соответственно подавляют персистирующий ангиогенез и тем самым останавливают рост и распространение опухолей, причем в первую очередь они отличаются меньшей степенью ингибирования изоформ цитохрома Р 450 (2С9 и 2С19). Поэтому лечение с использованием соединений по изобретению можно проводить без риска и в тех случаях, когда одновременно применяются дополнительные ("сопровождающие") лекарственные средства, расщепляемые под действием указанных изоформ.
Соединения формулы I равно как и их физиологически совместимые соли благодаря их ингибирующей активности по отношению к фосфорилированию VEGF-рецептора могут применяться в качестве лекарственных средств. Профиль их действия позволяет применять предлагаемые в изобретении соединения для лечения заболеваний, обусловленных или стимулируемых персистирующим ангиогенезом.
Поскольку соединения формулы I идентифицируются как ингибиторы тирозинкиназ VEGFR-1 и VEGFR-2, они пригодны прежде всего для лечения таких болезней, которые обусловлены или развитию которых способствует инициированный через VEGF-рецептор персистирующий ангиогенез или повышение проницаемости сосудов.
Объектом настоящего изобретения является также применение предлагаемых в нем соединений в качестве ингибиторов тирозинкиназ VEGFR-1 и VEGFR-2, соответственно KDR и FLT.
Объектом настоящего изобретения в соответствии с этим являются также лекарственные средства для лечения опухолей и применение таких средств.
Предлагаемые в изобретении соединения могут применяться либо индивидуально, либо в составе соответствующей композиции в качестве лекарственных средств для лечения псориаза, саркомы Капоши, рестеноза, такого, например, как рестеноз, индуцированный стентами, эндометриоза, болезни Крона, болезни Ходжкина, лейкемии, артрита, такого как ревматоидный артрит, гемангиомы, ангиофибромы, глазных болезней, таких как диабетическая ретинопатия, неоваскулярная глаукома, заболеваний почек, таких как гломерулонефрит, диабетическая нефропатия, злокачественный нефросклероз, тромбоангиопатия, отторжение трансплантата и гломерулопатия, фиброзных заболеваний, таких как цирроз печени, заболеваний, связанных с пролиферацией мезангиальных клеток, артериосклероза, повреждений нервной ткани и для торможения повторной окклюзии сосудов после лечения с использованием баллонных катетеров, при протезировании сосудов или после применения механических приспособлений, таких, например, как стенты, для сохранения проходимости (просвета) сосудов, в качестве иммуносупрессоров, в качестве вспомогательных средств, способствующих безрубцовому заживлению ран, при старческих пятнах и при контактном дерматите.
При лечении повреждений нервной ткани с использованием соединений по изобретению удается предотвратить быстрое рубцевание в поврежденных местах, т.е. рубцевание удается предотвратить до того момента, когда аксоны восстановят взаимосвязь друг с другом. Это, как очевидно, облегчает восстановление нервных путей и связей.
С помощью предлагаемых в изобретении соединений можно подавить, кроме того, образование асцита у пациентов. В равной степени с их помощью удается подавить отеки, обусловленные фактором VEGF.
Лимфоангиогенез играет важную роль при лимфогенном метастазировании (см. Т.Karpanen и др., Cancere Res. за 1 марта 2001, 61 (5), cc.1786-1790, Т.Veikkola и др., EMBO J. за 15 марта 2001, 20 (6), cc.1223-1231).
Предлагаемые в изобретении соединения также исключительно высокоэффективны в качестве ингибиторов VEGFR-киназы 3 и благодаря этому могут успешно применяться в качестве активных ингибиторов лимфоангиогенеза. Лечение с использованием соединений по изобретению позволяет не только снизить разрастание метастаз, но и уменьшить их число.
Предлагаемые в изобретении соединения проявляют свою эффективность и при заболеваниях, которые связаны с чрезмерным лимфоангиогенезом и которые относят по этой причине к синдрому лимфоангиогиперплазии и -дисплазии.
Лекарственные средства такого типа, содержащие их композиции и их применение также являются объектом настоящего изобретения.
В соответствии с этим изобретение относится далее к применению соединений общей формулы I для получения лекарственного средства, соответственно к применению этого лекарственного средства для лечения псориаза, саркомы Капоши, рестеноза, такого, например, как рестеноз, индуцированный стентами, эндометриоза, болезни Крона, болезни Ходжкина, лейкемии, артрита, такого как ревматоидный артрит, гемангиомы, ангиофибромы, глазных болезней, таких как диабетическая ретинопатия, неоваскулярная глаукома, заболеваний почек, таких как гломерулонефрит, диабетическая нефропатия, злокачественный нефросклероз, тромбоангиопатия, отторжение трансплантата и гломерулопатия, фиброзных заболеваний, таких как цирроз печени, заболеваний, связанных с пролиферацией мезангиальных клеток, артериосклероза, повреждений нервной ткани и для торможения повторной окклюзии сосудов после лечения с использованием баллонных катетеров, при протезировании сосудов или после применения механических приспособлений, таких, например, как стенты, для сохранения проходимости (просвета) сосудов, в качестве иммуносупрессоров, в качестве вспомогательных средств, способствующих безрубцовому заживлению ран, при старческих пятнах и при контактном дерматите.
Кроме того, с помощью предлагаемых в изобретении соединений можно, как указывалось выше, подавить образование асцита у пациентов. В равной мере с их помощью удается подавить отеки, обусловленные фактором VEGF.
Для применения соединений формулы I в качестве лекарственного средства их переводят в соответствующую лекарственную форму, т.е. изготавливают фармацевтический препарат, содержащий наряду с действующим веществом для энтерального или парентерального применения пригодные для таких целей фармацевтические органические или неорганические инертные наполнители, такие, например, как вода, желатин, гуммиарабик, лактоза, крахмал, стеарат магния, тальк, масла растительного происхождения, полиалкиленгликоли и т.п. Фармацевтические препараты могут выпускаться в твердой форме, например в виде таблеток, драже, суппозиториев, капсул, либо в жидкой форме, например в виде растворов, суспензий или эмульсий. При необходимости в их состав могут включаться, кроме того, вспомогательные вещества, такие как консерванты, стабилизаторы, смачиватели или эмульгаторы, соли для изменения осмотического давления или буферы.
Для парентерального применения пригодны прежде всего растворы для инъекции или суспензии, в первую очередь водные растворы активных соединений в полигидроксиэтоксилированном касторовом масле.
В качестве систем-носителей могут использоваться также поверхностно-активные вспомогательные вещества, такие как соли желчных кислот или фосфолипиды животного либо растительного происхождения, равно как и их смеси, а также липосомы или их компоненты.
Для перорального применения пригодны прежде всего таблетки, драже или капсулы с тальком и/или углеводородным наполнителем либо связующим, таким, например, как лактоза, кукурузный или картофельный крахмал. Возможно также применение и жидких лекарственных форм, таких, например, как микстура, к которой при необходимости добавляют подслащивающее вещество или одно либо несколько вкусовых веществ.
Дозировку действующих веществ можно варьировать в зависимости от методики введения лекарственных средств, возраста и веса пациента, типа и степени тяжести конкретного заболевания и тому подобных факторов. Суточная доза составляет от 0,5 до 1000 мг, предпочтительно от 50 до 200 мг, причем эта доза может назначаться для одноразового приема или ее можно разделять на две и более суточных дозы.
Вышеописанные композиции и лекарственные формы также являются объектом настоящего изобретения.
Предлагаемые в изобретении соединения получают в принципе по известным методам. Так, например, для получения соединений общей формулы I соединение общей формулы II
в которой А, В, D, G, L, M, Q, W и R1 имеют значения, указанные для общей формулы I, a E представляет собой СООН-группу карбоновой кислоты, подвергают по известным из литературы методам в соответствующем растворителе и соответствующем органическом основании взаимодействию с амином общей формулы III
где R8 и R9 имеют значения, указанные в общей формулы I, либо, если Е представляет собой нитрильную группу, нитрил омыляют с образованием амида, или соединение общей формулы IV
в которой А, В, D, G, L, M, Q, W, R8 и R9 имеют значения, указанные для общей формулы I, a Rx обозначает сложноэфирную либо кислотную группу, переводят в соответствующий амид.
Процесс образования амида проводят по методам, известным из литературы. Так, например, для образования амида можно исходить из соответствующего сложного эфира. Этот сложный эфир согласно описанной в Journ. Org. Chem. (1995), с.8414, методике подвергают взаимодействию с алюминийтриметилом и соответствующим амином в растворителях, таких как толуол, при температурах в интервале от 0°С до температуры кипения используемого растворителя. При наличии в молекуле двух сложноэфирных групп обе эти группы переводят в один и тот же амид. Вместо алюминийтриметила может использоваться также гексаметилдисилазид натрия.
Для образования амида, кроме вышеназванных, могут использоваться все методы, известные из химии пептидов. Так, в частности, соответствующую кислоту в апротонных полярных растворителях, таких как диметилформамид, через активированное производное кислоты, получаемое, например, с помощью гидроксибензотриазола и карбодиимида, такого как диизопропилкарбодиимид, или же с помощью предварительно образованных реагентов, таких как ГАТУ (Chem. Comm. (1994), с.201) или БТУ, при температурах в интервале от 0°С до температуры кипения используемого растворителя, предпочтительно при 80°С, подвергают взаимодействию с амином. Для образования амида пригоден также метод с использованием смешанного ангидрида кислоты, имидазолида или азида.
Нитрилы с помощью известных из литературы методов можно омылять с получением в результате амидов. Высокоэффективной является обменная реакция, описанная в Synthesis (1989), с.949, с использованием карбоната калия и пероксида водорода в апротонном полярном растворителе, таком как диметилсульфоксид, предпочтительно при комнатной температуре.
Еще одна возможность получать предлагаемые в изобретении соединения общей формулы I состоит в том, что соединение общей формулы IIa
в которой А, В, D, G, L, М, Q, W и R1 имеют значения, указанные для общей формулы I, a E представляет собой галоген или O-сульфонат, такой, например, как атом хлора, брома либо иода, O-трифторметансульфонат или O-метилсульфонат,
а) подвергают взаимодействию с соответствующим образом замещенными концевыми алкенами по реакции Хекка (см. "Palladium Reagents in Organic Syntheses", изд-во Academic Press (1985), New York, c.179 и далее) или с винилбороновыми кислотами либо эфирами винилбороновых кислот по реакции Сузуки (см. Tetrahedron Lett. 39 (1983), cc.3271 и далее) или с винилстаннанами по реакции Штилле (см. Pure & Appl. Chem. 57 (1985), с.1771), или
б) подвергают реакции сочетания с любым образом замещенными концевыми алкинами, например по методу Стефена-Кастро (см. Journ. Org. Chem. 28 (1963), cc.3313 и далее) либо при катализе палладием по методу Соногашира (см. "Comprehensive Organic Synthesis: Carbon-Carbon σ-Bond Formation", изд-во Pergamon Press (1991), Oxford UK, том 3, cc.551 и далее), или
в) подвергают реакции сочетания с арил- и гетарилборными кислотами либо их эфирами по методу Сузуки (см. Acc.Chem.Res. 63 (1991), cc.419 и далее, или Journ. Am. Soc. 122 (2000), cc.4020 и далее), либо с арил- и гетарилстаннанами по методу Штилле (см. Angew. Chem. 98 (1986), cc.504 и далее, или Angew. Chem. Int. Ed. (международное издание) 38 (1999), cc.2411 и далее), либо с арильными и гетарильными соединениями Гриньяра или аналогичными цинкорганическими производными по методу Негиши (см. "Metal-catalyzed Cross-coupling Reaction", под ред. Diederich/Stang, изд-во Wiley-VCH (1998), New York, глава 1, или Journ. Am. Soc. 123 (2001), cc.2719 и далее), или
г) переводят путем катализированного палладием карбонилирования в атмосфере моноксида углерода при давлении от 1 до 20 бар в диметилформамиде в присутствии соответствующего спирта (см. "Palladium Reagents in Organic Syntheses", изд-во Academic Press (1985), New York, cc.352 и далее или Synth. Comm. 27 (1997), cc.515 и далее) в соответствующий эфир карбоновой кислоты, или
д) переводят путем катализированного палладием карбонилирования в атмосфере моноксида углерода при давлении от 1 до 20 бар в смесях диметилформамида и воды в соответствующую карбоновую кислоту (см. Journ. Org. Chem. 46 (1981), cc.4614 и далее); карбоновые кислоты можно также получать омылением соответствующих эфиров карбоновых кислот, или
е) подвергают катализированному палладием карбонилированию в атмосфере моноксида углерода при давлении от 1 до 20 бар в диметилформамиде в присутствии аминов с получением соответствующих амидов карбоновых кислот (см. "Palladium Reagents in Organic Syntheses", изд-во Academic Press (1985), New York, cc.352 и далее, Tetrahedron Lett. 23 (1982), cc.3383 и далее); синтез амидов карбоновых кислот можно также осуществлять исходя из эфиров карбоновых кислот, особенно эффективным в этих целях зарекомендовал себя метод Вайнреба (Weinreb) (см. Tetrahedron Lett. 17 (1977), cc.4171 и далее, Journ. Org., Chem. 60 (1995), cc.8414 и далее); амиды карбоновых кислот можно также синтезировать из получаемых в разделе д) карбоновых кислот, используя с этой целью в принципе все методы, известные из химии пептидов (см. Synthesis (1972), cc.453-463, или "Comprehensive Organic Transformations", изд-во Wiley-VCH (1989), New York, cc.972-976); так, например, соответствующую карбоновую кислоту можно подвергать в апротонных полярных растворителях, таких как диметилформамид, через активированное производное карбоновой кислоты, получаемое, например, за счет добавления карбонилдиимидазола, при температурах в интервале от 0 до 120°С, предпочтительно при комнатной температуре, взаимодействию с аминами, такими, в частности, как ГАТУ (см. Chem. Comm. (1994), с.201), или
ж) взаимодействием с тиоалкилами, -арилами и -гетарилами непосредственно, в присутствии оснований, таких, например, как гидрид калия либо трет-бутанолят калия, или переходных металлов, например медной стружки, хлорида либо бромида меди, или дихлорида палладия, в апротонных растворителях, таких, например, как диметилформамид, N-метилпирролидон, диметилсульфоксид или ксилол, при температурах в интервале от 20 до 200°С переводят в соответствующий сульфид; при этом может оказаться целесообразным проводить данную реакцию в микроволновой печи (см. Tetrahedron 39 (1983), cc.4153 и далее); 2-тиозамещенные пиридильные производные можно также без проблем получать из 2-пиридонового производного после тионилирования пентасульфидом фосфора (см. Bull. Soc. Chim. Fr. (1953), cc.1001 и далее) либо реагентом Лоуссона (см. Tetrahedron 40 (1984), cc.2047 и далее) и последующим алкилированием алкилгалогенидами, предпочтительно алкилиодидами (см. Journ. Org. Chem. 64 (1999), cc.7935-7939) либо алкилсульфонатами, предпочтительно алкилтрифторметилсульфонатами.
Далее возможны следующие варианты реакции:
з) оксидированием сульфидов обычными окислителями, такими, например, как пероксид водорода, периодат натрия, трет-бутоксигипохлорит, хлорит натрия, метахлорпербензойная кислота, трифторперуксусная кислота, диметилдиоксиран, аммонийнитрат церия или азотная кислота (см. "Oxidations in Organic Chemistry", изд-во ACS Washington (1990), cc.252-263), в растворителях, таких, например, как дихлорметан, дихлорэтан, хлороформ, тетрагидрофуран, ацетонитрил, диметилформамид, N-метилпирролидон, диметилсульфоксид, диметоксиэтан, диглим, тетраглим или вода, при температурах в интервале от 20°С до температуры кипения используемого растворителя могут быть получены соответствующие сульфоксиды. Полученные таким путем сульфоксиды можно далее оксидировать до соответствующих сульфонов; эта операция осуществляется, например, с помощью окислителей, таких как пероксид водорода, перманганат калия, перборат натрия или гидроперсульфат калия (см. Tetrahedron Lett. 22 (1981), cc.1287 и далее), в растворителях, таких, например, как дихлорметан, дихлорэтан, хлороформ, тетрагидрофуран, ацетонитрил, диметилформамид, N,N-диметилацетамид, диметилсульфоксид или вода, при температурах в интервале от 20°С до температуры кипения используемого растворителя. Обработка сульфидов избытком вышеназванных окислителей приводит непосредственно к соответствующим сульфонам (см. "The chemistry of sulphones and sulfoxides" в Patai, изд-во Wiley, New York (1988), cc.165-231).
и) оксидированием полученных в разделе ж) тиолов могут быть получены хлорсульфонаты, особенно эффективным при этом зарекомендовало себя оксидирование хлором в водной соляной кислоте (см. Journ. Org. Chem. 64 (1999), cc.5896-5903), либо тетрахлорметаном (см. Journ. Med. Chem. 43)2000), cc.843-858), либо гипохлоритом натрия в серной кислоте (см. Tetrahedron Asymm. 8 (1997), cc.3559-3562).
к) взаимодействием со смесью из роданида меди и роданида калия в полярно апротонных растворителях, таких, например, как ацетонитрил, диметилформамид, N,N-диметилацетамид, диметилсульфоксид, диглим, тетраглим или N-метилпирролидон, могут быть получены соответствующие тиоцианаты (см. Journ. Chem. Soc. Chem. Comm. (1989), cc.81 и далее). Из этих тиоцианатов в свою очередь путем оксидирования гипохлоритом можно получать соответствующие хлорангидриды сульфокислот.
л) взаимодействием указанных в разделе и) хлорсульфонатов с аминами в растворителях, таких, например, как дихлорметан, дихлорэтан, хлороформ, тетрагидрофуран, этилацетат, ацетонитрил, диметилформамид, N-метилпирролидон, N,N-диметилацетамид, диметоксиэтан или вода, при температурах в интервале от 0°С до температуры кипения используемого растворителя могут быть получены соответствующие сульфамиды (см. Tetrahedron 56 (2000), cc.8253-8262).
м) путем гидролиза полученных в разделе и) хлорсульфонатов в воде либо в водном щелоке при температурах в интервале от 5 до 100°С получают соответствующие сульфокислоты.
н) катализированным палладием взаимодействием с О,О-диалкилфосфитами в апротонных растворителях, таких, например, как диметилформамид, N-метилпирролидон, N,N-диметилацетамид, диметилсульфоксид или толуол, в присутствии основания, такого, например, как триэтиламин или диизопропилэтиламин, при температурах в интервале от 0°С до температуры кипения используемого растворителя, предпочтительно при 80°С, могут быть получены соответствующие фосфонаты (см. Bull. Chem. Soc. Jpn. 55 (1982), cc.909 и далее).
о) путем металлирования, например с помощью н-бутиллития, втор-бутиллития, трет-бутиллития, метиллития, диизопропиламида лития или этилмагнийбромида, в апротонных растворителях, таких как диэтиловый эфир, тетрагидрофуран или диоксан, при температурах в интервале от -100°С до 0°С, предпочтительно при -78°С в тетрагидрофуране, и реакцией с изоцианатами могут быть получены соответствующие амиды карбоновых кислот.
п) по реакции, аналогично описанной в разделе о), и улавливанием металлированных промежуточных продуктов эфиром хлормуравьиной кислоты могут быть получены соответствующие эфиры карбоновых кислот.
р) по реакции, аналогично описанной в разделе о), и улавливанием металлированных промежуточных продуктов диметилформамидом, этилформиатом либо N-формилморфолином могут быть получены соответствующие альдегиды.
с) по реакции, аналогично описанной в разделе о), и улавливанием металлированных промежуточных продуктов алкилгалогенидами либо алкилсульфонатами, предпочтительно алкилиодидами либо алкилтрифторметансульфонатами, могут быть получены соответствующие пиридилалкильные производные.
т) путем восстановления водородом в присутствии каталитических количеств палладия, никеля либо родия или солей этих металлов, например палладия на активированном угле, в полярно-протонных растворителей либо в смесях растворителей, таких, например, как метанол - ледяная уксусная кислота, полученные в разделе а) пиридилалкены и полученные в разделе б) пиридилалкины можно переводить в соответствующие пиридилалканы.
Последовательность проведения описанных стадий способа может во всех случаях варьироваться.
Получение предлагаемых в изобретении соединений
Ниже получение соединений по изобретению более подробно поясняется на примерах, которые не ограничивают его объем.
Пример 1
Получение пропиламида 5-{[2-(изохинолин-3-илкарбамоил)фенил-амино]метил}пиридин-2-карбоновой кислоты
В 2,5 мл диметилформамида в атмосфере аргона и исключая доступ влаги вводят 50 мг (0,13 ммоля) 5-{[2-(изохинолин-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты и 42 мг (0,26 ммоля) карбонилдиимидазола и в течение 30 мин перемешивают при комнатной температуре. Затем к этой смеси добавляют 15 мг (0,26 ммоля) н-пропиламина и в течение 12 ч продолжают перемешивание при комнатной температуре. После этого разбавляют водой до объема порядка 30 мл и трижды экстрагируют встряхиванием с этиловым эфиром уксусной кислоты его порциями по 20 мл. Собранную органическую фазу сушат, фильтруют и концентрируют, а остаток хроматографируют на колонке для экспресс-хроматографии (5 г материала Isolute flash silica, фирма Separtis) путем градиентного элюирования, начиная со 100%-ного гексана и заканчивая смесью гексана и этилового эфира уксусной кислоты в соотношении 50%:50%. В результате получают 45 мг (79% от теории) пропиламида 5-{[2-(изохинолин-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты с молярным пиком в МС (масс-спектроскопии) m/e=439.
По аналогичной методике получают также соединения в представленных ниже примерах:
| Пример № | А | B | D | R2 | R3 | ММ | tпл [°С]/молярный пик в МС (m/e) | |||
| 1.1 | С | С | N | -СН3 | -СН3 | 425,49 | ||||
| 1.2 | С | С | N | -СН(СН3)2 | Н | 439,52 | смола/439 | |||
| 1.3 | С | С | N | Н | 437,50 | смола/437 | ||||
| 1.4 | С | С | N | -СН2CF3 | Н | |||||
| 1.5 | С | С | N | -(СН2)2-ОН | Н | 441,49 | смола/441 | |||
| 1.6 | С | С | N | -(СН2)3ОН | Н | 455,52 | смола/455 | |||
| 1.7 | С | С | N | -(СН2)4OH | Н | 469,54 | смола/469 | |||
| 1.8 | С | С | N | Н | 455,52 | 155 | ||||
| 1.9 | С | С | N | Н | 455,52 | смола/455 | ||||
| 1.10 | С | С | N | Н | 455,52 | 109 | ||||
| 1.11 | С | С | N | Н | 455,52 | 82 | ||||
| 1.12 | С | С | N | 483,87 | смола/483 | |||||
| 1.13 | С | С | N | -(СН2)2N(СН3)2 | Н | 468, | /468 | |||
| 1.14 | С | С | N | -(СН2)3N(СН3)2 | Н | 482,59 | /469 | |||
| Пример № | A | В | D | R2 | R3 | ММ | tпл [°С]/молярный пик в МС (m/e) | |||
| 1.15 | С | N | С | -СН3 | -СН3 | 425,49 | 106 | |||
| Пример № | А | B | D | R2 | R3 | ММ | tпл [°С]/молярный пик в МС (m/e) |
| 1.16 | С | N | С | -СН3 | Н | 411,46 | 180 |
| 1.17 | С | N | С | -С2Н5 | Н | 425,49 | 165 |
| 1.18 | С | N | С | Н | 437,50 | 172 | |
| 1.19 | С | N | С | -(СН2)2-ОН | Н | 441,49 | 136 |
| 1.20 | С | N | С | Н | 474,52 | 207 | |
| 1.21 | С | N | С | Н | 465,55 | 94 | |
| 1.22 | С | N | С | Н | 473,53 | 187 | |
| 1.23 | С | N | С | -С3Н7 | Н | 439,52 | 96 |
| 1.24 | С | N | С | -СН(СН3)2 | Н | 439,52 | 174 |
| 1.25 | С | N | С | Н | 455,52 | 103 | |
| 1.26 | С | N | С | Н | 455,52 | 110 | |
| 1.27 | С | N | С | Н | 455,52 | 105 | |
| 1.28 | С | N | С | Н | 455,52 | 100 | |
| 1.29 | С | N | с | Н | 479,58 | 110 | |
| 1.30 | С | N | с | Н | 491,52 | 204 | |
| 1.31 | С | N | С | Н | 487,56 | 151 | |
| 1.32 | С | N | С | -(СН2)3-ОН | Н | 455,52 | 65 |
| 1.33 | С | N | С | -(СН2)5-ОН | Н | 483,57 | 70 |
| 1.34 | С | N | С | -(СН2)4-ОН | Н | 469,54 | 70 |
| 1.35 | С | N | С | -(СН2)2N(СН3)2 | Н | 455,52 | 98 |
| 1.36 | С | N | С | -(СН2)3Н(СН3)2 | Н | 482,59 | 95 |
| 1.37 | С | N | С | Н | 503,56 | 190 |
| Пример № | А | B | D | R2 | R3 | ММ | tпл [°С]/молярный пик в МС (m/e) |
| 1.38 | С | N | С | Н | 474,52 | 190 | |
| 1.39 | С | N | С | Н | 474,52 | 105 | |
| 1.40 | С | N | С | Н | 483,57 | 75 | |
| 1.41 | С | N | С | Н | 469,54 | 50 | |
| 1.42 | С | N | С | Н | 469,54 | 170 | |
| 1.43 | С | N | С | -(СН2)2OCH3 | Н | 455,52 | 67 |
| 1.44 | С | N | С | Н | 483,57 | 86 | |
| 1.45 | С | N | С | Н | 497,6 | 86 | |
| 1.46 | С | N | С | Н | 483,57 | 66 | |
| 1.47 | С | N | С | Н | 495,58 | 148 | |
| 1.48 | С | N | С | Н | 517,58 | 78 | |
| 1.49 | С | N | С | Н | 517,58 | 91 | |
| 1.50 | С | N | С | Н | 471,51 | 85 | |
| 1.51 | С | N | С | Н | 497,59 | 98 | |
| 1.52 | С | N | С | СН2CF3 | Н | 479,46 | 96 |
| 1.53 | С | N | С | Н | 495,58 | 127 | |
| 1.54 | С | N | С | Н | 497,59 | 96 |
| Пример № | А | В | D | R2 | R3 | ММ | tпл [°С]/молярныи пик в МС (m/е) | |
| 1.55 | С | N | С | Н | 469,54 | 78 | ||
| 1.56 | С | N | С | Н | 469,54 | 78 | ||
| 1.57 | С | N | С | Н | 510,59 | |||
| 1.58 | С | N | С | Н | 524,62 | |||
| 1.59 | С | N | С | Н | 469,54 | |||
| Пример № | А | B | D | R2 | R3 | ММ | tпл [°С]/молярный пик в МС (m/е) | |
| 1.60 | С | С | N | -СН(СН2OH)2 | Н | 488,46 | 97 | |
| 1.61 | С | С | N | -(СН2)3ОН | Н | 500,52 | 125 | |
| 1.62 | С | С | N | -(СН2)2-ОМе | Н | 472,46 | 67 | |
| 1.63 | С | С | N | -(СН2)5OH | Н | 500,52 | 92 | |
| 1.64 | С | С | N | -(СН2)4OH | Н | 486,49 | 73 | |
| 1.65 | С | С | N | Н | 472,46 | 82 | ||
| 1.66 | С | С | N | Н | 472,46 | 73 | ||
| 1.67 | С | С | N | Н | 472,46 | 87 | ||
| 1.68 | С | С | N | Н | 472,46 | 93 | ||
| 1.69 | С | С | N | Н | 486,49 | 67 | ||
| 1.70 | С | С | N | Н | 500,52 | 67 | ||
| 1.71 | С | С | N | -(СН2)2Н(СН3)2 | Н | 485,51 | 82 | |
| 1.72 | С | С | N | -(CH2)3N(CH3)2 | Н | 499,53 | 74 | |
| Пример № | А | B | D | R2 | R3 | MM | tпл [°С]/молярный пик в МС (m/е) | |
| 1.73 | С | С | N | Н | 491,47 | 142 | ||
| 1.74 | С | С | N | Н | 491,47 | 104 | ||
| 1.75 | С | С | N | Н | 491,47 | 73 | ||
| Пример № | A | В | D | Z | ММ | tпл [°С]/молярный пик в МС (m/е) | ||
| 1.76 | С | N | С | -СН3 | 480,57 | 99 | ||
| Пример № | А | В | D | R2 | R3 | ММ | tпл [°С]/молярный пик в МС (m/е) | |
| 1.77 | С | N | С | Н | 473,50 | |||
| 1.78 | С | N | С | Н | 473,50 | |||
| 1.79 | С | N | С | Н | 473,50 | |||
| 1.80 | С | N | С | Н | 473,50 | |||
| 1.81 | С | N | С | -(CH2)3N(CH3)2 | Н | 486,54 | ||
| Пример № | А | B | D | R2 | R3 | ММ | tпл [°С]/молярный пик в МС (m/e) |
| 1.82 | С | С | N | -(СН2)3ОН | Н | 500,52 | 80 |
| 1.83 | С | С | N | Н | 472,46 | 50 | |
| 1.84 | С | С | N | Н | 472,46 | 83 | |
| 1.85 | С | С | N | Н | 472,46 | 129 | |
| 1.86 | С | С | N | Н | 491,47 | 150 | |
| 1.87 | С | С | N | Н | 491,47 | 148 | |
| 1.88 | С | С | N | -(СН2)5OH | Н | 500,52 | 101 |
| 1.89 | С | С | N | -СН(СН2OH)2 | Н | 488,46 | 144 |
| 1.90 | С | С | N | -(CH2)3N(CH3)2 | Н | 499,53 | 117 |
| 1.91 | С | С | N | -(СН2)2-ОМе | Н | 472,46 | 54 |
| 1.92 | С | С | N | Н | 491,47 | 121 | |
| 1.93 | С | С | N | -(СН2)2Н(СН3)2 | Н | 485,51 | 139 |
| 1.94 | С | С | N | Н | 500,52 | 70 | |
| 1.95 | С | С | N | Н | 486,49 | 88 | |
| 1.96 | С | С | N | Н | 472,46 | 76 | |
| 1.97 | С | С | N | -(СН2)4OH | Н | 488,52 | |
| Пример № | А | B | D | R1 | R2 | R3 | ММ | tпл [°С]/молярный пик в МС (m/e) |
| 1.98 | С | N | С | Н | 459,50 | |||
| 1.99 | С | N | С | Н | 458,51 | |||
| 1.100 | С | N | С | Н | 458,51 | |||
| 1.101 | С | N | С | Н | 444,49 | |||
| 1.102 | С | N | С | Н | 444,49 | |||
| 1.103 | С | N | С | Н | 458,51 | |||
| 1.104 | С | N | С | Н | 458,51 | |||
| 1.105 | С | N | С | Н | 444,49 | |||
| 1.106 | С | N | С | Н | 444,49 | |||
| Пример № | А | B | D | R1 | R2 | R3 | MM | tпл [°С]/молярный пик в МС (m/e) |
| 1.107 | С | N | С | H | 459,50 | 160,7 | ||
| 1.108 | С | N | С | H | 459,50 | 123,8 | ||
| 1.109 | С | N | С | H | 459,50 | 123 | ||
| 1.110 | С | N | С | H | 459,50 | |||
| 1.111 | С | N | С | H | 502,52 | 199,2 | ||
| 1.112 | С | N | С | H | 502,52 | 180,4 | ||
| 1.113 | С | N | С | H | 502,52 | |||
| 1.114 | С | N | С | H | 499,56 | |||
| 1.115 | С | N | С | H | 499,56 | 174 | ||
| 1.116 | С | N | С | H | 499,56 | 173,8 | ||
| 1.117 | С | N | С | H | 458,51 | |||
| 1.118 | С | N | С | H | 458,51 | |||
| Пример № | А | В | D | R1 | R2 | R3 | MM | tпл [°С]/молярный пик в МС (m/e) |
| 1.119 | С | N | С | H | 458,51 | |||
| 1.120 | С | N | С | H | 458,51 | |||
| 1.121 | С | N | С | H | 444,49 | |||
| 1.122 | С | N | С | H | 444,49 | |||
| 1.123 | С | N | С | H | 444,49 | |||
| 1.124 | С | N | С | H | 444,49 | |||
| 1.125 | С | N | С | H | 502,52 |
Пример 2.0
Получение пиридин-3-иламида 5-{[2-(изохинолин-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
120 мг (0,3 ммоля) 5-{[2-(изохинолин-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты растворяют в атмосфере аргона в 5 мл абсолютного диметилформамида, смешивают с 56 мг (0,6 ммоля) 3-аминопиридина, 76 мг (0,75 ммоля) N-метилморфолина и 136 мг (0,36 ммоля) гексафторфосфата O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (ГАТУ) и в течение 48 ч перемешивают при комнатной температуре. Затем концентрируют в вакууме и остаток хроматографируют на колонке для экспресс-хроматографии (5 г материала Isolute flash silica, фирма Sepostis) путем градиентного элюирования, используя в качестве элюента метиленхлорид:этанол в соотношении 100:0-95:5. В результате получают пиридин-3-иламида 5-{[2-(изохинолин-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты.
МС (m/е 474).
По аналогичной методике получают также следующие соединения:
| Пример № | А | В | D | R2 | R3 | ММ | tпл [°С]/молярный пик в МС (m/е) |
| 2.1 | С | С | N | Н | 474,52 | 474 (m/e) | |
| 2.2 | С | С | N | Н | 474,52 | 474 (m/e) | |
Пример 3.0
Получение амида 5-{[2-(2-оксо-2,3-дигидро-1Н-индол-5-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
36 мг (0,09 ммоля) 2-[(6-цианопиридин-3-илметил)амино]-N-(2-оксо-2,3-дигидро-1Н-индол-5-ил)бензамида смешивают в 1 мл диметилсульфоксида с 30 мг (0,22 ммоля) карбоната калия и 0,05 мл (0,42 ммоля) пероксида водорода (30%-ного) и в течение 3,5 ч перемешивают при комнатной температуре. Затем разбавляют водой и экстрагируют этиловым эфиром уксусной кислоты.
Органическую фазу промывают, сушат, фильтруют и концентрируют. Остаток разделяют путем перемешивания с теплым метанолом. В результате получают 5 мг (11% от теории) амида 5-{[2-(2-оксо-2,3-дигидро-1Н-индол-5-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты.
По аналогичной методике получают также следующие соединения:
Пример 3.1
Амид 4-{[2-(7-метокси-3-метилхинолин-2-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
Пример 3.2
Амид 4-{[2-(7-метокси-2-оксо-2Н-хромен-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
Пример 3.3
Амид 5-{[2-(7-метокси-2-оксо-2Н-хромен-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
Пример 3.4
Амид 5-{[2-(7-метокси-3-метилхинолин-2-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
Пример 3.5
Амид 4-{[2-(изохинолин-3-илкарбамоил)-6-азафениламино]метил}пиридин-2-карбоновой кислоты
Пример 3.6
Амид 5-{[2-(2-оксо-2,3-дигидро-1Н-индол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
Пример 3.7
Амид 4-{[2-(2-метил-2Н-индазол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
Пример 3.8
Амид 4-{[2-(1Н-индазол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
Пример 3.9
Амид 4-{[2-(1-метил-1Н-индазол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
Пример 3.10
Амид 5-{[2-(изохинолин-3-илкарбамоил)-6-азафениламино]метил}пиридин-2-карбоновой кислоты
Пример 3.11
Амид 4-{[2-(2-оксо-2,3-дигидро-1Н-индол-5-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
Пример 4.0
Получение N-трет-бутиламида 4-{[2-(изохинолин-3-илкарбамоил)-6-азафениламино]метил}пиридин-2-карбоновой кислоты
В 5 мл толуола в атмосфере защитного газа и исключая доступ влаги 72 мг (0,5 ммоля) 3-аминоизохинолина смешивают с 0,25 мл триметилалюминия (0,5 ммоля, 2-молярного в толуоле) и в течение 30 мин перемешивают при комнатной температуре. Затем добавляют 120 мг (0,45 ммоля) метилового эфира 2-[(2-трет-бутилкарбамоилпиридин-4-илметил)амино]никотиновой кислоты и в течение 2 ч нагревают до 120°С. После охлаждения смешивают с 30 мл разбавленного раствора гидрокарбоната натрия и трижды экстрагируют этиловым эфиром уксусной кислоты его порциями по 30 мл. Собранную уксусноэфирную фазу промывают водой, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле, используя в качестве элюента метиленхлорид: этанол в соотношении 95:5. После повторной хроматографии на силикагеле, используя в качестве элюента гексан: этиловый эфир уксусной кислоты в соотношении 1:1, получают 70 мг (30% от теории) N-трет-бутиламида 4-{[2-(изохинолин-3-илкарбамоил)-6-азафениламино]метил}пиридин-2-карбоновой кислоты с температурой плавления 201°С.
Пример 5.0
Получение (2-гидроксипропил)амида 4-{[2-(изохинолин-3-илкарбамоил)-6-азафениламино]метил}пиридин-2-карбоновой кислоты
283 мг (1 ммоль) 2-хлор-N-изохинолин-3-илникотинамида смешивают в 5 мл пиридина с примерно 1,66 ммоля (2-гидроксипропил)амида 4-аминометилпиридин-2-карбоновой кислоты и в течение 2 ч нагревают до 100°С. После концентрирования растворяют в воде и трижды экстрагируют встряхиванием с этиловым эфиром уксусной кислоты его порциями по 30 мл. Собранную органическую фазу промывают водой, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле, используя в качестве элюента метиленхлорид: ацетон в соотношении 1:1. В результате получают 40 мг (9% от теории) (2-гидроксипропил)амида 4-{[2-(изохинолин-3-илкарбамоил)-6-азафениламино]метил}пиридин-2-карбоновой кислоты в виде смолы.
Пример 6.0
Получение амида N-(изохинолин-3-ил)-2-[3-(пиридин-3-ил)пиридин-4-илметиламино]бензойной кислоты
94 мг (0,22 ммоля) амида N-(изохинолин-3-ил)-2-[3-бромпиридин-4-илметиламино]бензойной кислоты последовательно смешивают в 3,7 мл толуола с 0,73 мл этанола, 0,36 мл 2-молярного раствора карбоната натрия, 6 мг палладий(0)тетракистрифенилфосфина и 32 мг пиридин-3-бороновой кислоты и в течение 6,5 ч нагревают до температуры бани 120°С. Затем водой разбавляют до объема 25 мл и трижды экстрагируют этиловым эфиром уксусной кислоты его порциями по 25 мл. Собранную уксусноэфирную фазу сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле с использованием в качестве элюента метиленхлорида и этанола в соотношении 10:1. В результате получают 45 мг (47% от теории) амида N-(изохинолин-3-ил)-2-[3-(пиридин-3-ил)пиридин-4-илметиламино]бензойной кислоты в виде смолы.
1H-ЯМР (d6-ДМСО): 10,68 (s, 1Н), 9,21 (s, 1H), 8,72 (s, 1H), 8,64 (d, J=3,8, 1H), 8,57 (d, J=5,1, 1H), 8,54 (s, 1H), 8,48 (s, 1H), 8,11-7,94 (m, 4H), 7,85 (d, J=7,6, 1H), 7,74 (t, J≈7,3, 1H), 7,59-7,47 (m, 3H), 7,23 (t, J≈7,5, 1H), 6,63 (t, J=7,5, 1H), 6,39 (d, J=8,3, 1H), 4,45 (d, J=5,0, 2H).
MC (CI-NH3): 432 (80%, [M+H]+).
Пример 6.1
Получение амида N-(изохинолин-3-ил)-2-[3-(тиен-3-ил)пиридин-4-илметиламино]бензойной кислоты
По аналогичной методике получают также амид N-(изохинолин-3-ил)-2-[3-(тиен-3-ил)пиридин-4-илметиламино]бензойной кислоты
MC (CI-NH3): 437 (100%, [M+H]+).
Пример 6.2
Получение амида N-(изохинолин-3-ил)-2-[2-аминокарбонилпиридин-4-илметиламино]бензойной кислоты
130 мг (0,34 ммоля) амида N-(изохинолин-3-ил)-2-[2-цианопиридин-4-илметиламино]бензойной кислоты смешивают в 2,5 мл диметилсульфоксида со 126 мг карбоната калия и 0,25 мл пероксида водорода (30%-ного) и в течение 1 ч перемешивают при комнатной температуре. Затем смешивают с водой и выпавший в осадок продукт отделяют вакуум-фильтрацией. Остаток размешивают в смеси из метиленхлорида и этанола и отделяют вакуум-фильтрацией. В результате получают 96 мг (71% от теории) амида N-(изохинолин-3-ил)-2-[2-аминокарбонилпиридин-4-илметиламино]бензойной кислоты с температурой плавления 200°С.
1H-ЯМР (d6-ДМСО): 10,73 (s, 1Н), 9,22 (s, 1H), 8,60 (s, 1H), 8,56 (d, J=4,7, 1H), 8,25 (шир.s, 1H), 8,10-8,04 (m, 3H), 7,95 (d, J=8,0, 1H), 7,88 (d, J=6,9, 1H), 7,74 (t, J≈7,4, 1H), 7,63-7,57 (m, 3H), 7,25 (t, J≈7,0, 1H), 6,64 (t, J≈7,5, 1H), 6,54 (d, J=8,4, 1H), 4,62 (шир.d, J=5,5, 2H).
MC (EI): 397 (38%, [M]+).
Пример 6.3
Получение амида N-(изохинолин-3-ил)-2-[(2-аминокарбонилпиридин-5-ил)метиламино]бензойной кислоты
По аналогичной методике получают также амид N-(изохинолин-3-ил)-2-[(2-аминокарбонилпиридин-5-ил)метиламино]бензойной кислоты
MC (ESI): 398 (78%, [М+Н]+).
Пример 6.4
Получение амида N-(изохинолин-3-ил)-2-[(2-метоксикарбонилпиридин-4-ил)метиламино]бензойной кислоты
20 мг (0,05 ммоля) амида N-(изохинолин-3-ил)-2-[2-бромпиридин-4-илметиламино]бензойной кислоты, 1,6 мг (0,003 ммоля) бис(дифенилфосфин)ферроцена (ДФФФ), 0,35 мг (0,0015 ммоля) ацетата палладия(II), 14 мкл (0,1 ммоля) триэтиламина суспендируют в смеси из 1 мл метанола и 1 мл диметилформамида и в течение 5 ч перемешивают в автоклаве в атмосфере СО (3 бара) при 50°С. Затем реакционную смесь фильтруют через мембранный фильтр, концентрируют и в завершение хроматографируют на силикагеле, используя в качестве элюента гексан: EtOAc в соотношении 3:7. В результате получают 12 мг (58% от теории) амида N-(изохинолин-3-ил)-2-[(2-метоксикарбонилпиридин-4-ил)метиламино]бензойной кислоты.
1H-ЯМР (CDCl3): 9,12 (шир.s, 1H), 8,94 (s, 1Н), 8,67 (s, 1H), 8,61 (d, J=5,1, 1H), 8,36 (шир.s, 1H), 8,09 (s, 1H), 7,87 (d, J=8,5, 1H), 7,81 (d, J=8,5, 1H), 7,71 (d, J=7,7, 1H), 7,64 (t, J≈7,8, 1H), 7,49-7,44 (m, 2H), 7,24-7,19 (m, 1H), 6,68 (t, J≈7,8, 1H), 6,42 (d, J=8,0, 1H), 4,50 (шир.s, 2H), 3,93 (s, 3H).
MC (ESI): 413 (100%, [M+H]+).
Пример 6.5
Получение амида N-(изохинолин-3-ил)-2-[(2-бензилоксикарбонилпиридин-4-ил)метиламино]бензойной кислоты
По аналогичной методике получают также амид N-(изохинолин-3-ил)-2-[(2-бензилоксикарбонилпиридин-4-ил)метиламино]бензойной кислоты
1H-ЯМР (CDCl3): 9,00 (s, 1H), 8,76 (шир.s, 1H), 8,68 (d, J=5,0, 1H), 8,66 (s, 1H), 8,39 (t, J≈6,1, 1H), 8,14 (s, 1H), 7,91 (d, J=7,9, 1H), 7,85 (d, J=8,0, 1H), 7,69-7,62 (m, 2H), 7,53-7,46 (m, 4H), 7,38-7,25 (m, 4H), 6,73 (t, J≈7,2, 1H), 6,48 (d, J=7,8, 1H), 5,44 (s, 2H), 4,56 (d, J=6,0, 2H).
MC (CI-NH3): 489 (85%, [M+H]+).
Пример 6.6
Получение амида N-(изохинолин-3-ил)-2-[(2-гидроксикарбонилпиридин-4-ил)метиламино]бензойной кислоты
а) 20 мг (0,05 ммоля) амида N-(изохинолин-3-ил)-2-[(2-метоксикарбонилпиридин-4-ил)метиламино]бензойной кислоты смешивают в смеси из 1 мл тетрагидрофурана и 1 мл метанола с 10,2 мг (0,25 ммоля) гидроксида лития в воде и в течение 4 ч перемешивают при 22°С. Затем реакционную смесь фильтруют через мембранный фильтр, концентрируют и хроматографируют на силикагеле, используя в качестве элюента толуол, уксусную кислоту и воду в соотношении 10:10:1. В результате получают 14 мг (69% от теории) амида N-(изохинолин-3-ил)-2-[(2-гидроксикарбонилпиридин-4-ил)метиламино]бензойной кислоты.
б) 433 мг (1 ммоль) амида N-(изохинолин-3-ил)-2-[(2-бромпиридин-4-ил)метиламино]бензойной кислоты, 50 мг (0,09 ммоля) бис(дифенилфосфин)ферроцена (ДФФФ), 10 мг (0,045 ммоля) ацетата палладия(II), 280 мкл (2 ммоля) триэтиламина суспендируют в смеси из 5 мл воды и 10 мл диметилформамида и в течение 5 ч перемешивают в автоклаве в атмосфере СО (3 бара) при 50°С. Затем реакционную смесь фильтруют через мембранный фильтр, концентрируют, растворяют в дихлорметане, смешивают с активированным углем, нагревают, фильтруют и концентрируют. Полученное твердое вещество перекристаллизовывают из дихлорметана. В результате получают 283 мг (71% от теории) амида N-(изохинолин-3-ил)-2-[(2-гидроксикарбонилпиридин-4-ил)метиламино]бензойной кислоты.
1H-ЯМР (d6-DMSO): 10,73 (s, 1H), 9,22 (s, 1H), 8,63 (d, J=4,9, 1H), 8,60 (s, 1H), 8,22 (шир.t, J≈6,0, 1H), 8,10 (d, J=8,0, 1H), 8,04 (s, 1H), 7,94 (d, J=8,1, 1H), 7,87 (d, J=6,8, 1H), 7,74 (t, J≈7,5, 1H), 7,60-7,54 (m, 2H), 7,25 (t, J≈7,0, 1H), 6,65 (t, J≈7,6, 1H), 6,54 (d, J=8,4, 1H), 4,62 (шир.d, J=5,5, 2H). Протон не наблюдается или закрыт.
МС (CI-NH3): 399 (75%, [М+Н]+).
Температура плавления: 185°С.
Пример 6.7
Получение амида N-(изохинолин-3-ил)-2-[(2-морфолинокарбонилпиридин-4-ил)метиламино]бензойной кислоты
Смесь из 40 мг (0,1 ммоля) амида N-(изохинолин-3-ил)-2-[(2-гидроксикарбонилпиридин-4-ил)метиламино]бензойной кислоты и 9 мкл (0,1 ммоля) морфолина в 1 мл диметилформамида порциями смешивают с 34 мг (0,2 ммоля) карбонилдиимидазола. После 4-часового перемешивания при 22°С смесь концентрируют, остаток растворяют в 5 мл дихлорметана, промывают 1-молярным водным раствором карбоната калия (2 мл), сушат над MgSO4, фильтруют и концентрируют. В результате получают бесцветную смолу (38 мг, 81% от теории).
1Н-ЯМР (CDCl3): 9,02 (s, 1H), 8,71 (шир.s, 1H), 8,64 (s, 1H), 8,51 (d, J=5,1, 1H), 8,36 (t, J≈6,0, 1H), 8,01 (s, 1H), 7,93-7,82 (m, 2H), 7,69-7,64 (m, 2H), 7,50 (t, J≈7,8, 1H), 7,39 (d, J=6,1, 1H), 7,28-7,20 (m, 1H), 6,73 (t, J≈7,8, 1H), 6,52 (d, J=8,1, 1H), 4,55 (d, J=6,0, 2H), 3,79-3,62 (m, 8H).
MC (EI): 467 (15%, [M+H]+).
Пример 6.8
Получение амида N-(изохинолин-3-ил)-2-[(3-триметилсилилэтинилпиридин-4-ил)метиламино]бензойной кислоты
108 мг (0,25 ммоля) амида N-(изохинолин-3-ил)-2-[(3-бромпиридин-4-ил)метиламино]бензойной кислоты смешивают в 1 мл диметилформамида с 1 мл триэтиламина, 5 мг (0,026 ммоля) иодида меди(I), 9 мг (0,008 ммоля) палладийтетракистрифенилфосфина и 0,07 мл триметилсилилацетилена и затем в атмосфере аргона, исключая при этом доступ влаги, нагревают в течение 3,5 ч до температуры бани 70°С. Далее примешивают 40 мл воды и трижды экстрагируют этиловым эфиром уксусной кислоты его порциями по 25 мл. Уксусноэфирную фазу промывают водой, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле, используя в качестве элюента этиловый эфир уксусной кислоты:гексан в соотношении 1:1. В результате получают 38 мг (33,6% от теории) амида N-(изохинолин-3-ил)-2-[(3-триметилсилилэтинилпиридин-4-ил)метиламино]бензойной кислоты в виде аморфного твердого вещества.
1H-ЯМР (d6-ДМСО): 10,71 (s, 1H), 9,22 (s, 1H), 8,62 (s, 1H), 8,58 (s, 1H), 8,49 (d, J=4,9, 1H), 8,21 (шир.t, J≈6,1, 1H), 8,09 (d, J=8,2, 1H), 7,92 (d, J=8,0, 1H), 7,88 (d, J=7,9, 1H), 7,74 (t, J≈8,0, 1H), 7,57 (t, J≈7,7, 1H), 7,40 (d, J=5,1, 1H), 7,28 (t, J≈7,5, 1H), 6,65 (t, J≈7,7, 1H), 6,54 (d, J=8,1, 1H), 4,58 (d, J=6,0, 2H), 0,27 (s, 3H).
MC (EI): 450 (105%, [M]+).
Пример 6.9
Получение амида N-(изохинолин-3-ил)-2-[(2-триметилсилилэтинилпиридин-4-ил)метиламино]бензойной кислоты
По методике, аналогично описанной в примере 9, получают также амид N-(изохинолин-3-ил)-2-[(2-триметилсилилэтинилпиридин-4-ил)метиламино]бензойной кислоты
Получение исходных и промежуточных соединений
Если получение промежуточных соединений не описывается, то подразумевается, что эти соединения известны либо их можно получать аналогично известным соединениям или с помощью описанных в настоящей заявке способов.
Пример А
Стадия 1 способа
А-1) Получение 2-бромпиридин-5-карбальдегида
2-бромпиридин-5-карбальдегид получают по методу, описанному F.J.Romero-Salguerra и др. в THL 40 (1999), с.859.
А-2) Получение 2-бромизоникотиновой кислоты
160 г (0,93 моля) 2-бром-4-метилпиридина по каплям добавляют к 152 г (0,96 моля) перманганата калия в 4 л воды. Затем после одночасового перемешивания с обратным холодильником повторно добавляют 152 г (0,96 моля) перманганата калия. После дальнейшего 2-часового перемешивания с обратным холодильником фильтруют в горячем состоянии через целит и промывают водой. Водную фазу трижды экстрагируют встряхиванием с дихлорметаном. Затем водную фазу концентрируют до половины ее объема и с помощью концентрированной соляной кислоты рН устанавливают на значение 2. Выпавшее в осадок твердое вещество отделяют вакуум-фильтрацией и при 70°С сушат в вакууме. В результате получают 56,5 г (28% от теории) 2-бромизоникотиновой кислоты в виде твердого продукта белого цвета.
А-3) Получение 2-бром-4-гидроксиметилпиридина
К 56,5 г (280 ммолей) 2-бромизоникотиновой кислоты в 1,2 л тетрагидрофурана (ТГФ) добавляют 30,2 мл (295 ммолей) триэтиламина. Затем охлаждают до -10°С и по каплям смешивают с 38,2 мл (295 ммолей) изобутилового эфира хлормуравьиной кислоты. После одночасового перемешивания при -10°С смесь охлаждают до -70°С и по каплям смешивают с 590 мл (590 ммолей) раствора алюмогидрида лития (LiAlH4) (1-молярного в ТГФ). После одночасового перемешивания при -70°С температуре дают повыситься до -40°С. Далее добавляют 600 мл 50%-ной уксусной кислоты. В течение ночи перемешивают при комнатной температуре. Нерастворимые компоненты отделяют вакуум-фильтрацией и фильтрат концентрируют. Остаток очищают на силикагеле гексаном и гексаном/этиловым эфиром уксусной кислоты в соотношении 1:1. В результате получают 28,0 г (55% от теории) 2-бром-4-гидроксиметилпиридина в виде затвердевающегося масла белого цвета.
А-4) Получение 2-бром-4-формилпиридина
К 28,0 г (148,9 ммоля) 2-бром-4-гидроксиметилпиридина в 500 мл дихлорметана добавляют в течение 6 ч 149 г (1714 ммолей) пиролюзита. Затем в течение 48 ч перемешивают при комнатной температуре. Далее отделяют вакуум-фильтрацией через целит и концентрируют. В результате получают 16,4 г (60% от теории) 2-бром-4-формилпиридина в виде затвердевающегося масла белого цвета.
Стадия 2 способа
А-5) Получение 2-[(6-бромпиридин-3-илметил)амино]-N-изохинолин-3-илбензамида
3,46 г (13,17 ммоля) 2-амино-N-изохинолин-3-илбензамида предварительно помещают в 50 мл метанола, затем смешивают с 1,5 мл ледяной уксусной кислоты и 2,45 г (13,17 ммоля) 2-бромпиридин-5-карбальдегида, после чего в течение 24 ч перемешивают при комнатной температуре в атмосфере аргона, исключая при этом доступ влаги. Далее примешивают 828 мг (13,17 ммоля) цианборогидрида натрия и продолжают перемешивание при комнатной температуре в течение последующих 24 ч. После концентрирования под вакуумом остаток растворяют в разбавленном растворе гидрокарбоната натрия и отделяют вакуум-фильтрацией. Полученный остаток размешивают в небольшом количестве этилового эфира уксусной кислоты и повторно отделяют вакуум-фильтрацией. Полученный таким путем остаток хроматографируют на силикагеле, используя в качестве элюента гексан и этиловый эфир уксусной кислоты в соотношении 1:1. В результате получают 3,27 г (57% от теории) 2-[(6-бромпиридин-3-илметил)амино]-N-изохинолин-3-илбензамида.
А-6) Получение амида N-(изохинолин-3-ил)-2-[3-бромпиридин-4-илметиламино]бензойной кислоты
263 мг (1 ммоль) амида N-(изохинолин-3-ил)-2-аминобензойной кислоты последовательно смешивают в 6 мл МеОН с 0,06 мл ледяной уксусной кислоты, 298 мг (1,6 ммоля) 3-бромпиридин-4-карбальдегида (получение согласно Tetrahedron 2000, с.347) и в течение 24 ч перемешивают при комнатной температуре. Затем добавляют 100 мг (1,6 ммоля) цианборогидрида натрия и продолжают перемешивание в течение последующих 24 ч. Далее примешивают 50 мл разбавленного раствора гидрокарбоната натрия и выпавший в осадок продукт отделяют вакуум-фильтрацией. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси метиленхлорида и этанола в соотношении 95:5. В результате получают амид ЧМ-(изохинолин-3-ил)-2-[3-бромпиридин-4-илметиламино]бензойной кислоты в виде смолы. Используемый в реакции 3-бромпиридин-4-карбальдегид получают по методу, описанному в Chem. Pharm. Bull., 38 (1970), с.2446.
По аналогичной методике получают также следующие соединения:
А-7) 2-[(2-бромпиридин-4-илметил)амино]-N-изохинолин-3-илбензамид
1H-ЯМР (CDCl3): 9,00 (s, 1H), 8,78 (s, 1H), 8,66 (s, 1H), 8,35 (t, J≈5,7, 1H), 8,30 (d, J=5,1, 1H), 7,92 (d, J=8,1, 1H), 7,86 (d, J=8,5, 1H), 7,70-7,65 (m, 2H), 7,53-7,48 (m, 2H), 7,33-7,26 (m, 2H), 6,75 (t, J≈7,8, 1H), 6,48 (d, J=8,5, 1H), 4,48 (d, J=5,9, 2H).
МС (Cl, NH3): 435 (100%), 433 (100%).
А-8) 2-[(2-бромпиридин-4-илметил)амино]-N-(2-оксо-2,3-дигидро-1Н-индол-6-ил)бензамид
A-9) 2-[(2-бромпиридин-4-илметил)амино]-N-(2-оксо-2,3-дигидро-1Н-индол-5-ил)бензамид
A-10) 2-[(6-бромпиридин-3-илметил)амино]-N-(2-оксо-2,3-дигидро-1Н-индол-6-ил)бензамид
A-11) 2-[(6-бромпиридин-3-илметил)амино]-N-(2-оксо-2,3-дигидро-1Н-индол-5-ил)бензамид
А-12) 2-[(6-бромпиридин-3-илметил)амино]-N-(7-метокси-2-оксо-2H-хромен-3-ил)бензамид
А-13) 2-[(2-бромпиридин-4-илметил)амино]-N-(7-метокси-2-оксо-2Н-хромен-3-ил)бензамид
А-14а) 2-[(2-бромпиридин-4-илметил)амино]-N-(3-трифторметилфенил)бензамид
А-14б) 2-[(6-бромпиридин-3-илметил)амино]-N-(7-метокси-3-метилхинолин-2-ил)бензамид
Стадия 3 способа
А-15) Получение 5-{[2-(изохинолин-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты
3,27 г (7,55 ммоля) 2-[(6-бромпиридин-3-илметил)амино]-N-изохинолин-3-илбензамида смешивают в 75 мл диметилформамида с 2,2 мл триэтиламина, 36 мл воды, 362 мг (0,65 ммоля) бисдифенилфосфинферроцена и 75 мг (0,33 ммоля) ацетата палладия(II) и встряхивают в автоклаве в атмосфере моноксида углерода при давлении 3 бара и температуре 50°С в течение 3 ч. После охлаждения проводят на силикагеле вакуум-фильтрацию и фильтрат концентрируют. Остаток растворяют в воде, с помощью ледяной уксусной кислоты рН устанавливают на значение 5-6, отделяют вакуум-фильтрацией и осадок на фильтре промывают гексаном. В результате получают 3,35 г 5-{[2-(изохинолин-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновой кислоты, которую без дальнейшей очистки используют в последующей обменной реакции.
По аналогичной методике получают также следующие соединения:
А-16) 4-{[2-(изохинолин-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
A-17) 4-{[2-(2-оксо-2,3-дигидро-1H-индол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-18) 5-{[2-(2-оксо-2,3-дигидро-1H-индол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-19) 4-{[2-(2-оксо-2,3-дигидро-1H-индол-5-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-20) 5-{[2-(2-оксо-2,3-дигидро-1H-индол-5-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
A-21) 5-{[2-(7-метокси-2-оксо-2H-хромен-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-22) 4-{[2-(7-метокси-2-оксо-2H-хромен-3-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-23) 4-{[2-(7-метокси-3-метилхинолин-2-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-24) 5-{[2-(7-метокси-3-метилхинолин-2-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-25) 5-{[2-(1-метил-1H-индазол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
A-26) 4-{[2-(1-метил-1H-индазол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-27) 4-{[2-(2-метил-2H-индазол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-28) 5-{[2-(2-метил-2H-индазол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-29) 4-{[2-(3-трифторметилфенилкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
температура плавления 151°С;
А-30) 4-{[2-(1H-индазол-6-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
А-31) 4-{[2-(1H-индазол-5-илкарбамоил)фениламино]метил}пиридин-2-карбоновую кислоту
Пример Б
Стадия 1 способа
Б-1) Получение 5-нитро-1,3-дигидроиндол-2-она
5-нитро-1,3-дигидроиндол-2-он получают по методу R.T.Courts, описанному в Journ. Org. Chem. 48 (1970), с.3747.
Б-2) Получение метилового эфира динитрофенилуксусной кислоты
22,6 г (100 ммолей) 2,4-динитрофенилуксусной кислоты растворяют в смеси из 200 мл метанола и 830 мл толуола и при комнатной температуре смешивают с 83 мл триметилсилилдиазометана (2-молярном в толуоле, 166 ммолей) и затем в течение 3 ч перемешивают при комнатной температуре. После концентрирования досуха и сушки при 70°С под вакуумом получают 24 г (100% от теории) метилового эфира 2,4-динитрофенилуксусной кислоты.
Б-3) Получение 6-нитро-1,3-дигидроиндол-2-она
20 г (83 ммоля) метилового эфира 2,4-динитрофенилуксусной кислоты гидрируют в 400 мл ледяной уксусной кислоты с помощью 2,1 г палладия на угле (10%-ного) при давлении водорода 20 бар в течение 1,5 ч при комнатной температуре. После отфильтровывания катализатора концентрируют и интенсивно сушат над твердым гидроксидом калия под вакуумом. Остаток хроматографируют на силикагеле градиентным элюированием с использованием в качестве элюента смеси метиленхлорида и этанола в соотношении от 97,5:2,5 до 90:10. После перекристаллизации из этилового эфира уксусной кислоты получают 4 г (30% от теории) 6-нитро-1,3-дигидроиндол-2-она с температурой плавления 206°С.
Стадия 2 способа
Б-4) Получение 5-амино-1,3-дигидроиндол-2-она
356 мг 5-нитро-1,3-дигидроиндол-2-она гидрируют в 30 мл смеси тетрагидрофурана и этанола (соотношение 1:1) с помощью 400 мг палладия на угле (10%-ного) при комнатной температуре и нормальном давлении в течение 1 ч. После удаления катализатора вакуум-фильтрацией на кизельгуре и концентрирования получают 320 мг (100% от теории) 5-амино-1,3-дигидроиндол-2-она.
Б-5) Получение 6-амино-1,3-дигидроиндол-2-она
Аналогичным путем, исходя из соответствующего нитросоединения, получают 6-амино-1,3-дигидроиндол-2-он.
Стадия 3 способа
Б-6) 2-нитро-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)бензамид
В 1 мл диметилацетамида растворяют 320 мг 5-амино-1,3-дигидроиндол-2-она и по каплям смешивают с 371 мг (2 ммоля) 2-нитробензоилхлорида, при этом происходит небольшое повышение температуры. После перемешивания в течение ночи при комнатной температуре концентрируют под вакуумом и остаток растворяют в этиловом эфире уксусной кислоты и воде. После удаления вакуум-фильтрацией нерастворимых твердых веществ получают 130 мг (21,9% от теории) 2-нитро-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)бензамида. После экстракции встряхиванием органическую фазу промывают, фильтруют и концентрируют и в результате повторно получают 400 мг (67% от теории) 2-нитро-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)бензамида с температурой плавления 265°С.
Б-7) Получение 2-нитро-N-(2-оксо-2,3-дигидро-1H-индол-6-ил)бензамида
По методике, аналогичной стадии 1 способа, получают 2-нитро-N-(2-оксо-2,3-дигидро-1H-индол-6-ил)бензамида с температурой плавления >300°С.
Стадия 4 способа
Б-8) Получение амида 2-амино-N-(индол-2-он-5-ил)бензойной кислоты
По методике, аналогичной стадии 2 способа, получают также амид 2-амино-N-(индол-2-он-5-ил)бензойной кислоты с температурой плавления 219°С.
Б-9) Получение амида 2-амино-N-(индол-2-он-6-ил)бензойной кислоты
По методике, аналогичной стадии 2, получают также амид 2-амино-N-(индол-2-он-6-ил)бензойной кислоты с температурой плавления 230°С.
Пример В
В-1) Получение 2-амино-N-(7-метокси-2-оксо-2H-хромен-3-ил)бензамида
Стадия 1 способа
В-2) Получение 3-нитро-7-метоксихромен-2-она
13 г (85,4 ммоля) 2-гидрокси-4-метоксибензальдегида в течение 15 ч нагревают в 300 мл толуола с использованием водоотделителя вместе с 9,8 г (102,5 ммоля) н-пропиламингидрохлорида и 11,5 мл (102,5 ммоля) этилового эфира нитроуксусной кислоты и кипятят далее в течение 5 ч с использованием водоотделителя. После охлаждения разбавляют этиловым эфиром уксусной кислоты и экстрагируют встряхиванием с водой. Уксусноэфирную фазу сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле с помощью метиленхлорида в качестве элюента. В результате получают 6,14 г (33% от теории) 3-нитро-7-метоксихромен-2-она.
Стадия 2 способа
В-3) Получение 3-амино-7-метоксихромен-2-она
По методике, аналогичной стадии 2 способа из примера Б, исходя из 3-нитро-7-метоксихромен-2-она в этаноле получают 3-амино-7-метоксихромен-2-он.
Стадия 3 способа
В-4) Получение амида 2-нитро-N-(7-метоксибензопиран-2-он-3-ил)бензойной кислоты
По методике, аналогичной стадии 3 способа из примера Б, исходя из 2-нитробензоилхлорида и 3-амино-7-метоксихромен-2-она, а также 2-нитро-N-(7-метокси-2-оксо-2H-хромен-3-ил)бензамида получают амид 2-нитро-N-(7-метоксибензопиран-2-он-3-ил)бензойной кислоты.
Стадия 4 способа
В-5) Получение 2-амино-N-(7-метокси-2-оксо-2H-хромен-3-ил)бензамида
По методике, аналогичной стадии 2 способа из примера Б, исходя из 2-нитро-N-(7-метокси-2-оксо-2H-хромен-3-ил)бензамида в толуоле/тетрагидрофуране (соотношение 5:2) получают 2-амино-N-(7-метокси-2-оксо-2H-хромен-3-ил)бензамид.
Пример Г
Г-1) Получение 2-[(6-цианопиридин-3-илметил)амино]-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)бензамида
219 мг (0,5 ммоля) 2-[(6-бромпиридин-3-илметил)амино]-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)бензамида помещают в 7 мл диметилацетамида, добавляя 59 мг (0,5 ммоля) цианида цинка(II), 12 мг (0,013 ммоля) трис(дибензилиденацетон)дипалладия, 10 мг (0,018 ммоля) бис(дифенилфосфино)ферроцена и 4 мг (0,06 ммоля) цинкового порошка, и в атмосфере аргона, исключая при этом доступ влаги, перемешивают в течение 7,5 ч при температуре бани 150°С. После охлаждения смесь разбавляют водой, экстрагируют встряхиванием с этиловым эфиром уксусной кислоты и органическую фазу сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле путем градиентного элюирования с использованием в качестве элюента смеси метиленхлорид/этанол в соотношении от 97,5:2,5 до 90:10. В результате получают 65 мг (30% от теории) 2-[(6-цианопиридин-3-илметил)амино]-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)бензамида.
По аналогичной методике получают также следующее соединение:
Г-2) 2-[(6-цианопиридин-3-илметил)амино]-N-(7-метокси-2-оксо-2H-хромен-3-ил)бензамид
Пример Д
Стадия 1 способа
Д-1) Получение метилового эфира 2-хлорникотиновой кислоты
5,6 г 2-хлорникотиновой кислоты растворяют в 280 мл толуола и 80 мл метанола, смешивают с 37,4 мл (74,8 ммоля) триметилсилилдиазометана (2-молярного в гексане) и в течение 3 ч перемешивают при комнатной температуре. После концентрирования смеси получают 7 г (100% от теории) метилового эфира 2-хлорникотиновой кислоты.
Стадия 2 способа
Д-2) Получение метилового эфира 2-[(пиридин-4-илметил)амино]никотиновой кислоты
4,0 г (23,3 ммоля) метилового эфира 2-хлорникотиновой кислоты в течение 1,5 ч нагревают с 2,52 г (23,3 ммоля) 4-аминометилпиридина до температуры бани 100°С. После охлаждения разбавляют 100 мл разбавленного раствора гидрокарбоната натрия и трижды экстрагируют встряхиванием с этиловым эфиром уксусной кислоты его порциями по 50 мл. Объединенную органическую фазу промывают, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле, используя в качестве элюента смесь метиленхлорид/этанол в соотношении 10:1. В результате получают 1,36 г (24% от теории) метилового эфира 2-[(пиридин-4-илметил)амино]никотиновой кислоты.
По аналогичной методике получают также следующее соединение:
Д-3) метиловый эфир 2-[(пиридин-3-илметил)амино]никотиновой кислоты
Стадия 3 способа
Д-4) Получение метилового эфира 2-[(1-оксипиридин-4-илметил)амино]никотиновой кислоты
2,09 г (8,59 ммоля) метилового эфира 2-[(пиридин-4-илметил)амино]никотиновой кислоты смешивают в 150 мл метиленхлорида с 2,21 г (9,98 ммоля) м-хлорпербензойной кислоты и в течение 24 ч перемешивают при комнатной температуре. Затем примешивают 50 мл разбавленного раствора гидрокарбоната натрия, встряхивают, органическую фазу отделяют и трижды экстрагируют метиленхлоридом его порциями по 50 мл. Объединенную органическую фазу промывают, сушат, фильтруют и концентрируют. В результате получают 2,7 г (100% от теории) метилового эфира 2-[(1-оксипиридин-4-илметил)амино]никотиновой кислоты в виде масла.
По аналогичной методике получают также следующее соединение:
Д-5) метиловый эфир 2-[(1-оксипиридин-3-илметил)амино]никотиновой кислоты
Стадия 4 способа
Д-6) Получение метилового эфира 2-[(2-цианопиридин-4-илметил)амино]никотиновой кислоты
2,7 г (10,4 ммоля) метилового эфира 2-[(1-оксипиридин-4-илметил)амино] никотиновой кислоты в течение 8 ч нагревают в 52 мл диметилформамида в сосуде под давлением вместе с 3,15 г (31,2 ммоля) триэтиламина и 9,19 г (62,4 ммоля) триметилсилилцианида до температуры бани 110°С. После концентрирования под вакуумом остаток растворяют в 100 мл разбавленного раствора гидрокарбоната натрия и трижды экстрагируют этиловым эфиром уксусной кислоты его порциями по 100 мл. Объединенную органическую фазу промывают, сушат, фильтруют и концентрируют. Остаток хроматографируют на колонке для экспресс-хроматографии (50 г, материал Isoplute flash silica; фирма Separtis) путем градиентного элюирования с использованием в качестве элюента смеси метиленхлорид/этанол в соотношении от 100:0 до 95:5. В результате получают 1,31 г (47% от теории) метилового эфира 2-[(2-цианопиридин-4-илметил)амино]никотиновой кислоты.
По аналогичной методике получают также следующее соединение:
Д-7) Получение метилового эфира 2-[(6-цианопиридин-3-илметил)амино]никотиновой кислоты
При получении указанного соединения одновременно в небольшом количестве образуется также метиловый эфир 2-[(2-цианопиридин-3-илметил)амино]никотиновой кислоты.
Стадия 5 способа
Д-8) Получение 2-[(2-цианопиридин-4-илметил)амино]-N-изохинолин-3-илникотинамида
В 10 мл толуола в атмосфере аргона и исключая доступ влаги перемешивают в течение 30 мин при 4°С 277 мг (1,92 ммоля) 3-аминоизохинолина и 0,86 мл триметилалюминия (2-молярный раствор в толуоле). Затем добавляют 468 мг (1,74 ммоля) метилового эфира 2-[(2-цианопиридин-4-илметил)амино]никотиновой кислоты, после чего в течение 2 ч нагревают с обратным холодильником. Далее примешивают 30 мл разбавленного раствора гидрокарбоната натрия и трижды экстрагируют встряхиванием с этиловым эфиром уксусной кислоты его порциями по 30 мл. Объединенную органическую фазу промывают, сушат, фильтруют и концентрируют. Остаток хроматографируют на колонке для экспресс-хроматографии (20 г, материал Isolute flash silica, фирма Separtis) путем градиентного элюирования с использованием в качестве элюента смеси метиленхлорид/этанол в соотношении от 100:0 до 95:5. В результате получают 400 мг (60% от теории) 2-[(2-цианопиридин-4-илметил)амино]-N-изохинолин-3-илникотинамида.
Д-9) Получение амида N-(изохинолин-3-ил)-2-[2-цианопиридин-4-илметиламино]бензойной кислоты
920 г (2,5 ммоля) N-оксида амида N-(изохинолин-3-ил)-2-(4-пиридилметил)аминобензойной кислоты последовательно смешивают в стеклянном сосуде под давлением, куда предварительно помещают 20 мл диметилформамида, с 760 мг (7,5 ммоля) триэтиламина и 1,24 г (12,5 ммоля) триметилсилилцианида, после чего в течение 10 ч нагревают до температуры бани 110°С. Затем смесь разбавляют водой до объема порядка 200 мл и трижды экстрагируют встряхиванием с этиловым эфиром уксусной кислоты его порциями по 50 мл. Собранную органическую фазу промывают 50 мл воды, сушат, фильтруют и концентрируют. Остаток хроматографируют сначала на силикагеле, используя в качестве элюента смесь этиловый эфир/гексан в соотношении 1:1, а затем повторно на силикагеле, но используя в качестве элюента смесь дихлорметан/этанол в соотношении 100:2. В результате получают 132 мг (14% от теории) амида N-(изохинолин-3-ил)-2-[2-цианопиридин-4-илметиламино]бензойной кислоты в виде смолы.
Если получение промежуточных соединений не описывается, то, как указывалось выше, подразумевается, что эти соединения известны либо их можно получать аналогично известным соединениям или с помощью описанных в настоящей заявке способов.
По аналогичной методике получают также следующие соединения:
Д-10) 2-[(2-цианопиридин-3-илметил)амино]-N-изохинолин-3-илникотинамид
Д-11) 2-[(6-цианопиридин-3-илметил)амино]-N-изохинолин-3-илникотинамид
Пример Е
Стадия 1 способа
Е-1) Получение метилового эфира 2-[(2-бромпиридин-4-илметил)амино]бензойной кислоты
6,04 г (40 ммолей) метилового эфира антраниловой кислоты в 600 мл метанола смешивают с 3,2 мл уксусной кислоты и 7,4 г (40 ммолей) 2-бромпиридин-4-карбальдегида и в течение ночи перемешивают при 40°С. После добавления 3,8 г (60 ммолей) цианборогидрида натрия продолжают перемешивание в течение ночи при 40°С. Затем повторно добавляют 3,8 г (60 ммолей) цианборогидрида натрия и в течение выходных дней перемешивают при 40°С. Далее примешивают воду и концентрируют практически досуха. Водную фазу экстрагируют этиловым эфиром уксусной кислоты, объединенные органические фазы сушат, фильтруют и концентрируют. Сырой продукт хроматографируют на силикагеле путем градиентного элюирования с использованием в качестве элюента гексана и смеси гексан/этиловый эфир уксусной кислоты в соотношении 1:3 и смеси гексан/этиловый эфир уксусной кислоты в соотношении 1:1. В результате получают 10,0 г (78% от теории) метилового эфира 2-[(2-бромпиридин-4-илметил)амино]бензойной кислоты в виде бесцветного масла.
Стадия 2 способа
Е-2) Получение метилового эфира 2-[(2-пианопиридин-4-илметил)амино]бензойной кислоты
1,28 г (4,0 ммоля) метилового эфира 2-[(2-бромпиридин-4-илметил)амино]бензойной кислоты в 140 мл диметилацетамида смешивают с 0,532 г (4,56 ммоля) цианида цинка(II), 0,072 г (0,08 ммоля) трис(дибензилиденацетон)дипалладия, 0,088 г (0,16 ммоля) бис(дифенилфосфино)ферроцена и 0,029 г (0,46 ммоля) цинкового порошка. Далее перемешивают в течение 6 ч при 150°С. После охлаждения реакционную смесь сливают на воду. Затем трижды экстрагируют этиловым эфиром уксусной кислоты, объединенные органические фазы сушат над сульфатом натрия и концентрируют. Полученный продукт хроматографируют на силикагеле путем градиентного элюирования с использованием в качестве элюента смеси гексан/этиловый эфир уксусной кислоты в соотношении от 100:0 до 50:50. В результате получают 0,887 г (83% от теории) метилового эфира 2-[(2-цианопиридин-4-илметил)амино]бензойной кислоты в виде твердого вещества желтого цвета.
Стадия 3 способа
Е-3) Получение 2-[(2-цианопиридин-4-илметил)амино]-N-(7-метокси-3-метилхинолин-2-ил)бензамида
При 0°С 0,25 г триметилалюминия (2-молярного в толуоле) по каплям добавляют к 0,094 г (0,5 ммоля) 7-метокси-3-метилхинолин-2-иламина в 4 мл толуола. После 10-минутного перемешивания при 0°С по каплям добавляют 0,133 г (0,5 ммоля) метилового эфира 2-[(2-цианопиридин-4-илметил)амино]бензойной кислоты в 2 мл толуола. Затем в течение 2 ч перемешивают с обратным холодильником и в течение ночи при комнатной температуре. Осадок отделяют вакуум-фильтрацией и суспендируют в насыщенном растворе гидрокарбоната натрия. Затем добавляют этилендиаминтетрауксусную кислоту. Далее экстрагируют встряхиванием с этиловым эфиром уксусной кислоты, сушат над сульфатом натрия и концентрируют. После очистки колоночной хроматографией на силикагеле путем градиентного элюирования с использованием смеси гексан/ацетон в соотношении от 100:0 до 50:50 получают 0,113 г (54% от теории) 2-[(2-цианопиридин-4-илметил)амино]-N-(7-метокси-3-метилхинолин-2-ил)бензамида в виде пенистого вещества желтого цвета.
Пример Ж
Стадия 1 способа
Ж-1) Получение 2-[(2-бромпиридин-4-илметил)амино]бензойной кислоты
10,0 г (31,2 ммоля) метилового эфира 2-[(2-бромпиридин-4-илметил)амино]бензойной кислоты растворяют в 290 мл этанола и смешивают с 31,2 мл 2-молярного едкого натра. После перемешивания в течение ночи при комнатной температуре этанол удаляют, а водную фазу экстрагируют встряхиванием с этиловым эфиром уксусной кислоты. Водную фазу подкисляют концентрированной соляной кислотой. Образовавшийся осадок отделяют вакуум-фильтрацией и сушат. В результате получают 5,93 г (62% от теории) 2-[(2-бромпиридин-4-илметил)амино]бензойной кислоты в виде твердого вещества белого цвета.
Стадия 2 способа
Ж-2) Получение 2-[(2-бромпиридин-4-илметил)амино]-N-(2-метил-2H-индазол-6-ил)бензамида
0,500 г (1,6 ммоля) 2-[(2-бромпиридин-4-илметил)амино]бензойной кислоты, 0,471 г (3,2 ммоля) 2-метил-2H-индазол-6-иламина, 0,4 мл (3,68 ммоля) N-метилморфолина и 0,729 г (1,92 ммоля) гексафторфосфата О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (ГАТУ) в 25 мл диметилформамида перемешивают в течение 16 ч при комнатной температуре. Затем диметилформамид удаляют в вакууме, создаваемом масляным насосом. Образующийся остаток растворяют в насыщенном растворе гидрокарбоната натрия. Затем трижды экстрагируют этиловым эфиром уксусной кислоты и объединенные органические фазы сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле путем градиентного элюирования с использованием в качестве элюента смеси гексан/ацетон в соотношении от 100:0 до 50:50. В результате получают 0,669 г (96% от теории) 2-[(2-бромпиридин-4-илметил)амино]-N-(2-метил-2H-индазол-6-ил)бензамида в виде пенистого вещества бежевого цвета.
По аналогичной методике получают также следующие соединения:
Ж-3) 2-[(2-бромпиридин-4-илметил)амино]-N-(1-метил-1H-индазол-6-ил)бензамид
Ж-4) 2-[(2-бромпиридин-4-илметил)амино]-N-(1Н-индазол-6-ил)бензамид
Ж-5) 2-[(2-бромпиридин-4-илметил)амино]-N-(1Н-индазол-5-ил)бензамид
Ж-6) 2-[(2-бромпиридин-4-илметил)амино]-N-(2-оксо-2,3-дигидро-1H-индол-6-ил)бензамид
Ж-7) 2-[(2-бромпиридин-4-илметил)амино]-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)бензамид
З-1) 4-(трет-бутоксикарбониламинометил)пиридин-2-карбоновая кислота
4-(трет-бутоксикарбониламинометил)пиридин-2-карбоновую кислоту получают согласно Chem Eur. J. 2 (2000), с.216, исходя из трет-бутилового эфира (2-цианопиридин-4-илметил)карбаминовой кислоты.
З-2) Оптически активный трет-бутиловый эфир [2-(2-гидроксипропилкарбамоил)пиридин-4-илметил]карбаминовой кислоты
Оптически активный трет-бутиловый эфир [2-(2-гидроксипропилкарбамоил)пиридин-4-илметил]карбаминовой кислоты получают по способу, указанному в примере 2.0, исходя из 4-(трет-бутоксикарбониламинометил)пиридин-2-карбоновой кислоты и S-(+)-1-амино-2-пропанола с выходом 91%.
З-3) Оптически активный (2-гидроксипропил)амид 4-аминометилпиридин-2-карбоновой кислоты
480 мг (1,7 ммоля) трет-бутилового эфира [2-(2-гидроксипропилкарбамоил)пиридин-4-илметил]карбаминовой кислоты смешивают в 30 мл этанола с 17 мл 1 н. соляной кислоты и при пропускании потока азота в течение 3 ч нагревают до температуры бани 110°С. Затем смесь концентрируют под вакуумом, сушат и без дальнейшей очистки используют аналогично примеру 5.0.
З-4) 2-хлор-N-изохинолин-3-илникотинамид
2,9 г (20 ммолей) 3-аминоизохинолина суспендируют в 45 мл тетрагидрофурана и по каплям смешивают с раствором из 3,5 г (20 ммолей) 2-хлорникотиноилхлорида в 45 мл тетрагидрофурана. После перемешивания в течение ночи при комнатной температуре смесь отделяют вакуум-фильтрацией и остаток промывают тетрагидрофураном. Затем остаток взмучивают в воде и повторно отделяют вакуум-фильтрацией и сушат. В результате получают 3,14 г (55% от теории) 2-хлор-N-изохинолин-3-илникотинамида.
Ниже на примерах по применению, которые не ограничивают объем изобретения, более подробно поясняются биологическое действие предлагаемых соединений и их применение.
Использовавшиеся в опытах растворы
Исходные растворы:
исходный раствор А: 3 мМ АТФ в воде, рН 7,0 (-70°С),
исходный раствор Б: g-33 Р-АТФ 1 мКи/100 мкл,
исходный раствор В: поли(Glu4Тyr) 10 мг/мл в воде.
Раствор для разведений:
растворители субстратов: 10 мМ ДТТ, 10 мМ хлорид марганца, 100 мМ хлорид магния,
раствор фермента: 120 мМ трис/HCl, рН 7,5, 10 мкМ оксид натрийванадия.
Пример по применению 1
Подавление активности киназы KDR и FLT-1 в присутствии соединений по изобретению
В сужающийся по концам титрационный микропланшет (без связывания протеина) добавляют 10 мкл питательной смеси (исходный раствор А объемом 10 мкл АТФ +25 мкКи γ-33Р-АТФ (примерно 2,5 мкл исходного раствора Б) + исходный раствор В: 30 мкл поли(Glu4Тyr) +1,21 мл растворителя субстратов), 10 мкл раствора ингибитора (соединения в соответствии с разведениями, в качестве контроля служит 3%-ный раствор ДМСО в растворителе субстратов) и 10 мкл раствора фермента (11,25 мкг исходного раствора фермента (киназы KDR или FLT-1), разведенного при 4°С в 1,25 мл раствора фермента). Указанные ингредиенты тщательно перемешивают и в течение 10 мин инкубируют при комнатной температуре. Затем добавляют 10 мкл стоп-раствора (250 мМ ЭДТК, рН 7,0), перемешивают и 10 мкл раствора переносят на фосфоцеллюлозный фильтр типа Р 81, после чего несколько раз промывают в 0,1-молярной фосфорной кислоте. Фильтровальную бумагу сушат, покрывают слоем Meltilex и с помощью микросчетчика бета-частиц измеряют радиоактивность.
IC50-значения представляют собой величины, определяемые по концентрации ингибитора, необходимой для подавления встраивания фосфата на 50% от его встраивания в отсутствие ингибитора, за вычетом контрольного значения, полученного в результате слепого опыта (реакция, прекращенная с помощью ЭДТК).
Результаты ингибирования киназы (IC50-значения в нМ) представлены в нижеследующей таблице 1.
| Таблица 1 | |
| Пример № | VEGFR II (KDR) [нМ] |
| 1.32 | 40 |
Пример по применению 2
Ингибирование цитохрома Р450
Ингибирование цитохрома Р450 проводили в соответствии с публикацией авторов Crespi и др. (Anal. Biochem. 248 (1997), cc.188-190) с использованием экспрессируемых бакуловирусом/клетками насекомых изоферментов цитохрома Р450 (1А2, 2С9, 2С19, 3А4) человека.
Результаты представлены в нижеследующей таблице 2.
Ингибирование изоферментов цитохрома Р450 (IC50, мкМ)
| Таблица 2 | ||||
| Изофермент цитохрома Р450 | 1А2 | 2С9 | 2С19 | 3А4 |
| Пример 2.54 из заявки WO 00/27819 | 5,2 | 0,2 | 0,05 | 3,6 |
| Пример 1.32 | 30 | 2,9 | 4,9 | 25 |
Приведенные результаты однозначно подтверждают, что предлагаемые в изобретении соединения по своим свойствам превосходят известные соединения, т.е. предлагаемые в изобретении соединения проявляют в существенно меньшей степени ингибирующее действие детоксифицирующей системы цитохрома Р450 по сравнению с известными соединениями, что приводит к заметно ослабленному взаимодействию с другими действующими веществами.
Claims (8)
1. Соединения общей формулы I
в которой
А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце,
Е представляет собой арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий 5 или 6 кольцевых атомов и вместо углерода содержащий в кольце идентичные либо разные гетероатомы, выбранные из атомов азота или серы, или представляет собой группу -COOR8, -CONR2R3 или -C≡C-R9,
G представляет собой атом азота или группу -С-Х,
L представляет собой атом азота или группу -С-Х,
М представляет собой атом азота или группу -С-Х,
Q представляет собой атом азота или группу -С-Х,
при этом в кольце расположен максимум один атом азота,
Х представляет собой водород,
W представляет собой водород или галоген,
R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, C1-С6алкилом или группой =O арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий от 3 до 16 кольцевых атомов и вместо углерода содержащий в кольце один или более идентичных либо разных гетероатомов, таких как кислород, азот или сера, который может быть моно-, би- или трициклическим и дополнительно может быть сконденсирован с бензольным ядром,
R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, цианогруппой, С1-С6алкилом, фенилом, гидрокси-C1-С6алкилом, гало-С1-С6алкилом либо группой -NR6R7, -OR5, C1-С6алкил-OR5 C1-С6алкил, С3-С6циклоалкил, С3-С6циклоалкенил арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий от 3 до 6 кольцевых атомов и вместо углерода содержащий в кольце один или более гетероатомов, таких как азот или сера, или
R2 и R3 вместе с атомом азота образуют С3-С8кольцо, которое необязательно может содержать еще один атом азота или кислорода, либо может содержать группу -N(R10),
R5 представляет собой водород,
R6 и R7 независимо друг от друга представляют собой водород или C1-С6алкил
R8 представляет собой водород или необязательно одно- либо многозамещенный галогеном C1-С6алкил или бензил,
R9 представляет собой водород или три-C1-С6алкилсилил,
R10 представляет собой водород или С1-С6алкил,
а также их изомеры, энантиомеры и соли.
2. Соединения общей формулы I по п.1, в которой
А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце,
Е представляет собой арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий 5 или 6 кольцевых атомов и вместо углерода содержащий в кольце идентичные либо разные гетероатомы, выбранные из атомов азота и серы, или представляет собой группу -COOR8, -CONR2R3 или -C≡C-R9,
G представляет собой атом азота или группу -С-Х,
L представляет собой атом азота или группу -С-Х,
М представляет собой атом азота или группу -С-Х,
Q представляет собой атом азота или группу -С-Х,
при этом в кольце расположен максимум один атом азота,
Х представляет собой водород,
W представляет собой водород или галоген,
R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, C1-С6алкилом или группой =O арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий от 3 до 16 кольцевых атомов и вместо углерода содержащий в кольце один или более идентичных либо разных гетероатомов, таких как кислород, азот или сера, который может быть моно-, би- или трициклическим и дополнительно может быть сконденсирован с бензольным ядром,
R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, C1-С6алкилом, фенилом, гидрокси-C1-С6алкилом, гало-С1-С6алкилом либо группой -NR6R7, -OR5, C1-С6алкил-OR5 C1-С6алкил, С3-С6циклоалкил, С3-С6циклоалкенил арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий от 3 до 6 кольцевых атомов и вместо углерода содержащий в кольце один или более гетероатомов, таких как азот или сера, или
R2 и R3 вместе с атомом азота образуют С3-С8кольцо, которое необязательно может содержать еще один атом азота, либо кислорода или может содержать группу -N(R10),
R5 представляет собой водород,
R6 и R7 независимо друг от друга представляют собой водород или С1-С6алкил,
R8 представляет собой водород или необязательно одно- либо многозамещенный галогеном C1-С6алкил или бензил,
R9 представляет собой водород или три-C1-С6алкилсилил,
а также их изомеры, энантиомеры и соли.
3. Соединения общей формулы I по п.1, в которой
А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце,
Е представляет собой арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий 5 или 6 кольцевых атомов и вместо углерода содержащий в кольце идентичные либо разные гетероатомы, выбранные из атомов азота или серы, или представляет собой группу -COOR8, -CONR2R3 или -C≡C-R9,
G представляет собой атом азота или группу -С-Х,
L представляет собой атом азота или группу -С-Х,
М представляет собой атом азота или группу -С-Х,
Q представляет собой атом азота или группу -С-Х,
при этом в кольце расположен максимум один атом азота,
Х представляет собой водород,
W представляет собой водород или галоген,
R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, С1-С6алкилом арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий от 3 до 16 кольцевых атомов и вместо углерода содержащий в кольце один или более идентичных либо разных гетероатомов, таких как кислород, азот или сера, который может быть моно-, би- или трициклическим и дополнительно может быть сконденсирован с бензольным ядром,
R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, C1-С6алкилом, фенилом, гидрокси-С1-С6алкилом, гало-С1-С6алкилом либо группой -NR6R7, -OR5, C1-С6алкил-OR5 C1-С6алкил, С3-С6циклоалкил, С3-С6циклоалкенил арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий от 3 до 6 кольцевых атомов и вместо углерода содержащий в кольце один или более гетероатомов, таких как азот или сера, или
R2 и R3 вместе с атомом азота образуют С3-С8кольцо, которое необязательно может содержать еще один атом азота, либо кислорода или может содержать группу -N(R10),
R5 представляет собой водород,
R6 и R7 независимо друг от друга представляют собой водород или C1-С6алкил,
R8 представляет собой водород или необязательно одно- либо многозамещенный галогеном С1-С6алкил или бензил,
R9 представляет собой водород или три-С1-С6алкилсилил,
R10 представляет собой водород, С1-С6алкил,
а также их изомеры, энантиомеры и соли.
4. Соединения общей формулы I по п.1, в которой
А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце,
Е представляет собой гетероарил, включающий 5 или 6 кольцевых атомов и вместо углерода содержащий в кольце идентичные либо разные гетероатомы, выбранные из атомов азота или серы, или представляет собой группу -COOR8, -CONR2R3 или -C≡C-R9,
G представляет собой группу -С-Х,
L представляет собой группу -С-Х,
М представляет собой группу -С-Х,
Q представляет собой атом азота или группу -С-Х,
Х представляет собой водород,
R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, С1-С6алкилом фенил, тиофен, фуран, оксазол, тиазол, имидазол, пиразол, пиридин, пиримидин, триазин, хинолин, изохинолин или замещен по группе
в которой Т обозначает водород, C1-С6алкил или C1-С6алкоксигруппу,
R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, C1-С6алкилом, фенилом, гидрокси-C1-С6алкилом, гало-C1-С6алкилом либо группой -NR6R7, -OR5, С1-С6алкил-OR5 C1-С6алкил, С3-С6циклоалкил, С3-С6циклоалкенил арил, содержащий 6-12 кольцевых атомов углерода, либо гетероарил, включающий от 3 до 6 кольцевых атомов и вместо углерода содержащий в кольце один или более гетероатомов, таких как азот или сера, или
R2 и R3 вместе с атомом азота образуют С3-С8кольцо, которое необязательно может содержать еще один атом азота либо кислорода или может содержать группу -N(R10),
R5 представляет собой водород,
R6 и R7 независимо друг от друга представляют собой водород или С1-С6алкил,
R8 представляет собой водород или необязательно одно- либо многозамещенный галогеном C1-С6алкил или бензил,
R9 представляет собой водород или три-С1-С6алкилсилил,
а также их изомеры, энантиомеры и соли.
5. Соединения общей формулы I по п.1, в которой
А, В и D независимо друг от друга представляют собой атом азота или атом углерода, при этом по меньшей мере один атом азота содержится в кольце,
Е представляет собой тиенил, пиридил либо группу -COOR8, -CONR2R3 или -C≡C-R9,
G представляет собой группу -С-Х,
L представляет собой группу -С-Х,
М представляет собой группу -С-Х,
Q представляет собой атом азота или группу -С-Х,
Х представляет собой водород,
R1 представляет собой необязательно идентично либо различно одно- или многозамещенный галогеном, гидроксигруппой, C1-С6алкилоксигруппой, С1-С6алкилом фенил, тиофен, фуран, оксазол, тиазол, имидазол, пиразол, пиридин, пиримидин, триазин, хинолин, изохинолин или замещен по группе
или в которой Т обозначает водород, С1-С6алкил или C1-С6алкоксигруппу,
R2 и R3 независимо друг от друга представляют собой водород или необязательно идентично либо различно одно- или многозамещенный галогеном, C1-С6алкилом, фенилом либо группой -NR6R7, -OR5 или С1-С6алкил-OR5 C1-С6алкил, С3-С6циклоалкил, фенил либо пиридил или
R2 и R3 вместе с атомом азота образуют С3-С8кольцо, которое необязательно может содержать еще один атом азота либо кислорода,
R5 представляет собой водород,
R6 и R7 независимо друг от друга представляют собой водород или С1-С6алкил,
R8 представляет собой водород, С1-С6алкил или бензил,
R9 представляет собой водород или три-C1-С6алкилсилил,
а также их изомеры и соли.
6. Соединения по одному из пп.1-5, которые совместно с вспомогательными веществами и наполнителями предназначены для приготовления соответствующей композиции.
7. Лекарственное средство, содержащее по меньшей мере одно соединение по одному из пп.1-5, обладающее ингибирующим действием в отношении VEGFR-2 и VEGFR-3, предназначенное для применения при псориазе, саркоме Капоши, рестенозе, таком, например, как рестеноз, индуцированный использованием стента, при эндометриозе, болезни Крона, болезни Ходжкина, лейкемии, артрите, таком как ревматоидный артрит, при гемангиоме, ангиофиброме, глазных болезнях, таких как диабетическая ретинопатия, неоваскулярная глаукома, при заболеваниях почек, таких как гломерулонефрит диабетическая нефропатия, злокачественный нефросклероз, тромбомикроангиопатия, отторжение трансплантата и гломерулопатия, при фиброзных заболеваниях, таких как цирроз печени, при заболеваниях, связанных с пролиферацией мезангиальных клеток, при артериосклерозе, повреждениях нервной ткани, торможении повторной окклюзии сосудов после лечения с использованием баллонных катетеров, при протезировании сосудов или применении механических приспособлений, таких, например, как стенты, для сохранения просвета сосудов, а также в качестве иммуносупрессоров, в качестве вспомогательных средств, способствующих безрубцовому заживлению ран, при старческих пятнах и контактном дерматите.
8. Лекарственное средство по п.7, которое дополнительно содержит вспомогательные вещества и наполнители.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE10123574.7 | 2001-05-08 | ||
| DE2001123574 DE10123574A1 (de) | 2001-05-08 | 2001-05-08 | Selektive Anthranylamid-Derivate als VEGFR II Inhibitoren |
| DE10125294.3 | 2001-05-15 | ||
| DE2001125294 DE10125294A1 (de) | 2001-05-15 | 2001-05-15 | Selektive Anthranylamid-Derivate als VEGFR-2 und VEGFR-3 Inhibitoren |
| DE10164590.2 | 2001-12-21 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2003134148A RU2003134148A (ru) | 2005-06-10 |
| RU2299208C2 true RU2299208C2 (ru) | 2007-05-20 |
Family
ID=35833609
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2003134148/04A RU2299208C2 (ru) | 2001-05-08 | 2002-05-03 | Антраниламидпиридинамиды избирательного действия в качестве ингибиторов vegfr-2 и vegfr-3 |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2299208C2 (ru) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2550258C2 (ru) * | 2008-11-03 | 2015-05-10 | Молекьюлар Партнерс Аг | Связывающие белки, ингибирующие взаимодействия vegf-a рецептора |
| RU2625882C2 (ru) * | 2010-11-26 | 2017-07-20 | Молекьюлер Партнерс Аг | Сконструированные белки повторов, которые связываются с сывороточным альбумином |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2128644C1 (ru) * | 1993-12-27 | 1999-04-10 | Эйсай Ко., Лтд. | Производные антраниловой кислоты или их фармакологически приемлемые соли, промежуточные продукты для их получения и лекарственный препарат на их основе |
-
2002
- 2002-05-03 RU RU2003134148/04A patent/RU2299208C2/ru not_active IP Right Cessation
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2128644C1 (ru) * | 1993-12-27 | 1999-04-10 | Эйсай Ко., Лтд. | Производные антраниловой кислоты или их фармакологически приемлемые соли, промежуточные продукты для их получения и лекарственный препарат на их основе |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2550258C2 (ru) * | 2008-11-03 | 2015-05-10 | Молекьюлар Партнерс Аг | Связывающие белки, ингибирующие взаимодействия vegf-a рецептора |
| RU2650765C1 (ru) * | 2008-11-03 | 2018-04-17 | Молекьюлар Партнерс Аг | Связывающие белки, ингибирующие взаимодействие vegf-a рецептора |
| RU2625882C2 (ru) * | 2010-11-26 | 2017-07-20 | Молекьюлер Партнерс Аг | Сконструированные белки повторов, которые связываются с сывороточным альбумином |
| RU2636552C2 (ru) * | 2010-11-26 | 2017-11-23 | Молекьюлер Партнерс Аг | Улучшенные n-терминальные кэппинг модули для сконструированных белков с анкириновым повтором |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2003134148A (ru) | 2005-06-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1392680B1 (de) | Selektive anthranylamidpyridinamide als vegfr-2 und vegfr-3 inhibitoren | |
| CA2493026C (en) | Vegfr-2 and vegfr-3 inhibitory anthranilamide pyridines | |
| CN101052634B (zh) | 作为vegf受体激酶抑制剂的邻氨基苯甲酰胺吡啶脲 | |
| CZ2004714A3 (cs) | Sloučeniny a jejich použití ke snížení aktivity lipázy citlivé vůči hormonu | |
| JP4343681B2 (ja) | シアノアントラニルアミド誘導体およびそれらの薬剤としての使用 | |
| WO2006048248A2 (en) | Novel anthranilamide pyridinureas as vegf receptor kinase imhibitors | |
| US20040147535A1 (en) | VEGFR-2 and VEGFR-3 inhibitory anthranilamide pyridines | |
| JP5069119B2 (ja) | 血管内皮成長因子(vegf)受容体キナーゼインヒビターとしてのニコチンアミドピリジンウレア | |
| RU2299208C2 (ru) | Антраниламидпиридинамиды избирательного действия в качестве ингибиторов vegfr-2 и vegfr-3 | |
| US20050049281A1 (en) | VEGFR-2 and VEGFR-3 inhibitory anthranilamide pyridones | |
| KR20060021887A (ko) | Vegfr2 및 vegfr3을 억제하는 안트라닐아미드피리돈 | |
| DE10164590A1 (de) | Anthranylamidpyridinamide als VEGFR-2 und VEGFR-3 Inhibitoren | |
| HK1109403B (en) | Anthranilamide pyridinureas as vegf receptor kinase inhibitors | |
| DE10123574A1 (de) | Selektive Anthranylamid-Derivate als VEGFR II Inhibitoren | |
| DE10125294A1 (de) | Selektive Anthranylamid-Derivate als VEGFR-2 und VEGFR-3 Inhibitoren | |
| NZ537291A (en) | VEGFR-2 and VEGFR-3 inhibitory anthranylamidopyridines for the treatment of diseases caused by persistent angiogenesis | |
| DE10328036A1 (de) | VEGFR-2 und VEGFR-3 inhibitorische Anthranylamidpyridine | |
| DE10235690A1 (de) | VEGFR-2 und VEGFR-3 inhibitorische Anthranylamidpyridinamide |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20090504 |