RU2233879C1 - Рекомбинантная плазмидная днк pes1-6, кодирующая полипептид соматотропин, и штамм escherichia coli bl 21(de3)/pes1-6-продуцент рекомбинантного соматотропина - Google Patents
Рекомбинантная плазмидная днк pes1-6, кодирующая полипептид соматотропин, и штамм escherichia coli bl 21(de3)/pes1-6-продуцент рекомбинантного соматотропина Download PDFInfo
- Publication number
- RU2233879C1 RU2233879C1 RU2002133932/13A RU2002133932A RU2233879C1 RU 2233879 C1 RU2233879 C1 RU 2233879C1 RU 2002133932/13 A RU2002133932/13 A RU 2002133932/13A RU 2002133932 A RU2002133932 A RU 2002133932A RU 2233879 C1 RU2233879 C1 RU 2233879C1
- Authority
- RU
- Russia
- Prior art keywords
- recombinant
- somatotropin
- pes1
- gene
- plasmid
- Prior art date
Links
- 102000018997 Growth Hormone Human genes 0.000 title claims abstract description 56
- 108010051696 Growth Hormone Proteins 0.000 title claims abstract description 56
- 239000013612 plasmid Substances 0.000 title claims abstract description 37
- 239000000122 growth hormone Substances 0.000 title claims abstract description 22
- 241001198387 Escherichia coli BL21(DE3) Species 0.000 title claims abstract description 13
- 239000012634 fragment Substances 0.000 claims abstract description 19
- 102000002265 Human Growth Hormone Human genes 0.000 claims abstract description 16
- 108010000521 Human Growth Hormone Proteins 0.000 claims abstract description 16
- 108091008146 restriction endonucleases Proteins 0.000 claims abstract description 12
- 241000588724 Escherichia coli Species 0.000 claims abstract description 11
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 claims abstract description 9
- 229960000723 ampicillin Drugs 0.000 claims abstract description 9
- 108090000204 Dipeptidase 1 Proteins 0.000 claims abstract description 8
- 238000013518 transcription Methods 0.000 claims abstract description 7
- 230000035897 transcription Effects 0.000 claims abstract description 7
- 239000003623 enhancer Substances 0.000 claims abstract description 5
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 5
- 238000013519 translation Methods 0.000 claims abstract description 5
- 101710137500 T7 RNA polymerase Proteins 0.000 claims abstract description 4
- 230000002068 genetic effect Effects 0.000 claims abstract description 4
- 229920001184 polypeptide Polymers 0.000 claims abstract description 4
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 4
- 239000003550 marker Substances 0.000 claims abstract description 3
- 108090000623 proteins and genes Proteins 0.000 claims description 31
- 101150072531 10 gene Proteins 0.000 claims description 3
- 239000000854 Human Growth Hormone Substances 0.000 abstract description 15
- 238000000034 method Methods 0.000 abstract description 12
- 108700005078 Synthetic Genes Proteins 0.000 abstract description 5
- 125000003275 alpha amino acid group Chemical group 0.000 abstract description 4
- 230000000694 effects Effects 0.000 abstract description 2
- 238000005516 engineering process Methods 0.000 abstract description 2
- 239000000126 substance Substances 0.000 abstract description 2
- 101000714491 Escherichia phage T7 Major capsid protein Proteins 0.000 abstract 1
- 230000004071 biological effect Effects 0.000 abstract 1
- 238000010353 genetic engineering Methods 0.000 abstract 1
- 210000004027 cell Anatomy 0.000 description 23
- 108020004414 DNA Proteins 0.000 description 19
- 230000015572 biosynthetic process Effects 0.000 description 12
- 102000004169 proteins and genes Human genes 0.000 description 12
- 238000003752 polymerase chain reaction Methods 0.000 description 8
- 239000002773 nucleotide Substances 0.000 description 7
- 125000003729 nucleotide group Chemical group 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 108091034117 Oligonucleotide Proteins 0.000 description 5
- 150000001413 amino acids Chemical class 0.000 description 5
- 230000003321 amplification Effects 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- 239000000499 gel Substances 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 238000003199 nucleic acid amplification method Methods 0.000 description 5
- 230000014616 translation Effects 0.000 description 5
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 241000894006 Bacteria Species 0.000 description 4
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 4
- 238000001962 electrophoresis Methods 0.000 description 4
- 230000014509 gene expression Effects 0.000 description 4
- 230000006698 induction Effects 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 108020004705 Codon Proteins 0.000 description 3
- 101000599951 Homo sapiens Insulin-like growth factor I Proteins 0.000 description 3
- 102100037852 Insulin-like growth factor I Human genes 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 102000012410 DNA Ligases Human genes 0.000 description 2
- 108010061982 DNA Ligases Proteins 0.000 description 2
- 241000701832 Enterobacteria phage T3 Species 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 102000003960 Ligases Human genes 0.000 description 2
- 108090000364 Ligases Proteins 0.000 description 2
- 239000006142 Luria-Bertani Agar Substances 0.000 description 2
- 102000035195 Peptidases Human genes 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 102000006877 Pituitary Hormones Human genes 0.000 description 2
- 108010047386 Pituitary Hormones Proteins 0.000 description 2
- 108010021757 Polynucleotide 5'-Hydroxyl-Kinase Proteins 0.000 description 2
- 102000008422 Polynucleotide 5'-hydroxyl-kinase Human genes 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 239000011543 agarose gel Substances 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 239000000960 hypophysis hormone Substances 0.000 description 2
- 210000003000 inclusion body Anatomy 0.000 description 2
- 239000000411 inducer Substances 0.000 description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 239000011707 mineral Substances 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 230000006337 proteolytic cleavage Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- ATHGHQPFGPMSJY-UHFFFAOYSA-N spermidine Chemical compound NCCCCNCCCN ATHGHQPFGPMSJY-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 1
- 108010077805 Bacterial Proteins Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 238000007399 DNA isolation Methods 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000672609 Escherichia coli BL21 Species 0.000 description 1
- 241000620209 Escherichia coli DH5[alpha] Species 0.000 description 1
- 206010056438 Growth hormone deficiency Diseases 0.000 description 1
- 102100020948 Growth hormone receptor Human genes 0.000 description 1
- 206010062767 Hypophysitis Diseases 0.000 description 1
- 239000006137 Luria-Bertani broth Substances 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- 108010002747 Pfu DNA polymerase Proteins 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 108010057464 Prolactin Proteins 0.000 description 1
- 102100024819 Prolactin Human genes 0.000 description 1
- 108010068542 Somatotropin Receptors Proteins 0.000 description 1
- 208000026928 Turner syndrome Diseases 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O ammonium group Chemical group [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 239000003263 anabolic agent Substances 0.000 description 1
- 210000004198 anterior pituitary gland Anatomy 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 102000006635 beta-lactamase Human genes 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- UDSAIICHUKSCKT-UHFFFAOYSA-N bromophenol blue Chemical compound C1=C(Br)C(O)=C(Br)C=C1C1(C=2C=C(Br)C(O)=C(Br)C=2)C2=CC=CC=C2S(=O)(=O)O1 UDSAIICHUKSCKT-UHFFFAOYSA-N 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 229940041514 candida albicans extract Drugs 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 210000003850 cellular structure Anatomy 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 229940107161 cholesterol Drugs 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 229940063135 genotropin Drugs 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 208000027488 iatrogenic Creutzfeldt-Jakob disease Diseases 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002608 insulinlike Effects 0.000 description 1
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 230000002934 lysing effect Effects 0.000 description 1
- UEGPKNKPLBYCNK-UHFFFAOYSA-L magnesium acetate Chemical compound [Mg+2].CC([O-])=O.CC([O-])=O UEGPKNKPLBYCNK-UHFFFAOYSA-L 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 210000003098 myoblast Anatomy 0.000 description 1
- 229940063137 norditropin Drugs 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 125000003835 nucleoside group Chemical group 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 229940063149 nutropin Drugs 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- AQSJGOWTSHOLKH-UHFFFAOYSA-N phosphite(3-) Chemical class [O-]P([O-])[O-] AQSJGOWTSHOLKH-UHFFFAOYSA-N 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 230000001817 pituitary effect Effects 0.000 description 1
- 210000003635 pituitary gland Anatomy 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 239000005373 porous glass Substances 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 230000009596 postnatal growth Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 229940097325 prolactin Drugs 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 239000007320 rich medium Substances 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000007480 sanger sequencing Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 229940117012 serostim Drugs 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 238000005063 solubilization Methods 0.000 description 1
- 230000007928 solubilization Effects 0.000 description 1
- 210000001875 somatotroph Anatomy 0.000 description 1
- 108700031632 somatrem Proteins 0.000 description 1
- 229960004532 somatropin Drugs 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 229940063673 spermidine Drugs 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 230000017423 tissue regeneration Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- PIEPQKCYPFFYMG-UHFFFAOYSA-N tris acetate Chemical compound CC(O)=O.OCC(N)(CO)CO PIEPQKCYPFFYMG-UHFFFAOYSA-N 0.000 description 1
- 239000012137 tryptone Substances 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000012138 yeast extract Substances 0.000 description 1
- -1 β-cyanethyl-diisopropylamino Chemical group 0.000 description 1
Images
Landscapes
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Изобретение относится к биотехнологии, в частности к генной инженерии, и может быть использовано для получения рекомбинантного гормона роста человека. Рекомбинантная плазмидная ДНК pES1-6, кодирующая полипептид с последовательностью соматотропина, имеющей молекулярную массу 3,66 Мда (5949 п.о.); состоит из: NdeI/XhoI-фрагмента ДНК плазмиды рЕТ22b(+), содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы, и NdeI/XhoI-фрагмента ДНК, содержащего последовательность искусственного гена рекомбинантного соматотропина; содержащую: в качестве генетического маркера ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pESl-6 клеток Е. coli к ампициллину; уникальные сайты узнавания эндонуклеаз рестрикции, расположенные на следующем расстоянии вправо от сайта NdeI: XbaI - 38 п.о., HpaI - 1332 п.о., PstI - 4065 п.о., PvuI - 4190 п.о., XhoI - 5363 п.о. Получают штамм Escherichia coli BL21(DE3)/pESl-6, содержащий рекомбинантную плазмидную ДНК pESl-6 - продуцент рекомбинантного соматотропина. Изобретение позволяет получить рекомбинантный соматотропин с высоким выходом и по упрощенной технологии, 2 н.з.п. ф-лы, 2 ил.
Description
Изобретение относится к биотехнологии, в частности к генной и белковой инженерии, и может быть использовано для получения рекомбинантного соматотропина.
Соматотропин (синонимы: соматропин, гормон роста человека, соматотропный гормон, соматотропный гормон роста) относится к наиболее изученным гормонам гипофиза и принадлежит к белковому семейству, включающему гормон роста, пролактин, ХС. Соматотропин синтезируется в передней доле гипофиза в соматотрофах, которые составляют подкласс ацидофильных клеток гипофиза и являются наиболее многочисленной группой в этой железе. Соматотропин у всех видов млекопитающих представляет собой одиночный пептид с молекулярной массой около 22000. Несмотря на высокую степень гомологии последовательностей гормонов роста различных млекопитающих, в клетках человека активен только собственный гормон роста человека или гормон роста высших приматов. Молекула соматотропина состоит из 191 аминокислотного остатка и содержит два внутримолекулярных дисульфидных мостика. Соматотропин - анаболический гормон, который необходим для постнатального роста, нормализации углеводного, липидного, азотного и минерального обмена, регенерации тканей и выживанию клеток. Ростовые эффекты соматотропина опосредуются главным образом инсулинподобным фактором роста 1 (ИФР-1), ген которого относится к семейству инсулиноподобных генов. Таким образом, соматотропин стимулирует секрецию ИФР-1, дифференцировку и пролиферацию миобластов, усвоение аминокислот и синтез белка в мышцах и других тканях [Roskam W.G., Rougeon F.// Molecular cloning and nucleotide sequence of the human growth hormone structural gene. Nucl.Acids Res., 1979, v. 7, p. 305-320.; Martial J.A., Hallewell R.A., Baxter J.D., Goodman H.M.// Human growth hormone: complementary DNA cloning and expression in bacteria. Science, 1979, v. 205, No 4406, p. 602-607].
Соматотропин, как и другие гормоны, осуществляет свое действие через связывание со специфическим рецептором [Herington AC.// Identification and characterization of growth hormone receptors on isolated rat adipocytes. J Recept Res 1981-82; 2(4):299-316].
Лекарственные формы соматотропина (синонимы - нутропин или протропин (Genentech), нордитропин (Novo Nordisk), генотропин (Pharmacia Upjohn), гуматроп (Eli Lilly), саизен или серостим (Serono)) широко используются в медицине для терапии дефицитности гормона роста и синдрома Тернера.
Известен способ получения соматотропина, состоящий в его выделении из тканей гипофиза человека [Simionescu L., Dimitriu V., Zamfir-Grigorescu D., Aman E., Terbancea M.// The simultaneous isolation of human pituitary hormones. I. Human growth hormone. Endocrinologie 1982 Oct.-Dec.; 20(4):273-83]. Недостатками способа являются сложность с получением исходного материала и риск заражения инфекцией [Rappaport Е.В.// Iatrogenic Creutzfeldt-Jakob disease. Neurology, 1987, Sep.; 37(9):1520-2].
В настоящее время известно два основных способа получения рекомбинантного соматотропина.
Способ, основанный на получении рекомбинантного соматотропина в трансформированных клетках мыши линии С 127 [Carter M.J., Facklam T.J., Long P.C., Scotland R.A.// Are continuous cell lines safe as substrates for human drugs and biologies? A case study with human growth hormone. Dev Biol Stand 1989; 70:101-7]. При таком подходе удается получить гормон роста человека в правильной конформации с хорошей физиологической активностью. Недостатками этого способа являются чрезвычайно низкий выход и длительное время культивации продуцирующих клеток.
А также способ получения соматотропина, включающий экспрессию в клетках Escherichia coli, заключающийся в достаточно быстром биосинтезе клетками бактерий рекомбинантного соматотропина в виде нерастворимых “телец включения” [Olson К.С., Fenno J., Lin N., Harkins R.N., Snider C., Kohr W.H., Ross M.J., Fodge D., Prender G., Stebbing N.// Purified human growth hormone from E. coli is biologically active. Nature 1981 Oct. 1; 293(5831):408-11]. При использовании данного общего способа получения соматотропина уровень биосинтеза целевого белка может колебаться в широких пределах.
Наиболее близким по технической сущности к предлагаемому изобретению является продуцент соматотропина на основе плазмиды pHGH 107 (патент США №5795745, МКИ С 12 В 21/02), несущей под контролем двух последовательных Lac-промоторов ген соматотропина, состоящий из синтетической части (соответствующей аминокислотам 1-24) и фрагмента природного гена (соответствующего аминокислотам 25-191). Использование Lac-промоторов, а также почти полностью (на 88%) природной кДНК, включающей редко встречающиеся в генах Escherichia coli (минорные) кодоны, приводит к существенному снижению уровня биосинтеза белка относительно теоретически возможного.
Изобретение решает задачу конструирования плазмиды, детерминирующей синтез рекомбинантного белка, и создания высокопродуктивного бактериального штамма-продуцента, позволяющего получать рекомбинантный соматотропин с высоким выходом и по упрощенной технологии.
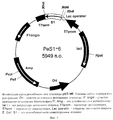
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pES1-6, кодирующей полипептид с последовательностью соматотропина, имеющей молекулярную массу 3,66 Мда (5949 п.о.); состоящей из: NdeI/XhoII-фрагмента ДНК плазмиды pет 22b(+), содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы, и NdeI/XhoI-фрагмента ДНК, содержащего последовательность искусственного гена рекомбинантного соматотропина; содержащую: в качестве генетического маркера ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pES1-6 клеток Е.coli к ампициллину; уникальные сайты узнавания эндонуклеаз рестрикции, расположенные на следующем расстоянии вправо от сайта NdeI: XbaI - 38 п.о., НраI - 1332 п.о., PstI - 4065 п.о., PvuI - 4190 п.о., XhoI - 5363 п.о., а также штамма-продуцента Escherichia coli BL21(DE3)/pES1-6, содержащего рекомбинантную плазмидную ДНК pES1-6 - продуцент рекомбинантного соматотропина, обеспечивающего синтез рекомбинантного соматотропина в количестве 60-70% от суммарного содержания белка клеток.
Преимущества предлагаемого изобретения заключаются, во-первых, в использовании при химико-ферментативном синтезе гена соматотропина максимально широкого набора кодонов, являющихся оптимальными для продукции белка в Escherichia coli, расположение которых в синтетическом гене устраняет возможность образования на синтезируемой мРНК протяженных "шпилек", потенциально ингибирующих трансляцию. На фиг. 1 приведена аминокислотная последовательность соматотропина и соответствующая ей нуклеотидная последовательность гена: верхняя строка - природная кДНК соматотропина, нижняя строка - синтезированный искусственный ген. Во-вторых, - применение для биосинтеза рекомбинантного белка оптимальных регуляторных элементов, контролирующих его экспрессию: Т7-lас промотора для предотвращения базальной экспрессии гена до момента начала индукции и высокого уровня транскрипции соответствующей мРНК при индукции, высокоэффективного терминатора транскрипции Т7 и блока различных стоп-кодонов, исключающих биосинтез удлиненных вариантов рекомбинантного соматотропина. Преимущество предлагаемого штамма E.coli заключается в использовании бактерий с фенотипом Lon OmpT, что исключает возможность протеолитического расщепления синтезируемого de novo рекомбинантного соматотропина и загрязнения выделяемого белка наиболее активными протеазами E.coli.
Конструирование нового гена, кодирующего соматотропин человека, осуществляют на основе плазмиды рЕТ22b(+). Искусственный ген, кодирующий соматотропин, фланкированный сайтами рестриктаз NdeI и XhoI, получают химико-ферментативным синтезом набора олигонуклеотидных фрагментов с последующей их сборкой и амплификацией при помощи полимеразной цепной реакции (ПЦР). Перед лигированием для генерации липких концов амплификат и векторную плазмиду обрабатывают рестриктазами NdeI и XhoI. Лигазную смесь используют для трансформации компетентных клеток Е.coli DH5α. Отбор положительных клонов проводят при помощи ПЦР с использованием специфических праймеров, с последующим рестриктным анализом выделенной плазмидной ДНК рестриктазами NaeI и XhoI. Структуру гена, кодирующего рекомбинантный соматотропин, определяют секвенированием по методу Сенгера.
Она должна полностью соответствовать нуклеотидной последовательности исходного искусственного гена соматотропина (фиг.1).
Рекомбинантная плазмидная ДНК pES1-6, кодирующая полипептид соматотропин, характеризуется следующими признаками:
- имеет молекулярную массу 3,66 МДа;
- кодирует полипептид соматотропин;
- состоит из: NdеI/XhoI-фрагмента ДНК плазмиды рЕТ22b(+), содержащей промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы и NdеI/XhoI-фрагмента ДНК, включающего искусственный ген соматотропина;
- имеет уникальную совокупность признаков: промотор и терминатор транскрипции РНК-полимеразы бактериофага Т7, усилитель трансляции гена 10 бактериофага Т7; искусственный ген, кодирующий соматотропин; ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pES1-6 клеток Е.coli к ампициллину; уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии вправо от сайта NdеI:XhoI - 38 п.о., НраI - 1332 п.о., PstI - 4065 п.о., PvuI - 4190 п.о., XhoI - 5363 п.о.
Для получения штамма-продуцента рекомбинантного соматотропина плазмидную ДНК pES1-6 используют для трансформации компетентных клеток Escherichia coli BL21(DE3) и проводят отбор клонов, сохраняющих уровень биосинтеза рекомбинантного полипептида не ниже 60-70% от суммарного клеточного белка в течение по крайней мере шести последовательных пассирований. Для этого клоны трансформированных плазмидой pES1-6 клеток Е.coli BL21(DE3) выращивают в богатой среде (YT-, LB-бульон и др.) с добавлением ампициллина до 100 мкг/мл и раствора глюкозы до 1% в течение 12-14 часов, инокулируют новую порцию питательной среды в соотношении 1:100, растят культуру до достижения оптической плотности 1 О.Е., индуцируют изопропилтио-β-D-галактозидом и растят еще 3-6 часов. Получение из клеток продуцента рекомбинантного соматотропина включает следующие стадии: отделение бактерий от культуральной среды, их разрушение одним из обычно применяемых способов; отмывку буферными растворами телец включения от водорастворимых компонентов клетки; солюбилизацию и восстановление целевого белка, его рефолдинг и окончательную очистку.
Полученный штамм-продуцент Escherichia coli BL21(DE3)/pES1-6 характеризуется следующими признаками.
Морфологические признаки: клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки: при росте на агаризованной среде LB колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или YT-бульоне) образуют интенсивную ровную муть.
Физико-биологические признаки: клетки растут при температуре от 4°С до 40°С при оптимуме рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам: клетки проявляют устойчивость к ампициллину (до 500 мкг/мл), обусловленную наличием в плазмиде гена β-лактамазы(blа).
Преимущество предлагаемого штамма-продуцента заключается в использовании бактерий с фенотипом Lon OmpT, что исключает возможность протеолитического расщепления синтезируемого de novo рекомбинантного гормона роста и загрязнения выделяемого белка наиболее активными протеазами E.coli.
Клетки Е.coli BL21(DE3)/pES1-6 являются суперпродуцентом. При индукции изопропилтио-β-D-галактозидом происходит эффективный биосинтез рекомбинантного соматотропина, который накапливается в клетках в количестве более 60% суммарного белка бактерий.
На фиг.1 представлена нуклеотидная последовательность и кодируемая ею аминокислотная последовательность NdеI/XhoI-фрагмента плазмиды pES1-6; на фиг.2 - физическая карта плазмиды pES1-6.
Изобретение иллюстрируют примеры.
Пример 1.
Конструирование рекомбинантной плазм идной ДНК pES1-6.
Нуклеотидную последовательность, соответствующую гену соматотропина, получают химико-ферментативным синтезом. Для этого теоретически рассчитанную последовательность ДНК разбивают на перекрывающиеся фрагменты размером около 50 п.о. Химический синтез олигонуклеотидов, соответствующих этим фрагментам, выполняют твердофазным фосфоамидитным методом при помощи, например, ДНК-синтезатора ASM-102U (БИОССЕТ, Новосибирск) с наращиванием олигонуклеотидной цепи в направлении от 3’-конца к 5’-концу с помощью защищенных фосфамидитов - 5’-диметокситритил-N-ацил-2’-дезоксинуклеозид-3’-O-(β-цианэтил-диизопропиламино)-фосфитов, активированных тетразолом. Синтез проводят в масштабе 0,5-0,7 мкмоль, используя в качестве носителя пористое стекло (размер пор 500 А), к которому через 3’-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 20-30 мкмоль/г). Полученные олигонуклеотиды подвергают 5’-концевому фосфорилированию с использованием Т4 полинуклеотидкиназы (Fermentas, Литва). Для этого олигонуклеотиды в количестве 20 пмоль смешивают с ферментом в количестве 10 ед. в буферном растворе, содержащем 50 мМ Tris-HCl (pH 7,6 при 25°С), 10 мМ MgCl2, 5 мМ дитиотреита, 1 мМ спермидина, 0,1 мМ АТФ и 0,1 мМ ЭДТА. Реакцию ведут 30 минут, полинуклеотид киназу инактивируют нагреванием до 65°С в течение 10 мин.
Фософрилированные олигонуклеотиды смешивают в эквимолярном соотношении в 50 мкл буфера, содержащего 20 мМ трис-HCl, pH 7,56, 10 мМ MgCl2, 0,2 мМ rАТР, 10 мМ дитиотреита, прогревают до 65°С, медленно охлаждают до 37°С в течение часа и добавляют 10 ед.ак. Т4-ДНК-лигазы. Реакцию лигирования ДНК проводят 4 ч при 37°С. 0,1 мкл полученного раствора используют в качестве матрицы в полимеразной цепной реакции (ПЦР) в присутствии термостабильной ДНК-полимеразы Pfu и специфических праймеров
Проводят 25 циклов амплификации (95°С, 20 с; 62°С, 40 с; 72°С, 60 с) для синтеза полноразмерного фрагмента ДНК, содержащего последовательность гена соматотропина, фланкированного сайтами узнавания рестриктаз NdeI и XhoI. Продукт амплификации гидролизуют рестриктазами NdeI и XhoI, очищают электрофорезом в 5% акриламидном геле, полосу ДНК величиной около 600 п.о. выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.
Для приготовления вектора ДНК плазмиды рЕТ-22b(+) (3 мкг, 1 пмоль) обрабатывают в 40 мкл буфера Y (33 мМ трис-ацетат, pH 7,9, 10 мМ Mg-ацетат,66 мМ К-ацетат 1, 0,5 мМ DTT, 0,1 мг/мл BSA) рестриктазой NdeI (10 ед. акт.), осаждают ДНК этанолом, растворяют в 40 мкл буфера R (10 мМ трис-HCl, рН 8,5, 10 мМ MgCl2, 100 мМ КСl, 0,1 мг/мл BSA) и обрабатывают рестриктазой XhoI (10 ед. акт.) в течение 1 ч при 37°С. Полученный фрагмент ДНК величиной 5,4 т.п.о. после электрофоретического разделения в 1% агарозном геле выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.
1 мкг полученного векторного фрагмента лигируют с 2 пмоль NdeI/XhoI-фрагмента размером 600 п.о., содержащего синтетический ген рекомбинантного соматотропина, в 10 мкл буфера (20 мМ трис-HCl, рН 7,56, 10 мМ MgCl2, 0,2 мМ rATP, 10 мМ дитиотреита) с помощью 10 ед. акт. Т4-ДНК-лигазы в течение 12 ч при 10°С.
1 мкл полученной лигазной смеси используют для электротрансформации компетентных клеток Е.coli BL21(DE3), которую проводят, например, при помощи аппарата для электротрансформации ВТХ 600 при зазоре между пластинами электропорационной кюветы 1 мм и напряжении разряда 1,4 кВ. После трансформации суспензию бактерий смешивают с питательной средой SOC, растят 1 час на +37°С и высевают на чашки Петри с LB-агаром, содержащим 50 мкг/мл ампициллина.
Первичный отбор клонов, содержащих нужную плазмиду, проводят методом "ПЦР с клонов" с использованием специфических праймеров
Провоят 25 циклов амплификации (95°С, 20 с; 62°С, 40 с; 72°С, 60 с), с последующим электрофоретическим анализом ПЦР продуктов в 1% агарозном геле на наличие ПЦР-продукта длиной около 600 п.н. Отобранные клоны используют для подроста в жидкой среде и выделения плазмидной ДНК плазмиды, которую анализируют на наличие вставки с помощью эндонуклеаз рестрикции NdeI и XhoI с последующим разделением продуктов гидролиза в 5% полиакриламидном геле. Окончательное строение плазмид, содержащих NdeI/XhoI-фрагмент около 600 п.о., подтверждают определением нуклеотидной последовательности методом секвенирования по Сенгеру. По данным секвенирования отбирают ту плазмиду, нуклеотидная и соответствующая ей аминокислотная последовательности NdeI/XhoI-фрагмента которой полностью идентичны первоначально запланированной (фиг.1). Проводят трансформацию клеток Е.coli BL21(DE3) выбранной плазмидой, как описано выше, петлей переносят 5-10 колоний в 5 мл жидкой среды 2xYT, содержащей 50 мкг/мл ампициллина, в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, отбирают аликвоту культуры для последующего анализа, прибавляют индуктор - изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают рост еще 2 ч. Равные аликвоты суспензии клеток, отобранных до внесения индуктора и после завершения роста центрифугируют, отделяют супернатант и анализируют осадок клеток электрофорезом в ППАГ, как описано в примере 2. Появление отчетливо видимой полосы белка в районе 20 КДа в образце пробы, отобранной после индукции, свидетельствует о способности штамма синтезировать рекомбинантный соматотропин при индукции IPTG и полностью подтверждает корректность сборки плазмиды.
Пример 2.
Получение штамма-продуцента Е.coli BL21(DE3)/pes1-6 с рекомбинантным гормоном роста и определение его продуктивности.
Штамм-продуцент Е.coli BL21(DE3)/pES1-6 получают трансформацией компетентных клеток Е.coli BL21(DE3) плазмидой pES1-6, как описано в примере 1.
Штамм продуцента Е.coli BL21(DE3)/pES1-6 выращивают при 37°С в 100 мл YT-бульона (рН 7,0) с 50 мкг/мл ампициллина в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, прибавляют изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают процесс еще 6 ч или продолжают выращивание в отсутствие индуктора в течение 6 ч. Каждый час отбирают пробу по 2 мл, определяют А550 и количество культуры, соответствующее 1 мл с А550 1,0, центрифугируют 5 мин при 6000 об/мин. Осажденные клетки в 100 мкл лизирующего буфера с красителем бромфеноловым синим обрабатывают 20 с ультразвуком, нагревают 3 мин при 100°С и пробы по 1 мкл используют для электрофореза в 15% SDS-ПААГ. Гель прокрашивают кумасси R-250 по стандартной методике и сканируют для определения относительного количества белка в полосе целевого белка. По данным сканирования содержание рекомбинантного соматотропина составляет 60-70% от всех клеточных белков.
Claims (2)
1. Рекомбинантная плазмидная ДНК pES1-6, кодирующая полипептид с последовательностью гормона роста человека соматотропина, имеющая молекулярную массу 3,66 Мда (5949 п.о.); состоящая из NdeI/XhoI-фрагмента ДНК плазмиды рЕТ22b(+), содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, NdeI/XhoI-фрагмент ДНК, содержащий последовательность искусственного гена рекомбинантного соматотропина, содержащая в качестве генетического маркера ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pESl-6 клеток Е.coli к ампициллину, уникальные сайты узнавания эндонуклеаз рестрикции, расположенные на следующем расстоянии вправо от сайта NdeI:XbaI - 38 п.о., HpaI - 1332 п.о., PstI - 4065 п.о., PvuI - 4190 п.о., XhoI - 5363 п.о.
2. Штамм Escherichia coli BL21 (DE3)/pES1-6, содержащий рекомбинантную плазмидную ДНК pESl-6, - продуцент рекомбинантного соматотропина.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2002133932/13A RU2233879C1 (ru) | 2002-12-17 | 2002-12-17 | Рекомбинантная плазмидная днк pes1-6, кодирующая полипептид соматотропин, и штамм escherichia coli bl 21(de3)/pes1-6-продуцент рекомбинантного соматотропина |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2002133932/13A RU2233879C1 (ru) | 2002-12-17 | 2002-12-17 | Рекомбинантная плазмидная днк pes1-6, кодирующая полипептид соматотропин, и штамм escherichia coli bl 21(de3)/pes1-6-продуцент рекомбинантного соматотропина |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2002133932A RU2002133932A (ru) | 2004-07-27 |
| RU2233879C1 true RU2233879C1 (ru) | 2004-08-10 |
Family
ID=33413531
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2002133932/13A RU2233879C1 (ru) | 2002-12-17 | 2002-12-17 | Рекомбинантная плазмидная днк pes1-6, кодирующая полипептид соматотропин, и штамм escherichia coli bl 21(de3)/pes1-6-продуцент рекомбинантного соматотропина |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2233879C1 (ru) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2465315C1 (ru) * | 2011-08-08 | 2012-10-27 | Общество с ограниченной ответственностью "Амбер" | РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pPBS-St9, КОДИРУЮЩАЯ ПОЛИПЕПТИД СОМАТОТРОПИНА, И ШТАММ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE ДЛЯ ПРОДУКЦИИ РЕКОМБИНАНТНОГО СОМАТОТРОПИНА |
| WO2019070162A1 (ru) * | 2017-10-08 | 2019-04-11 | Илья Владимирович ДУХОВЛИНОВ | Штамм-продуцент соматотропина преимущественно мономерной формы |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU1248280C (ru) * | 1983-07-08 | 1995-02-09 | Институт молекулярной биологии им.В.А.Энгельгардта РАН | Рекомбинантные плазмидные днк, кодирующие синтез производных соматотропного гормона человека, способ их конструирования, штаммы escherichia coli, содержащие эти плазмиды - продуценты производных соматотропного гормона человека (их варианты) |
| RU2075509C1 (ru) * | 1989-06-12 | 1997-03-20 | Питман-Мур, Инк. | Способ выделения рекомбинантного соматотропина |
| US5795745A (en) * | 1979-07-05 | 1998-08-18 | Genentech, Inc. | Human growth hormone |
-
2002
- 2002-12-17 RU RU2002133932/13A patent/RU2233879C1/ru active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5795745A (en) * | 1979-07-05 | 1998-08-18 | Genentech, Inc. | Human growth hormone |
| RU1248280C (ru) * | 1983-07-08 | 1995-02-09 | Институт молекулярной биологии им.В.А.Энгельгардта РАН | Рекомбинантные плазмидные днк, кодирующие синтез производных соматотропного гормона человека, способ их конструирования, штаммы escherichia coli, содержащие эти плазмиды - продуценты производных соматотропного гормона человека (их варианты) |
| RU2075509C1 (ru) * | 1989-06-12 | 1997-03-20 | Питман-Мур, Инк. | Способ выделения рекомбинантного соматотропина |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2465315C1 (ru) * | 2011-08-08 | 2012-10-27 | Общество с ограниченной ответственностью "Амбер" | РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pPBS-St9, КОДИРУЮЩАЯ ПОЛИПЕПТИД СОМАТОТРОПИНА, И ШТАММ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE ДЛЯ ПРОДУКЦИИ РЕКОМБИНАНТНОГО СОМАТОТРОПИНА |
| WO2019070162A1 (ru) * | 2017-10-08 | 2019-04-11 | Илья Владимирович ДУХОВЛИНОВ | Штамм-продуцент соматотропина преимущественно мономерной формы |
| EA035207B1 (ru) * | 2017-10-08 | 2020-05-15 | Илья Владимирович ДУХОВЛИНОВ | ШТАММ БАКТЕРИЙ ESCHERICHIA COLI BL21(DE3)/pET-21a(+) - ПРОДУЦЕНТ СОМАТОТРОПИНА ПРЕИМУЩЕСТВЕННО МОНОМЕРНОЙ ФОРМЫ |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR860001230B1 (ko) | 이중 가닥 dna의 분할 방법 | |
| KR900005776B1 (ko) | 인터페론의 제조방법 | |
| US6773899B2 (en) | Phage-dependent superproduction of biologically active protein and peptides | |
| CN101967485A (zh) | 人fgf21突变基因及制备重组人fgf21蛋白方法 | |
| RU2233879C1 (ru) | Рекомбинантная плазмидная днк pes1-6, кодирующая полипептид соматотропин, и штамм escherichia coli bl 21(de3)/pes1-6-продуцент рекомбинантного соматотропина | |
| JPH08503376A (ja) | 細菌内の異種遺伝子の発現の間の内因性アミノペプチダーゼ媒介n−末端アミノ酸開裂の防止 | |
| US6316004B1 (en) | Chimeric somatostatin containing protein and encoding DNA, plasmids of expression, method for preparing chimeric protein, strain-producers, immunogenic composition, method for increasing the productivity of farm animals | |
| SU1479005A3 (ru) | Способ получени интерлейкина-2 человека | |
| RU2610173C1 (ru) | Рекомбинантная плазмида pFM-IFN-17, обеспечивающая экспрессию интерферона альфа-2b человека, рекомбинантная плазмида pFM-АР, обеспечивающая экспрессию фермента метионинаминопептидазы E. coli, биплазмидный штамм Escherichia coli FM-IFN-АР (pFM-IFN-17, pFM-АР) - продуцент (Met-) рекомбинантного интерферона альфа-2b человека | |
| RU2260049C2 (ru) | Рекомбинантная плазмидная днк pes3-7, кодирующая полипептид с последовательностью гранулоцитарного колониестимулирующего фактора человека, и штамм escherichia coli bl21(de3)/pes3-7 - продуцент рекомбинантного гранулоцитарного колониестимулирующего фактора человека | |
| RU2619170C2 (ru) | Рекомбинантная плазмидная ДНК pER-APHC3, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием APHC3, штамм Escherichia coli C3030/pER-APHC3 продуцент указанных белков и способ получения рекомбинантного APCH3 | |
| KR100890184B1 (ko) | SlyD를 융합파트너로 이용한 재조합 단백질의 제조방법 | |
| RU2258081C1 (ru) | Рекомбинантная плазмидная днк pes4-4, кодирующая полипептид интерферон альфа-2b человека, и штамм escherichia coli bdees4 - продуцент рекомбинантного интерферона альфа-2b человека | |
| RU2261913C1 (ru) | РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pES6-1, КОДИРУЮЩАЯ ПОЛИПЕПТИД ИНТЕРФЕРОН БЕТА-1b ЧЕЛОВЕКА, И ШТАММ Escherichia coli BDEES6 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА БЕТА-1b ЧЕЛОВЕКА | |
| RU2316590C1 (ru) | РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pE-His8-TrxL-Ar2, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК, СОДЕРЖАЩИЙ АНТИМИКРОБНЫЙ ПЕПТИД АРЕНИЦИН МОРСКОГО КОЛЬЧАТОГО ЧЕРВЯ Arenicola marina, И ШТАММ Escherichia coli BL21(DE3)/pE-His8-TrxL-Ar2 - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА, СОДЕРЖАЩЕГО АРЕНИЦИН | |
| RU2302465C2 (ru) | СПОСОБ ПОЛУЧЕНИЯ ГЕННО-ИНЖЕНЕРНОГО ГЛЮКАГОНА ЧЕЛОВЕКА, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pER-Gl, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК, СПОСОБНЫЙ К АВТОКАТАЛИТИЧЕСКОМУ РАСЩЕПЛЕНИЮ С ОБРАЗОВАНИЕМ ГЛЮКАГОНА ЧЕЛОВЕКА, И ШТАММ Escherichia coli ER-2566/pER-Gl - ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА | |
| RU2323976C2 (ru) | СПОСОБ ПОЛУЧЕНИЯ ГЕННО-ИНЖЕНЕРНОГО ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА ЧЕЛОВЕКА, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pER-hEGF, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК, СПОСОБНЫЙ К АВТОКАТАЛИТИЧЕСКОМУ РАСЩЕПЛЕНИЮ С ОБРАЗОВАНИЕМ ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА ЧЕЛОВЕКА, И ШТАММ Escherichia coli ER2566/pER-hEGF - ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА | |
| RU2697375C2 (ru) | ПЛАЗМИДНЫЙ ВЕКТОР pRh15A ДЛЯ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2b, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI BL21 DE3 - ПРОДУЦЕНТ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2b И СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2b | |
| CN1167799C (zh) | 分泌表达酸性成纤维细胞生长因子的方法 | |
| RU2465315C1 (ru) | РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pPBS-St9, КОДИРУЮЩАЯ ПОЛИПЕПТИД СОМАТОТРОПИНА, И ШТАММ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE ДЛЯ ПРОДУКЦИИ РЕКОМБИНАНТНОГО СОМАТОТРОПИНА | |
| JPH0691832B2 (ja) | ポリペプチドの産生を向上する方法 | |
| KR100890187B1 (ko) | Tsf를 융합파트너로 이용한 재조합 단백질의 제조방법 | |
| JPH0928380A (ja) | ニトリラーゼ遺伝子発現に関わる調節因子およびその遺伝子 | |
| RU2426787C2 (ru) | РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pET32M/mTrx-rhIL-11, КОДИРУЮЩАЯ ИНТЕРЛЕЙКИН -11 ЧЕЛОВЕКА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ШТАММ Escherichia coli BL21(DE3)/pET32M/mTrx-rhIL-11 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИНТЕРЛЕЙКИНА-11 | |
| JP3696322B2 (ja) | 新規hs遺伝子及び該遺伝子を異種遺伝子産物をコードする構造遺伝子の下流に連結した発現プラスミド並びに該発現プラスミドを保有する形質転換体を用いた異種遺伝子産物の製造法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC43 | Official registration of the transfer of the exclusive right without contract for inventions |
Effective date: 20161202 |
|
| PD4A | Correction of name of patent owner |