RU2233879C1 - Recombinant plasmid dna pes1-6 encoding polypeptide somatotropin and strain escherichia coli bl21(de3)/pes1-6 as producer of recombinant somatotropin - Google Patents
Recombinant plasmid dna pes1-6 encoding polypeptide somatotropin and strain escherichia coli bl21(de3)/pes1-6 as producer of recombinant somatotropin Download PDFInfo
- Publication number
- RU2233879C1 RU2233879C1 RU2002133932/13A RU2002133932A RU2233879C1 RU 2233879 C1 RU2233879 C1 RU 2233879C1 RU 2002133932/13 A RU2002133932/13 A RU 2002133932/13A RU 2002133932 A RU2002133932 A RU 2002133932A RU 2233879 C1 RU2233879 C1 RU 2233879C1
- Authority
- RU
- Russia
- Prior art keywords
- recombinant
- somatotropin
- pes1
- gene
- plasmid
- Prior art date
Links
Images
Landscapes
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Description
Изобретение относится к биотехнологии, в частности к генной и белковой инженерии, и может быть использовано для получения рекомбинантного соматотропина.The invention relates to biotechnology, in particular to genetic and protein engineering, and can be used to produce recombinant growth hormone.
Соматотропин (синонимы: соматропин, гормон роста человека, соматотропный гормон, соматотропный гормон роста) относится к наиболее изученным гормонам гипофиза и принадлежит к белковому семейству, включающему гормон роста, пролактин, ХС. Соматотропин синтезируется в передней доле гипофиза в соматотрофах, которые составляют подкласс ацидофильных клеток гипофиза и являются наиболее многочисленной группой в этой железе. Соматотропин у всех видов млекопитающих представляет собой одиночный пептид с молекулярной массой около 22000. Несмотря на высокую степень гомологии последовательностей гормонов роста различных млекопитающих, в клетках человека активен только собственный гормон роста человека или гормон роста высших приматов. Молекула соматотропина состоит из 191 аминокислотного остатка и содержит два внутримолекулярных дисульфидных мостика. Соматотропин - анаболический гормон, который необходим для постнатального роста, нормализации углеводного, липидного, азотного и минерального обмена, регенерации тканей и выживанию клеток. Ростовые эффекты соматотропина опосредуются главным образом инсулинподобным фактором роста 1 (ИФР-1), ген которого относится к семейству инсулиноподобных генов. Таким образом, соматотропин стимулирует секрецию ИФР-1, дифференцировку и пролиферацию миобластов, усвоение аминокислот и синтез белка в мышцах и других тканях [Roskam W.G., Rougeon F.// Molecular cloning and nucleotide sequence of the human growth hormone structural gene. Nucl.Acids Res., 1979, v. 7, p. 305-320.; Martial J.A., Hallewell R.A., Baxter J.D., Goodman H.M.// Human growth hormone: complementary DNA cloning and expression in bacteria. Science, 1979, v. 205, No 4406, p. 602-607].Somatotropin (synonyms: somatropin, human growth hormone, growth hormone, growth hormone growth hormone) is among the most studied pituitary hormones and belongs to the protein family, including growth hormone, prolactin, cholesterol. Somatotropin is synthesized in the anterior pituitary gland in somatotrophs, which are a subclass of acidophilic pituitary cells and are the most numerous group in this gland. Growth hormone in all mammalian species is a single peptide with a molecular weight of about 22,000. Despite the high degree of homology of the growth hormones of various mammals, only human growth hormone or higher primates are active in human cells. The growth hormone molecule consists of 191 amino acid residues and contains two intramolecular disulfide bridges. Somatotropin is an anabolic hormone that is necessary for postnatal growth, normalization of carbohydrate, lipid, nitrogen and mineral metabolism, tissue regeneration and cell survival. Growth effects of growth hormone are mainly mediated by insulin-like growth factor 1 (IGF-1), the gene of which belongs to the family of insulin-like genes. Thus, somatotropin stimulates IGF-1 secretion, myoblast differentiation and proliferation, amino acid uptake and protein synthesis in muscles and other tissues [Roskam W.G., Rougeon F. // Molecular cloning and nucleotide sequence of the human growth hormone structural gene. Nucl. Acids Res., 1979, v. 7, p. 305-320 .; Martial J.A., Hallewell R.A., Baxter J.D., Goodman H.M. // Human growth hormone: complementary DNA cloning and expression in bacteria. Science, 1979, v. 205, No. 4406, p. 602-607].
Соматотропин, как и другие гормоны, осуществляет свое действие через связывание со специфическим рецептором [Herington AC.// Identification and characterization of growth hormone receptors on isolated rat adipocytes. J Recept Res 1981-82; 2(4):299-316].Somatotropin, like other hormones, acts through binding to a specific receptor [Herington AC.// Identification and characterization of growth hormone receptors on isolated rat adipocytes. J Recept Res 1981-82; 2 (4): 299-316].
Лекарственные формы соматотропина (синонимы - нутропин или протропин (Genentech), нордитропин (Novo Nordisk), генотропин (Pharmacia Upjohn), гуматроп (Eli Lilly), саизен или серостим (Serono)) широко используются в медицине для терапии дефицитности гормона роста и синдрома Тернера.Dosage forms of growth hormone (synonyms - nutropin or protropin (Genentech), norditropin (Novo Nordisk), genotropin (Pharmacia Upjohn), humatrop (Eli Lilly), saisen or serostim (Serono)) are widely used in medicine for the treatment of growth hormone deficiency and Turner syndrome .
Известен способ получения соматотропина, состоящий в его выделении из тканей гипофиза человека [Simionescu L., Dimitriu V., Zamfir-Grigorescu D., Aman E., Terbancea M.// The simultaneous isolation of human pituitary hormones. I. Human growth hormone. Endocrinologie 1982 Oct.-Dec.; 20(4):273-83]. Недостатками способа являются сложность с получением исходного материала и риск заражения инфекцией [Rappaport Е.В.// Iatrogenic Creutzfeldt-Jakob disease. Neurology, 1987, Sep.; 37(9):1520-2].A known method of producing growth hormone, consisting in its isolation from the tissues of the human pituitary gland [Simionescu L., Dimitriu V., Zamfir-Grigorescu D., Aman E., Terbancea M. // The simultaneous isolation of human pituitary hormones. I. Human growth hormone. Endocrinologie 1982 Oct.-Dec .; 20 (4): 273-83]. The disadvantages of the method are the difficulty in obtaining the source material and the risk of infection [Rappaport E.V. // Iatrogenic Creutzfeldt-Jakob disease. Neurology, 1987, Sep .; 37 (9): 1520-2].
В настоящее время известно два основных способа получения рекомбинантного соматотропина.Currently, there are two main methods for producing recombinant growth hormone.
Способ, основанный на получении рекомбинантного соматотропина в трансформированных клетках мыши линии С 127 [Carter M.J., Facklam T.J., Long P.C., Scotland R.A.// Are continuous cell lines safe as substrates for human drugs and biologies? A case study with human growth hormone. Dev Biol Stand 1989; 70:101-7]. При таком подходе удается получить гормон роста человека в правильной конформации с хорошей физиологической активностью. Недостатками этого способа являются чрезвычайно низкий выход и длительное время культивации продуцирующих клеток.A method based on the production of recombinant growth hormone in transformed mouse cells of the C 127 line [Carter M.J., Facklam T.J., Long P.C., Scotland R.A. // Are continuous cell lines safe as substrates for human drugs and biologies? A case study with human growth hormone. Dev Biol Stand 1989; 70: 101-7]. With this approach, it is possible to obtain human growth hormone in the correct conformation with good physiological activity. The disadvantages of this method are the extremely low yield and the long cultivation time of the producing cells.
А также способ получения соматотропина, включающий экспрессию в клетках Escherichia coli, заключающийся в достаточно быстром биосинтезе клетками бактерий рекомбинантного соматотропина в виде нерастворимых “телец включения” [Olson К.С., Fenno J., Lin N., Harkins R.N., Snider C., Kohr W.H., Ross M.J., Fodge D., Prender G., Stebbing N.// Purified human growth hormone from E. coli is biologically active. Nature 1981 Oct. 1; 293(5831):408-11]. При использовании данного общего способа получения соматотропина уровень биосинтеза целевого белка может колебаться в широких пределах.As well as a method of producing growth hormone, including expression in Escherichia coli cells, which consists in a sufficiently rapid biosynthesis of recombinant growth hormone in the form of insoluble “inclusion bodies” by bacterial cells [Olson KS, Fenno J., Lin N., Harkins RN, Snider C. , Kohr WH, Ross MJ, Fodge D., Prender G., Stebbing N. // Purified human growth hormone from E. coli is biologically active. Nature 1981 Oct. 1; 293 (5831): 408-11]. When using this General method of producing growth hormone, the level of biosynthesis of the target protein can vary widely.
Наиболее близким по технической сущности к предлагаемому изобретению является продуцент соматотропина на основе плазмиды pHGH 107 (патент США №5795745, МКИ С 12 В 21/02), несущей под контролем двух последовательных Lac-промоторов ген соматотропина, состоящий из синтетической части (соответствующей аминокислотам 1-24) и фрагмента природного гена (соответствующего аминокислотам 25-191). Использование Lac-промоторов, а также почти полностью (на 88%) природной кДНК, включающей редко встречающиеся в генах Escherichia coli (минорные) кодоны, приводит к существенному снижению уровня биосинтеза белка относительно теоретически возможного.The closest in technical essence to the present invention is a somatotropin producer based on plasmid pHGH 107 (US patent No. 5795745, MKI C 12 V 21/02), which carries under the control of two consecutive Lac promoters a somatotropin gene consisting of a synthetic part (corresponding to amino acids 1 -24) and a fragment of a natural gene (corresponding to amino acids 25-191). The use of Lac promoters, as well as almost completely (88%) of natural cDNA, including codons that are rarely found in Escherichia coli genes, leads to a significant decrease in the level of protein biosynthesis relative to the theoretically possible one.
Изобретение решает задачу конструирования плазмиды, детерминирующей синтез рекомбинантного белка, и создания высокопродуктивного бактериального штамма-продуцента, позволяющего получать рекомбинантный соматотропин с высоким выходом и по упрощенной технологии.The invention solves the problem of constructing a plasmid that determines the synthesis of recombinant protein, and create a highly productive bacterial producer strain that allows to obtain recombinant somatotropin in high yield and using simplified technology.
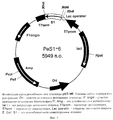
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pES1-6, кодирующей полипептид с последовательностью соматотропина, имеющей молекулярную массу 3,66 Мда (5949 п.о.); состоящей из: NdeI/XhoII-фрагмента ДНК плазмиды pет 22b(+), содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы, и NdeI/XhoI-фрагмента ДНК, содержащего последовательность искусственного гена рекомбинантного соматотропина; содержащую: в качестве генетического маркера ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pES1-6 клеток Е.coli к ампициллину; уникальные сайты узнавания эндонуклеаз рестрикции, расположенные на следующем расстоянии вправо от сайта NdeI: XbaI - 38 п.о., НраI - 1332 п.о., PstI - 4065 п.о., PvuI - 4190 п.о., XhoI - 5363 п.о., а также штамма-продуцента Escherichia coli BL21(DE3)/pES1-6, содержащего рекомбинантную плазмидную ДНК pES1-6 - продуцент рекомбинантного соматотропина, обеспечивающего синтез рекомбинантного соматотропина в количестве 60-70% от суммарного содержания белка клеток.The problem is solved by constructing a recombinant plasmid DNA pES1-6 encoding a polypeptide with a somatotropin sequence having a molecular weight of 3.66 Mda (5949 bp); consisting of: an NdeI / XhoII DNA fragment of plasmid pet 22b (+) containing a promoter and terminator for transcription of T7 RNA polymerase, a translation enhancer of T7 phage 10 gene, β-lactamase gene, and an NdeI / XhoI DNA fragment containing an artificial recombinant somatotropin gene; containing: as a genetic marker, a β-lactamase gene that determines the resistance of ampicillin to E. coli transformed with plasmid pES1-6; unique recognition sites for restriction endonucleases located to the right of the NdeI site: XbaI - 38 bp, HraI - 1332 bp, PstI - 4065 bp, PvuI - 4190 bp, XhoI - 5363 bp, as well as the producer strain Escherichia coli BL21 (DE3) / pES1-6, containing recombinant plasmid DNA pES1-6 - producer of recombinant growth hormone, which provides the synthesis of recombinant growth hormone in the amount of 60-70% of the total protein content of cells.
Преимущества предлагаемого изобретения заключаются, во-первых, в использовании при химико-ферментативном синтезе гена соматотропина максимально широкого набора кодонов, являющихся оптимальными для продукции белка в Escherichia coli, расположение которых в синтетическом гене устраняет возможность образования на синтезируемой мРНК протяженных "шпилек", потенциально ингибирующих трансляцию. На фиг. 1 приведена аминокислотная последовательность соматотропина и соответствующая ей нуклеотидная последовательность гена: верхняя строка - природная кДНК соматотропина, нижняя строка - синтезированный искусственный ген. Во-вторых, - применение для биосинтеза рекомбинантного белка оптимальных регуляторных элементов, контролирующих его экспрессию: Т7-lас промотора для предотвращения базальной экспрессии гена до момента начала индукции и высокого уровня транскрипции соответствующей мРНК при индукции, высокоэффективного терминатора транскрипции Т7 и блока различных стоп-кодонов, исключающих биосинтез удлиненных вариантов рекомбинантного соматотропина. Преимущество предлагаемого штамма E.coli заключается в использовании бактерий с фенотипом Lon OmpT, что исключает возможность протеолитического расщепления синтезируемого de novo рекомбинантного соматотропина и загрязнения выделяемого белка наиболее активными протеазами E.coli.The advantages of the present invention are, firstly, in the use of the somatotropin gene for chemical and enzymatic synthesis of the widest possible set of codons that are optimal for the production of protein in Escherichia coli, the location of which in the synthetic gene eliminates the possibility of the formation of extended "hairpins" on the mRNA that are synthesized, broadcast. In FIG. Figure 1 shows the amino acid sequence of somatotropin and the corresponding nucleotide sequence of the gene: the top line is the natural somatotropin cDNA, the bottom line is the synthesized artificial gene. Secondly, the use of optimal regulatory elements that control its expression for biosynthesis of the recombinant protein: the T7-lac promoter to prevent basal gene expression until induction and a high level of transcription of the corresponding mRNA during induction, a highly efficient T7 transcription terminator and a block of various stop codons excluding the biosynthesis of elongated variants of recombinant growth hormone. The advantage of the proposed E. coli strain is the use of bacteria with the Lon OmpT phenotype, which excludes the possibility of proteolytic cleavage of the synthesized de novo recombinant somatotropin and contamination of the secreted protein with the most active E. coli proteases.
Конструирование нового гена, кодирующего соматотропин человека, осуществляют на основе плазмиды рЕТ22b(+). Искусственный ген, кодирующий соматотропин, фланкированный сайтами рестриктаз NdeI и XhoI, получают химико-ферментативным синтезом набора олигонуклеотидных фрагментов с последующей их сборкой и амплификацией при помощи полимеразной цепной реакции (ПЦР). Перед лигированием для генерации липких концов амплификат и векторную плазмиду обрабатывают рестриктазами NdeI и XhoI. Лигазную смесь используют для трансформации компетентных клеток Е.coli DH5α. Отбор положительных клонов проводят при помощи ПЦР с использованием специфических праймеров, с последующим рестриктным анализом выделенной плазмидной ДНК рестриктазами NaeI и XhoI. Структуру гена, кодирующего рекомбинантный соматотропин, определяют секвенированием по методу Сенгера.The construction of a new gene encoding human growth hormone is carried out on the basis of plasmid pET22b (+). An artificial gene encoding somatotropin flanked by the restriction enzyme sites NdeI and XhoI is obtained by enzyme-chemical synthesis of a set of oligonucleotide fragments, followed by their assembly and amplification by polymerase chain reaction (PCR). Before ligation to generate sticky ends, the amplification and the vector plasmid are treated with restriction enzymes NdeI and XhoI. The ligase mixture is used to transform competent E. coli DH5α cells. The selection of positive clones is carried out by PCR using specific primers, followed by restriction analysis of the isolated plasmid DNA with restriction enzymes NaeI and XhoI. The structure of the gene encoding the recombinant growth hormone is determined by sequencing according to the Sanger method.
Она должна полностью соответствовать нуклеотидной последовательности исходного искусственного гена соматотропина (фиг.1).It should fully correspond to the nucleotide sequence of the original artificial somatotropin gene (Fig. 1).
Рекомбинантная плазмидная ДНК pES1-6, кодирующая полипептид соматотропин, характеризуется следующими признаками:Recombinant plasmid DNA pES1-6 encoding a somatotropin polypeptide is characterized by the following features:
- имеет молекулярную массу 3,66 МДа;- has a molecular weight of 3.66 MDa;
- кодирует полипептид соматотропин;- encodes a somatotropin polypeptide;
- состоит из: NdеI/XhoI-фрагмента ДНК плазмиды рЕТ22b(+), содержащей промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы и NdеI/XhoI-фрагмента ДНК, включающего искусственный ген соматотропина;- consists of: NdeI / XhoI DNA fragment of plasmid pET22b (+), containing the promoter and terminator of transcription of T7 RNA polymerase, translation enhancer of T7 phage 10 gene, β-lactamase gene and NdeI / XhoI DNA fragment, including the artificial somatotropin gene ;
- имеет уникальную совокупность признаков: промотор и терминатор транскрипции РНК-полимеразы бактериофага Т7, усилитель трансляции гена 10 бактериофага Т7; искусственный ген, кодирующий соматотропин; ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pES1-6 клеток Е.coli к ампициллину; уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии вправо от сайта NdеI:XhoI - 38 п.о., НраI - 1332 п.о., PstI - 4065 п.о., PvuI - 4190 п.о., XhoI - 5363 п.о.- has a unique combination of features: promoter and terminator of transcription of RNA polymerase of bacteriophage T7, translation enhancer of gene 10 of bacteriophage T7; an artificial gene encoding somatotropin; a β-lactamase gene that determines the resistance of ampicillin to E. coli transformed with plasmid pES1-6; unique recognition sites for restriction endonucleases located to the right of the NdeI site: XhoI - 38 bp, HraI - 1332 bp, PstI - 4065 bp, PvuI - 4190 bp, XhoI - 5363 by.
Для получения штамма-продуцента рекомбинантного соматотропина плазмидную ДНК pES1-6 используют для трансформации компетентных клеток Escherichia coli BL21(DE3) и проводят отбор клонов, сохраняющих уровень биосинтеза рекомбинантного полипептида не ниже 60-70% от суммарного клеточного белка в течение по крайней мере шести последовательных пассирований. Для этого клоны трансформированных плазмидой pES1-6 клеток Е.coli BL21(DE3) выращивают в богатой среде (YT-, LB-бульон и др.) с добавлением ампициллина до 100 мкг/мл и раствора глюкозы до 1% в течение 12-14 часов, инокулируют новую порцию питательной среды в соотношении 1:100, растят культуру до достижения оптической плотности 1 О.Е., индуцируют изопропилтио-β-D-галактозидом и растят еще 3-6 часов. Получение из клеток продуцента рекомбинантного соматотропина включает следующие стадии: отделение бактерий от культуральной среды, их разрушение одним из обычно применяемых способов; отмывку буферными растворами телец включения от водорастворимых компонентов клетки; солюбилизацию и восстановление целевого белка, его рефолдинг и окончательную очистку.To obtain a producer strain of recombinant somatotropin, pES1-6 plasmid DNA is used to transform competent Escherichia coli BL21 (DE3) cells and select clones that maintain the level of biosynthesis of the recombinant polypeptide at least 60-70% of the total cellular protein for at least six consecutive passings. For this, clones of E. coli BL21 (DE3) cells transformed with plasmid pES1-6 are grown in a rich medium (YT-, LB-broth, etc.) with the addition of ampicillin up to 100 μg / ml and glucose solution up to 1% for 12-14 hours, inoculate a new portion of the nutrient medium in a ratio of 1: 100, grow the culture until the optical density reaches 1 O.E., induce isopropylthio-β-D-galactoside and grow another 3-6 hours. Obtaining recombinant somatotropin from producer cells involves the following steps: separating bacteria from the culture medium, destroying them using one of the commonly used methods; washing with buffer solutions of inclusion bodies from water-soluble cell components; solubilization and restoration of the target protein, its refolding and final purification.
Полученный штамм-продуцент Escherichia coli BL21(DE3)/pES1-6 характеризуется следующими признаками.The resulting producer strain Escherichia coli BL21 (DE3) / pES1-6 is characterized by the following features.
Морфологические признаки: клетки палочковидной формы, грамотрицательные, неспороносные.Morphological signs: rod-shaped cells, gram-negative, non-spore.
Культуральные признаки: при росте на агаризованной среде LB колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или YT-бульоне) образуют интенсивную ровную муть.Cultural traits: when growing on LB agar medium, the colonies are round, smooth, cloudy, shiny gray, the edge is even. When growing on liquid media (on a minimal medium with glucose or YT-broth) they form an intense smooth haze.
Физико-биологические признаки: клетки растут при температуре от 4°С до 40°С при оптимуме рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.Physico-biological characteristics: cells grow at a temperature of from 4 ° C to 40 ° C with an optimum pH of 6.8 to 7.5. As a source of nitrogen, both mineral salts in the ammonium form and organic compounds in the form of peptone, tryptone, yeast extract, amino acids, etc. are used. Amino acids, glycerin, carbohydrates are used as a carbon source.
Устойчивость к антибиотикам: клетки проявляют устойчивость к ампициллину (до 500 мкг/мл), обусловленную наличием в плазмиде гена β-лактамазы(blа).Antibiotic resistance: cells show resistance to ampicillin (up to 500 μg / ml) due to the presence of the β-lactamase (blа) gene in the plasmid.
Преимущество предлагаемого штамма-продуцента заключается в использовании бактерий с фенотипом Lon OmpT, что исключает возможность протеолитического расщепления синтезируемого de novo рекомбинантного гормона роста и загрязнения выделяемого белка наиболее активными протеазами E.coli.The advantage of the proposed producer strain is the use of bacteria with the Lon OmpT phenotype, which excludes the possibility of proteolytic cleavage of the synthesized de novo recombinant growth hormone and contamination of the secreted protein with the most active E. coli proteases.
Клетки Е.coli BL21(DE3)/pES1-6 являются суперпродуцентом. При индукции изопропилтио-β-D-галактозидом происходит эффективный биосинтез рекомбинантного соматотропина, который накапливается в клетках в количестве более 60% суммарного белка бактерий.E. coli BL21 (DE3) / pES1-6 cells are superproducers. When isopropylthio-β-D-galactoside is induced, an effective biosynthesis of recombinant growth hormone occurs, which accumulates in the cells in an amount of more than 60% of the total bacterial protein.
На фиг.1 представлена нуклеотидная последовательность и кодируемая ею аминокислотная последовательность NdеI/XhoI-фрагмента плазмиды pES1-6; на фиг.2 - физическая карта плазмиды pES1-6.Figure 1 shows the nucleotide sequence and its encoded amino acid sequence of the NdeI / XhoI fragment of plasmid pES1-6; figure 2 is a physical map of the plasmid pES1-6.
Изобретение иллюстрируют примеры.The invention is illustrated by examples.
Пример 1.Example 1
Конструирование рекомбинантной плазм идной ДНК pES1-6.Construction of recombinant plasmid DNA pES1-6.
Нуклеотидную последовательность, соответствующую гену соматотропина, получают химико-ферментативным синтезом. Для этого теоретически рассчитанную последовательность ДНК разбивают на перекрывающиеся фрагменты размером около 50 п.о. Химический синтез олигонуклеотидов, соответствующих этим фрагментам, выполняют твердофазным фосфоамидитным методом при помощи, например, ДНК-синтезатора ASM-102U (БИОССЕТ, Новосибирск) с наращиванием олигонуклеотидной цепи в направлении от 3’-конца к 5’-концу с помощью защищенных фосфамидитов - 5’-диметокситритил-N-ацил-2’-дезоксинуклеозид-3’-O-(β-цианэтил-диизопропиламино)-фосфитов, активированных тетразолом. Синтез проводят в масштабе 0,5-0,7 мкмоль, используя в качестве носителя пористое стекло (размер пор 500 А), к которому через 3’-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 20-30 мкмоль/г). Полученные олигонуклеотиды подвергают 5’-концевому фосфорилированию с использованием Т4 полинуклеотидкиназы (Fermentas, Литва). Для этого олигонуклеотиды в количестве 20 пмоль смешивают с ферментом в количестве 10 ед. в буферном растворе, содержащем 50 мМ Tris-HCl (pH 7,6 при 25°С), 10 мМ MgCl2, 5 мМ дитиотреита, 1 мМ спермидина, 0,1 мМ АТФ и 0,1 мМ ЭДТА. Реакцию ведут 30 минут, полинуклеотид киназу инактивируют нагреванием до 65°С в течение 10 мин.The nucleotide sequence corresponding to the somatotropin gene is obtained by chemical-enzymatic synthesis. To do this, the theoretically calculated DNA sequence is divided into overlapping fragments of about 50 bp in size. Chemical synthesis of oligonucleotides corresponding to these fragments is carried out by the solid-state phosphoamidite method using, for example, ASM-102U DNA synthesizer (BIOSSET, Novosibirsk) with the oligonucleotide chain being extended from the 3'-end to the 5'-end using protected phosphamidites - 5 '-dimethoxytrityl-N-acyl-2'-deoxynucleoside-3'-O- (β-cyanethyl-diisopropylamino) phosphites activated by tetrazole. The synthesis is carried out on a scale of 0.5-0.7 μmol, using porous glass (pore size 500 A) as a carrier, to which the first nucleoside unit (load 20-30 μmol / g) is connected via a 3'-succinate bond. The resulting oligonucleotides are subjected to 5'-terminal phosphorylation using T4 polynucleotide kinase (Fermentas, Lithuania). For this, oligonucleotides in an amount of 20 pmol are mixed with the enzyme in an amount of 10 units. in a buffer solution containing 50 mM Tris-HCl (pH 7.6 at 25 ° C), 10 mM MgCl 2 , 5 mM dithiotreite, 1 mM spermidine, 0.1 mM ATP and 0.1 mM EDTA. The reaction is carried out for 30 minutes, the polynucleotide kinase is inactivated by heating to 65 ° C for 10 minutes.
Фософрилированные олигонуклеотиды смешивают в эквимолярном соотношении в 50 мкл буфера, содержащего 20 мМ трис-HCl, pH 7,56, 10 мМ MgCl2, 0,2 мМ rАТР, 10 мМ дитиотреита, прогревают до 65°С, медленно охлаждают до 37°С в течение часа и добавляют 10 ед.ак. Т4-ДНК-лигазы. Реакцию лигирования ДНК проводят 4 ч при 37°С. 0,1 мкл полученного раствора используют в качестве матрицы в полимеразной цепной реакции (ПЦР) в присутствии термостабильной ДНК-полимеразы Pfu и специфических праймеровPhosphorylated oligonucleotides are mixed in an equimolar ratio of 50 μl of buffer containing 20 mM Tris-HCl, pH 7.56, 10 mM MgCl 2 , 0.2 mM rATP, 10 mM dithiothreit, heated to 65 ° C, slowly cooled to 37 ° C within an hour and add 10 units T4 DNA ligases. The DNA ligation reaction is carried out for 4 hours at 37 ° C. 0.1 μl of the resulting solution is used as a template in the polymerase chain reaction (PCR) in the presence of thermostable Pfu DNA polymerase and specific primers
5’ATATTCCCGACCATCCCACTGTC3’ и5'ATA TTCCCGACCATCCCACTGTC3 'and
5’CCGTCATTAGAAGCCACAGCTGCCC3’.5'CCG TCATTAGAAGCCACAGCTGCCC3 '.
Проводят 25 циклов амплификации (95°С, 20 с; 62°С, 40 с; 72°С, 60 с) для синтеза полноразмерного фрагмента ДНК, содержащего последовательность гена соматотропина, фланкированного сайтами узнавания рестриктаз NdeI и XhoI. Продукт амплификации гидролизуют рестриктазами NdeI и XhoI, очищают электрофорезом в 5% акриламидном геле, полосу ДНК величиной около 600 п.о. выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.25 amplification cycles (95 ° C, 20 s; 62 ° C, 40 s; 72 ° C, 60 s) are carried out to synthesize a full-sized DNA fragment containing the somatotropin gene sequence flanked by the NdeI and XhoI restriction enzyme recognition sites. The amplification product is hydrolyzed with restriction enzymes NdeI and XhoI, purified by electrophoresis in 5% acrylamide gel, a DNA strip of about 600 bp. isolated from the gel by electroelution and precipitated DNA from the solution with ethanol.
Для приготовления вектора ДНК плазмиды рЕТ-22b(+) (3 мкг, 1 пмоль) обрабатывают в 40 мкл буфера Y (33 мМ трис-ацетат, pH 7,9, 10 мМ Mg-ацетат,66 мМ К-ацетат 1, 0,5 мМ DTT, 0,1 мг/мл BSA) рестриктазой NdeI (10 ед. акт.), осаждают ДНК этанолом, растворяют в 40 мкл буфера R (10 мМ трис-HCl, рН 8,5, 10 мМ MgCl2, 100 мМ КСl, 0,1 мг/мл BSA) и обрабатывают рестриктазой XhoI (10 ед. акт.) в течение 1 ч при 37°С. Полученный фрагмент ДНК величиной 5,4 т.п.о. после электрофоретического разделения в 1% агарозном геле выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.To prepare the DNA vector of plasmid pET-22b (+) (3 μg, 1 pmol), it is treated with 40 μl of Y buffer (33 mM Tris-acetate, pH 7.9, 10 mM Mg-acetate, 66 mM K-acetate 1, 0 , 5 mM DTT, 0.1 mg / ml BSA) with restriction enzyme NdeI (10 units act.), DNA is precipitated with ethanol, dissolved in 40 μl of buffer R (10 mm Tris-HCl, pH 8.5, 10 mm MgCl 2 , 100 mM KCl, 0.1 mg / ml BSA) and treated with restriction enzyme XhoI (10 units act.) For 1 h at 37 ° C. The resulting DNA fragment of 5.4 kbp after electrophoretic separation in a 1% agarose gel, it is isolated from the gel by electroelution and DNA is precipitated from the solution with ethanol.
1 мкг полученного векторного фрагмента лигируют с 2 пмоль NdeI/XhoI-фрагмента размером 600 п.о., содержащего синтетический ген рекомбинантного соматотропина, в 10 мкл буфера (20 мМ трис-HCl, рН 7,56, 10 мМ MgCl2, 0,2 мМ rATP, 10 мМ дитиотреита) с помощью 10 ед. акт. Т4-ДНК-лигазы в течение 12 ч при 10°С.1 μg of the obtained vector fragment is ligated with 2 pmol of a 600 bp NdeI / XhoI fragment containing the synthetic recombinant somatotropin gene in 10 μl of buffer (20 mM Tris-HCl, pH 7.56, 10 mM MgCl 2 , 0, 2 mM rATP, 10 mM dithiothreitis) using 10 units. Act. T4 DNA ligases for 12 hours at 10 ° C.
1 мкл полученной лигазной смеси используют для электротрансформации компетентных клеток Е.coli BL21(DE3), которую проводят, например, при помощи аппарата для электротрансформации ВТХ 600 при зазоре между пластинами электропорационной кюветы 1 мм и напряжении разряда 1,4 кВ. После трансформации суспензию бактерий смешивают с питательной средой SOC, растят 1 час на +37°С и высевают на чашки Петри с LB-агаром, содержащим 50 мкг/мл ампициллина.1 μl of the obtained ligase mixture is used for electrotransformation of competent E. coli BL21 cells (DE3), which is carried out, for example, using an apparatus for electrotransformation BTX 600 with a gap between the plates of the electroporation cell 1 mm and a discharge voltage of 1.4 kV. After transformation, the bacterial suspension is mixed with SOC growth medium, grown for 1 hour at + 37 ° C and plated on Petri dishes with LB agar containing 50 μg / ml ampicillin.
Первичный отбор клонов, содержащих нужную плазмиду, проводят методом "ПЦР с клонов" с использованием специфических праймеровThe primary selection of clones containing the desired plasmid is carried out by the method of "PCR from clones" using specific primers
5’ATATTCCCGACCATCCCACTGTC3’ и5'ATA TTCCCGACCATCCCACTGTC3 'and
5’CCGTCATTAGAAGCCACAGCTGCCC3’.5'CCG TCATTAGAAGCCACAGCTGCCC3 '.
Провоят 25 циклов амплификации (95°С, 20 с; 62°С, 40 с; 72°С, 60 с), с последующим электрофоретическим анализом ПЦР продуктов в 1% агарозном геле на наличие ПЦР-продукта длиной около 600 п.н. Отобранные клоны используют для подроста в жидкой среде и выделения плазмидной ДНК плазмиды, которую анализируют на наличие вставки с помощью эндонуклеаз рестрикции NdeI и XhoI с последующим разделением продуктов гидролиза в 5% полиакриламидном геле. Окончательное строение плазмид, содержащих NdeI/XhoI-фрагмент около 600 п.о., подтверждают определением нуклеотидной последовательности методом секвенирования по Сенгеру. По данным секвенирования отбирают ту плазмиду, нуклеотидная и соответствующая ей аминокислотная последовательности NdeI/XhoI-фрагмента которой полностью идентичны первоначально запланированной (фиг.1). Проводят трансформацию клеток Е.coli BL21(DE3) выбранной плазмидой, как описано выше, петлей переносят 5-10 колоний в 5 мл жидкой среды 2xYT, содержащей 50 мкг/мл ампициллина, в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, отбирают аликвоту культуры для последующего анализа, прибавляют индуктор - изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают рост еще 2 ч. Равные аликвоты суспензии клеток, отобранных до внесения индуктора и после завершения роста центрифугируют, отделяют супернатант и анализируют осадок клеток электрофорезом в ППАГ, как описано в примере 2. Появление отчетливо видимой полосы белка в районе 20 КДа в образце пробы, отобранной после индукции, свидетельствует о способности штамма синтезировать рекомбинантный соматотропин при индукции IPTG и полностью подтверждает корректность сборки плазмиды.25 amplification cycles are observed (95 ° C, 20 s; 62 ° C, 40 s; 72 ° C, 60 s), followed by electrophoretic analysis of PCR products in 1% agarose gel for the presence of a PCR product of about 600 bp in length. The selected clones are used for the adolescent in a liquid medium and plasmid DNA isolation of the plasmid, which is analyzed for the presence of insert using restriction endonucleases NdeI and XhoI, followed by separation of the hydrolysis products in 5% polyacrylamide gel. The final structure of plasmids containing an NdeI / XhoI fragment of about 600 bp is confirmed by the determination of the nucleotide sequence by Sanger sequencing. According to sequencing data, that plasmid is selected whose nucleotide and its corresponding amino acid sequence of the NdeI / XhoI fragment of which are completely identical to the originally planned (Fig. 1). E. coli BL21 (DE3) cells are transformed with the selected plasmid as described above, 5-10 colonies are transferred in a loop in 5 ml of 2xYT liquid medium containing 50 μg / ml ampicillin for 2 hours on a shaker at a speed of 190 rpm to a turbidity A 550 0.7-0.8, an aliquot of the culture is taken for subsequent analysis, the inducer isopropylthio-β-D-galactoside is added to a concentration of 0.2 mM, and growth is continued for another 2 hours. Equal aliquots of the cell suspension selected prior to application inducer and after growth is centrifuged, the supernatant is separated and the cell pellet is analyzed PPAG to electrophoresis as described in Example 2. The appearance of protein bands clearly visible around 20 kDa in the specimen sample collected after induction, indicates the ability of the strain to synthesize the recombinant somatotropin with IPTG induction and fully confirms the correctness of the assembly plasmid.
Пример 2.Example 2
Получение штамма-продуцента Е.coli BL21(DE3)/pes1-6 с рекомбинантным гормоном роста и определение его продуктивности.Obtaining a producer strain of E. coli BL21 (DE3) / pes1-6 with recombinant growth hormone and determining its productivity.
Штамм-продуцент Е.coli BL21(DE3)/pES1-6 получают трансформацией компетентных клеток Е.coli BL21(DE3) плазмидой pES1-6, как описано в примере 1.The E. coli BL21 (DE3) / pES1-6 producer strain is obtained by transforming competent E. coli BL21 (DE3) cells with the plasmid pES1-6, as described in Example 1.
Штамм продуцента Е.coli BL21(DE3)/pES1-6 выращивают при 37°С в 100 мл YT-бульона (рН 7,0) с 50 мкг/мл ампициллина в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, прибавляют изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают процесс еще 6 ч или продолжают выращивание в отсутствие индуктора в течение 6 ч. Каждый час отбирают пробу по 2 мл, определяют А550 и количество культуры, соответствующее 1 мл с А550 1,0, центрифугируют 5 мин при 6000 об/мин. Осажденные клетки в 100 мкл лизирующего буфера с красителем бромфеноловым синим обрабатывают 20 с ультразвуком, нагревают 3 мин при 100°С и пробы по 1 мкл используют для электрофореза в 15% SDS-ПААГ. Гель прокрашивают кумасси R-250 по стандартной методике и сканируют для определения относительного количества белка в полосе целевого белка. По данным сканирования содержание рекомбинантного соматотропина составляет 60-70% от всех клеточных белков.The producer strain E. coli BL21 (DE3) / pES1-6 was grown at 37 ° C in 100 ml of YT broth (pH 7.0) with 50 μg / ml ampicillin for 2 hours on a shaker at a speed of 190 rpm to turbidity A 550 0.7-0.8, add isopropylthio-β-D-galactoside to a concentration of 0.2 mm and continue the process for another 6 hours or continue growing in the absence of an inductor for 6 hours. Every hour, a 2 ml sample is taken, A 550 is determined and the amount of culture corresponding to 1 ml with A 550 1.0, centrifuged for 5 minutes at 6000 rpm. Precipitated cells in 100 μl of lysing buffer with dye bromphenol blue are treated with 20 ultrasound, heated for 3 min at 100 ° C and samples of 1 μl are used for electrophoresis in 15% SDS-PAGE. The gel was stained with Coomassie R-250 according to standard procedures and scanned to determine the relative amount of protein in the target protein band. According to the scan, the content of recombinant growth hormone is 60-70% of all cellular proteins.
Claims (2)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2002133932/13A RU2233879C1 (en) | 2002-12-17 | 2002-12-17 | Recombinant plasmid dna pes1-6 encoding polypeptide somatotropin and strain escherichia coli bl21(de3)/pes1-6 as producer of recombinant somatotropin |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2002133932/13A RU2233879C1 (en) | 2002-12-17 | 2002-12-17 | Recombinant plasmid dna pes1-6 encoding polypeptide somatotropin and strain escherichia coli bl21(de3)/pes1-6 as producer of recombinant somatotropin |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2002133932A RU2002133932A (en) | 2004-07-27 |
| RU2233879C1 true RU2233879C1 (en) | 2004-08-10 |
Family
ID=33413531
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2002133932/13A RU2233879C1 (en) | 2002-12-17 | 2002-12-17 | Recombinant plasmid dna pes1-6 encoding polypeptide somatotropin and strain escherichia coli bl21(de3)/pes1-6 as producer of recombinant somatotropin |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2233879C1 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2465315C1 (en) * | 2011-08-08 | 2012-10-27 | Общество с ограниченной ответственностью "Амбер" | RECOMBINANT PLASMID DNA pPBS-St9 CODING SOMATOTROPIN POLYPEPTIDE, AND SACCHAROMYCES CEREVISIAE YEAST STRAIN FOR PRODUCING RECOMBINANT SOMATOTROPIN |
| WO2019070162A1 (en) * | 2017-10-08 | 2019-04-11 | Илья Владимирович ДУХОВЛИНОВ | Production strain of somatotropin, primarily in monomeric form |
-
2002
- 2002-12-17 RU RU2002133932/13A patent/RU2233879C1/en active
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2465315C1 (en) * | 2011-08-08 | 2012-10-27 | Общество с ограниченной ответственностью "Амбер" | RECOMBINANT PLASMID DNA pPBS-St9 CODING SOMATOTROPIN POLYPEPTIDE, AND SACCHAROMYCES CEREVISIAE YEAST STRAIN FOR PRODUCING RECOMBINANT SOMATOTROPIN |
| WO2019070162A1 (en) * | 2017-10-08 | 2019-04-11 | Илья Владимирович ДУХОВЛИНОВ | Production strain of somatotropin, primarily in monomeric form |
| EA035207B1 (en) * | 2017-10-08 | 2020-05-15 | Илья Владимирович ДУХОВЛИНОВ | Strain of escherichia coli bl21 (de3)/pet-21a(+) bacteria - producer of predominantly monomeric somatotropine |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR860001230B1 (en) | Cutting method of double stranded dna | |
| KR900005776B1 (en) | Process for the preparation of interferon | |
| WO2002014468A9 (en) | Phage-dependent superproduction of biologically active protein and peptides | |
| RU2233879C1 (en) | Recombinant plasmid dna pes1-6 encoding polypeptide somatotropin and strain escherichia coli bl21(de3)/pes1-6 as producer of recombinant somatotropin | |
| CN101497863B (en) | Method for preparing N-terminated acetylated thymosin alpha 1 and special engineering bacteria therefor | |
| RU2610173C1 (en) | Recombinant plasmid pfm-ifn-17 providing expression of interferon alpha-2b of human, recombinant plasmid pfm-ap, providing expression of enzyme methionine-aminopeptidase e coli, biplasmid strain escherichia coli fm-ifn-ap (pfm-ifn-17, pfm-ap) - producer (met-) of recombinant interferon alpha -2b of human | |
| SU1479005A3 (en) | Method of producing human interleukin | |
| JP2545377B2 (en) | DNA sequence | |
| RU2260049C2 (en) | Recombinant plasmid dna pes3-7 encoding peptide with sequence of human granulocyte colony-stimulating factor (g-csf) and strain escherichia coli bl21(de3)/pes3-7 as producer of human recombinant g-csf | |
| RU2258081C1 (en) | Recombinant plasmid dna pes4-4 encoding human polypeptide interferon alpha-2b and strain escherichia coli brees4 as producer of recombinant human interferon alpha-2b | |
| RU2302465C2 (en) | METHOD FOR PRODUCTION OF HUMAN GENE ENGINEERED GLUCAGONE, RECOMBINANT PLASMIDE DNA pER-Gl, ENCODING AUTOCATALITICALLY CLEAVABLE HYBRID PROTEIN FORMING HUMAN GLUCAGONE AND STRAIN OF Escherichia coli ER-2566/pER-Gl AS PRODUCER OF SAID PROTEIN | |
| KR100890184B1 (en) | PREPARATION METHOD OF RECOMBINANT PROTEIN BY USE OF SlyD AS A FUSION EXPRESSION PARTNER | |
| RU2261913C1 (en) | RECOMBINANT PLASMID DNA pES6-1 ENCODING HUMAN POLYPEPTIDE INTERFERON BETA-1b AND STRAIN Escherichia coli BDEES6 AS PRODUCER OF HUMAN RECOMBINANT INTERFERON BETA-1b | |
| RU2323976C2 (en) | METHOD OF OBTAINING OF GENI-ENGENIERING ECDERONIC FACTOR OF PERSON GROWTH, PLASM RECOMBINATION DNA pER-hEGF, CODING HYBRID PROTEIN CAPABLE FOR AUTO-CATALYTIC SPLITTING, CAPABLE FOR AUTO-CATALYTIC SPLITTING WITH GENERATING OF EPIDERMAL FACTOR OF PERSON GROWTH, AND STAMP Escherichia coli ER2566/pER-hEGF-PRODUCER OF MENTIONED PROTEIN | |
| RU2465315C1 (en) | RECOMBINANT PLASMID DNA pPBS-St9 CODING SOMATOTROPIN POLYPEPTIDE, AND SACCHAROMYCES CEREVISIAE YEAST STRAIN FOR PRODUCING RECOMBINANT SOMATOTROPIN | |
| CN1167799C (en) | Method for secreting and expressing acid fibroblast growth factor | |
| KR100890187B1 (en) | PREPARATION METHOD OF RECOMBINANT PROTEIN BY USE OF Tsf AS A FUSION EXPRESSION PARTNER | |
| JPH0691832B2 (en) | Methods for improving the production of polypeptides | |
| JPH0928380A (en) | Control factor related to expression of nitrilase gane and the gane | |
| RU2426787C2 (en) | RECOMBINANT PLASMID DNA pET32M/mTrx-rhIL-11 CODING HUMAN INTERLEUKIN-11, METHOD OF PRODUCING AND Escherichia coli BL21 (DE3)/pET32M/mTrx-rhIL-11 STRAIN - PRODUCER OF RECOMBINANT INTERLEUKIN-11 | |
| WO2012128661A1 (en) | Fusion protein, fusion protein-producing strain of escherichia coli bacteria and a method for producing methionine-free human interferon alpha-2b from said fusion protein | |
| RU2181771C1 (en) | Recombinant plasmid dna perpins1 encoding amino acid sequence of human recombinant proinsulin and strain escherichia coli bl21(de3)/perpins1 as producer of human recombinant proinsulin | |
| SU1703693A1 (en) | Dna ppr-il 2-19 recombination plasmid which codes human interleucine-2 synthesis and structure escherichia coli strain, human interleucine-2 producent | |
| JP2628883B2 (en) | Fish growth hormone gene, recombinant plasmid of the gene, organism containing the recombinant plasmid, method of producing fish growth hormone by the organism, and method of promoting fish growth by the growth hormone | |
| KR100890183B1 (en) | Preparation method of recombinant protein by use of malate dehydrogenase as a fusion expression partner |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC43 | Official registration of the transfer of the exclusive right without contract for inventions |
Effective date: 20161202 |
|
| PD4A | Correction of name of patent owner |