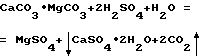RU2198842C2 - Способ получения оксида магния - Google Patents
Способ получения оксида магния Download PDFInfo
- Publication number
- RU2198842C2 RU2198842C2 RU2001106316/12A RU2001106316A RU2198842C2 RU 2198842 C2 RU2198842 C2 RU 2198842C2 RU 2001106316/12 A RU2001106316/12 A RU 2001106316/12A RU 2001106316 A RU2001106316 A RU 2001106316A RU 2198842 C2 RU2198842 C2 RU 2198842C2
- Authority
- RU
- Russia
- Prior art keywords
- magnesium oxide
- magnesium
- dolomite
- solution
- precipitate
- Prior art date
Links
Images
Landscapes
- Compounds Of Alkaline-Earth Elements, Aluminum Or Rare-Earth Metals (AREA)
Abstract
Изобретение относится к производству оксида магния, используемого, например, при производстве огнеупорных материалов, в электрохимической и целлюлознобумажной промышленности, в строительстве. Способ получения оксида магния заключается в обработке природного доломита серной кислотой или смесью серной и соляной кислот в молярном соотношении 1:2. После отделения раствора солей магния от осадка осаждают гидроксид магния из раствора щелочным реагентом, обеспечивающим рН 10,6-12, затем отделяют выпавший осадок и осуществляют его термическую обработку при температуре 760-1200oС для получения огнеупорного оксида магния. Изобретение позволяет упростить технологию за счет исключения обжига доломита и использования отходов кислот, а также улучшить качество оксида магния из-за отделения соединений магния от соединений кальция. 1 табл.
Description
Изобретение относится к производству оксида магния, используемого, например, при производстве огнеупорных материалов, в электротехнической и целлюлозно-бумажной промышленности, в строительстве.
Известен способ получения оксида магния, защищенный а.с. СССР 1695622, кл. С 01 F 5/08, опубл. 10.02.1996 г.
Способ заключается в обжиге природного магнезита, выщелачивании спека раствором нитрата аммония, отделении полученного раствора и обработке его аммиаком с получением гидроксида магния и последующей прокалкой.
Недостатками способа являются высокая энергоемкость, т.к. проводится двухкратный обжиг при температуре выше 1000oС, а также высокая стоимость и труднодоступность природного магнезита.
Наиболее близким к заявляемому по технической сущности и достигаемому результату, выбранным в качестве прототипа, является способ производства оксида магния и/или продуктов его гидратации, защищенный а.с. СССР 1599304, кл. С 01 F 5/06, опубл. 15.10.1990 г.
Способ включает обработку обожженного доломита при температуре 0-100oС водным раствором органического вещества, отделение осадка от маточного раствора, промывку осадка и его сушку, при этом обработку исходного сырья ведут водным раствором, содержащим моноэтаноламин, и/или диэтаноламин, и/или пиперидины, и/или этилендиамин и соль указанных веществ с соляной, азотной, муравьиной и уксусной кислотами.
Маточный раствор подвергают регенерации диоксидом углерода при рН 7-12, отделяют образовавшийся осадок карбоната кальция, а оставшийся после отделения осадка раствор рециркулируют на стадию обработки исходного сырья.
Недостатком известного способа является сложность технологии из-за обжига доломита, использования дорогих реагентов, их регенерации.
Задача, решаемая предлагаемым изобретением, - создание экологичного способа получения оксида магния.
Технический результат от использования изобретения заключается в упрощении технологии за счет исключения обжига доломита и использования отходов кислот, а также улучшении качества оксида магния из-за отделения соединений магния от соединений кальция.
Указанный результат достигается тем, что в способе получения оксида магния, включающем обработку доломита и отделение раствора от осадка, обработку природного доломита осуществляют серной кислотой или смесью серной и соляной кислот в молярном соотношении 1:2, полученный раствор солей магния отделяют от осадка, осаждают гидрооксид магния из раствора щелочными реагентами, обеспечивающими рН 10,6-12, отделяют выпавший осадок и осуществляют его термическую обработку при температуре 500-750oС для получения каустического магнезита и 760-1200oС для получения огнеупорного оксида магния.
Способ осуществляют следующим образом.
Природный доломит - двойной карбонат магния и кальция состава CaCO3•MgCO3. Обычно содержит примеси глины, силикатов, соединения железа, органических веществ. В зависимости от примесей доломит бывает почти белого (Ковровское месторождение Владимирской области) или темно-коричневого (Гремячевское месторождение Нижегородской области) цвета.
При реакции доломита с серной кислотой в водный раствор переходит только MgSО4, т.к. сульфат кальция - плохо растворимое вещество и остается в осадке в виде гипса.
Уравнение реакций, происходящих при воздействии серной кислоты на доломит, таковы:
Реакцию необходимо проводить в разбавленной серной кислоте, т.к. происходит частичное связывание воды в двухводный гипс и раствор густеет.
Реакцию необходимо проводить в разбавленной серной кислоте, т.к. происходит частичное связывание воды в двухводный гипс и раствор густеет.
При обработке природного доломита смесью серной и соляной кислот при их молярном соотношении 1:2 происходит реакция:
В металлургической, химической и других отраслях промышленности образуется большое количество растворов серной и соляной кислот с ненормированной концентрацией, т.е. отходов, не находящих сбыта и загрязняющих окружающую среду. Например, ингибированная соляная кислота содержит 19-25 % HCl, извлеченная из отбросных газов органических производств - 20-27% HCl. Серная кислота, регенерированная из сернистого газа металлургических и других производств, содержит до 75% Н2SO4.
В металлургической, химической и других отраслях промышленности образуется большое количество растворов серной и соляной кислот с ненормированной концентрацией, т.е. отходов, не находящих сбыта и загрязняющих окружающую среду. Например, ингибированная соляная кислота содержит 19-25 % HCl, извлеченная из отбросных газов органических производств - 20-27% HCl. Серная кислота, регенерированная из сернистого газа металлургических и других производств, содержит до 75% Н2SO4.
Малорастворимый осадок сульфата кальция (гипса) отделяют от раствора солей магния, например, отстаиванием, фильтрованием (на фильтр-центрифуге), отжиманием (на фильтр-прессе).
В раствор солей магния добавляют щелочной реагент, обеспечивающий рН 10,6-12, например гидроксиды Са, Na, К, аммиак или карбонат натрия (Nа2СО3) или гидрокарбонат натрия (NаНСО3) или поташ (К2СО3). При рН 10,6 начинается осаждение гидроксида Mg, при рН 12 заканчивается.
Выпавший осадок гидроксида Mg промывают водой, центрифугируют или отжимают на фильтр-прессе и упаривают до сухого порошка.
Прокаливают гидроксид Mg при 500-750oС для получения каустического магнезита (MgO), а прокаливанием при 760-1500oС получают металлургический огнеупорный порошок MgO.
Природный доломит обрабатывают смесью серной и соляной кислот в молярном соотношении (1:2), чтобы соединения кальция осадились и не перешли в конечный продукт.
Анализ доломита, гидроксида магния и оксида магния проводили химическим методом согласно ГОСТ 23260.4-78, ГОСТ 22688-77 и спектральным методом по ГОСТ 23260.2-78.
Пример 1.
Была приготовлена смесь кислот с концентрацией: серная кислота - 1,5 моль/литр (14,7%), соляная кислота - 3,0 моль/литр (10,9%).
Молярное соотношение серной и соляной кислот равно 1:2.
Для опыта взяли 200 мл раствора кислот, в котором содержалось 0,3 моль серной кислоты (29,4 г) и 0,6 моль соляной кислоты (21,9 г). Теоретическое количество доломита, требующегося для их нейтрализации, составляет 0,3 моль (61,3 г).
Доломит добавляли в реактор-смеситель постепенно до прекращения газовыделения (рН 7,0). Практическое количество доломита составило 64 г (избыток 2,7 г приходится на примеси). В ходе реакции было добавлено ~100 мл воды, т. к. раствор густеет. После фильтрования получен осадок сульфата кальция (гипса) массой 77 г, что составляет 0,44 моль (теоретический расчет - 0,3 моль). Превышение на 0,14 моль связано с наличием в осадке всех примесей, содержащихся в исходном доломите, а также воды. Цвет осадка светло-коричневый.
В результате опыта было получено 230 мл раствора хлорида магния плотностью 1080 кг/м3, что соответствует концентрации солей 10% (по ареометру).
Химический анализ показал, что данный раствор содержит 22,5 г хлорида магния (9%) и 2,5 г хлорида кальция (1%), что также соответствует суммарной концентрации солей 10 мас.%. Выход реакции по хлориду магния составляет 0,26 моль, т.е. 87,3% от теоретического.
В полученный раствор хлорида магния добавили избыток щелочного осадителя гидроксида Na с рН 10,6 до рН 12,0. Выпавший осадок гидроксида Mg промыли водой до рН 7,5, отфильтровали на вакуумном фильтре и высушили при 120oС. Масса сухого осадка Mg(OH)2 составила 9,8 г. После обжига при 750oС получили 6,8 г каустического магнезита, содержащего 96,1 % MgO, 1,5 % СаО, суммарное содержание SiO2, Аl2О3 и Fе2O3 составляло 2,2 %. В процессе осаждения Mg(OH)2 в щелочной среде происходит дополнительная очистка от соединений кальция, т.к. его гидроксид Са(ОН)2 хорошо растворимое вещество и удаляется при промывании осадка водой.
Примеры 2-6.
Проводили аналогично примеру 1. Данные сведены в таблицу. Предлагаемый способ получения оксида магния имеет следующие преимущества:
позволяет исключить обжиг доломита и использовать отходы серной и соляной кислот, что упрощает, удешевляет и делает его экологичным;
позволяет улучшить качество оксида магния за счет отделения соединений магния от соединений кальция;
продукт, полученный по данному способу, был подвергнут исследованию на кафедре минералогии Российского химико-технологического университета им. Д. И. Менделеева. Дисперсионный и петрографический анализ состава оксида магния и высокое значение огнеупорности (1700oС) позволяют использовать его в производстве высококачественных огнеупорных материалов и изделий.
позволяет исключить обжиг доломита и использовать отходы серной и соляной кислот, что упрощает, удешевляет и делает его экологичным;
позволяет улучшить качество оксида магния за счет отделения соединений магния от соединений кальция;
продукт, полученный по данному способу, был подвергнут исследованию на кафедре минералогии Российского химико-технологического университета им. Д. И. Менделеева. Дисперсионный и петрографический анализ состава оксида магния и высокое значение огнеупорности (1700oС) позволяют использовать его в производстве высококачественных огнеупорных материалов и изделий.
Claims (1)
- Способ получения оксида магния, включающий обработку доломита и отделение раствора солей магния от осадка, отличающийся тем, что обработку природного доломита осуществляют серной кислотой или смесью серной и соляной кислот в молярном соотношении 1:2, после отделения раствора солей магния от осадка осаждают гидроксид магния из раствора щелочным реагентом, обеспечивающим рН 10,6-12, отделяют выпавший осадок и осуществляют его термическую обработку при температуре 760-1200oС для получения огнеупорного оксида магния.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2001106316/12A RU2198842C2 (ru) | 2001-03-05 | 2001-03-05 | Способ получения оксида магния |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2001106316/12A RU2198842C2 (ru) | 2001-03-05 | 2001-03-05 | Способ получения оксида магния |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2001106316A RU2001106316A (ru) | 2003-02-20 |
| RU2198842C2 true RU2198842C2 (ru) | 2003-02-20 |
Family
ID=20246907
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2001106316/12A RU2198842C2 (ru) | 2001-03-05 | 2001-03-05 | Способ получения оксида магния |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2198842C2 (ru) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN100457625C (zh) * | 2006-11-03 | 2009-02-04 | 高佳令 | 利用白云灰与硼泥生产工业氧化镁的方法 |
| RU2456250C2 (ru) * | 2010-05-11 | 2012-07-20 | Юрий Викторович Наделяев | Способ получения магнезиального вяжущего, способ получения затворителя магнезиального вяжущего |
| RU2602137C1 (ru) * | 2015-08-07 | 2016-11-10 | Общество с ограниченной ответственностью "ХМК-Инжиниринг" (ООО "ХМК-Инжиниринг") | Способ получения оксида магния |
| RU2619689C1 (ru) * | 2016-06-09 | 2017-05-17 | Общество с ограниченной ответственностью "ТВЭЛЛ" | Способ переработки доломита |
| RU2777802C1 (ru) * | 2022-01-28 | 2022-08-10 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Оренбургский государственный университет" | Способ комплексной переработки магнийсодержащего сырья с получением чистого оксида магния |
-
2001
- 2001-03-05 RU RU2001106316/12A patent/RU2198842C2/ru not_active IP Right Cessation
Non-Patent Citations (1)
| Title |
|---|
| W0 8102153 A1, 06.08.1981. * |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN100457625C (zh) * | 2006-11-03 | 2009-02-04 | 高佳令 | 利用白云灰与硼泥生产工业氧化镁的方法 |
| RU2456250C2 (ru) * | 2010-05-11 | 2012-07-20 | Юрий Викторович Наделяев | Способ получения магнезиального вяжущего, способ получения затворителя магнезиального вяжущего |
| RU2602137C1 (ru) * | 2015-08-07 | 2016-11-10 | Общество с ограниченной ответственностью "ХМК-Инжиниринг" (ООО "ХМК-Инжиниринг") | Способ получения оксида магния |
| RU2619689C1 (ru) * | 2016-06-09 | 2017-05-17 | Общество с ограниченной ответственностью "ТВЭЛЛ" | Способ переработки доломита |
| RU2777802C1 (ru) * | 2022-01-28 | 2022-08-10 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Оренбургский государственный университет" | Способ комплексной переработки магнийсодержащего сырья с получением чистого оксида магния |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1097247B1 (en) | A method for isolation and production of magnesium based products | |
| RU2554136C2 (ru) | Способ получения глинозема | |
| CN101327942A (zh) | 白云石海水卤水制取轻质碳酸镁和氧化镁的方法 | |
| CN103738986A (zh) | 一种白云石煅烧并水溶分离钙镁生产氢氧化镁和碳酸钙的方法 | |
| CA2736379A1 (en) | Process for the production of high purity magnesium hydroxide | |
| FR2575149A1 (fr) | Procede pour recuperer des produits de valeur des boues rouges du procede bayer | |
| Meng et al. | Recovery of titanium from undissolved residue (tionite) in titanium oxide industry via NaOH hydrothermal conversion and H2SO4 leaching | |
| GB2099410A (en) | Treatment for aluminous materials | |
| RU2198842C2 (ru) | Способ получения оксида магния | |
| RU2535254C1 (ru) | Способ комплексной переработки серпентин-хромитового рудного сырья | |
| US2210892A (en) | Process for recovering magnesium oxide | |
| Meher et al. | Recovery of Al and Na values from red mud by BaO-Na 2 CO 3 sinter process | |
| RU2202516C1 (ru) | Способ получения оксида алюминия | |
| RU2638847C1 (ru) | Способ получения гидроксида алюминия | |
| JP2007523815A (ja) | バイヤー法によって製造される低有機炭素量の水酸化アルミニウム | |
| RU2750429C1 (ru) | Способ получения магнетита | |
| RU2687470C1 (ru) | Способ извлечения оксида алюминия из отходов глиноземного производства | |
| RU2808415C1 (ru) | Способ получения натриево-кальциевого силиката | |
| RU2344076C2 (ru) | Способ комплексной переработки магнийхромсодержащего рудного сырья | |
| RU2295494C2 (ru) | Способ получения оксида магния | |
| RU2351668C1 (ru) | Способ получения пятиокиси ванадия | |
| SU1699920A1 (ru) | Способ получени гидроксида магни | |
| RU2197429C2 (ru) | Способ переработки алюминийсодержащего сырья | |
| SU1599304A1 (ru) | Способ производства оксида магни и/или продуктов его гидратации | |
| RU2051101C1 (ru) | Способ получения химически осажденного мела |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20040306 |