RU2175136C2 - Способ и соединения для обнаружения аналитов с помощью измерения остаточной магнитной индукции и их применение - Google Patents
Способ и соединения для обнаружения аналитов с помощью измерения остаточной магнитной индукции и их применение Download PDFInfo
- Publication number
- RU2175136C2 RU2175136C2 RU97116162/14A RU97116162A RU2175136C2 RU 2175136 C2 RU2175136 C2 RU 2175136C2 RU 97116162/14 A RU97116162/14 A RU 97116162/14A RU 97116162 A RU97116162 A RU 97116162A RU 2175136 C2 RU2175136 C2 RU 2175136C2
- Authority
- RU
- Russia
- Prior art keywords
- substances
- ferromagnetic
- ferrimagnetic
- specific structure
- binding
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54313—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being characterised by its particulate form
- G01N33/54326—Magnetic particles
- G01N33/54333—Modification of conditions of immunological binding reaction, e.g. use of more than one type of particle, use of chemical agents to improve binding, choice of incubation time or application of magnetic field during binding reaction
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S436/00—Chemistry: analytical and immunological testing
- Y10S436/80—Fluorescent dyes, e.g. rhodamine
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/24—Nuclear magnetic resonance, electron spin resonance or other spin effects or mass spectrometry
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Medicinal Chemistry (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Cell Biology (AREA)
- Food Science & Technology (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Wood Science & Technology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Genetics & Genomics (AREA)
- General Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Investigating Or Analyzing Materials By The Use Of Magnetic Means (AREA)
- Investigating Or Analyzing Non-Biological Materials By The Use Of Chemical Means (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
Abstract
Способ может быть использован в области медицины, в частности в радиоиммунных методах исследования. Проводят количественное обнаружение аналитов в жидких и твердых фазах с помощью измерения связывающей остаточной магнитной индукции с использованием соединений, пригодных для этого. При этом сначала маркируют имеющие специфическую структуру вещества ферримагнитными или ферромагнитными веществами, а затем эти магнитно-маркированные вещества со специфической структурой добавляют к измеряемой пробе, измеряемую пробу намагничивают с помощью прикладываемого снаружи магнитного поля соответствующей силы и после отключения внешнего поля измеряют остаточную магнитную индукцию намагничивания коллоидальных частиц с помощью сенсоров магнитного поля, при этом остаточную магнитную индукцию, возникающую вследствие специфического связывания, и ее величину привлекают к анализу. Соединения, используемые в способе, представляют собой ферримагнитные или ферромагнитные вещества, являющиеся стабильными или квазистабильными коллоидальными частицами из окисей железа, феррита бария, феррита стронция, чистого железа, двуокиси хрома, никеля, кобальта, а также окислов железа с добавлением марганца, меди, никеля или кобальта. Способы и соединения, используемые для обнаружения аналитов, обеспечивают более высокую точность обнаружения, а также упрощение проведения анализа. 6 с. и 25 з.п. ф-лы, 2 ил.
Description
Изобретение касается предмета, охарактеризованного в формуле изобретения, то есть способа качественного и/или количественного обнаружения аналитов в жидких и твердых фазах с помощью измерения остаточного магнетизма, пригодных для этих соединений и их применения в аналитике.
Далее, известно, что количественные методы иммунного анализа, а также другие методы анализа связывания (например, методы блокирования рецептора) позволяют определять в пробах различного состава очень большое число веществ, которые могут обладать также биологической значимостью. Однако, как правило, при одном анализе определяется лишь один параметр на пробу. Актуальный обзор различных способов дает T. Chard [An Introduction to Radio-immunoassay and Related Techiques: Laboratory Techniques in Biochemistry and Molecular Bioloqy, 4 ed., Elsevier Science Publishers, Amsterdam (1990)]. Основой всех анализов связывания является высокая чувствительность индикации маркированных изотопами или другим образом соединений в комбинации с большой специфичностью рецепторных реакций лиганд.
В способе, раскрытом в публикации JP3-220442A, проводится определение титра антигена путем замера масштаба передающей антитела аггрегации (агглютинации) с помощью раскрытого в публикации способа измерения размеров аггломерированных магнитных частиц. Способ определения размера частиц состоит во включении магнитного поля, которое пронизывает стационарную седиментированную пробу, и в замере остаточной магнитной плотности потока аггломерированных магнитных частиц.
Из публикации US-4,661,408 известны феррофлюиды, которые содержат суперпарамагнитные частицы из двуокиси хрома с присоединенными к ним антителами. Здесь требуется, чтобы эти частицы имели очень небольшое внутреннее время релаксации, поэтому они не соответствуют требованиям по применению замеров остаточного магнетизма.
Известные способы проведения анализа имеют, однако, следующие недостатки.
Способы одновременного определения различных аналитов внутри одной и той же пробы базируются на привязывании по разному маркированных радиологически, флюоресцентно или энзимологически зондов к аналитам. При этом, как правило, после последующей сепарации и промывки замеряется несвязанная или же связанная активность зонда для количественного определения аналита. При этом количество используемых различных меченых атомов зонда сильно ограничено. Так, например, в случае различных радиоизотопов в качестве зондовой маркировки выступают так называемые перекрывающие феномены, которые приводят к быстрой потере количественной точности индивидуальных сигналов. Комбинация различных энзимов в качестве меченых атомов зонда является причиной сопоставимых проблем, причем осуществимость здесь затруднена дополнительно необходимым поиском условий реакции, которые позволяют проводить одновременное определение энзимных реакций в одной системе.
Чувствительность способов ограничена, например, неспецифичными взаимодействиями между матрицей и зондом или же лимитированной возможностью маркирования зонда (малая удельная активность).
Успешное осуществление способов часто предполагает переработку полученного материала проб (например, приготовление сыворотки или плазмы из цельной крови, экстракцию проб с помощью органических растворителей, обогащение аналита посредством хроматографических способов и т. д.).
Для успешного осуществления способов недопустимы операции сепарации и промывки, которые служат для разделения связанных и несвязанных рецепторов или же лиганд.
Для осуществления радиоиммунных анализов требуется использование дорогих излучающих нуклидов, связанных с большими затратами при работе с ними.
Хранение используемых до этого маркеров на практике зачастую доставляет проблемы, поскольку они либо нестабильны (радиоиммунные анализы) и поэтому должны постоянно заново создаваться, или же чувствительно реагируют на воздействия окружающей среды.
Задача настоящего изобретения состояла поэтому в том, чтобы разработать новые способы и вещества, которые превосходили бы уровень техники.
Эта задача решается с помощью настоящего изобретения.
Было обнаружено, что качественное и/или количественное обнаружение аналитов в жидкой и/или твердой фазе удается, если стабильные или квазистабильные ферромагнитные или ферримагнитные вещества используются в качестве индицирующих магнитных маркирующих веществ в иммунных анализах или в анализах связывания, и определяется остаточный магнетизм пробы как измеряемый параметр.
Ниже сначала описываются способы, которые преодолевают недостатки известных способов.
Способы согласно изобретению основаны на использовании коллоидальных ферромагнитных или ферримагнитных веществ, называемыми ниже также магнитными маркирующими веществами, которые комбинируются с индицируемыми веществами - обозначаемыми ниже также аналитами, - или с веществами со специфической структурой. Подобные комбинации из магнитных маркирующих веществ с аналитами или с веществами, имеющими специфическую структуру, ниже называются магнитными маркерами. За счет использования понятия коллоидальные вещества описывается как диапазон размеров частиц или веществ в диапазоне величин коллоидов, то есть, диапазон от 1 нм до приблизительно 1000 нм, так и их применение в качестве диспергированной фазы в соответствующей дисперсионной среде, которая в большинстве случаев является водной. Коллоидальные вещества, которые ниже обозначаются как частицы, для целей улучшения способности к хранению или транспортировке могут присутствовать в высушенной или замороженной форме, в то время как для проведения замеров они все же присутствуют в состоянии, диспергированном в жидкой фазе.
Существенная основа изобретения состоит в том, что зависимость намагничивания ферромагнитных и ферримагнитных коллоидальных веществ после отключения внешнего намагничивающего поля очень чувствительно зависит от материала и формы (постоянная анизотропии использованного материала частиц), объема и температуры использованных частиц. Причиной этого является поворот внутреннего вектора намагничивания внутри частиц. Этот механизм называют релаксацией по методу Нила. Если намагничивание частиц происходит в пределах времени замера, то это обозначается как внутренний супермагнетизм. Частицы, время релаксации которых по методу Нила существенно длиннее, чем время наблюдения, обозначаются как остаточные частицы или также как стабильные частицы. Частицы, время релаксации которых по методу Нила порядка времени наблюдения, обозначаются как квазистабильные частицы.
Следующая существенная основа изобретения заключается в том, что намагничивание совокупности свободно передвигающихся стабильных или квазистабильных ферро- или ферримагнитных коллоидальных частиц после отключения внешнего намагничивающего поля в пределах времени замера релаксирует с помощью второго механизма. При этом начинается вращение всей коллоидальной частицы внутри окружающей ее жидкости, причем постоянная времени зависит от гидродинамического диаметра частиц, включая оболочку, вязкости жидкости-носителя и температуры. Этот параметр в основном определяется окружающей частицу средой. Этот механизм обозначается как релаксация по методу Брауна или внешний суперпарамагнетизм.
Способ качественного и/или количественного обнаружения аналитов в жидких и твердых фазах осуществляется следующим образом:
(I) сначала маркируют имеющие специфическую структуру вещества ферримагнитными или ферромагнитными веществами, а затем
(II) эти магнитно маркированные вещества со специфической структурой добавляют к замеряемой пробе,
(III) замеряемую пробу намагничивают с помощью прикладываемого снаружи магнитного поля соответствующей силы, и
(IV) после отключения внешнего поля замеряют остаточную магнитную индукцию намагничивания коллоидальных частиц (магнитных маркирующих веществ) с помощью сенсоров магнитного поля,
причем остаточная магнитная индукция, возникающая путем удельного связывания, и ее величина привлекаются к анализу.
(I) сначала маркируют имеющие специфическую структуру вещества ферримагнитными или ферромагнитными веществами, а затем
(II) эти магнитно маркированные вещества со специфической структурой добавляют к замеряемой пробе,
(III) замеряемую пробу намагничивают с помощью прикладываемого снаружи магнитного поля соответствующей силы, и
(IV) после отключения внешнего поля замеряют остаточную магнитную индукцию намагничивания коллоидальных частиц (магнитных маркирующих веществ) с помощью сенсоров магнитного поля,
причем остаточная магнитная индукция, возникающая путем удельного связывания, и ее величина привлекаются к анализу.
Возможное в способах согласно уровню техники лишь в исключительных случаях различение между связанными и несвязанными маркерами становится возможным в способе согласно изобретению благодаря использованию исчезающей остаточной магнитной индукции (т.е. внешнего супермагнитизма) несвязанных магнитных маркеров в жидкой фазе. И наоборот, совокупность связанных магнитных маркеров показывает измеряемую остаточную магнитную индукцию - зависимую от материала частиц. Итак, при замере остаточной магнитной индукции определяемой пробы захватывается только часть связанных магнитных маркеров. Поэтому способ ниже обозначается также как измерение остаточной магнитной индукции связывания и базируется на количественном обнаружении связанных маркеров со специфической структурой.
Другими словами, обнаружение аналита может происходить также без дорогостоящей операции сепарации и промывки, поскольку только специфически привязанные к аналиту стабильные или квазистабильные ферромагнитные или ферримагнитные вещества (которые скомбинированы для цели придания специфичности с помощью веществ, имеющих специфическую структуру) являются причиной остаточной магнитной индукции, вопреки чему намагничивание присутствующих одновременно в пробе избыточных, несвязанных стабильных или квазистабильных ферромагнитных или ферримагнитных веществ (которые также скомбинированы с веществами со специфической структурой) затухает уже перед началом замеров внешнего супермагнетизма.
В следующей форме выполнения изобретения способ модифицирован таким образом, что вместо веществ со специфической структурой сами аналиты комбинируют со стабильными или квазистабильными ферромагнитными или ферримагнитными веществами, как это аналогичным образом часто применяется при проведении конкурентных радиологических иммунных методов анализа. К пробам должно быть добавлено еще и вещество со специфической структурой.
Но способ может осуществляться также и как мультианалитный метод исследований, который позволяет производить непосредственное одновременное определение множества различных аналитов в жидкостях или твердых веществах. Для этого требуется маркировать аналиты сначала различными ферромагнитными или ферримагнитными коллоидальными веществами с достаточно дискретными значениями коэрцитивной силы поля. Во время связывания магнитных маркеров прикладывается намагничивающее поле (первичное намагничивающее поле), которое ведет к выравниванию всех содержащихся в пробе магнитных маркеров вдоль их легкой оси. После этого определяется остаточная магнитная индукция пробы. На следующих этапах проба подвергается перемагничиванию с помощью внешних встречно вращающихся полей (в противоположность первичному полю намагничивания), которые по своей силе приведены в соответствие с коэрцитивными силами поля магнитных маркирующих веществ. В результате этого становится возможным целенаправленно переориентировать всегда только те маркирующие вещества, коэрцитивные поля которых меньше, чем приложенное намагничивающее поле. Между отдельными этапами перемагничивания остаточная магнитная индукция пробы определяется соответственно заново.
Из всех замеренных значений остаточной магнитной индукции пробы при каждом отдельном этапе перемагничивания таким образом может определяться количество части различных связанных магнитных маркеров.
Благодаря этому способу имеется возможность одновременно определять несколько аналитов в каждой пробе.
Способ согласно изобретению, а также варианты способа могут находить применение, в репродуктивной способности, гистосовместимости, аллергологии, инфекциологии, гигиене, генетике, вирусологии, бактериологии, токсикологии, патологии, аналитике окружающей среды и медицинской диагностике.
Обнаружение остаточной магнитной индукции связывания происходит с помощью известных, пригодных для этого измерительных устройств, как, например. Superconducting Quantum Interference Devices (SQUIDs), причем сначала производится намагничивание с помощью соответствующего магнитного поля, а затем, после отключения поля, с помощью чувствительных сенсоров магнитного по ля производится измерение остаточной магнитной индукции намагниченного вещества со специфической структурой или зависимых от него сигналов.
Во время замера проба, предпочтительным образом, может двигаться.
В частности, предпочтительным образом, модуляция сигнала происходит за счет вибрации или вращения пробы. Таким образом, реализуется преобразование измерительного сигнала постоянного тока (dc) в более высокий диапазон частоты.
Для измерения могут использоваться - наряду с названными SQUIDs - также и переключенные в виде градиометра индукционные катушки, магнетометр Fluxqate, сенсоры Giant-Maqnetoresistance или магниторезистивные преобразователи.
При использовании сенсоров, которые могут замерять поля постоянного тока dc (например, SQUlDs, магнетометр Fluxqate, сенсоры Giant-Maqnetoresistance или магниторезистивные преобразователи), возможно также измерение остаточной магнитной индукции после предшествующего намагничивания пробы, которая при этом не двигается.
Соответствующее измерительное устройство изображено, например, на фиг. 1. Подобное устройство было использовано в последующих примерах.
Следующий аспект изобретения касается соединений для измерения остаточной магнитной индукции связывания. Соответствующие соединения состоят из коллоидальных суспензий ферримагнитных или ферромагнитных веществ, имеющих специфическую структуру веществ или аналитов.
Под веществами со специфической структурой, в рамках изобретения, следует понимать, в частности, все вещества, которые специфически привязаны к желательной структуре, как, например, антитела, фрагменты антител, биотин или связывающие биотин вещества, как, например, авидин или стрептавидин, специфически привязывающие к рецепторам агонисты, как, например, цитокины, лимфокины, эндотелины или их антагонисты, специфические пептиды и протеины, рецепторы, энзимы, субстраты энзимов, нуклеотиды, рибонуклеиновые кислоты, дезоксирибонуклеиновые кислоты, углеводы, липопротеины и т.п.
При этом предпочтение отдается веществам, имеющим постоянную связь в диапазоне от 105 до 1015 (моль/л)-1, в частности, подходящими являются вещества, которые имеют постоянную связи от 10 > до 1015 (моль/л)-1.
В качестве ферромагнитных или ферримагнитных коллоидальных веществ применяются все ферромагнитные или ферримагнитные вещества, внутреннее время релаксации которых по методу Нила больше или равно времени замера и которые являются, таким образом, стабильными или же квазистабильными.
Особенно пригодными являются все ферромагнитные или ферримагнитные вещества, время релаксации которых при 20oC является более продолжительным чем 10-4. В частности, пригодным являются все ферромагнитные или ферримагнитные вещества, время релаксации которых более 1 секунды.
Ферромагнитные и ферримагнитные вещества могут быть, предпочтительным образом, стабилизированы оболочкой из олигомерных или полимерных углеводов, протеинов, пептидов, нуклеотидов, тензидов, синтетических полимеров и/или липидов.
Размеры частиц ферромагнитных и ферримагнитных веществ составляют, предпочтительным образом, от 1 до 1000 нм. В частности, предпочтительным образом, размеры частиц составляют от 2 до 500 нм. (Данные относительно величины частиц относятся к гидродинамическому диаметру).
В качестве ферромагнитных или ферримагнитных веществ, в частности, являются пригодными стабильные или квазистабильные коллоидальные частицы из окисей железа (Fe3О4, γ -Fe2O3), феррита бария, феррита стронция, чистого железа, двуокиси хрома, никеля, кобальта, а также окислов железа с добавлением марганца, меди, никеля или кобальта (как, например, описано в патенте ФРГ - DE 30 27 012 и в патенте ФРГ - DE 41 16 093).
Получение используемых согласно изобретению соединений, состоящих из стабильных или квазистабильных ферромагнитных или ферримагнитных веществ, которые связаны с имеющими специфическую структуру веществами или аналитами, происходит с помощью способов, которые применяются в области иммунной, пептидной и белковой химии. При этом вещество со специфической структурой или аналит связано через ковалентные связи с веществами, образующими стабилизирующую оболочку ферромагнитных или ферримагнитных веществ. В качестве стабилизирующей оболочки речь идет, например, об углеводах, пептидах, нуклеотидах, липидах, тензидах или полимерах. Особенно пригодными методами связывания являются, например, активирование и связь с помощью карбодиимидов. [Jakoby and Wilchek, eds. (1974) Methods Enzymol, 34], образование Шиффовых оснований после воздействия периодат на содержащие углеводы соединения (Wichek and Bayer, eds. Methods Enzym 184:177), которые далее - при необходимости - еще и подлежат восстановлению для дальнейшей стабилизации, и связь с помощью глютардиальдегида [Heitzmann and Richards, Proc. Natl. Acad. Sci. USA 71 (1974)3537], образование мостиков между бромацетилированными частицами с тиолилированными веществами [Anqerer et al.; Cell 9 (1976)81], а также восстановительное алкилирование [Bayer et al.: J. Histochem. Сytochem. 24 (1976) 933].
Могут быть также получены ферромагнитные или ферримагнитные коллоидальные частицы со стабилизирующей оболочкой из имеющего специфическую структуру вещества или из самого аналита, при этом частицы после получения вводятся непосредственно в раствор имеющего специфическую структуру вещества или аналита, при необходимости в присутствии других вспомогательных веществ, как, например, протеинов, углеводов, а также натуральных, синтетических или частично синтетических поверхностно-активных веществ и т.д. или же получают непосредственно в присутствии имеющих специфическую структуру веществ или аналитов.
С целью проведения методов исследования мультианалита могут использоваться также смеси соединений, которые состоят из множества различных магнитных маркеров, причем различные магнитные маркеры состоят из комбинаций различных имеющих специфическую структуру веществ или подлежащих обнаружению аналитов с различными ферромагнитными или ферримагнитными веществами. Основой этого применения комбинаций различных магнитных маркеров согласно изобретению является то, что в качестве магнитных маркирующих веществ для соответствующих имеющих специфическую структуру веществ или подлежащих обнаружению аналитов применяются ферромагнитные или ферримагнитные вещества с различаемыми коэрцитивными силами (Hc), причем параметры коэрцитивной силы (Hс) и остаточный магнетизм (МR) для различных магнитных маркировок известным образом определяются предварительно отдельно и, таким образом, являются известными.
Имеющие специфическую структуру вещества, маркированные ферромагнитными или ферримагнитными коллоидальными веществами, могут присутствовать также и в высушенной форме (например, в виде лиофилизатов), при необходимости в комбинации с другими вспомогательными веществами, которые облегчают, например, сушку или повышают стабильность высушенного продукта. Получение готовых к употреблению средств из подобных лиофилизатов происходит за счет ресуспендирования в соответствующей суспензионной среде непосредственно перед применением.
Следующий аспект изобретения касается, таким образом, средств для измерения остаточной магнитной индукции связывания, содержащих ферромагнитные или ферримагнитные коллоидальные вещества в соответствующей суспензионной среде.
В качестве суспензионных сред в расчет принимаются все жидкости, в которых коллоидальные частицы имеют возможность свободного движения. Если измерения проводятся без операций сепарации и промывки, то вязкость использованной суспензионной среды должна быть приведена в соответствие со временем релаксации по методу Нила ферромагнитных и ферримагнитных веществ и временем замера, поскольку суспензионная среда существенно определяет временную постоянную релаксации по методу Броуна. В противном случае, например, при использовании частиц с коротким временем релаксации (например, 0,01 сек) в высоковязких суспензионных средах (например, 80% глицерола) и коротким временем измерения (например, 0,0001 секунд после отключения внешнего поля) релаксация по методу Броуна (внешний супермагнетизм) замедляется так, что нельзя более установить разницу между связанными и несвязанными маркерами, имеющими специфическую структуру. В общем и целом, предпочтительно, использовать суспензионную среду, имеющую вязкость менее 100 мПас.
Особенно пригодными в качестве суспензионной среды являются вода, водные растворы поверхностно-активных вспомогательных веществ, как, например, тензиды или олигомерные, или полимерные углеводы и белки, а также смеси из воды со спиртами, как, например, глицерол и полиэтиленгликоль, при этом для целей инъекции предпочтение отдается соответствующей воде. Суспензионные среды могут дополнительно содержать вспомогательные вещества, меняющие осмотическое давление, как, например, поваренную соль. Далее, могут содержаться буферные вещества, определяющие значение pH, как, например, фосфаты.
Следующим предметом изобретения является применение соединений в способе согласно изобретению для замера остаточной магнитной индукции связывания.
На основании определения связывания, основанного на физических механизмах, могут быть исключены неспецифические сигналы измерения (феномены матрицы). Специфичность способа зависит, таким образом, еще лишь и от "истинной" специфичности имеющего специфическую структуру вещества (перекрестная реактивность антител, неспецифичное связывание лиганд).
На основе высокой чувствительности способа согласно изобретению без труда снижаются обычные граничные значения детектирования методов связывания.
В противоположность уже известным способам (JP-235774 и WO 91/15243) в способе согласно изобретению замеряются не статическое намагничивание в присутствии внешнего намагничивающего поля, а остаточная магнитная индукция связывания в отсутствии магнитного поля или зависимые от них сигналы. Только благодаря этому становится доступной информации о состоянии связывания маркеров.
Далее, в результате этого исключается влияние сигнала измерения за счет диа- или парамагнитных компонентов и соответственно загрязнения, что способствует дальнейшему увеличению чувствительности измерения.
Способы измерения остаточной магнитной индукции связывания согласно изобретению могут далее быть использованы для того, чтобы обнаружить местопребывание ферромагнитных или ферримагнитных веществ в живом организме. Особое преимущество при этом состоит в том, что для определения остаточной магнитной индукции связывания могут быть использованы ферромагнитные и ферримагнитные вещества, тем самым, можно избежать особо критического использования на человеке радиоактивных изотопов, при этом чувствительность способа согласно изобретению достигает чувствительности традиционных способов радиационной медицины - гамма-сцинтиграфии или позитронно-эмиссионной томографии. Кроме того, предшествующее отделение циркулирующих в крови несвязанных маркеров является излишним, поскольку оно (в противоположность радиодиагностическим методам) не является причиной "сигнала помех" и, тем самым, не влияет на процесс обнаружения специфически связанного маркера.
Согласно изобретению для этого пациенту дается суспензия стабильных или квазистабильных ферромагнитных или ферримагнитных веществ. В качестве пути введения выступают локальное нанесение, пероральное введение и все формы парентерального введения. Особенно пригодными являются формы внутрисосудистого введения.
Коллоидальные вещества распределяются в организме, при этом рисунок распределения в теле находится под влиянием пути введения, а также различных других фармакокинетических параметров. Определение остаточной магнитной индукции связывания, раздельно воспринимаемое по месту, в различное время после введения стабильных или квазистабильных ферромагнитных или ферримагнитных веществ может служить установлению патологических состояний в теле, которые характеризуются как необычным обогащением, так и отсутствием возникновения обогащений.
Особенно предпочтительным для изображения патологических структур в человеческом теле может быть применение согласно изобретению стабильных или квазистабильных ферро- или ферримагнитных веществ (магнитных маркеров), скомбинированных с имеющими специфическую структуру веществами. Для этого специфическая привязка магнитных маркеров к патологической структуре ведет к специфическому сигналу, который в соответствии с изобретением может быть определен с помощью способов определения остаточной магнитной индукции связывания на живом организме, описанных для проведения методов анализа связи.
В качестве примера применения согласно изобретению стабильных или квазистабильных ферромагнитных или ферримагнитных веществ в комбинации со способами измерения остаточной магнитной индукций связывания следует назвать определение опухолей в теле путем использования специфических для опухолей магнитных маркеров. Специфичными для опухолей маркерами могут быть, например, комбинации стабильных или квазистабильных ферромагнитных или ферримагнитных веществ со специфичными для опухолей веществами, как, например, антитела, фрагменты антител, пептиды, рецепторы, протеины, нуклеиновые кислоты, олигонуклеотиды, мономерные, олигомерные или полимерные углеводы.
Другими примерами возможного применения является изображение тромбов, атеросклеротических бляшек, воспалительных реакций, ревматических или ревматоидных изменений, причем соответственно предпочтительным образом используются комбинации согласно изобретению из стабильных или квазистабильных ферромагнитных или ферримагнитных веществ с имеющими соответствующую патологическую структуру специфическими веществами в качестве магнитных маркеров.
Измерения на живом объекте пространственного распределения введенных в человека стабильных или квазистабильных маркеров может осуществляться согласно изобретению в двух вариантах:
1. Образованием по возможности гомогенного магнитного поля в интересующем регионе организма, отключением поля и измерением пространственного распределения остаточной магнитной индукции связывания с помощью многоканального сенсора SQUID, который используется для биомагнитных исследований [cм. D. Drunq, IEEE Trans. Appl. Supercond., 5 (1995) 2112-2117]. Он должен по возможности полностью охватывать объект измерения. Для создания достаточной информации об измерениях предпочтительным является многократное проведение измерений при последовательном растрировании объекта измерения.
1. Образованием по возможности гомогенного магнитного поля в интересующем регионе организма, отключением поля и измерением пространственного распределения остаточной магнитной индукции связывания с помощью многоканального сенсора SQUID, который используется для биомагнитных исследований [cм. D. Drunq, IEEE Trans. Appl. Supercond., 5 (1995) 2112-2117]. Он должен по возможности полностью охватывать объект измерения. Для создания достаточной информации об измерениях предпочтительным является многократное проведение измерений при последовательном растрировании объекта измерения.
2. Последовательным формированием пространственно ограниченного локального поля, отключением поля и измерением пространственной остаточной магнитной индукции связывания с помощью одноканального сенсора. Применение мультиканального сенсора является тоже возможным.
При использовании обоих методов для получения максимальной информации следует предпочтение отдавать как намагничиванию объекта измерения, так и измерению результирующего магнитного поля во всех трех пространственных направлениях.
Обработка данных измерения может происходить путем соответствующего способа аппроксимации. Так, например, в основу может быть положена модель магнитного диполя, мультиполя или мультидиполя. Специальные параметры модели, в частности, местоположение диполей или мультиполей, определяют соответствующим методом аппроксимации, который сводит к минимуму отклонения между данными измерения и параметрами модели. Эти параметры позволяют известным образом определять пространственное распределение намагниченных частиц.
Аналогичная технология известна и доказывает на деле пригодность ее для анализа магнитных полей биоэлектрических потоков.
Для измерения остаточной магнитной индукции связывания на живом организме пригодны, в основном, те же вещества - или приготовленные из них средства - которые используются в исследованиях на живом организме.
Особенно пригодными для использования на живом объекте являются магнитные маркирующие вещества, которые могут биологически расщепляться и являются биологически переносимыми. Это касается, в частности, магнитных маркирующих веществ, которые состоят из окисей железа или из комбинаций окисей железа с марганцем или кобальтом. Магнитные частицы, к которым согласно названным способам могут быть привязаны имеющие специфическую структуру вещества, находят применение, например, в ядерной спинтомографии и описываются, кроме всего прочего, в WO 92/12735, WO 92/22586, а также в EP О 186 616. Другой аспект изобретения касается, таким образом, применения магнитных маркирующих веществ в способе измерения в живом организме остаточной магнитной индукции связывания.
Под веществами со специфической структурой в связи с применением измерения остаточной магнитной индукции связывания в живом организме следует понимать, в частности, все вещества, которые специфически привязывают к идентифицируемым структурам человеческого организма. Особенно пригодными являются антитела, фрагменты антител, специфически привязывающие к рецепторам агонисты или их антагонисты, специфические пептиды и протеины, рецепторы, энзимы, субстраты энзимов, нуклеотиды, рибонуклеиновые кислоты, дезоксирибонуклеиновые кислоты, углеводы или липопротеины. Из агонистов, привязывающих к рецепторам, подходят, в частности, цитокины, лимфокины или эндотелины.
Хорошо подходящими являются все вещества со специфической структурой, которые имеют постоянную связи в диапазоне от 105 - 1015 (моль/л). В частности, пригодными являются все вещества со специфической структурой, которые имеют постоянную связи в диапазоне от 10 > - 1015 (моль/л).
Приводимые ниже примеры служат для более подробного пояснения предмета изобретения, но он ими не ограничивается.
ПРИМЕР 1
100 мкг моноклонального антитела, направленного против Collaqen III, называемого ниже анти-Collaqen III, растворяют в 500 мкл 0,1 М раствора бикарбоната натрия. 1 мл суспензии магнетита с добавкой декстрана (Meito Sanqyo) с 1 моль Fe/л и размером частиц приблизительно 40 нм (гидродинамический диаметр) пропускают через колонну "Sephadex" (Pharmacia PD 10) с 0,1 М бикарбоната натрия с приданием раствору буферных свойств. К суспензии добавляют 0,5 мл 10 ммоль раствора периодата натрия. Раствор оставляют настаиваться в темноте в течение 2 часов. Затем через PD 10 производят вымывание 0,1 М раствора бикарбоната натрия. К суспензии добавляют раствор анти-Collaqen III. Смесь настаивают в течение 3 часов при 4oC в темноте. После этого добавляют 5 мг NaBH4 в виде твердого вещества и немного покачивают. Смесь настаивают 8 часов при 4oC в темноте. После этого маркированные магнетитом анти-Collaqen III (ниже называемые маг-анти-Collaqen III) элюируют через колонну PD 10 с раствором поваренной соли, имеющим буферные свойства фосфата (ниже это - PBS, pH 7,4).
100 мкг моноклонального антитела, направленного против Collaqen III, называемого ниже анти-Collaqen III, растворяют в 500 мкл 0,1 М раствора бикарбоната натрия. 1 мл суспензии магнетита с добавкой декстрана (Meito Sanqyo) с 1 моль Fe/л и размером частиц приблизительно 40 нм (гидродинамический диаметр) пропускают через колонну "Sephadex" (Pharmacia PD 10) с 0,1 М бикарбоната натрия с приданием раствору буферных свойств. К суспензии добавляют 0,5 мл 10 ммоль раствора периодата натрия. Раствор оставляют настаиваться в темноте в течение 2 часов. Затем через PD 10 производят вымывание 0,1 М раствора бикарбоната натрия. К суспензии добавляют раствор анти-Collaqen III. Смесь настаивают в течение 3 часов при 4oC в темноте. После этого добавляют 5 мг NaBH4 в виде твердого вещества и немного покачивают. Смесь настаивают 8 часов при 4oC в темноте. После этого маркированные магнетитом анти-Collaqen III (ниже называемые маг-анти-Collaqen III) элюируют через колонну PD 10 с раствором поваренной соли, имеющим буферные свойства фосфата (ниже это - PBS, pH 7,4).
Раствор 5 мкг Collaqen III в 200 мкл буфера [раствор поваренной соли с буферными свойствами фосфата (PBS)] инкубируют в сосуде из полистирола, предназначенном для проб. (Сосуд, предназначенный для проб, служит при этом твердой фазой, на которой фиксируется часть Collaqen). Затем сбрасывают жидкую фазу. Сосуд, предназначенный для проб, промывают три раза раствором поваренной соли с буферными свойствами фосфата, содержащим 0,1% Tween 20 (ниже называемый PBST), для вымывания фиксированного Collaqen. В сосуд, предназначенный для проб, добавляют затем 5 мкл маг-анти- Collaqen III в 200 мкл PBST. Инкубируют 1 час при комнатной температуре. Затем пробу намагничивают в магнитно экранированной камере в поле с напряженностью 2 мТ 4 см под детектором Squid (см. фиг. 1). После отключения магнитного поля производят измерение пробы. Для этого пробу по время процесса измерения удаляют из катушки намагничивания. Из разницы установленных значений плотности магнитных потоков после отключения магнитного поля - до и после удаления пробы из поля замера получают остаточную магнитную индукцию. В настоящем примере можно определить одну остаточную магнитную индукцию.
ПРИМЕР 2
Раствор 5 мкг Collaqen V в 20 мкл PBS буферного раствора pH 7,4 инкубируют в сосуде из полистирола, предназначенном для проб. Затем сбрасывают жидкую фазу. Сосуд, предназначенный для проб, промывают три раза PBST промывочным буферным раствором, имеющим pH 7,4. К пробе добавляют 5 мкл маг-анти-Collaqen III, приготовленного в соответствии с примером 1, в 200 мкл PBST. Инкубируют 1 час при комнатной температуре. Затем пробу намагничивают в магнитно экранированной камере в поле с напряженностью 2 мТ 4 см под детектором Squid (см. фиг. 1). После отключения магнитного поля пробу замеряют. Пробу во время процесса измерения удаляют на катушки намагничивания. На пробах, содержащих Collaqen V, нельзя установить наличие остаточной магнитной индукции.
Раствор 5 мкг Collaqen V в 20 мкл PBS буферного раствора pH 7,4 инкубируют в сосуде из полистирола, предназначенном для проб. Затем сбрасывают жидкую фазу. Сосуд, предназначенный для проб, промывают три раза PBST промывочным буферным раствором, имеющим pH 7,4. К пробе добавляют 5 мкл маг-анти-Collaqen III, приготовленного в соответствии с примером 1, в 200 мкл PBST. Инкубируют 1 час при комнатной температуре. Затем пробу намагничивают в магнитно экранированной камере в поле с напряженностью 2 мТ 4 см под детектором Squid (см. фиг. 1). После отключения магнитного поля пробу замеряют. Пробу во время процесса измерения удаляют на катушки намагничивания. На пробах, содержащих Collaqen V, нельзя установить наличие остаточной магнитной индукции.
ПРИМЕР 3
Из 10 мл раствора, 1,9 мг/мл Collaqen III в PBS (pH 7,4) получают соответственно 5 мл приводимых ниже разбавленных растворов:
1000 нг/мл, 100 нг/мл, 10 нг/мл
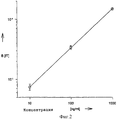
Из каждого разбавленного раствора в трубочку из полистирола капают из пипетки три раза по 1 мл (емкость 2,5 мл). Все три трубочки ингибируют 1 час при 37oC. После этого содержимое трубочек сбрасывают. Трубочки промывают 3 раза каждый раз по 1 мл PBST. В каждую трубочку добавляют 1 мл разбавленного в соотношении 1:100 раствора маркированного магнетитом антитела, полученного по примеру 1. Трубочки оставляют в течение 1 часа при комнатной температуре. После этого пробы намагничиваются с помощью измерительного устройства, схематичное изображение которого дается на фиг. 1, (2 мТ), и после отключения намагничивающего поля производят замер проб. Для этого во время замера пробы удаляются из катушки намагничивания. Определение измеренных сигналов является мерой для остаточной магнитной индукции связывания и дает зависимость, изображенную на фиг. 2.
Из 10 мл раствора, 1,9 мг/мл Collaqen III в PBS (pH 7,4) получают соответственно 5 мл приводимых ниже разбавленных растворов:
1000 нг/мл, 100 нг/мл, 10 нг/мл
Из каждого разбавленного раствора в трубочку из полистирола капают из пипетки три раза по 1 мл (емкость 2,5 мл). Все три трубочки ингибируют 1 час при 37oC. После этого содержимое трубочек сбрасывают. Трубочки промывают 3 раза каждый раз по 1 мл PBST. В каждую трубочку добавляют 1 мл разбавленного в соотношении 1:100 раствора маркированного магнетитом антитела, полученного по примеру 1. Трубочки оставляют в течение 1 часа при комнатной температуре. После этого пробы намагничиваются с помощью измерительного устройства, схематичное изображение которого дается на фиг. 1, (2 мТ), и после отключения намагничивающего поля производят замер проб. Для этого во время замера пробы удаляются из катушки намагничивания. Определение измеренных сигналов является мерой для остаточной магнитной индукции связывания и дает зависимость, изображенную на фиг. 2.
Claims (31)
1. Способ качественного и/или количественного обнаружения аналитов в гетерогенных иммунных методах, отличающийся тем, что сначала маркируют имеющие специфическую структуру вещества ферримагнитными или ферромагнитными веществами, причем имеющими специфическую структуру веществами являются антитела, фрагменты антител, биотин или специфически связывающие биотин вещества, авидин или стрептавидин, специфически привязывающие к рецепторам агонисты или их антагонисты, специфические пептиды и протеины, рецепторы, энзимы, субстраты энзимов, нуклеотиды, рибонуклеиновые кислоты, дезоксирибонуклеиновые кислоты, углеводы или липопротеины, затем эти магнитно маркированные, имеющие специфическую структуру вещества добавляют к измеряемой пробе, измеряемую пробу намагничивают с помощью прикладываемого снаружи магнитного поля соответствующей силы и после отключения внешнего поля измеряют остаточную магнитную индукцию намагничивания коллоидальных частиц с помощью сенсоров магнитного поля, при этом остаточную магнитную индукцию, возникающую вследствие специфического связывания, и ее величину привлекают к анализу.
2. Способ по п. 1, отличающийся тем, что вместо имеющих специфическую структуру веществ маркируют ферримагнитными или ферромагнитными веществами определяемые аналиты и к измеряемым пробам добавляют имеющие специфическую структуру вещества.
3. Способ по п. 1 или 2, отличающийся тем, что имеющие специфическую структуру вещества имеют постоянную связывания в диапазоне 105-1015(моль/л)-1.
4. Способ по п. 1 или 2, отличающийся тем, что имеющие специфическую структуру вещества имеют постоянную связывания в диапазоне 107-1015 (моль/л)-1.
5. Способ по одному из пп.1-4, отличающийся тем, что пробу во время измерения перемещают и тем самым модулируют сигнал пробы.
6. Способ по одному из пп.1-5, отличающийся тем, что в качестве сенсоров магнитного поля используют включенные в виде градиометра индукционные катушки, магнетомер Fluxgate, сенсоры Giant-Magnetoresistance или магниторезистивные преобразователи.
7. Способ по одному из пп.1-5, отличающийся тем, что в качестве сенсоров магнитного поля используют SQUIDs (Superconducting Quantum Interference Devices).
8. Способ по одному из пп.1-7, отличающийся тем, что благодаря ступенчатому намагничиванию измеряемой пробы одновременно определяют несколько различных аналитов.
9. Способ по п.8, отличающийся тем, что для одновременного количественного определения аналитов применяют различные ферромагнитные и ферримагнитные вещества с дискретными коэрцитивными силами поля.
10. Способ по одному из пп.1-9, отличающийся тем, что внутреннее время релаксации по методу Нееля ферромагнитных и ферримагнитных веществ больше времени измерения.
11. Способ по п. 10, отличающийся тем, что время релаксации по методу Нееля ферромагнитных и ферримагнитных веществ при 20oC является более продолжительным чем 10-4 с.
12. Способ по п. 10, отличающийся тем, что время релаксации по методу Нееля ферромагнитных и ферримагнитных веществ при 20oC является более продолжительным чем 1 с.
13. Способ по одному из пп.1-12, отличающийся тем, что ферромагнитные и ферримагнитные вещества имеют размер частиц в диапазоне 1-1000 нм.
14. Способ по одному из пп.1-12, отличающийся тем, что ферромагнитные и ферримагнитные вещества имеют размер частиц в диапазоне 2-500 нм.
15. Способ по одному из пп.1-14, отличающийся тем, что ферромагнитные и ферримагнитные вещества стабилизированы оболочкой из олигомерных или полимерных углеводов, протеинов, пептидов, нуклеотидов, тензидов, синтетических полимеров и/или липидов.
16. Способ по одному из пп.1-15, отличающийся тем, что его используют в репродуктивной способности, гистосовместимости, аллергологии, инфекциологии, гигиене, генетике, вирусологии, бактериологии, токсикологии, патологии, аналитике окружающей среды и медицинской диагностике.
17. Соединения для использования в способе по пп.1-15, отличающиеся тем, что они состоят из комбинации стабильных или квазистабильных ферромагнитных или ферримагнитных веществ с имеющими специфическую структуру веществами, причем имеющими специфическую структуру веществами являются антитела, фрагменты антител, специфически привязывающие к рецепторам агонисты, цитокины, лимфокины, эндотелины или их антагонисты, прочие специфические пептиды и протеины, рецепторы, энзимы, субстраты энзимов, нуклеотиды, рибонуклеиновые кислоты, дезоксирибонуклеиновые кислоты, углеводы, липопротеины.
18. Соединения для использования в способе по пп.1-15, отличающиеся тем, что ферромагнитные и ферримагнитные частицы имеют время релаксации по методу Нееля, которое больше, чем 10-4 с.
19. Соединения для использования в способе по пп.1-15, отличающиеся тем, что ферромагнитные и ферримагнитные частицы имеют время релаксации по методу Нееля, больше чем 1 с.
20. Соединения для использования в способе по пп.1-15, отличающиеся тем, что ферромагнитными или ферримагнитными веществами являются стабильные или квазистабильные коллоидальные частицы из окисей железа, феррита, бария, феррита стронция, чистого железа, двуокиси хрома, никеля, кобальта, а также окислов железа с добавлением марганца, меди, никеля или кобальта.
21. Средства для использования в способе по одному из п.8 или 9, отличающиеся тем, что они содержат несколько ферромагнитных или ферримагнитных веществ с различными коэрцитивными силами поля.
22. Способ обнаружения ферромагнитных или ферримагнитных веществ, введенных в человеческий организм или нанесенных на человеческое тело, отличающийся тем, что остаточную магнитную индукцию намагничивания коллоидальной суспензии стабильных или квазистабильных ферромагнитных или ферримагнитных веществ определяют после отключения намагничивающего поля.
23. Способ обнаружения ферромагнитных или ферримагнитных веществ, введенных в человеческий организм или нанесенных на человеческое тело, отличающийся тем, что сначала маркируют имеющие специфическую структуру вещества коллоидальной суспензией стабильных или ферримагнитных веществ, причем в качестве имеющих специфическую структуру веществ используют антитела, фрагменты антител, специфически привязывающие к рецепторам агонисты или их антагонисты, специфические пептиды и протеины, рецепторы, энзимы, субстраты энзимов, нуклеотиды, рибонуклеиновые кислоты, дезоксирибонуклеиновые кислоты, углеводы, липопротеины, затем эти магнитно-маркированные имеющие специфическую структуру вещества вводят в живой организм или наносят на тело, интересующий объем организма намагничивают с помощью прикладываемого снаружи магнитного поля и после отключения внешнего поля измеряют остаточную индукцию намагничивания магнитных маркеров с помощью сенсоров магнитного поля.
24. Способ по п.23, отличающийся тем, что специфическими привязывающими к рецепторам агонистами или антагонистами являются цитокины, лимфокины, эндотелины или их антагонисты.
25. Способ по одному из п.23 или 24, отличающийся тем, что вещества со специфической структурой имеют постоянную связывания в диапазоне 105-1015 (моль/л)-1.
26. Способ по одному из п.23 или 24, отличающийся тем, что вещества со специфической структурой имеют постоянную связывания в диапазоне 107-1015 (моль/л)-1.
27. Способ по одному из пп.22-26, отличающийся тем, что в качестве сенсоров магнитного поля используют Superconducting Quantum Interference Devices (SQUIDs), индукционные катушки, магнетрометр Fluxgate, сенсоры Giant-Magnetoresistance или магниторезистивные преобразователи.
28. Соединения для использования в способе по пп.23-27, отличающиеся тем, что содержат смесь различных ферромагнитных или ферримагнитных веществ с имеющими специфическую структуру веществами, причем в качестве имеющих специфическую структуру веществ используют антитела, фрагменты антител, специфически привязывающие к рецепторам агонисты или их антагонисты, специфические пептиды и протеины, рецепторы, энзимы, субстраты энзимов, нуклеотиды, рибонуклеиновые кислоты, дезоксирибонуклеиновые кислоты, углеводы, липопротеины.
29. Соединения для использования в способе по пп.23-27, отличающиеся тем, что время релаксации по методу Нееля ферромагнитных или ферримагнитных веществ при 37oC является более продолжительным чем 10-4 с.
30. Соединения для использования в способе по пп.23-27, отличающиеся тем, что время релаксации по методу Нееля ферромагнитных или ферримагнитных веществ при 37oC является более продолжительным чем 1 с.
31. Соединения по одному из п.29 или 30, отличающиеся тем, что ферромагнитными или ферримагнитными веществами являются окиси железа или окиси железа с добавлением марганца, меди, никеля или кобальта.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19508772.0 | 1995-03-01 | ||
| DE19508772A DE19508772C2 (de) | 1995-03-01 | 1995-03-01 | Verfahren und Verbindungen zur Detektion von Analyten mittels Remanenzmessung und deren Verwendung |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU97116162A RU97116162A (ru) | 1999-08-10 |
| RU2175136C2 true RU2175136C2 (ru) | 2001-10-20 |
Family
ID=7756385
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU97116162/14A RU2175136C2 (ru) | 1995-03-01 | 1996-02-29 | Способ и соединения для обнаружения аналитов с помощью измерения остаточной магнитной индукции и их применение |
Country Status (23)
| Country | Link |
|---|---|
| US (1) | US7033841B1 (ru) |
| EP (1) | EP0812422B1 (ru) |
| JP (1) | JP3628704B2 (ru) |
| KR (1) | KR100416186B1 (ru) |
| CN (1) | CN1144048C (ru) |
| AT (1) | ATE197507T1 (ru) |
| AU (1) | AU706804B2 (ru) |
| CA (1) | CA2214267A1 (ru) |
| DE (2) | DE19508772C2 (ru) |
| DK (1) | DK0812422T3 (ru) |
| ES (1) | ES2153565T3 (ru) |
| FI (1) | FI973561A0 (ru) |
| GR (1) | GR3035495T3 (ru) |
| HU (1) | HU221384B1 (ru) |
| IL (1) | IL117201A (ru) |
| MX (1) | MX9706437A (ru) |
| NO (1) | NO974000D0 (ru) |
| NZ (1) | NZ303196A (ru) |
| PT (1) | PT812422E (ru) |
| RU (1) | RU2175136C2 (ru) |
| UA (1) | UA51646C2 (ru) |
| WO (1) | WO1996027133A1 (ru) |
| ZA (1) | ZA961704B (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2528885C2 (ru) * | 2011-10-04 | 2014-09-20 | Общество с ограниченной ответственностью "Инноград Пущино" | Способ детекции аналита из раствора на частицах и устройство для его реализации |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE19615254C2 (de) * | 1996-04-18 | 1999-03-11 | Diagnostikforschung Inst | Gerät zur höchstempfindlichen magnetischen Detektion von Analyten |
| US6592820B1 (en) * | 1998-11-05 | 2003-07-15 | Bio-Spectrum Technologies, Inc. | System and method for biochemical assay |
| JP2001147230A (ja) * | 1999-11-19 | 2001-05-29 | Hitachi Software Eng Co Ltd | バイオチップ読取装置及び標識試薬 |
| JP3962385B2 (ja) | 2004-03-11 | 2007-08-22 | 株式会社日立製作所 | 免疫検査装置及び免疫検査方法 |
| JP4347107B2 (ja) | 2004-03-26 | 2009-10-21 | 株式会社イノアックコーポレーション | 磁気的免疫反応測定のための試験容器およびその製造方法 |
| WO2008075285A1 (en) * | 2006-12-19 | 2008-06-26 | Koninklijke Philips Electronics N.V. | Measuring agglutination parameters |
| KR100863153B1 (ko) * | 2007-02-15 | 2008-10-13 | 엘지마이크론 주식회사 | 질병 진단용 바이오 센서 및 카트리지와 이를 이용한 질병진단 시스템 |
| JP2011504236A (ja) * | 2007-11-20 | 2011-02-03 | スリーエム イノベイティブ プロパティズ カンパニー | ジアセチレンを含むポリマーセンサーを用いる細菌試料の分析方法 |
| DE102008013997B4 (de) | 2008-03-13 | 2012-10-31 | Bundesrepublik Deutschland, vertr. durch d. Bundesministerium f. Wirtschaft und Technologie, dieses vertreten durch d. Präsidenten d. Physikalisch-Technischen Bundesanstalt | Verfahren zum quantitativen Nachweis von Analyten in flüssigem Medium |
| DE102008057081A1 (de) * | 2008-11-13 | 2010-05-20 | Siemens Aktiengesellschaft | Vorrichtung und Verfahren zur Bestimmung der Menge ferromagnetischer Partikel in einer Suspension |
| US10732178B2 (en) * | 2013-01-29 | 2020-08-04 | Bio-Rad Haifa Ltd. | Detection assays employing magnetic nanoparticles |
| CN108333536B (zh) * | 2017-01-20 | 2021-11-19 | 国家纳米科学中心 | 基于纵向弛豫时间信号读出的磁传感器及其构建方法、用途 |
Family Cites Families (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA1156795A (en) | 1979-04-11 | 1983-11-08 | Richard G. Newell | Curable fluorocarbon substituted polyetherurethaneacrylates |
| FR2461521A1 (fr) * | 1979-07-20 | 1981-02-06 | Anvar | Fluides magnetiques, notamment ferrofluides, et procede pour leur obtention |
| CA1235856A (en) | 1983-03-23 | 1988-05-03 | Reiho Takabe | Biocompatible composite material |
| DE3582649D1 (de) * | 1984-11-01 | 1991-05-29 | Technicon Instr | Magnetisch empfindlicher reagenstraeger und verfahren zur herstellung. |
| US4824587A (en) * | 1985-03-18 | 1989-04-25 | The Dow Chemical Company | Composites of coercive particles and superparamagnetic particles |
| US4849210A (en) * | 1985-05-08 | 1989-07-18 | Molecular Biosystems, Inc. | Magnetic resonance imaging of liver and spleen with superparamagnetic contrast agents |
| WO1987001040A1 (en) | 1985-08-23 | 1987-02-26 | Washington Research Foundation | Polymeric intraocular lens material having improved surface properties |
| US5597531A (en) * | 1985-10-04 | 1997-01-28 | Immunivest Corporation | Resuspendable coated magnetic particles and stable magnetic particle suspensions |
| IT1190428B (it) | 1985-12-05 | 1988-02-16 | Ausimont Spa | Poliesteri fluorurati |
| US4661408A (en) * | 1986-03-18 | 1987-04-28 | E.I. Du Pont De Nemours And Company | Coated chromium dioxide particles |
| US4724390A (en) * | 1986-03-24 | 1988-02-09 | Rauscher Elizabeth A | Non-superconducting apparatus for detecting magnetic and electromagnetic fields |
| US5100689A (en) | 1987-04-10 | 1992-03-31 | University Of Florida | Surface modified surgical instruments, devices, implants, contact lenses and the like |
| US4913883A (en) * | 1987-07-20 | 1990-04-03 | Hitachi, Ltd. | Particle agglutination immunoassay apparatus |
| FR2620624B1 (fr) | 1987-09-23 | 1993-08-20 | Irap | Article en materiau polymere, modifie en surface pour presenter une hemocompatibilite amelioree et une thrombogeneicite diminuee, et son procede d'obtention |
| JPH0235774A (ja) * | 1988-07-26 | 1990-02-06 | Matsushita Electric Ind Co Ltd | 半導体装置 |
| JP2938918B2 (ja) * | 1990-01-25 | 1999-08-25 | ティーディーケイ株式会社 | 磁気微粒子の粒度測定方法 |
| GB9007408D0 (en) * | 1990-04-02 | 1990-05-30 | Nycomed As | Compositions |
| US5164297A (en) * | 1990-05-03 | 1992-11-17 | Advanced Magnetics Inc. | Solvent mediated relaxation assay system |
| IL98744A0 (en) * | 1990-07-06 | 1992-07-15 | Gen Hospital Corp | Method of studying biological tissue using monocrystalline particles |
| FR2669226B1 (fr) | 1990-11-21 | 1997-01-03 | Irap | Dispositif a usage ophtalmologique forme d'un substrat polymerique comportant des groupements fluores en surface, et procede d'obtention. |
| DE4117782C2 (de) * | 1991-05-28 | 1997-07-17 | Diagnostikforschung Inst | Nanokristalline magnetische Eisenoxid-Partikel, Verfahren zu ihrer Herstellung sowie diagnostische und/oder therapeutische Mittel |
| US5464696A (en) * | 1992-08-13 | 1995-11-07 | Bracco International B.V. | Particles for NMR imaging |
| DE4309333A1 (de) * | 1993-03-17 | 1994-09-22 | Silica Gel Gmbh | Superparamagnetische Teilchen, Verfahren zu ihrer Herstellung und Verwendung derselben |
| CA2147813A1 (en) | 1994-04-28 | 1995-10-29 | Richard Dixon | Intravascular prosthesis with anti-thrombogenic coating |
| US5700559A (en) | 1994-12-16 | 1997-12-23 | Advanced Surface Technology | Durable hydrophilic surface coatings |
| DE19503664C2 (de) * | 1995-01-27 | 1998-04-02 | Schering Ag | Magnetorelaxometrische Detektion von Analyten |
| DE19514104C2 (de) | 1995-04-13 | 1997-05-28 | Behringwerke Ag | Beschichtung für in den Blutstrom oder in das Gewebe des menschlichen Körpers einbringbares Biomaterial |
| US5609629A (en) | 1995-06-07 | 1997-03-11 | Med Institute, Inc. | Coated implantable medical device |
| DE19535729A1 (de) | 1995-09-26 | 1997-03-27 | Huels Chemische Werke Ag | Mikroorganismenabweisende Oberflächen |
-
1995
- 1995-03-01 DE DE19508772A patent/DE19508772C2/de not_active Expired - Fee Related
-
1996
- 1996-02-20 IL IL11720196A patent/IL117201A/xx not_active IP Right Cessation
- 1996-02-29 DK DK96905824T patent/DK0812422T3/da active
- 1996-02-29 MX MX9706437A patent/MX9706437A/es not_active IP Right Cessation
- 1996-02-29 AU AU49434/96A patent/AU706804B2/en not_active Ceased
- 1996-02-29 JP JP52602296A patent/JP3628704B2/ja not_active Expired - Fee Related
- 1996-02-29 CA CA002214267A patent/CA2214267A1/en not_active Abandoned
- 1996-02-29 DE DE59606129T patent/DE59606129D1/de not_active Expired - Lifetime
- 1996-02-29 AT AT96905824T patent/ATE197507T1/de not_active IP Right Cessation
- 1996-02-29 KR KR1019970706071A patent/KR100416186B1/ko not_active IP Right Cessation
- 1996-02-29 CN CNB961922826A patent/CN1144048C/zh not_active Expired - Fee Related
- 1996-02-29 US US08/894,767 patent/US7033841B1/en not_active Expired - Fee Related
- 1996-02-29 RU RU97116162/14A patent/RU2175136C2/ru not_active IP Right Cessation
- 1996-02-29 HU HU9800225A patent/HU221384B1/hu unknown
- 1996-02-29 WO PCT/EP1996/000823 patent/WO1996027133A1/de active IP Right Grant
- 1996-02-29 UA UA97094838A patent/UA51646C2/ru unknown
- 1996-02-29 NZ NZ303196A patent/NZ303196A/en unknown
- 1996-02-29 EP EP96905824A patent/EP0812422B1/de not_active Expired - Lifetime
- 1996-02-29 ES ES96905824T patent/ES2153565T3/es not_active Expired - Lifetime
- 1996-02-29 PT PT96905824T patent/PT812422E/pt unknown
- 1996-03-01 ZA ZA961704A patent/ZA961704B/xx unknown
-
1997
- 1997-08-29 FI FI973561A patent/FI973561A0/fi unknown
- 1997-09-01 NO NO974000A patent/NO974000D0/no not_active Application Discontinuation
-
2001
- 2001-02-05 GR GR20010400190T patent/GR3035495T3/el not_active IP Right Cessation
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2528885C2 (ru) * | 2011-10-04 | 2014-09-20 | Общество с ограниченной ответственностью "Инноград Пущино" | Способ детекции аналита из раствора на частицах и устройство для его реализации |
Also Published As
| Publication number | Publication date |
|---|---|
| FI973561A (fi) | 1997-08-29 |
| ATE197507T1 (de) | 2000-11-11 |
| IL117201A (en) | 2000-11-21 |
| PT812422E (pt) | 2001-03-30 |
| WO1996027133A1 (de) | 1996-09-06 |
| HU221384B1 (en) | 2002-09-28 |
| GR3035495T3 (en) | 2001-05-31 |
| HUP9800225A3 (en) | 1999-03-01 |
| CN1144048C (zh) | 2004-03-31 |
| KR100416186B1 (ko) | 2004-03-18 |
| CN1177401A (zh) | 1998-03-25 |
| DE19508772A1 (de) | 1996-09-05 |
| NZ303196A (en) | 1999-04-29 |
| ES2153565T3 (es) | 2001-03-01 |
| NO974000L (no) | 1997-09-01 |
| DE19508772C2 (de) | 1998-01-29 |
| AU4943496A (en) | 1996-09-18 |
| ZA961704B (ru) | 1996-07-29 |
| AU706804B2 (en) | 1999-06-24 |
| US7033841B1 (en) | 2006-04-25 |
| UA51646C2 (ru) | 2002-12-16 |
| EP0812422B1 (de) | 2000-11-08 |
| MX9706437A (es) | 1997-11-29 |
| JP3628704B2 (ja) | 2005-03-16 |
| KR19980702665A (ko) | 1998-08-05 |
| HUP9800225A2 (hu) | 1998-04-28 |
| DE59606129D1 (de) | 2000-12-14 |
| NO974000D0 (no) | 1997-09-01 |
| FI973561A0 (fi) | 1997-08-29 |
| EP0812422A1 (de) | 1997-12-17 |
| IL117201A0 (en) | 1996-06-18 |
| JPH11508031A (ja) | 1999-07-13 |
| DK0812422T3 (da) | 2001-01-29 |
| CA2214267A1 (en) | 1996-09-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2176393C2 (ru) | Способ и соединения для магниторелаксометрического обнаружения аналитов и их применение | |
| US6825655B2 (en) | Method and arrangement for detecting changes of a magnetic response in magnetic particles | |
| JP4171139B2 (ja) | 磁性体標識による免疫検査方法とその装置 | |
| RU97114745A (ru) | Способ и соединения для магниторелаксометрического обнаружения аналитов и их применение | |
| RU2175136C2 (ru) | Способ и соединения для обнаружения аналитов с помощью измерения остаточной магнитной индукции и их применение | |
| EP1421382B1 (en) | Methdo and arrangement for analyzing substances | |
| JP2009098145A (ja) | 超高感度磁力減少測定システムおよびこれを用いた超高感度、洗浄不要の測定方法 | |
| US20030076087A1 (en) | Method and arrangement relating to substance analysis | |
| Yang et al. | Development of antibody functionalized magnetic nanoparticles for the immunoassay of carcinoembryonic antigen: a feasibility study for clinical use | |
| Tsukada et al. | Using magnetic field gradients to shorten the antigen-antibody reaction time for a magnetic immunoassay | |
| JP2003528289A (ja) | 磁性粒子の二重屈折の緩和の測定を利用する結合反応を検出するための方法 | |
| US20030124745A1 (en) | Process for detecting or quantifying a biological reaction using superparamagnetic label | |
| Li et al. | Magnetism of iron oxide nanoparticles and magnetic biodetection | |
| MXPA97005543A (en) | Processes and compounds for magnetorrelaxometric detection of analytics and its |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20050301 |