KR870001924B1 - N-아세틸- β-D-글루코사미니다아제 활성 측정을 위한 N-아세틸-β -D-글루코사미니드류의 제조방법 - Google Patents
N-아세틸- β-D-글루코사미니다아제 활성 측정을 위한 N-아세틸-β -D-글루코사미니드류의 제조방법 Download PDFInfo
- Publication number
- KR870001924B1 KR870001924B1 KR8201133A KR820001133A KR870001924B1 KR 870001924 B1 KR870001924 B1 KR 870001924B1 KR 8201133 A KR8201133 A KR 8201133A KR 820001133 A KR820001133 A KR 820001133A KR 870001924 B1 KR870001924 B1 KR 870001924B1
- Authority
- KR
- South Korea
- Prior art keywords
- acetyl
- nag
- solution
- substrate
- beta
- Prior art date
Links
- 230000000694 effects Effects 0.000 title description 19
- 108010055851 Acetylglucosaminidase Proteins 0.000 title description 15
- 238000002360 preparation method Methods 0.000 title description 4
- 102100030122 Protein O-GlcNAcase Human genes 0.000 title description 2
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 4
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 4
- 150000002367 halogens Chemical class 0.000 claims abstract description 4
- 238000000034 method Methods 0.000 claims description 30
- 150000001875 compounds Chemical class 0.000 claims description 19
- 239000002585 base Substances 0.000 claims description 8
- 229910052783 alkali metal Inorganic materials 0.000 claims description 6
- 150000001340 alkali metals Chemical class 0.000 claims description 5
- 238000001816 cooling Methods 0.000 claims description 3
- 229910052739 hydrogen Inorganic materials 0.000 claims description 3
- 125000002252 acyl group Chemical group 0.000 claims description 2
- 239000001257 hydrogen Substances 0.000 claims description 2
- 125000000218 acetic acid group Chemical group C(C)(=O)* 0.000 claims 1
- 150000002431 hydrogen Chemical class 0.000 claims 1
- 150000008053 sultones Chemical group 0.000 abstract description 3
- 239000002798 polar solvent Substances 0.000 abstract description 2
- 239000002184 metal Substances 0.000 abstract 2
- 239000000543 intermediate Substances 0.000 abstract 1
- 238000007363 ring formation reaction Methods 0.000 abstract 1
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 54
- 239000000243 solution Substances 0.000 description 43
- 239000000758 substrate Substances 0.000 description 33
- 238000006243 chemical reaction Methods 0.000 description 17
- 239000003153 chemical reaction reagent Substances 0.000 description 17
- 239000000203 mixture Substances 0.000 description 17
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 15
- 239000012153 distilled water Substances 0.000 description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 14
- 238000002835 absorbance Methods 0.000 description 13
- 239000000047 product Substances 0.000 description 13
- 238000005259 measurement Methods 0.000 description 12
- 239000002904 solvent Substances 0.000 description 12
- 210000002700 urine Anatomy 0.000 description 12
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 10
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 239000000872 buffer Substances 0.000 description 9
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 8
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 8
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 8
- 239000000741 silica gel Substances 0.000 description 8
- 229910002027 silica gel Inorganic materials 0.000 description 8
- 239000012670 alkaline solution Substances 0.000 description 7
- 210000002966 serum Anatomy 0.000 description 7
- 229910000029 sodium carbonate Inorganic materials 0.000 description 7
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- BELBBZDIHDAJOR-UHFFFAOYSA-N Phenolsulfonephthalein Chemical compound C1=CC(O)=CC=C1C1(C=2C=CC(O)=CC=2)C2=CC=CC=C2S(=O)(=O)O1 BELBBZDIHDAJOR-UHFFFAOYSA-N 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- 239000007979 citrate buffer Substances 0.000 description 6
- 229960003531 phenolsulfonphthalein Drugs 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 5
- 238000004440 column chromatography Methods 0.000 description 5
- 239000000843 powder Substances 0.000 description 5
- 238000003756 stirring Methods 0.000 description 5
- GHCZTIFQWKKGSB-UHFFFAOYSA-N 2-hydroxypropane-1,2,3-tricarboxylic acid;phosphoric acid Chemical compound OP(O)(O)=O.OC(=O)CC(O)(C(O)=O)CC(O)=O GHCZTIFQWKKGSB-UHFFFAOYSA-N 0.000 description 4
- OLQIKGSZDTXODA-UHFFFAOYSA-N 4-[3-(4-hydroxy-2-methylphenyl)-1,1-dioxo-2,1$l^{6}-benzoxathiol-3-yl]-3-methylphenol Chemical compound CC1=CC(O)=CC=C1C1(C=2C(=CC(O)=CC=2)C)C2=CC=CC=C2S(=O)(=O)O1 OLQIKGSZDTXODA-UHFFFAOYSA-N 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- -1 and the like Chemical compound 0.000 description 4
- 229920001429 chelating resin Polymers 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- 239000008363 phosphate buffer Substances 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- QXNVGIXVLWOKEQ-UHFFFAOYSA-N Disodium Chemical class [Na][Na] QXNVGIXVLWOKEQ-UHFFFAOYSA-N 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 3
- 239000004698 Polyethylene Substances 0.000 description 3
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 3
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 239000003513 alkali Substances 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- RTEXIPZMMDUXMR-UHFFFAOYSA-N benzene;ethyl acetate Chemical compound CCOC(C)=O.C1=CC=CC=C1 RTEXIPZMMDUXMR-UHFFFAOYSA-N 0.000 description 3
- MDHYEMXUFSJLGV-UHFFFAOYSA-N beta-phenethyl acetate Natural products CC(=O)OCCC1=CC=CC=C1 MDHYEMXUFSJLGV-UHFFFAOYSA-N 0.000 description 3
- 239000000460 chlorine Chemical group 0.000 description 3
- 229940088598 enzyme Drugs 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 229920000573 polyethylene Polymers 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- SUBJHSREKVAVAR-UHFFFAOYSA-N sodium;methanol;methanolate Chemical compound [Na+].OC.[O-]C SUBJHSREKVAVAR-UHFFFAOYSA-N 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- PGHNKGRDWREWOR-UTDOCYJHSA-N 1-hydroxy-1-[(2r,3r,4r,5s,6r)-3,4,5-triacetyl-5-amino-6-chloro-3,4-dihydroxyoxan-2-yl]propan-2-one Chemical compound CC(=O)C(O)[C@H]1O[C@H](Cl)[C@@](N)(C(C)=O)[C@](O)(C(C)=O)[C@@]1(O)C(C)=O PGHNKGRDWREWOR-UTDOCYJHSA-N 0.000 description 2
- TWCMVXMQHSVIOJ-UHFFFAOYSA-N Aglycone of yadanzioside D Natural products COC(=O)C12OCC34C(CC5C(=CC(O)C(O)C5(C)C3C(O)C1O)C)OC(=O)C(OC(=O)C)C24 TWCMVXMQHSVIOJ-UHFFFAOYSA-N 0.000 description 2
- PLMKQQMDOMTZGG-UHFFFAOYSA-N Astrantiagenin E-methylester Natural products CC12CCC(O)C(C)(CO)C1CCC1(C)C2CC=C2C3CC(C)(C)CCC3(C(=O)OC)CCC21C PLMKQQMDOMTZGG-UHFFFAOYSA-N 0.000 description 2
- BPYKTIZUTYGOLE-IFADSCNNSA-N Bilirubin Chemical compound N1C(=O)C(C)=C(C=C)\C1=C\C1=C(C)C(CCC(O)=O)=C(CC2=C(C(C)=C(\C=C/3C(=C(C=C)C(=O)N\3)C)N2)CCC(O)=O)N1 BPYKTIZUTYGOLE-IFADSCNNSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical group [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 238000010306 acid treatment Methods 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 239000003463 adsorbent Substances 0.000 description 2
- 229910021538 borax Inorganic materials 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Chemical group BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- UREBWPXBXRYXRJ-UHFFFAOYSA-N ethyl acetate;methanol Chemical compound OC.CCOC(C)=O UREBWPXBXRYXRJ-UHFFFAOYSA-N 0.000 description 2
- PFOARMALXZGCHY-UHFFFAOYSA-N homoegonol Natural products C1=C(OC)C(OC)=CC=C1C1=CC2=CC(CCCO)=CC(OC)=C2O1 PFOARMALXZGCHY-UHFFFAOYSA-N 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 208000017169 kidney disease Diseases 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000004328 sodium tetraborate Substances 0.000 description 2
- 235000010339 sodium tetraborate Nutrition 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 101800001241 Acetylglutamate kinase Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 101150041968 CDC13 gene Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 229920002683 Glycosaminoglycan Polymers 0.000 description 1
- 102000001554 Hemoglobins Human genes 0.000 description 1
- 108010054147 Hemoglobins Proteins 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 102000016943 Muramidase Human genes 0.000 description 1
- 108010014251 Muramidase Proteins 0.000 description 1
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 1
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 1
- 125000003047 N-acetyl group Chemical group 0.000 description 1
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 1
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 235000005811 Viola adunca Nutrition 0.000 description 1
- 240000009038 Viola odorata Species 0.000 description 1
- 235000013487 Viola odorata Nutrition 0.000 description 1
- 235000002254 Viola papilionacea Nutrition 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 150000008044 alkali metal hydroxides Chemical class 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 239000012131 assay buffer Substances 0.000 description 1
- 238000010533 azeotropic distillation Methods 0.000 description 1
- 230000008033 biological extinction Effects 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 230000007541 cellular toxicity Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- WWAABJGNHFGXSJ-UHFFFAOYSA-N chlorophenol red Chemical compound C1=C(Cl)C(O)=CC=C1C1(C=2C=C(Cl)C(O)=CC=2)C2=CC=CC=C2S(=O)(=O)O1 WWAABJGNHFGXSJ-UHFFFAOYSA-N 0.000 description 1
- 238000004737 colorimetric analysis Methods 0.000 description 1
- OBRMNDMBJQTZHV-UHFFFAOYSA-N cresol red Chemical compound C1=C(O)C(C)=CC(C2(C3=CC=CC=C3S(=O)(=O)O2)C=2C=C(C)C(O)=CC=2)=C1 OBRMNDMBJQTZHV-UHFFFAOYSA-N 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 1
- MIODCCLUBBHWRC-UHFFFAOYSA-N ethyl acetate;methanol Chemical compound OC.CCOC(C)=O.CCOC(C)=O MIODCCLUBBHWRC-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 230000002949 hemolytic effect Effects 0.000 description 1
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical group II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000004325 lysozyme Substances 0.000 description 1
- 229960000274 lysozyme Drugs 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 1
- 229940100630 metacresol Drugs 0.000 description 1
- 238000003541 multi-stage reaction Methods 0.000 description 1
- 229950006780 n-acetylglucosamine Drugs 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- LQNUZADURLCDLV-UHFFFAOYSA-N nitrobenzene Chemical group [O-][N+](=O)C1=CC=CC=C1 LQNUZADURLCDLV-UHFFFAOYSA-N 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- VXPLXMJHHKHSOA-UHFFFAOYSA-N propham Chemical compound CC(C)OC(=O)NC1=CC=CC=C1 VXPLXMJHHKHSOA-UHFFFAOYSA-N 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 239000011369 resultant mixture Substances 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- NESLWCLHZZISNB-UHFFFAOYSA-M sodium phenolate Chemical compound [Na+].[O-]C1=CC=CC=C1 NESLWCLHZZISNB-UHFFFAOYSA-M 0.000 description 1
- 238000005063 solubilization Methods 0.000 description 1
- 230000007928 solubilization Effects 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 231100000041 toxicology testing Toxicity 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H13/00—Compounds containing saccharide radicals esterified by carbonic acid or derivatives thereof, or by organic acids, e.g. phosphonic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H15/00—Compounds containing hydrocarbon or substituted hydrocarbon radicals directly attached to hetero atoms of saccharide radicals
- C07H15/20—Carbocyclic rings
- C07H15/203—Monocyclic carbocyclic rings other than cyclohexane rings; Bicyclic carbocyclic ring systems
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/34—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving hydrolase
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2334/00—O-linked chromogens for determinations of hydrolase enzymes, e.g. glycosidases, phosphatases, esterases
- C12Q2334/40—Triphenylmethane dye chromogens, e.g. fluorescein derivatives
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/90—Enzymes; Proenzymes
- G01N2333/914—Hydrolases (3)
- G01N2333/924—Hydrolases (3) acting on glycosyl compounds (3.2)
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Immunology (AREA)
- Microbiology (AREA)
- Biophysics (AREA)
- Analytical Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Saccharide Compounds (AREA)
Abstract
내용 없음.
Description
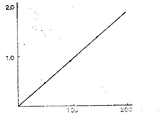
제 1 도는, MCP-NAG법에 의한 NAG아제(NAGase) 활성 및 유리된 MCP간의 관계를 나타낸다. 가로축은 NAG아제의 냉도(μ-L)를, 세로축은 유리된 MCP의 양(△E 580nm/15분)을 나타낸다. 이 수치는 MCP-NAG법에 의한 NAG아제 활성의 측정이, 200μ-L 이상의 냉도에서 가능하다는 것을 보여준다.
제 2도는, PNP-NAG법 및 MCP-NAG법간의 상호관계를 나타낸다. 가로축은 PNP-NAP법에 의한 NAG 아제의 농도(μ-L)를 나타내고, 새로축은 MCP-NAG에 의한 (μ-L)를 나타낸다.
직선회기 Y=1.04X+0.02 r=0.9997
N-아세틸-β-D-글루코사미니다아제(NAG 아제로 약칭)는, 세뇨관 상피에 많이 함유되어 있는 리소조음내의 효소로서 무코다당류 및 당단백질의 분해에 관여한다. 각종 신장질환 또는 신장수술후에는 뇨(urine)중의 NAG 아제가 상승하고, 당뇨병의 경우에는 뇨뿐만아니라 혈청중의 NAG 아제가 상승한다는 사실이 확인되었다. 임상 및 동물실험면에 있어서, NAG 아제의측정은 각종 신장질환 진단의 한 방편으로서, 또 신세포 독성검사의 지표로서 주목을 끌어왔다.
종래에는, 일반적으로 P-니트로페닐 N-아세틸-β-D-글루코사미니드[Biochemical Preparations,10, 118(1963)] 및 4-메틸룸벨리페릴- N-아세틸-β-D글루코사 미니드[Clinica Acta, 69(1), 85-91(1976)]가 NAG 이제 활성의 측정에 사용되어 왔다. 그러나 전자는 측정파장에서 빌리루빈 및 용혈 헤모글로빈과 같은 생체성분의 영향을 받기 쉬워서 각 표본 마다의 공시험이 필요하므로, 측정절차가 매우 복잡하는 등의 결점이 있다. 후자 또한 분광광도제와 같은 특수한 장치를 필요로 하는 결점이 있다. 본 발명자들은 집중적인 연구끝에, 상술의 결점없이 고감도로 정밀 및 신속하게 측정을 수행할 수 있는 NAG 아제 활성 측정용 기질을 발견함으로써 본 발명을 완성하였다. 일본국 특허 미심사 공고번호 51-114990등에는, 본 발명 화합물과 구조상으로 유사한, 페놀프탈레이닐 N-아세틸-β-D-글루코사미니드를 사용하여 임부의 타액중의 NAG 아제를 측정할 수 있음이 기제되어 있다. 그러나 이 시약은 분석 완충액에 불용이고, 가용화제로 가용화 시킨후에도, 분석반응은 즉시 탈색되기 쉬운 불안정한 발색을 나타내는 결점이 있다. 본 발명의 화합물은 이상과 같은 결점을 전혀 가지고 있지 않다.
본 발명은 신규 N-아세틸-β-D-글루코사미니드류, N-아세틸-β-D-글루코사미다아제 활성의 측정방법 및 그를 위한 시약(kits)에 관한 것이다.
본 발명의 신규 N-아세틸-β-D-글루코사미니드류는 1-클로로-1-데옥시-2,3,4,6-테트라아세틸-α-D-글루코사아민 및 이에 상응하는 에글리코운으로 부터 용이하게 제조할 수 있고, 인간 또는 동물로부터 채취한 뇨 또는 혈청중의 NAG 아제 측정용 기질로 사용된다. 본 발명에서 NAG 아제 활성은 가질시약, 완충시약 및 알칼리시약으로 구성되는 시약을 사용하여 비색 측정된다.
본 발명의 신규 N-아세틸-β-D-글루코사미니드류는 하기의 일반식(I)을 갖는다.
(여기서, 각각의 R1,R2및 R3는 수소, 저급알킬 또는 할로겐이고 Y2는 알칼리 금속임)
식(I)에 대한 상기의 정의에서, R1,R2및 R3표시되는 저급알킬은, 메틸, 에틸, 프로필, 이소프로필, 부틸 및 이소부틸과 같은 탄소수 1-4의 직쇄 또는 축쇄 알킬을 나타내고, 특히 메틸 및 이소프로필이 바람직하다. 할로겐은 플루오르, 염소, 브롬, 또는 요오드를 나타내고, 특히 염소 또는 브롬이 바람직하다. Y2로 표시되는 알칼리 금속은 리튬, 나트륨 또는 칼륨을 나타낸다.
본 발명의 화합물은 (I)은 하기식(II)로 표시되는 1-클로로-1-데옥시-2,3,4,6-테트라아세틸-α-D-글루코사민 및 하기식(III)으로 표시되는 애글리코운으로 부터 용이하게 제조된다.
(여기서, 각각의 R1,R2및 R3는 상기와 동일한 의미이고, Ac는 아세틸 임)
화합물(II)는 공지물질이고, 생화학 제조 (Biochemical Preparations) 10, 118(1963)에 기재되어 있다.
화합물(III)은 시판의 적정시약으로부터 선택되는데, 여기에는 알카리용액(약 pH 10-11)에서 레드 또는 퍼플-블루로 변색하는 페놀레드(페놀폰프탈레인)[R1=R2=R3=H],크레솔 레드(0-크레솔술폰프탈레인) [R1=R2=H, R3=CH3], 메타-크레솔 퍼플(m-크레솔술폰프랄레인),[R1=CH3, R2=R3=H], 클로로페놀 레드 (디클로로페놀술폰프랄레인)[R1=R2= H, R3=Cl] 등이 있고, 특히 페놀레드 및 메타-크레솔이 바람직하다. 상기의 애글리코운은 모드 흡수극대의 파장이 550nm 이상이고, 표본 블랭크의 측정을 생략 할 수 있다.
본 발명의 화합물은 하기의 반응순서에 따라 제조된다.
(여기에서, 각각의 R1,R2,R3, 및 Ac는 상기와 동일하고, Y1및 Y2는 알칼리 금속이고, Z는 아실임)
(제1공정)
본 공정은, 화합물(III)의 술톤환을 개환(cleavage)시켜, 그의 이-알칼리금속염을 수득하는 것으로 이루어지고, 이 반응은 염기처리에 의해 용이하게 수행된다. 염기로는 알칼리금속 수산화물 또는 알코올레이트를 사용하는 것이 적당하다. 수산화리튬, 수산화나트륨, 수산화칼륨, 나트륨메틸레이트, 나트륨페놀레이트 등을 그 예로 들 수 있고, 특히 수산화나트륨 및 나트륨 메틸레이트가 바람직하다. 또는 상기의 단계적인 반응대신에, 적당한 용매, 바람직하게는 극성용매, 좀더 바람직하기는 아세톤 내에서 화합물(II)와(III)의 반응을 염기존재하 수행하여, 혼합물(V)을 수득한다.
(제 2공정)
본 공정은 화합물(II)와 (IV)의 반응에 의해, 에테르결합을 형성시키는 것으로 이루어진다. 용매로는, 아세톤, 디메틸포름아미드, 디메틸술폭시드 등을 사용할 수 있다. 무수조건하에서 디메틸포름아미드를 사용하는 것이 특히 바람직하다. 반응은 실온 또는 냉각하에서 수행될 수 있고, 일반적으로 십수시간 내에 완료된다.
반응종료후, 생성물은 산처리에 의해 불변의 출발물질(IV)로 부터 분리된다. 산으로는 묽은 염산, 묽은 황산 및 묽은 질산과 같은 유기산 이외에도, 앰버리트(Amberite) IRC-50(롬앤드 하스사) 같은 약산성 및 양이온성 교환수지를 사용할 수 있다.
(제 3공정)
본 공정은, 정제를 위한 제 2공정으로 부터 생성물(V)을 아실화시키는 것으로 이루어지나, 애글리코운의 종류 및 반응조건에 따라 가능하면 본 공정을 생략할 수도 있다. 아실화에 있어서는 특히 아세틸화가 바람직하고, 적당한 용매, 바람직하게는 피리딘 내에서, 동량 또는 약간 과량의 부수 아세트산과 함께 반응을 수행할 수 있다. 일반적으로, 반응은 실온에서 십수시간 내에 완결된다.
(제4공정)
본 공정에서는 N-아세틸기를 제외한 아세틸기(O-아세틸기) 또는 O-보호기가 제거되고, 염기처리에 의해 반응이 완성된다. 염기로는, 알칼리 금속의 알코올레이트가 적당하고, 특히 나트륨 메틸레이트가 바람직하다. 반응은 보통 냉각하, 바람직하기는 0-10℃의 온도에서 수행되고, 십수시간 내에 완료된다.
반응종료후, 생성물은 산으로 처리하여, 과량의 염기를 제거한다.
상술의 각 공정은 단일반응 용기내에서 수행이 가능한다. 예를들어, 화합물(III)을 알칼리로 처리하고, 화합물(II)를 가한다음, 알칼리 가수분해에 의해 아세틸을 제거하고, 산처리하여 화합물(I)을 수득한다.
본 발명에서 NAG 아제 측정용 시약을 하기의 약품으로 구성된다.
i) 본 발명의 화합물 (I)로 구성된 기질시약
ii) 완충제
iii) 알칼리 시약
i)의 기질시약은, 화합물(I) 또는, 화합물(I) 및 봉사의 혼합물인 기질자체를 의미한다. 이 시약은 동결건조되고, 타이트하게 밀폐된 앰푸울 또는 바이알 속에 봉입되어, 특정의 pH범위, 즉ii)의 완충액의 유지를 위해, 사용직전에 완충용액에 용해시켜 사용하는 것이 바람직하다.
ii)의 완충시약은, NAG 아제의 반응에 있어서의 pH 범위를 3.5-6.0, 좀 더 바람직하게는 4.0-5.5로 유지시키는 시약을 의미한다. 예를들어, 시트레이트 완충액, 붕사-시트레이트 완충액, 시트레이트-포스페이트 완충액 등을 증류수에 용해시킨 용액을 사용할 수 있는데 붕사-시트레이트 완충액을 사용하는 것이 특히 바람직하다. 기질과 NAG 아제의 반응은, 기질의 가수분해를 억제하면서 처음 30분간 37℃에서 직선적으로 진행됨으로써, 기질 블랭크의 흡광도는 작아지고, NAG 아제의 측정범위는 확대된다. 붕사를 섞은 기질시약을 사용하는 경우, 시트레이트 완충액을 사용함으로써 동일한 효과를 달성할 수 있다. 시트레이트-포스페이트 완충액의 사용은 뇨에만 한정되는데, 왜냐하면 혈청중의 NAG 아제 분석시에는 지연상(laf-phase)이 나타나기 쉽다.
ⅲ)의 알칼리 시약은, 분석용액의 최종 pH를 10-11로 조정할 수 있는 시약을 의미한다. 예를들어, 탄산나트륨, 탄산칼륨, 수산화나트륨, 수산화칼륨, 붕산염-탄산나트륨 등을 선택할 수 있고, 이들을 사용하기 직전에 증류수에 용해시키면 된다. 기질의 가수분해를 억제하기 위해서는, 붕산염-탄산나트륨 완충액이 특히 바람직하다.
효과 및 용도
본 발명의 화합물(I)은, 인간 또는 동물에서 채취한 뇨 또는 혈청내의 NAG 아제 활성 측정용 기질로서 사용된다.
[측정의 원리]
계의 산성pH(pH3.5-6.0, 특히 4.0-5.5)를 유지하는 완충액 내에서, 표본은 기질로 사용된 화합물(I)과 같이 일정시간 배양시키는 경우, 표본의 NAG 아제는 기질(I)을 가수분해시켜서 하기에 나타낸 바와 같이 애글리코운(Ⅷ) 및 N-아세틸 글루코사민(Ⅶ)을 생성한다. 애글리코운(Ⅷ)을 하기 식(IV)의 착색된이-알칼리염으로 변화시키기 위해, 알칼리 용액을 사용하여 생성혼합물의 pH를 10-11로 조정하고, 분광 광도계로 생성된 색상의 비색검정을 실시한다.
(여기에서, R1,R2,R3,Y1및 Y2는 상기와 동일한 의미임)
[측정절차]
10㎖의 튜브에 1.0㎖l의 기질용액(2-6mM/L)을 채우고, 37℃에서 5분간 예비가온 시킨후, 50㎕의 표본*을 가하고, 혼합물을 37℃에서 x분간 배양시킨다. x분후, 알칼리 용액을 2.0㎖ 가하여 반응을 정지시키고, 증류수 또는 공기를 대조로 사용하여, 최종용액의 흡광도를 생성된 애글리코운의 최대 흡수파장에서 1시간 이내에 측정한다. 기질 블랭크는 표본대신에 50㎕의 증류수를 사용함으로써 수득이 가능하다.
*주:표본; 인간 또는 동물로 부터 채집된 뇨 또는 혈청으로서, 채취후 즉시 측정을 하는 것 바람직하다. 이를 장시간 보존해야 하는 경우에는, 2N-염산 또는 2N-수산화 칼륨을 사용하여 2의 pH를 6.5로 조정한다. 이 조건하에서, 표본의 NAG 아제 활성은 실온에서 하루 및, -20℃에서 4달간 안정하게 보존된다.
여기에서, 1분당, (I)로 부터 1μmol의 애글리코운(Ⅷ)을 생산하는 NAG 아제의 양을 1유닛(u)으로 정한다.
[효소농도의 계산]
표본의 NAG 아제 농도를 하기식에 따라 산출한다.
표본의 NAG 아제 농도(μ/l)
AE=E1-E2
E1=최종 용액의 흡광도
E2=기질블랭크의 흡광도
d=광로(path)의 길이(cm)
ε=측정 파장에 있어서의 애글리코운(Ⅷ)의 흡광계수(cm1/μM)
x=반응시간(분)
본 분석에서는 10-30분간, 바람직하게는 10-15분간의 시간이 적당하다.
[표준곡선]
측정절차의 항에 기재한 대로, 일정량의 NAG 아제를 화합물 (I)의 기질용액에 가하고, 생성혼합물을 반응시켜서, 애글리코운(Ⅷ)을 수득한다. 그런다음 애글리코운 양(Ⅷ)과 NAG 아제 유닛간의 관계로부터 표준곡선을 작성한다. 예를 들어 NAG아제의 활성은, 기질로서 소디오-m-크레솔술폰프탈레이닐 β-D-글루코사미니드(I)(R1=CH3,R2R3=H, Y2=Na)(MCP-NAG로 약칭)을 함유하는 시약을 사용하여 측정하고, NAG 아제 유닛 및 유리된 MCP [메타-크레솔 퍼플(m-크레솔 술폰프탈레인)] 양의 관계는 제 1도에 나타낸 바와 같다. 제1도는 MCP-NAG가 기질인 경우에 NAG 아제의 측정은 200μ/L이상의 농도에서 가능하다는 것을 나타낸다.
[정밀도]
특정 NAG 아제 용액을 사용하여, 복수측정에 의해 분석의 재현성도를 검사한다: 변동계수는 1.95%인데, 이는 본 분석의 고 재현성도를 나타낸다.
[정상치]
건강한 사람 26명(남 : 14, 여 : 12)에 있어서의 뇨의 NAG 아제 활성을 MCP-NAG법으로 측정하는 경우, 활성은 남자의 경우 1.13-13.10μ/L, 여자의 경우에는 0.68-5.20μ/L이다. 이른 아침 3시간동안 채집한 뇨의 평균활성은 8.1μ/L(1.5-29.8μ/L)이라는 사실이 보고되어 있다. (Clinica Chimica Acta 73,453 (1976) )
[공지방법과의 비교]
기질로서 P-니트로페닐-N-아세틸-β-D-글루코 사미드를 사용하는 방법(PNP-NAG법)과 비교하면서, 본 발명의 MCP-NAG법으로 소의 신장의 NAG활성을 측정한다. 제 2도에 이들의 상관관계를 표시한다. PNP-NAG법에 의한 NAG아제의 활성 측정을 하기와 같이 실시한다.
10㎖의 튜브에, 1.0㎖의 시약-I용액i)을 채운다음, 37℃에서 10분간 예비가온 한 후, 50㎕의 뇨를 가하고, 혼합물을 37℃에서 반응시킨다. 30분후에, 시약-II용액ii)을 2.0㎖가하여, 반응을 정지시킨다. 그런다음 2시간 이내에, 대조로서 증류수 또는 공기를 사용하여 405nm에서 흡광도를 측정한다. 각 표본에 필요한 뇨 블랭크를 측정키 위해, 시약-I용액 대신에 시약-III용액iii) 1.0㎖를 사용하고, 동일한 방법으로 하여 위의 절차를 실시한다. 시약-I용액(1.0㎖), 증류수(50㎕) 및 시약-II용액(2.0㎖)를 사용하여 이 절차를 실시함으로써, 기질블랭크를 수득한다.
주 : i) 5mM기질 용액(0.05M 시트레이트-포스페이트 완충액, pH 4.40)
ii) 0.2M붕산염-탄산나트륨 완충액(pH 10.5)
iii) 0.05M 시트레이트-포스페이트 완충액(pH 4.40)
표본의 NAG 아제 농도는 하기의 식으로 부터 산출된다.
표본중의 NAG 아제 농도(μ/L)
△D=E1-(E2+E3)
E1=최종용액의 흡광도
E2=뇨블랭크의 흡광도
E3=기질블랭크의 흡광도
d=광로의 길이(cm)
제2도에서 보는 바와같이, MCP-NAG법 및 PNP-NAG법 간에는 양호한 상호 관계가 있다. 그러나, MCP-NAG에 의해 측정되는 활성이, 동일한 표본에 PNP-NAG법을 실시함으로써 얻어지는 활성보다 약 4%가 높다.
하기의 실시예가 본 발명을 좀 더 자세히 설명한 것이다.
[실시예 1]
소디오-페놀술폰프탈레이닐-N-아세틸-β-D-글루코사미니드
(1) 페놀술폰프탈레인 1(373mg,1.05mmol)을 1N나트륨 메톡시드 메탄올용액(2.0ml,2.0mmol)에 녹이고, 메탄올을 35℃ 이하의 온도에서 감압하 제거한다. 잔류물에 벤젠을 가하고, 고형물을 연마한 후, 용매를 35℃이하의 온도에서 감압하 증발시킨다. 이 과정을 2회 반복하고, 생성 잔류물을 감압하에서 3시간 건조시켜, 페놀술폰프탈레인의 이-나트륨염 2를 얻는다.
(2) 상기에서 수득한 이나트륨염 2를 디메틸포름아미드(10㎖)와 가능한한 잘 섞어, 청자색의 혼합물을 얻는다. 1-클로로-1-데옥시-2,3,4,6-데트라아세틸-α-D-글루코사민 3(366mg,1.0mmol)[BiocRemical Preparation 10; 118(1963)]을 교반하 가하여,적자색의 거의 투명한 용액을 얻는다. 이 용액을 약 30분간 실옥에서 교반한 다음, 5℃에서 철야(18시간) 방치한다. 여기에 메탄올로 세척한 앰버리트8IRC-50(2㎖)을 가하고, 혼합물을 30분간 교반시키고, 여과한다. 침전물을 메탄올로 세척한다. 여액 및 세척액을 섞고, 감압하에서 증발시킨다. 잔류물에 톨루엔을 가하고, 이 용액을 감압하 건조상태까지 증발시킨다. 잔류물을 메탄올에 용해시키고, 실리카겔(3g)에 흡착시킨 다음, 메탄올을 제거한뒤, 잔류물을 크로마토그래피(고정상 : 30g실리카겔, 용매계 : 에틸아세테이트-에틸아세테이트-메탄올=3 : 1)하여, 소디오-페놀술폰프탈레이닐-2,3,4,6-테트라아세틸-β-D-글루코사미니드 4를 주성분으로하는 함유하는 획분(540mg)을 수득한다.
(3) 상기 과정(2)에서 수득한 확분에,무수 아세트산(4.5㎖) 및 피리딘(7㎖)의 혼합물을 가한다. 철야 방치시킨후, 냉각 교반하 (2㎖)을 가한다. 생성 혼합물을 1시간 방치시킨 후, 용매를 감압하 제거한다. 전류물에 톨루엔을 가하고, 혼합물을 건조 상태까지 감압하 증발시킨다. 이 과정을 2회 반복하고, 생성 잔류물에 염화 메틸렌을 가하여, 가용성 획분(약 540mg)을 수득한다. 이 획분은 박층 크로마토그래피 상에서 2개의 주점을 나타낸다. 컬럼 크로마토그래피[고정상 : 실리카겔(8.5g), 용매계 : 벤젠-에틸아세테이트=1 : 2]로 분리시켜, 0,0-디아세틸페놀술폰프탈레인(제1획분) 및 0-아세틸페놀술폰프탈레이닐-2,3,4,6-테트라아세틸-β-D-글루코사미니드류 5(제2획분)을 거의 무색의 발포성 물질로서 수득한다. (수율42%).
생성물 5를 다시 컬럼 크로마토그래피(고정상 : 실리카겔, 용매계 : 벤젠-에틸아세테이트=1 : 2)로 정제하여, 순순한 생성물 5를 수득한다.
NMR:CDC131.86(s,3H), 2.03(s,9H), 2.29(s,3H), 3.7-4.4(4H), 5.10(t,J=9.5Hz,1H), 5.36(d,J =8.0Hz,1H), 5.43(t,J=9.5Hz,1H), 6.24(d,J=9.0Hz,1H), 6.8-8.0(12H).
[α]d-6.3±0.3° (C=1.956, CHCl3)
(4) 상기의 (3)에서 수득한 생성물 5(308mg, 0.424mmol)를 메탄올(4㎖)에 용해시키고, 여기에 나트륨 메톡시드의 1N 메탄올 용액(0.85㎖ 0.85mmol)을 가한다. 생성된 적색 용액을 5℃에서 15시간 방치한다. 메탄올을 적신 앰버리트8 IRC-50(1.5㎖)를 가하고, 혼합물을 1.5시간 교반한다. 여과로 고형물을 모우고, 메탄올로 세척한다. 여액 및 세척액을 섞고, 감압하 증발시켜, 오렌지 빛의 분말 잔류물을 수득한다. 이 생성물을 컬럼 크로마토그래피[고정상 : 실리카겔(1.5g),용매계 : 에틸아세테이트-메탄올=2 : 1]로 정제하면, 소디오-페놀술폰프탈레이닐 N-아세틸-β-D-글루코사미니드 6(209mg)이고 흡착성의 오렌지 빛 분말로서 수득된다.(수율:89%)
NMR:CD3OD1.95(s,3H), 3.3-4.2(6H), 5.12(d,J=8.0Hz,1H), 6.0-6.6(2H), 6.8-7.8(9H), 7.9-8.3(1H)
TLC(머어크사제 키이젤, 에틸 아세테이트:메탄올=2 : 1) Rf치 : 약 0.14.
[실시예 2]
소디오-m-크레솔술폰프탈레이닐-N-아세틸-β-D-글루코사미니드
(1) 실시예1(1)의 방법에 따라, m-크레솔술폰프탈레인 7(4.02g, 10.5mmol) 및 1N의 나트륨 메톡시드 메탄올 용액(20㎖, 20mmol)으로부터, m-크레솔술폰프탈레인의 이나트륨염 8을 수득한다.
(2) 상기에서 수득한 이나트륨염 8을 디메틸포름아미드(50㎖)와 가능한한 잘 섞은다음, 1-클로로-1-데옥시-2,3,4,6-데트라아세틸-α-D-클루코사민 3(3.66g, 10mmol)을 교반하 가하여, 적자색의 거의 투명한 용액을 수득한다. 이 용액을 5℃에서 16.5시간 방치시킨 뒤, 메탄올을 적신 앰버리트7 IRC-50(25㎖)을 가하면, 색이 적갈색으로 변색한다. 30분간 교반한 후, 혼합물을 여과하고, 고형물을 메탄올로 세척한다. 여액 및 세척액을 섞고, 증발시킨다. 그런 다음, 톨루엔과의 공비 증류에 의해 디메틸포름아미드를 제거하고, 잔류물을 메탄올(25㎖)에 용해시킨다. 이 용액을 실리카겔(25g)과 혼합하고, 메탄올을 잘 농축시킨 다음, 잔류물을 컬럼 크로마토그래피(고정상 : 실리카겔)한다. 에틸아세테이트(2.3L)로 용출되는 획분은 버리고, 뒤이어 다시 메탄올(0.8L)로 용출시켜, 주성분으로서 소디오-m-크레솔술폰프탈레이닐-2,3,4,6-데트라아세틸-β-D-글루코사미니드 9를 함유하는 획분을 수득한다.
(3) 상기의 (2)에서 얻은 획분에, 무수 아세트산(50㎖) 및 피리딘(70㎖)의 혼합물을 가한다. 철야 방치시킨 후, 실시예 1(3)과 동일한 방법으로 이 혼합물을 처리한다. 수득된 잔류물은 박층 크로마토그래피상에서 2개의 점을 나타낸다. 컬럼크로마토그래피[고정상 : 살라카겔(100g), 용매계 : 벤젠-에틸 아세테이트=1 : 2]로 분리시켜, 0,0-디아세틸-m-클레솔술폰프탈레인(제1획분) 및 0-아세틸-m-크레솔술폰프탈레이닐-2,3,4,6-데트라아세틸-β-D-글루코사미니드 10(4.50g)(제2획분)을 담황색 발포상 물질로서 수득한다(수율60%)
NMR :CDCl31.88(s,3H), 2.02(s,9H), 2.12(s,6H), 2.27(s,3H), 3.7-4.4(4H), 5.10(t,J=9.5Hz,1H), 5.32(d,J=8.0Hz,1H), 5.43(t,J=9.5Hz,1H), 5.98(d,J=9.0Hz,1H), 6.8-8.0(10H).
(4) 상기 (3)에서 수득한 생성물 10(4.42g, 5.86mmol)을 무수 메탄올(100㎖)에 용해시키고, 여기에 1N나트륨 메톡시드 메탄올 용액(11.72㎖, 11.72mmol )을 가한다. 생성된 암갈색 용액을 5℃에서 철야 방치시킨다. 메탄올을 적신 앰버리트 7 IRC-50(30㎖l)를 가하고, 30분간 교반시킨 후, 혼합물을 여과하고, 메탄올로 세척한다. 여액 및 세척액을 섞어, 감압하 증발시킨다. 생성물을 컬럼 크로마토그래피[고정상 : 실리카겔(120g), 용매계 : 에틸 아세테이트-메탄올=2 : 1]로 정제하여, 소디오-m-크레솔술폰프탈레이닐-N-아세틸-β-D-글루코사미니드 11(2.77g)을 고 흡착성 오렌지 빛 분말로서 수득한다.
NMR : δCD3OD1.6-2.4(9H), 3.3-4.2(6H), 4.9-5.2(1H), 5.9-8.4(10H).
[실시예 3]
MCP-NAG 및 붕사의 동결 건조품을 0.05M 시트레이트 완충액(pH 4.15, 50㎖)에 용해시켜, 기질 용액을 제조한다(MCP-NAG 5.13ml, pH4.4). 10ml튜브에, 1.0㎖의 기질 용액을 채우고, 37℃에서 5분간 예비 가온시킨 후, 여기에 뇨(50㎕)를 가한다. 생성 용액을 37℃에서 반응시킨다. 15분 후, 여기에 0.3M의 탄산나트륨액(2.0㎖)을 가하여, 유리된 MCP를 발색시키고, 580nm(E1)에서의 흡광도를, 대조로서 증류수 또는 공기를 사용하여 1시간 내에 측정한다. 기질 블랭크로서, 표본 대신에 증류수(50㎕)를 가하여, 흡광도(E2)를 측정한다.
NAG 아제의 농도는 하기와 같이 계산한다.
NAG 아제의 농도(μ/L)
=△E×107.0
[실시예 4]
소디오-페놀술폰프탈레이닐-N-아세틸-β-D-글루코 사미니드(PR-NAG)의 동결 건조품을 0.05M붕사-시트레이트 완충액(pH 4.4)(5mM)에 용해시켜, 기질 용액을 수득한다. 10㎖튜브에 1.0㎖의 기질 용액을 채우고, 37℃에서 5분간 예비 가온한 후, 사람의 혈청(50㎕)을 가하고 그 즉시 교반 시킨다. 생성 혼합물을 37℃에서 10분간 반응시킨 후, 0.2M붕산염-탄산나트륨 완충액(pH10.5, 20㎖)을 가하여, 효소를 비활성화 하는 동시에 유리된 PR[페놀 레드(페놀술폰프탈레인)]을 발색시킨다. 557nm에서의 흡광도(E1)를, 대조로서 증류수 또는 공기를 사용하여 측정한다. 기질 블랭크로서, 혈청 대신에 증류수(50㎕)를 사용하여, 흡광도(E2)를 측정한다.NAG 아제의 농도를 하기와 같이 계산한다.
NAG 아제의 농도(μ/L)
=△W×96.8
[실시예 5]
PR-NAG를 0.25M의 붕사-시트레이트(pH 4.4)에 용해시켜, 25mM 용액을 제조한다. 생성된 용액을 10-㎖씩 분할하여, 각각 50㎖의 유리 바이알에 채운다음, 동결 건조 시킨다. 붕산(93.7g) 및 탄산나트륨(706.3g)을 연마하고, 혼합시킨 다음, 입제화한다. 그런 다음, 혼합물 1.98g을 분말 충전기를 사용하여, 120㎖ 플리에틸렌 병에 포장한다.
[실시예 6]
실시예 5에서 수득한, PR-NAG 동결 건조품을 증류수(50㎖)에 용해시키고, 1㎖의 생성 용액을 기질 용액으로 사용한다. 증류수(100㎖)를, 실시예 5에서 수득한 폴리에틸렌 병에 채운 분말에 첨가하고, 이 용액 2.0㎖를 알칼리 용액으로 사용한다. 실시예 4에서 설명한 것과 동일한 방법으로 수행되는 분석 절차에, 이 기질 용액 및 알칼리 용액을 사용한다. NAG 아제의 농도를 하기와 같이 계산한다.
NAG 아제의 농도(μ/L)
=△E×96.8
[실시예 7]
실시예 5와 동일한 방법으로 제조된, MCP-NAG 동결 건조품을 증류수 (50㎖)에 용해시키고, 이 용액 1㎖를 기질 용액으로 사용한다. 실시예 5에서 수득한 폴리에틸렌.병에 채운 분말에, 증류수(100㎖)를 가하고 이 용액 2㎖를 알칼리 용액으로 사용한다. 이 기질 용액 및 알칼리 용액을 사용하여, 실시예 3과 동일한 방법으로 분석 절차를 수행한다. 흡광도를 580nm에서 측정한다.
NAG 아제의 농도(μ/L)
=△E×106.46
Claims (1)
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP56039104A JPS58994A (ja) | 1981-03-17 | 1981-03-17 | 新規N−アセチル−β−D−グルコサミン誘導体およびこれを基質として用いるN−アセチル−β−D−グルコサミニダ−ゼ活性測定法 |
| JP39104 | 1981-03-17 | ||
| JP56-39104 | 1981-03-17 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR830009136A KR830009136A (ko) | 1983-12-17 |
| KR870001924B1 true KR870001924B1 (ko) | 1987-10-22 |
Family
ID=12543756
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR8201133A KR870001924B1 (ko) | 1981-03-17 | 1982-03-17 | N-아세틸- β-D-글루코사미니다아제 활성 측정을 위한 N-아세틸-β -D-글루코사미니드류의 제조방법 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US4433139A (ko) |
| EP (1) | EP0060793B1 (ko) |
| JP (1) | JPS58994A (ko) |
| KR (1) | KR870001924B1 (ko) |
| DE (1) | DE3260690D1 (ko) |
| DK (1) | DK163516C (ko) |
| GB (1) | GB2095666B (ko) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4552841A (en) * | 1981-03-17 | 1985-11-12 | Shionogi & Co., Ltd. | N-Acetyl-β-D-glucosaminides for determining N-acetyl-β-D-glucosaminidase activity |
| DE3345748A1 (de) * | 1983-12-17 | 1985-08-29 | Boehringer Mannheim Gmbh, 6800 Mannheim | Phenolsulfonphthaleinyl-ss-d-galactoside, verfahren zu deren herstellung sowie deren verwendung zur bestimmung der ss-d-galactosidase |
| US5034317A (en) * | 1987-01-30 | 1991-07-23 | Polaroid Corporation | Enzyme controlled release system and organic conjugate reactant |
| IL85581A (en) * | 1987-05-21 | 1992-05-25 | Technicon Instr | Substrate for beta-galactosidase comprising derivatives of 4-nitrophenyl-beta-d-galactopyranoside and beta-galactosidase immunoassay containing said substrate |
| JPH0650991B2 (ja) * | 1987-06-11 | 1994-07-06 | 塩野義製薬株式会社 | NAGase活性測定用試薬および測定方法 |
| JP2722874B2 (ja) * | 1991-08-01 | 1998-03-09 | 日東紡績株式会社 | 新規N−アセチル−β−D−グルコサミン誘導体及びこれを基質に用いたN−アセチル−β−D−グルコサミニダーゼ活性測定法 |
| US5208326A (en) * | 1991-11-08 | 1993-05-04 | Miles Inc. | 8-hydroxy-2h-dibenz(b,f)azepin-2-one dyes |
| CN111850092A (zh) * | 2020-07-01 | 2020-10-30 | 甘肃省地质矿产勘查开发局第三地质矿产勘查院(甘肃遥感地质中心、甘肃地质灾害防治工程勘查设计院、甘肃省地质遗迹评估中心、甘肃省中心实验室) | 基于土壤酶活性测定的土壤生物学活性和生产力评价方法 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2453069A1 (de) * | 1974-11-06 | 1976-05-13 | Schering Ag | Neue glykoside |
| US4152513A (en) * | 1977-06-01 | 1979-05-01 | University Of Delaware | Preparation of alkyl glycosides of amino sugars |
-
1981
- 1981-03-17 JP JP56039104A patent/JPS58994A/ja active Granted
-
1982
- 1982-03-11 US US06/357,317 patent/US4433139A/en not_active Expired - Lifetime
- 1982-03-16 DK DK115282A patent/DK163516C/da not_active IP Right Cessation
- 1982-03-16 DE DE8282400485T patent/DE3260690D1/de not_active Expired
- 1982-03-16 EP EP82400485A patent/EP0060793B1/en not_active Expired
- 1982-03-17 KR KR8201133A patent/KR870001924B1/ko active
- 1982-03-17 GB GB8207797A patent/GB2095666B/en not_active Expired
Also Published As
| Publication number | Publication date |
|---|---|
| US4433139A (en) | 1984-02-21 |
| KR830009136A (ko) | 1983-12-17 |
| DK163516C (da) | 1992-07-27 |
| GB2095666A (en) | 1982-10-06 |
| EP0060793B1 (en) | 1984-09-12 |
| DK115282A (da) | 1982-09-18 |
| JPS637196B2 (ko) | 1988-02-15 |
| DE3260690D1 (de) | 1984-10-18 |
| JPS58994A (ja) | 1983-01-06 |
| GB2095666B (en) | 1985-02-27 |
| DK163516B (da) | 1992-03-09 |
| EP0060793A1 (en) | 1982-09-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US4716222A (en) | Substrates for hydrolases | |
| EP0231125B1 (en) | Hydrolyzable fluorescent substrates and analytical determinations using same | |
| DK160948B (da) | Middel, testmateriale og fremgangsmaade til bestemmelse af tilstedevaerelsen af leukocyter, esterase eller protease | |
| NO164201B (no) | Reagens for spektrofotometrisk bestemmelse av tilstedevaerelsen av leukocytter, esterase eller protease i en proeve, forsoeksinnretning omfattende denne og fremgangsmaate til bestemmelse av tilstedevaerelsen av de nevnte stoffene. | |
| CA1337656C (en) | Substrates for phospholipases | |
| KR870001924B1 (ko) | N-아세틸- β-D-글루코사미니다아제 활성 측정을 위한 N-아세틸-β -D-글루코사미니드류의 제조방법 | |
| US4668622A (en) | Phenolsulphonphthaleinyl-β-D-galactosides and diagnostic agents containing them | |
| CA1190223A (en) | Substrates for enzymes | |
| US4271265A (en) | Method and reagent for the determination of glutamate-oxalacetate transaminase and glutamate-pyruvate transaminase | |
| US4396714A (en) | N-Sulfoalkylaniline derivatives | |
| US4552841A (en) | N-Acetyl-β-D-glucosaminides for determining N-acetyl-β-D-glucosaminidase activity | |
| US4171432A (en) | Flavin adenine dinucleotide-iodothyronine conjugates | |
| GB2134524A (en) | Fluorogenic esters of phosphoric acid | |
| US5399488A (en) | Method for assaying enzyme activity using N-acetyl-β-D-glucosamine derivatives | |
| US4719097A (en) | Phosphates of resorufin derivatives and compositions thereof for the determination of the activity of phosphatases | |
| KR900005623B1 (ko) | Nag 아제의 측정 방법 및 그의 시약 | |
| US4045290A (en) | Diagnostic method and compounds for use therewith | |
| US5011964A (en) | Novel diacylglycerophosphoric acid esters and use thereof as substrates in enzyme assays | |
| EP0411159B1 (en) | Method for determining enzymatic activity | |
| EP0155825A2 (en) | Novel choline derivatives | |
| EP0363688B1 (en) | Novel phosphoric acid derivatives and a method for determination of acid phosphatase activity using the same | |
| EP0292169B1 (en) | Substrates for B-galactosidase | |
| EP0160980B1 (en) | Novel method for determining cholinesterase activity | |
| US4861713A (en) | Novel method for determining cholinesterase activity | |
| US6534637B2 (en) | Synthesis of chlorophenol red glucuronic acid |