KR20230013259A - 자성 나노 입자를 사용하는 분석물(들)의 검출 및 정량화 - Google Patents
자성 나노 입자를 사용하는 분석물(들)의 검출 및 정량화 Download PDFInfo
- Publication number
- KR20230013259A KR20230013259A KR1020227044248A KR20227044248A KR20230013259A KR 20230013259 A KR20230013259 A KR 20230013259A KR 1020227044248 A KR1020227044248 A KR 1020227044248A KR 20227044248 A KR20227044248 A KR 20227044248A KR 20230013259 A KR20230013259 A KR 20230013259A
- Authority
- KR
- South Korea
- Prior art keywords
- magnetic field
- sample
- particles
- sensor
- magnetisable particles
- Prior art date
Links
- 239000012491 analyte Substances 0.000 title claims abstract description 100
- 238000001514 detection method Methods 0.000 title claims description 67
- 238000011002 quantification Methods 0.000 title claims description 15
- 239000002122 magnetic nanoparticle Substances 0.000 title description 4
- 230000005291 magnetic effect Effects 0.000 claims abstract description 303
- 239000002245 particle Substances 0.000 claims abstract description 291
- 238000000034 method Methods 0.000 claims abstract description 119
- 239000011230 binding agent Substances 0.000 claims abstract description 52
- 230000027455 binding Effects 0.000 claims abstract description 35
- 230000033001 locomotion Effects 0.000 claims abstract description 30
- 230000008859 change Effects 0.000 claims abstract description 24
- 230000000295 complement effect Effects 0.000 claims abstract description 11
- 238000012545 processing Methods 0.000 claims description 14
- 230000000694 effects Effects 0.000 claims description 12
- 238000006243 chemical reaction Methods 0.000 claims description 11
- 238000012360 testing method Methods 0.000 claims description 11
- 230000007613 environmental effect Effects 0.000 claims description 10
- 230000005294 ferromagnetic effect Effects 0.000 claims description 7
- 230000005298 paramagnetic effect Effects 0.000 claims description 7
- 230000008878 coupling Effects 0.000 claims description 4
- 238000010168 coupling process Methods 0.000 claims description 4
- 238000005859 coupling reaction Methods 0.000 claims description 4
- 230000001419 dependent effect Effects 0.000 claims description 3
- 230000001360 synchronised effect Effects 0.000 claims description 3
- 239000000523 sample Substances 0.000 description 180
- 239000000090 biomarker Substances 0.000 description 46
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 39
- 238000009792 diffusion process Methods 0.000 description 22
- 239000003446 ligand Substances 0.000 description 19
- 239000000377 silicon dioxide Substances 0.000 description 19
- 108010090804 Streptavidin Proteins 0.000 description 18
- 238000000576 coating method Methods 0.000 description 17
- 239000012530 fluid Substances 0.000 description 16
- 239000011248 coating agent Substances 0.000 description 15
- 230000035945 sensitivity Effects 0.000 description 13
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 12
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical group [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 11
- 238000003556 assay Methods 0.000 description 11
- 239000006249 magnetic particle Substances 0.000 description 11
- 230000008569 process Effects 0.000 description 11
- 230000003993 interaction Effects 0.000 description 10
- 238000002360 preparation method Methods 0.000 description 10
- 125000000524 functional group Chemical group 0.000 description 9
- 239000010931 gold Substances 0.000 description 9
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N iron oxide Inorganic materials [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 9
- 229910052737 gold Inorganic materials 0.000 description 8
- 238000002156 mixing Methods 0.000 description 8
- 102000004169 proteins and genes Human genes 0.000 description 8
- 108090000623 proteins and genes Proteins 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 108090000790 Enzymes Proteins 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 7
- 206010028980 Neoplasm Diseases 0.000 description 7
- 239000004094 surface-active agent Substances 0.000 description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 6
- 230000002776 aggregation Effects 0.000 description 6
- 238000004220 aggregation Methods 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 239000003153 chemical reaction reagent Substances 0.000 description 6
- -1 heating rate Substances 0.000 description 6
- 238000013537 high throughput screening Methods 0.000 description 6
- 150000007523 nucleic acids Chemical class 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 5
- 201000011510 cancer Diseases 0.000 description 5
- 239000003638 chemical reducing agent Substances 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 235000013980 iron oxide Nutrition 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 102000039446 nucleic acids Human genes 0.000 description 5
- 108020004707 nucleic acids Proteins 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 4
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 4
- 108700012920 TNF Proteins 0.000 description 4
- BOTDANWDWHJENH-UHFFFAOYSA-N Tetraethyl orthosilicate Chemical compound CCO[Si](OCC)(OCC)OCC BOTDANWDWHJENH-UHFFFAOYSA-N 0.000 description 4
- 229960002685 biotin Drugs 0.000 description 4
- 239000011616 biotin Substances 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- CVSVTCORWBXHQV-UHFFFAOYSA-N creatine Chemical compound NC(=[NH2+])N(C)CC([O-])=O CVSVTCORWBXHQV-UHFFFAOYSA-N 0.000 description 4
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 4
- 235000013305 food Nutrition 0.000 description 4
- 238000007306 functionalization reaction Methods 0.000 description 4
- 239000010410 layer Substances 0.000 description 4
- 239000000696 magnetic material Substances 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 229910052751 metal Inorganic materials 0.000 description 4
- 239000002184 metal Substances 0.000 description 4
- 239000013642 negative control Substances 0.000 description 4
- 230000009871 nonspecific binding Effects 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 229920000642 polymer Chemical group 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 238000005070 sampling Methods 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- 229910000077 silane Inorganic materials 0.000 description 4
- 229910052709 silver Inorganic materials 0.000 description 4
- 239000004332 silver Substances 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 229910002546 FeCo Inorganic materials 0.000 description 3
- 229910005335 FePt Inorganic materials 0.000 description 3
- 230000005355 Hall effect Effects 0.000 description 3
- 230000003213 activating effect Effects 0.000 description 3
- 125000003277 amino group Chemical group 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 235000020958 biotin Nutrition 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 150000007942 carboxylates Chemical class 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000000975 co-precipitation Methods 0.000 description 3
- 239000000356 contaminant Substances 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 239000003792 electrolyte Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 239000005556 hormone Substances 0.000 description 3
- 229940088597 hormone Drugs 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000003780 insertion Methods 0.000 description 3
- 230000037431 insertion Effects 0.000 description 3
- 229910052742 iron Inorganic materials 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 150000004706 metal oxides Chemical group 0.000 description 3
- 239000004530 micro-emulsion Substances 0.000 description 3
- 239000000203 mixture Substances 0.000 description 3
- 239000002105 nanoparticle Substances 0.000 description 3
- PXHVJJICTQNCMI-UHFFFAOYSA-N nickel Substances [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 3
- 244000045947 parasite Species 0.000 description 3
- 210000003296 saliva Anatomy 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 150000003573 thiols Chemical class 0.000 description 3
- 230000036962 time dependent Effects 0.000 description 3
- 239000011782 vitamin Substances 0.000 description 3
- 229940088594 vitamin Drugs 0.000 description 3
- 229930003231 vitamin Natural products 0.000 description 3
- 235000013343 vitamin Nutrition 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- DUUGKQCEGZLZNO-UHFFFAOYSA-N 5-hydroxyindoleacetic acid Chemical compound C1=C(O)C=C2C(CC(=O)O)=CNC2=C1 DUUGKQCEGZLZNO-UHFFFAOYSA-N 0.000 description 2
- 108010088751 Albumins Proteins 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 229920001661 Chitosan Polymers 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- 241000282324 Felis Species 0.000 description 2
- 101710193519 Glial fibrillary acidic protein Proteins 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical compound OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 2
- 229920002873 Polyethylenimine Polymers 0.000 description 2
- 229920002125 Sokalan® Polymers 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- UCTWMZQNUQWSLP-UHFFFAOYSA-N adrenaline Chemical compound CNCC(O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-UHFFFAOYSA-N 0.000 description 2
- 229910045601 alloy Inorganic materials 0.000 description 2
- 239000000956 alloy Substances 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 230000005290 antiferromagnetic effect Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- 210000001124 body fluid Anatomy 0.000 description 2
- YCIMNLLNPGFGHC-UHFFFAOYSA-N catechol Chemical compound OC1=CC=CC=C1O YCIMNLLNPGFGHC-UHFFFAOYSA-N 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 239000002131 composite material Substances 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 229960003624 creatine Drugs 0.000 description 2
- 239000006046 creatine Substances 0.000 description 2
- 229940109239 creatinine Drugs 0.000 description 2
- 238000013480 data collection Methods 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000002405 diagnostic procedure Methods 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 230000009881 electrostatic interaction Effects 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 239000003302 ferromagnetic material Substances 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 210000005046 glial fibrillary acidic protein Anatomy 0.000 description 2
- 208000006454 hepatitis Diseases 0.000 description 2
- 231100000283 hepatitis Toxicity 0.000 description 2
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 238000007689 inspection Methods 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 229920002521 macromolecule Polymers 0.000 description 2
- 230000005415 magnetization Effects 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 229910044991 metal oxide Inorganic materials 0.000 description 2
- 239000002159 nanocrystal Substances 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 150000002924 oxiranes Chemical class 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 210000002381 plasma Anatomy 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- WGYKZJWCGVVSQN-UHFFFAOYSA-N propylamine Chemical group CCCN WGYKZJWCGVVSQN-UHFFFAOYSA-N 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 238000011896 sensitive detection Methods 0.000 description 2
- 150000004756 silanes Chemical class 0.000 description 2
- 230000003068 static effect Effects 0.000 description 2
- 239000010907 stover Substances 0.000 description 2
- YUYCVXFAYWRXLS-UHFFFAOYSA-N trimethoxysilane Chemical compound CO[SiH](OC)OC YUYCVXFAYWRXLS-UHFFFAOYSA-N 0.000 description 2
- 150000003722 vitamin derivatives Chemical class 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 229910000859 α-Fe Inorganic materials 0.000 description 2
- 150000005206 1,2-dihydroxybenzenes Chemical class 0.000 description 1
- XQKJQIUZEFAGFC-UHFFFAOYSA-N 2,2-dihydroxy-3-phenylpropanoic acid Chemical compound OC(=O)C(O)(O)CC1=CC=CC=C1 XQKJQIUZEFAGFC-UHFFFAOYSA-N 0.000 description 1
- YTVQIZRDLKWECQ-UHFFFAOYSA-N 2-benzoylcyclohexan-1-one Chemical compound C=1C=CC=CC=1C(=O)C1CCCCC1=O YTVQIZRDLKWECQ-UHFFFAOYSA-N 0.000 description 1
- GXDMUOPCQNLBCZ-UHFFFAOYSA-N 3-(3-triethoxysilylpropyl)oxolane-2,5-dione Chemical compound CCO[Si](OCC)(OCC)CCCC1CC(=O)OC1=O GXDMUOPCQNLBCZ-UHFFFAOYSA-N 0.000 description 1
- SJECZPVISLOESU-UHFFFAOYSA-N 3-trimethoxysilylpropan-1-amine Chemical group CO[Si](OC)(OC)CCCN SJECZPVISLOESU-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 102000011767 Acute-Phase Proteins Human genes 0.000 description 1
- 108010062271 Acute-Phase Proteins Proteins 0.000 description 1
- 208000020576 Adrenal disease Diseases 0.000 description 1
- 208000005676 Adrenogenital syndrome Diseases 0.000 description 1
- PQSUYGKTWSAVDQ-ZVIOFETBSA-N Aldosterone Chemical compound C([C@@]1([C@@H](C(=O)CO)CC[C@H]1[C@@H]1CC2)C=O)[C@H](O)[C@@H]1[C@]1(C)C2=CC(=O)CC1 PQSUYGKTWSAVDQ-ZVIOFETBSA-N 0.000 description 1
- PQSUYGKTWSAVDQ-UHFFFAOYSA-N Aldosterone Natural products C1CC2C3CCC(C(=O)CO)C3(C=O)CC(O)C2C2(C)C1=CC(=O)CC2 PQSUYGKTWSAVDQ-UHFFFAOYSA-N 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 208000000412 Avitaminosis Diseases 0.000 description 1
- 208000012904 Bartter disease Diseases 0.000 description 1
- 208000010062 Bartter syndrome Diseases 0.000 description 1
- 102000015081 Blood Coagulation Factors Human genes 0.000 description 1
- 108010039209 Blood Coagulation Factors Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 229910018979 CoPt Inorganic materials 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- 208000008448 Congenital adrenal hyperplasia Diseases 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- 239000000055 Corticotropin-Releasing Hormone Substances 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 208000030453 Drug-Related Side Effects and Adverse reaction Diseases 0.000 description 1
- 206010014405 Electrocution Diseases 0.000 description 1
- 208000017701 Endocrine disease Diseases 0.000 description 1
- 244000282866 Euchlaena mexicana Species 0.000 description 1
- 239000012692 Fe precursor Substances 0.000 description 1
- CWYNVVGOOAEACU-UHFFFAOYSA-N Fe2+ Chemical compound [Fe+2] CWYNVVGOOAEACU-UHFFFAOYSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 102000053171 Glial Fibrillary Acidic Human genes 0.000 description 1
- 102100039289 Glial fibrillary acidic protein Human genes 0.000 description 1
- 102000004457 Granulocyte-Macrophage Colony-Stimulating Factor Human genes 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102000018997 Growth Hormone Human genes 0.000 description 1
- 108010051696 Growth Hormone Proteins 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 101000942118 Homo sapiens C-reactive protein Proteins 0.000 description 1
- 101000922020 Homo sapiens Cysteine and glycine-rich protein 1 Proteins 0.000 description 1
- 101000599852 Homo sapiens Intercellular adhesion molecule 1 Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 208000023105 Huntington disease Diseases 0.000 description 1
- 208000002682 Hyperkalemia Diseases 0.000 description 1
- 208000029422 Hypernatremia Diseases 0.000 description 1
- 206010021135 Hypovitaminosis Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 208000032420 Latent Infection Diseases 0.000 description 1
- 206010067125 Liver injury Diseases 0.000 description 1
- 208000004852 Lung Injury Diseases 0.000 description 1
- 208000004155 Malabsorption Syndromes Diseases 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- 229920000426 Microplastic Polymers 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 241000244206 Nematoda Species 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000013612 Parathyroid disease Diseases 0.000 description 1
- 102000003982 Parathyroid hormone Human genes 0.000 description 1
- 108090000445 Parathyroid hormone Proteins 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 102000006877 Pituitary Hormones Human genes 0.000 description 1
- 108010047386 Pituitary Hormones Proteins 0.000 description 1
- 208000014993 Pituitary disease Diseases 0.000 description 1
- 229920002845 Poly(methacrylic acid) Polymers 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 102100024819 Prolactin Human genes 0.000 description 1
- 108010057464 Prolactin Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- 239000002262 Schiff base Substances 0.000 description 1
- 150000004753 Schiff bases Chemical class 0.000 description 1
- 239000004115 Sodium Silicate Substances 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 102000011923 Thyrotropin Human genes 0.000 description 1
- 108010061174 Thyrotropin Proteins 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- 206010069363 Traumatic lung injury Diseases 0.000 description 1
- 102000001400 Tryptase Human genes 0.000 description 1
- 108060005989 Tryptase Proteins 0.000 description 1
- 208000009311 VIPoma Diseases 0.000 description 1
- 102000009524 Vascular Endothelial Growth Factor A Human genes 0.000 description 1
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- NJSVDVPGINTNGX-UHFFFAOYSA-N [dimethoxy(propyl)silyl]oxymethanamine Chemical compound CCC[Si](OC)(OC)OCN NJSVDVPGINTNGX-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 230000004520 agglutination Effects 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 229960002478 aldosterone Drugs 0.000 description 1
- 239000012670 alkaline solution Substances 0.000 description 1
- 150000001345 alkine derivatives Chemical class 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 210000004381 amniotic fluid Anatomy 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 230000002686 anti-diuretic effect Effects 0.000 description 1
- 229940124538 antidiuretic agent Drugs 0.000 description 1
- 239000002885 antiferromagnetic material Substances 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- IVRMZWNICZWHMI-UHFFFAOYSA-N azide group Chemical group [N-]=[N+]=[N-] IVRMZWNICZWHMI-UHFFFAOYSA-N 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 239000003114 blood coagulation factor Substances 0.000 description 1
- 230000008416 bone turnover Effects 0.000 description 1
- 230000006931 brain damage Effects 0.000 description 1
- 231100000874 brain damage Toxicity 0.000 description 1
- 208000029028 brain injury Diseases 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 208000002458 carcinoid tumor Diseases 0.000 description 1
- 230000003683 cardiac damage Effects 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 238000012650 click reaction Methods 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 230000006854 communication Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 239000002772 conduction electron Substances 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000007771 core particle Substances 0.000 description 1
- 239000011258 core-shell material Substances 0.000 description 1
- 229960000258 corticotropin Drugs 0.000 description 1
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- CZWCKYRVOZZJNM-USOAJAOKSA-N dehydroepiandrosterone sulfate Chemical compound C1[C@@H](OS(O)(=O)=O)CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC=C21 CZWCKYRVOZZJNM-USOAJAOKSA-N 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 239000002889 diamagnetic material Substances 0.000 description 1
- 229910003460 diamond Inorganic materials 0.000 description 1
- 239000010432 diamond Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 208000037771 disease arising from reactivation of latent virus Diseases 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 238000011143 downstream manufacturing Methods 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 206010013663 drug dependence Diseases 0.000 description 1
- 239000002359 drug metabolite Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- OUDSFQBUEBFSPS-UHFFFAOYSA-N ethylenediaminetriacetic acid Chemical compound OC(=O)CNCCN(CC(O)=O)CC(O)=O OUDSFQBUEBFSPS-UHFFFAOYSA-N 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 210000003722 extracellular fluid Anatomy 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 230000007274 generation of a signal involved in cell-cell signaling Effects 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- OTCKNHQTLOBDDD-UHFFFAOYSA-K gold(3+);triacetate Chemical compound [Au+3].CC([O-])=O.CC([O-])=O.CC([O-])=O OTCKNHQTLOBDDD-UHFFFAOYSA-K 0.000 description 1
- 239000003163 gonadal steroid hormone Substances 0.000 description 1
- 230000005484 gravity Effects 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 231100000234 hepatic damage Toxicity 0.000 description 1
- 102000051143 human CRP Human genes 0.000 description 1
- 229960000890 hydrocortisone Drugs 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 238000001027 hydrothermal synthesis Methods 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 239000011229 interlayer Substances 0.000 description 1
- 150000002505 iron Chemical class 0.000 description 1
- VBMVTYDPPZVILR-UHFFFAOYSA-N iron(2+);oxygen(2-) Chemical class [O-2].[Fe+2] VBMVTYDPPZVILR-UHFFFAOYSA-N 0.000 description 1
- SZVJSHCCFOBDDC-UHFFFAOYSA-N iron(II,III) oxide Inorganic materials O=[Fe]O[Fe]O[Fe]=O SZVJSHCCFOBDDC-UHFFFAOYSA-N 0.000 description 1
- JEIPFZHSYJVQDO-UHFFFAOYSA-N iron(III) oxide Inorganic materials O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 238000002032 lab-on-a-chip Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 230000008818 liver damage Effects 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 238000007449 liver function test Methods 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 231100000515 lung injury Toxicity 0.000 description 1
- 230000005381 magnetic domain Effects 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 235000000824 malnutrition Nutrition 0.000 description 1
- 230000001071 malnutrition Effects 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- HDUNVICUTAZXTE-UHFFFAOYSA-N methyl(3-trihydroxysilylpropoxy)phosphinic acid Chemical compound CP(O)(=O)OCCC[Si](O)(O)O HDUNVICUTAZXTE-UHFFFAOYSA-N 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 238000000593 microemulsion method Methods 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 239000002086 nanomaterial Substances 0.000 description 1
- 229940031182 nanoparticles iron oxide Drugs 0.000 description 1
- 229920005615 natural polymer Polymers 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 208000030212 nutrition disease Diseases 0.000 description 1
- 208000015380 nutritional deficiency disease Diseases 0.000 description 1
- 230000008816 organ damage Effects 0.000 description 1
- 239000013110 organic ligand Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 239000000199 parathyroid hormone Substances 0.000 description 1
- 229960001319 parathyroid hormone Drugs 0.000 description 1
- 239000013618 particulate matter Substances 0.000 description 1
- 238000009928 pasteurization Methods 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 229910000889 permalloy Inorganic materials 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 239000002831 pharmacologic agent Substances 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000010399 physical interaction Effects 0.000 description 1
- 238000000053 physical method Methods 0.000 description 1
- 238000012123 point-of-care testing Methods 0.000 description 1
- 229920000867 polyelectrolyte Polymers 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 229940097325 prolactin Drugs 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000000197 pyrolysis Methods 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 208000023504 respiratory system disease Diseases 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 210000000582 semen Anatomy 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 125000005373 siloxane group Chemical group [SiH2](O*)* 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- NTHWMYGWWRZVTN-UHFFFAOYSA-N sodium silicate Chemical compound [Na+].[Na+].[O-][Si]([O-])=O NTHWMYGWWRZVTN-UHFFFAOYSA-N 0.000 description 1
- 229910052911 sodium silicate Inorganic materials 0.000 description 1
- 239000002689 soil Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 208000011117 substance-related disease Diseases 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 238000006557 surface reaction Methods 0.000 description 1
- 210000004243 sweat Anatomy 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 210000001138 tear Anatomy 0.000 description 1
- 230000002123 temporal effect Effects 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- NJRXVEJTAYWCQJ-UHFFFAOYSA-N thiomalic acid Chemical compound OC(=O)CC(S)C(O)=O NJRXVEJTAYWCQJ-UHFFFAOYSA-N 0.000 description 1
- 230000006016 thyroid dysfunction Effects 0.000 description 1
- 239000005495 thyroid hormone Substances 0.000 description 1
- 229940036555 thyroid hormone Drugs 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 238000001771 vacuum deposition Methods 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 208000030401 vitamin deficiency disease Diseases 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/72—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating magnetic variables
- G01N27/74—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating magnetic variables of fluids
- G01N27/745—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating magnetic variables of fluids for detecting magnetic beads used in biochemical assays
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/50273—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the means or forces applied to move the fluids
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54313—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being characterised by its particulate form
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54313—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being characterised by its particulate form
- G01N33/54326—Magnetic particles
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54313—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being characterised by its particulate form
- G01N33/54326—Magnetic particles
- G01N33/54333—Modification of conditions of immunological binding reaction, e.g. use of more than one type of particle, use of chemical agents to improve binding, choice of incubation time or application of magnetic field during binding reaction
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/544—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being organic
- G01N33/545—Synthetic resin
- G01N33/547—Synthetic resin with antigen or antibody attached to the carrier via a bridging agent
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/551—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being inorganic
- G01N33/553—Metal or metal coated
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01R—MEASURING ELECTRIC VARIABLES; MEASURING MAGNETIC VARIABLES
- G01R33/00—Arrangements or instruments for measuring magnetic variables
- G01R33/12—Measuring magnetic properties of articles or specimens of solids or fluids
- G01R33/1269—Measuring magnetic properties of articles or specimens of solids or fluids of molecules labeled with magnetic beads
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/043—Moving fluids with specific forces or mechanical means specific forces magnetic forces
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/46—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans from vertebrates
- G01N2333/47—Assays involving proteins of known structure or function as defined in the subgroups
- G01N2333/4701—Details
- G01N2333/4737—C-reactive protein
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/52—Assays involving cytokines
- G01N2333/525—Tumor necrosis factor [TNF]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/52—Assays involving cytokines
- G01N2333/53—Colony-stimulating factor [CSF]
- G01N2333/535—Granulocyte CSF; Granulocyte-macrophage CSF
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/52—Assays involving cytokines
- G01N2333/54—Interleukins [IL]
- G01N2333/5412—IL-6
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/76—Assays involving albumins other than in routine use for blocking surfaces or for anchoring haptens during immunisation
- G01N2333/765—Serum albumin, e.g. HSA
Landscapes
- Health & Medical Sciences (AREA)
- Immunology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Hematology (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Physics & Mathematics (AREA)
- General Health & Medical Sciences (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Pathology (AREA)
- Medicinal Chemistry (AREA)
- Biotechnology (AREA)
- Food Science & Technology (AREA)
- Cell Biology (AREA)
- Microbiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Dispersion Chemistry (AREA)
- Clinical Laboratory Science (AREA)
- Electrochemistry (AREA)
- Inorganic Chemistry (AREA)
- Condensed Matter Physics & Semiconductors (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Nanotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- General Engineering & Computer Science (AREA)
- Medical Informatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Crystallography & Structural Chemistry (AREA)
- Investigating Or Analyzing Materials By The Use Of Magnetic Means (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Compounds Of Iron (AREA)
- Soft Magnetic Materials (AREA)
Abstract
시료에서 분석물을 검출하기 위한 방법 및 장치로서, 타겟 분석물을 포함하는 시료를 자화성 입자들 ― 입자들은 타겟 분석물에 상보적인 결합 분자들로 코팅됨 ― 과 접촉시켜, 결합 및 비결합 결합제 복합체들을 생성하는 단계, 결합 및 비결합 결합제 복합체들 둘 다를 포함하는, 자화성 입자들을 자기장 센서 근처에 위치시키는 단계, 결합 및 비결합 결합제 복합체들 둘 다를 포함하는, 자화성 입자들의 적어도 일부를 자기장 센서 근처로부터 방출하기에 충분하게 자기장을 변화시키는 단계, 및 자기 센서에 대한 자화성 입자들의 순 이동 ― 병진 또는 회전 이동 중 어느 하나임 ― 으로부터 검출되는 자기 신호의 변화를 측정하는 단계를 포함하는, 방법 및 장치가 설명된다.
Description
본 발명은 시료에서 분석물(들)을 검출하기 위한 방법, 보다 구체적으로, 자화성 나노입자들 및 자기 센서 시스템의 사용에 관한 것이다. 본 발명은 또한 자화성 나노입자들의 사용에 기초하여 분석물을 검출하기 위한 장치에 관한 것이다.
시료에서 분석물을 검출하고 정량화하는 많은 방법들이 알려져 있다. 이러한 시스템들은 분석물에 결합된 복합체를 검출하고 측정하여 분석물을 정량화하는 간접적인 방법이 필요하다. 통상적으로, 이러한 방법들은 시각화 보조제가 시료의 분석물에 결합하는 결합 분자에 코팅되거나 연결되는 결합 또는 인식 시스템에 의존한다.
결합 분자는 타겟 분석물에 대한 친화도에 기초하여 특이적으로 선택된 항체, 효소 또는 약리학적 제제를 포함할 수 있다. 분석물에 직접 결합하는 분자 자체는 효소 또는 형광단으로 표지될 수 있다(형광 표지의 경우).
대안적으로, 분석물에 직접 결합하는 분자는 그 자체가 표지되지 않을 수 있고, 대신 효소 또는 형광단으로 자체 표지된 추가 결합제에 결합된다. 이 추가 표지 절차는 신호를 증폭하고 배경 염색을 줄일 수 있다. 잘 알려져 있는 복합체는 아비딘-비오틴 복합체와 페록시다아제-안티페록시다아제 기술이다.
시료에서 분석물을 검출하고 정량화하는 기술은 체외 진단의 요구를 충족하기 위해 신속하고 민감하며 정성적 및/또는 소형화 가능해야 한다. 장치의 소형화는 점성력의 증가로 인해 유체의 느리고 비효율적인 혼합으로 이어질 수 있다.
현장 진료 검사는 진단 검사의 처리 시간을 줄여 워크플로를 개선하고 잠재적으로 환자 치료를 개선하는 데 도움이 될 수 있다. 이러한 시스템에는 생체 표지(예를 들어, 단백질 표지 또는 핵산 표지)를 감지하는 감지 기술이 포함되어야 한다. 자화성 입자들은 기초 연구에서 높은 처리량 검사에 이르기까지 수동 분석 전반에 걸쳐 분석물을 검출하는 데 사용되었다.
자화성 입자들에 부착된 분석물을 검출하기 위한 기존의 많은 장치는 현장 진단 검사 적용예에서 소형화에 적합하지 않거나 쉽게 적응되지 않는 복잡한 구성을 필요로 한다.
자화성 입자들의 사용은 타겟 분석물에 대한 결합을 가능하게 하기 위해 결합 분자(예를 들어, 타겟 분석물에 대한 높은 친화도를 갖는 항체)로 입자들을 기능화한 다음, 분리 및 정제를 달성하기 위한 유체 교환 단계에 의존한다. 분석물 포획율은 부유 입자들의 총 표면적 및 이에 따라 입자 농도에 따라 확장되는 것으로 보고되었다. 그러나, 매우 높은 농도의 입자들을 사용하면 일반적으로 높은 입자 농도가 비특이적 입자-입자 및 입자-표면 상호작용을 증가시키고, 자기장 유도 입자 응집을 향상시키고, 입자 농도 단계들에서 입체 장애를 일으키고 입자들에 대한 화학 반응을 방해하며, 입자들과 바이오 감지 표면 사이의 반응을 입체적으로 저해하기 때문에 통합된 다단계 랩온칩 분석에서 다운스트림 공정에 대한 단점이 있다.
타겟 분석물은 혈액 또는 타액과 같은 고농도의 배경 물질을 함유하는 시료 내에 저농도로 존재할 수 있다. 이러한 복합 기질에서, 타겟이 아닌 분자가 자화성 입자들에 비특이적으로 부착되면 분석의 효과가 감소할 수 있다.
타겟 분석물의 자성 입자 기반 포획 과정은 두 성분들(대상 분석물과 자성 입자들) 간의 충돌로 이루어지고, 두 성분들이 서로에 대해 매우 특이적 방식으로 외측 표면들을 정렬하는 것에 의존할 수 있다. 이에 따라, 두 성분들의 연관율은 확산과 두 성분의 결합 위치들의 기하학적 제약들에 의해 제한될 수 있고, 또한 최종 화학 반응에 의해 감소될 수 있다.
분석물은 흐르는 유체 또는 정적 유체에 포획될 수 있다. 흐름이 없으면, 표면 고정된 항체에 의존하는 방법은 확산에 의해 제한되고, 결합율이 감소할 수 있다.
자성 입자에 의해 타겟 분석물을 포획한 후, 검출을 위한 추가 처리가 필요하다. 자화성 입자들은 캐리어로서만 사용된다면, 통상적으로 발광 표지 또는 형광 분자와 같은 식별 분자에 결합된다. 정확한 검출을 위해서는 결합된 분석물에만 표지를 지정하고, 결합된 표지만 검출하는 것이 중요하다. 이를 위해서는 몇몇 세척 또는 분리 단계들이 필요하다.
자화성 입자들은 또한 감지 표면에서 타겟 분석물의 결합을 나타내는 표지로서 사용될 수 있다. 응집 분석은 특정 분석물이 시료 유체에 존재할 때, 입자들의 응집이 형성되는 과정을 이용한다. 응집의 정도는 유체 내의 분석물의 농도에 대한 척도이다. 응집 분석은 분리 또는 엄격함 없이 한 단계로 분석이 수행되기 때문에 시약에 대한 요구가 높다.
자기 응집 분석에서, 입자 클러스터들의 형성이 자기장의 영향 하에 입자들을 결합함으로써 가속화된다. 이러한 방법론들의 문제는 분석물 농도가 자화성 입자 농도보다 훨씬 작을 때, 푸아송(Poisson) 통계에 따라 적은 수의 입자 응집체가 형성된다는 것이다. 자기장의 인가는 배양 중에 자기장을 적용하여 향상될 수 있다. 그러나, 자기장은 입자들 사이의 비특이적 결합을 증가시킬 수 있다. 비특이적 결합(즉, 결합이 타겟 분석물에 의해 매개되지 않음)은 위양성 신호를 초래한다. 비특이적 결합은 반데르발스 상호작용, 정전기 상호작용 및 소수성 상호작용과 같은 여러 유형의 상호작용에서 유래할 수 있으며, 이는 결과들의 통계적 변화뿐만 아니라 배경 수준을 유발하므로, 정량화의 한계와 방법의 정밀도에 영향을 미친다.
자화성 입자들의 사용은 예를 들어, 결합 입자들과 비결합 입자들을 분리하기 위해 입자들에 추가 힘을 가할 수 있음을 의미한다.
검출 방법론의 분석 수행의 평가는 정량 한계(LoQ), 즉 주어진 요구 정밀도로 정량화할 수 있는 가장 낮은 생체 표지 농도에 기초한다.
검출 감도, 분자 특이성, 및 적용 복잡성에 대한 요구가 증가함에 따라 특정 적용에 대해 자화성 입자들을 최적화하고 적절한 검출 방법을 선택하는 것은 자기 나노기술 커뮤니티에서 여전히 어려운 일이다.
면역 분석에서 GMR을 사용하는 것은 샌드위치형 접근 방식(이를테면, ELISA)에서 사용되어 왔으며, 여기서 분자 타겟은 태깅된 자기 프로브들을 추가하여 센서 표면에 고정된다(Koh 및 Josephson “Magnetic nanoparticle sensors” Sensors 2009: 9; 8130-45 및 Yao 및 Xu “Detection of magnetic nanomaterials in molecular imaging and diagnosis applications” Nanotechnol. Rev 2014: 3;247-268 참조).
일부 기술들은 초전도 양자 간섭 장치(SQUID)를 사용하여 자기 표지된 박테리아에서 Nel 이완(자기 쌍극자의 오정렬)을 검출하고 측정한다. 이러한 기술들에서, 자기장이 펄싱되어 자기 쌍극자 정렬을 유발하고 후속 쌍극자 정렬 불량이 검출된다.
본 발명의 목적은 상술된 문제들 중 하나 이상을 해결하고/하거나 시료에서 분석물을 검출하는 방법을 제공하고/하거나 적어도 대중에게 유용한 선택을 제공하는 것이다.
제1 양태에서, 시료에서 분석물을 검출하기 위한 방법으로서,
추가 양태에서, 시료에서 분석물을 검출하기 위한 방법으로서,
o 시료 웰 또는 시료 저장소,
o 시료 웰 또는 시료 저장소에서 자기장을 생성하기 위한 하나 이상의 자석, 및
o 시료 웰 또는 시료 저장소의 자기장에서 시간에 따른 변화를 측정하기 위한 자기장 센서를 포함함 ―, 및
추가 양태에서, 시료에서 분석물을 검출하기 위한 방법이 설명되며, 본 방법은:
a) 시료에서 타겟 분석물의 양을 검출 및/또는 측정하기에 충분한 자기 신호를 10초 이내에 생성하거나, 또는
b) 적어도 약 0.05 pg/mL의 검출 한계(limit of detection, LOD)를 갖거나, 또는
c) 적어도 약 0.1 pg/mL의 정량 한계(limit of quantification, LOQ)를 갖거나, 또는
d) (a) 내지 (c) 중 하나 이상인 것인, 방법.
추가 양태에서, 시료에서 분석물을 검출하기 위한 장치로서,
하나 이상의 자석 및 자석 센서는 자기 센서가 자기장 센서에 관한 자화성 입자들의 순 이동(병진 또는 회전 이동)에 기초하여 자기장의 변화를 검출할 수 있도록 사용하기 위해 구성되는 것인, 장치가 설명된다.
추가 양태에서, 시료에서 분석물을 검출하기 위한 진단 시스템으로서,
진단 시스템은
a) 시료에서 타겟 분석물의 양을 검출 및/또는 측정하기에 충분한 자기 신호를 20초 이내에 획득하거나, 또는
b) 적어도 약 0.05 pg/mL의 검출 한계(limit of detection, LOD)를 갖거나, 또는
c) 적어도 약 0.1 pg/mL의 정량 한계(limit of quantification, LOQ)를 갖거나, 또는
d) (a) 내지 (c) 중 하나 이상을 포함하도록 구성되는 것인, 진단 시스템이 설명된다.
다음의 실시예들 중 임의의 하나 이상은 상기한 양태들 중 임의의 양태와 관련될 수 있다.
일 구성에서, 본 장치 또는 진단 시스템은 시료에서 타겟 분석물의 양을 검출 및/또는 측정하기에 충분한 자기 신호를 5, 10, 15 또는 20초 이내에 획득하고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다.
일 구성에서, 자기장이 자화성 입자들을 자기장 센서 근처에 위치시키기 위해 인가된다.
일 구성에서, 자기장은 시료를 혼합시킨다.
일 구성에서, 시료에서의 분석물의 검출 및 정량화는 자기장 센서를 통해 검출되는 자화성 입자들의 양에 의존한다.
일 구성에서, 자화성 입자들은 원심력, 음향 또는 압전기를 사용하여 위치된다.
일 구성에서, 자화성 입자들은 분석물에 특이적으로 결합하는 분자들로 기능화된다.
일 구성에서, 시료 및 자화성 입자들은 미세유체 장치에 의해 처리된다. 바람직하게는, 미세유체 장치는 자화성 입자들과 분석물 사이의 결합을 용이하게 한다.
일 구성에서, 자기장은 자화성 입자들과 타겟 분석물의 결합을 촉진하거나 향상시킨다.
일 구성에서, 자화성 입자들은 자성 입자들이다.
일 구성에서, 자화성 입자들은 상자성이다.
일 구성에서, 자화성 입자들은 강자성이다.
일 구성에서, 검출은 랩온칩 장치에 의해 제공된다. 바람직하게는, 랩온칩 장치는 미세유체 장치를 포함한다.
일 구성에서, 칩 장치는 다중 칩셋 설계를 가진다.
일 구성에서, 자화성 입자들은 약 5 내지 약 500 nm의 평균 입자 크기를 갖고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다.
일 구성에서, 자화성 입자들은 약 5, 10, 50, 100, 150, 200, 250, 300, 350, 400, 450 또는 500 nm의 평균 입자 크기를 갖고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다.
일 구성에서, 자화성 입자들은 약 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 또는 1000 nm의 평균 입자 크기를 갖고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다.
일 구성에서, 자화성 입자들은 약 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500 또는 5000 nm의 평균 입자 크기를 갖고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다.
일 구성에서, 미세유체 장치는 자기 센서 바로 근처에 자화성 입자들 및 분석물을 위치시킨다.
일 구성에서, 자화성 입자들 및 분석물은 자기 센서의 감지 요소로부터 1, 10, 100, 500, 1000, 2000, 3000, 4000 또는 5,000 ㎛ 이내로 들어오게 되고, 이들 값들 중 임의의 값들 사이에서 유용한 범위들이 선택될 수 있다.
일 구성에서, 하나 이상의 자석(또는 전자석)은 자화성 입자들을 정렬시킨다
일 구성에서, 하나 이상의 자석은 시간에 따라 변하는 자기장을 생성한다.
일 구성에서, 자기장 생성기는 크기의 연속성을 생성할 수 있다.
일 구성에서, 자기장 생성기는 자기장을 온과 오프 사이에서 교번시킬 수 있다.
일 구성에서, 자기장은 자화성 입자들에 미치는 영향을 최대화하지만 자기 센서에 미치는 영향을 최소화하는 방식으로 생성되고 위치된다.
일 구성에서, 자기장 센서는 자화성 입자들의 감지를 최대화하고 자석으로부터의 감지를 최소화하도록 구성된다.
일 구성에서, 센서에 의한 데이터 획득은 미세유체 장치와 동기화되어, 미세유체 장치가 자화성 입자들을 처리하고 자기 센서 바로 근처에 위치시켰을 때 센서로부터의 자기장 신호가 시료로부터의 데이터로서 식별가능하다.
일 구성에서, 데이터는 센서로부터 연속적으로 획득된다. 바람직하게는, 데이터는 자기 센서로부터의 신호들의 처리에 의해 획득된다.
일 구성에서, 획득된 데이터는 (1) 환경 및/또는 주변, 또는 (2) 검사 데이터로서 플래깅된다. 바람직하게는, 데이터의 (1) 환경 및/또는 주변 또는 (2) 검사 데이터로의 분류는 데이터 획득과 미세유체 장치의 작동의 동기화에 의존한다.
일 구성에서, 본 방법은 신호 획득과 미세유체 장치의 동작의 동기화에 기초하여 교정된다.
일 구성에서, 데이터는 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 90 또는 120초(들)의 기간에 걸쳐 획득되고, 이들 값들 중 임의의 값들 사이에서 유용한 범위들이 선택될 수 있다.
일 구성에서, 자기 센서로부터 출력된 신호는 신호 증폭기에 의해 부스트된다.
일 구성에서, 자기 센서로부터 출력된 신호는 자기장 센서가 감지하는 자기장 강도에 비례하는 전압 판독치이다.
일 구성에서, 센서로부터의 전압은 모든 변화가 원래 신호에 비례하여, 데이터 처리 및 수집 전자 장치와 호환 가능한 범위로 유지되면서, 더 높은 전압으로 크기가 부스트된다.
일 구성에서, 증폭된 신호는 전압 판독치로부터 디지털 비트스트림으로 변환되고, 컴퓨터에 의해 기록된다.
일 구성에서, 변환은 아날로그-디지털 변환기(ADC)에 의해 수행된다.
일 구성에서, 변환율 또는 시료 추출율은 50-500,000 Hertz일 수 있다.
일 구성에서, 변환 정밀도 또는 시료 추출 정밀도는 16-32 비트일 수 있다.
일 구성에서, 신호 출력은 해석 및 분석에 사용될 수 있는 판독치를 생성하기 위해 수학적 연산들과 디지털로 처리된다.
일 구성에서, 장치 또는 진단 시스템의 사용은 적어도 0.05, 0.06, 0.07, 0.08, 0.09, 0.10, 0.15 또는 0.20 pg/mL의 LOD를 갖고, 이들 값들 중 임의의 값들 사이에서 유용한 범위들이 선택될 수 있다.
일 구성에서, 장치 또는 진단 시스템의 사용은 적어도 0.1 pg/mL의 LOD를 갖는다.
일 구성에서, 장치 또는 진단 시스템의 사용은 적어도 0.10, 0.11, 0.12, 0.13, 0.14, 0.15, 0.16, 0.17, 0.18, 0.19 또는 0.20 pg/mL의 LOQ를 갖고, 이들 값들 중 임의의 값들 사이에서 유용한 범위들이 선택될 수 있다.
일 구성에서, 장치 또는 진단 시스템의 사용은 적어도 0.1 pg/mL의 LOQ를 갖는다.
"포함하는(comprising)"이라는 용어는 본 명세서에서 사용될 때 "적어도 부분적으로 구성되는"을 의미한다. 해당 용어를 포함하는 본 명세서의 서술을 해석할 때, 각 서술에서 해당 용어가 앞에 오는 특징들은 모두 존재해야 하지만, 다른 특징들도 있을 수 있다. "포함하다(comprise)" 및 "포함되는(comprised)"과 같은 관련 용어들도 동일한 방식으로 해석되어야 한다.
본원에서 개시되는 수 범위(예를 들어, 1 내지 10)의 언급은 또한 해당 범위 내의 모든 유리수(예를 들어, 1, 1.1, 2, 3, 3.9, 4, 5, 6, 6.5, 7, 8, 9 및 10) 그리고 또한 해당 범위 내의 임의의 유리수 범위(예를 들어, 2 내지 8, 1.5 내지 5.5 및 3.1 내지 4.7)의 언급을 포함하는 것으로 의도된다.
본 발명은 또한 본 출원의 명세서에서 언급되거나 표시되는 부분들, 요소들 및 특징들로 개별적으로 또는 집합적으로, 그리고 상기의 부분들, 요소들 및 특징들 중 임의의 둘 이상의 임의의 또는 모든 조합으로 구성된다고 광범위하게 말할 수 있고, 본 발명과 관련된 기술분야에서 알려진 등량들을 갖는 특정 정수들이 본원에서 언급되는 경우, 그러한 알려진 등량들이 개별적으로 제시된 것처럼 본원에 포함되는 것으로 간주된다.
본 발명이 관련된 기술분야의 당업자들에게는 첨부된 청구범위에서 정의되는 바와 같은 본 발명의 범주로부터 벗어나지 않으면서 본 발명의 구성 및 폭넓게 다양한 실시예들 및 적용예들의 많은 변경이 시사될 것이다. 본원에서의 개시 및 설명은 순전히 예시적이고, 어떠한 의미도 제한하려는 의도가 아니다.
이제, 본 발명이 단지 예로서 그리고 다음의 도면들을 참조하여 설명될 것이다:
도 1은 설명되는 바와 같은 방법의 셋업을 도시한 흐름도이다.
도 2는 미세유체 장치의 도식적 표현이다.
도 3은 약 0.5 pg의 LoQ를 나타내는 신호 대 감도 플롯을 도시한 그래프이다.
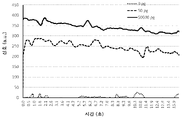
도 4는 50 pg의 입자들 및 500,000 pg의 입자들을 제어하기 위한 신호 획득을 시간에 따라 도시한 그래프이다.
도 1은 설명되는 바와 같은 방법의 셋업을 도시한 흐름도이다.
도 2는 미세유체 장치의 도식적 표현이다.
도 3은 약 0.5 pg의 LoQ를 나타내는 신호 대 감도 플롯을 도시한 그래프이다.
도 4는 50 pg의 입자들 및 500,000 pg의 입자들을 제어하기 위한 신호 획득을 시간에 따라 도시한 그래프이다.
시료에서 분석물을 검출하기 위한 방법으로서,
자기 센서에 관한 자화성 입자들의 순 이동의 결과로서 자화성 입자들로부터 검출되는 자기 신호의 변화를 측정하는 단계를 포함하는, 방법이 설명된다. 이동은 병진 또는 회전 이동 중 어느 하나이다.
설명되는 방법은 자화성 입자들과 분석물 복합체를 자기장 센서 바로 근처로 가져오는 개념에 기초한다. 자기장 강도는 자화성 입자들과 분석물 복합체가 자기장 센서로부터 멀어지게 확산될 수 있도록(즉, 병진 또는 회전 이동에 의해) 조절된다. 그 다음, 자기장 센서는 브라운(Brownian) 회전 또는 확산으로 인해 시간에 따라 자화성 입자들에 의해 생성되는 자기장 강도의 변화를 측정하여, 자화성 입자들-분석물 복합체의 양을 정량화할 수 있으며, 이를 통해 시료에서 분석물의 양을 결정할 수 있다. 즉, 결합 결합제 복합체와 비결합 결합제 복합체는 확산 특성들에 따라 구별된다. 자화성 비드(즉, 결합 복합체와 비결합 복합체 둘 다)는 자기장 센서에 대해 물리적으로 이동하여서, (상이한 확산 특성들로 인해 상이한 정도로 이동할 것임을 고려하여) 결합 복합체와 비결합 복합체가 구별될 수 있다.
대략적으로 말하면, 시료를 분석하는 방법에는 세 개의 단계가 있을 수 있다. 첫 번째 단계는 사전 시료 기준선 감지 단계일 수 있다. 이 단계는 시료가 없는 상태에서 기준선 판독치를 획득하기 위해 수행된다. 기준선 판독치는 후속 시료 판독치에 대한 기준 비교를 제공한다. 사전 시료 기준선 감지 단계는 1, 2, 3, 4 또는 5초가 소요될 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다(예를 들어, 약 1 내지 약 5, 약 1 내지 약 4, 약 2 내지 약 5, 약 2 내지 약 3 또는 약 3 내지 약 5초).
두 번째 단계는 시료를 장치로 로딩하는 것일 수 있다. 이 단계는 시료 혼합 및 분석물-결합 복합체(즉, 기능화된 자화성 입자들이 분석물에 결합하는 경우)를 포함할 수 있다. 이 단계는 약 3, 4, 5, 6, 7 또는 8분이 소요될 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다(예를 들어, 약 3 내지 약 8, 약 3 내지 약 7, 약 3 내지 약 5, 약 4 내지 약 8, 약 4 내지 약 6 또는 약 5 내지 8분).
세 번째 단계는 시료 판독 단계일 수 있다. 즉, 자화성 입자들이 자기장 센서 근처에 위치되고, 자기장이 결합 및 비결합 결합제 복합체들의 적어도 일부를 방출하도록 변화되며, 자기장 센서가 자기 센서에 관한 자화성 입자들의 순 이동의 결과로서 자화성 입자들로부터 검출되는 자기 신호의 변화를 측정한다. 이 단계는 약 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20초가 소요될 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다(예를 들어, 10 내지 약 20, 약 10 내지 약 18, 약 10 내지 약 15, 약 11 내지 약 20, 약 11 내지 약 19, 약 11 내지 약 16, 약 11 내지 약 15, 약 12 내지 약 20, 약 12 내지 약 18, 약 12 내지 약 15, 약 13 내지 약 20, 약 13 내지 약 19, 약 13 내지 약 17 또는 약 13 내지 약 15초).
상술한 바와 같이, 시료 내의 분석물의 양은 자기 센서에 의해 검출된 자기 신호의 변화에 기초하여 결정된다. 자기 센서는 자화성 입자들의 순 이동에 기초하여 변화를 검출한다. 결합 및 비결합 결합제 복합체들 둘 다를 포함하는 자화성 입자들은 자기장 센서 근처로부터 방출되면, 자기장 센서로부터 멀어지게 이동할 것이다. 이러한 이동은 브라운 확산에 기초하여 무작위이다.
통상적으로, 자기장 센서는 시료 웰 또는 시료 저장소의 표면에 가깝거나 이에 인접하여(시료가 아닌 것 쪽에) 위치한다. 결합 및 비결합 자화성 입자들이 자기장 센서 근처에 위치될 때, 결합 및 비결합 자화성 입자들은 방출될 때까지 시료 웰 또는 시료 저장소의 벽 표면에 또는 그 가까이에 위치할 수 있다. 자화성 입자들은 자기장 센서 근처로부터 방출되면, 병진 또는 회전으로 이동할 수 있다. 시료 웰 또는 시료 저장소의 표면에 대한 근접성을 고려하여, 결합 및 비결합 자화성 입자들은 통상적으로 시료 웰 또는 시료 저장소의 표면에 대해 180° 이동 자유도로 이동할 수 있다. 브라운 확산은 자화성 입자들이 자기장 센서 향하는 방향을 포함하여, 임의의 방향으로 이동할 수 있음을 의미한다. 자기장 센서에 의해 감지되는 자기 신호는 결합 및 비결합 자화성 입자들의 순 이동에 기초한다.
본 발명의 이점들은 신속한 검출(예를 들어, 예 2 참조) 및 매우 민감한 검출 방법(예를 들어, 예 1 및 3 참조)을 포함할 수 있다.
용액에 없는 분석물과 자화성 입자 간의 충돌을 고려할 때, 확산 충돌 단계는 (1) 유체 체적을 통한 확산 수송 과정, (2) 표면 부근 정렬 과정으로 나눌 수 있다. 체적 수송이 입자들과 타겟 분석물 간의 첫 번째 충돌을 발생시키는 경우, 후속 표면 부근 정렬 과정은 반응물의 결합 부위의 정렬율을 다룬다. 체적 수송은 본질적으로 병진 과정인 한편, 정렬은 반응물의 병진 및 회전 이동성 둘 다에 의해 결정된다.
용액에서 자유 성분들이 반응할 때, 정렬 과정(즉, 회전 확산)은 고도로 특이적인 정렬 제약들로 인해 중요한 제한 사항이지만, 체적 수송(즉, 병진 확산)은 제한이 아니다. 성분들 중 하나가 표면에 부착되는 경우에, 체적 수송은 제한이 될 수 있다.
나노 및 마이크론 크기의 자성 물질들의 자기 속성들은 대응하는 벌크 자성 물질들의 자기 속성들과 상이하다. 통상적으로, 자화성 입자들은 인가된 자기장이 있고 없을 때의 자기 이동에 기초하여 상자성, 강자성, 준자성, 반강자성, 또는 초상자성으로서 분류된다.
반자성 물질들은 자기장이 없을 때 쌍극자 모멘트를 나타내지 않고, 자기장이 있을 때 자기장의 방향에 대해 정렬된다.
상자성 입자들은 자기장이 없을 때 무작위 쌍극자 모멘트를 나타내고, 자기장이 있을 때 자기장의 방향과 정렬된다.
강자성 물질들은 정렬된 쌍극자 모멘트들을 나타낸다.
준자성 및 반강자성 물질들은 교대로 정렬된 쌍극자 모멘트들을 나타낸다.
일 실시예에서, 자화성 입자들은 상자성 입자들이다. 이러한 입자들은 자기장을 받을 때 자성이 될 것이다. 자기장이 제거되면, 입자들은 자성 특성들을 잃기 시작할 것이다.
대안적인 실시예에서, 자화성 입자들은 강자성 입자들이다. 즉, 자화성 입자들은 자기장을 받는지 여부에 관계없이 항상 자성 특성들을 나타낸다.
시중에서 입수 가능한 자화성 입자들은 Thermo Fisher Scientific의 Dynaparticles M-270, Dynaparticles M-280, Dynaparticles MyOne T1, 및 Dynaparticles MyOne C1, Miltenyi Biotec의 μMACS MicroParticles, Spherotech의 SPHERO™ Superparamagnetic Particles, SPHERO™ Paramagnetic Particles, 및 SPHERO™ Ferromagnetic Particles를 포함한다.
자화성 입자들은 산화철(예를 들어, 자철석 및 마그헤마이트)로부터 형성되는 아철산염에 의해 형성될 수 있다. 공침, 열분해, 및 열수와 같은 산화철과 금속 치환 아철산염 자화성 입자들을 합성하기 위한 다양한 방법들이 알려져 있다. 공침 과정들은 알칼리 용액 중의 화학량론적 양의 제일철 및 제이철 염을 폴리에틸렌 글리콜(PEG)과 같은 수용성 표면 코팅 물질과 함께 사용하며, 여기서 코팅은 콜로이드 안정성 및 생체 적합성을 제공한다. 자화성 입자들의 크기와 속성들은 환원제 농도, pH, 이온 강도, 온도, 철 염 공급원, 또는 Fe2+ 대 Fe3+ 비를 조정함으로써 제어할 수 있다.
자화성 입자들의 크기 및 형상은 유기 용매의 유형, 가열율, 계면활성제, 및 반응 시간과 같은 반응 조건들을 변경함으로써 조정될 수 있다. 이 방법은 10 내지100 nm 크기 범위 내의 자화성 입자들의 크기 분포를 좁게 만든다. Fe2+는 포화 자화를 부스트하기 위해 다른 금속들로 대체될 수 있다.
자화성 입자들은 합성 과정 동안 소수성 코팅으로 코팅될 수 있다. 그렇다면, 자화성 입자들을 제조하는 방법은 추가의 사용을 위해 자화성 입자들이 수중에 분산될 수 있도록 리간드 교환의 추가 단계를 포함할 수 있다.
자화성 입자들은 수십 내지 수백 나노미터 크기 범위 내의 수분산 자화성 입자들을 생성하는 폴리올-열수 환원에 의해 제조될 수 있다. 산화철 자화성 입자들의 크기 및 표면 기능화는 사용되는 용매계, 환원제, 및 계면활성제의 유형을 조정함으로써 최적화할 수 있다. 이 과정은 FePt 자화성 입자들을 합성하기 위해 사용될 수 있다.
자화성 입자들은 역 유중수 미셀 방법에 의해 제조될 수 있다. 이 방법은 침전에 의해 얻어지는 자성 나노입자들과 유상의 계면활성제에 의해 안정화되는 철 전구체의 수성 나노 물방울의 마이크로에멀젼을 형성한다. 산화철 나노결정은 마이크로에멀젼과 실리카 졸-겔을 조합함으로써 회합될 수 있으며, 이는 공침을 통해 100 nm 초과의 직경을 갖는 자화성 입자들로 얻어질 수 있다.
금속 자화성 입자들은 단금속(예를 들어, Fe, Co, 또는 Ni) 또는 이금속(예를 들어, FePt 및 FeCo)일 수 있다. 합금 자화성 입자들은 진공 증착 및 기상 증발을 포함한 물리적 방법들에 의해 합성될 수 있다. 이러한 방법들은 높은 포화 자화(약 207 emu/g)를 갖는 FeCo 자화성 입자들을 생성할 수 있고, Fe3+ 및 Co2+ 염의 환원을 통해 합성될 수 있다.
자화성 입자들은 단일 금속 또는 금속 산화물 코어를 포함할 수 있다. 자화성 입자들은 다중 코어들, 다층의 자성 물질들 및 비자성 물질들을 포함할 수 있다. 자화성 입자들은 자성 쉘을 갖는 실리카 또는 폴리머 코어의 코팅을 포함할 수 있다. 비자성 코어 입자들은 실리카 또는 다른 폴리머를 포함할 수 있다.
자화성 입자들은 자성 쉘로 코팅된 유전체 실리카 코어를 포함할 수 있다. 자성 쉘은 Co, FePt, 또는 Fe3O4로 형성될 수 있다. 쉘은 또한 실리카 쉘 또는 고분자 전해질 층과 같은 안정화제를 포함할 수 있다. 자화성 입자들은 메조다공성 자화성 입자들일 수 있다.
자화성 입자들의 코팅은 자화성 입자들과 생물학적 분자들(이를테면, 분석물) 간의 상호작용 및 이들의 생체 적합성을 규정할 수 있다. 코팅은 표면 전하를 규정하기 위해 사용될 수 있으며, 이와 함께 코팅은 자성 입자의 유체역학적 크기를 변경할 수 있다. 자화성 입자의 유체역학적 크기는 자성 입자들의 기능을 변경할 수 있다.
자화성 입자들은 정전기력 및 입체 반발력을 제공하는 특정 코팅들로 코팅될 수 있다. 이러한 코팅들은 자화성 입자들의 응집 또는 침전을 방지할 수 있는 자화성 입자들의 안정화를 도울 수 있다.
자화성 입자들은 무기 물질들로부터 형성된 코팅으로 구성될 수 있다. 이러한 자화성 입자들은 코어-쉘 구조로 형성될 수 있다. 예를 들어, 자화성 입자는 생체 적합성 실리카 또는 금으로 코팅된다(예를 들어, 합금 자성 나노입자들, FeCo 및 CoPt는 실리카로 코팅된다). 쉘은 자화성 입자들을 리간드(예를 들어, 티올)로 개질하기 위한 플랫폼을 제공할 수 있다. 다른 무기 코팅 물질들은 티탄산염 또는 은을 포함할 수 있다. 예를 들어, 은 코팅 산화철 자화성 입자들은 합성되어 탄소 페이스트와 혼입될 수 있다.
쉘은 실리카로부터 형성될 수 있다. 실리카 코팅의 이점은 실리카 코팅된 자화성 입자들이 다양한 기능 분자들 및 표면 반응성 기들과 공유 결합하는 능력이다. 실리카 쉘은 예를 들어, 졸-겔 원리들을 사용하는 스토버(Stober) 방법 또는 필립스(Philipse) 방법 또는 이들의 조합에 의해 제조될 수 있다. 자화성 입자들의 코어는 예를 들어, TEOS를 자성 코어 표면 상의 실리카 쉘로 축합 및 중합하는 염기성 조건들 하에 TEOS의 가수분해에 의해 테트라에톡시실란(TEOS)으로 코팅될 수 있다. 코발트 자화성 입자는 3-아미노프로필)트리메톡시실란과 TEOS를 조합하는 변형된 스토버 방법을 사용하여 코팅될 수 있다.
필립스 방법은 자기 코어 상에 소듐 실리케이트의 실리카 쉘을 형성한다. 두 번째 실리카 층은 스토버 방법에 의해 증착될 수 있다. 실리카로 코팅하기 위해 역 마이크로에멀젼 방법이 사용될 수 있다. 이 방법은 계면활성제와 사용될 수 있다. 계면활성제는 약 5 내지 약 20 nm의 실리카 쉘 두께를 제공하기 위해 Igeoal CO-520으로부터 선택될 수 있다. 바람직하게는, 실리카 쉘을 제조하기 위한 시약은 아미노 말단 실란 또는 알켄 말단 실란으로부터 선택된다. 바람직하게는, 아미노 말단 실란은 (3-아미노프로필)트리메톡시실란(APTMS)이다. 바람직하게는, 알켄 말단 실란은 3-메타크릴옥시프로필)트리메톡실실란이다.
자화성 입자들은 금으로 코팅될 수 있다. 금 코팅 산화철 나노입자들은 화학적 방법들, 역 마이크로에멀젼, 레이저 촉진 방법들 중 임의의 방법으로 합성될 수 있다. 금 코팅 자화성 입자들은 자화성 입자 코어 상에 금을 직접 코팅하여 합성할 수 있다. 대안적으로, 금 코팅 자화성 입자들은 금 코팅을 위한 중간층으로 실리카를 사용하여 합성될 수 있다. 바람직하게는, 환원이 자화성 입자들 상에 금 쉘을 증착하기 위해 환원이 사용된다.
금 쉘을 형성하기 위해 금속 산화물 또는 실리카 코팅 자기 코어가 약 2 내지 약 3 nm의 금 나노결정 시드를(클로로아우르산으로부터) 표면에 정전기적으로 부착시킨 후 환원제를 첨가하기 전에 먼저 3-아미노프로필)트리메톡시실란으로 기능화될 수 있다. 바람직하게는, 환원제는 소듐 시트레이트 또는 테트라키스(히드록시메틸)포스포늄 클로라이드로부터 선택되는 약한 환원제이다. 일부 실시예들에서, 금 쉘은 금(III) 아세테이트(Au(OOCCH3)3)의 환원으로 형성된다. 일부 실시예들에서, 금 쉘은 역 미셀에 의해 금속 자기 코어들(예를 들어, 니켈 및 철) 상에 형성된다.
자화성 입자들은 유기 리간드로 기능화될 수 있다. 이는 제자리(즉, 합성 단계 동안 기능적 리간드가 자화성 입자들 상에 제공됨) 또는 합성 후에 수행될 수 있다. 자화성 입자들은 말단 히드록실기(-OH), 아미노기(-NH2), 및 카르복실기(-COOH)로 기능화될 수 있다. 이는 열수 합성에 사용되는 계면활성제(예를 들어, 덱스트란, 키토산, 또는 폴리(아크릴산))를 변경하여 달성할 수 있다.
합성 후 자화성 입자들의 기능화는 임의의 자화성 입자 표면 상의 맞춤형 리간드의 기능화를 가능하게 할 수 있다. 합성 후 기능화는 리간드 첨가 및 리간드 교환에 의해 수행될 수 있다. 리간드 첨가는 이중층 구조를 형성하기 위해 (소수성 부분과 친수성 성분을 둘 다 포함하는) 양친매성 분자들의 흡착을 포함한다. 리간드 교환은 원래의 계면활성제(또는 리간드)를 새로운 기능적 리간드로 대체한다. 바람직하게는, 새로운 리간드는 강한 화학적 결합 또는 정전기적 인력 중 어느 하나를 통해 자화성 입자 표면 상에 결합할 수 있는 기능기를 함유한다. 일부 실시예들에서, 자화성 입자들은 또한 수중 안정화 및/또는 생체 기능화를 위한 기능기들을 포함한다.
자화성 입자들은 이온 안정성을 향상시키는 리간드로 코팅될 수 있다. 기능기는 카르복실레이트, 포스페이트, 및 카테콜(예를 들어, 도파민)로부터 선택될 수 있다. 리간드는 하이드록실 기가 풍부한 표면(예를 들어, 금속 산화물 자성 입자들 또는 실리카 코팅 자성 입자들)의 코팅을 위한 실록산기일 수 있다. 리간드는 자화성 입자들과 다양한 기능성 리간드들(예를 들어, 아민, 카르복실레이트, 티올, 및 에폭사이드)을 연결하는 작은 실란 리간드일 수 있다. 실란 리간드는 N-(트리메톡시실릴프로필)에틸렌 디아민트리아세트산 및 (트리에톡시실릴프로-필)숙신산 무수물로부터 선택되어 카르복실레이트 말단 자성 입자들을 제공할 수 있다. 기능기는 (친수성 꼬리 기를 제공하기 위해) 포스폰산 및 카테콜로부터 선택될 수 있다. 기능기는 아미노 말단 포스폰산으로부터 선택될 수 있다. 기능기는 수용액에서의 분산을 위해 3-(트리히드록시실릴)프로필 메틸포스포네이트로부터 선택될 수 있다. 리간드는 수중 분산을 위한 자화성 입자들을 위한 디히드록시히드로신남산, 시트르산, 또는 티오말산으로부터 선택될 수 있다.
일부 실시예들에서 자화성 입자들은 폴리머성 리간드로 기능화된다. 폴리머는 천연 폴리머(예를 들어, 전분, 덱스트란 또는 키토산), PEG, 폴리아크릴산(PAA), 폴리(메타크릴산)(PMAA), 폴리(N,N-메틸렌-비스아크릴아미드)(PMBBAm), 및 폴리 (N,N/-메틸렌비스아크릴아미드-코-글리시딜 메타크릴레이트)(PMG)로부터 선택될 수 있다.
자화성 입자들 표면 상의 기능기는 상보적인 생체 분자들과 결합하는 링커 역할을 한다. 생체 분자들을 작은 생체 분자일 수 있다. 작은 생체 분자는 비타민, 펩타이드, 및 앱타머로부터 선택될 수 있다. 생체 분자는 보다 큰 생체 분자일 수 있다. 보다 큰 생체 분자는 DNA, RNA 및 단백질로부터 선택될 수 있다.
핵산 부착과 관련하여, 핵산은 비화학적 방법들(예를 들어, 정전기 상호작용) 또는 화학적 방법들(예를 들어, 공유 결합)에 의해 공액 결합될 수 있다. 핵산 사슬은 기능기들로 개질될 수 있다. 기능기들은 티올 또는 아민, 또는 이들의 임의의 조합으로부터 선택될 수 있다.
보다 큰 생체 분자의 공액 결합은 특이 수용체 기질 인식(즉, 항원-항체 및 비오틴-아비딘 상호작용)과 같은 광범위한 상쇄 및 합성 유사체들과의 특이적 결합 상호작용에 의존할 수 있다.
특이 단백질 쌍이 종들을 자성 입자에 고정하기 위해 사용될 수 있다. 물리적 상호작용들은 정전기, 친수성-소수성, 및 친화성 상호작용을 포함한다.
일부 실시예들에서, 생체 분자는 자성 폴리머 코팅(예를 들어, 폴리에틸렌이민 또는 폴리에틸렌이민)의 전하와 반대 전하를 갖는다. 예를 들어, 양전하를 띤 자화성 입자들이 음전하를 띤 DNA와 결합한다.
자화성 입자들은 비오틴-아비딘 상호작용을 이용할 수 있다. 비오틴 분자들과 4량체 스트렙트아비딘은 항원에 대한 항체의 Fab 영역의 노출과 같이, 상호작용하는 생체 분자들의 방향을 제어하기 위해 낮은 비특이적 결합을 갖는 위치 특이적 인력을 갖는다.
자화성 입자는 공유 결합을 사용하여 생체 분자들에 결합할 수 있다. 공유 결합은 동종이기능/이종이기능성 가교제(아미노기), 카르보디이미드 결합(카르복실기), 말레이미드 결합(아미노기), 직접 반응(에폭사이드기), 말레이미드 결합(티올기), 시프-염기 축합(알데하이드기), 및 클릭 반응(알킨/아지드기)으로부터 선택될 수 있다.
자화성 입자들은 약 5, 10, 50, 100, 150, 200, 250, 300, 350, 400, 450 또는 500 nm의 평균 입자 크기를 가질 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다(예를 들어, 약 5 내지 약 500, 약 5 내지 약 400, 약 5 내지 약 250, 약 5 내지 약 100, 약 5 내지 약 50, 약 10 내지 약 500, 약 10 내지 약 450, 약 10 내지 약 300, 약 10 내지 약 150, 약 10 내지 약 50, 약 50 내지 약 500, 약 50 내지 약 350, 약 50 내지 약 250, 약 50 내지 약 150, 약 100 내지 약 500, 약 100 내지 약 300, 약 150 내지 약 500, 약 150 내지 약 450 또는 약 200 내지 약 500 nm).
자화성 입자들은 약 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 또는 1000 nm의 평균 입자 크기를 가질 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다(예를 들어, 약 500 내지 약 1000, 약 500 내지 약 850, 약 500 내지 약 700, 약 550 내지 약 1000, 약 550 내지 약 800, 약 600 내지 약 1000, 약 600 내지 약 900, 약 650 내지 약 1000, 약 650 내지 약 950, 약 650 내지 약 800 또는 내지 약 700 내지 약 1000 nm).
자화성 입자들은 약 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500 또는 5000 nm의 평균 입자 크기를 가질 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다(예를 들어, 약 1000 내지 약 5000, 약 1000 내지 약 4000, 약 1500 내지 약 5000, 약 1500 내지 약 4500, 약 1500 내지 약 3500, 약 2000 내지 약 5000, 약 2000 내지 약 4000, 약 2500 내지 약 5000, 약 2500 내지 약 3500, 약 3000 내지 약 5000 nm).
자화성 비드의 입자 크기의 변화는 10, 9, 8, 7, 6, 5, 4, 3, 2 또는 1% 미만일 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다.
미세유체학은 보다 빠른 분석과 응답 시간 감소를 가능하게 한다. 미세유체 시스템은 또한 시료 준비를 자동화하는 능력을 제공하여, 사람의 실수로 인한 오염 및 위양성의 위험을 줄인다. 또한 미세유체 시스템은 적은 시료 체적을 필요로 한다. 미세유체학은 표면적 대 체적 비를 증가시키고/거나, 미세 및 나노 제조된 채널들 및 챔버들을 통해 시약 소모를 줄이고/거나, 과정의 모든 단계들을 자동화함으로써 확산 거리를 줄일 수 있다.
미세유체학은 소형화를 가능하게 하여 랩온칩 애플리케이션을 가능하게 한다. 미세유체학은 예를 들어, 생물학적 시료(예를 들어, 타액 및/또는 치은열구액) 획득, 유체 처리(예를 들어, 하나 이상의 시약과 결합 및/또는 생체 분자와의 상호작용 등)을 위한 채널들을 포함하는 바이오센서의 일부로서 사용될 수 있다.
미세유체는 어느 정도의 시료 준비를 필요로 할 수 있다. 시료 준비에는 세포 용해, 세척, 원심분리, 분리, 여과, 및 용리가 포함될 수 있다. 일부 실시예들에서, 시료 준비는 오프칩으로 준비된다. 대안적인 시료 준비는 온칩으로 준비된다.
일부 구성들에서, 미세유체 시스템은 단단하거나 유연한 물질들을 포함하고, 장치에 통합될 수 있는 전자 장치를 포함할 수 있다. 전자 장치는 무선 통신 전자 장치를 포함할 수 있다.
미세유체 시스템은 관통형 또는 고정식 시스템일 수 있다. 예를 들어, 미세유체 시스템은 미세유체 시스템에 대해 고정적인 자기장 센서를 포함할 수 있다.
미세유체 시스템은 수동적으로 작동할 수 있다. 예를 들어, 미세유체 시스템은 수동 확산 하에서 작동할 수 있다. 즉, 미세유체 시스템은 효과적으로 작동하기 위해 능동적으로 생성된 흐름을 필요로 하지 않는다.
미세유체 시스템은 저장소들의 네트워크를 포함할 수 있고, 미세유체 채널들에 의해 연결될 수 있다. 미세유체 채널들은 능동 계량 또는 수동 계량을 위해 구성될 수 있다. 이는 시료 유체가 미세유체 채널로 유입되어 시료 챔버로 전달되도록 할 수 있다.
미세유체 시스템은 다양한 시간에 장치의 다양한 시료 및/또는 검출 영역들에 접근할 수 있도록 구성된 미세유체 채널들을 포함할 수 있다. 예를 들어, 얼라이너 내로 또는 얼라이너 상에 통합된 미세유체 장치는 유체의 시간적 시료 추출을 통한 타이밍을 제공하도록 구성될 수 있다. 예를 들어, 미세유체 시스템은 시간순과 제어된 타이밍으로 시료 추출이 가능하도록 설계할 수 있다. 일부 변형예들에서, 마이크로채널 내 유체의 타이밍은 예를 들어, 밸브(예를 들어, 전기기계 밸브, 전자기 밸브, 압력 밸브)의 방출을 통한 채널의 개방에 의해, 능동적으로 타이밍될 수 있다. 미세유체 네트워크에서 유체를 제어하는 밸브들의 예들에는 압전, 동전기 및 화학적 접근법들이 포함된다.
미세유체는 순차적으로 배열된 복수의 미세유체 채널들을 포함할 수 있다. 유체는 계량된 비율로 미세유체로 유입될 수 있다. 채널들에 대한 시료들의 접근 타이밍은 엇갈릴 수 있다.
장치는 신호 다중화를 수행할 수 있다. 즉, 장치는 제어된 간격으로 다수의 생체 표지들을 시료 추출 및/또는 측정하는 데 사용될 수 있다. 예를 들어, 장치는 하나 이상의 시료 챔버에 대한 접근을 제공하는 데 사용될 수 있다. 장치는 장치의 제어 회로에 의해 제어되는 하나 이상의 밸브를 포함할 수 있다. 하나 이상의 밸브는 서로 연결될 수 있다. 이에 따라, 장치는 공통 시료 바디에서 다수의 분석물의 동시 검출을 수행하도록 구성될 수 있다. 추가적으로 또는 대안적으로, 장치는 동일한 타겟의 다수의 시료의 다중 검출을 동시에 수행하도록 구성될 수 있다.
미세유체 채널(들)은 약 0.001 내지 0.01 mm2, 0.01 내지 0.1 mm2, 0.1 내지 0.25 mm2, 0.25 내지 0.5 mm2, 0.1 내지 1 mm2, 0.5 내지 1 mm2, 1 내지 2 mm2, 또는 2 내지 10 mm2 범위의 단면을 가질 수 있rh, 이들 값들 중 임의의 값들 사이에서 유용한 범위들이 선택될 수 있다.
일부 실시예들에서, 미세유체는 약 약 0.1 내지 1 μL, 1 내지 5 μL, 5 내지 10 μL, 10 내지 20 μL, 또는 20 내지 50 μL 이상의 범위 내의 미리 결정된 시료 체적을 수용하고, 이들 값들 중 임의의 값들 사이에서 유용한 범위들이 선택될 수 있다.
도 2에는 미세유체 장치(1)의 예가 도시되어 있다. 미세유체 장치(1)는 액체 및 입자 흐름을 시료 삽입 영역(4)으로부터 센서들(3)을 향해 지향시키도록 배열된 복수의 채널들(2)을 포함할 수 있다.
채널들은 위에서 언급한 바와 같은 단면 치수를 가질 수 있고, 보다 바람직하게는 약 0.1 mm2(0.1 mm x 1.0 mm)의 단면 치수를 가질 수 있다. 채널들은 가변 길이를 가질 수 있다. 예를 들어, 채널들은 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 250, 또는 300 mm 길이일 수 있고, 이들 값들 중 임의의 값들 사이에서 유용한 범위들이 선택될 수 있다(예를 들어, 약 약 1 내지 10, 1 내지 20, 1 내지 50, 1 내지 100, 1 내지 200, 1 내지 300, 10 내지 20, 10 내지 40, 10 내지 60, 10 내지 80, 10 내지 100, 50 내지 100, 50 내지 150, 50 내지 200, 50 내지 250, 50 내지 300, 100 내지 200, 또는 100 내지 300 mm 길이).
채널들의 상기한 치수들을 수동 모세관 흐름을 촉진한다.
사용 중일 때, 시료는 시료 삽입 영역(4)을 통해 미세유체 장치(1)에 도입된다.
일부 실시예들에서, 필터 멤브레인은 시료의 원하는 성분들을 분리하고 통과시킬 수 있도록 삽입 영역(4)에 존재할 수 있다. 예를 들어, 혈액의 혈장은 미세유체 장치(1)로 통과하지만 세포는 통과할 수 없다. 필터 멤브레인의 존재는 시료의 특성, 그리고 필터 멤브레인이 미세유체 장치(1)로 통과하지 않는 것이 바람직한 성분들을 포함하는지 여부에 의존한다.
일단 삽입 영역(4)으로 도입되면, 시료는 미세유체 채널들(2)과 접촉하고 채널 회로의 나머지를 통해 흐를 것이다.
미세유체 장치(1)는 채널들(2) 근처에 하나 이상의 자기 센서(3)를 포함할 수 있다. 예를 들어, 미세유체 장치(1)는 미세유체 장치(1) 주위에 배열된 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 자기 센서를 포함할 수 있다. 도 5에 도시된 바와 같이, 미세유체 장치(1)는 채널(2) 접합점들에 위치된 여섯 개의 자기 센서들(6)을 포함한다.
일 실시예에서, 미세유체 장치(1)는 혼합을 향상시키기 위해 채널들(2) 내의 액체를 통해 자화성 입자들을 유입하도록 활성화될 수 있는 채널들 바로 근처에 배열된, 예를 들어, 영구 자석 또는 전자석과 같은 두 개 이상의 자석들을 포함한다. 혼합은 예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10분 동안 수행될 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다. 혼합 시기는 시료 체적, 점도, 조성 및 타겟 분석물의 검출 범위와 같은 분석 요건들에 따라 달라질 수 있다.
혼합을 수행하기 위해, 자석들(예를 들어, 전자석들)은 채널 또는 미세유체 장치(1)의 실질적으로 반대쪽 끝에 배치될 수 있다. 예를 들어, 자석들은, 채널들 또는 미세유체 장치(1)의 일단부 쪽으로 자화성 입자들을 끌어당기고, 그 다음 채널 또는 미세유체 장치(1)의 타단부 쪽으로 자화성 입자들을 끌어당기는 효과가 역전되도록 제어 또는 전환될 수 있다. 이 사이클은 원하는 혼합 수준이 달성될 때까지 여러 번 반복될 수 있다.
자석은 전자석일 수 있다. 전자석은 약 0.5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45 또는 50 Gauss의 자계 강도를 발휘할 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다.
시료가 분석할 준비가 될 때, 자석들은 자화성 입자들을 자기 센서들 바로 근처에 위치시키도록 제어 또는 전환될 수 있다. 자석은 약 0.01, 0.05, 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1, 5, 10, 50 또는 100 Gauss의 자계 강도를 발휘할 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다. 그 다음, 시료 데이터가 설명된 대로 획득된다.
자화성 입자들은 자기 센서에 의해 감지된다.
자기 센서는 스핀트로닉 센서, 원자 자력계(AM), 핵 자기 공명(NMR) 시스템, 플럭스게이트 센서, 패러데이 유도 코일 센서, 다이아몬드 자력계, 및 자구벽 기반 센서로부터 선택될 수 있다.
평면 홀 효과(planar hall effect, PHE) 센서들과 같은 체적 기반 센서들이 간단하고 신속한 시료 준비 및 검출을 제공한다. 거대 자기저항(giant magnetoresistance, GMR)과 같은 표면 기반 센서들은 자화성 입자들과 센서 사이의 거리가 짧기 때문에 감지 한계가 더 낮다(단일 입자). 그러나, 이러한 기술들에는 통상적으로 힘든 시료 및/또는 기질 준비가 필요하다. 검출 감도, 분자 특이성, 및 적용 복잡성에 대한 요구가 증가함에 따라 특정 적용에 대해 자화성 입자들을 최적화하고 적절한 검출 방법을 선택하는 것은 자기 나노기술 커뮤니티에서 여전히 어려운 일이다. 스핀트로닉 센서들은 거대 자기 저항(GMR), 터널 자기 저항(tunnel magnetoresistance, TMR), 이방성 자기 저항(anisotropic magnetoresistance, AMR), 및 평면 홀 효과(PHE) 센서들로부터 선택될 수 있다.
GMR 효과는 1980년대에 발견되었고, 전통적으로 데이터 기록에 사용되었다. 스핀 밸브는 마이크론 크기의 설계로 보다 높은 감도를 제공한다. 스핀 밸브 GMR 센서는 강자성과 비자성 층들이 교대로 있는 인공 자기 구조로 구성된다. 자기 저항 효과는 상이한 층들을 가로지르는 전도 전자들 사이의 스핀 궤도 결합에 의해 발생한다. 자기 저항의 변화는 이러한 스핀 종속 센서에 의한 정량적 분석을 제공한다. GMR 센서들은 DNA-DNA 또는 단백질(항체)-DNA 상호작용을 검출하는 데 사용할 수 있다. 센서 어레이의 치수들은 개별 자화성 입자들의 검출을 위해 조정될 수 있다. GMR 센서들은 반강자성 입자들과 조합하여 사용할 수 있다.
평면 홀 효과는 강자성 물질들의 이방성 자기 저항 효과에 기초한 교환 바이어스 퍼멀로이 평면 센서이다. PHE 센서는 스핀 밸브 PHE 또는 PHE 브리지 센서일 수 있다. PHE 센서는 단일 입자 감지를 수행할 수 있다.
시료에서 분석물을 검출하기 위한 방법으로서,
도 1에 도시된 바와 같이, 이 방법의 실시예에 따른 셋업은 대략적으로 미세유체 장치, 센서, 자석, 신호 증폭기, 아날로그-디지털 변환기 및 컴퓨터를 포함할 수 있다.
타겟 분석물은 자화성 입자들에 제공되는 결합 분자들에 상보적이고 이들에 의해 결합할 수 있는 임의의 물질 또는 분자일 수 있다. 예를 들어, 타겟 분석물은 단백질, 펩티드, 핵산, 지질 또는 탄수화물을 이루어지는 군으로부터 선택될 수 있다.
타겟 분석물은 항체, 효소, 신호전달 분자 또는 호르몬으로 이루어지는 군으로부터 선택되는 단백질 또는 이의 단편일 수 있다.
타겟 분석물은 DNA, RNA, cDNA, mRNA, 또는 rRNA로 이루어지는 군로부터 선택되는 핵산일 수 있다.
이 방법은 단일 시료에서 하나 초과의 타겟 분석물을 검출할 수 있다. 예를 들어, 본 방법은 단일 시료에서 2개 이상, 3개 이상, 4개 이상, 5개 이상, 10개 이상, 15개 이상, 20개 이상의 타겟 분석물을 검출할 수 있다.
분석될 시료는 하나 이상의 타겟 분석물(들)을 함유할 수 있는 임의의 시료일 수 있다. 예를 들어, 시료는 임상, 수의학, 환경, 식품, 법의학 또는 기타 적합한 생물학적 시료일 수 있다.
임상 시료는 체액으로부터 선택될 수 있다. 예를 들어, 체액은 혈액, 땀, 타액, 소변, 가래, 정액, 점액, 눈물, 뇌척수액, 양수, 위액, 치은열구액 또는 간질액으로부터 선택될 수 있다.
환경 시료는 물, 토양 또는 에어로졸로 이루어지는 군으로부터 선택될 수 있다.
본 발명의 이점은 시료 준비가 힘들거나 준비하기 어렵지 않다는 것이다. 시료 준비는 미세유체 표면들 또는 자화성 입자들 표면들 중 어느 하나에서, 분자 기능화 및 부착을 위해 확립된 생화학을 이용한다.
분석될 시료는 추가 처리 없이 시료 웰 또는 미세유체 장치에 직접 추가될 수 있다.
시료는 하나 이상의 시료 처리 단계를 거칠 수 있다. 적합한 시료 처리 단계들은 분석될 시료의 유형 및/또는 특성에 따라 달라질 수 있다. 일부 실시예들에서, 시료 처리 단계들은 희석, 여과, 또는 추출(예를 들어, 액체-액체, 고체상)을 포함하는 군으로부터 선택될 수 있다. 예를 들어, 전혈 시료는 분석될 혈장을 분리하기 위해 셀룰로오스계 필터들을 사용하여 여과될 수 있다.
방법의 첫 번째 단계는 분석될 시료를 시료 웰 또는 시료 저장소에서 타겟 분석물에 상보적인 결합 분자들(결합제 복합체)로 코팅된 자유롭게 확산 가능한 자화성 입자들을 함유하는 제제와 조합하는 것을 포함할 수 있다. 적절한 경우, 용어 '결합제 복합체'는 코팅된 결합 분자들인 자화성 입자들을 지칭하기 위해 상호교환적으로 사용될 수 있다.
일부 실시예들에서, 자화성 입자들은 제한된 확산성을 가질 수 있다. 이는 자화성 입자들이 거대분자들과 가교되거나 유도체화되는 경우에 발생할 수 있다. 거대분자들은 하이드로겔 또는 PEG 링커일 수 있다. 이는 하나의 시료에서 다수의 타겟들 또는 시료들의 검출을 위한 다중 분석을 위해 장치를 사용할 때 발생할 수 있다.
본 방법은 용액 내에서 자유롭게 확산 가능하고 이동성인 결합제 복합체들을 제공함으로써 결합 분자들이 타겟 분석물들에 결합하는 비율을 개선할 수 있다. 시료와 결합제 복합체 제제가 조합될 때, 결합제 복합체들은 자유롭게 확산 가능하고 결합 분자들은 전체 시료 체적에 걸쳐 타겟 분석물들과 상호작용할 수 있다. 결합제 복합체와 타겟 분석물들은 둘 다 시료 체적에서 자유롭게 확산 가능하고 현탁되므로, 타겟 분석물과 결합제 복합체 사이의 평균 물리적 거리는 작을 가능성이 높다. 이와 같이, 결합율이 개선될 수 있고, 결합 평형이 훨씬 더 빠르게 달성될 수 있다.
ELISA와 같은 검출 분석에서, 항체와 같은 결합 분자들은 검사 웰의 표면과 같은 거시적 규모의 객체들 상에 고정된다. 이러한 방법에서, 타겟 분석물과 항체 사이의 물리적 거리는 시료 체적에서의 분석물의 위치에 따라 크게 달라질 수 있다. 예를 들어, 시료 체적의 상단 부근의 타겟 분석물은 고정된 항체로부터 상당히 멀리 떨어져 있을 수 있고, 포획 및 결합될 가능성이 적을 것이다. 이와 같이, 결합율은 타겟 분석물들이 시료 체적에서 고정된 항체 쪽으로 확산되는 비율에 의해 제한될 수 있다.
시료와 결합제 복합체는 결합 분자들이 결합 평형에 도달할 수 있게 하기에 적합한 시간 동안 조합할 수 있게 될 수 있다. 일부 실시예들에서, 결합이 평형에 도달할 수 있게 하기에 적합한 시간량은 약 1, 2, 3, 4, 5, 10, 20, 30, 45, 60, 90, 120, 180, 240, 300 또는 360초일 수 있고, 이들 값들 중 임의의 값들 사이에서 유용한 범위들이 선택될 수 있다(예를 들어, 약 1 내지 30, 1 내지 60, 1 내지 120, 10 내지 30, 10 내지 60, 10 내지 90, 30 내지 60, 30 내지 90, 30 내지 120, 60 내지 90, 60 내지 120, 60 내지 180, 90 내지 120, 90 내지 180, 90 내지 240, 180 내지 240, 180 내지 300, 180 내지 360초).
자기장 생성기는 결합 평형에 도달하는 비율을 개선하기 위해 시료의 자기-유체역학적 혼합을 유도하는 데 사용될 수 있다. 이러한 실시예에서, 자기장 생성기는 시료 체적에서 결합제 복합체들의 이동을 유도하는 데 사용된다.
결합 분석물이 자기장 센서로부터 멀어짐에 따라 자기장의 변화를 측정하여 시료에서 분석물의 정량화를 가능하게 하기 위한 신호가 생성된다.
자기장 센서는 온칩 자력계일 수 있다. 자기장 센서는 적어도 1 mV/V/gauss의 감도를 가질 수 있다. 일부 실시예들에서, 자기장 센서는 적어도 약 10 mGauss, 1 mGauss, 100 μGauss, 또는 10 μGauss의 자기장을 검출 및/또는 측정할 수 있다.
자기장 센서는 다축, 예를 들어, 1축, 2축 또는 3축을 포함할 수 있다.
자기장 센서는 Honeywell HMC 1021S 자력계일 수 있다. 다른 실시예에서, 자기장 센서는 Honeywell HMC1041Z 자기 센서일 수 있다. 다른 실시예들에서, 자기장 센서는 Honeywell HMC 1001, HMC 1002, HMC 1022, HMC 1051, HMC 1052, HMC 1053, 또는 HMC 2003 자력계들을 포함하는 군으로부터 선택될 수 있다.
자기장 센서는 주문형 구성요소들을 갖는 맞춤형 자기장 센서를 포함할 수 있다.
자기장의 변화를 측정하기 위해 다수의 자기장 센서들이 동시에 사용될 수 있다. 예를 들어, 소형 휴대용 애플리케이션을 위한 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 22, 또는 24개의 자기장 센서들.
자기장 센서들은 장치에서의 비교적 작은 면적에 제공될 수 있다. 예를 들어, 약 13 mm x 19 mm의 면적에 24개의 자기장 센서들이 제공될 수 있다. 이러한 구성은 자기장 센서 구성과 사용되는 보다 짧은 미세유체 채널들로 인해, 위의 단락 [0081] 내지 [0082]에서 논의한 바와 같이, 보다 빠른 시료-데이터 시간을 가능하게 한다. 이 구성은 또한 보다 작고 보다 휴대 가능한 장치를 가능하게 한다.
장치는 인쇄 회로 기판의 cm2당 약 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 또는 15개의 자기장 센서들을 포함할 수 있고, 이들 값들 중 임의의 값들 사이에서 유용한 범위들이 선택될 수 있다(예를 들어, 인쇄 회로 기판의 cm2당 5 내지 약 15, 약 5 내지 약 13, 약 5 내지 약 10, 약 6 내지 약 15, 약 6 내지 약 12, 약 6 내지 약 9, 약 7 내지 약 15, 약 7 내지 약 14, 약 7 내지 약 13, 약 7 내지 약 10, 약 8 내지 약 15, 약 8 내지 약 14, 약 8 내지 약 11, 약 9 내지 약 15, 약 9 내지 약 13 또는 약 10 내지 약 15개의 센서들).
일부 실시예들에서, 자기장의 변화를 측정하기 위해 다수의 자기장 센서들이 동시에 사용될 수 있다. 예를 들어, 50, 60, 70, 80, 90, 100, 110 또는 120개의 자기장 센서들이 소형 휴대용 애플리케이션 및 현장 실험실 또는 임상 응용 분야에 사용될 수 있고, 이들 값들 중 임의의 값들 사이에서 유용한 범위들이 선택될 수 있다(예를 들어, 약 50 내지 약 120, 약 50 내지 약 100, 약 50 내지 약 90, 약 50 내지 약 80, 약 60 내지 약 120, 약 60 내지 약 110, 약 60 내지 약 90, 약 70 내지 약 110, 약 70 내지 약 90, 약 80 내지 약 120 또는 약 80 내지 약 11개의 자기장 센서들).
일부 실시예들에서, 자기장의 변화를 측정하기 위해 다수의 자기장 센서들이 동시에 사용될 수 있다. 예를 들어, 1000, 1250, 1500, 1750, 2000, 2250, 2500, 2750 또는 3000개의 자기장 센서들이 실험실 또는 임상, 연구 또는 산업 응용 분야에 사용될 수 있다.
본 방법의 추가 단계는 자기장 센서 근처에 결합제 복합체들을 위치시키기 위해 시료에 자기장을 인가하는 것을 포함할 수 있다. 자화성 입자들에 의해 생성되는 자기장의 변화를 효과적으로 측정할 수 있게 하는 위치로 결합 및 비결합 결합제 복합체들을 조작하기 위해 자기장을 생성하는 데 단락 [0171]에 설명된 바와 같은 자기장 생성기가 자기장 센서가 사용될 수 있다.
일부 실시예들에서, 결합제 복합체들은 미세유체, 음향, 압전 또는 다른 적절한 수단들을 사용하여 자기장 센서 근처에 위치될 수 있다. 다른 실시예들에서, 결합제 복합체들은 원심분리에 의해 위치될 수 있다.
일부 실시예들에서, 자기장은 시료 체적에서 자화성 입자들을 자기장 센서 쪽으로 이동시키는 방향으로 생성될 수 있다. 자기장 센서는 검사 웰 또는 미세유체 장치에 대한 임의의 위치에 제공될 수 있다. 예를 들어, 자기장 센서가 검사 웰 또는 시료 저장소 아래에 위치된다면, 자기장은 자화성 입자들을 검사 웰 또는 시료 저장소의 하단 쪽으로 이동시킬 것이다. 다른 예로서, 자기장 센서가 검사 웰 또는 시료 저장소 위에 위치된다면, 자기장은 자화성 입자들을 검사 웰 또는 시료 저장소의 상단 쪽으로 이동시킬 것이다.
일부 실시예들에서, 생성된 자기장은 정적이거나 동적일 수 있다.
일부 실시예들에서, 생성된 자기장의 강도는 조절될 수 있다.
이론에 얽매이지 않고, 이러한 자기장(즉, 바이어스 자기장)의 조절은 검출 동안 가장 높은 검출 감도를 달성하기 위해 자화성 입자들을 센서에 정렬하는 주요 기능을 갖는다. 강자성 입자들의 경우, 자체 영구 자기장을 가지므로, 여기서 바이어스 자기장이 꺼져서 자성 입자들의 오정렬을 초래한다. 상자성(또는 초상자성) 입자들의 경우, 자기장이 외부 자기장에 의해 유도되어야 하므로, 바이어스 자기장은 이러한 자기장을 유도하는 추가 기능을 제공한다.
상이한 입자들이(화학적 조성에 의해서든 또는 물리적 크기에 의해서든) 상이한 바이어스 자기장 강도 및 구성들을 필요로 할 수 있기 때문에, 바이어스 자기장은 상이한 자화성 입자들을 지원하기 위해 조절될 수 있다.
일부 실시예들에서, 자기장은 자화성 입자들에 미치는 영향을 최대화하지만 자기 센서에 미치는 영향을 최소화하는 방식으로 생성되고 위치될 수 있다. 자기장 생성기는 자기장 센서 바로 근처에 생성 및/또는 위치될 수 있다. 일부 실시예들에서, 자기장 생성기는 자기장 센서의 위, 아래 또는 옆에 위치된다. 일부 실시예들에서, 자기장 생성기는 자기장 센서와 동일한 평면 수직 또는 수평 평면 상에 위치될 수 있다.
본 방법의 추가 단계는 결합 및 비결합 결합제 복합체들이 자기장 센서 바로 근처에 위치될 때, 결합제 복합체들의 적어도 일부를 자기장 센서 근처로부터 방출하기에 충분하게 자기장을 변화시키는 단계를 포함할 수 있다.
일부 실시예들에서, 자기장은 점진적으로 감소될 수 있다.
일부 실시예들에서, 자기장은 즉시 제거될 수 있다.
일부 실시예들에서, 자기장은 형태가 가변적일 수 있다.
시료에 인가된 자기장이 감소 및/또는 제거됨에 따라, 결합 및 비결합 결합제 복합체들이 자기장으로부터 방출되고, 자기장 센서 근처로부터 자유롭게 확산(병진 이동)할 수 있다. 결합제 복합체는 또한 시료에 인가된 자기장이 감소 및/또는 제거됨에 따라 자기장 센서에 대해 회전할 수 있다(회전 이동).
본 발명의 방법에 따르면, 확산율이 분자량의 제곱근에 반비례한다는 그레이엄(Graham)의 분자 확산 법칙에 따라 분자 확산 특성들의 변화에 기초하여 결합 결합제 복합체와 비결합 결합제 복합체가 구별될 수 있다. 확산율은 하기의 식을 사용하여 계산될 수 있다:
상기 식에서,
RA = 분자 A의 확산율,
RB = 분자 B의 확산율,
MA = 분자 A의 분자량, 그리고
MB = 분자 B의 분자량이다.
타겟 분석물에 결합된 결합제 복합체는 비결합 결합제 복합체에 비해 더 큰 분자량을 가질 것임에 따라, 비결합 결합제 복합체는 그레이엄의 법칙에 따라 더 높은 확산율을 가질 것이다. 이에 따라, 결합된 결합제 복합체와 비결합 결합제 복합체는 이들의 동역학 프로파일들에 따라 구별될 수 있다.
본 방법의 추가 단계는 자화성 입자들이 자기장 센서와 관련하여 (병진 또는 회전 이동을 통해) 이동할 때, 이들로부터 검출되는 자기 신호의 변화를 측정하는 것을 포함할 수 있다. 자기장 센서는 이전 단락들에서 상세히 설명된 바와 같이, 시간에 따라 자화성 입자들에 의해 생성된 자기장 강도의 변화를 측정한다. 본 방법은 타겟 분석물의 결합을 위해 하나의 결합 분자만 필요로 하는 시간에 따른 자기장 변화를 사용한다.
일부 실시예들에서, 시간에 따른 자기장 변화는 시간에 따른 자기저항 효과 및 신호 강하를 측정함으로써 결정될 수 있다.
자기장 센서와 관련하여 자화성 입자들에 의해 생성되는 자기장 신호는 다음 자기장 쌍극자 방정식을 따른다:
상기 식에서,
m은 (벡터) 쌍극자 모멘트이다
μ0는 자유 공간의 투과성이다
자기장 쌍극자 방정식에 기초하여, 검출 신호는 자기장 센서로부터 세제곱 거리까지 떨어진다. 위에서 설명한 확산 속도론과 관련된 이러한 현상은 다음 단락에서 설명하는 신호 생성에 사용할 수 있다.
비결합 결합제 복합체들의 더 높은 확산율로 인해, 비결합 결합제 복합체들은 타겟 분석물에 결합되는 결합제 복합체와 비교할 때, 더 빠른 비율로 센서로부터 더 멀어지게 이동할 수 있다. 확산율의 차이는 시간에 따른 자기장 감쇠 신호를 생성할 것이다. 감쇠율은 결합 및 비결합 결합제 복합체들의 분자량에 의존하여, 이 경우 비결합 결합제 복합체가 결합 결합제 복합체에 비해 더 빠른 감쇠율을 가질 것이다.
감쇠율은 감쇠 곡선으로 모델링될 수 있다. 감쇠 곡선은 결합 결합제 복합체와 비결합 결합제 복합체를 구별하는 데 사용될 수 있다. 예를 들어, 가속 감쇠 곡선은 비결합 결합제 복합체를 나타낼 수 있고, 약화 감쇠 곡선은 결합된 결합제 복합체들을 나타낼 수 있다.
본 방법은 타겟 분석물을 정량화하기 위해 결합된 결합제 복합체와 비결합 결합제 복합체를 구별하기 위한 시간에 따른 신호 곡선을 생성하기 위해 다음 단계들을 여러 차례 포함할 수 있다.
본 방법은 결합 또는 비결합 결합제 복합체들에 의해 생성되는 총 자기장 강도를 측정함으로써 기준 교정 단계를 포함할 수 있다.
자화성 입자들에 의해 생성되는 자기장 신호는 자화성 입자들의 고유한 속성들로 인한 것일 수 있거나 외부 자기장에 의해 유도될 수 있다.
자기장 센서는 자화성 입자들의 감지를 최대화하지만 자기장 생성기의 감지는 최소화하는 방식으로 위치된다.
자화성 입자들로부터의 자기장 또는 신호는 이의 원자 구성에 고유하거나, 외부 자기장에 의해 유도될 수 있다.
센서에 의한 데이터 획득은 미세유체 장치와 동기화될 수 있다. 이는 검출된 센서의 데이터가 시료 데이터 또는 환경 또는 주변 데이터 사이에서 특성화될 수 있게 할 수 있다. 예를 들어, 미세유체 장치로의 시료 주입이 없는 신호를 자기 센서에 의해 검출하면 해당 데이터를 환경 또는 주변 데이터로서 특성화할 수 있다. 데이터를 환경 또는 주변 데이터로서 특성화하면 배경을 확립하는 데 도움이 될 수 있고, 교정 데이터를 준비하는 데에도 도움이 될 수 있다.
자기 센서가 미세유체 장치로의 시료 주입 후 신호를 검출하는 경우, 이는 자기 센서 바로 근처 자화성 입자들의 위치와 일치하며, 이러한 데이터는 시료 데이터로서 특성화될 수 있다.
센서로부터의 데이터 획득은 연속적일 수 있다. 즉, 자기 센서는 연속적으로 신호들을 송신하고, 데이터 수집과 미세유체 장치로의 시료 주입의 동기화에 기초하여 데이터를 시료 데이터 또는 배경 데이터로서 특성화한다.
센서 데이터는 자화성 입자들로부터의 자기 신호의 변화를 측정하기 위해 일정 시구간 동안 획득될 수 있다. 감지된 자기 신호의 변화로부터 행동들 또는 이벤트들이 추론될 수 있다. 행동들 또는 이벤트들에는 유체 흐름, 외부 자기력, 또는 확산으로부터의 자화성 입자들의 이동이 포함될 수 있다.
본 방법은 자기장 센서로부터 출력된 원시 데이터를 처리하여 시료 내의 타겟 분석물의 양을 정량화하는 단계를 포함할 수 있다. 원시 데이터 처리는 이전 단락에서 상세히 설명된 하드웨어 및 소프트웨어 구현예들의 조합을 사용하여 수행될 수 있다.
원시 데이터 출력의 처리는 신호 증폭기를 사용하여 자기장 센서로부터 출력된 신호를 증폭하는 단계를 포함할 수 있다. 자기장 센서로부터 출력된 신호는 감지된 자기장에 비례하는 전압 판독치일 수 있다. 일부 실시예들에서, 신호 증폭기는 Texas Instruments INA819 증폭기이다.
자기장 센서로부터의 전압 판독치는 데이터 처리 및 수집 전자 장치 구성요소들과 호환되는 (원래 전압 판독치에 비례하여) 더 높은 전압으로 증폭될 수 있다.
원시 데이터 출력의 처리는 자기장 센서로부터 출력된 아날로그 데이터를 디지털 데이터 출력으로 변환하는 단계를 더 포함할 수 있다. 예를 들어, 전압 판독치는 컴퓨터에 의해 기록 가능한 디지털 비트스트림으로 변환될 수 있다.
아날로그 대 디지털 변환은 아날로그-디지털 변환기(ADC)를 사용하여 수행될 수 있다.
변환 또는 시료 추출 정밀도는 16, 24, 32, 64, 128, 256, 또는 512 비트일 수 있다.
검출 방법론의 분석 성능 평가는 보통 검출 한계(LoD)가 도출될 수 있는 선량-반응 곡선들을 측정하여 이루어진다. LoD는 선택된 신뢰도 수준에 대해 검출될 수 있는 생체 표지와 같은 물질의 최소량이다. 선택된 분석(생체 표지, 생체 물질, 시료 기질, 배양 시간 등)은 LoD에 강한 영향을 미칠 수 있다. 또한, 주어진 요구 정밀도로 정량화될 수 있는 최저 생체 표지 농도인 정량 한계(LoQ)가 사용된다. 선량-반응 곡선이 양호한 감도를 갖는다면, 즉 신호가 타겟 농도의 함수로서 크게 변한다면, LoQ는 LoD에 가깝다.
본 방법은 약 0.05, 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.5 또는 2.0 pg/m의 LoQ를 제공할 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다.
본 방법은 약 0.1, 1.1, 1.2, 1.3, 1.4, 1.5, 1.6, 1.7, 1.8, 1.9 또는 2.0 pg/mL의 LoD를 제공할 수 있고, 이들 값들 중 임의의 값들 사이로부터 적합한 범위들이 선택될 수 있다.
본 발명은 시료에서 분석물을 검출하고 정량화하는 방법들, 시약들 및 시스템들을 설명한다.
고처리율 스크리닝(High-throughput screening, HTS) 시스템들은 비교적 짧은 시간에 다수의 분석이 수행될 수 있게 한다. HTS 시스템들은 마이크로플레이트들, 마이크로플레이트 판독기들, 로봇 액체 및 마이크로플레이트 핸들링 플랫폼들을 포함할 수 있다. 일부 실시예들에서, 설명된 본 방법의 하나 이상의 단계는 HTS 시스템들을 사용하여 수행될 수 있다.
일부 실시예들에서, 마이크로플레이트들은 예를 들어, 6, 12, 24, 48, 96, 384 또는 1536개의 시료 웰들을 포함할 수 있다.
일부 실시예들에서, 자기 센서(들)는 마이크로플레이트들에 제공될 수 있다.
일부 실시예들에서, 로봇식 액체 핸들링 장치들은 시료 및/또는 시약을 마이크로플레이트 상에 분배하는 데 사용될 수 있다.
일부 실시예들에서, 본 방법은 HTS 시스템들을 사용하여 부분적으로 또는 완전히 자동화될 수 있다.
분석물을 검출하기 위한 장치는 임의의 배향으로 작동가능할 수 있다. 본 장치의 작동 또는 본 방법의 수행은 효과적으로 기능하기 위해 중력에 의존하지 않다. 즉, 본 장치는 장치가 어떻게 배향되는지에 관계 없이 본 방법을 수행할 수 있다. 예를 들어, 본 장치는 자기장 센서가 시료 저장소 또는 미세유체 장치 위에 배향되는 경우 반전된 구성으로 작동가능할 수 있다.
본 방법은 타겟 분석물의 검출 및/또는 정량화를 필요로 하는 임의의 적용예에서 광범위하게 사용될 수 있음을 이해할 것이다. 특히, 본 방법은 시료 내 타겟 분석물의 존재의
i) 빠른 결정, 또는
ii) 민감한 결정, 또는
iii) 정량적 결정, 또는
iv) 또는 (i) 내지 (iii)의 임의의 조합;
을 필요로 하는 적용예들에서 사용될 수 있다.
예를 들어, 적합한 적용예들에는 임상, 수의학, 환경, 식품 안전 또는 법의학 적용예들이 포함될 수 있다.
일부 실시예들에서, 임상 적용예는 임상 병태를 나타낼 수 있는 시료에서 생체 표지들의 진단 검출을 포함할 수 있다. 일 예에서, 본 방법은 병원체에 의한 잠재적인 감염을 나타낼 수 있는 혈액 시료에서 특정 항체들의 신속하고 민감하며 정량적인 진단 검출에 사용될 수 있다. 추가 예에서, 본 방법은 암에서 과발현되는 특정 단백질 생체 표지들의 진단 검출을 위해 사용될 수 있다. 진단 검출은 다양한 종들에 걸친 시료들에 대해 수행될 수 있다.
임상 병태는 박테리아, 진균, 바이러스(예를 들어, 간염 및 HIV)(예를 들어, 간염 및 HIV 항체와 같은 생체 표지), 기생충(예를 들어, 미생물 기생충[예를 들어, 말라리아], 선충류, 곤충 기생충)으로부터의 감염과 같은 감염들로부터 선택될 수 있다.
임상 병태는 심장 질환(BNP와 같은 생체 표지), 암(예를 들어, 고형장기암, 혈액암, 기타 암), (예를 들어, Ca-125 및 기타 종양 표이와 같은 생체 표지), 신경계 질환(예를 들어, 다발성 경화증, 알츠하이머병, 파킨슨병, 헌팅턴병)(예를 들어, CNS 면역글로불린과 같은 생체 표지), 호흡기 질환(예를 들어, 혈청 ACE와 같은 생체 표지), 간 질환(예를 들어, 간 기능 검사 및 알부민과 같은 생체 표지), 신장 질환( 예를 들어, 크레아티닌 및 단백질과 같은 생체 표지)과 같은 질환들로부터 선택될 수 있다.
임상 병태는 뇌 손상(예를 들어, 신경교섬유질산성단백질 또는 GFAP과 같은 생체 표지), 신장 손상(예를 들어, 혈청 크레아틴과 같은 생체 표지), 심장 손상(예를 들어, 크레아틴 키나제-근육과 같은 생체 표지), 폐 손상(예를 들어, 세포간 접착 분자-1 또는 ICAM1과 같은 생체 표지), 또는 간 손상(예를 들어, 알칼리 포스파타제와 같은 생체 표지)과 같은 장기 손상 또는 부전로부터 선택될 수 있다.).
임상 병태는 당뇨병(예를 들어, 인슐린, 상승된 HbA1C, 갑상선 기능 장애, 갑상선 호르몬, 뇌하수체 장애와 같은 생체 표지(예를 들어, ACTH, 프로락틴, 난포 호르몬, 갑상선 자극 호르몬, 성장 호르몬, 항이뇨제와 같은 생체 표지), 부갑상선 장애(예를 들어, 부갑상선 호르몬과 같은 생체 표지), 부신 장애(예를 들어, 코티솔, 알도스테론, 아드레날린, DHEAS와 같은 생체 표지), 성 호르몬 불균형(예를 들어, 안드로겐 및 에스트로겐과 같은 생체 표지), 카르시노이드 종양(예를 들어, 5-HIAA, VIPoma, 혈청 VIP와 같은 생체 표지), 골전환 상승(예를 들어, P1NP와 같은 생체 표지)과 같은 내분비 장애들로부터 선택될 수 있다.
임상 병태는 지질 장애(예를 들어, 콜레스테롤 및 트리글리세리드와 같은 생체 표지)로부터 선택될 수 있다.
임상 병태는 영양 장애들(예를 들어, 비타민 결핍, 흡수 장애 증후군, 영양실조, 비타민 대사 장애), (예를 들어, 비타민 수준, 철 수준, 미네랄 수준과 같은 생체 표지)로부터 선택될 수 있다.
임상 병태는 염증 또는 염증성 장애들(예를 들어, ESR, Crp 및 기타 급성기 단백질과 같은 생체 표지)로부터 선택될 수 있다.
임상 병태는 자가면역 질환들(예를 들어, 특정 항체 표지와 같은 생체 표지)으로부터 선택될 수 있다.
임상 병태는 알레르기 질환들(예를 들어, 트립타제와 같은 생체 표지)로부터 선택될 수 있다.
임상 병태는 감전사와 같은 물리적 외상들(예를 들어, 크레아티닌 키나제와 같은 생체 표지)로부터 선택될 수 있다.
임상 병태는 면역 결핍 장애들(예를 들어, 공통 가변 면역 결핍), (예를 들어, 보체, 백혈구 및 면역글로불린과 같은 생체 표지)로부터 선택될 수 있다.
임상 병태는 응고 장애들예를 들어, 혈전증)(예를 들어, 응고 인자 및 기타 표지와 같은 생체 표지와 같은 생체 표지들)로부터 선택될 수 있다.
임상 병태는 유전적 또는 후천적 효소 장애, 결핍 또는 과잉 및 기타 선천적 또는 후천적 대사 결함들(예를 들어, 바터 증후군, 선천성 부신 과형성), (예를 들어, 전해질, 효소 수준, 효소의 대사 산물과 같은 생체 표지)로부터 선택될 수 있다.
임상 병태는 고칼륨혈증 및 고나트륨혈증과 같은 전해질 장애들(예를 들어, 전해질과 같은 생체 표지)로부터 선택될 수 있다.
임상 병태는 약물 부작용 또는 중독(예를 들어, 약물 수준 및 약물 대사 산물 수준과 같은 생체 표지)로부터 선택될 수 있다.
수의학에 특정한 임상 병태는 신부전, FIV/AIDS(고양잇과), 암, 및 장기 기능/부전에 대한 임의의 생체 표지로부터 선택될 수 있다.
일부 실시예들에서, 임상 병태는 고양이, 개, 소, 양, 말, 돼지 또는 쥐와 같은 수의학적 대상체들의 병태일 수 있다.
일부 실시예들에서, 환경 적용예는 환경 시료에서 오염물의 검출을 포함할 수 있다. 환경 오염물은 예를 들어, 납, 미립자 물질, 미세 플라스틱 및 호르몬과 같은 오염물로부터 선택될 수 있다.
예를 들어, 본 방법은 물 시료에서 중금속을 모니터링하고 정량화하는 데 사용할 수 있다.
일부 실시예들에서, 식품 안전 적용예는 식품 시료에서 병원체의 검출을 포함할 수 있다. 예를 들어, 본 방법은 박테리아 병원체에 의한 우유의 저온 살균 후 오염을 신속하고 민감하게 감지하는 데 사용할 수 있다.
예들
예 1: 감도 및 검출 한계
이 연구의 목적은 검출의 민감도를 검사하는 것이었다.
특정 양의 자화성 입자들을 검출을 위해 미세유체 시스템에 추가하였다. 시스템의 셋업은 아래에 요약되어 있다.
o 시료 1: 대조군 - 0 pg의 입자들
o 시료 2: 0.5 pg의 입자들
o 시료 3: 5 pg의 입자들
o 시료 4: 50 pg의 입자들
o 시료 5: 500 pg의 입자들
o 시료 6: 50,000 pg의 입자들
o 시료 7: 500,000 pg의 입자들
o 판독당 0.012초
o 시료당 1,200회 판독
o 총 판독 시간 약 15초
미세유체 시스템으로 도입된 후 입자들은 미세유체 장치에 의해 센서 위에 위치되었다. 자석을 활성화하여 자화성 입자들이 자기 센서 바로 근처로 오도록 했다. 그 다음, 자석을 끄고, 센서 밑에 위치한 영구 자석을 사용하여 바이어스 자기장을 생성했다. 자기장 센서는 시간에 따라 자화성 입자들이 자기 센서로부터 멀리 확산함에 따라 생성되는 자기장 강도의 변화를 측정했다. 본 장치는 자기장 센서에 대한 자화성 입자들의 순 이동을 측정하여 시료 내 분석물의 양을 결정한다.
각 시료에 대한 센서 데이터를 획득했다.
그 다음, 센서 데이터를 다음과 같이 처리했다. 30개 시료 창 이동 평균 필터를 적용하고, 데이터를 시간에 따라 평균화하며, 음성 대조군 시료(시료 1)로 정규화했다.
도 3은 검출된 신호를 임의의 단위(a.u.)로서 표현되는 세로축으로 나타낸 그래프이다.
입자들의 양은 가로축에 피코그램(pg)으로서 표현된다.
결과들은 감도와 신호 획득이 보다 많은 수의 입자들로 개선됨을 보여준다.
도 3의 그래프는 민감도 플롯이고, 약 0.5 pg의 LoQ를 보여준다.
예 2: 검출 속도
이 연구의 목적은 검출 시스템의 속도를 검사하는 것이었다.
특정 양의 자화성 입자들을 검출을 위해 미세유체 시스템에 추가하였다. 시스템의 셋업은 아래에 요약되어 있다.
o 시료 1: 대조군 - 0 pg의 입자들
o 시료 2: 50 pg의 입자들
o 시료 3: 500,000 pg의 입자들
o 판독당 0.012초
o 시료당 1,200회 판독
o 총 판독 시간 약 15초
미세유체 시스템으로 도입된 후 입자들은 미세유체 장치에 의해 센서 위에 위치되었다. 자석을 활성화하여 자화성 입자들이 자기 센서 바로 근처로 오도록 했다. 그 다음, 자석을 끄고, 센서 밑에 위치한 영구 자석을 사용하여 바이어스 자기장을 생성했다. 자기장 센서는 시간에 따라 자화성 입자들이 자기 센서로부터 멀리 확산함에 따라 생성되는 자기장 강도의 변화를 측정했다. 본 장치는 자기장 센서에 대한 자화성 입자들의 순 이동을 측정하여 시료 내 분석물의 양을 결정한다.
각 시료에 대한 센서 데이터를 획득했다.
그 다음, 센서 데이터를 다음과 같이 처리했다. 30개 시료 창 이동 평균 필터를 적용하고, 데이터를 음성 대조군 시료(시료 1)로 정규화했다.
도 4에는 시간에 따른 신호 획득을 임의의 단위(a.u.)로서 표현되는 세로축으로 나타낸 그래프가 도시되어 있다.
각 판독의 시점이 가록축에 초로서 표현된다.
결과들은 본 방법이 시료 내에 존재하는 입자들의 양을 정성적으로 측정하고 구별하기에 15초 이내에 충분한 신호를 획득할 수 있음을 보여준다.
도 4의 그래프는 데이터 획득 플롯에 대한 시간이고, 15초 이내에 빠른 시료 검출 및 데이터 수집을 보여준다.
도 4의 그래프는 상기한 시스템이 매우 적은 양의 입자들(즉, 피코그램 범위)에 반응하고, 몇 초 만에 빠르게 감지하고 식별할 수 있음을 보여준다.
예 3: 시료에서 스트렙트아비딘 단백질의 검출
이 연구의 목적은 타겟 분석물로서 시료에서 스트렙트아비딘 단백질의 정량적 검출을 입증하는 것이었다.
라텍스 입자들에 공액 결합된 비오틴(비자화성 입자들)을 사용하여 검출을 위해 미세유체 시스템에 추가된 특정 양의 스트렙트아비딘을 포획하고 연관시켰다. 시스템의 셋업은 아래에 요약되어 있다.
o 시료 1: 자화성 입자들에 공액 결합된 0 pmoles/ml 스트렙트아비딘 단백질
o 시료 2: 자화성 입자들에 공액 결합된 0.33 pmoles/ml 스트렙트아비딘 단백질
o 시료 3: 자화성 입자들에 공액 결합된 3.3 pmoles/ml 스트렙트아비딘 단백질
o 시료 4: 자화성 입자들에 공액 결합된 33 pmoles/ml 스트렙트아비딘 단백질
o 시료 5: 자화성 입자들에 공액 결합된 330 pmoles/ml 스트렙트아비딘 단백질
o 판독당 0.012초
o 시료당 1,200회 판독
o 총 판독 시간 약 15초
미세유체 시스템으로 도입된 후 입자들은 미세유체 장치에 의해 센서 위에 위치되었다. 자석을 활성화하여 자화성 입자들이 자기 센서 바로 근처로 오도록 했다. 그 다음, 자석을 끄고, 센서 밑에 위치한 영구 자석을 사용하여 바이어스 자기장을 생성했다. 자기장 센서는 시간에 따라 자화성 입자들이 자기 센서로부터 멀리 확산함에 따라 생성되는 자기장 강도의 변화를 측정했다. 본 장치는 자기장 센서에 대한 자화성 입자들의 순 이동을 측정하여 시료 내 분석물의 양을 결정한다.
각 시료에 대한 센서 데이터를 획득했다.
그 다음, 센서 데이터를 다음과 같이 처리했다. 30개 시료 창 이동 평균 필터를 적용하고, 데이터를 시간에 따라 평균화하며, 음성 대조군 시료(시료 1)로 정규화했다.
스트렙트아비딘 단백질의 비오틴 포획 및 연관을 통해 검출된 신호가 임의의 단위(a.u.)로서 표 1에 제시되어 있다.
표 1. 스트렙트아비딘 농도 대 검출 속도
표 1은 본 발명의 방법이 3.3 pmol/mL 이하에서 스트렙트아비딘 수준을 검출할 수 있음을 입증한다.
예 4: 감도 및 정량 한계
이 연구의 목적은 상이한 종들로부터의 시료들 내의 생체 표지들의 감도와 정량적 검출을 입증하는 것이다.
자화성 입자들은 각 항체가 각각 특정 생체 표지를 타겟으로 하는 재조합 항체로 기능화되었다. 기능화된 자화성 입자들을 사용하여 정량화를 위해 미세유체 시스템에 추가된 각 시료의 특정 농도들의 생체 표지들과 연관시켰다. 시스템의 셋업은 아래에 요약되어 있다.
o 항-인체 CRP 검출 항체(R&D systems DY1707)
o 항-인체 알부민 검출 항체(R&D Systems DY1455)
o 항-개과 IL-6 검출 항체(R&D Systems DY1609)
o 항-개과 CRP 검출 항체(R&D systems DY1603)
o 항-고양잇과 TNFa 검출 항체 (R&D Systems DY2586)
o 항-고양잇과 GM-CSF 검출 항체 (R&D Systems DY987)
o 항-말과 TNFa 검출 항체 (R&D Systems DY1814)
o 판독당 0.007초
o 시료당 1,000회 판독
o 총 판독 시간 약 10초
o 인체 CRP
o 인체 알부민
o 개과 IL-6
o 개과 VEGF-A
o 고양잇과 TNFa
o 고양잇과 GM-CSF
o 말과 TNFa
미세유체 시스템으로 도입된 후 입자들은 미세유체 장치에 의해 센서 위에 위치되었다. 자석을 활성화하여 자화성 입자들이 자기 센서 바로 근처로 오도록 했다('포획' 단계). 그 다음, 자석을 껐다('방출' 단계). 자기장 센서는 시간에 따라 자화성 입자들이 자기 센서로부터 멀리 확산함에 따라 생성되는 자기장 강도의 변화를 측정했다.
각 시료에 대한 센서 데이터를 획득했다.
그 다음, 센서 데이터를 다음과 같이 처리했다. 데이터는 처음 10회 판독에 걸쳐 평균을 낸 다음, 각 상대적인 음성 대조군 시료에 대해 정규화했다.
각 시료에 대한 항체 포획 및 생체 표지와의 연관성을 통해 검출된 센서 값들(임의 단위 [a.u.])이 표 2에 제시되어 있다.
표 2. 생체 표지 농도 대 센서 값
표 2의 결과들은 다양한 종들의 생체 표지 범위에 걸쳐 0.1 pg/mL 범위의 정량 한계를 보여준다. 결과들은 또한 6차수에 걸쳐 0.1 내지 10,000 pg/mL의 생체 표지 검출을 보여준다.
Claims (33)
- 시료에서 분석물을 검출하기 위한 방법으로서,
타겟 분석물을 포함하는 시료를 자화성 입자들 ― 상기 입자들은 상기 타겟 분석물에 상보적인 결합 분자들로 코팅됨 ― 과 접촉시켜, 결합 및 비결합 결합제 복합체들을 생성하는 단계,
상기 결합 및 비결합 결합제 복합체들 둘 다를 포함하는, 상기 자화성 입자들을 자기장 센서 근처에 위치시키는 단계,
상기 결합 및 비결합 결합제 복합체들 둘 다를 포함하는, 상기 자화성 입자들의 적어도 일부를 상기 자기장 센서 근처로부터 방출하기에 충분하게 상기 자기장을 변화시키는 단계, 및
상기 자기 센서에 대한 상기 자화성 입자들의 순 이동(net movement) ― 병진 또는 회전 이동 중 어느 하나임 ― 으로부터 검출되는 자기 신호의 변화를 측정하는 단계를 포함하는, 방법. - 제2항 또는 제3항에 있어서, 상기 자화성 입자들의 적어도 일부를 상기 자기 센서 근처로부터 방출하기에 충분하게 상기 자기장을 변화시키는 단계를 포함하는 시료 검사 장치를 제공하는 단계를 더 포함하는, 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 시료에서의 상기 분석물의 상기 검출 및 정량화가 자기장 센서를 통해 검출되는 자화성 입자들의 양에 의존하는 것인, 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 자화성 입자들은 상기 분석물에 특이적으로 결합하는 분자들로 기능화되는 것인, 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 시료 및 상기 자화성 입자들은 미세유체 장치에 의해 처리되는 것인, 방법.
- 제6항에 있어서, 상기 미세유체 장치는 상기 자화성 입자들과 분석물 사이의 결합을 용이하게 하는 것인, 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 자화성 입자들은 자화성 입자들인 것인, 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 자화성 입자들은 상자성 또는 강자성인 것인, 방법.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 상기 자화성 입자들은 약 5 내지 약 5000 nm의 평균 입자 크기를 갖는 것인, 방법.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 미세유체 장치는 상기 자기 센서 바로 근처에 상기 자화성 입자들 및 분석물을 위치시키는 것인, 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 상기 자화성 입자들 및 분석물이 상기 자기 센서의 감지 요소로부터 1 내지 5,000 ㎛ 이내로 들어오게 하는 것인, 방법.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 상기 하나 이상의 자석(또는 전자석)은 상기 자화성 입자들을 정렬시키는 것인, 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 상기 하나 이상의 자석은 시간에 따라 변하는 자기장을 생성하는 것인, 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 자기장 생성기는 크기의 연속성을 생성할 수 있는 것인, 방법.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 상기 자기장 생성기는 상기 자기장을 온과 오프 사이에서 교번시킬 수 있는 것인, 방법.
- 제1항 내지 제16항 중 어느 한 항에 있어서, 상기 자기장은 상기 자화성 입자들에 미치는 영향을 최대화하지만 상기 자기 센서에 미치는 영향을 최소화하는 방식으로 생성되고 위치되는 것인, 방법.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 상기 자기장 센서는 시간에 따라 상기 자화성 입자들에 의해 생성되는 자기장 강도의 변화를 측정하는 것인, 방법.
- 제1항 내지 제18항 중 어느 한 항에 있어서, 상기 자기장 센서는 상기 자화성 입자들의 감지를 최대화하고 상기 자석으로부터의 감지를 최소화하도록 구성되는 것인, 방법.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 상기 센서에 의한 데이터 획득이 상기 미세유체 장치와 동기화되는 것인, 방법.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 데이터가 상기 센서로부터 연속적으로 획득되는 것인, 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 획득된 데이터가 (1) 환경 및/또는 주변, 또는 (2) 시료 데이터로서 플래깅되는 것인, 방법.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 신호 획득과 상기 미세유체 장치의 동작의 동기화에 기초하여 교정되는, 방법.
- 제1항 내지 제23항 중 어느 한 항에 있어서, 상기 데이터는 약 1 내지 약 60초의 시구간에 걸쳐 획득되는 것인, 방법.
- 제1항 내지 제24항 중 어느 한 항에 있어서, 상기 자기장 센서로부터 출력된 신호는 신호 증폭기에 의해 부스트되는 것인, 방법.
- 제1항 내지 제25항 중 어느 한 항에 있어서, 상기 자기장 센서로부터 출력된 신호는 상기 자기장 센서가 감지하는 자기장 강도에 비례하는 전압 판독치인 것인, 방법.
- 제1항 내지 제26항 중 어느 한 항에 있어서, 상기 자기장 센서로부터의 전압은 모든 변화가 원래 신호에 비례하여, 데이터 처리 및 수집 전자 장치와 호환 가능한 범위로 유지되면서, 더 높은 전압으로 크기가 부스트되는 것인, 방법.
- 제1항 내지 제27항 중 어느 한 항에 있어서, 상기 증폭된 신호는 전압 판독치로부터 디지털 비트스트림으로 변환되고, 컴퓨터에 의해 기록 및/또는 분석되는 것인, 방법.
- 제1항 내지 제28항 중 어느 한 항에 있어서, 상기 변환은 아날로그-디지털 변환기(Analog 내지 Digital Converter, ADC)에 의해 수행되는 것인, 방법.
- 제1항 내지 제29항 중 어느 한 항에 있어서,
a) 상기 시료에서 타겟 분석물의 양을 검출 및/또는 측정하기에 충분한 자기 신호를 15초 이내에 생성하거나, 또는
b) 적어도 약 0.05 pg/mL의 검출 한계(limit of detection, LOD)를 갖거나, 또는
c) 적어도 약 0.1 pg/mL의 정량 한계(limit of quantification, LOQ)를 갖거나, 또는
d) (a) 내지 (c) 중 하나 이상인 것인, 방법. - 제1항 내지 제30항 중 어느 한 항의 방법을 수행하기 위한 장치로서, 상기 자기장 센서, 자기장을 생성하기 위한 하나 이상의 자석, 및 시료 웰 또는 시료 저장소를 포함하는, 장치.
- 제31항 또는 제32항에 있어서, 상기 장치는 임의의 배향에서 작동 가능한 것인, 장치.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AU2020904881 | 2020-05-25 | ||
| AU2020904881 | 2020-05-25 | ||
| PCT/AU2021/050497 WO2021237283A1 (en) | 2020-05-25 | 2021-05-25 | Use of magnetic nanoparticles for the detection and quantitation of analyte(s) |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20230013259A true KR20230013259A (ko) | 2023-01-26 |
Family
ID=78745678
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227044248A KR20230013259A (ko) | 2020-05-25 | 2021-05-25 | 자성 나노 입자를 사용하는 분석물(들)의 검출 및 정량화 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US11604187B2 (ko) |
| EP (1) | EP3938785A4 (ko) |
| JP (1) | JP2023528687A (ko) |
| KR (1) | KR20230013259A (ko) |
| CN (1) | CN114341641A (ko) |
| AU (2) | AU2021232687B2 (ko) |
| BR (1) | BR112022023995A2 (ko) |
| CA (1) | CA3180264A1 (ko) |
| IL (1) | IL298373A (ko) |
| MX (1) | MX2022014818A (ko) |
| TW (1) | TW202215051A (ko) |
| WO (1) | WO2021237283A1 (ko) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114214391A (zh) * | 2021-12-14 | 2022-03-22 | 徐州医科大学 | Au/Fe3O4复合的磁纳米马达材料、制备方法及应用 |
| CN117434141A (zh) * | 2023-10-13 | 2024-01-23 | 中国计量科学研究院 | 样品检测方法、装置、计算机设备和存储介质 |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020123079A1 (en) * | 2000-10-20 | 2002-09-05 | Qi Chen | Process for detecting or quantifying a biological rreaction using superparamagnetic label |
| US6825655B2 (en) * | 2001-08-31 | 2004-11-30 | Imego Ab | Method and arrangement for detecting changes of a magnetic response in magnetic particles |
| WO2003067258A1 (fr) * | 2002-01-29 | 2003-08-14 | Asahi Kasei Kabushiki Kaisha | Biocapteur, procede de mesure de molecules magnetiques et procede de mesure de l'objet mesure |
| US7906345B2 (en) * | 2003-11-12 | 2011-03-15 | The Board Of Trustees Of The Leland Stanford Junior University | Magnetic nanoparticles, magnetic detector arrays, and methods for their use in detecting biological molecules |
| JP3962385B2 (ja) * | 2004-03-11 | 2007-08-22 | 株式会社日立製作所 | 免疫検査装置及び免疫検査方法 |
| GB0410980D0 (en) * | 2004-05-17 | 2004-06-16 | Randox Lab Ltd | Magnetic particle detector system and method of performing binding assay |
| WO2006128167A2 (en) * | 2005-05-27 | 2006-11-30 | Board Of Regents, The University Of Texas System | Optical coherence tomographic detection of cells and compositions |
| WO2007010368A1 (en) * | 2005-07-20 | 2007-01-25 | Inverness Medical Switzerland Gmbh | Assay device and method |
| US20070197900A1 (en) * | 2005-11-22 | 2007-08-23 | Vanderbilt University | Magnetic flow cytometer with SQUID microscopy |
| JP4837410B2 (ja) * | 2006-03-22 | 2011-12-14 | 富士フイルム株式会社 | 標的化合物の検出方法 |
| WO2011053435A1 (en) * | 2009-10-05 | 2011-05-05 | Scientific Nanomedicine, Inc. | Cell detection using targeted nanoparticles and magnetic properties thereof |
| JP2012523576A (ja) * | 2009-04-13 | 2012-10-04 | ザ ボード オブ トラスティーズ オブ ザ リーランド スタンフォード ジュニア ユニバーシティ | 試料中の分析物の存在を検出するための方法および装置 |
| US8153442B2 (en) * | 2009-10-21 | 2012-04-10 | Siemens Healthcare Diagnostics Inc. | Stabilization of signal generation in particles used in assays |
| US8927294B2 (en) * | 2009-11-30 | 2015-01-06 | Bio-Rad Laboratories Inc. | Bead reader |
| WO2012012596A2 (en) * | 2010-07-22 | 2012-01-26 | University Of Houston System | Force-induced magnetization contrast for diagnosis and imaging |
| GB201014805D0 (en) * | 2010-09-07 | 2010-10-20 | Multi Sense Technologies Ltd | Microfluidics based assay device |
| US9039992B2 (en) * | 2011-06-06 | 2015-05-26 | Abbott Laboratories | Apparatus for closed tube sampling and open tube sampling for automated clinical analyzers |
| US10802089B2 (en) * | 2015-05-12 | 2020-10-13 | Magarray, Inc. | Devices and methods for increasing magnetic sensor sensitivity |
| WO2017155570A1 (en) * | 2016-03-08 | 2017-09-14 | Magarray, Inc. | Protein and autoantibody biomarkers for the diagnosis and treatment of lung cancer |
| GB201707140D0 (en) * | 2017-05-04 | 2017-06-21 | Oxford Nanopore Tech Ltd | Method |
-
2021
- 2021-05-25 CN CN202180003838.4A patent/CN114341641A/zh active Pending
- 2021-05-25 WO PCT/AU2021/050497 patent/WO2021237283A1/en active Application Filing
- 2021-05-25 MX MX2022014818A patent/MX2022014818A/es unknown
- 2021-05-25 IL IL298373A patent/IL298373A/en unknown
- 2021-05-25 CA CA3180264A patent/CA3180264A1/en active Pending
- 2021-05-25 BR BR112022023995A patent/BR112022023995A2/pt unknown
- 2021-05-25 EP EP21765819.4A patent/EP3938785A4/en active Pending
- 2021-05-25 AU AU2021232687A patent/AU2021232687B2/en active Active
- 2021-05-25 JP JP2023515223A patent/JP2023528687A/ja active Pending
- 2021-05-25 KR KR1020227044248A patent/KR20230013259A/ko active Search and Examination
- 2021-05-26 TW TW110119112A patent/TW202215051A/zh unknown
- 2021-08-31 US US17/462,209 patent/US11604187B2/en active Active
-
2023
- 2023-02-15 US US18/169,445 patent/US20230251249A1/en active Pending
-
2024
- 2024-02-21 AU AU2024201129A patent/AU2024201129A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP3938785A1 (en) | 2022-01-19 |
| WO2021237283A1 (en) | 2021-12-02 |
| CN114341641A (zh) | 2022-04-12 |
| US20230251249A1 (en) | 2023-08-10 |
| AU2024201129A1 (en) | 2024-03-14 |
| BR112022023995A2 (pt) | 2023-02-07 |
| US11604187B2 (en) | 2023-03-14 |
| TW202215051A (zh) | 2022-04-16 |
| AU2021232687B2 (en) | 2023-11-23 |
| EP3938785A4 (en) | 2022-11-30 |
| CA3180264A1 (en) | 2021-12-02 |
| US20220003758A1 (en) | 2022-01-06 |
| MX2022014818A (es) | 2023-04-03 |
| JP2023528687A (ja) | 2023-07-05 |
| IL298373A (en) | 2023-01-01 |
| AU2021232687A1 (en) | 2021-12-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2019252255B2 (en) | Superparamagnetic particle imaging and its applications in quantitative multiplex stationary phase diagnostic assays | |
| Jamshaid et al. | Magnetic particles: From preparation to lab-on-a-chip, biosensors, microsystems and microfluidics applications | |
| US9528995B2 (en) | Systems and methods for high-throughput detection of an analyte in a sample | |
| US20080206104A1 (en) | Accurate Magnetic Biosensor | |
| Dittmer et al. | Sensitive and rapid immunoassay for parathyroid hormone using magnetic particle labels and magnetic actuation | |
| US20230251249A1 (en) | Use of magnetic nanoparticles for the detection and quantitation of analyte(s) | |
| JP2008544246A5 (ko) | ||
| CN101868286A (zh) | 采用磁性传感器进行的分析物检测 | |
| US10571464B2 (en) | Detecting an analyte and determining the concentration of an analyte using magnetizable beads | |
| Sun et al. | Magnetic nanoparticles for magnetoresistance-based biodetection | |
| JP2009020097A (ja) | 生化学的分析方法 | |
| EP3295163B1 (en) | Devices and methods for increasing magnetic sensor sensitivity | |
| Wu et al. | Magnetic Nanoparticle-Based Biosensing | |
| Liang et al. | Magnetoresistive (MR) biosensor | |
| CN118696231A (zh) | 用于检测分析物的设备 | |
| KR20240134877A (ko) | 분석물을 검출하기 위한 장치 | |
| AU2022402592A1 (en) | Apparatus for detecting analytes |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination |