KR20220004640A - 운동이상증 치료 약물 - Google Patents
운동이상증 치료 약물 Download PDFInfo
- Publication number
- KR20220004640A KR20220004640A KR1020217034115A KR20217034115A KR20220004640A KR 20220004640 A KR20220004640 A KR 20220004640A KR 1020217034115 A KR1020217034115 A KR 1020217034115A KR 20217034115 A KR20217034115 A KR 20217034115A KR 20220004640 A KR20220004640 A KR 20220004640A
- Authority
- KR
- South Korea
- Prior art keywords
- levodopa
- tandospiron
- prodrug
- pharmaceutically acceptable
- acceptable salt
- Prior art date
Links
- 208000012661 Dyskinesia Diseases 0.000 title claims abstract description 313
- 238000011282 treatment Methods 0.000 title claims abstract description 37
- 239000003814 drug Substances 0.000 title claims description 112
- 229940079593 drug Drugs 0.000 title claims description 82
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 claims abstract description 276
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 claims abstract description 275
- 229960004502 levodopa Drugs 0.000 claims abstract description 267
- 239000000203 mixture Substances 0.000 claims abstract description 182
- 150000003839 salts Chemical class 0.000 claims abstract description 160
- 239000000651 prodrug Substances 0.000 claims abstract description 142
- 229940002612 prodrug Drugs 0.000 claims abstract description 142
- 238000000034 method Methods 0.000 claims abstract description 88
- 208000018737 Parkinson disease Diseases 0.000 claims abstract description 83
- 238000002560 therapeutic procedure Methods 0.000 claims abstract description 51
- 230000005764 inhibitory process Effects 0.000 claims abstract description 14
- 238000011321 prophylaxis Methods 0.000 claims abstract description 4
- 208000024891 symptom Diseases 0.000 claims description 124
- 238000009472 formulation Methods 0.000 claims description 89
- 239000003795 chemical substances by application Substances 0.000 claims description 51
- 230000006872 improvement Effects 0.000 claims description 39
- 238000007911 parenteral administration Methods 0.000 claims description 33
- 239000008280 blood Substances 0.000 claims description 31
- 210000004369 blood Anatomy 0.000 claims description 31
- 238000007920 subcutaneous administration Methods 0.000 claims description 24
- 230000002265 prevention Effects 0.000 claims description 23
- 230000002503 metabolic effect Effects 0.000 claims description 15
- 239000000853 adhesive Substances 0.000 claims description 13
- 230000001070 adhesive effect Effects 0.000 claims description 13
- 239000003112 inhibitor Substances 0.000 claims description 13
- 102000004190 Enzymes Human genes 0.000 claims description 12
- 108090000790 Enzymes Proteins 0.000 claims description 12
- 230000001976 improved effect Effects 0.000 claims description 12
- 230000035515 penetration Effects 0.000 claims description 12
- 230000002401 inhibitory effect Effects 0.000 claims description 11
- 238000004904 shortening Methods 0.000 claims description 11
- 238000007918 intramuscular administration Methods 0.000 claims description 10
- 230000007012 clinical effect Effects 0.000 claims description 9
- 229940000425 combination drug Drugs 0.000 claims description 8
- 230000004044 response Effects 0.000 claims description 8
- 239000002671 adjuvant Substances 0.000 claims description 7
- 230000006866 deterioration Effects 0.000 claims description 7
- 239000002532 enzyme inhibitor Substances 0.000 claims description 7
- 230000002051 biphasic effect Effects 0.000 claims description 6
- 229940125532 enzyme inhibitor Drugs 0.000 claims description 6
- 230000001629 suppression Effects 0.000 claims description 3
- 229940126585 therapeutic drug Drugs 0.000 abstract description 8
- 239000007924 injection Substances 0.000 description 42
- 238000002347 injection Methods 0.000 description 42
- 238000011156 evaluation Methods 0.000 description 40
- 241000700159 Rattus Species 0.000 description 39
- 239000000243 solution Substances 0.000 description 39
- 230000006399 behavior Effects 0.000 description 33
- 230000000694 effects Effects 0.000 description 32
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 30
- 239000002904 solvent Substances 0.000 description 30
- 239000004480 active ingredient Substances 0.000 description 24
- 238000004519 manufacturing process Methods 0.000 description 23
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 21
- 238000001802 infusion Methods 0.000 description 21
- 238000011552 rat model Methods 0.000 description 21
- -1 dihydroxyphenyl Chemical group 0.000 description 20
- 238000012360 testing method Methods 0.000 description 19
- 238000002360 preparation method Methods 0.000 description 16
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 15
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 14
- MRBFGEHILMYPTF-UHFFFAOYSA-N 1-(2-Pyrimidyl)piperazine Chemical compound C1CNCCN1C1=NC=CC=N1 MRBFGEHILMYPTF-UHFFFAOYSA-N 0.000 description 12
- 230000008859 change Effects 0.000 description 12
- 229940068196 placebo Drugs 0.000 description 12
- 239000000902 placebo Substances 0.000 description 12
- 239000000843 powder Substances 0.000 description 12
- 239000002674 ointment Substances 0.000 description 11
- 239000003960 organic solvent Substances 0.000 description 11
- 150000001875 compounds Chemical class 0.000 description 10
- 210000003491 skin Anatomy 0.000 description 10
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 9
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 9
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 9
- 238000002513 implantation Methods 0.000 description 9
- 230000001965 increasing effect Effects 0.000 description 9
- RAPZEAPATHNIPO-UHFFFAOYSA-N risperidone Chemical compound FC1=CC=C2C(C3CCN(CC3)CCC=3C(=O)N4CCCCC4=NC=3C)=NOC2=C1 RAPZEAPATHNIPO-UHFFFAOYSA-N 0.000 description 9
- 239000012790 adhesive layer Substances 0.000 description 8
- 238000003745 diagnosis Methods 0.000 description 8
- 238000002156 mixing Methods 0.000 description 8
- DIVDFFZHCJEHGG-UHFFFAOYSA-N oxidopamine Chemical compound NCCC1=CC(O)=C(O)C=C1O DIVDFFZHCJEHGG-UHFFFAOYSA-N 0.000 description 8
- 230000002459 sustained effect Effects 0.000 description 8
- 238000010998 test method Methods 0.000 description 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 7
- 230000009471 action Effects 0.000 description 7
- 239000000654 additive Substances 0.000 description 7
- 210000004556 brain Anatomy 0.000 description 7
- 229960004205 carbidopa Drugs 0.000 description 7
- TZFNLOMSOLWIDK-JTQLQIEISA-N carbidopa (anhydrous) Chemical compound NN[C@@](C(O)=O)(C)CC1=CC=C(O)C(O)=C1 TZFNLOMSOLWIDK-JTQLQIEISA-N 0.000 description 7
- 238000011049 filling Methods 0.000 description 7
- 229930195733 hydrocarbon Natural products 0.000 description 7
- 150000002430 hydrocarbons Chemical class 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 230000017311 musculoskeletal movement, spinal reflex action Effects 0.000 description 7
- 230000003204 osmotic effect Effects 0.000 description 7
- 238000013519 translation Methods 0.000 description 7
- 230000014616 translation Effects 0.000 description 7
- 239000004215 Carbon black (E152) Substances 0.000 description 6
- 238000010521 absorption reaction Methods 0.000 description 6
- 230000037396 body weight Effects 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 229960003638 dopamine Drugs 0.000 description 6
- 150000002148 esters Chemical class 0.000 description 6
- 230000005713 exacerbation Effects 0.000 description 6
- 210000003414 extremity Anatomy 0.000 description 6
- 229940057995 liquid paraffin Drugs 0.000 description 6
- 239000003921 oil Substances 0.000 description 6
- 239000008194 pharmaceutical composition Substances 0.000 description 6
- 239000007921 spray Substances 0.000 description 6
- 238000010254 subcutaneous injection Methods 0.000 description 6
- 239000007929 subcutaneous injection Substances 0.000 description 6
- 238000000585 Mann–Whitney U test Methods 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 201000010099 disease Diseases 0.000 description 5
- 239000002207 metabolite Substances 0.000 description 5
- 230000036470 plasma concentration Effects 0.000 description 5
- 239000011347 resin Substances 0.000 description 5
- 229920005989 resin Polymers 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 5
- 239000004094 surface-active agent Substances 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 239000001993 wax Substances 0.000 description 5
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- 210000001015 abdomen Anatomy 0.000 description 4
- 230000000996 additive effect Effects 0.000 description 4
- 239000006071 cream Substances 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 235000014113 dietary fatty acids Nutrition 0.000 description 4
- NULMGOSOSZBEQL-QMMMGPOBSA-N etilevodopa Chemical compound CCOC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 NULMGOSOSZBEQL-QMMMGPOBSA-N 0.000 description 4
- 239000000194 fatty acid Substances 0.000 description 4
- 229930195729 fatty acid Natural products 0.000 description 4
- 239000000499 gel Substances 0.000 description 4
- 238000010438 heat treatment Methods 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 239000000546 pharmaceutical excipient Substances 0.000 description 4
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 4
- 210000000434 stratum corneum Anatomy 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- 239000008215 water for injection Substances 0.000 description 4
- 101710138638 5-hydroxytryptamine receptor 1A Proteins 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 208000015592 Involuntary movements Diseases 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 3
- 206010044565 Tremor Diseases 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 208000024453 abnormal involuntary movement Diseases 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 229960004046 apomorphine Drugs 0.000 description 3
- VMWNQDUVQKEIOC-CYBMUJFWSA-N apomorphine Chemical compound C([C@H]1N(C)CC2)C3=CC=C(O)C(O)=C3C3=C1C2=CC=C3 VMWNQDUVQKEIOC-CYBMUJFWSA-N 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 239000004359 castor oil Substances 0.000 description 3
- 235000019438 castor oil Nutrition 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N dodecahydrosqualene Natural products CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 229960001820 etilevodopa Drugs 0.000 description 3
- 238000004299 exfoliation Methods 0.000 description 3
- 230000001747 exhibiting effect Effects 0.000 description 3
- 239000003925 fat Substances 0.000 description 3
- 235000019197 fats Nutrition 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 3
- 230000007774 longterm Effects 0.000 description 3
- 238000012423 maintenance Methods 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 239000006072 paste Substances 0.000 description 3
- 230000002688 persistence Effects 0.000 description 3
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical group CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 3
- 229940001089 sinemet Drugs 0.000 description 3
- 239000012086 standard solution Substances 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 238000013268 sustained release Methods 0.000 description 3
- 239000012730 sustained-release form Substances 0.000 description 3
- 229920002725 thermoplastic elastomer Polymers 0.000 description 3
- GBLRQXKSCRCLBZ-YVQAASCFSA-N (1R,2S,1'R,2'S)-doxacurium Chemical compound COC1=C(OC)C(OC)=CC(C[C@H]2[N@+](CCC3=C2C(=C(OC)C(OC)=C3)OC)(C)CCCOC(=O)CCC(=O)OCCC[N@@+]2(C)[C@@H](C3=C(OC)C(OC)=C(OC)C=C3CC2)CC=2C=C(OC)C(OC)=C(OC)C=2)=C1 GBLRQXKSCRCLBZ-YVQAASCFSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- 102100022738 5-hydroxytryptamine receptor 1A Human genes 0.000 description 2
- ACVFJYKNBOHIMH-DPFKZJTMSA-N 99095-10-0 Chemical compound Cl.O=C([C@H]1[C@@H](C2=O)[C@]3([H])CC[C@]1(C3)[H])N2CCCCN(CC1)CCN1C1=NC=CC=N1 ACVFJYKNBOHIMH-DPFKZJTMSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 2
- 239000005695 Ammonium acetate Substances 0.000 description 2
- 102000006378 Catechol O-methyltransferase Human genes 0.000 description 2
- 108020002739 Catechol O-methyltransferase Proteins 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 102000017911 HTR1A Human genes 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 2
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 102000010909 Monoamine Oxidase Human genes 0.000 description 2
- 108010062431 Monoamine oxidase Proteins 0.000 description 2
- 229940123685 Monoamine oxidase inhibitor Drugs 0.000 description 2
- 208000016285 Movement disease Diseases 0.000 description 2
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 2
- 206010029333 Neurosis Diseases 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- QOSMNYMQXIVWKY-UHFFFAOYSA-N Propyl levulinate Chemical compound CCCOC(=O)CCC(C)=O QOSMNYMQXIVWKY-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 2
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 2
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 2
- 239000003522 acrylic cement Substances 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 229960003805 amantadine Drugs 0.000 description 2
- DKNWSYNQZKUICI-UHFFFAOYSA-N amantadine Chemical compound C1C(C2)CC3CC2CC1(N)C3 DKNWSYNQZKUICI-UHFFFAOYSA-N 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 229940043376 ammonium acetate Drugs 0.000 description 2
- 235000019257 ammonium acetate Nutrition 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 229940035678 anti-parkinson drug Drugs 0.000 description 2
- 229940125713 antianxiety drug Drugs 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- HUXSAESWQBPYHL-UHFFFAOYSA-N azecane-2,10-dione Chemical compound O=C1CCCCCCCC(=O)N1 HUXSAESWQBPYHL-UHFFFAOYSA-N 0.000 description 2
- 230000003542 behavioural effect Effects 0.000 description 2
- BNQDCRGUHNALGH-UHFFFAOYSA-N benserazide Chemical compound OCC(N)C(=O)NNCC1=CC=C(O)C(O)=C1O BNQDCRGUHNALGH-UHFFFAOYSA-N 0.000 description 2
- IIBYAHWJQTYFKB-UHFFFAOYSA-N bezafibrate Chemical compound C1=CC(OC(C)(C)C(O)=O)=CC=C1CCNC(=O)C1=CC=C(Cl)C=C1 IIBYAHWJQTYFKB-UHFFFAOYSA-N 0.000 description 2
- 229960000516 bezafibrate Drugs 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical group OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- PAFZNILMFXTMIY-UHFFFAOYSA-N cyclohexylamine Chemical compound NC1CCCCC1 PAFZNILMFXTMIY-UHFFFAOYSA-N 0.000 description 2
- 239000003954 decarboxylase inhibitor Substances 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 2
- 239000000534 dopa decarboxylase inhibitor Substances 0.000 description 2
- 230000007977 dopaminergic denervation Effects 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 229920001971 elastomer Polymers 0.000 description 2
- 239000000806 elastomer Substances 0.000 description 2
- 230000001804 emulsifying effect Effects 0.000 description 2
- JRURYQJSLYLRLN-BJMVGYQFSA-N entacapone Chemical compound CCN(CC)C(=O)C(\C#N)=C\C1=CC(O)=C(O)C([N+]([O-])=O)=C1 JRURYQJSLYLRLN-BJMVGYQFSA-N 0.000 description 2
- 229960003337 entacapone Drugs 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 229960002725 isoflurane Drugs 0.000 description 2
- 238000004898 kneading Methods 0.000 description 2
- 230000033001 locomotion Effects 0.000 description 2
- 239000006210 lotion Substances 0.000 description 2
- 229920002521 macromolecule Polymers 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 239000004005 microsphere Substances 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 239000002899 monoamine oxidase inhibitor Substances 0.000 description 2
- 210000004400 mucous membrane Anatomy 0.000 description 2
- 208000015238 neurotic disease Diseases 0.000 description 2
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 239000003961 penetration enhancing agent Substances 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 230000004962 physiological condition Effects 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920000259 polyoxyethylene lauryl ether Polymers 0.000 description 2
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 229940068968 polysorbate 80 Drugs 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- XOJVVFBFDXDTEG-UHFFFAOYSA-N pristane Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)C XOJVVFBFDXDTEG-UHFFFAOYSA-N 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 229940043274 prophylactic drug Drugs 0.000 description 2
- 239000008213 purified water Substances 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 229930195734 saturated hydrocarbon Natural products 0.000 description 2
- 229960003946 selegiline Drugs 0.000 description 2
- MEZLKOACVSPNER-GFCCVEGCSA-N selegiline Chemical compound C#CCN(C)[C@H](C)CC1=CC=CC=C1 MEZLKOACVSPNER-GFCCVEGCSA-N 0.000 description 2
- 229940076279 serotonin Drugs 0.000 description 2
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 230000001954 sterilising effect Effects 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 229940095064 tartrate Drugs 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 239000006211 transdermal dosage form Substances 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- XZVHHLNLLVICFA-SNVBAGLBSA-N α-difluoromethyl-dopa Chemical compound FC(F)[C@](C(O)=O)(N)CC1=CC=C(O)C(O)=C1 XZVHHLNLLVICFA-SNVBAGLBSA-N 0.000 description 2
- IVTMXOXVAHXCHI-YXLMWLKOSA-N (2s)-2-amino-3-(3,4-dihydroxyphenyl)propanoic acid;(2s)-3-(3,4-dihydroxyphenyl)-2-hydrazinyl-2-methylpropanoic acid Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1.NN[C@@](C(O)=O)(C)CC1=CC=C(O)C(O)=C1 IVTMXOXVAHXCHI-YXLMWLKOSA-N 0.000 description 1
- QXWYKJLNLSIPIN-YUMQZZPRSA-N (2s,3s)-2-azaniumyl-3-(3,4-dihydroxyphenyl)-3-hydroxypropanoate Chemical compound [O-]C(=O)[C@@H]([NH3+])[C@@H](O)C1=CC=C(O)C(O)=C1 QXWYKJLNLSIPIN-YUMQZZPRSA-N 0.000 description 1
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 description 1
- NWLPAIVRIWBEIT-SEPHDYHBSA-N (e)-but-2-enedioic acid;dihydrate Chemical compound O.O.OC(=O)\C=C\C(O)=O NWLPAIVRIWBEIT-SEPHDYHBSA-N 0.000 description 1
- KPAPHODVWOVUJL-UHFFFAOYSA-N 1-benzofuran;1h-indene Chemical compound C1=CC=C2CC=CC2=C1.C1=CC=C2OC=CC2=C1 KPAPHODVWOVUJL-UHFFFAOYSA-N 0.000 description 1
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical compound CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 description 1
- DHSSDEDRBUKTQY-UHFFFAOYSA-N 6-prop-2-enyl-4,5,7,8-tetrahydrothiazolo[4,5-d]azepin-2-amine Chemical compound C1CN(CC=C)CCC2=C1N=C(N)S2 DHSSDEDRBUKTQY-UHFFFAOYSA-N 0.000 description 1
- RSWGJHLUYNHPMX-UHFFFAOYSA-N Abietic-Saeure Natural products C12CCC(C(C)C)=CC2=CCC2C1(C)CCCC2(C)C(O)=O RSWGJHLUYNHPMX-UHFFFAOYSA-N 0.000 description 1
- 244000291564 Allium cepa Species 0.000 description 1
- 235000002732 Allium cepa var. cepa Nutrition 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 1
- KORNTPPJEAJQIU-KJXAQDMKSA-N Cabaser Chemical compound C1=CC([C@H]2C[C@H](CN(CC=C)[C@@H]2C2)C(=O)N(CCCN(C)C)C(=O)NCC)=C3C2=CNC3=C1 KORNTPPJEAJQIU-KJXAQDMKSA-N 0.000 description 1
- 206010008748 Chorea Diseases 0.000 description 1
- 229940081615 DOPA decarboxylase inhibitor Drugs 0.000 description 1
- 101150049660 DRD2 gene Proteins 0.000 description 1
- 229940123736 Decarboxylase inhibitor Drugs 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- 208000014094 Dystonic disease Diseases 0.000 description 1
- JOYRKODLDBILNP-UHFFFAOYSA-N Ethyl urethane Chemical compound CCOC(N)=O JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 1
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 1
- CTKXFMQHOOWWEB-UHFFFAOYSA-N Ethylene oxide/propylene oxide copolymer Chemical compound CCCOC(C)COCCO CTKXFMQHOOWWEB-UHFFFAOYSA-N 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 101150015707 HTR1A gene Proteins 0.000 description 1
- 239000013032 Hydrocarbon resin Substances 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 239000004166 Lanolin Substances 0.000 description 1
- 239000005639 Lauric acid Substances 0.000 description 1
- OYHQOLUKZRVURQ-HZJYTTRNSA-N Linoleic acid Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(O)=O OYHQOLUKZRVURQ-HZJYTTRNSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 208000037490 Medically Unexplained Symptoms Diseases 0.000 description 1
- 208000008238 Muscle Spasticity Diseases 0.000 description 1
- 206010052904 Musculoskeletal stiffness Diseases 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 102000004108 Neurotransmitter Receptors Human genes 0.000 description 1
- 108090000590 Neurotransmitter Receptors Proteins 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 208000027089 Parkinsonian disease Diseases 0.000 description 1
- 206010034010 Parkinsonism Diseases 0.000 description 1
- 239000004264 Petrolatum Substances 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 208000001431 Psychomotor Agitation Diseases 0.000 description 1
- 208000035755 Psychosomatic disease Diseases 0.000 description 1
- 206010038743 Restlessness Diseases 0.000 description 1
- KHPCPRHQVVSZAH-HUOMCSJISA-N Rosin Natural products O(C/C=C/c1ccccc1)[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 KHPCPRHQVVSZAH-HUOMCSJISA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 1
- HWHLPVGTWGOCJO-UHFFFAOYSA-N Trihexyphenidyl Chemical group C1CCCCC1C(C=1C=CC=CC=1)(O)CCN1CCCCC1 HWHLPVGTWGOCJO-UHFFFAOYSA-N 0.000 description 1
- AMHPTVWBZSYFSS-BZUAXINKSA-N [(1r,3r,5r)-6,6,9-trimethyl-9-azabicyclo[3.3.1]nonan-3-yl] 2-hydroxy-2,2-dithiophen-2-ylacetate Chemical compound O([C@H]1C[C@@H]2C(C)(C)CC[C@H](C1)N2C)C(=O)C(O)(C=1SC=CC=1)C1=CC=CS1 AMHPTVWBZSYFSS-BZUAXINKSA-N 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000002390 adhesive tape Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 125000002723 alicyclic group Chemical group 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 102000003802 alpha-Synuclein Human genes 0.000 description 1
- 108090000185 alpha-Synuclein Proteins 0.000 description 1
- CJCSPKMFHVPWAR-JTQLQIEISA-N alpha-methyl-L-dopa Chemical compound OC(=O)[C@](N)(C)CC1=CC=C(O)C(O)=C1 CJCSPKMFHVPWAR-JTQLQIEISA-N 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 230000001668 ameliorated effect Effects 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 230000000049 anti-anxiety effect Effects 0.000 description 1
- 230000001078 anti-cholinergic effect Effects 0.000 description 1
- 230000000648 anti-parkinson Effects 0.000 description 1
- 230000000561 anti-psychotic effect Effects 0.000 description 1
- 239000000939 antiparkinson agent Substances 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 239000002249 anxiolytic agent Substances 0.000 description 1
- 230000000949 anxiolytic effect Effects 0.000 description 1
- 239000000010 aprotic solvent Substances 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 229940090047 auto-injector Drugs 0.000 description 1
- 159000000009 barium salts Chemical class 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 229960000911 benserazide Drugs 0.000 description 1
- 229960001335 benserazide hydrochloride Drugs 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- YSXKPIUOCJLQIE-UHFFFAOYSA-N biperiden Chemical compound C1C(C=C2)CC2C1C(C=1C=CC=CC=1)(O)CCN1CCCCC1 YSXKPIUOCJLQIE-UHFFFAOYSA-N 0.000 description 1
- 229960003003 biperiden Drugs 0.000 description 1
- 239000012496 blank sample Substances 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- 229960002802 bromocriptine Drugs 0.000 description 1
- OZVBMTJYIDMWIL-AYFBDAFISA-N bromocriptine Chemical compound C1=CC(C=2[C@H](N(C)C[C@@H](C=2)C(=O)N[C@]2(C(=O)N3[C@H](C(N4CCC[C@H]4[C@]3(O)O2)=O)CC(C)C)C(C)C)C2)=C3C2=C(Br)NC3=C1 OZVBMTJYIDMWIL-AYFBDAFISA-N 0.000 description 1
- 239000004067 bulking agent Substances 0.000 description 1
- 239000001273 butane Substances 0.000 description 1
- AZDOLIXTFBPILY-UHFFFAOYSA-N butanedioic acid;dihydrate Chemical compound O.O.OC(=O)CCC(O)=O AZDOLIXTFBPILY-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229960004596 cabergoline Drugs 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 239000000378 calcium silicate Substances 0.000 description 1
- 229910052918 calcium silicate Inorganic materials 0.000 description 1
- OYACROKNLOSFPA-UHFFFAOYSA-N calcium;dioxido(oxo)silane Chemical compound [Ca+2].[O-][Si]([O-])=O OYACROKNLOSFPA-UHFFFAOYSA-N 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 150000005827 chlorofluoro hydrocarbons Chemical class 0.000 description 1
- 208000012601 choreatic disease Diseases 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 238000001723 curing Methods 0.000 description 1
- 238000011461 current therapy Methods 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 229960003829 desipramine hydrochloride Drugs 0.000 description 1
- XAEWZDYWZHIUCT-UHFFFAOYSA-N desipramine hydrochloride Chemical compound [H+].[Cl-].C1CC2=CC=CC=C2N(CCCNC)C2=CC=CC=C21 XAEWZDYWZHIUCT-UHFFFAOYSA-N 0.000 description 1
- 230000002542 deteriorative effect Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000007599 discharging Methods 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000002224 dissection Methods 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- OJLOUXPPKZRTHK-UHFFFAOYSA-N dodecan-1-ol;sodium Chemical compound [Na].CCCCCCCCCCCCO OJLOUXPPKZRTHK-UHFFFAOYSA-N 0.000 description 1
- 229940052760 dopamine agonists Drugs 0.000 description 1
- 239000003136 dopamine receptor stimulating agent Substances 0.000 description 1
- 210000005064 dopaminergic neuron Anatomy 0.000 description 1
- 229960001104 droxidopa Drugs 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 208000010118 dystonia Diseases 0.000 description 1
- 238000001227 electron beam curing Methods 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 230000003090 exacerbative effect Effects 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 210000003194 forelimb Anatomy 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 238000002695 general anesthesia Methods 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 239000010440 gypsum Substances 0.000 description 1
- 229910052602 gypsum Inorganic materials 0.000 description 1
- 210000004209 hair Anatomy 0.000 description 1
- 229960003878 haloperidol Drugs 0.000 description 1
- 210000004247 hand Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 238000007757 hot melt coating Methods 0.000 description 1
- 229920006270 hydrocarbon resin Polymers 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003983 inhalation anesthetic agent Substances 0.000 description 1
- 239000003999 initiator Substances 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000000752 ionisation method Methods 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000005001 laminate film Substances 0.000 description 1
- 229940039717 lanolin Drugs 0.000 description 1
- 235000019388 lanolin Nutrition 0.000 description 1
- 239000000865 liniment Substances 0.000 description 1
- 235000020778 linoleic acid Nutrition 0.000 description 1
- OYHQOLUKZRVURQ-IXWMQOLASA-N linoleic acid Natural products CCCCC\C=C/C\C=C\CCCCCCCC(O)=O OYHQOLUKZRVURQ-IXWMQOLASA-N 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 230000003137 locomotive effect Effects 0.000 description 1
- 208000018883 loss of balance Diseases 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 239000012931 lyophilized formulation Substances 0.000 description 1
- 229960003511 macrogol Drugs 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 238000009115 maintenance therapy Methods 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229960000219 mazaticol Drugs 0.000 description 1
- 238000000691 measurement method Methods 0.000 description 1
- XBBDACCLCFWBSI-ZETCQYMHSA-N melevodopa Chemical compound COC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 XBBDACCLCFWBSI-ZETCQYMHSA-N 0.000 description 1
- 229960001794 melevodopa Drugs 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- WFGNJLMSYIJWII-FJXQXJEOSA-N methyl (2s)-2-amino-3-(3,4-dihydroxyphenyl)propanoate;hydrochloride Chemical compound Cl.COC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WFGNJLMSYIJWII-FJXQXJEOSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 238000002552 multiple reaction monitoring Methods 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 229940105132 myristate Drugs 0.000 description 1
- DUWWHGPELOTTOE-UHFFFAOYSA-N n-(5-chloro-2,4-dimethoxyphenyl)-3-oxobutanamide Chemical compound COC1=CC(OC)=C(NC(=O)CC(C)=O)C=C1Cl DUWWHGPELOTTOE-UHFFFAOYSA-N 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- JXTPJDDICSTXJX-UHFFFAOYSA-N n-Triacontane Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCC JXTPJDDICSTXJX-UHFFFAOYSA-N 0.000 description 1
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 1
- GOQYKNQRPGWPLP-UHFFFAOYSA-N n-heptadecyl alcohol Natural products CCCCCCCCCCCCCCCCCO GOQYKNQRPGWPLP-UHFFFAOYSA-N 0.000 description 1
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-M octanoate Chemical compound CCCCCCCC([O-])=O WWZKQHOCKIZLMA-UHFFFAOYSA-M 0.000 description 1
- 230000009965 odorless effect Effects 0.000 description 1
- 229920006285 olefinic elastomer Polymers 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 229960004851 pergolide Drugs 0.000 description 1
- YEHCICAEULNIGD-MZMPZRCHSA-N pergolide Chemical compound C1=CC([C@H]2C[C@@H](CSC)CN([C@@H]2C2)CCC)=C3C2=CNC3=C1 YEHCICAEULNIGD-MZMPZRCHSA-N 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 229940066842 petrolatum Drugs 0.000 description 1
- 235000019271 petrolatum Nutrition 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000005011 phenolic resin Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- XNGIFLGASWRNHJ-UHFFFAOYSA-L phthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC=C1C([O-])=O XNGIFLGASWRNHJ-UHFFFAOYSA-L 0.000 description 1
- 239000010773 plant oil Substances 0.000 description 1
- 229920001993 poloxamer 188 Polymers 0.000 description 1
- 229940044519 poloxamer 188 Drugs 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229940068977 polysorbate 20 Drugs 0.000 description 1
- 150000003097 polyterpenes Chemical class 0.000 description 1
- 239000004810 polytetrafluoroethylene Substances 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 230000001144 postural effect Effects 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 238000000634 powder X-ray diffraction Methods 0.000 description 1
- 229960003089 pramipexole Drugs 0.000 description 1
- FASDKYOPVNHBLU-ZETCQYMHSA-N pramipexole Chemical compound C1[C@@H](NCCC)CCC2=C1SC(N)=N2 FASDKYOPVNHBLU-ZETCQYMHSA-N 0.000 description 1
- 238000007781 pre-processing Methods 0.000 description 1
- 229940071643 prefilled syringe Drugs 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- AMLFJZRZIOZGPW-UHFFFAOYSA-N prop-1-en-1-amine Chemical compound CC=CN AMLFJZRZIOZGPW-UHFFFAOYSA-N 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- YXKPMPXNTYMMKQ-VIFPVBQESA-N propyl (2s)-2-amino-3-(3,4-dihydroxyphenyl)propanoate Chemical compound CCCOC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 YXKPMPXNTYMMKQ-VIFPVBQESA-N 0.000 description 1
- 210000004129 prosencephalon Anatomy 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 229960000245 rasagiline Drugs 0.000 description 1
- RUOKEQAAGRXIBM-GFCCVEGCSA-N rasagiline Chemical compound C1=CC=C2[C@H](NCC#C)CCC2=C1 RUOKEQAAGRXIBM-GFCCVEGCSA-N 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 229960001879 ropinirole Drugs 0.000 description 1
- UHSKFQJFRQCDBE-UHFFFAOYSA-N ropinirole Chemical compound CCCN(CCC)CCC1=CC=CC2=C1CC(=O)N2 UHSKFQJFRQCDBE-UHFFFAOYSA-N 0.000 description 1
- 229960003179 rotigotine Drugs 0.000 description 1
- KFQYTPMOWPVWEJ-INIZCTEOSA-N rotigotine Chemical compound CCCN([C@@H]1CC2=CC=CC(O)=C2CC1)CCC1=CC=CS1 KFQYTPMOWPVWEJ-INIZCTEOSA-N 0.000 description 1
- NEMGRZFTLSKBAP-LBPRGKRZSA-N safinamide Chemical compound C1=CC(CN[C@@H](C)C(N)=O)=CC=C1OCC1=CC=CC(F)=C1 NEMGRZFTLSKBAP-LBPRGKRZSA-N 0.000 description 1
- 229950002652 safinamide Drugs 0.000 description 1
- 150000003873 salicylate salts Chemical class 0.000 description 1
- 201000000980 schizophrenia Diseases 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 230000000862 serotonergic effect Effects 0.000 description 1
- 210000003625 skull Anatomy 0.000 description 1
- 208000019116 sleep disease Diseases 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 208000018198 spasticity Diseases 0.000 description 1
- 239000012177 spermaceti Substances 0.000 description 1
- 229940084106 spermaceti Drugs 0.000 description 1
- 229940032094 squalane Drugs 0.000 description 1
- 229940031439 squalene Drugs 0.000 description 1
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 210000003523 substantia nigra Anatomy 0.000 description 1
- 150000003900 succinic acid esters Chemical class 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 229950008418 talipexole Drugs 0.000 description 1
- 229950000505 tandospirone Drugs 0.000 description 1
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 1
- TUNFSRHWOTWDNC-UHFFFAOYSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCCC(O)=O TUNFSRHWOTWDNC-UHFFFAOYSA-N 0.000 description 1
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- KHPCPRHQVVSZAH-UHFFFAOYSA-N trans-cinnamyl beta-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OCC=CC1=CC=CC=C1 KHPCPRHQVVSZAH-UHFFFAOYSA-N 0.000 description 1
- 229960001032 trihexyphenidyl Drugs 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 229930195735 unsaturated hydrocarbon Natural products 0.000 description 1
- 235000019871 vegetable fat Nutrition 0.000 description 1
- 230000003313 weakening effect Effects 0.000 description 1
- 210000000707 wrist Anatomy 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
- UBQNRHZMVUUOMG-UHFFFAOYSA-N zonisamide Chemical compound C1=CC=C2C(CS(=O)(=O)N)=NOC2=C1 UBQNRHZMVUUOMG-UHFFFAOYSA-N 0.000 description 1
- 229960002911 zonisamide Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
- A61K31/198—Alpha-amino acids, e.g. alanine or edetic acid [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4015—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil having oxo groups directly attached to the heterocyclic ring, e.g. piracetam, ethosuximide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7023—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7023—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms
- A61K9/703—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms characterised by shape or structure; Details concerning release liner or backing; Refillable patches; User-activated patches
- A61K9/7038—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer
- A61K9/7046—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds
- A61K9/7053—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds obtained by reactions only involving carbon to carbon unsaturated bonds, e.g. polyvinyl, polyisobutylene, polystyrene
- A61K9/7061—Polyacrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Dermatology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Psychology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
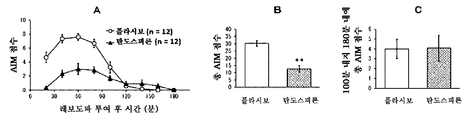
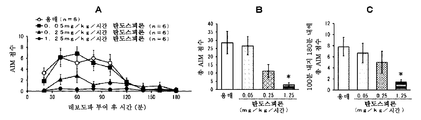
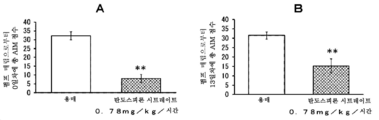
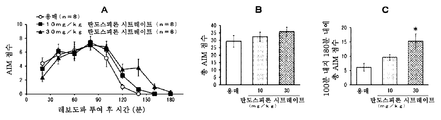
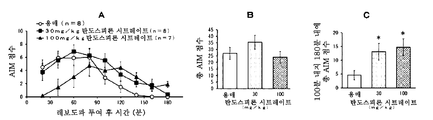
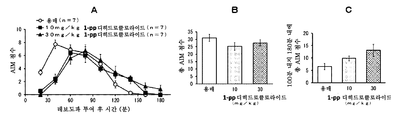
본 발명은 파킨슨병에서의 레보도파 유발 운동이상증에 유용한 치료 약물을 제공한다. 특히, 본 발명은 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증, 특히 레보도파 유발 운동이상증 (PD-LID)의 치료, 개선, 진행 억제, 또는 예방을 위한 조성물 및 방법이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 조성물 및 방법을 제공한다.
Description
본 발명은 활성 성분으로서 의약으로서 유용한 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 비경구 투여 (예를 들어, 경피 투여)에 의해 파킨슨병에서의 레보도파 유발 운동이상증을 치료하기 위한 제제에 관한 것이다.
파킨슨병은 추체외로 기능 이상의 주 증상을 가진 진행성 신경퇴행성 질환이다. 병리학적으로, 흑색질 치밀부에서 도파민성 뉴런의 소실 및 알파-시누클레인 침착이 관찰된다. 임상적으로, 다양한 운동 증상 예컨대 운동장애, 진전, 경직, 및 자세 반사의 소실이 나타난다.
파킨슨병 요법은 근본적으로 뇌내 도파민을 보충하기 위한 약물 요법이다. 도파민 전구체인 레보도파 (L-dopa)를 포함하는 약물은 파킨슨병의 초기 요법을 위한 제1선의 치료 약물로서 사용된다. 그러나, 파킨슨병 레보도파 유발 운동이상증 (이하에, "PD-LID"라고도 함)과 같은 운동 합병증은 병적 상태가 진행되면서 레보도파 요법을 받는 거의 모든 환자에서 나타난다.
초기 레보도파 요법 후 5년 내에 PD-LID가 발생하는 빈도는 30 내지 50%이다. 빈도는 병적 상태의 진행에 따라 증가하며 초기 요법 후 10년 내에 50 내지 100%에 도달한다. 피크-용량 운동이상증은 혈중 레보도파 농도가 높을 때 얼굴, 혀, 목, 팔다리, 몸통 등에 나타나는 불수의 운동인 PD-LID의 대표적인 증상으로서 공지되어 있다.
특허문헌 1 [일본공개공보 번호 11-228414]은 경피 흡수 탄도스피론 작용제에 대한 개시내용을 갖는다.
본 발명자들은 근면하게 연구한 결과, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 비경구 투여 (예를 들어, 경피 투여, 피내 투여, 피하 투여, 근육내 투여 등)함으로써, 경구 투여와 비교하여, 파킨슨병 레보도파 유발 운동이상증 (PD-LID) 등의 개선 효과가 높은 치료, 개선, 진행 억제, 또는 예방에 유용한 기술을 제공할 수 있음을 발견하였다. 본 발명은 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, PD-LID 개선용 경피 투여 제약 조성물, 및 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함한 비경구 투여에 의한 파킨슨병의 운동 합병증의 치료, 개선, 진행 억제, 및 예방 방법을 제공한다.
구체적으로, 본 발명은 다음을 포함한다.
(항 1)
탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증의 치료, 개선, 진행 억제, 또는 예방을 위한 조성물이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 조성물.
(항 2)
항 1에 있어서, 비경구 투여가 경피 투여, 피내 투여, 피하 투여, 근육내 투여, 및 그의 조합으로부터 선택된 것인 조성물.
(항 3)
항 1 또는 항 2에 있어서, 비경구 투여가 지속성을 갖거나 지속가능하게 투여되는 것인 조성물.
(항 4)
항 1 내지 항 3 중 어느 한 항에 있어서, 비경구 투여가 경피 투여를 포함하는 것인 조성물.
(항 5)
항 1 내지 항 4 중 어느 한 항에 있어서, 운동 합병증이 레보도파 유발 운동이상증 (PD-LID)을 포함하는 것인 조성물.
(항 6)
탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증의 치료, 개선, 또는 예방을 위한 조성물이며, 여기서 레보도파 유발 운동이상증 (PD-LID)이 반동 증상을 발생시키지 않고 개선되고, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 경피 투여되는 것인 조성물.
(항 7)
항 1 내지 항 6 중 어느 한 항에 있어서, 레보도파 유발 운동이상증 (PD-LID)이 피크-용량 운동이상증, 2상성 운동이상증, 및 그의 조합을 포함하는 것인 조성물.
(항 8)
항 1 내지 항 7 중 어느 한 항에 있어서, 운동 합병증의 치료, 개선, 진행 억제, 또는 예방이 레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축, 또는 그의 조합을 포함하는 것인 조성물.
(항 9)
탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축, 또는 그의 조합을 달성하기 위한 조성물이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 조성물.
(항 10)
항 9에 있어서, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선이 임상적으로 유의한 개선 이상인 조성물.
(항 11)
항 9 또는 항 10에 있어서, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선이 임상 효과를 달성하기에 충분한 수준까지인 것인 조성물.
(항 12)
항 9 내지 항 11 중 어느 한 항에 있어서, 경피 투여 제제인 조성물.
(항 13)
항 9 내지 항 12 중 어느 한 항에 있어서, 접착제 제제인 조성물.
(항 14)
항 9 내지 항 13 중 어느 한 항에 있어서, 경피 투여 제제가 테이프/패치인 조성물.
(항 15)
항 9 내지 항 14 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 약물 투여량이 탄도스피론의 유리 형태로서 1일 0.1 내지 100 mg인 조성물.
(항 16)
항 9 내지 항 15 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물에 대한 약물 침투의 양이 탄도스피론의 유리 형태로서 1일 0.1 내지 20 mg인 조성물.
(항 17)
항 9 내지 항 16 중 어느 한 항에 있어서, 조성물이 경피 투여 제제이고, 용량당 총 적용 면적이 1 내지 100 cm2인 조성물.
(항 18)
항 9 내지 항 17 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 인간 혈중 (혈장) 탄도스피론 농도가 1일 12시간 이상 동안 0.05 내지 20 ng/mL가 되도록 투여되는 것인 조성물.
(항 19)
항 9 내지 항 18 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 인간 혈중 (혈장) 탄도스피론 농도가 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 투여 후 8 내지 16시간 동안 0.05 내지 20 ng/mL가 되도록 투여되는 것인 조성물.
(항 20)
항 9 내지 항 19 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 레보도파의 보조약인 조성물.
(항 21)
항 9 내지 항 20 중 어느 한 항에 있어서, 고정-용량 조합으로서 레보도파와 함께 또는 별도의 제제로서 공동으로 사용되는 조성물.
(항 22)
탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물과 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제의 조합을 포함하는, PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 의약이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 의약.
(항 23)
탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 의약이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제와 조합하여 투여되며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 의약.
(항 24)
(1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제를 포함하는, PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 의약이며, 여기서 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제가 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물과 조합하여 투여되며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 의약.
(항 25)
탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 운동이상증을 가진 파킨슨병 환자의 레보도파 요법에 대한 반응의 질 악화를 개선하기 위한 조성물이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 조성물.
(항 26)
항 25에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 탄도스피론의 유리 형태인 의약 또는 조성물.
(항 1A)
유효량의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 대상체에게 비경구 투여하는 것을 포함하는, 파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증을 치료, 개선, 또는 예방하는 방법.
(항 2A)
항 1A에 있어서, 비경구 투여가 경피 투여, 피내 투여, 피하 투여, 근육내 투여, 및 그의 조합으로부터 선택된 것인 방법.
(항 3A)
항 1A 또는 항 2A에 있어서, 비경구 투여가 지속성을 갖거나 지속가능하게 투여되는 것인 방법.
(항 4A)
항 1A 내지 항 3A 중 어느 한 항에 있어서, 비경구 투여가 경피 투여를 포함하는 것인 방법.
(항 5A)
항 1A 내지 항 4A 중 어느 한 항에 있어서, 운동 합병증이 레보도파 유발 운동이상증 (PD-LID)을 포함하는 것인 방법.
(항 6A)
레보도파 유발 운동이상증 (PD-LID)이 반동 증상 없이 개선되도록, 유효량의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 대상체에게 경피 투여하는 것을 포함하는, 파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증을 치료, 개선, 또는 예방하는 방법.
(항 7A)
항 6A에 있어서, 레보도파 유발 운동이상증 (PD-LID)이 피크-용량 운동이상증, 2상성 운동이상증, 및 그의 조합을 포함하는 것인 방법.
(항 8A)
항 6A 또는 항 7A에 있어서, 운동 합병증의 치료, 개선, 진행 억제, 또는 예방이 레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축, 또는 그의 조합을 포함하는 것인 방법.
(항 9A)
유효량의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 대상체에게 비경구 투여하는 것을 포함하는, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축, 또는 그의 조합을 달성하는 방법.
(항 10A)
항 9A에 있어서, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선이 임상적으로 유의한 개선 이상인 방법.
(항 11A)
항 9A 또는 항 10A에 있어서, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선이 임상 효과를 달성하기에 충분한 수준까지인 것인 방법.
(항 12A)
항 9A 내지 항 11A 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 경피 투여 제제로서 제공되는 것인 방법.
(항 13A)
항 9A 내지 항 12A 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 접착제 제제로서 제공되는 것인 방법.
(항 14A)
항 9A 내지 항 13A 중 어느 한 항에 있어서, 경피 투여 제제가 테이프/패치인 방법.
(항 15A)
항 9A 내지 항 14A 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 약물 투여량이 탄도스피론의 유리 형태로서 1일 0.1 내지 100 mg인 방법.
(항 16A)
항 9A 내지 항 15A 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물에 대한 약물 침투의 양이 탄도스피론의 유리 형태로서 1일 0.1 내지 20 mg인 방법.
(항 17A)
항 9A 내지 항 16A 중 어느 한 항에 있어서, 투여가 경피 투여 제제로 달성되고, 용량당 총 적용 면적이 1 내지 100 cm2인 방법.
(항 18A)
항 9A 내지 항 17A 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 인간 혈중 (혈장) 탄도스피론 농도가 1일 12시간 이상 동안 0.05 내지 20 ng/mL가 되도록 투여되는 것인 방법.
(항 19A)
항 9A 내지 항 18A 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 인간 혈중 (혈장) 탄도스피론 농도가 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 투여 후 8 내지 16시간 동안 0.05 내지 20 ng/mL가 되도록 투여되는 것인 방법.
(항 20A)
항 9A 내지 항 19A 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 레보도파의 보조약인 방법.
(항 21A)
항 9A 내지 항 20A 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 고정-용량 조합으로서 레보도파와 함께 또는 별도의 제제로서 공동으로 사용되는 것인 방법.
(항 22A)
대상체에게 유효량의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물과 (1) 유효량의 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제의 유효량의 조합을 투여하는 것을 포함하는, 대상체에서 PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하는 방법이며, 여기서 유효량의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 파킨슨병을 치료 또는 예방하는 방법.
(항 23A)
항 22A에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물 및 (1) 또는 (2)가 동시에 또는 상이한 시간에 투여되는 것인 방법.
(항 24A)
탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 운동이상증을 가진 파킨슨병 환자의 레보도파 요법에 대한 반응의 질 악화를 개선하기 위한 조성물이며, 여기서 유효량의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 조성물.
(항 25A)
항 24A에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염이 탄도스피론의 유리 형태인 방법.
(항 1B)
파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증을 치료, 개선, 또는 예방하기 위한 의약의 제조에 있어서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 용도이며, 여기서 의약이 비경구 투여되는 것인 용도.
(항 2B)
항 1B에 있어서, 비경구 투여가 경피 투여, 피내 투여, 피하 투여, 근육내 투여, 및 그의 조합으로부터 선택된 것인 용도.
(항 3B)
항 1B 또는 항 2B에 있어서, 비경구 투여가 지속성을 갖거나 지속가능하게 투여되는 것인 용도.
(항 4B)
항 1B 내지 항 3B 중 어느 한 항에 있어서, 비경구 투여가 경피 투여를 포함하는 것인 용도.
(항 5B)
항 1B 내지 항 3B 중 어느 한 항에 있어서, 운동 합병증이 레보도파 유발 운동이상증 (PD-LID)을 포함하는 것인 용도.
(항 6B)
파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증의 치료, 개선, 또는 예방을 위한 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는 의약의 제조에 있어서의 용도이며, 여기서 레보도파 유발 운동이상증 (PD-LID)이 반동 증상을 발생시키지 않고 개선되고, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 경피 투여되는 것인 용도.
(항 7B)
항 6B에 있어서, 레보도파 유발 운동이상증 (PD-LID)이 피크-용량 운동이상증, 2상성 운동이상증, 및 그의 조합을 포함하는 것인 용도.
(항 8B)
항 6B 또는 항 7B에 있어서, 운동 합병증의 치료, 개선, 진행 억제, 또는 예방이 레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축, 또는 그의 조합을 포함하는 것인 용도.
(항 9B)
레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축, 또는 그의 조합을 달성하기 위한 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는 의약의 제조에 있어서의 용도이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 용도.
(항 10B)
항 9B에 있어서, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선이 임상적으로 유의한 개선 이상인 용도.
(항 11B)
항 9B 또는 항 10B에 있어서, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선이 임상 효과를 달성하기에 충분한 수준까지인 것인 용도.
(항 12B)
항 9B 내지 항 11B 중 어느 한 항에 있어서, 의약이 경피 투여 제제인 용도.
(항 13B)
항 9B 내지 항 12B 중 어느 한 항에 있어서, 의약이 접착제 제제인 용도.
(항 14B)
항 9B 내지 항 13B 중 어느 한 항에 있어서, 경피 투여 제제가 테이프/패치인 용도.
(항 15B)
항 9B 내지 항 14B 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 약물 투여량이 탄도스피론의 유리 형태로서 1일 0.1 내지 100 mg인 용도.
(항 16B)
항 9B 내지 항 15B 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물에 대한 약물 침투의 양이 탄도스피론의 유리 형태로서 1일 0.1 내지 20 mg인 용도.
(항 17B)
항 9B 내지 항 16B 중 어느 한 항에 있어서, 의약이 경피 투여 제제이고, 용량당 총 적용 면적이 1 내지 100 cm2인 용도.
(항 18B)
항 9B 내지 항 17B 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 인간 혈중 (혈장) 탄도스피론 농도가 1일 12시간 이상 동안 0.05 내지 20 ng/mL가 되도록 투여되는 것인 용도.
(항 19B)
항 9B 내지 항 18B 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 인간 혈중 (혈장) 탄도스피론 농도가 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 투여 후 8 내지 16시간 동안 0.05 내지 20 ng/mL가 되도록 투여되는 것인 용도.
(항 20B)
항 9B 내지 항 19B 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 레보도파의 보조약인 용도.
(항 21B)
항 9B 내지 항 20B 중 어느 한 항에 있어서, 의약이 고정-용량 조합으로서 레보도파와 함께 또는 별도의 제제로서 공동으로 사용되는 것인 용도.
(항 22B)
PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 의약의 제조에 있어서의 용도이며, 여기서 의약이 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물과 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제의 조합을 포함하며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 용도.
(항 23B)
탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 의약의 제조에 있어서의 용도이며, 여기서 의약이 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제와 조합하여 투여되며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 용도.
(항 24B)
PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 의약의 제조에 있어서의 용도이며, 여기서 의약이 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제를 포함하며, 여기서 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제가 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물과 조합하여 투여되며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 용도.
(항 25B)
운동이상증을 가진 파킨슨병 환자의 레보도파 요법에 대한 반응의 질 악화를 개선하기 위한 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는 의약의 제조에 있어서의 용도이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 용도.
(항 26B)
항 25B에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염이 탄도스피론의 유리 형태인 용도.
(항 1C)
비경구 투여되는, 파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증을 치료, 개선, 또는 예방하기 위한, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 2C)
항 1C에 있어서, 비경구 투여가 경피 투여, 피내 투여, 피하 투여, 근육내 투여, 및 그의 조합으로부터 선택된 것인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 3C)
항 1C 또는 항 2C에 있어서, 비경구 투여가 지속성을 갖거나 지속가능하게 투여되는 것인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 4C)
항 1C 내지 항 3C 중 어느 한 항에 있어서, 비경구 투여가 경피 투여를 포함하는 것인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 5C)
항 1C 내지 항 4C 중 어느 한 항에 있어서, 운동 합병증이 레보도파 유발 운동이상증 (PD-LID)을 포함하는 것인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 6C)
파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증을 치료, 개선, 또는 예방하기 위한 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이며, 여기서 레보도파 유발 운동이상증 (PD-LID)이 반동 증상을 발생시키지 않고 개선되고, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 경피 투여되는 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 7C)
항 1C 내지 항 6C 중 어느 한 항에 있어서, 레보도파 유발 운동이상증 (PD-LID)이 피크-용량 운동이상증, 2상성 운동이상증, 및 그의 조합을 포함하는 것인, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 8C)
항 1C 내지 항 7C 중 어느 한 항에 있어서, 운동 합병증의 치료, 개선, 진행 억제, 또는 예방이 레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축, 또는 그의 조합을 포함하는 것인, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 9C)
비경구 투여되는, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축, 또는 그의 조합을 달성하기 위한 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 10C)
항 9C에 있어서, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선이 임상적으로 유의한 개선 이상인 것인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 11C)
항 9C 또는 항 10C에 있어서, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선이 임상 효과를 달성하기에 충분한 수준까지인 것인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 12C)
항 9C 내지 항 11C 중 어느 한 항에 있어서, 경피 투여 제제인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 13C)
항 9C 내지 항 12C 중 어느 한 항에 있어서, 접착제 제제인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 14C)
항 9C 내지 항 13C 중 어느 한 항에 있어서, 경피 투여 제제가 테이프/패치인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 15C)
항 9C 내지 항 14C 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 약물 투여량이 탄도스피론의 유리 형태로서 1일 0.1 내지 100 mg인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 16C)
항 9C 내지 항 15C 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물에 대한 약물 침투의 양이 탄도스피론의 유리 형태로서 1일 0.1 내지 20 mg인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 17C)
항 9C 내지 항 16C 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 경피 투여 제제이고, 용량당 총 적용 면적이 1 내지 100 cm2인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 18C)
항 9C 내지 항 17C 중 어느 한 항에 있어서, 인간 혈중 (혈장) 탄도스피론 농도가 1일 12시간 이상 동안 0.05 내지 20 ng/mL가 되도록 투여되는 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 19C)
항 9C 내지 항 18C 중 어느 한 항에 있어서, 인간 혈중 (혈장) 탄도스피론 농도가 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 투여 후 8 내지 16시간 동안 0.05 내지 20 ng/mL가 되도록 투여되는 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 20C)
항 9C 내지 항 19C 중 어느 한 항에 있어서, 레보도파의 보조약인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 21C)
항 9C 내지 항 20C 중 어느 한 항에 있어서, 고정-용량 조합으로서 레보도파와 함께 또는 별도의 제제로서 공동으로 사용되는 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 22C)
PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물과 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제의 조합이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 조합.
(항 23C)
(1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제와 조합하여 투여되며, 비경구 투여되는, PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 24C)
PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제의 조합이며, 여기서 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제의 조합이 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물과 조합하여 투여되며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 조합.
(항 25C)
비경구 투여되는, 운동이상증을 가진 파킨슨병 환자의 레보도파 요법에 대한 반응의 질 악화를 개선하기 위한 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
(항 26C)
항 25C에 있어서, 유리 형태인 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물.
구체적 실시양태에서, 본 발명은 접착제 제제 (또한 경피 패치/테이프제라고도 함)로서 제공된다. 본 발명의 테이프제를 적용하는 경우, 파킨슨병에 대한 레보도파 요법과 연관된 운동이상증 증상을 보다 바람직하게 예방 또는 개선할 수 있다. 본 발명의 테이프제를 사용한 치료 전에 비해, 레보도파의 1회 용량 및/또는 1일 용량이 증가된 파킨슨병의 요법은, 본 발명의 테이프제가 파킨슨병에 대한 레보도파 요법과 연관된 운동이상증 증상을 보다 바람직하게 예방 또는 개선하기 위해 적용되는 경우 실제 임상 환경에서, 운동 이상증의 악화 없이 투여될 수 있다.
현재의 요법은 운동이상증의 발현을 예방하기 위해 소량의 그리고 빈번한 용량의 레보도파로 파킨슨병 환자를 치료하려고 시도하고 있다 (파킨슨병 진료 가이드라인 2018 버전 [Parkinson's Disease Diagnosis and Treatment Guidelines 2018 version] (Third edition, Q&A for Parkinson's disease diagnosis, Chapter III, Therapy for motor symptoms)).
본 발명에 의해 제공된 탄도스피론의 비경구 투여 제제를 투여함으로써 운동이상증의 징후가 억제될 수 있고 레보도파 함유 제제가 최적 용량으로 조정될 수 있다. 환언하면, 운동이상증을 갖거나 그의 발현에 위험에 처한 파킨슨병 환자의 경우 레보도파의 1회 용량이 증가되어 투여 횟수를 감소시키거나 레보도파의 1일 투여량이 증가된다할지라도, 운동이상증 증상을 악화시키지 않고 파킨슨병 증상의보다 바람직한 요법이 가능하다.
본 발명의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물 및 치료 방법은 요법 또는 예방이 일본 신경과학회에 의해 발행된 파킨슨병 진료 가이드라인 2018 버전 [Parkinson's Disease Diagnosis and Treatment Guidelines 2018 version] 또는 미국 또는 유럽에서의 상응하는 가이드라인에 구체화된 레보도파 요법에 대한 정상적인 1일 투여량을 포함하는 레보도파 유발 운동 합병증 또는 레보도파 유발 운동이상증을 감소시키는 것을 가능하게 한다.
추가로, 본 발명에 의해 제공되는 탄도스피론의 비경구 투여 제제를 투여함으로써 경구 투여에 비해 레보도파 유발 운동이상증 (PD-LID) 등을 개선하는 보다 바람직한 효과가 제공될 수 있다.
본 발명자들은 운동이상증 개선 효과를 기대하면서 탄도스피론의 경구 투여가 대신에 운동이상증을 일시적으로 악화시킨다는 것을 처음으로 밝혀냈다. 환언하면, 본 발명자들은 탄도스피론의 경구 투여가 운동이상증의 "반동 증상"을 수반하기 때문에 운동이상증 개선을 위한 치료 약물로서 바람직하지 않다는 것을 밝혀냈다. 본원에 사용된 바와 같이, "반동 증상"은 하기 단락 [0036] (번역문 <0274>)에 기재된 증상이다. 탄도스피론의 경구 투여는 "반동 증상"을 발생시키기 때문에, 레보도파 함유 제제의 투여량을 증가시키는 것은 바람직하지 않다.
본 발명자들은 본 발명의 탄도스피론 비경구 조성물이 "반동 증상" 없이 운동이상증을 개선할 수 있다는 것을 밝혀냈다. 운동이상증 점수는 하기 단락 [0038] (번역문 <0276>)에 기재된 방법에 의해 "AIM 점수" (AIM은 "비정상적 불수의 운동"의 약어이다)로서 측정될 수 있다.
따라서, 본 발명은 하기 구체적 실시양태로서 실시될 수 있다.
(1) (A) 탄도스피론을 비경구 투여하는 단계; 및
(B) 통상적인 투여량과 비교하여 증가된 투여량의 레보도파를 투여하는 단계
를 포함하는, 파킨슨병을 예방 또는 치료하는 방법, 운동이상증을 개선하는 방법, 또는 개선된 운동이상증을 가진 파킨슨병을 예방 또는 치료하는 방법.
(2) (A) 탄도스피론을 비경구 투여하는 단계; 및
(B) 레보도파의 1일 투여 횟수를 조정하기 위해 레보도파의 투여량을 통상적인 1회 투여량 초과로 증가시키는 단계
를 포함하는, 파킨슨병을 예방 또는 치료하는 방법, 운동이상증을 개선하는 방법, 또는 개선된 운동이상증을 가진 파킨슨병을 예방 또는 치료하는 방법.
(3) (A) 탄도스피론을 비경구 투여하는 단계; 및
(B) 레보도파를 유지 또는 증가된 투여량으로 투여하는 단계
를 포함하는, 운동이상증을 갖거나 그의 발현에 위험에 처한 환자에서 파킨슨병을 예방 또는 치료하는 방법, 운동이상증을 개선하는 방법, 또는 개선된 운동이상증을 가진 파킨슨병을 예방 또는 치료하는 방법.
(4) (A) 통상적인 레보도파 요법에 탄도스피론의 비경구 투여를 부가하는 단계; 및
(B) 운동이상증이 악화되지 않을 정도까지 레보도파 투여량을 증가시키고 탄도스피론의 비경구 투여를 공동으로 사용하는 단계
를 포함하는, 운동이상증을 갖거나 그의 발현에 위험에 처한 환자에서 파킨슨병을 예방 또는 치료하는 방법, 운동이상증을 개선하는 방법, 또는 개선된 운동이상증을 가진 파킨슨병을 예방 또는 치료하는 방법.
(5) (A) 탄도스피론의 혈장 농도를 0.05 내지 20 ng/mL로 유지하는 단계; 및
(B) 레보도파를 투여하는 단계
를 포함하는, 파킨슨병을 예방 또는 치료하는 방법, 운동이상증을 개선하는 방법, 또는 개선된 운동이상증을 가진 파킨슨병을 예방 또는 치료하는 방법.
(6) (A) 탄도스피론의 혈장 농도를 0.05 내지 20 ng/mL로 유지하는 단계; 및
(B) 레보도파를 투여하는 단계
를 포함하는, 운동이상증을 갖거나 그의 발현에 위험에 처한 환자에서 파킨슨병을 예방 또는 치료하는 방법, 운동이상증을 개선하는 방법, 또는 개선된 운동이상증을 가진 파킨슨병을 예방 또는 치료하는 방법.
본 발명의 기초는 다음과 같다.
*레보도파는 짧은 반감기를 갖고 효과가 지속되지 않기 때문에, 레보도파는 일반적으로 1일 다수회 투여된다. 한편, 탄도스피론의 혈중 농도는 본 발명의 탄도스피론이 테이프제로서 투여되며, 즉 하루에 한 장 적용되는 경우 24시간 동안 유지된다. 이 이유로, 경피 투여 제제의 경우, 레보도파 투여 시점에 관계없이 탄도스피론에 노출되어 있는 동안에 레보도파를 투여한다. 다른 한편으로는, 세디엘정(Sediel tablet)과 레보도파가 1일 3회 동일한 시간에 투여 (경구 투여)되는 경우, 탄도스피론의 혈중 농도가 감소되면서 레보도파가 투여되게 될 것이다. 환언하면, 특징은 경구 작용제와 상이하다는 점에 있다. 추가로, 레보도파의 투여시 탄도스피론의 혈중 농도를 유지하는 것이 바람직하다.
구체적 실시양태에서, 본 발명은 다양한 적용 (적응증)에서 사용될 수 있다. 예를 들어, 뇌에서 도파민의 효과를 증가시키는 다른 약물의 유무와 관계 없이, 적응증 예컨대 레보도파 요법으로 치료받은 파킨슨병 환자에서 운동이상증의 개선 (항운동이상증 약물) <PD-LID 개선 약물>, 운동이상증 (불수의 운동)의 치료, 사용상의 주의 또는 표지 (패키지 삽입물)를 첨부할 수 있다.
본 발명은 상술한 특징 중 하나 이상이 명시적으로 개시된 조합으로서 뿐만 아니라 다른 조합으로서도 제공될 수 있도록 의도된다. 본 발명의 추가적인 실시양태 및 이점은 필요에 따라 하기 상세한 설명을 읽고 이해함으로써 관련 기술분야의 통상의 기술자에 의해 인식된다.
본원에 사용된 바와 같이, 운동 합병증 및 운동이상증은 파킨슨병에 대한 레보도파 요법과 연관된 증상을 지칭하며, 특별히 달리 언급되지 않는 한, 다른 질환에서 비롯된 증상 및 레보도파 이외의 화합물을 사용한 요법과 연관된 증상은 제외한다.
본 발명의 제약 조성물은 파킨슨병에서 레보도파 유발 운동 합병증 (예를 들어, 레보도파 유발 운동이상증 (PD-LID) 등)의 치료 약물, 개선 약물, 진행 억제 약물, 또는 예방 약물로서 기대된다. 구체적으로, 본 발명의 제약 조성물은 반동 증상이 없는 PD-LID에 대한 치료 약물, 개선 약물, 진행 억제 약물, 또는 예방 약물로서 기대된다.
도 1은 정상 래트에 탄도스피론 테이프제를 적용한 경우 혈장 농도의 변화를 나타낸 도표이다. 구체적으로, 정상 래트 (9 cm2: 31 ± 2 cm2/kg)에 탄도스피론 테이프제를 적용함으로써 수득된 혈장 탄도스피론 농도의 변화를 평균값 ± 표준 편차로 환산하여 나타냈다. x축은 적용으로부터의 시간을 나타내며, y축은 혈장 탄도스피론 농도를 나타낸다.
도 2는 투여 조건 1 하에 탄도스피론 테이프제를 PD-LID 래트 모델에 적용한 경우 운동이상증-유사 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론 테이프제를 PD-LID 래트 모델에게 경피 투여하고 레보도파를 4시간 후에 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. **는 p < 0.01을 나타내며, 이는 플라시보 테이프제 적용군과 비교하여 유의한 차이가 있음을 의미한다 (윌콕슨 순위합 검정(Wilcoxon rank sum test)). 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타내고, 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 3은 투여 조건 2 하에 탄도스피론 테이프제를 PD-LID 래트 모델에 적용한 경우 운동이상증-유사 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론 테이프제를 PD-LID 래트 모델에게 경피 투여하고 상기 모델에서 테이프제 적용 부위에 각질층 박리를 수행하고, 레보도파를 4시간 후에 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. **는 p < 0.01을 나타내며, 이는 플라시보 테이프제 적용군과 비교하여 유의한 차이가 있음을 의미한다 (윌콕슨 순위합 검정). 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타낸다. 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 4는 탄도스피론을 PD-LID 래트 모델에 지속적으로 피하 주입시 운동이상증 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론을 PD-LID 래트 모델에게 피하 및 지속가능하게 투여하고, 레보도파를 4시간 후에 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. *는 p < 0.05를 나타내며, 이는 용매 투여군과 비교하여 유의한 차이가 있음을 의미한다 (스틸 검정(Steel test)). 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타낸다. 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 5는 탄도스피론 시트레이트를 PD-LID 래트 모델에 지속적으로 피하 주입 직후 운동이상증-유사 증상을 장기간 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론 시트레이트를 PD-LID 래트 모델에게 피하 및 지속가능하게 투여하고, 운동이상증-유사 증상을 투여 시작일에 및 투여 13일차에 평가하였다. 180분 내에 총 AIM 점수는 평균값 ± 표준 오차로 환산하여 표시된다. **는 p < 0.01을 나타내며, 이는 용매 투여군과 비교하여 유의한 차이가 있음을 의미한다 (윌콕슨 순위합 검정). 상기 도면에서, 그래프 A는 펌프를 이식한 0일차에 결과를 나타낸다. 그래프 B는 펌프를 이식한 13일차에 결과를 나타낸다.
도 6은 6-히드록시도파민으로 뇌의 한쪽 면이 처리된 래트에 대한 탄도스피론 시트레이트의 지속적인 피하 주입이 운동이상증 발달에 미치는 영향을 나타내는 도표이다. 구체적으로, 레보도파를 반복 투여하고 탄도스피론 시트레이트를 6-히드록시도파민으로 뇌의 한쪽이 처리된 래트에게 피하 및 지속가능하게 투여하여 레보도파 반복 투여로 유발된 운동이상증-유사 증상 발현에 대한 효과를 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. *는 p < 0.05를 나타내며, **는 p < 0.01를 나타내며, 이는 용매 투여군과 비교하여 유의한 차이가 있음을 의미한다 (스틸 검정). 상기 도면에서, 그래프 A는 시간 경과에 따른 레보도파 반복 투여의 결과를 나타낸다. 그래프 B는 탄도스피론 시트레이트 투여 완료 다음날 (16일차)의 결과를 나타낸다.
도 7은 탄도스피론 시트레이트를 PD-LID 래트 모델에게 경구 투여한 경우 운동이상증-유사 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론 시트레이트 (시트레이트 농도로서 10 mg/kg, 30 mg/kg)를 PD-LID 래트 모델에게 경구 투여하고, 5분 후 레보도파를 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. *는 p < 0.05를 나타내며, 이는 용매 투여군과 비교하여 유의한 차이가 있음을 의미한다 (스틸 검정). 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타낸다. 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 8은 탄도스피론 시트레이트를 PD-LID 래트 모델에게 경구 투여한 경우 운동이상증-유사 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론 시트레이트 (시트레이트 농도로서 30 mg/kg, 100 mg/kg)를 PD-LID 래트 모델에게 경구 투여하고, 5분 후 레보도파를 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타낸다. 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 9는 탄도스피론 유리 형태, 탄도스피론 시트레이트 (수화물), 및 탄도스피론 시트레이트 (무수화물)의 X-선 분말 회절 패턴을 나타내는 도표이다.
도 10은 1-PP 디히드로클로라이드를 PD-LID 래트 모델에게 피하 투여한 경우 운동이상증-유사 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 1-PP 디히드로클로라이드 (10 mg/kg, 30 mg/kg)를 PD-LID 래트 모델에게 피하 투여하고, 5분 후 레보도파를 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타낸다. 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 2는 투여 조건 1 하에 탄도스피론 테이프제를 PD-LID 래트 모델에 적용한 경우 운동이상증-유사 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론 테이프제를 PD-LID 래트 모델에게 경피 투여하고 레보도파를 4시간 후에 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. **는 p < 0.01을 나타내며, 이는 플라시보 테이프제 적용군과 비교하여 유의한 차이가 있음을 의미한다 (윌콕슨 순위합 검정(Wilcoxon rank sum test)). 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타내고, 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 3은 투여 조건 2 하에 탄도스피론 테이프제를 PD-LID 래트 모델에 적용한 경우 운동이상증-유사 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론 테이프제를 PD-LID 래트 모델에게 경피 투여하고 상기 모델에서 테이프제 적용 부위에 각질층 박리를 수행하고, 레보도파를 4시간 후에 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. **는 p < 0.01을 나타내며, 이는 플라시보 테이프제 적용군과 비교하여 유의한 차이가 있음을 의미한다 (윌콕슨 순위합 검정). 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타낸다. 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 4는 탄도스피론을 PD-LID 래트 모델에 지속적으로 피하 주입시 운동이상증 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론을 PD-LID 래트 모델에게 피하 및 지속가능하게 투여하고, 레보도파를 4시간 후에 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. *는 p < 0.05를 나타내며, 이는 용매 투여군과 비교하여 유의한 차이가 있음을 의미한다 (스틸 검정(Steel test)). 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타낸다. 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 5는 탄도스피론 시트레이트를 PD-LID 래트 모델에 지속적으로 피하 주입 직후 운동이상증-유사 증상을 장기간 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론 시트레이트를 PD-LID 래트 모델에게 피하 및 지속가능하게 투여하고, 운동이상증-유사 증상을 투여 시작일에 및 투여 13일차에 평가하였다. 180분 내에 총 AIM 점수는 평균값 ± 표준 오차로 환산하여 표시된다. **는 p < 0.01을 나타내며, 이는 용매 투여군과 비교하여 유의한 차이가 있음을 의미한다 (윌콕슨 순위합 검정). 상기 도면에서, 그래프 A는 펌프를 이식한 0일차에 결과를 나타낸다. 그래프 B는 펌프를 이식한 13일차에 결과를 나타낸다.
도 6은 6-히드록시도파민으로 뇌의 한쪽 면이 처리된 래트에 대한 탄도스피론 시트레이트의 지속적인 피하 주입이 운동이상증 발달에 미치는 영향을 나타내는 도표이다. 구체적으로, 레보도파를 반복 투여하고 탄도스피론 시트레이트를 6-히드록시도파민으로 뇌의 한쪽이 처리된 래트에게 피하 및 지속가능하게 투여하여 레보도파 반복 투여로 유발된 운동이상증-유사 증상 발현에 대한 효과를 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. *는 p < 0.05를 나타내며, **는 p < 0.01를 나타내며, 이는 용매 투여군과 비교하여 유의한 차이가 있음을 의미한다 (스틸 검정). 상기 도면에서, 그래프 A는 시간 경과에 따른 레보도파 반복 투여의 결과를 나타낸다. 그래프 B는 탄도스피론 시트레이트 투여 완료 다음날 (16일차)의 결과를 나타낸다.
도 7은 탄도스피론 시트레이트를 PD-LID 래트 모델에게 경구 투여한 경우 운동이상증-유사 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론 시트레이트 (시트레이트 농도로서 10 mg/kg, 30 mg/kg)를 PD-LID 래트 모델에게 경구 투여하고, 5분 후 레보도파를 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. *는 p < 0.05를 나타내며, 이는 용매 투여군과 비교하여 유의한 차이가 있음을 의미한다 (스틸 검정). 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타낸다. 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 8은 탄도스피론 시트레이트를 PD-LID 래트 모델에게 경구 투여한 경우 운동이상증-유사 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 탄도스피론 시트레이트 (시트레이트 농도로서 30 mg/kg, 100 mg/kg)를 PD-LID 래트 모델에게 경구 투여하고, 5분 후 레보도파를 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타낸다. 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
도 9는 탄도스피론 유리 형태, 탄도스피론 시트레이트 (수화물), 및 탄도스피론 시트레이트 (무수화물)의 X-선 분말 회절 패턴을 나타내는 도표이다.
도 10은 1-PP 디히드로클로라이드를 PD-LID 래트 모델에게 피하 투여한 경우 운동이상증-유사 증상을 평가한 결과를 나타낸 도표이다. 구체적으로, 1-PP 디히드로클로라이드 (10 mg/kg, 30 mg/kg)를 PD-LID 래트 모델에게 피하 투여하고, 5분 후 레보도파를 투여하여 운동이상증-유사 증상을 평가하였다. 결과는 평균값 ± 표준 오차로 환산하여 표시된다. 상기 도면에서, 그래프 A는 레보도파 투여 후 시간 경과에 따른 AIM 점수의 변화를 나타낸다. 그래프 B는 180분 내에 총 AIM 점수를 나타낸다. 그래프 C는 100분 내지 180분 내에 총 AIM 점수를 나타낸다.
본 발명은 본 발명의 최선의 방식을 나타내면서 이하에 설명한다. 전반적인 명세서 전체에 걸쳐, 단수 표현은 특별히 달리 언급되지 않는 한, 그의 개념을 복수 형태로 포함하는 것으로 이해되어야 한다. 따라서, 단수 형태 (예를 들어, 영어의 경우에 "a", "an", "the" 등)는 특별히 달리 언급하지 않는 한, 그의 개념을 복수 형태로 포함하는 것으로 또한 이해되어야 한다. 추가로, 본원에 사용된 용어는 특별히 달리 언급하지 않는 한, 관련 기술분야에서 통상적으로 사용되는 의미로 사용되는 것으로 이해되어야 한다. 따라서, 본원에 사용되는 모든 용어 및 과학 기술 용어는, 달리 정의되지 않는 한, 본 발명이 속하는 관련 기술분야의 통상의 기술자에게 일반적으로 이해되는 바와 동일한 의미를 갖는다. 모순의 경우에, 본 명세서 (정의 포함)가 우선한다.
(정의 등)
본원에 특히 사용되는 용어의 정의 및/또는 기본 기술은 적절하게 이하에 기재된다.
본원에 사용된 바와 같이, "탄도스피론" [화학명: (1R,2S,3R,4S)-N-[4-{4-(피리미딘-2-일)피페라딘-1-일}부틸]-2,3-비시클로[2.2.1]헵탄디카르복스이미드]는 하기 구조를 갖는다.
[화학식 1]
탄도스피론의 시트르산 염을 활성 성분으로서 포함하는 세디엘정은 세로토닌성 항불안 약물로서의 요법에 사용된다 (예를 들어, 세디엘 패키지 삽입물 또는 표지, 2016년 4월 개정, 14판, 스미토모 다이니뽄 세이야쿠 가부시키가이샤(Sumitomo Dainippon Pharma Co., Ltd.); 일본 공개공보번호 58-126865 참조). 탄도스피론은 만성 조현병에서의 기억력에 유익한 효과를 갖는다. 특히, 할로페리돌과 같은 전형적인 항정신병약물을 사용하여 유지 요법을 계속하면서 탄도스피론 또는 그의 제약상 허용되는 염을 투여함으로써 인지 기능장애를 개선할 수 있는 것으로 공지되어 있다 (일본 공개공보번호 2002-20291 참조).
본 발명의 제약 조성물에 사용되는 활성 성분으로서, 탄도스피론 (유리 형태)이 바람직하나, 탄도스피론의 제약상 허용되는 염 또는 탄도스피론의 전구약물이 또한 동일한 방식으로 사용될 수 있다. 탄도스피론의 제약상 허용되는 염 및 전구약물은 무기 산의 염 예컨대 히드로클로라이드, 히드로브로마이드, 술페이트, 및 포스페이트 및 유기 산의 염 예컨대 아세테이트, 부티레이트, 타르트레이트, 시트레이트, 말레에이트, 및 푸마레이트를 포함한다.
탄도스피론의 전구약물은 탄도스피론과 상이한 구조를 가지나, 투여 후 대사에 의해 탄도스피론 또는 이를 기반으로 하는 활성 성분으로 전환되어 효능을 발휘할 수 있는 임의의 구성요소를 지칭한다.
탄도스피론의 전구약물은 체내 생리학적 조건 하에 효소 등과 반응하여 탄도스피론으로 전환되는 화합물, 즉, 효소적 산화, 환원, 가수분해 등의 결과로서 탄도스피론으로 변화하는 화합물 등을 지칭한다. 탄도스피론의 전구약물은 또한 생리학적 조건 하에 탄도스피론으로 변화하는 화합물 예컨대 문헌 ["Iyakuhin no Kaihatsu" [Drug Development], Hirokawa-Shoten Ltd., 1990, Vol. 7, Molecular Design, pp. 163 to 198]에 기재된 것들일 수 있다.
본 발명의 탄도스피론 또는 그의 염 또는 전구약물 (이하에, 탄도스피론이라고도 함)은 우수한 세로토닌 5-HT1A 수용체 활성화 작용을 갖는다.
본 발명의 탄도스피론은 낮은 독성을 갖고 안전하다.
"탄도스피론 시트레이트"의 활성 성분을 가진 약물은 (1) 신경증에서의 우울증 또는 공황 및 (2) 심신성 질환에서 신체 증상, 및 우울증, 불안, 안절부절, 또는 수면 장애에 대한 치료제로서 경구 작용제로서 임상적으로 적용된다. 탄도스피론은 세로토닌 1A 수용체 (이하에, "5-HT1A 수용체"라고도 함)에 대해 매우 선택적이나, 다양한 신경전달물질 수용체에 대한 시험관내 수용체 결합 평가에서 도파민 2 수용체 ("D2 수용체"라고도 함)에 대한 낮은 친화도를 갖는다. 이 이유로, 탄도스피론은 5-HT1A 수용체를 활성화시켜 세로토닌 신경에 선택적으로 작용하여 신경증 등에 효과를 발휘하는 것으로 이해된다.
본원에 사용된 바와 같이 "레보도파" (광범위하게 정의됨)는 좁게 정의된 레보도파 (L-3,4-디히드록시페닐알라닌 (IUPAC 명명법은 (S)-2-아미노-3-(3,4-디히드록시페닐)프로판산이다); L-도파라고도 함)뿐만 아니라 L-3,4-디히드록시페닐알라닌과 동일한 효능을 달성하는 임의의 다른 약물을 포함한다. 이러한 다른 약물의 예는 L-3,4-디히드록시페닐알라닌의 에스테르 및 그의 염을 포함하나, 이에 제한되지는 않는다. L-3,4-디히드록시페닐알라닌의 에스테르의 예는 레보도파 에틸 에스테르 (LDEE; 에틸(2S)-2-아미노-3-(3,4-디히드록시페닐)프로파노에이트), 레보도파 프로필 에스테르; 레보도파 프로필 에스테르 (프로필(2S)-2-아미노-3-(3,4-디히드록시페닐)프로파노에이트), 레보도파 메틸 에스테르 (메틸(2S)-2-아미노-3-(3,4-디히드록시페닐)프로파노에이트) 등을 포함한다. L-3,4-디히드록시페닐알라닌의 에스테르는, 예를 들어, 수화된 염을 포함한 염일 수 있다. 레보도파 에스테르의 염은 옥타노에이트, 미리스테이트, 숙시네이트, 숙시네이트 이수화물, 푸마레이트, 푸마레이트 이수화물, 메실레이트, 타르트레이트, 및 히드로클로라이드 중 하나를 포함할 수 있으나, 이에 제한되지는 않는다. L-3,4-디히드록시페닐알라닌의 에스테르의 숙시네이트 탈수화물 또는 숙시네이트의 예는 레보도파 에틸 에스테르 숙시네이트 (LDEE-S) 및 레보도파 에틸 에스테르 숙시네이트 탈수화물 (LDEE-S-이수화물 또는 LDEE-S(d))를 포함한다.
본원에 사용된 바와 같이, "레보도파의 대사 효소 억제제"는 광범위하게 정의된 레보도파의 대사를 억제하여 그의 작용을 향상시키는 작용을 갖는 임의의 약물을 지칭한다. 그의 예는 레보도파가 장, 간, 또는 혈관에서 도파민으로 변화하지 못하도록 하는 도파 데카르복실라제 억제제 (DCI) (그의 예는 카르비도파, α-메틸도파, 벤세라지드 (Ro4-4602), α-디플루오로메틸-DOPA (DFMD), 및 그의 염 등을 포함한다), 유사하게 뇌에 진입하기 전에 레보도파의 분해를 방지하는 카테콜-O-메틸 트랜스퍼라제 억제제 (COMT-I) (그의 예는 엔타카폰을 포함한다), 뇌에서의 도파민 분해를 방지하는 모노아민 옥시다제 억제제 (MAO-I) (그의 예는 셀레길린을 포함한다) 등을 포함한다.
(질환/장애)
본원에 사용된 바와 같이, "운동 합병증"은 진행성 파킨슨병을 가진 환자에서 발견되는 치료해야 할 문제인 임의의 운동 증상을 지칭한다. 그의 예는 레보도파 요법과 연관된 불수의 운동인 운동이상증 (레보도파 유발 운동이상증 (PD-LID)) 등을 포함한다. 운동 합병증은 레보도파의 과도한 작용에 기반하는 것으로 이해되나, 그의 메카니즘이 반드시 밝혀진 것은 아니다.
본원에 사용된 바와 같이, "레보도파 유발 운동이상증 <불수의 운동> (PD-LID)"은 레보도파 과다복용에 의해 유도되는, 손, 다리, 또는 신체의 비의도적으로 좌우로 흔듦의 불수의 운동을 지칭한다. 운동이상증은 많은 양의 레보도파를 질환의 초기 단계부터 필요 이상으로 지속적으로 투여하면 쉽게 나타나는 것으로 공지되어 있으며, 한번 나타나면 비록 레보도파의 투여량이 다양한 수준으로 후속적으로 증가 또는 감소될지라도 제어하기가 매우 어려운 것으로 공지되어 있다. 피크-용량 운동이상증은 PD-LID의 대표적인 증상이다. 상기 증상은 혈중 레보도파 농도가 높을 때 얼굴, 혀, 목, 팔다리, 몸통 등에 나타난다.
불수의 운동 (운동이상증)은 신체의 일부가 무의식적으로 움직이거나 멈추지 않거나, 입술을 깨물거나, 말하는데 어려움이 있거나, 가만히 있지 못하거나, 손 또는 다리를 의도한 대로 움직이는데 어려움이 있는 것을 지칭하며, 불수의 운동이 사지 및/또는 입 또는 얼굴, 및/또는 신체 축에서 관찰되는 운동 장애이다. 레보도파 요법을 받고 있는 PD 환자에서 관찰되는 운동이상증은 레보도파 유발 운동이상증 (LID)으로 공지되어 있으며, 이는 지난 5년 내지 10년 동안 레보도파 요법을 받은 PD 환자의 절반 초과에서 발생한다. LID를 앓고 있는 환자의 백분율 (%)은 시간이 지남에 따라 증가한다 (개요에 대해서는, 예를 들어, 문헌 [Encarnacion and Hauser, (2008), "Levodopa-induced dyskinesias in Parkinson's disease: etiology, impact on quality of life, and treatments.", Eur Neurol, 60(2), pages 57 to 66] 참조).
피크-용량 운동이상증은 과다한 항파킨슨병 약물로부터 생긴 불수의 운동이다. 2상성 운동이상증은 두 단계로, 즉, 항파킨슨병 약물의 효과가 시작될 때와 거의 끝날 때 나타나는 운동이상증이다.
본원에 사용된 바와 같이, "제약상 허용되는 염"은 무기 및/또는 유기 산 및 염기로 형성된 산 및/또는 염기 염을 포함한다. 그의 예는 산 부가 염 및 염기 부가 염을 포함한다. 산 부가 염의 예는 무기 산 염 예컨대 히드로클로라이드, 히드로브로마이드, 술페이트, 히드로아이오다이드, 니트레이트, 및 포스페이트, 및 유기 산 염 예컨대 시트레이트, 옥살레이트, 프탈레이트, 푸마레이트, 말레에이트, 숙시네이트, 말레이트, 아세테이트, 포름메이트, 프로피오네이트, 벤조에이트, 트리플루오로아세테이트, 메탄술포네이트, 벤젠술포네이트, p-톨루엔술포네이트, 및 캄포술포네이트를 포함한다. 염기 부가 염의 예는 무기 염기 염 예컨대 나트륨 염, 칼륨 염, 칼 슘염, 마그네슘 염, 바륨 염, 및 알루미늄 염, 및 유기 염기 염 예컨대 트리메틸아민, 트리에틸아민, 피리딘, 피콜린, 2,6-루티딘, 에탄올아민, 디에탄올아민, 트리에탄올아민, 트로메타민[트리스(히드록시메틸)메틸아민], tert-부틸아민, 시클로헥실아민, 디시클로헥실아민, 및 N-N-디벤질에틸아민을 포함한다. 더욱이, "제약상 허용되는 염"의 예는, 염기성 또는 산성 아미노산 예컨대 아르기닌, 리신, 오르니틴, 아스파르트산, 및 글루탐산의 아미노산 염을 포함한다. 제약상 허용되는 염은 관련 기술분야에 널리 공지되어 있다. 예를 들어, 베지(Berge) 등은 문헌 [J. Pharmaceutical Sciences (1977) 66: 1-19]에서 제약상 허용되는 염을 상세히 기재한다.
본 발명의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물 또는 의약은 필요에 따라 담체를 포함할 수 있다. 본원에 사용된 바와 같이, 용어 "담체"는 제약상 허용되는 물질, 조성물, 또는 부형제 예컨대 액체 또는 고체 증량제, 희석제, 첨가제, 용매, 기제(base agent), 또는 피부 침투 촉진제를 지칭하며, 이는 신체의 기관/조직 또는 그의 일부로부터 또는 신체의 또 다른 기관/조직 또는 그의 일부로 표적 제약 화합물의 수송 또는 운반과 연관되거나 이를 가능하게 한다. "제약상 허용되는"은 제제 중의 다른 원료와 상용성이고 대상체에 무해함을 지칭한다.
본 발명에서 치료가능한 질환은 파킨슨병에서 임의의 레보도파 유발 운동 합병증을 포함한다.
구체적 실시양태에서, 본 발명에서 치료가능한 환자는 레보도파 유발 운동 합병증을 갖거나 나타낼 가능성을 가진 파킨슨병 환자를 포함한다. 레보도파 유발 운동 합병증은 레보도파 유발 운동이상증을 포함한다.
본 발명에서 파킨슨병에서의 레보도파 유발 운동이상증에 대한 개선 효과는 환자 일지 또는 임상 평가 척도 예컨대 통합 운동이상증 평가 척도 (UDysRS), 임상 운동이상증 평가 척도 (CDRS), 또는 비정상적 불수의 운동 척도 (AIMS)를 사용하여 임상적으로 확인할 수 있다. 운동이상증 개선 효과는 또한 비임상 모델 PD-LID 래트 모델에서 운동이상증-유사 비정상적 불수의 운동 거동 평가에 의해 확인할 수 있다. 레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 뿐만 아니라 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축은 이러한 접근법을 사용함으로써 측정할 수 있다.
본 발명은 운동이상증의 임상 평가 척도 예컨대 UDysRS, CDRS, 또는 AIMS가 탄도스피론 요법 전에 비해 유의하게 저하되었는지 여부를 통해 PD-LID 증상이 악화되는지 여부를 확인할 수 있다. 이는 또한 환자 일지로부터 운동이상증 연관 증상의 분명한 악화가 관찰되는지 여부에 의해 확인할 수 있다. 레보도파 유발 운동이상증 증상이 통증을 동반하는지 여부는 본원에서 임상 기록 예컨대 환자 일지로 확인할 수 있다.
본 발명에서, 레보도파 유발 운동이상증 (PD-LID)의 "반동 증상"은 운동이상증 점수가 운동이상증을 개선하기 위한 치료 약물에 의해 일시적으로 오히려 악화되는 현상을 지칭한다. "반동 증상"은 운동이상증 개선 약물을 사용한 요법 동안 레보도파의 항파킨슨병 작용의 피크 기간 (예를 들어, 1시간) 후에 운동이상증 개선 약물을 사용하는 요법이 없는 경우보다 운동이상증이 더 악화되는 현상이다. 증상은 레보도파 투여 후 1 내지 6시간 내에 나타날 것으로 예상된다.
본 발명에서, 반동 증상이 없는 레보도파 유발 운동이상증 (PD-LID)의 개선은 레보도파 투여 후 운동이상증 개선 약물을 사용한 요법을 하지 않은 경우와 비교하여, 일시적이 아니라도, 운동이상증의 악화 없이 운동이상증의 총 점수가 개선된다는 것을 의미한다. "운동이상증의 악화 없이"는 운동이상증 (비임상 PD-LID 래트 모델의 AIM 평가 시스템에서 2 이상의 AIM 점수)을 가진 상태 그리고 운동이상증 개선 약물을 사용한 요법이 없는 경우와 비교하여 운동이상증 점수의 유의한 저하가 없는 상태를 지칭한다.
레보도파 유발 운동이상증 (PD-LID)의 반동 증상은 비임상 PD-LID 래트 모델의 AIM 평가 시스템에서 지표로서 레보도파 투여 후 120 내지 140분에 관찰된 분명한 운동이상증-유사 증상 (2 이상의 AIM 점수), 100분 내지 180분 내에 총 AIM 점수 등으로 평가될 수 있다. 운동이상증의 개선은 레보도파 투여 후 180분 내에 총 AIM 점수에 의해 평가될 수 있다. PD-LID 래트 모델의 이러한 AIM 평가 시스템에서, 2 이상의 AIM 점수는 운동이상증으로서 진단되며, 숫자가 많을수록 운동이상증이 더 증증인 것을 의미한다. 2 미만의 AIM 점수는 어떤 운동이상증도 없는 것으로 진단된다.
본 발명자들은 탄도스피론의 경구 투여가 반동 증상을 발생시키며, PD-LID의 요법에 부적합하다는 것을 밝혀냈다. 한편, 본 발명자들은 본 발명에서와 같은 탄도스피론의 비경구 투여가 반동 증상 없이 레보도파 유발 운동이상증 (PD-LID)을 개선한다는 것을 밝혀냈다. 치료 방식은 바람직하게는 탄도스피론의 지속 비경구 투여 또는 지속 방출 제제의 비경구 투여이고, 보다 바람직하게는 탄도스피론의 경피 투여이다.
본원에 사용된 바와 같이, "보조약"은 1차 작용을 가진 약물 이외의 약물을 지칭한다. 레보도파가 1차 작용제인 경우, 탄도스피론 등이 본 발명에서의 보조약이다.
본원에 1차 작용제 레보도파의 1일 투여량은 파킨슨병 진료 가이드라인 2018 버전 [Parkinson's Disease Diagnosis and Treatment Guidelines 2018 version] 또는 미국 또는 유럽에서의 상응하는 가이드라인에 구체화된 레보도파 요법에 대한 정상 용량이다. 일반적으로, 레보도파의 정상 1일 용량은 말초 도파 데카르복실라제 억제제 (DCI)와 조합 작용제로서 또는 공동 사용으로서 50 내지 1200 mg/일, 바람직하게는 100 mg 내지 600 mg/일이다. 예를 들어, FDA 승인을 받은 SINEMET(등록 상표) (카르비도파-레보도파 조합 정제) (신약 허가신청(New Drug Application) (NDA) #017555)는 1:4 비의 조합 정제 (25 mg 카르비도파 - 100 mg 레보도파) 및 1:10 비의 조합 정제 (10 mg 카르비도파 - 100 mg 레보도파 또는 25 mg 카르비도파 - 250 mg 레보도파)로서 제공된다. SINEMET(등록 상표)의 1일 유지 용량은 카르비도파가 70 mg 내지 100 mg이 되도록 투여한다. SINEMET(등록 상표)는 카르비도파로서 최대 200 mg의 최대 1일 용량으로 투여된다.
본원의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물 또는 치료 방법은 요법이 운동 합병증의 레보도파 요법 또는 예방에서 정상 용량의 투여와 연관된 운동 합병증을 감소시키는 것을 가능하게 할 수 있다.
레보도파 투여량은 본 발명의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 투여함으로써 적절하게 조정될 수 있다. 투여량은, 예를 들어, 일본 신경과학회에 의해 발행된 파킨슨병 진료 가이드라인 2018 버전 [Parkinson's Disease Diagnosis and Treatment Guidelines 2018 version] 또는 미국 또는 유럽에서의 상응하는 가이드라인에 구체화된 1회 투여량 및 1일 투여량 범위 내에서 증가될 수 있다.
본원에 사용된 바와 같이, "지속성을 갖는다"는 본원의 기재를 고려하면서 관련 기술분야에 공지된 연구결과들을 이용함으로써 관련 기술분야의 통상의 기술자에 의해 결정될 수 있다. 구체적으로, 지속성을 갖는다는 것은 장기간 동안 혈중 약물 농도를 유지하고 장기간의 생물학적 반감기의 효과를 나타내는 것으로 정의할 수 있다. 지속성을 갖는 조성물의 예는 하기 단락 [0051] (번역문 <0290>)에 기재된 다양한 경피 투여 제제, 하기 단락 [0089] (번역문 <0336>)에 기재된 다양한 지속 방출 주사제, 하기 단락 [0090] (번역문 <0337>)에 기재된 다양한 이식 작용제 등을 포함한다. 본원에 사용된 바와 같이, "지속가능하게 투여되는"은 본 발명의 활성 성분을 외부로부터 체내로의 지속 투여를 지칭하며, 이는 하기 단락 [0048] (번역문 <0287>)에 기재된 비경구 투여 경로를 선택하면서 경피 흡수, 주사, 주입 등을 통해 달성될 수 있다.
본원에 사용된 바와 같이, "임상적으로 유의한 기간"은 본원의 기재를 고려하면서 관련 기술분야에 공지된 연구결과들을 이용함으로써 관련 기술분야의 통상의 기술자에 의해 결정될 수 있다. 구체적으로, 본 발명이 목표로 하는 운동 합병증의 예방, 치료, 또는 완화와 같은 유의한 효과가 나타나는 경우, 그 기간은 임상적으로 유의한 기간으로 정의될 수 있다. 본원에 사용된 바와 같은 "임상적으로 유의한 개선"의 경우, 본 발명이 목표로 하는 운동 합병증의 예방, 치료, 또는 완화와 같은 유의한 효과가 나타나는 경우, 그 상태는 유사하게 임상적으로 유의한 개선으로 정의될 수 있다. 이러한 기간 또는 개선을 측정하는 방법은 관련 기술분야의 통상의 기술자에 의해 적절하게 선택될 수 있다. 예를 들어, 본원에 기재된 임의의 방법이 고려될 수 있다. 그러나, 상기 방법이 이에 제한되는 것은 아니다. 예를 들어, 일본 신경과학회에 의해 발행된 파킨슨병 진료 가이드라인 2018 버전 [Parkinson's Disease Diagnosis and Treatment Guidelines 2018 version]이 또한 사용될 수 있다. 대안적으로, 운동이상증 임상 평가 지수 (MDS UDysRS 파트 III)가 2.32점인 것으로 보고되어 있다 (Parkinsonism Relat Disord 21: 1349, 2015). 상기 방법은 (1) 플라시보와의 비교, (2) 각각의 환자에 대한 치료 전후 등을 고려하여 적절하게 결정될 수 있다.
본원에 사용된 바와 같이, "임상 효과를 달성하기에 충분한 기간" 및 "임상 효과를 달성하기에 충분한 수준"은 또한 본원의 기재를 고려하면서 관련 기술분야에 공지된 연구결과들을 이용함으로써 관련 기술분야의 통상의 기술자에 의해 결정될 수 있다. 구체적으로, 본 발명이 목표로 하는 운동 합병증의 예방, 치료, 또는 완화와 같은 임상 효과를 달성할 수 있는 기간 또는 수준을 측정할 수 있는 경우, 그 기간 또는 수준은 임상 효과를 달성하기에 충분한 기간으로 평가될 수 있다. 이러한 기간 또는 수준을 측정하는 접근법은 관련 기술분야의 통상의 기술자에 의해 적절하게 선택될 수 있다. 예를 들어, 본원에 기재된 임의의 방법이 고려될 수 있다. 그러나, 상기 방법이 이에 제한되는 것은 아니다. 예를 들어, 일본 신경과학회에 의해 발행된 파킨슨병 진료 가이드라인 2018 버전 [Parkinson's Disease Diagnosis and Treatment Guidelines 2018 version] 또는 미국 또는 유럽에서의 상응하는 가이드라인이 또한 사용될 수 있다.
본원에 사용된 바와 같이, "파킨슨병 환자에서 레보도파 유발 운동이상증 (PD-LID) 증상의 악화" "전혀 없음"은 이미 발생된 운동이상증 증상이 임상적으로 유의한 정도로 악화되지 않거나 유의하게 악화되지 않거나, 운동이상증 발현 기간이 연장되지 않고, 증상이 유의하게 악화되지 않고, 운동이상증의 반동 증상에서와 같이 심지어 일시적으로도 악화되지 않거나, 운동이상증이 새로 발생되지 않음을 의미한다. 운동이상증 증상은, 예를 들어, UPDRS, UDysRS, CDRS, AIMS 등을 사용한 측정, 또는 임상 기록 예컨대 환자 일지에 의해 확인할 수 있다.
본원에 사용된 바와 같이, "파킨슨병 환자의 레보도파 요법에 대한 반응의 질 악화"는 레보도파 요법에 대한 환자의 반응성에서의 임의의 감소를 지칭한다. 이러한 반응의 질 악화는 운동이상증 증상 등으로부터 측정할 수 있다. "파킨슨병 환자의 레보도파 요법에 대한 반응의 질 악화"의 "개선"은 각각의 환자의 레보도파 요법에 있어서의 운동이상증 증상의 정도의 개선을 지칭한다. 개선은 UPDRS, UDysRS, CDRS, AIMS 등을 사용한 측정, 또는 임상 기록 예컨대 환자 일지에 의해 확인할 수 있다.
본원에 사용된 바와 같이, "비경구 투여"는 경구 투여가 아닌 임의의 경로에 대한 투여 형태를 지칭한다. 바람직하게는, 파킨슨병에서 레보도파 유발 운동 합병증에 효과적인 방식 및 수준으로 탄도스피론을 투여하기 위한 임의의 방식이 이용된다. 비경구 투여 수단의 예는 경피 흡수 또는 경점막 흡수를 통한 투여, 뿐만 아니라 주사, 주입을 통한 투여, 및 그의 조합을 포함한다. 예를 들어, 경피 흡수 또는 경점막흡수를 통한 투여는 경피 투여 제제 예컨대 페이스트제, 접착제 제제, 또는 스프레이를 피부 또는 점막에 접촉시켜 제제 내의 약물이 피부 또는 점막을 통해 체내로 이동함으로써 효과를 발휘한다. 주사 또는 주입을 통한 투여의 예는 정맥내, 피내, 피하, 근육내, 및 장내 투여 (장 주입)를 포함하며, 이는 또한 볼루스 및/또는 지속 주입으로서 투여될 수 있다. 주사 또는 주입은 또 다른 제제 물질 예컨대 현탁제, 안정제, 및/또는 분산제를 포함하는, 유성 또는 수성 매질에 현탁액, 액제, 에멀젼, 또는 이식 작용제를 사용할 수 있다. 장내 투여 (장 주입)는 경피적 내시경 위조루술에 의한 튜브 또는 휴대용 주입 펌프를 사용함으로써 근위 소장으로 지속 약물 전달을 제공할 수 있다. 바람직한 실시양태에서, 비경구 투여는 지속 투여의 형태로 수행될 수 있다. 이러한 지속 투여는 경피 패치/테이프 등, 주사, 주입 등으로 달성될 수 있다.
본 발명에서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물은 바람직하게는, 장기간 동안 혈중 약물 농도를 유지할 수 있는 방법에 의해 투여되며, 보다 바람직하게는, 대사산물의 생성을 억제할 수 있는 방법에 의해 투여된다. 투여 방법의 예는 경피 투여 및 주사 예컨대 피하, 피내, 및 근육내 투여를 포함한다. 주사 예컨대 피하, 피내, 및 근육내 투여는 바람직하게는 혈중 농도를 지속시키는 투여 방법이 바람직하다. 특히, 경피 투여는 낮은 침습도를 갖고 어떤 병원 방문도 필요 없는 투여 방법이기 때문에 가장 선호된다.
본 발명에서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함한 비경구 투여에 의한 파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증의 치료, 개선, 진행 억제, 또는 예방은 본원의 발명 이외의 다른 활성 성분을 사용한 요법 또는 본원의 발명 이외의 치료 방법 및 조성물과 비교하여, 레보도파 작용 시간 (ON-time(온-타임))에 대한 어떤 유해 효과도 갖지 않고, 파킨슨병 증상에 대한 어떤 유해 효과도 갖지 않고 (UPDRS 등에 의해 평가될 수 있음), 반복 투여에 있어서 본 발명의 효과의 어떤 약화도 갖지 않고, 운동 합병증 등을 악화시키지 않으면서 레보도파 제제를 최적 용량으로 증가시킴으로써 1일 레보도파 제제의 용량 횟수를 감소시키는 능력 등의 관점에서 바람직하다.
"경피 투여 제제"는 페이스트제, 접착제 제제, 또는 스프레이 (에어로졸)를 지칭한다. 접착제 제제의 구체적 예는 테이프제 (경피 패치), 습포제, 석고 등을 포함하며, 페이스트제의 예는 연고, 크림, 로션, 도찰제, 액제, 겔 등을 포함한다. 경피 투여 제제는 바람직하게는 접착제 제제이고, 보다 바람직하게는 테이프제 (경피 패치)이다. "테이프제"는 본 발명에서 "패치"와 동의어이므로, 이들은 또한 본원에서 "테이프/패치"로서 표시된다.
경피 투여 제제는 제약상 허용되는 첨가제를 사용하여 공지된 방법으로 제조한다. 일 실시양태에서, 본 발명에 사용되는 경피 투여 제제는 지지체 상에 제공된 접착제층을 갖고, 접착제층은 열가소성 탄성중합체 등을 포함함으로써 제조될 수 있다. "열가소성 탄성중합체"는 가열시 연화되고 유동성을 나타내며, 냉각시 고무-유사 탄성체로 복귀하는 열가소성을 나타내는 탄성중합체이다. 그의 예는 다양한 열가소성 탄성중합체 예컨대 우레탄, 아크릴, 스티렌, 및 올레핀계 탄성중합체를 포함한다.
본 발명의 경피 투여 제제의 경우, 접착제층은 비휘발성 탄화수소 오일을 포함할 수 있다. 비휘발성 탄화수소 오일로서, 약 20 내지 40개의 탄소를 가진 쇄형 포화 탄화수소 또는 약 20 내지 40개의 탄소를 가진 쇄형 불포화 탄화수소가 바람직하다. 그의 예는 유동 파라핀, 스쿠알렌, 스쿠알란, 프리스탄 등을 포함한다. 특히, 이용 가능성의 관점에서 유동 파라핀이 보다 바람직하다. 유동 파라핀은 20개 이상의 탄소를 가진 무색, 무취의 액체 알칸의 혼합물이다. 본 발명에서, 일본 약전, 미국 약전 등에 특정된 사양에 따라 유동 파라핀을 바람직하게 사용할 수 있다. 높은 점도를 가진 비휘발성 탄화수소 오일이 바람직하다. 높은 점도를 가진 유동 파라핀을 사용하는 것이 접착력의 관점에서 특히 바람직하다.
접착제층은 또한 필요에 따라 점착부여제를 포함할 수 있다. 점착부여제는 일반적으로 접착제 제제의 관련 기술분야에서 피부 접착력을 부여하기 위해 통상적으로 사용되는 수지이다. 그의 예는 로진계 수지, 폴리테르펜 수지, 쿠마론-인덴 수지, 석유계 수지, 테르펜-페놀 수지, 지환족 포화 탄화수소 수지 등을 포함한다. 그 중 1종 이상을 그로부터 선택하여 사용할 수 있다.
경피 투여가 계획되면, 이는 또한 피부에 연고를 적용하여 실현될 수 있다.
테이프/패치 이외의, 본원에 개시된 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 비경구 투여 (예를 들어, 경피 투여)를 위한 투여 형태는 분말, 스프레이, 연고, 페이스트, 크림, 로션, 젤, 및 액체 용액을 포함할 수 있다.
연고, 페이스트, 크림 및 겔은 본원에 개시된 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물에 더하여, 첨가제, 예컨대 동물 및 식물 지방, 오일, 왁스, 파라핀, 전분, 트라가칸트, 셀룰로스 유도체, 폴리에틸렌 글리콜, 실리콘, 벤토나이트, 규산, 활석, 또는 산화아연, 또는 그의 혼합물을 포함할 수 있다.
분말 및 스프레이는 본원에 개시된 제약 조성물에 더하여, 첨가제 예컨대 락토스, 활석, 규산, 수산화알루미늄, 규산칼슘, 또는 폴리아미드 분말 또는 그의 혼합물을 포함할 수 있다. 스프레이는 통상적인 고압 가스 예컨대 클로로플루오로탄화수소 또는 휘발성 비치환 탄화수소 예컨대 부탄 또는 프로판을 추가로 포함할 수 있다.
연고에 더하여, 분말, 용액 등이 비경구 투여에 적합한 한, 본원의 개시내용의 범위 내에 있는 것으로 또한 이해된다.
비경구 투여에 적합한 조성물은 사용 직전에 무균 주사 용액 또는 분산액으로 재구성될 수 있는 제약상 허용되는 무균 등장성 수용액 또는 비수성 용액, 분산액, 현탁액, 에멀젼, 이식 작용제, 또는 무균 분말 중 적어도 1종 유형을 포함할 수 있다.
본원에 개시된 조성물은 직장 또는 질 투여를 위한 좌제로서 제조될 수 있다. 조성물은 본원의 개시내용에 따른 1종 이상의 화합물을 코코아 버터, 폴리에틸렌 글리콜, 좌약 왁스, 살리실레이트 등을 포함한 1종 이상의 적합한 비자극성 첨가제 또는 담체와 혼합함으로써 제조될 수 있다. 조성물은 실온에서 고체이나, 체온에서 액체이다. 따라서, 조성물은 직장 또는 질강에서 용융되어 본원의 개시내용에서 화합물을 방출한다. 질 투여에 적합한 제약 조성물은 선행 기술에서 적합한 것으로 공지된 담체를 포함하는, 페서리, 탐폰, 크림, 겔, 페이스트, 폼, 또는 스프레이 제제를 포함할 수 있다.
본원에 사용된 바와 같이, "약물 투여량"은 조성물에 함유된 약물의 양이다. 본원에 사용된 바와 같이, "약물 침투의 양"은 체내로의 약물 섭취의 양이다. 조성물이 경피 투여 제제인 경우, "약물 침투의 양"은 경피 투여 제제로부터 피부에 흡수된 약물의 양이며, 하기 방정식에 의해 계산된 값이다. "잔류 약물의 양"은 적용 후 박리된 경피 투여 제제에 남아 있는 약물의 양이다. 이 양은 실시예 (참조 제조 실시예) ([0098 내지 0101] (번역문 <0358> 내지 <0390>) 등에 기재된 방법에 의해 정량될 수 있다.
약물 침투의 양 (mg/day) = 약물 투여량 (mg/day) - 잔류 약물의 양 (mg/day)
본 발명에서, 약물 투여량, 약물 침투의 양, 잔류 약물의 양, 및 혈중 (혈장) 탄도스피론 농도는 특별히 달리 언급하지 않는 한, 탄도스피론 유리 형태로 환산하여 전환된 양이다.
본 발명에서, 탄도스피론 또는 그의 염의 투여량 또는 침투의 양은 화합물의 유형, 환자의 증상/연령/체중/신장 또는 간 기능 등에 따라 적절하게 조정될 수 있다. 예를 들어, 1일 약물 투여량은 0.1 내지 100 mg, 바람직하게는 0.2 내지 50 mg 등이다. 그 상한의 예는 100 mg, 80 mg, 50 mg, 30 mg, 15 mg 등을 포함한다. 하한의 예는 0.1 mg, 0.2 mg, 1 mg, 2 mg, 3 mg 등을 포함한다. 바람직한 범위의 예는 이들 상한 및 하한의 임의의 조합을 포함한다. 약물 침투의 1일 양은 0.1 내지 20 mg, 바람직하게는 0.2 내지 10 mg일 수 있다. 그 상한의 예는 20 mg, 10 mg, 8 mg, 7 mg, 5 mg, 3 mg 등을 포함한다. 하한의 예는 0.1 mg, 0.2 mg, 1 mg, 1.5 mg 등을 포함한다. 바람직한 범위의 예는 이들 상한 및 하한의 임의의 조합을 포함한다. 투여 빈도는 조성물의 성질에 따라 적절하게 조정될 수 있다. 조성물이 경피 투여 제제인 경우, 빈도는 예를 들어 12시간마다 1회 내지 7일마다 1회이다. 2일마다 1회, 3일마다 1회, 4일마다 1회 등과 같은, 그 사이의 임의의 빈도가 또한 선택될 수 있다. 조성물이 주사 제제인 경우, 빈도는 예를 들어 1일 1회 내지 3개월마다 1회이다. 1주 1회, 2주마다 1회, 4주마다 1회, 3개월마다 1회 등과 같은, 그 사이의 임의의 빈도가 선택될 수 있다. 또한, 펌프식 자동 주사기로 증상에 따라 투여 시간을 조정하여 24시간 지속 투여하거나, 환자가 깨어 있을 때만 투여하는 것이 가능하다. 작용제는 레보도파를 포함하는 제제와 혼합되어 지속가능하게 투여될 수 있다.
본 발명에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물는 바람직하게는 레보도파가 활성화되기를 바라는 기간 내에 유리 형태로 환산하여 전환된 양으로서 인간 혈중 (혈장) 탄도스피론 농도가 0.05 내지 20 ng/mL가 되도록 투여한다. 구체적으로, 기간은 1일 12시간 이상, 바람직하게는 16시간 이상이다.
인간 혈중 (혈장) 탄도스피론 농도의 예는 유리 형태로 환산하여 전환된 양으로서 0.05 내지 20 ng/mL 등을 포함한다. 그 상한의 예는 20 ng/mL, 15 ng/mL, 10 ng/mL, 8 ng/mL, 5 ng/mL 등을 포함한다. 하한의 예는 0.05 ng/mL, 0.1 ng/mL, 0.2 ng/mL, 0.5 ng/mL, 1 ng/mL 등을 포함한다. 바람직한 범위의 예는 이들 상한 및 하한의 임의의 조합을 포함한다. 상술한 인간 혈중 (혈장) 탄도스피론 농도는 1회 투여로 또는 반복 투여에 의한 유지 농도로서 달성될 수 있다.
본 발명에서, 인간 혈중 (혈장) 탄도스피론 농도의 최대값 (Cmax)의 예는 유리 형태로 환산하여 전환된 양으로서 0.1 내지 20 ng/mL 등을 포함한다. 그 상한의 예는 20 ng/mL, 15 ng/mL, 10 ng/mL, 8 ng/mL, 5 ng/mL 등을 포함한다. 하한의 예는 0.1 ng/mL, 0.2 ng/mL, 0.5 ng/mL, 1 ng/mL 등을 포함한다. 바람직한 범위의 예는 이들 상한 및 하한의 임의의 조합을 포함한다.
본 발명에서, 인간 혈중 (혈장) 탄도스피론 농도-시간 곡선 (AUC) 하 면적 의 예는 유리 형태로 환산하여 전환된 양으로서 3 내지 700 ng*h/mL 등을 포함한다. 그 상한의 예는 700 ng*h/mL, 600 ng*h/mL, 400 ng*h/mL, 300 ng*h/mL, 200 ng*h/mL 등을 포함한다. 하한의 예는 3 ng*h/mL, 5 ng*h/mL, 10 ng*h/mL, 30 ng*h/mL 등을 포함한다. 바람직한 범위의 예는 이들 상한 및 하한의 임의의 조합을 포함한다.
본 발명에서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는 조성물은 인간 혈중 (혈장) 탄도스피론 농도가 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 투여 후 8 내지 16시간 동안 0.05 내지 20 ng/mL가 되도록 투여되는 것을 특징으로 하는 조성물이다.
본 발명에서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는 조성물이 경피 투여 제제인 경우, 제제 적용 면적은 일반적으로 적절한 경우 조정될 수 있으나, 1회 용량당 총 적용 면적은 바람직하게는 1 내지 100 cm2이다. 그 상한의 예는 100 cm2, 50 cm2, 40 cm2, 30 cm2, 20 cm2 등을 포함한다. 하한의 예는 1 cm2, 2 cm2, 4 cm2, 9 cm2 등을 포함한다. 바람직한 범위의 예는 바람직한 치료 효과가 달성될 수 있게 하는, 이들 상한 및 하한의 임의의 조합을 포함한다.
본 발명의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물은 1회 용량 후 8시간 이내, 바람직하게는 6시간 이내, 보다 바람직하게는 4시간 이내 인간 혈중 (혈장) 탄도스피론 농도의 하한값을 초과하고, 인간 혈중 (혈장) 탄도스피론 농도는 1회 용량 후 최대 16시간, 바람직하게는 최대 18시간, 보다 바람직하게는 최대 20시간 동안 상한과 하한 사이의 범위로 유지된다.
본 발명에서, 탄도스피론 경피 투여 제제는 레보도파 함유 제제와의 공동 사용에 의한 파킨슨병의 요법을 위해 제공된다. 본 발명의 탄도스피론 경피 투여 제제는 탄도스피론 경피 투여 제제의 적용 6시간 후, 바람직하게는 8시간 후, 보다 바람직하게는 12시간 후 레보도파 함유 제제를 투여함으로써 바람직한 효과를 기대할 수 있다. 추가로, 제제를 미리 결정된 양의 시간마다 교체하여 탄도스피론 경피 투여 제제를 반복 투여함으로써 레보도파 함유 제제의 투여 시기에 의존하지 않고 안정적인 치료 효과를 달성한다.
이하에, 본 발명의 경피 투여 제제의 제조 방법을 기재하나, 본 발명이 이에 제한되는 것은 아니다.
본 발명의 경피 투여 제제는 통상적으로 공지된 방법에 의해 제조할 수 있다. 본 발명의 테이프제는, 예를 들어, 하기 제조 실시예 1에 따라 제조할 수 있다.
(제조 실시예 1)
테이프제 (경피 패치)의 통상적인 제조 방법이 설명되어 있다.
본 발명의 테이프제는 통상적인 방법에 의해 제조할 수 있다. 예를 들어, 테이프제는 미쓰오 마쓰모토(Mitsuo Matsumoto)(1985)가 감수한 "경피 적용 제제의 개발 매뉴얼" [Development manual for transdermally applied formulation]에 기재된 석고제의 제조에 관한 섹션에 따라 제조할 수 있다. 테이프제는 또한, 예를 들어, 문헌 ["Development of Portable Equipment for Manufacturing Transdermal Patches (MEMBRANE), 32(2), 116-119 (2007))"]에 기재된 장치, 방법 등에 의해 제조할 수 있다.
구체적으로, 본 발명의 테이프제의 제조에 있어서 접착제층을 형성하기 위해 접착 테이프의 일반적인 제조 방법을 적용할 수 있다. 그의 전형적인 예는 용매 코팅법이나, 핫멜트 코팅법, 전자빔 경화형 에멀젼 코팅법 등을 또한 사용할 수 있다.
용매 코팅법을 사용하여 접착제층을 형성하기 위해, 탄도스피론, 접착제 함유 혼합물, 침투 촉진제, 경화제, 및 기타 제제 구성요소를 유기 용매와 혼합하여 접착제층 혼합물을 제조하고, 혼합물을 지지체 또는 이형 라이너의 한쪽 면에 적용한 다음에, 유기 용매를 제거하고, 이형 라이너 또는 지지체를 건조 전 또는 후에 붙인다. 테이프제의 접착제층의 두께는 특히 제한되지는 않으나, 바람직하게는 약 10 μm 내지 약 400 μm, 보다 바람직하게는 약 20 μm 내지 약 200 μm, 더욱 보다 바람직하게는 약 50 μm 내지 약 180 μm, 특히 바람직하게는 약 70 μm 내지 약 150 μm이다.
(제조 실시예 2)
기타 비경구 투여 제제의 제조
연고를 공지된 방법으로 제조할 수 있다. 유지(oil and fat) 연고는 일반적으로 탄화수소 등의 유지 기질 예컨대 유지, 왁스, 또는 파라핀을 가열 및 용융하고, 활성 성분을 첨가하고, 혼합하여 활성 성분을 용해 또는 분산시킨 후, 전체 혼합물이 균질해질 때까지 혼합 및 혼련함으로써 제조할 수 있다. 수용성 연고는 일반적으로 수용성 기질 예컨대 마크로골을 가열 및 용융하고, 활성 성분을 첨가하고, 전체 혼합물이 균질해질 때까지 혼합 및 혼련함으로써 제조할 수 있다.
연고는 탄도스피론을 고급 알콜 예컨대 세탄올 또는 스테아릴 알콜, 고급 지방산 예컨대 미리스트산, 라우르산, 팔미트산, 스테아르산, 또는 리놀레산 또는 그의 에스테르, 왁스 예컨대 정제 라놀린, 스페르마세티, 계면활성제 예컨대 소르비탄 지방산 에스테르 또는 수크로스 지방산 에스테르, 및 탄화수소 예컨대 친수성 바셀린, 유동 파라핀 또는 플라스티베이스를 블렌딩함으로써 제조할 수 있다. 이러한 연고 제제의 조성은, 예를 들어 0.5 내지 10 중량%의 탄도스피론, 0.1 내지 5%의 고급 알콜, 1 내지 15 중량%의 고급 지방산 또는 그의 에스테르, 1 내지 10 중량%의 계면활성제, 4 내지 10 중량%의 왁스, 및 50 내지 80 중량%의 탄화수소이다. 연고는, 예를 들어, 탄도스피론 및 상술한 첨가제 구성요소를 첨가하고 성분을 가열하면서 혼합하고, 50 내지 100℃의 온도를 유지하고, 일단 모든 성분이 투명한 용해 용액이 되면, 성분을 균질화기 믹서로 성분을 균질하게 혼합한 다음에, 냉각하면서 교반하고 혼합물을 냉각시키는 것을 포함하는 제조 방법에 의해 수득할 수 있다.
피하, 피내, 또는 근육내 투여를 위한 주사제 또는 제제는 통상적으로 공지된 방법에 의해 제조될 수 있다. 이러한 주사제는 일반적으로 하기 방법에 의해 제조할 수 있다.
(i) 활성 성분을 직접 충전하거나, 첨가제를 첨가한 활성 성분을 주사용수, 기타 수용액 또는 비수성 용액 등에 용해, 현탁, 또는 유화하고 균질화하고, 용액을 주입 용기에 충전하고, 밀봉하고, 멸균한다.
(ii) 활성 성분을 직접 충전하거나, 첨가제를 첨가한 활성 성분을 주사용수, 기타 수용액 또는 비수성 용액 등에 용해, 현탁, 또는 유화하고 균질화하고, 용액을 무균 여과하거나 무균 제조하고 균질화한 다음에 주입 용기에 충전하고 밀봉한다.
주사제는 또한 용액에서 활성 성분의 분해 또는 불활성화를 방지하기 위해 동결건조된 주사제 또는 분말 주사제로서 제조될 수 있다.
동결건조된 주사제는 일반적으로 주사제용 용기에 활성 성분을 직접 충전하거나, 주사제용 용기에 활성 성분과 첨가제 예컨대 부형제를 주사용수에 용해시켜 무균 여과하여 충전한 다음에, 동결건조시키거나, 특수 용기에 성분을 동결건조시킨 다음에 용기에 그로 직접 충전함으로써 제조할 수 있다.
분말 주사제는 일반적으로 주사제용 용기를 무균 필터로 여과한 다음에 결정화하여 수득한 분말로 충전하거나 상기 분말에 멸균 첨가제를 첨가하여 제조할 수 있다.
예를 들어, 활성 성분 용액은 탄도스피론을, 계면활성제와 함께, 물, 유기 용매, 또는 물과 유기 용매의 혼합물에 용해시킴으로써 제조한다. 생성된 용액을 여과하고 멸균 필터로 멸균하여 무균 활성 성분 용액을 제조할 수 있다. 이와 관련하여, 상기 용해에 사용되는 용매 (물, 유기 용매, 또는 물과 유기 용매의 혼합물)는 유기 용매 또는 유기 용매와 물의 혼합물인 것이 바람직하고, 보다 바람직하게는 유기 용매와 물의 혼합물이다. 멸균 필터는 여과 및 멸균, 뿐만 아니라 원료에서 비롯한 이물질 또는 제조 공정 동안 혼입된 외인성 이물을 제거하는데 효과적이다.
계면활성제의 예는 폴리소르베이트 80, 폴리소르베이트 20, 폴리옥시에틸렌 경화 피마자유 50, 폴리옥시에틸렌 경화 피마자유 60, 폴록사머 188, 폴리옥시에틸렌 피마자유, 벤즈알코늄 클로라이드, 소듐 라우릴 술페이트 등을 포함하며, 그의 2종 이상이 또한 사용될 수 있다. 계면활성제는 바람직하게는 폴리소르베이트 80이다. 계면활성제는 바람직하게는 약 0.005% (w/v) 내지 약 10% (w/v)로 사용된다.
물로서, 정제수, 정제수와 동급 이상의 물, 또는 주사용수를 사용한다. 유기 용매의 예는 알콜 용매 (예를 들어 메탄올, 에탄올 등), 비양성자성 용매 (예를 들어 아세톤, 디메틸술폭시드, N,N-디메틸아세트아미드 등) 등을 포함하거나, 2종 이상의 용매가 사용될 수 있다. 유기 용매는 바람직하게는 1-프로판올, 메탄올, 에탄올, 2-프로판올, 아세톤, 디메틸술폭시드, 또는 N,N-디메틸아세트아미드이다.
본 발명의 주사제는 제제로 충전된 미리 충전된 주사기에 주사 바늘을 부착한 후 근육내 또는 피하 주사될 수 있다. 주사제는 또한 제제로 충전된 바이알과 같은 용기로부터 제제를 주사 바늘을 통해 주사 주사기로 흡인한 다음에, 근육내 또는 피하로 제제를 방출함으로써 투여될 수 있다. 더욱이, 제제는 제제를 바이알과 같은 용기에 충전하고 제제를 동결건조시킨 동결건조 제제, 또는 바이알과 같은 용기에 제제내 활성 성분 결정을 단리한 다음에 건조시킴으로써 수득된 건조 분말 결정을 충전함으로써 제조한 분말 충전 제제일 수 있다. 동결건조 제제 및 분말 충전 제제는 사용시 제제를 현탁액 용액을 가진 용기에 현탁시킴으로써 제조된 현탁액을 주사 바늘을 통해 용기로부터 주사 주사기로 흡인한 후 근육내 또는 피하 주사할 수 있다. 본 발명의 주사제는 또한 무바늘 주사기 (주사 장치에 혼입된 가스, 개시제, 스프링 등에 의해 발생하는 압력을 이용함으로써 주사 바늘 없이 투여할 수 있고, 용기에 충전된 약물 용액을 방출하는 메커니즘을 갖는 주사기)에 제제가 충전된 용기를 배치한 후 근육내 또는 피하 주사될 수 있다.
지속 분사 펌프 제조의 예
본 발명의 주사제는 시판되는 피하 지속 분사 펌프를 사용함으로써 지속가능하게 투여할 수 있다. 피하 지속 분사 펌프는 약물 저장 유닛 및 약물 지속 분사용 펌프를 갖는 주사 튜브를 통해 환자에게 지속가능하게 약물을 피하 주사하는 장치이다. 이러한 장치는 일반적으로 일정 기간 동안 분사량을 변경할 수 있는 내장형 시계 및 프로그램을 갖는다. 약물 저장 유닛은 약물 효능에 필요한 약물 농도로 조정된 약물 용액으로 충전된 밀봉된 용기이며, 펌프와 연결되는 약물 유입구 및 출구를 포함한다. 펌프는 약 0.1 mL/일 내지 10 mL/hr까지 미량의 액체를 주입할 수 있는 장치이며, 이는 정밀하게 미량의 약물 용액을 지속가능하게 주입할 수 있는 펌프이다. 약물 저장 단위는 무균적으로 보장된 탄도스피론 용액으로 충전되고 상기 용액을 저장한다.
지속 주사제는 장기간에 걸쳐 활성 성분을 방출시키기 위해 피하, 피내, 근육내 등에 투여하는 주사제이다. 지속 주사제는 일반적으로 활성 성분을 식물 오일 등에 용해 또는 현탁시키거나, 생분해성 거대분자 화합물을 사용하여 미소구체의 현탁액을 제조함으로써 통상적으로 공지된 방법에 의해 제조할 수 있다.
이식제(implanted agent)는 활성 성분을 장기간에 걸쳐 방출하기 위해, 피하, 근육 등에 이식용 기기를 사용하여 적용되거나 수술에 의해 적용되는 고체 또는 겔-유사 주사제이다. 이식 작용제는 일반적으로 공지된 방법으로 제조할 수 있다. 이식 작용제는 일반적으로 생분해성 거대분자 화합물을 사용하여 펠렛, 미소구체, 또는 겔-유사 제제를 제조함으로써 수득될 수 있다.
(조합 약물)
본 발명의 경피 투여 제제는 레보도파 이외의 기존 파킨슨병 치료제와 공동으로 사용될 수 있다. 파킨슨병에 대한 이러한 기존 치료 약물의 예는 도파민 효능제 (예를 들어 브로모크립틴, 퍼골리드, 탈리펙솔, 카베르골린, 프라미펙솔, 로피니롤, 로티고틴 등), 모노아민 옥시다제 B (MAOB) 억제제 (예를 들어 셀레길린, 라사길린, 및 사피나미드), 카테콜-O-메틸트랜스퍼라제 (COMT) 억제제 (예를 들어, 엔타카폰), 아만타딘, 아포모르핀, 이스트라데필린, 항콜린성 약물 (예를 들어, 비페리덴, 트리헥시페니딜, 프로페나민, 및 마자티콜), 티아프리드, 드록시도파, 카르비도파, 조니사미드 등을 포함하나, 이에 제한되지는 않는다.
본 발명은 참조 실시예, 실시예, 및 시험 실시예로 보다 상세히 구체적으로 기재되나, 본 발명은 이에 제한되지는 아니다. 하기 참조 실시예, 실시예 등에서 사용된 화합물명은 IUPAC 명명법을 반드시 따를 필요는 없다.
실시예
실시예는 이하에 기재된다.
실시예에 기재된 제품은 구체적 시약으로서 사용되었지만, 다른 제조사 (시그마-알드리치(Sigma-Aldrich), 와코 퓨어 케미컬(Wako Pure Chemical), 나칼라이 테스크(Nacalai Tesque), 알앤디 시스템즈(R&D Systems), USCN 라이프 사이언스 인크(Life Science INC) 등)로부터의 동등한 제품으로 대체 가능할 수 있다.
(제조 실시예)
참조 제조 실시예 1: 탄도스피론의 제조
탄도스피론 ((1R,2S,3R,4S)-N-[4-[4-(피리미딘-2-일)피페라딘-1-일]부틸]-2,3-비시클로[2.2.1]헵탄디카르복스이미드)는 하기에 제시된 화학식을 갖는다. 그의 제조 방법은 일본 공개공보번호 58-126865에 기재되어 있다. 그의 설명은 본원에 참조로 포함된다.
[화학식 2]
(참조 제조 실시예: 탄도스피론 테이프제의 제조)
(탄도스피론 테이프제의 제조)
아크릴 접착제 (MAS683, 코스메드 파마슈티칼 콤파니 리미티드(CosMED Pharmaceutical Co. Ltd.), 35.6 중량% 고형분, 12.5068 g), 에틸 아세테이트 (1.5 mL), 및 폴리옥시에틸렌 라우릴 에테르 (0.2530 g)를 혼합하였다. 탄도스피론 (0.32512 g)의 에틸 아세테이트 (5.5 mL) 용액을 제조하고 접착제의 혼합물에 첨가하고 완전히 교반하였다. 생성된 혼합물을 지지체에 바르고 실온에서 1일 동안 건조시켰다. 이어서 이형 라이너를 그와 함께 붙여서 탄도스피론 테이프제를 제조하였다.
(플라시보 테이프제의 제조)
아크릴 접착제 (MAS683, 코스메드 파마슈티칼 콤파니 리미티드, 35.6 중량% 고형분, 18.6962 g), 에틸 아세테이트 (5.5 mL), 및 폴리옥시에틸렌 라우릴 에테르 (0.3520 g)를 혼합하고 완전히 교반하였다. 생성된 혼합물을 지지체에 바르고 실온에서 1일 동안 건조시켰다. 이어서 이형 라이너를 그와 함께 붙여서 플라시보 테이프제를 제조하였다.
쓰리엠 헬쓰 케어 리미티드(3M Health Care Ltd.)로부터의 50.8 μm의 폴리에틸렌 테레프탈레이트 및/또는 에틸렌 비닐 아세테이트 공중합체 라미네이트 필름 (스카치팩(Scotchpak) #9732)을 지지체로서 사용하였다. 후지모리 고쿄 가부시키 가이샤(Fujimori Kogyo Co., Ltd.)로부터의 비나시트(Bynasheet) 64S-018B를 이형 라이너로서 사용하였다.
<표 1>
표. 탄도스피론 테이프제 중 약물 함량
테이프제 중 약물의 양 (약물 투여량) 및 잔류 약물의 측정
하기에 약물 투여량 및 잔류 약물의 양에 대한 측정 조건의 예를 기재하지만, 탄도스피론의 약물 투여량 또는 잔류 약물의 양을 측정할 수 있는 것으로 검증된 또 다른 측정 방법을 대신 사용할 수 있다.
<측정 조건의 예>
표준 용액의 제조
탄도스피론 용액 (약 4, 20 또는 100 μg/mL)을 제조한다.
제제 용액의 제조
(1) 테이프제를 용기에 넣는다. 10 mL의 아세톤을 첨가하고, 그 위에 초음파를 30분 동안 조사한다.
(2) 1 mL의 메탄올을 (1)의 1 mL 추출물에 첨가하고 혼합한다.
(3) 용액을 필터 (밀리포어(Millipore): 밀렉스(Millex)-FH (0.45 μm, PTFE))로 여과한다.
고성능 액체 크로마토그래피 (HPLC) 조건
컬럼: YMC-팩(Pack) ODS-AM 250 x 4.6 mm (입자 크기: 5 μm)
컬럼 오븐: 40℃
검출기: 자외선 흡수 분광광도계 (측정 파장: 240 nm)
유량: 0.9 mL/분
주입량: 10 μL
이동상: 10 mM 포스페이트 완충제 (pH 6.8)/아세토니트릴 혼합물 (35:65)
(혈장 농도의 평가)
1. 시험 방법
1.1. 전처리 조작 방법
50 μL의 래트 혈장 샘플을 폴리프로필렌 마이크로튜브로 분획화하였다. 50 μL의 메탄올 (50 μL의 검량 곡선 샘플용 표준 용액) 및 200 μL의 내부 표준 용액 (베자피브레이트 메탄올 용액: 200 nmol/L, 블랭크 샘플용 200 μL의 메탄올)을 넣고 약 10초 동안 믹서로 교반하였다. 이를 원심분리 (4℃, 4500 rpm, 10분)한 다음에, 상청액을 필터 (패스트리무버(FastRemover) MF 0.2 μm)를 사용하여 진공 여과하였다. 70 μL의 10 mmol/L 암모늄 아세테이트 수용액을 70 μL의 생성된 여액에 첨가하고 믹서로 약 10초 동안 교반하여 측정 샘플을 제조하였다.
탄도스피론 농도는 액체 크로마토그래피-질량 분석법에 의해 측정하였다.
1.2. 측정 조건
컬럼: XSELECT CSH C18, 3.5 μm, 100 x 3.0 mm I.D.
컬럼 온도: 50℃
이동상 A: 10 mmol/L 암모늄 아세테이트 수용액
이동상 B: 메탄올
유량: 0.6 mL/분
구배 조건:
<표 2>
이온화 방법: 전자분무 이온화
검출 방법: 다중 반응 모니터링, 양이온 검출 모드
모니터 이온: 384.2/122.1(탄도스피론 Q1/Q3, m/z), 362.02/138.9 (베자피브레이트 Q1/Q3, m/z)
(실시예 1: 탄도스피론 테이프제를 정상 래트에 적용시 혈장 농도 변화의 평가)
(시험 방법)
위스타르(Wistar) 수컷 래트 (14-주령, 저팬 에스엘씨, 인크.(Japan SLC, Inc.))를 사용하였다. 테이프제 평가일 이전에 래트의 복부를 제모하고, 평가일에 복부에 제제 1의 테이프제를 적용하였다 (크기는 9 cm2이었다). 혈장 탄도스피론 농도를 분석하기 위해 적용에 의한 투여로부터 2, 4, 6, 및 24시간 후에 시간에 따라 혈액을 수집하였다. 결과는 평균값 ± 표준 편차로 나타냈다.
(결과)
탄도스피론 테이프제 (9 cm2: 31 ± 2 cm2/kg)를 적용함으로써 도 1에 나타낸 혈장 탄도스피론 농도의 변화를 관찰하였다. 테이프제가 탄도스피론의 혈중 농도를 매끄럽게 하고 지속시킨다는 것을 확인하였다.
(실시예 2: 탄도스피론 테이프제의 운동이상증 개선 효과의 평가)
뇌의 한쪽 면에 6-히드록시도파민 (이하에, "6-OHDA"라고도 함)의 국소 투여를 사용한 래트의 선조체 도파민성 탈신경 모델은 PD-LID (한쪽 면이 6-OHDA로 처리된 래트 (6-OHDA-병변 래트))에 대한 전형적인 실험 모델로서 공지되어 있다. 운동이상증-유사 비정상적 불수의 운동 (AIM)은 레보도파의 반복 투여로 상기 모델에서 나타난다 (Lundblad et al., European Journal of Neuroscience, 2002, 15: 120-132, Winkler et al., Neurobiology of Disease, 2002, 10: 165-186).
(시험 방법)
위스타르 수컷 래트 (12-주령, 저팬 에스엘씨, 인크.)를 동물 모델 제조에 사용하였다. 데시프라민 히드로클로라이드 (25 mg/kg; 와코 퓨어 케미컬)를 복강내 투여하였다. 투여 30분 후, 실험 동물용 전신 마취 장치를 사용하여 이소플루란 흡입 마취제를 래트에 적용하였다. 이소플루란 마취 하에, 래트를 뇌 정위 기기에 고정시켰다. 머리의 피부를 수술용 메스로 절개하여 두개골을 노출시켰다. 기점으로 사용된 브레그마의 좌표 (AP: 0, ML: 0, DV: 0)를 결정하고, 우측 내측전뇌속의 좌표 (브레그마로부터 AP: -4.4 mm, ML: 1.5 mm, DV: 7.8 mm)를 측정하였다. 측정된 좌표에 투여용 주입관을 삽입한 후, 도파민성 탈신경을 유도하는 6-OHDA (9 μg/4 μL; 시그마-알드리치)를 국소적으로 주사하였다. 수술 2주 후, 아포모르핀히드로클로라이드 반수화물 (0.5 mg/kg; 와코 퓨어 케미컬)을 피하 투여하고, 6-OHDA 주입 부위로부터 반대측으로의 회전 운동을 관찰하였다. 한쪽 면이 6-OHDA로 처리된 래트로서 분당 7회전 이상의 래트를 사용하였다.
PD-LID 모델을 제조하기 위해, 식염수에 용해된 레보도파 메틸 에스테르 히드로클로라이드 (6 mg/kg; 시그마-알드리치)와 벤세라지드 히드로클로라이드 (15 mg/kg; 시그마-알드리치) (이하에, "레보도파 함유 용액"이라고도 함)을 6-OHDA-병변 래트에게 1일 1회 복강내 투여하였다. 레보도파 함유 용액을 3주 이상 동안 반복 투여하여 거동을 관찰하고 평가하였다. 레보도파 함유 용액의 복강내 투여로부터 20분 후부터 20분마다 1분 동안, 투여로부터 3시간 후까지, 거동을 투명 아크릴 케이지에서 관찰하고 평가하였다. 거동 관찰을 사지 AIM (장애 반대측 앞다리의 불수의 굽힘 또는 스트레칭, 손 벌림/닫힘, 손목의 위아래 움직임, 무도병-유사 진전, 근육긴장이상-유사 강직), 축 AIM (상체/목을 장애의 반대측으로 비틀기, 균형 상실 및 넘어짐, 불안정한 자세 유지), 구설 AIM (턱의 떨림 또는 격렬하게 혀를 앞으로 내미는 것), 및 보행적 거동(Locomotive behavior) (파괴의 다른 측면에 대한 회전 거동)으로 분류하였으며, 0에서 4까지의 점수를 주었다 (0: 없음, 1: 30초 미만의 발현, 2: 30초 이상의 발현, 3: 끊임없이, 그러나 소리와 같은 자극으로 정지, 및 4: 소리와 같은 자극으로 정지하지 않는 끊임없는 발현). 3시간 내에 사지 AIM, 축 AIM 및 구설 AIM에 대한 점수의 합을 총 AIM 점수로서 사용하였다. 10 미만의 총 AIM 점수를 가진 개체는 운동이상증-유사 증상을 나타내지 않는 것이므로 시험으로부터 제외하였다. 약물 평가일 이전에 거동을 관찰하고 평가하였다. 약물 평가에 사용된, 3시간 AIM 점수, 보행적 거동 점수, 및 래트 체중을 지표로서 사용하여 각각의 투여군에 래트를 할당하였다.
(경피 투여 (조건 1))
테이프제를 평가할 때, 평가일 이전에 래트의 복부 털을 제모하였다. 제제 2의 테이프제는 평가일에 래트의 복부에 60 cm2/kg (37 mg/kg)으로 적용하였다. 적용으로부터 4시간 후, 레보도파 함유 용액을 복강내 투여하여 거동을 관찰하고 평가하였다. 시험 동안 테이프제가 50% 이상 떨어져 나온 개체는 분석으로부터 제외하였다. 거동의 관찰 및 평가가 완료된 후, 혈장을 수집하여 혈장 탄도스피론 농도를 분석하였다.
(경피 투여 (조건 2))
각질층 박리 상태 (탄도스피론 고노출 상태) 하에 테이프제를 평가할 때, 평가일에 트랜스포(transpore) 수술용 테이프 (3M)를 사용하여 래트의 복부에 10회 박리를 수행한 다음에, 제제 3의 테이프제를 60 cm2/kg (45 mg/kg)으로 적용하였다. 적용으로부터 4시간 후, 레보도파 함유 용액을 복강내 투여하여 거동을 관찰하고 평가하였다. 시험 동안 테이프제가 50% 이상 떨어져 나온 개체는 분석으로부터 제외하였다. 거동의 관찰 및 평가가 완료된 후, 혈장을 수집하여 혈장 탄도스피론 농도를 분석하였다.
운동이상증-유사 증상을 평가할 때, 각각 평가점에서의 사지 AIM, 축 AIM, 구설 AIM의 합을 AIM 점수로서 사용하였다. 시험 결과에 대한 통계적 분석은 3시간 동안의 AIM 점수의 합인, 총 AIM 점수, 및 100분 내지 180분 내에 총 AIM 점수를 파라미터로 사용하여 윌콕슨 순위합 검정에 의해 수행하였다. **는 p < 0.01을 나타내며, 이는 플라시보 테이프제 적용군과 비교하여 유의한 차이가 있음을 의미한다. 도면에서의 결과는 평균값 ± 표준 오차로 환산하여 표시된다.
(결과)
탄도스피론을 경피 투여 (조건 1)를 통해 탄도스피론 테이프제 (제제 2: 37 mg/kg의 약물 투여량)를 적용함으로써 경피 흡수한 경우, 총 AIM 점수는 12.6이었다. 탄도스피론이 없는 플라시보 테이프제의 적용과 비교하여, 총 AIM 점수가 17.7로 감소하여, 운동이상증-유사 증상에서 유의한 개선이 관찰되었다 (도 2-A 및 B). 추가로, 레보도파 투여 후 120 내지 140분에 플라시보 테이프제 적용군 또는 탄도스피론 테이프제 적용군에서 분명한 운동이상증-유사 증상 (2 이상의 평균 AIM 점수)이 관찰되지 않았다. 100분 내지 180분 내에 총 AIM 점수에서는 두 군 간에 유의한 차이가 발견되지 않았다 (도 2-C). 거동의 관찰 및 평가가 완료된 후 측정한 혈장 탄도스피론 농도의 평균값은 71.8 ng/mL이었다.
고노출 탄도스피론을 경피 투여 (조건 2)를 통해 각질층 박리 상태 하에 탄도스피론 테이프제 (제제 3: 45 mg/kg의 약물 투여량)를 적용함으로써 경피 흡수한 경우, 총 AIM 점수는 5.8이었다. 탄도스피론이 없는 플라시보 테이프제의 적용과 비교하여, 총 AIM 점수가 27.1 감소하여, 운동이상증-유사 증상에서 유의한 개선이 관찰되었다. 투여 조건 1 하에서보다 투여 조건 2 하에서 더 높은 개선 효과가 관찰되었다 (도 3-A 및 B). 추가로, 각질층 박리 상태에서 레보도파 투여 후 120 내지 140분에 플라시보 테이프제 적용군 또는 탄도스피론 테이프제 적용군에서 분명한 운동이상증-유사 증상 (2 이상의 평균 AIM 점수)이 관찰되지 않았다. 100분 내지 180분 내에 총 AIM 점수에서는 두 군 간에 유의한 차이가 발견되지 않았다 (도 3-C). 거동의 관찰 및 평가가 완료된 후 측정한 혈장 탄도스피론 농도의 평균값은 269 ng/mL이었다. 투여 조건 2 하에 혈장 탄도스피론 농도의 평균값은 투여 조건 1 하에서의 것보다 3배 이상 높았다.
상기 결과를 고려하여, 탄도스피론 경피 투여 제제는 반동 증상 없이 PD-LID 증상을 개선시켰다.
추가로, PD-LID에 대한 효과 및 탄도스피론의 항불안 작용은 비임상 모델에서 동일한 투여량에서 발휘되는 것으로 밝혀졌다. 래트 보겔 갈등 시험(Vogel conflict test) 모델을 사용하여 항불안 작용을 평가하고, PD-LID에 대한 효과를 6-OHDA-병변 래트에서 평가하였다. 따라서, 본 발명의 치료 효과는 항불안 약물로서 시판되는 탄도스피론 시트레이트 정제 (세디엘정)와 동일한 혈중 농도에서 발휘된다.
(실시예 3: 탄도스피론의 지속적인 피하 주입에 따른 운동이상증 개선 효과의 평가)
운동이상증-유사 증상에 대한 탄도스피론의 효능은 PD-LID 래트 모델에 탄도스피론의 지속적인 피하 주입에 의해 평가하였다.
(시험 방법)
실시예 2와 같이, 레보도파 함유 용액을 6-OHDA-병변 래트에 3주 이상 동안 반복 투여하여 거동을 관찰하고 평가하였다. 거동은 약물 평가일 이전에 관찰하고 평가하였다. 약물 평가에 사용된, 3시간 AIM 점수, 보행적 거동 점수, 및 래트 체중을 지표로서 사용하여 각각의 투여군에 래트를 할당하였다. 그러나, 10 미만의 총 AIM 점수를 가진 개체는 운동이상증-유사 증상의 발현이 없는 것이므로 시험으로부터 제외하였다. 또한, 평균 체중으로부터 10% 이상 벗어나는 체중을 갖는 개체를 또한 시험으로부터 제외하여 각각의 개체에 대한 투여량의 편차를 최소화하였다.
탄도스피론 (유리 형태)을 1M 염산 (나칼라이 테스크)에 용해시키고 식염수로 희석하고 0.05, 0.25 또는 1.25 mg/kg/시간으로 조정하였다. 제조된 용액은 ALZET(등록 상표) 삼투 펌프(Osmotic Pump) 모델 2ML1 (9.68 μL/시간, 듀렉트(DURECT))에 주입 후 사용하였다.
탄도스피론 또는 용매가 주입된 삼투 펌프를 n = 6인 각각의 군의 래트의 피부 아래에 이식하였다. 4시간 후, 레보도파 함유 용액을 투여하여 거동을 관찰하고 평가하였다. 거동의 관찰 및 평가 후, 탄도스피론 투여군의 래트로부터 혈액을 수집하여 혈장 탄도스피론 농도를 분석하였다.
도면에서의 결과는 평균값 ± 표준 오차로 환산하여 표시된다. 시험 결과는 3시간 내 총 AIM 점수 및 100분 내지 180분 내 총 AIM 점수를 파라미터로 사용하여 스틸 검정에 의해 용매 투여군과 비교하여 통계적으로 분석하였다. *는 p < 0.05를 나타내며, 이는 유의한 차이가 있음을 의미한다.
(결과)
탄도스피론의 지속적인 피하 주입은 운동이상증-유사 증상을 용량-의존적으로 개선시켰고, 1.25 mg/kg/시간에서 유의한 개선이 관찰되었다 (도 4-A 및 B). 레보도파 투여 후 120 내지 140분에 용매 투여군과 탄도스피론 투여군 둘 다에서 분명한 운동이상증-유사 증상 (2 이상의 평균 AIM 점수)은 발견되지 않았다. 더욱이, 총 AIM 점수는 탄도스피론의 지속적인 피하 주입에 의해 용량-의존적으로 감소하였고, 100분 내지 180분 내에 총 AIM 점수에서 1.25 mg/kg/시간에서 유의한 개선이 관찰되었다 (도 4-C). 거동 관찰 및 평가가 완료된 후 측정한 혈장 탄도스피론 농도의 평균값은 0.05 mg/kg/시간에서 23.5 ng/mL, 0.25 mg/kg/시간에서 119 ng/mL, 및 1.25 mg/kg/시간에서 541 ng/mL이었다.
결과를 고려하여, 탄도스피론의 지속적인 피하 주입은 용량-의존적으로 운동이상증-유사 증상을 개선시켰다. 투여는 어떠한 투여량에서도 반동 증상을 야기하지 않았다.
(실시예 4: 탄도스피론의 지속적인 피하 주입의 장기간 운동이상증 개선 효과의 평가)
운동이상증-유사 증상에 대한 탄도스피론의 효능의 지속성은 PD-LID 래트 모델에 2주에 걸쳐 탄도스피론을 지속적으로 피하 주입하여 평가하였다.
(시험 방법)
레보도파 함유 용액을 6-OHDA-병변 래트에 3주 이상 반복 투여하여 실시예 2와 동일한 방법으로 거동을 관찰하고 평가하였다. 15 미만의 총 AIM 점수를 가진 개체는 운동이상증-유사 증상을 나타내지 않으므로 시험으로부터 제외시켰다. 거동은 약물 평가일 이전에 관찰하고 평가하였다. 약물 평가에 사용된, 3시간 AIM 점수, 보행적 거동 점수, 및 래트 체중을 지표로서 사용하여 각각의 투여군에 래트를 할당하였다.
탄도스피론 시트레이트 1M 염산 (나칼라이 테스크)에 용해시키고 식염수로 희석하고 60 mg/mL 농도 (시트레이트 농도)로 조정하였다. 제조된 용액은 ALZET(등록 상표) 삼투 펌프 모델 2ML2 (4.53 μL/시간; 듀렉트)에 주입한 후 사용하여 2주 동안 안정한 속도로 약물 용액을 방출하도록 하였다.
탄도스피론 시트레이트 또는 용매가 주입된 삼투 펌프를 n = 8을 가진 래트의 피부 아래에 이식하였다. 4시간 후, 레보도파 함유 용액을 투여하여 거동을 관찰하고 평가하였다 (펌프 이식 0일차). 그 후 레보도파 함유 용액을 1일 1회 반복 투여하였다. 거동은 펌프 이식 13일차에 또한 관찰하고 평가하였다. 거동의 각각의 관찰 및 평가 후, 탄도스피론 투여군에서 래트의 절반 (n = 4)으로부터 혈액을 수집하여 혈장 탄도스피론 농도를 분석하였다.
도면에서의 결과는 3시간 내 총 AIM 점수의 평균값 ± 표준 오차로 환산하여 표시된다. 시험 결과는 총 AIM 점수를 파라미터로 사용하여 윌콕슨 순위합 검정을 사용하여 통계적으로 분석하였다. **는 p < 0.01을 나타내며, 이는 용매 투여군과 비교하여 유의한 차이가 있음을 의미한다.
(결과)
탄도스피론 시트레이트 (60 mg/mL: 탄도스피론 시트레이트로서 평균 0.78 mg/kg/시간)의 지속적인 피하 주입으로부터 펌프 이식 0일차에 용매군과 비교하여 운동이상증-유사 증상의 유의한 개선이 관찰되었다 (도 5-A). 거동의 관찰 및 평가가 완료된 후 측정한 혈장 탄도스피론 농도의 평균값 (유리 형태로 환산하여 전환된 값)은 281 ng/mL이었다. 펌프 주입 13일차에 용매군에 비해 운동이상증-유사 증상의 유의한 개선이 또한 관찰되었다 (도 5-B). 거동의 관찰 및 평가가 완료된 후 측정한 혈장 탄도스피론 농도의 평균값 (유리 형태로 환산하여 전환된 값)은 143 ng/mL이었다.
결과를 고려하여, 탄도스피론을 13일 동안 지속적으로 피하 주입한 후에도 PD-LID 증상 개선 효과가 지속되었다.
(실시예 5: 운동이상증의 발현 예방/억제에 대한 탄도스피론의 지속적인 피하 주입의 효과의 평가)
운동이상증-유사 비정상적 불수의 운동은 6-OHDA-병변 래트에 레보도파를 반복 투여할 때 나타난다. 이와 관련하여, 운동이상증-유사 증상의 발현 예방에 대한 탄도스피론의 효과는 레보도파 반복 투여 시작 직후부터 탄도스피론을 피하 지속 투여하여 평가하였다.
(시험 방법)
탄도스피론 시트레이트를 1M 염산 (나칼라이 테스크)에 용해시키고 식염수로 희석하고 60 mg/mL 또는 30 mg/mL의 농도로 조정하였다. 제조된 용액은 ALZET(등록 상표) 삼투 펌프 모델 2ML2 (4.53 μL/시간; 듀렉트)에 주입 후 사용하였다.
아포모르핀 히드로클로라이드 반수화물 유도 회전수 및 체중을 지표로 하여 6-OHDA-병변 래트를 각각의 투여군에 할당하였다. 실시예 2와 동일한 조성을 가진 레보도파 함유 용액의 반복 투여를 시작한 다음 날 래트의 피부 아래에 탄도스피론 시트레이트 또는 용매가 주입된 삼투 펌프를 이식하였다. 거동은 레보도파 반복 투여를 시작한 후 3일, 5일, 9일 및 15일차에 실시예 2와 동일한 방법을 사용하여 관찰하고 평가하였다. 피하 이식된 삼투 펌프는 15일차 거동의 관찰 및 평가 후 회수하였다. 거동은 다음 날 (레보도파 반복 투여 16일차)에 또한 관찰하고 평가하였다.
도면에서의 결과는 3시간 내 총 AIM 점수의 평균값 ± 표준 오차로 환산하여 표시된다. 시험 결과는 반복 레보도파 투여의 16일차에 총 AIM 점수를 파라미터로하는 스틸 검정을 사용하여 용매 투여군과 비교하여 통계적으로 분석하였다. *는 p < 0.05를 나타내며, **는 p < 0.01을 나타내며, 이는 용매 투여군과 비교하여 유의한 차이가 있음을 의미한다.
(결과)
탄도스피론 시트레이트의 지속적인 피하 주입 (30 mg/mL: 평균 0.41 mg/kg/시간 또는 60 mg/mL: 평균 0.83 mg/kg/시간)은 용매군과 비교하여 레보도파의 반복 투여와 연관된 총 AIM 점수의 증가를 억제하였다 (도 6-A). 총 AIM 점수는 탄도스피론 시트레이트 투여 완료 다음날 용매군과 비교하여 탄도스피론 시트레이트 투여군에서 유의하게 낮았다 (도 6-B).
결과를 고려하여, 탄도스피론의 지속적인 피하 주입은 PD-LID의 발병을 예방하였고, 그의 효과는 또한 탄도스피론의 최종 투여 다음날까지 지속되었다.
(비교 실시예 1: 운동이상증 증상에 대한 탄도스피론의 경구 투여 평가)
(시험 방법)
거동은 실시예 2와 동일한 방법으로 관찰하고 평가하였다. 탄도스피론 시트레이트를 0.5% 메틸셀룰로스 용액에 현탁하고 래트에게 경구 투여하였다. 5분 후, 레보도파 함유 용액을 복강내 투여하고, 거동을 관찰하고 평가하였다. 도면에서의 결과는 평균값 ± 표준 오차로 환산하여 표시된다. 시험 결과는 3시간 내 총 AIM 점수 및 100분 내지 180분 내에 총 AIM 점수를 파라미터로 사용하여 스틸 검정에 의해 용매 투여군과 비교하여 통계적으로 분석하였다. *는 p < 0.05를 나타내며, 이는 유의한 차이가 있음을 의미한다.
(결과)
(1) 운동이상증-유사 증상
탄도스피론 시트레이트 (시트레이트 농도로서 10, 30, 또는 100 mg/kg) 경구 투여군에서, 총 AIM 점수의 유의한 변화는 용매 투여군과 비교하여 관찰되지 않았다 (도 7 및 8-A 및 B) . 결과는 PD-LID가 탄도스피론 경구 투여 제제로 개선될 수 없음을 시사한다.
레보도파 투여 후 120 내지 140분에, 용매 투여군에서는 운동이상증-유사 증상이 가라앉았으나, 탄도스피론 시트레이트 경구 투여군 (30 또는 100 mg/kg)에서 분명한 운동이상증-유사 증상 (2 이상의 평균 AIM 점수)이 관찰되었다. 더욱이, 100분 내지 180분 내에 총 AIM 점수를 지표로서 사용하여 용매 투여군과 탄도스피론 시트레이트 경구 투여군을 비교한 경우, 용매 투여군과 비교하여 탄도스피론 시트레이트 경구 투여군 (30 또는 100 mg/kg)에서 총 AIM 점수의 유의한 증가가 관찰되었다 (도 7 및 8-C). 결과는 탄도스피론의 경구 투여용 제제에서 지연 발현 및 운동이상증-유사 증상의 악화 (운동이상증의 반동 증상)와 함께 현상의 발현 가능성을 시사한다.
상기를 고려하여, 탄도스피론 경구 투여군에서 PD-LID 래트 모델에서는 운동이상증 증상의 개선이 관찰되지 않았다 (표 3-(i)). 높은 투여량 경구 투여군에서는 운동이상증의 반동 증상이 관찰되었다 (표 3-(ii)). 결과를 고려하여, 탄도스피론의 경구 투여는 운동이상증의 개선의 불충분한 효과를 가지며, 반동 증상을 나타낼 위험을 갖는다. 따라서, 레보도파 제제와의 조합 요법은 적합하지 않을 수 있다.
<표 3>
경피 투여와 경구 투여에 대한 운동이상증-유사 증상 점수의 비교
투여량은 탄도스피론 유리 형태로 환산하여 전환된 수치로 기재되었다. 3시간 내에 총 AIM 점수의 차이 (#1)를 운동이상증 증상의 개선 정도의 지표로서 사용하고, 100분 내지 180분 내에 총 AIM 점수의 차이 (#2)를 운동이상증의 반동 증상의 지표로서 사용하였다.
(#1) 3시간 내에 총 AIM 점수 차이 = (플라시보 테이프제 또는 용매 투여군의 총 AIM 점수) - (탄도스피론 투여군의 총 AIM 점수)
(#2) 100분 내지 180분 내에 총 AIM 점수 차이 = (플라시보 테이프제 또는 용매 투여군의 100분 내지 180분 내에 총 AIM 점수) - (탄도스피론 투여군의 100분 내지 180분 내에 총 AIM 점수)
**: 유의한 차이가 있음 (p < 0.01), *: 유의한 차이가 있음 (p < 0.05)
표 3에 나타낸 바와 같이, 레보도파 유발 운동이상증 증상 개선의 유의한 차이가 경구 투여에서는 밝혀지지 않았으나, 경피 투여에서는 그의 유의한 개선이 밝혀졌다.
경구 투여는 운동이상증의 반동 증상을 갖는 것으로 또한 새로 밝혀졌으며, 따라서 탄도스피론의 경구 투여에 의한 요법은 바람직하지 않은 것으로 밝혀졌다. 한편, 경피 투여의 경우 운동이상증의 반동 증상이 관찰되지 않았다.
상기를 고려하여, 레보도파 유발 운동이상증 증상에 대한 탄도스피론 경구 투여의 치료 효과는 제한적이며, 이는 탄도스피론 경피 투여가 바람직함을 시사한다.
(비교 실시예 2: 운동이상증 증상에 대한 탄도스피론 대사산물의 평가)
운동이상증-유사 증상에 대한 탄도스피론 대사산물인 1-(2-피리미딜)피페라진 (이하에, "1-PP"라고도 함)의 효과를 평가하였다.
(시험 방법)
거동은 실시예 2에서와 동일한 방법을 사용하여 관찰하고 평가하였다. 1-PP 디히드로클로라이드 (도쿄 케미컬 인더스트리(Tokyo Chemical Industry))를 식염수에 용해시키고 래트에게 피하 투여하였다. 5분 후, 레보도파 함유 용액을 복강내 투여하여 거동을 관찰하고 평가하였다. 도면에서의 결과는 평균값 ± 표준 오차로 환산하여 표시된다. 시험 결과는 3시간 내에 총 AIM 점수 및 100분 내지 180분 내에 총 AIM 점수를 파라미터로 사용함으로써 스틸 검정에 의해 용매 투여군과 비교하여 통계적으로 분석하였다.
(결과)
용매 투여군에 비해, 1-PP 디히드로클로라이드 (10 또는 30 mg/kg) 피하 투여군에서 총 AIM 점수의 유의한 변화가 밝혀지지 않았다 (도 10-A 및 B).
레보도파 투여 후 120분 내지 140분에, 1-PP 디히드로클로라이드 피하 투여군 (10 또는 30 mg/kg)에서 분명한 운동이상증-유사 증상 (2 이상의 평균 AIM 점수)이 관찰되었다. 100분 내지 180분 내에 총 AIM 점수를 지표로 사용하여 용매 투여군과 1-PP 디히드로클로라이드 투여군을 비교한 경우, 용매 투여군에 비해 1-PP 디히드로클로라이드 투여군에서는 유의하지는 않았지만 총 AIM 점수가 증가하는 경향이 관찰되었다 (도 10-C). 결과는 탄도스피론 대사산물 1-PP가 운동이상증의 반동 증상을 유발할 가능성을 시사한다.
결과는 탄도스피론 대사산물 1-PP를 생성하는 투여 조건 하에 운동이상증의 반동 증상의 가능성을 시사한다. 환언하면, 탄도스피론의 경우, 1-PP의 생성을 억제할 수 있는 투여 방법이 운동이상증의 반동 증상에 미치는 영향이 덜하여 바람직하다.
(실시예 6: 임상 프로토콜의 실증)
본 발명의 화합물 또는 본 발명의 조합 약물의 PD-LID 개선 효과는 PD-LID를 평가할 수 있는 적합한 설계를 가진 임상 연구로서 하기 참고 문서 1 (아만타딘 P3)에 기재된 방법에 따른 임상 연구에 의해 확인할 수 있다 (참고 문서 1: JAMA Neurology 2017; 74 (8) 941-949; 참고 문서 2: Movement Disorders 2015; 30 (19) 1343-1350).
보다 구체적으로, PD-LID 개선 효과는, 예를 들어 본 발명의 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물 또는 본 발명의 조합 약물을 파킨슨병 진단을 받은 20세 이상의 환자에서 특정 투여 기간 (그의 예는 8 내지 12주를 포함하나, 이에 제한되지는 않는다) 동안 투여하고 투여 기간 전후의 환자 일지 또는 점수 예컨대 UPDRS, UDysRS, CDRS, 또는 AIMS를 기준으로 운동이상증 발현 기간 등을 비교함으로써 확인할 수 있다.
상기 시험에서 표적 환자, 투여 기간, 작용제의 투여량, 및 평가 방법과 같은 조건은 적절하게 변화시킬 수 있다.
(주)
상기에 개시된 바와 같이, 본 발명은 그의 바람직한 실시양태를 사용하여 예시된다. 그러나, 본 발명의 범위는 특허청구범위만을 기반으로 해석되어야 하는 것으로 이해된다. 본 출원은 미국 특허출원 번호 16/395,531에 대한 우선권을 주장하며, 그 전체 내용은 본원에 참조로 포함된다. 또한, 여기에 인용된 임의의 특허, 임의의 특허 출원, 및 임의의 다른 참고문헌은 그 내용이 본원에 구체적으로 기재된 바와 동일한 방식으로 본원에 참조로 포함되어야 하는 이해된다.
산업적 이용가능성
비경구 투여된 탄도스피론 제제는 PD-LID를 개선하는 치료 약물로서 유용하다.
Claims (26)
- 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증의 치료, 개선, 진행 억제, 또는 예방을 위한 조성물이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 조성물.
- 제1항에 있어서, 비경구 투여가 경피 투여, 피내 투여, 피하 투여, 근육내 투여, 및 그의 조합으로부터 선택된 것인 조성물.
- 제1항 또는 제2항에 있어서, 비경구 투여가 지속성을 갖거나 지속가능하게 투여되는 것인 조성물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 비경구 투여가 경피 투여를 포함하는 것인 조성물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 운동 합병증이 레보도파 유발 운동이상증 (PD-LID)을 포함하는 것인 조성물.
- 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 파킨슨병에 대한 레보도파 요법과 연관된 운동 합병증의 치료, 개선, 또는 예방을 위한 조성물이며, 여기서 레보도파 유발 운동이상증 (PD-LID)이 반동 증상을 발생시키지 않고 개선되고, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 경피 투여되는 것인 조성물.
- 제6항에 있어서, 레보도파 유발 운동이상증 (PD-LID)이 피크-용량 운동이상증, 2상성 운동이상증, 및 그의 조합을 포함하는 것인 조성물.
- 제6항 또는 제7항에 있어서, 운동 합병증의 치료, 개선, 진행 억제, 또는 예방이 레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축, 또는 그의 조합을 포함하는 것인 조성물.
- 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선, 진행 억제, 또는 예방, 레보도파 유발 운동이상증 (PD-LID) 발현 기간의 단축, 또는 그의 조합을 달성하기 위한 조성물이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 조성물.
- 제9항에 있어서, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선이 임상적으로 유의한 개선 이상인 조성물.
- 제9항 또는 제10항에 있어서, 레보도파 유발 운동이상증 (PD-LID) 증상의 개선이 임상 효과를 달성하기에 충분한 수준까지인 것인 조성물.
- 제9항 내지 제11항 중 어느 한 항에 있어서, 경피 투여 제제인 조성물.
- 제9항 내지 제12항 중 어느 한 항에 있어서, 접착제 제제인 조성물.
- 제9항 내지 제13항 중 어느 한 항에 있어서, 경피 투여 제제가 테이프/패치인 조성물.
- 제9항 내지 제14항 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 약물 투여량이 탄도스피론의 유리 형태로서 1일 0.1 내지 100 mg인 조성물.
- 제9항 내지 제15항 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물에 대한 약물 침투의 양이 탄도스피론의 유리 형태로서 1일 0.1 내지 20 mg인 조성물.
- 제9항 내지 제16항 중 어느 한 항에 있어서, 조성물이 경피 투여 제제이고, 용량당 총 적용 면적이 1 내지 100 cm2인 조성물.
- 제9항 내지 제17항 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 인간 혈중 (혈장) 탄도스피론 농도가 1일 12시간 이상 동안 0.05 내지 20 ng/mL가 되도록 투여되는 것인 조성물.
- 제9항 내지 제18항 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 인간 혈중 (혈장) 탄도스피론 농도가 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물의 투여 후 8 내지 16시간 동안 0.05 내지 20 ng/mL가 되도록 투여되는 것인 조성물.
- 제9항 내지 제19항 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 레보도파의 보조약인 조성물.
- 제9항 내지 제20항 중 어느 한 항에 있어서, 고정-용량 조합으로서 레보도파와 함께 또는 별도의 제제로서 공동으로 사용되는 조성물.
- 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물과 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제의 조합을 포함하는, PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 의약이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 의약.
- 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 의약이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제와 조합하여 투여되며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 의약.
- (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제를 포함하는, PD-LID를 동반하지 않거나 최소화함으로써 파킨슨병을 치료 또는 예방하기 위한 의약이며, 여기서 (1) 레보도파 또는 (2) 레보도파 및 레보도파의 대사 효소 억제제가 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물과 조합하여 투여되며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 의약.
- 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물을 포함하는, 운동이상증을 가진 파킨슨병 환자의 레보도파 요법에 대한 반응의 질 악화를 개선하기 위한 조성물이며, 여기서 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 비경구 투여되는 것인 조성물.
- 제1항 내지 제25항 중 어느 한 항에 있어서, 탄도스피론 또는 그의 제약상 허용되는 염 또는 전구약물이 탄도스피론의 유리 형태인 의약 또는 조성물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US16/395,531 US10758535B1 (en) | 2019-04-26 | 2019-04-26 | Therapeutic drug for dyskinesia |
| US16/395,531 | 2019-04-26 | ||
| PCT/JP2020/017652 WO2020218487A1 (en) | 2019-04-26 | 2020-04-24 | Therapeutic drug for dyskinesia |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20220004640A true KR20220004640A (ko) | 2022-01-11 |
Family
ID=72241591
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020217034115A KR20220004640A (ko) | 2019-04-26 | 2020-04-24 | 운동이상증 치료 약물 |
Country Status (12)
| Country | Link |
|---|---|
| US (3) | US10758535B1 (ko) |
| EP (1) | EP3958972A4 (ko) |
| JP (1) | JP2022529661A (ko) |
| KR (1) | KR20220004640A (ko) |
| CN (1) | CN113646045A (ko) |
| AU (1) | AU2020260895A1 (ko) |
| BR (1) | BR112021021184A8 (ko) |
| CA (1) | CA3137400A1 (ko) |
| EA (1) | EA202192928A1 (ko) |
| MX (1) | MX2021013070A (ko) |
| SG (1) | SG11202111852TA (ko) |
| WO (1) | WO2020218487A1 (ko) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11559525B2 (en) | 2019-04-26 | 2023-01-24 | Sumitomo Pharma Co., Ltd. | Therapeutic drug for dyskinesia |
| WO2022045336A1 (ja) | 2020-08-31 | 2022-03-03 | 大日本住友製薬株式会社 | パーキンソン病の運動合併症治療薬 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH11228414A (ja) | 1998-02-06 | 1999-08-24 | Sumitomo Pharmaceut Co Ltd | タンドスピロン経皮剤 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4507303A (en) | 1981-12-22 | 1985-03-26 | Sumitomo Chemical Company, Limited | Succinimide derivatives, compositions and method of use |
| EP1743645A4 (en) * | 2004-06-01 | 2012-11-14 | Hisamitsu Pharmaceutical Co | ADHESIVE PATCH |
| DE602005010812D1 (de) | 2004-11-22 | 2008-12-18 | Hisamitsu Pharmaceutical Co | Transdermales Pflaster enthaltend einen schmelzpunktsenkenden Hilfsstoff |
| JP4873871B2 (ja) | 2005-02-28 | 2012-02-08 | 久光製薬株式会社 | 粘着剤及び貼付剤 |
| WO2008044336A1 (fr) | 2006-10-11 | 2008-04-17 | Hisamitsu Pharmaceutical Co., Inc. | Préparation adhésive contenant un cristal |
| US20140243350A1 (en) | 2011-07-05 | 2014-08-28 | Contera Pharma Aps | Use of serotonin receptor agonists for treatment of movement disorders |
| US10561618B2 (en) | 2012-04-18 | 2020-02-18 | Contera Pharma Aps | Orally available pharmaceutical formulation suitable for improved management of movement disorders |
| EP4335504A3 (en) * | 2018-12-20 | 2024-05-29 | Contera Pharma A/S | Treatment of movement disorders |
-
2019
- 2019-04-26 US US16/395,531 patent/US10758535B1/en active Active
-
2020
- 2020-04-22 US US16/855,213 patent/US20210060015A1/en not_active Abandoned
- 2020-04-24 JP JP2021561833A patent/JP2022529661A/ja active Pending
- 2020-04-24 EP EP20794266.5A patent/EP3958972A4/en active Pending
- 2020-04-24 WO PCT/JP2020/017652 patent/WO2020218487A1/en unknown
- 2020-04-24 CN CN202080029464.9A patent/CN113646045A/zh active Pending
- 2020-04-24 CA CA3137400A patent/CA3137400A1/en active Pending
- 2020-04-24 KR KR1020217034115A patent/KR20220004640A/ko not_active Application Discontinuation
- 2020-04-24 EA EA202192928A patent/EA202192928A1/ru unknown
- 2020-04-24 AU AU2020260895A patent/AU2020260895A1/en active Pending
- 2020-04-24 BR BR112021021184A patent/BR112021021184A8/pt not_active Application Discontinuation
- 2020-04-24 SG SG11202111852TA patent/SG11202111852TA/en unknown
- 2020-04-24 MX MX2021013070A patent/MX2021013070A/es unknown
- 2020-04-24 US US17/606,394 patent/US20220193075A1/en active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH11228414A (ja) | 1998-02-06 | 1999-08-24 | Sumitomo Pharmaceut Co Ltd | タンドスピロン経皮剤 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3958972A1 (en) | 2022-03-02 |
| EA202192928A1 (ru) | 2022-02-07 |
| AU2020260895A1 (en) | 2021-12-23 |
| US20220193075A1 (en) | 2022-06-23 |
| US20210060015A1 (en) | 2021-03-04 |
| SG11202111852TA (en) | 2021-11-29 |
| CA3137400A1 (en) | 2020-10-29 |
| MX2021013070A (es) | 2021-11-17 |
| EP3958972A4 (en) | 2023-01-04 |
| US10758535B1 (en) | 2020-09-01 |
| WO2020218487A1 (en) | 2020-10-29 |
| BR112021021184A2 (ko) | 2021-12-14 |
| JP2022529661A (ja) | 2022-06-23 |
| BR112021021184A8 (pt) | 2023-02-28 |
| CN113646045A (zh) | 2021-11-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102014883B1 (ko) | 근위축성 측삭 경화증 치료용 신규 조성물 | |
| TW201707704A (zh) | 激酶調節及其適應症 | |
| MX2007001172A (es) | Gotas acuosas para ojos que promueven la penetracion intraocular. | |
| KR20210055052A (ko) | 아미노산 영양소, 및 아미노산 영양소를 포함하는 약제학적 조성물의 적용 | |
| KR20160070077A (ko) | 안구내 투여를 위한 에피네프린-기반 안과용 조성물 및 이의 제조 방법 | |
| KR20190035927A (ko) | 안구 내 투여를 위한 에피네프린-기반 안과용 조성물 및 이의 제조방법 | |
| KR20220004640A (ko) | 운동이상증 치료 약물 | |
| CA2962655C (en) | A combination of kynurenine and antigen presenting cells (apc) as therapeutics and methods for their use in immune modulation | |
| HU219482B (hu) | (+)Doxazoszin alkalmazása vizeletfolyást fokozó gyógyászati készítmények előállítására | |
| US11559525B2 (en) | Therapeutic drug for dyskinesia | |
| US20240058320A1 (en) | Mydriatic compositions and methods for fabricating thereof | |
| US20210346318A1 (en) | Epinephrine-based ophthalmic compositions for intraocular administration and methods for fabricating thereof | |
| US11628169B2 (en) | Therapeutic drug for motor complications in Parkinson's disease | |
| JPH09500375A (ja) | パーキンソン病の治療を目的とする医薬品の製造のためのエファロキサンおよびその誘導体の使用 | |
| WO2016001682A1 (en) | Treatment of hypertransaminasemia | |
| CN101208095A (zh) | 瑞波西汀在治疗疼痛中的应用 | |
| US20230270755A1 (en) | Combination of medications in a parenteral dosage form for long-term anaesthesia | |
| US20220401398A1 (en) | Creatine, its derivatives, compositions and methods of use thereof | |
| JP2020033322A (ja) | パーキンソン病の治療のための医薬組成物 | |
| EP2351565A1 (en) | Medicine for preventing or treating pain related to herpes zoster |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITB | Written withdrawal of application |