KR20190124247A - Csf1r-기반 키메라 단백질 - Google Patents
Csf1r-기반 키메라 단백질 Download PDFInfo
- Publication number
- KR20190124247A KR20190124247A KR1020197027869A KR20197027869A KR20190124247A KR 20190124247 A KR20190124247 A KR 20190124247A KR 1020197027869 A KR1020197027869 A KR 1020197027869A KR 20197027869 A KR20197027869 A KR 20197027869A KR 20190124247 A KR20190124247 A KR 20190124247A
- Authority
- KR
- South Korea
- Prior art keywords
- ser
- leu
- chimeric protein
- gly
- val
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/53—Colony-stimulating factor [CSF]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70575—NGF/TNF-superfamily, e.g. CD70, CD95L, CD153, CD154
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70578—NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/715—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
- C07K14/7153—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons for colony-stimulating factors [CSF]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06008—Dipeptides with the first amino acid being neutral
- C07K5/06017—Dipeptides with the first amino acid being neutral and aliphatic
- C07K5/0606—Dipeptides with the first amino acid being neutral and aliphatic the side chain containing heteroatoms not provided for by C07K5/06086 - C07K5/06139, e.g. Ser, Met, Cys, Thr
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06086—Dipeptides with the first amino acid being basic
- C07K5/06095—Arg-amino acid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06139—Dipeptides with the first amino acid being heterocyclic
- C07K5/06165—Dipeptides with the first amino acid being heterocyclic and Pro-amino acid; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0802—Tripeptides with the first amino acid being neutral
- C07K5/0804—Tripeptides with the first amino acid being neutral and aliphatic
- C07K5/081—Tripeptides with the first amino acid being neutral and aliphatic the side chain containing O or S as heteroatoms, e.g. Cys, Ser
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/31—Fusion polypeptide fusions, other than Fc, for prolonged plasma life, e.g. albumin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
Abstract
본 발명은, 부분적으로는, 집락 자극 인자 1 수용체(CSF1R)의 세포외 도메인을 포함하는 키메라 단백질, 및 질환의 치료, 예컨대, 암 및/또는 염증성 질환을 위한 면역요법에서의 이의 용도에 관한 것이다.
Description
우선권
본 출원은 2017년 2월 27일자로 출원된 미국 가출원 제62/463,997호의 이익을 주장하며, 이의 내용은 본 명세서에 전체적으로 참고로 포함된다.
전자적으로 제출된 자료의 참고에 의한 포함
본 출원은 서열 목록을 포함한다. 이것은 파일명이 "SHK-002PC_SequenceListing_ST25"인 ASCII 텍스트 파일로서 EFS-Web을 통해서 전자적으로 제출되었다. 서열 목록은 92,976바이트 크기이고, 2018년 2월 27일경에 작성되었다. 서열 목록은 이의 전문이 참고로 포함된다.
기술분야
본 발명은, 부분적으로는, 집락 자극 인자 1 수용체(colony stimulating factor 1 receptor: CSF1R)의 세포외 도메인을 포함하는 키메라 단백질, 및 질환의 치료, 예컨대, 암 및/또는 염증성 질환을 위한 면역요법에서의 이의 용도에 관한 것이다.
최근 임상 데이터는, 예를 들어, YERVOY, KEYTRUDA 및 OPDIVO의 승인으로 이어진 임상 시험을 비롯한, 면역 공저해성(coinhibitory) 분자를 표적으로 하는 작용제에 대한 인상적인 환자 반응을 입증하였다. 이러한 면역요법은 총괄하여 면역관문 저해제(checkpoint inhibitor)로서 특징규명되며, 불행하게도, 이러한 요법은 암 환자의 약 15 내지 30%에 대해서만 임상적인 이점을 제공한다. 암 환자의 더 넓은 집단에 대해서 임상 반응률을 개선시키기 위한 가능한 한 접근법은 면역관문 저해제 요법을 또 다른 요법과 병용하는 것을 포함한다. 이러한 병용법은, 다수의 개별 요법을 사용하여 적용되는 경우, 개선된 임상적인 이점으로 이어질 수 있지만, 개발하기가 번거롭다. 추가로, 다수의 면역요법은 치료에 대한 환자의 치료 창을 상당히 좁히는 중증 부작용에 의해서 복잡해진다.
다수의 치료 기전을 단일 약물에 통합하는 것을 비롯한, 효과적인 면역요법을 제공하는 신규 방법 및 조성물에 대한 필요성이 존재한다.
따라서, 본 발명은, 부분적으로, 예를 들어, 종양 미세환경에서 다수의 억제 기전을 극복하고, 면역 항종양 기전을 자극함으로써, 암 치료에서 사용되는 조성물 및 방법을 제공한다. 유사하게, 이러한 조성물 및 방법은 염증성 질환의 치료에서 사용된다. 예를 들어, 본 발명은, 부분적으로, CSF1/CSF1R 신호전달의 억제에 의한 억제성 골수 집단, 및 CD40/CD40L 신호전달의 자극에 의한 항원-제시 세포의 활성화를 이중으로 표적으로 하는 것을 허용하는 조성물 및 방법을 제공한다. 이러한 공존하는 CSF1R 차단 및 CD40 효능작용은, 특히, 면역억제 세포 및 보다 염증성인 환경으로의 이동의 전체 감소 및 증가된 항종양 효과를 유발한다.
일 양상에서, 본 발명은 (a) 집락 자극 인자 1 수용체(CSF1R) 리간드에 결합할 수 있는 CSF1R의 부분을 포함하는 제1 도메인; (b) CD40 리간드(CD40L) 수용체에 결합할 수 있는 CD40L의 부분을 포함하는 제2 도메인; 및 (c) 제1 도메인과 제2 도메인을 연결하는 링커를 포함하는 이종 키메라 단백질을 제공한다. 일 양상에서, 본 발명은 이러한 이종 키메라 단백질로 암을 치료하는 방법을 제공한다. 일 양상에서, 본 발명은 이러한 이종 키메라 단백질로 염증성 질환을 치료하는 방법을 제공한다.
실시형태에서, 본 발명은 하기 일반 구조식을 포함하는 재조합 융합 단백질을 제공한다: N 말단 - (a) - (b) - (c) - C 말단, 식 중, (a)는 서열번호 2의 아미노산 서열과 적어도 95% 동일하고, CSF1R 리간드에 결합할 수 있는 CSF1R의 세포외 도메인을 포함하는 제1 도메인이고, (b)는 제1 도메인과 제2 도메인을 연결하고, 인간 IgG4로부터 유래된 힌지-CH2-CH3 Fc 도메인을 포함하는 링커(예를 들어, 서열번호 25, 서열번호 26 또는 서열번호 27의 아미노산 서열과 95% 동일함)이며, (c)는 서열번호 4의 아미노산 서열과 적어도 95% 동일하고, CD40 리간드(CD40L) 수용체에 결합할 수 있는 CD40L의 세포외 도메인을 포함하는 제2 도메인이다. 실시형태에서, 본 발명은 이러한 이종 키메라 단백질로 암을 치료하는 방법을 제공한다. 실시형태에서, 본 발명은 이러한 이종 키메라 단백질로 염증성 질환을 치료하는 방법을 제공한다.
본 명세서에 기술된 임의의 양상 또는 실시형태는 본 명세서에 개시된 바와 같은 임의의 다른 양상 또는 실시형태와 조합될 수 있다.
도 1A는 이론에 얽매이고자 함은 아니지만, CSF1R-Fc-CD40L 키메라 단백질에 대한 작용 기전에 대한 개략도. 도 1B는 종양 세포와 T 세포 사이에 키메라 단백질에 의해서 형성된 시냅스를 나타낸 도면. 도 1C는 3개의 도메인이 이의 자연 상태에서 어떻게 형성되는지를 예측한 것을 나타낸, 인간 CSF1R-Fc-CD40L의 예측된 2차 구조. CSF1R-Fc-CD40L 키메라 단백질의 예측된 단량체 분자량은 약 105.4Da이다.
도 2는 비환원/비등, 환원/비등 및 환원/탈글리코실화/비등(PNGase) 조건 하에서 인간 CSF1R-Fc-CD40L의 3개의 도메인의 웨스턴 블롯 분석에 의한 특징규명을 나타낸 도면. 밴드 크기는 약 105.4kDa의 예측된 단량체 분자량을 확인해 주며, 이는 네이티브 상태가 글리코실화된 이량체로서 존재한다는 것을 시사한다. 도시된 바와 같이, 각각의 블롯에서 좌측에서 시작하여, 레인 1은 단백질 분자량 마커이다.
도 3은 개별적으로 3개의 도메인(Fc - 좌측 상단에 나타냄, CSF1R - 우측 상단에 나타냄, 및 CD40L - 좌측 하단에 나타냄)의 표적에 대한 인간 CSF1R-Fc-CD40L의 결합뿐만 아니라 재조합 CSF1 및 CD40 둘 모두에 대한 동시 결합(우측 하단에 나타냄)을 입증하는, 기능성 효소 결합 면역흡착 검정(enzyme linked immunosorbent assay: ELISA). 좌측 상단 패널에서, 상부 곡선은 IgG 표준품이고, 하부 곡선은 hCSFR1-Fc-CD40L이다. 좌측 하단 패널에서, 상부 곡선은 CD40L-Fc이고, 하부 곡선은 hCSFR1-Fc-CD40L이다.
도 4는 Jurkat 세포(인간 T 세포주)에 의해서 발현되는 CD40 수용체에 결합하는, 인간 CSF1R(CD115)-Fc-CD40L 키메라 단백질의 능력을 입증한 시험관내 세포 결합 검정. 결합 EC50은 77nM인 것으로 측정되었다. "ARC"는 hCSF1R-Fc-CD40L 키메라 단백질을 지칭한다.
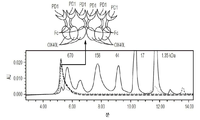
도 5A 내지 도 5F는 인간 CSF1R-Fc-CD40L의 OCTET 결합 친화도를 나타낸 도면. 온-레이트(on-rate), 오프-레이트(off-rate), 및 친화도(KD)를, CD40-His에 대한 인간 CSF1R-Fc-CD40L(도 5A), CD40-His에 대한 상업적으로 입수 가능한 단일-측 CD40L-Fc(도 5B), CD40-His에 대한 상업적으로 입수 가능한 CD40 항체(도 5C), CSF1-His에 대한 hCSF1R-Fc-CD40L(도 5D), 및 CSF1-His에 대한 상업적으로 입수 가능한 CSF1R-Fc(도 5E)에 대해서 결정하였다. 인간 CSF1R-Fc-CD40L은 4.83nM로 CD40에 결합하였고, 646pM로 CSF1에 결합하였다(도 5 F). 용어 "CSF1R-Fc-CD40L ARC"는 CSF1R-Fc-CD40L 키메라 단백질을 지칭한다. 도 5A 내지 도 5E 모두에서, 상부에서부터 하부로의 곡선의 순서는 100mM 시험 작용제, 33mM 시험 작용제, 11mM 시험 작용제 및 작용제 없음이다.
도 6은 재조합 인간 CD40, CSF1 및 IL-34에 대한 인간 CSF1R-Fc-CD40L의 상대적인 결합 친화도의 생물층 간섭계법(biolayer interferometry)(Octet)에 의한 특징규명을 나타낸 도면. 동일한 결합이 2개의 CFF1R 리간드: CSF1 및 IL-34에 대해서 관찰되었고; 따라서, 곡선이 나머지 것에 중첩된다. 따라서, 곡선의 순서는 상부 상의 CD40-his 및 중첩된 하부 상의 CSF1-his 및 IL-34-his이다.
도 7A 및 도 7B는 뮤린(murine) CSF1R-Fc-CD40L의 웨스턴 블롯 및 기능성 ELISA 결합에 의한 특징규명을 나타낸 도면. 도 7A는 비환원(레인 2), 환원(레인 3) 및 환원+PNGase 처리(레인 4) 하에서 mCSF1R-Fc-CD40L 키메라 단백질의 3개 도메인 모두의 웨스턴 블롯 검출을 나타낸다. 단백질의 환원된 탈글리코실화된 형태는 105kDa의 예측된 분자량으로 이동한다. 도 7B는, ELISA 검정을 수행하여 각각의 그래프 위에 개략도로 나타낸 검출 방법을 사용하여 재조합 CSF1에 대한 CSF1R(좌측 패널), IgG에 대한 Fc(중심 패널), 및 rCD40에 대한 CD40L(우측 패널)의 결합을 검출한 것을 나타낸다. CD115은 CSF1R과 동의어이다. 도 7B에서, 좌측 패널 mCD115-Fc-CD40L은 상부 곡선이고, 중간 및 우측 패널에서 mCD115-Fc-CD40L은 하부 곡선이다.
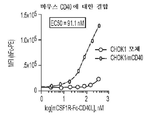
도 8은 mCD40을 발현하지 않는 모체 CHO-K1 세포주(하부 곡선)와 비교한, 뮤린 CD40을 과발현하는 CHO-K1 세포(상부 곡선)에 대한 뮤린 CSF1R-Fc-CD40L의 시험관내 세포 결합을 나타낸 도면. 결합 EC50은 91.1nM인 것으로 측정되었다.
도 9는 인간 CSF1R-Fc-CD40L 키메라 단백질을 사용한 시험관내 NF-κB/NIK 신호전달 검정으로부터의 데이터를 나타낸 도면. DiscoverX NIK 신호전달 검정으로부터의 U2OS 세포를 상업적으로 입수 가능한 단일-측 CD40L-Fc, 단일-측 CSF1R-Fc, 또는 항-CD40, 또는 인간 CSF1R-Fc-CD40L 키메라 단백질로 적정하면서 배양하였다. 상대적인 루시퍼라제 단위(relative luciferase unit: RLU)는, 제시된 요법으로의 처리 이후에 활성화된 NF-κB/NIK 신호전달의 상대적인 강도를 나타낸다. 곡선은 하기와 같이 식별되고: X-축 상의 0.01㎍/㎖에서, 상부에서 하부로 CD40L-Fc, hCSF1R-Fc-CD40L, CSF1R-Fc 및 항-CD40이다.
도 10A 및 도 10B은 뮤린 CSF1R-Fc-CD40L 활성도의 생체내 기능성 판독치를 나타낸 도면. 도 10A는 CSF1 트랩(trap)/싱크(sink) 검정을 나타낸다. 비-종양 보유 마우스에 단일 용량의 항-CD115(CSF1R)를 0일에 주사하였다. 2일에, 마우스를 치료하지 않고 두거나, 또는 단일 용량의 CSF1R-Fc-CD40L 키메라 단백질을 주사하였다. 키메라 단백질을 주사하기 2일 전 및 키메라 단백질 처리 3일 후에 혈액 혈청을 수집하였다. 뮤린 CSF1 ELISA를 혈청 상에서 수행하였고, 이는 뮤린 CSF1R-Fc-CD40L 키메라 단백질이 혈청 CSF1에 결합하고, 이를 제거함을 나타내었다. (도 10B는 생체내 IL15Rα 유도를 나타낸다.) 종양-보유 마우스를 최초 종양 접종 5일 및 7일 후에 150㎍의 mCSF1R-Fc-CD40L ARC 2회 용량으로 처리하였다. 13일에, 마우스의 코호트를 희생시키고, 이의 비장 및 림프절을 제거하고, IL15Rα의 유세포 분석법을 위해서 분리시켰다. CD40L 기능의 공지된 기전과 일관되게, CSF1R-Fc-CD40L 키메라 단백질로 처리된 마우스는 두 조직 구획 모두에서 IL15Rα의 증가를 나타내었다. CD115은 CSF1R과 동의어이다. 도 10A의 그래프의 경우, 상부 곡선은 +αCD115이고, 중간 곡선은 +αCD115 이어서 2일에 CD115-Fc-CD40L이고, 하부 곡선은 미처리된 것이다. 도 10B(상단 패널 또는 하단 패널)의 경우, 좌측 지점은 대조군이고, 우측은 CSF1R-Fc-CD40L이다.
도 11A 내지 도 11C는 결장직장 CT26 종양에서 뮤린 CSF1R-Fc-CD40L의 항종양 효능을 나타낸 도면. Balb/c 마우스를 0일에 CT26 종양으로 접종하였다. 종양 성장 4일 후에, 종양이 4 내지 5㎜의 직경에 도달했을 때, 마우스를 대조군 항체 또는 mCSF1R-Fc-CD40L 키메라 단백질로 처리하였다. 이어서 7일에 처리를 다시 반복하였다. 상기 도면은 하기를 포함한다: (도 11A) 각각의 처리군에 대한 개별 종양 성장 곡선, (도 11A) 60일의 실험을 통한 전체 생존 및 (도 11A) 각각의 군에 대한 처리 결과를 요약한 표. CD115은 CSF1R과 동의어이다. 도 11B의 경우, 35일을 참고하여, 곡선은 (상부에서 하부로): CD115-Fc-CD40L(150㎍×2), αCD115, αCD115/CD40, αCD40(미처리 마우스는 이 지점에 생존하지 않았음)이다.
도 12A 내지 도 12E는 종양-보유 마우스에서 생체내 면역표현형결정(immunophenotyping)을 나타낸 도면. 종양 접종 13일 후에 각각의 군으로부터의 마우스에 대해서 비장세포, 림프절 세포 및 종양 침윤 림프구(tumor infiltrating lymphocyte)를 분석함으로써 종양-보유 면역표현형결정을 또한 각각의 처리군에 대해서 수행하였다. 도 12A는 뮤린 CSF1R-Fc-CD40L로 처리된 마우스가 대조군과 비교할 때, 림프절 또는 종양이 아닌, 비장에서 CD4+ 및 CD8+ T 세포 둘 모두의 빈도가 증가되었다는 것을 입증하는 결과를 나타낸다. 도 12B는 비장 및 종양에서 CD4+CD25+ 세포의 비율의 감소를 나타내는데, 이것은 면역조절 T 세포의 감소를 나타낼 수 있다. 흥미롭게도, 종양 내에서의 총 CD8+ 세포의 비율의 미미한 증가에도 불구하고(도 12C 참고), AH1 종양 항원에 대해서 특이적인 CD8+ T 세포의 비율의 상당한 증가가 (사량체 염색에 의해서) 검출되었다. CD40 수용체 활성화의 잠재적인 증거를 결정하기 위해서, CD19+ 세포(도 12D) 및 IL-15Rα-양성 세포(도 12E)의 유도를 분석하였다. 도 12A 내지 도 12E 모두의 경우, 좌측 지점은 대조군이고, 우측은 CSF1R-Fc-CD40L이다.
도 13A 및 도 13B는 뮤린 CSF1R-Fc-CD40L 대 CD40 효능제 항체의 안전성을 나타낸 도면. CD40 효능제 항체(클론 FGK4.5)를 사용한 단일요법 또는 CD40 효능제 항체와 항-CD115(CSF1R) 항체(클론 AFS98)를 사용한 병용 요법은, 실험 기간에 걸쳐서 마우스에서 상당한 설사 및 체중 감소를 생성하였다. 이러한 데이터는, CD40 효능제 항체가 설사 및 체중 감소로 이어지는 장 염증성 반응을 개시하였고, 이것은 이어서 CD115 차단과의 조합에 의해서 상당히 악화되었다는 것을 나타낸다. 항체 조합물 군의 마우스는 이의 체중의 25% 초과가 감소되었고(도 13B 참고), 빈사상태 외관을 가졌고(도 13A), 일부 경우에 이러한 염증성 반응은 치명적이었다. 중요하게는, 뮤린 CD115-Fc-CD40L 키메라 단백질(이것은 mCSF1R-Fc-CD40L 키메라 단백질에 대한 또 다른 명칭)로 처리된 마우스는, 건강해 보였고, 설사 또는 체중 감소의 어떠한 징후도 발달하지 않았고, 정상적으로 거동하였다(좌측 패널에서의 사진 참고). 이러한 데이터는 CD40 효능제 항체로 처리된 인간에서 임상 데이터에 따르며, mCD115-Fc-CD40L의 유리한 안전성 프로파일을 시사한다. CD115은 CSF1R과 동의어이다. 도 13B에서, 막대의 순서는 다음과 같다: 미처리, αCD115, αCD40, αCD115+αCD40, CD115-Fc-CD40L FP.
도 14는 예시적인 키메라 단백질(PD1-Fc-OX40L)의 4가지 잠재적인 구성을 나타낸 도면.
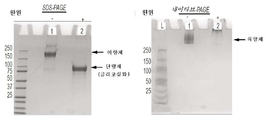
도 15는 비환원 조건, 환원 조건, 및 환원 조건 및 그 다음 펩타이드-N-글리코시다제 F(PNGaseF)로의 처리 하에서 SDS-PAGE 상에서 전개된 PD1-Fc-OX40L 키메라 단백질의 웨스턴 블롯을 나타낸 도면.
도 16은 크기 배제 크로마토그래피(SEC) 상에서 전개된 PD1-Fc-OX40L 키메라 단백질에 대한 크로마토그래프를 나타낸 도면.
도 17은 비환원 조건("-") 하에서 또는 환원 조건("+") 하에서 전개된 PD1-Fc-OX40L 키메라 단백질에 대한 SDS-PAGE 및 네이티브(비-SDS) PAGE 젤을 나타낸 도면.
도 18은 링커에서 Fc 도메인이 결핍된 PD1-No Fc-OX40L 키메라 단백질에 대한 네이티브(비-SDS) PAGE 젤을 나타낸 도면.
도 19는 이론에 얽매이고자 함은 아니지만, 육량체 및 콘카티머(concatemer)가 본 발명의 키메라 단백질로부터 형성되는 방법에 대한 모델을 나타낸 도면.
도 20은 예시적인 모듈식 링커에 조합될 수 있는 접합 링커 및 Fc 링커를 나타낸 표. 도시된 예시적인 모듈식 링커는 임의의 본 명세서에 기술된 타입 I 및 타입 II 단백질 및/또는 본 명세서에 기술된 타입 I 및 타입 II 단백질의 세포외 도메인과 조합되어 본 발명의 키메라 단백질을 형성할 수 있다.
도 2는 비환원/비등, 환원/비등 및 환원/탈글리코실화/비등(PNGase) 조건 하에서 인간 CSF1R-Fc-CD40L의 3개의 도메인의 웨스턴 블롯 분석에 의한 특징규명을 나타낸 도면. 밴드 크기는 약 105.4kDa의 예측된 단량체 분자량을 확인해 주며, 이는 네이티브 상태가 글리코실화된 이량체로서 존재한다는 것을 시사한다. 도시된 바와 같이, 각각의 블롯에서 좌측에서 시작하여, 레인 1은 단백질 분자량 마커이다.
도 3은 개별적으로 3개의 도메인(Fc - 좌측 상단에 나타냄, CSF1R - 우측 상단에 나타냄, 및 CD40L - 좌측 하단에 나타냄)의 표적에 대한 인간 CSF1R-Fc-CD40L의 결합뿐만 아니라 재조합 CSF1 및 CD40 둘 모두에 대한 동시 결합(우측 하단에 나타냄)을 입증하는, 기능성 효소 결합 면역흡착 검정(enzyme linked immunosorbent assay: ELISA). 좌측 상단 패널에서, 상부 곡선은 IgG 표준품이고, 하부 곡선은 hCSFR1-Fc-CD40L이다. 좌측 하단 패널에서, 상부 곡선은 CD40L-Fc이고, 하부 곡선은 hCSFR1-Fc-CD40L이다.
도 4는 Jurkat 세포(인간 T 세포주)에 의해서 발현되는 CD40 수용체에 결합하는, 인간 CSF1R(CD115)-Fc-CD40L 키메라 단백질의 능력을 입증한 시험관내 세포 결합 검정. 결합 EC50은 77nM인 것으로 측정되었다. "ARC"는 hCSF1R-Fc-CD40L 키메라 단백질을 지칭한다.
도 5A 내지 도 5F는 인간 CSF1R-Fc-CD40L의 OCTET 결합 친화도를 나타낸 도면. 온-레이트(on-rate), 오프-레이트(off-rate), 및 친화도(KD)를, CD40-His에 대한 인간 CSF1R-Fc-CD40L(도 5A), CD40-His에 대한 상업적으로 입수 가능한 단일-측 CD40L-Fc(도 5B), CD40-His에 대한 상업적으로 입수 가능한 CD40 항체(도 5C), CSF1-His에 대한 hCSF1R-Fc-CD40L(도 5D), 및 CSF1-His에 대한 상업적으로 입수 가능한 CSF1R-Fc(도 5E)에 대해서 결정하였다. 인간 CSF1R-Fc-CD40L은 4.83nM로 CD40에 결합하였고, 646pM로 CSF1에 결합하였다(도 5 F). 용어 "CSF1R-Fc-CD40L ARC"는 CSF1R-Fc-CD40L 키메라 단백질을 지칭한다. 도 5A 내지 도 5E 모두에서, 상부에서부터 하부로의 곡선의 순서는 100mM 시험 작용제, 33mM 시험 작용제, 11mM 시험 작용제 및 작용제 없음이다.
도 6은 재조합 인간 CD40, CSF1 및 IL-34에 대한 인간 CSF1R-Fc-CD40L의 상대적인 결합 친화도의 생물층 간섭계법(biolayer interferometry)(Octet)에 의한 특징규명을 나타낸 도면. 동일한 결합이 2개의 CFF1R 리간드: CSF1 및 IL-34에 대해서 관찰되었고; 따라서, 곡선이 나머지 것에 중첩된다. 따라서, 곡선의 순서는 상부 상의 CD40-his 및 중첩된 하부 상의 CSF1-his 및 IL-34-his이다.
도 7A 및 도 7B는 뮤린(murine) CSF1R-Fc-CD40L의 웨스턴 블롯 및 기능성 ELISA 결합에 의한 특징규명을 나타낸 도면. 도 7A는 비환원(레인 2), 환원(레인 3) 및 환원+PNGase 처리(레인 4) 하에서 mCSF1R-Fc-CD40L 키메라 단백질의 3개 도메인 모두의 웨스턴 블롯 검출을 나타낸다. 단백질의 환원된 탈글리코실화된 형태는 105kDa의 예측된 분자량으로 이동한다. 도 7B는, ELISA 검정을 수행하여 각각의 그래프 위에 개략도로 나타낸 검출 방법을 사용하여 재조합 CSF1에 대한 CSF1R(좌측 패널), IgG에 대한 Fc(중심 패널), 및 rCD40에 대한 CD40L(우측 패널)의 결합을 검출한 것을 나타낸다. CD115은 CSF1R과 동의어이다. 도 7B에서, 좌측 패널 mCD115-Fc-CD40L은 상부 곡선이고, 중간 및 우측 패널에서 mCD115-Fc-CD40L은 하부 곡선이다.
도 8은 mCD40을 발현하지 않는 모체 CHO-K1 세포주(하부 곡선)와 비교한, 뮤린 CD40을 과발현하는 CHO-K1 세포(상부 곡선)에 대한 뮤린 CSF1R-Fc-CD40L의 시험관내 세포 결합을 나타낸 도면. 결합 EC50은 91.1nM인 것으로 측정되었다.
도 9는 인간 CSF1R-Fc-CD40L 키메라 단백질을 사용한 시험관내 NF-κB/NIK 신호전달 검정으로부터의 데이터를 나타낸 도면. DiscoverX NIK 신호전달 검정으로부터의 U2OS 세포를 상업적으로 입수 가능한 단일-측 CD40L-Fc, 단일-측 CSF1R-Fc, 또는 항-CD40, 또는 인간 CSF1R-Fc-CD40L 키메라 단백질로 적정하면서 배양하였다. 상대적인 루시퍼라제 단위(relative luciferase unit: RLU)는, 제시된 요법으로의 처리 이후에 활성화된 NF-κB/NIK 신호전달의 상대적인 강도를 나타낸다. 곡선은 하기와 같이 식별되고: X-축 상의 0.01㎍/㎖에서, 상부에서 하부로 CD40L-Fc, hCSF1R-Fc-CD40L, CSF1R-Fc 및 항-CD40이다.
도 10A 및 도 10B은 뮤린 CSF1R-Fc-CD40L 활성도의 생체내 기능성 판독치를 나타낸 도면. 도 10A는 CSF1 트랩(trap)/싱크(sink) 검정을 나타낸다. 비-종양 보유 마우스에 단일 용량의 항-CD115(CSF1R)를 0일에 주사하였다. 2일에, 마우스를 치료하지 않고 두거나, 또는 단일 용량의 CSF1R-Fc-CD40L 키메라 단백질을 주사하였다. 키메라 단백질을 주사하기 2일 전 및 키메라 단백질 처리 3일 후에 혈액 혈청을 수집하였다. 뮤린 CSF1 ELISA를 혈청 상에서 수행하였고, 이는 뮤린 CSF1R-Fc-CD40L 키메라 단백질이 혈청 CSF1에 결합하고, 이를 제거함을 나타내었다. (도 10B는 생체내 IL15Rα 유도를 나타낸다.) 종양-보유 마우스를 최초 종양 접종 5일 및 7일 후에 150㎍의 mCSF1R-Fc-CD40L ARC 2회 용량으로 처리하였다. 13일에, 마우스의 코호트를 희생시키고, 이의 비장 및 림프절을 제거하고, IL15Rα의 유세포 분석법을 위해서 분리시켰다. CD40L 기능의 공지된 기전과 일관되게, CSF1R-Fc-CD40L 키메라 단백질로 처리된 마우스는 두 조직 구획 모두에서 IL15Rα의 증가를 나타내었다. CD115은 CSF1R과 동의어이다. 도 10A의 그래프의 경우, 상부 곡선은 +αCD115이고, 중간 곡선은 +αCD115 이어서 2일에 CD115-Fc-CD40L이고, 하부 곡선은 미처리된 것이다. 도 10B(상단 패널 또는 하단 패널)의 경우, 좌측 지점은 대조군이고, 우측은 CSF1R-Fc-CD40L이다.
도 11A 내지 도 11C는 결장직장 CT26 종양에서 뮤린 CSF1R-Fc-CD40L의 항종양 효능을 나타낸 도면. Balb/c 마우스를 0일에 CT26 종양으로 접종하였다. 종양 성장 4일 후에, 종양이 4 내지 5㎜의 직경에 도달했을 때, 마우스를 대조군 항체 또는 mCSF1R-Fc-CD40L 키메라 단백질로 처리하였다. 이어서 7일에 처리를 다시 반복하였다. 상기 도면은 하기를 포함한다: (도 11A) 각각의 처리군에 대한 개별 종양 성장 곡선, (도 11A) 60일의 실험을 통한 전체 생존 및 (도 11A) 각각의 군에 대한 처리 결과를 요약한 표. CD115은 CSF1R과 동의어이다. 도 11B의 경우, 35일을 참고하여, 곡선은 (상부에서 하부로): CD115-Fc-CD40L(150㎍×2), αCD115, αCD115/CD40, αCD40(미처리 마우스는 이 지점에 생존하지 않았음)이다.
도 12A 내지 도 12E는 종양-보유 마우스에서 생체내 면역표현형결정(immunophenotyping)을 나타낸 도면. 종양 접종 13일 후에 각각의 군으로부터의 마우스에 대해서 비장세포, 림프절 세포 및 종양 침윤 림프구(tumor infiltrating lymphocyte)를 분석함으로써 종양-보유 면역표현형결정을 또한 각각의 처리군에 대해서 수행하였다. 도 12A는 뮤린 CSF1R-Fc-CD40L로 처리된 마우스가 대조군과 비교할 때, 림프절 또는 종양이 아닌, 비장에서 CD4+ 및 CD8+ T 세포 둘 모두의 빈도가 증가되었다는 것을 입증하는 결과를 나타낸다. 도 12B는 비장 및 종양에서 CD4+CD25+ 세포의 비율의 감소를 나타내는데, 이것은 면역조절 T 세포의 감소를 나타낼 수 있다. 흥미롭게도, 종양 내에서의 총 CD8+ 세포의 비율의 미미한 증가에도 불구하고(도 12C 참고), AH1 종양 항원에 대해서 특이적인 CD8+ T 세포의 비율의 상당한 증가가 (사량체 염색에 의해서) 검출되었다. CD40 수용체 활성화의 잠재적인 증거를 결정하기 위해서, CD19+ 세포(도 12D) 및 IL-15Rα-양성 세포(도 12E)의 유도를 분석하였다. 도 12A 내지 도 12E 모두의 경우, 좌측 지점은 대조군이고, 우측은 CSF1R-Fc-CD40L이다.
도 13A 및 도 13B는 뮤린 CSF1R-Fc-CD40L 대 CD40 효능제 항체의 안전성을 나타낸 도면. CD40 효능제 항체(클론 FGK4.5)를 사용한 단일요법 또는 CD40 효능제 항체와 항-CD115(CSF1R) 항체(클론 AFS98)를 사용한 병용 요법은, 실험 기간에 걸쳐서 마우스에서 상당한 설사 및 체중 감소를 생성하였다. 이러한 데이터는, CD40 효능제 항체가 설사 및 체중 감소로 이어지는 장 염증성 반응을 개시하였고, 이것은 이어서 CD115 차단과의 조합에 의해서 상당히 악화되었다는 것을 나타낸다. 항체 조합물 군의 마우스는 이의 체중의 25% 초과가 감소되었고(도 13B 참고), 빈사상태 외관을 가졌고(도 13A), 일부 경우에 이러한 염증성 반응은 치명적이었다. 중요하게는, 뮤린 CD115-Fc-CD40L 키메라 단백질(이것은 mCSF1R-Fc-CD40L 키메라 단백질에 대한 또 다른 명칭)로 처리된 마우스는, 건강해 보였고, 설사 또는 체중 감소의 어떠한 징후도 발달하지 않았고, 정상적으로 거동하였다(좌측 패널에서의 사진 참고). 이러한 데이터는 CD40 효능제 항체로 처리된 인간에서 임상 데이터에 따르며, mCD115-Fc-CD40L의 유리한 안전성 프로파일을 시사한다. CD115은 CSF1R과 동의어이다. 도 13B에서, 막대의 순서는 다음과 같다: 미처리, αCD115, αCD40, αCD115+αCD40, CD115-Fc-CD40L FP.
도 14는 예시적인 키메라 단백질(PD1-Fc-OX40L)의 4가지 잠재적인 구성을 나타낸 도면.
도 15는 비환원 조건, 환원 조건, 및 환원 조건 및 그 다음 펩타이드-N-글리코시다제 F(PNGaseF)로의 처리 하에서 SDS-PAGE 상에서 전개된 PD1-Fc-OX40L 키메라 단백질의 웨스턴 블롯을 나타낸 도면.
도 16은 크기 배제 크로마토그래피(SEC) 상에서 전개된 PD1-Fc-OX40L 키메라 단백질에 대한 크로마토그래프를 나타낸 도면.
도 17은 비환원 조건("-") 하에서 또는 환원 조건("+") 하에서 전개된 PD1-Fc-OX40L 키메라 단백질에 대한 SDS-PAGE 및 네이티브(비-SDS) PAGE 젤을 나타낸 도면.
도 18은 링커에서 Fc 도메인이 결핍된 PD1-No Fc-OX40L 키메라 단백질에 대한 네이티브(비-SDS) PAGE 젤을 나타낸 도면.
도 19는 이론에 얽매이고자 함은 아니지만, 육량체 및 콘카티머(concatemer)가 본 발명의 키메라 단백질로부터 형성되는 방법에 대한 모델을 나타낸 도면.
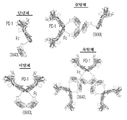
도 20은 예시적인 모듈식 링커에 조합될 수 있는 접합 링커 및 Fc 링커를 나타낸 표. 도시된 예시적인 모듈식 링커는 임의의 본 명세서에 기술된 타입 I 및 타입 II 단백질 및/또는 본 명세서에 기술된 타입 I 및 타입 II 단백질의 세포외 도메인과 조합되어 본 발명의 키메라 단백질을 형성할 수 있다.
본 발명은, 부분적으로, 집락 자극 인자 1 수용체(CSF1R) 리간드에 결합할 수 있는 CSF1R의 부분을 포함하는 제1 도메인을 포함하는 조작된 키메라 단백질의 발견을 기반으로 한다. 실시형태에서, 키메라 단백질은 CD40 리간드(CD40L) 수용체에 결합할 수 있는 CD40L의 부분을 포함하는 제2 도메인을 추가로 포함한다. 실시형태에서, 제1 도메인 및 제2 도메인은 링커에 의해서 연결된다. 실시형태에서, 본 발명의 키메라 단백질은, 면역억제로 균형을 달리 이동시킬 수 있는 저해 신호를 위한 국지화된 트랩을 제공하면서(예를 들어, CSF1 또는 IL-34), 예를 들어, 대식세포 및 항원 제시 세포를 활성화시킬 수 있는 면역 자극 신호를 제공한다. 따라서, 본 발명의 실시형태는 암 및/또는 염증성 질환의 효과적인 치료를 제공한다.
키메라 단백질
실시형태에서, 본 발명은 대식세포 집락-자극 인자 수용체(macrophage colony-stimulating factor receptor: M-CSFR) 및 분화 클러스터 115(cluster of differentiation 115: CD115)라고도 공지된, 면역 저해 수용체 집락 자극 인자 1 수용체(CSF1R)의 도메인, 예를 들어, 세포외 도메인을 포함하도록 조작된 키메라 단백질에 관한 것이다. 따라서, 본 개시내용 전체에서, CSF1R 및 CD115는 단독으로 지칭되는 경우 그리고/또는 키메라 단백질과 관련하여 지칭되는 경우 동의어이고, 따라서, 예를 들어, CSF1R-Fc-CD40L은 CD115-Fc-CD40L과 동일한 키메라 단백질이다. CSF1R은 집락 자극 인자 1(CSF1)에 대한 수용체로서 기능하는 단일 통과 타입 I 단백질(single-pass type I membrane protein)이다. CSF1R은 또한 IL-34에 대한 수용체인 것으로 밝혀져 있다. CSF1 또는 IL-34에 대한 CSF1R의 결합은 조혈 전구 세포, 특히 단핵 식세포, 예컨대, 대식세포 및 단핵구의 생존, 증식 및 분화에 중요한 역할을 한다. 추가로, CSF1R은 종양 미세환경 내에서 CSF1 또는 IL-34에 결합하는 것으로 밝혀져 있다. 이러한 리간드에 대한 수용체의 결합은 특히, 종양 연관 대식세포(TAM) 및 골수 유래 억제 세포(MDSC)의 유도를 통해서 면역 억제를 유도한다.
실시형태에서, 본 발명의 키메라 단백질은 인간 CSF1R의 도메인, 예를 들어, 세포외 도메인을 포함한다. 인간 CSF1R은 서열번호 1의 아미노산 서열(아미노산 20 내지 517개를 포함하는 세포외 도메인의 아미노산 서열을 가짐)을 포함한다.
실시형태에서, 본 발명의 키메라 단백질은 서열번호 2의 아미노산 서열을 갖는, 인간 CSF1R의 세포외 도메인을 포함한다. 실시형태에서, 본 발명의 키메라 단백질은 본 명세서에 기술된 바와 같은 CSF1R의 세포외 도메인, 또는 이의 변이체 또는 기능성 단편을 포함할 수 있다. 예를 들어, 키메라 단백질은 본 명세서에 기술된 바와 같은 CSF1R의 세포외 도메인의 아미노산 서열과 적어도 약 60%, 또는 적어도 약 61%, 또는 적어도 약 62%, 또는 적어도 약 63%, 또는 적어도 약 64%, 또는 적어도 약 65%, 또는 적어도 약 66%, 또는 적어도 약 67%, 또는 적어도 약 68%, 또는 적어도 약 69%, 또는 적어도 약 70%, 또는 적어도 약 71%, 또는 적어도 약 72%, 또는 적어도 약 73%, 또는 적어도 약 74%, 또는 적어도 약 75%, 또는 적어도 약 76%, 또는 적어도 약 77%, 또는 적어도 약 78%, 또는 적어도 약 79%, 또는 적어도 약 80%, 또는 적어도 약 81%, 또는 적어도 약 82%, 또는 적어도 약 83%, 또는 적어도 약 84%, 또는 적어도 약 85%, 또는 적어도 약 86%, 또는 적어도 약 87%, 또는 적어도 약 88%, 또는 적어도 약 89%, 또는 적어도 약 90%, 또는 적어도 약 91%, 또는 적어도 약 92%, 또는 적어도 약 93%, 또는 적어도 약 94%, 또는 적어도 약 95%, 또는 적어도 약 96%, 또는 적어도 약 97%, 또는 적어도 약 98%, 또는 적어도 약 99%의 서열 동일성을 갖는 상기에 제공된 바와 같은 CSF1R의 세포외 도메인의 서열, 또는 이의 변이체 또는 기능성 단편을 포함할 수 있다.
CSF1R의 구조는 예를 들어, 문헌[W.D. Tap, et al., "Structure-Guided Blockade of CSF1R Kinase in Tenosynovial Giant-Cell Tumor" N. Engl. J. Med. 2015 Jul 30;373(5):428-37]에 기술되어 있다. CSF1R의 유도체는 입수 가능한 CSF1R 구조를 기반으로 제조될 수 있다.
실시형태에서, 본 발명의 키메라 단백질은 신호 펩타이드(예를 들어, 서열번호 1에 제공된 바와 같음)가 대안적인 신호 펩타이드로 대체된 CSF1R의 변이체 세포외 도메인을 포함할 수 있다. 실시형태에서, 본 발명의 키메라 단백질은 단백질 생산 세포, 예컨대, 중국 햄스터 난소(Chinese Hamster Ovary: CHO) 또는 인간 태아 신장(human embryonic kidney: HEK) 세포에서 발현에 대해서 코돈-최적화된 cDNA로부터 발현된 CSF1R의 변이체 세포외 도메인을 포함할 수 있다.
실시형태에서, CSF1R의 세포외 도메인은 세포외 환경과 상호작용할 수 있는 단백질의 부분을 지칭한다. 실시형태에서, CSF1R의 세포외 도메인은 세포의 외부 또는 세포막에 존재하는 단백질의 전체 아미노산 서열이다. 실시형태에서, CSF1R의 세포외 도메인은 세포의 외부 또는 세포막에 존재하는 단백질의 아미노산 서열의 부분이며, 관련 기술 분야에 공지된 방법(예를 들어, 시험관내 리간드 결합 및/또는 세포 활성화 검정)을 사용하여 검정될 수 있는 바와 같이 신호 변환 및/또는 리간드 결합에 필요하다.
실시형태에서, CSF1R의 세포외 도메인은 집락 자극 인자 1(CSF1)에 결합할 수 있는 단백질의 부분을 지칭한다. 실시형태에서, 키메라 단백질은 약 1μM, 약 900nM, 약 800nM, 약 700nM, 약 600nM, 약 500nM, 약 400nM, 약 300nM, 약 200nM, 약 150nM, 약 130nM, 약 100nM, 약 90nM, 약 80nM, 약 70nM, 약 60nM, 약 55nM, 약 50nM, 약 45nM, 약 40nM, 약 35nM, 약 30nM, 약 25nM, 약 20nM, 약 15nM, 약 10nM, 또는 약 5nM, 또는 약 1nM 미만(예를 들어, 표면 플라스몬 공명 또는 생물층 간섭계법에 의해서 측정되는 경우)의 KD로 인간 CSF1에 결합한다. 실시형태에서, 키메라 단백질은 약 1nM, 약 900pM, 약 800pM, 약 700pM, 약 600pM, 약 500pM, 약 400pM, 약 300pM, 약 200pM, 약 100pM, 약 90pM, 약 80pM, 약 70pM, 약 60pM 약 55pM 약 50pM 약 45pM, 약 40pM, 약 35pM, 약 30pM, 약 25pM, 약 20pM, 약 15pM, 또는 약 10pM, 또는 약 1pM 미만(예를 들어, 표면 플라스몬 공명 또는 생물층 간섭계법에 의해서 측정되는 경우)의 KD로 인간 CSF1에 결합한다.
실시형태에서, CSF1R의 세포외 도메인은 IL-34에 결합할 수 있는 단백질의 부분을 지칭한다. 실시형태에서, 키메라 단백질은 약 1μM, 약 900nM, 약 800nM, 약 700nM, 약 600nM, 약 500nM, 약 400nM, 약 300nM, 약 200nM, 약 100nM, 약 90nM, 약 80nM, 약 70nM, 약 60nM, 약 55nM, 약 50nM, 약 45nM, 약 40nM, 약 35nM, 약 30nM, 약 25nM, 약 20nM, 약 15nM, 약 10nM, 또는 약 5nM, 또는 약 1nM 미만(예를 들어, 표면 플라스몬 공명 또는 생물층 간섭계법에 의해서 측정되는 경우)의 KD로 인간 IL-34에 결합한다. 실시형태에서, 키메라 단백질은 약 1nM, 약 900pM, 약 800pM, 약 700pM, 약 600pM, 약 500pM, 약 400pM, 약 300pM, 약 200pM, 약 100pM, 약 90pM, 약 80pM, 약 70pM, 약 60pM 약 55pM 약 50pM 약 45pM, 약 40pM, 약 35pM, 약 30pM, 약 25pM, 약 20pM, 약 15pM, 또는 약 10pM, 또는 약 1pM 미만(예를 들어, 표면 플라스몬 공명 또는 생물층 간섭계법에 의해서 측정되는 경우)의 KD로 IL-34에 결합한다. 실시형태에서, 키메라 단백질은 약 100pM 내지 약 600pM의 KD로 인간 CSF1에 결합한다.
본 발명의 키메라 단백질은 면역 자극 분자 CD40 리간드(CD40L, CD154라고도 공지됨)의 도메인, 예를 들어, 세포외 도메인을 추가로 포함한다. CD40L은 종양 괴사 인자(TNF) 슈퍼패밀리에 속하는 타입 II 막관통 단백질이다. CD40L은 대식세포 및 항원-제시 세포(APC), 예컨대, 항원-제시 B 세포 상의 CD40 수용체에 결합하고, 이것은 표적 세포 유형에 따라서 다수의 효과로 이어진다. CD40L은 또한 인테그린 α5β1 및 αIIbβ3에 결합하는 것으로 밝혀져 있다. CD40L은 공자극 분자로서 작용하고, T 소포성 헬퍼 세포(T follicular helper cell: TFH 세포)라고 불리는 T 세포의 하위세트에 특히 중요하다. TFH 세포 상에서, CD40L은 B 세포 표면 상에 CD40을 결속시켜, 세포-세포 소통을 용이하게 함으로써 B 세포 성숙 및 기능을 촉진시킨다.
실시형태에서, 본 발명의 키메라 단백질은 인간 CD40L의 도메인, 예를 들어, 세포외 도메인을 포함한다. 인간 CD40L은 서열번호 3의 아미노산 서열(아미노산 47 내지 261개를 포함하는 세포외 도메인의 아미노산 서열을 가짐)을 포함한다. 실시형태에서, 본 발명의 키메라 단백질은 서열번호 4의 아미노산 서열을 갖는, 인간 CD40L의, 세포외 도메인을 포함한다. 실시형태에서, 본 발명의 키메라 단백질은 본 명세서에 기술된 바와 같은 CD40L의 세포외 도메인, 또는 이의 변이체 또는 기능성 단편을 포함할 수 있다. 예를 들어, 키메라 단백질은 본 명세서에 기술된 바와 같은 CD40L의 세포외 도메인의 아미노산 서열과 적어도 약 60%, 또는 적어도 약 61%, 또는 적어도 약 62%, 또는 적어도 약 63%, 또는 적어도 약 64%, 또는 적어도 약 65%, 또는 적어도 약 66%, 또는 적어도 약 67%, 또는 적어도 약 68%, 또는 적어도 약 69%, 또는 적어도 약 70%, 또는 적어도 약 71%, 또는 적어도 약 72%, 또는 적어도 약 73%, 또는 적어도 약 74%, 또는 적어도 약 75%, 또는 적어도 약 76%, 또는 적어도 약 77%, 또는 적어도 약 78%, 또는 적어도 약 79%, 또는 적어도 약 80%, 또는 적어도 약 81%, 또는 적어도 약 82%, 또는 적어도 약 83%, 또는 적어도 약 84%, 또는 적어도 약 85%, 또는 적어도 약 86%, 또는 적어도 약 87%, 또는 적어도 약 88%, 또는 적어도 약 89%, 또는 적어도 약 90%, 또는 적어도 약 91%, 또는 적어도 약 92%, 또는 적어도 약 93%, 또는 적어도 약 94%, 또는 적어도 약 95%, 또는 적어도 약 96%, 또는 적어도 약 97%, 또는 적어도 약 98%, 또는 적어도 약 99%의 서열 동일성을 갖는 상기에 제공된 바와 같은 CD40L의 세포외 도메인의 서열, 또는 이의 변이체 또는 기능성 단편을 포함할 수 있다.
CD40L 유도체는 문헌[Oganesyan V., et al., "Fibronectin type III domains engineered to bind CD40L: cloning, expression, purification, crystallization and preliminary X-ray diffraction analysis of two complexes", Acta Crystallogr Sect F Struct Biol Cryst Commun. 2013 Sep;69(Pt 9):1045-8]에 의해서 기술된 것을 비롯한, 입수 가능한 구조 데이터로부터 작제될 수 있다.
실시형태에서, 본 발명의 키메라 단백질은 신호 펩타이드(예를 들어, 서열번호 3에 제공된 바와 같음)가 대안적인 신호 펩타이드로 대체된 CD40L의 변이체 세포외 도메인을 포함할 수 있다. 실시형태에서, 본 발명의 키메라 단백질은 단백질 생산 세포, 예컨대, 중국 햄스터 난소(CHO) 또는 HEK 세포에서 발현에 대해서 코돈-최적화된 cDNA로부터 발현된 CD40L의 변이체 세포외 도메인을 포함할 수 있다.
실시형태에서, CD40L의 세포외 도메인은 세포외 환경과 상호작용할 수 있는 단백질의 부분을 지칭한다. 실시형태에서, CD40L의 세포외 도메인은 세포의 외부 또는 세포막에 존재하는 단백질의 전체 아미노산 서열이다. 실시형태에서, CD40L의 세포외 도메인은 세포의 외부 또는 세포막에 존재하는 단백질의 아미노산 서열의 부분이며, 관련 기술 분야에 공지된 방법을 사용하여 검정될 수 있는 바와 같이 신호 변환 및/또는 리간드 결합에 필요하다.
실시형태에서, CD40L의 세포외 도메인은 CD40 수용체에 결합할 수 있는 단백질의 부분을 지칭한다. 다른 TNF 슈퍼패밀리 구성원과 유사하게, 막-결합된 CD40L은 동종삼량체로서 존재한다. CD40L은 수지상 세포(DC), B 세포 및 대식세포를 비롯한, 항원 제시 세포 상에서 우세하게 발현되는 TNF 수용체 슈퍼패밀리의 구성원인 CD40에 결합한다. CD40L/CD40 상호작용은, 조혈 및 비-조혈 구획의 다수의 세포 중에서, 수지상 세포, B 세포, 및 내피 세포에 엄청난 효과를 발휘한다. 예를 들어, CD40 신호전달은 DC가 성숙하여 T-세포 활성화 및 분화를 효과적으로 촉발하도록 유도한다. B 세포의 CD40 신호전달은 배중심(germinal center: GC) 형성, 면역글로불린(Ig) 아이소타입 스위칭, 항원에 대한 친화도를 향상시키기 위한 Ig의 체성 과변이(somatic hypermutation: SHM), 및 장기간 생존하는 형질 세포 및 기억 B 세포의 형성을 촉진시킨다. CD40 신호전달은 또한 면역 세포 생존에 중요하다.
실시형태에서, 본 발명의 키메라 단백질은 약 1μM, 약 900nM, 약 800nM, 약 700nM, 약 600nM, 약 550nM, 약 530nM, 약 500nM, 약 400nM, 약 300nM, 약 200nM, 약 100nM, 약 90nM, 약 80nM, 약 70nM, 약 60nM, 약 55nM, 약 50nM, 약 45nM, 약 40nM, 약 35nM, 약 30nM, 약 25nM, 약 20nM, 약 15nM, 약 10nM, 또는 약 5nM, 또는 약 1nM 미만(예를 들어, 표면 플라스몬 공명 또는 생물층 간섭계법에 의해서 측정되는 경우)의 KD로 인간 CD40에 결합한다. 실시형태에서, 키메라 단백질은 약 1nM, 약 900pM, 약 800pM, 약 700pM, 약 600pM, 약 500pM, 약 400pM, 약 300pM, 약 200pM, 약 100pM, 약 90pM, 약 80pM, 약 70pM, 약 60pM 약 55pM 약 50pM 약 45pM, 약 40pM, 약 35pM, 약 30pM, 약 25pM, 약 20pM, 약 15pM, 또는 약 10pM, 또는 약 1pM 미만(예를 들어, 표면 플라스몬 공명 또는 생물층 간섭계법에 의해서 측정되는 경우)의 KD로 인간 CD40에 결합한다. 실시형태에서, 키메라 단백질은 약 300pM 내지 약 700pM의 KD로 인간 CD40에 결합한다.
실시형태에서, 본 발명의 키메라 단백질은 CSF1R의 세포외 도메인(서열번호 2)을 포함한다.
실시형태에서, 본 발명의 키메라 단백질은 CD40L의 세포외 도메인(서열번호 4)을 포함한다.
실시형태에서, 본 발명의 키메라 단백질은 OX40L의 세포외 도메인(서열번호 7)을 포함한다.
실시형태에서, 본 발명의 키메라 단백질은 CSF1R의 세포외 도메인(서열번호 2) 및 CD40L의 세포외 도메인(서열번호 4)을 포함한다.
실시형태에서, 본 발명의 키메라 단백질은 CSF1R의 세포외 도메인(서열번호 2) 및 OX40L의 세포외 도메인(서열번호 7)을 포함한다.
실시형태에서, 본 발명의 키메라 단백질은 인간 IgG4 항체 서열(서열번호 25, 26 또는 27)로부터의 힌지-CH2-CH3 도메인을 포함한다.
실시형태에서, 키메라 단백질은 도 20에 나타낸 바와 같은 모듈식 링커를 포함한다.
실시형태에서, 본 발명의 키메라 단백질은 링커로서 인간 IgG4 항체 서열로부터의 힌지-CH2-CH3 도메인을 사용하는, CSF1R의 세포외 도메인 및 CD40L의 세포외 도메인을 포함한다(이러한 CSF1R-Fc-CD40L 키메라는 서열번호 5임).
실시형태에서, 본 발명의 키메라 단백질은 링커로서 인간 IgG4 항체 서열로부터의 힌지-CH2-CH3 도메인을 사용하는, CSF1R의 세포외 도메인 및 OX40L의 세포외 도메인을 포함한다(이러한 CSF1R-Fc-OX40L 키메라는 서열번호 8임).
실시형태에서, 본 발명의 키메라 단백질은 서열번호 5, 즉, 단량체 CSF1R-Fc-CD40L 키메라 단백질(SL-115154), 또는 이의 변이체 또는 기능성 단편을 포함한다.
실시형태에서, 키메라 단백질은 서열번호 5 또는 8 중 임의의 하나의 아미노산 서열과 적어도 약 60%, 또는 적어도 약 61%, 또는 적어도 약 62%, 또는 적어도 약 63%, 또는 적어도 약 64%, 또는 적어도 약 65%, 또는 적어도 약 66%, 또는 적어도 약 67%, 또는 적어도 약 68%, 또는 적어도 약 69%, 또는 적어도 약 70%, 또는 적어도 약 71%, 또는 적어도 약 72%, 또는 적어도 약 73%, 또는 적어도 약 74%, 또는 적어도 약 75%, 또는 적어도 약 76%, 또는 적어도 약 77%, 또는 적어도 약 78%, 또는 적어도 약 79%, 또는 적어도 약 80%, 또는 적어도 약 81%, 또는 적어도 약 82%, 또는 적어도 약 83%, 또는 적어도 약 84%, 또는 적어도 약 85%, 또는 적어도 약 86%, 또는 적어도 약 87%, 또는 적어도 약 88%, 또는 적어도 약 89%, 또는 적어도 약 90%, 또는 적어도 약 91%, 또는 적어도 약 92%, 또는 적어도 약 93%, 또는 적어도 약 94%, 또는 적어도 약 95%, 또는 적어도 약 96%, 또는 적어도 약 97%, 또는 적어도 약 98%, 또는 적어도 약 99% 서열 동일성을 가질 수 있다.
실시형태에서, 본 발명의 키메라 단백질은 본 명세서에 개시된 서열 중 임의의 하나와 관련하여 하나 이상의 아미노산 돌연변이를 갖는 서열을 포함할 수 있다. 실시형태에서, 키메라 단백질은 본 명세서에 개시된 키메라 단백질의 아미노산 서열 중 임의의 하나와 관련하여 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 또는 100개 또는 그 초과의 아미노산 돌연변이를 갖는 서열을 포함한다.
실시형태에서, 하나 이상의 아미노산 돌연변이는 치환, 삽입, 결실, 및 절두로부터 독립적으로 선택될 수 있다.
실시형태에서, 아미노산 돌연변이는 아미노산 치환이며, 보존적 및/또는 비보존적 치환을 포함할 수 있다.
"보존적 치환"은 예를 들어, 포함된 아미노산 잔기의 극성, 전하, 크기, 용해도, 소수성, 친수성 및/또는 양친매성 본성의 유사성을 기초로 수행될 수 있다. 20종의 자연 발생 아미노산은 하기 6종의 표준 아미노산 군으로 분류될 수 있다: (1) 소수성: Met, Ala, Val, Leu, Ile; (2) 중성 친수성: Cys, Ser, Thr; Asn, Gln; (3) 산성: Asp, Glu; (4) 염기성: His, Lys, Arg; (5) 쇄 배향에 영향을 미치는 잔기: Gly, Pro; 및 (6) 방향족: Trp, Tyr, Phe.
본 명세서에서 사용되는 바와 같이, "보존적 치환"은 아미노산을, 상기에 나타낸 6종의 표준 아미노산 군 중 동일한 군에 열거된 또 다른 아미노산으로 교환시키는 것으로서 정의된다. 예를 들어, Asp의 Glu에 의한 교환은 이렇게 변형된 폴리펩타이드에서 하나의 음전하를 보유한다. 또한, 글리신 및 프롤린은 α-나선을 파괴하는 이들의 능력을 기초로 또 다른 것에 대해서 치환될 수 있다.
본 명세서에서 사용되는 바와 같이, "비-보존적 치환"은 아미노산을, 상기에 나타낸 6종의 표준 아미노산 군 (1) 내지 (6) 중 상이한 군에 열거된 또 다른 아미노산으로 교환시키는 것으로서 정의된다.
실시형태에서, 치환은 또한 비고전적 아미노산(예를 들어, 일반적으로 셀레노시스테인, 피로라이신, N-폼일메티오닌 β-알라닌, GABA 및 δ-아미노레불린산, 4-아미노벤조산(PABA), 일반적인 아미노산의 D-이성질체, 2,4-다이아미노부티르산, α-아미노 아이소부티르산, 4-아미노부티르산, Abu, 2-아미노 부티르산, γ-Abu, ε-Ahx, 6-아미노 헥산산, Aib, 2-아미노 아이소부티르산, 3-아미노 프로피온산, 오르니틴, 노르류신, 노르발린, 하이드록시프롤린, 사르코슴(sarcosme), 시트룰린, 호모시트룰린, 시스테인산, t-부틸글리신, t-부틸알라닌, 페닐글리신, 사이클로헥실알라닌, β-알라닌, 플루오로-아미노산, 디자이너(designer) 아미노산, 예컨대, β 메틸 아미노산, C α-메틸 아미노산, N α-메틸 아미노산, 및 아미노산 유사체)을 포함할 수 있다.
코돈 축퇴를 고려하는 것을 포함하는, 유전자 암호를 참고하여 키메라 단백질의 뉴클레오타이드 서열에 대해서 돌연변이가 또한 행해질 수 있다.
실시형태에서, 키메라 단백질은 링커를 포함한다. 실시형태에서, 링커는 다이설파이드 결합을 형성할 수 있는 적어도 하나의 시스테인 잔기를 포함한다. 본 명세서 다른 곳에 기술된 바와 같이, 이러한 다이설파이드 결합을 형성할 수 있는 적어도 하나의 시스테인 잔기는 이론에 얽매이고자 함은 아니지만, 키메라 단백질의 적절한 다량체 상태를 유지시켜, 효율적인 생산을 가능하게 하는 책임이 있다.
실시형태에서, 본 발명의 키메라 단백질은 (a) 집락 자극 인자 1 수용체(CSF1R) 리간드에 결합할 수 있는 CSF1R의 부분, 예를 들어, CSF1R의 세포외 도메인을 포함하는 제1 도메인; (b) CD40 리간드(CD40L) 수용체에 결합할 수 있는 CD40L의 부분, 예를 들어, CD40L의 세포외 도메인을 포함하는 제2 도메인; 및 (c) 제1 도메인과 제2 도메인을 연결하는 링커를 포함한다.
실시형태에서, 키메라 단백질은 재조합 융합 단백질, 예를 들어, 본 명세서에 기술된 세포외 도메인(및 선택적으로 링커)을 갖는 단일 폴리펩타이드이다. 예를 들어, 실시형태에서, 키메라 단백질은 세포에서 단일 단위로 번역된다. 실시형태에서, 키메라 단백질은 예를 들어, 생체내에서, 연결되어 단일 단위를 산출하는 다수의 폴리펩타이드의 재조합 단백질, 예를 들어, 본 명세서에 기술된 다수의 세포외 도메인(예를 들어, 본 명세서에 기술된 하나 이상의 합성 링커를 가짐)을 지칭한다. 실시형태에서, 키메라 단백질은 하나의 폴리펩타이드로서 화학적으로 합성되거나 또는 각각의 도메인은 개별적으로 화학적으로 합성되고, 그 다음 조합될 수 있다. 실시형태에서, 키메라 단백질의 일부는 번역되고, 일부는 화학적으로 합성된다.
실시형태에서, 본 발명의 키메라 단백질은 본 명세서에 기술된 변이체일 수 있고, 예를 들어, 본 발명의 키메라 단백질은 본 발명의 키메라 단백질의 아미노산 서열, 예를 들어, 서열번호 5 및 8 중 하나 이상과 적어도 약 60% 또는 적어도 약 61% 또는 적어도 약 62% 또는 적어도 약 63% 또는 적어도 약 64% 또는 적어도 약 65% 또는 적어도 약 66% 또는 적어도 약 67% 또는 적어도 약 68% 또는 적어도 약 69% 또는 적어도 약 70% 또는 적어도 약 71% 또는 적어도 약 72% 또는 적어도 약 73% 또는 적어도 약 74% 또는 적어도 약 75% 또는 적어도 약 76% 또는 적어도 약 77% 또는 적어도 약 78% 또는 적어도 약 79% 또는 적어도 약 80% 또는 적어도 약 81% 또는 적어도 약 82% 또는 적어도 약 83% 또는 적어도 약 84% 또는 적어도 약 85% 또는 적어도 약 86% 또는 적어도 약 87% 또는 적어도 약 88% 또는 적어도 약 89% 또는 적어도 약 90% 또는 적어도 약 91% 또는 적어도 약 92% 또는 적어도 약 93% 또는 적어도 약 94% 또는 적어도 약 95% 또는 적어도 약 96% 또는 적어도 약 97% 또는 적어도 약 98% 또는 적어도 약 99%의 서열 동일성을 갖는 서열을 가질 수 있다.
실시형태에서, 키메라 단백질은 링커를 포함한다. 실시형태에서, 링커는 자연 발생 멀티-도메인 단백질로부터 유래될 수 있거나 또는 예를 들어, 전문이 참고로 포함된 문헌[Chichili et al., (2013), Protein Sci. 22(2):153-167, Chen et al., (2013), Adv Drug Deliv Rev. 65(10):1357-1369]에 기술된 바와 같은 경험적 링커이다. 실시형태에서, 링커는 링커 설계 데이터베이스 및 컴퓨터 프로그램, 예컨대, 전문이 참고로 포함된 문헌[Chen et al., (2013), Adv Drug Deliv Rev. 65(10):1357-1369 및 Crasto et. al., (2000), Protein Eng. 13(5):309-312]에 기술된 것을 사용하여 설계될 수 있다.
실시형태에서, 링커는 합성 링커, 예컨대, PEG이다.
실시형태에서, 링커는 폴리펩타이드를 포함한다. 실시형태에서, 폴리펩타이드는 약 500개 미만의 아미노산 길이, 약 450개 미만의 아미노산 길이, 약 400개 미만의 아미노산 길이, 약 350개 미만의 아미노산 길이, 약 300개 미만의 아미노산 길이, 약 250개 미만의 아미노산 길이, 약 200개 미만의 아미노산 길이, 약 150개 미만의 아미노산 길이, 또는 약 100개 미만의 아미노산 길이이다. 예를 들어, 링커는 약 100개, 약 95개, 약 90개, 약 85개, 약 80개, 약 75개, 약 70개, 약 65개, 약 60개, 약 55개, 약 50개, 약 45개, 약 40개, 약 35개, 약 30개, 약 25개, 약 20개, 약 19개, 약 18개, 약 17개, 약 16개, 약 15개, 약 14개, 약 13개, 약 12개, 약 11개, 약 10개, 약 9개, 약 8개, 약 7개, 약 6개, 약 5개, 약 4개, 약 3개, 또는 약 2개 미만의 아미노산 길이일 수 있다. 실시형태에서, 링커는 가요성이다. 실시형태에서, 링커는 강성이다.
실시형태에서, 링커는 글리신 및 세린 잔기(예를 들어, 약 30% 또는 약 40% 또는 약 50% 또는 약 60% 또는 약 70% 또는 약 80% 또는 약 90% 또는 약 95% 또는 약 97% 또는 약 98% 또는 약 99% 또는 약 100%의 글리신 및 세린)로 실질적으로 구성된다.
실시형태에서, 링커는 항체의(예를 들어, 하위부류(예를 들어, IgG1, IgG2, IgG3 및 IgG4 및 IgA1 및 IgA2)를 포함하는, IgG, IgA, IgD, 및 IgE의) 힌지 영역을 포함한다. IgG, IgA, IgD, 및 IgE 부류 항체에서 발견된 힌지 영역은 가요성 스페이서로서 작용하여, Fab 부분이 공간에서 자유롭게 이동하는 것을 가능하게 한다. 불변 영역과 대조적으로, 힌지 도메인은 구조적으로 다양하며, 면역글로불린 부류 및 하위부류 사이에서 서열 및 길이 둘 모두가 다양하다. 예를 들어, 힌지 영역의 길이 및 가요성은 IgG 하위부류 중에서 다양하다. IgG1의 힌지 영역은 아미노산 216 내지 231개를 포함하며, 그것은 자유롭게 가요성이기 때문에, Fab 단편은 이의 대칭축에 대해서 회전하여 2개의 중쇄간 다이설파이드 브리지 중 첫 번째 것에 중심이 있는 구체 내에서 이동할 수 있다. IgG2는 IgG1보다 더 짧은 힌지를 갖고, 12개의 아미노산 잔기 및 4개의 다이설파이드 브리지를 갖는다. IgG2의 힌지 영역은 글리신 잔기가 결핍되어 있고, 비교적 짧으며, 추가의 중쇄간 다이설파이드 브리지에 의해서 안정화된 강성 폴리-프롤린 이중 나선을 함유한다. 이러한 특성은 IgG2 분자의 가요성을 제한한다. IgG3은, 62개의 아미노산(21개의 프롤린 및 11개의 시스테인을 포함함)을 함유하고, 비가요성 폴리-프롤린 이중 나선을 형성하는, 이의 고유한 연장된 힌지 영역(IgG1 힌지의 약 4배 길이임)이 다른 하위부류와 상이하다. IgG3에서, Fab 단편은 Fc 단편으로부터 비교적 멀리 존재하여, 분자에 더 큰 가요성을 제공한다. IgG3 내의 연장된 힌지는 또한 다른 하위부류와 비교할 때 이의 더 높은 분자량에 대해서 책임이 있다. IgG4의 힌지 영역은 IgG1의 힌지 영역보다 더 짧고, 이의 가요성은 IgG1의 힌지 영역과 IgG2의 힌지 영역의 중간이다. 힌지 영역의 가요성은 보고된 바에 따르면 IgG3>IgG1>IgG4>IgG2의 순서로 감소된다. 실시형태에서, 링커는 인간 IgG4로부터 유래되고, 하나 이상의 돌연변이를 함유하여 이량체화(S228P를 포함함) 또는 FcRn 결합을 향상시킬 수 있다.
결정학 연구에 따르면, 면역글로불린 힌지 영역은 3개의 영역: 상부 힌지 영역, 코어 영역, 및 하부 힌지 영역으로 추가로 기능적으로 나뉠 수 있다(문헌[Shin et al., 1992 Immunological Reviews 130:87] 참고). 상부 힌지 영역은 CH1의 카복실 단부에서부터 운동을 제한하는 힌지 내의 제1 잔기, 일반적으로는 2개의 중쇄 사이에서 쇄간 다이설파이드 결합을 형성하는 제1 시스테인 잔기까지의 아미노산을 포함한다. 상부 힌지 영역의 길이는 항체의 분절 가요성과 상관관계가 있다. 상기와 동일하게, 코어 힌지 영역은 중쇄간 다이설파이드 브리지를 함유하고, 하부 힌지 영역은 CH2 도메인의 아미노 말단 단부에 결합되고, CH2 내의 잔기를 포함한다. 야생형 인간 IgG1의 코어 힌지 영역은 서열 CPPC(서열번호 48)을 함유하고, 이것은 다이설파이드 결합 형성에 의해서 이량체화되는 경우, 중심점으로서 작용한다고 여겨지는 환식 옥타펩타이드를 생성하여, 가요성을 부여한다. 실시형태에서, 본 발명의 링커는 임의의 항체의(예를 들어, 하위부류(예를 들어, IgG1, IgG2, IgG3 및 IgG4 및 IgA1 및 IgA2)를 포함하는, IgG, IgA, IgD, 및 IgE의) 상부 힌지 영역, 코어 영역, 및 하부 힌지 영역 중 1개, 2개 또는 3개를 포함한다. 힌지 영역은 또한 하나 이상의 글리코실화 부위를 함유할 수 있는데, 이것은 탄수화물 부착을 위해서 다수의 구조적으로 구별되는 유형의 부위를 포함한다. 예를 들어, IgA1은 힌지 영역의 17-아미노산 분절 내에 5개의 글리코실화 부위를 함유하여, 분비성 면역글로불린에 대해서 이로운 특성인 것으로 간주되는, 장 프로테아제에 대한 힌지 영역 폴리펩타이드의 내성을 부여한다. 실시형태에서, 본 발명의 링커는 하나 이상의 글리코실화 부위를 포함한다.
실시형태에서, 링커는 항체의(예를 들어, 하위부류(예를 들어, IgG1, IgG2, IgG3 및 IgG4 및 IgA1 및 IgA2)를 포함하는, IgG, IgA, IgD, 및 IgE의) Fc 도메인을 포함한다. 실시형태에서, 링커는 인간 IgG4 항체로부터 유래된 힌지-CH2-CH3 Fc 도메인을 포함한다. 실시형태에서, 링커는 인간 IgG1 항체로부터 유래된 힌지-CH2-CH3 Fc 도메인을 포함한다. 실시형태에서, Fc 도메인은 신생아 Fc 수용체(FcRn)에 대한 증가된 친화도 및 향상된 결합을 나타낸다. 실시형태에서, Fc 도메인은 FcRn에 대한 친화도를 증가시키고, 이에 대한 결합을 향상시키는 하나 이상의 돌연변이를 포함한다. 이론에 얽매이고자 함은 아니지만, FcRn에 대한 증가된 친화도 및 향상된 결합은 본 발명의 키메라 단백질의 생체내 반감기를 증가시킨다고 여겨진다.
실시형태에서, 링커에서 Fc 도메인은 아미노산 잔기 250, 252, 254, 256, 308, 309, 311, 416, 428, 433 또는 434(본 명세서에 명확하게 참고로 포함된 문헌[Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]에서와 같은 카밧 넘버링에 따름)에서 하나 이상의 아미노산 치환 또는 이의 등가물을 함유한다. 실시형태에서, 아미노산 잔기 250에서의 아미노산 치환은 글루타민으로의 치환이다. 실시형태에서, 아미노산 잔기 252에서의 아미노산 치환은 타이로신, 페닐알라닌, 트립토판 또는 트레오닌으로의 치환이다. 실시형태에서, 아미노산 잔기 254에서의 아미노산 치환은 트레오닌으로의 치환이다. 실시형태에서, 아미노산 잔기 256에서의 아미노산 치환은 세린, 아르기닌, 글루타민, 글루탐산, 아스파트산 또는 트레오닌으로의 치환이다. 실시형태에서, 아미노산 잔기 308에서의 아미노산 치환은 트레오닌으로의 치환이다. 실시형태에서, 아미노산 잔기 309에서의 아미노산 치환은 프롤린으로의 치환이다. 실시형태에서, 아미노산 잔기 311에서의 아미노산 치환은 세린으로의 치환이다. 실시형태에서, 아미노산 잔기 385에서의 아미노산 치환은 아르기닌, 아스파트산, 세린, 트레오닌, 히스티딘, 라이신, 알라닌 또는 글리신으로의 치환이다. 실시형태에서, 아미노산 잔기 386에서의 아미노산 치환은 트레오닌, 프롤린, 아스파트산, 세린, 라이신, 아르기닌, 아이소류신 또는 메티오닌으로의 치환이다. 실시형태에서, 아미노산 잔기 387에서의 아미노산 치환은 아르기닌, 프롤린, 히스티딘, 세린, 트레오닌 또는 알라닌으로의 치환이다. 실시형태에서, 아미노산 잔기 389에서의 아미노산 치환은 프롤린, 세린 또는 아스파라긴으로의 치환이다. 실시형태에서, 아미노산 잔기 416에서의 아미노산 치환은 세린으로의 치환이다. 실시형태에서, 아미노산 잔기 428에서의 아미노산 치환은 류신으로의 치환이다. 실시형태에서, 아미노산 잔기 433에서의 아미노산 치환은 아르기닌, 세린, 아이소류신, 프롤린 또는 글루타민으로의 치환이다. 실시형태에서, 아미노산 잔기 434에서의 아미노산 치환은 히스티딘, 페닐알라닌 또는 타이로신으로의 치환이다.
실시형태에서, 링커에서 Fc 도메인(예를 들어, IgG 불변 영역을 포함함)은 아미노산 잔기 252, 254, 256, 433, 434, 또는 436(본 명세서에 명확하게 참고로 포함된 문헌[Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]에서와 같은 카밧 넘버링을 따름)에서, 하나 이상의 돌연변이, 예컨대, 치환을 포함한다. 실시형태에서, IgG 불변 영역은 삼중 M252Y/S254T/T256E 돌연변이 또는 YTE 돌연변이를 포함한다. 실시형태에서, IgG 불변 영역은 삼중 H433K/N434F/Y436H 돌연변이 또는 KFH 돌연변이를 포함한다. 실시형태에서, IgG 불변 영역은 YTE 및 KFH 돌연변이를 조합하여 포함한다.
실시형태에서, 본 발명의 변형된 인간화된 항체는 아미노산 잔기 250, 253, 307, 310, 380, 428, 433, 434 및 435(본 명세서에 명확하게 참고로 포함된 문헌[Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]에서와 같은 카밧 넘버링을 따름)에서 하나 이상의 돌연변이를 함유하는 IgG 불변 영역을 포함한다. 예시적인 돌연변이는 T250Q, M428L, T307A, E380A, I253A, H310A, M428L, H433K, N434A, N434F, N434S 및 H435A를 포함한다. 실시형태에서, IgG 불변 영역은 M428L/N434S 돌연변이 또는 LS 돌연변이를 포함한다. 실시형태에서, IgG 불변 영역은 T250Q/M428L 돌연변이 또는 QL 돌연변이를 포함한다. 실시형태에서, IgG 불변 영역은 N434A 돌연변이를 포함한다. 실시형태에서, IgG 불변 영역은 T307A/E380A/N434A 돌연변이 또는 AAA 돌연변이를 포함한다. 실시형태에서, IgG 불변 영역은 I253A/H310A/H435A 돌연변이 또는 IHH 돌연변이를 포함한다. 실시형태에서, IgG 불변 영역은 H433K/N434F 돌연변이를 포함한다. 실시형태에서, IgG 불변 영역은 M252Y/S254T/T256E 및 H433K/N434F 돌연변이를 조합하여 포함한다.
IgG 불변 영역에서의 추가로 예시적인 돌연변이는 예를 들어, 전문이 참고로 포함된 문헌[Robbie, et al., Antimicrobial Agents and Chemotherapy (2013), 57(12):6147-6153, Dall'Acqua et al., JBC (2006), 281(33):23514-24, Dall'Acqua et al., Journal of Immunology (2002), 169:5171-80, Ko et al. Nature (2014) 514:642-645, Grevys et al. Journal of Immunology. (2015), 194(11):5497-508] 및 미국 특허 제7,083,784호에 기술되어 있다.
실시형태에서, 링커에서 Fc 도메인은 서열번호 25(하기 표 참고)의 아미노산 서열, 또는 이와 적어도 90% 또는 93% 또는 95% 또는 97% 또는 98% 또는 99%의 동일성을 갖는다. 실시형태에서, 돌연변이가 서열번호 25에 대해서 수행되어 안정성 및/또는 반감기를 증가시킨다. 예를 들어, 실시형태에서, 링커에서 Fc 도메인은 서열번호 26(하기 표 참고)의 아미노산 서열, 또는 이와 적어도 90% 또는 93% 또는 95% 또는 97% 또는 98% 또는 99%의 동일성을 포함한다. 예시적인 Fc 안정화 돌연변이체는 S228P이다. 예시적인 Fc 반감기 연장 돌연변이체는 T250Q, M428L, V308T, L309P, 및 Q311S이며, 본 발명의 링커는 이러한 돌연변이체 중 1개, 또는 2개, 또는 3개, 또는 4개, 또는 5개를 포함할 수 있다. 예를 들어, 실시형태에서, 링커에서 Fc 도메인은 서열번호 27(하기 표 참고)의 아미노산 서열, 또는 이와 적어도 90% 또는 93% 또는 95% 또는 97% 또는 98% 또는 99%의 동일성을 포함한다.
추가로, 하나 이상의 접합 링커를 사용하여 링커 내의 Fc 도메인(예를 들어, 서열번호 25, 서열번호 26, 또는 서열번호 27 중 하나 또는 이와 적어도 90% 또는 93% 또는 95% 또는 97% 또는 98% 또는 99% 동일성을 갖는 것)과 세포외 도메인을 연결할 수 있다. 예를 들어, 서열번호 28, 서열번호 29, 서열번호 30, 서열번호 31, 서열번호 32, 서열번호 33, 또는 이의 변이체 중 임의의 하나는 본 명세서에 기술된 바와 같은 세포외 도메인(ECD)과 본 명세서에 기술된 바와 같은 링커 내의 Fc 도메인을 연결할 수 있다. 선택적으로, 서열번호 28 내지 74 중 임의의 하나 또는 이의 변이체는 본 명세서에 기술된 바와 같은 세포외 도메인 및 본 명세서에 기술된 바와 같은 Fc 도메인 사이에 위치된다. 실시형태에서, 키메라 단백질은 Fc 도메인 이전에 하나의 접합 링커를 포함하고, Fc 도메인 이후에 제2 접합 링커를 포함하고; 따라서, 키메라 단백질은 하기 구조를 포함할 수 있다:
ECD 1(예를 들어, CSF1R) - 접합 링커 1 - Fc 도메인 - 접합 링커 2 - ECD 2(예를 들어, CD40L).
실시형태에서, 제1 접합 링커 및 제2 접합 링커는 상이할 수 있거나 또는 이들은 동일할 수 있다.
실시형태에서, 제1 접합 링커 및 제2 접합 링커는 서열번호 25 내지 74의 아미노산 서열로부터 선택될 수 있고, 하기 표 1에 제공된다:
실시형태에서, 접합 링커는 글리신 및 세린 잔기(예를 들어, 약 30% 또는 약 40% 또는 약 50% 또는 약 60% 또는 약 70% 또는 약 80% 또는 약 90% 또는 약 95% 또는 약 97% 또는 약 98% 또는 약 99% 또는 약 100%의 글리신 및 세린)를 실질적으로 포함한다. 예를 들어, 실시형태에서, 접합 링커는 (Gly4Ser)n이며, 여기서 n은 약 1 내지 약 8, 예를 들어, 1, 2, 3, 4, 5, 6, 7 또는 8(각각 서열번호 49 내지 서열번호 56)이다. 실시형태에서, 접합 링커 서열은 GGSGGSGGGGSGGGGS(서열번호 57)이다. 추가로 예시적인 접합 링커는 서열 LE, (Gly)8(서열번호 58), (Gly)6(서열번호 59), (EAAAK)n(n=1 내지 3)(서열번호 60 내지 서열번호 62), A(EAAAK)nA(n = 2 내지 5)(서열번호 63 내지 서열번호 66), A(EAAAK)4ALEA(EAAAK)4A(서열번호 67), PAPAP(서열번호 68), KESGSVSSEQLAQFRSLD(서열번호 69), GSAGSAAGSGEF(서열번호 70), 및 (XP)n(X는 임의의 아미노산, 예를 들어, Ala, Lys 또는 Glu를 나타냄)를 갖는 링커를 포함하지만 이들로 제한되지 않는다. 실시형태에서, 접합 링커는 GGS이다.
실시형태에서, 접합 링커는 GGGSE(서열번호 71), GSESG(서열번호 72), GSEGS(서열번호 73), GEGGSGEGSSGEGSSSEGGGSEGGGSEGGGSEGGS(서열번호 74), 및 4개의 아미노산 간격마다 무작위로 위치된 G, S 및 E의 접합 링커 중 하나 이상이다.
실시형태에서, 키메라 단백질은 도 20에 나타낸 바와 같은 모듈식 링커를 포함한다.
실시형태에서, 링커는 기능성일 수 있다. 예를 들어, 비제한적으로, 링커는 본 발명의 키메라 단백질의 폴딩 및/또는 안정성을 개선시키고/시키거나, 발현을 개선시키고/시키거나 약동학을 개선시키고/시키거나 생물활성도를 개선시키도록 기능할 수 있다. 또 다른 예에서, 링커는 키메라 단백질을 특정 세포 유형 또는 위치에 대해서 표적화하도록 기능할 수 있다.
실시형태에서, 키메라 단백질은 향상된 안정성 및 단백질 반감기를 나타낸다. 실시형태에서, 키메라 단백질은 높은 친화도로 FcRn에 결합한다. 실시형태에서, 키메라 단백질은 약 1nM 내지 약 80nM의 KD로 FcRn에 결합할 수 있다. 예를 들어, 키메라 단백질은 약 1nM, 약 2nM, 약 3nM, 약 4nM, 약 5nM, 약 6nM, 약 7nM, 약 8nM, 약 9nM, 약 10nM, 약 15nM, 약 20nM, 약 25nM, 약 30nM, 약 35nM, 약 40nM, 약 45nM, 약 50nM, 약 55nM, 약 60nM, 약 65nM, 약 70nM, 약 71nM, 약 72nM, 약 73nM, 약 74nM, 약 75nM, 약 76nM, 약 77nM, 약 78nM, 약 79nM, 또는 약 80nM의 KD로 FcRn에 결합할 수 있다. 실시형태에서, 키메라 단백질은 약 9nM의 KD로 FcRn에 결합할 수 있다. 실시형태에서, 키메라 단백질은 효과기 기능을 갖는 다른 Fc 수용체(즉, FcRn이 아닌 것)에 실질적으로 결합하지 않는다.
실시형태에서, 식 ECD 1 - 접합 링커 1 - Fc 도메인 - 접합 링커 2 - ECD 2를 갖는 키메라 단백질(식 중, ECD 1은 CSF1R이고, ECD 2는 CD40L임)은 CSF1R-Fc-CD40L로서 본 개시내용에서 지칭될 수 있다. 실시형태에서, 이 키메라 단백질은 접합 링커 중 하나 또는 둘 모두가 결여되어 있고; 이러한 키메라 단백질은 또한 본 개시내용에서 CSF1R-Fc-CD40L이라고 지칭될 수 있다.
실시형태에서, 키메라 단백질은 식 N 말단 - (a) - (b) - (c) - C 말단을 갖는 융합 단백질이고(식 중 (a)는 CSF1R이고, (b)는 Fc 도메인의 적어도 부분을 포함하는 링커이고, (c)는 CD40L임)이고, 본 개시내용에서 CSF1R-Fc-CD40L라고 지칭될 수 있다.
실시형태에서, 키메라 단백질은 뮤린 리간드/수용체에 대해서 최적화되고/이에 지향되고; 이러한 키메라 단백질의 예는 뮤린 CSF1R-Fc-CD40L인데, 이것은 또한 본 명세서에서 mCSF1R-Fc-CD40L이라고 지칭된다.
실시형태에서, 키메라 단백질은 인간 리간드/수용체에 대해서 최적화되고/이에 지향되고; 이러한 키메라 단백질의 예는 인간 CSF1R-Fc-CD40L인데, 이것은 또한 본 명세서에서 hCSF1R-Fc-CD40L이라고 지칭된다.
이러한 키메라 단백질은 접합 링커 중 하나 또는 둘 모두가 결핍될 수 있다. 예시적인 접합 링커 1s, Fc 도메인, 및 접합 링커 2s를 상기 표 1에 기술하며; 키메라 단백질을 형성하는 데 유용하고, 특정 접합 링커 1s, Fc 도메인, 및 접합 링커 2s를 포함하는 모듈식 링커를 도 20에 나타낸다. 실시형태에서, 본 발명의 키메라 단백질은 CSF1R/CSF1 면역 저해 신호전달 경로를 표적으로 하도록 조작된다. 실시형태에서, 키메라 단백질은 CSF1R에 대한 CSF1의 결합에 의해서 매개된 면역 저해 신호의 전달을 파괴, 차단, 감소 및/또는 저해하도록 조작된다. 실시형태에서, 면역 저해 신호는 면역 반응을 감소시키거나 제거하는 신호를 지칭한다. 예를 들어, 종양학과 관련하여, 이러한 신호는 항종양 면역을 감소시키거나 제거할 수 있다. 정상 생리학적 조건 하에서, 저해 신호는, 자기 관용의 유지(예를 들어, 자가면역의 예방)에 유용하며, 또한 면역계가 병원성 감염에 반응할 때 조직이 손상되는 것을 예방하는 데 유용하다. 예를 들어, 비제한적으로, 면역 저해 신호는, 이러한 저해 신호가 차단될 때, 세포 증식, 사이토카인 생산, 세포 사멸 활성도 또는 식세포 활성도의 증가를 검출함으로써 식별될 수 있다.
실시형태에서, 본 발명의 키메라 단백질은 CSF1R에 대한 CSF1 또는 IL-34의 결합에 의해서 매개된 면역 저해 신호의 전송을 파괴, 차단, 감소 및/또는 저해한다. 실시형태에서, 키메라 단백질은 CSF1 또는 IL-34에 결합하여, 이를 격리시키고, 이에 의해서 면역 세포(예를 들어, 종양-연관 대식세포, 항원 제시 세포, 골수 세포, 또는 T 세포)에 대한 저해 신호 전송을 파괴, 차단, 감소 및/또는 저해한다.
실시형태에서, 본 발명의 키메라 단백질은 면역 저해 수용체/리간드 쌍: CSF1R/CSF1 또는 CSF1R/IL-34의 결합을 저해하거나 감소시키는 것을 포함하는 방법에서 사용 가능하거나 사용된다. 실시형태에서, 본 발명의 키메라 단백질은, 예를 들어, 면역 세포 상의 CSF1R과 CSF1 또는 IL-34의 결합을 감소시킴으로써, CSF1R 활성화를 차단, 감소 및/또는 저해한다.
실시형태에서, 본 발명의 키메라 단백질은 CD40에 대한 CD40L의 결합에 의해서 매개되는 면역 자극 신호를 표적으로 한다. 실시형태에서, 키메라 단백질은 CD40에 대한 CD40L의 결합에 의해서 매개되는 면역 자극 신호의 전송을 향상, 증가 및/또는 자극하도록 조작된다. 실시형태에서, 면역 자극 신호는 면역 반응을 향상시키는 신호를 지칭한다. 예를 들어, 종양학과 관련하여, 이러한 신호는 항종양 면역을 향상시킬 수 있다. 예를 들어, 비제한적으로, 면역 자극 신호는 증식, 사이토카인 생산, 백혈구, 예컨대, T 세포의 하위세트의 사멸 활성도 또는 식세포 활성도를 직접 자극함으로써 식별될 수 있다.
실시형태에서, 본 발명의 키메라 단백질은 CD40에 대한 CD40L의 결합에 의해서 매개되는 면역 자극 신호의 전송을 향상, 증가 및/또는 자극한다. 실시형태에서, CD40L의 세포외 도메인을 포함하는 본 발명의 키메라 단백질은 CD40을 발현하고, 면역 세포(예를 들어, 수지상 세포, B 세포, 대식세포, 및 T 세포)에 대한 자극 신호 전송을 향상, 증가 및/또는 자극하는 면역 세포(예를 들어, 수지상 세포, B 세포, 대식세포, 항원 제시 세포, 또는 T 세포)에 대해서 작용한다.
실시형태에서, 본 발명의 키메라 단백질은 면역 자극 수용체/리간드 쌍: CD40:CD40L의 결합을 자극하거나 향상시키는 것을 포함하는 방법에서 사용 가능하거나 사용된다. 실시형태에서, 본 발명의 키메라 단백질은 CD40 및/또는 CD40과, CD40L 중 1종 이상의 결합을 증가시키고/시키거나 자극한다.
실시형태에서, 키메라 단백질은 CD40L이 아닌, 타입 II 단백질의 세포외 도메인을 포함한다. 예시적인 타입 II 단백질은 4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A, 및 TRAIL을 포함한다. 본 발명은 키메라 단백질 및 하기 키메라 단백질을 사용하는 방법을 추가로 포함한다: CSF1R/4-1BBL, CSF1R/CD30L, CSF1R/FasL, CSF1R/GITRL, CSF1R/LIGHT, CSF1R/OX40L, CSF1R/TL1A 및 CSF1R/TRAIL. 실시형태에서, 키메라 단백질은 CSF1R-Fc-4-1BBL, CSF1R-Fc-CD30L, CSF1R-Fc-FasL, CSF1R-Fc-GITRL, CSF1R-Fc-LIGHT, CSF1R-Fc-OX40L, CSF1R-Fc-TL1A 및 CSF1R-Fc-TRAIL 중 하나의 일반 구조식을 갖는다.
4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A 및 TRAIL에 대한 아미노산 서열은 각각 서열번호 9, 11, 13, 15, 17, 6, 21 및 23을 포함한다.
실시형태에서, 키메라 단백질은 각각 서열번호 10, 12, 14, 16, 18, 7, 22 및 24를 포함하는, 4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A 및 TRAIL 중 하나의 세포외 도메인을 포함한다. 실시형태에서, 본 발명의 키메라 단백질은 본 명세서에 기술된 바와 같은 4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A 또는 TRAIL의 세포외 도메인 또는 이의 변이체 또는 기능성 단편 포함할 수 있다. 예를 들어, 키메라 단백질은 상기에 제공된 바와 같은 4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A 또는 TRAIL의 세포외 도메인의 서열, 또는 본 명세서에 기술된 바와 같은 4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A 또는 TRAIL의 세포외 도메인의 아미노산 서열과 적어도 약 60%, 또는 적어도 약 61%, 또는 적어도 약 62%, 또는 적어도 약 63%, 또는 적어도 약 64%, 또는 적어도 약 65%, 또는 적어도 약 66%, 또는 적어도 약 67%, 또는 적어도 약 68%, 또는 적어도 약 69%, 또는 적어도 약 70%, 또는 적어도 약 71%, 또는 적어도 약 72%, 또는 적어도 약 73%, 또는 적어도 약 74%, 또는 적어도 약 75%, 또는 적어도 약 76%, 또는 적어도 약 77%, 또는 적어도 약 78%, 또는 적어도 약 79%, 또는 적어도 약 80%, 또는 적어도 약 81%, 또는 적어도 약 82%, 또는 적어도 약 83%, 또는 적어도 약 84%, 또는 적어도 약 85%, 또는 적어도 약 86%, 또는 적어도 약 87%, 또는 적어도 약 88%, 또는 적어도 약 89%, 또는 적어도 약 90%, 또는 적어도 약 91%, 또는 적어도 약 92%, 또는 적어도 약 93%, 또는 적어도 약 94%, 또는 적어도 약 95%, 또는 적어도 약 96%, 또는 적어도 약 97%, 또는 적어도 약 98%, 또는 적어도 약 99%의 서열 동일성을 갖는 이의 변이체 또는 기능성 단편을 포함할 수 있다.
실시형태에서, 본 발명의 키메라 단백질은, 면역 저해 신호의 국지적인 트랩을 제공하거나 또는 격리시키면서, 면역 세포(예를 들어, 항원 제시 세포)에 면역 자극을 전달한다. 실시형태에서, 키메라 단백질은 면역 활성화의 실제 결과를 갖는 신호를 전달한다.
실시형태에서, 본 발명의 키메라 단백질은 (예를 들어, 종양에 대한) 면역 활성화를 촉진시키는 단계를 포함하는 방법에서 사용 가능하고, 사용될 수 있다. 실시형태에서, 본 발명의 키메라 단백질은 (예를 들어, 종양이 생존하게 하는) 면역 저해를 억제시키는 단계를 포함하는 방법에서 사용 가능하고, 사용될 수 있다. 실시형태에서, 본 발명의 키메라 단백질은 작제물의 키메라 본성에 의해서 제공되는 신호전달의 근접성으로 인해서 개선된 면역 활성화 및/또는 면역 저해의 개선된 억제를 제공한다.
실시형태에서, 본 발명의 키메라 단백질은 면역 반응의 정도를 조정하는, 예를 들어, 효과기 생산량의 수준을 조정하는 단계를 포함하는 방법에서 사용 가능하고, 사용될 수 있다. 실시형태에서, 예를 들어, 암 및/또는 염증성 질환의 치료를 위해서 사용되는 경우, 본 발명의 키메라 단백질은, 사이토카인 생산, 증식 또는 표적 사멸 가능성의 증가된 수준을 자극하는 것을 포함하지만 이에 제한되지 않는, T 세포 반응의 크기를 증가시키기 위해서 면역 저해와 비교할 때 면역 자극의 정도를 변경한다.
실시형태에서 본 발명의 키메라 단백질은 종양 세포의 표면 상의 저해 리간드를 차폐시키고, 면역 저해 리간드를 면역 자극 리간드로 대체하는 것을 포함하는 방법에서 사용 가능하거나 사용된다. 예를 들어, 본 발명의 키메라 단백질은 (a) CSF1R의 세포외 도메인 및 (b) CD40L의 세포외 도메인을 포함하며, 저해 CSF1/CSF1R 신호의 중단을 허용하고, 그것을 자극 CD40L/CD40 신호로 대체한다. 따라서, 본 발명의 키메라 단백질은 실시형태에서 저해 면역 신호를 감소 또는 제거하고/하거나 면역 자극 신호를 증가 또는 활성화시키는 것을 포함하는 방법에서 사용 가능하거나 사용된다. 예를 들어, 저해 신호를 포함하는(따라서 면역 반응이 회피된) 종양 세포는, 이후에 종양 세포를 공격할 수 있는 대식세포 또는 T 세포 상의 양성 신호 결합에 대해서 치환될 수 있다. 따라서, 실시형태에서, 저해 면역 신호는 본 발명의 작제물에 의해서 차폐되고, 자극 면역 신호가 활성화된다. 이러한 이로운 특성은 본 발명의 키메라 단백질의 단일 작제물 접근법에 의해서 향상된다. 예를 들어, 신호 대체는 거의 일제히, 예를 들어, 동시에 달성될 수 있고, 신호 대체는 임상적으로 중요한 부위(예를 들어, 종양 미세환경)에서 국지화되도록 적합하게 조정된다.
실시형태에서, 본 발명의 키메라 단백질은 면역 조정을 향상, 회복, 촉진 및/또는 자극하는 것을 포함하는 방법에서 사용 가능하거나 사용된다. 실시형태에서, 본 명세서에 기술된 본 발명의 키메라 단백질은 T 세포, 세포독성 T 림프구, T 헬퍼 세포, 자연 살해(NK) 세포, 자연 살해 T(NKT) 세포, 항종양 대식세포(예를 들어, M1 대식세포), B 세포 및 수지상 세포를 포함하지만 이들로 제한되지 않는 종양 세포에 대한 1종 이상의 면역 세포의 활성도 또는 활성화를 회복, 촉진 및/또는 자극한다. 실시형태에서, 본 발명의 키메라 단백질은 비제한적인 예의 방식으로 1종 이상의 T-세포 내인성 신호, 예컨대, 생존 촉진 신호(pro-survival signal); 자가 분비 또는 주변분비 성장 신호; p38 MAPK-, ERK-, STAT-, JAK-, AKT- 또는 PI3K-매개 신호; 항-사포사멸 신호; 및/또는 전염증성 사이토카인 생산 또는 T 세포 이동 또는 T 세포 종양 침윤 중 하나 이상을 촉진시키고/시키거나 이에 필수적인 신호를 포함하는, T 세포의 활성도 및/또는 활성화를 향상, 복귀, 촉진 및/또는 자극한다.
실시형태에서, 본 발명의 키메라 단백질은 종양 또는 종양 미세환경 내에서 T 세포(비제한적으로 세포독성 T 림프구, T 헬퍼 세포, 자연 살해 T(NKT) 세포를 포함함), B 세포, 자연 살해(NK) 세포, 자연 살해 T(NKT) 세포, 수지상 세포, 단핵구, 및 대식세포(예를 들어, M1 및 M2 하나 이상) 중 1종 이상의 증가를 유발하는 것을 포함하는 방법에서 사용 가능하거나 사용된다. 실시형태에서, 키메라 단백질은 종양 미세환경 내로 침윤된 CD8+ T 세포, 특히 이러한 T 세포에 의해서 종양 항원의 인식을 향상시킨다. 실시형태에서, 본 발명의 키메라 단백질은 CD19 발현을 유도하고/유도하거나 CD19 양성 세포(예를 들어, CD19 양성 B 세포)의 수를 증가시킨다. 실시형태에서, 본 발명의 키메라 단백질은 IL-15Rα 발현을 유도하고/유도하거나 IL-15Rα 양성 세포(예를 들어, IL-15Rα 양성 수지상 세포)의 수를 증가시킨다.
실시형태에서, 본 발명의 키메라 단백질은 특히, 종양 미세환경(TME) 내에서, 면역억제 세포(예를 들어, 골수-유래 억제인자 세포(MDSC), 조절 T 세포(Treg), 종양 연관된 호중구(TAN), M2 대식세포, 및 종양 연관 대식세포(TAM))를 억제하고/하거나 이의 감소를 유발하는 것을 포함하는 방법에서 사용 가능하거나 사용된다. 실시형태에서, 본 발명의 요법은 종양 부위 및/또는 TME에서 M1 대 M2 대식세포의 비를, M1 대식세포를 선호하도록 조정할 수 있다.
실시형태에서, 본 발명의 키메라 단백질은 유효량의 본 명세서에 기술된 키메라 단백질을 대상체에게 투여하는 단계를 포함하는, T 세포 불활성화 및/또는 종양에 대한 면역 관용을 저해 및/또는 감소시키는 것을 포함하는 방법에서 사용 가능하고, 사용될 수 있다. 실시형태에서, 본 발명의 키메라 단백질은 IFNγ, TNFα, IL-2, IL-4, IL-5, IL-6, IL-9, IL-10, IL-13, IL-17A, IL-17F 및 IL-22 중 1종 이상을 포함하지만 이들로 제한되지 않는 다양한 사이토카인의 혈청 수준을 증가시킬 수 있다. 실시형태에서, 본 발명의 키메라 단백질은 치료된 대상체의 혈청에서 IL-2, IL-4, IL-5, IL-10, IL-13, IL-17A, IL-22, TNFα 또는 IFNγ를 향상시킬 수 있다. 이러한 사이토카인 반응의 검출은 제시된 키메라 단백질에 대한 최적의 투여 요법을 결정하기 위한 방법을 제공할 수 있다.
실시형태에서, 본 발명의 키메라 단백질은 항종양 CD8+ 및/또는 CD4+ T 세포의 세포사를 저해, 차단 및/또는 감소시키거나; 또는 프로(pro)-종양 T 세포의 세포사를 자극, 유도 및/또는 증가시킨다. T 세포 고갈은 증식성 및 효과기 기능의 점진적인 손실을 특징으로 하는 T 세포 기능장애의 상태이며, 클론 결실로 이어진다. 따라서, 프로-종양 T 세포는 다수의 만성 감염, 염증성 질환 및 암 동안 발생하는 T 세포 기능장애의 상태를 지칭한다. 이러한 기능장애는 불량한 증식성 및/또는 효과기 기능, 저해 수용체의 지속되는 발현 및 기능성 효과기 또는 기억 T 세포의 것과 구별되는 전사 상태에 의해서 정의된다. 고갈은 감염 및 종양의 최적의 제어를 방해한다. 예시적인 프로-종양 T 세포는 Treg, 1종 이상의 면역관문 저해 수용체를 발현하는 CD4+ 및/또는 CD8+ T 세포, Th2 세포 및 Th17 세포를 포함하지만 이들로 제한되지 않는다. 면역관문 저해 수용체는 제어되지 않는 면역 반응을 방지 또는 저해하는 면역 세포 상에서 발현되는 수용체를 지칭한다. 이에 반해서, 항종양 CD8+ 및/또는 CD4+ T 세포는 종양에 대한 면역 반응을 시작하는 T 세포를 지칭한다.
실시형태에서, 본 발명의 키메라 단백질은 효과기 T 세포 대 조절 T 세포의 비를 증가시키는 것을 포함하는, 방법에서 사용 가능하고, 사용될 수 있다. 예시적인 효과기 T 세포는 ICOS+ 효과기 T 세포; 세포독성 T 세포(예를 들어, αβ TCR, CD3+, CD8+, CD45RO+); CD4+ 효과기 T 세포(예를 들어, αβ TCR, CD3+, CD4+, CCR7+, CD62L고, IL-7R/CD127+); CD8+ 효과기 T 세포(예를 들어, αβ TCR, CD3+, CD8+, CCR7+, CD62L고, IL-7R/CD127+); 효과기 기억 T 세포(예를 들어, CD62L저, CD44+, TCR, CD3+, IL-7R/CD127+, IL-15R+, CCR7저); 중심 기억 T 세포(예를 들어, CCR7+, CD62L+, CD27+; 또는 CCR7고, CD44+, CD62L고, TCR, CD3+, IL-7R/CD127+, IL-15R+); CD62L+ 효과기 T 세포; CD8+ 효과기 기억 T 세포(TEM), 예컨대, 초기 효과기 기억 T 세포(CD27+ CD62L-) 및 후기 효과기 기억 T 세포 (CD27- CD62L-)(각각 TemE 및 TemL); CD127(+)CD25(저/-) 효과기 T 세포; CD127(-)CD25(-) 효과기 T 세포; CD8+ 줄기세포 기억 효과기 세포(TSCM)(예를 들어, CD44(저)CD62L(고)CD122(고)sca(+)); TH1 효과기 T-세포(예를 들어, CXCR3+, CXCR6+ 및 CCR5+; 또는 αβ TCR, CD3+, CD4+, IL-12R+, IFNγR+, CXCR3+), TH2 효과기 T 세포(예를 들어, CCR3+, CCR4+ 및 CCR8+; 또는 αβ TCR, CD3+, CD4+, IL-4R+, IL-33R+, CCR4+, IL-17RB+, CRTH2+); TH9 효과기 T 세포(예를 들어, αβ TCR, CD3+, CD4+); TH17 효과기 T 세포(예를 들어, αβ TCR, CD3+, CD4+, IL-23R+, CCR6+, IL-1R+); CD4+CD45RO+CCR7+ 효과기 T 세포, CD4+CD45RO+CCR7(-) 효과기 T 세포; 및 IL-2, IL-4 및/또는 IFN-γ를 분비하는 효과기 T 세포를 포함한다. 예시적인 조절 T 세포는 ICOS+ 조절 T 세포, CD4+CD25+FOXP3+ 조절 T 세포, CD4+CD25+ 조절 T 세포, CD4+CD25- 조절 T 세포, CD4+CD25고 조절 T 세포, TIM-3+PD-1+ 조절 T 세포, 림프구 활성화 유전자-3(LAG-3)+ 조절 T 세포, CTLA-4/CD152+ 조절 T 세포, 뉴로필린-1(Nrp-1)+ 조절 T 세포, CCR4+CCR8+ 조절 T 세포, CD62L(L-셀렉틴)+ 조절 T 세포, CD45RB저 조절 T 세포, CD127저 조절 T 세포, LRRC32/GARP+ 조절 T 세포, CD39+ 조절 T 세포, GITR+ 조절 T 세포, LAP+ 조절 T 세포, 1B11+ 조절 T 세포, BTLA+ 조절 T 세포, 타입 1 조절 T 세포(Tr1 세포), T 헬퍼 타입 3(Th3) 세포, 자연 살해 T 세포 표현형의 조절 세포(NKTreg), CD8+ 조절 T 세포, CD8+CD28- 조절 T 세포 및/또는 IL-10, IL-35, TGF-β, TNF-α, 갈렉틴-1, IFN-γ 및/또는 MCP1을 분비하는 조절 T-세포를 포함한다.
실시형태에서, 본 발명의 키메라 단백질은 효과기 T 세포(예를 들어, CD4+CD25- T 세포)의 증가를 유발한다.
실시형태에서, 키메라 단백질은 조절 T 세포(예를 들어, CD4+CD25+ T 세포)의 감소를 유발한다.
실시형태에서, 키메라 단백질은 예를 들어, 재발을 예방할 수 있거나 동물을 재감염으로부터 보호할 수 있는 기억 반응을 생성시킨다. 따라서, 키메라 단백질로 처리된 동물은 키메라 단백질로의 초기 처리 후에 재감염되는 경우, 이후에 종양 세포를 공격할 수 있고/거나 종양의 발달을 예방할 수 있다. 따라서, 본 발명의 키메라 단백질은 활성 종양 파괴 및 또한 종양 항원의 면역 인식(이것은 재발을 예방할 수 있는 기억 반응을 프로그래밍하는 데 필수적임) 둘 모두를 자극한다.
실시형태에서, 본 발명의 키메라 단백질은 약 12시간, 약 24시간, 약 48시간, 약 72시간 또는 약 96시간 또는 약 1주 또는 약 2주 이하 동안 효과기 면역 세포를 일시적으로 자극하는 것을 포함하는, 방법에서 사용 가능하고, 사용될 수 있다. 실시형태에서, 본 발명의 키메라 단백질은 약 12시간, 약 24시간, 약 48시간, 약 72시간 또는 약 96시간 또는 약 1주 또는 약 2주 이하 동안 조절 또는 면역 억제 세포를 일시적으로 고갈시키거나 또는 저해하는 포함하는, 방법에서 사용 가능하고, 사용될 수 있다. 실시형태에서, 효과기 T 세포의 일시적인 자극 및/또는 면역 억제 세포의 일시적인 고갈 또는 저해는 환자의 혈류에서 또는 특정 조직/위치, 예컨대, 림프계 조직, 예를 들어, 골수, 림프절, 비장, 흉선, 점막-연관 림프계 조직(MALT), 비-림프계 조직 등에서 또는 종양 미세환경에서 실질적으로 일어난다.
실시형태에서, 본 발명의 키메라 단백질은 비제한적으로, 사용 용이성 및 생산 용이성을 포함하는 이점을 제공한다. 이는, 2종의 구별되는 면역치료제가 단일 제품 내에 조합되어, 이것이 2개의 독립적인 제조 공정 대신에 단일 제조 공정을 허용하기 때문이다. 또한, 2종의 개별 작용제 대신에 단일 작용제를 투여하는 것은 더 용이한 투여 및 더 높은 환자 순응도(patient compliance)를 가능하게 한다.
실시형태에서, 본 발명의 키메라 단백질은 분비성 및 완전 기능성 단일 폴리펩타이드 쇄로서 포유동물 숙주 세포에서 생산 가능하다.
실시형태에서, 본 발명의 키메라 단백질은 예상치 못하게, 느린 오프 레이트(Kd 또는 Koff)로 각각의 결합 파트너에 대한 세포외 도메인 성분의 결합을 제공한다. 실시형태에서, 이것은 리간드에 대한 수용체의 예기치 못한 긴 상호작용 및 그 역을 제공한다. 이러한 효과는 지속되는 음성 신호 차폐 효과를 가능하게 한다. 추가로, 실시형태에서, 이것은 예를 들어, 효과기 세포가 항종양 효과를 위해서 적절하게 자극되도록 하기 위해서, 더 긴 양성 신호 효과를 전달한다. 예를 들어, 본 발명의 키메라 단백질은, 예를 들어, 긴 오프 레이트 결합을 통해서, 면역 세포 증식을 제공하기 위한 충분한 신호 전달을 가능하게 하며, 항종양 공격을 가능하게 한다. 추가 예의 방식에 의해서, 본 발명의 키메라 단백질은, 예를 들어, 긴 오프 레이트 결합을 통해서, 자극 신호, 예를 들어, 사이토카인 등의 방출을 제공하기 위한 충분한 신호 전달을 가능하게 한다.
본 발명의 작용제(예를 들어, 음성 신호를 보유하는 종양 세포 및 종양을 공격할 수 있는 T 세포)에 의해서 촉진되는 세포의 안정적인 시냅스는, 종양 감소를 선호하는 공간적인 배향을 제공하며, 예컨대, 종양 세포를 공격하도록 T 세포를 배치하고/하거나 종양 세포가 본 발명의 키메라 단백질에 의해서 차폐되는 것을 초과하는 음성 신호를 비롯한, 음성 신호를 전달하는 것을 입체적으로 방지한다.
실시형태에서, 본 발명의 키메라 단백질은 약 2×106, 약 2.5×106, 약 3×106, 약 3.5×106, 약 4×106, 약 4.5×106, 약 5×106, 약 5.5×106, 약 6×106, 약 6.5×106, 약 7×106, 약 7.5×106, 약 8×106, 약 8.5×106, 약 9×106, 또는 약 9.5×106 초과(예를 들어, 표면 플라스몬 공명 또는 생물층 간섭계법에 의해서 측정되는 경우)의 인간 CSF1 또는 IL-34에 대한 Kd(1/s)를 나타낸다. 실시형태에서, 키메라 단백질은 약 100pM 내지 약 600pM의 KD로 인간 CSF1에 결합한다. 실시형태에서, 키메라 단백질은 약 5.7×104의 Ka 온 레이트(1/Ms)로 인간 CSF1에 결합하고, 약 7.3×10-6의 Kd 온 레이트(1/s)로 인간 CSF1에 탈결합한다.
실시형태에서, 본 발명의 키메라 단백질은 약 2×106, 약 2.5×106, 약 3×106, 약 3.5×106, 약 4×106, 약 4.5×106, 약 5×106, 약 5.5×106, 약 6×106, 약 6.5×106, 약 7×106, 약 7.5×106, 약 8×106, 약 8.5×106, 약 9×106, 또는 약 9.5×106 초과(예를 들어, 표면 플라스몬 공명 또는 생물층 간섭계법에 의해서 측정되는 경우)의 인간 CD40에 대한 Kd(1/s)를 나타낸다. 실시형태에서, 키메라 단백질은 약 1.3×104의 Ka 온 레이트(1/Ms)로 인간 CD40에 결합하고, 약 6.7×10-6의 Kd 온 레이트(1/s)로 인간 CD40에 탈결합한다.
실시형태에서, 이는 키메라 단백질의 혈청 반감기(t1/2)와 비교할 때 더 긴 온-타깃(예를 들어, 종양내) t1/2를 제공한다. 이러한 특성은 키메라 단백질의 전신 분포와 연관된 오프-타깃 독성을 감소시키는 조합된 이점을 가질 수 있다.
실제로, CSF1 차단 항체 및 CD40 효능제 항체로의 순차적인 처리는, 예를 들어, 간 독성을 유도한다고 보고되어 있다(예를 들어, 문헌[Byrne et al. J. Immunology, 2016] 참고). 본 명세서에 개시된 데이터(예를 들어, 도 13 참고)는, 마우스에 공동 투여되는 경우 두 항체는 매우 독성이고, 치명적 장 염증 및 설사를 유발한다는 것을 유사하게 나타낸다. 이에 반해서 그리고 놀랍게도, CSF1R-Fc-CD40L 키메라 단백질로의 처리는, 항체 공동 처리로부터 유발되는 독성 없이, CSF1R(이것은 면역 저해 신호의 전송을 저해함)을 차단하고, CD40(이것은 면역 자극 신호의 전송을 향상, 증가 및/또는 자극함)를 활성화시킨다. 추가로, 실시형태에서, 본 발명의 키메라 단백질은 상승작용적 치료 효과(예를 들어, 항종양 효과)를 제공하는데, 그 이유는 그것이 2종의 면역치료제의 개선된 부위 특이적 상호작용을 가능하게 하기 때문이다. 실시형태에서, 본 발명의 키메라 단백질은 CD40 효능제 항체 및/또는 CSF1R 길항작용 항체와 비교할 때 상승작용적 치료 효과를 제공한다. 실시형태에서, 본 발명의 키메라 단백질은 오프-사이트 및/또는 전신 독성 감소의 가능성을 제공한다.
실시형태에서, 본 발명의 키메라 단백질은 향상된 안전성 프로파일을 나타낸다. 실시형태에서, 본 발명의 키메라 단백질은 감소된 독성 프로파일을 나타낸다. 예를 들어, 본 발명의 키메라 단백질의 투여는 CD40 효능제 항체 및/또는 CD115 길항작용 항체의 투여에서 관찰되는 부작용, 예컨대, 설사, (예를 들어, 장의) 염증, 또는 체중 감소 중 하나 이상의 감소를 유발할 수 있다. 실시형태에서, 본 발명의 키메라 단백질은, 효능을 희생시키지 않으면서, CD40 효능제 항체 및/또는 CD115 길항작용 항체와 비교할 때, 개선된 안전성을 제공한다.
실시형태에서, 본 발명의 키메라 단백질은 현재 면역요법, 예를 들어, 본 명세서에 기술된 바와 같은 면역관문 분자에 지향되는 항체에 비해서, 감소된 부작용, 예를 들어, GI 합병증을 제공한다. 예시적인 GI 합병증은 복통, 식욕 부진, 자가면역 효과, 변비, 경련, 탈수, 설사, 섭취 문제, 피로, 헛배, 복부의 유체 또는 복수, 위장(GI) 세균 불균형, GI 점막염, 염증성 장 질환, 과민성 장 증후군(IBS-D 및 IBS-C), 구역, 통증, 대변 및 소변 변화, 궤양성 장염, 구토, 체액 유지로부터의 체중 증가 및/또는 쇠약을 포함한다.
질환, 치료 방법 및 환자 선택
실시형태에서, 본 발명은 암 및/또는 종양; 예를 들어, 암 및/또는 종양의 치료 또는 예방에 관한 것이다. 본 명세서 다른 곳에 기술된 바와 같이, 암의 치료는 실시형태에서, 면역 저해보다 면역 자극을 선호하도록 면역계를 본 발명의 키메라 단백질로 조정하는 것을 포함할 수 있다.
암 또는 종양은 신체 기관 및 시스템의 정상 기능을 방해하는 세포의 제어되지 않는 성장 및/또는 비정상적으로 증가된 세포 생존력 및/또는 세포자멸의 저해를 지칭한다. 양성 암 및 악성 암, 폴립, 이상증식뿐만 아니라 휴지기 종양 또는 소전이(micrometastas)가 포함된다. 또한, 면역계에 의해서 저지되지 않은 비정상적인 증식을 갖는 세포(예를 들어, 바이러스 감염된 세포)가 포함된다. 암은 원발성 암 또는 전이성 암일 수 있다. 원발성 암은 임상적으로 검출 가능한 본래 부위에서의 암 세포의 면적일 수 있고, 원발성 종양일 수 있다. 이에 반해서, 전이성 암은 하나의 기관 또는 부위로부터 또 다른 비인접한 기관 또는 부위로의 질환의 확산일 수 있다. 전이성 암은 국지 영역에서 정상 조직 주변을 관통 및 침윤하여, 국소 전이성일 수 있는 새로운 종양을 형성하는 능력을 획득한 암 세포에 의해서 유발될 수 있다. 암은 또한 림프관 및/또는 혈관의 벽을 관통하는 능력을 획득한 암 세포에 의해서 유발될 수 있는데, 그 후 암 세포는 혈류를 통해서 신체의 다른 부위 및 조직으로 순환할 수 있다(이로 인해서 순환 종양 세포임). 암은 림프성 또는 혈행성 확산과 같은 과정으로 인한 것일 수 있다. 암은 또한 또 다른 부위에서 멈춰서, 혈관 또는 벽을 통해서 재침투하고, 증식을 계속하고, 결국 또 다른 임상적으로 검출 가능한 종양을 형성하는 종양 세포에 의해서 유발될 수 있다. 암은 이러한 새로운 종양일 수 있고, 이것은 전이성(또는 2차) 종양일 수 있다.
암은 전이된 종양 세포에 의해서 유발될 수 있고, 이것은 2차 또는 전이성 종양일 수 있다. 종양의 세포는 본래 종양에서의 것과 유사할 수 있다. 예로서, 유방암 또는 결장암이 간으로 전이되면, 2차 종양은, 간에 존재하면서, 비정상적인 간세포가 아닌 비정상적인 유방 또는 결장 세포로 구성된다. 따라서 간에서의 종양은 간암이 아닌 전이성 유방암 또는 전이성 결장암일 수 있다.
암은 임의의 조직으로부터의 기원을 가질 수 있다. 암은 각각 흑색종, 결장, 유방 또는 전립선으로부터 기원할 수 있고, 따라서 각각 본래 피부, 결장, 유방 또는 전립선에 존재하는 세포로 구성될 수 있다. 암은 또한 혈액 악성종양일 수 있고, 이것은 백혈병 또는 림프종일 수 있다. 암은 조직, 예컨대, 간, 폐, 방광 또는 장을 침범할 수 있다.
본 발명의 대표적인 암 및/또는 종양은 기저 세포 암종, 담관암; 방광암; 골암; 뇌 및 중추 신경계암; 유방암; 복막암; 자궁경부암; 융모암; 결장 및 직장암; 결합조직암; 소화기계암; 자궁내막암; 식도암; 안암; 두경부암; 위암(위장암 포함); 교모세포종; 간 암종; 간세포암; 상피내 신생물; 신장 또는 콩팥암; 후두암; 백혈병; 간암; 폐암(예를 들어, 소세포 폐암, 비소세포 폐암, 폐의 선종, 폐의 편평 암종); 흑색종; 골수종; 신경 모세포종; 구강암(입술, 혀, 입 및 인두); 난소암; 췌장암; 전립선암; 망막 모세포종; 횡문근육종; 직장암; 호흡기의 암; 타액선 암종; 육종; 피부암; 편평 세포암; 위암; 고환암; 갑상선암; 자궁 또는 자궁 내막암; 비뇨기계의 암; 외음부암; 림프종, 예컨대, 호지킨 림프종 및 비호지킨 림프종, 뿐만 아니라 B-세포 림프종(예컨대, 저등급/소포성 비호지킨 림프종(NHL); 소 림프성(SL) NHL; 중간 등급/소포성 NHL; 중간 등급 미만성 NHL; 고등급 면역모세포성 NHL; 고등급 림프구성 NHL; 고등급 소 비절단 세포 NHL; 벌키(bulky) 질환 NHL; 맨틀 세포 림프종; AIDS-관련 림프종; 및 발덴스트롬 마크로글로불린혈증(Waldenstrom's Macroglobulinemia); 만성 림프구성 백혈병(CLL); 급성 림프구성 백혈병(ALL); 털세포 백혈병; 만성 모구성 백혈병; 뿐만 아니라 다른 암종 및 육종; 및 이식 후 림프증식성 장애(PTLD), 뿐만 아니라 모반증, 부종과 연관된 비정상적인 혈관 증식(예컨대, 뇌종양과 연관된 것), 및 메이그스 증후군(Meigs' syndrome)을 포함하지만 이들로 제한되지 않는다.
실시형태에서, 키메라 단백질은 치료-난치성 암을 갖는 대상체를 치료하는 데 사용된다. 실시형태에서, 키메라 단백질은 1종 이상의 면역-조정제에 난치성인 대상체를 치료하는 데 사용된다. 예를 들어, 실시형태에서, 키메라 단백질은 12주 정도의 치료 후에, 치료에 반응을 나타내지 않거나 심지어는 진행된 대상체를 치료하는 데 사용된다. 예를 들어, 실시형태에서, 대상체는 예를 들어, 니볼루맙(nivolumab)(ONO-4538/BMS-936558, MDX1106, OPDIVO, BRISTOL MYERS SQUIBB), 펨브롤리주맙(pembrolizumab)(KEYTRUDA, MERCK), 피딜리주맙(pidilizumab)(CT-011, CURE TECH), MK-3475(MERCK), BMS 936559(BRISTOL MYERS SQUIBB), 이브루티닙(Ibrutinib)(PHARMACYCLICS/ABBVIE), 아테졸리주맙(TECENTRIQ, GENENTECH), 및/또는 MPDL328OA(ROCHE)-난치성 환자를 비롯하여, PD-1 및/또는 PD-L1 및/또는 PD-L2 작용제에 난치성이다. 예를 들어, 실시형태에서, 대상체는 항-CTLA-4 작용제에 대해서 난치성이고, 예를 들어, 이필리무맙(ipilimumab)(YERVOY)-난치성 환자(예를 들어, 흑색종 환자)이다. 따라서, 실시형태에서 본 발명은 1종 이상의 면역-조정제의 단일요법을 비롯하여, 다양한 요법에 비반응성인 환자를 구제하는 암 치료 방법을 제공한다.
실시형태에서, 본 발명의 방법은 추가 작용제에 난치성인 환자를 키메라 단백질로 치료하는 방법을 제공하며, 이러한 "추가 작용제"는 본 명세서 다른 곳에 기술되어 있고, 비제한적으로 본 명세서에 기술된 다양한 화학치료제를 비제한적으로 포함한다.
실시형태에서, 키메라 단백질은 1종 이상의 염증성 질환 또는 병태를 치료, 제어 또는 예방하는 데 사용된다. 염증성 질환의 비제한적인 예는, 여드름, 급성 염증, 알레르기성 비염, 천식 죽상 동맥경화증, 아토피성 피부염, 자가면역 질환, 자가염증성 질환, 상염색체 열성 경련성 운동 실조증, 기관지 확장증, 셀리악병, 만성 담낭염, 만성 염증, 만성 전립선염, 장염, 게실염, 가족성 호산구증가증(fe), 사구체신염, 글리세롤 키나제 결핍, 한선염, 땀샘염, 과민증, 염증, 염증성 장 질환, 염증성 골반 질환, 간질성 방광염, 후두 염증성 질환, 레이 증후군(Leigh syndrome), 편평태선, 비만 세포 활성화 증후군, 비만세포증, 안구 염증성 질환, 이염, 통증, 골반 염증성 질환, 허혈재관류 손상, 호흡기 질환, 재협착증, 류마티스열, 류마티스 관절염, 비염, 사르코이드증, 패혈증성 쇼크, 규폐증 및 기타 진폐증, 이식 거부, 결핵 및 혈관염을 포함한다.
실시형태에서, 염증성 질환은 자가면역 질환 또는 병태, 예컨대, 다발성 경화증, 진성 당뇨병, 루푸스, 셀리악병, 크론병, 궤양성 장염, 길랑-바레 증후군(Guillain-Barre syndrome), 경피증, 굿파스쳐 증후군(Goodpasture's syndrome), 베게너 육아종증, 자가면역 간질, 라스무슨 뇌염(Rasmussen's encephalitis), 원발성 담즙 경화증, 경화성 담관염, 자가면역 간염, 애디슨병, 하시모토 갑상선염, 섬유근육종, 메니에르 증후군(Menier's syndrome); 이식 거부(예를 들어, 동종이식편 거부의 예방), 악성 빈혈, 류마티스 관절염, 전신 홍반성 루푸스, 피부근염, 쇼그렌 증후군, 홍반성 루푸스, 다발성 경화증, 중증 근무력증, 라이터 증후군(Reiter's syndrome), 그레이브병 및 다른 자가면역 질환이다.
일 양상에서, 본 발명의 키메라 작용제는 예를 들어, CD40L의 세포외 도메인을 통해서 항원 제시 세포를 활성화시키는 방법에서 사용된다.
양상에서, 본 발명의 키메라 작용제는 CSF1R의 세포외 도메인을 통해서 면역억제 신호의 세포 전달을 예방하는 방법에서 사용된다.
병용 치료 및 접합
실시형태에서, 본 발명은 키메라 단백질, 및 대상체에게 추가 작용제를 투여하는 단계를 추가로 포함하는 방법을 제공한다. 실시형태에서, 본 발명은 공동 투여(co-administration) 및/또는 공동 제형(co-formulation)에 관한 것이다. 본 명세서에 기술된 임의의 조성물은 공동 제형화 및/또는 공동 투여될 수 있다.
실시형태에서, 본 명세서에 기재된 임의의 키메라 단백질은 또 다른 작용제와 공동 투여될 때 상승작용적으로 작용하며, 이러한 작용제가 단일요법으로서 사용될 때 흔히 사용되는 용량보다 더 낮은 용량으로 투여된다. 실시형태에서, 본 명세서에 언급된 임의의 작용제는 본 명세서에 기술된 임의의 키메라 단백질과 조합하여 사용될 수 있다.
실시형태에서, 본 명세서에 기술된 바와 같은 CSF1R의 세포외 도메인을 포함하는 본 발명의 키메라 단백질은 또 다른 키메라 단백질과 공동 투여된다. 실시형태에서, 본 명세서에 기술된 바와 같은 CSF1R의 세포외 도메인을 포함하는 본 발명의 키메라 단백질은 또 다른 키메라 단백질, 적응 면역 반응을 조정하는 것과 공동 투여된다. 실시형태에서, 본 명세서에 기술된 바와 같은 CSF1R의 세포외 도메인을 포함하는 본 발명의 키메라 단백질은 OX40L, PD-1, GITRL, 4-1BBL, SIRPα, TIM3, TIGIT, LIGHT 및 VSIG8 중 1종 이상을 포함하는 키메라 단백질과 공동 투여된다. 이론에 얽매이고자 함은 아니지만, 선천적인 면역 반응을 유도하는 본 발명의 키메라 단백질 및 적응 면역 반응을 유도하는 1종 이상의 키메라 단백질의 투여를 포함하는 병용 요법은 상승작용적 효과(예를 들어, 상승작용적 항종양 효과)를 제공할 수 있다고 여겨진다.
적응 면역 반응을 유도하는 임의의 키메라 단백질이 본 발명에서 사용될 수 있다. 예를 들어, 키메라 단백질은 적응 면역 반응을 유도하는 미국 특허 출원 제U.S. 62/464,002호에 개시된 키메라 단백질 중 임의의 것일 수 있다. 이러한 실시형태에서, 키메라 단백질은 N-말단에서 또는 그 근처에서 타입 I 막관통 단백질의 제1 세포외 도메인 및 C-말단에서 또는 그 근처에서 타입 II 막관통 단백질의 제2 세포외 도메인을 포함하고, 여기서 전문이 참고로 포함된 미국 특허 출원 제U.S. 62/464,002호에 개시된 바와 같이, 제1 세포외 도메인 및 제2 세포외 도메인 중 하나는 면역 저해 신호를 제공하고, 제1 세포외 도메인 및 제2 세포외 도메인 중 하나는 면역 자극 신호를 제공한다. 예시적인 실시형태에서, 적응 면역 반응을 유도하는 키메라 단백질은 N-말단에서 PD-1의 세포외 도메인, 및 C-말단에서 OX40L, GITR 또는 4-1BBL의 세포외 도메인을 포함하는 키메라 단백질이다. 실시형태에서, 적응 면역 반응을 유도하는 키메라 단백질은 N-말단에서 VSIG8의 세포외 도메인, 및 C-말단에서 OX40L, GITR 또는 4-1BBL의 세포외 도메인을 포함하는 키메라 단백질이다.
실시형태에서, 본 명세서에 기술된 바와 같은 CSF1R의 세포외 도메인을 포함하는 본 발명의 키메라 단백질은, 선천적인 면역 반응을 자극하기 위해서 환자에게 투여되고, 그 다음 (예를 들어, 1일 후, 또는 2일 후, 또는 3일 후, 또는 4일 후, 또는 5일 후, 또는 6일 후, 또는 1주 후, 또는 2주 후, 또는 3주 후, 또는 4주 후) 적응 면역 반응을 유도하는 키메라 단백질이 투여된다.
실시형태에서, 비제한적으로, 암 분야를 포함하여, 본 발명은 추가 작용제로서의 화학치료제에 관한 것이다. 화학치료제의 예는 알킬화제, 예컨대, 티오테파 및 CYTOXAN 사이클로스포스파마이드; 알킬 설포네이트, 예컨대, 부설판, 임프로설판 및 피포설판; 아지리딘, 예컨대, 벤조도파, 카보쿠온, 메투레도파 및 우레도파; 에틸렌이민 및 메틸아멜라민, 예컨대, 알트레타민, 트라이에틸렌멜라민, 트라이에틸렌포스포르아마이드, 트라이에틸렌티오포스포르아마이드 및 트라이메틸올로멜라민; 아세토게닌(예를 들어, 불라타신 및 불라타시논); 캄프토테신(합성 유사체 토포테칸 포함); 브리오스타틴; 칼리 스타틴; CC-1065(이의 아도젤레신, 카르젤레신 및 비젤레신 합성 유사체 포함); 크립토피신(예를 들어, 크립토피신 1 및 크립토피신 8); 돌라스타틴; 두오카르마이신(합성 유사체, KW-2189 및 CB 1-TM1 포함); 엘루에테로빈; 판크라티스타틴; 사르코딕틴; 스폰기스타틴; 질소 머스타드, 예컨대, 클로람부실, 클로르나파진, 클로로포스파마이드, 에스트라무스틴, 이포스파마이드, 멜클로레타민, 멜클로레타민 옥사이드 하이드로클로라이드, 멜팔란, 노벰비신, 페네스테린, 프레드니무스틴, 트로포스파마이드, 유라실 머스타드; 나이트로소우레아, 예컨대, 카르무스틴, 클로로조토신, 포테무스틴, 로무스틴, 니무스틴 및 라니무스틴; 항생제, 예컨대, 엔디인 항생제(예를 들어, 칼리키아미신, 특히 칼리키아미신 감말 및 칼리키아미신 오메갈(예를 들어, 문헌[Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)] 참고); 다이네미산, 예컨대, 다이네미산 A; 비스포스포네이트, 예컨대, 클로드로네이트; 에스페라미신; 뿐만 아니라 네오카르지노스타틴 발색단 및 관련 색소단백질 엔다인 항생제 발색단), 아클라시노마이신, 악티노마이신, 아우쓰라마이신, 아자세린, 블레오마이신, 칵티노마이신, 카라비신, 카미노마이신, 카르지노필린, 크로모마이신, 닥티노마이신, 다우노루비신, 데토루비신, 6-다이아조-5-옥소-L-노르류신, ADRIAMYCIN 독소루비신(모폴리노-독소루비신, 사이아노모폴리노-독소루비신, 2-피롤리노-독소루비신 및 데옥시 독소루비신 포함), 에피루비신, 에소루비신, 이다루비신, 마르셀로마이신, 미토마이신, 예컨대, 미토마이신 C, 마이코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포트피로마이신, 퓨로마이신, 쿠엘라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 투베르시딘, 우베니멕스, 지노스타틴, 조루비신; 항대사물질, 예컨대, 메토트렉세이트 및 5-플루오로유라실(5-FU); 엽산 유사체, 예컨대, 데노프테린, 메토트렉세이트, 프테로프테린, 트라이메트렉세이트; 퓨린 유사체, 예컨대, 플루다라빈, 6-머캅토퓨린, 티아미프린, 티오구아닌; 피리미딘 유사체, 예컨대, 안시타빈, 아자시티딘, 6-아자우리딘, 카모푸르, 사이타라빈, 다이데옥시우리딘, 독시플루리딘, 에노시타빈, 플록스우리딘; 안드로겐, 예컨대, 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스타놀, 메피티오스탄, 테스토스테론; 항아드레날린, 예컨대, 미노글루테티미드, 미토탄, 트리로스탄; 엽산 보충제, 예컨대, 프롤린산; 에세글라톤; 알도포스파마이드 글라이코사이드; 아미노레불린산; 에닐루라실; 암사크린; 베스트라부실; 비산트렌; 에다트락세이트; 데메콜신; 다이아지쿠온; 엘포르미틴; 엘리프티늄 아세테이트; 에포틸론; 에토글루시드; 질산갈륨; 하이드록시우레아; 렌티난; 로니다이닌; 메이탄시노이드, 예컨대, 메이탄신 및 안사미토신; 미토구아존; 미톡산트론; 모피단몰; 니트라에린; 펜토스타틴; 페나메트; 피라루비신; 로속산트론; 포도필린산; 2-에틸하이드라자이드; 프로카바진; PSK 폴리사카라이드 복합체(제이에이치에스 내추럴 프로덕츠(JHS Natural Products)(미국 오리건주 유진 소재)); 라족산; 리족신; 시조푸란; 스피로게르마늄; 테누아존산; 트리아지쿠온; 2,2',2"-트라이클로로트라이에틸아민; 트리코테센(예를 들어, T-2 독소, 베라쿠린 A, 로리딘 A 및 안구이딘); 우레탄; 빈데신; 다카바진; 만노무스틴; 미토브로니톨; 미톨락톨; 피포브로만; 가사이토신; 아라비노사이드("Ara-C"); 사이클로포스파마이드; 티오테파; 탁소이드, 예를 들어, TAXOL 파클리탁셀(브리스톨-마이어스 스큅 온콜로지(Bristol-Myers Squibb Oncology)(뉴저지주 프린스턴), 파클리탁셀의 ABRAXANE Cremophor 미함유, 알부민 조작된 나노입자 제제(아메리칸 파마슈티컬 파트너스(American Pharmaceutical Partners), 샤움베르크 111 소재)), 및 TAXOTERE 독세타셀(롱-프랑 로라(Rhone-Poulenc Rorer)(프랑스 안토니 소재)); 클로르암부실; GEMZAR 젬시타빈; 6-티오구아닌; 머캅토퓨린; 메토트렉세이트; 백금 유사체, 예컨대, 시스플라틴, 옥살리플라틴 및 카보플라틴; 빈블라스틴; 백금; 에토포사이드(VP-16); 이포스파마이드; 미톡산트론; 빈크리스틴; NAVELBINE. 비노렐빈; 노반트론; 테니포사이드; 에다트렉세이트; 다우노마이신; 아미노프테린; 젤로다; 이반드로네이트; 이리노테칸(Camptosar, CPT-11)(5-FU 및 류코보린에 의한 이리노테칸의 치료 요법 포함); 토포아이소머라제 저해제 RFS 2000; 다이플루오로메틸오르니틴(DMFO); 레티노이드, 예컨대, 레티노산; 카페시타빈; 콤브레타스타틴; 류코보린(LV); 옥살리플라틴 치료 섭생(FOLFOX)을 포함하는 옥살리플라틴; 라파티닙(TYKERB); 세포 증식을 감소시키는 PKC-α, Raf, H-Ras, EGFR(예를 들어, 에를로티닙(Tarceva)) 및 VEGF-A의 저해제, 및 상기 중 임의의 것의 약제학적으로 허용 가능한 염, 산 또는 유도체를 포함하지만 이들로 제한되지 않는다. 또한, 치료 방법은 방사선의 사용을 추가로 포함할 수 있다. 또한, 치료 방법은 광역학 요법의 사용을 추가로 포함할 수 있다.
실시형태에서, 제한 없이, 암 분야를 포함하여, 본 발명의 추가 작용제는 PD-1 및 PD-L1 또는 PD-L2 및/또는 PD-1과 PD-L1 또는 PD-L2의 결합을 차단하고/하거나, 감소시키고/시키거나, 저해하는 작용제(비제한적인 예로서, 니볼루맙(ONO-4538/BMS-936558, MDX1106, OPDIVO, BRISTOL MYERS SQUIBB), 펨브롤리주맙(KEYTRUDA, Merck), 피딜리주맙(CT-011, CURE TECH)), MK-3475(MERCK), BMS 936559(BRISTOL MYERS SQUIBB), 아테졸리주맙(TECENTRIQ, GENENTECH), MPDL328OA(ROCHE) 중 하나 이상), CD137(4-1BB) 및/또는 CD137(4-1BB)과 4-1BB 리간드 중 하나 이상의 결합을 증가시키고/시키거나 자극하는 작용제(비제한적인 예로서, 우렐루맙(BMS-663513 및 항-4-1BB 항체), 및 CTLA-4의 활성도 및/또는 CTLA-4와 AP2M1, CD80, CD86, SHP-2 및 PPP2R5A 중 하나 이상의 결합 및/또는 OX40과 OX40L의 결합을 차단하고/하거나, 감소시키고/시키거나, 저해하는 작용제(비제한적인 예로서 GBR 830(GLENMARK), MEDI6469(MEDIMMUNE))로부터 선택된 하나 이상의 면역조절제이다.
실시형태에서, 비제한적으로, 감염성 질환 분야를 포함하여, 본 발명은 추가 작용제로서 항감염제에 관한 것이다. 실시형태에서, 항감염제는 항바이러스제, 예컨대, 아바카버, 아시클로버, 아데포버, 암프레나버, 아타자나버, 시도포버, 다루나버, 델라비르딘, 디다노신, 도코사놀, 에파비렌즈, 엘비테그라버, 엠트리시타빈, 엔푸비르티드, 에트라비린, 팜시클로버 및 포스카르네트를 포함하지만 이들로 제한되지 않는 항바이러스제이다. 실시형태에서, 항감염제는 항박테리아제, 예컨대, 세팔로스포린 항생제(세팔렉신, 세푸록심, 세파드록실, 세파졸린, 세팔로틴, 세파클러, 세파만돌, 세폭시틴, 세프프로질 및 세프토비프롤); 플루오로퀴놀론 항생제(시프로, 레바퀸, 플록신, 테퀸, 아벨록스 및 노르플록스); 테트라사이클린 항생제(테트라사이클린, 미노사이클린, 옥시테트라사이클린 및 독시사이클린); 페니실린 항생제(아목시실린, 암피실린, 페니실린 V, 다이클록사실린, 카르베니실린 반코마이신 및 메티실린); 모노박탐 항생제(아즈트레오남); 및 카바페넴 항생제(에르타페넴, 도리페넴, 이미페넴/실라스타틴 및 메로페넴)을 포함하지만 이들로 제한되지 않는 항박테리아제이다. 실시형태에서, 항감염제는 항말라리아제(예를 들어, 클로로퀸, 퀴닌, 메플로퀸, 프리마퀸, 독시사이클린, 아르테메터/루메판트린, 아토바쿠온/프로쿠아닐 및 설파독신/피리메타민), 메트로니다졸, 티니다졸, 이베르멕틴, 피란텔 파모에이트 및 알벤다졸을 포함한다.
실시형태에서, 비제한적으로, 자가면역 분야를 포함하여, 추가 작용제는 면역억제제이다. 실시형태에서, 면역억제제는 소염제, 예컨대, 스테로이드성 소염제 또는 비스테로이드성 소염제(NSAID)이다. 스테로이드, 특히 부신 코티코스테로이드 및 이의 합성 유사체는 관련 기술 분야에 널리 공지되어 있다. 본 발명에 유용한 코티코스테로이드의 예는, 하이드록실트라이암시놀론, 알파-메틸 덱사메타손, 베타-메틸 베타메타손, 베크로메타손 다이프로피오네이트, 베타메타손 벤조에이트, 베타메타손 다이프로피오네이트, 베타메타손 발러레이트, 클로베타솔 발러레이트, 데소나이드, 데스옥시메타손, 덱사메타손, 다이플로라손 다이아세테이트, 다이플루코르톨론 발러레이트, 플루아드레놀론, 플루클로롤론 아세토나이드, 플루메타손 피발레이트, 플루오시놀론 아세토나이드, 플루오시노나이드, 플루코르틴 뷰틸에스터, 플루오코르톨론, 플루프레드니덴(플루프레드닐리덴) 아세테이트, 플루란드레놀론, 할시노나이드, 하이드로코르티손 아세테이트, 하이드로코르티손 부티레이트, 메틸프레드니솔론, 트라이암시놀론 아세토나이드, 코르티손, 코르토독손, 플루세토니드, 플루드로코르티손, 다이플루오로손 다이아세테이트, 플루라드레놀론 아세토나이드, 메드리손, 암시나펠, 암시나피드, 베타메타손 및 이의 에스터의 밸런스, 클로로프레드니손, 클로코르텔론, 클레스시놀론, 다이클로리손, 다이플루프레드네이트, 플루클로로나이드, 플루니솔리드, 플루오로메탈론, 플루페롤론, 플루프레드니솔론, 하이드로코르티손, 메프레드니손, 파라메타손, 프레드니솔론, 프레드니손, 베크로메타손 다이프로피오네이트를 포함하지만 이들로 제한되지 않는다. 본 발명에서 사용될 수 있는 (NSAIDS)는 살리실산, 아세틸 살리실산, 메틸 살리실레이트, 글라이콜 살리실레이트, 살리실마이드, 벤질-2,5-다이아세톡시벤조산, 이부프로펜, 풀린닥, 나프록센, 케토프로펜, 에토페나메이트, 페닐부타존 및 인도메타신을 포함하지만, 이들로 제한되지 않는다. 실시형태에서, 면역억제제는 정균제, 예컨대, 알킬화제, 항대사물질(예를 들어, 아자티오프린, 메토트렉세이트), 세포독성 항생제, 항체(예를 들어, 바실릭시맙, 다클리주맙 및 무로모납), 항이뮤노필린(예를 들어, 사이클로스포린, 타크롤리무스, 시롤리무스), 인터페론, 오피오이드, TNF 결합 단백질, 마이코페놀레이트 및 작은 생물제(예를 들어, 핑골리모드, 미리오신)일 수 있다.
실시형태에서, 본 명세서에 기술된 키메라 단백질(및/또는 추가 작용제)은 즉, 공유 부착이 조성물의 활성을 방해하지 않도록 조성물에 대한 분자의 임의의 유형의 공유 부착에 의해 변형된 유도체를 포함한다. 제한의 방식이 아니라, 예를 들어, 유도체는 특히 글리코실화, 지질화, 아세틸화, 페길화, 인산화, 아미드화, 공지된 보호/차단기에 의한 유도체화, 단백질분해 절단, 세포 리간드 또는 다른 단백질에 대한 연결 등에 의해 변형된 조성물을 포함한다. 임의의 다수의 화학 변형은 특이적 화학 절단, 아세틸화, 폼일화, 투리카마이신의 대사 합성 등을 포함하지만 이들로 제한되지 않는 공지된 기술에 의해 수행될 수 있다. 추가로, 유도체는 하나 이상의 비전통적 아미노산을 함유할 수 있다. 추가의 실시형태에서, 본 명세서에 기술된 키메라 단백질(및/또는 추가 작용제)은, 예시적인 실시형태에서, 독소, 화학치료제, 방사선동위원소, 및 세포자멸 또는 세포사를 야기하는 작용제를 포함하는 세포독성제를 추가로 포함한다. 이러한 작용제는 본 명세서에 기술된 조성물에 접합될 수 있다.
본 명세서에 기술된 키메라 단백질(및/또는 추가 작용제)은 따라서 효과기 모이어티, 예컨대, 화학 링커, 검출 가능한 모이어티, 예를 들어, 형광성 염료, 효소, 기질, 생물발광 물질, 방사능 물질, 및 화학발광 모이어티, 또는 기능성 모이어티, 예를 들어, 스트렙타비딘, 아비딘, 바이오틴, 세포독소, 세포독성제, 및 방사능 물질 등을 첨가하도록 번역후 변형될 수 있다.
제형
본 명세서에 기술된 키메라 단백질(및/또는 추가 작용제)은 약제학적으로 허용 가능한 염을 형성하기 위해서 무기산 또는 유기산과 반응할 수 있는 충분히 염기성인 작용기, 또는 무기 또는 유기 염기와 반응할 수 있는 카복실기를 보유할 수 있다. 약제학적으로 허용 가능한 산 부가염은 관련 기술 분야에 공지된 바와 같이, 약제학적으로 허용 가능한 산으로부터 형성된다. 이러한 염은 예를 들어, 전문이 참고로 포함된 문헌[Journal of Pharmaceutical Science, 66, 2-19 (1977) 및 The Handbook of Pharmaceutical Salts; Properties, Selection, and Use. P. H. Stahl and C. G. Wermuth (eds.), Verlag, Zurich (Switzerland) 2002]에 기술된 약제학적으로 허용 가능한 염을 포함한다.
실시형태에서, 본 명세서에 기술된 조성물은 약제학적으로 허용 가능한 염의 형태이다.
추가로, 본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)은 약제학적으로 허용 가능한 담체 또는 비히클을 포함하는 조성물의 성분으로서 대상체에게 투여될 수 있다. 이러한 조성물은 적절한 투여를 위한 형태를 제공하도록 적합한 양의 약제학적으로 허용 가능한 부형제를 선택적으로 포함할 수 있다. 약제학적 부형제는 액체, 예컨대, 물 및 오일, 예컨대, 석유, 동물, 식물 또는 합성 기원의 것, 예컨대, 땅콩유, 대두유, 광유, 참깨유 등일 수 있다. 약제학적 부형제는 예를 들어, 식염수, 아카시아검, 젤라틴, 전분 페이스트, 활석, 케라틴, 콜로이드성 실리카, 우레아 등일 수 있다. 또한, 보조제, 안정화제, 증점제, 활택제 및 착색제를 사용할 수 있다. 일 실시형태에서, 약제학적으로 허용 가능한 부형제는 대상체에게 투여될 때 멸균성이다. 물은 본 명세서에 기술된 임의의 작용제가 정맥내로 투여될 때 유용한 부형제이다. 식염수 용액 및 수성 덱스트로스 및 글리세롤 용액은 구체적으로 주사용 용액을 위한 액체 부형제로서 또한 사용될 수 있다. 적합한 약제학적 부형제는 또한 전분, 글루코스, 락토스, 수크로스, 젤라틴, 맥아, 쌀, 밀가루, 백악, 실리카젤, 스테아르산나트륨, 글리세롤 모노스테아레이트, 활석, 염화나트륨, 탈지분유, 글리세롤, 프로필렌, 글리콜, 물, 에탄올 등을 포함한다. 본 명세서에 기술된 임의의 작용제는, 바람직한 경우, 또한 소량의 습윤 또는 유화제, 또는 pH 완충제를 포함할 수 있다.
실시형태에서, 본 명세서에 기술된 조성물은 식염수 완충제(비제한적으로 TBS, PBS 등 포함) 중에 현탁된다.
실시형태에서, 키메라 단백질은 반감기를 연장하거나 또는 약물학적 및 약동학적 특성을 달리 개선시키도록 또 다른 작용제와 접합되고/되거나 융합될 수 있다. 실시형태에서, 키메라 단백질은 PEG, XTEN(예를 들어, rPEG로서), 폴리시알산(POLYXEN), 알부민(예를 들어, 인간 혈청 알부민 또는 HAS), 엘라스틴 유사 단백질(ELP), PAS, HAP, GLK, CTP, 트랜스페린 등 중 하나 이상과 융합되거나 접합될 수 있다. 실시형태에서, 각각의 개별 키메라 단백질은 전문이 참고로 포함된 문헌[BioDrugs(2015) 29:215-239]에 기술된 작용제 중 하나 이상에 융합된다.
투여, 투약 및 치료 요법
본 발명은 다양한 기술된 키메라 단백질(및/또는 추가 작용제)을 다양한 제형으로 포함한다. 본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)은 용액, 현탁액, 에멀션, 드롭, 정제, 환제, 펠릿, 캡슐, 액체 함유 캡슐, 분말, 서방형 제형, 좌제, 에멀션, 에어로졸, 스프레이, 현탁액의 형태, 또는 사용에 적합한 임의의 다른 형태를 취할 수 있다. 단백질 서열을 암호화하는 DNA 또는 RNA 작제물을 또한 사용할 수 있다. 일 실시형태에서, 조성물은 캡슐의 형태이다(예를 들어, 미국 특허 제5,698,155호 참고). 적합한 약제학적 부형제의 다른 예는 본 명세서에 참고로 포함된 문헌[Remington's Pharmaceutical Sciences 1447-1676(Alfonso R. Gennaro eds., 19th ed. 1995)]에 기술되어 있다.
필요한 경우, 키메라 단백질(및/또는 추가 작용제)을 포함하는 제형은 또한 가용화제를 포함할 수 있다. 또한, 이러한 작용제는 관련 기술 분야에 공지된 바와 같은 적합한 비히클 또는 전달 장치에 의해 전달될 수 있다. 본 명세서에 기술된 병용 요법은 단일 전달 비히클 또는 전달 장치에서 공동 전달될 수 있다. 투여를 위한 조성물은 선택적으로 국소 마취제, 예컨대, 주사의 부위에서 통증을 경감시키는 리그노카인을 포함할 수 있다.
본 발명의 키메라 단백질(및/또는 추가 작용제)을 포함하는 제형은 편리하게는 단위 제형으로 존재할 수 있고, 약학의 분야에 널리 공지된 임의의 방법에 의해 제조될 수 있다. 이러한 방법은 일반적으로 치료제를 1종 이상의 보조 성분을 구성하는 담체와 회합시키는 단계를 포함한다. 전형적으로, 제형은 치료제를 액체 담체, 미분 고체 담체 또는 둘 모두와 균일하고, 친밀하게 회합시키고, 이어서, 필요한 경우, 생성물을 목적하는 제형의 투여형으로 성형(예를 들어, 습식 또는 건식 과립화, 분말 블렌드 등, 그 다음 관련 기술 분야에 공지된 종래의 방법을 이용한 타정)함으로써 제조된다.
일 실시형태에서, 본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)은 본 명세서에 기술된 투여 방식에 채택된 조성물로서 일상적인 절차에 따라 제형화된다.
투여 경로는 예를 들어, 종양내, 피내, 근육내, 복강내, 정맥내, 피하, 비강내, 경막외, 경구, 설하, 비강내, 대뇌내, 질내, 경피, 직장, 흡입, 또는 특히 귀, 코, 눈 또는 피부에 대해서 국소에 의한 것을 포함한다. 실시형태에서, 투여는 경구로 또는 비경구 주사에 의해 달성된다. 대부분의 경우에, 투여는 혈류로의 본 명세서에 기술된 임의의 작용제의 방출을 초래하거나, 또는 대안적으로는, 작용제는 활성 질환의 부위에 직접 투여된다.
본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)은 경구로 투여될 수 있다. 이러한 키메라 단백질(및/또는 추가 작용제)은 또한 임의의 다른 편리한 경로, 예를 들어, 정맥내 점적주사 또는 볼러스 주사(bolus injection), 상피 또는 점막피부 내벽(예를 들어, 경구 점막, 직장 및 장 점막 등)을 통합 흡수에 의해 투여될 수 있고, 또 다른 생물학적으로 활성제와 함께 투여될 수 있다. 투여는 전신 또는 국소일 수 있다. 다양한 전달 시스템, 예를 들어, 리포솜, 마이크로입자, 마이크로캡슐, 캡슐 등 중의 캡슐화는 공지되어 있고, 투여에 사용될 수 있다.
구체적인 실시형태에서, 치료를 필요로 하는 면적에 국지적으로 투여하는 것이 바람직할 수 있다. 일 실시형태, 예를 들어, 암의 치료에서, 키메라 단백질(및/또는 추가 작용제)은 종양 미세환경(예를 들어, 종양 세포를 둘러싸고/거나 영양을 공급하는 세포, 분자, 세포외 기질 및/또는 혈관, 예를 들어, 종양 맥관구조; 종양-침윤 림프구; 섬유모세포 망상 세포; 내피 조상세포(EPC); 암-연관 섬유모세포; 주연세포; 다른 기질 세포; 세포외 기질(ECM)의 구성성분; 수지상 세포; 항원 제시 세포; T-세포; 조절 T 세포; 대식세포; 호중구; 및 종양에 인접하게 위치된 다른 면역 세포) 또는 림프절에 투여되고/거나 종양 미세환경 또는 림프절을 표적으로 한다. 실시형태에서, 예를 들어, 암의 치료에서, 키메라 단백질(및/또는 추가 작용제)은 종양내에 투여된다.
실시형태에서, 본 발명의 키메라 단백질은 종래의 면역요법(예를 들어, OPDIVO, KEYTRUDA, YERVOY 및 TECENTRIQ 중 1종 이상에 의한 치료)에 의해 인지되는 것보다 더 적은 부작용을 제공하는 이중 효과를 허용한다. 예를 들어, 본 발명의 키메라 단백질은 다양한 조직 및 기관, 예컨대, 피부, 위장관, 신장, 말초 및 중추 신경계, 간, 림프절, 눈, 췌장 및 내분비계; 예컨대, 뇌하수체염, 대장염, 간염, 폐렴, 발진 및 류마티스성 질환에 영향을 미치는 일반적으로 관찰되는 면역 관련 부작용을 감소시키거나 예방한다. 추가로, 예를 들어, 종양내와 같은 본 발명의 국소 투여는 종래의 면역요법(예를 들어, OPDIVO, KEYTRUDA, YERVOY 및 TECENTRIQ 중 1종 이상에 의한 치료)에서 사용되는 것과 같은 표준 전신 투여, 예를 들어, IV 주입에 의해 인지되는 부작용을 제거한다.
비경구 투여(예를 들어, 정맥내, 근육내, 복강내, 피하 및 관절내 주사 및 주입)에 적합한 투여형은 예를 들어, 용액, 현탁액, 분산액, 에멀션 등을 포함한다. 이들은 또한 사용 직전에 멸균 주사용 매질 중에 용해되거나 현탁될 수 있는 멸균 고체 조성물(예를 들어, 동결건조된 조성물)의 형태로 제조될 수 있다. 이들은 예를 들어, 관련 기술 분야에 공지된 현탁제 또는 분산제를 함유할 수 있다.
본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)의 투여량, 및 투여 스케줄은 치료하고자 하는 질환, 대상체의 일반적인 건강 및 투여하는 주치의의 결정을 포함하지만 이들로 제한되지 않는 다양한 매개변수에 따라 달라질 수 있다.
본 명세서에 기술된 임의의 키메라 단백질은 이를 필요로 하는 대상체에게 추가 작용제의 투여 이전에(예를 들어, 5분, 15분, 30분, 45분, 1시간, 2시간, 4시간, 6시간, 12시간, 24시간, 48시간, 72시간, 96시간, 1주, 2주, 3주, 4주, 5주, 6주, 8주, 또는 12주 전에), 동시에, 또는 이에 후속하여(예를 들어, 5분, 15분, 30분, 45분, 1시간, 2시간, 4시간, 6시간, 12시간, 24시간, 48시간, 72시간, 96시간, 1주, 2주, 3주, 4주, 5주, 6주, 8주, 또는 12주 후에) 투여될 수 있다. 실시형태에서 본 명세서에 기술된 임의의 키메라 단백질 및 추가 작용제는 1분 간격, 10분 간격, 30분 간격, 1시간 미만 간격, 1시간 간격, 1시간 내지 2시간 간격, 2시간 내지 3시간 간격, 3시간 내지 4시간 간격, 4시간 내지 5시간 간격, 5시간 내지 6시간 간격, 6시간 내지 7시간 간격, 7시간 내지 8시간 간격, 8시간 내지 9시간 간격, 9시간 내지 10시간 간격, 10시간 내지 11시간 간격, 11시간 내지 12시간 간격, 1일 간격, 2일 간격, 3일 간격, 4일 간격, 5일 간격, 6일 간격, 1주 간격, 2주 간격, 3주 간격, 또는 4주 간격으로 투여된다.
실시형태에서, 본 발명은 집락 자극 인자 1 수용체(CSF1R)의 세포외 도메인을 포함하는 본 발명의 키메라 단백질 및 적응 면역 반응을 유도하는 또 다른 키메라 단백질의 공동 투여에 관한 것이다. 이러한 실시형태에서, 본 발명의 키메라 단백질은 적응 면역 반응을 유도하는 키메라 단백질의 투여 이전에, 동시에 또는 이후에 투여될 수 있다. 예를 들어, 키메라 단백질은 1분 간격, 10분 간격, 30분 간격, 1시간 미만 간격, 1시간 간격, 1시간 내지 2시간 간격, 2시간 내지 3시간 간격, 3시간 내지 4시간 간격, 4시간 내지 5시간 간격, 5시간 내지 6시간 간격, 6시간 내지 7시간 간격, 7시간 내지 8시간 간격, 8시간 내지 9시간 간격, 9시간 내지 10시간 간격, 10시간 내지 11시간 간격, 11시간 내지 12시간 간격, 1일 간격, 2일 간격, 3일 간격, 4일 간격, 5일 간격, 6일 간격, 1주 간격, 2주 간격, 3주 간격 또는 4주 간격으로 투여될 수 있다. 예시적인 실시형태에서, CSF1R의 세포외 도메인을 포함하는 본 발명의 키메라 단백질 및 적응 면역 반응을 유도하는 키메라 단백질은 1주 간격으로 투여되거나, 또는 격주로 투여된다(즉, CSF1R의 세포외 도메인을 포함하는 본 발명의 키메라 단백질의 투여는 적응 면역 반응을 유도하는 키메라 단백질의 투여 1주 후에 수행되며, 그 등등이다).
본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)의 투여량은 예컨대, 병태의 중증도, 병태를 치료하고자 하는지 또는 예방하고자 하는지의 여부, 및 치료하고자 대상체의 연령, 체중 및 건강을 비롯한 몇몇 인자에 따라서 달라질 수 있다. 추가로, 특정한 대상체에 대한 파마코게놈(치료제의 약동학적, 약물학적 또는 효능 프로파일에 대한 유전자형의 효과) 정보는 사용된 투여량에 영향을 미칠 수 있다. 추가로, 정확한 개별 투여량은 투여되는 작용제, 투여 시간, 투여 경로, 제형의 본성, 배설 속도, 치료하고자 하는 특정한 질환, 장애의 중증도 및 장애의 해부학적 위치의 특정한 조합을 비롯한 다양한 인자에 따라 다소 조정될 수 있다. 투여량의 약간의 변동이 예상될 수 있다. 비경구 주사에 의한 본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)의 투여를 위해서, 투여량은 약 0.1㎎ 내지 약 250㎎/일, 약 1㎎ 내지 약 20㎎/일, 또는 약 3㎎ 내지 약 5㎎/일일 수 있다. 일반적으로, 경구 또는 비경구로 투여되는 경우, 본 명세서에 기술된 임의의 작용제의 투여량은 약 0.1㎎ 내지 약 1500㎎/일, 또는 약 0.5㎎ 내지 약 10㎎/일, 또는 약 0.5㎎ 내지 약 5㎎/일, 또는 약 200 내지 약 1,200㎎/일(예를 들어, 약 200㎎, 약 300㎎, 약 400㎎, 약 500㎎, 약 600㎎, 약 700㎎, 약 800㎎, 약 900㎎, 약 1,000㎎, 약 1,100㎎, 약 1,200㎎/일)일 수 있다.
실시형태에서, 본 명세서에 기술된 키메라 단백질(및/또는 추가 작용제)의 투여는 약 0.1㎎ 내지 약 1500㎎/치료, 또는 약 0.5㎎ 내지 약 10㎎/치료, 또는 약 0.5㎎ 내지 약 5㎎/치료, 또는 약 200 내지 약 1,200㎎/치료(예를 들어, 약 200㎎, 약 300㎎, 약 400㎎, 약 500㎎, 약 600㎎, 약 700㎎, 약 800㎎, 약 900㎎, 약 1,000㎎, 약 1,100㎎, 약 1,200㎎/치료)의 투여량으로 비경구 주사에 의해서 수행된다.
실시형태에서, 키메라 단백질(및/또는 추가 작용제)의 적합한 투여량은 약 0.01㎎/㎏ 내지 약 100㎎/체중 ㎏, 또는 약 0.01㎎/㎏ 내지 약 10㎎/대상체의 체중 ㎏, 예를 들어, 약 0.01㎎/㎏, 약 0.02㎎/㎏, 약 0.03㎎/㎏, 약 0.04㎎/㎏, 약 0.05㎎/㎏, 약 0.06㎎/㎏, 약 0.07㎎/㎏, 약 0.08㎎/㎏, 약 0.09㎎/㎏, 약 0.1㎎/㎏, 약 0.2㎎/㎏, 약 0.3㎎/㎏, 약 0.4㎎/㎏, 약 0.5㎎/㎏, 약 0.6㎎/㎏, 약 0.7㎎/㎏, 약 0.8㎎/㎏, 약 0.9㎎/㎏, 약 1㎎/㎏, 약 1.1㎎/㎏, 약 1.2㎎/㎏, 약 1.3㎎/㎏, 약 1.4㎎/㎏, 약 1.5㎎/㎏, 약 1.6㎎/㎏, 약 1.7㎎/㎏, 약 1.8㎎/㎏, 1.9㎎/㎏, 약 2㎎/㎏, 약 3㎎/㎏, 약 4㎎/㎏, 약 5㎎/㎏, 약 6㎎/㎏, 약 7㎎/㎏, 약 8㎎/㎏, 약 9㎎/㎏, 약 10㎎/체중 ㎏의 범위이고, 이들 값 및 이들 값 사이의 범위가 포함된다. 실시형태에서, 전달은 소포, 특히 리포솜 중에서 수행될 수 있다(문헌[Langer, 1990, Science 249:1527-1533; Treat et al., in Liposomes in Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989)] 참고).
본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)은 제어 방출형 또는 서방형 방출 수단 또는 관련 기술 분야의 통상의 기술자에게 널리 공지된 전달 장치에 의해 투여될 수 있다. 예는 미국 특허 제3,845,770호; 제3,916,899호; 제3,536,809호; 제3,598,123호; 제4,008,719호; 제5,674,533호; 제5,059,595호; 제5,591,767호; 제5,120,548호; 제5,073,543호; 제5,639,476호; 제5,354,556호; 및 제5,733,556호(이들 각각은 본 명세서에서 전문이 참고로 포함됨)에 기재된 것을 포함하지만 이들로 제한되지 않는다. 이러한 투여형은 다양한 비율로 목적하는 방출 프로파일을 제공하도록 예를 들어, 하이드로프로필메틸 셀룰로스, 다른 중합체 매트릭스, 젤, 투과성 막, 삼투 시스템, 다층 코팅, 마이크로입자, 리포솜, 마이크로구체, 또는 이들의 조합을 사용하여 1종 이상의 활성 성분의 제어 방출 또는 서방 방출을 제공하기에 유용할 수 있다. 활성 성분의 제어 방출 또는 서방 방출은 pH의 변화, 온도의 변화, 적절한 광 파장에 의한 자극, 효소의 농도 또는 이용 가능성, 물의 농도 또는 이용 가능성, 또는 다른 생리학적 조건 또는 화합물을 포함하지만 이에 제한되지 않는 다양한 조건에 의해 자극될 수 있다.
실시형태에서, 중합체 물질을 사용할 수 있다(문헌 [Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J. Macromol. Sci. Rev. Macromol. Chem. 23:61] 참고; 또한 문헌[Levy et al., 1985, Science 228:190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J. Neurosurg. 71:105] 참고).
실시형태에서, 제어 방출 시스템은 치료하고자 하는 표적 면적에 인접하게 위치하여, 전신 용량의 분율 만을 필요로 할 수 있다(예를 들어, 문헌[Goodson, in Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984)]을 참고). 문헌[Langer, 1990, Science 249:1527-1533]에 의한 검토에서 논의된 다른 제어 방출 시스템을 사용할 수 있다.
본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)의 투여는 독립적으로 매일 1회 내지 4회 또는 매월 1회 내지 4회 또는 매년 1회 내지 6회 또는 2년, 3년, 4년 또는 5년마다 1회일 수 있다. 투여는 1일 또는 1개월, 2개월, 3개월, 6개월, 1년, 2년, 3년의 기간 동안일 수 있고, 심지어는 대상체의 생애 동안일 수 있다.
본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)을 사용하는 투여 요법은 다양한 인자, 예컨대, 대상체의 유형, 종, 연령, 체중, 성별 및 의학적 상태; 치료하고자 하는 병태의 중증도; 투여 경로; 대상체의 신장 또는 간 기능; 개인의 파마코게놈 구성; 및 사용되는 본 발명의 특정 화합물에 따라 선택될 수 있다. 본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)은 단일 1일 용량으로 투여될 수 있거나, 전체 1일 투여량은 1일 2회, 3회 또는 4회의 분할 용량으로 투여될 수 있다. 추가로, 본 명세서에 기술된 임의의 키메라 단백질(및/또는 추가 작용제)은 투여 요법에 걸쳐 간헐적이 아닌 연속적으로 투여될 수 있다.
세포 및 핵산
실시형태에서, 본 발명은 본 명세서에 기술된 키메라 단백질을 암호화하는 핵산을 포함하는 발현 벡터를 제공한다. 실시형태에서, 발현 벡터는 DNA 또는 RNA를 포함한다. 다양한 실시형태에서, 발현 벡터는 포유동물 발현 벡터이다.
원핵생물 및 진핵생물 벡터 둘 모두가 키메라 단백질의 발현에 사용될 수 있다. 원핵생물 벡터는 이. 콜라이 서열을 기반으로 하는 작제물을 포함한다(예를 들어, 문헌[Makrides, Microbiol Rev 1996, 60:512-538]을 참고). 이. 콜라이에서의 발현에 사용될 수 있는 조절 영역의 비제한적인 예는 lac, trp, lpp, phoA, recA, tac, T3, T7 및 λPL을 포함한다. 원핵생물 발현 벡터의 비제한적인 예는 λgt 벡터 시리즈, 예컨대, λgt11(Huynh et al., in "DNA Cloning Techniques, Vol. I: A Practical Approach," 1984,(D. Glover, ed.), pp. 49-78, IRL Press, Oxford), 및 pET 벡터 시리즈(Studier et al., Methods Enzymol 1990, 185:60-89)를 포함할 수 있다. 그러나, 원핵생물 숙주-벡터 시스템은 포유동물 세포의 번역후 가공을 많이 수행할 수 없다. 따라서, 진핵생물 숙주-벡터 시스템이 특히 유용할 수 있다. 다양한 조절 영역은 포유동물 숙주 세포에서의 키메라 단백질의 발현에 사용될 수 있다. 예를 들어, SV40 초기 및 후기 프로모터, 사이토메갈로바이러스(CMV) 즉시 초기 프로모터 및 라우스 육종 바이러스 긴 말단 반복부(RSV-LTR) 프로모터를 사용할 수 있다. 포유동물 세포에서 유용할 수 있는 유도성 프로모터는, 비제한적으로 메탈로티오네인 II 유전자, 마우스 유방 종양 바이러스 글루코코르티코이드 반응성 긴 말단 반복부(MMTV-LTR), β-인터페론 유전자 및 hsp70 유전자와 연관된 프로모터를 포함한다(문헌[Williams et al., Cancer Res 1989, 49:2735-42; 및 Taylor et al., Mol Cell Biol 1990, 10:165-75]을 참고). 열 충격 프로모터 또는 스트레스 프로모터는 재조합 숙주 세포에서의 융합 단백질의 발현을 유도하기에 또한 유리할 수 있다.
실시형태에서, 본 발명의 발현 벡터는, 포유동물 세포에서 기능성인 발현 제어 영역, 또는 이의 보체에 작동 가능하게 연결된, 키메라 단백질(및/또는 추가 작용제) 또는 이의 보체를 암호화하는 핵산을 포함한다. 발현 제어 영역은, 차단제 및/또는 자극제가 발현 벡터로 형질전환된 인간 세포에서 생성되도록, 작동 가능하게 연결된 차단제 및/또는 자극제 암호화 핵산의 발현을 유도할 수 있다.
발현 제어 영역은 작동 가능하게 연결된 핵산의 발현에 영향을 미치는 조절 폴리뉴클레오타이드(때때로 본 명세서에서 요소라고 지칭됨), 예컨대, 프로모터 및 인핸서이다. 본 발명의 발현 벡터의 발현 제어 영역은 인간 세포에서 작동 가능하게 연결된 암호화 핵산을 발현할 수 있다. 실시형태에서, 세포는 종양 세포이다. 실시형태에서, 세포는 비-종양 세포이다. 실시형태에서, 발현 제어 영역은 작동 가능하게 연결된 핵산에 조절 가능한 발현을 부여한다. 신호(때때로 자극이라 지칭함)는 이러한 발현 제어 영역에 작동 가능하게 연결된 핵산의 발현을 증가시키거나 감소시킬 수 있다. 신호에 반응하여 발현을 증가시키는 이러한 발현 제어 영역은 대개 유도성이라고 지칭된다. 신호에 반응하여 발현을 감소시키는 이러한 발현 제어 영역은 대개 억제성이라고 지칭된다. 전형적으로, 이러한 요소에 의해 부여되는 증가 또는 감소의 양은 존재하는 신호의 양에 비례하고, 신호의 양이 더 높을수록, 발현의 증가 또는 감소가 더 높다.
실시형태에서, 본 발명은 신호에 반응하여 발현의 높은 수준을 일시적으로 실행할 수 있는 유도성 프로모터의 사용을 고려한다. 예를 들어, 종양 세포에 인접할 때, 이러한 발현 제어 서열을 포함하는 키메라 단백질(및/또는 추가 작용제)에 대한 발현 벡터에 의해서 형질전환된 세포는 형질전환된 세포를 적절한 신호에 노출시킴으로써 작용제의 높은 수준을 일시적으로 생성하도록 유도된다. 예시적인 유도성 발현 제어 영역은 신호에 의해 자극되는 유도성 프로모터를 포함하는 것, 예컨대, 소분자 화학 화합물을 포함한다. 특정 예는 예를 들어, 미국 특허 제5,989,910호, 제5,935,934호, 제6,015,709호 및 제6,004,941호에서 찾아볼 수 있으며, 이들 각각은 본 명세서에 전문이 참고로 포함된다.
발현 제어 영역 및 유전자좌 제어 영역은 전장 프로모터 서열, 예컨대, 네이티브 프로모터 및 인핸서 요소, 및 하위서열 또는 폴리뉴클레오타이드 변이체(전장 또는 비변이체 기능의 전부 또는 일부를 보유함)를 포함한다. 본 명세서에 사용되는 바와 같은, 용어 "기능성" 및 이의 문법적 변형은, 핵산 서열, 하위서열 또는 단편과 관련하여 사용되는 경우, 그 서열이 네이티브 핵산 서열(예를 들어, 비변이체 또는 비변형된 서열)의 하나 이상의 기능을 갖는다는 것을 의미한다.
본 명세서에서 사용되는 바와 같이, "작동 가능한 연결부"는 이의 의도된 방식으로 이들이 기능하도록 허용하는 것으로 기술되는 성분의 물리적 병치를 의미한다. 핵산과 작동 가능한 연결부에서의 발현 제어 요소의 예에서, 관계는 제어 요소가 핵산의 발현을 조정하게 하는 것이다. 전형적으로, 전사를 조정하는 발현 제어 영역은 전사된 핵산의 5' 단부 근처에(즉, "상류에") 병치된다. 발현 제어 영역은 또한 전사된 서열의 3' 단부에(즉, "하류에") 또는 전사체 내에(예를 들어, 인트론 내에) 위치할 수 있다. 발현 제어 요소는 전사된 서열로부터 이격된 거리(예를 들어, 핵산으로부터 100개 내지 500개, 500개 내지 1000개, 2000개 내지 5000개, 또는 이것 초과의 뉴클레오타이드)에 위치할 수 있다. 발현 제어 요소의 구체적인 예는 전사된 서열의 5'에 통상적으로 위치되는 프로모터이다. 발현 제어 요소의 또 다른 예는 전사된 서열의 5' 또는 3'에 또는 전사된 서열 내에 위치될 수 있는 인핸서이다.
인간 세포에서 기능성인 발현 시스템은 관련 기술 분야에 널리 공지되어 있고, 바이러스 시스템을 포함한다. 일반적으로, 인간 세포에서 기능성인 프로모터는 포유동물 RNA 중합효소에 결합하고, mRNA로의 암호 서열의 하류(3') 전사를 개시할 수 있는 임의의 DNA 서열이다. 프로모터는 암호 서열의 5' 단부에 보통 인접하게 배치된 전사 개시 영역, 및 전형적으로 전사 개시 부위의 25개 내지 30개의 염기쌍 상류에 위치된 TATA를 가질 것이다. TATA 박스는 정확한 부위에서 RNA 합성을 시작하도록 RNA 중합효소 II를 지시하는 것으로 생각된다. 프로모터는, 전형적으로 TATA 박스의 100개 내지 200개의 염기쌍 상류에 위치된, 상류 프로모터 요소(인핸서 요소)를 또한 전형적으로 가질 것이다. 상류 프로모터 요소는 전사가 개시되고 어느 한 배향으로 작용할 수 있는 속도를 결정한다. 포유동물 바이러스 유전자로부터의 프로모터가 프로모터로서 특히 사용되는데, 이는 바이러스 유전자가 대개 고도로 발현되고 광범위한 숙주 범위를 갖기 때문이다. 예는 SV40 초기 프로모터, 마우스 유방 종양 바이러스 LTR 프로모터, 아데노바이러스 주요 후기 프로모터, 단순 포진 바이러스 프로모터 및 CMV 프로모터를 포함한다.
전형적으로, 포유동물 세포에 의해 인식되는 전사 종결 및 폴리아데닐화 서열은 번역 중단 코돈에 3'에 위치한 조절 영역이고, 따라서, 프로모터 요소와 함께, 암호 서열에 측접한다. 성숙 mRNA의 3' 말단은 부위 특이적 번역후 절단 및 폴리아데닐화에 의해 형성된다. 전사 종결자 및 폴리아데닐화 신호의 예는 SV40으로부터 유래된 것을 포함한다. 인트론이 또한 발현 작제물에 포함될 수 있다.
생존 가능한 세포 내에 핵산을 도입하기 위해 사용 가능한 다양한 기술이 존재한다. 시험관내 포유동물 세포 내에 핵산을 운반하기에 적합한 기술은 리포솜의 사용, 전기천공, 마이크로주사, 세포 융합, 중합체 기반 시스템, DEAE-덱스트란, 바이러스 형질도입, 인산칼슘 침전 방법 등을 포함한다. 생체내 유전자 운반을 위해, 리포솜; 자연 중합체 기반 전달 비히클, 예컨대, 키토산 및 젤라틴을 포함하는 다수의 기술 및 시약을 또한 사용할 수 있고, 바이러스 벡터가 생체내 형질도입에 또한 적합하다. 몇몇 상황에서, 표적화제, 예컨대, 종양 세포 표면 막 단백질에 특이적인 항체 또는 리간드를 제공하는 것이 바람직하다. 리포솜이 사용되는 경우, 내포작용과 연관된 세포 표면 막 단백질에 결합하는 단백질, 예를 들어, 특정 세포 유형에 트로픽한 캡시드 단백질 또는 이의 단편, 순환에서 내재화를 겪는 단백질에 대한 항체, 세포내 국지화를 표적으로 하고, 세포내 반감기를 증가시키는 단백질이 표적화에 그리고/또는 흡수를 촉진하도록 사용될 수 있다. 수용체 매개된 내포작용의 기술은 예를 들어, 문헌[Wu et al., J. Biol. Chem. 262, 4429-4432(1987); 및 Wagner et al., Proc. Natl. Acad. Sci. USA 87, 3410-3414(1990)]에 기술되어 있다.
적절한 경우, 유전자 전달제, 예를 들어, 통합 서열 등이 또한 사용될 수 있다. 다수의 통합 서열은 관련 기술 분야에 공지되어 있다(예를 들어, 문헌[Nunes-Duby et al., Nucleic Acids Res. 26:391-406, 1998; Sadwoski, J. Bacteriol., 165:341-357, 1986; Bestor, Cell, 122(3):322-325, 2005; Plasterk et al., TIG 15:326-332, 1999; Kootstra et al., Ann. Rev. Pharm. Toxicol., 43:413-439, 2003] 참고). 이것은 재조합효소 및 트랜스포사제(transposase)를 포함한다. 예는 Cre(Sternberg and Hamilton, J. Mol. Biol., 150:467-486, 1981), 람다(Nash, Nature, 247, 543-545, 1974), FIp(Broach, et al., Cell, 29:227-234, 1982), R(Matsuzaki, et al., J. Bacteriology, 172:610-618, 1990), cpC31(예를 들어, 문헌[Groth et al., J. Mol. Biol. 335:667-678, 2004] 참조), 슬리핑 뷰티(sleeping beauty), 매리너 패밀리(mariner family)의 트랜스포사제(상기 Plasterk 등의 문헌 참고), 및 바이러스, 예컨대, AAV, 레트로바이러스, 및 바이러스 통합을 제공하는 성분을 갖는 항바이러스를 통합하기 위한 성분, 예컨대, 레트로바이러스 또는 렌티바이러스의 LTR 서열 및 AAV의 ITR 서열(Kootstra et al., Ann. Rev. Pharm. Toxicol., 43:413-439, 2003)을 포함한다. 또한, 키메라 단백질을 암호화하는 핵산 서열을 삽입하기 위해서 CRISPR/CAS9, 아연 핑거, TALEN 및 메가뉴클레아제 유전자 편집 기술을 비롯한 직접적인 및 표적화된 유전적 통합 전략을 사용할 수 있다.
양상에서, 본 발명은 바이러스 벡터인 키메라 단백질(및/또는 추가 작용제)의 발현을 위한 발현 벡터를 제공한다. 유전자 치료에 유용한 많은 바이러스 벡터가 공지되어 있다(예를 들어, 문헌[Lundstrom, Trends Biotechnol., 21: 1 17, 122, 2003] 참고). 예시적인 바이러스 벡터는 안티바이러스(LV), 레트로바이러스(RV), 아데노바이러스(AV), 아데노 연관된 바이러스(AAV) 및 α 바이러스로부터 선택된 것을 포함하지만, 다른 바이러스 벡터가 또한 사용될 수 있다. 생체내 사용을 위해서, 숙주 게놈 내에 통합되지 않는 바이러스 벡터, 예컨대, α 바이러스 및 아데노바이러스가 사용하기에 적합하다. α 바이러스의 예시적인 유형은 신드비스 바이러스, 베네수엘라 말 뇌염(VEE) 바이러스 및 셈리키 포레스트 바이러스(SFV)를 포함한다. 시험관내 사용을 위해서, 숙주 게놈 내에 통합하는 바이러스 벡터, 예컨대, 레트로바이러스, AAV 및 안티바이러스가 적합하다. 일 실시형태에서, 본 발명은 생체내에서 고형 종양을 본 발명의 바이러스 벡터와 접촉시키는 단계를 포함하는, 생체내에서 인간 세포에서 형질도입하는 방법을 제공한다.
실시형태에서, 본 발명은 본 명세서에 기술된 키메라 단백질을 포함하는 발현 벡터를 포함하는 숙주 세포를 제공한다.
발현 벡터는 본 발명의 키메라 단백질을 제조하기 위해 숙주 세포에 도입될 수 있다. 세포는 예를 들어, 시험관내에서 배양되거나 유전적으로 조작될 수 있다. 유용한 포유동물 숙주 세포는, 비제한적으로, 인간, 원숭이 및 설치류로부터 유래된 세포를 포함한다(예를 들어, 문헌[Kriegler in "Gene Transfer and Expression: A Laboratory Manual," 1990, New York, Freeman & Co.] 참고). 이들은 SV40에 의해서 형질전환된 원숭이 신장 세포주(예를 들어, COS-7, ATCC CRL 1651); 인간 배아 신장주(예를 들어, 현탁 배양에서 성장을 위해 서브클로닝된 293, 293-EBNA 또는 293 세포, [Graham et al., J Gen Virol 1977, 36:59]); 아기 햄스터 신장 세포(예를 들어, BHK, ATCC CCL 10); 중국 햄스터 난소 세포-DHFR(예를 들어, CHO, [Urlaub and Chasin, Proc Natl Acad Sci USA 1980, 77:4216]); DG44 CHO 세포, CHO-K1 세포, 마우스 세르톨리 세포(Mather, Biol Reprod 1980, 23:243-251); 마우스 섬유모세포 세포(예를 들어, NIH-3T3), 원숭이 신장 세포(예를 들어, CV1 ATCC CCL 70); 아프리카 녹색 원숭이 신장 세포(예를 들어, VERO-76, ATCC CRL-1587); 인간 자궁경부 암종 세포(예를 들어, HELA, ATCC CCL 2); 개 신장 세포(예를 들어, MDCK, ATCC CCL 34); 버팔로 래트 간 세포(예를 들어, BRL 3A, ATCC CRL 1442); 인간 폐 세포(예를 들어, W138, ATCC CCL 75); 인간 간 세포(예를 들어, Hep G2, HB 8065); 및 마우스 유방 종양 세포(예를 들어,MMT 060562, ATCC CCL51)를 포함한다. 본 명세서에 기술된 융합 단백질을 발현하기 위한 예시적인 암 세포 유형은 마우스 섬유모세포 세포주, NIH3T3, 마우스 루이스 폐암종 세포주, LLC, 마우스 비만세포종 세포주, P815, 마우스 림프종 세포주, EL4 및 이의 난알부민 형질감염체, E.G7, 마우스 흑색종 세포주, B16F10, 마우스 섬유육종 세포주, MC57, 및 인간 소세포 폐 암종 세포주, SCLC#2 및 SCLC#7을 포함한다.
숙주 세포는 정상 또는 영향을 받은 대상체, 예컨대, 건강한 인간, 암 환자 및 감염성 질환을 갖는 환자, 개인 실험실 기탁물, 공공 배양 수집품, 예컨대, 미국 균주 은행(American Type Culture Collection), 또는 상업적인 공급원으로부터의 것으로부터 수득될 수 있다.
시험관내, 생체외 및/또는 생체내에서 본 발명의 키메라 단백질을 제조하기 위해서 사용될 수 있는 세포는, 비제한적으로, 상피 세포, 내피 세포, 각질세포, 섬유모세포, 근육 세포, 간세포; 혈액 세포, 예컨대, T 림프구, B 림프구, 단핵구, 대식세포, 호중구, 호산구, 거핵구, 과립구; 다양한 줄기 또는 전구체 세포, 특히 조혈 줄기 또는 전구체 세포(예를 들어, 골수로부터 수득되는 것과 같음), 제대혈, 말초 혈액, 태아 간 등을 포함한다. 세포 유형의 선택은 치료하거나 하는 또는 예방하고자 종양 또는 감염성 질환의 유형에 따라 달라지고, 관련 분야의 통상의 기술자에 의해 결정될 수 있다.
대상체 및/또는 동물
실시형태에서, 대상체 및/또는 동물은 포유류, 예를 들어, 인간, 마우스, 래트, 기니피그, 개, 고양이, 말, 소, 돼지, 토끼, 양 또는 비인간 영장류, 예컨대, 원숭이, 침팬지 또는 개코원숭이이다. 실시형태에서, 대상체 및/또는 동물은 비포유동물, 예를 들어, 제브라피시이다. 실시형태에서, 대상체 및/또는 동물은 (예를 들어, GFP을 사용하여) 형광성으로 태그화된 세포를 포함할 수 있다. 실시형태에서, 대상체 및/또는 동물은 형질전환 동물은 형광성 세포를 포함하는 트랜스제닉 동물이다.
실시형태에서, 대상체 및/또는 동물은 인간이다. 실시형태에서, 인간은 소아 인간이다. 실시형태에서, 인간은 성인 인간이다. 실시형태에서, 인간은 노인 인간이다. 실시형태에서, 인간은 환자라고 지칭될 수 있다.
실시형태에서, 인간은 약 0개월 내지 약 6개월, 약 6 내지 약 12개월, 약 6 내지 약 18개월, 약 18 내지 약 36개월, 약 1세 내지 약 5세, 약 5 내지 약 10세, 약 10 내지 약 15세, 약 15 내지 약 20세, 약 20 내지 약 25세, 약 25 내지 약 30세, 약 30 내지 약 35세, 약 35 내지 약 40세, 약 40 내지 약 45세, 약 45 내지 약 50세, 약 50 내지 약 55세, 약 55 내지 약 60세, 약 60 내지 약 65세, 약 65 내지 약 70세, 약 70 내지 약 75세, 약 75 내지 약 80세, 약 80 내지 약 85세, 약 85 내지 약 90세, 약 90 내지 약 95세 또는 약 95 내지 약 100세 범위의 연령이다.
실시형태에서, 대상체는 비인간 동물이고, 따라서 본 발명은 수의학적 용도에 관한 것이다. 구체적인 실시형태에서, 비인간 동물은 애완동물이다. 또 다른 구체적인 실시형태에서, 비인간 동물은 가축 동물이다.
키트
본 발명은 본 명세서에 기술된 임의의 작용제의 투여를 단순화할 수 있는 키트를 제공한다. 본 발명의 예시적인 키트는 단위 투여형으로 본 명세서에 기술된 임의의 조성물을 포함한다. 일 실시형태에서, 단위 투여형은 본 명세서에 기술된 임의의 작용제 및 약제학적으로 허용 가능한 담체, 희석제, 부형제 또는 비히클을 함유하는 용기, 예컨대, 멸균일 수 있는 사전-충전 주사기이다. 키트는 본 명세서에 기술된 임의의 작용의 사용을 지시하는 레이블 또는 인쇄된 지시서를 추가로 포함할 수 있다. 키트는 또한 뚜껑 검경, 국소 마취제 및 투여 위치를 위한 세정제를 포함할 수 있다. 키트는 본 명세서에 기술된 1종 이상의 추가 작용제를 또한 추가로 포함할 수 있다. 일 실시형태에서, 키트는 유효량의 본 발명의 조성물 및 유효량의 또 다른 조성물, 예컨대, 본 명세서에 기술된 것을 함유하는 용기를 포함한다.
본 명세서에 기술된 임의의 양상 또는 실시형태는 본 명세서에 개시된 바와 같은 임의의 다른 양상 또는 실시형태와 조합될 수 있다.
본 발명을 하기 실시예에 의해서 추가로 기술할 것이며, 이는 청구범위에 기술된 본 발명의 범주를 제한하지 않는다.
실시예
실시예 1: 단량체 CSF1R-Fc-CD40L 키메라 단백질의 예측된 작용 기전 및 인 실리코(in silico) 예측된 구조
도 1A는 CSF1R-Fc-CD40L 키메라 단백질의 예측된 작용 기전의 개략적인 표현을 나타낸다. CSF1R 도메인은 CSF1 및/또는 IL-34에 결합하여 '싱크 효과'를 제공하고, CSF1 및/또는 IL-34가 항원 제시 세포의 표면 상의 CSF1R과 결합하는 것을 예방함으로써, 면역 저해 신호를 차단한다. 동시에, 키메라 단백질의 CD40L 도메인은 항원 제시 세포의 표면 상의 CD40과 결합함으로써, 면역 활성화 신호를 제공한다. 이러한 두 사건의 순 효과는, (IL-34 및/또는 CSF1을 통해서) 저해 신호를 차단하고, CD40을 통해서 활성화 신호를 제공함으로써 면역 반응을 증가시킨다.
도 1B는 종양 세포와 T 세포 사이에 키메라 단백질에 의해서 형성된 시냅스를 나타낸다.
도 1C는 947개 아미노산 잔기(서열번호 5)를 갖는 단량체 CSF1R-Fc-CD40L 키메라 단백질(SL-115154)의 인 실리코 구조 예측을 나타내고, p-값은 1.69×10-29이다. 단량체 단백질의 분자량은 105.4kDa인 것으로 예측된다. 키메라 단백질의 구조를 도 1A에 제공한다.
구체적으로, 구조 예측은, 33개 아미노산 위치(3%)가 정렬되지 않을 수 있다. 키메라 단백질의 전체 서열의 2차 구조 예측은 단백질이 2%의 α-나선(H), 51%의 β-시트(E), 및 45%의 코일(C)의 조성을 갖는다는 것을 나타내었다. 절대 전역 품질(absolute global quality)에 대한 GDT(전역 거리 시험(global distance test)) 및 uGDT(비정규화 GDT)를 또한 키메라 단백질에 대해서 계산하여 738(78)의 전체 uGDT(GDT)를 제공하였다. 단백질 잔기의 용매 접근성에 대한 3-상태 예측은 33% 노출(E), 46% 중간(M), 및 19% 묻힘(B)이었다.
실시예 2: CSF1R-Fc-CD40L 키메라 단백질의 특징규명
인간 CSF1R-Fc-CD40L(본 명세서에서 CD115-Fc-CD40L이라고도 지칭됨) 키메라 단백질을 상기 상세한 설명 및 내용이 전체적으로 참고로 포함된 미국 특허 출원 제U.S. 62/464,002호에 기술된 바와 같이 작제하였다. 즉, 항-CSF1R, 항-Fc 및 항-CD40L 항체를 통해서, 키메라 단백질의 각각의 개별 도메인에 대한 웨스턴 블롯 분석을 수행함으로써 키메라 단백질을 특징규명하였다.
웨스턴 블롯은, 비환원 레인(도 2, 각각의 블롯에서 레인 2)에서, 대략 240kDa의 겉보기 분자량을 갖는 올리고머 종(가능하게는 이량체)의 존재를 나타내었는데, 이것은 환원제, β-머캅토에탄올의 존재 하에서 글리코실화된 단량체 밴드로 환원되었다(도 2, 각각의 블롯에서 레인 3). 도 2, 각각의 블롯에서 레인 4에 도시된 바와 같이, 키메라 단백질은 환원제(β-머캅토에탄올) 및 엔도글리코시다제(PNGase)의 존재 하에서 대략 105kDa의 예측된 분자량에서 단량체로서 전개되었다.
실시예 3: ELISA를 사용한 CSF1R-Fc-CD40L 키메라 단백질의 상이한 도메인의 결합 친화도의 특징규명
효소 결합 면역흡착 검정(ELISA) 검정을 개발하여 각각의 결합 파트너(즉, CSF1, hIgG 또는 CD40)에 대한 hCSF1R-Fc-CD40L(본 명세서에서 CD115-Fc-CD40L이라고도 지칭됨)의 상이한 도메인의 결합 친화도를 입증하였다. 구체적으로, 플레이트 결합된 인간 IgG를 포획하고, HRP-접합된 항-인간 IgG 항체(도 3의 상부 좌측 사분면)를 통해서 검출함으로써 키메라 단백질의 Fc 부분을 검출하였다. 플레이트 결합된 재조합 인간 CSF1 단백질을 포획하고, HRP-접합된 항-인간 IgG 항체를 통해서 검출함으로써 hCSF1R-Fc-CD40L 키메라 단백질의 CSF1R 도메인을 검출하였다(도 3의 상부 우측 사분면). 플레이트 결합된 재조합 인간 CD40L 단백질을 포획하고, CD40L-특이적 항체를 통해서 검출함으로써 키메라 단백질의 CD40L 도메인을 검출하였다(도 3의 하부 우측 사분면). 마지막으로, 이중 ELISA 포맷을 사용하여 CSF1 및 CD40 둘 모두에 대한 동시 결합을 입증하였는데, 여기서 재조합 CD40을 사용하여 CSF1R-Fc-CD40L을 포획하였고, 재조합 CSF1을 사용하여 CSF1R-Fc-CD40L을 검출하였다(도 3의 하부 우측 부분).
실시예 4: CSF1R-Fc-CD40L 키메라 단백질의 생체외 세포 결합 친화도의 특징규명
세포 결합 검정을 수행하여 포유동물 세포 막의 표면 상의 각각의 결합 파트너에 대한 mCSF1R-Fc-CD40L 키메라 단백질의 상이한 도메인의 결합 친화도를 입증하였다.
세포 결합 검정을 위해서, CD40(Jurkat/CD40)을 안정적으로 발현하도록 불멸화된 세포주를 조작하였다. CSF1R-Fc-CD40L 키메라 단백질의 증가하는 농도를 2시간 동안 과발현 (Jurkat/CD40) 세포주와 함께 인큐베이션시켰다. 세포를 수집하고, 세척하고, 유세포 분석법에 의한 키메라 단백질 결합의 검출을 위해서 항체로 염색하였다.
도 4에 도시된 바와 같이, CSF1R-Fc-CD40L 키메라 단백질은 농도 의존적인 방식으로 그리고 낮은 nM 친화도로 세포 표면 상에 존재하는 CD40에 결합하였다. 구체적으로, 도 4에 도시된 바와 같이, 세포 결합 검정은, CSF1R-Fc-CD40L이 CD40에 결합하며, 약 77nM의 친화도(EC50 계산에 따름)를 가짐을 입증하였다.
실시예 5: 표면 플라스몬 공명(SPR) 및 바이오층 표면 간섭계법에 의한 CSF1R-Fc-CD40L 키메라 단백질의 결합 친화도의 특징규명
hCSF1R-Fc-CD40L 키메라 단백질의 상이한 도메인의 결합 친화도를 BioRad ProteOn XPR 360 시스템을 사용하여 표면 플라스몬 공명(SPR)에 의해서 측정하였다. 구체적으로, 인간 CSF1 및 CD40에 대한 키메라 단백질의 친화도를 결정하고, 재조합 대조군 단백질과 비교하고, 결과를 하기 표에 나타낸다:
hCSF1R-Fc-CD40L 키메라 단백질은 높은 친화도로 CSF1 및 CD40에 결합하는 것으로 결정되었다. 특히, hCSF1R-Fc-CD40L 키메라 단백질의 오프-레이트는 대조군 단백질(즉, CSF1R-Fc 및 CD40L-Fc)보다 훨씬 더 느리다는 것이 주목되었다. 예를 들어, CSF1로부터의 키메라 단백질의 오프-레이트는 CSF1R-Fc 단백질보다 45.9배 더 느렸다.
또한, CSF1R-Fc-CD40L의 각각의 도메인의 결합 친화도를 바이오층 표면 간섭계법을 기반으로 Octet 시스템을 사용하여 측정하였다(도 5A 내지 도 5F). 이러한 결과는 각각의 결합 파트너에 대한 CSF1R-Fc-CD40L 키메라 단백질의 높은 친화도 결합을 추가로 확인해준다.
실시예 6. 두 CSF1R 리간드 모두에 대한 결합 친화도
CSF1R은 2개의 리간드: CSF1 및 IL-34에 결합하는 것으로 보고되어 있다. 따라서, CSF1R-Fc-CD40L이 CSF1 및 IL-34 둘 모두에 결합할 수 있다는 것을 입증하는 것이 바람직하였다. 이것을 바이오층 표면 간섭계법(Octet)을 사용하여 시험하였고, 결과를 도 6에 나타낸다. CSF1 및 IL-34에 대한 CSF1R-Fc-CD40L의 결합은 구별 가능하지 않았고; 따라서, 곡선은 서로의 상부 상에 사실상 중첩된다.
실시예 7. 뮤린 CSF1R-Fc-CD40L 키메라 단백질의 특징규명
뮤린 CSF1R-Fc-CD40L(본 명세서에서 mCSF1R-Fc-CD40L이라고도 지칭됨) 키메라 단백질을 상기 상세한 설명 및 내용이 전체적으로 참고로 포함된 미국 특허 출원 제U.S. 62/464,002호에 기술된 바와 같이 작제하였다. 즉, α-CSF1R, α-Fc 및 α-CD40L 항체를 통해서, 키메라 단백질의 각각의 개별 도메인에 대한 웨스턴 블롯 분석을 수행함으로써 키메라 단백질을 특징규명하였다.
웨스턴 블롯은, 비환원 레인(도 7A, 각각의 블롯에서 레인 2)에서, 대략 240kDa의 겉보기 분자량을 갖는 올리고머 종(가능하게는 이량체)의 존재를 나타내었는데, 이것은 환원제, β-머캅토에탄올의 존재 하에서 글리코실화된 단량체 밴드로 환원되었다(도 7A, 각각의 블롯에서 레인 3). 도 7A, 각각의 블롯에서 레인 4에 도시된 바와 같이, 키메라 단백질은 환원제(β-머캅토에탄올) 및 엔도글리코시다제(PNGase)의 존재 하에서 대략 105kDa의 예측된 분자량에서 단량체로서 전개되었다.
효소 결합 면역흡착 검정(ELISA) 검정을 개발하여 각각의 결합 파트너(즉, CSF1, mIgG 또는 CD40)에 대한 mCSF1R-Fc-CD40L의 상이한 도메인의 결합 친화도를 입증하였다. 구체적으로, 플레이트 결합된 마우스 IgG를 포획하고, HRP-접합된 항-마우스 IgG 항체(도 7B의 중간 그래프)를 통해서 검출함으로써 키메라 단백질의 Fc 부분을 검출하였다. 플레이트 결합된 재조합 뮤린 CSF1 단백질을 포획하고, HRP-접합된 항-마우스 IgG 항체를 통해서 검출함으로써 mCSF1R-Fc-CD40L 키메라 단백질의 CSF1R 도메인을 검출하였다(도 7B의 좌측 그래프). 플레이트 결합된 재조합 마우스 CD40L 단백질을 포획하고, CD40L-특이적 항체를 통해서 검출함으로써 키메라 단백질의 CD40L 도메인을 검출하였다(도 7B의 우측 그래프).
도 7B에 도시된 바와 같이, hCSF1R-Fc-CD40L 키메라 단백질의 상이한 도메인은 높은 친화도로 그의 각각의 결합 파트너와 효과적으로 상호작용하였다. 그럼에도 불구하고, ELISA 검정에서, 키메라 단백질을 검출하기 위해서 중심 Fc 영역을 사용하는 것은 샘플에서 실제 단백질 함량을 과소평가하는 경향이 있었음이 관찰되었다. 따라서, 낮은 수준의 hCSF1R-Fc-CD40L 키메라 단백질은 본 검정에서 표준품과 비교하여 검출하였다.
실시예 8. 뮤린 CSF1R-Fc-CD40L 키메라 단백질의 생체외 세포 결합 친화도의 특징규명
세포 결합 검정을 수행하여 포유동물 세포 막의 표면 상의 각각의 결합 파트너에 대한 mCSF1R-Fc-CD40L 키메라 단백질의 상이한 도메인의 결합 친화도를 입증하였다.
세포 결합 검정을 위해서, CD40(CHOK1/CD40)을 안정적으로 발현하도록 불멸화된 세포주를 조작하였다. 뮤린 CSF1R-Fc-CD40L 키메라 단백질의 증가하는 농도를 2시간 동안 과발현 (CHOK1/CD40) 세포주와 함께 인큐베이션시켰다. 세포를 수집하고, 세척하고, 유세포 분석법에 의한 키메라 단백질 결합의 검출을 위해서 항체로 염색하였다.
도 8에 도시된 바와 같이, 뮤린 CSF1R-Fc-CD40L 키메라 단백질은 농도 의존적인 방식으로 그리고 낮은 nM 친화도로 세포 표면 상에 존재하는 CD40에 결합하였다. 구체적으로, 도 8에 도시된 바와 같이, 세포 결합 검정은, CSF1R-Fc-CD40L이 CD40에 결합하였고, 91.1nM의 친화도(EC50 계산에 따름)를 가짐을 입증하였다. 음성 대조군으로서, 모체(비-CD40 발현) CHOK1 세포주에 대한 검출 가능한 결합이 존재하지 않았다.
실시예 9. 시험관내에서 CD40 신호전달의 유도
인간 CD40은 동종 삼량체 수용체인데, 이것은 활성화되는 경우, NF-κB 및 NIK 활성화 둘 모두에 관련된 신호전달 캐스케이드의 유도로 이어진다. 도 9는 인간 CSF1R-Fc-CD40L 키메라 단백질을 사용한 시험관내 NF-κB / NIK 신호전달 검정으로부터의 예시적인 데이터를 나타낸 도면이다. DiscoverX NIK 신호전달 검정으로부터의 U2OS 세포를 상업적으로 입수 가능한 단일-측 CD40L-Fc, 단일-측 CSF1R-Fc, 또는 CD40 효능제 항체, 또는 인간 CSF1R-Fc-CD40L 키메라 단백질로 적정하면서 배양하였다. 상대적인 루시퍼라제 단위(relative luciferase unit: RLU)는, 제시된 요법으로의 처리 이후에 활성화된 NF-κB/NIK 신호전달의 상대적인 강도를 나타낸다. hCSF1R-Fc-CD40L은 NF-κB 및 NIK를 통해서 강하게 활성화된 신호전달을 갖는 것으로 나타나며, 이것은 CD40L-Fc 키메라 단백질과 대등한 정도이다. CD40 효능제 항체는 이러한 검정에서 CD40 활성화를 자극하지 않았는데, 그 이유는 CD40 수용체의 적절한 클러스터링을 용이하게 하기 위해서, 항체가 Fc 수용체 가교결합을 요구하기 때문이다.
실시예 10: CSF1R-Fc-CD40L 키메라 단백질의 기능성 검정
CSF1R(CD115라고도 공지됨)은 종양 미세환경 내에서 CSF1 및/또는 IL-34에 대한 결합에서의 이의 역할로 인해서 신생 면역 면역관문으로서 식별되었다. 도 1A에 도시된 바와 같이, 이들 두 리간드 중 어느 것에 대한 CSF1R의 결합은 골수 유래 억제 세포의 유도를 비롯한, 다양한 기전을 통해서 면역 억제를 자극한다. 이론에 얽매이고자 함은 아니지만, CSF1R-Fc-CD40L 키메라 단백질은, 동시에, CSF1/IL-34에 대한 사이토카인 트랩으로서 작용하고, CD40을 통해서 대식세포 및 항원 제시 세포를 자극함으로써 강한 항종양 면역을 생성할 수 있다고 여겨진다.
mCSF1R-Fc-CD40L 키메라 단백질의 기능성 활성도를 특징규명하기 위해서 두 기능성 검정을 개발하였다.
제1 검정은, 가용성 CSF1에 결합하여 이의 혈청 수준을 감소시키는 mCSF1R-Fc-CD40L 키메라 단백질의 능력을 평가하기 위한 생체내 트랩/싱크 검정이다. 구체적으로, 비-종양-보유 마우스에 단일 용량의 항-CSF1R 항체(항-CD115 항체라고도 지칭됨)를 0일에 주사하였다. 2일에, 마우스를 치료하지 않고 두거나, 또는 단일 용량의 CSF1R-Fc-CD40L 키메라 단백질을 주사하였다. 키메라 단백질을 주사하기 2일 전 및 키메라 단백질로의 처리 3일 후에 혈액 혈청을 수집하였다. 뮤린 CSF1의 ELISA 검정을 혈청 상에서 수행하였다. 도 10A에 도시된 바와 같이, mCSF1R-Fc-CD40L 키메라 단백질은 가용성 CSF1에 결합하여 이의 혈청 수준을 상당히 감소시킴으로써 ELISA에 의한 이의 검출을 제거할 수 있었다.
제2 검정은 mCSF1R-Fc-CD40L 키메라 단백질로의 처리 13일 후 종양-보유 마우스의 생체내 면역 프로파일링을 포함하였다. 구체적으로, 비장 및 림프절에서 IL15Rα+ 세포의 수준을 키메라 단백질에 의한(특히 키메라 단백질의 CD40L 부분에 의한) 면역 활성화에 대한 판독치로서 분석하였다. 종양-보유 마우스를 최초 종양 접종 5일 및 7일 후에 150㎍의 mCSF1R-Fc-CD40L 키메라 단백질 2회 용량으로 처리하였다. 13일에, 마우스의 코호트를 희생시키고, 이의 비장 및 림프절을 제거하고, IL15Rα의 유세포 분석법을 위해서 분리시켰다. 비장 및 림프절에서 IL15Rα+ 세포의 수준을 도 10B에 도시된 바와 같이 결정하였다. CD40L 기능의 공지된 기전과 일관되게, 키메라 단백질로 처리된 마우스는 미처리 마우스와 비교할 때 비장 및 림프절에서 IL15Rα의 증가를 나타내었는데, 이는, 키메라 단백질이 CD40/CD40L 경로를 통해서 면역 활성화를 자극하였음을 시사하였다.
실시예 11: CSF1R-Fc-CD40L 키메라 단백질의 생체내 항-종양 활성도의 특징규명
mCSF1R-Fc-CD40L 키메라 단백질의 생체내 항종양 활성도를 CT26 마우스 결장직장 종양 모델을 사용하여 분석하였다.
하나의 실험 세트에서, Balb/c 마우스를 0일에 CT26 종양 세포로 접종시키고, 30일에 CT26 종양 세포의 제2 접종으로 재시험감염시켰다. 종양 성장 5일 이후에, 종양이 4 내지 5mm의 직경에 도달했을 때, 마우스를 CD40 효능제 항체, CSF1R(CD115) 차단 항체, 이들 두 항체의 조합물, 또는 mCD115-Fc-CD40L 키메라 단백질로 처리하였다. 처리를 7일에 반복하였다.
각각의 처리군에 대한 종양 성장을 도 11A에 도시된 바와 같이 평가하였다. 구체적으로, 미처리 마우스는 종양이 신속하게 발달하였다. CD40 효능제 항체, CSF1R(CD115) 차단 항체, 또는 이들 두 항체의 조합물로의 처리는 종양 발달을 약간 지연시키는 것으로 보였다. 비교하면, 마우스를 mCD115-Fc-CD40L 키메라 단백질로 처리하는 것은 종양을 상당히 예방하고/하거나 종양의 발달을 지연시켰다. 상기 데이터는, CSF1R(CD115)-Fc-CD40L 키메라 단백질로의 처리가 생체내에서 면역 기억 효과를 생성한다는 것을 시사한다. 따라서, 처리된 동물은 키메라 단백질로의 초기 처리 후에 재감염되는 경우, 이후에 종양 세포를 공격할 수 있고/거나 종양의 발달을 예방할 수 있다.
종양 접종 주 50일 전체에서 마우스의 전체 생존 백분율을 또한 평가하였다. 미처리 마우스 모두는 종양 접종 후 30일 이내에 사망하였다. CD40 효능제 항체, CSF1R(CD115) 차단 항체 또는 이들 두 항체의 조합물로 처리된 마우스의 다른 군은 생존이 연장되었지만, 그 마우스 중 여전히 25% 미만이 종양접종 50일 이후에 생존하였다. 유의하게, mCD115-Fc-CD40L 키메라 단백질로 처리된 마우스 중 70% 초과는 도 11B에 도시된 바와 같이 종양 접종 50일 이후에 생존하였다. 도 11C에 도시된 바와 같이, 키메라 단백질로의 처리는 CD40 효능제 항체, CSF1R(CD115) 차단 항체, 이들 두 항체의 조합물로의 처리보다 상당히 더 높은 종양 거부를 초래하였다.
실시예 12. 종양 보유 마우스로부터의 림프구 집단의 면역표현형결정
종양 접종 13일 후에 비장세포, 림프절 세포 및 종양 침윤 림프구를 분석함으로써 면역 표현형결정을 또한 수행하였다. 도 12A에 도시된 바와 같이, mCD115-Fc-CD40L 키메라 단백질로 처리된 마우스는, 미처리 마우스와 비교할 때, 림프절 또는 종양이 아닌, 비장에서 CD4+ 및 CD8+ T 세포 둘 모두의 증가된 빈도를 나타내었다. 추가로, 키메라 단백질로 처리된 마우스는 비장 및 종양에서 CD4+CD25+ 세포의 비율의 감소를 나타내었는데, 이는 키메라 단백질이 조절 T 세포를 감소시킴을 시사한다(도 12B). 특히, 종양 내에서의 총 CD8+ 세포의 비율의 미미한 증가에도 불구하고(도 12A), mCD115-Fc-CD40L 키메라 단백질로 처리된 마우스에서 AH1 종양 항원에 대해서 특이적인 CD8+ T 세포의 비율의 상당한 증가가 (사량체 염색에 의해서) 검출되었는데(도 12C), 이는 키메라 단백질이 CD8+ T 세포에 의해서 종양 인식을 향상시켰다는 것을 시사한다.
mCD115-Fc-CD40L 키메라 단백질에 의한 CD40 수용체 활성화를 평가하기 위해서, 키메라 단백질에 의한 CD19+ 세포 및 IL-15Rα 양성 세포의 유도를 분석하였다. 도 12D에 도시된 바와 같이, 키메라 단백질로 처리된 마우스의 비장세포에서 CD19+ 세포의 상당한 증가가 관찰되었다. CD19+ 세포의 이러한 증가는 림프절 또는 종양 세포에서 관찰되지 않았다. 추가로, 키메라 단백질로 처리된 마우스의 비장세포에서는 IL-15Rα 양성 세포의 상당한 증가가 또한 존재하였다(도 12E). 다시, 이러한 증가는 림프절 또는 종양 세포에서 관찰되지 않았다.
실시예 13. CSF1R 및 CD40 항체와 비교한 CSF1R-Fc-CD40L의 감소된 독성
생체내 연구는 또한 놀랍게도 mCD115-Fc-CD40L 키메라 단백질이 향상된 안전성 프로파일을 나타내었다는 것을 입증하였다. 구체적으로, CD40 효능제 항체 및 CD40 + CD115 항체 조합물 처리로 처리된 마우스는 실험 기간에 걸쳐서 상당한 설사 및 체중 감소가 발달한 것이 관찰되었다. CD40 효능제 항체로 처리된 마우스에서, 설사 및 체중 감소로 이어지는 장 염증성 반응이 개시되었고, 이것은 이어서 CD115 차단체와의 병용 치료에 의해서 상당히 악화되었다. 항체 조합물(CD115 + CD40 항체) 군의 마우스는 이의 체중의 25% 초과가 감소되었고(도 13B), 빈사상태 외관을 가졌고 일부 경우에 이러한 염증성 반응은 치명적이었다(도 13A 참고). 이에 반해서, mCD115-Fc-CD40L 키메라 단백질로 처리된 마우스는 건강해 보였고, 설사 또는 체중 감소의 어떠한 징후도 발달하지 않았고, 정상적으로 거동하였다(도 13A 및 도 13B).
종합하면, 이러한 데이터는, mCD115-Fc-CD40L 키메라 단백질로의 처리가 CD115 차단 항체 단독, CD40 효능제 항체 단독, 또는 CD115 차단 항체와 CD40 효능제 항체의 조합물보다 상당히 더 높은 비율의 완전한 종양 거부로 이어졌다는 것을 나타낸다. 더 추가로, 키메라 단백질로의 처리는, 마우스에 공동 투여되는 경우 매우 독성이고, 치명적 장 염증 및 설사를 초래한 항체로의 처리와 비교할 때 향상된 안전성 프로파일을 제공하였다.
실시예 14: 키메라 단백질의 기능성에 대한, 링커 내의 Fc 도메인의 기여의 특징규명
본 실시예에서, 본 발명의 키메라 단백질의 기능성에 대한, 링커 내의 Fc 도메인의 기여를 검정하였다. 여기서, PD1-Fc-OX40L을 Fc-함유 키메라 단백질에 대한 모델로서 사용하였다. 따라서, 하기에 나타낸 데이터는 본 발명의 키메라 단백질과 관련된다.
이의 네이티브 상태에서, PD1은 단량체로서 존재하는 반면, OX40L은 OX40L 도메인들 간의 정전기적 상호작용으로 인해서 이량체화되는 경향이 있고; Fc 도메인은 다이설파이드 결합을 통해서 서로와 회합된다. 함께, 몇몇 분자간 상호작용이 PD1-Fc-OX40L의 4차 구조에 기여할 수 있다. PD1-Fc-OX40L의 적어도 4가지의 가능한 구성이 존재하는데, 키메라 단백질은 단량체, 이량체, 삼량체 또는 육량체로서 존재한다(도 14 참고).
키메라 단백질을 환원 및 비환원 조건에 노출시키고, 이어서 단백질을 SDS-PAGE 상에서 전개시킴으로써 키메라 단백질의 단량체 및 이량체 구성의 존재를 시험하였다. 비환원 조건(환원: "-") 하에서, 키메라 단백질은 SDS-PAGE에서, 약 200kDa으로 이동하였다. 여기서, 웨스턴 블롯을 각각 도 15에 나타낸 좌측, 중간 및 우측 블롯에서, PD1, Fc, 또는 OX40L에 대해서 지향되는 항체로 프로빙하였다. 키메라 단백질의 예측된 단량체 분자량은 57.6kDa이기 때문에, 200kDa 종은 적어도 이량체인 것으로 예측되었다. 그러나, (예를 들어, Fc 도메인 간의) 다이설파이드 결합을 환원시키는 환원 조건(환원: "+") 하에서, 키메라 단백질은 SDS-PAGE에서 약 100kDa으로 이동하였다. 100kDa 종은 예상된 것보다 더 무겁기 때문에, 추가 질량은 글리코실화로 인한 것이라고 예측되었다. 마지막으로, 키메라 단백질을 펩타이드-N-글리코시다제 F로 처리하였고(PNGaseF "+"), 환원 조건 하에서 SDS-PAGE 상에서 전개시켰다. 이러한 조건 하에서, 키메라 단백질은 약 57.6kDa으로 이동되었다. 이러한 데이터는, 키메라 단백질이 글리코실화되고, 자연에서 적어도 이량체로서 존재하는데; 이량체화는 Fc 도메인들 간의 다이설파이드 결합으로 인한 것이라는 것을 시사한다.
SDS-PAGE 젤 방법은 상당히 하전되고/되거나 큰 분자량 단백질에 대해서 분자량을 정확하게 예측하지 않는다. 따라서, 키메라 단백질을 그 다음에 크기 배제 크로마토그래피(SEC)를 사용하여 특징규명하였다. 음으로 하전된 SDS가 펩타이드들 간의 전하-기반 상호작용을 감소시키는 SDS-PAGE와 달리, SEC는 세정제 또는 환원제를 사용하지 않는다. PD1-Fc-OX40L 키메라 단백질을 SEC 상에서 전개시키는 경우, 피크 중 어느 것도 200kDa 근처에 존재하지 않았다. 이는, 본래, 키메라 단백질이 이량체로서 존재하지 않음을 시사한다. 대신, 670kDa을 초과하는 크기를 갖는 피크가 검출되었다(도 16 참고). 이러한 데이터 및 이전 데이터는, PD1-Fc-OX40L 키메라 단백질이 이의 본래 상태에서 육량체로서 존재한다는 것을 시사한다.
상기에 도시된 바와 같이, 비환원 조건 또는 환원 조건 하에서 SDS-PAGE 상에서 전개시키는 경우, 샘플 및/또는 전개 완충액에서 SDS는 육량체 PD1-Fc-OX40L 키메라 단백질을 각각 환원제의 부재 및 존재 하에서 우세한 이량체 또는 단량체로 전환시킨다(도 17 참고(좌측 젤)). 환원제의 부재 하에서 SDS가 결핍된 네이티브 PAGE 상에서 전개시키는 경우, 키메라 단백질은 육량체로서 존재한다. 그러나, 네이티브 PAGE 상에서 환원제(이것은 다이설파이드 결합을 환원시킴)의 존재 하에서 전개시키는 경우, 키메라 단백질은 예상된 것보다 더 무겁게 이동되었는데; 도 17(우측 젤, 레인 #2)에 도시된 바와 같이, 키메라 단백질은 적재 웰로부터 실질적으로 이동하지 않았다. 이러한 데이터는, 키메라 단백질이 고차 단백질로 올리고머화되었다는 것을 시사한다. 따라서, 키메라 단백질에서, 다이설파이드 결합이 고차 올리고머화의 제어에 중요한 것으로 보인다.
이를 추가로 확인하기 위해서, Fc 도메인이 결핍된 키메라 단백질, 예를 들어, "PD1-No Fc-OX40L"을 작제하였다. 이러한 키메라 단백질은 상기에 기술된 바와 같이 키메라 단백질에서 Fc 도메인 간에 발생하는 다이설파이드 결합을 갖지 않을 것이다. 도 18에 도시된 바와 같이, Fc 도메인이 결핍된 키메라 단백질을 네이티브 PAGE 상에서 전개시키는 경우, 단백질 중 어느 것도 이의 적재 웰로부터 실질적으로 이동하지 않았는데(레인 #1 내지 # 4는 PD1-No Fc-OX40L의 증가하는 적재 농도를 나타냄); 이는 다시 "No Fc" 키메라 단백질이 다수의 단백질을 포함하는 콘카티머-유사 복합체를 형성하였다는 것을 시사한다. 따라서, 키메라 단백질에서 Fc 도메인의 누락은 단백질 응집물의 형성으로 이어진다. 이러한 데이터는, 예를 들어, 상이한 키메라 단백질 상의 Fc 도메인 간의 다이설파이드 결합이 키메라 단백질을 안정화시키고, 이것은 각각 고차 단백질/콘카티머로서가 아니라 육량체로서 존재하는 것을 보장한다는 것을 나타낸다. 즉, Fc 도메인은 놀랍게도 키메라 단백질 복합체를 유발한다. 레인 #1 내지 #4는 각각 2.5㎍의 PD1-No Fc-OX40L, 5㎍의 PD1-No Fc-OX40L, 7.5㎍의 PD1-No Fc-OX40L, 및 10㎍의 PD1-No Fc-OX40L을 포함한다.
도 19에 상기 데이터를 요약하고, 육량체 및 콘카타머가 본 발명의 키메라 단백질로부터 형성되는 방법을 나타낸 모델을 나타낸다. 예시적인 키메라 단백질(PD1-Fc-OX40L)은 (OX40L 도메인들 간의 정전기적 상호작용 및 Fc 도메인에 의한 이량체화로 인해서) 본래 육량체로 형성된다. 그러나, Fc 도메인들 간의 다이설파이드 결합의 제어 효과의 부재 하에서는, PD1-Fc-OX40L 단백질의 경우 환원 조건 하에서 그리고 PD1-No Fc-OX40L에서의 Fc 도메인의 부재로 인해서, 이러한 후자 키메라 단백질은 콘카타머를 형성한다.
추가로, Fc 도메인(본 명세서에 기술된 바와 같음)을 피콜린(Ficolin)(이것은 키메라 단백질 간의 다이설파이드 결합에 필요한 시스테인 잔기가 결핍됨)으로 대체한 키메라 단백질을 작제하였다. "No Fc" 키메라 단백질 및 Fc를 포함하고, 네이티브 PAGE 상에서 환원제의 존재 하에서 전개된 키메라 단백질(이들 둘 모두는 젤에서 이동하지 않는 응집물을 형성하였음)에서와 같이 피콜린을 포함하는 키메라 단백질은 고차 격자를 또한 형성하는 것으로 보이며, 이것은 젤에서 이동하지 않았다. 이러한 데이터는, 다이설파이드 결합이 본 발명의 키메라 단백질의 적절한 폴딩 및 기능에 중요하다는 결론을 지지한다.
마지막으로, 코일형(coiled) Fc 도메인(CCDFc)을 사용하여 키메라 단백질을 제조하였다. 매우 적은 정제되지 않은 단백질을 기능성 평가 하에서 전달하였다.
따라서, 키메라 단백질의 링커 내에 Fc 도메인을 포함시키는 것은(이것은 키메라 단백질 사이에 다이설파이드 결합을 형성할 수 있음), 불용성 및 가능하게는 비기능성 단백질 콘카타머 및/또는 응집물의 형성을 회피하는 것을 돕는다.
실시예 15: 다른 타입 II 단백질의 세포외 도메인을 포함하는 추가적인 CSF1R-함유 키메라 단백질의 생산
본 실시예에서, 추가적인 본 발명의 키메라 단백질을 기술한다. 이러한 추가적인 키메라 단백질은, CSF1R-Fc-CD40L 키메라 단백질이 제조된 방법과 유사하게, 예를 들어, 상기 상세한 설명 및 이의 내용이 전체적으로 참고로 포함된 미국 특허 출원 제U.S. 62/464,002호에 기술된 바와 같이 제조될 것이다.
이러한 추가적인 키메라 단백질은 하기 일반 화학식을 가질 것이다: ECD 1 - 접합 링커 1 - Fc 도메인 - 접합 링커 2 - ECD 2, 식 중, ECD 1은 CSF1R의 세포외 도메인이고, ECD 2는 CD40L이 아닌, 타입 II 단백질의 세포외 도메인이다. 예시적인 타입 II 단백질은 4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A 및 TRAIL을 포함한다. 이러한 키메라 단백질은 접합 링커 중 하나 또는 둘 모두가 결핍될 수 있다.
이러한 키메라 단백질은 접합 링커 중 하나 또는 둘 모두가 결핍될 수 있다. 예시적인 접합 링커 1s, Fc 도메인, 및 접합 링커 2s를 상기 표 1에 기술하며; 키메라 단백질을 형성하는 데 유용하고, 특정 접합 링커 1s, Fc 도메인, 및 접합 링커 2s를 포함하는 모듈식 링커를 도 20에 나타낸다.
대안적으로, 추가적인 키메라 단백질은 하기 일반 화학식을 갖는 융합 단백질일 것이다: N 말단 - (a) - (b) - (c) - C 말단, 식 중, (a)는 CSF1R이고, (b)는 Fc 도메인의 적어도 일부를 포함하는 링커이고, (c)는 CD40L이 아닌, 타입 II 단백질의 세포외 도메인이다. 예시적인 타입 II 단백질은 4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A, 및 TRAIL을 포함한다.
4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A 및 TRAIL에 대한 아미노산 서열은 각각 서열번호 9, 11, 13, 15, 17, 6, 21 및 23을 포함한다. 4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A 및 TRAIL의 세포외 도메인에 대한 아미노산 서열은 각각 서열번호 10, 12, 14, 16, 18, 7, 22 및 24를 포함한다. CSF1R에 대한 아미노산 서열은 서열번호 1을 포함하고, CSF1R의 세포외 도메인은 서열번호 2를 포함한다. 키메라 단백질은 예를 들어, 상기에 언급된 서열과 적어도 약 95% 동일한 상기에 언급된 서열을 포함할 수 있다.
예시적인 링커를 상기 표 1에 기술하며; 키메라 단백질을 형성하는 데 유용하고, 특정 접합 링커 1s, Fc 도메인, 및 접합 링커 2s를 포함하는 모듈식 링커를 도 20에 나타낸다.
따라서, 본 발명은 하기 추가적인 키메라 단백질 및 (예를 들어, 암을 치료하고/거나 염증성 질환을 치료하는 데 있어서) 추가적인 키메라 단백질을 사용하는 방법을 추가로 포함한다: CSF1R-Fc-4-1BBL, CSF1R-Fc-CD30L, CSF1R-Fc-FasL, CSF1R-Fc-GITRL, CSF1R-Fc-LIGHT, CSF1R-Fc-OX40L, CSF1R-Fc-TL1A 및 CSF1R-Fc-TRAIL.
CSF1R-Fc-CD40L을 특징규명하는 데 필요한 것이 아닌 추가적인 키메라 단백질에 대해서 특이적인 시약(예를 들어, 결합 파트너, 재조합 표적 세포, 및 암 세포/종양 유형)이 존재하지만, 추가적인 키메라 단백질은 실시예 1 내지 13에서 CSF1R-Fc-CD40L에 대해서 상기에 기술된 바와 같이 특징규명될 것이다. 따라서, 예로서, CSF1R-Fc-4-1BBL을 사용하는 경우, 실시예 2와 유사한 CSF1R-Fc-4-1BBL의 특징규명은, CSF1R-Fc-CD40L에 대해서 필요한 항-CSF1R, 항-Fc, 및 항-CD40L 항체가 아니라 항-CSF1R, 항-Fc, 및 항-4-1BBL 항체를 사용하여 수행할 수 있다.
CSF1R-Fc-CD40L 키메라 단백질과 같이, 추가적인 키메라 단백질은, CSF1R(이것은 면역 저해 신호의 전달을 저해함)를 차단하고, 4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A, 및 TRAIL 중 하나의 수용체/리간드의 활성화를 통해서 면역 자극 신호의 전달을 향상, 증가 및/또는 자극함으로써 암을 치료하는 데 그리고/또는 염증성 질환을 치료하는 데 효과적일 것이다. 더욱이, 추가적인 키메라 단백질은, 복수의 항체, 예를 들어, CSF1 또는 IL-34 차단 항체 및 4-1BBL, CD30L, FasL, GITRL, LIGHT, OX40L, TL1A 및 TRAIL 중 하나의 수용체/리간드에 대한 효능제 항체를 포함하는 치료로부터 초래하는 독성 없이 암 및/또는 염증성 질환을 치료하는 데 효과적일 것이다.
SEQUENCE LISTING
<110> SHATTUCK LABS, INC.
<120> CSF1R-BASED CHIMERIC PROTEINS
<130> WO/2018/157164
<140> PCT/US2018/020039
<141> 2018-02-27
<150> US 62/463,997
<151> 2017-02-27
<160> 80
<170> PatentIn version 3.5
<210> 1
<211> 953
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 1
Ile Pro Val Ile Glu Pro Ser Val Pro Glu Leu Val Val Lys Pro Gly
1 5 10 15
Ala Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val Glu Trp Asp
20 25 30
Gly Pro Pro Ser Pro His Trp Thr Leu Tyr Ser Asp Gly Ser Ser Ser
35 40 45
Ile Leu Ser Thr Asn Asn Ala Thr Phe Gln Asn Thr Gly Thr Tyr Arg
50 55 60
Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala Ile His Leu
65 70 75 80
Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala Gln Glu Val
85 90 95
Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu Leu Thr Asp
100 105 110
Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Val Arg Gly Arg Pro
115 120 125
Leu Met Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His Gly Phe Thr
130 135 140
Ile His Arg Ala Lys Phe Ile Gln Ser Gln Asp Tyr Gln Cys Ser Ala
145 150 155 160
Leu Met Gly Gly Arg Lys Val Met Ser Ile Ser Ile Arg Leu Lys Val
165 170 175
Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val Pro Ala Glu
180 185 190
Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys Ser Ala Ser
195 200 205
Ser Val Asp Val Asn Phe Asp Val Phe Leu Gln His Asn Asn Thr Lys
210 215 220
Leu Ala Ile Pro Gln Gln Ser Asp Phe His Asn Asn Arg Tyr Gln Lys
225 230 235 240
Val Leu Thr Leu Asn Leu Asp Gln Val Asp Phe Gln His Ala Gly Asn
245 250 255
Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser Thr Ser Met
260 265 270
Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asn Leu Ser Ser Glu Gln
275 280 285
Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn Leu Lys Val
290 295 300
Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp Thr Tyr Leu
305 310 315 320
Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala Asn Ala Thr
325 330 335
Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu Pro Arg Leu
340 345 350
Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg Asn Pro Gly
355 360 365
Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr Pro Pro Glu
370 375 380
Val Ser Val Ile Trp Thr Phe Ile Asn Gly Ser Gly Thr Leu Leu Cys
385 390 395 400
Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu Gln Cys Ser
405 410 415
Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln Val Trp Asp
420 425 430
Asp Pro Tyr Pro Glu Val Leu Ser Gln Glu Pro Phe His Lys Val Thr
435 440 445
Val Gln Ser Leu Leu Thr Val Glu Thr Leu Glu His Asn Gln Thr Tyr
450 455 460
Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp Ala Phe Ile
465 470 475 480
Pro Ile Ser Ala Gly Ala His Thr His Pro Pro Asp Glu Phe Leu Phe
485 490 495
Thr Pro Val Val Val Ala Cys Met Ser Ile Met Ala Leu Leu Leu Leu
500 505 510
Leu Leu Leu Leu Leu Leu Tyr Lys Tyr Lys Gln Lys Pro Lys Tyr Gln
515 520 525
Val Arg Trp Lys Ile Ile Glu Ser Tyr Glu Gly Asn Ser Tyr Thr Phe
530 535 540
Ile Asp Pro Thr Gln Leu Pro Tyr Asn Glu Lys Trp Glu Phe Pro Arg
545 550 555 560
Asn Asn Leu Gln Phe Gly Lys Thr Leu Gly Ala Gly Ala Phe Gly Lys
565 570 575
Val Val Glu Ala Thr Ala Phe Gly Leu Gly Lys Glu Asp Ala Val Leu
580 585 590
Lys Val Ala Val Lys Met Leu Lys Ser Thr Ala His Ala Asp Glu Lys
595 600 605
Glu Ala Leu Met Ser Glu Leu Lys Ile Met Ser His Leu Gly Gln His
610 615 620
Glu Asn Ile Val Asn Leu Leu Gly Ala Cys Thr His Gly Gly Pro Val
625 630 635 640
Leu Val Ile Thr Glu Tyr Cys Cys Tyr Gly Asp Leu Leu Asn Phe Leu
645 650 655
Arg Arg Lys Ala Glu Ala Met Leu Gly Pro Ser Leu Ser Pro Gly Gln
660 665 670
Asp Pro Glu Gly Gly Val Asp Tyr Lys Asn Ile His Leu Glu Lys Lys
675 680 685
Tyr Val Arg Arg Asp Ser Gly Phe Ser Ser Gln Gly Val Asp Thr Tyr
690 695 700
Val Glu Met Arg Pro Val Ser Thr Ser Ser Asn Asp Ser Phe Ser Glu
705 710 715 720
Gln Asp Leu Asp Lys Glu Asp Gly Arg Pro Leu Glu Leu Arg Asp Leu
725 730 735
Leu His Phe Ser Ser Gln Val Ala Gln Gly Met Ala Phe Leu Ala Ser
740 745 750
Lys Asn Cys Ile His Arg Asp Val Ala Ala Arg Asn Val Leu Leu Thr
755 760 765
Asn Gly His Val Ala Lys Ile Gly Asp Phe Gly Leu Ala Arg Asp Ile
770 775 780
Met Asn Asp Ser Asn Tyr Ile Val Lys Gly Asn Ala Arg Leu Pro Val
785 790 795 800
Lys Trp Met Ala Pro Glu Ser Ile Phe Asp Cys Val Tyr Thr Val Gln
805 810 815
Ser Asp Val Trp Ser Tyr Gly Ile Leu Leu Trp Glu Ile Phe Ser Leu
820 825 830
Gly Leu Asn Pro Tyr Pro Gly Ile Leu Val Asn Ser Lys Phe Tyr Lys
835 840 845
Leu Val Lys Asp Gly Tyr Gln Met Ala Gln Pro Ala Phe Ala Pro Lys
850 855 860
Asn Ile Tyr Ser Ile Met Gln Ala Cys Trp Ala Leu Glu Pro Thr His
865 870 875 880
Arg Pro Thr Phe Gln Gln Ile Cys Ser Phe Leu Gln Glu Gln Ala Gln
885 890 895
Glu Asp Arg Arg Glu Arg Asp Tyr Thr Asn Leu Pro Ser Ser Ser Arg
900 905 910
Ser Gly Gly Ser Gly Ser Ser Ser Ser Glu Leu Glu Glu Glu Ser Ser
915 920 925
Ser Glu His Leu Thr Cys Cys Glu Gln Gly Asp Ile Ala Gln Pro Leu
930 935 940
Leu Gln Pro Asn Asn Tyr Gln Phe Cys
945 950
<210> 2
<211> 498
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 2
Ile Pro Val Ile Glu Pro Ser Val Pro Glu Leu Val Val Lys Pro Gly
1 5 10 15
Ala Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val Glu Trp Asp
20 25 30
Gly Pro Pro Ser Pro His Trp Thr Leu Tyr Ser Asp Gly Ser Ser Ser
35 40 45
Ile Leu Ser Thr Asn Asn Ala Thr Phe Gln Asn Thr Gly Thr Tyr Arg
50 55 60
Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala Ile His Leu
65 70 75 80
Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala Gln Glu Val
85 90 95
Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu Leu Thr Asp
100 105 110
Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Val Arg Gly Arg Pro
115 120 125
Leu Met Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His Gly Phe Thr
130 135 140
Ile His Arg Ala Lys Phe Ile Gln Ser Gln Asp Tyr Gln Cys Ser Ala
145 150 155 160
Leu Met Gly Gly Arg Lys Val Met Ser Ile Ser Ile Arg Leu Lys Val
165 170 175
Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val Pro Ala Glu
180 185 190
Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys Ser Ala Ser
195 200 205
Ser Val Asp Val Asn Phe Asp Val Phe Leu Gln His Asn Asn Thr Lys
210 215 220
Leu Ala Ile Pro Gln Gln Ser Asp Phe His Asn Asn Arg Tyr Gln Lys
225 230 235 240
Val Leu Thr Leu Asn Leu Asp Gln Val Asp Phe Gln His Ala Gly Asn
245 250 255
Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser Thr Ser Met
260 265 270
Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asn Leu Ser Ser Glu Gln
275 280 285
Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn Leu Lys Val
290 295 300
Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp Thr Tyr Leu
305 310 315 320
Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala Asn Ala Thr
325 330 335
Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu Pro Arg Leu
340 345 350
Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg Asn Pro Gly
355 360 365
Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr Pro Pro Glu
370 375 380
Val Ser Val Ile Trp Thr Phe Ile Asn Gly Ser Gly Thr Leu Leu Cys
385 390 395 400
Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu Gln Cys Ser
405 410 415
Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln Val Trp Asp
420 425 430
Asp Pro Tyr Pro Glu Val Leu Ser Gln Glu Pro Phe His Lys Val Thr
435 440 445
Val Gln Ser Leu Leu Thr Val Glu Thr Leu Glu His Asn Gln Thr Tyr
450 455 460
Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp Ala Phe Ile
465 470 475 480
Pro Ile Ser Ala Gly Ala His Thr His Pro Pro Asp Glu Phe Leu Phe
485 490 495
Thr Pro
<210> 3
<211> 261
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 3
Met Ile Glu Thr Tyr Asn Gln Thr Ser Pro Arg Ser Ala Ala Thr Gly
1 5 10 15
Leu Pro Ile Ser Met Lys Ile Phe Met Tyr Leu Leu Thr Val Phe Leu
20 25 30
Ile Thr Gln Met Ile Gly Ser Ala Leu Phe Ala Val Tyr Leu His Arg
35 40 45
Arg Leu Asp Lys Ile Glu Asp Glu Arg Asn Leu His Glu Asp Phe Val
50 55 60
Phe Met Lys Thr Ile Gln Arg Cys Asn Thr Gly Glu Arg Ser Leu Ser
65 70 75 80
Leu Leu Asn Cys Glu Glu Ile Lys Ser Gln Phe Glu Gly Phe Val Lys
85 90 95
Asp Ile Met Leu Asn Lys Glu Glu Thr Lys Lys Glu Asn Ser Phe Glu
100 105 110
Met Gln Lys Gly Asp Gln Asn Pro Gln Ile Ala Ala His Val Ile Ser
115 120 125
Glu Ala Ser Ser Lys Thr Thr Ser Val Leu Gln Trp Ala Glu Lys Gly
130 135 140
Tyr Tyr Thr Met Ser Asn Asn Leu Val Thr Leu Glu Asn Gly Lys Gln
145 150 155 160
Leu Thr Val Lys Arg Gln Gly Leu Tyr Tyr Ile Tyr Ala Gln Val Thr
165 170 175
Phe Cys Ser Asn Arg Glu Ala Ser Ser Gln Ala Pro Phe Ile Ala Ser
180 185 190
Leu Cys Leu Lys Ser Pro Gly Arg Phe Glu Arg Ile Leu Leu Arg Ala
195 200 205
Ala Asn Thr His Ser Ser Ala Lys Pro Cys Gly Gln Gln Ser Ile His
210 215 220
Leu Gly Gly Val Phe Glu Leu Gln Pro Gly Ala Ser Val Phe Val Asn
225 230 235 240
Val Thr Asp Pro Ser Gln Val Ser His Gly Thr Gly Phe Thr Ser Phe
245 250 255
Gly Leu Leu Lys Leu
260
<210> 4
<211> 215
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 4
His Arg Arg Leu Asp Lys Ile Glu Asp Glu Arg Asn Leu His Glu Asp
1 5 10 15
Phe Val Phe Met Lys Thr Ile Gln Arg Cys Asn Thr Gly Glu Arg Ser
20 25 30
Leu Ser Leu Leu Asn Cys Glu Glu Ile Lys Ser Gln Phe Glu Gly Phe
35 40 45
Val Lys Asp Ile Met Leu Asn Lys Glu Glu Thr Lys Lys Glu Asn Ser
50 55 60
Phe Glu Met Gln Lys Gly Asp Gln Asn Pro Gln Ile Ala Ala His Val
65 70 75 80
Ile Ser Glu Ala Ser Ser Lys Thr Thr Ser Val Leu Gln Trp Ala Glu
85 90 95
Lys Gly Tyr Tyr Thr Met Ser Asn Asn Leu Val Thr Leu Glu Asn Gly
100 105 110
Lys Gln Leu Thr Val Lys Arg Gln Gly Leu Tyr Tyr Ile Tyr Ala Gln
115 120 125
Val Thr Phe Cys Ser Asn Arg Glu Ala Ser Ser Gln Ala Pro Phe Ile
130 135 140
Ala Ser Leu Cys Leu Lys Ser Pro Gly Arg Phe Glu Arg Ile Leu Leu
145 150 155 160
Arg Ala Ala Asn Thr His Ser Ser Ala Lys Pro Cys Gly Gln Gln Ser
165 170 175
Ile His Leu Gly Gly Val Phe Glu Leu Gln Pro Gly Ala Ser Val Phe
180 185 190
Val Asn Val Thr Asp Pro Ser Gln Val Ser His Gly Thr Gly Phe Thr
195 200 205
Ser Phe Gly Leu Leu Lys Leu
210 215
<210> 5
<211> 947
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 5
Ile Pro Val Ile Glu Pro Ser Val Pro Glu Leu Val Val Lys Pro Gly
1 5 10 15
Ala Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val Glu Trp Asp
20 25 30
Gly Pro Pro Ser Pro His Trp Thr Leu Tyr Ser Asp Gly Ser Ser Ser
35 40 45
Ile Leu Ser Thr Asn Asn Ala Thr Phe Gln Asn Thr Gly Thr Tyr Arg
50 55 60
Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala Ile His Leu
65 70 75 80
Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala Gln Glu Val
85 90 95
Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu Leu Thr Asp
100 105 110
Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Val Arg Gly Arg Pro
115 120 125
Leu Met Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His Gly Phe Thr
130 135 140
Ile His Arg Ala Lys Phe Ile Gln Ser Gln Asp Tyr Gln Cys Ser Ala
145 150 155 160
Leu Met Gly Gly Arg Lys Val Met Ser Ile Ser Ile Arg Leu Lys Val
165 170 175
Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val Pro Ala Glu
180 185 190
Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys Ser Ala Ser
195 200 205
Ser Val Asp Val Asn Phe Asp Val Phe Leu Gln His Asn Asn Thr Lys
210 215 220
Leu Ala Ile Pro Gln Gln Ser Asp Phe His Asn Asn Arg Tyr Gln Lys
225 230 235 240
Val Leu Thr Leu Asn Leu Asp Gln Val Asp Phe Gln His Ala Gly Asn
245 250 255
Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser Thr Ser Met
260 265 270
Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asn Leu Ser Ser Glu Gln
275 280 285
Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn Leu Lys Val
290 295 300
Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp Thr Tyr Leu
305 310 315 320
Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala Asn Ala Thr
325 330 335
Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu Pro Arg Leu
340 345 350
Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg Asn Pro Gly
355 360 365
Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr Pro Pro Glu
370 375 380
Val Ser Val Ile Trp Thr Phe Ile Asn Gly Ser Gly Thr Leu Leu Cys
385 390 395 400
Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu Gln Cys Ser
405 410 415
Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln Val Trp Asp
420 425 430
Asp Pro Tyr Pro Glu Val Leu Ser Gln Glu Pro Phe His Lys Val Thr
435 440 445
Val Gln Ser Leu Leu Thr Val Glu Thr Leu Glu His Asn Gln Thr Tyr
450 455 460
Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp Ala Phe Ile
465 470 475 480
Pro Ile Ser Ala Gly Ala His Thr His Pro Pro Asp Glu Phe Leu Phe
485 490 495
Thr Pro Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu
500 505 510
Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
515 520 525
Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
530 535 540
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
545 550 555 560
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
565 570 575
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
580 585 590
Leu Ser Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro
595 600 605
Ser Ser Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu
610 615 620
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
625 630 635 640
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
645 650 655
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
660 665 670
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
675 680 685
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
690 695 700
Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
705 710 715 720
Ser Leu Ser Leu Gly Lys Ile Glu Gly Arg Met Asp His Arg Arg Leu
725 730 735
Asp Lys Ile Glu Asp Glu Arg Asn Leu His Glu Asp Phe Val Phe Met
740 745 750
Lys Thr Ile Gln Arg Cys Asn Thr Gly Glu Arg Ser Leu Ser Leu Leu
755 760 765
Asn Cys Glu Glu Ile Lys Ser Gln Phe Glu Gly Phe Val Lys Asp Ile
770 775 780
Met Leu Asn Lys Glu Glu Thr Lys Lys Glu Asn Ser Phe Glu Met Gln
785 790 795 800
Lys Gly Asp Gln Asn Pro Gln Ile Ala Ala His Val Ile Ser Glu Ala
805 810 815
Ser Ser Lys Thr Thr Ser Val Leu Gln Trp Ala Glu Lys Gly Tyr Tyr
820 825 830
Thr Met Ser Asn Asn Leu Val Thr Leu Glu Asn Gly Lys Gln Leu Thr
835 840 845
Val Lys Arg Gln Gly Leu Tyr Tyr Ile Tyr Ala Gln Val Thr Phe Cys
850 855 860
Ser Asn Arg Glu Ala Ser Ser Gln Ala Pro Phe Ile Ala Ser Leu Cys
865 870 875 880
Leu Lys Ser Pro Gly Arg Phe Glu Arg Ile Leu Leu Arg Ala Ala Asn
885 890 895
Thr His Ser Ser Ala Lys Pro Cys Gly Gln Gln Ser Ile His Leu Gly
900 905 910
Gly Val Phe Glu Leu Gln Pro Gly Ala Ser Val Phe Val Asn Val Thr
915 920 925
Asp Pro Ser Gln Val Ser His Gly Thr Gly Phe Thr Ser Phe Gly Leu
930 935 940
Leu Lys Leu
945
<210> 6
<211> 183
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 6
Met Glu Arg Val Gln Pro Leu Glu Glu Asn Val Gly Asn Ala Ala Arg
1 5 10 15
Pro Arg Phe Glu Arg Asn Lys Leu Leu Leu Val Ala Ser Val Ile Gln
20 25 30
Gly Leu Gly Leu Leu Leu Cys Phe Thr Tyr Ile Cys Leu His Phe Ser
35 40 45
Ala Leu Gln Val Ser His Arg Tyr Pro Arg Ile Gln Ser Ile Lys Val
50 55 60
Gln Phe Thr Glu Tyr Lys Lys Glu Lys Gly Phe Ile Leu Thr Ser Gln
65 70 75 80
Lys Glu Asp Glu Ile Met Lys Val Gln Asn Asn Ser Val Ile Ile Asn
85 90 95
Cys Asp Gly Phe Tyr Leu Ile Ser Leu Lys Gly Tyr Phe Ser Gln Glu
100 105 110
Val Asn Ile Ser Leu His Tyr Gln Lys Asp Glu Glu Pro Leu Phe Gln
115 120 125
Leu Lys Lys Val Arg Ser Val Asn Ser Leu Met Val Ala Ser Leu Thr
130 135 140
Tyr Lys Asp Lys Val Tyr Leu Asn Val Thr Thr Asp Asn Thr Ser Leu
145 150 155 160
Asp Asp Phe His Val Asn Gly Gly Glu Leu Ile Leu Ile His Gln Asn
165 170 175
Pro Gly Glu Phe Cys Val Leu
180
<210> 7
<211> 133
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 7
Gln Val Ser His Arg Tyr Pro Arg Ile Gln Ser Ile Lys Val Gln Phe
1 5 10 15
Thr Glu Tyr Lys Lys Glu Lys Gly Phe Ile Leu Thr Ser Gln Lys Glu
20 25 30
Asp Glu Ile Met Lys Val Gln Asn Asn Ser Val Ile Ile Asn Cys Asp
35 40 45
Gly Phe Tyr Leu Ile Ser Leu Lys Gly Tyr Phe Ser Gln Glu Val Asn
50 55 60
Ile Ser Leu His Tyr Gln Lys Asp Glu Glu Pro Leu Phe Gln Leu Lys
65 70 75 80
Lys Val Arg Ser Val Asn Ser Leu Met Val Ala Ser Leu Thr Tyr Lys
85 90 95
Asp Lys Val Tyr Leu Asn Val Thr Thr Asp Asn Thr Ser Leu Asp Asp
100 105 110
Phe His Val Asn Gly Gly Glu Leu Ile Leu Ile His Gln Asn Pro Gly
115 120 125
Glu Phe Cys Val Leu
130
<210> 8
<211> 865
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 8
Ile Pro Val Ile Glu Pro Ser Val Pro Glu Leu Val Val Lys Pro Gly
1 5 10 15
Ala Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val Glu Trp Asp
20 25 30
Gly Pro Pro Ser Pro His Trp Thr Leu Tyr Ser Asp Gly Ser Ser Ser
35 40 45
Ile Leu Ser Thr Asn Asn Ala Thr Phe Gln Asn Thr Gly Thr Tyr Arg
50 55 60
Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala Ile His Leu
65 70 75 80
Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala Gln Glu Val
85 90 95
Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu Leu Thr Asp
100 105 110
Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Val Arg Gly Arg Pro
115 120 125
Leu Met Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His Gly Phe Thr
130 135 140
Ile His Arg Ala Lys Phe Ile Gln Ser Gln Asp Tyr Gln Cys Ser Ala
145 150 155 160
Leu Met Gly Gly Arg Lys Val Met Ser Ile Ser Ile Arg Leu Lys Val
165 170 175
Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val Pro Ala Glu
180 185 190
Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys Ser Ala Ser
195 200 205
Ser Val Asp Val Asn Phe Asp Val Phe Leu Gln His Asn Asn Thr Lys
210 215 220
Leu Ala Ile Pro Gln Gln Ser Asp Phe His Asn Asn Arg Tyr Gln Lys
225 230 235 240
Val Leu Thr Leu Asn Leu Asp Gln Val Asp Phe Gln His Ala Gly Asn
245 250 255
Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser Thr Ser Met
260 265 270
Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asn Leu Ser Ser Glu Gln
275 280 285
Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn Leu Lys Val
290 295 300
Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp Thr Tyr Leu
305 310 315 320
Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala Asn Ala Thr
325 330 335
Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu Pro Arg Leu
340 345 350
Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg Asn Pro Gly
355 360 365
Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr Pro Pro Glu
370 375 380
Val Ser Val Ile Trp Thr Phe Ile Asn Gly Ser Gly Thr Leu Leu Cys
385 390 395 400
Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu Gln Cys Ser
405 410 415
Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln Val Trp Asp
420 425 430
Asp Pro Tyr Pro Glu Val Leu Ser Gln Glu Pro Phe His Lys Val Thr
435 440 445
Val Gln Ser Leu Leu Thr Val Glu Thr Leu Glu His Asn Gln Thr Tyr
450 455 460
Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp Ala Phe Ile
465 470 475 480
Pro Ile Ser Ala Gly Ala His Thr His Pro Pro Asp Glu Phe Leu Phe
485 490 495
Thr Pro Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu
500 505 510
Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
515 520 525
Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
530 535 540
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
545 550 555 560
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
565 570 575
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
580 585 590
Leu Ser Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro
595 600 605
Ser Ser Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu
610 615 620
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
625 630 635 640
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
645 650 655
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
660 665 670
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
675 680 685
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
690 695 700
Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
705 710 715 720
Ser Leu Ser Leu Gly Lys Ile Glu Gly Arg Met Asp Gln Val Ser His
725 730 735
Arg Tyr Pro Arg Ile Gln Ser Ile Lys Val Gln Phe Thr Glu Tyr Lys
740 745 750
Lys Glu Lys Gly Phe Ile Leu Thr Ser Gln Lys Glu Asp Glu Ile Met
755 760 765
Lys Val Gln Asn Asn Ser Val Ile Ile Asn Cys Asp Gly Phe Tyr Leu
770 775 780
Ile Ser Leu Lys Gly Tyr Phe Ser Gln Glu Val Asn Ile Ser Leu His
785 790 795 800
Tyr Gln Lys Asp Glu Glu Pro Leu Phe Gln Leu Lys Lys Val Arg Ser
805 810 815
Val Asn Ser Leu Met Val Ala Ser Leu Thr Tyr Lys Asp Lys Val Tyr
820 825 830
Leu Asn Val Thr Thr Asp Asn Thr Ser Leu Asp Asp Phe His Val Asn
835 840 845
Gly Gly Glu Leu Ile Leu Ile His Gln Asn Pro Gly Glu Phe Cys Val
850 855 860
Leu
865
<210> 9
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 9
Met Glu Tyr Ala Ser Asp Ala Ser Leu Asp Pro Glu Ala Pro Trp Pro
1 5 10 15
Pro Ala Pro Arg Ala Arg Ala Cys Arg Val Leu Pro Trp Ala Leu Val
20 25 30
Ala Gly Leu Leu Leu Leu Leu Leu Leu Ala Ala Ala Cys Ala Val Phe
35 40 45
Leu Ala Cys Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser
50 55 60
Ala Ala Ser Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp
65 70 75 80
Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val
85 90 95
Ala Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp
100 105 110
Pro Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu
115 120 125
Asp Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe
130 135 140
Phe Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser
145 150 155 160
Val Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala
165 170 175
Ala Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala
180 185 190
Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala
195 200 205
Gly Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg His
210 215 220
Ala Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val
225 230 235 240
Thr Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
245 250
<210> 10
<211> 205
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 10
Ala Cys Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser Ala
1 5 10 15
Ala Ser Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro
20 25 30
Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala
35 40 45
Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro
50 55 60
Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp
65 70 75 80
Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe
85 90 95
Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val
100 105 110
Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala
115 120 125
Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg
130 135 140
Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly
145 150 155 160
Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala
165 170 175
Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr
180 185 190
Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
195 200 205
<210> 11
<211> 234
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 11
Met Asp Pro Gly Leu Gln Gln Ala Leu Asn Gly Met Ala Pro Pro Gly
1 5 10 15
Asp Thr Ala Met His Val Pro Ala Gly Ser Val Ala Ser His Leu Gly
20 25 30
Thr Thr Ser Arg Ser Tyr Phe Tyr Leu Thr Thr Ala Thr Leu Ala Leu
35 40 45
Cys Leu Val Phe Thr Val Ala Thr Ile Met Val Leu Val Val Gln Arg
50 55 60
Thr Asp Ser Ile Pro Asn Ser Pro Asp Asn Val Pro Leu Lys Gly Gly
65 70 75 80
Asn Cys Ser Glu Asp Leu Leu Cys Ile Leu Lys Arg Ala Pro Phe Lys
85 90 95
Lys Ser Trp Ala Tyr Leu Gln Val Ala Lys His Leu Asn Lys Thr Lys
100 105 110
Leu Ser Trp Asn Lys Asp Gly Ile Leu His Gly Val Arg Tyr Gln Asp
115 120 125
Gly Asn Leu Val Ile Gln Phe Pro Gly Leu Tyr Phe Ile Ile Cys Gln
130 135 140
Leu Gln Phe Leu Val Gln Cys Pro Asn Asn Ser Val Asp Leu Lys Leu
145 150 155 160
Glu Leu Leu Ile Asn Lys His Ile Lys Lys Gln Ala Leu Val Thr Val
165 170 175
Cys Glu Ser Gly Met Gln Thr Lys His Val Tyr Gln Asn Leu Ser Gln
180 185 190
Phe Leu Leu Asp Tyr Leu Gln Val Asn Thr Thr Ile Ser Val Asn Val
195 200 205
Asp Thr Phe Gln Tyr Ile Asp Thr Ser Thr Phe Pro Leu Glu Asn Val
210 215 220
Leu Ser Ile Phe Leu Tyr Ser Asn Ser Asp
225 230
<210> 12
<211> 172
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 12
Gln Arg Thr Asp Ser Ile Pro Asn Ser Pro Asp Asn Val Pro Leu Lys
1 5 10 15
Gly Gly Asn Cys Ser Glu Asp Leu Leu Cys Ile Leu Lys Arg Ala Pro
20 25 30
Phe Lys Lys Ser Trp Ala Tyr Leu Gln Val Ala Lys His Leu Asn Lys
35 40 45
Thr Lys Leu Ser Trp Asn Lys Asp Gly Ile Leu His Gly Val Arg Tyr
50 55 60
Gln Asp Gly Asn Leu Val Ile Gln Phe Pro Gly Leu Tyr Phe Ile Ile
65 70 75 80
Cys Gln Leu Gln Phe Leu Val Gln Cys Pro Asn Asn Ser Val Asp Leu
85 90 95
Lys Leu Glu Leu Leu Ile Asn Lys His Ile Lys Lys Gln Ala Leu Val
100 105 110
Thr Val Cys Glu Ser Gly Met Gln Thr Lys His Val Tyr Gln Asn Leu
115 120 125
Ser Gln Phe Leu Leu Asp Tyr Leu Gln Val Asn Thr Thr Ile Ser Val
130 135 140
Asn Val Asp Thr Phe Gln Tyr Ile Asp Thr Ser Thr Phe Pro Leu Glu
145 150 155 160
Asn Val Leu Ser Ile Phe Leu Tyr Ser Asn Ser Asp
165 170
<210> 13
<211> 281
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 13
Met Gln Gln Pro Phe Asn Tyr Pro Tyr Pro Gln Ile Tyr Trp Val Asp
1 5 10 15
Ser Ser Ala Ser Ser Pro Trp Ala Pro Pro Gly Thr Val Leu Pro Cys
20 25 30
Pro Thr Ser Val Pro Arg Arg Pro Gly Gln Arg Arg Pro Pro Pro Pro
35 40 45
Pro Pro Pro Pro Pro Leu Pro Pro Pro Pro Pro Pro Pro Pro Leu Pro
50 55 60
Pro Leu Pro Leu Pro Pro Leu Lys Lys Arg Gly Asn His Ser Thr Gly
65 70 75 80
Leu Cys Leu Leu Val Met Phe Phe Met Val Leu Val Ala Leu Val Gly
85 90 95
Leu Gly Leu Gly Met Phe Gln Leu Phe His Leu Gln Lys Glu Leu Ala
100 105 110
Glu Leu Arg Glu Ser Thr Ser Gln Met His Thr Ala Ser Ser Leu Glu
115 120 125
Lys Gln Ile Gly His Pro Ser Pro Pro Pro Glu Lys Lys Glu Leu Arg
130 135 140
Lys Val Ala His Leu Thr Gly Lys Ser Asn Ser Arg Ser Met Pro Leu
145 150 155 160
Glu Trp Glu Asp Thr Tyr Gly Ile Val Leu Leu Ser Gly Val Lys Tyr
165 170 175
Lys Lys Gly Gly Leu Val Ile Asn Glu Thr Gly Leu Tyr Phe Val Tyr
180 185 190
Ser Lys Val Tyr Phe Arg Gly Gln Ser Cys Asn Asn Leu Pro Leu Ser
195 200 205
His Lys Val Tyr Met Arg Asn Ser Lys Tyr Pro Gln Asp Leu Val Met
210 215 220
Met Glu Gly Lys Met Met Ser Tyr Cys Thr Thr Gly Gln Met Trp Ala
225 230 235 240
Arg Ser Ser Tyr Leu Gly Ala Val Phe Asn Leu Thr Ser Ala Asp His
245 250 255
Leu Tyr Val Asn Val Ser Glu Leu Ser Leu Val Asn Phe Glu Glu Ser
260 265 270
Gln Thr Phe Phe Gly Leu Tyr Lys Leu
275 280
<210> 14
<211> 179
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 14
Gln Leu Phe His Leu Gln Lys Glu Leu Ala Glu Leu Arg Glu Ser Thr
1 5 10 15
Ser Gln Met His Thr Ala Ser Ser Leu Glu Lys Gln Ile Gly His Pro
20 25 30
Ser Pro Pro Pro Glu Lys Lys Glu Leu Arg Lys Val Ala His Leu Thr
35 40 45
Gly Lys Ser Asn Ser Arg Ser Met Pro Leu Glu Trp Glu Asp Thr Tyr
50 55 60
Gly Ile Val Leu Leu Ser Gly Val Lys Tyr Lys Lys Gly Gly Leu Val
65 70 75 80
Ile Asn Glu Thr Gly Leu Tyr Phe Val Tyr Ser Lys Val Tyr Phe Arg
85 90 95
Gly Gln Ser Cys Asn Asn Leu Pro Leu Ser His Lys Val Tyr Met Arg
100 105 110
Asn Ser Lys Tyr Pro Gln Asp Leu Val Met Met Glu Gly Lys Met Met
115 120 125
Ser Tyr Cys Thr Thr Gly Gln Met Trp Ala Arg Ser Ser Tyr Leu Gly
130 135 140
Ala Val Phe Asn Leu Thr Ser Ala Asp His Leu Tyr Val Asn Val Ser
145 150 155 160
Glu Leu Ser Leu Val Asn Phe Glu Glu Ser Gln Thr Phe Phe Gly Leu
165 170 175
Tyr Lys Leu
<210> 15
<211> 199
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 15
Met Thr Leu His Pro Ser Pro Ile Thr Cys Glu Phe Leu Phe Ser Thr
1 5 10 15
Ala Leu Ile Ser Pro Lys Met Cys Leu Ser His Leu Glu Asn Met Pro
20 25 30
Leu Ser His Ser Arg Thr Gln Gly Ala Gln Arg Ser Ser Trp Lys Leu
35 40 45
Trp Leu Phe Cys Ser Ile Val Met Leu Leu Phe Leu Cys Ser Phe Ser
50 55 60
Trp Leu Ile Phe Ile Phe Leu Gln Leu Glu Thr Ala Lys Glu Pro Cys
65 70 75 80
Met Ala Lys Phe Gly Pro Leu Pro Ser Lys Trp Gln Met Ala Ser Ser
85 90 95
Glu Pro Pro Cys Val Asn Lys Val Ser Asp Trp Lys Leu Glu Ile Leu
100 105 110
Gln Asn Gly Leu Tyr Leu Ile Tyr Gly Gln Val Ala Pro Asn Ala Asn
115 120 125
Tyr Asn Asp Val Ala Pro Phe Glu Val Arg Leu Tyr Lys Asn Lys Asp
130 135 140
Met Ile Gln Thr Leu Thr Asn Lys Ser Lys Ile Gln Asn Val Gly Gly
145 150 155 160
Thr Tyr Glu Leu His Val Gly Asp Thr Ile Asp Leu Ile Phe Asn Ser
165 170 175
Glu His Gln Val Leu Lys Asn Asn Thr Tyr Trp Gly Ile Ile Leu Leu
180 185 190
Ala Asn Pro Gln Phe Ile Ser
195
<210> 16
<211> 128
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 16
Gln Leu Glu Thr Ala Lys Glu Pro Cys Met Ala Lys Phe Gly Pro Leu
1 5 10 15
Pro Ser Lys Trp Gln Met Ala Ser Ser Glu Pro Pro Cys Val Asn Lys
20 25 30
Val Ser Asp Trp Lys Leu Glu Ile Leu Gln Asn Gly Leu Tyr Leu Ile
35 40 45
Tyr Gly Gln Val Ala Pro Asn Ala Asn Tyr Asn Asp Val Ala Pro Phe
50 55 60
Glu Val Arg Leu Tyr Lys Asn Lys Asp Met Ile Gln Thr Leu Thr Asn
65 70 75 80
Lys Ser Lys Ile Gln Asn Val Gly Gly Thr Tyr Glu Leu His Val Gly
85 90 95
Asp Thr Ile Asp Leu Ile Phe Asn Ser Glu His Gln Val Leu Lys Asn
100 105 110
Asn Thr Tyr Trp Gly Ile Ile Leu Leu Ala Asn Pro Gln Phe Ile Ser
115 120 125
<210> 17
<211> 240
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 17
Met Glu Glu Ser Val Val Arg Pro Ser Val Phe Val Val Asp Gly Gln
1 5 10 15
Thr Asp Ile Pro Phe Thr Arg Leu Gly Arg Ser His Arg Arg Gln Ser
20 25 30
Cys Ser Val Ala Arg Val Gly Leu Gly Leu Leu Leu Leu Leu Met Gly
35 40 45
Ala Gly Leu Ala Val Gln Gly Trp Phe Leu Leu Gln Leu His Trp Arg
50 55 60
Leu Gly Glu Met Val Thr Arg Leu Pro Asp Gly Pro Ala Gly Ser Trp
65 70 75 80
Glu Gln Leu Ile Gln Glu Arg Arg Ser His Glu Val Asn Pro Ala Ala
85 90 95
His Leu Thr Gly Ala Asn Ser Ser Leu Thr Gly Ser Gly Gly Pro Leu
100 105 110
Leu Trp Glu Thr Gln Leu Gly Leu Ala Phe Leu Arg Gly Leu Ser Tyr
115 120 125
His Asp Gly Ala Leu Val Val Thr Lys Ala Gly Tyr Tyr Tyr Ile Tyr
130 135 140
Ser Lys Val Gln Leu Gly Gly Val Gly Cys Pro Leu Gly Leu Ala Ser
145 150 155 160
Thr Ile Thr His Gly Leu Tyr Lys Arg Thr Pro Arg Tyr Pro Glu Glu
165 170 175
Leu Glu Leu Leu Val Ser Gln Gln Ser Pro Cys Gly Arg Ala Thr Ser
180 185 190
Ser Ser Arg Val Trp Trp Asp Ser Ser Phe Leu Gly Gly Val Val His
195 200 205
Leu Glu Ala Gly Glu Lys Val Val Val Arg Val Leu Asp Glu Arg Leu
210 215 220
Val Arg Leu Arg Asp Gly Thr Arg Ser Tyr Phe Gly Ala Phe Met Val
225 230 235 240
<210> 18
<211> 182
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 18
Leu Gln Leu His Trp Arg Leu Gly Glu Met Val Thr Arg Leu Pro Asp
1 5 10 15
Gly Pro Ala Gly Ser Trp Glu Gln Leu Ile Gln Glu Arg Arg Ser His
20 25 30
Glu Val Asn Pro Ala Ala His Leu Thr Gly Ala Asn Ser Ser Leu Thr
35 40 45
Gly Ser Gly Gly Pro Leu Leu Trp Glu Thr Gln Leu Gly Leu Ala Phe
50 55 60
Leu Arg Gly Leu Ser Tyr His Asp Gly Ala Leu Val Val Thr Lys Ala
65 70 75 80
Gly Tyr Tyr Tyr Ile Tyr Ser Lys Val Gln Leu Gly Gly Val Gly Cys
85 90 95
Pro Leu Gly Leu Ala Ser Thr Ile Thr His Gly Leu Tyr Lys Arg Thr
100 105 110
Pro Arg Tyr Pro Glu Glu Leu Glu Leu Leu Val Ser Gln Gln Ser Pro
115 120 125
Cys Gly Arg Ala Thr Ser Ser Ser Arg Val Trp Trp Asp Ser Ser Phe
130 135 140
Leu Gly Gly Val Val His Leu Glu Ala Gly Glu Lys Val Val Val Arg
145 150 155 160
Val Leu Asp Glu Arg Leu Val Arg Leu Arg Asp Gly Thr Arg Ser Tyr
165 170 175
Phe Gly Ala Phe Met Val
180
<210> 19
<400> 19
000
<210> 20
<400> 20
000
<210> 21
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 21
Met Ala Glu Asp Leu Gly Leu Ser Phe Gly Glu Thr Ala Ser Val Glu
1 5 10 15
Met Leu Pro Glu His Gly Ser Cys Arg Pro Lys Ala Arg Ser Ser Ser
20 25 30
Ala Arg Trp Ala Leu Thr Cys Cys Leu Val Leu Leu Pro Phe Leu Ala
35 40 45
Gly Leu Thr Thr Tyr Leu Leu Val Ser Gln Leu Arg Ala Gln Gly Glu
50 55 60
Ala Cys Val Gln Phe Gln Ala Leu Lys Gly Gln Glu Phe Ala Pro Ser
65 70 75 80
His Gln Gln Val Tyr Ala Pro Leu Arg Ala Asp Gly Asp Lys Pro Arg
85 90 95
Ala His Leu Thr Val Val Arg Gln Thr Pro Thr Gln His Phe Lys Asn
100 105 110
Gln Phe Pro Ala Leu His Trp Glu His Glu Leu Gly Leu Ala Phe Thr
115 120 125
Lys Asn Arg Met Asn Tyr Thr Asn Lys Phe Leu Leu Ile Pro Glu Ser
130 135 140
Gly Asp Tyr Phe Ile Tyr Ser Gln Val Thr Phe Arg Gly Met Thr Ser
145 150 155 160
Glu Cys Ser Glu Ile Arg Gln Ala Gly Arg Pro Asn Lys Pro Asp Ser
165 170 175
Ile Thr Val Val Ile Thr Lys Val Thr Asp Ser Tyr Pro Glu Pro Thr
180 185 190
Gln Leu Leu Met Gly Thr Lys Ser Val Cys Glu Val Gly Ser Asn Trp
195 200 205
Phe Gln Pro Ile Tyr Leu Gly Ala Met Phe Ser Leu Gln Glu Gly Asp
210 215 220
Lys Leu Met Val Asn Val Ser Asp Ile Ser Leu Val Asp Tyr Thr Lys
225 230 235 240
Glu Asp Lys Thr Phe Phe Gly Ala Phe Leu Leu
245 250
<210> 22
<211> 192
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 22
Arg Ala Gln Gly Glu Ala Cys Val Gln Phe Gln Ala Leu Lys Gly Gln
1 5 10 15
Glu Phe Ala Pro Ser His Gln Gln Val Tyr Ala Pro Leu Arg Ala Asp
20 25 30
Gly Asp Lys Pro Arg Ala His Leu Thr Val Val Arg Gln Thr Pro Thr
35 40 45
Gln His Phe Lys Asn Gln Phe Pro Ala Leu His Trp Glu His Glu Leu
50 55 60
Gly Leu Ala Phe Thr Lys Asn Arg Met Asn Tyr Thr Asn Lys Phe Leu
65 70 75 80
Leu Ile Pro Glu Ser Gly Asp Tyr Phe Ile Tyr Ser Gln Val Thr Phe
85 90 95
Arg Gly Met Thr Ser Glu Cys Ser Glu Ile Arg Gln Ala Gly Arg Pro
100 105 110
Asn Lys Pro Asp Ser Ile Thr Val Val Ile Thr Lys Val Thr Asp Ser
115 120 125
Tyr Pro Glu Pro Thr Gln Leu Leu Met Gly Thr Lys Ser Val Cys Glu
130 135 140
Val Gly Ser Asn Trp Phe Gln Pro Ile Tyr Leu Gly Ala Met Phe Ser
145 150 155 160
Leu Gln Glu Gly Asp Lys Leu Met Val Asn Val Ser Asp Ile Ser Leu
165 170 175
Val Asp Tyr Thr Lys Glu Asp Lys Thr Phe Phe Gly Ala Phe Leu Leu
180 185 190
<210> 23
<211> 281
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 23
Met Ala Met Met Glu Val Gln Gly Gly Pro Ser Leu Gly Gln Thr Cys
1 5 10 15
Val Leu Ile Val Ile Phe Thr Val Leu Leu Gln Ser Leu Cys Val Ala
20 25 30
Val Thr Tyr Val Tyr Phe Thr Asn Glu Leu Lys Gln Met Gln Asp Lys
35 40 45
Tyr Ser Lys Ser Gly Ile Ala Cys Phe Leu Lys Glu Asp Asp Ser Tyr
50 55 60
Trp Asp Pro Asn Asp Glu Glu Ser Met Asn Ser Pro Cys Trp Gln Val
65 70 75 80
Lys Trp Gln Leu Arg Gln Leu Val Arg Lys Met Ile Leu Arg Thr Ser
85 90 95
Glu Glu Thr Ile Ser Thr Val Gln Glu Lys Gln Gln Asn Ile Ser Pro
100 105 110
Leu Val Arg Glu Arg Gly Pro Gln Arg Val Ala Ala His Ile Thr Gly
115 120 125
Thr Arg Gly Arg Ser Asn Thr Leu Ser Ser Pro Asn Ser Lys Asn Glu
130 135 140
Lys Ala Leu Gly Arg Lys Ile Asn Ser Trp Glu Ser Ser Arg Ser Gly
145 150 155 160
His Ser Phe Leu Ser Asn Leu His Leu Arg Asn Gly Glu Leu Val Ile
165 170 175
His Glu Lys Gly Phe Tyr Tyr Ile Tyr Ser Gln Thr Tyr Phe Arg Phe
180 185 190
Gln Glu Glu Ile Lys Glu Asn Thr Lys Asn Asp Lys Gln Met Val Gln
195 200 205
Tyr Ile Tyr Lys Tyr Thr Ser Tyr Pro Asp Pro Ile Leu Leu Met Lys
210 215 220
Ser Ala Arg Asn Ser Cys Trp Ser Lys Asp Ala Glu Tyr Gly Leu Tyr
225 230 235 240
Ser Ile Tyr Gln Gly Gly Ile Phe Glu Leu Lys Glu Asn Asp Arg Ile
245 250 255
Phe Val Ser Val Thr Asn Glu His Leu Ile Asp Met Asp His Glu Ala
260 265 270
Ser Phe Phe Gly Ala Phe Leu Val Gly
275 280
<210> 24
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 24
Thr Asn Glu Leu Lys Gln Met Gln Asp Lys Tyr Ser Lys Ser Gly Ile
1 5 10 15
Ala Cys Phe Leu Lys Glu Asp Asp Ser Tyr Trp Asp Pro Asn Asp Glu
20 25 30
Glu Ser Met Asn Ser Pro Cys Trp Gln Val Lys Trp Gln Leu Arg Gln
35 40 45
Leu Val Arg Lys Met Ile Leu Arg Thr Ser Glu Glu Thr Ile Ser Thr
50 55 60
Val Gln Glu Lys Gln Gln Asn Ile Ser Pro Leu Val Arg Glu Arg Gly
65 70 75 80
Pro Gln Arg Val Ala Ala His Ile Thr Gly Thr Arg Gly Arg Ser Asn
85 90 95
Thr Leu Ser Ser Pro Asn Ser Lys Asn Glu Lys Ala Leu Gly Arg Lys
100 105 110
Ile Asn Ser Trp Glu Ser Ser Arg Ser Gly His Ser Phe Leu Ser Asn
115 120 125
Leu His Leu Arg Asn Gly Glu Leu Val Ile His Glu Lys Gly Phe Tyr
130 135 140
Tyr Ile Tyr Ser Gln Thr Tyr Phe Arg Phe Gln Glu Glu Ile Lys Glu
145 150 155 160
Asn Thr Lys Asn Asp Lys Gln Met Val Gln Tyr Ile Tyr Lys Tyr Thr
165 170 175
Ser Tyr Pro Asp Pro Ile Leu Leu Met Lys Ser Ala Arg Asn Ser Cys
180 185 190
Trp Ser Lys Asp Ala Glu Tyr Gly Leu Tyr Ser Ile Tyr Gln Gly Gly
195 200 205
Ile Phe Glu Leu Lys Glu Asn Asp Arg Ile Phe Val Ser Val Thr Asn
210 215 220
Glu His Leu Ile Asp Met Asp His Glu Ala Ser Phe Phe Gly Ala Phe
225 230 235 240
Leu Val Gly
<210> 25
<211> 217
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 25
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Ser Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 26
<211> 217
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 26
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Thr Pro His
65 70 75 80
Ser Asp Trp Leu Ser Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 27
<211> 217
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 27
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Ser Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 28
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 28
Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 29
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 29
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 30
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 30
Ser Lys Tyr Gly Pro Pro
1 5
<210> 31
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 31
Ile Glu Gly Arg Met Asp
1 5
<210> 32
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 32
Gly Gly Gly Val Pro Arg Asp Cys Gly
1 5
<210> 33
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 33
Ile Glu Gly Arg Met Asp Gly Gly Gly Gly Ala Gly Gly Gly Gly
1 5 10 15
<210> 34
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 34
Gly Gly Gly Ser Gly Gly Gly Ser
1 5
<210> 35
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 35
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
1 5 10
<210> 36
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 36
Glu Gly Lys Ser Ser Gly Ser Gly Ser Glu Ser Lys Ser Thr
1 5 10
<210> 37
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 37
Gly Gly Ser Gly
1
<210> 38
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 38
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly
1 5 10
<210> 39
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 39
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
<210> 40
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 40
Glu Ala Ala Ala Arg Glu Ala Ala Ala Arg Glu Ala Ala Ala Arg Glu
1 5 10 15
Ala Ala Ala Arg
20
<210> 41
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 41
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala
1 5 10 15
Ser
<210> 42
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 42
Gly Gly Gly Gly Ala Gly Gly Gly Gly
1 5
<210> 43
<400> 43
000
<210> 44
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 44
Gly Ser Gly Ser Gly Ser
1 5
<210> 45
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 45
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser
1 5 10
<210> 46
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 46
Gly Gly Gly Gly Ser Ala Ser
1 5
<210> 47
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 47
Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro
1 5 10 15
Ala Pro Ala Pro
20
<210> 48
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 48
Cys Pro Pro Cys
1
<210> 49
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 49
Gly Gly Gly Gly Ser
1 5
<210> 50
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 50
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 51
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 51
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 52
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 52
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 53
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 53
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25
<210> 54
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 54
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 55
<211> 35
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 55
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser
35
<210> 56
<211> 40
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 56
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser Gly Gly Gly Gly Ser
35 40
<210> 57
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 57
Gly Gly Ser Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 58
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 58
Gly Gly Gly Gly Gly Gly Gly Gly
1 5
<210> 59
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 59
Gly Gly Gly Gly Gly Gly
1 5
<210> 60
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 60
Glu Ala Ala Ala Lys
1 5
<210> 61
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 61
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10
<210> 62
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 62
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
<210> 63
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 63
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Ala
1 5 10
<210> 64
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 64
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Ala
<210> 65
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 65
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Glu Ala Ala Ala Lys Ala
20
<210> 66
<211> 27
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 66
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Ala
20 25
<210> 67
<211> 46
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 67
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Glu Ala Ala Ala Lys Ala Leu Glu Ala Glu Ala Ala Ala Lys Glu Ala
20 25 30
Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Ala
35 40 45
<210> 68
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 68
Pro Ala Pro Ala Pro
1 5
<210> 69
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 69
Lys Glu Ser Gly Ser Val Ser Ser Glu Gln Leu Ala Gln Phe Arg Ser
1 5 10 15
Leu Asp
<210> 70
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 70
Gly Ser Ala Gly Ser Ala Ala Gly Ser Gly Glu Phe
1 5 10
<210> 71
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 71
Gly Gly Gly Ser Glu
1 5
<210> 72
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 72
Gly Ser Glu Ser Gly
1 5
<210> 73
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 73
Gly Ser Glu Gly Ser
1 5
<210> 74
<211> 35
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 74
Gly Glu Gly Gly Ser Gly Glu Gly Ser Ser Gly Glu Gly Ser Ser Ser
1 5 10 15
Glu Gly Gly Gly Ser Glu Gly Gly Gly Ser Glu Gly Gly Gly Ser Glu
20 25 30
Gly Gly Ser
35
<210> 75
<211> 234
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 75
Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 76
<211> 234
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 76
Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Thr Pro His Ser Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 77
<211> 234
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 77
Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 78
<211> 234
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 78
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 79
<211> 234
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 79
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Thr Pro His Ser Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Ser Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
<210> 80
<211> 234
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 80
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
1 5 10 15
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Ser
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Ser Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Asn Ala Thr Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys Ile Glu Gly Arg Met Asp
225 230
Claims (70)
- 이종 키메라 단백질로서,
(a) 집락 자극 인자 1 수용체(colony stimulating factor 1 receptor: CSF1R) 리간드에 결합할 수 있는 CSF1R의 부분을 포함하는 제1 도메인;
(b) CD40 리간드(CD40L) 수용체에 결합할 수 있는 CD40L의 부분을 포함하는 제2 도메인; 및
(c) 상기 제1 도메인과 상기 제2 도메인을 연결할 수 있는 링커
를 포함하는, 이종 키메라 단백질. - 제1항에 있어서, 상기 제1 도메인은 CSF1R의 세포외 도메인의 실질적으로 전부를 포함하고, 상기 제2 도메인은 CD40L의 세포외 도메인의 실질적으로 전부를 포함하는, 이종 키메라 단백질.
- 제1항 또는 제2항에 있어서, 상기 키메라 단백질은 면역억제 신호를 저해할 수 있는, 이종 키메라 단백질.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 키메라 단백질은,
(a) 상기 CSF1R의 부분이 그의 리간드에 결합될 때 면역 저해 신호를 감소시키거나 또는 제거할 수 있고/있거나,
(b) 상기 CD40L의 부분이 이의 수용체에 결합될 때 면역 자극 신호를 증가 또는 활성화시킬 수 있는, 이종 키메라 단백질. - 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 CSF1R 리간드는 CSF1 또는 IL-34인, 이종 키메라 단백질.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 CD40L 수용체는 CD40인, 이종 키메라 단백질.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 키메라 단백질은 상기 CSF1R 리간드 및 상기 CD40L 수용체에 동시에 결합할 수 있되, 상기 CSF1R 리간드는 CSF1 또는 IL-34이고, 그리고 상기 CD40L 수용체는 CD40인, 이종 키메라 단백질.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 키메라 단백질은 시험관내에서 재조합 인간 CD40 및 인간 CSF1에 동시에 결합할 수 있는, 이종 키메라 단백질.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 키메라 단백질은 선택적으로는 혈청에서, CSF1 및/또는 IL-34를 고갈시키는, 이종 키메라 단백질.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 상기 키메라 단백질은 CD40 효능제 항체 및/또는 CSF1R 길항작용 항체와 비교할 때 향상된 안전성 프로파일 및/또는 감소된 독성 프로파일을 나타내는, 이종 키메라 단백질.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 키메라 단백질은 CD40 효능제 항체 및/또는 CSF1R 길항작용 항체와 비교할 때 향상된 항종양 효과를 나타내는, 이종 키메라 단백질.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 상기 키메라 단백질은 CD4+ 및/또는 CD8+ T 세포의 하위 집단을 증가시키거나 이의 감소를 예방할 수 있는, 이종 키메라 단백질.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 상기 키메라 단백질은 T 세포에 의해서 종양 사멸 활성도를 향상시킬 수 있는, 이종 키메라 단백질.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 상기 키메라 단백질은 지속적인 면역조정 효과를 제공할 수 있는, 이종 키메라 단백질.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 키메라 단백질은 항원 제시 세포의 활성화를 유발할 수 있는, 이종 키메라 단백질.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 상기 키메라 단백질은 존재하는 항원에 대한 항원 제시 세포의 능력을 향상시킬 수 있는, 이종 키메라 단백질.
- 제1항 내지 제16항 중 어느 한 항에 있어서, 상기 키메라 단백질은 종양을 보호하는 세포에 반하여 종양을 사멸시킬 수 있는 세포에 우호적으로 면역 세포의 비를 이동시키는, 이종 키메라 단백질.
- 제17항에 있어서, 상기 종양을 사멸시킬 수 있는 세포는 T 세포, 세포독성 T 림프구, T 헬퍼 세포, 자연 살해(natural killer: NK) 세포, 자연 살해 T(NKT) 세포, 항종양 대식세포(예를 들어, M1 대식세포), B 세포 및 수지상 세포로부터 선택되고, 그리고 상기 종양을 보호하는 세포는 골수-유래 억제 세포(myeloid-derived suppressor cell: MDSC), 조절 T 세포(Treg); 종양 연관 호중구(TAN), M2 대식세포 및 종양 연관 대식세포(TAM)로부터 선택되는, 이종 키메라 단백질.
- 제18항에 있어서, 상기 키메라 단백질은 CSF1 및/또는 IL-34의 저해를 통해서 MDSC의 유도를 회피하면서, 항종양 대식세포 및 항원 제시 세포를 자극하는, 이종 키메라 단백질.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 상기 키메라 단백질은 효과기 T 세포 대 조절 T 세포의 비를 증가시키는, 이종 키메라 단백질.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 상기 키메라 단백질은 면역 저해 신호의 지속적인 차폐 효과를 제공하는, 이종 키메라 단백질.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 상기 키메라 단백질은 상기 키메라 단백질의 혈청 반감기(t1/2)와 비교할 때 더 긴 온-타킷(on-target)(예를 들어, 종양내(intra-tumoral)) t1/2을 제공하는, 이종 키메라 단백질.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 상기 키메라 단백질은 CSF1R 및 CD40에 대한 항체로의 치료와 비교할 때 독성을 감소시키는, 이종 키메라 단백질.
- 제1항 내지 제23항 중 어느 한 항에 있어서, 상기 링커는 가요성 아미노산 서열, IgG 힌지 영역 또는 항체 서열로부터 선택된 폴리펩타이드인, 이종 키메라 단백질.
- 제24항에 있어서, 상기 링커는 IgG4로부터 유래된 힌지-CH2-CH3 Fc 도메인을 포함하는, 이종 키메라 단백질.
- 제25항에 있어서, 상기 힌지-CH2-CH3 Fc 도메인은 인간 IgG4로부터 유래되는, 이종 키메라 단백질.
- 제1항 내지 제26항 중 어느 한 항에 있어서, 상기 키메라 단백질은 분비성이고, 기능성인 단일 폴리펩타이드 쇄로서 포유동물 숙주 세포에 의해서 발현되는, 이종 키메라 단백질.
- 제1항 내지 제27항 중 어느 한 항에 있어서, 상기 CSF1R의 부분은 서열번호 1 또는 서열번호 2의 아미노산 서열과 적어도 95% 동일한, 이종 키메라 단백질.
- 제1항 내지 제28항 중 어느 한 항에 있어서, 상기 CD40L의 부분은 서열번호 3 또는 서열번호 4의 아미노산 서열과 적어도 95% 동일한, 이종 키메라 단백질.
- 제1항 내지 제29항 중 어느 한 항에 있어서, 상기 링커는 서열번호 25, 서열번호 26 또는 서열번호 27의 아미노산 서열과 적어도 95% 동일한 아미노산 서열을 포함하는, 이종 키메라 단백질.
- 제1항 내지 제30항 중 어느 한 항에 있어서, 상기 링커는 하나 이상의 접합 링커를 포함하되, 상기 접합 링커는 서열번호 28 내지 74로부터 독립적으로 선택되는, 이종 키메라 단백질.
- 제31항에 있어서, 상기 링커는 2개 이상의 접합 링커를 포함하되, 각각의 접합 링커는 서열번호 28 내지 74로부터 독립적으로 선택되고; 하나의 접합 링커는 상기 힌지-CH2-CH3 Fc 도메인에 대해서 N 말단이고, 그리고 또 다른 접합 링커는 상기 힌지-CH2-CH3 Fc 도메인에 대해서 C 말단인, 이종 키메라 단백질.
- 제1항 내지 제32항 중 어느 한 항에 있어서, 상기 키메라 단백질은 재조합 융합 단백질인, 이종 키메라 단백질.
- 제1항 내지 제33항 중 어느 한 항에 있어서, 상기 키메라 단백질은 세포들 사이에서 안정적인 시냅스를 형성할 수 있는, 이종 키메라 단백질.
- 제34항에 있어서, 세포들 사이의 상기 안정적인 시냅스는 종양 감소를 선호하는 공간 배향을 제공하는, 이종 키메라 단백질.
- 제34항 또는 제35항에 있어서, 상기 공간 배향은 종양 세포를 공격하도록 T 세포를 배치하고/하거나 종양 세포가 본 발명의 상기 키메라 단백질에 의해서 차폐되는 것을 초과하는 음성 신호를 비롯한, 음성 신호를 전달하는 것을 입체적으로 방지하는, 이종 키메라 단백질.
- 제1항 내지 제36항 중 어느 한 항에 있어서, 각각의 결합 파트너에 대한 상기 세포외 도메인 중 어느 하나 또는 둘 모두의 결합은 수용체와 그의 리간드의 긴 상호작용을 제공하는 느린 오프 레이트(Koff)로 일어나는, 이종 키메라 단백질.
- 제37항에 있어서, 상기 긴 상호작용은 더 긴 양성 신호 효과를 전달하는, 이종 키메라 단백질.
- 제38항에 있어서, 상기 더 긴 양성 신호 효과는 효과기 세포가 항종양 효과를 위해서 적절하게 자극되도록 하는, 이종 키메라 단백질.
- 제37항 내지 제39항 중 어느 한 항에 있어서, 상기 긴 상호작용은 T 세포 증식을 제공하고, 항종양 공격을 가능하게 하는, 이종 키메라 단백질.
- 제37항 내지 제40항 중 어느 한 항에 있어서, 상기 긴 상호작용은 충분한 신호 전송을 가능하게 하여 자극 신호의 방출을 제공하는, 이종 키메라 단백질.
- 제41항에 있어서, 상기 자극 신호는 사이토카인인, 이종 키메라 단백질.
- 제1항 내지 제42항 중 어느 한 항의 키메라 단백질을 암호화하는 핵산을 포함하는, 발현 벡터.
- 제43항의 발현 벡터를 포함하는, 숙주 세포.
- 치료적 유효량의 제1항 내지 제42항 중 어느 한 항의 이종 키메라 단백질을 포함하는, 약제학적 조성물.
- 유효량의 제45항의 약제학적 조성물을 암 또는 염증성 질환의 치료를 필요로 하는 대상체에게 투여하는 단계를 포함하는, 암 또는 염증성 질환의 치료 방법.
- 유효량의 제45항의 약제학적 조성물을 면역 반응의 조정을 필요로 하는 대상체에게 투여하는 단계를 포함하는, 환자의 면역 반응의 조정 방법.
- 제46항 또는 제47항에 있어서, 상기 환자의 T 세포가 활성화되는, 방법.
- 제46항 또는 제47항에 있어서, 상기 환자는 종양을 갖고, 그리고 하나 이상의 종양 세포는 면역억제 신호 전송이 예방되는, 방법.
- 암 또는 염증성 질환의 치료 방법으로서, 유효량의 약제학적 조성물을 암 또는 염증성 질환의 치료를 필요로 하는 대상체에게 투여하는 단계를 포함하되, 상기 약제학적 조성물은 이종 키메라 단백질을 포함하고, 상기 이종 키메라 단백질은,
(a) 집락 자극 인자 1 수용체(CSF1R) 리간드에 결합할 수 있는 CSF1R의 부분을 포함하는 제1 도메인;
(b) CD-40 리간드(CD40L) 수용체에 결합할 수 있는 CD40L의 부분을 포함하는 제2 도메인; 및
(c) 상기 제1 도메인과 상기 제2 도메인을 연결할 수 있는 링커
를 포함하는, 암 또는 염증성 질환의 치료 방법. - 제50항에 있어서, 상기 대상체의 T 세포는, 상기 이종 키메라 단백질의 상기 제2 도메인에 의해서 결합될 때 활성화되고 그리고:
(a) 상기 이종 키메라 단백질의 상기 제1 도메인에 의해서 결합될 때 하나 이상의 종양 세포는 면역억제 신호 전송이 예방되고/예방되거나,
(b) 상기 대상체의 말초 혈액에서 정량화 가능한 사이토카인 반응이 달성되고/달성되거나,
(c) CD40 차단 항체 및/또는 CSF1 또는 IL-34 차단 항체로 치료된 대상체와 비교할 때 종양 성장의 감소를 필요로 하는 상기 대상체에서 종양 성장이 감소되는, 암 또는 염증성 질환의 치료 방법. - 제50항 또는 제51항에 있어서, 상기 방법은 CSF1R 신호전달을 저해하고, 억제성 골수 세포 집단을 저해하는, 암 또는 염증성 질환의 치료 방법.
- 제50항 내지 제52항 중 어느 한 항에 있어서, 상기 방법은 CD40 신호전달을 자극하고, 항원-제시 세포를 활성화시키는, 암 또는 염증성 질환의 치료 방법.
- 제50항 내지 제53항 중 어느 한 항에 있어서, 상기 방법은 CD40/CD40L 및 CSF1/CSF1R 중 하나를 표적으로 하는 대상체 또는 미치료 대상체와 비교할 때 종양 연관 대식세포(TAM)의 양 또는 활성도를 감소시키는, 암 또는 염증성 질환의 치료 방법.
- 제50항 내지 제54항 중 어느 한 항에 있어서, 상기 방법은 CD40/CD40L 및 CSF1/CSF1R 중 하나를 표적으로 하는 대상체 또는 미치료 대상체와 비교할 때 종양 미세환경(TME)에서 종양 연관 대식세포(TAM)의 양 또는 활성도를 감소시키는, 암 또는 염증성 질환의 치료 방법.
- 제50항 내지 제55항 중 어느 한 항에 있어서, 상기 방법은 CD40/CD40L 및 CSF1/CSF1R 중 하나를 표적으로 하는 대상체 또는 미치료 대상체와 비교할 때 조절 T 세포(Treg)의 양 또는 활성도를 감소시키는, 암 또는 염증성 질환의 치료 방법.
- 제50항 내지 제56항 중 어느 한 항에 있어서, 상기 방법은 CD40/CD40L 및 CSF1/CSF1R 중 하나를 표적으로 하는 대상체 또는 미치료 대상체와 비교할 때 IL-10 및/또는 IL-4의 양 또는 활성도를 감소시키는, 암 또는 염증성 질환의 치료 방법.
- 제50항 내지 제57항 중 어느 한 항에 있어서, 상기 방법은 CD40/CD40L 및 CSF1/CSF1R 중 하나를 표적으로 하는 대상체 또는 미치료 대상체와 비교할 때 전염증성 대식세포 및 수지상 세포의 성숙 및 분화를 증가시키는, 암 또는 염증성 질환의 치료 방법.
- 제50항 내지 제58항 중 어느 한 항에 있어서, 상기 방법은 CD40/CD40L 및 CSF1/CSF1R 중 하나를 표적으로 하는 대상체 또는 미치료 대상체와 비교할 때 상기 대상체의 드레이닝 림프절(draining lymph node)에서 효과기 T 세포의 프라이밍(priming)을 증가시키는, 암 또는 염증성 질환의 치료 방법.
- 제50항 내지 제59항 중 어느 한 항에 있어서, 상기 방법은, CD40/CD40L 및 CSF1/CSF1R 중 하나를 표적으로 하는 대상체 또는 미치료 대상체와 비교할 때, 면역억제성 세포 및 더 염증성인 종양 환경으로의 이동의 전체 감소를 초래하는, 암 또는 염증성 질환의 치료 방법.
- 제1항 내지 제42항 중 어느 한 항에 있어서, 의약으로서 사용하기 위한, 키메라 단백질.
- 제1항 내지 제42항 중 어느 한 항에 있어서, 암의 치료에 사용하기 위한, 키메라 단백질.
- 제1항 내지 제42항 중 어느 한 항에 있어서, 염증성 질환의 치료에 사용하기 위한, 키메라 단백질.
- 의약의 제조에서의, 제1항 내지 제42항 중 어느 한 항의 키메라 단백질의 용도.
- 하기 일반 구조식을 포함하는 재조합 융합 단백질:
N 말단 - (a) - (b) - (c) - C 말단
식 중,
(a)는 서열번호 2의 아미노산 서열과 적어도 95% 동일하고, CSF1R 리간드에 결합할 수 있는 CSF1R의 세포외 도메인을 포함하는 제1 도메인이고,
(b)는 제1 도메인과 제2 도메인을 연결하고, 인간 IgG4로부터 유래된 힌지-CH2-CH3 Fc 도메인 및 선택적으로 서열번호 28 내지 74로부터의 접합 링커 서열을 포함하는 링커이며,
(c)는 서열번호 4의 아미노산 서열과 적어도 95% 동일하고, CD40 리간드(CD40L) 수용체에 결합할 수 있는 CD40L의 세포외 도메인을 포함하는 제2 도메인이다. - 제65항에 있어서, 상기 링커는 서열번호 25, 서열번호 26 또는 서열번호 27의 아미노산 서열과 적어도 95% 동일한 서열을 포함하는, 재조합 융합 단백질.
- 제65항 또는 제66항에 있어서, 의약으로서 사용하기 위한, 재조합 융합 단백질.
- 제65항 내지 제67항 중 어느 항에 있어서, 암의 치료에 사용하기 위한, 재조합 융합 단백질.
- 제65항 내지 제68항 중 어느 항에 있어서, 염증성 질환의 치료에 사용하기 위한, 재조합 융합 단백질.
- 의약의 제조에서의, 제65항 내지 제69항 중 어느 한 항의 재조합 융합 단백질의 용도.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762463997P | 2017-02-27 | 2017-02-27 | |
| US62/463,997 | 2017-02-27 | ||
| PCT/US2018/020039 WO2018157164A1 (en) | 2017-02-27 | 2018-02-27 | Csf1r-based chimeric proteins |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190124247A true KR20190124247A (ko) | 2019-11-04 |
Family
ID=63253352
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197027869A KR20190124247A (ko) | 2017-02-27 | 2018-02-27 | Csf1r-기반 키메라 단백질 |
Country Status (15)
| Country | Link |
|---|---|
| US (4) | US11267856B2 (ko) |
| EP (1) | EP3585409A4 (ko) |
| JP (2) | JP7121029B2 (ko) |
| KR (1) | KR20190124247A (ko) |
| CN (1) | CN110381974A (ko) |
| AU (1) | AU2018223822A1 (ko) |
| BR (1) | BR112019017713A2 (ko) |
| CA (1) | CA3054132A1 (ko) |
| IL (1) | IL268197A (ko) |
| MX (1) | MX2019010173A (ko) |
| PH (1) | PH12019501534A1 (ko) |
| SA (1) | SA519402522B1 (ko) |
| SG (1) | SG11201906464UA (ko) |
| WO (1) | WO2018157164A1 (ko) |
| ZA (1) | ZA201906235B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023287049A1 (ko) * | 2021-07-14 | 2023-01-19 | 주식회사 이뮤노로지컬디자이닝랩 | Cd30에 특이적으로 결합하는 키메릭 항원 수용체 및 이의 용도 |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112019017713A2 (pt) | 2017-02-27 | 2020-04-07 | Shattuck Labs Inc | proteínas quiméricas à base de csf1r |
| EP3986442A4 (en) * | 2019-06-21 | 2023-10-25 | Shattuck Labs, Inc. | T CELLS EXPRESSING CHIMERIC PROTEINS |
| CN111068054B (zh) * | 2019-11-06 | 2022-02-11 | 浙江大学医学院附属第一医院 | 以csf1r作为药物靶点治疗肿瘤的药剂及其制备方法 |
| CN116715771A (zh) * | 2019-12-24 | 2023-09-08 | 宝船生物医药科技(上海)有限公司 | 抗csf1r分子及其用途 |
Family Cites Families (62)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5844095A (en) | 1991-06-27 | 1998-12-01 | Bristol-Myers Squibb Company | CTLA4 Ig fusion proteins |
| DK0897983T3 (da) * | 1991-10-25 | 2003-08-11 | Immunex Corp | Antistoffer mod CD40-L |
| US20110041190A1 (en) | 2002-10-31 | 2011-02-17 | Tykocinski Mark L | Novel chimeric proteins |
| WO2001049318A1 (en) | 2000-01-03 | 2001-07-12 | Tr Associates, L.L.C. | Novel chimeric proteins and methods for using the same |
| US7696168B2 (en) | 2000-04-21 | 2010-04-13 | Tufts Medical Center, Inc. | G protein coupled receptor agonists and antagonists and methods of activating and inhibiting G protein coupled receptors using the same |
| KR20050047030A (ko) | 2003-11-13 | 2005-05-19 | 한미약품 주식회사 | 약물의 캐리어로서 유용한 IgG Fc 단편 및 그의제조방법 |
| JP2006345852A (ja) | 2005-06-16 | 2006-12-28 | Virxsys Corp | 抗体複合体 |
| EP2027151A2 (en) | 2006-05-15 | 2009-02-25 | Viral Logic Systems Technology Corp. | Cd47 related compositions and methods for treating immunological diseases and disorders |
| MX2008015524A (es) | 2006-06-12 | 2009-01-13 | Trubion Pharmaceuticals Inc | Proteinas de union multivalentes monocatenarias con funcion efectora. |
| WO2008061377A1 (en) | 2006-11-22 | 2008-05-29 | Centre Hospitalier De L'universite De Montreal | Novel receptor for cd40l and uses thereof |
| CA2711938C (en) | 2008-01-15 | 2019-11-12 | The Board Of Trustees Of The Leland Stanford Junior University | Methods for manipulating phagocytosis mediated by cd47 |
| US20090226435A1 (en) | 2008-03-08 | 2009-09-10 | Sanjay Khare | Engineered fusion molecules immunotherapy in cancer and inflammatory diseases |
| EP2111869A1 (en) | 2008-04-23 | 2009-10-28 | Stichting Sanquin Bloedvoorziening | Compositions and methods to enhance the immune system |
| AU2009269141B2 (en) | 2008-06-30 | 2013-04-04 | University Of Pennsylvania | Fn14/TRAIL fusion proteins |
| NZ590667A (en) | 2008-07-02 | 2013-01-25 | Emergent Product Dev Seattle | Tgf-b antagonist multi-target binding proteins |
| WO2010062399A2 (en) | 2008-11-26 | 2010-06-03 | Five Prime Therapeutics, Inc. | Csf1r extracellular domain fusion molecules and treatments using same |
| WO2010062401A2 (en) * | 2008-11-26 | 2010-06-03 | Five Prime Therapeutics, Inc. | Treatment of osteolytic disorders and cancer using csf1r extracellular domain fusion molecules |
| JP2012512640A (ja) | 2008-12-19 | 2012-06-07 | ノバルティス アーゲー | 自己免疫および炎症性障害の処置に使用するための可溶性ポリペプチド |
| CN102421913A (zh) | 2009-03-13 | 2012-04-18 | 宾夕法尼亚大学董事会 | Ox40/trail融合蛋白 |
| CA2791383C (en) | 2010-03-05 | 2022-09-20 | The Johns Hopkins University | Compositions and methods for targeted immunomodulatory antibodies and fusion proteins |
| EP2621514B1 (en) | 2010-09-28 | 2016-09-21 | KAHR Medical (2005) Ltd | Compositions and methods for treatment of hematological malignancies |
| US9029315B2 (en) | 2010-11-11 | 2015-05-12 | The University Of Hong Kong | Soluble PD-1 variants, fusion constructs, and uses thereof |
| WO2012142515A2 (en) | 2011-04-13 | 2012-10-18 | Bristol-Myers Squibb Company | Fc fusion proteins comprising novel linkers or arrangements |
| US10179164B2 (en) | 2011-05-25 | 2019-01-15 | Cel-Sci Corporation | Method for inducing an immune response for treatment of cancer and autoimmune diseases or conditions |
| CN102850458B (zh) | 2011-06-28 | 2014-10-01 | 华博生物医药技术(上海)有限公司 | 新型重组双功能融合蛋白及其制法和用途 |
| AU2012290342A1 (en) | 2011-07-29 | 2014-01-30 | The Trustees Of The University Of Pennsylvania | Switch costimulatory receptors |
| CA2863818A1 (en) | 2012-02-06 | 2013-08-15 | Brendan CURTI | Cancer treatment and monitoring methods using ox40 agonists |
| EP3489254B9 (en) | 2012-04-30 | 2022-12-21 | Biocon Limited | Targeted/immunomodulatory fusion proteins and methods for making same |
| US9745381B2 (en) | 2012-05-18 | 2017-08-29 | Scott & White Healthcare (Swh) | Bispecific scFv immunofusion (BIf) |
| CN112587658A (zh) | 2012-07-18 | 2021-04-02 | 博笛生物科技有限公司 | 癌症的靶向免疫治疗 |
| WO2014036357A1 (en) * | 2012-08-31 | 2014-03-06 | Five Prime Therapeutics, Inc. | Methods of treating conditions with antibodies that bind colony stimulating factor 1 receptor (csf1r) |
| HUE058790T2 (hu) | 2012-12-17 | 2022-09-28 | Pf Argentum Ip Holdings Llc | CD47+ beteg sejtek kezelése SIRP-alfa-Fc fúziókkal |
| EP2941438A1 (en) | 2013-01-01 | 2015-11-11 | Kahr Medical Ltd. | Stable form of signal converting protein fusion proteins, and methods of use and preparation thereof |
| EP2948475A2 (en) | 2013-01-23 | 2015-12-02 | AbbVie Inc. | Methods and compositions for modulating an immune response |
| WO2015116178A1 (en) | 2014-01-31 | 2015-08-06 | Thomas Jefferson University | Fusion proteins for modulating regulatory and effector t cells |
| US9873747B2 (en) | 2013-01-31 | 2018-01-23 | Thomas Jefferson University | Fusion proteins that facilitate cancer cell destruction |
| WO2014121099A1 (en) | 2013-01-31 | 2014-08-07 | Thomas Jefferson University | Agonist fusion protein for cd40 ox40 and uses thereof |
| WO2014121085A1 (en) | 2013-01-31 | 2014-08-07 | Thomas Jefferson University | Pd-l1 and pd-l2-based fusion proteins and uses thereof |
| EP2951199A4 (en) | 2013-01-31 | 2016-07-20 | Univ Jefferson | Fusion proteins for the modulation of regulatory and effector T cells |
| HUE050787T2 (hu) | 2013-02-26 | 2021-01-28 | Memorial Sloan Kettering Cancer Center | Immunterápiás készítmények és eljárások |
| NZ711445A (en) | 2013-03-12 | 2018-06-29 | Biocon Ltd | Fusion immunomodulatory proteins and methods for making same |
| US10196435B2 (en) | 2013-11-18 | 2019-02-05 | University Of Southern California | OX40L fusion protein for the immunotherapy of tumors of veterinary animals |
| CA2934028A1 (en) | 2013-12-17 | 2015-06-25 | Genentech, Inc. | Combination therapy comprising ox40 binding agonists and pd-1 axis binding antagonists |
| AU2015205530B8 (en) | 2014-01-13 | 2019-09-19 | Pieris Pharmaceuticals Gmbh | Multi-specific polypeptide useful for localized tumor immunomodulation |
| WO2015112534A2 (en) | 2014-01-21 | 2015-07-30 | Medimmune, Llc | Compositions and methods for modulating and redirecting immune responses |
| WO2015148416A1 (en) | 2014-03-24 | 2015-10-01 | Deqiang Jing | Novel recombinant bi-functional fusion proteins, preparation and use thereof |
| JP6666267B2 (ja) | 2014-05-29 | 2020-03-13 | メディミューン,エルエルシー | Ox40l融合タンパク質およびその使用 |
| WO2015200828A1 (en) | 2014-06-27 | 2015-12-30 | H. Lee Moffit Cancer Center And Research Institute, Inc. | Conjugates for immunotherapy |
| GB2532619A (en) | 2014-08-08 | 2016-05-25 | Alexo Therapeutics Int | Sirp-Alpha Variant Constructs And Uses Thereof |
| HUE043038T2 (hu) | 2014-08-11 | 2019-07-29 | Delinia Inc | Regulator T-sejteket szelektíven aktiváló, módosított IL-2-változatok autoimmun betegségek kezelésére |
| EP3643727A1 (en) | 2014-08-15 | 2020-04-29 | Merck Patent GmbH | Sirp-alpha immunoglobulin fusion proteins |
| BR112017010198A2 (pt) | 2014-11-17 | 2017-12-26 | Genentech Inc | terapia de combinação compreendendo agonistas de ligação a ox40 e antagonistas de ligação ao eixo de pd-1 |
| US11161907B2 (en) | 2015-02-02 | 2021-11-02 | Novartis Ag | Car-expressing cells against multiple tumor antigens and uses thereof |
| MA41460A (fr) * | 2015-02-03 | 2017-12-12 | Oncomed Pharm Inc | Agents de liaison à la tnfrsf et leurs utilisations |
| AU2016215175B2 (en) | 2015-02-06 | 2021-09-16 | Heat Biologics, Inc. | Vector co-expressing vaccine and costimulatory molecules |
| EP3283527B1 (en) | 2015-04-13 | 2021-01-13 | Five Prime Therapeutics, Inc. | Combination therapy for cancer |
| WO2016166139A1 (en) | 2015-04-14 | 2016-10-20 | Eberhard Karls Universität Tübingen | Bispecific fusion proteins for enhancing immune responses of lymphocytes against tumor cells |
| WO2016187226A1 (en) | 2015-05-18 | 2016-11-24 | Ab Initio Biotherapeutics, Inc. | Sirp polypeptide compositions and methods of use |
| PT3331902T (pt) | 2015-08-07 | 2021-07-26 | Alx Oncology Inc | Construções com um domínio de sirp-alfa ou uma sua variante |
| BR112018006578A2 (pt) * | 2015-10-01 | 2018-12-26 | Heat Biologics, Inc. | composições e métodos para juntar domínios extracelulares tipo i e tipo ii como proteínas quiméricas heterólogas |
| WO2018075960A1 (en) | 2016-10-21 | 2018-04-26 | Tioma Therapeutics, Inc. | Therapeutic cd47 antibodies |
| BR112019017713A2 (pt) | 2017-02-27 | 2020-04-07 | Shattuck Labs Inc | proteínas quiméricas à base de csf1r |
-
2018
- 2018-02-27 BR BR112019017713A patent/BR112019017713A2/pt unknown
- 2018-02-27 SG SG11201906464UA patent/SG11201906464UA/en unknown
- 2018-02-27 AU AU2018223822A patent/AU2018223822A1/en active Pending
- 2018-02-27 CA CA3054132A patent/CA3054132A1/en active Pending
- 2018-02-27 JP JP2019545954A patent/JP7121029B2/ja active Active
- 2018-02-27 KR KR1020197027869A patent/KR20190124247A/ko not_active Application Discontinuation
- 2018-02-27 MX MX2019010173A patent/MX2019010173A/es unknown
- 2018-02-27 CN CN201880014002.2A patent/CN110381974A/zh active Pending
- 2018-02-27 EP EP18756880.3A patent/EP3585409A4/en active Pending
- 2018-02-27 US US16/484,853 patent/US11267856B2/en active Active
- 2018-02-27 WO PCT/US2018/020039 patent/WO2018157164A1/en unknown
- 2018-12-18 US US16/223,332 patent/US10513548B2/en active Active
-
2019
- 2019-06-28 PH PH12019501534A patent/PH12019501534A1/en unknown
- 2019-07-21 IL IL268197A patent/IL268197A/en unknown
- 2019-08-25 SA SA519402522A patent/SA519402522B1/ar unknown
- 2019-09-20 ZA ZA2019/06235A patent/ZA201906235B/en unknown
- 2019-11-06 US US16/675,475 patent/US11267857B2/en active Active
-
2022
- 2022-01-28 US US17/587,447 patent/US20220144909A1/en active Pending
- 2022-08-04 JP JP2022125121A patent/JP2022159393A/ja active Pending
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023287049A1 (ko) * | 2021-07-14 | 2023-01-19 | 주식회사 이뮤노로지컬디자이닝랩 | Cd30에 특이적으로 결합하는 키메릭 항원 수용체 및 이의 용도 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20220144909A1 (en) | 2022-05-12 |
| US11267856B2 (en) | 2022-03-08 |
| EP3585409A4 (en) | 2020-12-02 |
| ZA201906235B (en) | 2021-04-28 |
| US20190382466A1 (en) | 2019-12-19 |
| RU2019129835A3 (ko) | 2021-07-16 |
| US11267857B2 (en) | 2022-03-08 |
| IL268197A (en) | 2019-09-26 |
| AU2018223822A1 (en) | 2019-07-11 |
| PH12019501534A1 (en) | 2019-09-09 |
| JP2020508063A (ja) | 2020-03-19 |
| JP7121029B2 (ja) | 2022-08-17 |
| CA3054132A1 (en) | 2018-08-30 |
| US10513548B2 (en) | 2019-12-24 |
| JP2022159393A (ja) | 2022-10-17 |
| RU2019129835A (ru) | 2021-03-29 |
| WO2018157164A1 (en) | 2018-08-30 |
| EP3585409A1 (en) | 2020-01-01 |
| MX2019010173A (es) | 2019-11-21 |
| SG11201906464UA (en) | 2019-08-27 |
| US20200123214A1 (en) | 2020-04-23 |
| US20190169249A1 (en) | 2019-06-06 |
| CN110381974A (zh) | 2019-10-25 |
| SA519402522B1 (ar) | 2023-03-12 |
| BR112019017713A2 (pt) | 2020-04-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7260477B2 (ja) | Tigit及びlightベースのキメラタンパク質 | |
| JP6981973B2 (ja) | I型及びii型細胞外ドメインを異種キメラタンパク質として連結する組成物及び方法 | |
| US11267857B2 (en) | CSF1R-based chimeric proteins | |
| US20240067698A1 (en) | Vsig8-based chimeric proteins | |
| US20200071380A1 (en) | Combination therapies comprising sirp alpha-based chimeric proteins | |
| JP2022512540A (ja) | Flt3l系キメラタンパク質 | |
| US20210379153A1 (en) | Combination therapies comprising sirp alpha-based chimeric proteins | |
| KR20210068432A (ko) | 병용 요법 | |
| RU2792239C2 (ru) | Химерные белки на основе csf1r | |
| US20230048633A1 (en) | Tgfbr2-based chimeric proteins |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |